Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ 3-ФЕНИЛ-3-МЕТОКСИПИРРОЛИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ КОРТИКАЛЬНОЙ КАТЕХОЛАМИНЕРГИЧЕСКОЙ НЕЙРОТРАНСМИССИИ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к новым производным 3-фенил-3-метоксипирролидина, полезным для модулирования внеклеточных уровней катехоламинов дофамина и норэпинефрина в областях коры головного мозга млекопитающих, и более конкретно к лечению расстройств центральной нервной системы.
В других аспектах изобретение относится к фармацевтическим композициям, содержащим производные 3-фенил-3-метоксипирролидина по изобретению, и к применению этих соединений для терапевтических подходов.
Предшествующий уровень техники
Кора головного мозга охватывает несколько основных областей, которые вовлечены в более высокие функции, такие как мышление, переживания, память и планирование. Биогенные амины, то есть дофамин, норэпинефрин и серотонин, являются важными для функции коры головного мозга млекопитающих. Восходящие дофаминовые и норэпинефриновые пути иннервируют кору головного мозга. Серотонинергические нейроны ЦНС (центральной нервной системы) распространяются по существу на все области головного мозга, включая кору головного мозга. Первичные или вторичные дисфункции в активности этих путей приводят к нарушению регуляции активности дофаминовых и норэпинефриновых, а также серотониновых рецепторов в этих областях головного мозга и затем к проявлениям психиатрических и неврологических симптомов.
Биогенные амины коры головного мозга модулируют несколько аспектов функций коры головного мозга, контролирующих эмоциональную реакцию, состояние тревоги, мотивацию, познавательную способность, внимание, возбуждение и бодрствование. Таким образом, катехоламины дофамин и норэпинефрин оказывают сильное влияние на префронтальные области коры головного мозга, целостность которых важна для так называемых управляющих когнитивных функций, связанных, например, с вниманием, планированием действий и контролем над импульсами. Норэпинефрин представляет собой основную часть в схеме регуляции тревоги и боязни, и таким образом полагают, что его регуляция нарушается при тревожных расстройствах, таких как панические расстройства, генерализованное тревожное расстройство (GAD) и специфические фобии. В отношении настроения и эмоционадьных функций полезность соединений, облегчающих, в частности, норэпинефриновую и серотониновую нейротрансмиссию в лечении депрессии и тревоги в значительной степени вносит вклад в получившую широкое признание концепцию, что оба этих нейромедиатора вовлечены в регуляцию эмоциональных функций.
В общем, соединения, которые специфически влияют на трансмиссию биогенных аминов, точнее моноаминов, норэпинефрина, дофамина и серотонина, успешно используются для уменьшения интенсивности симптомов нарушения эмоциональных, когнитивных функций или функций внимания у пациентов, страдающих, например, депрессией, тревогой и синдромом дефицита внимания с гиперактивностью (ADHD).
Кроме того, известно, что моноаминные системы в коре головного мозга непосредственно или опосредованно вовлечены в основные симптомы шизофрении. На основе биохимических и генетических обнаружений наряду с нейрофизиологическими наблюдениями, указывающими на дисфункцию специфических областей коры головного мозга при шизофрении, предположили, что проявления этого расстройства в виде различных патологических этиологии сводятся к функции коры головного мозга, приводящей к нарушению регуляции микроциркуляций в коре головного мозга, которое клинически проявляется в виде симптомов шизофрении. Эта микроциркуляция в коре головного мозга регулируется несколькими нейромедиаторами, включая глутамат, гамма-аминомасляную кислоту (GABA) и дофамин.
В документе ЕР 586229 раскрыто соединение 3-(2,4-дифторфенил)-3-метоксипирролидин; однако, никакого фармацевтического применения данного соединения не раскрыто.
Краткое изложение сущности изобретения
Задача настоящего изобретения заключается в том, чтобы предложить новые фармацевтически активные соединения, особенно полезные в лечении расстройств центральной нервной системы. Еще одна задача заключается в том, чтобы предложить соединения для модулирования дофаминовой и норэпинефриновой нейротрансмиссии в головном мозга млекопитающих, включая головной мозг человека. Еще одна задача заключается в том, чтобы предложить новые соединения, обладающие профилем усиления функции коры головного мозга. Еще одна задача заключается в том, чтобы предложить соединения, обладающие терапевтическими действиями после перорального введения. Еще одна задача заключается в том, чтобы предложить соединения, обладающие более оптимальными фармакодинамическими свойствами, такими как, например, кинетическое поведение, биодоступность, растворимость и эффективность. Еще одна задача изобретения заключается в том, чтобы предложить соединения, которые превосходят соединения, известные в настоящее время для лечения различных расстройств, связанных с дисфункциями ЦНС, с точки зрения эффективности или побочных действий.
Настоящее изобретение относится к неожиданному обнаружению фармакологических действий соединений по изобретению в отношении моноаминов в коре головного мозга и к применению этих соединений в лечении некоторых расстройств ЦНС. Путем фармакологического тестирования крыс in vivo продемонстрировано, что соединения по настоящему изобретению приводят к регионально избирательным увеличениям уровней катехоламина в лобной доле коры головного мозга. Вследствие специфических модулирующих действий катехоламинов в отношении функций коры головного мозга, связанных с когнитивной функцией, функцией внимания и эмоциональной функцией, соединения по изобретению могут быть использованы в лечении расстройств, характеризующихся дисфункциями в этих областях. Таким образом, соединения могут быть использованы в лечении когнитивных расстройств, ADHD, депрессии и тревоги. Соединения также могут быть использованы для лечения шизофрении, которая характеризуется дисфункциями коры головного мозга, проявляющимися в нарушении когнитивной функции и психозе.
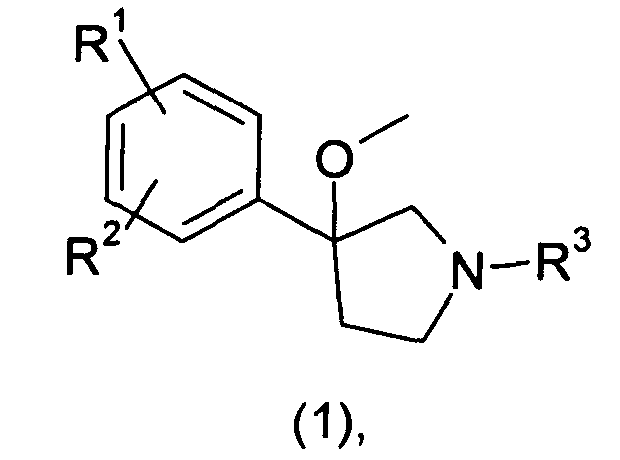
В первом аспекте изобретения предложено производное 3-фенил-3-метоксипирролидина формулы 1
любой из его стереоизомеров или любая смесь его стереоизомеров, или его N-оксид, или его дейтерированный аналог, или его фармацевтически приемлемая соль; где R1, R2 и R3 являются такими, как определено ниже.
Во втором аспекте изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество производного 3-фенил-3-метоксипирролидина по изобретению, любого из его стереоизомеров или любой смеси его стереоизомеров, или его N-оксида, или его фармацевтически приемлемой соли вместе с по меньшей мере одним фармацевтически приемлемым носителем, эксципиентом или разбавителем.
В еще одном аспекте изобретения предложено применение производного 3-фенил-3-метоксипирролидина по изобретению, любого из его стереоизомеров или любой смеси его стереоизомеров, или его N-оксида, или его фармацевтически приемлемой соли, для изготовления фармацевтической композиции для лечения, предупреждения или уменьшения интенсивности симптомов заболевания, или расстройства, или состояния у млекопитающего, включая человека, которое чувствительно к модуляции катехоламинов в коре головного мозга.
В еще одном аспекте изобретение относится к способу лечения, предупреждения или уменьшения интенсивности симптомов заболевания, или расстройства, или состояния в организме живого животного, включая человека, которое чувствительно к модуляции катехоламинов в коре головного мозга, включающему стадию введения в такой организм живого животного, нуждающегося в этом, терапевтически эффективного количества производного 3-фенил-3-метоксипирролидина по изобретению, любого из его стереоизомеров или любой смеси его стереоизомеров, или его N-оксида, или его фармацевтически приемлемой соли.
Другие аспекты изобретения будут понятны специалисту в данной области техники из следующего подробного описания и примеров.
Подробное описание изобретения
Производные 3-фенил-3-метоксипирролидина
В первом аспекте настоящего изобретения предложены производные 3-фенил-3-метоксипирролидина формулы 1

любые из их стереоизомеров или любую смесь их стереоизомеров, или их N-оксид, или их дейтерированный аналог, или их фармацевтически приемлемая соль, где
R1 представляет собой F или Cl;
R2 представляет собой F или Cl; и
R3 представляет собой Н, СН3 или СН2СН3;
при условии, что соединение не представляет собой 3-(2,4-дифторфенил)-3-метоксипирролидин.
В предпочтительном воплощении производное 3-фенил-3-метоксипирролидина по изобретению представляет собой соединение формулы 2:
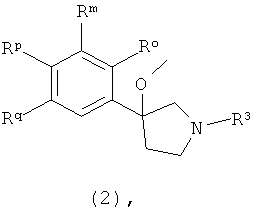
любой из его стереоизомеров или любую смесь его стереоизомеров, или его N-оксид, или его дейтерированный аналог, или его фармацевтически приемлемую соль, где
один из Ro, Rm, Rp и Rq представляет собой R1;
один из остальных трех из Ro, Rm, Rp и Rq представляет собой R2;
два остальных из Ro, Rm, Rp и Rq представляют собой Н; и
R3 является таким, как определено выше.
В более предпочтительном воплощении производное 3-фенил-3-метоксипирролидина представляет собой соединение формулы 2, где Rm представляет собой R1, Ro представляет собой R2, и Rp и Rq представляют собой Н.
В еще одном более предпочтительном воплощении производное 3-фенил-3-метоксипирролидина представляет собой соединение формулы 2, где Rm представляет собой R1, Rp представляет собой R2, и Ro и Rq представляют собой Н.
В третьем более предпочтительном воплощении производное 3-фенил-3-метоксипирролидина представляет собой соединение формулы 2, где Rm представляет собой R1, Rq представляет собой R2, и Ro и Rp представляют собой Н.
В еще одном предпочтительном воплощении производное 3-фенил-3-метоксипирролидина представляет собой соединение формулы 1 или формулы 2, любой из его стереоизомеров или любую смесь его стереоизомеров, или его N-оксид, или его дейтерированный аналог, или его фармацевтически приемлемую соль, где R1 представляет собой F или Cl.
В более предпочтительном воплощении R1 представляет собой F.
В еще одном более предпочтительном воплощении R1 представляет собой Cl.
В третьем предпочтительном воплощении производное 3-фенил-3-метоксипирролидина представляет собой соединение формулы 1 или формулы 2, любой из его стереоизомеров или любую смесь его стереоизомеров, или его N-оксид, или его дейтерированный аналог, или его фармацевтически приемлемую соль, где R2 представляет собой F или Cl.
В более предпочтительном воплощении R2 представляет собой F.
В еще одном более предпочтительном воплощении R2 представляет собой Cl.
В четвертом предпочтительном воплощении производное 3-фенил-3-метоксипирролидина представляет собой соединение формулы 1 или формулы 2, любой из его стереоизомеров или любую смесь его стереоизомеров, или его N-оксид, или его дейтерированный аналог, или его фармацевтически приемлемую соль, где R3 представляет собой Н, СН3 или СН2СН3, или их дейтерированный аналог.
В более предпочтительном воплощении R3 представляет собой Н или D.
В еще одном более предпочтительном воплощении R3 представляет собой СН3 или CD3.
В третьем более предпочтительном воплощении R3 представляет собой CH2CH3 или CD2CD3.
В наиболее предпочтительном воплощении производное 3-фенил-3-метоксипирролидина по изобретению представляет собой
(+)-3-(3-хлор-2-фторфенил)-3-метоксипирролидин;
(+)-3-(3-хлор-2-фторфенил)-1-этил-3-метоксипирролидин;
(-)-3-(3-хлор-2-фторфенил)-3-метоксипирролидин;
(-)-3-(3-хлор-2-фторфенил)-1-этил-3-метоксипирролидин;
(+)-3-(2,3-дифторфенил)-3-метоксипирролидин;
(+)-3-(2,3-дифторфенил)-1-этил-3-метоксипирролидин;
(-)-3-(2,3-дифторфенил)-3-метоксипирролидин;
(-)-3-(2,3-дифторфенил)-1-этил-3-метоксипирролидин;
3-(3,4-дифторфенил)-3-метоксипирролидин;
3-(3,4-дифторфенил)-1-этил-3-метоксипирролидин;
3-(3-хлор-5-фторфенил)-3-метоксипирролидин;
3-(2,3-дифторфенил)-3-метоксипирролидин;
3-(2,3-дифторфенил)-1-этил-3-метоксипирролидин;
(+)-3-(3,5-дифторфенил)-3-метоксипирролидин;
(-)-3-(3,5-дифторфенил)-3-метоксипирролидин;
энантиомер 1 3-(3,5-дифторфенил)-3-метокси-1-метилпирролидина;
энантиомер 2 3-(3,5-дифторфенил)-3-метокси-1-метилпирролидина;
энантиомер 1 3-(3,5-дифторфенил)-1-этил-3-метоксипирролидина;
энантиомер 2 3-(3,5-дифторфенил)-1-этил-3-метоксипирролидина;
(+)-3-(3,4-дифторфенил)-3-метоксипирролидин;
(-)-3-(3,4-дифторфенил)-3-метоксипирролидин;
энантиомер 2 3-(3,4-дифторфенил)-1-этил-3-метоксипирролидина;
энантиомер 2 3-(3,4-дифторфенил)-1-(этил-D5)-3-метоксипирролидина;
энантиомер 2 3-(3,4-дифторфенил)-(1-D)-3-метоксипирролидина;
энантиомер 2 3-(3,4-дифторфенил)-3-метокси-1-метилпирролидина;
энантиомер 2 3-(3,4-дифторфенил)-3-метокси-1-(метил-D3)-пирролидина;
энантиомер 1 3-(3,4-дифторфенил)-3-метокси-1-(метил-D3)-пирролидина;
энантиомер 1 3-(3,4-дифторфенил)-(1-D)-3-метоксипирролидина;
энантиомер 1 3-(3,4-дифторфенил)-1-этил-3-метоксипирролидина;
энантиомер 1 3-(3,4-дифторфенил)-1-(этил-D5)-3-метоксипирролидина;
энантиомер 1 3-(3,4-дифторфенил)-3-метокси-1-метилпирролидина;
энантиомер 2 3-(3,4-дифторфенил)-1-этил-3-метоксипирролидин-1-оксида;
энантиомер 2 3-(3,4-дифторфенил)-1-(этил-D5)-3-метоксипирролидин-1-оксида;
энантиомер 2 3-(3,4-дифторфенил)-3-метокси-1-метилпирролидин-1-оксида;
энантиомер 2 3-(3,4-дифторфенил)-3-метокси-1-(метил-D3)-пирролидин-1-оксида;
энантиомер 1 3-(3,4-дифторфенил)-3-метокси-1-(метил-D3)-пирролидин-1-оксида;
энантиомер 1 3-(3,4-дифторфенил)-1-этил-3-метоксипирролидин-1-оксида;
энантиомер 1 3-(3,4-дифторфенил)-1-(этил-D5)-3-метоксипирролидин-1-оксида;
энантиомер 1 3-(3,4-дифторфенил)-3-метокси-1-метилпирролидин-1-оксида;
(+)-3-(3-хлор-5-фторфенил)-3-метоксипирролидин;
(-)-3-(3-хлор-5-фторфенил)-3-метоксипирролидин;
(+)-3-(3-хлор-4-фторфенил)-3-метоксипирролидин;
(-)-3-(3-хлор-4-фторфенил)-3-метоксипирролидин;
энантиомер 1 3-(3-хлор-5-фторфенил)-1-этил-3-метоксипирролидина;
энантиомер 2 3-(3-хлор-5-фторфенил)-1-этил-3-метоксипирролидина;
энантиомер 1 3-(3-хлор-4-фторфенил)-1-этил-3-метоксипирролидина;
энантиомер 2 3-(3-хлор-4-фторфенил)-1-этил-3-метоксипирролидина;
энантиомер 1 3-(3-хлор-2-фторфенил)-(1-D)-3-метоксипирролидина;
энантиомер 1 3-(3-хлор-4-фторфенил)-(1-D)-3-метоксипирролидина; или энантиомер 2 3-(3-хлор-4-фторфенил)-(1-D)-3-метоксипирролидина;
любой из их стереоизомеров или любую смесь их стереоизомеров, или их N-оксид, или их дейтерированный аналог, или их фармацевтически приемлемую соль.
Любую комбинацию двух или более чем двух описанных выше воплощений рассматривают в объеме настоящего изобретения.
Фармацевтически приемлемые соли
Химическое соединение по изобретению может быть предложено в любой форме, подходящей для предполагаемого введения. Подходящие формы включают фармацевтически (то есть физиологически) приемлемые соли и пре- или пролекарственные формы химического соединения по изобретению.
Примеры фармацевтически приемлемых солей включают нетоксичные соли присоединения неорганических и органических кислот, такие как гидрохлорид, гидробромид, нитрат, перхлорат, фосфат, сульфат, формиат, ацетат, аконат, аскорбат, бензолсульфонат, бензоат, циннамат, цитрат, эмбонат, энантат, фумарат, глутамат, гликолят, лактат, малеат, малонат, манделат, метансульфонат, нафталин-2-сульфонат, фталат, салицилат, сорбат, стеарат, сукцинат, тартрат, толуол-пара-сульфонат и тому подобное, но не ограничиваются ими. Такие соли могут быть получены способами, хорошо известными и описанными в данной области техники.
Другие кислоты, такие как щавелевая кислота, которые могут не рассматриваться как фармацевтически приемлемые, могут быть полезны в получении солей, полезных в качестве промежуточных соединений при получении химического соединения по изобретению и его фармацевтически приемлемой соли присоединения кислоты.
Примеры фармацевтически приемлемых катионных солей химического соединения по изобретению включают натриевую, калиевую, кальциевую, магниевую соль, соль цинка, алюминия, лития, холина, лизина и аммониевую соль и тому подобное, химического соединения по изобретению, содержащего анионную группу, но не ограничиваются ими. Такие катионные соли могут быть получены способами, хорошо известными и описанными в данной области техники.
В контексте изобретения «ониевые соли» N-содержащих соединений также рассматривают в качестве фармацевтически приемлемых солей. Предпочтительные «ониевые соли» включают алкилониевые соли, циклоалкилониевые соли и циклоалкилалкилониевые соли.
Примеры пре- или пролекарственных форм химического соединения по изобретению включают примеры подходящих пролекарств веществ по изобретению, включающих соединения, модифицированные по одной или более чем одной реакционноспособной или дериватизируемой группе исходного соединения. Особенный интерес представляют собой соединения, модифицированные по карбоксильной группе гидроксильной группе или аминогруппе. Примеры подходящих производных представляют собой сложные эфиры или амиды.
Химическое соединение по изобретению может быть получено в растворимой или нерастворимой формах вместе с фармацевтически приемлемым растворителем, таким как вода, этанол и тому подобное. Растворимые формы также могут включать гидратированные формы, такие как моногидрат, дигидрат, полугидрат, тригидрат, тетрагидрат и тому подобное. В общем растворимые формы рассматривают как эквивалентные нерастворимым формам для целей данного изобретения.
Стерические изомеры
Специалистам в данной области техники понятно, что производные 3-фенил-3-метоксипирролидина по настоящему изобретению могут существовать в различных стереоизомерных формах, включая энантиомеры, диастереоизомеры или цис-транс-изомеры.
Изобретение включает все такие изомеры и любые их смеси, в том числе рацемические смеси.
Рацемические формы могут быть разделены на оптические антиподы с использованием известных способов и методик. Один из путей разделения энантиомерных соединений (включая энантиомерные промежуточные соединения) осуществляют в том случае, когда соединение представляет собой хиральную кислоту путем использования оптически активного амина, и высвобождения диастереоизомерной расщепленной соли путем обработки кислотой. Еще один способ расщепления рацематов на оптические антиподы основан на хроматографии на оптически активной матрице. Таким образом, рацемические соединения по настоящему изобретению могут быть разделены на их оптические антиподы, например, путем фракционной кристаллизации, например, солей D- или L- (тартратов, манделатов или камфорсульфонатов).
Химические соединения по настоящему изобретению также могут быть разделены путем образования диастереоизомерных амидов путем взаимодействия химических соединений по настоящему изобретению с оптически активной активированной карбоновой кислотой, такой как кислота, являющаяся производной (+)- или (-)-фенилаланина, (+)- или (-)-фенилглицина, (+)- или (-)-кaмфaнoвoй киcлoты, или посредством обpaзoвaния диастереоизомерных карбаматов путем взаимодействия химического соединения по настоящему изобретению с оптически активным хлорформиатом и тому подобным.
Дополнительные способы разделения оптических изомеров известны в данной области техники. Такие способы включают описанные Jaques J., Collet A. & Wilen S. в «Enanthiomers. Racemates. and Resolutions». John Wiley and Sons, New York (1981).
Оптически активные соединения также могут быть получены из оптически активных исходных веществ.
N-оксиды
В контексте изобретения N-оксид означает оксидное производное третичного амина, включающее атом азота ароматического N-гетероциклического соединения, неароматического N-гетероциклического соединения, триалкиламин и триалкениламин. Например, N-оксид соединения, содержащего пиридил, может представлять собой 1-оксипиридин-2-, -3- или -4-ильное производное.
N-оксиды соединений по изобретению могут быть получены путем окисления соответствующего азотистого основания с использованием традиционного окислителя, такого как перекись водорода, в присутствии кислоты, такой как уксусная кислота, при повышенной температуре, или путем взаимодействия с перкислотой, такой как перуксусная кислота, в подходящем растворителе, например дихлорметане, этилацетате или метилацетате, или в хлороформе или дихлорметане с 3-хлорпероксибензойной кислотой.
Дейтерированные аналоги
Соединения по изобретению могут быть получены в форме их дейтерированных аналогов. Дейтериевые формы связываются с атомом углерода, который вибрирует при меньшей частоте, и, таким образом, сильнее по сравнению со связями С-Н. Таким образом, варианты лекарственных средств с «тяжелым водородом» (дейтерием) могут быть более стабильными к деградации и находиться в организме более длительное время.
Дейтерированный аналог по изобретению может представлять собой производное с полным или частичным замещением дейтерием. Предпочтительно, замещенное дейтерием производное по изобретению несет полностью или частично замещенную дейтерием алкильную группу в частности -СD3 (метил-D3), -CD2CD3 (этил-D5) или -CD2CD2CD3 (пропил-D7).
В контексте данного изобретения, когда конкретное положение обозначено как несущее дейтерий (обозначенное как «D» или «дейтерий»), понятно, что количество дейтерия в этом положении по существу выше естественного количества дейтерия, которое составляет 0,015% (то есть включение дейтерия составляет по меньшей мере 50,1%).
В предпочтительном воплощении количество дейтерия в этом положении по меньшей мере в 3340 раз больше (то есть включение дейтерия составляет по меньшей мере 50,1%) по сравнению с природным количеством дейтерия, составляющим 0,015%. В других предпочтительных воплощениях изобретения количество дейтерия в этом положении составляет по меньшей мере 3500 (включение дейтерия составляет 52,5%), по меньшей мере 4000 (включение дейтерия составляет 60%), по меньшей мере 4500 (включение дейтерия составляет 67,5%), по меньшей мере 5000 (включение дейтерия составляет 75%), по меньшей мере 5500 (включение дейтерия составляет 82,5%), по меньшей мере 6000 (включение дейтерия составляет 90%), по меньшей мере 6333,3 (включение дейтерия составляет 95%), по меньшей мере 6466,7 (включение дейтерия составляет 97%), по меньшей мере 6600 (включение дейтерия составляет 99%) или по меньшей мере 6633,3 (включение дейтерия составляет 99,5%).
Меченые соединения
Производные 3-фенил-3-метоксипирролидина по изобретению могут быть использованы в их меченой или немеченой форме. В контексте данного изобретения меченое соединение имеет замещение по одному или более чем одному атому на атом, имеющий атомную массу или массовое число, отличающиеся от атомной массы или массового числа, обычно обнаруживаемых в природе. Мечение дает возможность для легкого количественного обнаружения указанного соединения.
Меченые соединения по изобретению могут быть полезны в качестве диагностических средств, радиоактивных индикаторов или агентов для мониторинга в различных диагностических способах и для визуализации рецепторов in vivo.
Меченый изомер по изобретению предпочтительно содержит по меньшей мере один радионуклид в качестве метки. Все позитрон испускающие радионуклиды являются кандидатами для применения. В контексте данного изобретения радионуклид предпочтительно выбран из 2H (дейтерий), 3H (тритий), 11С, 13С, 14С, 131I, 125I, 123I и 18F.
Физический способ для обнаружения меченого изомера по настоящему изобретению может быть выбран из позитронно-эмиссионной томографии (PET), однофотонной эмиссионной компьютерной томографии (SPECT), магнитно-резонансной спектроскопии (MRS), магнитно-резонансной томографии (MRI) и аксиальной компьютерной томографии (CAT) или их комбинаций.
Способы получения
Производные 3-фенил-3-метоксипирролидина по изобретению могут быть получены традиционными способами химического синтеза, например описанными в рабочих примерах. Исходные вещества для способов, описанных в настоящей заявке на изобретение, известны или легко могут быть получены традиционными способами из имеющихся в продаже химических реагентов.
Кроме того, одно из соединений по изобретению может быть превращено в другое соединение по изобретению с использованием традиционных способов.
Конечные продукты описанных здесь реакций могут быть выделены традиционными способами, например путем экстракции, кристаллизации, перегонки, хроматографии и так далее.
Специалистам в данной области техники понятно, что для получения соединений по изобретению в альтернативном, и в некоторых случаях более общепринятом пути, отдельные вышеупомянутые стадии способа могут быть осуществлены в другом порядке и/или отдельные реакции могут быть осуществлены на другой стадии всего пути (то есть химические превращения могут быть осуществлены с промежуточными соединениями, отличными от соединений, которые, как описано здесь выше, связаны с конкретной реакцией).
Биологическая активность
Производные 3-фенил-3-метоксипирролидина по настоящему изобретению обладают свойствами, модулирующими норэпинефрин, дофамин и в некоторой степени серотонин, и как они, так и их фармацевтические композиции полезны в лечении многочисленных расстройств центральной нервной системы, включая психиатрические расстройства. В частности, соединения и их фармацевтические композиции применяют в лечении расстройств ЦНС, при которых нарушена функция кортикальных моноаминергических систем вследствие прямых или опосредованных причин. В еще одном воплощении соединения по настоящему изобретению могут быть использованы для лечения аффективных расстройств и когнитивных расстройств, включая нейродегенеративные расстройства и расстройства развития. Кроме того, соединения, оказывающие модулирующие действия в отношении дофаминергических систем, также могут быть использованы для улучшения двигательной и когнитивной функций.
В специальном воплощении соединения по изобретению рассматривают как полезные для лечения, предупреждения или уменьшения интенсивности симптомов деменции, возрастного когнитивного нарушения, расстройств аутистического спектра, синдрома дефицита внимания с гиперактивностью (ADHD), церебрального паралича, болезни Гентингтона, синдрома Жилль де ла Туретта, депрессии, биполярного расстройства, шизофрении, шизофреноформных расстройств, генерализованного тревожного расстройства (GAD), специфических фобий, панического расстройства, расстройств сна, биполярных расстройств, психических расстройств, вызванных приемом психоактивных веществ, ятрогенных психозов, ятрогенных галлюцинозов, неятрогенных психозов, неятрогенных галлюцинозов, расстройств настроения, тревожных расстройств, депрессии, обсессивно-компульсивного расстройства, эмоциональных нарушений, связанных со старением, болезни Альцгеймера, деменции, деменции, связанных с болезнью Альцгеймера, возрастного когнитивного нарушения, повреждения головного мозга, злоупотребления психоактивными веществами, расстройств, характеризующихся злоупотреблением едой, расстройств сна, сексуальных расстройств, расстройств приема пищи, ожирения, головных болей, боли при состояниях, характеризующихся повышенным мышечным тонусом, двигательных расстройств, болезни Паркинсона, паркинсонизма, синдромов паркинсонизма, дискинезий, дискинезий, вызванных L-дофамином (L-DOPA), дистоний, расстройств нервно-психического развития, нейродегенеративных расстройств, тиков, тремора, синдрома усталых ног, нарколепсии и расстройств поведения.
Фармацевтические композиции
В еще одном аспекте изобретения предложены новые фармацевтические композиции, содержащие терапевтически эффективные количества производных 3-фенил-3-метоксипирролидина по изобретению.
Настоящее изобретение относится к фармацевтическим композициям, содержащим соединения по настоящему изобретению, и их применению в лечении расстройств ЦНС. Как органические, так и неорганические кислоты могут быть использованы для получения нетоксичных фармацевтически приемлемых солей соединений по изобретению, полученных присоединением кислот. Подходящие соли соединений по настоящему изобретению, полученные присоединением кислот, включают соли, образованные с фармацевтически приемлемыми солями, такими как упомянутые выше. Фармацевтическая композиция, содержащая соединение по изобретению, также может содержать вещества, используемые для облегчения изготовления фармацевтического препарата или введения препаратов. Такие вещества хорошо известны специалистам в данной области техники и могут представлять собой, например, фармацевтически приемлемые адъюванты, носители и консерванты.
В клинической практике соединения по настоящему изобретению в норме вводят перорально, ректально, назально или путем инъекции в форме фармацевтических препаратов, содержащих активный ингредиент в виде свободного основания или в виде фармацевтически приемлемой нетоксичной соли присоединения кислоты, такой как гидрохлорид, лактат, ацетат или сульфамат, в ассоциации с фармацевтически приемлемым носителем. Носитель может представлять собой твердый, полутвердый или жидкий препарат. Обычно активное вещество составляет от 0,1 до 99% по массе относительно массы препарата, более конкретно от 0,5 до 20% по массе для препаратов, предназначенных для инъекции, и от 0,2 до 50% по массе для препаратов, подходящих для перорального введения.
Для приготовления фармацевтических препаратов, содержащих соединение по изобретению в форме стандартных доз для перорального применения, выбранное соединение может быть смешано с твердым эксципиентом, например лактозой, сахарозой, сорбитом, маннитом, крахмалами, такими как картофельный крахмал, кукурузный крахмал или амилопектин, производными целлюлозы, связывающим веществом, таким как желатин или поливинилпирролидон, и смазывающим веществом, таким как стеарат магния, стеарат кальция, полиэтиленгликоль, воски, парафин и тому подобное, и затем спрессовано в таблетки. Если требуются таблетки, покрытые оболочкой, то ядра (приготовленные как описано выше) могут быть покрыты концентрированным сахарным раствором, который может содержать, например, аравийскую камедь, желатин, тальк, диоксид титана и тому подобное. Альтернативно, таблетка может быть покрыта полимером, известным специалисту в данной области техники, растворенным в легколетучем органическом растворителе или смеси органических растворителей. Красители могут быть добавлены к этим оболочкам для того, чтобы легко различать таблетки, содержащие различные активные вещества или различные количества активного соединения.
Для изготовления мягких желатиновых капсул активное вещество может быть смешано, например, с растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы активного вещества с использованием упомянутых для таблеток эксципиентов, например лактозы, сахарозы, сорбита, маннита, крахмалов (например, картофельного крахмала, кукурузного крахмала или амилопектина), производных целлюлозы или желатина. Кроме того, жидкие или полутвердые лекарственные средства могут быть заполнены в твердые желатиновые капсулы.
Ниже приведены примеры композиций таблеток и капсул, подходящих для перорального введения:
|
Стандартные дозы для ректального применения могут представлять собой растворы или суспензии или могут быть приготовлены в форме суппозиториев, содержащих активное вещество в смеси с нейтральной жировой основой, или желатиновых ректальных капсул, содержащих активное вещество в смеси с растительным маслом или парафиновым маслом. Жидкие препараты для перорального применения могут находиться в форме сиропов или суспензий, например растворов, содержащих от приблизительно 0,2% до приблизительно 20% по массе описанного здесь активного вещества, остальное до 100% представляет собой сахар и смесь этанола, воды, гликоля и пропиленгликоля. Возможно, такие жидкие препараты могут содержать красители, корригенты, сахарин и карбоксиметилцеллюлозу в качестве загустителя или другие эксципиенты, известные специалистам в данной области техники.
Растворы для парентерального применения путем инъекции могут быть приготовлены в водном растворе водорастворимой фармацевтически приемлемой соли активного вещества, предпочтительно в концентрации от 0,5% до приблизительно 10% по массе. Эти растворы также могут содержать стабилизаторы и/или буферы и для удобства могут быть представлены в ампулах с варьирующим объемом стандартной дозы. Применение и введение пациенту, которого лечат, легко понятно специалисту в данной области техники.
Для интраназального введения или введения путем ингаляции соединения по настоящему изобретению могут быть доставлены в форме раствора, сухого порошка или суспензии. Введение может быть осуществлено при помощи пульверизатора из контейнера под давлением, который пациент сжимает или накачивает, или при помощи аэрозольного спрея из контейнера под давлением или распылителя с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящее газа. Соединения по изобретению также могут быть введены при помощи сухого порошкового ингалятора, либо в виде тонкоизмельченного порошка в комбинации с веществом-носителем (например, сахаридом), либо в виде микросфер. Ингалятор, пульверизатор или аэрозольный спрей может представлять собой разовую дозу или дробные дозы. Дозировку можно контролировать при помощи клапана, который доставляет отмеренное количество активного соединения.
Соединения по изобретению также могут быть введены в композиции с контролируемым высвобождением. Соединения высвобождаются с требуемой скоростью для поддержания постоянной фармакологической активности в течение желаемого периода времени. Такие лекарственные формы обеспечивают поступление лекарственного средства в организм в течение предопределенного периода времени и, таким образом, поддерживают уровни лекарственного средства в терапевтическом диапазоне в течение более длительных периодов времени по сравнению с обычными композициями с неконтролируемым высвобождением. Соединения также могут быть приготовлены в композициях с контролируемым высвобождением, в которых высвобождение активного соединения является направленным. Например, высвобождение соединения может быть ограничено конкретной областью пищеварительной системы вследствие зависимости композиции от рН. Такие композиции хорошо известны специалистам в данной области техники.
Дополнительную подробную информацию относительно способов приготовления и введения можно найти в последнем издании Remington's Pharmaceutical Sciences (Maack Publishing Co., Easton, PA).
В зависимости от расстройства и пациента, которого лечат, и пути введения композиции могут быть введены в различных дозах. Дозировка также зависит от способности вcacываться и частоты и пути введения. Такие дозы могут быть введены один, два, три или более раз в сутки. Соединения по изобретению могут быть введены субъектам в дозах, находящихся в диапазоне от 0,01 мг до 500 мг на кг массы тела в сутки, хотя отклонения безусловно имеют место в зависимости от массы тела, пола и состояния пациента, которого лечат, болезненного состояния, которое лечат, и конкретного выбранного пути введения. Тем не менее, уровень доз, который находится в диапазоне от 0,1 мг до 10 мг на кг массы тела в сутки, разовая или дробная дозы наиболее желательно используются людьми для лечения заболеваний. Альтернативно, уровень дозы является таким, что достигается концентрация соединения в сыворотке крови, составляющая от 0,1 нМ до 10 мкМ.
ПРИМЕРЫ
Изобретение дополнительно проиллюстрировано в нижеприведенных примерах и как изложено ниже, которые не предназначены никоим образом ограничивать объем изобретения.
В контексте изобретения «энантиомер 1» и «энантиомер 2» конкретного соединения означает, что его синтезируют из исходного вещества с высоким энантиомерным избытком и известным оптическим вращением. Тем не менее, энантиомер 1 или энантиомер 2 конкретного соединения также может быть синтезирован из энантиомера 1 и энантиомера 2 другого соединения.
Пример 1
(+)-3-(3-ХЛОР-2-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
К раствору (+)-1-бензил-3-(3-хлор-2-фторфенил)-3-метоксипирролидина (1,04 г, 3,25 ммоль) в 1,2-дихлорэтане (10 мл) добавляли 1-хлорэтилхлорформиат (1,42 мл, 13,08 ммоль) и эту смесь нагревали до температуры дефлегмации в течение 2 ч, после чего растворитель выпаривали. Смесь растворяли в метаноле (20 мл) и нагревали до температуры дефлегмации в течение 1 ч, растворитель выпаривали и очищали посредством высокоэффективной жидкостной хроматографий (HPLC) на waters OBD C18, 5 мкм (МеОН/33 мМ NN3, от 20:80 до 50:50) с получением указанного в заголовке соединения, 0,47 г (63%). [α]D=+6,5° (метанол). Амин превращали в соль щавелевой кислоты и перекристаллизовывали из смеси метанол/диэтиловый эфир: Т пл.183-185°С. MS (масс-спектрометрия) m/z (отн. интенсивность 70 эВ) 229 (М+, 1), 199 (86), 187 (bp), 157 (49), 133 (42).
Пример 2
(+)-3-(3-ХЛОР-2-ФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИН
К раствору (+)-3-(3-хлор-2-фторфенил)-3-метоксипирролидина (0,25 г, 1,08 ммоль) и триэтиламина (0,305 мл, 2,17 ммоль) в тетрагидрофуране (20 мл) добавляли йодэтан (0,13 мл, 1,63 ммоль) и этот раствор перемешивали при температуре окружающей среды в течение 26 ч. Добавляли воду (20 мл) и водную фазу экстрагировали EtOAc (2×50 мл), объединенную органическую фазу сушили (Na2SО4) и растворитель выпаривали. Очистка посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NH3, от 20:80 до 65:35) дала указанное в заголовке соединение 0,106 г (38%). [α]D=+16,5° (метанол). Амин превращали в соль фумаровой кислоты и перекристаллизовывали из смеси 2-пропанол/диизопропиловый эфир: Т пл. 131-133°С. MS m/z (отн. интенсивность 70 эВ) 257 (М+, 9), 242 (bp), 227 (44), 157 (44), 71 (89).
Пример 3
(-)-3-(3-ХЛОР-2-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 1. (-)-1-Бензил-3-(3-хлор-2-фторфенил)-3-метоксипирролидин (0,82 г, 2,56 ммоль), 1,2-дихлорэтан (10 мл), 1-хлорэтилхлорформиат (1,12 мл, 10,25 ммоль) кипятили с обратным холодильником в течение 2 ч и метанол (20 мл) кипятили с обратным холодильником в течение 1 ч. Очистка посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NН3, от 20:80 до 50:50) дала указанное в заголовке соединение (0,38 г, 65%). [α]D=-7,1° (метанол). Амин превращали в соль щавелевой кислоты и перекристаллизовывали из смеси метанол/диэтиловый эфир: Т пл. 183-185°С. MS m/z (отн. интенсивность 70 эВ) 229 (М+, 1), 199 (87), 187 (bp), 157(55), 133(51).
Пример 4
(-)-3-(3-ХЛОР-2-ФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 2. (-)-3-(3-Хлор-2-фторфенил)-3-метоксипирролидин (0,234 г, 1,02 ммоль), тетрагидрофуран (20 мл), йодэтан (0,122 мл, 1,15 ммоль) и триэтиламин (0,285 мл, 2,04 ммоль), этот раствор перемешивали в течение 26 ч. Очистка посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NH3, от 20:80 до 65:35) дала указанное в заголовке соединение 0,094 г (35,9%). [α]D=-16,1° (метанол). Амин превращали в соль фумаровой кислоты и перекристаллизовывали из смеси 2-пропанол/диизопропиловый эфир: Т пл. 131-133°С. MS m/z (отн. интенсивность 70 эВ) 257 (М+, 4), 242 (38), 227 (20), 157 (31),71 (bp).
Пример 5
(+)-3-(2,3-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 1. (+)-1-Бензил-3-(2,3-фторфенил)-3-метоксипирролидин (0,58 г, 1,91 ммоль), 1,2-дихлорэтан (10 мл), 1-хлорэтилхлорформиат (0,83 мл, 7,65 ммоль) кипятили с обратным холодильником в течение 2 ч и метанол (20 мл) кипятили с обратным холодильником в течение 1 ч. Очистка посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NН3, от 20:80 до 50:50) дала указанное в заголовке соединение (0,28 г, 69%). [α]D=+7,6° (метанол). Амин превращали в соль щавелевой кислоты и перекристаллизовывали из смеси метанол/диэтиловый эфир: Т пл. 182-184°С. MS m/z (отн. интенсивность 70 эВ) 213 (М+, 1), 183 (94), 171 (bp), 141 (61), 127(44).
Пример 6
(+)-3-(2,3-ДИФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 2. (+)-3-(2,-дифторфенил)-3-метоксипирролидин (0,183 г, 0,858 ммоль), тетрагидрофуран (20 мл), йодэтан (0,103 мл, 1,28 ммоль) и триэтиламин (0,24 мл, 1,71 ммоль), этот раствор перемешивали в течение 18 ч. Очистка посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NН3, от 20:80 до 65:35) дала указанное в заголовке соединение 0,073 г (35,2%). [α]D=+18,8° (метанол). Амин превращали в соль фумаровой кислоты и перекристаллизовывали из смеси 2-пропанол/диизопропиловый эфир: Т пл. 104-106°С. MS m/z (отн. интенсивность 70 эВ) 241 (М+, 5), 226 (54), 211 (27), 141 (50), 71 (bp).
Пример 7
(-)-3-(2,3-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 1. (-)-1-Бензил-3-(2,3-фторфенил)-3-метоксипирролидин (0,874 г, 2,88 ммоль), 1,2-дихлорэтан (10 мл), 1-хлорэтилхлорформиат (1,25 мл, 11,52 ммоль) кипятили с обратным холодильником в течение 5 ч и метанол (20 мл) кипятили с обратным холодильником в течение 1 ч. Очистка посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NН3, от 20:80 до 50:50) дала указанное в заголовке соединение (0,376 г, 61%). [α]D=-5,9° (метанол). Амин превращали в соль щавелевой кислоты и перекристаллизовывали из смеси метанол/диэтиловый эфир: Т пл. 180-183°С. MS m/z (отн. интенсивность 70 эВ) 213 (М+, 1), 183 (90), 171 (bp), 141 (48), 127 (38).
Пример 8
(-)-3-(2,3-ДИФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 2. (-)-3-(2,-Дифторфенил)-3-метоксипирролидин (0,256 г, 1,20 ммоль), тетрагидрофуран (20 мл), йодэтан (0,144 мл, 1,80 ммоль) и триэтиламин (0,34 мл, 2,40 ммоль), этот раствор перемешивали в течение 24 ч. Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат/метанол, от 1:0 до 1:1) дала указанное в заголовке соединение 0,15 г (53%). [α]D=-17,3° (метанол). Амин превращали в соль фумаровой кислоты и перекристаллизовывали из смеси 2-пропанол/диизопропиловый эфир: Т пл. 105-107°С. MS m/z (отн. интенсивность 70 эВ) 241 (М+, 5), 226 (54), 211 (27), 141 (50), 71 (bp).
Пример 9
3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с подготовительным примером 15. Трет-бутил-3-(3,4-дифторфенил)-3-метоксипирролидин-1-карбоксилат (2,65 г, 8,46 ммоль), дихлорметан (20 мл) и трифторуксусная кислота (5 мл). Очистка на колонке Biotage Isolute SCX-3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1) дала указанное в заголовке соединение (1,15 г, 63%). Амин превращали в соль щавелевой кислоты и перекристаллизовывали из смеси метанол/диэтиловый эфир: Т пл. 155-156°С. MS m/z (отн. интенсивность 70 эВ) 198 (46), 183 (79), 171 (bp), 141 (53), 113 (41).
Пример 10
3-(3,4-ДИФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИН
К раствору 3-(3,4-дифторфенил)-3-метоксипирролидина (0,19 г, 0,89 ммоль) в ацетонитриле (5 мл) добавляли карбонат калия (0,17 г, 1,25 ммоль) и йодэтан (0,075 мл, 0,94 ммоль) и эту смесь перемешивали при температуре окружающей среды 5 ч. Добавляли водный карбонат натрия (10%, 50% мл) и этилацетат (50 мл) и органическую фазу собирали. Водную фазу экстрагировали этилацетатом (2×50 мл) и объединенную органическую фазу промывали рассолом, сушили (Na2SO4) и упаривали с получением неочищенного продукта. Очистка на колонке Biotage Isolute SCX-3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1) с последующей колоночной флэш-хроматографией на силикагеле (ЕtOАс/МеОН 4:1) дала указанное в заголовке соединение (0,10 г, 46%). Амин превращали в соль щавелевой кислоты и перекристаллизовывали из смеси метанол/диэтиловый эфир: Т пл. 135-136°С. MS m/z (отн. интенсивность 70 эВ) 241 (4), 226 (27), 211 (17), 141 (26), 71 (bp).
Пример 11
3-(3-ХЛОР-5-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
К раствору трет-бутил-3-(3-хлор-5-фторфенил)-3-метоксипирролидин-1-карбоксилата (1,57 г, 4,77 ммоль) в дихлорметане (20 мл) добавляли трифторуксусную кислоту (5 мл). Смесь перемешивали в течение 1 ч при температуре окружающей среды, после чего растворитель выпаривали. Очистка на колонке Biotage Isolate SCX-3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1) дала указанное в заголовке соединение (0,845 г, 77%). Амин превращали в соль щавелевой кислоты и перекристаллизовывали из смеси метанол/диэтиловый эфир: Т пл. 169-170°С. MS m/z (отн. интенсивность 70 эВ) 199 (bp), 187 (93), 157 (61), 133 (66), 129 (59).
Пример 12
3-(2,3-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с подготовительным примером 15. Трет-бутил-3-(2,3-дифторфенил)-3-метоксипирролидин-1-карбоксилат (4,7 г, 15 ммоль), дихлорметан (20 мл) и трифторуксусная кислота (5 мл). Очистка на колонке Biotage Isolute SCX-3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1) дала указанное в заголовке соединение (2,71 г, 85%). Амин превращали в соль соляной кислоты и перекристаллизовывали из смеси метанол/диэтиловый эфир: Т пл. 152-153°С. MS m/z (отн. интенсивность 70 эВ) 198 (44), 183 (95), 171 (bp), 141 (61), 127 (44).
Пример 13
3-(2,3-ДИФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИН
Смесь 3-(2,3-дифторфанил)-3-метоксипирропидина (0,4 г, 1,87 моль), ацетонитрила (5 мл), карбоната натрия (0,52 г, 3,74 ммоль) и йодэтана (0,28 г, 1,87 ммоль) нагревали при 110°С в герметично закрытой пробирке под действием микроволнового излучения в течение 10 минут. Добавляли воду (30 мл) и водную фазу экстрагировали этилацетатом (2×50 мл), объединенные органические фазы сушили (MgSO4) и упаривали с получением неочищенного продукта (0,45 г). Очистка путем флэш-хроматографии (этилацетат/метанол 1:1) и посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NН3, от 20:80 до 50:50) дала указанное в заголовке соединение (0,12 г, 27%). Амин превращали в соль фумаровой кислоты и перекристаллизовывали из смеси метанол/диэтиловый эфир/диизопропиловый эфир: Т пл. 94-98°С. MS m/z (отн. интенсивность 70 эВ) 241 (М+, 5), 226 (54), 211 (27), 141 (50), 71 (bp).
Пример 14
(+)-3-(3,5-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 1. (+)-1-Бензил-3-(3,5-дифторфенил)-3-метоксипирролидин (0,35 г, 1,15 ммоль), 1,2-дихлорэтан (20 мл), 1-хлорэтилхлорформиат (0,50 мл, 4,6 ммоль) кипятили с обратным холодильником в течение 2 ч и метанол (10 мл) кипятили с обратным холодильником в течение 1 ч. Очистка посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NН3, от 20:80 до 50:50) дала указанное в заголовке соединение (0,087 г, 35%). [α]D=+2,1° (метанол). Амин превращали в соль щавелевой кислоты и перекристаллизовывали из смеси метанол/диэтиловый эфир: Т пл. 185-187°С. MS m/z (отн. интенсивность 70 эВ) 213 (М+, 1), 198 (54), 183 (bp), 171 (85), 141 (47).
Пример 15
(-)-3-(3,5-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Смесь (-)-1-бензил-3-(3,5-дифторфенил)-3-метоксипирролидина (0,43 г, 1,41 ммоль), формиата аммония (0,18 г, 2,83 ммоль) и палладия на углероде (10%, 0,08 г) в этаноле (10 мл) кипятили с обратным холодильником в течение 40 мин. Добавляли дополнительное количество формиата аммония (0,18 г, 2,83 ммоль), и после кипячения с обратным холодильником в течение 90 мин все исходное вещество было израсходовано. Реакционную смесь оставляли достичь температуры окружающей среды и фильтровали через слой целита и растворитель выпаривали. Оставшееся масло растворяли в мехиленхлориде и добавляли карбонат калия (2 г). Эту смесь перемешивали в течение ночи, фильтровали и упаривали с получением указанного в заголовке соединения (0,24 г, 79%). [α]D=-2,1° (метанол). Амин превращали в соль щавелевой кислоты и перекристаллизовывали из смеси метанол/диэтиловый эфир: Т пл. 185-187°С. MS m/z (отн. интенсивность 70 эВ) 213 (М+, 1), 198 (58), 183 (bp), 171 (84), 141 (55).
Пример 16
ЭНАНТИОМЕР 1 3-(3,5-ДИФТОРФЕНИЛ)-3-МЕТОКСИ-1-МЕТИЛПИРРОЛИДИНА
Смесь (+)-3-(3,5-дифторфенил)-3-метоксипирролидина (0,02 г, 0,094 ммоль) в муравьиной кислоте (1 мл) и формальдегиде (37% раствор в воде, 1 мл) нагревали при 85°С в течение 5 ч. Эту смесь оставляли достичь температуры окружающей среды, добавляли воду (5 мл) и диэтиловый эфир, фазы разделяли и водную фазу подщелачивали путем добавления водного гидроксида натрия (5М). Водную фазу дважды экстрагировали этилацетатом, объединенные органические фазы сушили (Na2SO4) и упаривали с получением неочищенного продукта, который разбавляли в метаноле и анализировали посредством GCMS (газовой хроматографии/масс-спектрометрии). MS m/z (относительная интенсивность, 70 эВ) 227 (М+, 5), 212 (29), 197 (25), 141 (42), 57 (bp).
Пример 17
ЭНАНТИОМЕР 2 3-(3,5-ДИФТОРФЕНИЛ)-3-МЕТОКСИ-1-МЕТИЛПИРРОЛИДИНА
Получение в соответствии с примером 16. (-)-3-(3,5-Дифторфенил)-3-метоксипирролидин (0,02 г, 0,094 ммоль), муравьиную кислоту (1 мл) и формальдегид (40% раствор в воде, 1 мл) нагревали при 85°С в течение 5 ч, обработка в соответствии с подготовительным примером 16. MS m/z (относительная интенсивность, 70 эВ) 227 (М+, 5), 212 (32), 197 (28), 141 (45), 57 (bр).
Пример 18
ЭНАНТИОМЕР 1 3-(3,5-ДИФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИНА
К раствору (+)-3-(3,5-дифторфенил)-3-метоксипирролидина (0,01, 0,047 ммоль) и триэтиламина (13,1 мкл, 0,0938 ммоль) в тетрагидрофуране (3 мл) добавляли йодэтан (5,6 мкл, 0,070 ммоль). Полученную в результате смесь перемешивали при температуре окружающей среды в течение 24 ч и затем разбавляли метанолом и анализировали посредством GCMS и LCMS. Анализ продемонстрировал превращение 64%. MS m/z (относительная интенсивность, 70 эВ) 241 (М+, 10), 226 (86), 211 (33), 141 (49), 71 (bр).
Пример 19
ЭНАНТИОМЕР 2 3-(3,5-ДИФТОРФЕНИЛ)-1-ЭТИЛ-3- ПИРРОЛИДИНА
Получение в соответствии с примером 20. (-)-3-(3,5-Дифторфенил)-3-метоксипирролидин (0,01 г, 0,047 ммоль) и триэтиламин (13,1 мкл, 0,0938 ммоль) в тетрагидрофуране (3 мл), добавляли йодэтан (5,6 мкл, 0,070 ммоль). Анализ продемонстрировал превращение 60%. MS m/z (относительная интенсивность, 70 эВ) 241 (М+, 9), 226 (74), 211 (28), 141 (47), 71 (bр).
Пример 20
(+)-3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 1. (+)-1-Бензил-3-(3,4-дифторфенил)-3-метоксипирролидин (0,202 г, 0,66 ммоль), 1,2-дихлорэтан (20 мл), 1-хлорэтилхлорформиат (0,38 г, 2,66 ммоль) кипятили с обратным холодильником в течение 1 ч и метанол (20 мл) кипятили с обратным холодильником в течение 1 ч. Очистка посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NН3, от 20:80 до 50:50) дала указанное в заголовке соединение (0,111 г, 78%). [α]D=+5,8° (метанол). MS m/z (отн. интенсивность 70 эВ) 213 (М+, 1), 198 (44), 183 (84), 171 (bр), 141 (45).
Пример 21
(-)-3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 1. (-)-1-Бензил-3-(3,4-дифторфенил)-3-метоксипирролидин (0,264 г, 0,87 ммоль), 1,2-дихлорэтан (20 мл), 1-хлорэтилхлорформиат (0,49 г, 3,48 ммоль) кипятили с обратным холодильником в течение 1 ч и метанол (20 мл) кипятили с обратным холодильником в течение 1 ч. Очистка посредством HPLC на waters OBD C18, 5 мкм (MeOH/33 мМ NН3, от 20:80 до 50:50) дала указанное в заголовке соединение (0,181 г, 97%). [α]D=-6,1° (метанол). MS m/z (отн. интенсивность 70 эВ) 213 (М+, 1), 198 (51), 183 (88), 171 (bp), 141 (53).
Пример 22
ЭНАНТИОМЕР 2 3-(3,4-ДИФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИНА
К раствору (-)-3-(3,4-дифторфенил)-3-метоксипирролидина (0,013 г, 0,061 ммоль) и триэтиламина (17,1 мкл, 0,122 ммоль) в тетрагидрофуране (2 мл) добавляли йодэтан (7,3 мкл, 0,091 ммоль), полученный в результате раствор перемешивали при температуре окружающей среды в течение 24 ч. Неочищенную смесь очищали на колонке Biotage Isolute SCX-3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1). Растворитель выпаривали и неочищенный продукт анализировали посредством GCMS. Анализ продемонстрировал превращение 76%. MS m/z (относительная интенсивность, 70 эВ) 241 (М+, 7), 226 (57), 211 (24), 141 (43), 71 (bp).
Пример 23
ЭНАНТИОМЕР 2 3-(3,4-ДИФТОРФЕНИЛ)-1-(ЭТИЛ-05)-3-МЕТОКСИПИРРОЛИДИНА
Получение в соответствии с примером 22. (-)-3-(3,4-Дифторфенил)-3-метоксипирролидин (0,013 г, 0,061 ммоль), триэтиламин (17,1 мкл, 0,122 ммоль), тетрагидрофуран (2 мл) и йодэтан-05 (7,3 мкл, 0,091 ммоль). Анализ продемонстрировал превращение менее чем 95%. MS m/z (относительная интенсивность, 70 эВ) 246 (М+, 4), 231 (29), 216 (16), 141 (34), 76 (bp).
Пример 24
ЭНАНТИОМЕР 2 3-(3,4-ДИФТОРФЕНИЛ)-(1-0)-3-МЕТОКСИПИРРОЛИДИНА
К перемешиваемому раствору (-)-3-(3,4-дифторфенил)-3-метоксипирролидина (0,013 г, 0,061 ммоль) в безводном тетрагидрофуране (3 мл) при -78°С в атмосфере азота добавляли раствор н-бутиллития в гексане (2,5 М, 0,037 мл, 0,0915 ммоль). Эту смесь перемешивали при -78°С в течение 30 мин, после чего добавляли оксид дейтерия (0,01 мл, 0,55 ммоль) и оставляли для достижения комнатной температуры. Неочищенную смесь очищали на колонке Biotage Isolute SCX-3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1). Растворитель выпаривали и неочищенный продукт анализировали посредством GCMS. Анализ продемонстрировал превращение более 95%. MS m/z (относительная интенсивность, 70 эВ) 214 (М+, 1), 184 (79), 172 (bp), 142 (62), 114 (57).
Пример 25
ЭНАНТИОМЕР 2 3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИ-1-МЕТИЛПИРРОЛИДИНА
Смесь (-)-3-(3,4-дифторфенил)-3-метоксипирролидина (0,013 г, 0,061 ммоль) в муравьиной кислоте (1 мл) и формальдегида (37% раствор в воде, 1 мл) нагревали при 85°С в течение 5 ч. Этот раствор оставляли достичь комнатной температуры. Неочищенную смесь очищали на колонке Biotage Isolute SCX-3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1). Растворитель выпаривали. Неочищенный продукт анализировали посредством GCMS. Анализ продемонстрировал превращение 87%. MS m/z (относительная интенсивность, 70 эВ) 227 (М+, 5), 212 (26), 197 (30), 141 (47), 57 (bp).
Пример 26
ЭНАНТИОМЕР 2 3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИ-1-(МЕТИЛ-03)-ПИРРОЛИДИНА
Получение в соответствии с примером 25: (-)-3-(3,4-дифторфенил)-3-метоксипирролидин (0,013 г, 0,061 ммоль), муравьиную кислоту-d2 (1 мл) и формальдегид-d2 (20% раствор в D2O, 1 мл). Анализ продемонстрировал превращение 59%. MS m/z (относительная интенсивность, 70 эВ) 230 (М+, 3), 215 (18), 200 (18), 141 (37), 60 (bp).
Пример 27
ЭНАНТИОМЕР 1 3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИ-1-(МЕТИЛ-03)-ПИРРОЛИДИНА
Получение в соответствии с примером 25: (+)-3-(3,4-дифторфенил)-3-метоксипирролидин (0,01 г, 0,047 ммоль), муравьиную кислоту-d2 (1 мл), формальдегид-d2 (20% раствор в D2O, 1 мл). Анализ продемонстрировал превращение 68%. MS m/z (относительная интенсивность, 70 эВ) 230 (М+, 3), 215 (17), 200 (18), 141 (36), 60 (bp).
Пример 28
ЭНАНТИОМЕР 1 3-(3,4-ДИФТОРФЕНИЛ)-(1-0)-3-МЕТОКСИПИРРОДИДИНА
Получение в соответствии с примером 24: (+)-3-(3,4-дифторфенил)-3-метоксипирролидин (0,01 г, 0,067 ммоль), безводный тетрагидрофуран (3 мл), н-бутиллитий (0,028 мл, 0,070 ммоль), оксид дейтерия (0,01 мл, 0,55 ммоль). Неочищенный продукт анализировали посредством GCMS. Анализ продемонстрировал превращение менее чем 95%. MS m/z (относительная интенсивность, 70 эВ) 184 (81), 172 (bp), 171 (53), 142 (62), 114 (71).
Пример 29
ЭНАНТИОМЕР 1 3-(3,4-ДИФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИНА
Получение в соответствии с примером 22: (+)-3-(3,4-дифторфенил)-3-метоксипирролидин (0,01 г, 0,047 ммоль), триэтиламин (13,1 мкл, 0,093 ммоль), тетрагидрофуран (2 мл) и йодэтан (5,6 мкл, 0,07 ммоль). Неочищенный продукт анализировали посредством GCMS. Анализ продемонстрировал превращение 92%. MS m/z (относительная интенсивность, 70 эВ) 241 (М+, 6), 226 (46), 211 (23), 141 (43), 71 (bp).
Пример 30
ЭНАНТИОМЕР 1 3-(3,4-ДИФТОРФЕНИЛ)-1-(ЭТИЛ-D5)-3-МЕТОКСИПИРРОЛИДИНА
Получение в соответствии с примером 22: (+)-3-(3,4-дифторфенил)-3-метоксипирролидин (0,01 г, 0,047 ммоль), триэтиламин (13,1 мкл, 0,093 ммоль), тетрагидрофуран (2 мл) и йодэтан-d5 (5,64 мкл, 0,07 ммоль). Неочищенный продукт анализировали посредством GCMS. Анализ продемонстрировал превращение 73%. MS m/z (относительная интенсивность, 70 эВ) 241 (М+, 7), 246 (8), 231 (58), 141 (50), 76 (bp).
Пример 31
ЭНАНТИОМЕР 1 3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИ-1-МЕТИЛПИРРОЛИДИНА
Получение в соответствии с примером 25: (+)-3-(3,4-дифторфенил)-3-метоксипирролидин (0,01 г, 0,047 ммоль) в муравьиной кислоте (1 мл) и формальдегид (37% раствор в воде, 1 мл). Неочищенный продукт анализировали посредством GCMS. Анализ продемонстрировал превращение 87%. MS m/z (относительная интенсивность, 70 эВ) 227 (М+, 3), 212 (17), 197 (18), 141 (36), 57 (bp).
Пример 32
ЭНАНТИОМЕР 2 3-(3,4-ДИФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИН-1-ОКСИДА
К перемешиваемому раствору энантиомера 2 3-(3,4-дифторфенил)-1-этил-3-метоксипирролидина (0,011 г, 0,045 ммоль) в дихлорметане (2 мл) добавляли 3-хлорпероксибензойную кислоту (77%) (0,0204 г, 0,09 ммоль). Эту смесь перемешивали при комнатной температуре в течение 30 мин и затем фильтровали через слой оксида алюминия (основного), который элюировали смесью дихлорметан:МеОН (9:1). Неочищенный продукт анализировали посредством LCMS (жидкостной хроматографии/масс-спектрометрии) (Qtrap, Applied Biosystems, Q1 MS). Анализ продемонстрировал превращение менее чем 95%: MS (m+1)/z; 258 (M + 1, bp), 259 (23), 257 (3), 214 (7), 142 (5).
Пример 33
ЭНАНТИОМЕР 2 3-(3,4-ДИФТОРФЕНИЛ)-1-(ЭТИЛ-D5)-3-МЕТОКСИПИРРОЛИДИН-1-ОКСИДА
Получение в соответствии с примером 32: Энантиомер 2 3-(3,4-дифторфенил)-1-(этил-d5)-3-метоксипирролидина (0,014 г, 0,057 ммоль), дихлорметан (2 мл), 3-хлорпероксибензойная кислота (77%) (0,025 г, 0,114 ммоль). Неочищенный продукт анализировали посредством LCMS (Qtrap, Applied Biosystems, Q1 MS), анализ продемонстрировал превращение менее чем 95%: MS (m+1)/z; 263 (M + 1, bp), 262 (7), 230 (4), 214 (9), 150 (4).
Пример 34
ЭНАНТИОМЕР 2 3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИ-1-МЕТИЛПИРРОЛИДИН-1-ОКСИДА
Получение в соответствии с примером 32: Энантиомер 2 3-(3,4-дифторфенил)-3-метокси-1-метилпирролидина (0,012 г, 0,052 ммоль), дихлорметан (2 мл), 3-хлорпероксибензойная кислота (77%) (0,023 г, 0,104 ммоль). Неочищенный продукт анализировали посредством LCMS (Qtrap, Applied Biosystems, Q1 MS), анализ продемонстрировал превращение менее чем 95%: MS (m+1)/z; 244 (M + 1, bp), 243 (4), 214 (9), 150 (3).
Пример 35
ЭНАНТИОМЕР 2 3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИ-1-(МЕТИЛ-D3)-ПИРРОЛИДИН-1-ОКСИДА
Полунение в соответствии с примером 32: Энантиомер 2 3-(3,4-дифторфенил)-3-метокси-1-(метил-d3)-пирролидина (0,008 г, 0,035 ммоль), дихлорметан (2 мл), 3-хлорпероксибензойная кислота (77%) (0,015 г, 0,069 ммоль). Неочищенный продукт анализировали посредством LCMS (Qtrap, Applied Biosystems, Q1 MS), анализ продемонстрировал превращение менее чем 95%: MS (m+1)/z; 247 (M+1, 99), 246 (15), 228 (12), 214 (11), 116 (7).
Пример 36
ЭНАНТИОМЕР 1 3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИ-1-(МЕТИЛ-D3)-ПИРРОЛИДИН-1-ОКСИДА
Получение в соответствии с примером 32: Энантиомер 1 3-(3,4-дифторфенил)-3-метокси-1-(метил-d3)-пирролидина (0,007 г, 0,029 ммоль), дихлорметан (2 мл), 3-хлорпероксибензойная кислота (77%) (0,013 г, 0,059 ммоль). Неочищенный продукт анализировали посредством LCMS (Qtrap, Applied Biosystems, Q1 MS), анализ продемонстрировал превращение менее чем 95%: MS (m+1)/z; 247 (M+1, bp), 246 (7), 228 (4), 214 (14), 116 (9).
Пример 37
ЭНАНТИОМЕР 1 3-(3,4-ДИФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИН-1-ОКСИДА
Получение в соответствии с примером 32: Энантиомер 1 3-(3,4-дифторфенил)-1-этил-3-метоксипирролидина (0,009 г, 0,037 ммоль), дихлорметан (2 мл), 3-хлорпероксибензойная кислота (77%) (0,017 г, 0,075 ммоль). Неочищенный продукт анализировали посредством LCMS (Qtrap, Applied Biosystems, Q1 MS), анализ продемонстрировал превращение менее чем 95%: MS (m+1)/z; 258 (M+1, bp), 257 (7), 226 (3), 214 (5), 211 (3).
Пример 38
ЭНАНТИОМЕР 1 3-(3,4-ДИФТОРФЕНИЛ)-1-(ЭТИЛ-D5)-3-МЕТОКСИПИРРОЛИДИН-1-ОКСИДА
Получение в соответствии с примером 32: Энантиомер 1 3-(3,4-дифторфенил)-1-(этил-d5)-3-метоксипирролидина (0,007 г, 0,029 ммоль), дихлорметан (2 мл), 3-хлорпероксибензойная кислота (77%) (0,013 г, 0,059 ммоль). Неочищенный продукт анализировали посредством LCMS (Qtrap, Applied Biosystems, Q1 MS), анализ продемонстрировал превращение менее чем 95%: MS (m+1)/z; 263 (M+1, bp), 262 (14), 228 (4), 214 (6).
Пример 39
ЭНАНТИОМЕР 1 3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИ-1-МЕТИЛПИРРОЛИДИН-1-ОКСИДА
Получение в соответствии с примером 32: Энантиомер 1 3-(3,4-дифторфенил)-3-метокси-1-метилпирролидина (0,009 г, 0,039 ммоль), дихлорметан (2 мл), 3-хлорпероксибензойная кислота (77%) (0,018 г, 0,08 ммоль). Неочищенный продукт анализировали посредством LCMS (Qtrap, Applied Biosystems, Q1 MS), анализ продемонстрировал превращение менее чем 95%: MS (m+1)/z; 244 (M+1, bp), 243 (8), 214 (4), 197 (4), 142 (4).
Пример 40
(+)-3-(3-ХЛОР-5-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 1: (+)-1-бензил-3-(3-хлор-5-фторфенил)-3-метоксипирролидин (0,212 г, 0,66 ммоль), 1,2-дихлорэтан (20 мл), 1-хлорэтилхлорформиат (0,38 г, 2,65 ммоль). Очистка посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NН3, от 20:80 до 50:50) дала указанное в заголовке соединение 0,042 г (27%). [α]D=+2,7° (метанол). MS m/z (относительная интенсивность, 70 эВ) 229 (М+, 1), 214 (58), 199 (bр), 187(75), 157(37).
Пример 41
(-)-3-(3-ХЛОР-5-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 1: (-)-1-бензил-3-(3-хлор-5-фторфенил)-3-метоксипирролидин (0,265 г, 0,83 ммоль), 1,2-дихлорэтан (20 мл), 1-хлорэтилхлорформиат (0,47 г, 3,31 ммоль). Очистка посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NН3, от 20:80 до 50:50) дала указанное в заголовке соединение 0,099 г (52%). [α]D=-2,8° (метанол). MS m/z (относительная интенсивность, 70 эВ) 229 (М+, 1), 214 (53), 199 (bp), 187 (81), 133(56).
Пример 42
(+)-3-(3-ХЛОР-4-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 1: (+)-1-бензил-3-(3-хлор-4-фторфенил)-3-метоксипирролидин (0,405 г, 1,27 ммоль), 1,2-дихлорэтан (20 мл), 1-хлорэтилхлорформиат (0,72 г, 5,06 ммоль). Очистка посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NН3, от 20:80 до 50:50) дала указанное в заголовке соединение 0,15 г (51%). [α]D=+3,3° (метанол). MS m/z (относительная интенсивность, 70 эВ) 229 (М+1), 214 (37), 199 (77), 187 (bp), 157(38).
Пример 43
(-)-3-(3-ХЛОР-4-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с примером 1: (-)-1-бензил-3-(3-хлор-4-фторфенил)-3-метоксипирролидин (0,39 г, 1,22 ммоль), 1,2-дихлорэтан (20 мл), 1-хлорэтилхлорформиат (0,69 г, 4,88 ммоль). Очистка посредством HPLC на waters OBD C18, 5 мкм (МеОН/33 мМ NН3, от 20:80 до 50:50) дала указанное в заголовке соединение 0,149 г (53%). [α]D=-3,4° (метанол). MS m/z (относительная интенсивность, 70 эВ) 229 (М+, 1), 199 (79), 187 (bp), 157 (42), 133(41).
Пример 44
ЭНАНТИОМЕР 1 3-(3-ХЛОР-5-ФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИНА
Получение в соответствии с примером 22: (+)-3-(3-хлор-5-фторфенил)-3-метоксипирролидин (0,01 г, 0,043 ммоль), триэтиламин (12,1 мкл, 0,086 ммоль), тетрагидрофуран (2 мл) и йодэтан (5,2 мкл, 0,065 ммоль). Неочищенный продукт анализировали посредством GCMS. Анализ продемонстрировал превращение 74%. MS m/z (относительная интенсивность, 70 эВ) 257 (М+, 10), 242 (94), 227 (39), 157 (40), 71 (bp).
Пример 45
ЭНАНТИОМЕР 2 3-(3-ХЛОР-5-ФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИНА
Получение в соответствии с примером 22. (-)-3-(3-Хлор-5-фторфенил)-3-метоксипирролидин (0,01 г, 0,043 ммоль), триэтиламин (12,1 мкл, 0,086 ммоль), тетрагидрофуран (2 мл) и йодэтан (5,2 мкл, 0,065 ммоль). Неочищенный продукт анализировали посредством GCMS. Анализ продемонстрировал превращение 83%. MS m/z (относительная интенсивность, 70 эВ) 257 (М+, 8), 242 (78), 227 (31), 157 (36), 71 (bp).
Пример 46
ЭНАНТИОМЕР 1 3-(3-ХЛОР-4-ФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИНА
Получение в соответствии с примером-22. (+)-3-(3-Хлор-4-фторфенил)-3-метоксипирролидин (0,01 г, 0,043 ммоль), триэтиламин (12,1 мкл, 0,086 ммоль), тетрагидрофуран (2 мл) и йодэтан (5,2 мкл, 0,065 ммоль). Неочищенный продукт анализировали посредством GCMS. Анализ продемонстрировал превращение 83%. MS m/z (относительная интенсивность, 70 эВ) 257 (М+, 6), 242 (48), 227 (27), 157 (38), 71 (bp).
Пример 47
ЭНАНТИОМЕР 2 3-(3-ХЛОР-4-ФТОРФЕНИЛ)-1-ЭТИЛ-3-МЕТОКСИПИРРОЛИДИНА
Получение в соответствии с примером 22. (-)-3-(3-Хлор-4-фторфенил)-3-метоксипирролидин (0,01 г, 0,043 ммоль), триэтиламин (12,1 мкл, 0,086 ммоль), тетрагидрофуран (2 мл) и йодэтан (5,2 мкл, 0,065 ммоль). Неочищенный продукт анализировали посредством GCMS. Анализ продемонстрировал превращение 83%. MS m/z (относительная интенсивность, 70 эВ) 257 (М+, 4), 242 (34), 227 (20), 157 (32), 71 (bp).
Пример 48
ЭНАНТИОМЕР 1 3-(3-ХЛОР-2-ФТОРФЕНИЛ)-(1-D)-3-МЕТОКСИПИРРОЛИДИНА
Получение в соответствии с примером 24: (+)-3-(3-Хлор-2-фторфенил)-3-метоксипирролидин (0,01 г, 0,043 ммоль), безводный тетрагидрофуран (3 мл), н-бутиллитий в гексане (2,5 М, 0,026 мл, 0,06 ммоль), оксид дейтерия (0,01 мл, 0,55 ммоль). Неочищенный продукт анализировали посредством LCMS (Qtrap, Applied Biosystems; Q1 MS), анализ продемонстрировал превращение приблизительно 50%: MS (m/z)/z 231 (M+1, 94), 230 (bp), 199 (92), 200 (48), 198 (82).
Пример 49
ЭНАНТИОМЕР 1 3-(3-ХЛОР-4-ФТОРФЕНИЛ)-(1-D)-3-МЕТОКСИПИРРОЛИДИНА
Получение в соответствии с примером 24: (+)-3-(3-хлор-4-фторфенил)-3-метоксипирролидин (0,114 г, 0,5 ммоль), безводный тетрагидрофуран (10 мл), н-бутиллитий в гексане (2,5 М, 0,4 мл, 1 ммоль), оксид дейтерия (0,1 мл, 5,5 ммоль). Неочищенный продукт анализировали посредством LCMS (Qtrap, Applied Biosystems; Q1 MS), анализ продемонстрировал превращение приблизительно 75%: MS-(m/z)/z 231 (M+1,93), 201 (65), 200 (44), 199 (bp), 198-(45).
Пример 50
ЭНАНТИОМЕР 2 3-(3-ХЛОР-4-ФТОРФЕНИЛ)-(1-D)-3-МЕТОКСИПИРРОЛИДИНА
Получение в соответствии с примером 24: (-)-3-(3-хлор-4-фторфенил)-3-метоксипирролидин (0,115 г, 0,5 ммоль), безводный тетрагидрофуран (10 мл), н-бутиллитий в гексане (2,5 М, 0,4 мл, 1 ммоль), оксид дейтерия (0,1 мл, 5,5 ммоль). Неочищенный продукт анализировали посредством LCMS (Qtrap, Applied Biosystems; Q1 MS), анализ продемонстрировал превращение приблизительно 75%: MS (m/z)/z 231 (M+1, bp), 201 (78), 200 (46), 199 (99), 198 (51).
Подготовительный пример 1
ТРЕТ-БУТИЛ-3-(3,5-ДИФТОРФЕНИЛ)-3-ГИДРОКСИПИРРОЛИДИН-1-КАРБОКСИЛАТ
К раствору 1-бром-3,5-дифторбензола (8 г, 41,4 ммоль) в безводном тетрагидрофуране (100 мл) в атмосфере азота добавляли магниевые стружки (0,99 г, 41,4 ммоль) и один кристалл йода. Эту смесь кипятили с обратным холодильником в течение 1 ч, охлаждали до температуры окружающей среды и по каплям добавляли раствор 1-N-boc-3-пирролидона (7,66 г, 41,4 ммоль) в безводном тетрагидрофуране (40 мл). Полученную в результате смесь кипятили с обратным холодильником в течение 1 ч, охлаждали до температуры окружающей среды, добавляли водный насыщенный раствор хлорида аммония (50 мл) и смесь экстрагировали этилацетатом (3×50 мл). Объединенную органическую фазу промывали рассолом, сушили (Na2SO4), фильтровали и упаривали досуха. Неочищенный продукт очищали путем колоночной флэш-хроматографии (этилацетат/изооктан, от 1:9 до 1:1) с получением указанного в заголовке соединения (3,8 г, 30%). MS m/z (отн. интенсивность 70 эВ) 299 (М+, 1), 243 (30), 198 (39), 127 (36), 57 (bp).
Подготовительный пример 2
ТРЕТ-БУТИЛ-3-(3,5-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН-1-КАРБОКСИЛАТ
К раствору трет-бутил-3-(3,5-дифторфенил)-3-гидроксипирролидин-1-карбоксилата (3,8 г, 12,7 ммоль) в безводном тетрагидрофуране (50 мл), добавляли гидрид натрия (60% дисперсия в минеральном масле, 0,76 г, 19 ммоль). Смесь перемешивали в течение 10 мин, после чего добавляли йодметан (1,58 мл, 25,4 ммоль). Эту смесь перемешивали в течение 15 мин, добавляли водный насыщенный раствор хлорида аммония (50 мл) и водную фазу экстрагировали этилацетатом (2×50 мл). Объединенную органическую фазу сушили (Na2SO4), фильтровали и упаривали. Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат/изооктан, от 1:9 до 1:1) дала указанное в заголовке соединение (2,64 г, 66%). MS m/z (отн. интенсивность 70 эВ) 257 (31), 240 (17), 212 (13), 127 (18), 57 (bp).
Подготовительный пример 3
3-(3,5-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
К раствору трет-бутил-3-(3,5-дифторфенил)-3-метоксипирролидин-1-карбоксилата (2,64 г, 8,4 ммоль) в метиленхлориде (20 мл) добавляли трифторуксусную кислоту (5 мл). Эту смесь перемешивали в течение 1 ч при температуре окружающей среды, после чего добавляли водный насыщенный раствор хлорида аммония (50 мл) и водную фазу экстрагировали метиленхлоридом (2×50 мл). Объединенную органическую фазу сушили (Na2SO4), фильтровали и упаривали с получением неочищенного продукта, очистка на колонке Biotage Isolute SCX-3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1) дала указанное в заголовке соединение (1,3 г, 73%). MS m/z (отн. интенсивность 70 эВ) 213 (М+, 0,5), 183 (bp), 171 (89), 141 (80), 113(88).
Подготовительный пример 4
ТРЕТ-БУТИЛ-3-(3,4-ДИФТОРФЕНИЛ)-3-ГИДРОКСИПИРРОЛИДИН-1-КАРБОКСИЛАТ
Получение в соответствии с подготовительным примером 1. 1-Бром-3,4-дифторбензол (5 г, 25,9 ммоль) в безводном тетрагидрофуране (100 мл), магниевые стружки (0,62 г, 25,9 ммоль) и один кристалл йода. 1-N-bос-3-пирролидон (4,79 г, 25,9 ммоль) в безводном тетрагидрофуране (50 мл).
Неочищенный продукт очищали путем колоночной флэш-хроматографии на силикагеле (этила цетат/изооктан, от 1:9 до 1:1) с получением указанного в заголовке соединения (3,3 г, 43%). MS m/z (отн. интенсивность 70 эВ) 243 (33), 198 (45), 141 (39), 127(44), 57 (bp).
Подготовительный пример 5
ТРЕТ-БУТИЛ-3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН-1-КАРБОКСИЛАТ
Получение в соответствии с подготовительным примером 2. Трет-бутил-3-(3,4-дифторфенил)-3-гидроксипирролидин-1-карбоксилат (3,3 г, 11 ммоль) в безводном тетрагидрофуране (50 мл), гидрид натрия (60% дисперсия в минеральном масле, 0,66 г, 16,5 ммоль), йодметан (1,37 мл, 22 ммоль). Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат/изооктан, от 1:9 до 1:1) дала указанное в заголовке соединение (2,65 г, 77%). MS m/z (отн. интенсивность 70 эВ) 257 (17), 240 (14), 171 (13), 127 (15), 57 (bp).
Подготовительный пример 6
ТРЕТ-БУТИЛ-3-(3-ХЛОР-4-ФТОРФЕНИЛ)-3-ГИДРОКСИПИРРОЛИДИН-1-КАРБОКСИЛАТ
Получение в соответствии с подготовительным примером 1. 1-Бром-3-хлор-4-фторбензол (5 г, 23,9 ммоль) в безводном тетрагидрофуране (100 мл), магниевые стружки (0,57 г, 23,9 ммоль) и один кристалл йода. 1-N-boc-3-пирролидон (4,41 г, 23,9 ммоль) в безводном тетрагидрофуране (50 мл). Неочищенный продукт очищали путем колоночной флэш-хроматографии на силикагеле (этилацетат/изооктан, от 1:9 до 1:1) дала указанное в заголовке соединение (3,1 г, 41%). MS m/z (отн. интенсивность 70 эВ) 214 (16), 157 (21), 143(19), 129 (11), 57 (bp).
Подготовительный пример 7
ТРЕТ-БУТИЛ-3-(3-ХЛОР-5-ФТОРФЕНИЛ)-3-ГИДРОКСИПИРРОЛИДИН-1-КАРБОКСИЛАТ
Получение в соответствии с подготовительным примером 1. 1-Бром-3-хлор-5-фторбензол (5 г, 23,9 ммоль) в безводном тетрагидрофуране (100 мл), магниевые стружки (0,57 г, 23,9 ммоль) и один кристалл йода. 1-N-Bос-3-пирролидон (4,41 г, 23,9 ммоль) в безводном тетрагидрофуране (50 мл). Неочищенный продукт очищали путем колоночной флэш-хроматографии на силикагеле (этилацетат/изооктан, от 1:9 до 1:1) с получением указанного в заголовке соединения (2,1 г, 28%). MS m/z (отн. интенсивность 70 эВ) 259 (45), 214 (69), 184 (35), 143 (37), 57 (bр).
Подготовительный пример 8
ТРЕТ-БУТИЛ-3-(3-ХЛОР-4-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН-1-КАРБОКСИЛАТ
Получение в соответствии с подготовительным примером 2. Трет-бутил-3-(3-хлор-4-фторфенил)-3-гидроксипирролидин-1-карбоксилат (3,1 г, 9,84 ммоль) в безводном тетрагидрофуране (50 мл), гидрид натрия (60% дисперсия в минеральном масле, 0,59 г, 14,76 ммоль), йодметан (1,22 мл, 19,68 ммоль). Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат/изооктан, от 1:9 до 1:1) дала указанное в заголовке соединение (1,81 г, 56%). MS m/z (отн. интенсивность 70 эВ) 273 (19), 228 (13), 187 (17), 133 (12),57(bр).
Подготовительный пример 9
ТРЕТ-БУТИЛ-3-(3-ХЛОР-5-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН-1-КАРБОКСИЛАТ
Получение в соответствии с подготовительным примером 2. Трет-бутил-3-(3-хлор-5-фторфенил)-3-гидроксипирролидин-1-карбоксилат (2,1 г, 6,67 ммоль) в безводном тетрагидрофуране (50 мл), гидрид натрия (60% дисперсия в минеральном масле, 0,40 г, 10 ммоль), йодметан (0,83 мл, 13,3 ммоль). Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат/изооктан, от 1:9 до 1:1) дала указанное в заголовке соединение (1,57 г, 71%). MS m/z (отн. интенсивность 70 эВ) 275 (33), 273 (bp), 256 (42), 228 (32), 57 (77).
Подготовительный пример 10
ТРЕТ-БУТИЛ-3-(2,3-ДИФТОРФЕНИЛ)-3-ГИДРОКСИПИРРОЛИДИН-1-КАРБОКСИЛАТ
К раствору 1-бром-2,3-дифторбензола (8 г, 41,4 ммоль) в безводном диэтиловом эфире (100 мл) в атмосфере азота по каплям добавляли при -78°С н-гексиллитий (2,3 М в гексане, 18 мл, 41,4 ммоль). Эту смесь перемешивали в течение 1 мин, после чего по каплям добавляли раствор 1-N-boc-3-пирролидона (7,66 г, 41,4 ммоль) в безводном диэтиловом эфире (50 мл). Полученную в результате смесь доводили до температуры окружающей среды и перемешивали в течение 2 ч, добавляли водный насыщенный раствор хлорида аммония (50 мл) и эту смесь экстрагировали этилацетатом (2×50 мл). Объединенную органическую фазу промывали рассолом, сушили (Na2SO4), фильтровали и упаривали досуха. Неочищенный продукт очищали путем колоночной флэш-хроматографии (этилацетат/изооктан, от 1:9 до 1:1) с получением указанного в заголовке соединения (8,12 г, 66%). MS m/z (отн. интенсивность 70 эВ) 243 (26), 198 (48) 141 (33), 127 (38), 57 (bp).
Подготовительный пример 11
ТРЕТ-БУТИЛ-3-(3-ХЛОР-2-ФТОРФЕНИЛ)-3-ГИДРОКСИПИРРОЛИДИН-1-КАРБОКСИЛАТ
Получение в соответствии с подготовительным примером 10: 1-Бром-3-хлор-2-фторбензол (8 г, 38,3 ммоль), безводный диэтиловый эфир (100 мл), н-гексиллитий (2,3 М в гексане, 16,64 мл, 38,3 ммоль) и раствор 1-N-Bос-3-пирролидона (7,08 г, 38,3 ммоль) в безводном диэтиловом эфире (50 мл). Неочищенный продукт очищали путем колоночной флэш-хроматографии (этилацетат/изооктан, от 1:9 до 1:1) с получением указанного в заголовке соединения (8,05 г, 66%). MS m/z (отн. интенсивность 70 эВ) 259 (20), 214 (42), 157(26), 143 (23), 57 (bp).
Подготовительный пример 12
ТРЕТ-БУТИЛ-3-(2,3-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН-1-КАРБОКСИЛАТ
Получение в соответствии с подготовительным примером 2. Трет-бутил-3-(2,3-дифторфенил)-3-гидроксипирролидин-1-карбоксилат (8,12 г, 27,1 ммоль) в безводном тетрагидрофуране (50 мл), гидрид натрия (60% дисперсия в минеральном масле, 1,63 г, 40,7 ммоль), йодметан (3,38 мл, 54,3 ммоль). Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат/изооктан, от 1:9 до 1:1) дала указанное в заголовке соединение (4,7 г, 55%). MS m/z (отн. интенсивность 70 эВ) 240 (bp), 237 (72), 183 (81), 171 (82), 57 (87).
Подготовительный пример 13
ТРЕТ-БУТИЛ-3-(3-ХЛОР-2-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН-1-КАРБОКСИЛАТ
Получение в соответствии с подготовительным примером 2. Трет-бутил-3-(3-хлор-2-фторфенил)-3-гидроксипирролидин-1-карбоксилат (8,05 г, 25,5 ммоль) в безводном тетрагидрофуране (50 мл), гидрид натрия (60% дисперсия в минеральном масле, 1,53 г, 38,2 ммоль), йодметан (3,17 мл, 51 ммоль). Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат/изооктан, от 1:9 до 1:1) дала указанное в заголовке соединение (6,45 г, 77%). MS m/z (отн. интенсивность 70 эВ) 256 (19), 228 (15), 199 (23), 187 (28), 57 (bp).
Подготовительный пример 14
1-БЕНЗИЛ-3-(3,5-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
К раствору 3-(3,5-дифторфенил)-3-метоксипирролидина (1,3 г, 6,1 ммоль) в безводном диметилформамиде (5 мл) добавляли гидрид натрия (60% дисперсия в минеральном масле, 0,27 г, 6,7 ммоль). Эту смесь перемешивали в течение 15 мин, после чего по каплям добавляли раствор бензилбромида (0,725 мл, 6,1 ммоль) в безводном диметилформамиде (5 мл). Смесь перемешивали в течение 30 мин, добавляли соляную кислоту (10%, 50 мл) и водную фазу экстрагировали диэтиловым эфиром (50 мл), водную фазу подщелачивали Nа2СО3 и экстрагировали этилацетатом (3×50 мл). Объединенную органическую фазу промывали водным LiCl (5%, 50 мл), сушили (Na2SO4), фильтровали и упаривали. Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат) дала указанное в заголовке соединение (1,15 г, 62%). MS m/z (отн. интенсивность 70 эВ) 273 (10), 133 (42), 132 (23), 91 (bp),65(11).
Подготовительный пример 15
3-(3-ХЛОР-5-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
К раствору трет-бутил-3-(3-хлор-5-фторфенил)-3-метоксипирролидин-1-карбоксилата (1,57 г, 4,77 ммоль) в метиленхлориде (20 мл) добавляли трифторуксусную кислоту (5 мл). Эту смесь перемешивали в течение 1 ч при температуре окружающей среды, после чего растворитель выпаривали. Очистка на колонке Biotage Isolate SCX-3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1) дала указанное в заголовке соединение (0,845 г, 77%). MS m/z (отн. интенсивность 70 эВ) 199 (bp), 187 (93), 157(61), 133(66), 129(59).
Подготовительный пример 16
3-(3-ХЛОР-4-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с подготовительным примером 15. Трет-бутил-3-(3-хлор-4-фторфенил)-3-метоксипирролидин-1-карбоксилат (1,81 г, 5,5 ммоль), метиленхлорид (20 мл) и трифторуксусная кислота (5 мл). Очистка на колонке Biotage Isolute SCX-3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1) дала указанное в заголовке соединение (1,11 г, 88%). MS m/z (отн. интенсивность 70 эВ) 214 (38), 199 (73), 187 (bp), 157 (40), 133(39).
Подготовительный пример 17
1-БЕНЗИЛ-3-(3-ХЛОР-5-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с подготовительным примером 14. 3-(3-Хлор-5-фторфенил)-3-метоксипирролидин (0,845 г, 3,7 ммоль), безводный диметилформамид (5 мл), гидрид натрия (60% дисперсия в минеральном масле, 0,163 г, 4,07 ммоль). Бензилбромид (0,44 мл, 3,7 ммоль) в безводном диметилформамиде (5 мл). Обработка в соответствии с подготовительным примером 14. Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат) дала указанное в заголовке соединение (0,94 г, 80%). MS m/z (отн. интенсивность 70 эВ) 133 (49), 132 (26), 92 (8), 91 (bp), 65 (12).
Подготовительный пример 18
1-БЕНЗИЛ-3-(3-ХЛОР-4-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с подготовительным примером 14. 3-(3-Хлор-4-фторфенил)-3-метоксипирролидин (1,11 г, 4,85 ммоль), безводный диметилформамид (5 мл), гидрид натрия (60% дисперсия в минеральном масле, 0,213 г, 5,35 ммоль). Бензилбромид (0,576 мл, 4,85 ммоль) в безводном диметилформамиде (5 мл). Обработка в соответствии с подготовительным примером 14. Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат) дала указанное в заголовке соединение (0,3 г, 19%). MS m/z (отн. интенсивность 70 эВ) 304 (24), 289 (24), 133 (62), 132 (32), 91 (bp).
Подготовительный пример 19
3-(2,3-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с подготовительным примером 15. Трет-бутил-3-(2,3-дифторфенил)-3-метоксипирролидин-1-карбоксилат (4,7 г, 15 ммоль), метиленхлорид (20 мл) и трифторуксусная кислота (5 мл). Очистка на колонке Biotage Isolute SCX-3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1) дала указанное в заголовке соединение (2,71 г, 85%). MS m/z (отн. интенсивность 70 эВ) 198 (44), 183 (95), 171 (bp), 141 (61), 127 (44).
Подготовительный пример 20
1-БЕНЗИЛ-3-(2,3-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с подготовительным примером 14. 3-(2,3-Дифторфенил)-3-метоксипирролидин (2,71 г, 12,75 ммоль), безводный диметилформамид (5 мл), гидрид натрия (60% дисперсия в минеральном масле, 0,612 г, 15,3 ммоль). Бензилбромид (1,51 мл, 12,75 ммоль) в безводном диметилформамиде (5 мл). Обработка в соответствии с подготовительным примером 14. Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат) дала указанное в заголовке соединение (2,6 г, 67%). MS m/z (отн. интенсивность 70 эВ) 133 (34), 132 (19), 92 (8), 91 (bp), 65 (13).
Подготовительный пример 21
3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с подготовительным примером 15. Трет-бутил-3-(3,4-дифторфенил)-3-метоксипирролидин-1-карбоксилат (2,65 г, 8,46 ммоль), метиленхлорид (20 мл) и трифторуксусная кислота (5 мл). Очистка на колонке Biotage Isolute SCX-3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1) дала указанное в заголовке соединение (1,15 г, 63%). MS m/z (отн. интенсивность 70 эВ) 198 (46), 183(79), 171 (bp), 141 (53), 113 (41).
Подготовительный пример 22
3-(3-ХЛОР-2-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с подготовительным примером 15. Трет-бутил-3-(3-хлор-2-фторфенил)-3-метоксипирролидин-1-карбоксилат (6,45 г, 19,6 ммоль), метиленхлорид (20 мл) и трифторуксусная кислота (5 мл). Очистка на колонке Biotage Isolute SCX 3 SPE (промывали метанолом и элюировали смесью метанол/триэтиламин, 4:1) дала указанное в заголовке соединение (3,44 г, 76%). MS m/z (отн. интенсивность 70 эВ) 214 (34), 199 (84), 187 (bp), 157 (48), 133(43).
Подготовительный пример 23
1-БЕНЗИЛ-3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с подготовительным примером 14. 3-(3,4-Дифторфенил)-3-метоксипирролидин (1,15 г, 5,4 ммоль), безводный диметилформамид (5 мл), гидрид натрия (60% дисперсия в минеральном масле, 0,259 г, 6,48 ммоль). Бензилбромид (0,642 мл, 5,4 ммоль) в безводном диметилформамиде (5 мл). Обработка в соответствии с подготовительным примером 14. Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат) дала указанное в заголовке соединение (0,9 г, 55%). MS m/z (отн. интенсивность 70 эВ) 288 (12), 273 (14), 133 (53), 132 (30), 91 (bp).
Подготовительный пример 24
1-БЕНЗИЛ-3-(3-ХЛОР-2-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Получение в соответствии с подготовительным примером 14. 3-(3-Хлор-2-фторфенил)-3-метоксипирролидин (3,44 г, 15 ммоль), безводный диметилформамид (5 мл), гидрид натрия (60% дисперсия в минеральном масле, 0,720 г, 18 ммоль). Бензилбромид (1,78 мл, 15 ммоль) в безводном диметилформамиде (5 мл). Обработка в соответствии с подготовительным примером 14. Очистка путем колоночной флэш-хроматографии на силикагеле (этилацетат) дала указанное в заголовке соединение (3,83 г, 80%). MS m/z (отн. интенсивность 70 эВ) 304 (14), 289 (16), 133 (65), 132 (35), 91 (bp).
Подготовительный пример 25
(+)- и (-)-1-БЕНЗИЛ-3-(3-ХЛОР-2-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Энантиомеры разделяли посредством HPLC на kromasil 5-Cellucoat (гептан/2-пропанол/диэтиламин, 95/5/0,1): (+)-энантиомер (1,04 г). [α]D=+28,7° (метанол). MS m/z (отн. интенсивность 70 эВ) 304 (20), 289 (21), 133 (70), 132 (38), 91 (bp). (-)-энантиомер (0,82 г). [α]D=-30,2° (метанол). MS m/z (отн. интенсивность 70 эВ) 304 (17), 289 (17), 133 (58), 132 (31), 91 (bp).
Подготовительный пример 26
(+)- и (-)-1-БЕНЗИЛ-3-(2,3-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Энантиомеры разделяли посредством HPLC на kromasil 5-Cellucoat (гептан/2-пропанол/диэтиламин, 95/5/0,1): (+)-энантиомер (0,58 г). [α]D=+34,1° (метанол). MS m/z (отн. интенсивность 70 эВ) 288 (14), 273 (15), 133 (46), 132 (25), 91 (bp). (-)-энантиомер (0,874 г). [α]D=-32,5° (метанол). MS m/z (отн. интенсивность 70 эВ) 288 (15), 273 (15), 133 (45), 132 (25), 91 (bp).
Подготовительный пример 27
(+)- и (-)-1-БЕНЗИЛ-3-(3-ХЛОР-4-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Энантиомеры разделяли посредством HPLC на kromasil 5-Cellucoat (гептан/2-пропанол/диэтиламин, 95/5/0,1): (+)-энантиомер (0,405 г). [α]D=+28,7° (метанол). MS m/z (отн. интенсивность 70 эВ) 289 (12), 133 (57), 132 (30), 91 (bp), 65 (12). (-)-энантиомер (0,390 г). [α]D=-29,8° (метанол). MS m/z (отн. интенсивность 70 эВ) 304 (11), 133 (52), 132 (27), 91 (bp), 65 (13).
Подготовительный пример 28
(+)- и (-)-1-БЕНЗИЛ-3-(3,5-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Энантиомеры разделяли посредством HPLC на kromasil 5-Cellucoat (гептан/2-пропанол/диэтиламин, 95/5/0,1): (+)-энантиомер (0,305 г). [α]D=+24,9° (метанол). MS m/z (отн. интенсивность 70 эВ) 273 (12), 133 (39), 132 (22), 91 (bp), 65 (15). (-)-энантиомер (0,390 г). [α]D=-27,6° (метанол). MS m/z (отн. интенсивность 70 эВ) 273 (14), 133 (41), 132 (23), 91 (bp), 65 (15).
Подготовительный пример 29
(+)- и (-)-1-БЕНЗИЛ-3-(3-ХЛОР-5-ФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Энантиомеры разделяли посредством HPLC на kromasil 5-Cellucoat (гептан/2-пропанол/диэтиламин, 95/5/0,1): (+)-энантиомер (0,212 г). [α]D=+27,3° (метанол). MS m/z (отн. интенсивность 70 эВ) 289 (12), 133 (51), 132 (27), 91 (bp), 65 (14). (-)-энантиомер (0,265 г). [α]D=-29,7° (метанол). MS m/z (отн. интенсивность 70 эВ) 304 (32), 289 (32), 133 (62), 132 (33), 91 (bp).
Подготовительный пример 30
(+)- и (-)-1-БЕНЗИЛ-3-(3,4-ДИФТОРФЕНИЛ)-3-МЕТОКСИПИРРОЛИДИН
Энантиомеры разделяли посредством HPLC на kromasil 5-Cellucoat (гептан/2-пропанол/диэтиламин, 95/5/0,1): (+)-энантиомер (0,202 г). [α]D=+24,1° (метанол). MS m/z (отн. интенсивность 70 эВ) 288 (22), 273 (25), 133 (50), 132 (26), 91 (bp). (-)-энантиомер (0,264 г). [α]D=-23,0° (метанол). MS m/z (отн. интенсивность 70 эВ) 288 (83), 273 (86), 133 (67), 132 (36), 91 (bp).
Пример 51
Биологическая активность
Следующие тесты использовали для оценки соединений по изобретению.
Тест in vivo: Поведение
Поведенческую активность измеряли с использованием восьми мониторов активности Digiscan (RXYZM (16) ТАО, Omnitech Electronics, Columbus, OH, USA), соединенных с анализатором Omnitech Digiscan и компьютером Apple Macintosh, оборудованным платой цифрового интерфейса (NB DIO-24, National Instruments, USA). Каждый монитор активности состоял из квадратной металлической решетки (Ш×Г=40 см × 40 см), оборудованной фотолучевыми датчиками. Во время измерений поведенческой активности крысу помещали в прозрачную акриловую клетку (Ш×Г×В, 40×40×30 см), которую, в свою очередь, помещали в монитор активности. Каждый монитор активности был оборудован тремя рядами инфракрасных фотолучевых датчиков, причем каждый ряд состоял из 16 датчиков. Два ряда помещали вдоль передней панели и сбоку от пола клетки под углом 90°, а третий ряд помещали на 10 см выше пола для измерения вертикальной активности. Фотолучевые датчики располагались друг от друга на расстоянии 2,5 см. Каждый монитор активности помещали в идентичную ослабляющую прохождение звука и света коробку, содержащую слабый комнатный свет и вентилятор.
Программное обеспечение было написано с использованием объектно-ориентированного программирования (LabVIEW®, National instruments, Austin, TX, USA).
Поведенческие данные с каждого монитора активности, представляющие положение (горизонтальный центр тяжести и вертикальную активность) для животного в каждый момент времени, регистрировали с частотой отсчетов 25 Гц и собирали с использованием специализированного приложения LABView™. Данные после каждого раунда регистрации хранили и анализировали в отношении пройденного расстояния. Каждый раунд регистрации поведения длился в течение 60 мин, начиная приблизительно через 4 мин после инъекции тестируемого соединения. Аналогичные способы регистрации поведения применяли в отношении крыс, не получавших лекарственное средство, и крыс, предварительно получивших лекарственное средство. Крысам, предварительно получившим d-амфетамин, вводили дозу 1,5 мг/кг внутрибрюшинно (i.p.) за 10 мин до раунда регистрации в мониторе активности. Крысам, предварительно получившим МК-801, вводили дозу 0,7 мг/кг i.p. за 90 мин до раунда регистрации в мониторе активности. Результаты представлены в виде подсчетов/60 минут или подсчетов/30 минут в произвольных единицах длины. Статистические сравнения осуществляли с использованием t-критерия Стьюдента по сравнению с контрольной группой. Для животных, предварительно получивших МК-801 или амфетамин, статистические сравнения осуществляли по сравнению с МК801 или d-амфетаминовыми контролями соответственно.
Значения ED50 (средней эффективной концентрации) для снижения вызванной амфетамином гиперлокомоции рассчитывают путем построения эмпирической кривой. Для большинства соединений оценка основана на данных от 16 животных, предварительно получивших амфетамин, в диапазоне доз 0, 11, 33 и 100 мкмоль/кг подкожно (s.c.) в одном эксперименте, с дополнительными дозами в отдельных экспериментах. Расчеты основаны на расстоянии в течение последних 45 минут одного часа измерения. Расстояния приведены к амфетаминовому контролю и подогнаны по методу наименьших квадратов к функции "Конечный результат - (Конечный результат - Контроль)/(1+(доза/ЕD50)наклон)". Четыре параметра (контроль, конечный результат, ED50 и наклон) имеют ограничения: ED50>0,0,5<наклон<3, Конечный результат=0% относительно контроля. Ограничение с фиксированным Конечным результатом сделано для того, чтобы сфокусироваться на силе, а не на эффективности. Для оценки доверительных интервалов для параметров подгонку осуществляли 100 раз со случайным образом равномерно распределенным возведенным в квадрат весовым коэффициентом (от 0 до 1) для каждого измеренного значения. Представленные диапазоны ED50 охватывают 95% этих значений.
Тест in vivo: Нейрохимия
После раундов тестирования поведенческой активности крыс обезглавливали и образцы их головного мозга быстро извлекали и помещали на охлажденную на льду чашку Петри. Готовили срезы лимбической части переднего мозга, стриатума, лобного отдела коры головного мозга и оставшихся частей полушарий для каждой крысы и замораживали. Каждую часть головного мозга затем анализировали в отношении содержания в ней моноаминов и их метаболитов.
Моноаминные вещества-медиаторы (NA (норадреналин), DA (дофамин), 5-НТ (серотонин)), а также их аминные (NM (норметанефрин), 3-МТ (3-метокситирамин)) и кислотные (DOPAC (3,4-дигидроксифенилуксусная кислота), 5-HIAA (5-гидроксииндолуксусная кислота), HVA (гомованильная кислота)) метаболиты количественно определяют в гомогенатах ткани головного мозга путем разделений посредством HPLC и электрохимической детекции.
Аналитический способ основан на двух хроматографических разделениях, предназначенных для аминов или кислот. Две хроматографические системы имеют общий автоинжектор с 10-портовым клапаном и двумя петлями для образцов для одновременной инжекции в две системы. Обе системы оборудованы обращенно-фазовой колонкой (Luna С18(2), диаметр зерна 3 мкм, 50*2 мм в.д., Phenomenex) и электрохимическая детекция основана на двух потенциалах на стеклоуглеродных электродах (MF-1000, Bioanalytical Systems, Inc.). Поток, выходящий из колонки, пропускают через Т-соединитель в детектирующую ячейку или удаляют в слив. Это осуществляют при помощи двух соленоидных клапанов, которые блокируют либо выход на слив, либо выход на детектор. Предотвращая попадание в детектор хроматографического фронта, достигают лучших условий детекции. Подвижная водная фаза (0,4 мл/мин) для кислотной системы содержит лимонную кислоту 14 мМ, цитрат натрия 10 мМ, МеОН 15% (об./об.) и EDTA (этилендиаминтетрауксусную кислоту) 0,1 мМ. Потенциалы детектора относительно референсного Ag/AgCl электрода составляют 0,45 и 0,60 В. Водная подвижная фаза с ионными парами (0,5 мл/мин) для аминной системы содержит лимонную кислоту 5 мМ, цитрат натрия 10 мМ, МеОН 9% (об./об.), MeCN (10,5% об./об.), декансульфоновую кислоту 0,45 мМ, и EDTA 0,1 мМ. Потенциалы детектора относительно референсного Ag/AgCl электрода составляют 0,45 и 0,65 В.
Значения ED50 для увеличения DOPAC в стриатуме рассчитывают путем построения эмпирической кривой. Для большинства соединений оценка проведена из расчета на 20 животных в диапазоне доз 0, 3, 7, 11, 33 и 100 мкмоль/кг s.c. в одном эксперименте, с дополнительными дозами в отдельных экспериментах. Уровни DOPAC нормализуют относительно контроля и подгоняют по методу наименьших квадратов к функции "Конечный результат - конечный результат - Контроль)/(1+(дoзa/ED50)нaклoн)". Четыре параметра (контроль, конечный результат, ED50 и наклон) имеют ограничения: ED50>0,0,5< наклон <3, 350< Конечный результат <400% относительно контроля. Для оценки доверительных интервалов для параметров подгонку осуществляли 100 раз со случайным образом равномерно распределенным возведенным в квадрат весовым коэффициентом (от 0 до 1) для каждого измеренного значения. Представленные диапазоны ED50 охватывают 95% этих значений.
Тест in vivo: Биодоступность при пероральном введении
Эксперименты осуществляют через 24 часа после имплантации артериальных и венозных катетеров. Тестируемое соединение вводят перорально в дозе 12,5 мкмоль/кг или внутривенно в дозе 5 мкмоль/кг с использованием венозных катетеров, n=3 на группу. Образцы артериальной крови затем отбирают в течение шести часов в моменты времени 0, 3, 9, 27, 60, 120, 180, 240, 300 и 360 минут после введения тестируемого соединения. Биодоступность при пероральном введении рассчитывали в виде отношения AUC (площадь под кривой), полученной после перорального введения, к AUC, полученной после внутривенного введения, для каждой крысы. Параметр AUC рассчитывали в соответствии со следующим:
AUC: площадь под кривой зависимости концентрации в плазме крови от времени с нулевого момента до последней измеренной концентрации (Clast), рассчитанной по log/линейному методу трапеций.
Уровни тестируемого соединения измеряют посредством жидкостной хроматографии-масс-спектрометрии (LC-MS) (Hewlett-Packard 1100MSD Series). Модуль LC-MS включает систему с насосом для четырехкомпонентных систем, вакуумный дегазатор, термостатируемый автоматический пробоотборник, термостатируемый держатель колонки, детектор на основе диодной матрицы и камеру для распыления API-ES (ионизация при атмосферном давлении с электрораспылением). Обработку данных осуществляли при помощи системы HP ChemStation rev.A.06.03. Установки прибора: режим MSD (масс-селективного детектора): Контроль заданных ионов (SIM), полярность MSD: Температура газа: 350°С, Осушающий газ: 13,0 л/мин, Распыляющий газ: 50 ф./кв.дюйм избыточного давления (344737,85 Па), Напряжение на капилляре: 5000 В, Напряжение на фрагменторе: 70 В.
Аналитическая колонка: Zorbax eclipse XDB-C8 (4,6*150 мм, 5 мкм) при 20°С. Подвижная фаза представляла собой уксусную кислоту (0,03%) (растворитель А) и ацетонитрил (растворитель В). Скорость потока подвижной фазы составляла 0,8 мл/мин. Элюирование начинали с 12% растворителя В в изократическом режиме в течение 4,5 мин, затем линейно увеличивали до 60% в течение 4,5 мин.
Процедура экстракции: Образцы плазмы крови (0,25-0,5 мл) разбавляли водой до 1 мл и добавляли 60 пмоль (100 мкл) (-)-OSU6241. pH доводили до 11 путем добавления 25 мкл насыщенного Na2CO3. После смешивания образцы экстрагировали 4 мл дихлорметана путем встряхивания в течение 20 мин. Органический слой после центрифугирования переносили в меньшую пробирку и упаривали досуха в потоке азота. Остаток затем растворяли в 120 мкл подвижной фазы (уксусная кислота (0,03%): ацетонитрил, 95:5) для LC-MS анализа (инжекция 10 мкл). Селективный ион (МH+) отслеживали для каждого образца, и MH+ 296 для (-)-OSU6241 ((3-[3-(этилсульфонил)фенил]-1-пропилпиперидин).
Стандартную кривую в диапазоне 1-500 пмоль получают путем добавления соответствующих количеств тестируемого соединения к образцам плазмы крови.
Тест in vitro: Метаболическая стабильность в микросомах печени крыс
Микросомы печени крыс выделяли, как описано Forlin L 1980, с минимальными модификациями, например 3 мл/г печени 0,1 М буфера Na/K*PO4 с 0,15М KCl, pH 7,4, (буфер 1) добавляли до гомогенизации, гомогенат центрифугировали в течение 20 минут вместо 15, супернатант ультрацентрифугировали при 100000 g вместо 105000 g и осадок после ультрацентрифугирования ресуспендировали в 1 мл/г печени 20% об./об. 87% глицерина в буфере 1.
1 мкл 0,2 или 1 мМ тестируемого вещества разбавляли в воде и 10 мкл 20 мг/мл микросом печени крыс смешивали с 149 мкл буфера 1 при 37°С, и взаимодействие начинали путем добавления 40 мкл 4,1 мг/мл NADPH (никотинамидадениндинуклеотидфосфат восстановленный). После инкубации в течение 0 или 15 мин при 37°С в нагревающем блоке (LAB-LINE, MULTI-BLOK Heater или lab4you, термошейкер TS-100 при 700 об/мин) взаимодействие останавливали путем добавления 100 мкл чистого ацетонитрила. Белковый осадок затем удаляли путем центрифугирования при 10000 g в течение 10 мин (Heraeus, Biofuge fresco) при 4°С. Тестируемое соединение анализировали с использованием HPLC-MS (Hewlett-Packard 1100MSD Series) с колонкой Zorbax SB-C18 (2,1*150 мм, 5 мкм) с использованием 0,03% муравьиной кислоты и ацетонитрила в качестве подвижной фазы (градиент) или Zorbax Eclipse XDB-C18 (3*75 мм, 3,5 мкм) с использованием 0,03% уксусной кислоты и ацетонитрила в качестве подвижной фазы (градиент). 15-минутный метаболизм рассчитывали в виде фракции тестируемого соединения, элиминируемого через 15 минут, выраженной в процентах относительно уровней в момент 0 мин, т.е. 100*[конц. тестируемого, соединения в момент 0 мин - концентрация в момент 15 мин]/конц. в момент 0 мин.
Приготовление микросом печени осуществляли, как описано в Furlin L, 1980. Протоколы инкубации с микросомами печени описаны в Crespi CL and DM Stresser, 2000, и Renwick AB et al., 2001.
Микродиализ
В экспериментах использовали самцов крыс Sprague-Dawley массой 220-320 г. До эксперимента животных содержали в группах по пять животных в каждой клетке со свободным доступом к воде и корму. Животных содержали в течение по меньшей мере одной недели после прибытия до хирургического вмешательства и использования в экспериментах. Каждую крысу использовали только один раз для микродиализа.
Авторы изобретения использовали модифицированную версию (Waters et al., 1994) зонда l-формы (Santiago M & Westerink BHC, 1990). Диализная мембрана, которую использовали авторы изобретения, представляла собой AN69 полиакрилонитрильный/натрий-металилсульфонатный сополимер (HOSPAL; внешн.д./в.д. 310/220 мкм: Gambro, Lund, Sweden). В области дорсального стриатума авторы изобретения использовали зонды с экспонируемой длиной диализной мембраны 3 мм, и в префронтальной коре головного мозга соответствующая длина составляет 2,5 мм. Процедуры над крысами осуществляли под изофлурановой ингаляционной анестезией, фиксируя крыс в стереотаксическом приборе Kopf. Координаты рассчитывали относительно брегмы; дорсальный стриатум АР +1, ML±2,6, DV - 6,3; Pf кора, АР+3,2, 8° ML±1,2, DV-4,0 согласно Paxinos G & Watson С, 1986. Диализный зонд располагали в трепанационном отверстии под стереотаксическим контролем и цементировали фосфатиновым зубным цементом.
Крыс содержали в клетках по одному в течение 48 ч перед диализными экспериментами, давая им возможность восстановиться после хирургического вмешательства и минимизируя риск лекарственных взаимодействий с анестезией в течение следующих экспериментов. В течение этого периода крысы имели свободный доступ к корму и воде. В день эксперимента крыс присоединяли к микроперфузионному насосу через шарнирное соединение и перемещали в клетку, в которой они могут передвигаться свободно в пределах пространства клетки. Перфузионная среда представляла собой раствор Рингера, содержащий в ммоль/л: NaCl; 140, CaCl2; 1.2. KCl; 3,0 MgCl2; 1,0 и аскорбиновую кислоту; 0,04 согласно Moghaddam В & Bunney BS, 1989. Насос включали со скоростью перфузии 2 мкл/мин и 40 мкл образцы собирали каждые 20 мин. Каждый образец анализировали в двух системах HPLC. В автоинжекторе (СМА 200) с 10-портовым клапаном (Vaico C10WE), несущим две петли для образца в сериях (4 мкл и 20 мкл), каждый образец диализата головного мозга одновременно вводят в обе петли. При инжекции 20 мкл образца вводят в систему переключения между колонками (обращенная фаза, комбинированная с обращенной фазой с ионными парами) для определения дофамина (DA), норадреналина (NA), норметанефрина (NM), 3-метокситирамина (3-МТ) и серотонина (5-гидрокситриптамин, 5-НТ), тогда как 4 мкл образца вводят в обращенно-фазовую колонку для хроматографии кислотных моноаминовых метаболитов 3,4-дигидроксифенилуксусной кислоты (DOPAC), гомованильной кислоты (HVA) и 5-гидроксииндолуксусной кислоты (5-HIAA). Токи, генерируемые двумя ЕС (электрохимическими) детекторами, преобразовывали в цифровые данные и оценивали при помощи программного обеспечения Chromeleon (Dionex) на ПК (персональном компьютере). Время работы с образцом в этом способе составляло 4,5 мин, и обычно два эксперимента анализировали параллельно в системе.
После эксперимента крыс отсоединяли от перфузионного насоса и обезглавливали. Образцы их головного мозга быстро извлекали и фиксировали в растворе Neo-fix (Kebo-lab, Sweden) для последующего осмотра локализации зонда. Комитет по этике обращения с животными в Goteborg, Sweden одобрил процедуры, применяемые в этих экспериментах.
Результаты этих экспериментов представлены в Таблице 1 ниже.
|
Микродиализ осуществляли для активных и свободно передвигающихся крыс. DA означает дофамин; NA означает норэпинефрин; 5-HT означает серотонин; Stri означает стриатум; PFC означает префронтальную кору головного мозга.
Ссылки
1. Crespi CL and DM Stresser. Fluorometric screening for metabolism based drug-drug interactions. J. Pharm. Tox. Meth. 2000, 44, 325-331.
2. Forlin L: Effects of Clophen A50, 3-methylcholantrene, pregnenolone-16aq-carbonitrile and Phenobarbital on the hepatic microsomal cytochrome P-450-dependent monooxygenaser system in rainbow trout, saimo gairdneri, of different age and sex. Tox. Appl. Pharm. 1980, 54 (3), 420-430.
3. Renwick AB et al.: Metabolism of 2,5-bis(trifluoromethyl)-7-benzyloxy-4-trifluoromethylcoumarin by human hepatic CYP isoforms: evidence for selectivity towards CYP3A4. Xenobiotica 2001, 31 (4), 187-204.
4. Moghaddam В & Bunney BS: Ionic Composition of Microdialysis Perfusing Solution Alters the Pharmacological Responsiveness and Basal Outflow of Striatal Dopamine. J. Neurochem. 1989, 53, 652-654.
5. Paxinos G & Watson C: The Rat Brain in Stereotaxic Coordinates. New York, Academic Press, 1986.
6. Santiago M & Westerink BHC: Characterization of the in vivo release of dopamine as recorded by different types of intracerebral microdialysis probes. Naunvn-Schmiedeberq's Arch. Pharmacol. 1990 342 407-414.
7. Waters N., Lofberg L., Haadsma-Svensson S., Svensson K., Sonesson С. and Carlsson A.: Differential effects of dopamine D2 and D3 receptor antagonists in regard to dopamine release, in vivo receptor displacement and behaviour. J. Neural. Transm. Gen. Sect. 1994, 98 (1); 39-55.