ПРЕДУПРЕЖДЕНИЕ И ЛЕЧЕНИЕ ЦЕРЕБРАЛЬНОЙ АМИЛОИДНОЙ АНГИОПАТИИ
Вид РИД
Изобретение
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Сверхэкспрессия мутантного человеческого белка-предшественника амилоида (АРР) в организме различных трансгенных мышей приводит к некоторым поражениям типа болезни Альцгеймера (AD) (см. обзор D. Games et al., J Alzheimers Dis 9, 133-49 (2006); J. Gotz et al., Mol Psychiatry 9, 664-83 (2004)). Эти поражения включают развитие в паренхиме бета-амилоидных (Ар) бляшек, нейритной патологии, утраты синапсов и глиоза. В ряде сообщений показано, что активные (см. D. Schenk et al., Nature 400, 173-7 (1999); D.L. Dickstein et al., Faseb J 20, 426-33 (2006)) и пассивные (см. F. Bard et al., Nat Med 6, 916-9 (2000); M. Buttini et al., J Neurosci 25, 9096- 101 (2005); D.M. Wilcock et al., J Neuroinflammation 1, 24 (2004)) Аβ иммунотерапевтические методы эффективно уменьшают или/и устраняют эти патологии в преклинических исследованиях (см. R.P. Brendza & D. M. Hoizman, Ahheimer Dis Assoc Disord 20, 118-23 (2006); C.A. Lemere et al., Rejuvenation Res 9, 77-84 (2006)). Кроме того, многими исследователями показано улучшение в различных когнитивных тестах (см. D.M. Wilcock et al., supra; С. Janus et al., Nature 408, 979-82 (2000); D. Morgan et al., Nature 408, 982-5 (2000)). Эти результаты подтверждаются результатами, показывающими возрастающую корреляцию как при тестировании памяти, так и при нейропатологическом исследовании мозга пациентов, которые были зарегистрированы в клинических испытаниях Аβ иммунотерапии (AN1792), см. J.A. Nicoll et al., Nat Med 9, 448-52 (2003); I. Ferrer et al., Brain Pathol 14, 11-20 (2004); S. Oilman et al., Neurology 64, 1553-62 (2005).
В последнее время другой общий аспект AD патологии, сосудистый Aβ (VAβ), стал объектом тщательного изучения в преклинических исследованиях АРР трансгенных животных. Сообщалось, в частности, что пассивная иммунизация ассоциируется с повышением VAβ и микрокровоизлиянием (см. D.M. Wilcock et al., supra; M.M. Racke et al., J Neurosci 25, 629-36 (2005)). Однако прогностическая клиническая роль остается неясной, в особенности в свете предпочтительных поведенческих результатов некоторых из тех же самых исследований (см. D.M. Wilcock et al., supra), отсутствия ультраструктурных различий в морфологии гемосидерин-позитивных сосудов у непролеченных и пролеченных трансгенных мышей (см. G.J. Burbach et al., Neurobiol Aging 28, 202-12 (2007)) и, в особенности, отсутствия данных о заметном кровоизлиянии или сопутствующих удару последствиях в продолжающихся клинических испытаниях. Кроме того, мало известно о том, насколько, до какой степени VAβ в конечном счете поражается при Аβ иммунотерапевтических методах; например, могут ли отличаться результаты (показатели), полученные на моделях лечения хронического случая, от результатов, полученных при изучении случаев острого заболевания. Например, неизвестно, представляют ли сообщаемые увеличения VAβ временное явление, ассоциированное с клиренсом Аβ, так как, по-видимому, относительная доля продуцирования Аβ40 по сравнению с Аβ42 влияет как на агрегационные свойства Аβ, так и на эффективность связывания некоторых антител, в частности антител с C-концевыми эпитопами.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение включает способы терапевтического лечения САА (церебральной амилоидной ангиопатии, ЦАА). Способы включают введение агента пациенту, болеющему или предположительно болеющему САА. В некоторых способах агент представляет собой антитело, специфическое к N-концу Аβ и, вследствие этого, "врачует" пациента. Необязательно, агент представляет собой антитело, которое связывается в пределах остатков 1-5 белка Аβ. Необязательно, антитело является "гуманизированным", человеческим или химерным антителом. Необязательно, гуманизированное антитело представляет собой антитело 3D6. Необязательно, 3D6 гуманизированное антитело представляет собой бипинеузумаб. Необязательно, гуманизированное антитело является антителом 12А11.
В некоторых способах агент представляет собой фрагмент Аβ. Необязательно, фрагмент начинается с остатка 1 Аβ и кончается одним из остатков 5-10 Аβ. Необязательно, фрагмент представляет собой Аβ 1-7. Необязательно, Аβ фрагмент вводят с фармацевтически приемлемым адъювантом. Необязательно, Аβ фрагмент связан с носителем, который способствует индукции фрагментом антител к фрагменту. Необязательно, носитель связан с C-концом Аβ-фрагмента.
Некоторые способы по изобретению дополнительно включают установление наличия САА у пациента, причем стадия установления (определения) предшествует стадии (мерам) введения. В некоторых способах на стадии установления определяют, что у пациента наблюдаются клинические симптомы САА.
В некоторых способах терапевтического лечения САА в мозге пациента отсутствуют бляшки, характерные для болезни Альцгеймера. Необязательно, в мозге пациента отсутствуют бляшки, характерные для болезни Альцгеймера, а у пациента отсутствуют симптомы болезни Альцгеймера. В некоторых способах терапевтического лечения САА у пациента наблюдается инфаркт или удар.
Необязательно, способы включают введение дозы антитела, которая составляет, примерно, 0.01-5 мг/кг. Необязательно, способы включают введение дозы антитела, которая составляет, примерно, 0.1-5 мг/кг. Необязательно, способы включают введение дозы около 0.5 мг/кг. Необязательно, способы включают введение дозы около 1.5 мг/кг. Необязательно, способы включают введение дозы антитела, которая составляет, примерно, 0.5-3 мг/кг. Необязательно, способы включают введение дозы антитела, которая составляет, примерно, 0.5-1.5 мг/кг. Необязательно, способы включают многократное введение антитела. Необязательно, антитело вводят по схемам от еженедельной до ежеквартальной (раз в три месяца). Необязательно, антитело вводят каждые 13 недель. Необязательно, антитело вводят внутривенно или подкожно.
Необязательно, антитело вводят по схеме, достаточной для того, чтобы поддерживать среднюю сывороточную концентрацию антитела у пациента в интервале 1-15 мкг антитела/мл сыворотки и тем самым лечить пациента. Необязательно, средняя сывороточная концентрация находится в диапазоне 1-10 мкг антитела/мл сыворотки. Необязательно, средняя сывороточная концентрация находится в диапазоне 1-5 мкг антитела/мл сыворотки. Необязательно, средняя сывороточная концентрация находится в диапазоне 2-4 мкг антитела/мл сыворотки. Необязательно, антитело вводят по схеме, достаточной для поддержания средней сывороточной концентрации антитела по меньшей мере в течение одного года. Необязательно, средняя сывороточная концентрация антитела поддерживается по меньшей мере в течение шести месяцев.
Некоторые способы, в которых агентом является антитело, необязательно, дополнительно включают определение концентрации антитела в сыворотке и корректировку схемы, если определяемая концентрация выпадает из диапазона.
Необязательно, антитело вводят внутривенно по схеме, достаточной для того, чтобы поддерживать среднюю сывороточную концентрацию антитела у пациента в интервале 1-15 мкг антитела/мл сыворотки и тем самым лечить пациента. Необязательно, дозу 0.5-1.0 мг/кг вводят внутривенно ежемесячно. Необязательно, дозу 0.1-1.0 мг/кг вводят внутривенно ежемесячно.
Необязательно, антитело вводят подкожно. Необязательно, антитело вводят подкожно с частотой от еженедельного введения до ежемесячного. Необязательно, антитело вводят подкожно еженедельно или раз в две недели. Необязательно, антитело вводят подкожно в примерной дозе 0.01-0.35 мг/кг. Необязательно, антитело вводят подкожно в примерной дозе 0.05-0.25 мг/кг. Необязательно, антитело вводят подкожно в примерной дозе 0.015-0.2 мг/кг еженедельно или раз в две недели. Необязательно, антитело вводят подкожно в примерной дозе 0.05-0.15 мг/кг еженедельно или раз в две недели. Необязательно, антитело вводят подкожно в примерной дозе 0.05-0.07 мг/кг еженедельно. Необязательно, антитело вводят подкожно в дозе 0.06 мг/кг еженедельно. Необязательно, антитело вводят подкожно в примерной дозе 0.1-0.15 мг/кг раз в две недели.
Необязательно, антитело вводят подкожно в примерной дозе 0.01-0.6 мг/кг с частотой от еженедельной до ежемесячной. Необязательно, антитело вводят подкожно в примерной дозе 0.05-0.25 мг/кг. Необязательно, антитело вводят подкожно в примерной дозе 0.015-0.2 мг/кг еженедельно или раз в две недели. Необязательно, антитело вводят подкожно в примерной дозе 0.05-0.15 мг/кг еженедельно или раз в две недели. Необязательно, антитело вводят подкожно в примерной дозе 0.05-0.07 мг/кг еженедельно. Необязательно, антитело вводят подкожно в дозе 0.06 мг/кг еженедельно. Необязательно, антитело вводят подкожно в примерной дозе 0.1-0.15 мг/кг раз в две недели. Необязательно, антитело вводят подкожно в примерной дозе 0.1-0.3 мг/кг ежемесячно. Необязательно, антитело вводят подкожно в дозе 0.2 мг/кг ежемесячно.
Некоторые способы по изобретению дополнительно включают мониторинг изменений признаков или симптомов САА, реагирующих на лечебные меры. Некоторые способы по изобретению дополнительно включают введение второго агента, применимого для эффективного лечения САА.
Изобретение включает способы эффективной профилактики САА. Способы включают введение пациенту, восприимчивому к САА, агента по эффективной схеме. Агент представляет собой антитело, специфическое к N-концу Аβ, или агент, который индуцирует такое антитело после введения пациенту и тем самым позволяет провести профилактику пациента. Изобретение включает применение агента, причем агент представляет собой антитело, специфическое к N-концу Аβ, или агент, который индуцирует такое антитело после введения пациенту, при лечении или профилактике болезни Альцгеймера.
Изобретение включает способы снижения уровня сосудистого амилоида у пациента. Способы включают введение антитела, специфического к N-концу Аβ, по схеме лечения, которая позволяет эффективно удалять сосудистый амилоид и снижать частоту мозговых микрокровоизлияний. Некоторые способы включают дополнительно мониторинг пациента для определения мозгового микрокровоизлияния методом МРТ (ЯМР-томографии, магнито-резонансной томографии, MRI). Некоторые способы дополнительно включают мониторинг пациента методом ПЭТ-сканирования (позитронно-эмиссионной томографии, PET) для определения удаления сосудистого амилоида. Необязательно, в некоторых способах схема лечения является постоянной схемой лечения (хронической). Необязательно, в некоторых способах схема лечения включает дозу антитела 0.01-5 мг/кг массы тела пациента и введение от еженедельного до ежеквартального. Необязательно, в некоторых способах доза антитела составляет 0.1-5 мг/кг. Необязательно, в некоторых способах доза составляет около 0.5 мг/кг. Необязательно, в некоторых способах доза составляет около 1.5 мг/кг. Необязательно, в некоторых способах доза составляет около 0.5-3 мг/кг. Необязательно, в некоторых способах доза составляет 0.5-1.5 мг/кг. Необязательно, в некоторых способах дозу вводят каждые 13 недель. Необязательно, в некоторых способах антитело вводят внутривенно или подкожно. Необязательно, агент представляет собой антитело, которое связывается только с остатками 1-5 Аβ. Необязательно, антитело является гуманизированным, человеческим или химерным антителом. Необязательно, гуманизированное антитело представляет собой 3D6. Необязательно, 3D6 гуманизированное антитело представляет собой бапинеузумаб. Необязательно, гуманизированное антитело представляет собой 12А11.
Изобретение включает способы лечения болезни Альцгеймера. Способы включают введение антитела, специфического к N-концу Аβ, в дозе, которая снижает или ингибирует развитие сосудистой амилоидогенной патологии, сводит к минимуму микрокровоизлияние (микрогемморагию) и снижает или ингибирует развитие Аβ бляшек. Необязательно, в некоторых способах антитело связывается в пределах остатков 1-5 Аβ. Необязательно, антитело является гуманизированным, человеческим или химерным антителом. Необязательно, гуманизированное антитело представляет собой 3D6. Необязательно, 3D6 гуманизированное антитело представляет собой бапинеузумаб. Необязательно, гуманизированное антитело представляет собой 12А11.
Изобретение включает способы лечения болезни Альцгеймера, которые включают введение антитела, специфического к N-концу Аβ, в дозе, которая снижает или ингибирует развитие сосудистой амилоидогенной патологии, сводит к минимуму микрокровоизлияние (микрогемморагию) и снижает и/или ингибирует развитие нейритной патологии. Необязательно, в некоторых способах антитело связывается в пределах остатков 1-5 Аβ. Необязательно, антитело является гуманизированным, человеческим или химерным антителом. Необязательно, гуманизированное антитело представляет собой 3D6. Необязательно, 3D6 гуманизированное антитело представляет собой бапинеузумаб. Необязательно, гуманизированное антитело представляет собой 12А11.
Изобретение включает способы лечения болезни Альцгеймера, которые включают введение антитела, специфического к N-концу Аβ, в дозе, которая снижает или ингибирует развитие сосудистой амилоидогенной патологии, сводит к минимуму микрокровоизлияние (микрогемморагию) и/или улучшает когнитивную функцию у пациента. Необязательно, в некоторых способах антитело связывается с остатками в пределах остатков 1-5 Аβ. Необязательно, антитело является гуманизированным, человеческим или химерным антителом. Необязательно, гуманизированное антитело представляет собой 3D6. Необязательно, 3D6 гуманизированное антитело представляет собой бапинеузумаб. Необязательно, гуманизированное антитело представляет собой 12А11.
Необязательно, в некоторых способах лечения болезни Альцгеймера снижение или ингибирование сосудистой амилоидогенной патологии представляет собой предупреждение аккумуляции Аβ в сосудах или клиренс сосудистого Аβ.
Кроме того, изобретение включает диагностические наборы, пригодные для применения в вышеуказанных способах. Такой набор содержит антитело, которое специфически связывается с эпитопом с остатками 1-10 Аβ. Некоторые наборы включают этикетку с описанием применения антитела для in vivo диагностики или мониторинга болезни Альцгеймера.
Помимо этого, изобретение включает наборы для лечения САА, пригодные для применения в вышеуказанных способах. Такой набор включает виалу, содержащую препарат. Некоторые наборы по изобретению включают стеклянную виалу, содержащую препарат, включающий 0.5-3 мг/кг гуманизированного антитела против Аβ.
Некоторые наборы по изобретению включают стеклянную виалу, содержащую препарат, включающий: i) около 10 мг - 250 мг гуманизированного антитела против Аβ, ii) около 4% маннита или около 150 мМ NaCl, iii) около 5 мМ - 10 мМ гистидина и iv) около 10 мМ метионина. Некоторые наборы включают инструкции по мониторингу пациента, которому вводят препарат, на САА. Необязательно, инструкции включают: i) мониторинг у пациента микрокровоизлияний в мозг методом МРТ или ii) мониторинг пациента методом ПЭТ-сканирования для определения удаления сосудистого амилоида.
Помимо этого, изобретение включает наборы для лечения болезни Альцгеймера, пригодные для применения в вышеуказанных способах. Такие наборы включают стеклянную виалу, содержащую препарат, включающий: i) около 10 мг - 250 мг гуманизированного антитела против Ар, ii) около 4% маннита или около 150 мМ NaCl, iii) около 5 мМ - 10 мМ гистидина и iv) около 10 мМ метионина. Некоторые наборы включают инструкции по мониторингу пациента, которому вводят препарат, на болезнь Альцгеймера. Необязательно, инструкции включают: i) мониторинг у пациента микрокровоизлияний в мозг методом МРТ или ii) мониторинг пациента методом ПЭТ-сканирования для определения удаления сосудистого амилоида.
Далее изобретение включает наборы для лечения САА и болезни Альцгеймера, пригодные для применения в вышеуказанных способах. Такие наборы включают стеклянную виалу, содержащую препарат, включающий: i) около 10 мг - 250 мг гуманизированного антитела против AR, ii) около 4% маннита или около 150 мМ NaCl, iii) около 5 мМ - 10 мМ гистидина и iv) около 10 мМ метионина. Некоторые наборы включают инструкции по мониторингу пациента, которому вводят препарат, на САА и болезнь Альцгеймера. Необязательно, инструкции включают: i) мониторинг у пациента микрокровоизлияний в мозг методом МРТ или ii) мониторинг пациента методом ПЭТ-сканирования для определения удаления сосудистого амилоида.
Необязательно, антитело вводят в дозе около 0.05-0.5 мг/кг. Необязательно, антитело вводят в дозе около 1-40 мг с частотой от еженедельной до ежемесячной. Необязательно, антитело вводят в дозе около 5-25 мг с частотой от еженедельной до ежемесячной. Необязательно, антитело вводят в дозе около 2.5-15 мг с частотой от еженедельной до ежемесячной.
Необязательно, антитело вводят в дозе около 2.5-15 мг с частотой от еженедельной до раз в две недели. Необязательно, антитело вводят в дозе около 2.5-10 мг с частотой от еженедельной до раз в две недели. Необязательно, антитело вводят в дозе около 2.5-5 мг еженедельно. Необязательно, антитело вводят в дозе около 4-5 мг еженедельно. Необязательно, антитело вводят в дозе около 7-10 мг раз в две недели.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
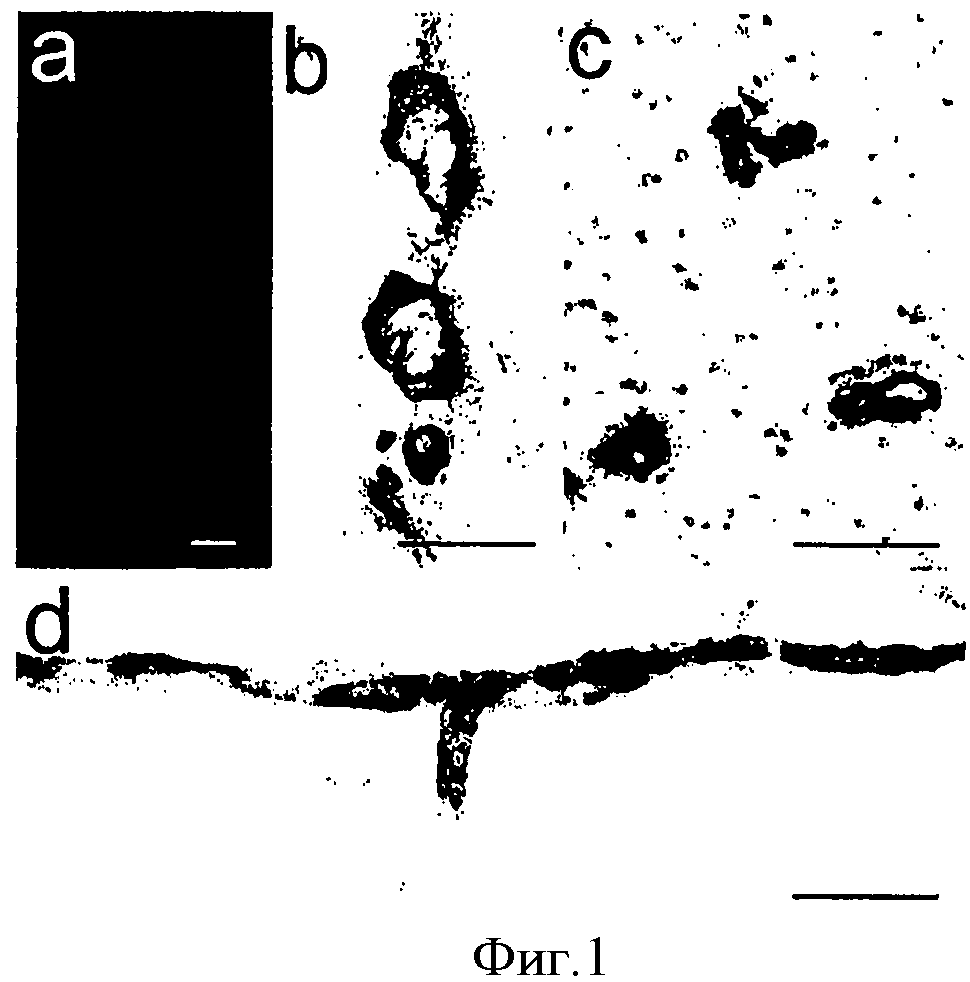
На Фигуре 1а показано окрашивание тиофлавином S, а на Фигуре 1b показано иммунномечение антителом 3D6 Аβ в сосудах срединных (медиальных) структур головного мозга 18-месячных мышей PDAPP. На Фигуре 1с показана человеческая AD ткань, а на Фигуре 1d показаны лептоменингеальные и поверхностные паренхимные сосуды мыши PDAPP с VAβ, иммуномеченными с помощью 3D6. Масштаб = 100 мкм.
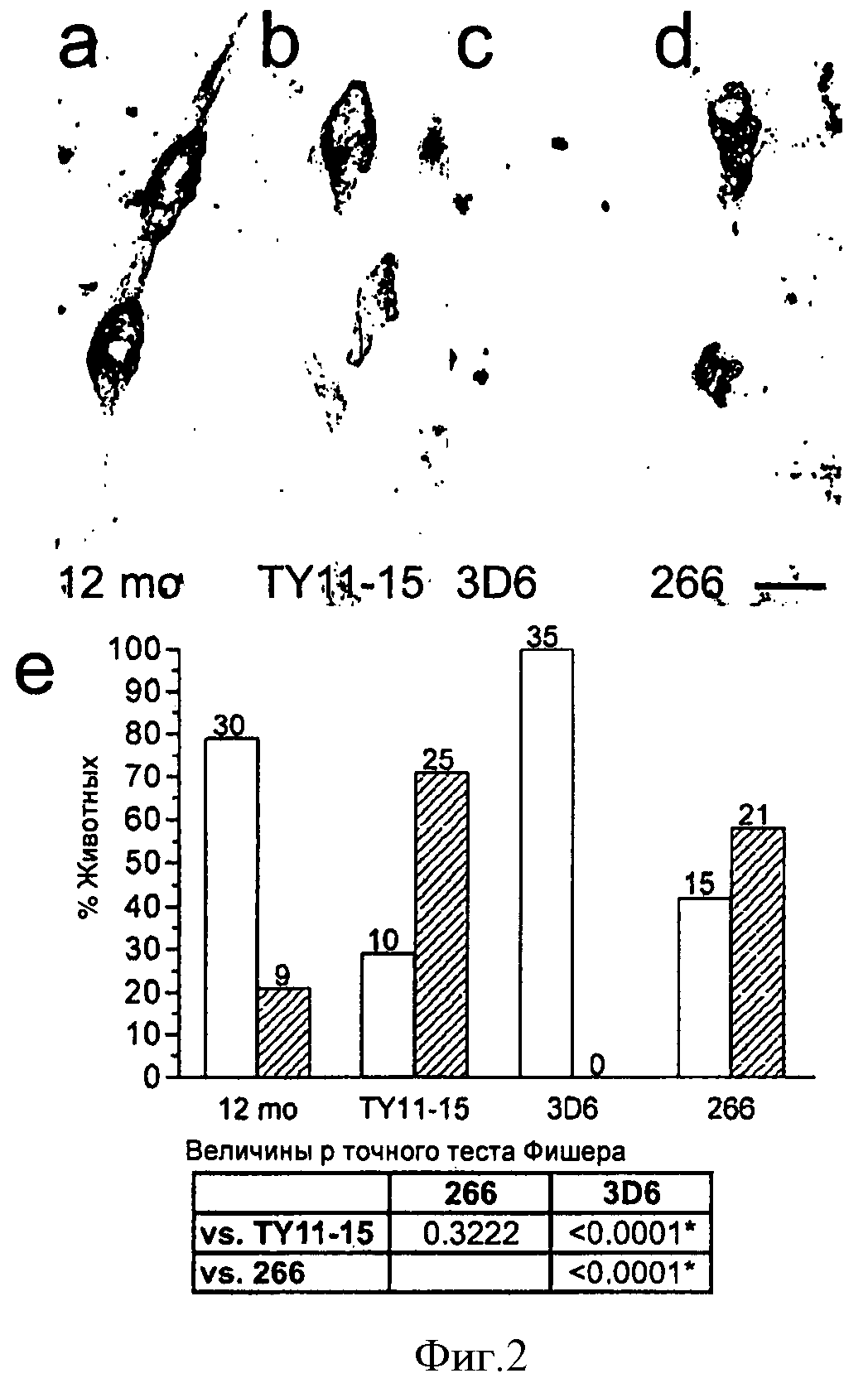
На Фигуре 2а показан мозг непролеченной 12-месячной мыши, на Фигуре 2b показан мозг мыши, получавшей контроль, на Фигуре 2c показан мозг мыши, получавшей 3D6 в дозе 3 мг/кг, и на Фигуре 2d показан мозг мыши, получавшей 3 мг/кг 266 с 3D6 иммунномеченными Vaβ в срединных сосудах. Масштаб = 50 мкм. На диаграмме показано количество животных (в процентах) в каждой группе не содержащих/содержащих мало VAβ (незаштрихованные столбцы) и содержащих умеренное число VAβ (заштрихованные столбцы).
На Фигуре 3а показан мозг мыши, получавшей контроль, на Фигуре 3b показан мозг мыши, пролеченной 3D6 в дозе 0.1 мг/кг, на Фигуре 3с показан мозг мыши, пролеченной 3D6 в дозе 0.3 мг/кг, и на Фигуре 3d показан мозг мыши, получавшей 3 мг/кг 3D6 с 3D6 иммунномеченными Vaβ в лептоменингеальных сосудах. Скобки и стрелки, VAβ, Масштаб = 100 мкм. На диаграмме показано количество животных (в процентах) в каждой группе не содержащих/содержащих мало VAβ (незаштрихованные столбцы) и содержащих умеренное число VAβ (заштрихованные столбцы).
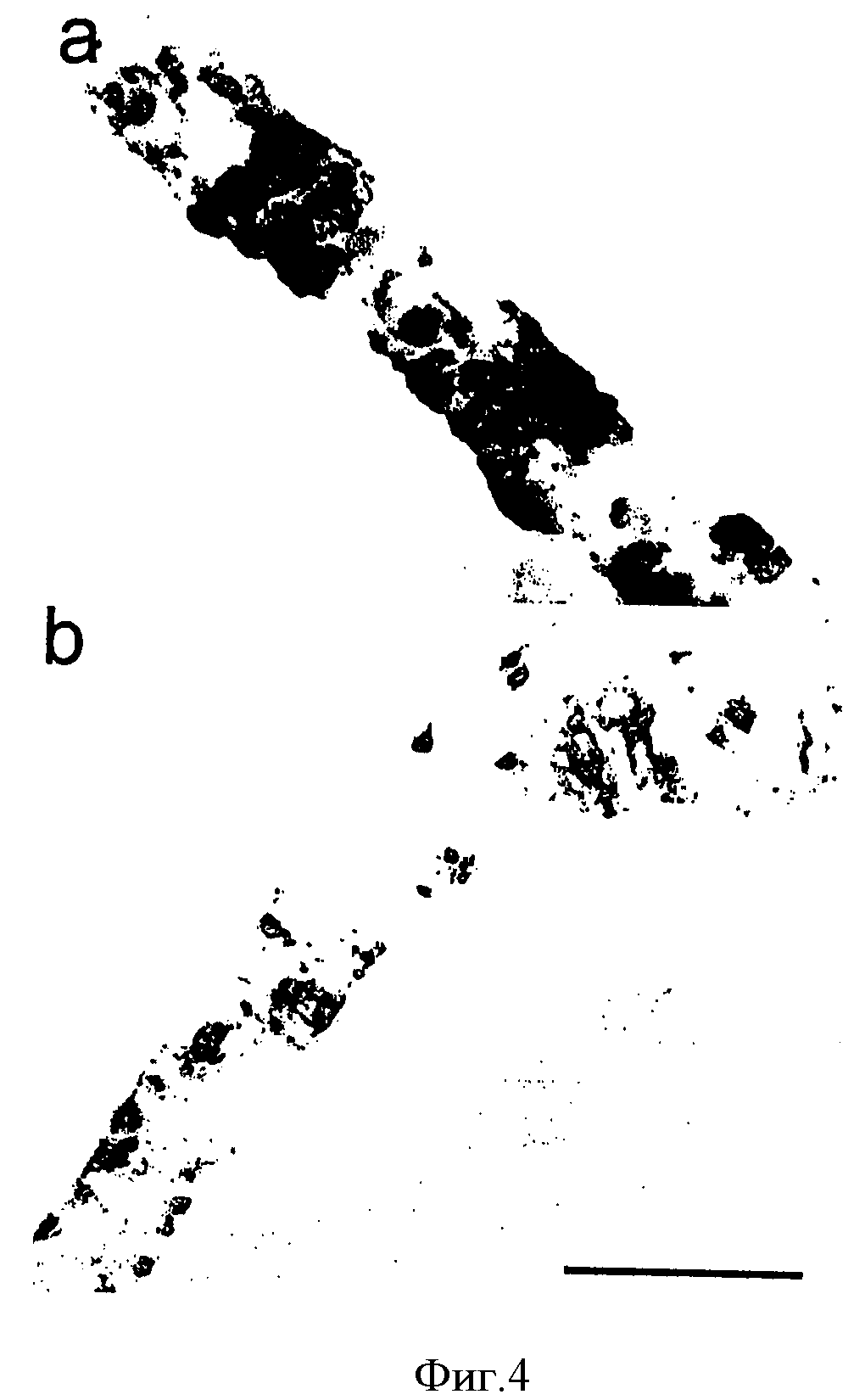
На Фигуре 4а показано 3D6 иммуномечение скругленных масс и полос интактного Vaβ, охватывающих непораженный лептоменингеальный сосуд мыши, пролеченной 3D6 в дозе 0.1 мг/кг. На Фигуре 4b показано 3D6 иммуномечение очагового, подвергшегося эрозии VAβ в процессе частичного клиренса у мыши, пролеченной 3D6 в дозе 0.1 мг/кг. Масштаб = 50 мкм.
На Фигурах 5а и 5b показан частичный клиренс или предупреждение Vaβ при пониженных дозах 3D6 без всяких признаков микрокровоизлияния у большинства животных. На Фигуре 5c показан полный клиренс или предупреждение Vaβ при дозе 3D6 3 мг/кг без всяких признаков микрокровоизлияния у большинства животных. На Фигурах 5d и 5е показано микрокровоизлияние в местах частичного клиренса при пониженных дозах 3D6. На Фигуре 5f показано микрокровоизлияние в местах полного клиренса при дозах 3D6 3 мг/кг. Стрелки, макрофаги. Масштаб = 100 мкм.
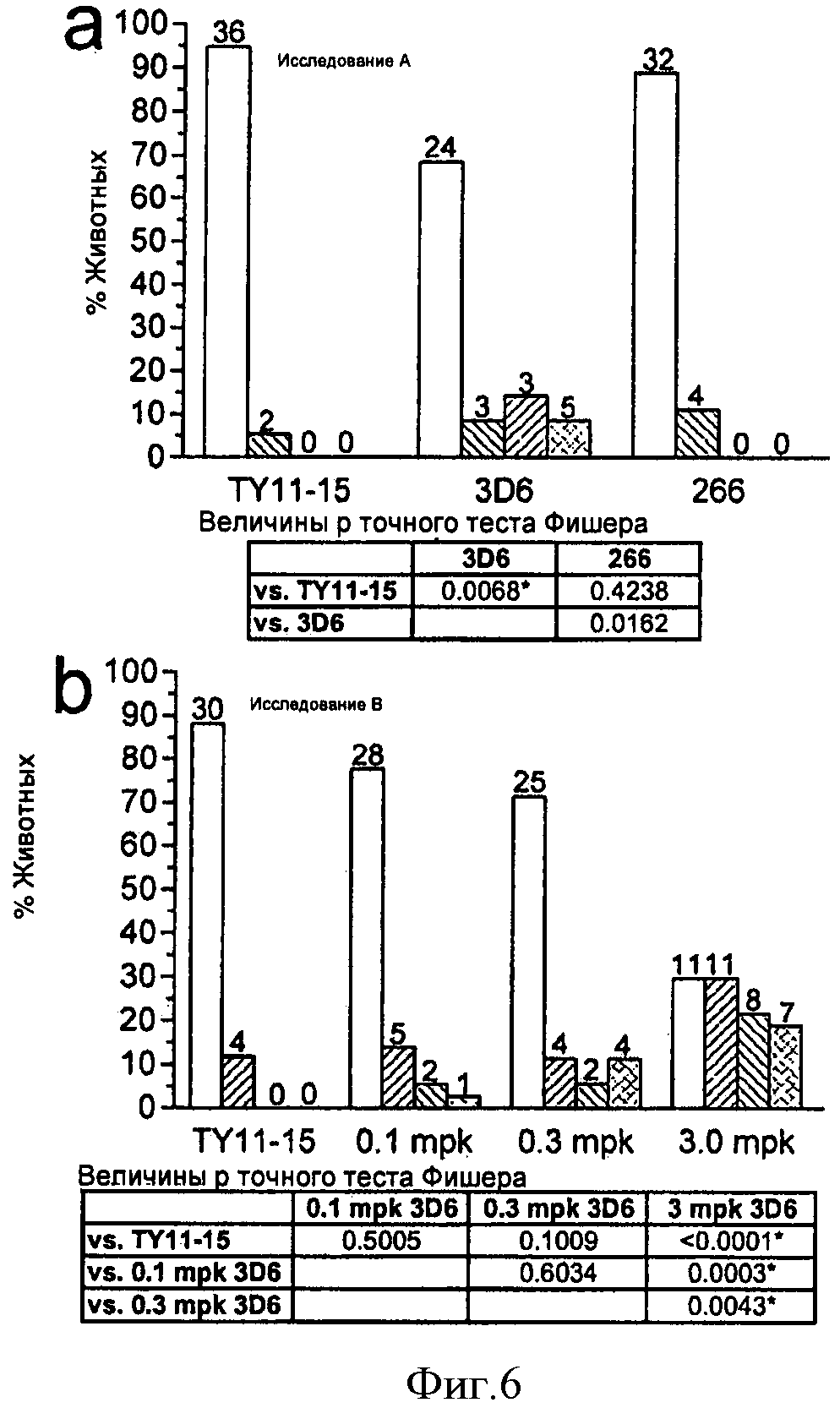
На Фигуре 6а показаны основные показатели гемосидерина в контрольной и пролеченных группах в Исследовании А. На Фигуре 6b показаны основные показатели гемосидерина в контрольной и пролеченных группах в Исследовании В.
ОПРЕДЕЛЕНИЯ
Термин "значительная (практическая) идентичность" означает, что две пептидных последовательности, будучи оптимально выравнены, например, с помощью программ GAP или BESTFIT с применением средневзвешенного гэпа по умолчанию, имеют последовательности, идентичные по меньшей мере на 65%, предпочтительно, последовательности, идентичные по меньшей мере на 80 или на 90%, более предпочтительно, последовательности, идентичные по меньшей мере на 95% (например, последовательности, идентичные на 99% или более). Предпочтительно, остатки, которые не являются идентичными, отличаются консервативными аминокислотными заменами.
При сравнении последовательностей обычно одна последовательность является эталонной последовательностью, с которой сравнивают тестируемую последовательность. При использовании алгоритма сравнения последовательностей тестируемая и эталонная последовательности вводят в компьютер, при необходимости соответствующие координаты назначают и назначают параметры программы последовательности по алгоритму. Затем по алгоритму сравнения последовательностей рассчитывают процент идентичности последовательностей для тестируемой последовательности (тестируемых последовательностей) относительно эталонной последовательности с учетом назначенных параметров программы.
Оптимальное выравнивание последовательностей для сравнения можно проводить, например, с помощью алгоритма локального выравнивания по гомологии Смита-Ватермана (Smith & Waterman, Adv. Appl. Math. 2: 482 (1981)), с помощью алгоритма выравнивания по гомологии Нидельмана-Вунша (Needleman & Wunsch, J. Mol. Biol. 48: 443 (1970)), по методу поиска подобия Пирсона-Липмана (Pearson & Lipman, Proc, Nat'l. Acad. Sci. USA 85: 2444 (1988)), с помощью компьютерного применения этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI) или с помощью визуального изучения (см. в целом Ausubel et al., supra). Примером алгоритма, пригодного для определения идентичности последовательностей в процентах и подобия последовательностей, является алгоритм BLAST, который описан Altschul et al., J. Mol. Biol. 215: 403-410 (1990). Программа для BLAST анализов находится на веб-сайте National Center for Biotechnology Information (NCBI). Обычно для сравнения последовательностей можно использовать параметры программы по умолчанию, хотя можно использовать также специальные параметры. Для аминокислотных последовательностей программа BLASTP использует в качестве параметров по умолчанию длину слова (разрядность, W) 3, математическое ожидание (Е) 10, и матрицу замен BLOSUM62 (см. Henikoff & Henikoff, Proc. Natl. Acad. Sci. USA 89, 10915 (1989)).
С целью классификации аминокислотных замен, консервативных или неконсервативных, аминокислоты распределяют по группам следующим образом: Группа I (гидрофобные боковые цепи): norleucine (норлейцин), met, ala, val, leu, ile; Группа II (нейтральные гидрофильные боковые цепи): cys, ser, thr; Группа III (кислые боковые цепи): asp, glu; Группа IV (основные боковые цепи): asn, gln, his, lys, arg; Группа V (остатки, влияющие на ориентацию цепи): gly, pro; и Группа VI (ароматические боковые цепи): trp, tyr, phe. Консервативные замены включают замены между аминокислотами одного класса. Неконсервативные замены представляют собой замену члена одного из этих классов на члена другого класса.
Терапевтические агенты по изобретению обычно являются практически чистыми, не содержащими нежелательных примесей. Это означает, что агент обычно по меньшей мере, примерно, на 50% вес. (вес./вес.) чистый, а также практически не содержит мешающих белков и примесей. Иногда чистота агентов составляет по меньшей мере около 80% вес. и, более предпочтительно, по меньшей мере около 90 или около 95% вес. Однако при использовании обычных методов очистки белков можно получить гомогенные пептиды с чистотой по меньшей мере около 99%.
Выражение молекула "специфически связывается" с мишенью или "специфически иммунореактивна" по отношению к мишени относится к реакции связывания, которая является определяющей для существования молекулы в непосредственной близости от гетерогенной популяции других биологических форм. Таким образом, в предполагаемых условиях иммуноанализа указанная молекула связывается с конкретной мишенью и не связывается в значительной мере с другими биологическими формами в образце. Специфическое связывание антитела с мишенью в таких условиях требует, чтобы антитело было отобрано по его специфичности относительно мишени. Можно применять различные форматы иммуноанализа для отбора антител, специфически иммунореактивных в отношении конкретного белка. Например, обычно для отбора моноклональных антител, специфически иммунореактивных в отношении белка, используют твердофазные иммуноанализы ELISA. См., например, в Harlow and Lane (1988) Antibodies, A Laboratory Manual, Cold Spring Harbor Publications, New York, описание форматов и условий иммуноанализа, которые можно применять для определения специфической иммунореактивности. Специфическое связывание двух частиц означает аффинность по меньшей мере 106, 107, 108, 109 М-1 или 1010 М-1. Предпочтительна аффинность более 108 М-1.
Термин "антитело" или "иммуноглобулин" применяется для обозначения интактных антител и их связывающих фрагментов. Обычно фрагменты конкурируют с интактным антителом, из которого они произошли, за специфическое связывание с фрагментом антигена, включая Fab, Fab', F(ab')2, Fabc и Fv. Фрагменты получают методами рекомбинантной ДНК или ферментативными или химическими методами деления интактных иммуноглобулинов. Термин "антитело" включает также одну или более цепей иммуноглобулина, которые химически конъюгированы в или экспрессируются как белки, слитые с другими белками. Термин "антитело" также включает биспецифическое антитело. Биспецифическое или бифункциональное антитело представляет собой искусственное гибридное антитело, имеющее две различные пары тяжелая/легкая цепь и два различных сайта связывания. Биспецифические антитела можно получать различными методами, включая слияние гибридом или связывание фрагментов Fab'. См., например, Songsivilai & Lachmann, Clin. Exp. Immunol. 79: 315-321 (1990); Kostelny et al., J. Immunol. 148, 1547-1553 (1992).
APP695, APP751 и АРР770 относятся, соответственно, к полипептидам длиной 695, 751 и 770 аминокислотных остатков, кодированным человеческим АРР геном. См. Kang et al., Nature 325, 773 (1987); Ponte et al., Nature 331, 525 (1988); и Kitaguchi et al., Nature 331, 530 (1988). Аминокислотам в человеческом амилоидном белке-предшественнике (АРР) присвоены номера, соответствующие номерам в последовательности изоформы АРР770.
Такие термины, как Аβ39, Аβ40, Аβ41, Аβ42 и Аβ43, относятся к Аβ пептиду, содержащему аминокислотные остатки 1-39, 1-40, 1-41, 1-42 и 1-43. Последовательности этих пептидов и их связь с АРР предшественником проиллюстрированы на Фиг.1 в статье Hardy et al., TINS 20, 155-158 (1997). Например, Аβ42 имеет последовательность:
DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIAT
Аβ41, Аβ40 и Аβ39 отличаются от Аβ42 тем, что в них удалены Ala, Ala-Ile и Ala-Ile-Val, соответственно, на С-конце. Аβ43 отличается от Аβ42 наличием остатка Thr на С-конце.
"Антиген" обозначает частицу (объект, элемент, самостоятельную структуру), с которой специфически связывается антитело.
Термин "эпитоп" или "антигенная детерминанта" относится к сайту на антигене, на который реагируют В и/или Т клетки. В-клеточные эпитопы могут образовываться как из соседних аминокислот, так и не из соседних аминокислот, сближающихся (располагающихся рядом) за счет образования третичной структуры (фолдинга, укладки) белка. Эпитопы, образованные из соседних аминокислот, обычно сохраняются при экспозиции с денатурирующими растворителями, тогда как эпитопы, образующиеся за счет фолдинга, образования третичной структуры, обычно утрачиваются при обработке денатурирующими растворителями. Эпитоп обычно включает по меньшей мере 3 и более, обычно по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации. Методы определения пространственной конформации эпитопов включают, например, рентгеноструктурный анализ (РСА) и 2-мерный ядерный магнитный резонанс. См., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol.66, Glenn E. Morris, Ed. (1996). Антитела, которые узнают один и тот же эпитоп, можно идентифицировать простым иммуноанализом, показывающим способность одного антитела блокировать связывание другого антитела с антигеном-мишенью. Т-клетки узнают непрерывные эпитопы, примерно, из девяти аминокислот, для CD8 клеток или, примерно, из 13-15 аминокислот для CD4 клеток. Т-клетки, которые узнают эпитоп, можно идентифицировать анализами in vitro, в которых измеряется антиген-зависимая пролиферация, определяемая с помощью включения 3H-тимидина примированными Т-клетками как реакции на эпитоп (Burke et al., J. Inf. Dis. 170, 1110-19 (1994)), антиген- зависимого киллинга (анализ цитотоксической Т лимфоцитарной активности, Tigges et al., J. Immunol. 156, 3901-3910) или секреции цитокинов.
Термин "иммунологический" или "иммунный" ответ обозначает развитие гуморального (опосредованного антителом) и/или клеточного (опосредованного антиген-специфическими Т-клетками или продуктами их секреции) ответа, направленного против амилоидного пептида в организме больного реципиента. Такой ответ может представлять собой активный ответ, индуцированный введением иммуногена, или пассивный ответ, индуцированный введением антитела или примированных Т-клеток. Клеточный иммунный ответ выявляется презентацией полипептидных эпитопов в ассоциации с Класса I и Класса II МНС молекулами для активации антиген-специфических CD4+ Т хелперных клеток и/или CD8+ цитотоксических Т клеток. Ответ (реакция) может также включать активацию моноцитов, макрофагов, NK клеток, базофилов, дендритных клеток, астроцитов, клеток макроглии, эозинофилов или других компонентов врожденного иммунитета. Наличие опосредованного иммунологического ответа можно определить анализами пролиферации (CD4+ Т клеток) или анализами CTL (цитотоксических Т лимфоцитов) (см. Burke, supra; Tigges, supra). Относительный вклад гуморального и клеточного ответов в протективное или терапевтическое действие иммуногена можно различить, раздельно выделяя антитела и Т-клетки из иммунизированного сингенного животного и определяя защитное (протективное) или терапевтическое действие на второго субъекта.
"Иммуногенный агент" или "иммуноген" способен индуцировать иммунологический ответ на самого себя при введении млекопитающему, необязательно, в сочетании с адъювантом.
Термин "полностью-D" относится к пептидам, имеющим аминокислоты с >75%, >80%, >85%, >90%, >95% или 100% D-конфигурацию.
Термин "незащищенный (голый) полинуклеотид" относится к полинуклеотиду, не комплексующемуся с коллоидными материалами. "Голые" полинуклеотиды иногда клонируют в плазмидный вектор.
Термин "адъювант" относится к соединению, которое, при введении в конъюгации с антигеном, усиливает иммунный ответ на антиген, но будучи введено самостоятельно, не вызывает иммунного ответа на антиген. Адъювант может усиливать иммунный ответ по нескольким механизмам, включая рекрутинг лимфоцитов, стимуляцию В и/или Т клеток и стимуляцию макрофагов.
Термин "эффективная доза" или "эффективная дозировка" определяют как количество, достаточное для достижения заданного эффекта. Термин "терапевтически эффективная доза" определяется как количество, достаточное для излечивания или по меньшей мере частичного подавления заболевания и его осложнений у пациента, уже страдающего заболеванием. Количество, эффективное для такого применения, зависит от тяжести инфекции и общего состояния собственной иммунной системы пациента.
Некоторые вариации раскрываемых диапазонов (вариантов) в примерах допустимы вследствие ошибок опыта (при измерении). Такие вариации обозначаются термином "около" ("примерно") по отношению к интервалам (диапазонам) или дозам.
Термин "пациент" включает человека и других млекопитающих, которые получают либо профилактическое, либо терапевтическое лечение.
Конкуренцию между антителами определяют анализом, в котором тестируемый иммуноглобулин ингибирует специфическое связывание эталонного антитела с обычным антигеном, таким как Аβ. Известны различные типы анализов конкурентного связывания, например: твердофазный прямой или "непрямой" радиоиммуноанализ (RIA), твердофазный прямой или "непрямой" ферментный иммуноанализ (EIA), конкурентный сэндвич-анализ (см. Stahli et al., Methods in Enzymology 9: 242-253 (1983)); твердофазный прямой EIA с комплексом биотин - авидин (см. Kirkland et al., J. Immunol. 137: 3614-3619 (1986)); твердофазный прямой анализ с меткой, твердофазный прямой сэндвич-анализ с меткой (см. Harlow and Lane, Antibodies, A Laboratory Manual, Cold Spring Harbor Press (1988)); твердофазный прямой анализ RIA с меткой, с применением метки I-125 (см. Morel et al., Molec. Immunol. 25(1): 7-15 (1988)); твердофазный прямой EIA с комплексом биотин - авидин (Cheung et al., Virology 176: 546-552 (1990)) и прямой RIA с меткой (Moldenhauer et al., Scand. J. Immunol. 32: 77-82 (1990)). Обычно такой анализ включает применение очищенного антигена, связанного с твердой фазой или клетками, несущими либо немеченый тестируемый иммуноглобулин, либо меченый эталонный иммуноглобулин. Конкурентное ингибирование измеряют, определяя количество метки, связанной с твердой поверхностью или клетками, в присутствии тестируемого иммуноглобулина. Обычно тестируемый иммуноглобулин присутствует в избытке. Антитела, идентифицированные конкурентным анализом (конкурентные антитела), включают антитела, связывающиеся с тем же эпитопом, что и эталонное антитело, и антитела, связывающиеся с прилегающим эпитопом, достаточно проксимальным к эпитопу, связанному эталонным антителом, так что возникли пространственные затруднения. Обычно, когда конкурентное антитело присутствует в избытке, оно ингибирует специфическое связывание эталонного антитела с обычным антителом по меньшей мере на 50 или 75%.
Термин "симптом" или "клинический симптом" относится к субъективному свидетельству заболевания, такому как измененная походка, подмечаемая пациентом. "Признак" относится к объективному свидетельству заболевания, наблюдаемому врачом.
Композиции или способы, "включающие" один или более перечисленных элементов, могут включать другие элементы, не указанные конкретно.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Общие сведения
Изобретение включает способы осуществления профилактики и лечения церебральной амилоидной ангиопатии (САА), заболевания, характеризующегося присутствием отложений Аβ пептида в сосудах. Эти сосудистые отложения отличаются от паренхимных отложений, которые являются отличительным признаком болезни Альцгеймера. У большинства больных болезнью Альцгеймера наблюдается по меньшей мере легкая степень САА. Однако САА может также возникать независимо от симптомов и/или характерной патологии болезни Альцгеймера. САА также ассоциируется с симптомами, обычно не ассоциирующимися с болезнью Альцгеймера, такими как инсульт (удар, нарушение мозгового кровообращения). Изобретение включает способы осуществления профилактики или лечения САА вне зависимости от того, встречается ли она одна или одновременно с болезнью Альцгеймера. У пациентов, больных одновременно болезнью Альцгеймера и САА, эти способы могут лечить обе болезни одновременно. У пациентов, у которых отсутствуют оба заболевания, эти способы позволят осуществить профилактику обоих заболеваний. У пациентов, у которых наблюдается САА, но отсутствует болезнь Альцгеймера, способы позволяют лечить САА и осуществить профилактику болезни Альцгеймера. Эти способы включают активную или пассивную иммунотерапию. При пассивной иммунотерапии вводят антитело, связывающееся с эпитопом в пределах остатков 1-10 Аβ. При активной иммунотерапии вводят агент, такой как Аβ фрагмент, который может индуцировать такое антитело. Хотя понимание механизма не является существенным для практического применения изобретения, полагают, что антитела связываются с сосудистыми отложениями Аβ и тем самым стимулируют клиринг отложений.
II. Агенты
В способах по настоящему изобретению применяется агент, который либо представляет собой антитело к N-концу Аβ (пассивное введение), либо способен индуцировать такое антитело при введении пациенту. Такие агенты были ранее описаны в научной и в патентной литературе в связи с иммунотерапией болезни Альцгеймера (см. Международные патентные заявки WO 98/25386 и WO 00/72880).
А. Активная иммунотерапия
Аβ, также известный как β-амилоидный пептид или А4 пептид (см. патент США 4666829; Glenner & Wong, Biochem. Biophys. Res. Commun. 120, 1131 (1984)), представляет собой пептид из 39-43 аминокислот, который является основным компонентом бляшек, характерных для болезни Альцгеймера. Аβ образуется при процессировании белка большего размера под действием двух ферментов, называемых β- и γ-секретазами (см. Hardy, TINS 20, 154 (1997)). Известные мутации в АРР, ассоциированные с болезнью Альцгеймера, происходят по соседству с сайтом расщепления АРР β- или γ-секретазой при его процессировании в Аβ или в пределах Аβ. Например, положение 717 находится рядом с сайтом расщепления АРР γ-секретазой при процессировании АРР в Аβ, а положения 670/671 являются соседними к сайту расщепления β-секретазой. Полагают, что мутации вызывают AD, воздействуя на реакции расщепления, в результате которых образуется Аβ, таким образом, что повышается количество образующейся формы Аβ из 42/43 аминокислот.
Аβ обладает необычным свойством, а именно, он может фиксировать и активировать как классический, так и альтернативный каскад комплемента. В частности, он связывается с Clq и в конечном счете с C3bi. Эта ассоциация способствует связыванию с макрофагами, что приводит к активации В клеток. Кроме того, C3bi расщепляется далее, а затем связывается с CR2 на В-клетках в зависимости от Т-клеток, что приводит к 10000-кратному увеличению активации этих клеток. Этот механизм заставляет Аβ вырабатывать иммунный ответ при избытке этого или других антигенов.
Предпочтительными агентами для активного введения являются фрагменты начиная с остатка 1 Аβ и кончая одним из остатков в пределах остатков 5-10. Такие фрагменты, будучи связаны с подходящим носителем, способны индуцировать антитела, которые специфически связываются с N-Aβ. В таких фрагментах отсутствуют природные свои Т-клеточные эпитопы, которые, как показали клинические испытания интактного Аβ, ассоциируются с нежелательными побочными эффектами. Предпочтительные иммуногенные фрагменты включают Арβ1-5, 1-6, 1-7, 1-10, 3-7, 1-3 и 1-4. Например, обозначение (название) Аβ1-5 указывает на фрагмент, включающий остатки 1-5 Аβ и не содержащий других остатков Аβ.
Аβ-производные лиганды, способные к диффузии (ADDL), заменители ADDL, ADDL-связывающие молекулы также можно использовать для активной иммунотерапии. См., например, Международную патентную заявку WO 2004/031400, вводимую в данное описание ссылкой во всей полноте для всех целей.
Необязательно, фрагменты Аβ конъюгируются с носителем, чтобы способствовать индукции антител к фрагменту. Некоторые агенты для индукции иммунного ответа содержат соответствующий эпитоп для индукции иммунного ответа на амилоид, но слишком малы, чтобы быть иммуногенными. В такой ситуации пептидный иммуноген может связываться с молекулой подходящего носителя с образованием конъюгата, который способствует выявлению иммунного ответа. Подходящие носители включают сывороточные альбумины, гемоцианин лимфы улитки, молекулы иммуноглобулинов, тироглобулин, овальбумин, столбнячный токсин или анатоксин (токсоид) других патогенных бактерий, таких как бактерии дифтерии (например, CRM197), Е. coli, холеры или Н. pylori, или ослабленное производное токсина. Т- клеточные эпитопы также являются подходящими молекулами носителя. Некоторые конъюгаты можно получать, связывая агенты по изобретению с иммуностимулирующей полимерной молекулой (например, трипальмитоил-S-глицерин цистеином (Pam3Cys), маннаном (полимером маннозы) или глюканом (бета 1→2 полимером)), цитокинами (например, IL-1, IL-1 альфа- и бета-пептидами, IL-2, гамма-INF, IL-10, GM-CSF) и хемокинами (например, MIP1 альфа и бета и RANTES). Иммуногенные агенты можно также связывать с пептидами, которые повышают перенос через ткани, как описано в O'Mahony, Международные патентные заявки WO 97/17613 и WO 97/17614. Иммуногены могут быть связаны с носителями с помощью спейсерных аминокислот или без помощи спейсерных аминокислот (например, gly-gly).
Некоторые конъюгаты могут образовываться путем связывания агентов по изобретению по меньшей мере с одним Т-клеточным эпитопом. Некоторые Т-клеточные эпитопы являются случайными (промискуитетными), тогда как другие Т-клеточные эпитопы являются универсальными. Случайные Т-клеточные эпитопы способны усиливать индукцию Т-клеточного иммунитета у широкого ряда субъектов, обнаруживающих различные типы HLA. В отличие от случайных Т-клеточных эпитопов, универсальные Т-клеточные эпитопы способны повышать индукцию Т-клеточного иммунитета у большой части (в процентах), например по меньшей мере у 75% субъектов, обнаруживающих различные HLA молекулы, кодированные различными HLA-DR аллелями.
Существует большое количество природных Т-клеточных эпитопов, таких как столбнячный токсин (например, эпитопы Р2 и Р30), поверхностный антиген гепатита В, коклюшный токсин, F белок вируса кори, основной белок наружной мембраны Chlamydia trachomitis, дифтерийный анатоксин, спорозоит Т малярийного плазмодия (Plasmodium falciparum), CS антиген малярийного плазмодия (Plasmodium falciparum), триозо-фосфатизомераза Schistosoma mansoni, белок наружной мембраны Escherichia coli TraT и гемагглютинин вируса гриппа (НА). Иммуногенные пептиды по изобретению можно также конъюгировать с Т-клеточными эпитопами, описанными в Sinigaglia F. et al., Nature, 336: 778-780 (1988); Chicz R.M. et al., J. Exp. Med, 178: 27-47 (1993); Hammer J. et al., Cell 74: 197-203 (1993); Falk K. et al., Immunogenetics, 39: 230-242 (1994); Международной патентной заявке WO 98/23635; и Southwood S. et al. J. Immunology, 160: 3363-3373 (1998) (каждый из этих ссылочных материалов вводится в данное описание во всей полноте для любых целей). Другие примеры включают:
Гемагглютинин вируса гриппа: НА307-319
CS возбудителя малярии: Т3 эпитоп EKKIAKMEKASSVFNV
Поверхностный антиген гепатита В: HBsAg19-28 FFLLTRILTI
Белок теплового шока 65: hsp65153-171 DQSIGDLIAEAMDKVGNEG
Бацилла Кальметта-Герена: QVHFQPLPPAVVKL
Столбнячный токсин: ТТ830-844 QYIKANSKFIGITEL
Столбнячный токсин: ТТ947-967 FNNFTVSFWLRVPKVSASHLE
ВИЧ gp120 T1: KQIINMWQEVGKAMYA
Некоторые примеры конъюгатов включают:
AN90549 (Аβ 1-7 - Столбнячный токсин 830-844 в МАР4 конфигурации):
DAEFRHD-QYIKANSKFIGITEL
AN90550 (Аβ 1-7 - Столбнячный токсин 947-967 в МАР4 конфигурации):
DAEFRHD-FNNFTVSFWLRVPKVSASHLE
AN90542 (Аβ 1-7 - Столбнячный токсин 830-844+947-967 в линейной конфигурации):
DAEFRHD-QYIKANSKFIGITELFNNFTVSFWLRVPKVSASHLE
Пептид PADRE (полностью в линейной конфигурации), где X, предпочтительно, обозначает циклогексилаланин, тирозин или фенилаланин, при этом наиболее предпочтителен циклогексилаланин:
AN90562 (PADRE-Aβ1-7):
AKXVAAWTLAAA-DAEFRHD
AN90543 (3 PADRE-Aβ1-7):
DAEFRHD-DAEFRHD-DAEFRHD-AKXVAAWTLKAAA
Другие примеры слитых белков (иммуногенный эпитоп Аβ выделен жирным шрифтом) включают:
AKXVAAWTLKAAA-DAEFRHD-DAEFRHD-DAEFRHD
DAEFRHD-AKXVAAWTLKAAA
DAEFRHD-ISQAVHAAHAEINEAGR
FRHDSGY-ISQAVHAAHAEINEAGR
EFRHDSG-ISQAVHAAHAEINEAGR
PKYVKQNTLKLAT-DAEFRHD-DAEFRHD-DAEFRHD
DAEFRHD-PKYVKQNTLKLAT-DAEFRHD
DAEFRHD-DAEFRHD-DAEFRHD-PKYVKQNTLKLAT
DAEFRHD-DAEFRHD-PKYVKQNTLKLAT
DAEFRHD-PKYVKQNTLKLAT-EKXIAKMEKASSVFNV-QYIKANSKFIGITEL-
FNNFTVSFWLRVPKVSASHLE-DAEFRHD
DAEFRHD-DAEFRHD-DAEFRHD-
QYIKANSKFIGITELNNFTVSFWLRWKVSASHLE
DAEFRHD-QYIKANSbCFIGITELCFNNFTVSFWLRVPKVSASHLE
DAEFRHD-QYIKANSKFIGITELCFNNFTVSFWLRVPKVSASHLE-DAEFRHD
DAEFRHD-QYIKANSICFIGITEL на 2 разветвленной смоле.
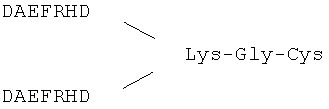
Фрагменты Аβ, такие как Аβ1-6, конъюгируются с носителями, такими как вирусоподобные частицы (VLP) и субъединицы VLP, что содействует индукции антител к фрагменту. См., например, Международную патентную заявку WO 2004/016282 и опубликованную патентную заявку США 20040141984, каждая из которых вводится в данное описание во всей полноте для любых целей.
Б. Пассивная иммунотерапия
Пассивную терапию осуществляют, используя антитело, специфическое к N-концу Аβ. "N-концевой эпитоп" представляет собой эпитоп, или антигенную детерминанту, локализованный (локализованную) не далее N-конца или включая N-конец Аβ-пептида. Примеры N-концевых эпитопов включают остатки в пределах аминокислот 1-10 или 1-12 Аβ, предпочтительно, из остатков 1-3, 1-4, 1-5, 1-6, 1-7, 2-6, 2-7, 3-6 или 3-7 Аβ. Другие примеры N-концевых эпитопов начинаются с остатков 1-3 и заканчиваются остатками 7-11 Аβ. Дополнительные примеры N- концевых эпитопов включают остатки 2-4, 2-5, 2-6, 2-7 или 2-8 Аβ, остатки 3-5, 3-6, 3-7, 3-8 или 3-9 Аβ или остатки 4-7, 4-8, 4-9 или 4-10 Аβ.
Если говорят, что антитело связывается с эпитопом в пределах конкретных остатков, таких как Аβ3-7, это означает, что антитело специфически связывается с полипептидом, содержащим эти конкретные остатки (т.е. Аβ3-7 в данном примере). Такое антитело не обязательно контактирует с каждым остатком в пределах Аβ3-7. Не обязательно каждая единичная аминокислотная замена или деления в пределах Аβ3-7 заметно влияет на аффинность связывания. В различных вариантах изобретения антитело к Аβ является специфическим к концу. Термин "специфический к концу" ("end-specific") относится к антителу, которое специфически связывается с N-концевыми или C-концевыми остатками Аβ пептида, но не распознает те же самые остатки, находящиеся в более протяженных вариантах Аβ, или в АРР. Предпочтительные антитела имеют человеческий IgG1 изотип.
Предпочтительные антитела против Аβ для пассивной иммунотерапии включают иммунизированное антитело против Аβ, например гуманизированное антитело 3D6, гуманизированное антитело 12В4 или гуманизированное антитело 12А11.
Антитела для пассивной иммунотерапии можно получать различными методами, включая методы, описанные в опубликованных патентных заявках США US 20040038304, US 20070020685, US 20060257396, US 20060160184, US 20060134098, US 20050255552, US 20050008625, US 20040132066, US 20040038317, US 20030198971 и US 20030157579, каждая из которых вводится в данное описание ссылкой во всей полноте для любых целей.
Антитела
i. Общая характеристика иммуноглобулинов
Известно, что основная структурная единица антитела представляет собой тетрамер из субъединиц. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, причем каждая пара имеет одну "легкую" (около 25 кДа) и одну "тяжелую" цепь (около 50-70 кДа). Амино-концевой участок каждой цепи включает вариабельную область, примерно, из 100-110 и более аминокислот, в первую очередь отвечающую за распознавание (узнавание) антигена. Карбокси-концевой участок каждой цепи определяет константную область, главным образом отвечающую за эффекторную функцию.
Легкие цепи классифицируются либо как каппа, либо как лямбда. Тяжелые цепи классифицируются как гамма, мю, альфа, дельта или эпсилон и определяют изотип антитела как IgG, IgM, IgA, IgD и IgE, соответственно. В легких и тяжелых цепях вариабельные и константные области соединяются "J" областью, примерно, из 12 или более аминокислот, причем тяжелая цепь включает также "D" область, примерно, из 10 или более аминокислот (см. в целом Fundamental Immunology, Ch. 7 (W. Paul, ed., Raven Press, N.Y., 2nd ed. 1989), вводимую ссылкой во всей полноте для всех целей).
Вариабельные области каждой пары легкая/тяжелая цепь образуют сайт связывания антитела. Таким образом, интактное антитело имеет два сайта связывания. За исключением бифункциональных или биспецифических антител, два сайта связывания одинаковы. Все цепи имеют одинаковую общую структуру относительно консервативных каркасных областей (FR), связанных тремя гипервариабельными областями, также называемыми областями определения комплементарности, или CDR. CDR из двух цепей каждой пары выравнивают при использовании каркасных областей, позволяющих связываться со специфическим эпитопом. От N-конца к С-концу как легкая, так и тяжелая цепи содержат домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Отнесения аминокислот к каждому домену осуществляют в соответствии с определениями Kabat, Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, MD, 1987 и 1991); Chothia & Lesk, J. Mol. Biol. 196: 901-917 (1987); или Chothia et al., Nature 342: 878-883 (1989).
ii. Получение антител нечеловеческого происхождения
Получение моноклональных антител нечеловеческого происхождения, например мышиных, морских свинок, приматов, кроличьих или крысиных, можно осуществлять, например, иммунизируя животное белком Аβ. Также можно использовать более протяженный полипептид, содержащий Аβ или иммуногенный фрагмент Аβ, или антиидиопатические антитела к антителу к Аβ. См. Harlow & Lane, Antibodies, A Laboratory Manual (CSHP NY, 1988) (вводимую в качестве ссылки для всех целей). Такой иммуноген можно получать из природного источника, пептидным синтезом или рекомбинантной экспрессией. Необязательно, иммуноген можно вводить в слитом виде или в виде комплекса иного рода с белком-носителем, как описано ниже. Необязательно, иммуноген можно вводить с адъювантом. Можно использовать некоторые типы адъювантов, описанные ниже. Введение полного адъюванта Фрейнда с последующим введением неполного адъюванта является предпочтительным для иммунизации лабораторных животных. Обычно для получения поликлональных антител используют кроликов или морских свинок. Для получения моноклональных антител обычно используют мышей. Антитела подвергают скринингу на специфическое связывание с Аβ. Необязательно, антитела подвергают дополнительному скринингу на связывание с конкретной областью Аβ. Последний скрининг можно осуществлять, устанавливая связывание антитела с совокупностью делеционных мутантов Аβ пептида и определяя, какие делеционные мутанты связываются с антителом. Связывание можно оценивать, например, методами Вестерн-блоттинга или ELISA. Наименьший фрагмент, проявляющий специфическое связывание с антителом, обозначает границы эпитопа антитела. Или же специфичность эпитопа можно определить конкурентным анализом, в котором тестируемое и эталонное антитело конкурируют за связывание с Аβ. Если тестируемое и эталонное антитело конкурируют, значит, они связываются с одним(и) и тем(и) же эпитопом (эпитопами) достаточно близко (проксимально), так что связывание одного антитела мешает связыванию другого. Предпочтительным изотипом для таких антител является мышиный изотип IgG2a или эквивалентный изотип в других видах. Мышиный изотип IgG2a является эквивалентом человеческого изотипа IgG1.
iii. Химерные и гуманизированные антитела
Химерные и гуманизированные антитела проявляют такую же специфичность и аффинность связывания, что и у мышиного или другого человеческого антитела, или подобную специфичности и аффинности связывания, наблюдаемым у мышиного или другого человеческого антитела, которое предоставляет исходный материал для конструкции химерного или гуманизированного антитела. Химерные антитела представляют собой антитела, у которых гены легкой и тяжелой цепей сконструированы, обычно генетической инженерией (методами рекомбинантной ДНК), при использовании сегментов генов иммуноглобулинов, относящихся к разным видам. Например, вариабельные (V) сегменты генов мышиного моноклонального антитела могут быть соединены с человеческими константными (С) сегментами, такими как сегменты IgG1 и IgG4. Предпочтительным является человеческий изотип IgG1. В некоторых способах изотип антитела представляет собой человеческий IgG1. В некоторых способах можно также использовать IgM антитела. Таким образом, типичное химерное антитело представляет собой гибридный белок, состоящий из V или антиген-связывающего домена мышиного антитела и С или эффекторного домена человеческого антитела.
Гуманизированные антитела содержат аминокислоты каркасного участка вариабельной области, главным образом, человеческого антитела (называемого акцепторным антителом) и гипервариабельные области, главным образом, мышиного антитела (называемого донорным иммуноглобулином). См. Queen et al., Proc. Natl. Acad. Sci. USA 86: 10029-10033 (1989), Международная патентная заявка WO 90/07861, патенты США US 5693762, US 5693761, US 5585089, US 5530101 и Winter, патент США US 5225539 (каждый из этих ссылочных материалов вводится в данное описание ссылкой во всей полноте для любых целей). Константная(ые) область(и), если таковая(ые) имеется (имеются), является (являются) в основном или полностью областью (областями) человеческого иммуноглобулина. Человеческие вариабельные домены обычно выбирают из человеческих антител, каркасные последовательности которых проявляют высокую степень идентичности с последовательностями мышиных вариабельных доменов, из которых происходят CDR. Остатки каркасного участка вариабельной области тяжелой и легкой цепей можно брать из тех же или других последовательностей человеческого антитела. Последовательности человеческого антитела могут представлять собой последовательности естественных человеческих антител или могут являться консенсусными последовательностями некоторых человеческих антител. См. Carter et al., WO 92/22653. Некоторые аминокислоты каркасных остатков вариабельной области выбирают из замен с учетом их возможного влияния на конформацию CDR и/или связывание CDR с антигеном. Исследование такого возможного влияния проводят путем моделирования, изучения характеристик аминокислот в конкретных местоположениях или с помощью эмпирического наблюдения за эффектами замены или мутагенеза конкретных аминокислот.
Например, если аминокислота каркасного остатка мышиной вариабельной области и выбранного каркасного остатка человеческой вариабельной области различаются, человеческую аминокислоту следует заменить на эквивалентную аминокислоту каркасного участка мышиного антитела, когда резонно ожидать, что аминокислота:
(1) нековалентной связью непосредственно связывает антиген;
(2) прилегает к CDR области;
(3) иным образом взаимодействует с CDR областью (например, в пределах около 6 Å от CDR области)
или
(4) принимает участие в VL-VH области контакта.
Другими кандидатами на замену являются аминокислоты каркасного участка человеческого акцепторного антитела, необычные для человеческого иммуноглобулина в этом положении. Эти аминокислоты можно заменить на аминокислоты из эквивалентного положения мышиного донорного антитела или из эквивалентных положений более обычных (типичных) человеческих иммуноглобулинов. Другими кандидатами на замену являются аминокислоты каркасного участка человеческого акцепторного антитела, необычные для человеческого иммуноглобулина в этом положении. Каркасные участки вариабельной области гуманизированного иммуноглобулина обычно по меньшей мере на 85% идентичны последовательности каркасного участка вариабельной области или консенсусу таких последовательностей.
iv. Человеческие антитела
Человеческие антитела против Аβ получают различными методами, описанными ниже. Некоторые человеческие антитела выбирают в экспериментах по конкурентному связыванию или иным образом так, чтобы они имели такую же эпитопную специфичность, что и конкретное мышиное антитело, такое как одно из мышиных моноклональных антител, описанных в Примере XI. Человеческие антитела можно также подвергнуть скринингу на конкретную эпитопную специфичность, используя только фрагмент Аβ в качестве иммуногена, и/или скринингу антител против совокупности делеционных мутантов Аβ. Человеческие антитела, предпочтительно, имеют изотопную специфичность человеческого IgG1.
(1) Методология с использованием триомы
Основной метод и типичный партнер по слиянию клеток, SPAZ-4, для применения в данном методе описаны в Oestberg et al., Hybridoma 2: 361-367 (1983); Oestberg, патент США No. 4634664; и Engleman et al., патент США 4634666 (каждый из этих материалов вводится в данное описание ссылкой во всей полноте для любых целей). Антителопродуцирующие линии клеток, полученные таким методом, называются триомами, так как они происходят из трех линий клеток - двух человеческих и одной мышиной. Сначала клетки линии мышиной миеломы сливают с человеческим В-лимфоцитом, получают неантителопродуцирующую ксеногенную гибридную клетку, такую как SPAZ-4, описанную в Oestberg, см. выше. Ксеногенную клетку затем сливают с иммунизированным человеческим В-лимфоцитом, получая линию антителопродуцирующих триомных клеток. Найдено, что триомы продуцируют антитело более стабильно, чем обычные гибридомы, полученные из человеческих клеток.
Иммунизированные В-лимфоциты получают из крови, селезенки, лимфатических узлов или костного мозга человека-донора. Если нужны антитела против специфического антигена или эпитопа, предпочтительно использовать этот антиген или его эпитоп для иммунизации. Иммунизацию можно проводить in vivo или in vitro. Для иммунизации in vivo В клетки обычно выделяют из человека, иммунизированного с помощью Аβ, его фрагмента, более протяженного полипептида, содержащего Аβ или фрагмент, или антиидиотипического антитела к антителу к Аβ. В некоторых методах В клетки выделяют из того же пациента, "антителотерапию" которого и проводят в конечном счете. Для in vitro иммунизации В-лимфоциты обычно экспонируют с антигеном в течение 7-14 дней в средах, таких как RPMI-1640 (см. Engleman, supra), дополненной 10% человеческой плазмой.
Иммунизированные человеческие В-лимфоциты сливают с ксеногенной (чужеродной) гибридной клеткой, такой как SPAZ-4, хорошо известными методами. Например, клетки обрабатывают 40-50% полиэтиленгликолем MW (молекулярная масса) 1000-4000, примерно, при 37°С около 5-10 минут. Клетки отделяют от смеси для слияния и размножают в селективных средах для нужных гибридов (например, HAT или АН). Клоны, секретирующие антитела с нужной специфичностью связывания, идентифицируют, анализируя культуральную среду триомы на способность связываться с Аβ или его фрагментом. Триомы, продуцирующие человеческие антитела с заданной специфичностью, субклонируют методом ограниченных разведений и выращивают in vitro в культуральной среде. Затем полученные линии триомных клеток проверяют на способность связывать Аβ или его фрагмент.
Хотя триомы генетически устойчивы, они не продуцируют очень высокие уровни антител. Уровни экспрессии можно повысить, клонируя гены антител, полученных при использовании триомы, в один или более экспрессионных векторов и трансформируя вектор в стандартные линии клеток млекопитающих, бактерий или дрожжей.
(2) Трансгенные отличные от человека млекопитающие
Человеческие антитела против Аβ можно также продуцировать при использовании отличных от человека трансгенных млекопитающих, имеющих трансгены, кодирующие по меньшей мере сегмент локуса человеческого иммуноглобулина. Обычно эндогенный локус иммуноглобулина таких трансгенных млекопитающих является функционально инактивированным. Предпочтительно, сегмент локуса иммуноглобулина человека включает переаранжированные последовательности компонентов тяжелой и легкой цепей. Как инактивация эндогенных генов иммуноглобулина, так и введение экзогенных генов иммуноглобулина можно осуществлять нацеленной гомологичной рекомбинацией или интродукцией YAC хромосом. Трансгенные млекопитающие, получающиеся в результате этого процесса, способны функционально реаранжировать (перестраивать) компоненты последовательностей иммуноглобулина и экспрессировать набор (спектр) антител различных изотипов, кодированных генами иммуноглобулина человека, не экспрессируя эндогенные гены иммуноглобулина. Получение и свойства млекопитающих с такими свойствами подробно описаны, например, Lonberg et al., Международная патентная заявка WO 93/1222, патенты США US 5877397, US 5874299, US 5814318, US 5789650, US 5770429, US 5661016, US 5633425, US 5625126, US 5569825, US 5545806, Nature 148, 1547-1553 (1994), Nature Biotechnology 14, 826 (1996), Kucherlapati, WO 91/10741 (каждый из этих ссылочных материалов вводится в данное описание ссылкой во всей полноте для любых целей). Особенно подходят трансгенные мыши. Антитела против Аβ получают иммунизацией трансгенного отличного от человека млекопитающего, такого как описанное Lonberg или Kucherlapati, supra, Аβ или его фрагментом. Моноклональные антитела получают, например, слиянием В-клеток таких млекопитающих с соответствующими линиями миеломных клеток, используя обычную технологию Колера и Мильштейна (Kohler-Milstein). Человеческие поликлональные антитела можно также представить в виде сыворотки людей, иммунизированных иммуногенным агентом. Необязательно, такие поликлональные антитела могут быть концентрированы аффинной очисткой с применением Аβ или другого амилоидного пептида в качестве аффинного реагента.
(3) Методы фагового дисплея
Другой способ получения человеческих антител против Аβ предназначен для скрининга библиотеки ДНК человеческих В-клеток в соответствии с общим протоколом, описанным Huse et al., Science 246: 1275-1281 (1989). Как описано для метода с использованием триомы, такие В-клетки можно получать от человека, иммунизированного Аβ фрагментами, более длинными полипептидами, содержащими Аβ или фрагменты, или антиидиопатическими антителами. Необязательно, такие В-клетки получают от пациента, который, в конечном счете, подвергается антителотерапии. Выбирают антитела, связывающиеся с Аβ, или их фрагмент. Затем последовательности, кодирующие такие антитела (или связывающие фрагменты), клонируют и амплифицируют. Протокол, описанный Huse, более эффективен в сочетании с методом фагового дисплея. См., например, Dower et al., Международная заявка WO 91/17271 и McCafferty et al., Международная заявка WO 92/01047, патенты США US 5877218, US 5871907, US 5858657, US 5837242, US 5733743 и US 5565332 (каждый из этих ссылочных материалов вводится в данное описание ссылкой во всей полноте для любых целей). Этими методами получают библиотеки фагов, члены которых выявляют различные антитела на своей наружной поверхности. Антитела обычно визуализируются в виде фрагментов Fv или Fab. Фаг-дисплейные антитела с заданной специфичностью выбирают путем аффинного обогащения по Аβ пептиду или его фрагменту.
Применяя вариант фаг-дисплейного метода, можно получать человеческие антитела со специфичностью связывания выбранного мышиного антитела. См. Winter, WO 92/20791. В этом методе в качестве исходного материала используют вариабельную область либо тяжелой, либо легкой цепи выбранного мышиного антитела. Если, например, выбирают вариабельную область легкой цепи, создают фаговую библиотеку, члены которой визуализируют вариабельную область той же самой легкой цепи (т.е. исходный материал получен от мыши) и вариабельную область другой тяжелой цепи. Вариабельные области тяжелой цепи получают из библиотеки реаранжированных (перестроенных) вариабельных областей человеческой тяжелой цепи. Выбирают фаг, проявляющий сильное специфическое связывание по отношению к Аβ (например, по меньшей мере 108 и, предпочтительно, по меньшей мере 109 М-1). Вариабельная область человеческой тяжелой цепи из этого фага служит затем в качестве исходного материала для создания следующей библиотеки фагов. В этой библиотеке каждый фаг визуализирует ту же самую вариабельную область тяжелой цепи (т.е. область, идентифицированную при использовании первой фаговой библиотеки) и вариабельную область другой легкой цепи. Вариабельные области легкой цепи получают из библиотеки реаранжированных (перестроенных) вариабельных областей человеческой легкой цепи. И снова выбирают фаг, проявляющий сильное специфическое связывание по отношению к Аβ. Этот фаг визуализирует вариабельные области полностью человеческих антител против Аβ. Эти антитела обычно обладают такой же или аналогичной эпитопной специфичностью, что и исходный материал, полученный от мыши ("мышиный исходный материал").
(4) Методы с использованием наноантител
Антитела против Аβ можно также получать методами Nanobody™ (Наноантитело™, Ablynx N.V.). Наноантитела (нанотела) представляют собой полученные из антител терапевтические белки, которые проявляют свойства тяжелых цепей естественных антител. Наноантитело может функционировать как изолированный относительно малый функциональный антиген-связывающий структурный элемент (единица), домен или белок. Технология Nanobody™ первоначально разработана после того, как было открыто, что у верблюдовых (верблюдов и лам) имеются функциональные антитела, которые не содержат легких цепей. Эти "тяжелоцепные" (состоящие из тяжелой цепи) антитела содержат единственный вариабельный домен (VHH) и два константных домена (СН2 и СН3). Обозначение VHH используется для того, чтобы отличить эти домены от вариабельных доменов тяжелых цепей, которые присутствуют в обычных антителах, содержащих 4 цепи (которые обозначаются "VH домены"). Клонированный и выделенный VHH домен представляет собой устойчивый полипептид, обладающий полной антиген-связывающей способностью исходного (начального) "тяжелоцепного" антитела. VHH домены и наноантитела можно также получить в мультивалентном и мультиспецифическом форматах. Наноантитела с аминокислотной последовательностью, которая соответствует аминокислотной последовательности естественного VHH домена, могут быть гуманизированы, например, заменой одного или более аминокислотных остатков в аминокислотной последовательности естественной VHH последовательности (и, в частности, в каркасных последовательностях) на один или более аминокислотных остатков, которые присутствуют в соответствующем(их) положении(ях) в VH домене обычного человеческого антитела, состоящего из четырех цепей. Подробнее см., например, опубликованные патентные заявки США US 20050130266, US 20040253638, Международную патентную заявку WO/2006/040153, опубликованную патентную заявку США US 20050214857, Международные патентные заявки WO/2006/079372 или WO/2006/122825, каждая из которых вводится в данное описание ссылкой для любых целей.
v. Выбор константной области
Вариабельные области тяжелой и легкой цепи химерных, гуманизированных или человеческих антител могут быть связаны по меньшей мере с участком человеческой константной области. Выбор константной области зависит, частично, от того, желательны ли антителозависимый комплемент и/или клеточно-опосредованная токсичность. Например, изотипы IgG1 и IgG3 имеют активность комплемента, а изотипы IgG2 и IgG4 не имеют. На выбор изотипа может также влиять проникновение антитела в мозг. Предпочтительным является человеческий изотип IgG1. Константные области легкой цепи могут представлять собой лямбда или каппа. Антитела могут экспрессироваться в качестве тетрамеров, содержащих две легкие и две тяжелые цепи, в виде отдельных тяжелых цепей, легких цепей, в виде Fab, Fab', F(ab')2 и Fv или в виде одноцепочечных антител, в которых вариабельные домены тяжелой и легкой цепей связаны спейсером.
vi. Экспрессия рекомбинантных антител
Химерные, гуманизированные и человеческие антитела обычно получают рекомбинантной экспрессией (экспрессией рекомбинантных полинуклеотидов). Конструкции рекомбинантных полинуклеотидов обычно включают последовательность контроля экспрессии, функционально связанную с последовательностями, кодирующими цепи антитела, включая естественно ассоциированные или гетерологичные промоторные области. Предпочтительно, последовательности контроля экспрессии представляют собой эукариотические промоторные системы в векторах, способных трансформировать или трансфецировать эукариотические клетки-хозяева. Если вектор включен в подходящего хозяина, хозяин поддерживается в условиях, пригодных для высокоуровневой экспрессии нуклеотидных последовательностей и сбора и очистки перекрестно-реактивных антител.
Эти экспрессионные векторы обычно реплицируются в организмах-хозяевах либо в виде эписом, либо в виде неотъемлемой части хромосомной ДНК клетки-хозяина. Обычно экспрессионные векторы содержат селективные маркеры, например, резистентности к ампициллину или резистентности к гигромицину, допускающие детекцию клеток, трансформированных заданными ДНК-последовательностями.
Е. coli является прокариотическим хозяином, особенно применимым для клонирования последовательностей ДНК по настоящему изобретению. Микробы, такие как дрожжи, также применимы для экспрессии. Сахаромицеты представляют собой предпочтительные дрожжевые клетки-хозяева с подходящими векторами, имеющими, по желанию, последовательности контроля экспрессии, ориджин репликации, последовательности терминации транскрипции и т.п. Типичные промоторы включают 3-фосфоглицераткиназу и другие гликолитические ферменты. Индуцибельные дрожжевые промоторы включают, среди прочих, промоторы из алкоголь-дегидрогеназы, изоцитохрома С и ферментов, отвечающих за утилизацию мальтозы и галактозы.
Клетки млекопитающих являются предпочтительными клетками-хозяевами для экспрессии нуклеотидных сегментов, кодирующих иммуноглобулины или их фрагменты. См. Winnacker, From Genes to Clones (VCH Publishers, NY, 1987). Различные подходящие линии клеток-хозяев, способных секретировать интактные гетерологичные белки, созданы в уровне техники и включают СНО клеточные линии, различные COS клеточные линии, клетки HeLa, клетки L, человеческую эмбриональную почечную клетку и линии клеток миеломы. Предпочтительно, клетки не являются человеческими клетками. Экспрессионные векторы для этих клеток могут иметь последовательности контроля экспрессии, такие как ориджин репликации, промотор, энхансер (Queen et al., Immunol. Rev. 89: 49 (1986)), и сайты, сообщающие о необходимом процессировании, такие как сайты связывания рибосом, сайты РНК сплайсинга, сайты полиаденилирования и последовательности терминации транскрипции. Предпочтительные последовательности контроля экспрессии представляют собой промоторы из эндогенных генов, цитомегаловируса, SV40, аденовируса, вируса бычьей папилломы и т.п. См. Со et al., J. Immunol. 148: 1149 (1992).
Или же последовательности, кодирующие антитело, можно включать в трансгены для введения в геном трансгенного животного и последующей экспрессии в молоке трансгенного животного (см., например, опубликованные патентные заявки США US 5741957, US 5304489, US 5849992). Подходящие трансгены включают последовательности, кодирующие легкие и/или тяжелые цепи, функционально связанные с промотором и энхансером из специфичного гена молочной железы, такого как ген казеина или бета-лактоглобулина.
Векторы, содержащие ДНК сегменты, представляющие интерес, можно перенести в клетку-хозяина общеизвестными методами, зависящими от типа клетки-хозяина. Например, трансфекцию с применением хлорида кальция можно использовать для кариотических клеток, тогда как обработку фосфатом кальция, электропорацию, липофекцию, биолистическую трансфекцию или вирусную трансфекцию можно использовать для других клеток-хозяев. Другие методы, применяемые для трансформации клеток-млекопитающих, включают применение полибрена, слияние протопластов, липосомы, электропорацию и микроинъекцию (см. в целом Sambrook et al., supra). Для получения трансгенных животных можно осуществить микроинъекцию трансгенов в оплодотворенные ооциты или можно их включить в геном эмбриональных стволовых клеток, а ядра таких клеток трансфецировать в безъядерные ооциты.
После экспрессии антитела можно очистить стандартными методами, известными в уровне техники, включая очистку ВЭЖХ, колоночную хроматографию, гель-электрофорез (см. Scopes, Protein Purification (Springer-Verlag, NY, 1982)).
3D6, или его химерная или гуманизированная форма, является предпочтительным антителом (см. опубликованные патентные заявки США No. 20030165496А1, No. 20040087777А1, Международные опубликованные патентные заявки No. WO 02/46237А3 и No. WO 04/080419A2). Описание 3D6 можно найти, например, в Международной опубликованной патентной заявке No. WO 02/088306A2 и в Международной опубликованной патентной заявке No. W002/088307A2. Другие 3D6 антитела описаны в патентной заявке США No. 11/303478 и в Международной патентной заявке No. PCT/US05/45614. 3D6 представляет собой моноклональное антитело (mAb), которое специфически связывается с N-концевым эпитопом, локализованным в человеческом Аβ-амилоидном пептиде, конкретно, с остатками 1-5. Линия клеток, продуцирующих 3D6 моноклональное антитело (RB96 3D6.32.2.4), депонирована в Американской коллекции типовых культур (АТСС), Manassas, VA 20108, USA, 8 апреля 2003 года согласно условиям Будапештского Соглашения и имеет номер депонирования РТА-5130.
Бапинеузумаб, означающий гуманизированное 3D6 антитело, содержащее легкую цепь, имеющую зрелую вариабельную область с аминокислотной последовательностью, обозначенной SEQ ID NO: 1, и тяжелую цепь, имеющую зрелую вариабельную область с аминокислотной последовательностью, обозначенной SEQ ID NO: 2, показан ниже.
Вариабельная область легкой цепи гуманизированного 3D6
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Lys Pro Gly Gln Ser Pro Gln Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly Thr His Phe Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys (SEQ ID NO: 1)
Вариабельная область тяжелой цепи гуманизированного 3D6
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Ser Ile Arg Ser Gly Gly Gly Arg Thr Tyr Tyr Ser Asp Asn Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Тут Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg Tyr Asp His Tyr Ser Gly Ser Ser Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser (SEQ ID NO: 2)
Бапинеузумаб известен как ААВ-001.
Второй вариант гуманизированного антитела 3D6, содержащий легкую цепь, имеющую зрелую вариабельную область с аминокислотной последовательностью, обозначенной SEQ ID NO: 3, и тяжелую цепь, имеющую зрелую вариабельную область с аминокислотной последовательностью, обозначенной SEQ ID NO: 4, показан ниже.
Вариабельная область легкой цепи гуманизированного 3D6
Tyr Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Lys Pro Gly Gln Ser Pro Gln Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly Thr His Phe Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys (SEQ ID NO: 3)
Вариабельная область тяжелой цепи гуманизированного 3D6
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Ser Ile Arg Ser Gly Gly Gly Arg Thr Tyr Tyr Ser Asp Asn Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys Val Arg Tyr Asp His Tyr Ser Gly Ser Ser Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser (SEQ ID NO: 4)
Третий вариант гуманизированного антитела 3D6, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 5, и тяжелую цепь, имеющую SEQ ID NO: 6, описан в патентной заявке США US 2005/0090649 А1, опубликованной 28 апреля 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 3D6
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr Leu Asn Trp Leu Gln Gln Arg Pro Gly Gln Ser Pro Arg Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Ala Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys (SEQ ID NO: 5)
Тяжелая цепь гуманизированного 3D6
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Gly Ser Gly Phe Thr Phe Ser Asn Tyr Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Ser Ile Arg Ser Gly Gly Gly Arg Thr Tyr Tyr Ser Asp Asn Val Lys Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg Tyr Asp His Tyr Ser Gly Ser Ser Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Gln Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Gln Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys (SEQ ID NO: 6)
Антитело 12А11 или его химерная или гуманизированная форма или форма наноантитела (нанотела) является предпочтительным антителом. Антитело 12А11, или его вариант, описано в опубликованной патентной заявке США No. 20050118651, U.S. Patent Publication No. 20060198851, Международной опубликованной патентной заявке No. WO 04/108895 и в Международной опубликованной патентной заявке No. WO 06/066089, все они вводятся в данное описание ссылкой во всей полноте для любых целей. Антитело 12А11 представляет собой mAb, которое специфически связывается с N-концевым эпитопом, локализованным в человеческом β-амилоидном пептиде, конкретно, с остатками 3-7. Клеточная линия, продуцирующая моноклональное антитело 12А11, депонирована в АТСС (Американской коллекции типовых культур, American Type Culture Collection, 10801 University Boulevard, Manassas, VA 20110-2209) 12 декабря 2005 года и имеет в АТСС номер доступа РТА-7271.
Первый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 8 вариант 1), описан в патентной заявке США US 20050118651 А1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7)
Тяжелая цепь гуманизированного 12А11 (вариант 1)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Ser Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu Ala His Ile Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Val Thr Val Ser Ser (SEQ ID NO: 8)
Второй вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 9 (вариант 2), описан в патентной заявке США US 20050118651 А1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO. 7)
Тяжелая цепь гуманизированного 12А11 (вариант 2)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Thr Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Phe Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 9).
Третий вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 10 (вариант 2.1), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7)
Тяжелая цепь гуманизированного 12А11 (вариант 2.1)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Thr Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Phe Thr Ile Ser Lys Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 10)
Четвертый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 11 (вариант 3), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7)
Тяжелая цепь гуманизированного 12А11 (вариант 3)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Thr Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEC ID NO: 11)
Пятый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 12 (вариант 4.1), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7)
Тяжелая цепь гуманизированного 12А11 (вариант 4.1)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Thr Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 12).
Шестой вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 13 (вариант 4.2), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7)
Тяжелая цепь гуманизированного 12А11 (вариант 4.2)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Ser Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 13).
Седьмой вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 14 (вариант 4.3), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7).
Тяжелая цепь гуманизированного 12А11 (вариант 4.3)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Ser Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Phe Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 14).
Восьмой вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ГО NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ГО NO: 15 (вариант 4.4), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7)
Тяжелая цепь гуманизированного 12А11 (вариант 4.4)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Ser Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 15).
Девятый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 16 (вариант 5.1), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID. NO: 7)/
Тяжелая цепь гуманизированного 12А11 (вариант 5.1)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Thr Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 16).
Десятый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 17 (вариант 5.2), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7).
Тяжелая цепь гуманизированного 12А11 (вариант 5.2)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Thr Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Phe Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 17).
Одиннадцатый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 18 (вариант 5.3), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7).
Тяжелая цепь гуманизированного 12А11 (вариант 5.3)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Thr Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Leu Тут Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Val (SEQ ID NO: 18)
Двенадцатый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 19 (вариант 5.4), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7)
Тяжелая цепь гуманизированного 12А11 (вариант 5.4)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Ser Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Phe Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Val (SEQ ID NO: 19)
Тринадцатый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 20 (вариант 5.5), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7).
Тяжелая цепь гуманизированного 12А11 (вариант 5.5)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Ser Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 20).
Четырнадцатый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 21 (вариант 5.6), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7).
Тяжелая цепь гуманизированного 12А11 (вариант 5.6)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Ser Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Phe Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 21)
Пятнадцатый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 22 (вариант 6.1), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7)
Тяжелая цепь гуманизированного 12А11 (вариант 6.1)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Thr Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Phe Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 22).
Шестнадцатый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 23 (вариант 6.2), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Тут Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7).
Тяжелая цепь гуманизированного 12А11 (вариант 6.2)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Thr Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 23).
Семнадцатый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ГО NO: 24 (вариант 6.3), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Тут Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Тут Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7)
Тяжелая цепь гуманизированного 12А11 (вариант 6.3)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Thr Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Phe Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Туг Туг Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 24).
Восемнадцатый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 25 (вариант 6.4), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7).
Тяжелая цепь гуманизированного 12А11 (вариант 6.4)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Ser Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Phe Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 25)/
Девятнадцатый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 26 (вариант 7), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 1)1
Тяжелая цепь гуманизированного 12А11 (вариант 7)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Thr Leu Ser Thr Ser Gly Met Ser Val Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 26).
Двадцатый вариант гуманизированного антитела 12А11, содержащий легкую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ГО NO: 7, и тяжелую цепь, имеющую аминокислотную последовательность, обозначенную SEQ ID NO: 27 (вариант 8), описан в патентной заявке США US 20050118651 A1, опубликованной 2 июня 2005 года, которая вводится в данное описание ссылкой для любых целей.
Легкая цепь гуманизированного 12А11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Ser Ser His Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 7).
Тяжелая цепь гуманизированного 12А11 (вариант 8)
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Phe Ser Gly Phe Ser Leu Ser Thr Ser Gly Met Ser Val Gly Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Thr Thr Thr Ala Asp Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 8).
Любое из описанных выше антител можно получать различных изотипов или мутантных изотипов, чтобы контролировать степень связывания с различными Fc рецепторами. Антитела, в которых отсутствует область Fc (например, Fab фрагменты), не связываются с Fc рецепторами. Выбор изотипа также влияет на связывание с Fc рецепторами. Была определена относительная аффинность различных человеческих IgG изотипов к трем Fey рецепторам, FcRI, FcRII и FcRIII (см. Ravetch & Kinet, Annu. Rev. Immunol. 9, 457 (1991)). FcRI представляет собой высокоаффинный рецептор, который связывается с IgG в мономерной форме, а два последних рецептора представляют собой низкоаффинные рецепторы, которые связывают IgG только в мультимерной форме. Обычно как IgG1, так и IgG3 имеют значительную активность связывания со всеми тремя рецепторами, IgG4 с FcRI, a IgG2 только с одним типом FcRII, названным IlaLR (см. Parren et al., J. Immunol. 148, 695 (1992). Поэтому для более сильного связывания с Fcγ рецепторами обычно выбирают изотип IgG1, a IgG2 обычно выбирают для более слабого связывания.
Мутации в прилегающих или в близких сайтах в шарнирной связывающей области (например, замена остатков 234, 235, 236 и/или 237 на другой остаток) во всех изотипах снижает аффинность к Fcγ рецепторам, в частности к FcγRI рецептору. Необязательно, остатки в положениях 234, 236 и/или 237 заменяют аланином, а в положении 235 глутамином. (См., например, патент США US 5624821). Аминокислота в положении 236 в человеческом IgG2 изотипе отсутствует. Типичными сегментами аминокислот в положениях 234, 235 и 237 для человеческого IgG2 являются are ala ala gly, val ala ala, ala ala ala, val glu ala и ala glu ala. Предпочтительной комбинацией мутантов является L234A, L235A и G237A для человеческого изотипа IgG1. Особенно предпочтительным антителом является бапинеузумаб, имеющий человеческий изотип IgG, и эти три мутации в Fc области. Другими мутациями, которые ослабляют связывание с Fc гамма рецепторами, являются мутации Е233Р (в особенности в мышином IgG1) и D265A.
Аминокислоты в константной области нумеруются с помощью выравнивания с человеческим антителом EU (см. Cunningham et al., J. Biol. Chem., 9, 3161 (1970)). To есть тяжелая и легкая цепи антитела выравниваются с тяжелой и легкой цепями EU так, чтобы максимально повысить идентичность аминокислотной последовательности, и каждой аминокислоте антитела присваивается тот же номер, что и соответствующей аминокислоте в EU. Система нумерации EU является общепринятой (см. в целом Kabat et al. Sequences of Protein of Immunological Interest, NIH Publication No. 91-3242, US Department of Health and Human Services (1991)).
Аффинность антитела к компоненту комплемента Clq можно изменять мутацией по меньшей мере одного из аминокислотных остатков 318, 320 и 322 с заменой на остаток с отличающейся боковой цепью. Другие подходящие изменения с целью изменения, например, уменьшения (ослабления) или аннулирования специфического Clq-связывания с антителом, включают замены любого из остатков 318 (Glu), 320 (Lys) и 322 (Lys) на Ala. Активность Clq-связывания можно аннулировать, заменяя любой из трех указанных остатков на остаток, имеющий несоответствующую (неадекватную) функциональность в боковой цепи. Необязательно заменять ионные остатки только на Ala, чтобы нарушить (отменить, аннулировать) Clq-связывание. Можно также использовать другие алкилзамещенные неионные остатки, такие как Gly, Ile, Leu или Val, или такие ароматические неполярные остатки, как Phe, Tyr, Trp и Pro вместо любого из трех остатков, чтобы нарушить Clq-связывание. Кроме того, можно также применять такие полярные неионные остатки, как Ser, Thr, Cys и Met вместо остатков 320 и 322, но не 318, чтобы отменить Clq связывающую активность. Замена остатка 318 (Glu) может модифицировать, но не отменить Clq связывающую активность. Замена остатка 297 (Asn) на Ala приводит к утрате литической активности, в то же время слегка снижает (ослабляет, примерно, в три раза) аффинность к Clq. Это изменение разрушает сайт гликозилирования и аннулирует углевод, необходимый для активации комплемента. Любое другое изменение в этом сайте также разрушает сайт гликозилирования.
III. ПАЦИЕНТЫ, КОТОРЫХ СЛЕДУЕТ ЛЕЧИТЬ ПО СХЕМАМ ЛЕЧЕНИЯ (САА)
Церебральная амилоидная ангиопатия также известна как конгофильная ангиопатия или цереброваскулярный амилоидоз. Это заболевание мелких кровеносных сосудов головного мозга, при котором отложения амилоидного белка в стенках сосудов может привести к удару, кровоизлиянию в мозг, ишемии белого вещества мозга и деменции. Амилоидный белок напоминает крахмал, отлагается в тканях в процессе некоторых хронических заболеваний.
САА может поражать пациентов старше 45 лет, но наиболее обычна она для пациентов старше 65 и с возрастом становится все более обычной. Она одинаково поражает мужчин и женщин. В некоторых случаях САА является спорадической, но она также может быть наследственной как аутосомно-доминантное состояние (форма наследственности, при которой для того, чтобы проявилось это заболевание, необходимо присутствие только одной копии гена, кодирующего заболевание; если у любого из родителей наблюдается это заболевание, вероятность наследования ребенком этого заболевания составляет 50%). САА ответственна за 5-20% кровоизлияний в мозг и до 30% лобарных кровоизлияний, локализованных в одной доле мозга. При аутопсии САА можно обнаружить более чем у трети людей старше 60 лет, даже если у них не было кровоизлияния в мозг, удара или других проявлений заболевания в течение жизни. У больных болезнью Альцгеймера САА более обычна, чем в целом в популяции, и может встречаться более чем у 80% пациентов в возрасте старше 60 лет.
Причина амилоидных отложений в кровеносных сосудах при случайной (спорадической) САА неизвестна. При наследственной САА генетические дефекты, как правило на хромосоме 21, способствуют аккумуляции амилоида, фибриллярного белка, состоящего из единиц-фибрилл, которые имеют бета-складчатую структуру с отдельными бета-слоями. Фибриллы стремятся к агрегации, так что амилоид не может растворяться и накапливается в стенках кровеносных сосудов мозга. Одной формой амилоидных фибриллярных белков является бета-амилоидный белок.
Амилоидные отложения могут разрушать эндотелиальные или гладкомышечные клетки или как эндотелиальные, так и гладкомышечные клетки, или вызывать воспаление в стенке кровеносных сосудов или могут также приводить к более легкому нарушению сосудов. Также может происходить внутримозговое кровоизлияние, кровеносные сосуды, несущие амилоидные отложения, становятся более тяжелыми и менее прочными и, следовательно, с большей вероятностью разрушаются при малейшей травме или при изменении кровяного давления. Могут развиться аневризмы, или баллонирование стенки кровеносного сосуда, и могут также разорваться по мере того, как растянутая стенка становится тоньше, и по мере повышения давления.
Наиболее общая форма САА представляет собой случайную форму, ассоциированную со старением. Этот тип САА обычно вызывает лобарное (долевое) кровоизлияние, которое может рецидивировать в различных долях мозга. Наиболее часто поражаются фронтальная доля (за лбом) и теменная доля (позади фронтальной доли); височная доля (около виска) и затылочная доля (в задней частит мозга) поражаются реже; а мозжечок (под затылочной долей) поражается редко. Примерно, 10-50% кровоизлияний при случайной САА охватывают более одной доли.
Симптомы лобарного кровоизлияния при САА включают внезапную головную боль, неврологические симптомы, такие как слабость, потеря чувствительности, визуальные изменения или затрудненная речь, в зависимости от того, какая доля задета; и пониженный уровень сознания (больного трудно привести в чувство), тошнота и рвота. Случайная САА может ассоциироваться с симптомами, не связанными с лобарным кровоизлиянием. Петехиальные (точечные) кровоизлияния (петехии, небольшие кровоизлияния, охватывающие множество мелких сосудов) могут вызывать повторяющиеся краткие неврологические симптомы, вторичные по отношению к пароксизму или пониженному кровотоку, или могут вызывать быстро прогрессирующую деменцию (утрату памяти и других функций мозга), которая ухудшается скорее скачкообразно, нежели постепенно. Более чем у 40% пациентов, страдающих кровоизлиянием вследствие САА, также наблюдается деменция.
Генетические факторы играют роль в некоторых типах САА и в болезнях, ассоциированных с САА:
- Наследственная церебральная геморрагия с амилоидозом (отложение амилоидного белка в кровеносных сосудах) голландского типа: аутосомно-доминантный тип наследования, заболевание с генетической мутацией, затрагивающей амилоидный белок- предшественник. Начинается в возрасте 40-60 лет с головных болей, внутримозговое кровоизлияние часто в теменной области, удары и деменция. Более половины пациентов умирает после первого кровоизлияния. Больные с САА голландского типа могут продуцировать абнормальный антикоагулянт, или разжижитель крови, который повышает вероятность кровоизлияния.
- Наследственная церебральная геморрагия с амилоидозом фламандского типа: аутосомно-доминантный тип наследования, заболевание с мутацией, затрагивающей амилоидный белок-предшественник. Симптомы включают внутримозговое кровоизлияние или деменцию.
- Семейная форма болезни Альцгеймера: аутосомно-доминантный тип наследования, заболевание, составляющее 5-10% всех случаев заболевания болезнью Альцгеймера (заболевание головного мозга, при котором гибель нервных клеток ведет к прогрессирующей деменции).
- Синдром Дауна: вызывается трисомией по 21 хромосоме (скорее три, нежели две копии хромосомы 21), что приводит к избытку гена амилоидного белка-предшественника. Дети с синдромом Дауна умственно отсталы и у них имеются проблемы с сердцем.
- Наследственная церебральная геморрагия с амилоидозом исландского типа: аутосомно-доминантный тип наследования, заболевание с мутацией в гене, кодирующем цистатин С. Симптомы часто начинают появляться в возрасте 30-40 лет, выражаются во множественных внутримозговых кровоизлияниях, деменции, параличе (слабости) и смерти через 10-20 лет. Головная боль наблюдается более чем у половины пациентов, а эпилептические припадки у четверти пациентов. В отличие от большинства других форм САА, большая часть кровоизлияний захватывает базальные ядра в глубине головного мозга. (Базальные ядра представляют собой островки тканей в области мозжечка головного мозга).
- Семейный окулолептоменингеальный амилоидоз: аутосомно-доминантный тип наследования, заболевание с неизвестным(и) генным(и) дефектом(ами), описанное в семьях Японии, Италии и Северной Америки. Симптомы могут включать деменцию, атаксию (расстройство координации движений), спастичность (тугоподвижность конечностей), удары, эпилептические припадки, периферическую нейропатию (заболевание, поражающее нервы, снабжающие мышцы конечностей), мигрень, проблемы со спинным мозгом, слепоту и глухоту. Внутримозговое кровоизлияние происходит редко, так как амилоидный белок отлагается в кровеносных сосудах глаза и в мягких оболочках мозга, но не в самом мозге. В итальянских семьях с таким заболеванием пациенты могут заболевать в возрасте 20-30 лет.
- Семейный амилоидоз британского типа: аутосомно-доминантный тип наследования, заболевание с неизвестным(и) генным(и) дефектом(ами), ассоциированное с прогрессирующей деменцией, спастичностью и атаксией. Ствол головного мозга, спинной мозг и мозжечок - все показывают наличие амилоидных отложений, но, как правило, кровоизлияния не наблюдается.
В некоторых способах у пациента наблюдается САА, но отсутствуют симптомы болезни Альцгеймера или другого заболевания, поддающегося лечению антителами к Аβ или агентами, способными их индуцировать. В других способах у пациента наблюдается как САА, так и болезнь Альцгеймера или другое заболевание, поддающееся лечению антителами к Аβ или агентами, способными их индуцировать. В других способах у пациента нет ни САА, ни болезни Альцгеймера или другого заболевания, поддающегося лечению антителами к Аβ или агентами, способными их индуцировать.
Лечение бессимптомных больных можно начинать в любом возрасте (например, в возрасте 10, 20 или 30 лет). Однако обычно нет необходимости начинать лечение до достижения пациентом 40, 50, 60 или 70 лет. Лечение обычно ограничивается многократными дозами в течение некоторого периода времени. Мониторинг лечения можно проводить, анализируя реакции антитела или активированных Т-клеток или В-клеток на терапевтический агент (антитело к Аβ или его фрагмент) во времени. Если реакция недостаточна, показана бустерная доза.
Необязательно, перед началом лечения определяют наличие или отсутствие симптомов, признаки или факторы риска заболевания.
IV. ДИАГНОСТИКА И МОНИТОРИНГ БОЛЬНЫХ САА
Как в случае большинства неврологических заболеваний диагноз ставят на основании истории болезни пациента, тщательно выясняя семейный анамнез и начало, и характер симптомов, а также проводя неврологическое обследование. С помощью компьютерной томографии головного мозга (СТ) или магниторезонансной томографии (MPT, MRI) можно идентифицировать лобарное внутримозговое кровоизлияние, удар или петехиальные (точечные) кровоизлияния, и они важны для исключения врожденных артериовенозных аномалий, опухоли мозга или других причин кровоизлияния. Ангиография (рентгеновское исследование внутреннего строения кровеносных сосудов и сердца) бесполезна при диагностике САА, но может потребоваться для того, чтобы исключить аневризму. Биопсия головного мозга (извлечение небольшого фрагмента ткани головного мозга хирургическим путем) может показать характерные амилоидные отложения. Если диагноз сомнительный, биопсия может потребоваться для того, чтобы исключить состояния, теоретически поддающиеся излечению. Люмбальная пункция для исследования белков спинномозговой жидкости может показать характерную патологию.
САА с кровоизлиянием должна отличаться от других типов внутримозгового кровоизлияния (внутримозговой геморрагии). При САА кровоизлияние обычно наблюдается в лобарной области, часто прорывается (проникает) в субарахноидальное пространство между головным мозгом и его оболочками и происходит по ночам. При кровоизлиянии, связанном с повышенным кровяным давлением, кровоизлияние обычно наблюдается глубже в мозге, проникает в желудочки или полости внутри мозга и происходит во время дневной деятельности. Другими причинами внутримозгового кровоизлияния являются артериовенозные аномалии, травма, аневризмы, кровотечение в опухоль мозга, васкулит (воспаление кровеносных сосудов) или геморрагические расстройства. У пациентов следует проводить мониторинг церебральной микрогеморрагии (микрокровоизлияния) методом MRI и/или удаления сосудистого амилоида методом позитронно-эмиссионной томографии (PET, ПЭТ).
Пациенты, поддающиеся лечению, включают индивидуумов с повышенным риском заболевания САА, но без симптомов, а также пациентов, у которых в настоящее время наблюдаются симптомы.
V. СХЕМЫ ЛЕЧЕНИЯ
Для применения с целью профилактики фармацевтические композиции или лекарственные препараты вводят пациенту, восприимчивому к САА, или в противном случае, подверженные повышенному риску заболевания САА, по схеме, включающей количество и частоту введения композиции или лекарственного препарата, достаточные для исключения или снижения риска, уменьшения тяжести или задержки начала заболевания, включая физиологические, биохимические, гистологические и/или поведенческие симптомы заболевания, включая их осложнения и промежуточные патологические фенотипы, появляющиеся в процессе развития заболевания. Для применения с целью терапии композиции или лекарства вводят пациенту, предположительно страдающему или уже страдающему таким заболеванием, по схеме, включающей количество и частоту введения композиции или лекарственного препарата, достаточные для излечения, или по меньшей мере частичного подавления симптомов заболевания (физиологических, биохимических, гистологических и/или поведенческих), включая их осложнения и промежуточные патологические фенотипы, появляющиеся в процессе развития заболевания. Количество, достаточное для осуществления терапевтического или профилактического лечения, определяют как терапевтически или профилактически эффективную дозу. Сочетание количества и частоты введения дозы, адекватное для осуществления терапевтического или профилактического лечения, определяют как терапевтически или профилактически эффективную схему лечения. Как при профилактической, так и при терапевтической схемах агенты обычно вводят в виде нескольких доз до достижения удовлетворительного иммунного ответа. Обычно иммунный ответ контролируют и дают повторную дозу, если иммунный ответ начинает слабеть.
Эффективные дозы композиций по настоящему изобретению для лечения вышеописанных состояний меняются в зависимости от множества различных факторов, включая способ введения, участок-мишень, физиологическое состояние пациента, является ли пациент человеком или животным, другие вводимые лекарственные препараты и является ли лечение профилактическим или терапевтическим. Обычно пациентом является человек, но можно также лечить отличных от человека млекопитающих, включая трансгенных млекопитающих. Лечебные дозы следует титровать, чтобы оптимизировать безопасность и эффективность. Количество иммуногена зависит от того, вводится ли также адъювант, причем в отсутствие адъюванта требуются повышенные дозы. Количество иммуногена для введения иногда варьируется от 1 до 500 мкг/пациент и более обычно от 5 до 500 мкг для введения человеку в виде инъекции. Как правило, на каждую инъекцию человеку используют 10, 20, 50 или 100 мкг. Масса иммуногена зависит также от отношения массы иммуногенного эпитопа в иммуногене к массе иммуногена в целом. Обычно на микрограмм иммуногена приходится 10-3-10-5 микромолей иммуногенного эпитопа. Частота инъекций может значительно меняться от одного раза в день до одного раза в год, до одного раза в десять лет. В любой день, в который дается доза иммуногена, доза больше 1 мкг/пациент и обычно больше 10 мкг/пациент, если вводят также адъювант, и больше 10 мкг/пациент и обычно больше 100 мкг/пациент в отсутствие адъюванта. Типичная схема состоит из иммунизации с последующими бустерными инъекциями через временные интервалы, такие как 6-недельные интервалы. Другая схема включает иммунизацию с последующими бустерными инъекциями через 1, 2 и 12 месяцев. Другая схема включает инъекцию каждые две недели в продолжение жизни. Или же бустерные инъекции можно вводить нерегулярно в зависимости от результатов мониторинга иммунного ответа.
Для пассивной иммунизации антителом лекарственная схема обычно включает введение от 0.01 до 5 мг/кг веса тела хозяина. В частности, интервалы доз составляют, примерно, от 0.5 мг/кг до менее чем 5 мг/кг, и более обычно, 0.5-3 мг/кг веса тела хозяина. Например, дозы могут быть менее 5 мг/кг веса тела, или 1.5/кг веса тела, или в интервале 0.5-1.5 мг/кг, предпочтительно, по меньшей мере 1.5 мг/кг. Субъектам можно вводить такие дозы ежедневно, или через день, еженедельно или по любой другой схеме, определенной эмпирическим путем. Типичное лечение включает введение многократных доз в течение продолжительного периода времени, например, по меньшей мере в течение шести месяцев. Другие типичные схемы лечения включают введение раз в две недели, или раз в месяц, или раз в 3-6 месяцев.
Типичные лекарственные схемы для пассивного лечения включают введение 1.5-3 мг/кг или 1.5 мг/кг каждые тринадцать недель. Агенты по изобретению обычно вводят многократно. Интервалы между единичными дозами могут составлять неделю, месяц, тринадцать недель или год. Интервалы могут также быть нерегулярными в соответствии с измеряемыми уровнями антитела к Аβ в крови пациента.
В некоторых способах дозу корректируют таким образом, чтобы достичь концентрации антитела в плазме 1-1000 мкг/мл, а в некоторых способах 25-300 мкг/мл. Или же антитело можно вводить в виде препарата пролонгированного действия, в этом случае лекарство вводится реже. Доза и частота введения меняются в зависимости от периода полужизни антитела в организме пациента. Обычно человеческие антитела имеют наибольший период полужизни, затем идут гуманизированные антитела, химерные антитела и нечеловеческие антитела.
В предпочтительных схемах введения антител, специфических к N-концу Аβ, достигается средняя сывороточная концентрация вводимого антитела в организме пациента 1-15 мкг/мл. Сывороточную концентрацию можно определять, действительно ее измеряя, или теоретически определять на основании обычной фармакокинетики (например, WinNonline Version 4/0/1 (Pharsight Corporation, Cary, USA)), исходя из количества вводимого антитела, частоты введения, пути введения и периода полужизни антитела. Средняя концентрация антитела в сыворотке, предпочтительно, находится в интервале 1-10, 1-5 или 2-4 мкг/мл.
При внутривенном введении дозы 0.1-5 мг/кг антитела вводят в диапазоне от ежемесячного до ежеквартального (предпочтительно, раз в 13 недель). При ежеквартальном введении предпочтителен интервал доз 0.5-3, 0.5-2 или 0.5-1.5 мг/кг. Предпочтительные дозы антитела для ежемесячного внутривенного введения находятся в интервале 0.1-1.0 мг/кг антитела или, предпочтительно, 0.5-1.0 мг/кг антитела.
При более частом введении доз, например, от еженедельного до ежемесячного, предпочтительно подкожное введение. Дозы, применяемые для подкожного введения, обычно находятся в интервале 0.1-0.6 мг/кг или 0.01-0.35 мг/кг, предпочтительно, 0.05-0.25 мг/кг. Для еженедельного введения или введения раз в две недели предпочтительна доза в интервале 0.015-0.2 мг/кг или 0.05-0.15 мг/кг. Для еженедельного введения предпочтительна доза в интервале 0.05-0.07 мг/кг, например, 0.06 мг/кг. Для введения раз в две недели предпочтительна доза в интервале 0.1-0.15 мг/кг. Для ежемесячного введения предпочтительна доза в интервале 0.1-0.3 мг/кг или 2 мг/кг. Ежемесячное введение доз включает введение раз в календарный месяц или раз в лунный месяц (т.е. каждые четыре недели).
Схему лечения обычно продолжают соблюдать таким образом, чтобы средние сывороточные концентрации антитела, описанные выше, сохранялись по меньшей мере в течение шести месяцев, или год, или, иногда, до конца жизни. Сывороточную концентрацию можно измерять в любое время в ходе лечения и повышать дозу и/или частоту введения, если средняя концентрация падает ниже целевого интервала, или понижать дозу и/или частоту введения, если средняя концентрация становится выше целевого интервала.
Хотя определение оптимальных концентраций антитела в плазме полезна для установления лекарственной схемы или оптимизации дозы у отдельного пациента, на практике, когда установлена эффективная лекарственная схема, выраженная в мг/кг и мг и в частоте введения, ту же самую лекарственную схему можно использовать для многих других пациентов, при этом нет необходимости подробного расчета или измерения титра у пациента. Так, любую из вышеуказанных лекарственных схем или схем лечения можно использовать вне зависимости от того, определен или предсказан титр у конкретного пациента. Например, одна подходящая схема представляет собой внутривенное введение с месячными интервалами в дозе в интервале 0.1-1.0 мг/кг антитела или, предпочтительно 0.5-1.0 мг/кг антитела. Для подкожного введения обычно применяют дозу в интервале 0.01-0.6 мг/кг или 0.01-0.35 мг/кг, предпочтительно, 0.05-0.25 мг/кг. Для еженедельного введения или введения раз в две недели предпочтительна доза в интервале 0.015-0.2 мг/кг или 0.05-0.15 мг/кг. Для еженедельного введения предпочтительна доза в интервале 0.05-0.07 мг/кг, например, 0.06 мг/кг. Для введения раз в две недели предпочтительна доза в интервале 0.1-0.15 мг/кг. Для ежемесячного введения предпочтительна доза в интервале 0.1-0.3 мг/кг или 2 мг/кг.
Здесь, как и в другом месте заявки, дозы, выражаемые в мг/кг, можно переводить в дозы с учетом абсолютной массы тела, умножая их на массу типичного пациента (например, 70 или 75 кг), обычно округляя до целого числа. Выраженные в пересчете на абсолютную массу, антитела обычно вводят в дозе 1-40 мг с частотой от еженедельной до ежемесячной. Предпочтительные интервалы составляют 5-25 мг или 2.5-15 мг с частотой от еженедельной до ежемесячной. Для еженедельного введения или введения раз в две недели доза часто составляет 1-12 мг или 2.5-10 мг. Для еженедельного введения доза часто составляет 2.5-5 мг 4-5 мг. При введении раз в две недели доза может быть 7-10 мг. Массу антитела в упаковке для введения в виде стандартных доз обычно округляют до целого числа, а именно, 1, 5, 10, 20, 30, 40, 50, 75 или 100 мг.
Доза и частота введения может меняться в зависимости от того, является лечение профилактическим или терапевтическим. При профилактическом лечении композиции, содержащие антитела по настоящему изобретению или их коктейль, вводят пациенту, не находящемуся уже в болезненном состоянии, для повышения устойчивости (сопротивляемости) пациента. Такое количество определяется как "профилактически эффективная доза". При таком применении точные количества опять же зависят от состояния здоровья пациента и общего иммунитета, но обычно находятся в интервале от 0.1 до 25 мг/доза, в особенности 0.5-2.5 мг/доза. Относительно низкую дозу вводят через сравнительно длинные интервалы в течение продолжительного периода времени. Некоторые пациенты продолжают получать лечение до конца жизни.
При терапевтическом применении иногда требуются относительно высокие дозы (например, примерно, от 10 до 250 мг антитела/доза, при этом наиболее часто применяют дозы от 5 до 25 мг) через сравнительно короткие интервалы до тех пор, пока прогрессирование заболевания не замедлится или не прекратится, и, предпочтительно, до тех пор, пока у пациента не будет наблюдаться частичное или полное уменьшение интенсивности симптомов заболевания. Затем пациенту можно предписать профилактическую схему.
Агенты по изобретению можно, необязательно, вводить в комбинации с другими агентами, которые, по меньшей мере, частично, эффективно лечат амилоидогенное заболевание. В случае САА, при которой наблюдаются амилоидные отложения в сосудистой сети головного мозга, агенты по изобретению можно также вводить в сочетании с другими агентами, которые повышают проникновение агентов по изобретению через гемато-энцефалический барьер.
Дозы нуклеиновых кислот, кодирующих иммуногены, находятся в интервале от 10 нг до 1 г, от 100 нг до 100 мг, от 1 мкг до 10 мг или от 30 мкг до 300 мкг ДНК/пациент. Дозы инфекционных вирусных векторов варьируются от 10 до 100 или более вирионов/доза.
Агенты для индукции иммунного ответа можно вводить парентеральным, топическим, внутривенным, пероральным, подкожным, интраартериальным, интракраниальным (внутричерепным), интратекальным (подоболочечным), интраперитонеальным, интраназальным или внутримышечным способами для профилактического и/или терапевтического лечения. Самым обычным путем (способом) введения иммуногенного агента является подкожный, хотя другие способы могут быть в равной степени эффективны. Следующим наиболее общим путем введения является внутримышечная инъекция. Этот тип инъекции наиболее часто делают в мышцы руки или ноги. В некоторых способах агенты инъецируют непосредственно в конкретную ткань, в которой накапливаются отложения, например, внутричерепная (интракраниальная) инъекция. Для введения антитела предпочтительны внутримышечная инъекция или внутривенная инфузия. В некоторых способах конкретные терапевтические антитела инъецируют непосредственно в череп. В некоторых способах антитела вводят в виде композиции с пролонгированным высвобождением или устройства, такого как Medipad™.
Как отмечается выше, агенты, вызывающие иммуногенную реакцию против Аβ, можно соответственно вводить в комбинации (сочетании). Агенты можно объединять в едином препарате или наборе для одновременного, последовательного или раздельного применения. Агенты могут находиться в раздельных виалах в препарате или в наборе или могут объединяться в единой виале. Эти агенты по изобретению можно, необязательно, вводить с другими агентами, которые по меньшей мере частично эффективны при лечении САА. Миметик гликозаминогликанов CEREBRILL (Neurochem) в настоящее время проходит клинические испытания для лечения САА. Большинству пациентов с САА следует проконсультироваться, чтобы не допустить самостоятельного приема агентов (с осторожностью применять агенты), которые "разжижают кровь" или препятствуют свертыванию крови. Лекарственным препаратом, оказывающим наиболее сильное действие на свертывание крови (и поэтому представляющим наибольшую опасность для САА пациентов), является варфарин (также известный под своей торговой маркой "Кумадин"). Другими медицинскими препаратами, обладающими более слабым действием на кровь, являются аспирин, тиклопидин ("Тиклид"), клопидогрел ("Плавикс") и большинство противовоспалительных препаратов, таких как ибупрофен. Обычно после выздоровления пациента после кровоизлияния целесообразно также следить за кровяным давлением и поддерживать его в нормальном диапазоне. Эпилептические припадки или рецидивирующие неврологические симптомы, предположительно являющиеся эпилептическими припадками, следует лечить противосудорожными лекарствами, хотя следует избегать Депакота (вальпроата натрия) ввиду его антитромбоцитарного действия. Противосудорожные лекарства иногда дают пациентам при обширном лобарном внутримозговом кровоизлиянии, чтобы предупредить эпилептические припадки, хотя польза от них не установлена. Для устранения внутримозгового кровотечения может потребоваться хирургическое вмешательство. Нечасто САА может ассоциироваться с церебральным васкулитом или воспалением стенок кровеносных сосудов. В таких случаях может помочь лечение стероидами или иммунодепрессантами.
Иммуногенные агенты по изобретению, такие как пептиды, иногда вводят в комбинации с адъювантом. Для выявления иммунного ответа можно использовать различные адъюванты в комбинации с пептидом. Предпочтительные адъюванты усиливают собственный (врожденный) ответ на иммуноген, не вызывая конформационных изменений в иммуногене, которые влияют на качественную форму ответа. Предпочтительные адъюванты включают гидроксид алюминия и фосфат алюминия, 3-дез-O-ацилированный монофосфориллипид A (MPL™) (см. английский патент GB 2220211 (RIBI ImmunoChem Research Inc., Hamilton, Montana, в настоящее время часть Corixa). Стимулон™ OS-21 представляет собой тритерпеновый гликозид или сапонин, выделенный из коры Quillaja Saponaria Molina, дерева, растущего в Южной Америке (см. Kensil et al., Vaccine Design: The Subunit and Adjuvant Approach (eds. Powell & Newman, Plenum Press, NY, 1995); патент США No. 5057540, Aquila BioPharmaceuticals, Framingham, MA. Другие адъюванты представляют собой эмульсии масла в воде (такого как сквален или арахисовое масло), необязательно в комбинации с иммуностимуляторами, такими как монофосфориллипид А (см. Stoute et al., N. Engl. J. Med. 336, 86-91 (1997)), плюроники и убитые микобактерии. Другим адъювантом является CpG (Международная патентная заявка WO 98/40100). Или же Аβ можно связывать с адъювантом. Однако такое связывание не должно значительно изменять конформацию альфа-азогруппы иммуногена, чтобы не повлиять на характер иммунного ответа на него. Адъюванты можно вводить в виде компонента терапевтической композиции с активным агентом, или можно вводить раздельно, до, во время или после введения терапевтического агента.
Предпочтительным классом адъювантов являются соединения алюминия, такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия. Такие адъюванты можно применять с другими специфическими иммуностимулирующими агентами (или без них), такими как MPL или 3-DMP, QS-21, полимерные или мономерные аминокислоты, такие как полиглутаминовая кислота или полилизин. Другой класс адъювантов представляет собой эмульсионные составы масло-в-воде. Такие адъюванты можно использовать с другими иммуностимулирующими агентами (или без них), такими как мурамил-пептиды (например, N-ацетилмурамил-L-треонил-D-изоглутамин (thr (Tp)-MDP), N-ацетил-нормурамил-L-аланил-D-изоглутамин (нор-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (МТР-РЕ), N-ацетилглюкозаминил-N-ацетилмурамил-L-А1-D-изоглю-L-Ala-дипальмитоксипропиламид (DTP-DPP) терамид™) или другие компоненты стенок бактерий. Эмульсии масло-в- воде включают (а) адъювант MF59 (Международная заявка WO 90/14837), содержащий 5% сквалена, 0.5% Tween (Твин) 80 и 0.5% Span 85 (необязательно содержащий различные количества МТР- РЕ), приготовленный в виде субмикронных частиц на микрофлюидизаторе, таком как микрофлюидизатор Model HOY (Microfluidics, Newton MA), (б) адъювант SAF, содержащий 10% сквалена, 0.4% Tween 80, 5% плюроника (блок-сополимера алкиленоксидов) L121 и thr-MDP, либо микрофлюидизированный в виде субмикронной эмульсии или перемешивают на вортексе, при этом получают эмульсию с большим размером частиц, и (в) Ribi™ адъювантная система (RAS), (Ribi ImmunoChem, Hamilton, МТ), содержащая 2% сквалена, 0.2% Tween 80 и один или более компонентов стенок бактерий из группы, состоящей из монофосфориллипида А (MPL), димиколята трегалозы (TDM) и скелета клеточных стенок (CWS), предпочтительно, MPL+CWS (Detox™).
Другим классом предпочтительных адъювантов являются сапониновые адъюванты, такие как Стимулон™ (QS-21, Aquila, Framingham, MA) или полученные из него частицы, такие как ISCOM (иммуностимулирующие комплексы) и ISCOMATRIX. Другие адъюванты включают RC-529, GM-CSF и неполный адъювант Фрейнда (IFA) фармацевтически приемлемой степени чистоты (выпускаемый под торговой маркой Монтанид). Другие адъюванты включают цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-6, IL-12, IL-13 и IL-15), макрофагальный колониестимулирующий фактор (M-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) и фактор некроза опухолей (TNF). Другим классом адъювантов являются аналоги гликолипидов, включая N-гликозиламиды, N-гликозилмочевины и N-гликозилкарбаматы, в каждом из которых остаток сахара имеет в качестве заместителя аминокислоту, в качестве иммуномодуляторов или адъювантов (см. патент США No. 4855283). В качестве адъювантов можно также использовать белки теплового шока, например, HSP70 и HSP90.
Адъювант можно вводить с иммуногеном в качестве единой композиции или его можно вводить до, во время или после введения иммуногена. Иммуноген и адъювант могут упаковываться и поставляться в одной и той же виале или могут упаковываться в раздельные виалы и смешиваться перед употреблением. Иммуноген и адъювант обычно упаковывают с этикеткой, указывающей предполагаемое терапевтическое применение. Если иммуноген и адъювант упакованы раздельно, упаковка обычно содержит инструкции по смешиванию перед употреблением. Выбор адъюванта и/или носителя зависит от устойчивости иммуногенного состава, содержащего адъювант, способа (пути) введения, лекарственной схемы, эффективности адъюванта по отношению к вакцинированному виду, и у людей фармацевтически приемлемым адъювантом является такой, который одобрен или заслуживает одобрения для лечения людей соответствующими контролирующими органами. Например, полный адъювант Фрейнда не подходит для применения к людям. Предпочтительными являются соединения алюминия, MPL и QS-21. Необязательно, одновременно можно использовать два или более различных адъювантов. Предпочтительные комбинации включают соединения алюминия с MPL, соединения алюминия с QS-21, MPL с QS-21, MPL или RC-529 с GM-CSF, и совместно соединения алюминия, QS-21 и MPL. Также можно использовать неполный адъювант Фрейнда (Chang et al., Advanced Drug Delivery Reviews 32, 173-186 (1998)), необязательно в сочетании с любым адъювантом из группы: соединения алюминия, QS-21 и MPL, или в комбинации со всеми этими адъювантами.
Агенты по изобретению часто вводят в виде фармацевтических композиций, содержащих активный терапевтический агент, ряд других фармацевтически приемлемых компонентов. См. Remington's Pharmaceutical Science (15th ed., Mack Publishing Company, Easton, Pennsylvania, 1980). Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения. Композиция может включать также, в зависимости от требуемого препарата, фармацевтически приемлемые нетоксические носители или разбавители, которые определяются как средства, применяемые обычно для приготовления фармацевтических композиций для введения животным или человеку. Разбавитель выбирают таким образом, чтобы он не влиял на биологическую активность комбинации. Примерами таких разбавителей являются дистиллированная вода, физиологический фосфатно-солевой буферный раствор, растворы Рингера, раствор декстрозы и раствор Хэнка. Кроме того, фармацевтическая композиция или состав может также включать другие носители, адъюванты или нетоксические нетерапевтические неиммуногенные стабилизаторы и т.п.
Фармацевтические композиции могут также включать большие медленно метаболизирующиеся макромолекулы, такие как белки, полисахариды, такие как хитозан, полимолочные кислоты, полигликолевые кислоты и сополимеры (такие как функционализированная латексом сефароза(ТМ), агароза, целлюлоза и т.п.), полимерные аминокислоты, сополимеры аминокислот и липидные агрегаты (такие как капельки масла или липосомы). Кроме того, эти носители могут функционировать как иммуностимулирующие агенты (т.е. адъюванты).
Для парентерального введения агенты по изобретению можно вводить в виде инъецируемых доз раствора или суспензии вещества в физиологически приемлемом разбавителе с фармацевтическим носителем, который может представлять собой стерильную жидкость, такую как вода, масла, физиологический раствор, глицерин или этанол. Кроме того, в композициях могут присутствовать добавки, такие как смачивающие вещества или эмульгаторы, поверхностно-активные вещества, рН забуферивающие вещества и т.п. Другими компонентами фармацевтических композиций являются вещества из нефти, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло и минеральное масло. Обычно предпочтительными жидкими носителями, в особенности для инъецируемых растворов, являются гликоли, такие как пропиленгликоль или полиэтиленгликоль. Антитела можно вводить в виде депо-инъекции или имплантата, которые могут быть приготовлены таким образом, чтобы способствовать пролонгированному высвобождению активного ингредиента. Типичная композиция содержит моноклональное антитело с концентрацией 5 мг/мл, приготовленное в водном буферном растворе, состоящем из 50 мМ L-гистидина, 150 мМ NaCl, доведенном до рН 6.0 с помощью HCl. Композиции для парентерального введения обычно практически стерильны, практически изотоничны и производятся в условиях GMP, утвержденных FDA или аналогичным органом. Например, композиции, содержащие биологически активные лекарственные средства, обычно стерилизуют фильтрационной стерилизацией. Композиции можно приготовить для однократного введения.
Обычно композиции готовят в виде инъецируемых препаратов, либо в виде жидких растворов или суспензий; следует также приготовить твердые формы, пригодные для растворения или суспендирования перед инъекцией в жидких носителях. Препарат можно также эмульгировать или инкапсулировать в липосомы или макрочастицы, такие как полилактидные, полигликолидные или сополимерные частицы, для усиления действия адъюванта, обсуждавшегося выше (см. Langer, Science 249, 1527 (1990) и Hanes, Advanced Drug Delivery Reviews 28, 97-119 (1997). Агенты по данному изобретению можно вводить в виде депо-инъекции или имплантата, которые могут быть приготовлены таким образом, чтобы способствовать пролонгированному высвобождению активного ингредиента или высвобождению его в импульсном режиме.
Другие рецептуры, пригодные для других способов введения, включают пероральные, интраназальные и легочные рецептуры, суппозитории и трансдермальные аппликации.
Для суппозиториев связующие и носители включают, например, полиалкиленгликоли или триглицериды; такие суппозитории можно готовить из смесей, содержащих активный ингредиент в интервале 0.5-10%, предпочтительно, 1-2%. Пероральные рецептуры включают эксципиенты, такие как фармацевтической степени чистоты маннит, лактоза, крахмал, стеарат магния, натрий сахарин, целлюлоза и карбонат магния. Эти композиции находятся в виде растворов, суспензий, таблеток, пилюль, капсул, препаратов пролонгированного действия или порошков и содержат 10-95% активного ингредиента, предпочтительно, 25-70%.
Топическая аппликация может обеспечить трансдермальную или интрадермальную доставку. Топическому введению может способствовать совместное введение агента с холерным экзотоксином или с обезвреженными производными или субъединицами этого экзотоксина или других аналогичных бактериальных токсинов (см. Glenn et al., Nature 391, 851 (1998)). Совместное введение можно осуществлять, используя компоненты в виде смесей или связанных молекул, полученных химическим сшиванием или экспрессией слитого белка.
Или же, трансдермальную доставку можно осуществлять, используя трансдермальный пластырь или трансфер(о)сомы (Paul et al., Eur. J. Immunol. 25, 3521-24 (1995); Cevc et al., Biochem. Biophys. Acta 1368, 201-15 (1998)).
VI. НАБОРЫ
Помимо этого, изобретение предусматривает терапевтические изделия. Изделия включают стеклянные виалы и инструкции. Стеклянная виала содержит препарат, содержащий около 10 мг - 250 мг гуманизированного антитела против Аβ, около 4% маннита или, примерно, 150 мМ NaCl, примерно, 5 мМ - 10 мМ гистидина и около 10 мМ метионина. Инструкции включают контроль церебрального микрокровоизлияния у пациента методом МРТ (MRI) или контроль удаления сосудистого амилоида у пациента методом ПЭТ (PET).
ПРИМЕРЫ
ПРИМЕР 1
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования. Действие постоянной пассивной иммунизации на установленный VAβ у мышей PDAPP изучают двумя путями. Исследование А проводится для сравнения эффективности N-концевого антитела (3D6, распознающего Аβ 1-5) с антителом к срединной области (266, распознающим Аβ16-23) в единичной дозе. В исследовании В изучается эффект дозы 3D6. В обоих исследованиях 12-месячных самок гетерозиготных мышей PDAPP делят на группы из 40 мышей; насколько это возможно, группы близко совпадают друг с другом по возрасту и трансгенному родителю. Отдельно группу из 40 животных умерщвляют при t0 для определения уровней сосудистого амилоида в возрасте 12 месяцев. Как представлено в Таблице 1, мышам в экспериментальных группах инъецируют интраперитонеально мышиные моноклональные антитела 3D6 γ2а (на уровне 3 доз), 266 γ1 или TY11-15 (в качестве отрицательного контроля). Все обработанные животные получают начальную ударную дозу, составляющую 250% намеченной еженедельной дозы. Дозы для животного рассчитывают, исходя из среднего веса мышей PDAPP в этом возрастном интервале, 50 грамм (по литературным данным). Животных обрабатывают еженедельно в течение, примерно, 6 месяцев (26 недель). По окончании фазы прижизненного (in-life) изучения оценивают наличие и степень (величину, область) VAβ и микрокровоизлияния. Все работы осуществляют в соответствии с рекомендациями Elan IACUC.
Получение антител. Методы получения антител 3D6 (узнающих Аβ 1-5), 266 (узнающих Аβ 16-23) и 12А11 (узнающих Аβ 3-7) описаны ранее (см. K. Johnson-Wood et al., Proc Natl Acad Sci USA 94, 1550-5 (1997), P. Seubert et al., Nature 359, 325-7 (1992), F. Bard et al., Proc Natl Acad Sci USA 100, 2023-8 (2003)). TY11/15 (IgG2a изотип) служит в качестве нерелевантного контрольного антитела. Оно узнает неизвестный человеческий лимфоцитарный антиген и не узнает мышиные лимфоциты. Антитела 3D6 и 12А11 метят NHS-биотином, как описано ранее (см Р. Seubert et al., Nature 359, 325-7 (1992)).
Подготовка тканей головного мозга для гистохимии. Животных подвергают глубокой анестезии изофлуораном и проводят интракардиальную перфузию физиологическим раствором. Одну полусферу каждого мозга погружают-фиксируют в течение 48 часов в 4% параформальдегиде при 4°С и делают коронарные срезы по 40 мкм, используя вибронож микротома. Срезы хранят в растворе антифриза (30% глицерина/30% этиленгликоля в 40 мМ Na2HPO4, pH 7.4) при -20°С до иммуноокрашивания. Для анализа отбирают четыре из шести секций, охватывающих ростральный гиппокампальный уровень с интервалами 240 мкм. Головной мозг и срезы, в которых лобная кора повреждена в процессе отделения от черепа, исключают из анализов. Конечные цифры указаны в Результатах. Срезы окрашивают и анализируют исследователи (эксперты), не знакомые со статусом обработки (слепое исследование).
Гистохимическая процедура совместного мечения VAβ и микрокровоизлияний: Отложения Аβ метят биотинилированными антителами 3D6 (3.0 мкг/мл) или 12А11 (3.0 мкг/мл) в 1% лошадиной сыворотке в PBS в течение ночи при 4°С. Плавающие срезы затем реагируют с комплексом авидин-биотинилированная пероксидаза хрена и проявляют 3,3-диаминобензидином. Затем срезы помещают на предметные стекла и совместно окрашивают по реакции Перлса на железо (см. М.М. Rathke et al., см. выше), модифицированной инкубацией при 37°С для интенсификации (окрашивания) продукта реакции - гемосидерина. Присутствие гемосидерина является показателем имевшего место события микрокровоизлияния (микрогеморрагии).
Анализ VAβ: 3D6- иммунореактивные кровеносные сосуды оценивают у каждого животного, относя животное к одной из двух категорий, в зависимости от количества Аβ: от "отсутствует до немного VAR" (≤3 амилоид-позитивных сосудов в любом единичном срезе на животное) или "умеренное количество VAβ (>3 амилоид-позитивных сосудов в любом единичном срезе на животное). Этот способ классификации дополняют, считая число всех амилоид-содержащих сосудов в тканях в исследованиях А и В и используя кривую ROC, чтобы определить срез, оптимальный по соотношению чувствительности и специфичности. Сосуды считают, если они содержат какое-либо количество амилоида, чтобы учитывать как частично очищенные сосуды, так и неочищенные сосуды. Проводят попарное сравнение с помощью точного теста Фишера (FET), чтобы идентифицировать заметную разницу в VAβ. В каждом исследовании для корректировки попарных множественных сравнений используют метод Хохберга (Y. Hochberg, Biometrica 75, 800-802 (1988)).
Анализ микрокровоизлияний (микрогеморрагии): Каждого животного оценивают по трехбалльной шкале от 0 до 3, определяя присутствие, количество, локализацию и интенсивность гемосидеринового окрашивания в срезах. Оценка "0" указывает на очень небольшое окрашивание или на его отсутствие, "1" указывает на точечное или слабое окрашивание в немногих срезах, "2" относится к прилегающим (непрерывным) скоплениям с более интенсивным окрашиванием во многих срезах, и "3" показывает наиболее темное окрашивание в большинстве срезов, обычно охватывающее большую часть окружения пораженного сосуда. Эти оценки предназначены для того, чтобы показать размер (интервал) гемосидерин-позитивного окрашивания, ограниченный настоящим преклиническим (доклиническим) исследованием на животных, и, следовательно, они не представляют собой или не транслируются в оценки клинических геморрагических расстройств. Проводят попарные сравнения с применением точного теста Фишера для проверки разницы между экспериментальными группами. Также проводят наблюдения морфологических особенностей иммуномеченного амилоида и их пространственное расположение относительно гемосидерина. В каждом исследовании для корректировки попарных множественных сравнений используют метод Хохберга (Y. Hochberg, см. выше).
РЕЗУЛЬТАТЫ
Сосудистый Аβ. VAβ очень заметен (выступает) в мягкой и паутинной оболочке мозга и в поверхностных слоях паренхимы непролеченных 18-месячных мышей PDAPP, как выявлено окрашиванием тиофлавином S (Фигура 1а) для компактной формы амилоида и с помощью антитела 3D6 (Фигура 1b), которое узнает как компактную, так и диффузную форму амилоида у мышей PDAPP и человеческого AD (Фигура 1 с). VAβ в значительной степени ограничен мягкими оболочками мозга и находится непосредственно под поверхностными слоями головного мозга (Фигура 1d). Он особенно отчетливо выступает в коре головного мозга, в частности, в сосудах срединной сагиттальной плоскости (сагиттальный синус), и аналогично, распределение в VA(3 выявлено тиофлавином S (Фигура 1а) и с помощью антитела 3D6 (Фигура 1b), как в мышиной, так и в человеческой ткани (Фигура 1с).
В исследовании по сравнению однократных доз антител к N-концевой и срединной области (Исследование А) 3D6 в дозе 3 мг/кг полностью очищает или предупреждает VAβ по сравнению как с 266, так и с TY11-15 (Фигура 2а-е); эта разница статистически значима (значение p (коэффициент корреляции)<0.0001 для обоих исследований). Лечение с помощью 3D6 снижает также нагрузку амилоидных бляшек в паренхиме на 98% (p<0.0001), тогда как 266 не вызывает никакого эффекта. Средние уровни присутствующего VAβ перед началом лечения составляют 23% у 12-месячных мышей. FET p-величина <0.025 является статистически значимой в методе множественных сравнений Хохберга.
В исследовании зависимости от дозы 3D6 (исследование В, Фигура 3a-d), VAβ опять же заметно очищается или предупреждается обработкой 3D6 в дозе 3.0 мг/кг по сравнению с контролем TY11-15 (p<0.001). Также наблюдается клиренс или предупреждение Vaβ под действием промежуточного уровня доз (0.3 мг/кг) по сравнению с контролем (р=0.016). Отсутствует разница между группой, получавшей дозу 0.1 мг/кг, и контрольной группой, получавшей TY11-15 (р=0.8037). FET p-величины <0.025 является статистически значимой в методе множественных сравнений Хохберга. Хотя число сосудов незначительно отличается, наблюдается частичный клиренс амилоида из сосудов в этой группе на микроскопическом уровне (Фигура 4а, b). Хотя интактные Аβ образуют массы (разрастания) и полосы, которые охватывают непораженный лептоменингеальный сосуд, показанный на Фигуре 4а, в ходе частичного клиренса в Vaβ наблюдаются пятна (очаги) и эрозия (Фигура 4b). Такая морфология не наблюдается у непролеченных мышей.
Оценки по гемосидериновому окрашиванию. Чтобы распознать едва заметные различия между экспериментальными группами, разработана шкала оценок по окрашиванию гемосидерином, которая отражает интервал плотностей окрашивания, обнаруженный в этом исследовании. Гемосидериновое окрашивание, показатель микрокровоизлияния, ограничено структурными границами сосудистой сети и не распространяется в окружающую паренхиму. Очаговые гемосидериновые отложения обнаруживаются в сосудах мягкой и паутинной оболочки (лептоменингеальных сосудах) коры головного мозга (Фигура 5a-f) и границы раздела гиппокамп- таламус, сосудах сагиттального синуса в срединной плоскости коры головного мозга, в немногих сосудах паренхимы под прямым углом и связанных с лептоменингеальными сосудами. В этих областях гемосидерин обычно концентрируется внутри макрофагоподобных клеток. Очаги гемосидерина часто ассоциируются с измененной VAβ морфологией: вместо характерных отдельных полос и пластинок (чешуек) VAβ отложений (например, Фигура 4а), амилоидные отложения имеют необычный испещренный пятнами и размытый вид (например, Фигура 4b) или совсем отсутствуют. Эти признаки особенно заметны в лептоменингеальных (Фигура 5) сосудах и сосудах сагиттального синуса, которые часто имеют хорошо развитую VAβ морфологию в контрольных группах, получавших TY11-15, и у непролеченных мышей (Фигуры 2 и 3).
Гемосидериновое окрашивание преимущественно отсутствует или является слабым у животных во всех пролеченных группах, причем большинство животных в группах имеют оценки 0 или 1 (Фигура 6). Оценки в группах, получавших 3D6 в дозе 3 мг/кг, в обоих исследованиях значительно выше, это показывает, что у этих животных оценки по гемосидерину выше 0 более вероятны, чем у контрольных. В Исследовании А распределение оценок по гемосидериновому окрашиванию в группах TY11-15 и 266 аналогично, это показывает, что лечение антителом 266, по-видимому, не повышает гемосидериновые оценки. В Исследовании В показано, что частота микрокровоизлияний уменьшается под действием дозы. Не обнаружено никаких заметных различий между получавшей TY11-15 контрольной группой и группами, получавшими 0.1 мг/кг 3D6 и 0.3 мг/кг 3D6, это показывает, что низкие и промежуточные дозы, по-видимому, не повышают оценки по гемосидерину выше уровней фона. Они отличаются от группы, получавшей 3 мг/кг, которые значительно отличаются от контрольной группы. По сравнению с исследованием А более высокие оценки по гемосидериновой окраске в группе, получавшей 3 мг/кг, могут быть вызваны различными уровнями экспозиции с антителом во времени и слегка повышенными уровнями фона в группе, так как в контрольной группе оценки немного повышены.
Связь клиренса VAβ и микрокровоизлияния. Значительное очищение (клиренс) или предупреждение сосудистого амилоида наблюдают в группах, получавших 0.3 мг/кг и 3.0 мг/кг на обеих стадиях. Большинство животных в этих группах имеют оценки по окрашиванию на гемосидерин 0 или 1, что показывает, что в головном мозге большинства животных с пониженным VAβ либо имеется немного проявлений, либо отсутствуют проявления микрогеморрагии (микрокровоизлияния). Несколько примеров гемосидерин- негативных сосудов с необычно редким VAβ и эродированных на вид обнаружено во всех экспериментальных группах (например, Фигура 4b); это могут быть сосуды, в которых происходило очищение (клиренс) амилоида, но микрокровоизлияние отсутствует. Если окрашивание на гемосидерин наблюдается в группах животных, получавших 0.1 мг/кг 3D6 (Фигура 5d), оно обычно сопровождается пятнистым, околососудистым (периваскулярным) распространением амилоида, что, возможно, говорит о происходящем клиренсе. Эти околососудистые пятна амилоида встречаются на участках мечения связанного с сосудом гемосидерина в сосудах мягкой мозговой оболочки, паренхимы и сагиттального синуса. Окрашивание на гемосидерин в группе животных, получавших 0.3 мг/кг 3D6, также сопровождается пятнистым околососудистым распространением амилоида (Фигура 5е). Морфология амилоида аналогична морфологии амилоида у животных, получавших 0.1 мг/кг 3D6, но амилоид менее избыточен, а некоторые гемосидерин- позитивные сосуды очищены от амилоида. Как полное, так и частичное удаление амилоида наблюдается на участках ассоциированного с сосудом гемосидеринового окрашивания, включая мягкие мозговые оболочки и паренхиму. Напротив, в гемосидерин-позитивных сосудах животных, получавших 3 мг/кг 3D6, часто полностью отсутствует амилоид (Фигура 5f). Эта особенность совсем не наблюдается у непролеченных мышей и, по-видимому, иллюстрирует остаточный "отпечаток пальца" гемосидерина, который встречается в совокупности сосудов с полностью удаленным VAβ. Другой особенностью этих областей является присутствие клеток, которые содержат фагоцитированный гемосидерин (Фигура 5f). Эти макрофагоподобные клетки не являются иммунореактивными по отношению к Аβ и, следовательно, являются, по-видимому, отдельной популяцией из микроглии и макрофагов, которые удаляют ассоциированный с бляшками амилоид.
ОБСУЖДЕНИЕ
САА определяется как независимый фактор риска развития нарушения когнитивных функций и связан со значительными патологиями, такими как кровоизлияние и ишемическое поражение (см. S.M. Greenberg et al., Stroke 35, 2616-9 (2004)). В типичном случае прогрессирующая САА ведет к деструкции (разрушению) клеток гладких мышц в сосудистой сети оболочек мозга и паренхимы, предположительно, приводящей к тональной недостаточности и нарушению как перфузионной, так и околососудистой (периваскулярной) систем клиренса (см R. Christie et al., Am J Pathol 158, 1065-71 (2001), S.D. Preston et al., Neuropathol Appl Neurobiol 29, 106-17 (2003)).
В данной работе мы впервые даем доказательство почти полного клиренса или предупреждения VAβ под действием специфического к N-концу Аβ антитела (3D6) на модели длительного иммунотерапевтического лечения вводимым периферически антителом. Хотя для практического применения изобретения не требуется понимание механизма, по-видимому, эффект зависит от способности прочно связывать амилоид в отложениях, так как антитело к срединной области Аβ (266), которое связывает отложения Aβ in vivo значительно менее сильно (охотно), не проявляет никаких признаков очищения от или предупреждения VAβ. Хотя увеличивающееся количество данных наводит на мысль, что образование и состав сосудистого амилоида может отличаться от образования и состава бляшек в паренхиме (см. М.С.Herzig et al., Nat Neurosci 7, 954-60 (2004)), антитело 3D6 способно устранять (очищать от) обе формы и, следовательно, проявляет широкий спектр активности, уменьшающей количество амилоида.
В более ранних работах по изучению действия Аβ иммунотерапии и микрососудов головного мозга у АРР трансгенных мышей, сообщалось о повышенной частоте микрокровоизлияний (микрогеморрагии). Однако четкая причинно-следственная связь между VAβ и микрокровоизлиянием не была описана. В данном сообщении мы показываем, что большая часть отложений сосудистого амилоида выводится, не вызывая микрокровоизлияние, дополняют более ранние наблюдения, демонстрируя, что частота возникновения микрокровоизлияния связана с удалением (выведением) VAβ. Кроме того, ограниченные участки (площади) микрокровоизлияний ограничены архитектурными границами сосудистой системы, которые не включают паренхиму. Они ассоциируются либо с частичным, либо с полным удалением VAβ. Важно отметить, что микрокровоизлияние можно значительно уменьшить (ослабить, подавить), модулируя дозу антитела в пределах значений, при которых все еще эффективно очищаются (удаляются) амилоидные бляшки в паренхиме.
Racke и соавторы (см М.М. Racke et al., supra) сообщали о нечасто встречающемся микрокровоизлиянии у мышей PDAPP после значительно более высокой дозы 3D6 после 6-недельного лечения. Причем размер (объем) сообщаемого микрокровоизлияния также больше, чем во всех случаях, наблюдаемых в настоящем исследовании, что соответствует нашим данным о позитивной корреляции между дозой антитела и оценками по микрокровоизлияниям. Данные наших наблюдений соответствуют результатам, относящимся к неспособности 266 связывать амилоидные отложения или индуцировать микрокровоизлияния, и позволяют экстраполировать эти результаты, чтобы показать, что 266 не способен выводить VAβ.
У трансгенных АРР мышей с очень тяжелой VAβ патологией (мыши АРР23) церебральная геморрагия возникает спонтанно и, как и у больных людей, по-видимому, является результатом разрушения и утраты клеток гладких мышц и других деструктивных последствий Аβ-связанной токсичности (см. R. Christie et al., supra). Пассивная иммунизация АРР23 мышей с помощью антитела к N-концевой области Аβ сначала увеличивает частоту и степень (размер) фонового кровоизлияния (см. М. Pfeifer et al., Science 298, 1379 (2002)). Однако последующее изучение ультраструктуры не смогло обнаружить структурные различия сосудистых систем пролеченных и неиммунизированных контрольных животных (см. G.J. Burbach et al., supra). Таким образом, иммунотерапия не вызывает или не обостряет выраженное поражение сосудистой стенки, несмотря на тяжесть основной VAβ патологии. В настоящем исследовании, в отличие от более раннего сообщения, проводится изучение модели с небольшим спонтанным микрокровоизлиянием и при этом совместно метят Аβ и гемосидерин. Мы документально подтвердили локализацию выведения (удаления) Аβ и микрокровоизлия и нашли, что очаговое микрокровоизлияние произошло только в совокупности сосудов, которые очищаются от амилоида. Так как наш количественный метод не находит различия между частично очищенным и интактным VAβ, абсолютная степень клиренса, по-видимому, занижена.
Связь между клиренсом амилоида в паренхиме и сосудистым амилоидом не совсем понятна. Однако, недавние сообщения показывают, что между двумя патологиями, по-видимому, существует сомодулирующая связь, которую можно далее прояснить с точки зрения удаления бляшек (см. D.M. Wilcock et al, supra; M.C. Herzig et al., supra; J.A. Nicoll et al., J Neuropathol Exp Neurol 65, 1040-8 (2006)). Например, скрещивание мутантных АРР мышей с интенсивным VAβ с мышами с высокой бляшечной нагрузкой в паренхиме действительно снижает VAβ, это наводит на мысль, что бляшки могут предоставлять матрицу для Аβ, которые в ином случае отлагались бы на сосудистом ложе (см. M.C. Herzig et al., supra). С другой стороны, Wilcock и сотрудники (см. D.M. Wilcock et al, supra) обнаружили увеличение обоих VAβ в процессе удаления бляшек в паренхиме на модели пассивной иммунизации, это позволяет предположить, что вытеснение Аβ из паренхимы в сосудистый компартмент может происходить в ходе иммунотерапии.
В настоящем исследовании мы демонстрируем, что VAβ можно почти полностью очистить или предотвратить пассивной иммунизацией, которая сопровождается повышенной частотой микрокровоизлияний, которую можно уменьшить дозировкой антитела. У больных AD (болезнью Альцгеймера) и у АРР трансгенных мышиных моделей AD наблюдается повышенная частота микрокровоизлияний, ассоциированных с прогрессированием VAβ. Микрокровоизлияние по данному описанию теоретически можно объяснить увеличением VAβ во время клиренса бляшек в паренхиме, как описано у Wilcock (см. D.M. Wilcock et al, supra), что, как предполагалось, в настоящей модели будет носить транзиторный характер, так как в конечном счете VAβ выводится к концу исследования. Альтернативный вариант, в исследовании Wilcock использовалась другая мышиная модель и другое антитело, так что изменения VAβ могут отражать фундаментальную разницу механизмов в том, что касается эпитопов другого антитела и животных моделей. Во всяком случае, по-видимому, возможная кумулятивная частота микрогеморрагии (микрокровоизлияния) может на самом деле снижаться после лечения 3D6, если предположить, что удаление имеющегося VAR и предупреждение дальнейшего отложения оказывает профилактический эффект на последующую микрогеморрагию (микрокровоизлияние), ассоциированную с прогрессирующим VAβ. Другими словами, как связанный с лечением VAβ, так и VAβ-зависящее микрокровоизлияние могут быть временным явлением, которое перестает существовать после окончательного удаления VAβ. Все вместе эти результаты на преклинических моделях показывают, что механизмы, ассоциированные с образованием и клиренсом VAβ, заслуживают дальнейшего, более подробного изучения. Важно отметить, что недавнее исследование показало, что иммунизация полноразмерным Аβ пептидом мышей TG 2576 действительно улучшает надежность (целостность) гематоэнцефалического барьера (т.е. понижает проницаемость красителя Эванса голубого), это наводит на мысль, что все эти факторы на самом деле могут оказывать позитивное воздействие на сосудистую сеть (см. D.L. Dickstein et al., supra). Следует отметить, что иммунизация тотальным Ар пептидом приводит в результате к антителам, направленным главным образом на N-конец, аналогично эпитопу 3D6.
Около 80% больных AD поражены по меньшей мере слабой формой САА, с клинически вредными последствиями в виде кровоизлияния, дегенерации белого вещества, ишемии и воспаления (см. S.M. Greenberg et al., supra). Результаты нашего исследования дают доказательство того, что Аβ иммунотерапия теоретически может обращать или предупреждать прогрессирование значительной сосудистой патологии, лекарство для лечения которой в настоящее время отсутствует и еще более расширит потенциальные терапевтические преимущества анти-Аβ иммунотерапии.
ПРИМЕР 2
МАТЕРИАЛЫ И МЕТОДЫ
Изучают действие структурных изменений, индуцированных амилоидом, на гладкомышечные клетки (клетки гладких мышц, ГМК, SMC) и внеклеточный матрикс (ЕСМ) сосудов мышей PDAPP и действие пассивной иммунизации на SMC и ЕСМ сосудов мышей PDAPP.
Мышей иммунизируют еженедельно в течение либо 3, либо 9 месяцев, вводя 1 или 3 мг/кг антитела 3D6. Количественные иммуногистохимические анализы (IHC) высокого разрешения проводят на менингеальных сосудах сагиттального синуса, где отложения VAβ значительны (~70% пораженных сосудов). Мониторинг событий микрогеморрагии (микрокровоизлияний) проводят детекцией гемосидерина или иммуногистохимическим определением ферритина.
РЕЗУЛЬТАТЫ
В настоящем исследовании авторы демонстрируют, что изменения в сосудистой стенке постоянно, без исключений ассоциируются с VAβ, и они включают как дегенерацию (уменьшение толщины), так гиперплазию/гипертрофию (увеличение толщины) SCM и ЕСМ. Эти два противоположных явления часто наблюдаются в одном и том же сосуде и отсутствуют в сосудах животных дикого типа или PDAPP, в которых нет амилоида. В наибольшей степени истончение и утолщение SM приводит в результате к изменяющемуся в широких пределах сосудистому фенотипу у непролеченных мышей PDAPP.
Пассивная иммунотерапия восстанавливает рисунок толщины SCM и ЕСМ сосудов и уменьшает фенотипическую вариабельность в зависимости от дозы и времени, причем высокая доза 3D6 позволяет достичь контрольных уровней (дикого типа) за 9 месяцев (p>0.05). Хотя частота микрокровоизлияний повышается в группе, принимавшей антитело в течение 3 месяцев, она снижается до контрольных уровней через 9 месяцев лечения (p>0.05). Результаты наводят на мысль, что пассивная иммунотерапия способствует восстановлению менингеальных сосудов после вызванных амилоидом структурных изменений. Кроме того, связанное с лечением увеличение микрокровоизлияний является, по-видимому, преходящим событием, которое разрешается в процессе клиренса VAβ. Механизмы восстановления можно включать, удаляя VAβ, что в конечном счете приводит к возвращению к норме после сосудистой дисфункции.
Хотя вышеприведенное изобретение подробно описано с целью более четкого понимания, очевидно, что на практике могут применяться определенные модификации в объеме прилагаемой формулы изобретения. Все публикации и патентные документы, цитированные в данном описании, а также текст в Фигурах вводятся во всей полноте для любых целей в той же степени, как если бы каждый из этих материалов указывался индивидуально.