Результат интеллектуальной деятельности: УСОВЕРШЕНСТВОВАННЫЙ СПОСОБ ОЧИСТКИ ПРАВАСТАТИНА
Вид РИД
Изобретение
Изобретение относится к химико-фармацевтической промышленности, а именно к процессам биосинтеза, и касается способа очистки лекарственного препарата правастатина.
Правастатин оказывает выраженное антигиперлипидемическое действие: существенно снижает уровень холестерина липопротеидов низкой плотности, в разной степени повышает уровень липопротеидов высокой плотности. Применяется при гиперлипидемии без ИБС (снижение риска инфаркта миокарда), атеросклерозе и ИБС, включая инфаркт миокарда (для замедления прогрессирования атеросклероза и уменьшения вероятности повторного инфаркта).
Правастатин-(3R,5R)-3,5-дигидрокси-7-[(1S,2S,6S,8S,8aR)-6-гидрокси-2-метил-8-[[(2S)-2-метилбутаноил]-окси-]-1,2,6,7,8,8а-гексагидронафталеи-1ил]-гептановая кислота (натриевая соль)
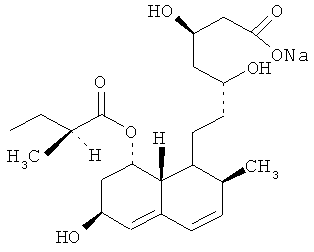
Правастатин. Брутто формула C23H36O7(Na) является биосинтетическим представителем первого поколения статинов, прочно вошедших в медицинскую практику.
1. Правастатин получают биоконверсией компактина, впервые выделенного в 1976 году группой японских исследователей. (Endo А., Kuroda М. and Tsujita Y. ML - 236B, ML - 236C, new inhibitors of cholesterogenesis produced by Penicillium citrinum. // J. Antiiot. - 1976. - 29. - P.1346-1348, Endo A., Kuroda M., Terahara A., Tsujita Y., Tamura C. Physiologically active substances and fermentative process for the same. // United States Patent No. 4,049,495; September, 20, 1977.
Правастатин получают в два этапа:
первый - биосинтез компактина с использованием гриба Penicillium citrinum (CAN 2185598, KP 20040052335 А).
второй - микробиологическое гидроксилирование натриевой соли компактина с помощью Streptomyces carbophilus) (RU 2235780 C2) (Схема 2).
Описаны несколько методов выделения и очистки правастатина.
Наиболее распространенный из них заключается в экстракции правастатина в органический растворитель из фильтрата культуральной жидкости и последующей его реэкстракции в воду. Эта операция, как правило, повторяется несколько раз для удаления большей части примесей. Затем органический растворитель упаривают в вакууме, и технический правастатин чистят с помощью метода колоночной хроматографии на силикагеле, элюаты упаривают в вакууме, а полученный продукт несколько раз перекристаллизовывают из смеси органических растворителей (например, US 4.346227, RU 2265665 C2, WO 2009/121870).
Второй популярный метод выделения базируется на использовании информации о том, что правастатин находится в культуралыюй жидкости в двух равновесных формах - кислоты и лактона.
После завершения биоконверсии правастатин экстрагируют из культуральной жидкости или из фильтрата, полученного после удаления мицелия.
Мицелий может быть удален из культуральной жидкости фильтрацией или центрифугированием. Перед экстракцией культуральную жидкость или ее фильтрат подкисляют минеральной кислотой до pH 3,5-3,7, затем проводят экстракцию правастатина сложными эфирами уксусной кислоты. Экстракт сушат, и завершают процесс образования лактона путем добавления к экстракту каталитических количеств трифторуксусной кислоты. После завершения процесса образования лактона последовательно промывают реакционную массу 5% водным раствором бикарбоната натрия, а затем водой, сушат и упаривают в вакууме досуха. Полученный технический продукт (лактон правастатина) чистят методом колоночной хроматографии на силикагеле, элюаты объединяют и упаривают в вакууме. Лактон правастатина растворяют в ацетоне и гидролизуют с эквивалентным количеством гидроокиси натрия. После завершения процесса образования натриевой соли правастатина ее высаживают из раствора избытком ацетона, отфильтровывают, сушат и перекристаллизовывают из смеси органических растворителей (например, US 4.346227, RU 2235780).
Большой интерес представляет также метод выделения и очистки правастатина через промежуточный продукт - его соль со вторичными аминами, содержащими алкил, циклоалкил-, арилалкил - заместители. Для этой цели используются нетоксичные амины, например диоктиламин, дициклогексиламин, дибензиламин и др.
После завершения биоконверсии правастатин экстрагируют из культуральной жидкости или из ее фильтрата органическим растворителем, затем добавляют амин в количестве 1,5 моля на моль правастатина, содержащегося в экстракте, и концентрируют экстракт в вакууме до объема, составляющего примерно 5% от исходного. К концентрату добавляют дополнительное количество амина (0,2 моля), при этом образуется кристаллическая соль правастатина, которую отфильтровывают и подвергают очистке (перекристаллизации, осветлению ее растворов активированным углем и др.). Очищенную аминную соль правастатина трансформируют в правастатин натриевую соль путем ее обработки гидроокисью натрия или алкоксидом натрия, предпочтительно этоксидом натрия(US 6.444452, WO 2009/068556).
Одним из вариантов этого метода является использование газообразного аммиака для получения аммонийных солей правастатина (US 6.444452).
Из обзора уровня техники видно, что биосинтез правастатина протекает неоднозначно. В результате образуется большое количество побочных продуктов (6-эпиправастатин, 3-а-правастатин и т.д.), которые соосаждаются вместе с целевым продуктом. Получение правастатина, пригодного для использования в качестве лекарственного средства, предполагает проведение многоступенчатой очистки, которая неизбежно влечет за собой значительные потери выхода целевого соединения (до 30-40%), в зависимости от выбранного метода, а также увеличивает время работы с правастатином, что крайне нежелательно, учитывая его высокую реакционноспособыость.
Наиболее сложной проблемой очистки правастатина от примесей является отделение правастатина от его стереоизомера 6-эпиправастатина, содержание которого жестко регламентировано международными требованиями к качеству препарата. (Европейская фармакопея №7 не более 0,3%). Биосинтез и компактина (предшественника правастатина), и правастатина не является стереоселективным и поэтому в культуральной жидкости может содержаться от 4 до 12% 6-эпиправастатина.
Известны способы получения и очистки правастатина от его стереоизомера (US 7425644 B2).
Описаны два варианта:
1. Очистка компактина от эпикомпактина и последующее его использование для биосинтеза правастатина.
2. Выделение и очистка натриевой соли правастатина.
Очистку компактина проводят с использованием хроматографии или путем перекристаллизации и далее используют очищенный продукт в процессе биосинтеза правастатина. В результате получают продукт высокой степени очистки от примеси 6-эпиправастатина.
Натриевую соль правастатина также очищают с использованием хроматографических методов, получая при этом высокоочищенный продукт.
Описанный метод является наиболее близким к предлагаемому изобретению.
Однако в прототипе, к сожалению, не указаны остальные показатели качества получаемого препарата (содержание основного вещества, сумма примесей и т.д.), без учета которых субстанция не может считаться фармацевтически чистой. Не указан также выход в расчете на количество правастатина в культуральной жидкости, какое количество эпиизомера содержит исходный компактин перед выделением из культуральной жидкости. Авторы описывают очистку уже выделенного и, по всей видимости, очищенного или частично очищенного препарата - т.е. его доочистку. Кроме этого, использование хроматографических методов очистки нежелательно для промышленных методов. При создании изобретения ставились следующие задачи:
- создать промышленный способ очистки лекарственного препарата правастатина;
- повысить качество целевого продукта с сохранением высокого выхода;
- упростить процесс.
Указанная цель достигается:
- фильтрованием нативного раствора правастатина через слой окиси алюминия, что позволяет не только удалить остатки балластных веществ, мешающих экстракции, но и, совершенно неожиданно, практически нацело освободиться от примеси 6-эпиправастатина. Фильтрация через слой окиси алюминия позволяет не только очистить правастатин, но и существенно сократить время на его обработку, и тем самым уменьшить вероятность накопления продуктов деструкции целевого соединения под действием света и атмосферного кислорода. Кроме того, этот прием значительно проще в практическом применении, чем, например, колоночная хроматография.
- путем использования при получении целевого соединения промежуточного продукта - аммонийной соли, получаемой с помощью 25% раствора аммиака, с дальнейшим переводом ее в натриевую соль.
Для достижения указанной цели нами были детально изучены условия работы с правастатином на каждом из этапов очистки. Подобраны экспериментальным путем значения pH растворов препарата, позволяющие минимизировать появление продуктов деструкции.
На первом этапе очистки проводится экстракция правастатина из нативного раствора (образовавшегося после центрифугирования культуральной жидкости) органическим растворителем, при этом процесс затрудняют остатки белков, находящиеся в фильтрате. Для освобождения от них, перед проведением процесса экстракции, можно использовать ультрафильтрацию, но мы решили упростить и удешевить процесс путем фильтрации нативного раствора через слой окиси алюминия. Для этой цели использовали окись алюминия основную (рН 10), имеющую активность, соответствующую 8% влаги. В результате удалось не только удалить остатки балластных веществ, мешавших экстракции, но, неожиданно, практически совсем освободиться от примеси 6-эпиправастатина. Причем следует отметить, что использование любого другого типа окиси с другой активностью оказывает обратный эффект, т.е. может привести даже к увеличению количества 6-эпиправастатина.
Для получения субстанции фармацевтического качества мы экспериментально проверили ряд методов очистки правастатина от неорганических солей и пришли к выводу, что наилучшие результаты получаются при использовании метода очистки через аммонийную соль с последующим ее переводом в натриевую соль. Метод позволяет наиболее полно освободиться от побочных продуктов биоконверсии и метаболитических продуктов, содержащихся в культуральной жидкости и перешедших в нативный раствор. Мы провели очистку правастатина через аммонийную соль, которую получали, используя водный раствор аммиака (25%), что позволяло значительно удешевить процесс и одновременно упростить, так как, используя раствор аммиака, мы избавлялись от необходимости чистить продукт от неорганических солей. После перевода аммонийной соли в натриевую мы стабильно получали целевой продукт фармацевтического качества с высоким выходом.
Предлагаемый способ осуществляется следующим образом.
1. Отделение мицелия от культуральной жидкости центрифугированием с получением нативного раствора (содержание 6-эпиправастатина - 7% - ВЭЖХ).
2. Фильтрация нативного раствора через слой окиси алюминия (содержание 6-эпиправастатина (0,01%).
3. Экстракция правастатин кислоты из нативного раствора.
4. Получение и выделение аммонийной соли правастатина.
5. Перевод аммонийной соли в натриевую с предварительным осветлением раствора аммонийной соли правастатина.
Изобретение иллюстрируется следующими примерами.
Пример 1
500 мл культуральной жидкости с концентрацией правастатина 7,4 г/л и содержанием 6-эпиправастатина 7% от массы правастатина подвергают центрифугированию для отделения мицелия и получения нативного раствора. Затем нативный раствор, имеющий pH 6,6, фильтруют через слой окиси алюминия (92,5 г основной окиси алюминия с pH 10 и влажностью 8%) и получают нативный раствор, содержащий 0.01% 6-эпиправастатина.
Полученный нативный раствор подкисляют до pH 3,5-3,7 с помощью 5% раствора соляной кислоты, далее приливают 200 мл этилацетата и экстрагируют правастатин кислоту. Экстракт промывают 60 мл воды, сушат безводным сульфатом натрия и упаривают в вакууме до объема в 50 мл. К полученному концентрату добавляют 3 мл 25% водного раствора аммиака, тщательно перемешивают и разделяют слои. Первый реэкстракт, содержащий аммонийную соль правастатина, отделяют, к оставшемуся в делительной воронке этилацетату добавляют 2 мл воды, содержащей 0,05 мл раствора аммиака (pH 9-10), перемешивают 10 минут, слои разделяют и нижний водный слой (второй реэкстракт) присоединяют к первому. К объединенным реэкстрактам правастатина аммонийной соли объемом 5-6 мл постепенно, в течение 10 минут, при перемешивании добавляют 60 мл ацетона, полученную суспензию охлаждают до 10-15°C и продолжают перемешивание в течение 2 часов. Кристаллический осадок отфильтровывают, промывают на фильтре охлажденным ацетоном, сушат и получают 2,98 г правастатина аммонийной соли в виде белого с желтым оттенком кристаллического порошка. Содержание основного вещества 99,2% (норма не менее 97%),содержание 6-эпиправастатина 0.01% (норма не более 0,3%), сумма примесей 0.5% (норма не более 0.6%).
2,98 г правастатина аммонийной соли растворяют в 35 мл 70% водного раствора изопропилового спирта, добавляют 0,05 мл 25% аммиака и 1,5 г активированного угля и перемешивают 30 минут. Уголь отфильтровывают, промывают 70% изопропанолом. Изопропанольный раствор упаривают в вакууме досуха, полученный остаток растворяют в 6 мл раствора 0,14 г гидроксида натрия и добавляют при перемешивании 50 мл ацетона. Перемешивание продолжают в течение 30 минут, затем осадок отфильтровывают, сушат и получают 2,8 г правастатина натриевой соли в виде белого кристаллического порошка. Содержание основного вещества 99,3%, (норма не менее 97%), содержание 6-эпиправастатина 0.01%) (норма не более 0,3%), сумма примесей 0,4% (норма не более 0.6%).
Пример 2
500 мл культуральной жидкости с концентрацией правастатина 7,4 г/л и содержанием 6-эпиправастатина 7% от массы правастатина подвергают центрифугированию для отделения мицелия и получения нативного раствора. Затем нативный раствор, имеющий pH 6,6, фильтруют через слой окиси алюминия (111 г основной окиси алюминия с pH 10 и влажностью 8%) и получают раствор, содержащий 0,01% 6-эпиправастатина.
Далее процесс ведут аналогично описанному в примере 1.
Получают 2,6 г натриевой соли правастатина в виде белого кристаллического порошка. Содержание основного вещества 99.8%, (норма не менее 97%), содержание 6-эпиправастатина 0.01% (норма не более 0,3%), сумма примесей 0.35% (норма не более 0,6%).

