Результат интеллектуальной деятельности: СПОСОБ КОРРЕКЦИИ ОКИСЛИТЕЛЬНОГО СТРЕССА И НАРУШЕНИЯ NO ПРОДУЦИРУЮЩЕЙ ФУНКЦИИ ЭНДОТЕЛИЯ ПРИ СОСУДИСТЫХ ОСЛОЖНЕНИЯХ САХАРНОГО ДИАБЕТА В ЭКСПЕРИМЕНТЕ
Вид РИД
Изобретение
Изобретение относится к фармацевтической промышленности и медицине, в частности к эндокринологии, и касается лечения ангиопатии и патологии внутренних органов при экспериментальном аллоксановом диабете.
Исследование биохимических показателей гемодинамических сосудистых осложнений сахарного диабета остается одной из наиболее актуальных проблем современной медико-биологической науки. Среди нескольких гипотез, объясняющих патогенез сосудистых диабетических поражений, особое место занимает развитие окислительного стресса, вследствие повышенной генерации активных метаболитов кислорода (АМК), и нарушения антиоксидантной защиты (АОЗ) клеток. Фактором риска в условиях окислительного стресса становится нарушение функции эндотелия, основными механизмами которой могут быть изменения активности и/или экспрессии эндотелиальной NO-синтазы (NOS-3), сниженный синтез NO из L-аргинина, чувствительность гладкомышечных клеток (ГМК) к NO или усиленная его деградация за счет взаимодействия с активными формами кислорода (АФК), включая супероксид-анион, а также другими продуктами ПОЛ.
Учитывая важную роль в развитии сахарного диабета (СД) окислительного стресса, и нарушения NO-продуцирующей функции эндотелия, можно полагать, что необходимой составляющей патогенетической терапии диабетических ангиопатии является новый методологический подход, основанный на применении препарата, обладающего антиоксидантными свойствами и способностью нормализовать метаболизм NO (Зенина Т.А., Силкина И.В., Серединин С.Б., Мирзоян Р.С. Экспериментальная и клиническая фармакологии. - 2006. - №4. - С.45-47; Balasanyan M.G., Kanayan A.S., Jhopchayan A.V. Acta Physiol. Hung. 2002. vol.89, №1-3, p.198).
По данным литературы селективный анксиолитик афобазол, синтезированный в ГУНИИ фармакологии им. В.В.Закусова РАМН, обладает способностью позитивно модулировать продукцию NO, ингибируя индуцибельную изоформу NO-синтазы и стимулируя конститутивную эндотелиальную NO-синтазу (NOS-3) и одновременно обладает антиоксидантными свойствами (Середенин С.Б., Мелкумян Д.С., Вальдман Е.А. Влияние афобазола на содержание BDNF в структурах мозга инбредных мышей с различным фенотипом эмоционально-стрессовой реакции. Экспериментальная и клиническая фармакология. 2006. - Т.69. - №3. - С.3-6). Однако препарат афобазол ранее не использовали для коррекции эндотелиальной дисфункции при сосудистых осложнениях нейроангиопатиях, вызванных экспериментальным сахарным диабетом.
Весьма актуальным является исследование в эксперименте у крыс с сахарным диабетом типа 1 показателей активности ПОЛ, антиокислительной системы (АОС), концентрации суммарных метаболитов оксида азота (NOx), роли уровня экспрессии эндотелиальной NO-синтазы (NOS-3), липидного спектра крови и на основе этих фундаментальных данных разработка возможного пути коррекции нарушений с применением афобазола при экспериментальном сахарном диабете (ЭСД) у крыс. Вместе с тем следует отметить, что в доступной литературе отсутствуют данные о биохимических маркерах нарушения функции эндотелия и изучение влияния афобазола на метаболические показатели эндотелиальной дисфункции при экспериментальном сахарном диабете.
Известен способ коррекции эндотелиальной дисфункции при сосудистых осложнениях аллоксанового диабета в эксперименте, включающий использование в качестве лекарственного препарата убихинон-коэнзим Q10, который вводят в количестве 0,11 мкл/100 г живого веса (см. патент РФ №2455702, МПК9 G09D 23/28, G01N 33/48, A61K 31/122, A61P 5/48, A61P 9/08, опубл. 10.07.2012 г.).
Недостатком данного способа является то, что не приводились данные экспрессии NOS-3 и не исследовалось участие L-аргинина - субстрата синтеза NO и стимулятора экспрессии NOS-3, а также влияние ингибитора энзима - L-NAME у крыс с экспериментальным сахарным диабетом. На фоне L-аргинина и L-NAME и их комбинации с коэнзимом Q10 не исследовались показатели системы ПОЛ-АОС и характер изменений гемодинамики.
Наиболее близким к заявляемому техническому решению является способ лечения нефроангиопатии при аллоксановом диабете у экспериментальных животных, включающий предварительное одноразовое введение в организм крысы натощак внутрибрюшинно 5% водного раствора аллоксана в дозе 15 мг/кг веса животного, с последующим введением лекарственного препарата (см. патент РФ №2372898, МПК9 A61K 31/197, A61P 13/12, G09B 23/28, опубл. 20.11.2009 г.).
Недостатками прототипа являются отсутствие исследований по изучению влияния донора NO - L-аргинина и ингибитора энзима L-NAME на эти показатели, тогда как исследование этих веществ позволило бы выяснить новые звенья патогенеза сосудистых осложнений участие субстрата фермента L-аргинина и его ингибитора - L-NAME. Более того не представлены сведения о нарушении метаболизма холестерина и его влиянии на биодоступность оксида азота. Во всех этих условиях эксперимента отсутствуют данные о характере гемодинамических нарушений.
Технический результат заключается в определении дозы афобазола, повышении точности и достоверности коррекции экспериментального сахарного диабета по показателям окислительного стресса, NO-продуцирующей функции эндотелия и биодоступности NO.
Технический результат достигается тем, что в способе коррекции окислительного стресса и нарушения NO-продуцирующей функции эндотелия при сосудистых осложнениях сахарного диабета в эксперименте, включающем предварительное одноразовое введение в организм крысы натощак внутрибрюшинно 5% водного раствора аллоксана в дозе 15 мг/кг веса животного, с последующим введением лекарственного препарата, согласно изобретению, в качестве лекарственного препарата используют афобазол, который вводят в условиях окислительного стресса после увеличения уровня глюкозы в крови крысы, по крайней мере, в два раза, подкожно в количестве 10 мг/кг живого веса один раз в сутки в течение 30 дней на фоне ежедневного введения L-аргинина в дозе 10 мг/кг веса животного или на фоне NG-нитроаргинин метилового эфира (L-NAME)-ингибитора фермента NOS-3 в дозе 25 мг/кг веса животного.
Данный способ позволит вскрыть новые звенья патогенеза ангиопатии при хроническом аллоксановом диабете, предложить лечение, повышающее эффективность, воспроизводимость, удобство, доступность, безопасность и невысокую стоимость для проведения эксперимента на животных.
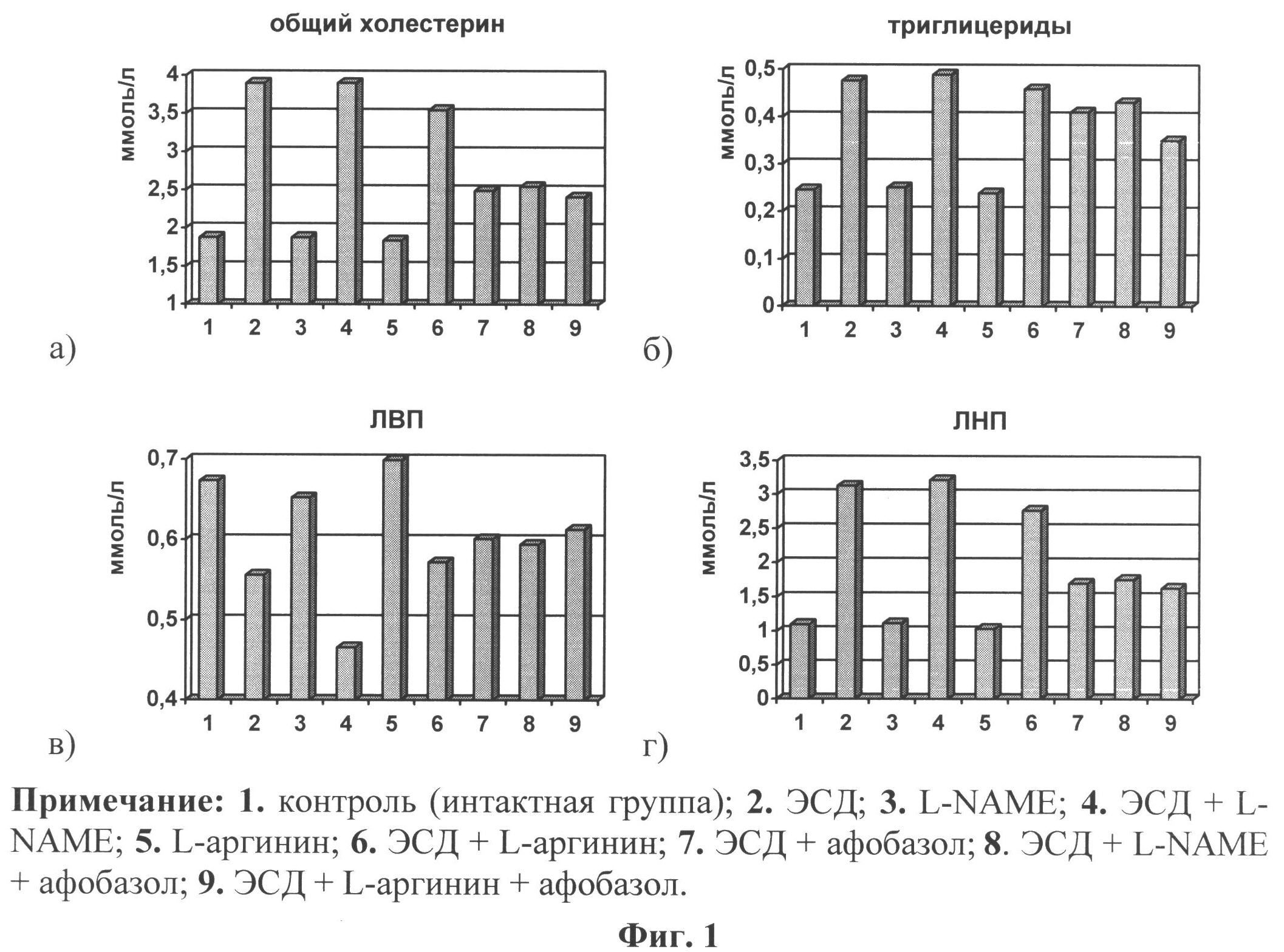
Сущность заявляемого способа подтверждена графически и таблицами: где на фиг.1 (а-г) представлены изменения концентрации общего холестерина и его содержание в липопротеинах различной плотности на фоне корригирующей терапии афобазолом при ЭСД.
Таблица №1. Изменение уровня экспрессии NOS-3 под влиянием афобазола и его комбинации с L-аргинином и L-NAME.
Таблица №2. Изменения системы ПОЛ-АОС на фоне ингибитора фермента NOS-3 - NG-нитроаргинин метилового эфира (L-NAME).
Таблица №3. Изменения системы ПОЛ-АОС на фоне субстрата L-аргинина.
Таблицы №4, 5, 6. Динамика изменения показателей гемодинамики в норме, при экспериментальном сахарном диабете и на фоне корригирующей терапии с афобазолом на фоне субстрата L-аргинина и ингибитора фермента NOS-3 - L-NAME.
Способ коррекции окислительного стресса и нарушения NO-продуцирующей функции эндотелия при сосудистых осложнениях сахарного диабета в эксперименте осуществляли следующим образом.
Для поражения инсулиногенных β-клеток островков Лангерганса экспериментальный сахарный диабет (аллоксановый) вызывали путем внутрибрюшинного введения крысам 5% водного раствора аллоксана (синтезированного в лаборатории отдела патобиохимии ФГБУН ИБМИ ВНЦ РАН и РСО-А) в дозе 15 мг/кг веса животного натощак, на фоне 24-48 часового голодания при свободном доступе к воде. Через 48-72 часа натощак забирали кровь из хвоста крысы (микроколичество) и определяли уровень глюкозы глюкозооксидазным методом (тест-наборы). Модель считали состоявшейся при повышении глюкозы в крови в 2 раза. Для коррекции вводили афобазол подкожно в количестве 10 мг/кг веса животного один раз в сутки в течение 30 дней. Для выяснения вопроса о влиянии афобазола на доступность субстрата L-аргинина для эндотелиальной NO-синтазы (NOS-3) вводили афобазол на фоне ежедневного введения L-аргинина в дозе 10 мг/кг веса животного. В другом варианте экспериментов вводили афобазол на фоне NG-нитроаргинин метилового эфира (L-NAME) - ингибитора фермента NOS-3 в дозе 25 мг/кг веса животного, определяли показатели антиоксидантной системы, липидного спектра крови, состояние микро- и макрогемодинамики, а также концентрацию суммарных метаболитов NO и экспрессию эндотелиальной NO-синтазы (eNOS) в условиях окислительного стресса, и по изменению этих показателей судили о наличии эндотелиальной дисфункции при сосудистых осложнениях сахарного диабета у животных.
По истечении срока эксперимента изучали перфузию в различных точках локации тканей (жидкостный обмен) прозвучиванием датчиком 10 МГц, работающим по принципу «слепого» допплера у наркотизированных животных. Затем крысы забивались под тиопенталовым наркозом; забирали кровь из сердца с использованием в качестве антикоагулянта 2,8% раствора ЭДТА для определения концентрации малонового диальдегида (МДА) и сыворотку для определения активности СОД, каталазы, церулоплазмина и NO.
Уровень экспрессии NOS-3 в эндотелии аорты определяли методом Метельской В.А., Гумановой Н.Г., Литинской О.А. (Оксид азота: роль в регуляции биологических функций, методы определения в крови человека // Лабораторная медицина. - 2005. - №7. - С.19-24). Аорты извлекали, промывали физиологическим раствором и помещали в пластиковые пробирки, которые хранили в жидком азоте, после чего аорты обрабатывали соответственно методике. Полосу, соответствующую NOS-3, детектировали в соответствии с ее молекулярной массой, устанавливаемой по сравнению с белками-метчиками. Пленку высушивали на воздухе, полосы сканировали и рассчитывали площадь под кривой с использованием программы Total Lab. Результаты представляли в условных единицах как отношение интенсивности полосы X к интенсивности полосы, принятой за контроль на каждой пленке. Аорта экспериментальных крыс подвергалась гистологическому исследованию микроскопически. Количественную оценку гистологических изменений структуры проводили по методу Автандилова с помощью цифрового фотоаппарата "Nikon", совмещенного с микроскопом.
Пример.
Исследование проводили в 9 группах крыс-самцов линии Вистар:
1-я группа - контрольная в количестве 20 голов;
2-я группа - крысы с экспериментальным сахарным диабетом в количестве 30 голов;
3-я опытная группа - интактные крысы+L-аргинин в дозе 10 мг/кг в течение 30 дней в количестве 15 голов;
4-я опытная группа - интактные крысы+L-NAME в дозе 25 мг/кг в течение 30 дней в количестве 15 голов;
5-я опытная группа - крысы с ЭСД+L-аргинин в дозе 10 мг/кг в течение 30 дней в количестве 20 голов;
6-я опытная группа - крысы с ЭСД+L-NAME в дозе 25 мг/кг в течение 30 дней в количестве 20 голов;
7-я опытная группа - крысы с ЭСД+афобазол в дозе 10 мг/кг веса животного в количестве 30 голов;
8-я опытная группа - крысы с ЭСД+афобазол в дозе 10 мг/кг веса животного+L-аргинин 10 мг/кг в течение 30 дней в количестве 20 голов;
9-я опытная группа - крысы с ЭСД+афобазол в дозе 10 мг/кг веса животного+L-NAME 25 мг/кг в течение 30 дней в количестве 20 голов.
Экспериментальный сахарный диабет, характеризующийся инсулиновой недостаточностью, вызывали у крыс опытной группы путем внутрибрюшинного введения 5% водного раствора аллокеана в дозе 15 мг/кг массы тела натощак на фоне 24-48-часового голодания при свободном доступе к воде. Через 48-72 часа натощак забирали кровь из хвоста (микроколичество) и определяли уровень глюкозы глюкозооксидазным методом (тест наборы) и при повышении глюкозы в крови, по крайней мере, в 2 раза.
Для коррекции нарушений ПОЛ, АОС, липидного спектра крови, микро- и макрогемодинамики а также концентрации суммарных метаболитов NO и экспрессии эндотелиальной NO-синтазы (NOS-3) в условиях окислительного стресса вводили крысам опытной группы с экспериментальным сахарным диабетом в течение месяца подкожно афобазол в дозе 10 мг/кг массы тела.
По истечении периода введения исследовали показатели перекисного окисления липидов, антиоксидантной системы, липидного спектра крови, состояние микро- и макрогемодинамики, а также концентрацию суммарных метаболитов NO и экспрессию эндотелиальной NO-синтазы (NOS-3) в условиях окислительного стресса.
Результаты свидетельствуют о существенном снижении концентрации МДА в крови под влиянием афобазола у диабетических крыс (с 8,65±0,031 нмоль/мл до 7,26±0,061 нмоль/мл (p<0,001) (см. строка 1, таблица 2). Анализ активности АОС показал достоверное возрастание активности СОД в сыворотке крови и эритроцитах (соответственно с 1,45±0,044 усл.ед. до 1,78±0,148 усл.ед. (p<0,05) и с 64,4±1,53 ед.акт. до 74,6±1,55 ед.акт. (p<0,001)) (см. строка 4, таблица 2), а повышенные данные каталазы и церулоплазмина достоверно снизились. Вместе с тем следует отметить, что активность каталазы осталась повышенной, что вероятно является проявлением клеточной компенсаторной реакции. В группе крыс на фоне лечения афобазолом статистически достоверно повысилась концентрация суммарных метаболитов NO в сыворотке крови с 32,54±1,56 мкмоль до 48,7±0,844 мкмоль (p<0,001) (см. строка 2, таблица 2). Для выяснения эффективности действия афобазола на процессы ПОЛ и активность ферментов АОЗ провели корреляционный анализ. Полученные данные в этой группе диабетических крыс, получавших лечение афобазолом, показали наличие прямой значимой корреляционной зависимости между концентрацией МДА и активностью каталазы (r=+0,60), и концентрацией церулоплазмина (r=+0,58) и обратной связи между снижением концентрации МДА и повышенной активности СОД в сыворотке крови (r=-0,61). Происходило повышение концентрации суммарных метаболитов NO и корреляционный анализ показал наличие отрицательной связи с МДА (r=-0,57).
Таким образом, афобазол угнетает ПОЛ, коррегирует взаимоотношения между ферментами АОЗ и способствует повышению концентрации суммарных метаболитов NO, хотя уровень их содержания не достигает контрольных значений. Полученные данные демонстрируют мембранопротекторные свойства афобазола in vivo при СД в эксперименте. Наши исследования впервые показали, что in vivo при СД у крыс афобазол, угнетая СРО и восстанавливая АОЗ, способствует повышению экспрессии eNOS и соответственно концентрации NO.
Ряд факторов влияют на экспрессию NOS-3 и эффективность образования NO:
- доступность субстрата L-аргинина
- наличие эндогенного ингибитора фермента NOS-3 - АДМА.
- состояние коферментов: НАДФН2, ТТБП и т.д.
- влияние окисленных ЛНП, вызывающих атерогенные изменения сосудистой стенки.
Были исследованы изменения показателей обмена ХС: концентрации ОХС, ХС ЛВП, ХС ЛНП, ТАГ на фоне лечения афобазолом у крыс с СД. Анализ содержания общего ХС в сыворотке крови и его распределения в липопротеинах различной плотности показал, что на фоне лечения происходит статистически достоверное снижение концентрации ОХС с 3,896±0,161 ммоль/л до 2,493±0,04 ммоль/л, p<0,001, повышение ХС ЛВП с 0,556±0,012 ммоль/л до 0,601±0,003 ммоль/л, p<0,01 и значительное снижение в ЛНП с 3,124±0,15 ммоль/л до 1,706±0,044 ммоль/л, p<0,001 (см. фиг.1). Одновременно снижалась и концентрация ТАГ в сыворотке крови с 0,476±0,018 ммоль/л до 0,41±0,019 ммоль/л, p<0,02 (см. фиг.1).
Для выяснения взаимосвязи между концентрацией NO и липопротеиновым спектром сыворотки крови провели корреляционный анализ и выявили наличие отрицательной связи между этими показателями (r=-0,69; r=-0,67; r=-0,64; r=-0,71). Следовательно, снижение ОХС и ХС ЛНП в условиях угнетения ПОЛ способствовало повышению биодоступности NO. Для выяснения вопроса о влиянии афобазола на доступность субстрата L-аргинина для NOS-3 в другом варианте исследований вводили афобазол на фоне ежедневного введения L-аргинина в дозе 10 мг/кг веса тела в течение 3-х недель диабетическим крысам. По окончании эксперимента определяли в сыворотке крови концентрацию суммарных метаболитов NO и показатели окислительного стресса. Полученные результаты продемонстрировали повышение концентрации NO с 32,54±1,56 мкмоль при ЭСД до 42,27±0,893 мкмоль (p<0,01) при ЭСД+аргинин и до 50,54±0,472 (p<0,001) (см. строка 2, таблица 3) на фоне введения аргинина с афобазолом в этих вариантах исследований. Сопоставительный анализ данных у крыс с ЭСД на фоне L-аргинина и комбинации L-аргинина с афобазолом показал более существенное снижение концентрации МДА и повышение концентрации NO на фоне комбинированного введения L-аргинина и афобазола (см. таблица 3).
Эти данные подтверждают, что афобазол повышает биодоступность субстрата L-аргинина к своему ферменту и соответственно концентрацию суммарных метаболитов NO. Можно полагать, что афобазол в комбинации с L-аргинином оказывает влияние и на сам фермент NOS-3. Для выяснения этого вопроса мы исследовали экспрессию NOS-3 на фоне комбинированного введения L-аргинина и афобазола. Данные показали повышение уровня экспрессии NOS-3 на фоне комбинированного применения L-аргинина и афобазола.
В другом варианте экспериментов вводили афобазол на фоне L-NAME-ингибитора фермента NOS-3, контролем служили исследования на фоне введения одного ингибитора L-NAME. У интактных и диабетических крыс в этих вариантах определили концентрацию МДА, NO и экспрессию NOS-3. Данные показали, что концентрация NO значительно снизилась через 3 недели после введения L-NAME с 51,069±0,50 мкмоль до 33,13±0,595 мкмоль (p<0,001) (см. строка 2, таблица 2), причиной чему могло послужить угнетение экспрессии eNOS. В другом варианте исследований при введении афобазола на фоне L-NAME концентрация суммарных метаболитов NO повысилась с 30,74±0,567 мкмоль до 40,23±0,62 мкмоль, p<0,001, тогда как уровень МДА в крови снизился с 9,186±0,009 нмоль/мл до 8,01±0,053 нмоль/мл, p<0,001 (см. строки 1, 2, таблица 2).
Для подтверждения участия NOS-3 исследовали уровень экспрессии NO продуцирующего фермента в экстрактах аорты у диабетических крыс (см. таблица 1). Экспериментальные данные подтвердили впервые, что анксиолитик - афобазол, угнетая ПОЛ, повышает концентрацию NO и несомненно оказывает стимулирующее влияние на экспрессию NOS-3, тогда как на фоне L-NAME уровень экспрессии NOS-3 в экстрактах аорты был значительно снижен.
Коррекция дисфункции эндотелия, показателей окислительного стресса и метаболизма NO, сопровождалась повышением средней и систолической скоростей кровотока в сосудах микроциркуляторного русла, снижением плотности сосудистой стенки - индекса Гослинга (PI) и удельного периферического сосудистого сопротивления - индекса Пурсело (RI) (см. таблицы 5, 6).
Эти гемодинамические изменения свидетельствуют о повышении процессов перфузии, обусловленные снижением сосудистого сопротивления - реографического индекса и повышением средней и систолической скоростей кровотока на фоне введения афобазола. Для подтверждения эффективности влияния афобазола на гемодинамику в микроциркуляторном русле провели корреляционный анализ между концентрацией NO и скоростью кровотока соответственно средней, систолической и диастолической (r=+0,51; r=+0,56; r=+0,57; p<0,001). Из таблицы видно, что между повышением концентрации NO и процессов микроциркуляции выявлена положительная сильная корреляционная связь.
Исследования кровотока в магистральных артериальных сосудах (БА) показали снижение средней (М), систолической (S) и диастолической (D) скоростей кровотока на фоне введения афобазола (см. таблицы 4, 5, 6). Характер изменений гемодинамики в почечных артериях показал аналогичную картину, характеризующуюся снижением средней (М) и систолической (S) скоростей кровотока на фоне лечения афобазолом. Данные реографических показателей выявили повышение индекса Гослинга (PI), следовательно, упругоэластических свойств (плотности) сосудистой стенки, а также индекса Пурсело (RI), отражающего регионарное периферическое сосудистое сопротивление на фоне афобазола. В HПB происходит снижение средней (М), систолической (S) и диастолической (D) скоростей кровотока, а также понижение реографических индексов: PI - индекса Гослинга и RI - индекса Пурсело (см. таблицы 5, 6). Эти данные свидетельствуют о том, что афобазол, оказывая антиоксидантное действие, повышает концентрацию суммарных метаболитов NO и уровень экспрессии NO - продуцирующего фермента - eNOS в эндотелии сосудов. Эти изменения метаболизма NO способствуют восстановлению функции эндотелия и снижают уровень гиперперфузии в магистральных артериальных сосудах. В противоположность этому восстановление функции регуляторов тонуса сосудов в микроциркуляторном звене способствует увеличению перфузии - жидкостного обмена.
Использование предлагаемого способа позволит по сравнению с прототипом повысить эффективность лечения, для коррекции экспериментального сахарного диабета в условиях окислительного стресса, что характеризует его влияние на основное патогенетическое звено развивающейся ангиопатии при аллоксановом диабете у экспериментальных животных, повысить воспроизводимость, удобство, доступность, безопасность, и низкую стоимость проведения эксперимента и эффективность на крысах с экспериментальным сахарным диабетом.
|
|
|
|
|
|