Результат интеллектуальной деятельности: РАЦИОНАЛЬНО РАЗРАБОТАННЫЕ СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК
Вид РИД
Изобретение
Данная заявка испрашивает приоритет согласно предварительной патентной заявке США №60/858289 от 8 ноября 2006 г., содержание которой полностью включено в данное описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0001] Изобретение относится к способам рационального создания среды для культивирования клеток, предназначенной для клеточных культур, применяемых, например, для получения полипептидов; к среде для культивирования клеток, полученной указанными способами; к способам получения в больших количествах полипептида, представляющего интерес, например антитела, с использованием указанной среды; к полипептидам, полученным с использованием способов и среды, описанных в данной заявке; а также к фармацевтическим составам, содержащим такие полипептиды. Изобретение является особенно полезным для крупномасштабного производства клеточных культур. Способы и составы, описанные здесь, особенно полезны для получения значительных количеств полипептидов в порционных, подпитываемых и перфузионных культурах клеток животных.
УРОВЕНЬ ТЕХНИКИ
[0002] Большую часть биотехнологических продуктов, серийно выпускаемых или находящихся только в стадии разработки, составляют белковые лекарственные препараты, поэтому существует потребность в получении таких полипептидов в клеточных культурах. Кроме того, для получения многих форм полипептидных лекарственных препаратов (в частности, гликозилированных белков или образованных гибридомами моноклональных антител (моноклональные антитела, MAbs)) часто требуется клеточный механизм клеток животных (в отличие, например, от клеток бактерий). Вследствие этого существует большая потребность в оптимизации продуцирования таких полипептидов в клеточных культурах, и в особенности - в клеточных культурах животных.
[0003] По сравнению с культурами клеток бактерий культуры клеток животных имеют более низкие скорости продуцирования и более низкий выход. Поэтому значительное количество исследований сфокусировано на определении условий получения культуры клеток животных, которые оптимизируют выход полипептида, т.е. условий, которые поддерживают высокую плотность клеток и высокий титр. Так, например, установлено, что поддержание концентраций глюкозы в среде для культивирования клеток на низком уровне и культивирование клеток в фазе продуцирования при осмотической концентрации примерно от 400 до 600 мОсм увеличивает продуцирование рекомбинантных белков культурой клеток животных, при этом культивацию во всех фазах проводят также при определенной концентрации глутамина (предпочтительно - примерно от 0.2 до примерно 2 мМ). Установлено также, что ограниченная подача глюкозы в культуры клеток животных в процессах с подпиткой регулирует продуцирование лактата, при этом постоянного потока глюкозы не требуется. Кроме того, известно, что модификация суммарной кумулятивной концентрации аминокислот, концентрации отдельных аминокислот и отношения содержания одних аминокислот к содержанию других (например, глутамина к аспарагину) и к суммарному содержанию аминокислот (например, глутамина к суммарному содержанию аминокислот) в среде культуры клеток для крупномасштабного производства может приводить к существенному усовершенствованию крупномасштабного производства полипептидов.
[0004] Традиционно исследования среды для культур клеток животных проводят по трем направлениям: 1) обогащение компонентов исходной среды и повышение частоты подпитки культуры; 2) применение многофакторного плана к средам различного состава и с различными концентрациями компонентов и 3) анализ содержания в кондиционированной (отработанной) среде аминокислот, витаминов и других компонентов и добавление тех компонентов, которые содержатся в недостаточном количестве или израсходованы. В качестве показателей оптимизации в этих способах обычно используют плотность клеток, жизнеспособность и титр.
[0005] Однако вышеуказанные способы позволяют лишь косвенно определить требования к питанию клеток исходя из конечного результата, т.е. плотности клеток, жизнеспособности и титра, не выясняя и не удовлетворяя фактических требований к питанию клеток для оптимального продуцирования белков.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0006] Настоящее изобретение обеспечивает способы рационального создания среды для культивирования клеток, например культуры клеток для крупномасштабного производства для применения, например для получения культуры клеток для крупномасштабного продуцирования полипептидов; к среде для культивирования клеток, например культуры клеток для крупномасштабного производства, полученной указанными способами; к способам получения в больших количествах полипептида, представляющего интерес, например антитела, с использованием указанной среды, к полипептидам, полученным при помощи указанных способов и описанной здесь среды, а также к фармацевтическим составам, содержащим эти полипептиды. Такие способы и составы полезны для культивирования, например периодического культивирования, культивирования в подпитываемых культурах и перфузионного культивирования клеток. Эти способы и составы особенно полезны для крупномасштабного культивирования, например периодического культивирования, культивирования в подпитываемых культурах и перфузионного культивирования клеток животных, например клеток млекопитающих.
[0007] Рационально разработанная среда согласно настоящему изобретению включает концентрацию аминокислоты, которую рассчитывают для использования в клеточной массе, концентрацию аминокислоты, которую рассчитывают для поддержания жизнедеятельности клеток, и концентрацию аминокислоты, которую рассчитывают для введения в полипептид, представляющий интерес.
[0008] В одном варианте реализации изобретение обеспечивает способ получения полипептида в культуре клеток, включающий обеспечение культуры клеток, которая содержит клетки, включающие нуклеиновую кислоту, кодирующую полипептид, представляющий интерес, и желаемую среду для культивирования клеток, содержащую концентрацию аминокислоты, которую рассчитывают для использования в клеточной массе, концентрацию аминокислоты, которую рассчитывают для поддержания жизнедеятельности клеток, и концентрацию аминокислоты, которую рассчитывают для введения в полипептид, представляющий интерес, а также поддержание культуры клеток при условиях, которые позволяют экспрессировать полипептид, представляющий интерес. В одном варианте реализации изобретения желаемая среда для культивирования клеток содержит концентрацию А аминокислоты, откорректированную по базовому уровню, которую определяют по формуле A=[(M*X)+(N*P)+(Y*M*X)]*F, где X - концентрация аминокислоты, используемая на единицу клеточной массы, Р - концентрация аминокислоты, используемая для введения в полипептид, представляющий интерес, на единицу титра полипептида, М - коэффициент желаемой пиковой плотности клеток в клеточной культуре, N - коэффициент желаемой концентрации полипептида, представляющего интерес, Y - коэффициент стабилизации клеток и F - коэффициент базового уровня.
[0009] В другом варианте реализации изобретение обеспечивает способ получения полипептида в культуре клеток, включающий обеспечение культуры клеток, содержащей клетки с нуклеиновой кислотой, кодирующей полипептид, представляющий интерес, и исходную среду для культивирования клеток, при этом объем исходной среды для культивирования клеток составляет примерно 60-99% от объема желаемой среды для культивирования клеток, подачу питательной среды для культивирования клеток в культуру клеток, при этом объем питательной среды для культивирования клеток составляет примерно 1-40% желаемой среды для культивирования клеток, а образующаяся желаемая среда для культивирования клеток содержит концентрацию аминокислоты, которую рассчитывают для использования в клеточной массе, концентрацию аминокислоты, которую рассчитывают для поддержания жизнедеятельности клеток, и концентрацию аминокислоты, которую рассчитывают для введения в полипептид, представляющий интерес, а также поддержание культуры клеток в условиях, которые позволяют экспрессировать полипептид, представляющий интерес. В одном варианте реализации изобретения образующаяся желаемая среда для культивирования клеток содержит концентрацию А аминокислоты, откорректированную по базовому уровню, которую определяют по формуле A=[(M*X)+(N*P)+(Y*M*X)]*F, где X - концентрация аминокислоты, используемая на единицу клеточной массы, Р - концентрация аминокислоты, используемая для введения в полипептид, представляющий интерес, на единицу титра полипептида, М - коэффициент желаемой пиковой плотности клеток в клеточной культуре, N - коэффициент желаемой концентрации полипептида, представляющего интерес, Y - коэффициент стабилизации клеток и F - коэффициент базового уровня, а также поддержание культуры клеток при условиях, которые позволяют экспрессировать полипептид, представляющий интерес. В другом варианте реализации изобретения исходная среда для культивирования клеток содержит концентрацию В аминокислоты согласно формуле B=[A-(Z*V)]/(1-V), где Z - концентрация аминокислоты в питательной среде для культивирования клеток, а V - объем питательной среды культуры, представляющий собой часть объема желаемой среды для культивирования клеток. В другом варианте реализации описанных здесь способов Y составляет от 0 до примерно 1.5. В еще одном варианте реализации описанных здесь способов F составляет примерно от 1 до примерно 1.5. В следующем варианте реализации описанных здесь способов Y составляет от 0 до примерно 1.5, a F - примерно от 1 до примерно 1.5.
[0010] В одном варианте реализации описанных здесь способов желаемая среда для культивирования клеток имеет содержание тирозина примерно 3 мМ или более. В других вариантах реализации описанных здесь способов желаемая среда для культивирования клеток содержит: примерно от 7 мМ до примерно 30 мМ лейцина, примерно от 7 мМ до примерно 30 мМ лизина, примерно от 7 мМ до примерно 30 мМ треонина, примерно от 7 мМ до примерно 30 мМ пролина и/или примерно от 7 мМ до примерно 30 мМ валина. В следующем варианте реализации описанных здесь способов суммарная концентрация лейцина, лизина, треонина, пролина и валина в желаемой среде для культивирования клеток составляет примерно от 35 мМ до примерно 150 мМ. В еще одном варианте реализации суммарная концентрация лейцина, лизина, треонина и валина в желаемой среде для культивирования клеток составляет примерно от 60% до примерно 80% от суммарной концентрации незаменимых аминокислот.
[0011] В одном варианте реализации описанных здесь способов суммарная концентрация незаменимых аминокислот в желаемой среде для культивирования клеток составляет примерно от 30% до примерно 50% концентрации всех аминокислот. В другом варианте реализации описанных здесь способов концентрация аминокислот в желаемой среде для культивирования клеток составляет примерно от 120 мМ до примерно 350 мМ. В следующем варианте реализации описанных здесь способов концентрацию пролина в культуре клеток поддерживают большей чем примерно 1 мМ. В еще одном варианте реализации описанных здесь способов концентрацию пролина в культуре клеток поддерживают большей чем примерно 2 мМ. В некоторых вариантах реализации способов получения полипептида культивирование представляет собой крупномасштабное культивирование. В других вариантах реализации клетки представляют собой клетки животных.
[0012] Следующий аспект изобретения обеспечивает полипептиды, полученные описанными здесь способами. Еще один аспект изобретения обеспечивает фармацевтический состав, содержащий полипептид, полученный описанными здесь способами, и фармацевтически приемлемый носитель.
[0013] Следующий аспект изобретения обеспечивает способ получения культуры клеток, включающий: обеспечение культуры клеток, содержащей клетки, и желаемую среду для культивирования клеток, содержащую концентрацию аминокислоты, которую рассчитывают для использования в клеточной массе, и концентрацию аминокислоты, которую рассчитывают для поддержания жизнедеятельности клеток, а также проведение культивирования при условиях, которые позволяют обеспечить рост и репликацию клеток при культивировании. В одном варианте реализации изобретения желаемая среда для культивирования клеток содержит концентрацию А' аминокислоты, откорректированную по базовому уровню согласно формуле A'=[(M*X)+(Y*M*X)]*F, где X - концентрация аминокислоты, которую используют на единицу клеточной массы, М - коэффициент желаемой пиковой плотности клеток в культуре клеток, Y - коэффициент стабилизации клеток и F - коэффициент базового уровня. В некоторых вариантах реализации способов получения культуры клеток культивирование представляет собой крупномасштабное культивирование. В других вариантах реализации клетки представляют собой клетки животных.
[0014] Следующий аспект изобретения обеспечивает среду для культивирования клеток, содержащую суммарную концентрацию аминокислот примерно от 120 мМ до примерно 350 мМ. Другой аспект изобретения обеспечивает среду для культивирования клеток, предназначенную для получения полипептида, представляющего интерес, и содержащую суммарную концентрацию аминокислот примерно от 120 мМ до примерно 350 мМ.
[0015] Другой аспект изобретения обеспечивает среду для культивирования клеток, предназначенную для получения полипептида, представляющего интерес, и содержащую концентрацию аминокислоты, которую рассчитывают для использования в клеточной массе, концентрацию аминокислоты, которую рассчитывают для поддержания жизнедеятельности клеток, и концентрацию аминокислоты, которую рассчитывают для введения в полипептид, представляющий интерес. В одном варианте реализации изобретения среда для культивирования клеток, предназначенная для получения полипептида, представляющего интерес, содержит концентрацию А аминокислоты, откорректированную по базовому уровню согласно формуле A=[(M*X)+(N*P)+(Y*M*X)]*F, где X - концентрация аминокислоты, которую используют на единицу клеточной массы, Р - концентрация аминокислоты, которую используют для введения в полипептид, представляющий интерес, на единицу титра полипептида, М - коэффициент желаемой пиковой плотности клеток в культуре клеток, N - коэффициент желаемой концентрации полипептида, представляющего интерес, Y - коэффициент стабилизации клеток, a F - коэффициент базового уровня.
[0016] Еще один аспект изобретения обеспечивает среду для культивирования клеток, содержащую концентрацию А' аминокислоты, откорректированную по базовому уровню согласно формуле A'=[(M*X)+(Y*M*X)]*F, где X - концентрация аминокислоты, которую используют на единицу клеточной массы, М - коэффициент желаемой пиковой плотности клеток в культуре клеток, Y - коэффициент стабилизации клеток, a F - коэффициент базового уровня. В некоторых вариантах реализации среда для культивирования клеток представляет собой среду для крупномасштабного культивирования клеток. В других вариантах реализации среда для культивирования клеток представляет собой среду для культивирования клеток животных.
[0017] Еще один аспект изобретения обеспечивает способ определения оптимальной концентрации аминокислоты, используемой в среде для культивирования клеток, которая предназначена для получения при культивировании полипептида, представляющего интерес, включающий: определение концентрации аминокислоты, которая требуется для клеточной массы клеток при культивировании при целевой плотности клеток, определение концентрации аминокислоты, которая требуется для получения полипептида, представляющего интерес, при культивировании при целевом титре полипептида, определение концентрации аминокислоты, которая требуется для поддержания жизнедеятельности клеток при культивировании, и повышение концентраций для обеспечения оптимальной концентрации аминокислоты, применяемой в среде для культивирования клеток, для получения полипептида, представляющего интерес, при культивировании.
[0018] Следующий аспект изобретения обеспечивает способ определения оптимальной концентрации А аминокислоты, используемой в среде для культивирования клеток, предназначенной для получения полипептида, представляющего интерес, при культивировании, включающий: определение концентрации аминокислоты X, которая требуется для клеточной массы при установленной плотности клеток, определение концентрации аминокислоты Р, которая требуется для получения полипептида, представляющего интерес, при установленном титре полипептида, и определение оптимальной концентрации аминокислоты А согласно формуле A=[(M*X)+(N*P)+(M*Y*X)]*F, где М - коэффициент желаемой целевой плотности клеток в культуре клеток, N - коэффициент желаемой целевой концентрации полипептида, представляющего интерес, Y - коэффициент стабилизации клеток; a F - коэффициент базового уровня. В некоторых вариантах реализации способов определения оптимальной концентрации аминокислоты культивирование представляет собой крупномасштабное культивирование. В других вариантах реализации клетки представляют собой клетки животных.
[0019] Другие особенности и достоинства изобретения станут очевидными из следующего подробного описания и прилагаемой формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
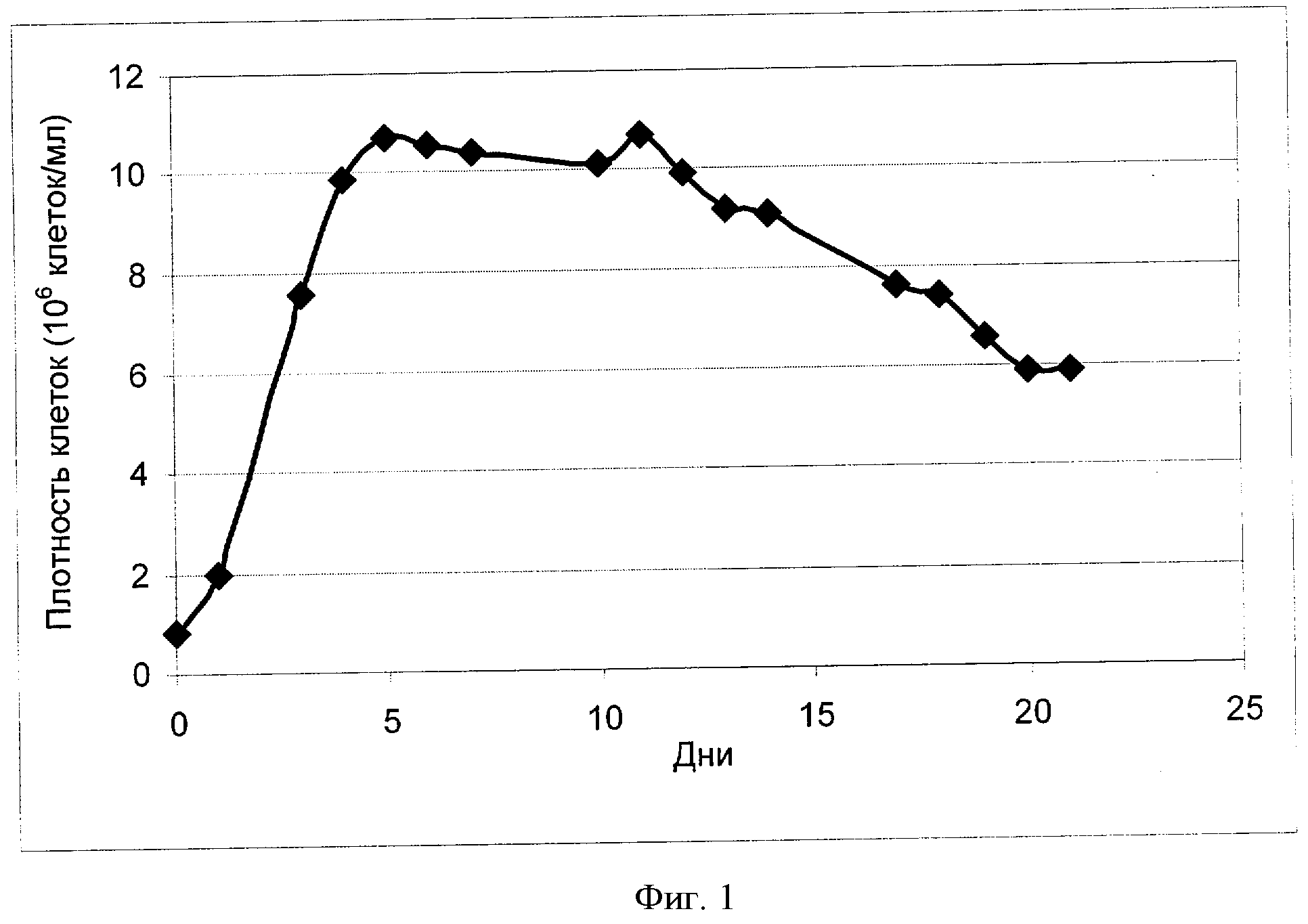
[0020] Фигура 1 показывает зависимость плотности клеток (ось Y; "Плотность клеток (106 клеток/мл)") от времени (ось X; "Дни") для клеток яичника китайского хомячка (Chinese Hamster Ovary, СНО), сконструированных для экспрессии анти-IL-22. Клетки культивировали в рационально разработанной среде примера 2.
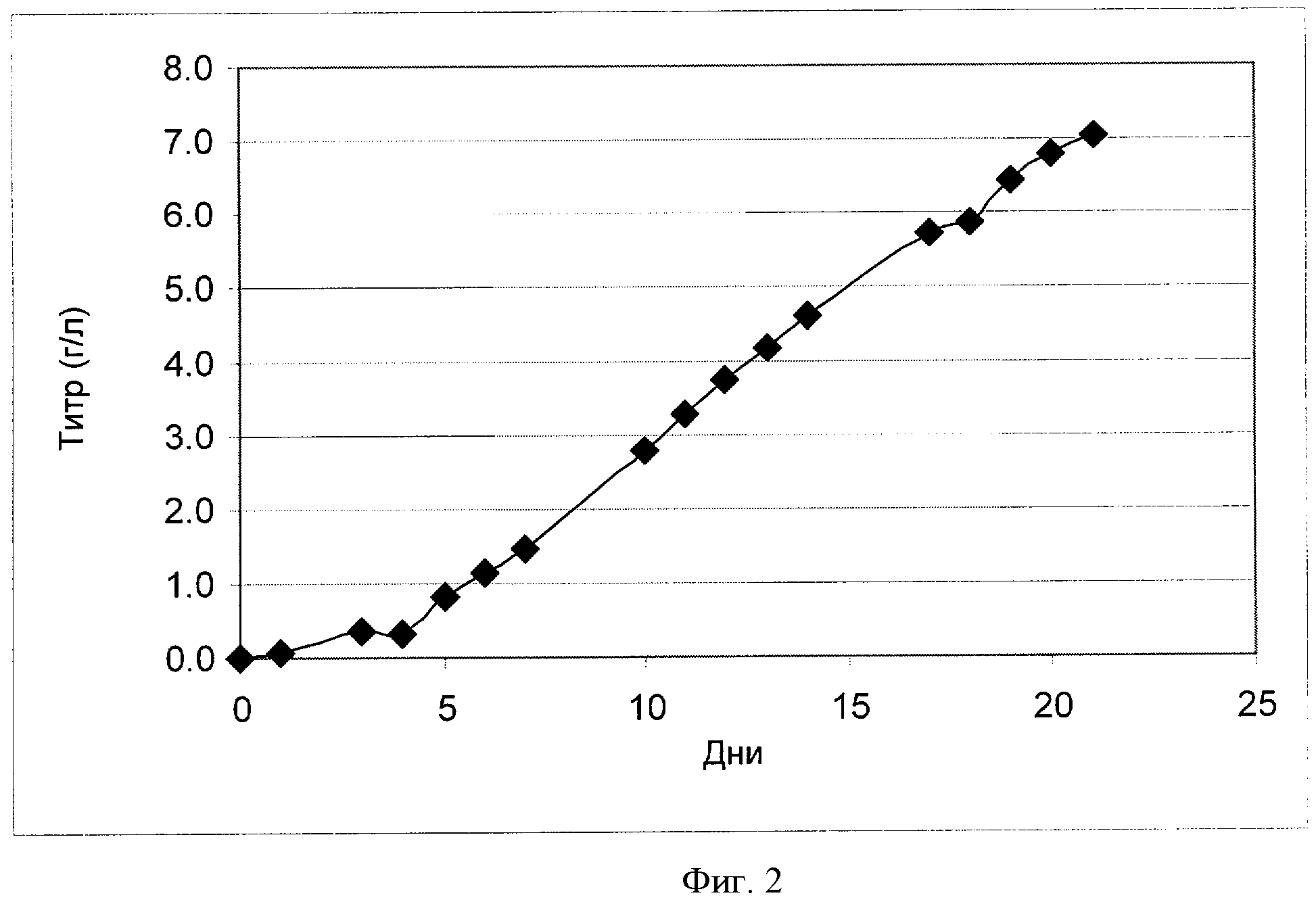
[0021] Фигура 2 показывает зависимость титра (ось Y; "Титр (г/л)") антитела анти-IL-22 от времени (ось X; "Дни") для клеток СНО, сконструированных для экспрессии анти-IL-22. Клетки культивировали в рационально разработанной среде примера 2.
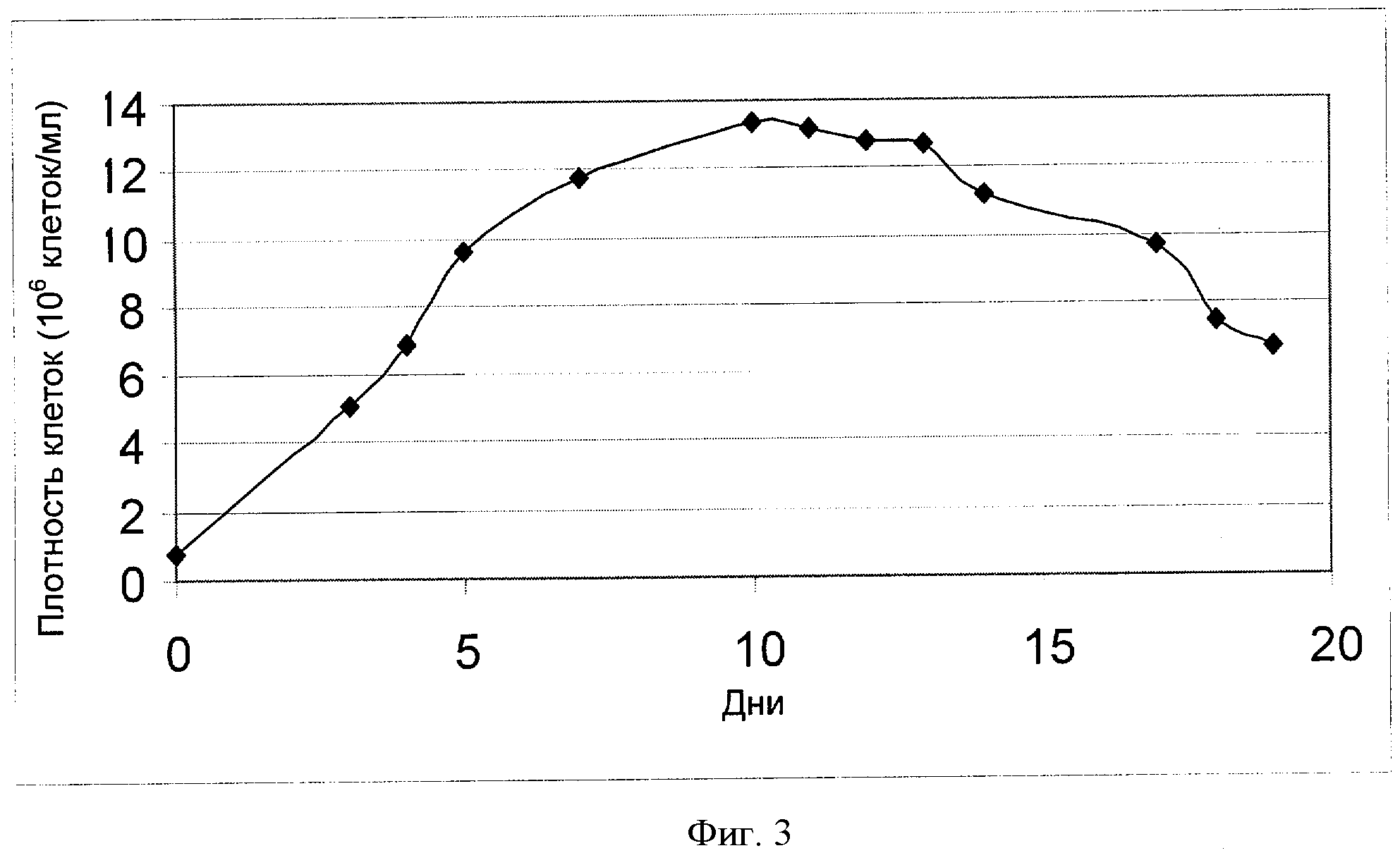
[0022] Фигура 3 показывает зависимость плотности клеток (ось Y; "Плотность клеток (106 клеток/мл)") от времени (ось X; "Дни") для клеток СНО, сконструированных для экспрессии анти-IL-22. Клетки культивировали в рационально разработанной среде примера 3.
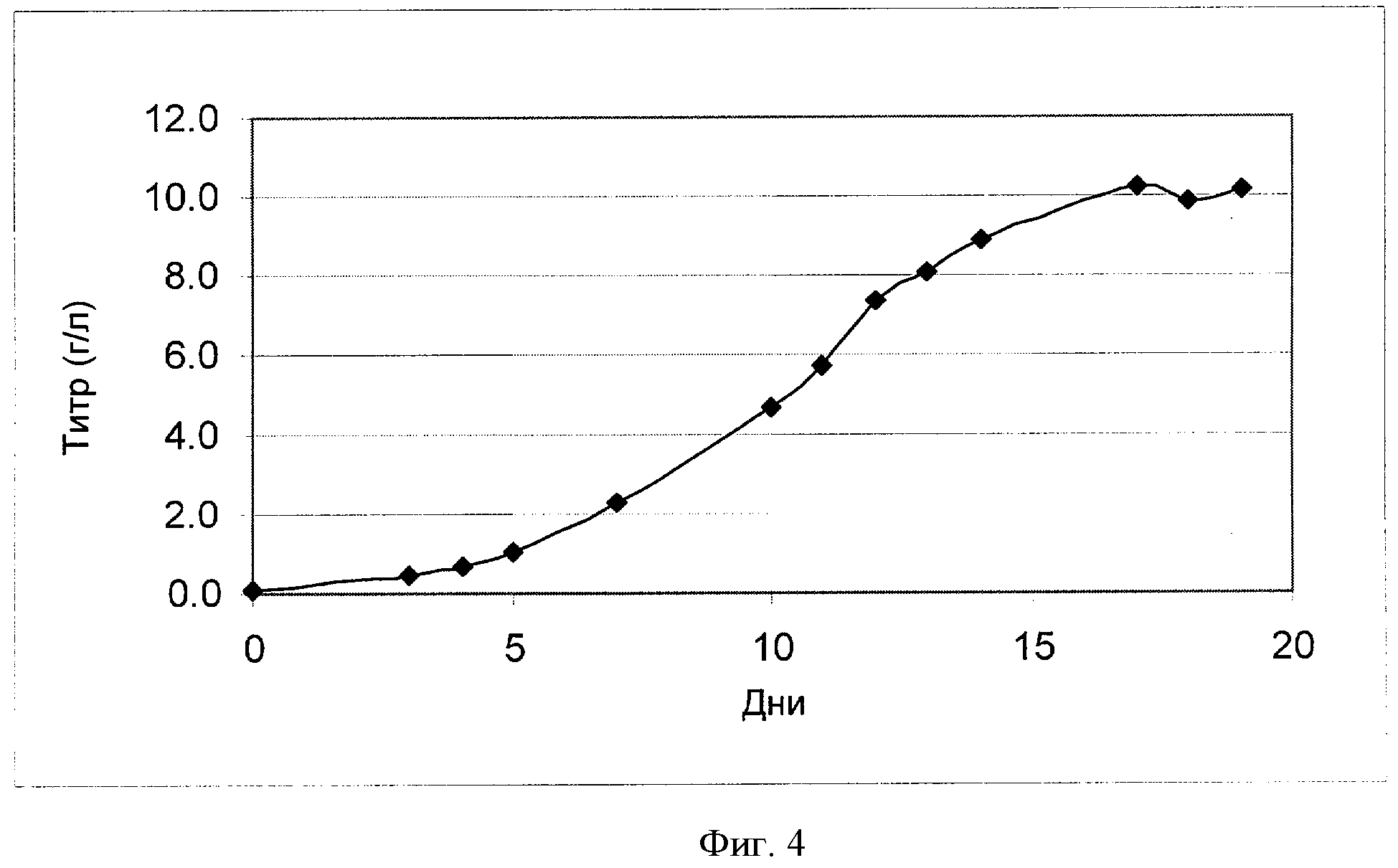
[0023] Фигура 4 показывает зависимость титра (ось Y; "Титр (г/л)") антитела анти-IL-22 от времени (ось X; "Дни") для клеток СНО, сконструированных для экспрессии анти-IL-22. Клетки культивировали в рационально разработанной среде примера 3.
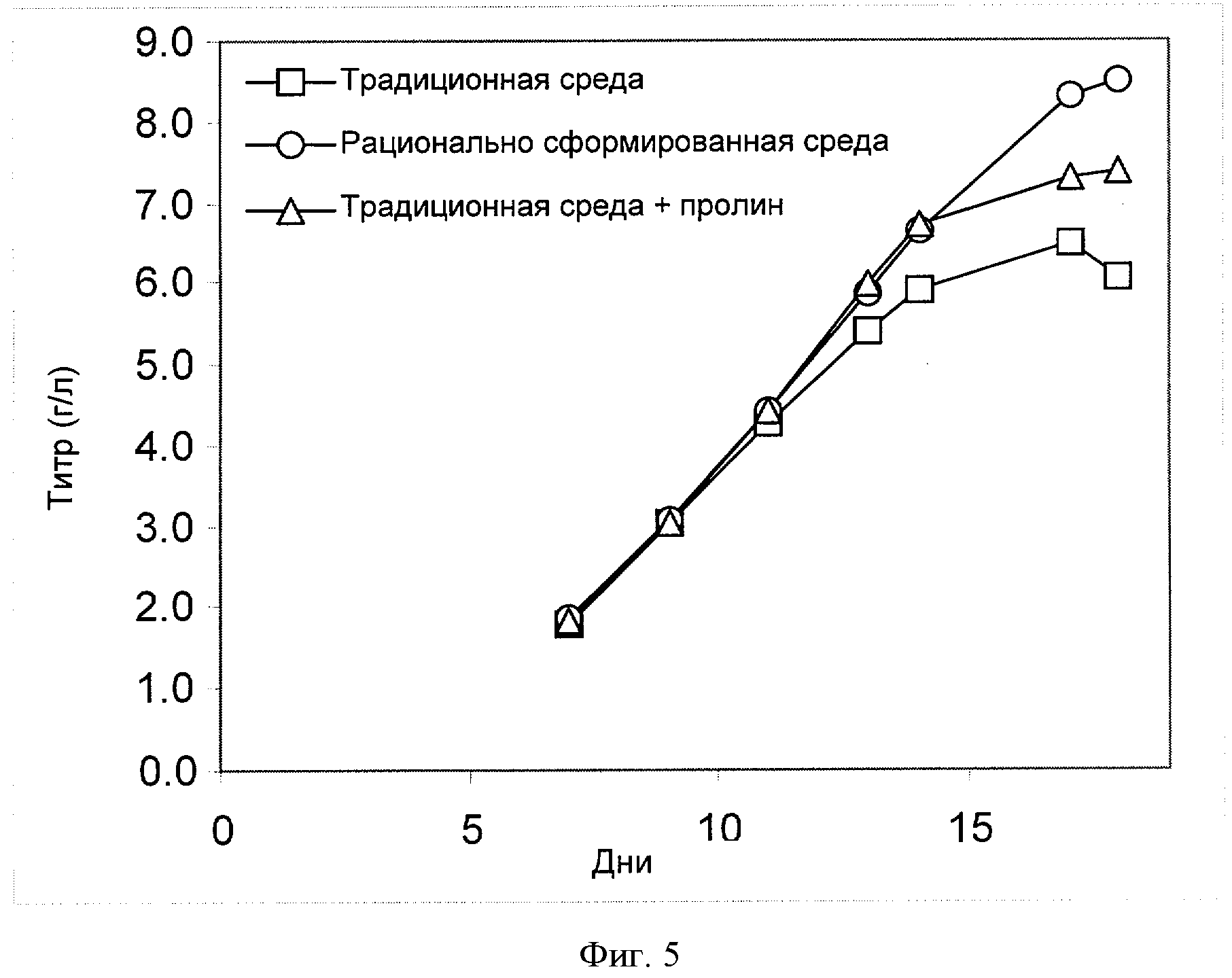
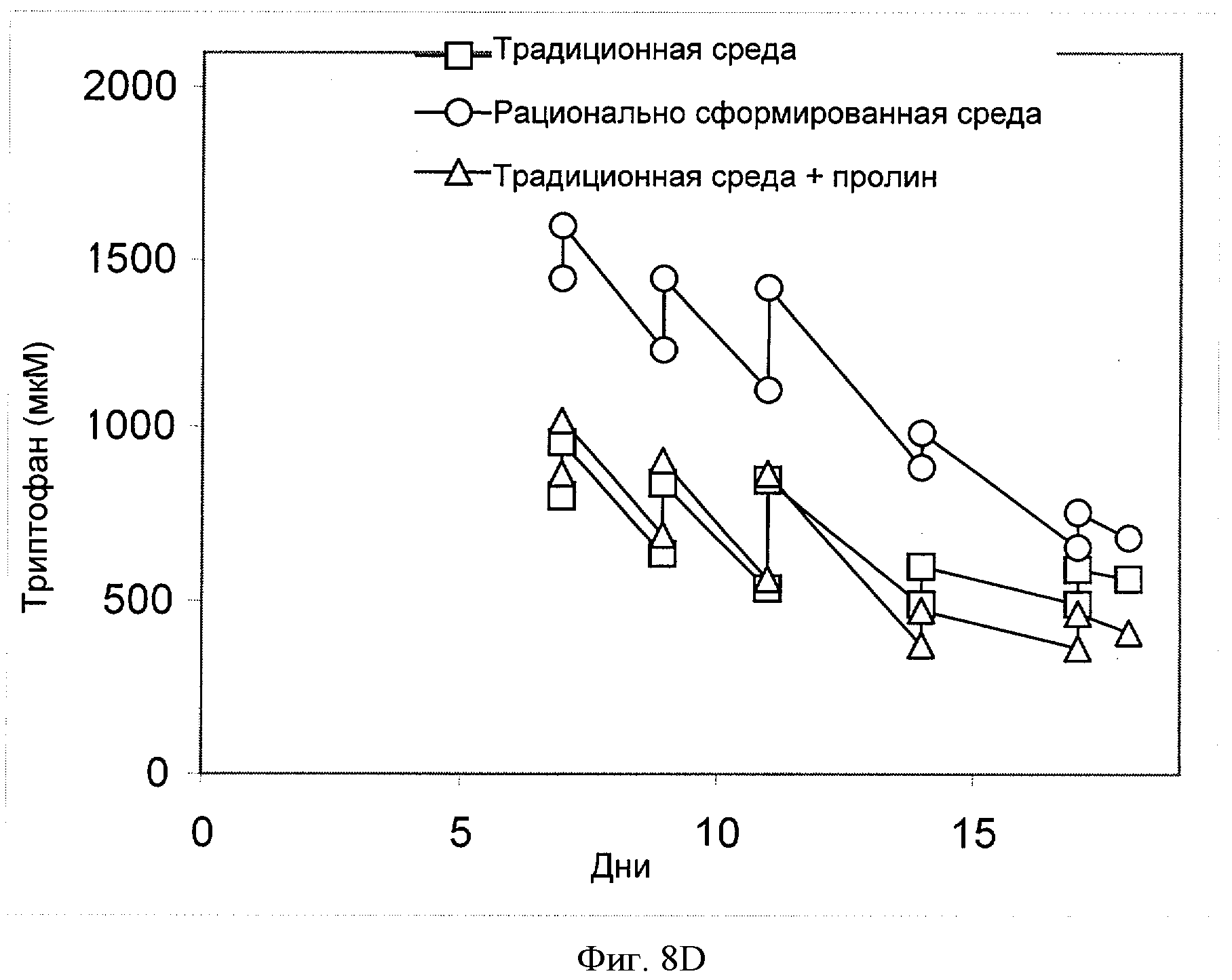
[0024] Фигура 5 показывает зависимость титра (ось Y; "Титр (г/л)") антитела анти-IL-22 от времени (ось X; "Дни") для клеток СНО, сконструированных для экспрессии анти-IL-22. Клетки культивировали в "традиционной среде" (в среде, созданной на основе традиционных требований к культуре клеток, см., например, опубликованную патентную заявку США №2006/0121568), в "рационально разработанной среде", полученной способами согласно настоящему изобретению, или в "традиционной среде + пролин", которая содержит дополнительно 3.7 мМ пролина, добавленного в "традиционную среду" (см. пример 4).
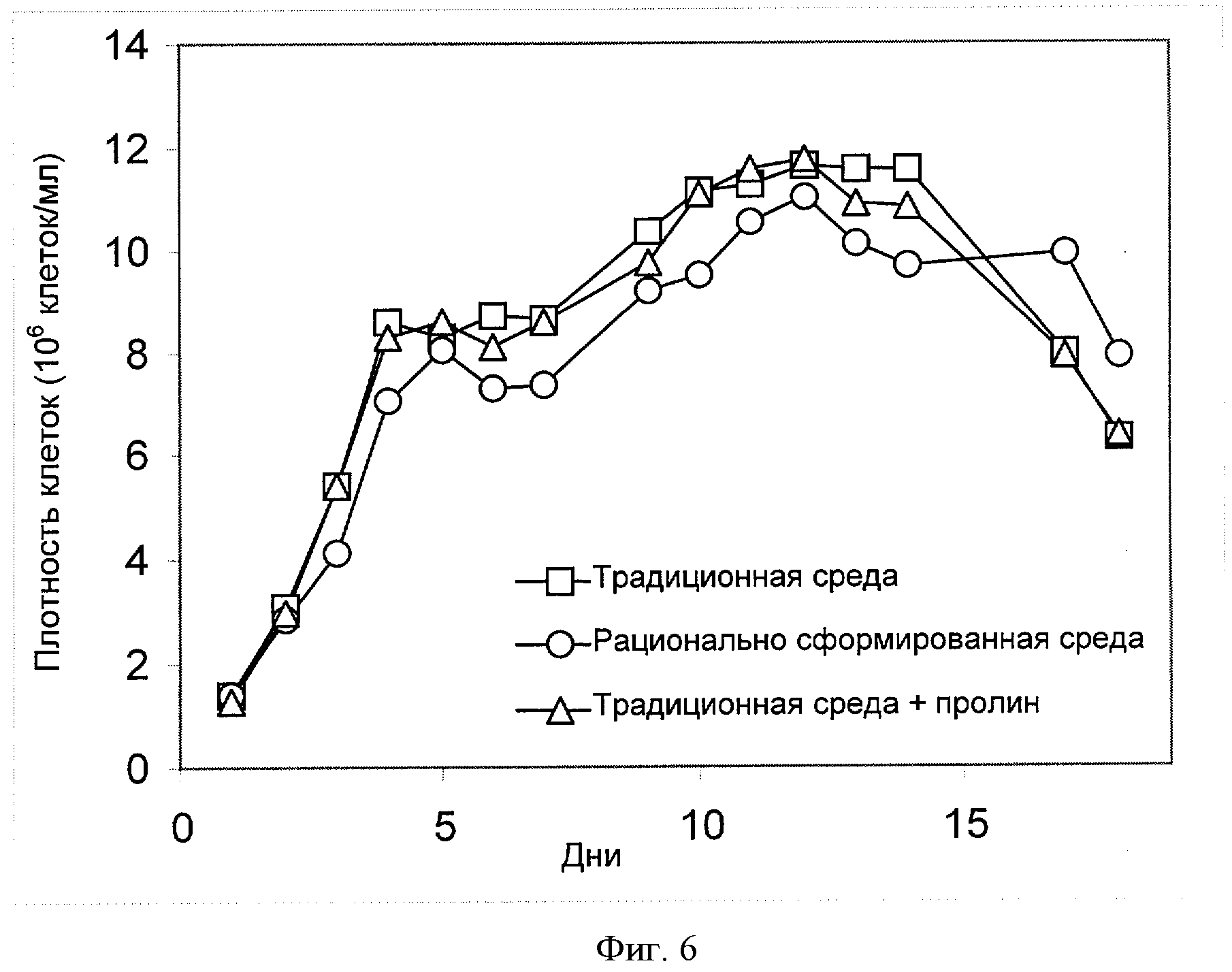
[0025] Фигура 6 показывает зависимость плотности клеток (ось Y; "Плотность клеток (106 клеток/мл)") от времени (ось X; "Дни") для клеток СНО, сконструированных для экспрессии анти-IL-22. Клетки культивировали в "традиционной среде", в "рационально разработанной среде" или в "традиционной среде + пролин" (см. пример 4).
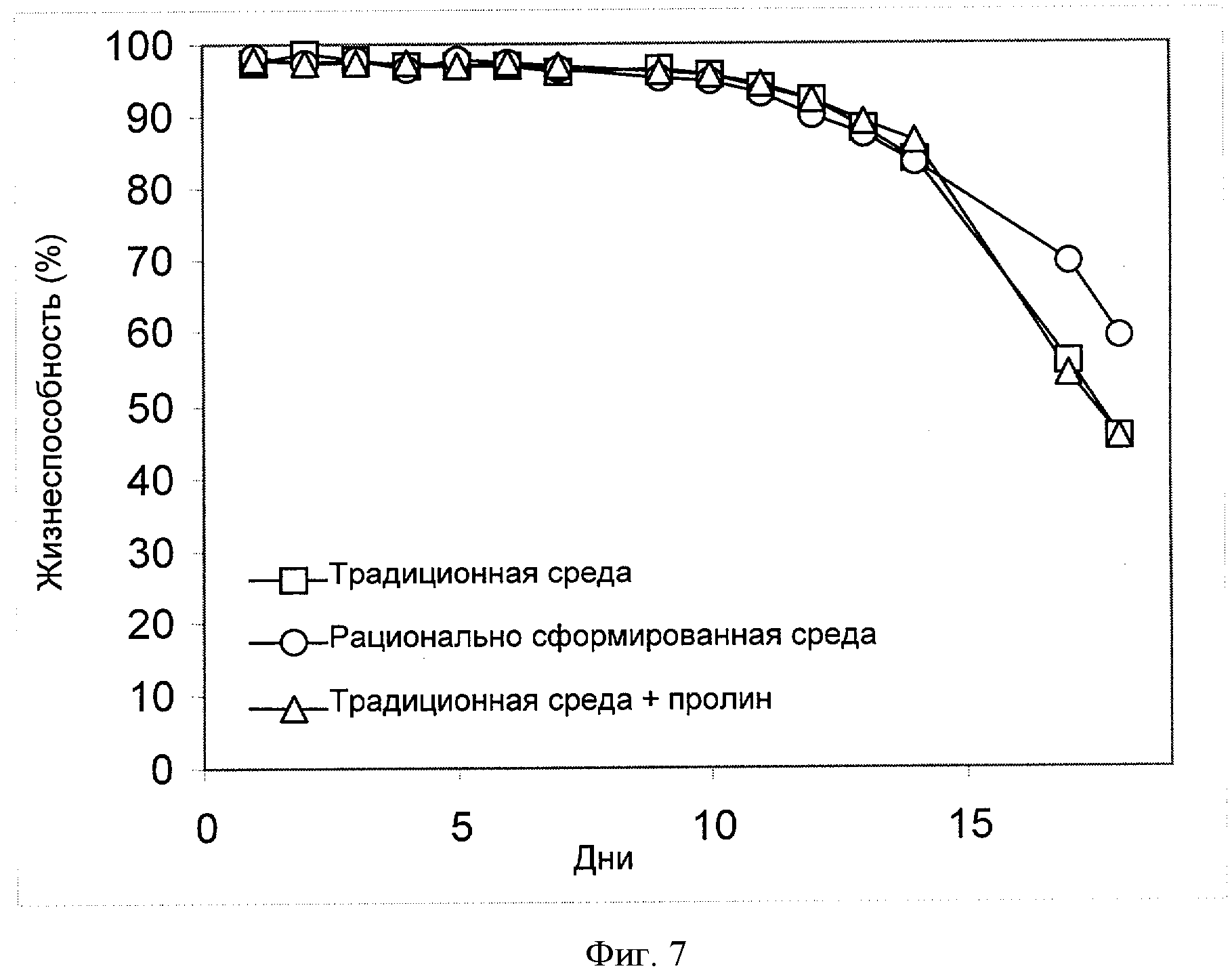
[0026] Фигура 7 показывает зависимость жизнеспособности клеток (ось Y; "Жизнеспособность [%]") от времени (ось X; "Дни") для клеток СНО, сконструированных для экспрессии анти-IL-22. Клетки культивировали в "традиционной среде", в "рационально разработанной среде" или в "традиционной среде + пролин" (см. пример 4).
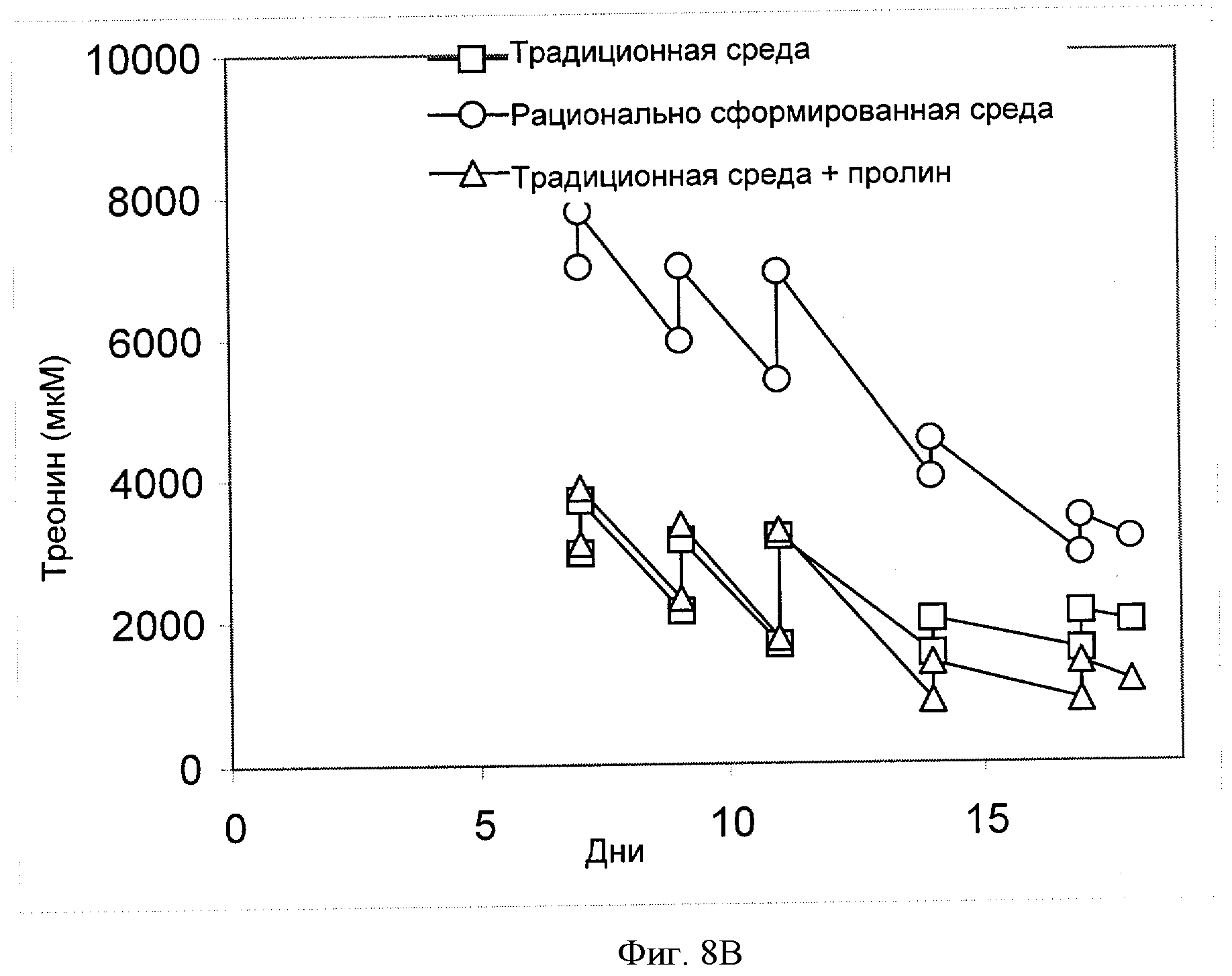
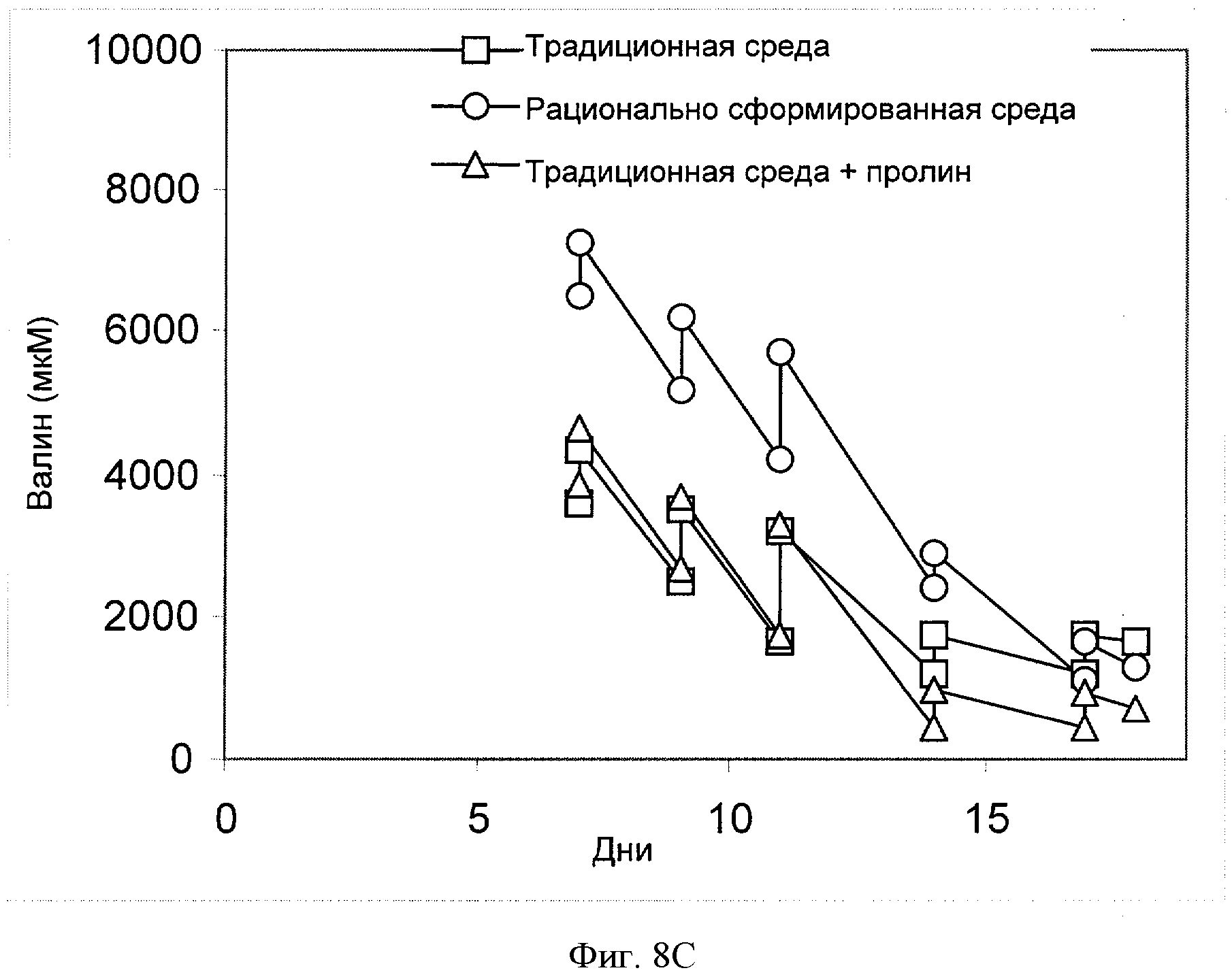
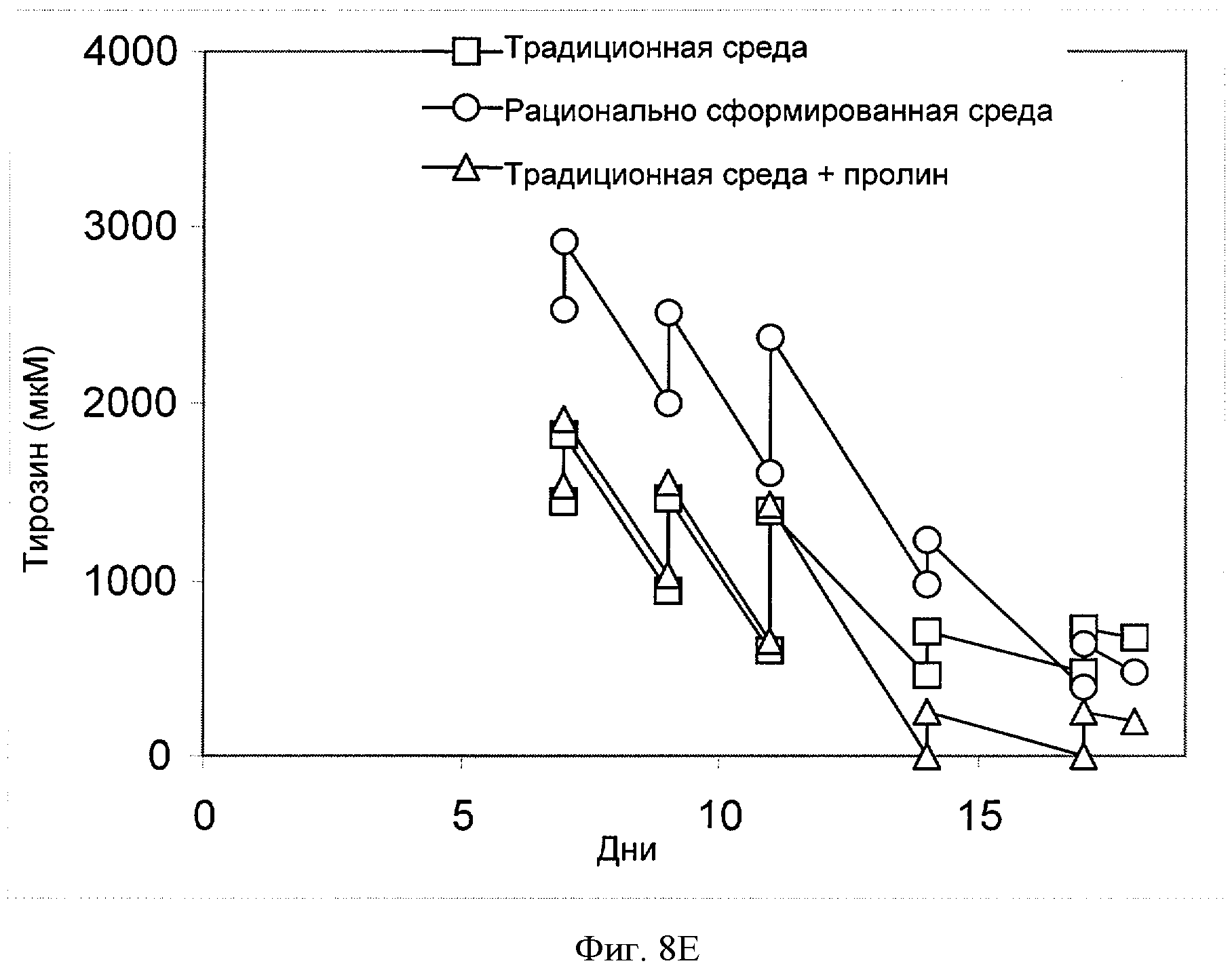
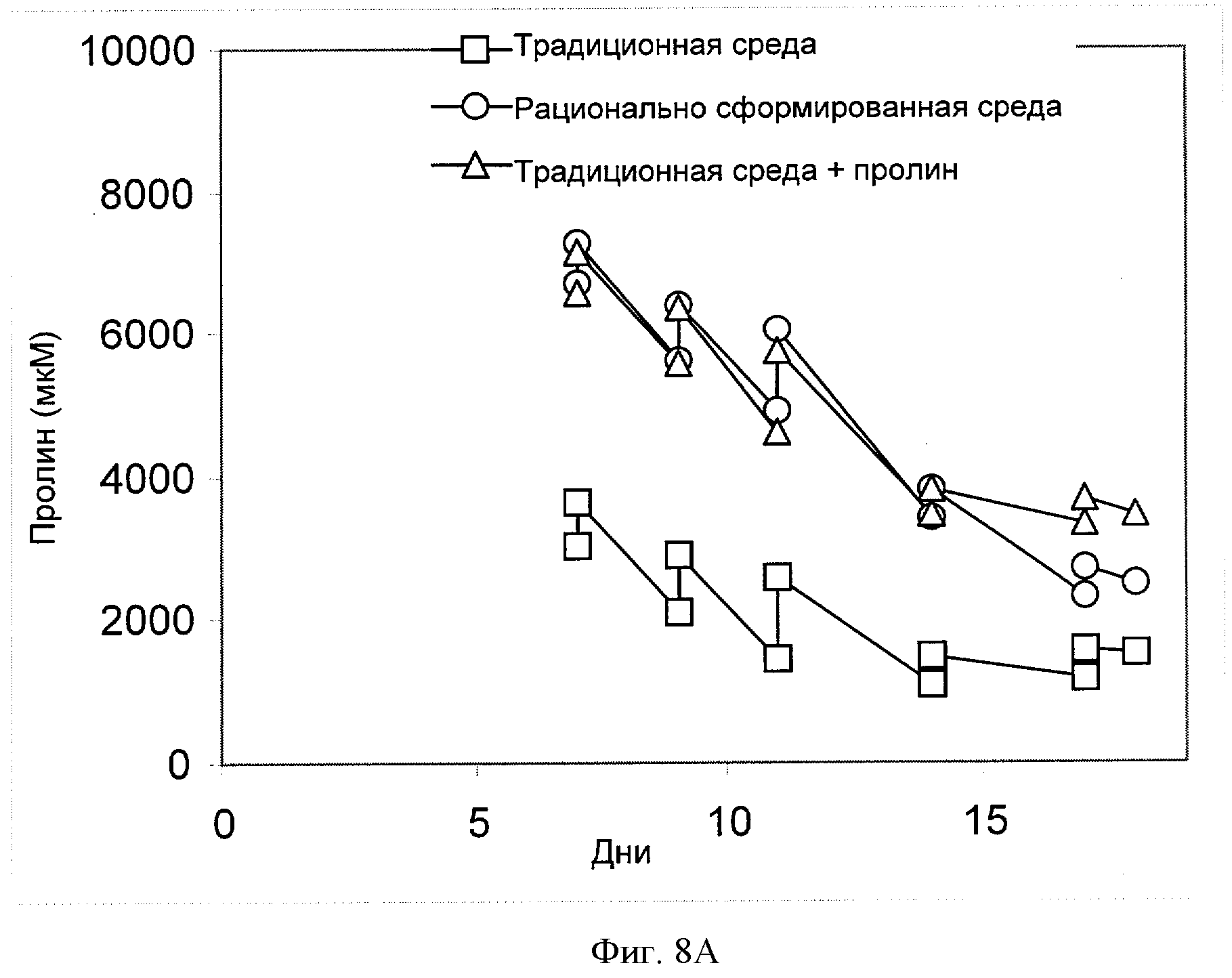
[0027] Фигура 8 показывает зависимость концентрации соответствующей аминокислоты (ось Y, "[мкМ]") ((Фигура 8А) - пролин, (Фигура 8В) - треонин, (Фигура 8С) - валин, (Фигура 8D) - триптофан или (Фигура 8Е) - тирозин) от времени (ось X; "Дни") для клеток СНО, сконструированных для экспрессии анти-IL-22. Клетки культивировали в "традиционной среде", в "рационально разработанной среде" или в "традиционной среде + пролин" (см. пример 4).
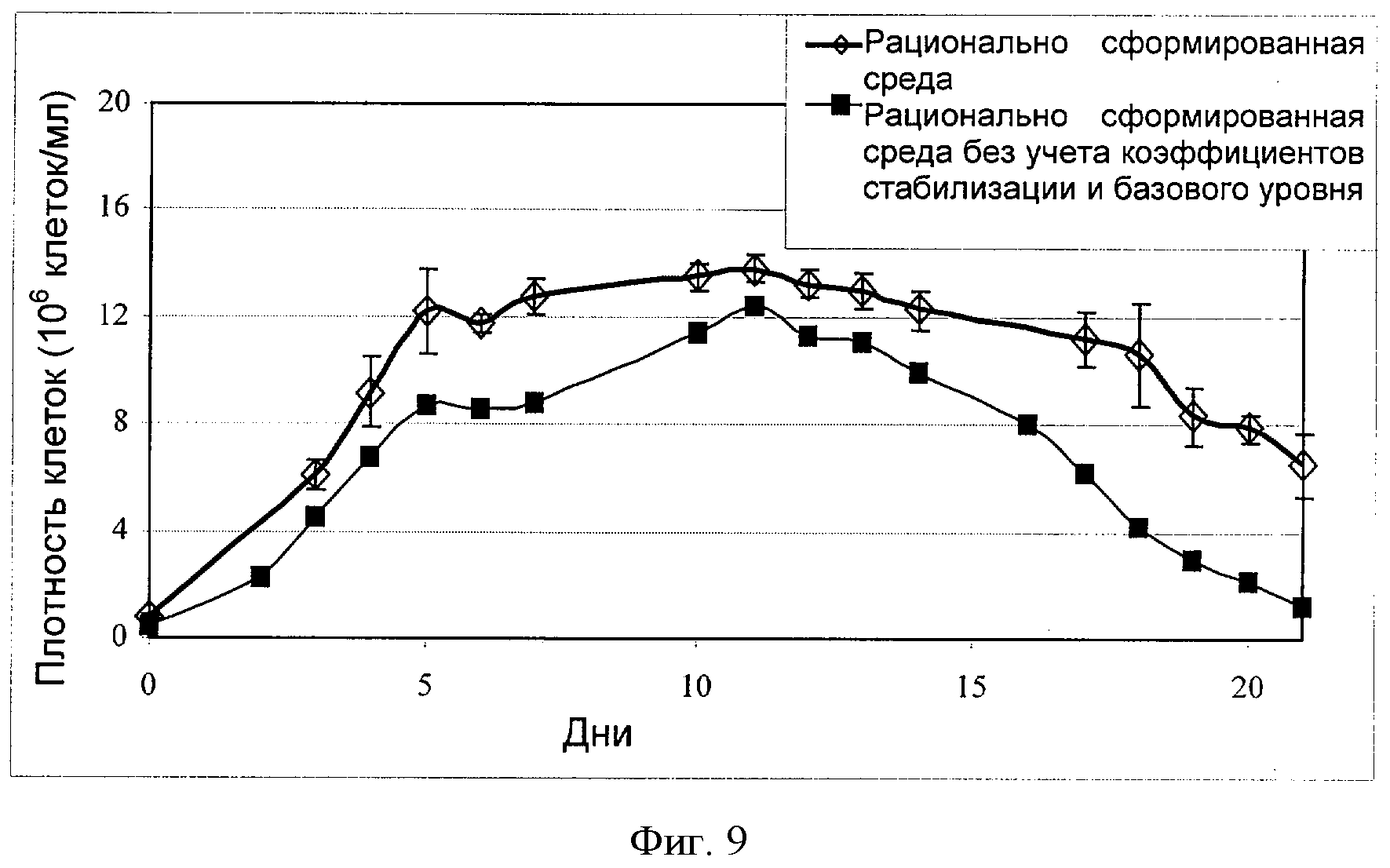
[0028] Фигура 9 показывает зависимость плотности клеток (ось Y; "Плотность клеток (106 клеток/мл)") от времени (ось X; "Дни") для клеток СНО, сконструированных для экспрессии анти-IL-22. Клетки культивировали в "рационально разработанной среде" или в "рационально разработанной среде без учета коэффициентов стабилизации и базового уровня". На фигуре показаны типичные результаты 5 независимых повторных экспериментов (n=5) (см. пример 6).
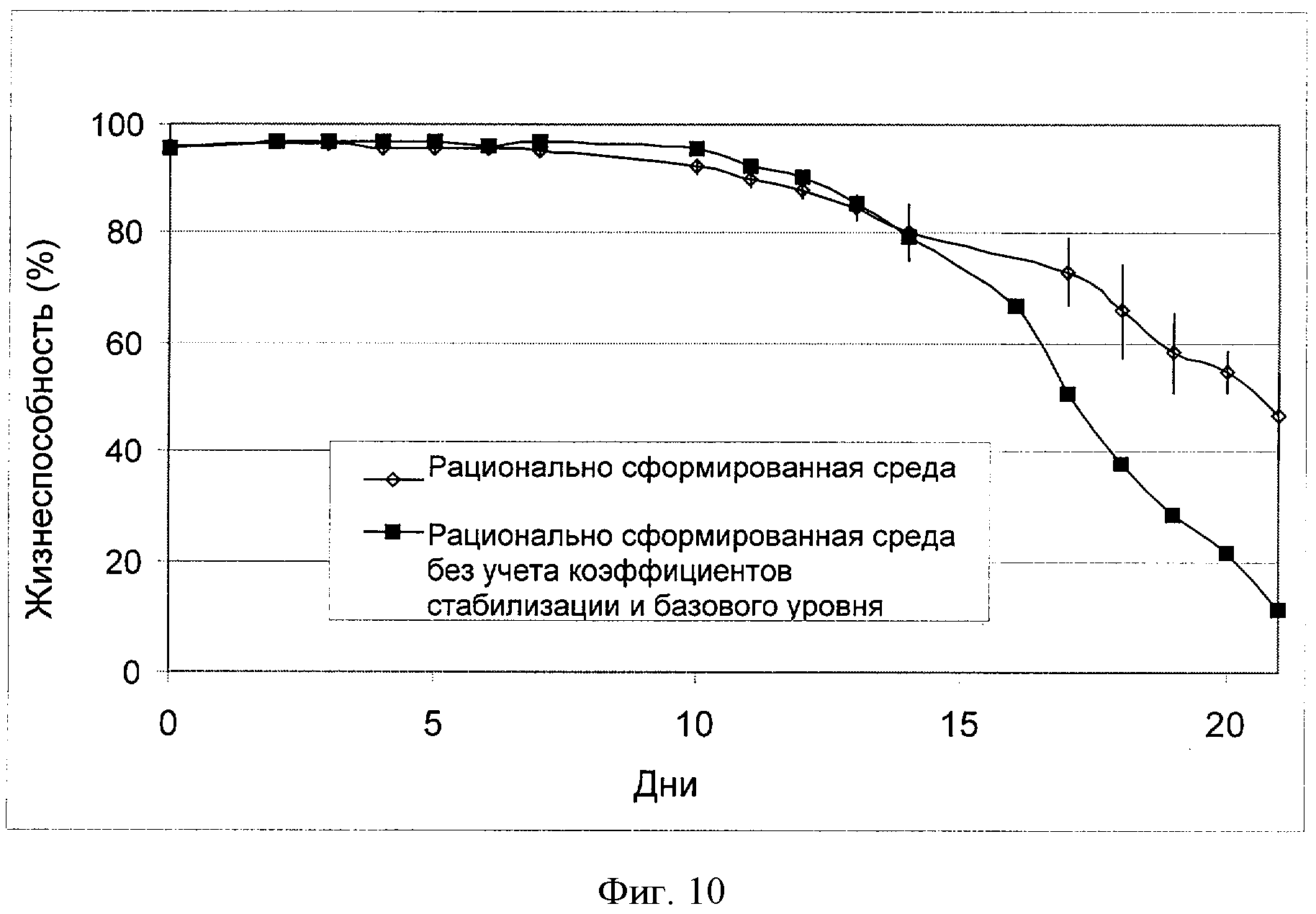
[0029] Фигура 10 показывает зависимость жизнеспособности клеток (ось Y: "Жизнеспособность (%)") от времени (ось X; "Дни") для клеток СНО, сконструированных для экспрессии анти-IL-22. Клетки культивировали в "рационально разработанной среде" или в "рационально разработанной среде без учета коэффициентов стабилизации и базового уровня". На фигуре показаны типичные результаты 5 независимых повторных экспериментов (n=5) (см. пример 6).
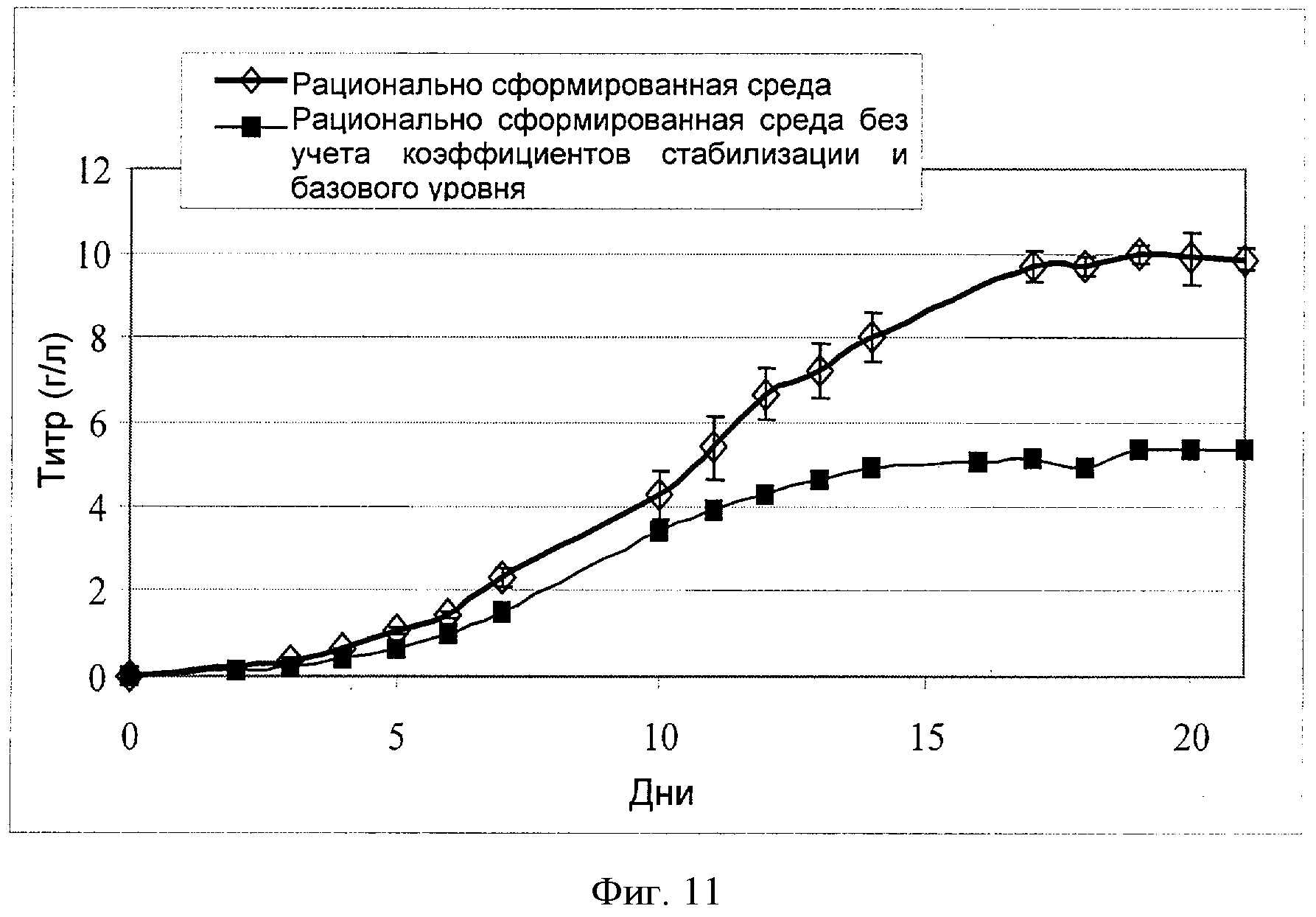
[0030] Фигура 11 показывает зависимость титра антитела (ось Y; "Титр (г/л)") от времени (ось X; "Дни") для клеток СНО, сконструированных для экспрессии анти-IL-22. Клетки культивировали в "рационально разработанной среде" или в "рационально разработанной среде без учета коэффициентов стабилизации и базового уровня" На фигуре показаны типичные результаты 5 независимых повторных экспериментов (n=5) (см. пример 6).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0031] Термин "периодическое культивирование", используемый в данном описании, относится к способу культивирования клеток, при котором все компоненты, которые, в конечном счете, используются в культивируемых клетках, включая среду, а также непосредственно клетки, вводят в начале процесса культивирования. Периодическое культивирование прекращают в определенный момент, а клетки и/или компоненты в среде собирают и по желанию очищают.
[0032] Термин "культивирование с подпиткой", используемый в данном описании, относится к способу культивирования клеток, при котором дополнительные компоненты подают в культуру спустя некоторое время после начала процесса культивирования. Вводимые компоненты обычно содержат питательные добавки, которые расходуются в процессе культивирования. Культивирование с подпиткой прекращают в определенный момент, а клетки и/или компоненты в среде собирают и по желанию очищают. В предпочтительном варианте реализации настоящего изобретения культура клеток представляет собой культуру клеток животных, например культуру клеток млекопитающих, которую культивируют периодически или с подпиткой.
[0033] Термин "перфузионное культивирование", используемый в данном описании, относится к способу культивирования клеток, при котором в культуру непрерывно или полунепрерывно подают дополнительные компоненты спустя некоторое время после начала процесса культивирования. Вводимые компоненты обычно содержат питательные добавки, которые расходуются в процессе культивирования. Порции клеток и/или компонентов в среде обычно собирают в непрерывном или полунепрерывном режиме и по желанию очищают.
[0034] Термин "биореактор", используемый в данном описании, относится к любому резервуару, который используют для выращивания прокариотной или эукариотной культуры клеток, например культуры клеток животных (в частности, культуры клеток млекопитающих). Биореактор может иметь любой размер, если он является пригодным для культивирования клеток, например клеток млекопитающих. Обычно объем биореактора составляет, по меньшей мере, 30 мл и может быть равным 1, 10, 100, 250, 500, 1000, 2500, 5000, 8000, 10000, 120000 литрам или более или какой-либо промежуточной величине. Внутренние режимы биореактора, включая, в частности, но без ограничения, pH и температуру, обычно регулируют в процессе культивирования. Биореактор может быть изготовлен из любого материала, пригодного для содержания культуры клеток млекопитающих, суспендированной в среде при условиях культивирования согласно настоящему изобретению, включая стекло, пластмассу или металл. Термин "производственный биореактор ", используемый в данном описании, относится к конечному биореактору, который используют для получения полипептида или белка, представляющего интерес. Объем производственного биореактора для крупномасштабного культивирования, как правило, превышает примерно 100 мл, обычно составляет, по меньшей мере, примерно 10 литров и может быть равен 500, 1000, 2500, 5000, 8000, 10000, 120000 литрам или более или какой-либо промежуточной величине. Специалисты в данной области техники имеют соответствующую информацию и могут выбрать биореакторы, пригодные для применения при реализации настоящего изобретения.
[0035] Термины "плотность клеток", "концентрация клеток" или т.п., используемые в данном описании, относятся к количеству, весу, массе и т.п. клеток, присутствующих в данном объеме среды. Термин "пиковая плотность клеток" или т.п. относится к максимальному количеству клеток, которое можно получить в данном объеме среды, а термин "желаемая пиковая плотность клеток" или т.п. относится к максимальному количеству клеток (например, к заданной величине), которое желает получить практикующий специалист в данном объеме клеток. Отклонения таких заданных величин очевидны для специалистов в данной области техники, например, специалист может представить заданную величину как желаемую клеточную массу и выразить такую заданную величину одной или несколькими соответствующими единицами измерения (например, единицами желаемой пиковой клеточной массы).
[0036] Термин "жизнеспособность клеток", используемый в данном описании, относится к способности клеток выживать в культуре при заданной совокупности условий культивирования или экспериментальных отклонениях. Данный термин включает также отношение той части клеток, которые в определенное время являются живыми, к суммарному количеству живых и мертвых клеток в культуре в указанное время.
[0037] Термины "культура" и "культура клеток", используемые в данном описании, относятся к популяции клеток, которая суспендирована в среде для культивирования клеток в условиях, пригодных для выживания и/или выращивания популяции клеток. Эти термины в данном описании могут относиться к комбинации, включающей популяцию клеток (например, культуру клеток животных) и среду, в которой суспендирована указанная популяция.
[0038] Термин "интегральная плотность жизнеспособных клеток" или "IVC", используемый в данном описании, относится к средней плотности жизнеспособных клеток в процессе культивирования, умноженной на время культивирования. Если допустить, что масса полученного полипептида и/или белка пропорциональна количеству жизнеспособных клеток, присутствующих в процессе культивирования, интегральная плотность жизнеспособных клеток является полезным инструментом для определения массы полипептида и/или белка, образовавшегося при культивировании.
[0039] Термины "среда", "среда для культивирования клеток" и "культуральная среда", используемые в данном описании, относятся к раствору, содержащему питательные вещества, которые питают выращиваемые клетки животных, например клетки млекопитающих. Обычно эти растворы содержат незаменимые и заменимые аминокислоты, витамины, источники энергии, липиды и микроэлементы, которые требуются для минимального роста и/или выживания клеток. Раствор может также содержать компоненты, которые усиливают рост и/или выживание, превышающие минимальный уровень, в том числе гормоны и факторы роста. Для раствора предпочтительно подбирают величину pH и концентрацию соли, оптимальные для выживания и пролиферации клеток. В одном варианте реализации указанная среда представляет собой определенную среду. Определенные среды представляют собой среды, в которых все компоненты имеют определенную химическую структуру. В другом варианте реализации изобретения среда может содержать одну или несколько аминокислот, полученных из какого-либо источника или каким-либо способом, известным специалистам, включая, в частности, но без ограничения, аминокислоты, полученные из добавок одной аминокислоты или из добавок пептонового или белкового гидролизата (в том числе из животных или растительных источников).
[0040] Термин "посев", используемый в данном описании, относится к процессу введения культуры клеток в биореактор или в другой резервуар. Клетки можно предварительно репродуцировать в другом биореакторе или резервуаре. Альтернативно клетки можно предварительно подвергнуть замораживанию и оттаиванию, например, непосредственно перед их подачей в биореактор или резервуар. Термин относится к любому количеству клеток, включая одиночную клетку.
[0041] Термин "титр", используемый в данном описании, представляет собой отношение полной массы представляющего интерес полипептида, который вырабатывается культурой клеток животных, к величине данного объема среды, таким образом, термин "титр" относится к концентрации. Титр обычно выражают в миллиграммах полипептида на миллилитр среды.
[0042] Термин "антитело", используемый в данном описании, включает белок, содержащий, по меньшей мере, одну, а типично - две вариабельные области тяжелой цепи или их части и/или, по меньшей мере, одну, а типично две вариабельные области легкой цепи или их части. В некоторых вариантах реализации антитело представляет собой тетрамер, состоящий из двух тяжелых и двух легких цепей иммуноглобулина, при этом тяжелые и легкие цепи иммуноглобулина связаны друг с другом, например, при помощи дисульфидных связей. Антитела или их части можно получить из любого источника, включая, в частности, но без ограничения, грызунов, приматов (например, человека и обезьян), верблюдовых и т.п., или их можно получить рекомбинантно, например химерными, гуманизованными и/или генерированными in vitro, например, способами, хорошо известными специалистам в данной области.
[0043] Примеры связывающих фрагментов, которые описывает термин "антиген-связывающий фрагмент" антитела, включают, в частности, но без ограничения, (1) фрагмент Fab, одновалентный фрагмент, состоящий из доменов VL, VH, CL и СН1, (2) фрагмент F(ab')2, двухвалентный фрагмент, содержащий два фрагмента Fab, связанных дисульфидным мостиком в шарнирном участке, (3) фрагмент Fd, состоящий из доменов VH и СН1, (4) фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела, (5) фрагмент dAb, который состоит из домена VH, (6) верблюжий или камелизированный вариабельный домен тяжелой цепи (VHH), (7) одиночную цепь Fv (scFv; см. ниже), (8) биспецифическое антитело и (9) один или более фрагментов молекулы иммуноглобулина, слитых с участком Fc. Кроме того, хотя два домена фрагмента Fv, VL и VH кодируются отдельными генами, их можно соединять, используя рекомбинантые способы, синтетическим линкером, позволяющим им образовывать одну белковую цепь, в которой участки VL и VH связываются попарно, образуя одновалентные молекулы (известные как одиночная цепь Fv (scFv)); см., например, Bird et al. (1988) Science 242:423-26; Huston et al. (1988) Proc. Natl. Acad. Sci. U.S.A. 85:5879-83). Такие антитела с одиночной цепью также включаются в термин "антиген-связывающий фрагмент" антитела. Эти фрагменты можно получить, пользуясь традиционными способами, известными специалистам в данной области, а функцию фрагментов определяют таким же образом, как и функцию целых антител.
[0044] Антиген-связывающий фрагмент" может дополнительно содержать функциональную группу, которая усиливает один или несколько таких параметров, как, например, стабильность, эффекторная функция клетки или фиксация комплемента. Антиген-связывающий фрагмент может включать также, например, пегилированную группу, альбумин или константную область тяжелой и/или легкой цепи.
[0045] За исключением "биспецифических" или "бифункциональных" антител все сайты связывания остальных антител являются идентичными. "Биспецифическое" или "бифункциональное антитело" является искусственным гибридным антителом, которое имеет две различные пары тяжелой/легкой цепи и два различных сайта связывания. Биспецифические антитела можно получить разными способами, включая слияние гибридом или соединение фрагментов Fab'. См., например, Songsivilai and Lachmann. (1990) Clin. Exp. Immunol. 79:315-21; Kostelny et al. (1992) J. Immunol. 148:1547-53.
[0046] Выражение "белок" или "белковый продукт" относится к одной или нескольким цепям аминокислот. Термин "белок", используемый в данном описании, является синонимом "полипептида" и, как в общем случае понимают специалисты в данной области техники, относится, по меньшей мере, к одной цепи аминокислот, присоединенной посредством последовательных пептидных связей. В некоторых вариантах реализации "белок, представляющий интерес" или "полипептид, представляющий интерес" является белком, кодированным молекулой экзогенной нуклеиновой кислоты, которая трансформирована в клетку-хозяина. В некоторых вариантах реализации, где "белок, представляющий интерес", кодируется экзогенной ДНК, с которой трансформируется клетка-хозяин, последовательность экзогенной ДНК определяет последовательность аминокислот. В некоторых вариантах реализации "белок, представляющий интерес", является белком, кодированным молекулой нуклеиновой кислоты, которая является эндогенной по отношению к клетке-хозяину. В некоторых вариантах реализации экспрессию такого эндогенного белка, представляющего интерес, изменяют путем трансфицирования клетки-хозяина молекулой экзогенной нуклеиновой кислоты, которая может содержать, например, одну или несколько регуляторных последовательностей и/или кодировать белок, усиливающий экспрессию белка, представляющего интерес. Способы и составы согласно настоящему изобретению можно использовать для получения любого белка, представляющего интерес, включая, в частности, но без ограничения, белки, имеющие фармацевтические, диагностические, агротехнические и/или какие-либо иные из многочисленных свойств, полезных для применения в промышленной, исследовательской и/или других областях. Кроме того, белок, представляющий интерес, может быть терапевтическим белком. Терапевтический белок является белком, который оказывает биологический эффект на область организма, в которой он непосредственно действует, или на область организма, на которую он действует дистанционно посредством промежуточных компонентов. Более подробно примеры терапевтических белков рассматриваются далее. В некоторых вариантах реализации белки, получаемые с использованием способов и/или составов согласно настоящему изобретению, можно процессировать и/или модифицировать. Например, белок, получаемый согласно настоящему изобретению, можно гликозилировать.
[0047] Настоящее изобретение можно использовать для культивирования клеток с целью эффективного производства любого терапевтического белка, в частности пригодных для фармацевтического или промышленного применения ферментов, рецепторов, антител (например, моноклональных и/или поликлональных антител), Fc-слитых белков, цитокинов, гормонов, регуляторных факторов, факторов роста, факторов коагуляции/свертывания, антиген-связывающих агентов и т.п. Специалистам в данной области техники известны другие белки, которые можно получать согласно настоящему изобретению, и для получения таких белков они могут использовать описанные здесь способы.
Модели экспрессии и создание рекомбинантных клеток хозяина
[0048] Настоящее изобретение использует рекомбинантные клетки хозяина, например прокариотные или эукариотные клетки хозяина, т.е. клетки, трансфицированные конструктом экспрессии, содержащим нуклеиновую кислоту, которая кодирует полипептид, представляющий интерес. Выражение "клетки животных" включает клетки беспозвоночных, позвоночных немлекопитающих (например, птиц, рептилий и земноводных), а также клетки млекопитающих. Неограничительные примеры клеток беспозвоночных включают следующие клетки насекомых: Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (дрозофила) и Bombyx mori (тутовый шелкопряд).
[0049] Ряд клеточных линий млекопитающих пригоден в качестве клеток хозяина для рекомбинантной экспрессии полипептидов, представляющих интерес. Клеточные линии клетки-хозяина млекопитающих включают, например, COS, PER.C6, ТМ4, VERO076, MDCK, BRL-3A, W138, Hep G2, ММТ, MRC 5, FS4, СНО, 293Т, А431, 3Т3, CV-1, С3Н10Т1/2, Colo205, 293, Не La, клетки L, BHK, HL-60, FRhL-2, U937, HaK, клетки Jurkat, Rat2, BaF3, 32D, FDCP-1, PC12, M1x, клетки мышиной миеломы (например, SP2/0 и NS0) и клетки С2С12, а также трансформированные клеточные линии приматов, гибридомы, нормальные диплоидные клетки и клеточные штаммы, полученные в результате культивирования in vitro первичной ткани и первичных эксплантатов. Любую эукариотную клетку, которая способна экспрессировать полипептид, представляющий интерес, можно использовать в способах создания среды согласно данному изобретению. Многочисленные клеточные линии поставляются коммерческими организациями, в частности Американской коллекцией типовых культур (АТСС). В одном варианте реализации изобретения для получения культуры клеток, например культуры клеток для крупномасштабного производства, используют клетки гибридомы. Конструкция клеток гибридомы, продуцирующих антитела, хорошо известна специалистам в данной области техники. В одном варианте реализации изобретения для получения культуры клеток, например культуры клеток для крупномасштабного производства, используют клетки СНО.
[0050] В альтернативном варианте может оказаться возможным рекомбинантное продуцирование полипептидов, представляющих интерес, в низших эукариотах, в частности в дрожжах, или в прокариотах, в частности в бактериях. Пригодные штаммы дрожжей включают Saccharomyces cerevisiae, Schizosaccharomyces pombe, штаммы Kluyveromyces, Candida или любой другой штамм дрожжей, способный экспрессировать полипептид, представляющий интерес. Пригодные бактериальные штаммы включают Escherichia coli, Bacillus subtilis, Salmonella typhimurium или любой бактериальный штамм, способный экспрессировать полипептид, представляющий интерес. Экспрессия в бактериях может приводить к образованию внутриклеточных телец, включенных в рекомбинантный белок. Поэтому для получения активного или более активного материала может потребоваться рефолдинг такого рекомбинантного белка. Специалистам в данной области техники известно несколько способов получения правильно свернутых гетерологических белков из бактериальных внутриклеточных телец. Эти способы включают, как правило, солюбилизацию белка из внутриклеточных телец с последующей полной денатурацией белка при помощи хаотропного агента. Если в первичной последовательности аминокислот белка присуствуют цистиновые остатки, часто оказывается необходимым произвести рефолдинг в среде, которая позволяет правильно сформировать дисульфидные связи (окислительно-восстановительная система). Общие способы рефолдинга описаны в работе Kohno. (1990) Meth. Enzymol. 185:187-95, ЕР 0433225 и в патенте США №5399677.
[0051] Настоящее изобретение использует модели в форме плазмид, векторов и транскрипционных или экспрессионных кассет, содержащих, по меньшей мере, один полинуклеотид, который кодирует полипептид, представляющий интерес. Векторы способны направлять экспрессию генов, с которыми они связаны функционально. Такие векторы называются в данном описании "векторами рекомбинантной экспрессии" или "векторами экспрессии". Как правило, полезные векторы экспрессии в способах с рекомбинантными ДНК имеют форму плазмид. В настоящем описании термины "плазмида" и "вектор" могут использоваться на равных основаниях, поскольку плазмида представляет собой наиболее распространенную форму вектора. Однако изобретение включает и другие формы векторов экспрессии, которые выполняют эквивалентные функции, в том числе, в частности, но без ограничения, вирусные векторы (например, репликация дефективных ретровирусов, модифицированных альфа-вирусов, аденовирусов и аденоассоциированных вирусов).
[0052] Модели, пригодные для экспрессии белков в клетках животных, хорошо известны специалистам в данной области техники. Так, например, полинуклеотиды могут быть функционально связаны с последовательностью, управляющей экспрессией, в частности с присутствующей в векторах экспрессии рМТ2 или pED, которые описаны, например, в работе Kaufman et al. (1991) Nuc. Acids Res. 19:4485-90. Другие пригодные последовательности, управляющие экспрессией, найдены в векторах, известных специалистам в данной области техники, и включают, в частности, но без ограничения: HaloTag™ pHT2, рАСТ, pBIND, рСАТ®3, pCI, phRG, phRL (Promega, Madison, WI); pcDNA3.1, pcDNA3.1-E, pcDNA4/HisMAX, pcDNA4/HisMAX-E, pcDNA3.1/Hygro, pcDNA3.1/Zeo, pZeoSV2, pRc/CMV2, pBudCE4 pRc/RSV (Invitrogen, Carlsbad, CA); векторы pCMV-3Tag, вектор pCMV-Script®, векторы pCMV-Tag, векторы pSG5 (Stratagene, La Jolla, CA); pDNR-Dual, pDNR-CMV (Clonetech, Palo Alto, CA) и pSMEDA (Wyeth, Madison, WI). Общие способы экспрессирования рекомбинантных белков также известны и описаны с примерами, например, в работе Kaufman. (1990) Meth. Enzymol. 185:537-66.
[0053] Термин "функционально связанный", используемый в данном описании, означает ферментное или химическое лигирование для образования ковалентной связи между экспрессируемым полинуклеотидом и последовательностью, управляющей экспрессией, таким образом, чтобы кодированный белок экспрессировался трансфицированной клеткой-хозяином.
[0054] Модели рекомбинантной экспрессии согласно изобретению могут содержать дополнительные последовательности, в частности регуляторные последовательности (например, последовательности, которые регулируют репликацию вектора (например, источники репликации, транскрипционные последовательности нуклеиновых кислот, кодирующих полипептид (или пептид), представляющий интерес) или экспрессию кодированного полипептида), маркирующие последовательности, в частности, гистидин и селектируемые маркерные гены. Термин "регуляторная последовательность" включает промоторы, энхансеры и любые другие элементы регулирования экспрессии (например, сигнальные последовательности полиаденилирования, сайты сплайсинга транскрипции), которые регулируют транскрипцию, репликацию или трансляцию. Такие регуляторные последовательности описаны, например, в работе Goeddel, Gene Expression Technology: Methods in Enzymology, Academic Press, San Diego, CA (1990). Для специалистов в данной области техники очевидно, что конструкция вектора экспрессии, включая выбор регуляторных последовательностей, будет зависеть от различных факторов, в том числе от выбора клетки-хозяина и уровня экспрессии желаемого белка. Предпочтительные регуляторные последовательности для экспрессии белков в клетках хозяина млекопитающих включают вирусные элементы, которые обеспечивают высокие уровни экспрессии белка, в частности промоторы и/или энхансеры, полученные из промотора FF-1a и поли-A BGH, цитомегаловирус (cytomegalovirus, CMV) (например, промотор/энхансер CMV), обезьяний вирус 40 (SV40) (например, промотор/энхансер SV40), аденовирус (например, главный поздний промотор аденовируса (adenovirus major late promoter (AdMLP)) и вирус полиомы. Вирусные регуляторные элементы и их последовательности описаны, например, в патентах США №№5168062, 4510245 и 4968615, все из которых включены в данное описание посредством ссылки.
[0055] Пригодные векторы, содержащие соответствующие регуляторные последовательности, включая промоторные последовательности, терминальнальные последовательности, последовательности полиаденилирования, энхансерные последовательности, маркерные гены и другие соответствующие последовательности, можно выбирать или конструировать. В описанном способе можно использовать также индуцируемую экспрессию белков, которую получают при помощи векторов с индуцируемыми промоторными последовательностями, в частности тетрациклин-индуцируемые векторы, например pTet-On™ и pTet-Off™ (Clontech, Palo Alto, CA). Дальнейшие детали, касающиеся векторов экспрессии, см., например, в работе Molecular Cloning: a Laboratory Manual (2nd ed.), eds. Sambrook et al., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1989). Кроме того, многие известные методики и протоколы манипуляций с нуклеиновыми кислотами, например получение конструктов нуклеиновых кислот, мутагенез, секвенирование, введение ДНК в клетки, генная экспрессия и анализ белков, подробно описаны в работе Current Protocols in Molecular Biology (2nd ed.), eds. Ausubel et al., Wiley & Sons, Alameda, CA (1992).
[0056] Полинуклеотид, введенный в экспрессионную модель для продуцирования полипептида, представляющего интерес, может кодировать любой полипептид, способный экпрессироваться в клетке-хозяине, которую используют в культуре клеток. Таким образом, полинуклеотид может кодировать продукты первичных генов, части первичных генов, пептиды или слитые белки. Такие полинуклеотиды могут состоять из геномной ДНК или кДНК и могут быть получены от любого животного. Полинуклеотиды могут быть выделены из клеток или организмов способами, хорошо известными специалистам в данной области техники, например способами полимеразной цепной реакции (PCR), или полимеразной цепной реакции с обратной транскрипцией (RT-PCR), или известными способами традиционного химического синтеза. Такие химически синтезированные полинуклеотиды могут иметь биологические свойства, подобные свойствам натуральных полинуклеотидов, и, следовательно, могут быть использованы в качестве заместителей натуральных полинуклеотидов.
[0057] Полипептиды можно также получать рекомбинантным способом путем функционального связывания полинуклеотида, который кодирует полипептид, представляющий интерес, с соответствующими регулирующими последовательностями в одном или более векторах экспрессии насекомых, в частности в бакуловирусных векторах, при использовании системы экспрессии клеток насекомых. Материалы и методики для систем экспрессии бакуловирус/St9 поставляются на рынок в форме наборов (например, набор МАХВАС®, Invitrogen, Carlsbad, СА).
[0058] Трансфекцию клеток хозяина, например клеток животных, конструктом экспрессии можно обеспечить многочисленными способами, которые хорошо известны специалистам в данной области техники. Клетки могут быть временно или постоянно трансфицированными. Существует несколько различных хорошо обоснованных способов доставки молекул, в частности молекул нуклеиновых кислот, в клетки хозяина, например в клетки животных. В зависимости от типа клеток, желаемой трансфекции (т.е. временной или постоянной) и конкретных условий эксперимента, в частности трансфекции сложных клеточных линий или первичных клеток, типа трансфицируемой молекулы (геномная ДНК, ДНК, олигонуклеотиды), или выбранной модели экспрессии каждый способ передачи имеет достоинства и недостатки, известные специалистам в данной области техники. Традиционные способы трансфекции включают, например, осаждение фосфатом кальция, липосомно-опосредованную трансфекцию, диэтиламиноэтилдекстран (DEAE Dextan)-опосредованную трансфекцию, генные пушки, электропорацию, доставку наночастиц, полиаминов, эписом и полиэтилениминов. Кроме того, различные компании серийно выпускают многочисленные наборы и реагенты для трансфекции, в частности Invitrogen (VOYAGER™, LIPOFECTIN®), EMD Biosciences, San Diego, CA (GENEJUICE™), Qiagen, Germantown, MD (SUPERFECT™), Orbigen, San Diego, CA (SAPPHIRE™) и многие другие, известные специалистам в данной области техники. Протоколы трансфекции можно найти также в работе Basic Methods in Molecular Biology (2nd ed.), eds. Davis et al., Appleton and Lange, CT (1994).
[0059] Настоящее изобретение использует клеточные культуры, например культуры для крупномасштабного получения клеток животных, чтобы получать полипептид, представляющий интерес, в больших количествах. Способы крупномасштабной временной трансфекции описаны в работах Large-scale Mammalian Cell Culture Technology (Biotechnology and Bioprocessing Series), ed. Lubiniecki, Marcel Dekker, NY (1990); Kunaparaju et al. (2005) Biotechnol. Bioeng. 91:670-77; Maiorella et al. (1988) Bio/Technology 6:1406-10; Baldi et al., supra; Lan Pham et al., supra; Meissner et al., supra; Durocher et al., supra). В общем случае крупномасштабная временная экспрессия генов в культурах клеток млекопитающих может использовать один из нескольких традиционных способов трансфекции, например полиэтиленимин, импульсное электрическое поле, CALFECTION™ или фосфат кальция, чтобы получить высокоэффективную трансфекцию в желаемых масштабах или объемах, например более 10 литров (Derouazi et al., supra; Rols et al. (1992) Eur. J. Biochem. 206(1):115-21; Wurm and Bernard. (1999) Curr. Opin. Biotechnol. 10(2): 156-59; Schlaeger and Christensen. (1999) Cytotechnology 30(1-3):71-83; Jordan et al. (1998) Cytotechnology 26(1):39-47; Lindell et al. (2004) Biochim. Biophys. Acta 1676(2): 155-61). Такие культуры для крупномасштабного производства клеток выращивают, как правило, в биореакторах, шейкерах или инкубаторах с пластинами для смешивания. Они могут быть известны также как "спин-культуры" или "суспензионные" культуры. Таким образом, в отличие от традиционных способов трансфекции, в которых клетки присоединяются к планшетам или колбам, в описанных способах обычно используют суспензионные культуры. Средой для крупномасштабного производства клеток обычно считают клеточные культуры, объем которых превышает примерно 100 мл.
[0060] В некоторых случаях можно сначала получать клеточные линии, которые экспрессируют полипептид, представляющий интерес, а затем использовать их для посева культуры клеток для крупномасштабного культивирования. Стабильные клеточные линии, которые экспрессируют белок, представляющий интерес, можно получить различными хорошо известными способами, включая описанные здесь способы временной трансфекции. Как правило, стабильные клеточные линии получают путем длительного выращивания и селекции в среде с определенными химическими характеристиками. Так, например, клетки, трансфицированные (в частности, путем осаждения фосфатом кальция или липосомной трансфекции) нуклеиновой кислотой, которая кодирует полипептид, представляющий интерес, могут быть параллельно трансфицированы вектором, содержащим неомицин-резистентный ген, который придает резистентность неомицину/генетицину (G418). Затем трансфицированные клетки выращивают в среде, содержащей G418, и выжившие клетки клонируют, чтобы получить клеточную линию со стабильной экспрессией. Далее аликвоты этой клеточной линии можно использовать для посева культуры для крупномасштабного культивирования и получения белка, представляющего интерес, в больших количествах.
[0061] Трансфицирование клеток требует оптимизации нескольких переменных, включая плотность посева клеток (в частности, примерно от 1×105 до примерно 3×106 клеток/мл культуры), концентрации сыворотки (например, 0-10%), температуру инкубации (в частности, примерно 20-38°C), носитель или реагент для трансфекции (химический или электрический), объем культуры (в частности, примерно 5 мл - 20 литров) и время инкубации (в частности, примерно 24-144 часа). Для каждого типа клеток оптимальные параметры будут изменяться. Однако изготовители обычно предоставляют рекомендации по оптимизации для трансфекции конкретных типов клеток, как и различные справочные материалы, известные специалистам в данной области техники, которые применяют трансфекцию соответствующей клетки-хозяина. Эти источники можно использовать для трансфекции выбранной клетки-хозяина или в качестве исходной точки, из которой простым методом проб и ошибок можно определить оптимальные параметры трансфекции.
Культивирование клеток
[0062] Типичные способы продуцирования полипептида, представляющего интерес, включают периодическое культивирование и культивирование с подпиткой. Способы периодического культивирования традиционно включают инокуляцию культуры для крупномасштабного производства посевной культурой с определенной плотностью клеток, выращивание клеток в условиях, способствующих росту и жизнеспособности клеток, сбор культуры, когда клетки достигают определенной плотности, и очистку экспрессированного полипептида. Способы культивирования с подпиткой включают одну или несколько дополнительных операций, когда при периодическом культивировании дополнительно вводят питательные вещества и другие компоненты, которые потребляются в процессе роста клеток. Для специалистов в данной области очевидно, что настоящее изобретение можно использовать в любой системе культивирования клеток, включая, в частности, но без ограничения, периодические, подпитываемые и перфузионнные системы. В некоторых предпочтительных вариантах реализации настоящего изобретения клетки выращивают в подпитываемых системах.
[0063] Постоянной и нерешенной проблемой традиционного культивирования, например периодического культивирования и культивирования с подпиткой, является образование метаболических побочных продуктов, которые оказывают отрицательное влияние на рост и жизнеспособность клеток, а также на продуцирование экспрессируемых полипептидов. Два метаболических побочных продукта, которые оказывают особенно вредное влияние, представляют собой лактат и аммоний, которые образуются в результате метаболизма глюкозы и глутамина соответственно. Кроме ферментного образования в результате метаболизма глутамина аммоний аккумулируется в клеточных культурах в результате неметаболического разложения с течением времени.
[0064] Традиционные составы среды, включая серийно выпускаемые составы, в частности Ham's F10 (Sigma), минимальную поддерживающую среду (Minimal Essential Medium, [MEM], Sigma)), RPMI-1640 (Sigma) и среду Игла, модифицированную по способу Дульбекко (Dulbecco's Modified Eagle's Medium ([DMEM], Sigma), имеют относительно высокое содержаение глюкозы и глутамина (последнего - по сравнению с другими аминокислотами). Ранее предполагали, что эти компоненты требуются в избытке, поскольку они являются основными источниками метаболической энергии для клеток. Однако, как указано выше, быстрое потребление этих питательных веществ приводит к аккумулированию лактата и аммония. Кроме того, высокое начальное содержание глюкозы и глутамина и последующее аккумулирование лактата и аммония приводит к высокой осмоляльности, к состоянию, которое само по себе часто является вредным для роста и жизнеспособности клеток, а также для продуцирования полипептидов. Описанная здесь рационально разработанная среда может быть модифицирована для уменьшения аккумулирования вредных метаболических продуктов. Такие модификации описаны, например, в опубликованных патентных заявках США №№2005/0070013 (ограниченная подпитка глюкозой) и 2006/0121568 (модификации содержания и соотношений аминокислот) (обе из которых полностью включены в данное описание в качестве ссылки).
Создание и составы рациональной среды
[0065] Традиционные составы среды начинаются с относительно низкого уровня общего содержания аминокислот по сравнению с составами среды согласно настоящему изобретению. Например, DME-F12 (смесь 50:50 среды Игла, модифицированной по способу Дульбекко, и среды Ham's F12) имеет общее содержание аминокислот 7.29 мМ, а традиционная среда для культивирования клеток, известная как RPMI-1640, имеет общее содержание аминокислот 6.44 мМ (см., например, Morton. (1970) In Vitro 6:89-108; Ham. (1965) Proc. Nat. Acad. Sci. U.S.A. 53:288-93; Moore et al. (1967) J. Am. Medical Assn. 199:519-24, все из которых включены в данное описание посредством ссылки). Более поздние составы среды (в частности, среда, описанная в опубликованной патентной заявке США №2006/0121568) имеют более высокое содержание аминокислот и питательных веществ. Однако традиционные составы не основаны на реальных расчетных требованиях к клеткам, которые включают выращивание и поддержание жизнедеятельности клеток, а также к клеточным культурам, которые используют для получения рекомбинантных полипептидов, и на требованиях продуцирования. Используя эти переменные, настоящее изобретение обеспечивает способы определения составов среды с гораздо более высоким, однако не токсичным общим содержанием аминокислот.
[0066] Описанные здесь составы среды для культивирования клеток, в частности составы среды для крупномасштабного культивирования клеток, при использовании, например, в соответствии с другими операциями культивирования и, например, с модификациями, описанными, например, в опубликованной патентной заявке США №2006/0121568, позволяют оптимизировать плотность клеток и титр полипептида. Концентрация аминокислот(ы) описанных здесь составов среды основана на концентрации аминокислот(ы), необходимой для: 1) клеточной массы, 2) поддержания жизнедеятельности клеток и 3) продуцирования полипептида. В одном варианте реализации изобретения среда для культивирования клеток содержит концентрацию аминокислот(ы), которую рассчитывают для использования в клеточной массе, концентрацию аминокислот(ы), которую рассчитывают для поддержания жизнедеятельности клеток, и концентрацию аминокислот(ы), которую рассчитывают для введения в полипептид, представляющий интерес. В другом варианте реализации изобретения среда для культивирования клеток имеет концентрацию А аминокислоты, которая представлена формулой A=[(M*X)+(N*P)+(Y*M*X)]*F, где X - концентрация аминокислоты, которую используют на единицу клеточной массы, Р - концентрация аминокислоты, которую используют для введения в полипептид, представляющий интерес, на единицу титра полипептида, М - коэффициент желаемой клеточной массы (т.е. желаемые пиковые единицы клеточной массы), N - коэффициент желаемой концентрации полипептида, представляющего интерес (т.е. желаемый или целевой титр полипептида), Y - коэффициент стабилизации клеток и F - коэффициент базового уровня.
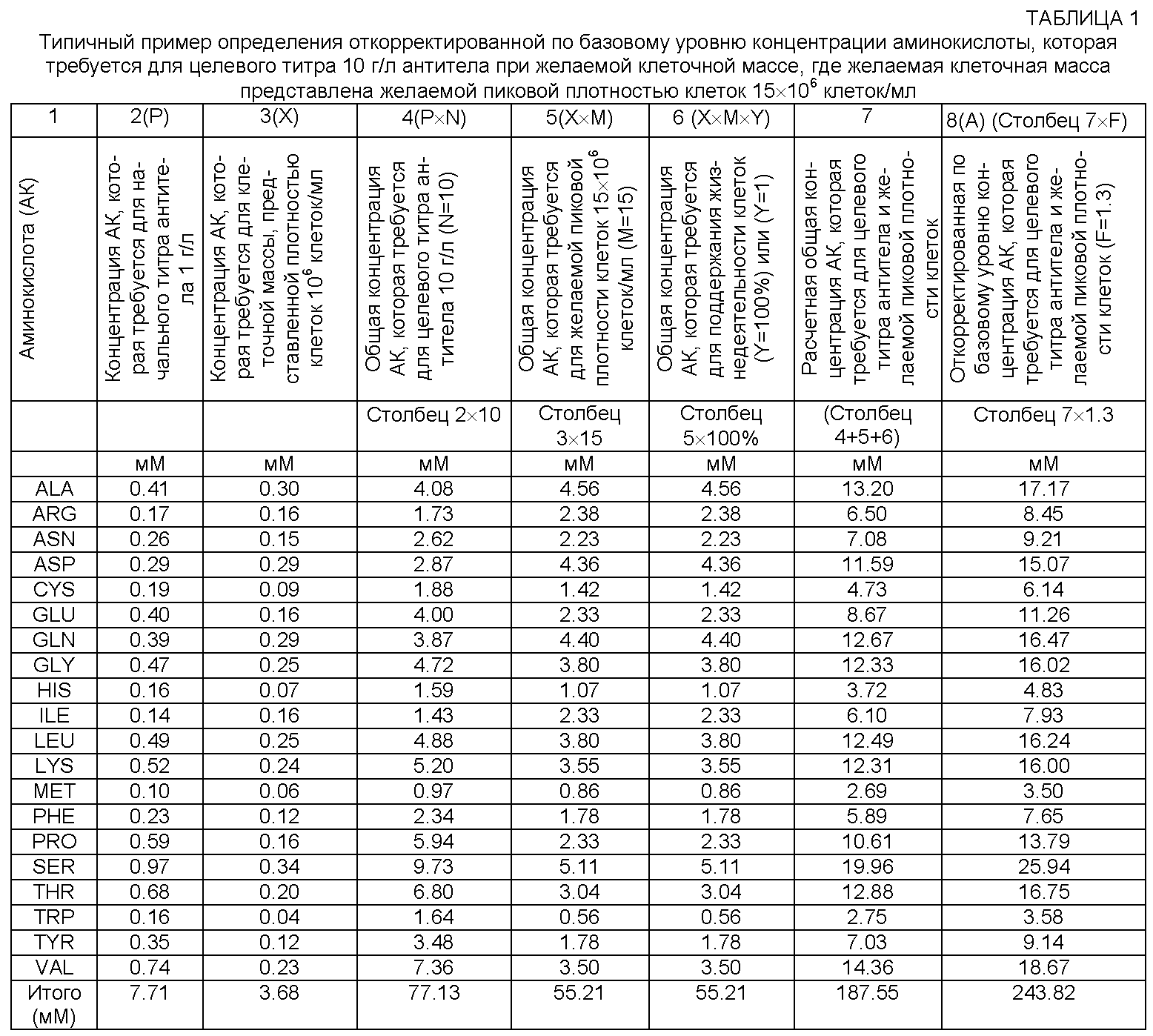
[0067] Концентрация Р аминокислоты, которую используют для введения в полипептид, представляющий интерес, на единицу титра полипептида в приведенной выше формуле, основана на первичной структуре рекомбинантного белка, т.е. на содержании аминокислот полипептида. Поэтому Р будет изменяться в зависимости от полипептида, который представляет интерес и который продуцируется клеточной культурой для крупномасштабного культивирования. Затем Р можно превратить в требуемую концентрацию аминокислот для целевой концентрации полипептида, представляющего интерес, при помощи N, коэффициента желаемой концентрации полипептида, представляющего интерес (т.е. желаемый или целевой титр полипептида). В некоторых репрезентативных примерах реализации изобретения, приведенных далее, базовый единичный титр полипептида равен 1 г/л. Ниже в таблице 1 показан типовой расчет с использованием приведенной здесь формулы, при этом концентрацию аминокислоты в среде для культивирования клеток, которая требуется для полипептида, представляющего интерес, с титром 10 г/л (столбец 4) определяют путем умножения концентрации Р аминокислоты, которая требуется для 1 г/л (столбец 2) на коэффициент N, где N=10.
[0068] Коэффициент N может быть рассчитан, например, путем умножения интегральной плотности жизнеспособных клеток (IVC) на удельную продуктивность (qp) конкретной клеточной линии (N=IVC*qp). Так, например, если плотность посева конкретной клеточной линии составляет 0.8×106 клеток/мл, плотность клеток на 6 и 10 день составляет 15×106 клеток/мл, а плотность клеток на 18 день составляет 11×106 клеток/мл (т.е. 73% от соответствующего значения на 6 и 15 дни), то IVC=211×106 (клеток/мл)*день (т.е. [(0.8+15)/2]*6 дней +[ (15+15)/2]*4 дней + [(15+11)/2]*8 дней). Если средняя удельная продуктивность (qp) выбранной клеточной линии составляет, например, 47 мкг/106 клеток/день, то N=10 г/л на 18 день (т.е. 211×106 (клеток/мл)*день × 47 мкг/106 клеток/день). Для специалиста в данной области техники очевидно, что эти расчеты можно произвести для любой клеточной линии и что N можно определить исходя из характеристик и происхождения клетки. Альтернативно коэффициент N можно не рассчитывать из IVC и qp, а просто принять в качестве разумного целевого титра для конкретной культуры клеток. Типовой расчет IVC и qp и последующий выбор разумных значений N и М приведен ниже в примере 5.
[0069] Термины "клеточная масса", "плотность клеток" и т.п., используемые в данном описании, относятся к совокупности клеток. Так, например, клеточная масса может относиться к клеточному осадку. Термин "желаемая клеточная масса" и т.п. относится к совокупности клеток, например к клеточному осадку, который практикующий специалист желает получить в культуре клеток. Термин "единица клеточной массы" и т.п. отражает различные способы представления клеточной массы, например количество клеток, плотность клеток, объем клеток, объем осажденных клеток, сухая масса клеток и т.п. Специалистам в данной области техники известно, какой способ является наиболее удобным и приемлемым для представления единицы клеточной массы и т.п. применительно к конкретным условиям эксперимента. Для специалистов в данной области техники также очевидно, что в зависимости от единицы клеточной массы коэффициент желаемой клеточной массы М, т.е. желаемые пиковые единицы клеточной массы, будет выражен желаемым пиковым количеством клеток, желаемой пиковой плотностью клеток, желаемым пиковым объемом клеток, желаемым пиковым объемом осажденных клеток, желаемой пиковой сухой массой или т.п.
[0070] В одном варианте реализации изобретения единица клеточной массы представлена плотностью клеток, а желаемая клеточная масса представлена желаемой пиковой плотностью клеток. В другом варианте реализации единица клеточной массы представлена сухим клеточным весом или массой. Дегидратированная клеточная масса содержит практически все белки, углеводы, липиды и нуклеиновые кислоты, присутствующие в этой клеточной массе. Поэтому концентрацию X аминокислоты можно определить экспериментально, получив вначале клеточный осадок путем центрифугирования известного количества клеток, высушив полученный клеточный осадок и подвергнув высушенный клеточный осадок гидролизу в кислой среде, вызвав тем самым расщепление клеточных белков клеточного осадка на отдельные аминокислоты, которые можно затем количественно определить при помощи анализатора аминокислот (см., в частности, пример 1). Это позволяет определить концентрацию X аминокислоты в данном количестве клеток, а затем превратить ее в требуемое содержание аминокислоты для желаемой пиковой плотности клеток, используя коэффициент М желаемой пиковой плотности клеток. В таблице 1 общую концентрацию аминокислот в среде для культивирования клеток, которая требуется для желаемой пиковой плотности клеток 15×106 клеток/мл (столбец 5), определяют путем умножения концентрации X аминокислоты, которая требуется для 106 клеток/мл (столбец 3) на коэффициент М, где М=15. Таким образом, в некоторых репрезентативных примерах реализации изобретения единица клеточной массы составляет 106 клеток/мл. Альтернативно, например, для аминокислот, чувствительных к разложению, концентрацию X аминокислоты, которую используют в приведенной выше формуле, можно определить из литературных данных, например Nyberg et al. (1999) Biotechnol. Bioeng. 62:324-35; Nadeau et al. (2000) Metab. Eng. 2:277-92 и Bonarius. (1996) Biotechnol. Bioeng. 50:299-318, или пользуясь способами, описанными в этих или аналогичных публикациях, известных специалистам в данной области техники.
[0071] Если коэффициент М для желаемой клеточной массы представляет желаемую пиковую плотность клеток, то М можно выбрать, например, как пиковую плотность конкретной клеточной линии, т.е. плотность, при которой продуктивность клеточной линии является максимальной, или как прогнозируемую плотность клеточной линии для конкретного периода времени исходя из удельной скорости роста.
[0072] Концентрация Y аминокислот в среде для культивирования клеток, которая требуется для поддержания жизнедеятельности клеток, представляет собой процентную концентрацию аминокислот, необходимую для получения желаемой клеточной массы, например желаемой пиковой плотности клеток. В одном варианте реализации изобретения требуемая концентрация для поддержания жизнедеятельности клеток составляет от 0% до 300% требуемой концентрации для получения желаемой клеточной массы, что обеспечивает достаточное количество питательных веществ для используемых клеток без риска возникновения токсичности, индуцированной питательными веществами. В другом варианте реализации изобретения требуемая концентрация для поддержания жизнедеятельности клеток составляет от 0% до 150% требуемой концентрации для получения желаемой клеточной массы, что обеспечивает достаточное количество питательных веществ для используемых клеток без риска возникновения токсичности, индуцированной питательными веществами. Требуемая концентрация для поддержания жизнедеятельности клеток возрастает по мере увеличения длительности культивирования (например, 100-150% концентрации для поддержания жизнедеятельности клеток для культивирования в течение 21 дня). В таблице 1 концентрацию аминокислот среды для культивирования клеток, которая требуется для поддержания жизнедеятельности клеток (столбец 6), определяют путем умножения концентрации аминокислоты, которая требуется для желаемой пиковой плотности клеток (столбец 5) на коэффициент Y стабилизации клеток, который в данном типичном примере равен 100%, чтобы обеспечить более длительный период культивирования. Коэффициент Y стабилизации отличается для различных клеток (и различных клеточных линий) в зависимости от конкретной метаболической потребности клеток в культуре. Кроме того, требуемая концентрация для поддержания жизнедеятельности клеток в культуре также будет отличаться вследствие вариабельности различных процессов, например плотности инокуляции, длительности культивирования, времени температурного сдвига и т.п. В качестве исходной рекомендации можно использовать, например, 0% для поддержания жизнедеятельности (ежедневно) при культивировании в 0-5 дни, 3-5% для поддержания жизнедеятельности (ежедневно) при культивировании в 6-10 дни и 7%-10% для поддержания жизнедеятельности (ежедневно) при культивировании в 11-21 дни. Если длительность процесса превышает 21 день, то для поддержания жизнедеятельности клеток можно обеспечить от 2% до 5% (ежедневно) для таких дополнительных дней. Для специалиста в данной области техники очевидно, что корректировка коэффициента Y стабилизации для оптимизации плотности и титра производится простым способом проб и ошибок. Корректировка концентрации аминокислот в соответствии с потребностью поддержания жизнедеятельности клеток является важным фактором для повышения жизнеспособности и продуктивности культуры клеток, и следовательно, важным аспектом настоящего изобретения. Так, например, адаптирование концентрации аминокислот к требуемой величине для поддержания жизнедеятельности клеток позволяет обеспечить более высокую плотность и жизнеспособность клеток в культуре и получить более высокий титр полипептида (см., в частности, пример 6).
[0073] После того как определены требования к концентрации аминокислот для получения желаемых параметров, а именно: 1) клеточной массы (столбец 5), 2) поддержания жизнедеятельности клеток (столбец 6) и 3) целевого титра продуцируемого полипептида (столбец 4), можно определить общую расчетную концентрацию аминокислот в целевой культуре клеток. В таблице 1 общую расчетную концентрацию аминокислот в среде для культивирования клеток, которая требуется для целевой культуры клеток (столбец 7), определяют путем сложения концентрации аминокислот среды для культивирования клеток, которая требуется для полипептида, представляющего интерес, с титром 10 г/л (столбец 4), концентрации аминокислот среды для культивирования клеток, которая требуется для желаемой пиковой плотности клеток 15×106 клеток/мл (столбец 5), и концентрации аминокислот среды для культивирования клеток, которая требуется для выбранного уровня поддержания жизнедеятельности клеток (столбец 6).
[0074] После того как общую расчетную концентрацию аминокислот среды, которая требуется для целевой культуры клеток, определяют, как описано выше, полученное значение корректируют до величины желаемой концентрации А аминокислот в среде для культивирования клеток при помощи коэффициента F базового уровня, который учитывает движущие силы переноса аминокислот, например дополнительного количества аминокислот, которое требуется для переноса массы, дополнительного количества аминокислот, которое требуется для осуществления переноса через клеточную мембрану, и т.п. Эта откорректированная величина А называется в данном описании "концентрацией аминокислот, откорректированной по базовому уровню" или "оптимизированной концентрацией". Концентрация А аминокислот, откорректированная по базовому уровню, представляет собой кумулятивную общую массу аминокислот(ы), которая будет введена в культуру, деленную на конечный объем культуры, который включает объем исходной среды плюс объем дополнительного питания для перфузионного культивирования или культивирования с подпиткой. Приведение общей концентрации аминокислот к концентрации аминокислот, откорректированной по базовому уровню, является важным аспектом изобретения, поскольку это позволяет повысить жизнеспособность и плотность клеток, а также увеличить титры полипептидов (см., в частности, пример 6).
[0075] Коэффициент базового уровня F, который увеличивает расчетную общую концентрацию аминокислот среды для культивирования клеток до 200%, лежит в пределах от 1 (увеличение 0%) до 3 (увеличение 200%). В одном варианте реализации изобретения диапазон изменения F ограничен 1 и 1.5. В другом варианте реализации изобретения можно сдвинуть значение F ниже 1 путем модификации расчетной общей концентрации аминокислот среды для культивирования клеток (таблица 1, столбец 7), что можно получить путем изменения концентрации аминокислот, которая требуется для желаемой клеточной массы, концентрации аминокислот, которая требуется для поддержания жизнедеятельности клеток, и/или концентрации аминокислот, которая требуется для введения в полипептид, представляющий интерес. Так, например, коэффициент базового уровня 0.5 можно получить, если увеличить расчетную общую концентрацию аминокислот среды для культивирования клеток, например, в два раза (или более), что можно обеспечить изменением параметров М, X, N, Р и/или Y. В таблице 1 концентрацию А аминокислот, откорректированную по базовому уровню, в среде для культивирования клеток, которая требуется для целевого титра и желаемой пиковой плотности клеток (столбец 8), определяют путем умножения расчетной общей концентрации аминокислот среды для культивирования клеток (столбец 7) на коэффициент базового уровня F, который в типичном примере в таблице 1 равен 1.3 (соответствует 30% увеличения расчетной общей концентрации аминокислот среды для культивирования клеток).
[0076] Среду, содержащую концентрацию А аминокислот, откорректированную по базовому уровню, называют "желаемой средой для культивирования клеток". Таким образом, "желаемая среда для культивирования клеток" представляет собой целевую среду, которая содержит концентрацию А, откорректированную по базовому уровню. Эта среда содержит концентрацию, по меньшей мере, одной аминокислоты, которую определяют по приведенной выше формуле. Предпочтительно желаемая среда для культивирования клеток содержит концентрацию более чем одной аминокислоты, которую определяют по приведенной выше формуле. Более предпочтительно желаемая среда для культивирования клеток содержит, по меньшей мере, двенадцать аминокислот с откорректированной концентрацией, например откорректированные концентрации аргинина, гистидина, изолейцина, лейцина, лизина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина, которые определяют по приведенной выше формуле. Для специалистов в данной области техники очевидно, что концентрацию А аминокислот, откорректированную по базовому уровню, в желаемой среде для культивирования клеток можно получить различными способами, включая, в частности, но без ограничения, отдельное добавление аминокислот(ы), добавление пептоновых или других белковых гидролизатов и/или добавление другой концентрированной среды для культивирования клеток (например, питательной среды для культивирования клеток (или комбинированной среды, например порошкообразной среды)) в исходную среду для культивирования клеток (или в комбинированную исходную среду для культивирования клеток, например в порошкообразную среду). Для специалиста в данной области техники очевидно, что добавление пептона (или другого белкового гидролизата) можно производить в соответствии с содержанием аминокислот конкретного выбранного пептонового продукта или на основании определения концентрации аминокислот, которую создает конкретный пептон. Так, например, в общем случае 5 г/л пептона обеспечивает общую концентрацию аминокислот примерно от 40 мМ до примерно 50 мМ.
[0077] Концентрация аминокислот в желаемой среде для культивирования клеток основана на концентрации А, по меньшей мере, одной аминокислоты, откорректированной по базовому уровню, которую определяют по формуле согласно настоящему изобретению. Однако эта концентрация, так же как и концентрации других аминокислот в желаемой среде для культивирования клеток, может отличаться от концентрации аминокислот(ы), откорректированной по базовому уровню, вследствие влияния нескольких факторов. Так, например, некоторые аминокислоты могут образовываться в процессе культивирования и, следовательно, могут сохраняться на низком уровне. Содержание других аминокислот может изменяться на основании опубликованных данных (см., например, опубликованную патентную заявку США №2006/0121568). Кроме того, некоторые аминокислоты, например метионин, могут потребляться отдельными типами клеток с повышенной скоростью, поэтому их следует добавлять в избытке. Еще одни аминокислоты, в частности пролин, обеспечивают движущую силу для роста клеток и продуцирования полипептида (см. пример 4). Эти аминокислоты необходимо добавлять в некоторых случаях в большем количестве, чем это определяется приведенной выше формулой согласно изобретению. Кроме того, можно изменять концентрацию аминокислот, откорректированную по базовому уровню, если концентрация, полученная по приведенной выше формуле, является токсичной (например, при определении содержания серина, тирозина, метионина и валина). Руководствуясь своими знаниями, специалист в данной области техники, определив концентрацию А аминокислот(ы), откорректированную по базовому уровню, для применения в желаемой среде для культивирования клеток, может изменить эту концентрацию на основании ряда факторов, в частности указанных выше.
[0078] Дополнительные компоненты среды, например витамины, соли, глюкоза, элементы, могут быть рассчитаны при помощи (или на основании) различных источников, например опубликованных патентных заявок США №№2005/0070013 и 2006/0121568. Кроме того, концентрацию А аминокислоты, откорректированную по базовому уровню и полученную по приведенной выше формуле, можно изменить, чтобы получить определенное отношение к другой аминокислоте (например, отношение глутамина к аспарагину) или создать желаемую комбинированную концентрацию (например, суммарную концентрацию глутамина и аспарагина). Например, известно, что среда с высоким содержанием аспарагина и низким содержанием глутамина в сочетании с температурным сдвигом способствует поглощению лактата, что обеспечивает детоксикацию культуры клеток (опубликованная патентная заявка США №2006/0121568). Таким образом, можно изменять концентрацию А глутамина и/или аспарагина, откорректированную по базовому уровню, чтобы получить оптимальное отношение этих компонентов.
[0079] Следует отметить, что в типичном примере в таблице 1 суммарная концентрация аминокислот, откорректированная по базовому уровню, для применения в желаемой среде для культивирования клеток является высокой, т.е. более 243 мМ. Таким образом, согласно настоящему изобретению можно использовать высокую концентрацию аминокислот в желаемой среде для культивирования клеток, не вызывая токсичности или ухудшения титра, если эта концентрация основана на расчетных требованиях к содержанию аминокислот для целевой плотности клеток и титра полипептида. В одном варианте реализации изобретения суммарная концентрация аминокислот в желаемой среде для культивирования клеток составляет примерно от 120 мМ до примерно 250 мМ. В других вариантах реализации суммарная концентрация аминокислот в желаемой среде для культивирования клеток превышает примерно 250 мМ и составляет, в частности, примерно 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500 или 510 мМ или имеет какое-либо промежуточное значение.
[0080] Определенную выше концентрацию А аминокислот, откорректированную по базовому уровню, которую используют в желаемой среде для культивирования клеток, можно применять в способах периодического, подпитываемого и перфузионного культивирования. В случае периодического культивирования начальная концентрация аминокислот, используемая в желаемой среде для культивирования клеток, представляет собой концентрацию аминокислот А, откорректированную по базовому уровню. В случае подпиточного или перфузионного культивирования концентрация А аминокислот, откорректированная по базовому уровню, представляет собой кумулятивную общую концентрацию аминокислот(ы), которую вводят в культуру и которая включает объем исходной среды плюс объем всех подпиток. Таким образом, для культивирования с подпитками, когда применяют непрерывную подпитку (например, в период с 3 по 21 день) или периодические подпитки (например, каждые 2-3 дня), исходную среду формируют таким образом, чтобы она содержала начальную концентрацию В аминокислот согласно формуле В=[А-(Z*V)]/(1-V), где Z представляет собой концентрацию аминокислот в питательной среде для культивирования клеток, а V - объем питательной среды культуры как часть объема желаемой среды для культивирования клеток. Типичный пример расчетов, необходимых для определения начальной концентрации аминокислот В, приведен ниже в таблице 2. В таблице 2 показано, что откорректированная по базовому уровню концентрация А аминокислот (столбец 2) пересчитывается в концентрацию В аминокислот в исходной среде (столбец 5) исходя из 17% объема подпитки (V=17%) и концентрации Z аминокислот питательной среды (столбец 4). В этом примере некоторые концентрации А аминокислот, откорректированные по базовому уровню (столбец 2), и исходные концентрации В аминокислот (столбец 5) изменены на значения, выделенные полужирным шрифтом в столбцах 3 и 6. Концентрации аспарагина, аспарагиновой кислоты, глутамина и цистина изменены в соответствии со значениями, предлагаемыми в опубликованной патентной заявке США №2006/0121568. Концентрацию метионина откорректировали на 50%, чтобы компенсировать его потребление на более высоком уровне по сравнению с прогнозом. Аланин, глутаминовая кислота и глицин образуются в процессе культивирования (и поэтому сохраняются на низком уровне). Концентрации серина, тирозина и валина снизили до нетоксичного уровня. Таким образом, следует понимать, что начальную концентрацию В аминокислот можно получить, исходя из концентрации А аминокислот, откорректированной по базовому уровню, или из модифицированной концентрации аминокислот, откорректированной по базовому уровню.
[0081] Для специалистов в данной области техники очевидно, что питательная среда, применяемая для получения желаемой среды для культивирования клеток способами подпиточного и перфузионного культивирования, должна иметь максимально возможную концентрацию, чтобы избежать переполнения контейнера, в котором производят культивирование (например, биореактор или шейкер) и исключить разбавление компонентов среды. В примере, показанном в таблице 2, предпочтительная питательная среда указана как "питательная среда", а концентрация Z аминокислот питательной среды показана в столбце 4. При этом можно использовать любую высококонцентрированную питательную среду или любой способ получения высокой концентрации аминокислот в исходной среде для культивирования клеток, если желаемая концентрация А аминокислот, откорректированная по базовому уровню, будет обеспечена в целевом объеме. Такие способы получения высокой концентрации аминокислот в культуре клеток хорошо известны специалистам в данной области техники и широко используются.
[0082] Для специалистов в данной области техники очевидно, что начальную концентрацию В аминокислот в исходной среде для культивирования клеток можно получить различными способами, включая, в частности, но без ограничения, отдельное добавление аминокислот(ы), добавление пептона и/или другого белкового гидролизата и/или добавление другой концентрированной культуральной среды (или комбинированной среды, например порошкообразной среды) в исходную среду для культивирования клеток (или в комбинированную исходную среду для культивирования клеток, например в порошкообразную среду). Для специалистов в данной области техники также очевидно, что концентрацию Z аминокислот в питательной среде для культивирования клеток можно получить различными способами, включая, в частности, но без ограничения, отдельное добавление аминокислот(ы), добавление пептона и/или другого белкового гидролизата и/или добавление другой концентрированной культуральной среды (или комбинированной среды, например порошкообразной среды) в питательную среду для культивирования клеток (или в комбинированную питательную среду для культивирования клеток, например в порошкообразную среду).
[0083] В типичном примере, представленном в таблице 2, показано, что суммарная концентрация аминокислот в исходной среде для культивирования клеток высока, т.е. более 125 мМ. Таким образом, согласно настоящему изобретению можно использовать высокую концентрацию аминокислот в исходной среде для культивирования клеток, не вызывая токсичности или ухудшения титра, если эта исходная концентрация основана на расчетных требованиях к содержанию аминокислот для желаемой пиковой плотности клеток и желаемого титра полипептида. В одном варианте реализации изобретения суммарная концентрация аминокислот составляет примерно от 70 мМ до примерно 510 мМ. В другом варианте реализации изобретения суммарная концентрация аминокислот составляет примерно от 120 мМ до примерно 350 мМ. В еще одном варианте реализации изобретения суммарная концентрация аминокислот в исходной среде для культивирования клеток составляет примерно от 70 мМ до примерно 140 мМ. В следующем варианте реализации изобретения суммарная концентрация аминокислот в исходной среде для культивирования клеток превышает примерно 140 мМ.
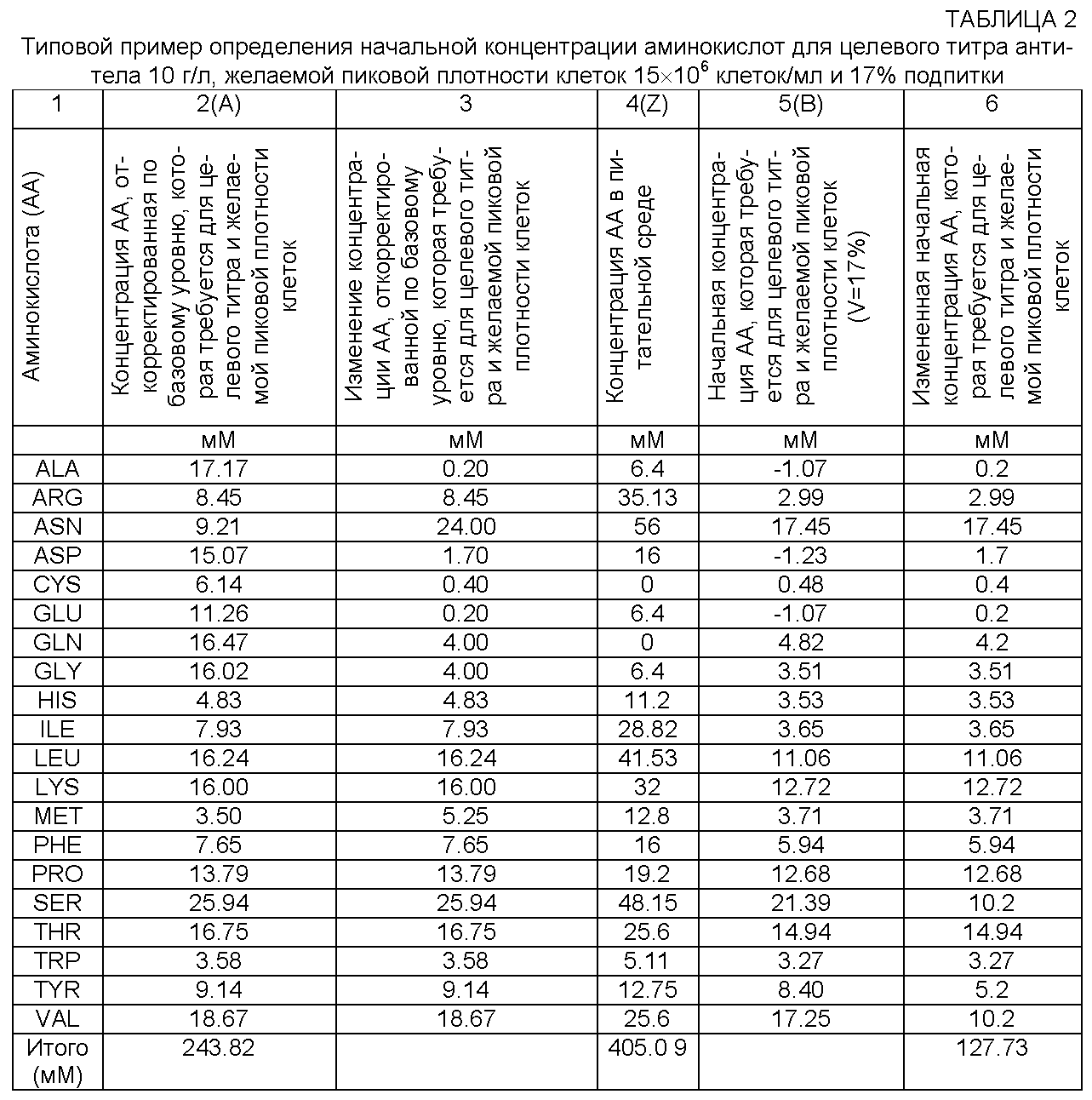
[0084] Как показано в таблице 3А и таблице 3B, определение концентрации А аминокислот, откорректированной по базовому уровню и используемой в желаемой среде для культивирования клеток, и определение начальной концентрации В аминокислот, используемой в исходной среде для культивирования клеток, можно рассчитать для любого желаемого целевого титра полипептида и желаемой пиковой (целевой) плотности клеток. Желаемая пиковая плотность клеток культуры для крупномасштабного культивирования изменяется примерно от 3 до примерно 40×106 клеток/мл для культивирования с подпиткой. В одном варианте реализации изобретения желаемая пиковая плотность клеток изменяется примерно от 5 до примерно 20×106 клеток/мл. Целевой титр культуры клеток для крупномасштабного культивирования изменяется примерно от 3 до примерно 25 г/л. В еще одном варианте реализации изобретения целевой титр культуры клеток для крупномасштабного культивирования изменяется примерно от 5 до примерно 20 г/л. Например, как показано в таблице 3, желаемая пиковая плотность клеток изменяется от 10 до 15×106 клеток/мл, а целевой титр изменяется от 3 до 10 г/л.
|
|
[0085] Используя формулу для определения концентрации аминокислот, откорректированной по базовому уровню, и разрабатывая желаемые составы среды для культивирования клеток, предназначенной для крупномасштабного производства полипептидов, авторы настоящего изобретения установили несколько критериев, которые обеспечивают высокий титр и высокую плотность клеток в культуре. Критерии содержания аминокислот для получения титра, превышающего 5 г/л, представлены значениями, указанными в таблице 4, и включают, в частности, но без ограничения, один или более из следующих: больше или равно примерно 3 мМ тирозина, примерно от 7 мМ до примерно 30 мМ пролина, примерно от 7 мМ до примерно 30 мМ валина, примерно от 7 мМ до примерно 30 мМ лейцина, примерно от 7 мМ до примерно 30 мМ треонина, примерно от 7 мМ до примерно 30 мМ лизина, суммарная концентрация лейцина, лизина, пролина, треонина и валина составляет примерно от 35 мМ до примерно 150 мМ, суммарная концентрация лейцина, лизина, треонина и валина составляет примерно от 60% до примерно 80% общего содержания незаменимых аминокислот в желаемой среде для культивирования клеток, суммарная концентрация незаменимых аминокислот в желаемой среде для культивирования клеток составляет примерно от 30% до примерно 50% общего содержания аминокислот, и/или общая концентрация всех аминокислот составляет примерно от 75 мМ до примерно 510 мМ.
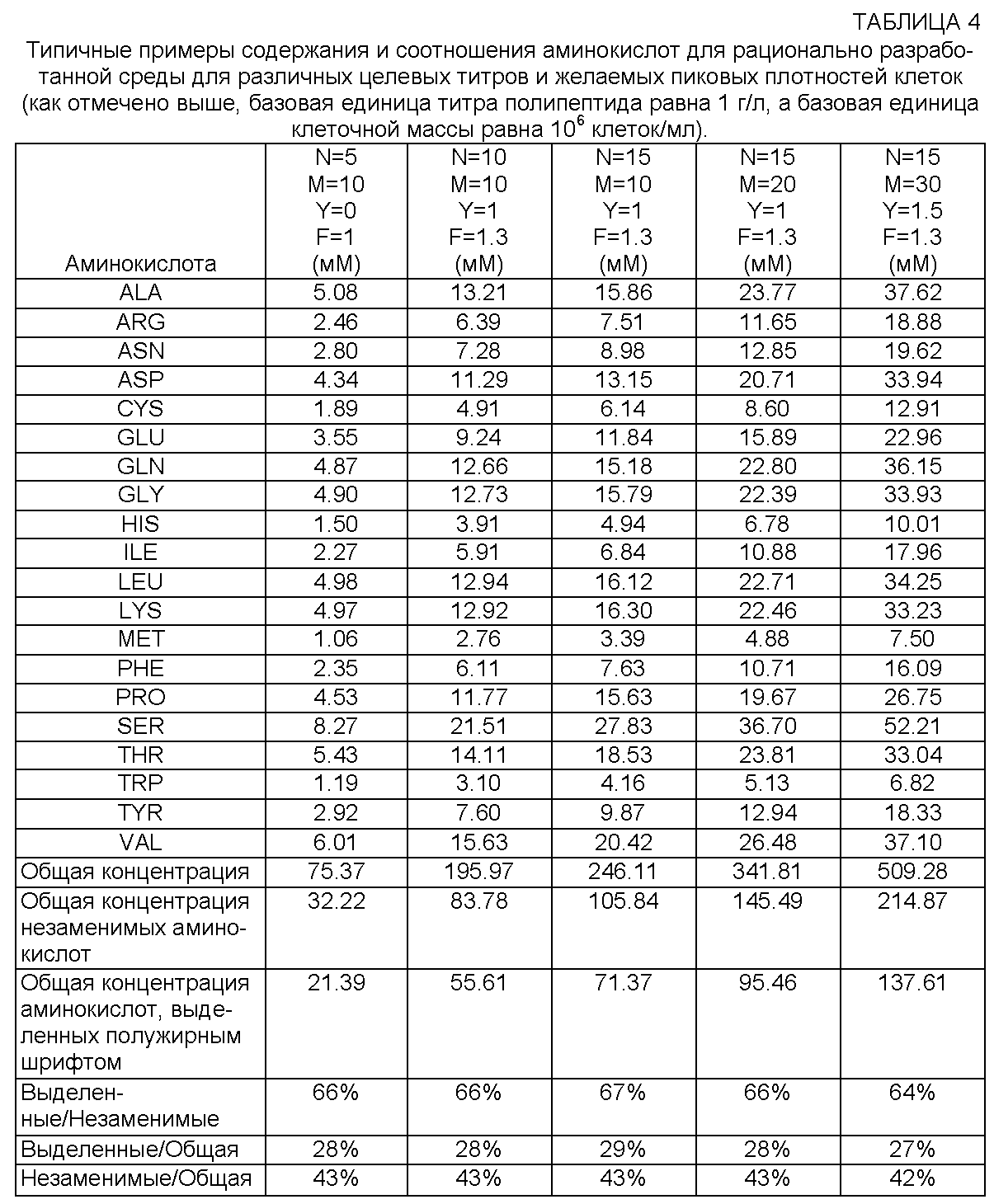
[0086] В таблице 4 полужирным шрифтом выделены следующие аминокислоты: валин, треонин, лейцин и лизин. Незаменимые аминокислоты показаны курсивом (например, аргинин, гистидин, лейцин, изолейцин, лизин, метионин, триптофан, треонин и валин; для клеточных культур СНО пролин является дополнительной незаменимой аминокислотой; для специалистов в данной области техники очевидна возможность изменения определения незаменимых аминокислот применительно к различным клеткам и т.п.). В таблице 4 показаны типичные варианты желаемой среды для клеток СНО для различных значений целевой плотности (М) клеток, целевого титра (N), коэффициента (Y) стабилизации клеток и коэффициента (F) базового уровня.
[0087] Для специалиста в данной области техники очевидно, что рационально разработанную среду согласно изобретению можно использовать для получения полипептида, представляющего интерес, или для культивирования клеток, которые не предназначены для производства полипептида. В соответствии с этим рационально разработанную среду можно использовать в описанных способах культивирования клеток, например, для эффективного выращивания, репликации и/или поддержания клеточных культур, например клеточных культур для крупномасштабного производства, которые не содержат клеток хозяина, сконструированных для производства экзогенного полипептида, представляющего интерес, или которые не культивируются для производства эндогенного полипептида, представляющего интерес. В таком случае желаемая среда для культивирования клеток не предусматривает наличия аминокислот, которые требуются для введения в полипептид, представляющий интерес, а вместо этого содержит концентрацию аминокислот, которая требуется для: 1) желаемой клеточной массы и 2) поддержания жизнедеятельности клеток. Такая желаемая среда для культивирования клеток, применяемая в описанных способах культивирования клеток, содержит концентрацию А' аминокислоты, откорректированную по базовому уровню, согласно формуле A'=[(M*X)+(Y*M*X)]*F, где X - концентрация аминокислоты, которую используют в расчете на единицу клеточной массы, М - коэффициент желаемой пиковой клеточной массы (например, желаемой пиковой плотности клеток и т.п.) культуры клеток, Y - коэффициент стабилизации клеток, a F - коэффициент базового уровня. Желаемую среду для культивирования клеток, которую получают в соответствии с этой формулой, вводят в культуру клеток при условиях, позволяющих обеспечить рост и репликацию клеток в указанной культуре клеток. В одном варианте реализации изобретения способ культивирования клеток использует крупномасштабное культивирование. В другом варианте реализации изобретения способ культивирования клеток использует клетки животных.
Добавление пролина в среду для культивирования клеток
[0088] Применение среды, рационально разработанной способами, описанными в данном изобретении, позволило установить, что поддержание высокого уровня пролина на протяжении всего периода культивирования клеток, например крупномасштабного культивирования клеток, приводит к повышению титра полипептида и увеличению плотности клеток. Такая "пороговая концентрация" пролина составляет примерно от 1 мМ до примерно 2 мМ, и поддержание уровня пролина в культуре клеток выше этой пороговой концентрации является движущей силой для получения клеточных культур для крупномасштабного производства с высокой плотностью клеток и с высоким титром. Интересно, что вызываемое пролином увеличение титра полипептида и жизнеспособности клеток параллельно увеличивает потребность культуры в дополнительном количестве аминокислот (чтобы удовлетворить повышение интенсивности потребления). Этот факт, по меньшей мере, частично объясняет, почему описанные здесь рационально разработанные составы среды имеют высокую концентрацию аминокислот.
Получение культуры клеток
[0089] Различные способы подготовки клеток млекопитающих для производства полипептидов путем периодического и подпиточного культивирования хорошо известны специалистам в данной области техники. Как описано выше, нуклеиновую кислоту в достаточном количестве для обеспечения экспрессии (обычно - вектор, содержащий нуклеиновую кислоту, которая кодирует полипептид, представляющий интерес, и функционально связанные генетические регуляторные элементы) можно ввести в линию клетки-хозяина несколькими хорошо известными способами. Обычно клетки подвергают скринингу, чтобы определить, какие именно клетки хозяина фактически поглощают вектор и экспрессируют полипептид или белок, представляющий интерес. Традиционные способы определения конкретного полипептида или белка, представляющего интерес и экспрессируемого клетками млекопитающих, включают, в частности, но без ограничения, иммуногистохимию, иммунопреципитацию, проточную цитометрию, иммунофлуоресцентную микроскопию, анализ методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), вестерн-блоттинг, твердофазный иммуноферментный анализ (ELISA), методы высокоэффективной жидкостной хроматографии (HPLC), анализы биологической активности и аффинную хроматографию. Специалистам в данной области техники известны другие соответствующие способы определения экспрессированных полипептидов или белков. Если множество клеток хозяина экспрессирует полипептид или белок, представляющий интерес, можно использовать некоторые или все указанные способы, чтобы определить, какие клетки экспрессируют этот полипептид или белок в максимальной степени.
[0090] После идентификации клетки, которая экспрессирует полипептид или белок, представляющий интерес, эту клетку репродуцируют в культуре одним из многих способов, хорошо известных специалистам в данной области техники. Обычно клетку, которая экспрессирует полипептид или белок, представляющий интерес, репродуцируют путем выращивания при температуре и в среде, которые являются благоприятными для выживания, роста и жизнеспособности клетки. Исходная культура может занимать любой объем, однако этот объем часто является меньшим, чем объем культивирования в производственном биореакторе, который используют на конечной стадии производства полипептида или белка, представляющего интерес, и клетки часто пассируют несколько раз в биореакторах с возрастающим объемом перед посевом в продукционный биореактор. Культуру клеток можно перемешивать или встряхивать для увеличения оксигенации среды и диспергирования питательных веществ в клетках. Альтернативно или дополнительно для повышения и регулирования оксигенации культуры можно использовать специальные разбрызгивающие устройства, которые хорошо известны специалистам в данной области техники. Для специалистов в данной области техники очевидно, что согласно настоящему изобретению можно успешно контролировать или регулировать определенные внутренние условия культивирования клеток, включая, в частности, но без ограничения, pH (например, от 6.6 до 7.6), температуру (например, от 25°С до 42°С), содержание кислорода и диоксида углерода (например, O2: от 10% до 80% и CO2: от 7% до 15% в процессе культивирования), осмоляльность (например, исходная осмоляльность от 260 до 340 мОсм/кг) и т.п.
[0091] Термин "инокулят", используемый в данном описании, относится к объему клеток, содержащему нуклеиновую кислоту, которая экспрессирует полипептид, представляющий интерес, и применяемому для посева в промышленный резервуар, где получают культуру клеток животных для крупномасштабного производства, например в продукционный биореактор. В одном варианте реализации изобретения объем инокулята составляет примерно от 60 до 80% конечного объема.
[0092] Специалист в данной области техники может выбрать исходную плотность клеток в продукционном биореакторе. Согласно настоящему изобретению исходная плотность клеток в продукционном биореакторе может быть низкой, вплоть до одной клетки на объем культивирования. В предпочтительных вариантах реализации настоящего изобретения исходные плотности клеток в продукционном биореакторе могут составлять примерно от 0.1×106 жизнеспособных клеток на мл до примерно 10×106 жизнеспособных клеток на мл и выше.
[0093] Начальная и промежуточная клеточные культуры могут быть выращены до любой желаемой плотности перед посевом в следующий промежуточный или конечный продукционный биореактор. В одном варианте реализации изобретения плотность клеток инокулята составляет примерно 0.5-1×106 клеток/мл. Предпочтительно, чтобы большинство клеток перед посевом оставалось живыми, хотя полной или почти полной жизнеспособности не требуется. В одном варианте реализации настоящего изобретения клетки могут быть удалены из надосадочной жидкости, например, при помощи низкоскоростного центрифугирования. Может оказаться желательным промыть удаленные клетки со средой перед посевом в следующий биореактор для удаления каких-либо нежелательных метаболических побочных продуктов или компонентов среды. Указанная среда может представлять собой ту же самую среду, в которой были предварительно выращены клетки, или другую среду, или промывочный раствор, выбранные практикующим специалистом согласно настоящему изобретению.
[0094] Затем клетки можно разбавить до соответствующей плотности для посева в продукционный биореактор. Клетки можно разбавить в другой среде или растворе, например в исходной среде для культивирования клеток или желаемой среде для культивирования клеток, в зависимости от потребностей и пожеланий практикующего специалиста согласно настоящему изобретению или для удовлетворения конкретных требований, предъявляемых к самим клеткам (например, если клетки нужно хранить в течение короткого периода времени перед посевом в продукционный биореактор).
Начальная фаза роста
[0095] После проведения посева в продукционном резервуаре, как описано выше, культуру клеток животных можно поддерживать в начальной фазе роста в желаемой среде для культивирования клеток, полученных в соответствии с приведенной здесь формулой согласно изобретению, и в условиях, благоприятных для выживания, роста и жизнеспособности культуры клеток. Точные условия будут изменяться в зависимости от типа клеток, организма, из которого они получены, природы и характера экспрессированного полипептида или белка.
[0096] Продукционный биореактор может иметь любой объем, который пригоден для крупномасштабного производства полипептидов или белков. В предпочтительном варианте реализации объем продукционного биореактора составляет, по меньшей мере, 500 литров. В других предпочтительных вариантах реализации продукционный биореактор имеет объем 1000, 2500, 5000, 8000, 10000, 12000 литров или более или имеет любой промежуточный объем. Специалисты в данной области техники имеют информацию о пригодных биореакторах для применения при реализации настоящего изобретения, которые они могут выбирать. Продукционный биореактор может быть выполнен из любого материала, который благоприятен для роста и жизнеспособности клеток и не оказывает отрицательного влияния на экспрессию или стабильность продуцируемого полипептида или белка.
[0097] Температуру культуры клеток в начальной фазе роста выбирают исходя главным образом из диапазона температур, в котором культура клеток остается жизнеспособной. Так, например, во время начальной фазы роста клетки СНО хорошо растут при 37°С. В общем случае большинство клеток млекопитающих хорошо растет в диапазоне температур примерно от 35°С до 39°С. В одном варианте реализации изобретения температура фазы роста (от 0 до 3-го дня) составляет 37°С, а температура для фазы продуцирования (после 3-го дня) составляет 31°С. Специалисты в данной области техники могут выбрать соответствующую температуру или диапазон температур для выращивания клеток в зависимости от потребности клеток и требований практикующих специалистов к производству белка или полипептида.
[0098] В одном варианте реализации настоящего изобретения температуру начальной фазы роста поддерживают на одном постоянном уровне. В другом варианте реализации температуру начальной фазы роста поддерживают в некотором диапазоне. Так, например, температуру можно непрерывно увеличивать или уменьшать во время начальной фазы роста. Альтернативно температуру во время начальной фазы роста можно увеличивать или уменьшать на дискретную величину в различные периоды времени. Специалисты в данной области техники могут определить, следует ли использовать одно или несколько значений температуры и следует ли изменять температуру непрерывно или дискретно.
[0099] Клетки можно выращивать в начальной фазе роста в течение большего или меньшего периода времени в зависимости от задач практикующего специалиста и требований к самим клеткам. В одном варианте реализации клетки выращивают в течение периода времени, достаточного для получения плотности жизнеспособных клеток, представляющей собой заданное процентное отношение к максимальной плотности жизнеспособных клеток, которая была бы достигнута в конечном итоге, если бы рост клеток не нарушался. Так, например, клетки могут быть выращены в течение периода времени, достаточного для достижения желаемой плотности жизнеспособных клеток, которая составляет 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99 процентов или более от максимальной плотности жизнеспособных клеток.
[0100] В другом варианте реализации клетки выращивают в течение определенного периода времени. Например, в зависимости от начальной концентрации культуры клеток, температуры, при которой выращивают клетки, и естественной скорости роста клетки можно вырастить в течение 0, 1,2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более дней. В некоторых случаях клетки можно выращивать в течение месяца или более. Клетки можно вырастить за 0 дней в продукционном биореакторе, если их выращивание в посевном биореакторе при температуре начальной фазы роста было достаточным для того, чтобы плотность жизнеспособных клеток в продукционном биореакторе во время посева была равна желаемому процентному отношению к максимальной плотности жизнеспособных клеток. Практикующий специалист согласно настоящему изобретению сможет выбрать длительность начальной фазы роста в зависимости от требований к производству полипептида или белка и потребностей самих клеток.
[0101] Культуру клеток можно перемешивать или встряхивать во время начальной фазы культивирования для увеличения оксигенации среды и диспергирования питательных веществ в клетках. Для специалистов в данной области техники очевидно, что согласно настоящему изобретению можно успешно контролировать или регулировать определенные внутренние условия в биореакторе во время начальной фазы роста, включая, в частности, но без ограничения, pH, температуру, оксигенацию и т.п. Так, например, pH можно регулировать, добавляя соответствующее количество кислоты или основания, а оксигенацию можно регулировать при помощи разбрызгивающих устройств, которые хорошо известны специалистам в данной области техники.
Изменение условий культивирования
[0102] В конце начальной фазы роста условия культивирования могут быть изменены таким образом, чтобы применить второй режим условий культивирования и вызвать метаболический сдвиг в культуре. Аккумулирование ингибирующих метаболитов, в первую очередь - лактата и аммония, подавляет рост. Метаболический сдвиг, который происходит, например, в результате изменения температуры, pH, осмоляльности или уровня химической индукции культуры клеток, может характеризоваться, например, уменьшением отношения удельной скорости продуцирования лактата к удельной скорости потребления глюкозы. В одном неограничительном примере реализации изобретения условия культивирования изменяют путем изменения температуры культивирования. В другом варианте реализации изобретения изменение температуры производят на 1-7 дни. В следующем варианте реализации изобретения температуру смещают до 29°С-32°С. В еще одном варианте реализации изобретения на 3 день температуру изменяют до 31°С. Рекомендации, которые касаются изменения температуры и метаболического сдвига, можно найти в литературе (см., например, опубликованную патентную заявку США №US 2006/0121568).
Следующая фаза продуцирования
[0103] После изменения условий, как указано выше, дальнейшее культивирование клеток может происходить в субсеквентной фазе продуцирования при применении второго режима условий, благоприятных для выживания и жизнеспособности культуры клеток и обеспечивающих экспрессию желаемого полипептида или белка в адекватных количествах, например в промышленных масштабах.
[0104] Как указано выше, изменение режима культивирования можно произвести путем изменения одного или более условий культивирования, включая, в частности, но без ограничения, температуру, pH, осмоляльность и содержание бутирата натрия. В одном варианте реализации изобретения изменяют температуру культивирования. Согласно этому варианту реализации во время следующей фазы продуцирования температуру или диапазон температур культивирования поддерживают на более низком уровне по сравнению с начальной фазой роста. Так, например, во время следующей фазы продуцирования клетки СНО хорошо экспрессируют рекомбинантные полипептиды и белки в диапазоне температур от 25°С до 35°С. В одном варианте реализации изобретения фаза продуцирования начинается после 3 дня. В другом варианте реализации изобретения фаза продуцирования протекает при температуре 31°С. Как указано в опубликованной патентной заявке США №US 2006/0121568, различные дискретные температурные сдвиги можно использовать для повышения плотности или жизнеспособности клеток или для увеличения экспрессии рекомбинантного полипептида или белка.
[0105] В соответствии с формулой, приведенной в настоящем изобретении желаемую клеточную массу (например, плотность клеток) и продуцируемый титр (например, целевой титр) выбирают, чтобы определить концентрацию А аминокислот, откорректированную по базовому уровню, и исходную концентрацию В аминокислот. Поэтому в общем случае клетки поддерживают в фазе продуцирования до тех пор, пока не будет достигнута величина желаемой плотности клеток или продуцируемого титра или близких к ним значений. В одном варианте реализации клетки поддерживают в фазе продуцирования до тех пор, пока титр рекомбинантного полипептида или белка не достигнет максимума. В других вариантах реализации культуру можно собирать до достижения этой точки в зависимости от требований к продуцированию, выдвигаемых практикующим специалистом, или потребностей или жизнеспособности самих клеток. Так, например, клетки могут поддерживаться в течение периода времени, достаточного для достижения плотности жизнеспособных клеток, составляющей 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 99 процентов или более от максимальной плотности жизнеспособных клеток. В некоторых случаях может оказаться желательным достичь максимальной плотности жизнеспособных клеток, а затем снизить ее до определенного уровня перед сбором культуры. В экстремальном случае перед сбором культуры может быть желательным получение плотности жизнеспособных клеток, близкой или равной нулю.
[0106] В другом варианте реализации настоящего изобретения клетки выращивают в течение определенного периода во время фазы продуцирования. Например, в зависимости от концентрации культуры клеток в начале фазы роста, температуры, при которой выращивают клетки, и естественной скорости роста клеток можно вырастить клетки за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более дней. В некоторых случаях клетки могут выращиваться в течение одного месяца или более. Практикующий специалист согласно настоящему изобретению сможет выбрать продолжительность фазы продуцирования в зависимости от требований производства полипептида или белка и потребностей самих клеток. Продолжительность культивирования позволит определить концентрацию аминокислот, которая требуется для поддержания жизнедеятельности клеток и которая может изменяться согласно настоящему изобретению, например, от 0% до 150% концентрации аминокислот, требуемой для клеточной массы.
[0107] В некоторых случаях может быть полезным или необходимым пополнять культуру клеток, т.е. подпитывать культуру клеток во время фазы продуцирования питательными веществами или другими компонентами среды, которые потребляются или метаболизируются клетками. Например, может оказаться предпочтительным пополнять культуру клеток питательными веществами или другими компонентами среды, которые потребляются согласно наблюдениям во время мониторинга культуры клеток (см. следующий раздел "Мониторинг состояния культуры клеток"). Альтернативно или дополнительно может оказаться полезным или необходимым дополнять культуру клеток перед фазой продуцирования. В качестве неограничительных примеров может оказаться полезным или необходимым дополнять культуру клеток гормонами и/или другими факторами роста, некоторыми ионами (в частности, ионами натрия, хлора, кальция, магния и фосфора), буферами, витаминами, нуклеозидами или нуклеотидами, микроэлементами (неорганические соединения обычно имеют очень низкие конечные концентрации), липидами, аминокислотами или глюкозой (или другим источником энергии).
[0108] Все эти дополнительные компоненты можно добавлять, т.е. подпитывать среду для культивирования клеток, единовременно или в форме последовательных добавлений. В одном варианте реализации настоящего изобретения дополнительные компоненты вводят для культивирования клеток несколько раз пропорциональными порциями. В другом варианте реализации может быть желательным ввести вначале определенные дополнительные компоненты, а остальные компоненты добавлять в более позднее время. В еще одном варианте реализации настоящего изобретения культуру клеток непрерывно подпитывают указанными дополнительными компонентами.
[0109] Согласно настоящему изобретению общий объем, добавленный для культивирования клеток, оптимально поддерживать на минимальном уровне. Так, например, общий объем питательной среды или раствора, содержащего дополнительные компоненты и добавляемого для культивирования клеток, может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45 или 50% от объема культуры клеток перед введением дополнительных компонентов. Поэтому питательную среду следует концентрировать, чтобы избежать переполнения биореактора или разбавления компонентов среды. Питательную среду предпочтительно вводят в основную культуру при таком же значении pH, температуры и т.п., однако с более высокими концентрациями питательных веществ относительно исходной среды. В одном варианте реализации изобретения указанная питательная среда представляет собой питательную среду, обозначенную как "питательная среда" в столбце 4 таблицы 2.
[0110] В одном варианте реализации изобретения в культуру клеток с исходной концентрацией В аминокислот аминокислоты вводят в дополнительном количестве, чтобы получить откорректированную по базовому уровню концентрацию А аминокислот. В другом варианте реализации изобретения культуру клеток непрерывно подпитывают примерно в период с 3 по 21 день или периодически каждые 2-3 дня. В другом варианте реализации изобретения подпитываение производят примерно с 3 до примерно 20 дня (при культивировании в течение 21 дня) в форме подпиток болюсами. В другом варианте реализации изобретения подпитывание производят в форме периодических подпиток примерно каждые 2-3 дня. В еще одном варианте реализации изобретения объем подпитки составляет примерно от 1% до примерно 40% общего объема культуры клеток.
[0111] Культуру клеток можно перемешивать или встряхивать во время начальной фазы культивирования для увеличения оксигенации среды и диспергирования питательных веществ в клетках. Для специалистов в данной области техники очевидно, что согласно настоящему изобретению можно успешно контролировать или регулировать определенные внутренние условия в биореакторе во время начальной фазы роста, включая, в частности, но без ограничения, pH, температуру, оксигенацию и т.п. Так, например, pH можно регулировать, добавляя соответствующее количество кислоты или основания, а оксигенацию можно регулировать разбрызгивающими устройствами, которые хорошо известны специалистам в данной области техники.
Мониторинг состояния культуры клеток
[0112] В некоторых вариантах реализации настоящего изобретения для практикующего специалиста может оказаться полезным или необходимым периодический контроль конкретного состояния выращиваемой культуры клеток. Мониторинг состояния культуры клеток позволяет практикующему специалисту определить, продуцирует ли культура клеток рекомбинантный полипептид, представляющий интерес, на субоптимальном уровне или культура начинает входить в субоптимальную фазу продуцирования. Для контроля отдельных параметров состояния клеточной культуры может оказаться необходимым отбор аликвот культуры для анализа. Специалисты в данной области техники понимают, что указанный отбор потенциально может вводить загрязнения в культуру клеток, и примут соответствующие меры, чтобы минимизировать опасность таких загрязнений.
[0113] Неограничительными примерами параметров, контроль которых может оказаться полезным или необходимым, являются температура, pH, плотность клеток, жизнеспособность клеток, интегральная плотность жизнеспособных клеток, содержание лактата, содержание аммония, осмоляльность или титр экспрессируемого полипептида, специалистам в данной области техники хорошо известны многочисленные способы, которые позволяют измерять эти параметры. Так, например, плотность клеток можно измерить при помощи гемацитометра, счетчика Культера или системы контроля плотности клеток (CEDEX®, Innovatis, Malvern, РА). Плотность жизнеспособных клеток можно определить способом окрашивания образца культуры трипановым синим красителем. Поскольку только мертвые клетки поглощают трипановый синий (т.е. жизнеспособные клетки не воспринимают краситель), плотность жизнеспособных клеток можно определить, сосчитав общее количество клеток, разделив количество клеток, которые поглощают краситель, на общее количество клеток и взяв обратную величину. ВЭЖХ можно использовать для опеределения содержания лактата, аммония или экспрессированного полипептида или белка. Альтернативно содержание экспрессированного полипептида или белка можно определить стандартными методами анализа молекулярной биологии, включая, в частности, метод электрофореза полиакриламидных гелей в присутствии додецилсульфата натрия с окрашиванием красителем кумасси, вестерн-блоттинг, метод Брэдфорда, метод Фолина-Чикальтеу, метод биуретовой реакции и метод ультрафиолетового поглощения. Кроме того, может оказаться полезным или необходимым контролировать посттрансляционные модификации экспрессированного полипептида или белка, включая фосфорилирование и гликозилирование.
Сбор полипептидов, продуцированных культурой клеток
[0114] Полипептид, представляющий интерес и продуцированный культурой клеток, затем может быть очищен от культуральной среды или от клеточных экстрактов для применения в различных областях. Растворимые формы полипептида можно очистить от кондиционированных сред. Мембраносвязанные формы полипептида можно очистить путем получения общей мембранной фракции из экспрессирующей клетки и экстрагирования мембран неионным детергентом, в частности TRITON® Х-100 (EMD Biosciences, San Diego, CA). Цитозолевые или ядерные белки можно получить путем лизинга клетки-хозяина (при помощи приложения механической силы, бомбы Парра, обработки ультразвуком, детергента и т.п.), удаления мембранной фракции клеток центрифугированием и отделения надосадочной жидкости.
[0015] Полипептид можно очищать другими способами, известными специалистам в данной области техники. Так, например, полипептид, полученный описанными здесь способами, можно сконцентрировать при помощи серийно выпускаемого фильтра для концентрации белка, например блока для ультрафильтрации AMICON® или PELLICON® (Millipore, Billerica, MA). После стадии концентрирования концентрат можно поместить на очистительную матрицу, в частности в гелевую фильтрационную среду. Альтернативно можно использовать анионообменную смолу (например, колонка MonoQ, Amersham Biosciences, Piscataway, NJ). Такая смола содержит матрицу или субстрат, включающий боковые диэтиламиноэтиловые (DEAE) или полиэтилениминовые (PEI) группы. Матрицы, применяемые для очистки, могут быть акриламидного, агарозного, декстранового, целлюлозного или другого типа, которые обычно используют для очистки белков. Альтернативно для очистки белков можно использовать стадию катионного обмена. Пригодные катионообменные компоненты включают различные нерастворимые матрицы, содержащие сульфопропиловые или карбоксиметиловые группы (например, колонки S-SEPHAROSE®, Sigma-Aldrich, St. Louis, МО).
[0116] Очистка полипептида от надосадочной жидкости культуры может включать также одну или более операций очистки в колонке над аффинными смолами, в частности конкавалин А-агарозой, AF-HEPARIN650, гепарином-TOYOPEARL® или цибакроном синим 3GA SEPHAROSE® (Tosoh Biosciences, San Francisco, CA), в хроматографических колонках гидрофобного взаимодействия с использванием таких смол, как простой фениловый эфир, простой бутиловый эфир или простой пропиловый эфир, или в иммуноаффинных колонках с использованием антител к меченому белку. И наконец, для дополнительной очистки белка можно использовать одну или более стадий высокоэффективной жидкостной хроматографии (HPLC) с гидрофобной средой, например с силикагелем, имеющим боковые метиловые или другие алифатические группы (например, в колонке Ni-NTA). Альтернативно полипептиды могут быть рекомбинантно экспрессированы в форме, которая способствует очистке. Например, полипептиды могут быть экспрессированы в слиянии с белками, в частности с белком, связывающим мальтозу (МБР), глутатион-S-трансферазой (GST) или тиоредоксином (TRX). Наборы для экспрессии и очистки белков слияния серийно выпускают компании New England BioLabs (Beverly, MA), Pharmacia (Piscataway, NJ) и Invitrogen (Carlsbad, CA) соответственно. Белки можно также пометить малым эпитопом (например, метки His, myc или Flag) и затем идентифицировать или очистить при помощи специфического антитела для выбранного эпитопа. Антитела для обычно применяемых эпитопов поставляются многими компаниями.
[0117] В качестве альтернативы традиционным способам хроматографической очистки (например, проточной хроматографической очистки и хроматографической очистки со связыванием и элюированием), полипептиды, полученные способами согласно настоящему изобретению, могут быть очищены в хроматографической колонке в режиме слабого разделения (weak partitioning), когда, по меньшей мере, один продукт, содержащийся в препарате, и, по меньшей мере, одно загрязнение или примесь связываются с хроматографической смолой или средой. В режиме слабого разделения, по меньшей мере, одна примесь связывается со средой более тесно, чем полипептидный продукт, и по мере продолжения загрузки (заливаемой жидкости) несвязанный полипептидный продукт селективно проходит сквозь среду и извлекается из эффлюэнта колонки. Такая очистка обеспечивает высокую степень снижения содержания примеси и извлечения продукта. Указанную очистку можно произвести при помощи сред и смол, известных специалистам в данной области техники, включая, в частности, но без ограничения, заряженную ионообменную среду, смолу для хроматографии гидрофобного взаимодействия, иммобилизованную на металле смолу для аффинной хроматографии и гидроксиапатитовую смолу. По меньшей мере, в одном варианте реализации изобретения удаление примеси/загрязнения в режиме слабого разделения производят, когда загружаемая жидкость проходит через среду/смолу, которая связывает, по меньшей мере, 2.8 мг продукта на мл среды/смолы. По меньшей мере, в одном из других вариантов реализации изобретения удаление примеси/загрязнения при слабом разделении производят, когда загружаемая жидкость проходит через среду/смолу при технологических режимах, которые определяются коэффициентом распределения, равным, по меньшей мере, 0.1. Очищенный продукт извлекают из эффлюэнта колонки, содержащей среду/смолу.
[0118] В таблице 5 обобщены отличия характеристик следующих режимов: элюирования (flow-through, FT), связывания-элюирования (bind-elute, В-Е) и слабого разделения (weak partitioning, WP).
[0119] Коэффициент распределения (Кр) представляет собой отношение концентрации (Q) адсорбированного продукта к концентрации (С) продукта в растворе, поэтому Кр для режима слабого разделения является промежуточным между Кр для режима элюирования и Кр для режима связывания-элюирования и составляет, в частности, примерно от 0.1 до 20. Для того чтобы определить соответствующие параметры, например соль, буфер, pH и т.п., для очистки в режиме слабого разделения, можно произвести анализ способом высокопроизводительного скрининга или скрининга порционной очистки. При этом специалист в данной области техники может определить коэффициенты распределения Кр продукта в зависимости от технологических режимов (см. пример 7.1).
[0120] Способы очистки, использующие режим слабого разделения, подробно описаны в патентных заявках США №№11/372054 и 11/510634, обе из которых полностью включены в данное описание посредством ссылки.
[0121] Некоторые или все вышеуказанные стадии очистки в различных комбинациях или с другими известными методами можно использовать для очистки полипептида, представляющего интерес и полученного при помощи описанных здесь способов крупномасштабного культивирования клеток животных и сред.
Фармацевтические составы, содержащие полипептиды, полученные путем культивирования клеток
[0122] Вышеописанные среды для культивирования клеток, например среды для крупномасштабного культивирования клеток, и способы культивирования клеток обеспечивают получение полипептидов, представляющих интерес, например антител, растворимых рецепторов, белков слияния и т.п. Полипептиды, полученные описанными способами культивирования клеток с новыми средами и соответствующими описанными здесь способами, включая антитела и их фрагменты, можно использовать in vitro, ex vivo или путем включения в фармацевтические составы и введения индивидуумам (например, людям), которые в этом нуждаются. Несколько фармакогеномных подходов определения целесообразности введения полипептидов согласно изобретению хорошо известны специалистам в данной области техники и включают широкомасштабный геномный анализ, ген-кандидатный подход и профилирование экспрессии генов. Фармацевтический состав согласно изобретению приготавливают таким образом, чтобы он был совместим с предполагаемым способом введения (например, составы для перорального введения включают инертный разбавитель или пищевой носитель). Другие неограничительные примеры способов введения включают парентеральный (например, внутривенный), внутрикожный, подкожный, пероральный (например, ингаляция), чрескожный (топический), чресслизистый и прямокишечный способы. Фармацевтические составы, совместимые с каждым предполагаемым способом введения, хорошо известны специалистам в данной области техники.
[0123] Полипептид согласно изобретению можно использовать в фармацевтическом составе в сочетании с фармацевтически приемлемым носителем. Такой состав кроме полипептида согласно изобретению может содержать носители, различные разбавители, наполнители, соли, буферы, стабилизаторы, солюбилизаторы и другие материалы, хорошо известные специалистам в данной области техники. Термин "фармацевтически приемлемый" означает нетоксичный материал, который не оказывает отрицательного влияния на эффективность биологической активности активных ингредиентов. Характеристики носителя зависят от способа введения.
[0124] Фармацевтический состав согласно изобретению может также включать дополнительные терапевтические факторы или агенты для лечения конкретного целевого нарушения. Так, например, фармацевтический состав для лечения диабета типа 2 может содержать пероральный антидиабетический агент. Фармацевтический состав может содержать тромболитические или антитромботические факторы, в частности плазминогенный активатор и фактор VIII. Фармацевтический состав может содержать также противовоспалительные агенты. Такие дополнительные факторы и/или агенты могут быть включены в фармацевтический состав для создания синергического эффекта с полипептидом согласно изобретению или для минимизации побочных эффектов, которые вызывают полипептиды согласно изобретению.
[0125] Фармацевтический состав согласно изобретению можно получить в форме липосомы, в которой полипептид согласно изобретению соединяют с другими фармацевтически приемлемыми носителями, а также с амфипатическими агентами, в частности с липидами, которые существуют в агрегированной форме как мицеллы, нерастворимые монослои, жидкие кристаллы или чешуйчатые слои в водном растворе. Пригодные липиды для липосомного состава включают, в частности, но без ограничения, моноглицериды, диглицериды, сульфолипиды, лизолецитин, фосфолипиды, сапонин, желчные кислоты и т.п.
[0126] Термин "терапевтически эффективная доза" означает суммарную дозу каждого активного компонента фармацевтического состава, которая является достаточной, чтобы подтвердить значительную пользу для пациента, например облегчение симптомов, излечение или увеличение скорости излечения патологических состояний. В случае применения индивидуального активного ингредиента, который вводят отдельно, термин относится только к указанному ингредиенту. Применительно к комбинации этот термин относится к объединенной дозе активных ингредиентов, которая обеспечивает терапевтический эффект при введении в их сочетании, последовательно или одновременно.
[0127] При реализации способа лечения или применения согласно настоящему изобретению терапевтически эффективную дозу полипептида согласно изобретению вводят субъекту, например млекопитающему (в частности, человеку). Полипептид согласно изобретению может быть введен в соответствии со способом согласно изобретению отдельно или в сочетании с другими терапевтическими агентами. При совместном введении с одним или несколькими агентами полипептид согласно изобретению можно вводить одновременно или последовательно со вторым агентом. При последовательном введении лечащий врач должен определить соответствующую последовательность введения полипептидов согласно изобретению в сочетании с другими агентами.
[0128] Если терапевтически эффективную дозу полипептида согласно изобретению вводят перорально, связующий агент будет иметь форму таблетки, капсулы, порошка, раствора или эликсира. При введении в форме таблетки фармацевтический состав согласно изобретению может дополнительно содержать твердый носитель, в частности желатин, или адъювант. Таблетка, капсула и порошок содержат примерно от 5 до 95% связующего агента и предпочтительно - примерно от 25 до 90% связующего агента. При введении состава в жидкой форме может быть добавлен жидкий носитель, в частности вода, вазелин, масла животного или растительного происхождения, в частности арахисовое масло (соблюдая осторожность с учетом возможной аллергии к арахису), минеральное масло, соевое масло или кунжутное масло, а также синтетические масла. Жидкая форма фармацевтического состава может содержать также физиологический раствор, раствор декстрозы или другого сахарида или гликоли, в частности этиленгликоль, пропиленгликоль или полиэтиленгликоль. При введении в жидкой форме фармацевтический состав содержит примерно от 0.5% до примерно 90% по массе связующего агента и предпочтительно - примерно от 1% до примерно 50% по массе связующего агента.
[0129] Если терапевтически эффективную дозу полипептида согласно изобретению вводят путем внутривенной, чрескожной или подкожной инъекции, полипептид согласно изобретению имеет форму апирогенного, парентерально приемлемого водного раствора. Способы приготовления такого парентерально приемлемого раствора белка, обладающего с учетом величины pH изотоничностью, стабильностью и т.п. известны специалистам в данной области техники. Предпочтительный фармацевтический состав для внутривенной, чрескожной или подкожной инъекции кроме полипептида согласно изобретению должен содержать изотонический наполнитель, в частности хлорид натрия для инъекций, раствор Рингера для инъекций, декстрозу для инъекций, декстрозу и хлорид натрия для инъекций, лактатный раствор Рингера для инъекций или другой наполнитель, известный специалистам в данной области техники. Фармацевтический состав согласно настоящему изобретению может также содержать стабилизаторы, консерванты, буферы, антиоксиданты или какие-либо другие добавки, известные специалистам в данной области техники.
[0130] Содержание полипептида в фармацевтическом составе согласно настоящему изобретению зависит от природы и тяжести патологического состояния, подлежащего лечению, и от предшествующего лечения, которому был подвергнут пациент. В конечном итоге лечащий врач определяет дозу фармацевтического состава или полипептида согласно изобретению, необходимую для лечения каждого отдельного пациента. Вначале лечащий врач вводит низкие дозы фармацевтического состава или полипептида согласно изобретению и наблюдает за реакцией пациента. Более высокие дозы фармацевтического состава или полипептида согласно изобретению можно вводить до получения оптимально терапевтического эффекта для пациента, после чего дозы, как правило, не увеличивают. Считается, что различные фармацевтические составы, применяемые для лечения субъекта, который в этом нуждается, содержат примерно от 0.1 мкг до примерно 100 мг полипептида согласно изобретению на кг массы тела.
[0131] Длительность внутривенной терапии с использованием фармацевтического состава согласно настоящему изобретению будет изменяться в зависимости от тяжести заболевания, подвергаемого лечению, а также от состояния и потенциальной идиосинкразической реакции каждого отдельного пациента. Считается, что длительность каждого курса применения фармацевтического состава или полипептида согласно настоящему изобретению может лежать в пределах, например, 1-12, 6-18 или 12-24 часа при непрерывном или периодическом внутривенном введении. Возможно также проведение подкожной терапии с использованием фармацевтического состава согласно настоящему изобретению. Такие виды лечения можно применять ежедневно, еженедельно или - более предпочтительно - один раз в две недели или ежемесячно. В конечном итоге лечащий врач принимает решение о соответствующей продолжительности внутривенной или подкожной терапии или терапии с синтетическими препаратами, а также о графике проведения терапии с использованием фармацевтического состава согласно настоящему изобретению.
[0132] Все статьи, патенты, патентные заявки и публикации, которые цитируются в данном описании, полностью включаются в него посредством ссылок.
ПРИМЕРЫ
[0133] Приведенные далее примеры предназначены для лучшего понимания изобретения, однако они не ограничивают области изобретения в какой-либо степени. Эти примеры не содержат подробного описания традиционных технологий, в частности метода рекомбинантных ДНК. Такие методы хорошо известны специалистам в данной области техники.
ПРИМЕР 1
Количественный анализ состава аминокислот клеток СНО
[0134] Для количественного анализа состав аминокислот клеток СНО, экспрессирующих антитела, и клеток СНО, экспрессирующих рекомбинантный белок, т.е. для определения процентного молярного содержания каждой аминокислоты по отношению к сумме аминокислот клеточной массы (биомассы) выполнили следующую процедуру. Вкратце, три клеточные линии СНО, обеспечивающие повышенную экспрессию антител или рекомбинантного белка, более конкретно - анти-IL-22 антитело (рекомбинантное анти-IL-22 антитело человека), антитело Муо-029 (анти-GDFe IgG1 моноклональное антитело) и рекомбинантный белок ВМР-2 человека вырастили в колбе на качалке в течение одного (ВМР-2) или трех (Муо-029 и анти-IL-22) дней. В последний день культуры собрали и клетки центрифугировали до получения концентрации 106 клеток/мл. Клеточный осадок, содержащий 106 клеток, дважды промыли 1 × PBS (фосфатно-солевой буфер) и ресуспендировали в 500 мкл 5 н. HCl. Суспензию, содержащую клетки, нагревали при 100°С в течение 24 часов, а затем центрифугировали в вакууме. Образовавшийся клеточный осадок ресуспендировали в 500 мкл PBS и провели анализ аминокислот способом газовой или жидкостной хроматографии.
[0135] Гидролиз кислот показал, что метионин и триптофан разлагаются в процессе гидролиза кислот, поэтому концентрации этих аминокислот в примерах 2 и 3 основаны на литературных данных для клеток СНО. Кроме того, оказалось, что в процессе гидролиза глутамин и аспарагин превращаются в их кислотные формы - в глутаминовую кислоту и аспарагиновую кислоту соответственно, поэтому концентрации этих четырех аминокислот в примерах 2 и 3 откорректировали исходя из опубликованных в литературе соотношений глутамин/глутаминовая кислота и аспарагин/аспарагиновая кислота. В остальном оказалось, что эти клеточные линии СНО имеют схожие составы аминокислот и хорошо соответствуют значениям параметров, опубликованным для других клеток млекопитающих (данные не показаны) (см. Bonarius. (1996) Biotechnol. Bioeng. 50:299-318).
ПРИМЕР 2
Получение желаемой пиковой плотности клеток 15×106 клеток/мл и целевого титра анти-IL-22 антитела 9 г/л в клетках СНО (клеточная линия 1) при объеме подпитки 32% с использованием рационально разработанной среды
Пример 2.1: Рационально разработанная среда
[0136] Используя формулу, приведенную в данном описании, определили концентрацию А аминокислот, откорректированную по базовому уровню, необходимую для получения 15×106 клеток/мл, вырабатывающих 9 г/л анти-IL-22 антитела в клеточной линии СНО 1 (таблица 6, столбец 2) (уровень поддержания клеток установили равным 50%, т.е. Y=0.5). Произвели корректировку по базовому уровню концентрации А различных аминокислот (таблица 6, столбец 2), чтобы получить модифицированную, откорректированную по базовому уровню суммарную концентрацию аминокислот, которая показана в столбце 3 таблицы 6. Получили следующие концентрации: содержание Asn, Asp и Gin установили согласно опубликованной патентной заявке США №US 2006/0121568A1, 2) поскольку Ala, Glu, Gly вырабатывались клеточными культурами, их уровни откорректировали до более низких значений, 3) содержание Cys откорректировали с учетом того, что цистин также использовали в питательной среде, при этом содержание цистина в среде установили согласно опубликованной патентной заявке США №US 2006/0121568A1, 4) содержание Arg, His, Ile, Leu, Lys, Met, Phe было на 20%-100% выше, чем концентрация А аминокислот, откорректированная по базовому уровню, вследствие того, что для приготовления желаемой среды для культивирования клеток использовали порошкообразную подпитку, содержащую установленный состав аминокислот, поэтому точная корректировка не представлялась возможной. Исходную концентрацию В аминокислот в среде (таблица 6, столбец 4) рассчитали исходя из модифицированной откорректированной по базовому уровню общей концентрации аминокислот, показанной в столбце 3 таблицы 6. 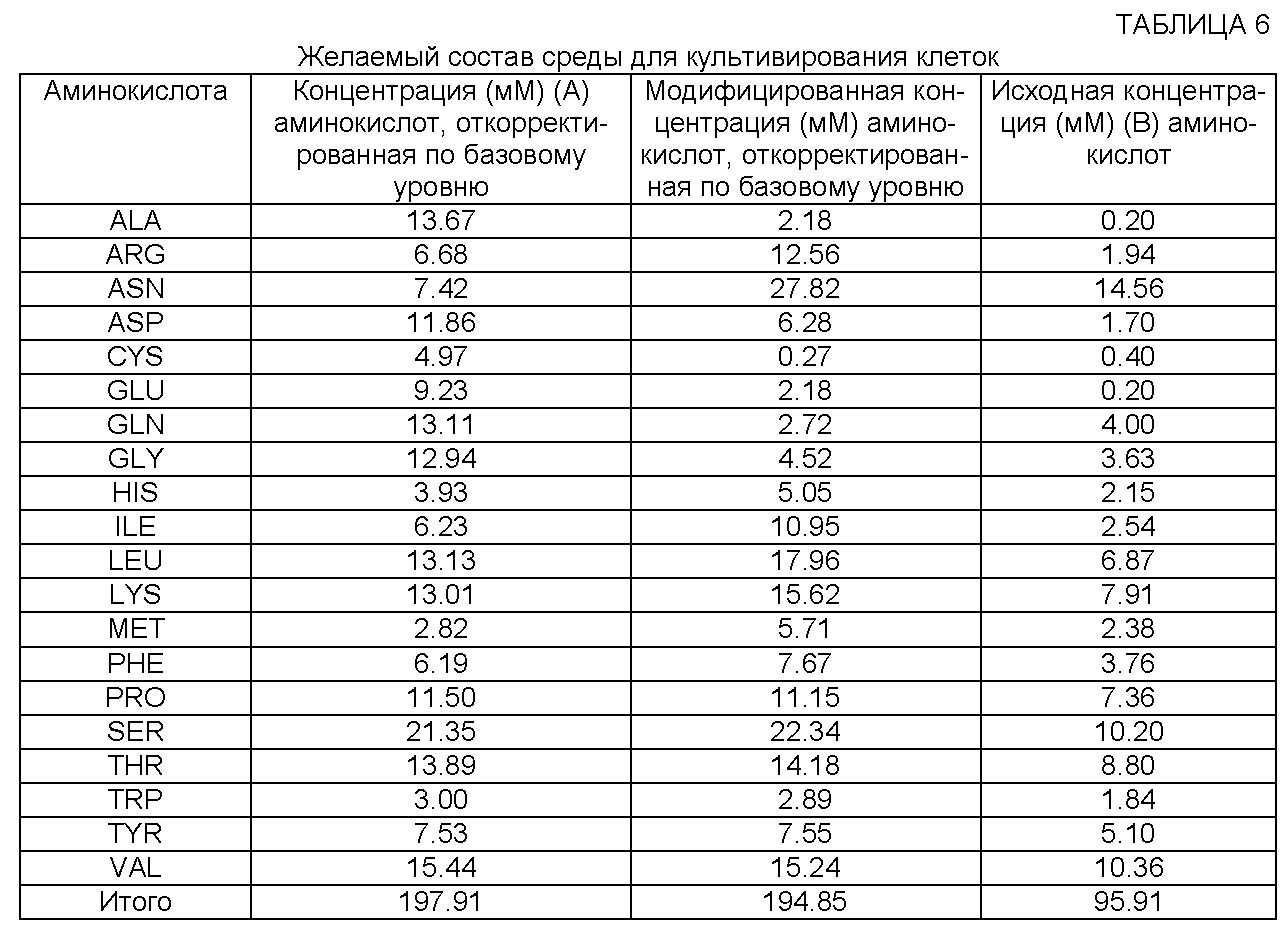
Пример 2.2: Плотность клеток и титр антитела в рационально разработанной среде
[0137] Клеточную линию 1 клеток (анти-IL-22-экспрессирующих клеток СНО) получили из колб на качалке, содержащих 3-дневные культуры, и инокулировали при плотности 0.7×106 клеток/мл в 0 день в исходную среду для культивирования клеток в биореакторе объемом 1 л (Applikon 2L (Applikon Be, Foster City, CA)). Ha 3 день (примерно 80 часов) температуру снизили с 37°С до 31°С и добавили питательную среду (см. столбец 4 таблицы 2) в количестве 3.75%, 4%, 4%, 9%, 2%, 1%, 1%, 1%, 3%, 2% и 1% по объему в 3, 5, 6, 7, 10, 11, 12, 13, 14, 17 и 20 дни соответственно, получив желаемую среду для культивирования клеток, которая содержала концентрацию аминокислот, показанную в таблице 6, столбец 3. Клеточные культуры поддерживали при pH 7.0, при содержании растворенного кислорода 30% и при перемешивании со скоростью 200 об/мин. Ежедневно отбирали образцы, чтобы проверять плотность клеток (прибор для подсчета клеток CEDEX® (Innovatis, Malvern, РА)), жизнеспособность (CEDEX®) и содержание определенных метаболитов (Nova BioProfile Analyzer, Nova Biomedical Cooperation, Waltham, MA). После центрифугирования среду хранили при -80°С для определения титра антитела при помощи ВЭЖХ белка А.
[0138] Результаты показаны на фигурах 1 и 2. Как можно видеть на фигуре 1, максимальную плотность клеток (примерно 11×106 клеток/мл) получили на 11 день культивирования, после чего плотность клеток уменьшалась. Максимальный титр антитела (примерно 7 г/л) получили на 21 день культивирования. Таким образом, рационально разработанную среду можно использовать для получения высокой плотности клеток и высокого титра антитела.
ПРИМЕР 3
Получение желаемой пиковой плотности 15×106 клеток/мл и целевого титра анти-IL-22 антитела 10 г/л в клетках СНО (клеточная линия 2) при подпитке 33% по объему с использованием рационально разработанной среды
Пример 3.1: Рационально разработанная среда
[0139] Используя формулу, приведенную в данном описании, определили концентрацию А аминокислот, откорректированную по базовому уровню, необходимую для получения 15×106 клеток/мл и 10 г/л анти-IL-22 антитела (как описано выше) (уровень поддержания клеток установили равным 50%, т.е. Y=0.5). Произвели корректировку по базовому уровню концентрации А различных аминокислот (таблица 7, столбец 2), как описано в примере 2, чтобы получить модифицированную откорректированную по базовому уровню суммарную концентрацию аминокислот, которая показана в столбце 3 таблицы 7. Кроме того, для приготовления данного препарата исходную среду для культивирования клеток и подпитывающую среду получали из имеющихся порошков с фиксированными составами, поэтому точная корректировка состава не представлялась возможной. Исходную концентрацию В аминокислот в среде (таблица 7, столбец 4) рассчитали исходя из модифицированной откорректированной по базовому уровню общей концентрации аминокислот, показанной в столбце 3 таблицы 7. 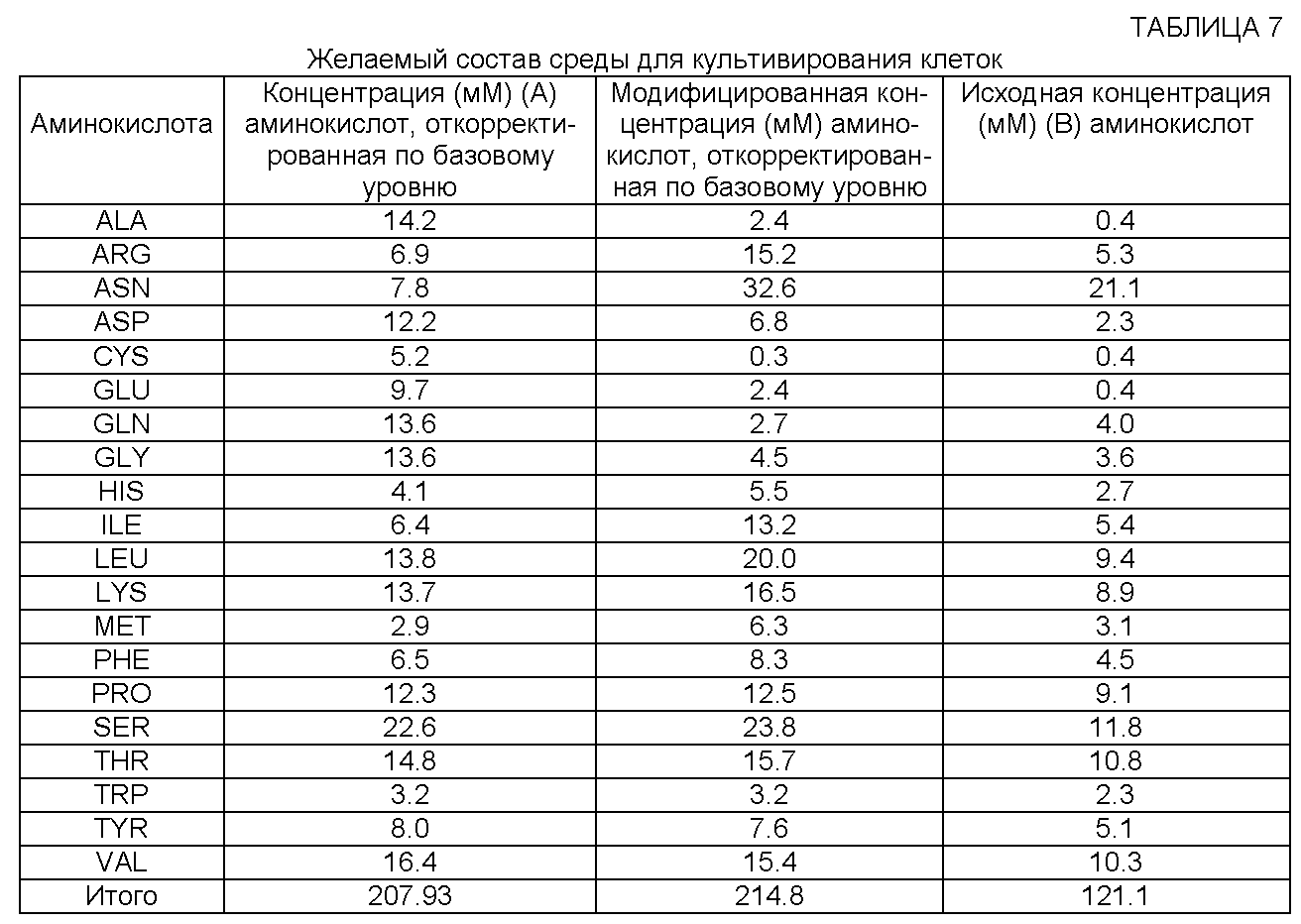
Пример 3.2: Плотность клеток и титр антитела в рационально разработанной среде
[0140] Клеточную линию 2 клеток (анти-IL-22-экспрессирующих клеток СНО) получили из колб на качалке, содержащих 3-дневные культуры, и инокулировали при плотности 0.7×106 клеток/мл в 0 день в исходную среду для культивирования клеток в биореакторе объемом 1 л (Applikon 2L). На 3 день (примерно 80 часов) температуру снизили с 37°С до 31°С и при помощи автоматического питательного насоса стали непрерывно добавлять питательную среду (1,8% по объему в день), получив желаемую среду для культивирования клеток, которая содержит концентрацию аминокислот, показанную в таблице 7, столбец 3. Клеточные культуры поддерживали при pH 7.0, при содержании растворенного кислорода 30% и при перемешивании со скоростью 200 об/мин. Ежедневно отбирали образцы, чтобы проверять плотность клеток (прибор для подсчета клеток CEDEX® (Innovatis, Malvern, РА)), жизнеспособность (CEDEX ®) и содержание определенных метаболитов (Nova BioProfile Analyzer, Nova Biomedical Cooperation, Waltham, MA). После центрифугирования среду хранили при -80°С для определения титра антитела при помощи ВЭЖХ белка А.
[0141] Результаты показаны на фигурах 3 и 4. Как можно видеть на фигуре 3, максимальную плотность клеток (примерно 12×106 клеток/мл) получили на 10 день культивирования, после чего плотность клеток уменьшалась. Максимальный титр антитела (более 10 г/л) получили на 19 день культивирования. Таким образом, рационально разработанную среду можно использовать для получения высокой плотности клеток и высокого титра антитела.
ПРИМЕР 4
Влияние добавления пролина на процесс культивирования клеток
[0142] Клетки СНО, продуцирующие антитело анти-IL-22, культивировали в колбах на качалке (500 мл колбы с рабочим объемом 100 мл) с корректировкой pH и выдерживали на качалке при ~100 об/мин в инкубаторе с регулированием температуры и 7% CO2. Указанные клетки посеяли с плотностью 0.7×106 клеток/мл. Культивирование произвели в течение 18 дней. Первые 3 дня клетки выдерживали при 37°С, после чего температуру снизили до 31°С и поддерживали на этом уровне в течение остального времени культивирования. В течение первых 3 дней pH регулировали 1 М бикарбонатом натрия. Среду для культивирования клеток приготовили в следующих вариантах: на основе среды с традиционными требованиями к культуре клеток, называемой "традиционной средой", и на основе рационально разработанной среды, т.е. среды с описанным здесь рациональным составом и называемой "рационально разработанной средой", чтобы получить плотность 10×106 клеток/мл и титр антитела 10 г/л. Основное различие между этими двумя составами заключается в том, что несколько аминокислот (PRO, THR, GLY, TYR, TRP, VAL и РНЕ) имеют более высокую концентрацию в "рационально разработанной среде", чем в "традиционной среде". В качестве третьего варианта исполнения была представлена традиционная среда с добавлением 3.7 мМ пролина с целью получения состава с уровнем пролина, как в "рационально разработанной среде", обозначенная как "традиционная среда + пролин". Такие составы представлены ниже в таблице 8. Фирменную питательную среду Wyeth ("питательная среда", см. таблицу 2) добавляли в культуру в суммарном количестве 23% по объему, включая ежедневные подпитки 2% в 3-4, 9-14 и 17 дни, 1% в 5-6 дни и 3% в 7 день.
|
[0143] Результаты этих экспериментов показаны на фигурах 5-7. Добавление пролина в традиционную среду, т.е. "традиционная среда + пролин" (фигура 5), приводит к продуцированию антитела, эквивалентному продуцированию антитела в "рационально разработанной среде" вплоть до 14 дня. Как показано на фигуре 6, все три среды обеспечивали высокую плотность клеток, при этом максимальная плотность имела место в 12 день. Как показано на фигуре 7, все три среды обеспечивали высокую жизнеспособность клеток, при этом в "рационально разработанной среде" культуры имели более высокую жизнеспособность в 15-18 дни по сравнению с культурами, содержащими "традиционную среду" и "традиционную среду + пролин". Поскольку другие различные среды, содержащие рационально выбранную концентрацию глицина, фенилаланина, треонина, триптофана, тирозина или валина, не обеспечивали получения в клеточных культурах более высокого титра антитела, чем "традиционная среда" (данные не показаны), пролин служит в качестве лимитирующей аминокислоты, которая требуется для достижения высокого титра. Это поясняют фигуры 8А-Е, на которых показано, что на 14 день содержание многих аминокислот в "традиционной среде + пролин" достигало чрезвычайно низкого уровня (тирозин вообще был исчерпан), при этом предотвращалось дальнейшее включение этих аминокислот в антитело. Этот результат наблюдается также на графике титра (фигура 5), поскольку наклон кривой для "традиционной среды + пролин" уменьшался после 14 дня, в то время как в "рационально разработанной среде", которая имеет более высокое содержание других аминокислот, продуцирование антитела поддерживалось вплоть до 18 дня.
[0144] Интересно, что концентрация пролина в "традиционной среде" не опускалась ниже 1 мМ (фигура 8А), однако влияние пролина на общее включение аминокислот в антитело уменьшалось после 11 дня. Это обстоятельство предполагает существование определенного порогового содержания пролина, и, следовательно, концентрацию пролина в процессе культивирования необходимо поддерживать большей 1 мМ.
ПРИМЕР 5
Прогностический пример: Оптимизированная среда для культивирования клеток для новой клеточной линии
[0145] Способы создания среды согласно настоящему изобретению можно применять для любого культивирования, включая культивирования, которые используют новые клетки/клеточные линии. Оптимизированная среда для применения с новой клеточной линией должна содержать, по меньшей мере, одну аминокислоту с концентрацией А, откорректированной по базовому уровню согласно формуле A=[(M*X)+(N*P)+(Y*M*X)]*F.
[0146] Коэффициент М при подстановке в указанное выше уравнение для новой культуры клеток может быть выбран, например, в пределах от 1 до 20×106 клеток/мл. Специалист в данной области техники может рассчитать соответствующее значение М путем удвоения максимальной плотности клеток во время фазы роста, которую в свою очередь можно рассчитать исходя из скорости роста.
[0147] Коэффициент N при подстановке в указанное выше уравнение для новой культуры клеток можно рассчитать, например, путем умножения IVC на qp клеток. Специалист в данной области техники может рассчитать IVC, определив профиль роста способами, которые описаны в разделе "Способы получения и составы рациональной среды". Специалист в данной области техники может также рассчитать qp на основании определения продуцирования антитела или рекомбинантного белка в расчете на одну клетку.
[0148] Коэффициент стабилизации клеток Y при подстановке в указанное выше уравнение для новой культуры клеток можно определить, приняв вначале Y=1 (т.е. 100% аминокислот требуется для получения желаемой клеточной массы), а затем откорректировав значение Y (в большую или меньшую сторону).
[0149] Коэффициент базового уровня F при подстановке в указанное выше уравнение для новой культуры клеток можно определить, приняв вначале F=1.3 (т.е. 30% добавка аминокислот(ы)), а затем откорректировав значение F (в большую или меньшую сторону).
ПРИМЕР 6
Влияние коэффициентов стабилизации и базового уровня на процесс культивирования клеток
[0150] Для того чтобы показать, что коэффициент стабилизации Y и коэффициент базового уровня F являются важными/существенными для процесса культивирования клеток, анти-IL-22-экспрессирующие клетки СНО посеяли при плотности 0.7×106 клеток/мл и культивировали в течение 21 дня в биореакторах объемом 2 л при заданном значении pH 7.0 и содержании растворенного кислорода (dissolved oxygen, DO) 30%. pH корректировали 2 н. Na2CO3/NaHCO3, a DO регулировали барботажем воздуха (содержащего 7% CO2). Температуру культивирования поддерживали равной 37°С в течение первых 3 дней, а затем снизили до 31°С и поддерживали равной 31°С до окончания культивирования. Клетки культивировали в течение 21 дня (1) в среде, содержащей аминокислоты, которые требуются для получения целевого титра белка и желаемой пиковой плотности клеток (но без учета коэффициента стабилизации или коэффициента базового уровня), т.е. в "рационально разработанной среде без учета коэффициентов стабилизации и базового уровня", или (2) в "рационально разработанной среде".
[0151] Как показано на фигурах 9 и 10, в среде, созданной без учета коэффициентов стабилизации и базового уровня, имеет место значительное снижение жизнеспособности, практически приближающееся к 0% на 21 день культивирования клеток, и значительное уменьшение плотности клеток. Кроме того, фигура 11 показывает, что на 21 день культивирования клеток та же самая среда смогла поддерживать титр антитела, равный всего лишь 5 г/л.
[0151] В отличие от этого рационально разработанная среда (с учетом коэффициентов стабилизации и базового уровня) обеспечивала более высокую жизнеспособность, плотность клеток и титры антитела (фигуры 9-11). На 21 день культивирования клеток рационально разработанная среда была способна поддерживать титр антитела, равный 10 г/л.
[0153] Эти результаты позволяют предполагать, что учет коэффициентов стабилизации и базового уровня при определении концентрации аминокислот в желаемой среде для культивирования клеток улучшает свойства клеток согласно измерениям жизнеспособности клеток, плотности клеток и титра полипептида.
ПРИМЕР 7
Очистка полипептида способом анионообменной хроматографии в режиме слабого разделения
Пример 7.1. Высокопроизводительный скрининг для установления режима слабого разделения и режима элюирования
[0154] Вначале провели исходный анализ методом скрининга, чтобы определить коэффициент распределения и/или концентрацию продукта, связанного со смолой в различных условиях прохождения раствора и тем самым определить рабочие области режима слабого разделения (weak partitioning, WP) и режима элюирования (flow-through, FT) для полипептида Mab-AAB, представляющего интерес, и среды TMAE-HiCap (М). При проведении скрининга изменяли концентрацию хлорида натрия и величину pH, чтобы определить их влияние на степень связывания Mab-AAB и соответствующих примесей (белок А и НСР) со средой ТМАЕ.
[0155] Содержание остатков белка А в пробных образцах измеряли при помощи твердофазного иммуноферментного анализа (enzyme-linked immunosorbent assay, ELISA) белка А. Содержание агрегата с высокой молекулярной массой измеряли способом гельпроникающей хроматографии (size exclusion chromatography, SEC). Содержание белков клетки-хозяина (host cell proteins, HCPs) измеряли при помощи ELISA HCP. Все скрининговые и колоночные исследования проводили при температуре окружающей среды.
[0156] Пятьдесят мкл среды ТМАЕ HiCap добавили в каждую лунку фильтр-планшета с 96 лунками. Каждую лунку уравновесили растворами, содержащими 50 мМ глицина, переменное количество Трис-буфера (в зависимости от количества, необходимого для нейтрализации pH до величины, указанной в таблице 9) и хлорид натрия (как указано в таблице 10). Величину pH изменяли в пределах от 7.6 до 9.0, а содержание хлорида натрия - от 0 мМ до 80 мМ.
[0157] Буферные растворы, используемые в каждом ряду, разбавляли при помощи автоматической пипеточной системы (Tecan 100 RST). Маточный раствор для буферов готовили из 500 мМ глицина, подкисленного HCl до pH 3.0, и затем нейтрализовывали 2 М Трис-основанием до величины pH, указанной в таблице 9. В результате такого титрования получали соответствующее содержание Трис в зависимости от pH буфера. pH буфера измеряли при разбавлении концентрации маточного буфера в 1-10 раз, что соответствовало разбавлению автоматической пипеточной системой. В результате подкисления глицином до pH 3.0 буфер вносил в конечный раствор примерно 10 мМ ионной силы. Опробовали два варианта загрузки (загрузочной жидкости) для смолы: 5 мг/мл для измерения коэффициента распределения Кр и 122 мг/мл для измерения емкости смолы для удаления примесей и связанного продукта Q в равновесии с раствором белка при концентрации, примерно равной концентрации загрузки колонки.
|
|
[0158] На первом этапе высокопроизводительного скрининга каждую лунку уравновесили по NaCl и pH, как показано в таблицах 9 и 10, в отношении фазовых объемов 6:1 (300 мкл раствора: 50 мкл смолы). Планшет встряхивали 20 минут, чтобы обеспечить достижение равновесия. Затем раствор удаляли путем центрифугирования фильтр-планшета. Этот цикл уравновешивания повторили три раза.
[0159] На втором этапе в каждую лунку ввели смолу с концентрированным раствором MAb-ААВ до 5 мг/мл смолы с отношением объемов 6:1 (300 мкл раствора: 50 мкл смолы) при соответствующей концентрации NaCl и pH. Раствор 36 мг/мл Mab-AAB в 1 мМ HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфоновой кислоты), 10 мМ NaCl, pH 7.0, с добавлением 300 ppm белка А использовали в качестве маточного раствора. Загруженный планшет встряхивали в течение 20 минут, чтобы уравновесить смолу и раствор. Надосадочную жидкость удалили из фильтр-планшета путем центрифугирования и собрали в сборнике. Определили концентрацию белка в надосадочной жидкости каждой лунки по поглощению излучения при А 280 нм.
[0160] На третьем этапе смолу промыли путем добавления растворов с содержанием NaCl и pH согласно таблице 10. Надосадочную жидкость удалили после встряхивания в течение 20 минут. На четвертом этапе добавили 2 М NaCl, чтобы удалить остаточный белок, связанный со смолой. В таблице 11 показаны коэффициенты распределения, рассчитанные для каждой лунки с использованием массы, элюированной на этапах 3 и 4, и концентрации продукта с этапа 2.
|
[0161] Как показано в таблице 11, величину Кр можно использовать для описания тех областей, где MAb-ААВ связывается со средой ТМАЕ с различной силой. Силу связи MAb-ААВ со средой ТМАЕ можно регулировать, изменяя величину pH и концентрацию хлорида в областях элюирования (К≤0.1), слабого разделения (0.1<К<20) и связывания (К≥20).
[0162] Образцы надосадочной жидкости из всех лунок в каждой зоне отбирали на этапе загрузки и проводили анализ на белок А. Результаты анализа этих образцов представлены в таблице 12. При этом существует область с pH и электропроводностью, в которой хроматография ТМАЕ обеспечивает весьма существенное удаление белка А с ограниченной потерей белка на смоле. Оказалось, что эта область тесно коррелирует с величиной коэффициента распределения Кр, а не с конкретной величиной pH или концентрацией хлорида.
|
Пример 7.2. Работа колонки в режиме элюирования
[0163] Следующий эксперимент провели в режиме элюирования (flow-through, FT), когда MAb-AAB очень слабо взаимодействует с колонкой. Два цикла произвели с загрузкой 110 мг/мл и 200 мг/мл смолы.
[0164] Для всех описанных циклов анионообменной хроматографии ТМАЕ (HiCapM) использовали следующие режимы (исключения указаны в описании отдельных экспериментов).
Рабочая скорость потока - 150-300 см/час
Уравновешивание 1-50 мМ Трис, 2.0 М NaCl, pH 7.5 (5 объемов колонки)
Уравновешивание 2 - как указано, примерно эквивалентно pH и содержанию хлорида в загрузке
Промывка после загрузки - как указано, примерно эквивалентно pH и содержанию хлорида в загрузке
Стрип-буфер - 50 мМ Трис, 2.0 М NaCl, pH 7.5 (5 объемов колонки)
Хроматография белка А с колонкой Mabselect
[0165] Культуру, содержащую моноклональное антитело, очистили в полупромышленном количестве, используя колонку MabSelect (2,389 мл), соединенную с хроматографической системой Millipore K-prime 400. Колонку Mabselect для определения белка А уравновесили 5 объемами колонки (column volume, CV) 50 мМ Трис /150 мМ NaCl, pH 7.5, при скорости потока 300 см/час. Затем колонку загрузили нагрузкой, составляющей примерно 40 мг продукта / мл смолы. Затем произвели промывку 5 объемами колонки (CV) в 1 М NaCl, 50 мМ Трис, pH 7.5, и промывку 5 CV 10 мМ Трис, 75 мМ NaCl, pH 7.5. После этого произвели элюирование, используя 50 мМ глицина, 75 мМ NaCl, pH 3.0. Объединенный продукт нейтрализовали до pH 7.6, используя 2 М Трис, pH 8.5. Пик нейтрализации имел место при концентрации хлорида примерно 90 мМ.
Хроматография ТМАЕ HiCap (М)
[0166] Далее объединенный нейтрализованный белок А очистили ТМАЕ с уравновешиванием, загрузкой и промывочными растворами при pH 7.5 с 50 мМ Трис и 75 мМ хлорида натрия. Произвели промывку пятью объемами колонки. Размеры колонок и загрузки для этих двух исследований составляли: цикл 1 - диаметр 7.0 см × высота слоя 20.6 см (объем - 793 мл) с концентрацией загрузки 11.9 мг/мл, цикл 2 - диаметр 7.0 см × высота слоя 13 см (объем - 500 мл) с концентрацией загрузки 17.6 мг/мл.
[0167] Эти характеристики загрузки имели место в области элюирования (flow-through, FT) (таблица 13). Для измерения коэффициента распределения (Кр) использовали опыты с периодическим связыванием и определяли связанный продукт по анализу белка в съеме с колонки при помощи поглощения в ультрафиолетовой области. Этот способ определения связанного продукта обычно дает заниженные результаты количества связанного продукта в загрузке вследствие изократического элюирования продукта во время промывки. Определив содержание белка А, НСР и агрегатов с высокой молекулярной массой (HMW) в загрузке и объединенном продукте, рассчитали степень удаления. Результаты представлены в таблице 13. Имеет место плохое удаление белка А и HMW и умеренное снижение содержания НСР.
|
Пример 7.3. Работа колонки в режиме слабого распределения (высокая загрузка продукта)
Анионообменная хроматография ТМАЕ (HiCap М)
[0168] Несколько циклов с белком A Mabselect провели практически, как описано в примере 7.2, чтобы получить загрузочный материал для этих циклов. Частично очищенный пул антител с операции с белком А дополнительно очистили в колонке с ТМАЕ. Загрузка в колонку с ТМАЕ находилась в 50 мМ Трис, pH 8.2. Диаметр колонки составлял 0.5 см, а высота слоя - 10 см (объем - 2.0 мл). В колонку вводили загрузку 500 мг/мл смолы при концентрации загрузки 27.7 мг/мл.
[0169] Колонку уравновесили 5 CV раствора, содержащего 50 мМ Трис, 2 М NaCl, pH 7.5, а затем повторно уравновесили раствором, содержащим 50 мМ Трис, pH 8.2. Затем колонку загрузили до 500 мг продукта / мл смолы с нейтрализованным пиком белка с предшествующей операции и извлекли продукт в элюате колонки во время цикла загрузки и в нескольких объемах колонки промывочной фракции.
[0170] Такой режим загрузки имел место в области слабого разделения. Для измерения коэффициента распределения (Кр) использовали опыты с порционным связыванием и определяли связывание продукта при высоких концентрациях белка. При pH 8.2 и примерном содержании хлорида 12 мМ коэффициент распределения (Кр) составлял 1.9 (согласно интерполяции данных, полученных в результате скрининга HTS).
[0171] Содержание НСР и белка А измеряли в трех фракциях при загрузках, которые составляли примерно 250, 375 и 500 мг/мл смолы. Результаты экспериментов из примера 7.3 представлены в таблице 14. Эти результаты показывают возможность введения очень высокого содержания продукта в режиме слабого разделения без проскока примесей. При этом достигается превосходное снижение содержания НСР и белка А наряду с 50% снижения содержания HMW. По сравнению с результатами работы в режиме элюирования, которые представлены в таблице 13, удаление примесей в режиме слабого разделения происходило гораздо лучше.
|
Пример 7.4. Работа колонки в режиме слабого разделения (исследование стабильности)
[0172] Для дополнительного подтверждения успешной работы колонки с ТМАЕ в области слабого разделения провели несколько циклов, изменяя pH и концентрацию NaCl в загрузке, чтобы испытать стабильность процесса. Все циклы проводили при загрузке 250 мг/мл смолы. Несколько циклов с белком A Mabselect провели практически, как описано в примере 7.2, чтобы получить загрузочный материал для этих циклов. Единственным фактором, который изменяли во время этих циклов, была концентрация хлорида натрия в элюате белка А. Ее изменяли для того, чтобы обеспечить соответствие концентрации NaCl в загрузке ТМАЕ для каждого конкретного эксперимента. Колонки уравновешивали буферами Equil 2 и промывали промывочными буферами, которые имели примерно такую же величину pH и содержание хлорида натрия, как и загрузка.
[0173] Эти условия загрузки имели место в области слабого разделения. Для измерения коэффициента распределения (Кр) провели опыты с периодическим связыванием. Циклы ранжировали в зависимости от величины коэффициента распределения, как указано в таблице 15. Связанный продукт определяли путем измерения содержания белка на выходе из колонки при помощи поглощения излучения в УФ-области и получили от 7.8 до 25.3 мг/мл. Результаты определения белка А, НСР и HMW в этих экспериментах также представлены в таблице 15. Удаление всех примесей оказалось стабильным в рабочей области, которая включает общее содержание хлорида в пределах 13.5-38.8 мМ и pH 7.8-8.4.
|
Пример 7.5. Заключение
[0174] Из этих исследований можно видеть, что удаление белка A (LRV) сильно изменяется в зависимости от Кр, в то время как LRV НСР имеет превосходную величину для любого значения Кр, равного или большего 0.26, однако сильно уменьшается при Кр=0.17 (в режиме элюирования). Удаление белка клетки-хозяина на один логарифм ниже для режима элюирования, чем для режима слабого разделения, даже при уменьшенной величине загрузки. Содержание связанного продукта изменяется в пределах 7.8-25 мг/мл для такого режима слабого разделения при указанной комбинации смолы и моноклонального антитела. Коэффициент распределения является оптимальным в пределах 0.41<Кр<5.4. Он не является оптимальным при Кр=0.17 и содержании связанного продукта 1.4-3.3 мг/мл, как указано в условиях примера 7.2.
[0175] Эти исследования предлагают альтернативный режим очистки полипептида, полученного при помощи рационально разработанной среды для культуры клеток, который существенно уменьшает присутствие примесей, агрегатов с высокой молекулярной массой, ДНК, белков клетки-хозяина и т.п.