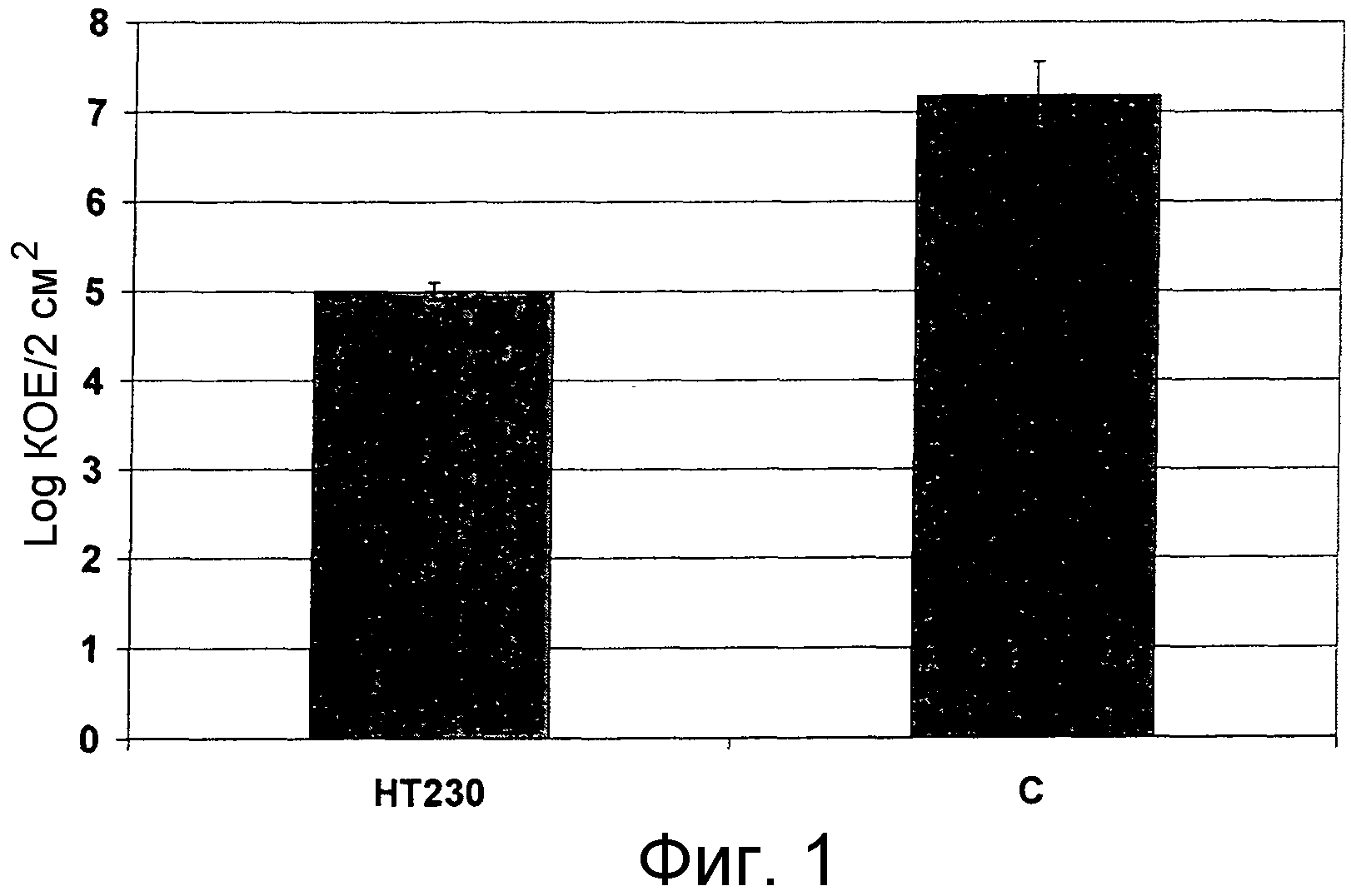
Результат интеллектуальной деятельности: ПРИМЕНЕНИЕ СОЕДИНЕНИЙ 4-(ПИРРОЛИДИН-1-ИЛ)ХИНОЛИНА ДЛЯ УНИЧТОЖЕНИЯ КЛИНИЧЕСКИ ЛАТЕНТНЫХ МИКРООРГАНИЗМОВ
Вид РИД
Изобретение
Настоящее изобретение относится к применению соединений на основе кольцевой системы 4-(пирролидин-1-ил)хинолина для уничтожения клинически латентных микроорганизмов. Изобретение дополнительно относится к применению таких соединений для лечения микробных инфекций, а также, среди прочего, некоторых соединений как таковых.
В этом описании изобретения нет необходимости приводить описание или обсуждение ранее опубликованного документа для подтверждения того, что документ является частью уровня техники или представляет хорошо известный уровень техники.
До введения антибиотиков пациенты, страдающие острыми бактериальными инфекциями (например, туберкулезом или пневмонией), имели высокий риск летального исхода. Например, смертность от туберкулеза составляла около 50%.
Несмотря на то, что введение антибактериальных агентов в 1940-х и 1950-х годах быстро изменило эту ситуацию, бактерии ответили постепенно приобретаемой устойчивостью к широко используемым антибиотикам. На сегодняшний день во всех странах мира существуют бактерии, резистентные к антибиотикам. Фактически, в США более 70% бактерий, которые вызывают внутрибольничные инфекции, устойчивы по меньшей мере к одному из основных антимикробных агентов, которые, как правило, используются для борьбы с инфекцией (см. Nature Reviews, Drug Discovery 1, 895-910 (2002)).
Одним из способов решения возрастающей проблемы резистентных бактерий является разработка новых классов антимикробных агентов. Тем не менее, до введения в 2000 году линезолида более 37 лет на рынке не было представлено нового класса антибиотиков. Более того, даже разработка новых классов антибиотиков обеспечивает лишь временное решение проблемы, и в самом деле, уже существуют сообщения об устойчивости некоторых бактерий к линезолиду (см. Lancet 357, 1179 (2001) и Lancet 358, 207-208 (2001)).
Понятно, что для более перспективного решения проблемы бактериальной резистентности требуются альтернативные подходы. Один из таких альтернативных подходов представляет собой сведение к минимуму, насколько это возможно, потенциала, который дает бактериям возможность развивать устойчивость к важным антибиотикам.
Таким образом, к стратегиям, которые могут быть приняты, относятся ограничение применения антибиотиков для лечения инфекций вне обострения, а также контроль за тем, какие антибиотики дают животным для стимуляции роста.
Тем не менее, для более эффективного решения проблемы необходимо понять действительные механизмы, которыми бактерии вырабатывают устойчивость к антибиотическим агентам. Для этого необходим, во-первых, анализ того, каким образом существующие на сегодняшний день антибиотические агенты уничтожают бактерии.
Антимикробные агенты нацелены на важные составляющие метаболизма бактерий. Например, β-лактамы (например, пенициллины и цефалоспорины) ингибируют синтез клеточной стенки, тогда как другие агенты ингибируют иной ряд мишеней, таких как ДНК-гираза (хинолоны), и синтез белка (например, макролиды, аминогликозиды, тетрациклины и оксазолидиноны). Диапазон организмов, против которых эффективны антимикробные агенты, варьирует в зависимости от того, какие организмы существенным образом зависят от стадии(й) метаболизма, которая(ые) ингибирует(ют)ся. Кроме того, влияние на бактерии может варьировать от одного лишь ингибирования роста (т.е. бактериостатический эффект, что видно на примере агентов, таких как тетрациклины) до полного уничтожения (т.е. бактерицидный эффект, что видно на примере пенициллина).
Бактерии появились на Земле более 3 миллионов лет назад, а в то время требовалось отвечать на огромное число стрессов окружающей среды. Возможно, поэтому неудивительно, что бактерии развили, казалось бы, неистощимое число механизмов, которыми они могут отвечать на метаболические стрессы, создаваемые для них антибиотическими агентами. Действительно, механизмы, которыми бактерии могут создавать устойчивость, включают такие различные стратегии как инактивация лекарственного средства, модификация сайта воздействия, модификация проницаемости клеточной стенки, сверхпродукция мишенного фермента и обход ингибированных стадий.
Тем не менее, было показано, что скорость возникновения резистентности к конкретному агенту изменяется в широких пределах в зависимости от факторов, таких как механизм действия агента, является ли способ уничтожения агента зависимым от времени или концентрации, эффективность против популяции бактерий и величина и продолжительность доступной концентрации в сыворотке.
Было предположено (см. статью в журнале Science 264, 388-393 (1994)), что наиболее склонны к развитию резистентности агенты, которые нацелены на единичные ферменты (например, рифампицин). Кроме того, чем дольше близкие к оптимальным уровни антимикробного агента находятся в контакте с бактериями, тем более вероятно появление резистентности.
Более того, в настоящее время известно, что многие бактериальные инфекции включают субпопуляции бактерий, которые фенотипически резистентны к антимикробным препаратам (см., например: J. Antimicrob. Chemother. 4, 395-404 (1988); J. Med. Microbiol. 38, 197-202 (1993); J. Bacteriol. 182, 1794-1801 (2000); там же 182, 6358-6365 (2000); там же 183, 6746-6751 (2001); FEMS Microbiol. Lett. 202, 59-65 (2001); и Trends in Microbiology 13, 34-40 (2005)). Обнаруживают несколько типов таких фенотипически резистентных бактерий, включая персистирующие бактерии, бактерии в стационарной фазе, а также находящиеся в толще биопленки. Тем не менее, каждый из этих типов отличается своей низкой скоростью роста (по сравнению с бактериями в log-фазе в тех же условиях). Также частыми отличиями таких бактерий являются истощение питательных веществ и высокая плотность клеток.
Несмотря на устойчивость к антимикробным агентам в состоянии своего медленного роста, фенотипически резистентные бактерии отличаются от генотипически резистентных тем, что они восстанавливают свою чувствительность к антимикробным препаратам при возвращении к состоянию быстрого роста (например, когда питательные вещества становятся более доступными для них).
Наличие фенотипически резистентных бактерий в инфекции приводит к необходимости длительных курсов антимикробных агентов, содержащих множественные дозы. Это происходит, поскольку устойчивые медленно размножающиеся бактерии создают пул «латентных» организмов, которые могут переходить к состоянию быстрого роста, когда позволяют условия (вследствие чего происходит по существу повторная инициация инфекции). Множественными дозами с течением времени борются с этой проблемой путем постепенного уничтожения «латентных» бактерий, которые переходят к «активной» форме.
Тем не менее, борьба с «латентными» бактериями путем применения длительных курсов антимикробных препаратов создает свои собственные проблемы. То есть длительное воздействие на бактерии субоптимальными концентрациями антимикробного агента может привести к появлению генотипически резистентных бактерий, которые затем могут быстро размножиться даже в присутствии высоких концентраций антимикробного препарата.
Длительные курсы антимикробных препаратов более вероятно содействуют появлению генотипической резистентности, чем более короткие курсы на основании того, что неразмножающиеся бактерии будут склонны к выживаемости и, что интересно, возможно будут обладать повышенной способностью мутировать к резистентности (см., например, Proc. Natl. Acad. Sci. USA 92, 11736-11740 (1995); J. Bacteriol. 179, 6688-6691 (1997); и Antimicrob. Agents Chemother. 44, 1771-1777 (2000)). Например, неделящаяся E. coli непрерывно мутирует к состоянию устойчивости к ципрофлоксацину во время семидневной экспозиции с данным агентом. Таким образом, «латентные» бактерии могут представлять собой один из источников генотипически резистентных бактерий.
В свете вышесказанного, новым подходом для противодействия проблеме бактериальной устойчивости может быть отбор и разработка антимикробных агентов на основе их способности уничтожать «латентные» микроорганизмы. Продукция таких агентов позволила бы среди прочего сократить схемы химиотерапии в лечении микробных инфекций, таким образом снижая частоту, с которой в микроорганизмах возникает генотипическая резистентность.
Некоторые соединения, содержащие скелет 4-(пирролидин-1-ил)хинолин, описываются в WO 92/17452; WO 98/05644; WO 02/094789; и WO 2006/070284. Ни в одном из этих документов не описывается, что соединения на основе 4-(пирролидин-1-ил)хинолиновой кольцевой системы уничтожают клинически латентные микроорганизмы.
Дополнительные соединения, содержащие скелет 4-(пирролидин-1-ил)хинолин, описываются в US 2006/217377 и WO 2006/071875. В этих документах описываются соединения на основе 4-(пирролидин-1-ил)хинолиновой кольцевой системы для применения лишь в качестве ингибиторов потенциалзависимых (калий или натрий) ионных каналов или в качестве антагонистов хемокиновых рецепторов.
В статье Yao Xue Xue Bao 827-834 (1982) упоминается активность в отношении возбудителей малярии для некоторых 6-замещенных соединений (2,4-дипирролидин-1-ил) хиназолина.
К настоящему моменту авторы изобретения неожиданно обнаружили, что некоторые 4-(пирролидин-1-ил)хинолины могут быть использованы для уничтожения клинически латентных микроорганизмов.
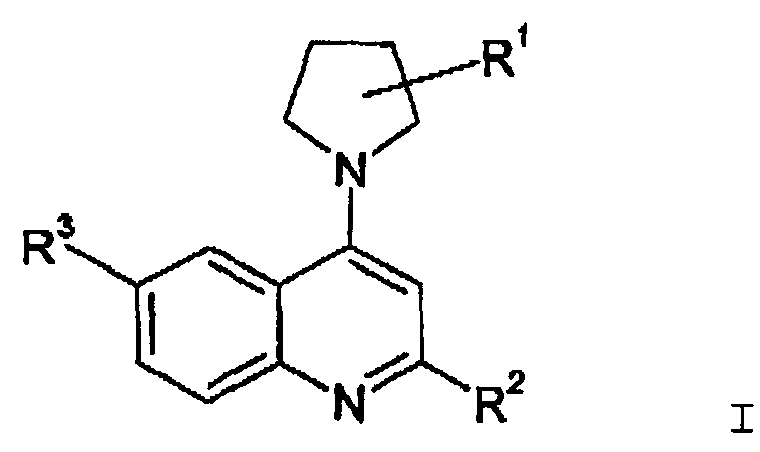
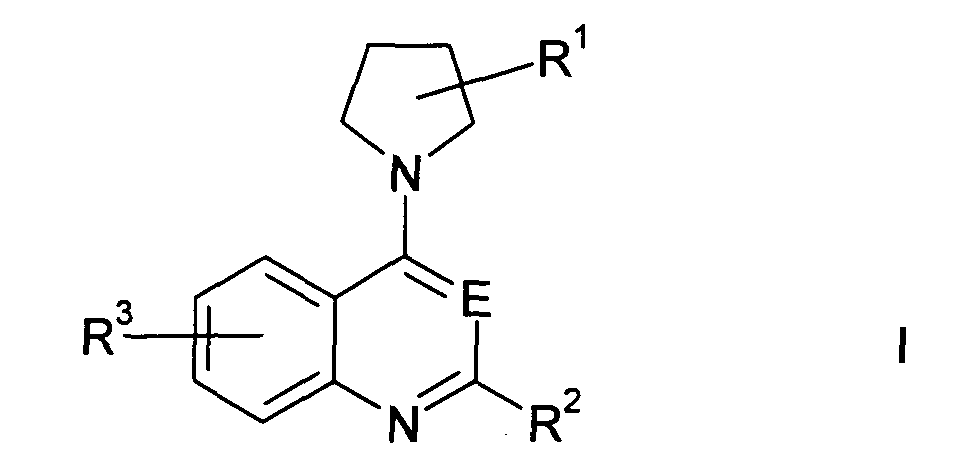
По первому аспекту изобретения предлагается применение соединения формулы I или его фармацевтически приемлемого производного для получения лекарственного средства для уничтожения клинически латентных микроорганизмов, где соединение формулы I представлено структурой
где
Е представляет собой СН или N;
R1 представляет собой от одного до четырех заместителей в пирролидинильном кольце, причем каждый заместитель независимо представляет собой группу -X-R4а;
Х представляет собой
(а) простую связь,
(b) -O- или
(c) -N (R4b)-;
R4а и R4b независимо представляют
(а) Н,
(b) С1-12 алкил, С3-12 циклоалкил, С3-12 циклоалкенил (эти последние три группы необязательно замещены одним или несколькими заместителями, выбранными из галогена, азота, CN, С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С3-8 циклоалкила (последние три группы необязательно замещены одним или несколькими заместителями, выбранными из ОН, =О, галогена, С1-4 алкила и С1-4 алкокси), ОR5а, S(O)nR5b, S(O)2N(R5c)(R5d), N(R5e)S(O)2R5f, N(R5g)(R5h), B1-C(O)-B2-R5i, арила и Het1, и эти С3-12 циклоалкильная или С4-12 циклоалкенильная группы дополнительно могут быть замещены =О),
(с) арил или
(d) Het2;
R2 представляет
H,
(b) С1-12 алкил, С2-12 алкенил, С2-12 алкинил, С3-12 циклоалкил, С4-12 циклоалкенил, эти последние пять групп необязательно замещены одним или несколькими заместителями, выбранными из галогена, азота, CN, С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С3-8 циклоалкила (последние три группы необязательно замещены одним или несколькими заместителями, выбранными из ОН, =О, галогена, С1-4 алкила и С1-4 алкокси), ОR6а, S(O)рR6b, S(O)2N(R6c)(R6d), N(R6e)S(O)2R6f, N(R6g)(R6h), B3-C(O)-B4-R6i, арила и Het3, и эти С3-12 циклоалкильная или С4-12 циклоалкенильная группы дополнительно могут быть замещены =О),
(с) арил или
(d) Het4;
R3 представляет собой H или от одного до четырех заместителей по конденсированному бензольному кольцу, выбранных из
(а) галогена,
(b) CN,
(c) С1-12 алкила, С2-12 алкенила, С2-12 алкинила, С3-12 циклоалкила, С4-12 циклоалкенила, эти последние пять групп необязательно замещены одним или несколькими заместителями, выбранными из галогена, азота, CN, С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С3-8 циклоалкила (последние три группы необязательно замещены одним или несколькими заместителями, выбранными из ОН, =О, галогена, С1-4 алкила и С1-4 алкокси), ОR7а, S(O)qR7b, S(O)2N(R7c)(R7d), N(R7e)S(O)2R7f, N(R7g)(R7h), B5-C(O)-B6-R7i, арила и Het5, и эти С3-12 циклоалкильная или С4-12 циклоалкенильная группы дополнительно могут быть замещены =О),
(d) OR8a,
(e) S(O)rR8b,
(f) S(O)2N(R8c)(R8d),
(g) N(R8e)S(O)2R8f,
(h) N(R8g)(R8h),
(i) B7-C(O)-B8-R8i,
(j) арила или
(k) Het6;
R5а-R5i, R6а-R6i, R7а-R7i и R8а-R8i независимо представляют собой в каждом случае
(а) Н,
(b) С1-10 алкил, С2-10 алкенил, С2-10 алкинил (последние три группы необязательно замещены одним или несколькими заместителями, выбранными из галогена, ОН, С1-6 алкокси, арила и Het7),
(с) С3-10 циклоалкил, С4-10 циклоалкенил (последние две группы необязательно замещены одним или несколькими заместителями, выбранными из галогена, ОН, =О, С1-6 алкила, С1-6 алкокси, арила и Het8),
(d) арил или
(е) Het9,
при условии, что R5b, R6b, R7b или R8b отличаются от Н, если n, p, q или r соответственно принимают значения 1 или 2;
каждый арил независимо представляет собой С6-10 карбоциклическую ароматическую группу, которая может содержать либо одно, либо два кольца и может быть замещена одним или несколькими заместителями, выбранными из
(а) галогена,
(b) CN,
(c) С1-12 алкила, С2-12 алкенила, С2-12 алкинила, С3-12 циклоалкила, С4-12 циклоалкенила, эти последние пять групп необязательно замещены одним или несколькими заместителями, выбранными из галогена, азота, CN, С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С3-8 циклоалкила (последние три группы необязательно замещены одним или несколькими заместителями, выбранными из ОН, =О, галогена, С1-4 алкила и С1-4 алкокси), ОR9а, S(O)tR9b, S(O)2N(R9c)(R9d), N(R9e)S(O)2R9f, N(R9g)(R9h), B9-C(O)-B10-R9i, фенила, нафтила (последние две группы необязательно замещены одним или несколькими заместителями, выбранными из ОН, галогена, С1-4 алкила и С1-4 алкокси) и Het10, и эти С3-12 циклоалкильная или С4-12 циклоалкенильная группы дополнительно могут быть замещены =О),
(d) OR10a,
(e) S(O)uR10b,
(f) S(O)2N(R10c)(R10d),
(g) N(R10e)S(O)2R10f,
(h) N(R10g)(R10h),
(i) B11-C(O)-B12-R10i,
(j) фенила (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из ОН, галогена, С1-4 алкила и С1-4 алкокси) или
(k) Het11;
R9а-R9i и R10а-R10i независимо представляют собой в каждом случае
(а) Н,
(b) С1-12 алкил, С2-12 алкенил, С2-12 алкинил, С3-12 циклоалкил, С4-12 циклоалкенил (эти последние пять групп необязательно замещены одним или несколькими заместителями, выбранными из галогена, ОН, С1-6 алкила, С3-12 циклоалкила, С4-12 циклоалкенила (последние две группы необязательно замещены одним или несколькими заместителями, выбранными из ОН, =О, галогена, С1-4 алкила и С1-4 алкокси), С1-6 алкокси, NH2, N(H)-С1-6 алкила, N(С1-6 алкил)2, фенила (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из ОН, галогена, С1-4 алкила и С1-4 алкокси) и Het12, и эти С3-12 циклоалкильная или С4-12 циклоалкенильная группы дополнительно могут быть замещены =О),
(с) фенил (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из ОН, CN, галогена, С1-6 алкила и С1-6 алкокси) или
(е) Het13,
при условии, что R9b или R10b отличаются от Н, если t или u соответственно принимают значения 1 или 2;
Het1 - Het13 независимо представляют собой 4-14-членные гетероциклические группы, содержащие один или несколько гетероатомов, выбранных из кислорода, азота и/или серы, эти гетероциклические группы могут содержать одно, два или три кольца и могут быть замещены одним или несколькими заместителями, выбранными из
(а) галогена,
(b) CN,
(c) С1-12 алкила, С2-12 алкенила, С2-12 алкинила, С3-12 циклоалкила, С4-12 циклоалкенила, эти последние пять групп необязательно замещены одним или несколькими заместителями, выбранными из галогена, азота, CN, С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С3-8 циклоалкила (последние три группы необязательно замещены одним или несколькими заместителями, выбранными из ОН, =О, галогена, С1-4 алкила и С1-4 алкокси), ОR11а, S(O)vR11b, S(O)2N(R11c)(R11d), N(R11e)S(O)2R11f, N(R11g)(R11h), B13-C(O)-B14-R11i, фенила, нафтила (последние две группы необязательно замещены одним или несколькими заместителями, выбранными из ОН, галогена, С1-4 алкила и С1-4 алкокси) и Hetа, и эти С3-12 циклоалкильная или С4-12 циклоалкенильная группы дополнительно могут быть замещены =О,
(d) OR12a,
(e) =O,
(f) S(O)wR12b,
(g) S(O)2N(R12c)( R12d),
(h) N(R12e)S(O)2R12f,
(i) N(R12g)(R12h),
(j) B15-C(O)-B16-R12i,
(k) фенила (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из ОН, галогена, С1-4 алкила и С1-4 алкокси) или
(l) Hetb;
R11а-R11i и R12а-R12i независимо представляют собой в каждом случае
(а) Н,
(b) С1-12 алкил, С2-12 алкенил, С2-12 алкинил, С3-12 циклоалкил, С4-12 циклоалкенил (эти последние пять групп необязательно замещены одним или несколькими заместителями, выбранными из галогена, ОН, С1-6 алкила, С3-12 циклоалкила, С4-12 циклоалкенила (последние две группы необязательно замещены одним или несколькими заместителями, выбранными из ОН, =О, галогена, С1-4 алкила и С1-4 алкокси), С1-6 алкокси, фенила (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из ОН, галогена, С1-4 алкила и С1-4 алкокси) и Hetс, и эти С3-12 циклоалкильная или С4-12 циклоалкенильная группы дополнительно могут быть замещены =О),
(с) фенил (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из ОН, галогена, С1-4 алкила и С1-4 алкокси) или
(е) Hetd,
при условии, что R11b или R12b отличаются от Н, если v или w соответственно принимают значения 1 или 2;
B1 - B16 независимо представляют собой простую связь, O, S, NH или N(R13);
n, p, q, r, s, t, u, v и w независимо принимают значения 0, 1 или 2;
R13 представляет
(а) С1-6 алкил,
(b) фенил (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из ОН, галогена, С1-4 алкила и С1-4 алкокси),
(с) С3-7 циклоалкил (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из ОН, =О, галогена, С1-4 алкила и С1-4 алкокси) или
(е) Hetе;
Hetа - Hetе независимо представляют собой 5-ти или 6-членные гетероциклические группы, содержащие от одного до четырех гетероатомов, выбранных из кислорода, азота и/или серы, эти гетероцикличные группы могут быть замещены одним или несколькими заместителями, выбранными из галогена, =О и С1-6 алкила; и
если не указано иного
(i) алкильная, алкенильная, алкинильная, циклоалкильная и циклоалкенильная группы, а также алкильная часть алкоксигрупп могут быть замещены одним или несколькими атомами галогена, и
(ii) циклоалкильная и циклоалкенильная группы могут содержать одно или два кольца и дополнительно могут представлять собой кольцо, конденсированное с одним или двумя бензольными кольцами.
Во избежание неопределенности, каждый заместитель -Х-R4а присоединяется к пирролидинильному кольцу через фрагмент Х.
При использовании в данном документе под термином «фармацевтически приемлемое производное» понимают:
(а) фармацевтически приемлемые соли либо с кислотами, либо с основаниями (например, кислотно-аддитивные соли) и/или
(b) сольваты (например, гидраты)
К кислотно-аддитивным солям, которые могут быть указаны, относятся карбоксилатные соли (например, соли формиат, ацетат, трифторацетат, пропионат, изобутират, гептаноат, деканоат, капрат, каприлат, стеарат, акрилат, капроат, пропиолат, аскорбат, цитрат, глюкуронат, глутамат, гликолят, α-гидроксибутират, лактат, тартрат, фенилацетат, манделат, фенилпропионат, фенилбутират, бензоат, хлорбензоат, метилбензоат, гидроксибензоат, метоксибензоат, динитробензоат, о-ацетоксибензоат, салицилат, никотинат, изоникотинат, циннамат, оксалат, малонат, сукцинат, суберат, себацинат, фумарат, малат, малеат, гидроксималеат, гиппурат, фталат или терефталат), соли галиды (например, соли хлорид, бромид или йодид), соли сульфонаты (например, соли бензолсульфонат, метил-, бром- или хлорбензолсульфонат, ксиленсульфонат, метансульфонат, этансульфонат, пропансульфонат, гидроксиэтансульфонат, 1- или 2-нафталинсульфонат или 1,5-нафталиндисульфонат) или соли сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрогенфосфат, дигидрогенфосфат, метафосфат, пирофосфат или нитрат и подобное.
Под термином «фармацевтически приемлемое производное» также понимают:
(а) С1-4 алкил четвертичные соли аммония; или
(b) N-оксиды
либо по двум третичным атомам N кольцевой системы 4-(пирролидин-1-ил)хинолина, либо по третичному атому N, который может присутствовать в любом из заместителей R1, R2 и R3.
Во избежание неопределенности, определения терминов арил, алкил, алкенил, алкинил, циклоалкил, циклоалкенил и алкоксигрупп, представленных выше, применяют, если не указано иного, при каждом использовании таких терминов в данном документе. Кроме того, одно или два бензольных кольца, которые могут быть конденсированы с циклоалкильными группами, могут нести один или несколько заместителей, определенных в отношении соответствующей циклоалкильной группы.
Под термином «галоген», используемым в данном документе, понимают хлор, бром и йод.
Гетероциклические (Het1-Het13 и Hetа-Hetе) группы по природе могут быть полностью насыщенными, частично ненасыщенными, целиком ароматическими или частично ароматическими. К гетероциклическим (Het1-Het13 и Hetа-Hetе) группам, которые могут быть указаны, относятся 1-азабицикло[2.2.2] октанил, бензимидазолил, бензо[c]изоксазолидинил, бензизоксазолил, бензодиоксанил, бензодиоксепанил, бензодиоксолил, бензофуранил, бензофуразанил, бензоморфолинил, 2,1,3-бензоксадиазолил, бензоксазолидинил, бензоксазолил, бензопиразолил, бензо[e]пиримидин, 2,1,3-бензотиадиазолил, бензотиазолил, бензотиенил, бензотриазолил, хроманил, хроменил, циннолинил, 2,3-дигидробензимидазолил, 2,3-дигидробензо [b] фуранил, 1,3-дигидробензо[c]фуранил, 1,3-дигидро-2,1-бензизоксазолил, 2,3-дигидропирроло[2,3-b]пиридинил, диоксанил, фуранил, гексагидропиримидинил, гидантоинил, имидазолил, имидазо [1,2-а]пиридинил, имидазо[2,3-b]тиазолил, индолил, изохинолинил, изоксазолидинил, изоксазолил, малеимидо, морфолинил, нафто[1,2-b]фуранил, оксадиазолил, 1,2- или 1,3-оксазинанил, оксазолил, фталазинил, пиперазинил, пиперидинил, пуринил, пиранил, пиразинил, пиразолил, пиридазинил, пиридинил, пиримидинил, пирролидинонил, пирролидинил, пирролинил, пирроло[2,3-b]пиридинил, пирроло[5,1-b]пиридинил, пирроло[2,3-c]пиридинил, пирролил, хиназолинил, хинолинил, сульфоланил, 3-сульфоленил, 4,5,6,7-тетрагидробензимидазолил, 4,5,6,7-тетрагидробензопиразолил, 5,6,7,8-тетрагидробензо[е]пиримидин, тетрагидрофуранил, тетрагидропиранил, 3,4,5,6-тетрагидропиридинил, 1,2,3,4-тетрагидропиримидинил, 3,4,5,6-тетрагидропиримидинил, тиадиазолил, тиазолидинил, тиазолил, тиенил, тиено[5,1-c]пиридинил, тиохроманил, тиазолил, 1,3,4-тиазоло[2,3-b]пиримидинил, ксантенил и подобное.
К заместителям Het2, которые могут быть указаны, относятся бензимидазолил (например, бензимидазол-2-ил), пиперидинил (например, пиперидин-4-ил), пиридинил (например, пиридин-3-ил) и пирролидинил (например, пирролидин-3-ил).
К заместителям Het6, которые могут быть указаны, относятся морфолинил (например, морфолин-4-ил), пиперидинил (например, пиперидин-4-ил) или, в частности, пирролидинонил (например, 1-пирролидин-2-он).
К заместителям Het7, которые могут быть указаны, относятся изоксазолил (например, изоксазол-3-ил) и пиридинил (например, пиридин-3-ил).
К заместителям Het9, которые могут быть указаны, относятся пиперидинил (например, пиперидин-1-ил) или, в частности, фуранил (например, фуран-2-ил), имидазолил (например, имидазол-5-ил), изоксазолил (например, изоксазол-3-ил, изоксазол-4-ил или изоксазол-5-ил), пиразинил (например, пиразин-2-ил), пиразолил (например, пиразол-3-ил или пиразол-4-ил), пиридазинил (например, пиридазин-4-ил) или пиридинил (например, пиридин-2-ил или пиридин-3-ил).
К заместителям Het11, которые могут быть указаны, относятся пиперазинил (например, пиперазин-1-ил), пиперидинил (например, пиперидин-1-ил) и пиридинил (например, пиридин-3-ил).
К заместителям Het13, которые могут быть указаны, относится пиридинил (например, пиридин-3-ил).
При использовании в данном документе под термином «микроорганизмы» понимают:
(а) грибы (определенные ниже); и в особенности
(b) бактерии (определенные ниже).
В данном документе термины «микробный», «антимикробный» и «антимикробно» должны интерпретироваться в соответствии с определением «микроорганизмы». Например, под термином «микробный» понимают грибковый или, в особенности, бактериальный.
При использовании в данном документе под термином «клинически латентный» понимают микроорганизмы, которые являются жизнеспособными, но некультивируемыми (например, бактерии, которые нельзя детектировать стандартными техниками культивирования, но которые определяются и подсчитываются с помощью методик, таких как подсчет при разведении среды, микроскопия, или методик молекулярной биологии, таких как полимеразная цепная реакция).
Под термином «клинически латентный» также понимают микроорганизмы, которые фенотипически толерантны, например микроорганизмы, которые:
(а) чувствительны (например, в log-фазе) к биостатическим (например, бактериостатическим) эффектам общепринятых антимикробных агентов (т.е. микроорганизмы, для которых минимальная ингибирующая концентрация (MIC) общепринятых антимикробных средств по существу не изменяется); но
(b) обладают существенно сниженной чувствительностью к уничтожению, индуцированному лекарственным средством (например, микроорганизмы, для которых с каким-либо данным общепринятым антимикробным агентом отношение минимальной микробицидной концентрации (например, минимальной бактерицидной концентрации, МВС) к MIC принимает значения 10 или более).
В отношении пункта (а) выше, «по существу неизменяемый» относится к величинам MIC, которые находятся в пределах от 50 до 200% (например, от 90 до 110%) величины, определенной в стандартных для микроорганизма и интересующего общепринятого антимикробного агента условиях.
Во избежание неопределенности термин «клинически латентный» исключает микроорганизмы, которые генотипически резистентны к общепринятым антимикробным агентам (т.е. микроорганизмы, которые генетически отличаются от чувствительных к антимикробным препаратам членов того же рода и у которых наблюдается повышенная MIC (например, в log-фазе) для одного или нескольких общепринятых антимикробных агентов по сравнению с указанными чувствительными к антимикробным препаратам микроорганизмами).
Термин «клинически латентный» включает микроорганизмы, которые
(i) метаболически активны; но
(ii) обладают скоростью роста, которая ниже порога развития инфекционного заболевания.
Специалистам в данной области будет понятно, что под термином «порог развития инфекционного заболевания» понимают пороговую величину скорости роста, ниже которой симптомы инфекционного заболевания (у пациента, инфицированного соответствующим микроорганизмом) отсутствуют.
В отношении пункта (i) выше, метаболическая активность латентных микроорганизмов может быть определена несколькими способами, известными специалистам в данной области, например измерением уровней мРНК в микроорганизмах или определением скорости поглощения ими уридина. В связи с этим под термином «клинически латентный» дополнительно понимают микроорганизмы, которые по сравнению с тем же количеством микроорганизмов в состоянии логарифмической фазы роста (in vitro или in vivo) обладают сниженными, но все-таки существенными уровнями:
(I) мРНК (например, от 0,0001 до 50%, такими как от 1 до 30, от 5 до 25 или от 10 до 20% уровня мРНК); и/или
(II) поглощения уридина (например, [3Н] уридина) (например, от 0,0005 до 50%, такое как от 1 до 40, от 15 до 35 или от 20 до 30% уровня поглощения [3Н] уридина.
При использовании в данном документе под термином «общепринятый(е) антимикробный(е) агент(ы)» понимают:
(а) общепринятые противогрибковые агенты; и особенно
(b) общепринятые антибактериальные агенты,
где каждый из пунктов (а) и (b) определяется ниже.
При использовании в данном документе под термином «общепринятый(е) антимикробный(е) агент(ы)» понимают бактерицидные и бактериостатические агенты, которые известны из предшествующего уровня техники (т.е. агенты, которые были отобраны и разработаны на основе величин их MIC - точнее, их способности ингибировать рост бактерий). В связи с этим к конкретным общепринятым антибактериальным агентам, которые могут быть указаны, относятся какой-либо один или несколько агентов из следующего списка.
(а) β-лактамы, включающие:
(i) пенициллины, такие как
(I) бензилпенициллин, прокаин бензилпенициллин, феноксиметилпенициллин, метициллин, пропициллин, эпициллин, циклациллин, гетациллин, 6-аминопенициллановая кислота, пенициллиновая кислота, сульфон пенициллановой кислоты (сульбактам), пенициллин G, пенициллин V, фенетициллин, феноксиметилпенициллиновая кислота, азлоциллин, карбенициллин, клоксациллин,
D-(-)-пеницилламин, диклоксациллин, нафциллин и оксациллин,
(II) пенициллины, резистентные к пенициллиназе (например, флуклоксациллин),
(III) пенициллины широкого спектра (например, ампициллин, амиксициллин, метампициллин и бакампициллин),
(IV) противопсевдомональные пенициллины (например, карбоксипенициллины, такие как тикарциллин или уреидопенициллины, такие как пиперациллин),
(V) мециллинамы (например, пивмециллинам) или
(VI) комбинации любых двух или больше агентов, указанных в пунктах c (I) по (V) выше, или комбинации любых агентов, указанных в пунктах c (I) по (V) выше, с ингибитором β-лактамазы, таким как тазобактам или, в особенности, клавулановая кислота (которая необязательно находится в форме соли металла, например в форме соли со щелочным металлом, таким как натрий или особенно калий);
(ii) цефалоспорины, такие как цефаклор, цефадроксил, цефалексин, цефкапен, цефкапена пивоксил, цефдинир, цефдиторен, цефдиторена пивоксил, цефиксим, цефотаксим, цефпиром, цефподоксим, цефподоксима проксетил, цефпрозил, цефрадин, цефтазидим, цефтерам, цефтерама пивоксил, цефтриаксон, цефуроксим, цефуроксима аксетил, цефалоридин, цефацетрил, цефамандол, цефалоглицин, цефтобипрол, PPI-0903 (TAK-599), 7-аминоцефалоспорановая кислота, 7-аминодезацетоксицефалоспорановая кислота, цефамандол, цефазолин, цефметазол, цефоперазон, цефсулодин, цефалоспорин С (цинковая соль), цефалотин, цефапирин; и
(iii) другие β-лактамы, такие как монобактамы (например, азтреонам), карбапенемы (например, имипенем (необязательно в комбинации с ингибитором фермента почек, таким как циластатин), меропенем, эртапенем, дорипенем (S-4661) и RO4908463 (CS-023)), пенемы (например, фаропенем) и 1-окса-β-лактамы (например, моксалактам).
(b) Тетрациклины, такие как тетрациклин, демеклоциклин, доксициклин, лимециклин, миноциклин, окситетрациклин, хлортетрациклин, меклоциклин и метациклин, а также глицилциклины (например, тигециклин).
(c) Аминогликозиды, такие как амикацин, гентамицин, нетилмицин, неомицин, стрептомицин, тобрамицин, амастатин, бутирозин, бутирозин А, даунорубицин, дибекацин, дигидрострептомицин, G 418, гигромицин В, канамицин В, канамицин, кирромицин, паромомицин, рибостамицин, сизомицин, спектиномицин, стрептозоцин и тиострептон.
(d) (i) Макролиды, такие как азитромицин, кларитромицин, эритромицин, рокситромицин, спирамицин, амфотерицины В (например, амфотерицин В), бафиломицины (например, бафиломицин А1), брефелдины (например, брефелдин А), конканамицины (например, конканамицин А), филипин комплекс, джозамицин, мепартрицин, мидекамицин, нонактин, нистатин, олеандомицин, олигомицины (например, олигомицин А, олигомицин В и олигомицин С), пимарицин, рифампицин, рифамицин, розамицин, тилозин, виргиниамицин и фосфомицин.
(ii) Кетолиды, такие как телитромицин и цетромицин (АВТ-773).
(iii) Линкозамины, такие как линкомицин.
(e) Клиндамицин и клиндамицина 2-фосфат.
(f) Фениколы, такие как хлорамфеникол и тиамфеникол.
(g) Стероиды, такие как фузидиевая кислота (необязательно в форме соли металла, например в форме соли с щелочным металлом, таким как натрий).
(h) Гликопептиды, такие как ванкомицин, тейкопланин, блеомицин, флеомицин, ристомицин, телаванцин, далбаванцин и оритаванцин.
(i) Оксазолидиноны, такие как линезолид и AZD2563.
(j) Стрептограмины, такие как хинупристин и дальфопристин или их комбинация.
(k) (i) Пептиды, такие как полимиксины (например, колистин и полимиксин В), лизостафин, дурамицин, актиномицины (например, актиномицин С и актиномицин D), актинонин, 7-аминоактиномицин D, антимицин А, антипаин, бацитрацин, циклоспорин А, эхиномицин, грамицидины (например, грамицидин А и грамицидин С), миксотиазол, низин, парацельзин, валиномицин и виомицин.
(ii) Липопептиды, такие как даптомицин.
(iii) Липогликопептиды, такие как рамопланин.
(l) Сульфонамиды, такие как сульфаметоксазол, сульфадиазин, сульфахиноксалин, сульфатиазол (последние два агента необязательно находятся в форме соли металла, например в форме соли с щелочным металлом, таким как натрий), сукцинилсульфатиазол, сульфадиметоксин, сульфагуанидин, сульфаметазин, сульфамонометоксин, сульфаниламид и сульфасалазин.
(m) Триметоприм, необязательно в сочетании с сульфонамидом, таким как сульфаметоксазол (например, комбинация ко-тримоксазол).
(n) Противотуберкулезные лекарственные средства, такие как изониазид, рифампицин, рифабутин, пиразинамид, этамбутол, стрептомицин, амикацин, капреомицин, канамицин, хинолоны (например, такие как в пункте (q) ниже), пара-аминосалициловая кислота, циклосерин и этионамид.
(o) Противолепрозные лекарственные средства, такие как дапсон, рифампицин и клофазимин.
(p) (i) Нитроимидазолы, такие как метронидазол и тинидазол.
(ii) Нитрофураны, такие как нитрофурантоин.
(q) Хинолоны, такие как налидиксовая кислота, норфлоксацин, ципрофлоксацин, офлоксацин, левофлоксацин, моксифлоксацин, гатифлоксацин, гемифлоксацин, гареноксацин, DX-619, WCK 771 (S-(-)-надифлоксацина аргининовая соль), 8-хинолинол, циноксацин, энрофлоксацин, флумехин, ломефлоксацин, оксолиновая кислота и пипемидиновая кислота.
(r) Производные аминокислот, такие как азасерин, бестатин, D-циклосерин, 1,10-фенантролин, 6-диазо-5-оксо-L-норлейцин и L-аланил-L-1-аминоэтилфосфоновая кислота.
(s) Ауреолиевые кислоты, такие как хромомицин А3, митрамицин А и митомицин С.
(t) Бензохиноиды, такие как гербимицин А.
(u) Кумарин-гликозиды, такие как новобиоцин.
(v) Производные дифенилового эфира, такие как иргасан.
(w) Эпиполитиодиксопиперазины, такие как глиотоксин из Gliocladium fimbriatum.
(x) Производные жирных кислот, такие как церуленин.
(y) Глюкозамины, такие как 1-дезоксиманноджиримицин, 1-дезоксиноджиримицин и N-метил-1-дезоксиноджиримицин.
(z) Производные индола, такие как стауроспорин.
(aa) Диаминопиримидины, такие как иклаприм (AR-100).
(ab) Макролактамы, такие как аскомицин.
(ac) Таксоиды, такие как паклитаксел.
(ad) Статины, такие как мевастатин.
(ae) Полифеноловые кислоты, такие как (+)-усниновая кислота.
(af) Полиэфиры простые, такие как лазалоцид А, лономицин А, монензин, нигерицин и салиномицин.
(ag) Производные пиколиновой кислоты, такие как фузариевая кислота.
(ah) Пептидил-нуклеозиды, такие как бластицидин S, никкомицин, нурсеотрицин и пуромицин.
(ai) Нуклеозиды, такие как аденин 9-β-D-арабинофуранозид, 5-азацитидин, кордицепин, формицин А, туберцидин и туникамицин.
(aj) Плеуромутилины, такие как GSK-565154, GSK-275833 и тиамулин.
(ak) Ингибиторы пептидной деформилазы, такие как LВМ415 (NVP PDF-713) и ВВ 83698.
(al) Антибактериальные агенты для кожи, такие как фуцидин, бензамицин, клиндамицин, эритромицин, тетрациклин, сульфадиазин серебра, хлортетрациклин, метронидазол, мупироцин, фрамицитин, грамицидин, неомицина сульфат, полимиксины (например, полимиксин В) и гентамицин.
(am) Прочие агенты, такие как метенамин (гексамин), доксорубицин, пиерицидин А, стигмателлин, актидион, анизомицин, апрамицин, кумермицин А1, L(+)-молочная кислота, цитохалазины (например, цитохалазин В и цитохалазин D), эметин и иономицин.
К конкретным общепринятым антибактериальным агентам, которые могут быть указаны, относятся агенты, перечисленные в пунктах с (а) по (q) выше, такие как:
-циллины, перечисленные в пункте (a)(i) выше (например, амоксициллин, ампициллин, феноксиметилпенициллин или, особенно, ко-амоксиклав (ко-амоксициллин));
цефалоспорины, перечисленные в пункте (a)(ii) выше (например, цефуроксим, цефаклор или цефалексин);
карбапенемы, перечисленные в пункте (a)(iii) выше (например, эртапенем);
тетрациклины, перечисленные в пункте (b) выше (например, доксициклин или миноциклин);
макролиды, перечисленные в пункте (d)(i) выше (например, кларитромицин, эритромицин, рокситромицин или, особенно, азитромицин);
кетолиды, перечисленные в пункте (d)(ii) выше (например, телитромицин);
оксазолидиноны, перечисленные в пункте (i) выше (например, линезолид);
липопептиды, перечисленные в пункте (k)(ii) выше (например, даптомицин);
триметоприм и комбинации с ним (например, ко-тримоксазол), перечисленные в пункте (m) выше;
нитрофураны, перечисленные в пункте (р) выше (например, нитрофурантоин); и
хинолоны, перечисленные в пункте (q) выше (например, норфлоксацин, ципрофлоксацин, офлоксацин или, особенно, левофлоксацин или моксифлоксацин).
При использовании в данном документе под термином «общепринятый(е) противогрибковый(е) агент(ы)» понимают фунгицидные и фунгистатические агенты, которые известны из предшествующего уровня техники (т.е. агенты, которые были отобраны и разработаны на основе величин их MIC - то есть их способности ингибировать рост грибов). В связи с этим к конкретным противогрибковым агентам, которые могут быть указаны, относятся какой-либо один или несколько агентов из следующего списка.
(а) азольные противогрибковые препараты, такие как имидазолы (например, клотримазол, эконазол, фентиконазол, кетоконазол, миконазол, сульконазол и тиоконазол) или триазолы (например, флуконазол, итраконазол и вориконазол);
(b) полиеновые противогрибковые препараты, такие как амфотерицин и нистатин;
(c) прочие противогрибковые агенты, такие как гризеофульвин, каспофунгин или флуцитозин, последние два агента необязательно используют в сочетании;
(d) аллиламиновые противогрибковые препараты, такие как тербинафин.
К вариантам осуществления соединений формулы I, которые могут быть указаны, относятся такие варианты, где:
(1) R1 представляет собой от одного до четырех заместителей (например, два заместителя или, в частности, один заместитель), по меньшей мере в одном из которых R4а и/или R4b отличается от Н;
(2) R4a представляет
(a) С1-12 алкил, С3-12 циклоалкил, С3-12 циклоалкенил (эти последние три группы замещены арилом или группой Het1 и необязательно дополнительно замещены одним или несколькими заместителями, выбранными из галогена, азота, CN, С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С3-8 циклоалкила (последние три группы необязательно замещены одним или несколькими заместителями, выбранными из ОН, =О, галогена, С1-4 алкила и С1-4 алкокси), ОR5а, S(O)nR5b, S(O)2N(R5c)(R5d), N(R5e)S(O)2R5f, N(R5g)(R5h), B1-C(O)-B2-R5i, арила и Het1, и эти С3-12 циклоалкильная или С4-12 циклоалкенильная группы дополнительно могут быть замещены =О),
(c) арил или
(d) Het2;
(3) R2 отличается от Н.
К дополнительным вариантам осуществления соединений формулы I, которые могут быть указаны, относятся такие варианты,
где:
(1) R1 представляет собой два заместителя или, в частности, один заместитель на пирролидинильном кольце, причем каждый заместитель независимо представляет собой группу -Х-R4а;
(2) Х представляет собой простую связь, -О- или -N(H)- (например, простую связь или -N(H)-);
(3) R4a представляет собой
(a) С1-8 алкил (например, С1-6 или С1-4 алкил, такой как метил) или С4-6 циклоалкил, эта алкильная или циклоалкильная группа необязательно замещена одним или несколькими заместителями, выбранными из галогена, азота, CN, С1-2 алкила, С4-6 циклоалкила (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из =О, галогена, метила и метокси), ОR5а, фенила, нафтила (последние две группы необязательно замещены одним или несколькими (например, от одного до четырех) заместителями, выбранными из галогена, CN, С1-6 алкила, С2-6 алкенила, С2-6 алкинила или С3-6 циклоалкила, OR10а, S(O)2 R10b и -С(O)R10i) или
(b) фенил или нафтил (последние две группы необязательно замещены одним или несколькими (например, от одного до четырех) заместителями, выбранными из галогена, CN, С1-6 алкила, С2-6 алкенила, С2-6 алкинила или С3-6 циклоалкила, OR10а, S(O)2R10b и -С(O)R10i);
(4) R2 представляет собой
(а) Н,
(b) С1-8 алкил (например, С1-6 алкил, такой как С1-4 алкил или, в частности, метил), С2-8 алкенил, С2-8 алкинил, С3-6 циклоалкил, последние четыре группы необязательно замещены одним или несколькими заместителями, выбранными из галогена, метила и метокси;
(5) R3 представляет собой Н или от одного до четырех (например, два или, в частности, один) заместителей на конденсированном бензольном кольце (например, от одного до четырех заместителей, включая по меньшей мере один заместитель в положении 6 хинолиновой или хиназолиновой кольцевой системы), выбранных из
(а) галогена,
(b) CN,
(с) С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С4-6 циклоалкила, последние четыре группы необязательно замещены одним или несколькими заместителями, выбранными из галогена, азота, CN, С1-3 алкила, С2-3 алкенила, С2-3 алкинила, С4-6 циклоалкила, OR7а, N(Н)S(O)2 R7f, N(Н)(R7h), -С(O)R7i, арила и Het5,
(d) OR8a,
(e) S(O)2R8b,
(f) S(O)2N(R8c)(R8d),
(g) N(R8e)S(O)2R8f,
(h) N(R8g)(R8h),
(i) -C(O)R8i, -N(R13)C(O)R8i, OC(O)R8i, C(O)N(H)R8i, C(O)OR8i,
(j) арила или
(k) Het6;
(6) R5а представляет в каждом случае
(а) С1-6 алкил, С2-6 алкенил, С2-6 алкинил (последние три группы необязательно замещены одним или несколькими заместителями, выбранными из галогена, С1-2 алкокси, фенила и нафтила, последние две группы необязательно замещены одним или несколькими (например, от одного до четырех) заместителями, выбранными из галогена, CN, С1-6 алкила, С2-6 алкенила, С2-6 алкинила или С3-6 циклоалкила, ОR10а, S(O)2R10b и -С(О)R10i),
(b) С3-6 циклоалкил (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из галогена, =О, метила, метокси и фенила),
(с) фенил или нафтил (последние две группы необязательно замещены одним или несколькими (например, от одного до четырех) заместителями, выбранными из галогена, CN, С1-6 алкила, С2-6 алкенила, С2-6 алкинила или С3-6 циклоалкила, ОR10а, S(O)2R10b и -С(О)R10i);
(7) R7а-R7i и R8а-R8i независимо представляют собой в каждом случае
(а) Н,
(b) С1-6 алкил, С2-6 алкенил, С2-6 алкинил (последние три группы необязательно замещены одним или несколькими заместителями, выбранными из галогена, ОН, метокси, арила и Het7),
(с) С4-6 циклоалкил (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из галогена, ОН, =О, метила, метокси, арила и Het8),
(d) арил или
(е) Het9,
при условии, что R7b или R8b отличаются от Н, если q или r соответственно принимают значения 1 или 2;
(8) R10а, R10b и R10i независимо представляют собой в каждом случае
(а) С1-6 алкил, С2-6 алкенил, С2-6 алкинил, С4-6 циклоалкил (последние четыре группы необязательно замещены одним или несколькими заместителями, выбранными из галогена, метила и метокси) или
(с) фенил (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из CN, галогена, С1-2 алкилила и С1-2 алкокси);
(9) Het6 представляет собой 4-7-членную ароматическую частично ненасыщенную или, в частности, полностью насыщенную гетероциклическую группу, содержащую один атом азота (который может образовывать точку присоединения группы Het6 к остатку молекулы) и необязательно один или два дополнительных гетероатома, выбранных из кислорода, азота и/или серы, эта гетероциклическая группа может быть замещена одним или несколькими заместителями, выбранными из галогена, метила, метокси и =О;
(10) Het7-Het9 независимо представляют собой 5-10-членные ароматические гетероциклические группы, содержащие один или несколько (например, от одного до трех) гетероатомов, выбранных из кислорода, азота и/или серы, эти гетероциклические группы могут содержать одно или два кольца и могут быть замещены одним или несколькими (например, одним или двумя) заместителями, выбранными из
(а) галогена,
(b) CN,
(c) С1-8 алкила (например, С1-6 алкила, такого как С1-4 алкил или, в частности, метил), С2-8 алкенила, С2-8 алкинила, С4-6 циклоалкила, последние четыре группы необязательно замещены одним или несколькими заместителями, выбранными из галогена, метила и метокси,
(d) OR12a,
(i) N(H)( R12h),
(j) -C(O)R12i, -N(H)C(O)R12i, -OC(O)R12i, -C(O)N(H)R12i, -C(O)OR12i,
(k) фенила (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из ОН, галогена, метила и метокси) или
(l) Hetb;
(11) R12а, R12h и R12i независимо представляют собой в каждом случае H, С1-2 алкил или фенил (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из ОН, галогена, метила и метокси);
(12) R13 представляет собой С1-3 алкил (например, метил) или, в частности, Н;
(13) Hetb представляет собой 5- или 6-членный ароматический гетероцикл, содержащий от одного до трех гетероатомов, выбранных из азота и кислорода, эта гетероциклическая группа необязательно замещена заместителями в количестве от одного до трех, выбранными из галогена и метила;
(14) если не указано иного, алкильная, алкенильная, алкинильная, циклоалкильная и циклоалкенильная группы, а также алкильная часть алкоксигрупп не замещаются;
(15) если не указано иного, циклоалкильные группы содержат одно или (если имеется достаточное количество атомов С) два кольца и необязательно кольцо конденсировано с бензольным кольцом (таким образом, чтобы образовать группу, такую как, например, 1,2,3,4-тетрагидронафтил или, в частности, инданил).
К дополнительным вариантам осуществления соединений формулы I, которые могут быть указаны, относятся варианты, где:
(1) Е представляет собой СН;
(2) R1 представляет собой один заместитель -Х-R4а на пирролидинильном кольце (например, заместитель по 3 положению кольца);
(3) Х представляет собой простую связь или -N(H)-;
(4) R4а представляет
(a) С1-2 алкил (такой как метил), эта алкильная группа замещается одним или несколькими заместителями, выбранными из фенила (последняя группа необязательно замещена одним или несколькими (например, двумя или, в частности, одним) заместителями, выбранными из галогена (например, хлора), CN, С1-3 алкила и ОR10а), или
(b) фенил (последняя группа необязательно замещена одним или несколькими (например, двумя или, в частности, одним) заместителями, выбранными из галогена (например, хлора), CN, С1-3 алкила и ОR10а);
(5) R2 представляет собой С1-2 алкил, такой как метил;
(6) R3 представляет собой от одного до четырех заместителей на конденсированном бензольном кольце, включая по меньшей мере один заместитель в положении 6 хинолиновой или хиназолиновой кольцевой системы, где каждый заместитель независимо выбирают из
(а) галогена (например, хлора),
(b) ОR8а,
(с) N(H)S(O)2R8f,
(d) N(H)( R8h),
(e) -N(H)C(O)R8i, C(O)N(H)R8i или
(f) Het6;
(7) R8a-R8i независимо представляют собой в каждом случае
(а) С1-4 алкил (например, метил или этил), необязательно замещенный фенилом (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из галогена, CN, С1-2 алкила, метокси, этокси и S(O)2-(С1-2 алкила)) или Het7,
(b) фенил (последняя группа необязательно замещена одним или несколькими заместителями, выбранными из галогена, CN, С1-2 алкила, метокси, этокси и S(O)2-(С1-2 алкила)) или
(е) Het9;
(8) R10а представляет собой С1-4 алкил (например, метил);
(9) Het6 представляет собой 5- или 6-членную полностью насыщенную гетероциклическую группу, содержащую один атом азота (этот атом образует точку присоединения группы Het6 к остатку молекулы) и необязательно один дополнительный гетероатом, выбранный из кислорода и азота, эта гетероциклическая группа может быть замещена одним или несколькими заместителями, выбранными из галогена, метила и =О;
(10) Het7-Het9 независимо представляют собой 5- или 6-членные ароматические гетероциклические группы, содержащие от одного до трех (например, один или два) гетероатомов, выбранных из кислорода, азота и/или серы (например, выбранных из кислорода и/или азота), эти гетероциклические группы могут быть замещены одним или несколькими (например, одним или двумя) заместителями, выбранными из галогена, CN и С1-2 алкила (например, метила).
В определенных вариантах осуществления изобретения соединение формулы I представляет собой соединение формулы Ia,
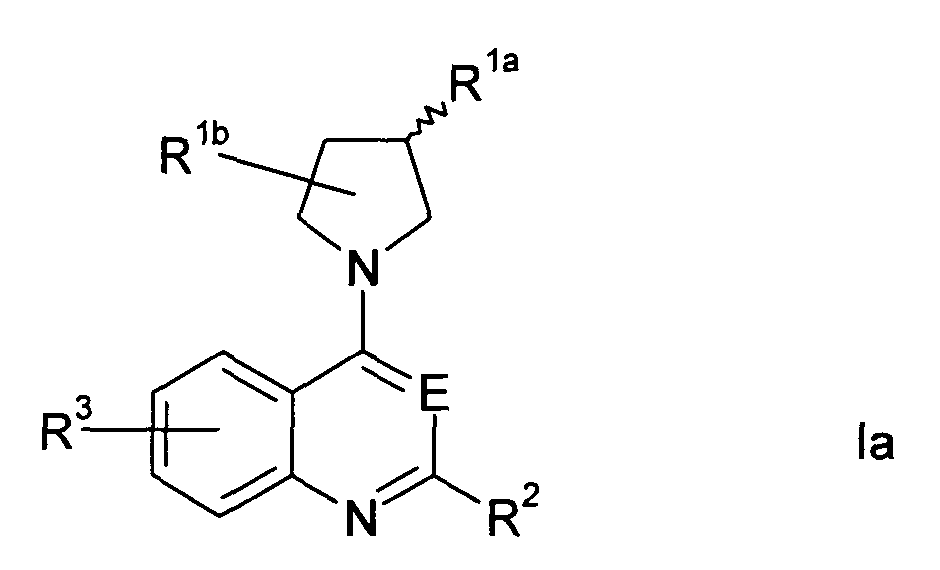
где R1а представляет собой -Х-R4а;
R1b представляет собой H или один или два заместителя на пирролидинильном кольце, причем каждый заместитель независимо представляет собой группу -Х-R4а;
и Е, Х, R2, R3 и R4а определены в данном документе ранее.
Далее в данном документе под соединениями формулы I, если в контексте не указано иного, понимают соединения формулы Ia. Напротив, при обращении к конкретным вариантам осуществления соединений формулы Ia эти варианты осуществления применяют в равной мере в соответствующих случаях к соединениям формулы I.
К вариантам осуществления соединений формулы Ia, которые могут быть указаны, относятся варианты, в которых структурный фрагмент
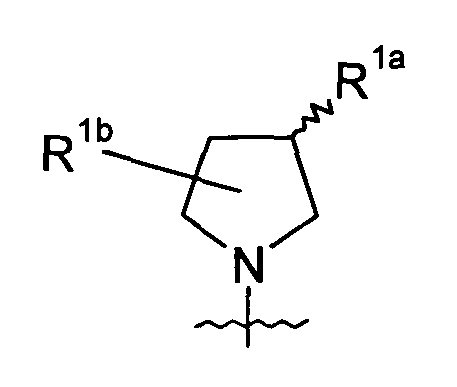
находится в:
(а) R-конфигурации по атому С, к которому присоединен R1а; или
(b) S-конфигурации по атому С, к которому присоединен R1а.
К дополнительным вариантам осуществления соединений формулы Ia, которые могут быть указаны, относятся варианты, где:
(1) Е представляет собой СН;
(2) R1b представляет собой Н;
(3) -Х-R4а представляет собой
(а) фенил (последняя группа необязательно замещена одним или несколькими (например, двумя или, в частности, одним) заместителями, выбранными из галогена (например, хлора) и метокси),
(b) СН2-фенил (фенильная часть этой группы необязательно замещена одним или несколькими (например, двумя или, в частности, одним) заместителями, выбранными из галогена (например, хлора) и метокси, но в конкретном варианте осуществления не замещается) или
(с) NH-фенил (фенильная часть этой группы необязательно замещена одним или несколькими (например, двумя или, в частности, одним) заместителями, выбранными из галогена (например, хлора) и метокси, но в конкретном варианте осуществления не замещается);
(4) R2 представляет собой метил;
(5) R3 представляет собой один или два заместителя (например, один заместитель) на конденсированном бензольном кольце, включая по меньшей мере один заместитель в положении 6 хинолиновой или хиназолиновой кольцевой системы, где каждый заместитель независимо выбирают из галогена (например, хлора), ОR8а, N(H)S(O)2R8f, N(H)(R8h), -N(H)C(O)R8i или Het6 (например, каждый заместитель независимо выбирают из ОR8а, N(H)(R8h), -N(H)C(O)R8i или Het6);
(6) R8а представляет собой
(а) фенил, необязательно замещенный заместителями в количестве от одного до трех (например, одним заместителем, таким как один заместитель по 2- или, особенно, 4 положению), выбранными из галогена, CN, метила, метокси и S(O)2СН3 (например, выбранными из метокси и S(O)2СН3),
(b) С1-2 алкил, замещенный фенилом, последняя группа необязательно замещена заместителями в количестве от одного до трех (например, одним заместителем, таким как один заместитель по 2- или, особенно, 4 положению), выбранными из галогена, CN, метила, метокси и S(O)2СН3 (например, выбранными из метокси и S(O)2СН3) или
(с) С1-2 алкил, замещенный гетероциклической группой Het7;
(7) R8f представляет собой фенил, необязательно замещенный заместителями в количестве от одного до трех (например, одним заместителем, таким как один заместитель во 2- или, особенно, 4 положении), выбранными из галогена, CN, метила, метокси и S(O)2СН3;
(8) R8h представляет собой С1-2 алкил (например, метил), замещенный фенилом, последняя группа необязательно замещена заместителями в количестве от одного до трех (например, одним заместителем, таким как один заместитель во 2- или, особенно, 4 положении), выбранными из галогена, CN, метила, метокси и S(O)2СН3 (например, выбранными из CN и метокси);
(6) R8i представляет собой
(а) фенил, необязательно замещенный заместителями в количестве от одного до трех (например, одним заместителем, таким как один заместитель во 2- или, особенно, 4 положении), выбранными из галогена, CN, метила, метокси и S(O)2СН3 (например, выбранными из хлора, метила и метокси),
(b) С1-3 алкил (например, метил или этил), замещенный фенилом, последняя группа необязательно замещена заместителями в количестве от одного до трех (например, одним заместителем, таким как один заместитель во 2- или, особенно, 4 положении), выбранными из галогена, CN, метила, метокси и S(O)2СН3 (например, выбранными из хлора, метила и метокси),
(с) С1-2 алкил, замещенный гетероциклической группой Het7 или
(d) Het9;
(9) Het6 представляет собой пирролидин-1-ил, замещенный заместителями в количестве от одного до трех (например, одним заместителем, таким как единственный заместитель во 2-м положении), выбранными из галогена, метила, и =О (например, заместитель =О);
(10) Het7 и Het9 независимо представляют собой 5- или 6-членные ароматические гетероциклические группы, содержащие от одного до трех (например, один или два) гетероатомов, выбранных из кислорода и/или азота, эти гетероциклические группы могут быть замещены одним или несколькими (например, одним или двумя) заместителями, выбранными из галогена и метила (например, замещены двумя или, особенно, одной метильной группой).
К конкретным заместителям R1а, которые могут быть указаны в связи с соединениями формулы Ia, относятся фенил, 4-метоксифенил, 4-хлорфенил, бензил и фениламино.
К конкретным заместителям R3 (например, в виде единственного заместителя в положении 6 хинолиновой или хиназолиновой кольцевой системы), которые могут быть указаны в связи с соединениями формулы Ia, относятся:
хлор;
фенокси;
бензилокси; 4-метансульфонилбензилокси; 4-метоксибензилокси;
2-фенилэтокси;
5-метилизоксазол-3-илметокси;
бензиламино; (4-цианобензил)амино; (4-метоксибензил)амино;
фенилкарбониламино; (4-хлорфенил)карбониламино; (4-метоксифенил)карбониламино; (2-метилфенил)карбониламино;
фенилметилкарбониламино; (4-хлорфенил)метилкарбониламино; (4-метоксифенил)метилкарбониламино;
фуран-2-илкарбониламино;
3-метил-3Н-имидазол-4-илкарбониламино;
5-метил-изоксазол-3-илкарбониламино; 3,5-диметилизоксазол-4-илкарбониламино;
2-фенилэтилкарбониламино;
пиразин-2-илкарбониламино;
5-метил-1Н-пиразол-3-илкарбониламино; 1Н-пиразол-4-илкарбониламино;
пиридазин-4-илкарбониламино;
пиридин-2-илкарбониламино; пиридин-3-илкарбониламино;
2-(3-метил-изоксазол-5-ил) метилкарбониламино;
бензолсульфониламино; и
2-оксопирролидин-1-ил.
К вариантам осуществления изобретения, которые могут быть указаны, относятся варианты, в которых соединение формулы I представляет собой соединение примеров с 1 по 39 ниже, такое как:
2-метил-6-фенэтилокси-4-(3-фенилпирролидин-1-ил)хинолин;
4-(3-бензилпирролидин-1-ил)-2-метил-6-феноксихинолин;
4-[3-(4-метоксифенил)пирролидин-1-ил]-2-метил-6-феноксихинолина гидрохлорид;
[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид 5-метил-1Н-пиразол-3-карбоновой кислоты; или
N-[4-(3-бензилпирролидин-1-ил)-2-метилхинолин-6-ил]бензамид
или их фармацевтически приемлемое производное.
К дополнительным вариантам осуществления изобретения, которые могут быть указаны, относятся варианты, в которых соединение формулы I представляет собой соединение формулы Iа, где соединение находится в R-конфигурации по атому С, к которому присоединен R1а, и выбирают из:
(i) 4-((R)-3-бензилпирролидин-1-ил)-2-метил-6-феноксихинолина;
(ii) 4-[(R)-3-(4-метоксифенил)пирролидин-1-ил]-2-метил-6-феноксихинолина;
(iii) [2-метил-4-((R)-3-фенил-пирролидин-1-ил)-хинолин-6-ил]амида 5-метил-1Н-пиразол-3-карбоновой кислоты; и
(iv) N-[4-((R)-3-бензилпирролидин-1-ил)-2-метилхинолин-6-ил] бензамида,
или их фармацевтически приемлемого производного.
К характерным соединениям, которые могут быть указаны в этом отношении, относятся соединения (i) и (iv) выше и их фармацевтически приемлемые производные.
К другим дополнительным вариантам осуществления изобретения, которые могут быть указаны, относятся варианты, в которых соединение формулы I представляет собой соединение формулы Iа, где соединение находится в S-конфигурации по атому С, к которому присоединен R1а, и выбирают из:
(I) 4-((S)-3-бензилпирролидин-1-ил)-2-метил-6-феноксихинолина;
(II) 4-[(S)-3-(4-метоксифенил)пирролидин-1-ил]-2-метил-6-феноксихинолина;
(III) [2-метил-4-((S)-3-фенил-пирролидин-1-ил)-хинолин-6-ил]амида 5-метил-1Н-пиразол-3-карбоновой кислоты; и
(IV) N-[4-((S)-3-бензилпирролидин-1-ил)-2-метилхинолин-6-ил] бензамида,
или их фармацевтически приемлемого производного.
К характерным соединениям, которые могут быть указаны в этом отношении, относятся соединения (I) и (IV) выше и их фармацевтически приемлемые производные.
Лекарственное средство, указанное в первом аспекте изобретения, может быть использовано в способе медикаментозного лечения. Таким образом, по второму аспекту изобретения предлагается:
(i) способ уничтожения клинически латентных микроорганизмов у млекопитающего, инфицированного такими латентными микроорганизмами, который включает введение указанному млекопитающему микробицидно эффективного количества соединения формулы I, определенного в данном документе ранее; и
(ii) соединение формулы I, определенное в данном документе ранее, для применения в уничтожении клинически латентных микроорганизмов у млекопитающего, инфицированного такими латентными микроорганизмами.
Более того, соединение формулы I может быть использовано для уничтожения клинически латентных микроорганизмов. Таким образом, по третьему аспекту изобретения предлагается применение соединения формулы I, определенного в данном документе ранее, для уничтожения клинически латентных микроорганизмов. В одном из вариантов осуществления применение по этому аспекту изобретения представляет собой применение ex vivo.
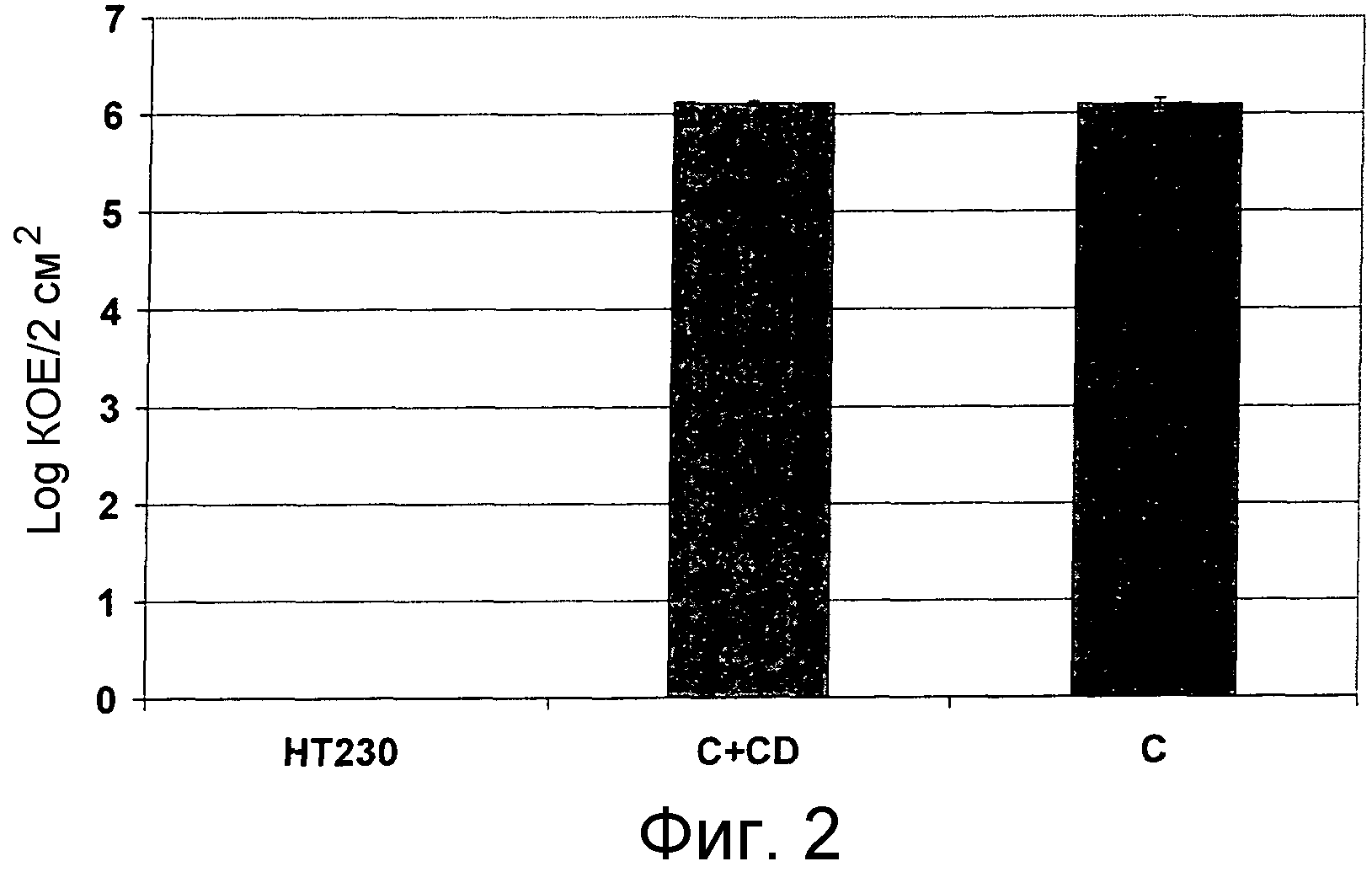
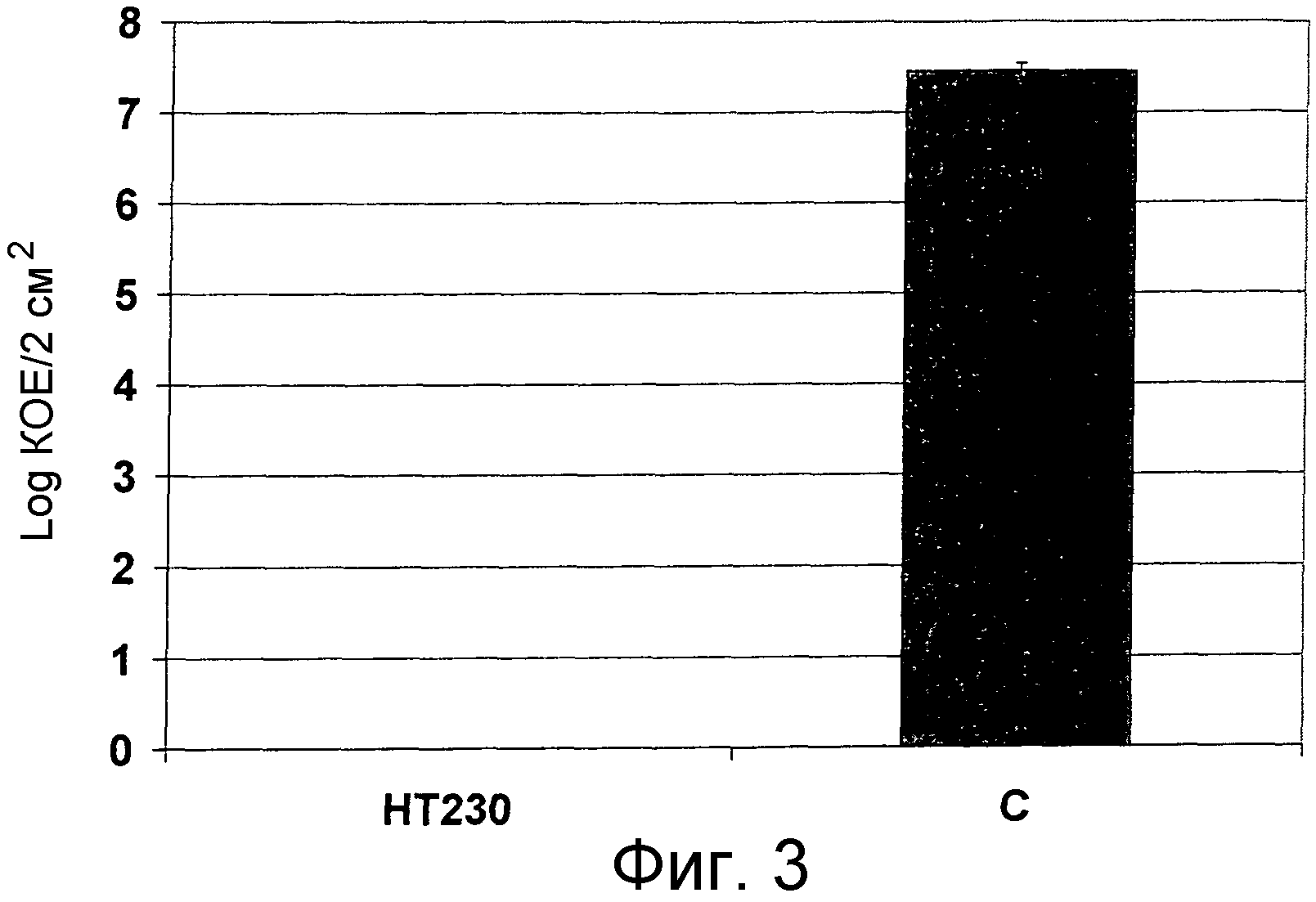
Помимо уничтожения клинически латентных микроорганизмов авторы изобретения обнаружили, что соединения формулы I способны уничтожать микроорганизмы большого числа различных фенотипов, включая микроорганизмы в фазе роста.
В этом отношении по четвертому, пятому, шестому и седьмому аспектам изобретения предлагаются, соответственно:
(а) применение соединения формулы I, определенного в данном документе ранее, для получения лекарственного средства для лечения или профилактики микробной инфекции;
(b) способ лечения или профилактики микробной инфекции у млекопитающего, включающий введение указанному млекопитающему антимикробно эффективного количества соединения формулы I, определенного в данном документе ранее;
(c) применение (например, применение ex vivo) соединения формулы I для уничтожения микроорганизмов;
(d) соединение формулы I, определенное в данном документе ранее, для применения в лечении или профилактике микробной инфекции у млекопитающего.
Во избежание неопределенности, под термином «лечение», используемым в настоящем документе, понимают терапевтическое и/или профилактическое лечение.
Как указано выше, применение по третьему и шестому аспектам изобретения может представлять собой применение ex vivo, такое как применение соединения формулы I, определенного в данном документе ранее:
(а) в качестве стерилизующего агента; или
(b) в качестве консерванта.
В свою очередь, соединения формулы I могут использоваться в способах стерилизации или консервации, таких как:
(i) способ стерилизации объекта, включающий применение к указанному объекту соединения формулы I, определенного в данном документе ранее; или
(ii) способ консервации неорганического или предпочтительно органического материала, включающий контактактирование, объединение или смешивание указанного материала с соединением формулы I, определенным в данном документе ранее.
В отношении способа, описанного в пункте (i) выше, объект предпочтительно отличается от организма человека или животного. Кроме того, к материалам, которые могут быть законсервированы по способу, описанному в пункте (ii) выше, относятся полимеры, лубриканты, краски, волокна, изделия из кожи, бумага, продукты питания, вода и водные смеси и растворы.
При использовании для уничтожения клинически латентных микроорганизмов или для лечения микробной инфекции соединения формулы I могут быть использованы либо самостоятельно (т.е. в виде отдельных микробицидных или антимикробных агентов) или в сочетании с каким-либо одним или несколькими общепринятыми антимикробными агентами, описанными выше.
Кроме того, при использовании в качестве стерилизующего агента соединения формулы I могут быть использованы либо самостоятельно, либо в сочетании с общепринятым стерилизующим агентом. Под термином «общепринятый стерилизующий агент», используемым в данном документе, понимают спирты (например, промышленные метилированные спирты или этанол), хлорид натрия, тимол, хлоргексидин, катионные поверхностно-активные вещества (например, цетримид), йод (необязательно в сочетании с повидоном), фенолы (например, триклозан), оксиданты (например, перекись водорода, перманганат калия или гипохлорит натрия) и какой-либо один или несколько общепринятых антимикробных агентов, описанных выше.
Таким образом, по восьмому и девятому аспектам изобретения предлагается, соответственно:
(а) комбинированный продукт, содержащий
(А) соединение формулы I, определенное в данном документе выше, и
(В) общепринятый антимикробный агент, определенный в данном документе выше,
где каждый из компонентов (А) и (В) находится в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем; и
(b) композиция, содержащая соединение формулы I, определенное в данном документе выше, и общепринятый стерилизующий агент, определенный в данном документе выше, или их соль и/или сольват.
Комбинированный продукт по восьмому аспекту изобретения обеспечивает введение компонента (А) в сочетании с компонентом (В) и может, таким образом, находиться либо в виде отдельных композиций, в которых по меньшей мере одна из этих композиций содержит компонент (А) и по меньшей мере одна содержит компонент (В), или может быть представлен (т.е. быть составленным) в виде комбинированного препарата (т.е. представлен в виде одной композиции, включающей компонент (А) и компонент (В)).
Таким образом, дополнительно предлагаются:
(1) фармацевтическая композиция, включающая соединение формулы I, определенное в данном документе выше, и общепринятый антимикробный агент, определенный в данном документе выше, или его фармацевтически приемлемое производное в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем (эта композиция далее в настоящем документе обозначается как «комбинированный препарат»); и
(2) набор, части которого содержат компоненты:
(I) фармацевтическую композицию, включающую соединение формулы I, определенное в данном документе выше, в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем; и
(II) фармацевтическую композицию, включающую общепринятый антимикробный агент, определенный в данном документе выше, или его фармацевтически приемлемое производное в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем,
каждый из компонентов (I) и (II) предлагаются в форме, которая подходит для введения в сочетании с другой.
Компонент (I) набора представляет собой, таким образом, компонент (А) в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем. Аналогично компонент (II) представляет собой компонент (В) в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем.
По десятому аспекту изобретения предлагается способ создания набора, определенного выше, включающий приведение компонента (I), определенного выше, в ассоциацию с компонентом (II), определенным выше, таким образом, помещая два компонента, подходящих для введения, вместе друг с другом.
Под приведением двух компонентов «в ассоциацию» друг с другом авторы понимают, что компоненты (I) и (II) набора могут быть:
(i) предложены в виде отдельных композиций (т.е. независимо друг от друга), которые впоследствии объединяют для применения в сочетании друг с другом в комбинированной терапии; или
(ii) упакованы и представлены вместе в виде отдельных компонентов «комбинированной упаковки» для применения в сочетании друг с другом в комбинированной терапии.
Таким образом, дополнительно предлагается набор, части которого содержат:
(1) один из компонентов (I) и (II), определенных в данном документе; вместе с
(2) руководством по применению этого компонента вместе с другим компонентом из двух возможных.
Для обеспечения повторной дозировки набор, описанный в данном документе, может содержать более чем одну композицию, включающую подходящее количество/дозу компонента (А), и/или более чем одну композицию, включающую подходящее количество/дозу компонента (В). Если присутствует более одной композиции (содержащей то или иное активное соединение), то такие композиции могут быть одинаковыми или могут отличаться в пересчете на дозу компонента (А) или компонента (В), химическим составом и/или физической формой.
Комбинированный продукт по восьмому аспекту изобретения может быть использован для уничтожения клинически латентных микроорганизмов и/или лечения микробной инфекции. Таким образом, в дополнительных аспектах изобретения предлагаются:
(i) применение комбинированного продукта по восьмому аспекту изобретения для получения лекарственного средства для уничтожения клинически латентных микроорганизмов;
(ii) способ уничтожения клинически латентных микроорганизмов у млекопитающего, инфицированного такими латентными микроорганизмами, включающий введение указанному млекопитающему микробицидно эффективного количества комбинированного продукта по восьмому аспекту изобретения;
(iii) комбинированный продукт по восьмому аспекту изобретения для применения в уничтожении клинически латентных микроорганизмов у млекопитающего, инфицированного такими латентными микроорганизмами;
(iv) применение комбинированного продукта по восьмому аспекту изобретения для получения лекарственного средства для лечения или профилактики микробной инфекции;
(v) способ лечения или профилактики микробной инфекции у млекопитающего, включающий введение указанному млекопитающему антимикробно эффективного количества комбинированного продукта по восьмому аспекту изобретения; и
(vi) комбинированный продукт по восьмому аспекту изобретения для применения в лечении или профилактике микробной инфекции у млекопитающего.
Способ (v) выше создает преимущество, заключающееся в том, что количество общепринятого антимикробного агента, необходимого для лечения микробной инфекции, снижается по сравнению с количеством, требуемым в отсутствие соединения формулы I.
При использовании в данном документе под терминами «бактерии» (и их производными, такими как «бактериальная инфекция») понимают организмы (или инфекции, обусловленные организмами) следующих классов и конкретных видов:
Грамположительные кокки, такие как
стафилококки (например, Staph. aureus, Staph. epidermidis, Staph. saprophytics, Staph. auricularis, Staph. capitis capitis, Staph. c. ureolyticus, Staph. caprae, Staph. cohnii cohnii, Staph. c. urealyticus, Staph. equorum, Staph. gallinarυm, Staph. haemolyticus, Staph. hominis hominis, Staph. h. novobiosepticius, Staph. hyicus, Staph. intermedius, Staph. lugdunensis, Staph. pasteuri, Staph. saccharolyticus, Staph. schleiferi schleiferi, Staph. s. coagulans, Staph. sciuri, Staph. simulans, Staph. wameri and Staph. xylosus) и
стрептококки (например,
бета-гемолитические пиогенные стрептококки (такие как beta-haemolytic, pyogenic streptococci (такие как Strept. agalactiae, Strept. canis, Strept. dysgalactiae dysgalactiae, Strept. dysgalactiae equisimilis, Strept. equi equi, Strept. equi zooepidemicus, Strept. iniae, Strept. porcinus and Strept. pyogenes),
микроаэрофильные пиогенные стрептококки (Streptococcus “milleri”, такие как Strept. anginosus, Strept. constellatus constellatus, Strept. constellatus pharyngidis and Strept. intermedius),
стрептококки ротовой полости групп “mitis” (альфа-гемолитические - Streptococcus “viridans”, такие как Strept. mitis, Strept. oralis, Strept. sanguinis, Strept. cristatus, Strept. gordonii and Strept. parasanguinis), “salivarius” (негемолитические, такие как Strept. salivarius и Strept. vestibularis) и “mutans” (стрептококки поверхности зубов, такие как Strept. criceti, Strept. mutans, Strept. ratti и Strept. sobrinus),
Strept. acidominimus, Strept. bovis, Strept. faecalis, Strept. equinus, Strept. pneumoniae and Strept. suis,
или стрептококки, альтернативно классифицируемые как стрептококки групп A, B, C, D, E, G, L, P, U или V);
Грамотрицательные кокки, такие как Neisseria gonorrhoeae, Neisseria meningitidis, Neisseria cinerea, Neisseria elongate, Neisseria flavescens, Neisseria lactamica, Neisseria mucosa, Neisseria sicca, Neisseria subflava и Neisseria weaveri;
Bacillaceae, такие как Bacillus anthracis, Bacillus subtilis, Bacillus thuringiensis, Bacillus stearothermophilus and Bacillus cereus;
Enterobacteriaceae, такие как
Escherichia coli,
Enterobacter (например, Enterobacter aerogenes, Enterobacter agglomerans и Enterobacter cloacae)
Citrobacter (такие как Citrob. freundii и Citrob. divernis),
Hafnia (например, Hafnia alvei),
Erwinia (например, Erwinia persicinus),
Morganella morganii,
Salmonella (Salmonella enterica и Salmonella typhi),
Shigella (например, Shigella dysenteriae, Shigella flexneri, Shigella boydii и Shigella sonnei),
Klebsiella (например, Klebs. pneumoniae, Klebs. oxytoca, Klebs. ornitholytica, Klebs. planticola, Klebs. ozaenae, Klebs. ternigena, Klebs. granulomatis (Calymmatobacterium granulomatis) и Klebs. minoscleromatis),
Proteus (например, Pr. mirabilis, Pr. rettgeri и Pr. vulgaris),
Providencia (например, Providencia alcalifaciens, Providencia rettgeri и Providencia stuartii),
Serratia (например, Serratia marcescens and Serratia liquifaciens), и
Yersinia (например, Yersinia enterocolitica, Yersinia pestis и Yersinia pseudotuberculosis) ;
Enterococci (например, Enterococcus avium, Enterococcus casseliflavus, Enterococcus cecorum, Enterococcus dispar, Enterococcus durans, Enterococcus faecalis, Enterococcus faecium, Enterococcus flavescens, Enterococcus gallinarum, Enterococcus hirae, Enterococcus malodoratus, Enterococcus mundtii, Enterococcus pseudoavium, Enterococcus raffinosus и Enterococcus solitarius);
Helicobacter (например, Helicobacter pylori, Helicobacter cinaedi и Helicobacter fennelliae);
Acinetobacter (например, A. baumanii, A. calcoaceticus, A. haemolyticus, A. johnsonii, A. junii, A. Iwoffi и A. radioresistens);
Pseudomonas (например, Ps. aeruginosa, Ps. maltophilia (Stenotrophomonas maltophilia), Ps. alcaligenes, Ps. chlororaphis, Ps. fluorescens, Ps. luteola. Ps. mendocina, Ps. monteilii, Ps. oryzihabitans, Ps. pertocinogena, Ps. pseudalcaligenes, Ps. putida и Ps. stutzeri);
Bacteriodes fragilis;
Peptococcus (например, Peptococcus niger);
Peptostreptococcus;
Clostridium (например, C. perfringens, C. difficile, C. botulinum, C. tetani, C. absonum, C. argentinense, C. baratii, C. bifermentans, C. beijerinckii, C. butyricum, C. cadaveris, C. carnis, C. celatum, C. clostridioforme, C. cochlearium, C. cocleatum, C. fallax, C. ghonii, C. glycolicum, C. haemolyticum, C. hastiforme, C. histolyticum, C. indolis, C. innocuum, C. irregulare, C. leptum, C. limosum, C. malenominatum, C. novyi, C. oroticum, C. paraputrificum, C. piliforme, C. putrefasciens, C. ramosum, C. septicum, C. sordelii, C. sphenoides, C. sporogenes, C. subterminale, C. symbiosum и C. tertium);
Mycoplasma (например, M. pneumoniae, M. hominis, M. genitalium и M. urealyticum);
Mycobacteria (например, Mycobacterium tuberculosis, Mycobacterium avium, Mycobacterium fortuitum, Mycobacterium marinum, Mycobacterium kansasii, Mycobacterium chelonae, Mycobacterium abscessus, Mycobacterium leprae, Mycobacterium smegmitis, Mycobacterium africanum, Mycobacterium alvei, Mycobacterium asiaticum, Mycobacterium aurum, Mycobacterium bohemicum, Mycobacterium bovis, Mycobacterium branderi, Mycobacterium brumae, Mycobacterium celatum, Mycobacterium chubense, Mycobacterium confluentis, Mycobacterium conspicuum, Mycobacterium cookii, Mycobacterium flavescens, Mycobacterium gadium, Mycobacterium gastri, Mycobacterium genavense, Mycobacterium gordonae, Mycobacterium goodii, Mycobacterium haemophilum, Mycobacterium hassicum, Mycobacterium intracellular, Mycobacterium interjectum, Mycobacterium heidelberense, Mycobacterium lentiflavum, Mycobacterium malmoense, Mycobacterium microgenicum, Mycobacterium microti, Mycobacterium mucogenicum, Mycobacterium neoaurum, Mycobacterium nonchromogenicum, Mycobacterium peregrinum, Mycobacterium phlei, Mycobacterium scrofulaceum, Mycobacterium shimoidei, Mycobacterium simiae, Mycobacterium szulgai, Mycobacterium terrae, Mycobacterium thermoresistabile, Mycobacterium triplex, Mycobacterium triviale, Mycobacterium tusciae, Mycobacterium ulcerans, Mycobacterium vaccae, Mycobacterium wolinskyi и Mycobacterium xenopi);
Haemophilus (например, Haemophilus influenzae, Haemophilus ducreyi, Haemophilus aegyptius, Haemophilus parainfluenzae, Haemophilus haemolyticus и Haemophilus parahaemolyticus);
Actinobacillus (например, Actinobacillus actinomycetemcomitans, Actinobacillus equuli, Actinobacillus hominis, Actinobacillus lignieresii, Actinobacillus suis и Actinobacillus ureae);
Actinomyces (например, Actinomyces israelii);
Propionibacteria (например, Propionibacterium acnes);
Brucella (например, Brucella abortus, Brucella canis, Brucella melintensis и Brucella suis);
Campylobacter (например, Campylobacter jejuni, Campylobacter coli, Campylobacter lari и Campylobacter fetus);
Listeria monocytogenes;
Vibrio (например, Vibrio cholerae and Vibrio parahaemolyticus, Vibrio alginolyticus, Vibrio carchariae, Vibrio fluvialis, Vibrio furnissii, Vibrio hollisae, Vibrio metschnikovii, Vibrio mimicus и Vibrio vulnificus);
Erysipelothrix rhusopathiae;
Corynebacteriaceae (например, Corynebacterium diphtheriae, Corynebacterium jeikeium и Corynebacterium urealyticum);
Spirochaetaceae, такие как Borrelia (например, Borrelia recurrentis, Borrelia burgdorferi, Borrelia afzelii, Borrelia andersonii, Borrelia bissettii, Borrelia garinii, Borrelia japonica, Borrelia lusitaniae, Borrelia tanukii, Borrelia turdi, Borrelia valaisiana, Borrelia caucasica, Borrelia crocidurae, Borrelia duttoni, Borrelia graingeri, Borrelia hermsii, Borrelia hispanica, Borrelia latyschewii, Borrelia mazzottii, Borrelia parkeri, Borrelia persica, Borrelia turicatae и Borrelia venezuelensis) и Treponema (Treponema pallidum ssp. pallidum, Treponema pallidum ssp. endemicum, Treponema pallidum ssp. pertenue и Treponema carateum);
Pasteurella (например, Pasteurella aerogenes, Pasteurella bettyae, Pasteurella canis, Pasteurella dagmatis, Pasteurella gallinarum, Pasteurella haemolytica, Pasteurella multocida multocida, Pasteurella multocida gallicida, Pasteurella multocida septica, Pasteurella pneumotropica и Pasteurella stomatis);
Bordetella (например, Bordetella bronchiseptica, Bordetella hinzii, Bordetella holmseii, Bordetella parapertussis, Bordetella pertussis и Bordetella trematum);
Nocardiaceae, такие как Nocardia (например, Nocardia asteroides и Nocardia brasiliensis);
Rickettsia (например, Ricksettsii или Coxiella burnetii);
Legionella (например, Legionella anisa, Legionella birminghamensis, Legionalla bozemanii, Legionalla cincinnatiensis, Legionalla dumoffii, Legionalla feeleii, Legionalla gormanii, Legionalla hackeliae, Legionalla israelensis, Legionalla jordanis, Legionalla lansingensis, Legionalla longbeachae, Legionalla maceachernii, Legionalla micdadei, Legionalla oakridgensis, Legionalla pneumophila, Legionalla sainthelensi, Legionalla tucsonensis и Legionalla wadsworthii);
Moraxella catarrhalis;
Stenotrophomonas maltophilia;
Burkholderia cepacia;
Francisella tularensis;
Gardnerella (например, Gardneralla vaginalis и Gardneralla mobiluncus);
Streptobacillus moniliformis;
Flavobacteriaceae, такие как Capnocytophaga (например, Capnocytophaga canimorsυs, Capnocytophaga cynodegmi, Capnocytophaga gingivalis, Capnocytophaga granulosa, Capnocytophaga haemolytica, Capnocytophaga ochracea и Capnocytophaga sputigena);
Bartonella (Bartonella bacilliformis, Bartonella clarridgeiae, Bartonella elizabethae, Bartonella henselae, Bartonella quintana и Bartonella vinsonii arupensis);
Leptospira (например, Leptospira biflexa, Leptospira borgpetersenii, Leptospira inadai, Leptospira interrogans, Leptospira kirschneri, Leptospira noguchii, Leptospira santarosai и Leptospira weilii);
Spirillium (например, Spirillum minus);
Bacteroides (например, Bacteroides caccae, Bacteroides capillosus, Bacteroides coagulans, Bacteroides distasonis, Bacteroides eggerthii, Bacteroides forsythus, Bacteroides fragilis, Bacteroides merdae, Bacteroides ovatus, Bacteroides putredinis, Bacteroides pyogenes, Bacteroides splanchinicus, Bacteroides stercoris, Bacteroides tectus, Bacteroides thetaiotaomicron, Bacteroides uniformis, Bacteroides ureolyticus и Bacteroides vulgatus);
Prevotella (например, Prevotella bivia, Prevotella buccae, Prevotella corporis, Prevotella dentalis (Mitsuokella dentalis), Prevotella denticola, Prevotella disiens, Prevotella enoeca, Prevotella heparinolytica, Prevotella intermedia, Prevotella loeschii, Prevotella melaninogenica, Prevotella nigrescens, Prevotella oralis, Prevotella oris, Prevotella oulora, Prevotella tannerae, Prevotella venoralis и Prevotella zoogleoformans);
Porphyromonas (например, Porphyromonas asaccharolytica, Porphyromonas cangingivalis, Porphyromonas canons, Porphyromonas cansulci, Porphyromonas catoniae, Porphyromonas circumdentaria, Porphyromonas crevioricanis, Porphyromonas endodontalis, Porphyromonas gingivalis, Porphyromonas gingivicanis, Porphyromonas levii и Porphyromonas macacae);
Fusobacterium (например, F. gonadiaformans, F. mortiferum, F. naviforme, F. necrogenes, F. necrophorum necrophorum, F. necrophorum fundiliforme, F. nucleatum nucleatum, F. nucleatum fusiforme, F. nucleatum polymorphum, F. nucleatum vincentii, F. periodonticum, F. russii, F. ulcerans и F. varium);
Chlamydia (например, Chlamydia trachomatis);
Chlamydophila (например, Chlamydophila abortus (Chlamydia psittaci), Chlamydophila pneumoniae {Chlamydia pneumoniae) и Chlamydophila psittaci (Chlamydia psittaci));
Leuconostoc (например, Leuconostoc citreum, Leuconostoc cremoris, Leuconostoc dextranicum, Leuconostoc lactis, Leuconostoc mesenteroides и Leuconostoc pseudomesenteroides) ;
Gemella (например, Gemella bergeri, Gemella haemolysans, Gemella morbillorum и Gemella sanguinis); и
Ureaplasma (например, Ureaplasma parvum и Ureaplasma urealyticum).
В одном из вариантов осуществления изобретения под термином «бактерии» понимают любой из указанных выше классов или конкретных видов организмов, исключая Shigella (например, Shigella flexneri) или Salmonella (например, Salmonella typhi).
При использовании в данном документе под терминами «грибы» (и их производными, такими как «грибковая инфекция») понимают организмы (или инфекции, вызванные организмами) следующих классов и конкретных видов:
Absidia (например, Absidia corymbifera);
Ajellomyces (например, Ajellomyces capsulatus и Ajellomyces dermatitidis);
Arthroderma (например, Arthroderma benhamiae, Arthroderma fulvum, Arthroderma gypseum, Arthroderma incurvatum, Arthroderma otae и Arthroderma vanbreuseghemii);
Aspergillus (например, Aspergillus flavus, Aspergillus fumigatus, Aspergillus niger и Aspergillus terreus);
Blastomyces (например, Blastomyces dermatitidis);
Candida (например, Candida albicans, Candida glabrata, Candida guillierinondii, Candida krusei, Candida parapsilosis, Candida tropical is, Candida pelliculosa и Candida lusitaniae);
Cladophialophora (например, Cladophialophora carrionii);
Coccidioides (например, Coccidioides immitis);
Cryptococcus (например, Cryptococcus neoformans);
Cunninghamella (например, Cunninghamella sp.)
Epidermophyton (например, Epidermophyton floccosum);
Exophiala (например, Exophiala dermatitidis);
Filobasidiella (например, Filobasidiella neoformans);
Fonsecaea (например, Fonsecaea pedrosoi);
Fusarium (например, Fusarium solani и Fusarium oxysporum);
Geotrichum (например, Geotrichum candidum);
Histoplasma (например, Histoplasma capsulatum);
Hortaea (например, Hortaea wemeckii);
Issatchenkia (например, Issatchenkia orientalis);
Madurella (например, Madurella grisae);
Malassezia (иначе известный как Pityrosporum) (например, Malassezia furfur, Malassezia globosa, Malassezia obtusa, Malassezia pachydermatis, Malassezia resthcta, Malassezia slooffiae, Malassezia sympodialis, Malassezia dermatis, Malassezia nana и Malassezia yamatoensis);
Microsporum (например, Microsporum canis, Microsporum fulvum, Microsporum gypseum, Microsporum audouinii и Microsporum ferrugineum);
Mucor (например, Mucor circinelloides);
Nectria (например, Nectha haematococca);
Paecilomyces (например, Paecilomyces variotii);
Paracoccidioides (например, Paracoccidioides brasiliensis);
Penicillium (например, Penicillium mameffei);
Pichia (например, Pichia anomala и Pichia guilliermondii);
Pneumocystis (например, Pneumocystis jiroveci (Pneumocystis carinii));
Pseudallescheria (например, Pseudallescheha boydii);
Rhizopus (например, Rhizopus oryzae и Rhizopus oligosporus);
Rhodotorula (например, Rhodotorula rubra);
Scedosporium (например, Scedosporium apiospermum);
Schizophyllum (например, Schizophyllum commune);
Sporothrix (например, Sporothrix schenckii);
Trichophyton (например, Trichophyton mentagrophytes, Trichophyton rubrum, Trichophyton verrucosum, Trichophyton violaceum, Trichophyton schoenleinii, Trichophyton tonsurans, Trichophyton concentricum, Trichophyton gourvilii, Trichophyton interdigitale, Trichophyton megninii, Trichophyton soudanense); и
Trichosporon (например, Trichosporon asahii, Trichosporon cutaneum, Trichosporon inkin и Trichosporon mucoides).
Таким образом, соединения формулы I или комбинированные продукты, содержащие соединения формулы I, могут использоваться для уничтожения любых указанных выше бактериальных или грибковых организмов (клинически латентных или иных).
К конкретным бактериям, которые могут быть указаны в этом отношении, относятся:
(i) стафилококки, такие как Staph. aureus (либо метициллин-чувствительные (т.е. MSSA), либо метициллин-резистентные (т.е. MRSA)), Staph. epidermidis, Staphylococcus haemolyticus, Staphylococcus hominis и Staphylococcus lugdunensis);
(ii) стрептококки, такие как Strept. agalactiae, Strept. pyogenes; Strept. pneumoniae и стрептококки группы С);
(iii) Bacillaceae, такие как Bacillus anthracis или, особенно, Bacillus cereus;
(iv) энтеробактерии, такие как Escherichia coli, Klebsiella (например, Klebs. pneumoniae и Klebs. oxytoca) и Proteus (например, Pr. mirabilis, Pr. rettgeri и Pr. vulgaris);
(v) Haemophilus influenzae;
(vi) энтерококки, такие как Enterococcus faecalis, Enterococcus faecium, Enterococcus gallinarum и Enterococcus casseliflavus;
(vii) микобактерии, такие как Mycobacterium tuberculosis;
(viii) пропионобактерии, такие как Propionibacterium acnes;
(ix) коринебактерии, такие как Corynebacterium jeikeium;
(x) Stenotrophomonas maltophilia; и
(xi) микоплазмы, такие как M. pneumoniae.
К некоторым бактериям, которые могут быть указаны, относятся бактерии в пунктах (i), (ii) и (viii) выше.
К конкретным грибам, которые также могут быть указаны в этом отношении, относятся:
(I) Aspergillus (например, Aspergillus fumigatus; Aspergillus niger, Aspergillus flavus или Aspergillus terreus);
(II) Candida (например, Candida albicans, Candida tropicalis, Candida parapsilosis, Candida glabrata или Candida lusitaniae);
(III) Cryptococcus neoformans;
(IV) Histoplasma capsulatum;
(V) Pneumocystis jiroveci;
(VI) Issatchenkia orientalis;
(VII) Rhizopus oligosporus;
(VIII) Fusarium oxysporum;
(IX) Microsporum (например, Microsporum audouinii, Microsporum ferrugineum или Microsporum canis);
(X) Epidermophyton floccosum;
(XI) Malassezia (например, Malassezia furfur); b
(XII) Trichophyton (например, Trichophyton mentagrophytes, Trichophyton rubrum, Trichophyton verrucosum, Trichophyton violaceum, Trichophyton schoenleinii, Trichophyton tonsurans, Trichophyton concentricum, Trichophyton gourvilii, Trichophyton interdigitale, Trichophyton megninii, Trichophyton soudanense (такие как Trichophyton violaceum, Trichophyton mentagrophytes или, особенно, Trichophyton rubrum)).
К некоторым грибам, которые могут быть указаны, относятся грибы в пунктах (I), (II), (X), (XI) и (XII) выше.
К конкретным бактериальным или грибковым инфекциям, которые могут быть указаны в связи с
(i) применением по первому или четвертому аспекту изобретения,
(ii) способом по второму или шестому аспекту изобретения,
(iii) соединением для применения по второму или седьмому аспекту изобретнения, и
(iv) описанными выше применениями, способами или комбинированными продуктами для применения, включая комбинированный продукт по восьмому аспекту изобретения (т.е. применения (i) или (iv) выше, способ (ii) или (v) выше или комбинированный продукт для применения (iii) или (vi) выше),
относятся инфекционные заболевания, вызванные
Staph. aureus (либо метициллин-чувствительными (т.е. MSSA), либо метициллин-резистентными (т.е. MRSA)) и Staph. epidermidis,
стрептококками, такими как Strept. agalactiae и Strept. pyogenes,
Bacillaceae, такими как Bacillus anthracis или, особенно, Bacillus cereus,
энтеробактериями, такими как Escherichia coli, Klebsiella (например, Klebs. pneumoniae и Klebs. oxytoca) и Proteus (например, Pr. mirabilis, Pr. rettgeri и Pr. vulgaris),
Haemophilus influenzae,
энтерококками, такими как Enterococcus faecalis и Enterococcus faecium,
микобактериями, такими как Mycobacterium tuberculosis,
пропионобактериями, такими как Propionibacterium acnes или
грибами, такими как Aspergillus fumigatus, Candida albicans, Cryptococcus neoformans, Histoplasma capsulatum, Pneumocystis jiroveci, Epidermophyton floccosum, Malassezia (например, Malassezia furfur) или, особенно, Trichophyton (например, Trichophyton violaceum, Trichophyton mentagrophytes или, особенно, Trichophyton rubrum).
В этой связи, к конкретным состояниям, при которых соединения формулы I или комбинированные продукты, содержащие соединения формулы I, могут использоваться для лечения, относятся туберкулез (например, туберкулез легких, нелегочный туберкулез (такой как туберкулез лимфатических узлов, мочеполовой туберкулез, туберкулез костей и суставов, туберкулезный менингит) и милиарный туберкулез), сибирская язва, абсцессы, вульгарные угри, розовые угри, розацеа (включая эритематотелеангиэктатическую розацеа, папулопустулярную розацеа, фиматозную розацеа и окулярную розацеа), актиномикоз, бациллярная дизентерия, бактериальный конъюнктивит, бактериальный кератит, ботулизм, язва Бурули, инфекционные заболевания костей и суставов, бронхит (острый или хронический), бруцеллез, ожоговые раны, лихорадка от кошачьих царапин, целлюлит, фолликулит (включая джакузи фолликулит), шанкроид, холангит, холецистит, кожная дифтерия, кистозный фиброз, цистит, диффузный панбронхиолит, дифтерия, зубной кариес, заболевания верхних дыхательных путей, емпиема, эндокардит, эндометрит, кишечная лихорадка, энтерит, эпидидимит, эпиглоттит, рожистое воспаление, эризипелоид, эритразма, эктима, прободающая эктима, глазные инфекции, фурункулы, гарднереллезный вагинит, инфекционные заболевания желудочно-кишечного тракта (гастроэнтерит), генитальные инфекции, гингивит, гонорея, паховая гранулема, хейверхиллская лихорадка, атопическая экзема со стафилококковым носительством, инфекционная экзема, инфицированные ожоговые раны, инфицированные царапины, инфицированные раны кожи, инфекции после операционных вмешательств на зубах, инфекционные заболевания ротовой полости, инфекции, ассоциированные с протезами, внутрибрюшные абсцессы, болезнь легионеров, лепра, лептоспироз, листериоз, абсцессы печени, болезнь Лайма, венерическая лимфогранулема, мастит, мастоидит, менингит и инфекционные заболевания нервной системы, мицетома, нокардиоз (например, мадурская стопа), неспецифический уретрит, офтальмия (например, офтальмия новорожденных), остеомиелит, отит (например, наружный отит и средний отит), орхит, панкреатит, паронихия, пельвиоперитонит, перитонит, перитонит с аппендицитом, фарингит, флегмоны, пинта, чума, плевральный выпот, пневмония, инфекции послеоперационной раны, послеоперационная газовая гангрена, простатит, псевдомембранозный колит, орнитоз, эмфизема легких, пиелонефрит, пиодермия (например, импетиго), фурункулез, карбункулез, стафилококковый токсический эпидермальный некролиз, хирургическая скарлатина, перианальное стрептококковое заболевание, синдром стрептококкового токсического шока, мелкоточечный кератолиз, подмышечный трихомикоз, инфекции наружного слухового прохода, синдром зеленых ногтей, спирохеты, некротизирующий фасцит, микобактериальные инфекции кожи (такие как волчанка обыкновенная, скрофулодерма, бородавчатый туберкулез, туберкулиды, узловатая эритема, индуративная эритема, кожные проявления туберкулоидной лепры или лепроматозной лепры, лепрозная узловатая эритема, кожные инфекционные заболевания, вызванные M. kansasii, M. malmoense, M. szulgai, M. simiae, M. gordonae, M. haemophilum, M. avium, M. intracellulare, M. chelonae (включая M. abscessus) или M. fortuitum, гранулема пловцов (или аквариумная), лимфаденит и язва Бурули (язва Бэрнсдейла, язва Сирлеса, язва Какерифу или язва Торо)), лихорадка Ку, болезнь от укуса крыс, ретикулез, болезнь Риттера, сальмонеллез, сальпингит, септический артрит, септические инфекции, септицемия, синусит, кожные инфекции (например, гранулема кожи), сифилис, системные инфекции, тонзиллит, синдром токсического шока, трахома, туляремия, тифоид, сыпной тиф (например, эпидемический сыпной тиф, крысиный сыпной тиф, японская речная лихорадка и эпидемический цереброспинальный менингит), уретрит, раневые инфекции, тропическая фрамбезия, аспергиллез, кандидоз (например, орофарингеальный кандидоз, вагинальный кандидоз или баланит), криптококкоз, фавус, гистоплазмоз, интертригинозный дерматит, мукормикоз, дерматомикоз (например, трихофития гладкой кожи, стригущий лишай, паховый дерматомикоз, дерматофития стоп и дерматофития ногтей), онихомикоз, разноцветный лишай, трихофития и споротрихоз.
К дополнительным состояниям, которые могут быть указаны в этой связи, относятся инфекционные заболевания, вызванные MSSA, MRSA, Staph. epidermidis, Strept. agalactiae, Strept. pyogenes, Escherichia coli, Klebs. pneumoniae, Klebs. oxytoca, Pr. mirabilis, Pr. rettgeri, Pr. vulgaris, Haemophilus influenzae, Enterococcus faecalis или Enterococcus faecium.
К конкретным соединениям формулы I, которые могут быть указаны в связи с вышеописанными аспектами изобретения, относятся соединения примеров с 1 по 43 (например, с 1 по 39) ниже.
Применение некоторых соединений формулы I в медицине, включая соединения формулы I (и Iа), определенные в данном документе ранее, является новым по сведениям изобретателей.
Во избежание неопределенности, в данном документе под соединениями формулы I понимают все варианты осуществления, описанные выше в связи с соединениями формул I и Iа.
В этой связи в дополнительном аспекте изобретения предлагается соединение формулы Ib для применения в медицине, где соединения формулы Ib имеют такое же определение, как и соединения формулы I, определенные в данном документе ранее, за исключением того, что:
R4а представляет собой
(а) С1-12 алкил, С3-12 циклоалкил, С3-12 циклоалкенил (эти последние три группы замещаются арилом или группой Het1 и необязательно дополнительно замещаются одним или несколькими заместителями, выбранными из галогена, азота, CN, С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С3-8 циклоалкила (последние три группы необязательно замещены одним или несколькими заместителями, выбранными из ОН, =О, галогена, С1-4 алкила и С1-4 алкокси), ОR5а, S(O)nR5b, S(O)2N(R5c)(R5d), N(R5e)S(O)2R5f, N(R5g)(R5h), B1-C(O)-B2-R5i, арила и Het1, и эти С3-12 циклоалкильная или С4-12 циклоалкенильная группы дополнительно могут быть замещены =О),
(с) арил или
(d) Het2,
и при условии, что:
(а) если Е представляет собой СН, то R3 отличается от одного или нескольких (например, одного или двух) заместителей, к которым относится один заместитель ОR8а в положении 7 кольцевой системы хинолина; и
(b) если Е представляет собой N и R2 представляет собой Н. то R1 отличается от заместителя -О-R4а в положении 3 пирролидинового кольца, где R4а представляет собой арил или Het2.
К соединениям формулы Ib, которые могут быть указаны, относятся соединения, где:
(i) R3 отличается от одного или нескольких (например, одного или двух) заместителей, к которым относится один заместитель ОR8а в положении 7 хинолиновой кольцевой системы;
(ii) R1 отличается от (например, если R2 представляет собой Н) заместителя -О-R4а в положении 3 пирролидинового кольца (например, заместителя -О-R4а, в котором R4а представляет собой арил или Het2);
(iii) R2 отличается от арила или Het4, если Е представляет собой N; и/или
(iv) R1 отличается от пиперазин-1-ила.
К применению соединений формулы Ib в медицине относится их использование в качестве фармацевтических средств. Изобретение поэтому дополнительно относится к применению соединения формулы Ib в качестве фармацевтического средства.
По сведениям авторов изобретения соединения формулы Ib являются по существу новыми. Таким образом, по еще одному дополнительному аспекту изобретения предлагается соединение формулы Ib.
При использовании в данном документе под термином «соединения примеров с 1 по 43 ниже» понимают соединения этих примеров, указанные в заголовках, а именно:
(1) 6-хлор-2-метил-4-(3-фенилпирролидин-1-ил)хинолин;
(2) 6-бензилокси-2-метил-4-(3-фенилпирролидин-1-ил)хинолин;
(3) 2-метил-4-(3-фенилпирролидин-1-ил)-6-(пиридин-3-илметокси) хинолин;
(4) 6-(4-метансульфонилбензилокси)-2-метил-4-(3-фенилпирролидин-1-ил)хинолин;
(5) 6-(4-метоксибензилокси)-2-метил-4-(3-фенилпирролидин-1-ил)хинолин;
(6) 2-метил-6-фенэтилокси-4-(3-фенилпирролидин-1-ил)хинолин;
(7) 2-метил-6-(5-метилизоксазол-3-илметокси)-4-(3-фенилпирролидин-1-ил)хинолин;
(8) 4-(3-бензилпирролидин-1-ил)-2-метил-6-феноксихинолин;
(9) 4[3-(4-метоксифенил)пирролидин-1-ил]-2-метил-6-феноксихинолин;
(10) 4[3-(4-хлорфенил)пирролидин-1-ил]-2-метил-6-феноксихинолин;
(11) [1-(2-метил-6-феноксихинолин-4-ил)пирролидин-3-ил] фениламин;
(12) N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] бензамид;
(13) N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]-2-фенилацетамид;
(14) 4-хлор-N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] бензамид;
(15) 4-метокси-N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] бензамид;
(16) 2-метил-N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] бензамид;
(17) [2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид пиразин-2-карбоновой кислоты;
(18) [2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид 1Н-пиразол-4-карбоновой кислоты;
(19) [2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид фуран-2-карбоновой кислоты;
(20) N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] никотинамид;
(21) [2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид 3-метил-3Н-имидазол-4-карбоновой кислоты;
(22) [2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид 5-метил-1Н-пиразол-3-карбоновой кислоты;
(23) [2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид пиридазин-4-карбоновой кислоты;
(24) 2-(4-метоксифенил)-N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]ацетамид;
(25) 2-(4-хлорфенил)-N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]ацетамид;
(26) [2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид 3,5-диметил-изоксазол-4-карбоновой кислоты;
(27) 2-(3-метил-изоксазол-5-ил)- N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]ацетамид;
(28) N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] бензолсульфонамид;
(29) бензил-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] амин;
(30) (R- или S-) бензил-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амин;
(31) (S- или R-)бензил-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амин;
(32) (4-метоксибензил)-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амин;
(33) 4-{[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-иламино]метил}бензонитрил;
(34) 1-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] пирролидин-2-он;
(35) N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]-3-фенилпропионамид;
(36) [2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид 5-метилизоксазол-3-карбоновой кислоты;
(37) [2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид пиридин-2-карбоновой кислоты;
(38) N-[4-(3-бензилпирролидин-1-ил)-2-метилхинолин-6-ил] бензамид;
(39) 2-метил-6-фенокси-4-(3-фенилпирролидин-1-ил)хинолин;
(40(а)) 4-((R или S)-3-бензилпирролидин-1-ил)-2-метил-6-феноксихинолин;
(40(b)) 4-((S или R)-3-бензилпирролидин-1-ил)-2-метил-6-феноксихинолин;
(41(a)) 4-[(R или S)-3-(4-метоксифенил)пирролидин-1-ил]-2-метил-6-феноксихинолин;
(41(b)) 4-[(S или R)-3-(4-метоксифенил)пирролидин-1-ил]-2-метил-6-феноксихинолин;
(42(a)) [2-метил-4-((R или S)-3-фенилпирролидин-1-ил)хинолин-6-ил]амид 5-метил-1Н-пиразол-3-карбоновой кислоты;
(42(b)) [2-метил-4-((S или R)-3-фенилпирролидин-1-ил)хинолин-6-ил]амид 5-метил-1Н-пиразол-3-карбоновой кислоты;
(43(a)) N-[4-((R или S)-3-бензилпирролидин-1-ил)-2-метилхинолин-6-ил]бензамид;
(43(b)) N-[4-((S или R)-3-бензилпирролидин-1-ил)-2-метилхинолин-6-ил]бензамид
и их фармацевтически приемлемые соли и/или сольваты.
Кроме того, обладая активностью против грибов и бактерий, соединения формулы I (например, соединения формулы Ia или Ib) также могут обладать активностью против других организмов, таких как простейшие. Поэтому по дополнительным аспектам изобретения предлагается:
(i) применение соединения формулы I, Ia или Ib, определенного в данном документе ранее, для получения лекарственного средства для лечения или профилактики заболевания, вызванного простейшими;
(ii) способ лечения или профилактики заболевания, вызванного простейшими, у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения формулы I, Ia или Ib, определенного в данном документе ранее;
(iii) соединение формулы I, Ia или Ib, для применения в лечении или профилактике заболевания, вызванного простейшими;
(iv) применение (например, применение ex vivo) соединения формулы I, Ia или Ib для уничтожения простейших.
По этим аспектам изобретения соединение формулы I, Ia или Ib может представлять собой соединение, в котором R2 отличается от Het4 (например, пирролидин-1-ил), если Е представляет собой N.
При использовании для лечения или профилактики заболевания, вызванного простейшими, соединения формулы I, Ia или Ib могут находиться в смеси, как описано ниже (т.е. быть включенными в фармацевтическую композицию или фармацевтическую композицию для местного применения, содержащую соединение формулы I, Ia или Ib в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем).
При использовании в данном документе под терминами «простейшие» (и его производными, такими как «заболевание, вызванное простейшими») понимают организмы (или инфекционные заболевания, вызванные организмами) следующих классов и конкретных видов:
Leishmania (например, Leishmania donovanii );
Plasmodium spp.;
Trypanosoma spp.;
Giardia lamblia;
кокцидии (например, Cryptosporidium parvum, Isospora belli);
Toxoplasma (например, Тoxoplasma gondii);
Balantidium coli;
амебы (например, Entamoeba, такие как Entamoeba histolytica, Entamoeba coli, Entamoeba hartmanni и Entamoeba polecki); и
Microsporidia (например, Enterocylozoon bieneusi, Encephalitozoon hellem, Encephalitozoon cuniculi и Septata intestinalis).
К конкретным состояниям, при которых соединения формулы I, Ia или Ib могут быть использованы для лечения, относятся лейшманиоз, малярия, трипаносомоз, токсоплазмоз, лямблиоз, балантидиаз, амебиаз (амебная дизентерия), криптоспоридиоз, изоспориоз и микроспоридиоз.
Соединения формулы I (включая соединения формул Ia или Ib) могут быть получены в соответствии с методами, известными специалистам в данной области, например, как описано в данном документе далее.
Таким образом, по дополнительному аспекту изобретения предлагается способ получения соединения формулы I (например, соединения формулы Ia или Ib), который включает:
(а) взаимодействие соединения формулы II,
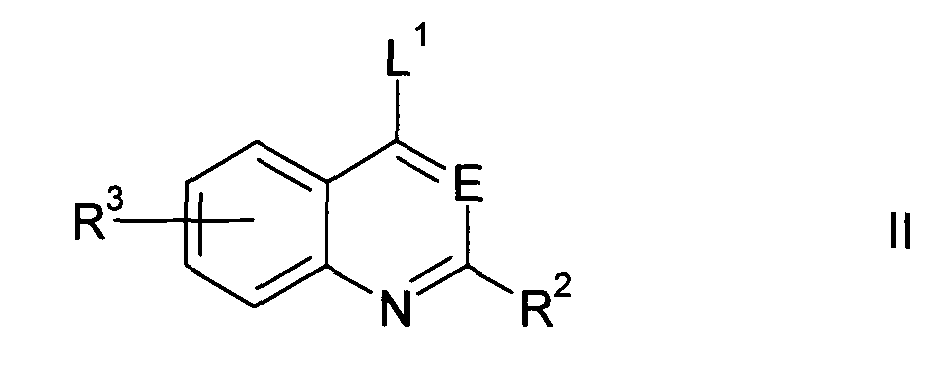
где L1 представляет собой подходящую удаляемую группу (например, галоген, такой как хлор), и Е, R2 и R3 определены в данном документе ранее, с соединением формулы III,
где R1 определен в данном документе ранее, например, в условиях, известных специалистам в данной области, таких как взаимодействие при повышенной температуре (например, от 70 до 250°С, например, достигаемой путем нагрева в микроволновой печи) и необязательно при повышенном давлении (т.е. выше 1 атмосферы) в присутствии подходящего органического растворителя, такого как С2-4 алкиленгликоль (например, этиленгликоль) или моно- или ди- С1-4 алкилэфир С2-4 алкиленгликоля (например, этоксиэтанол) и необязательно в присутствии подходящего основания (например, соединение формулы II может взаимодействовать с соединением формулы III, взятым в количестве от 1 до 3 эквивалентов (например, от 2 до 2,5 эквивалентов) при повышенной температуре (например, выше 180°С, такой как от 200 до 240°С), где реакционную смесь необязательно нагревают, используя микроволны, в присутствии подходящего растворителя, кипящего при высоких температурах (например, этоксиэтанола));
(b) для соединений формулы I, где Е представляет собой СН, взаимодействие соединения формулы IV
где R2 и R3 определены в данном документе ранее, с соединением формулы III, определенным в данном документе ранее, например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 40 до 200°С) в присутствии силилирующего агента (например, гексаметилдисилазана) и необязательно в присутствии подходящего катализатора (например, соли аммония, такой как сульфат аммония);
(с) для соединений формулы I, где R3 представляет собой или включает заместитель -N(H)C(O)R8i, конденсацию соответствующего соединения формулы I, где R3 представляет собой или включает заместитель -NH2 с соединением формулы V,

где L2 представляет собой удаляемую группу (такую как ОН, галоген (такой как хлор или бром) или -C(O)R8i и R8i определен в данном документе ранее, например, в условиях, известных специалистам в данной области (таких как: (i) если L2 представляет собой ОН в присутствии связующего агента (например, оксалилхлорида в DMF; EDC; DCC; HBTU; HATU; PyBOP; или TBTU, эти последние шесть агентов необязательно могут быть использованы вместе с катализатором, таким как HOBt, HOAt или HOSu), подходящего основания (например, пиридина, DMAP, TEA, 2,4,6-коллидина или DIPEA) и подходящего органического растворителя (например, DCM, MeCN, EtOAc или DMF); или (ii) если L2 представляет собой галоген или ОC(O)R8i в присутствии подходящего основания (например, пиридина, DMAP, TEA, 2,4,6-коллидина или DIPEA) и подходящего органического растворителя (например, DCM, MeCN, EtOAc или DMF));
(d) для соединений формулы I, где R3 представляет собой или включает заместитель -N(H)S(O)2R8f, конденсацию соответствующего соединения формулы I, где R3 представляет собой или включает заместитель -NH2, с соединением формулы VI,

где L3 представляет собой удаляемую группу (например, галоген (такой как хлор) или OS(O)2R8f и R8f определен в данном документе ранее, например, в условиях, известных специалистам в данной области, таких как присутствие подходящего растворителя (например, DCM) и подходящего основания (например, пиридина);
(е) для соединений формулы I, где R3 представляет собой или включает заместитель -N(H)R8h, где R8h необязательно замещается С1-10 алкилом, взаимодействие соответствующего соединения формулы I, где R3 представляет собой или включает заместитель -NH2, с соединением формулы VII,

где R8h1 представляет собой H или С1-9 алкил, эта последняя группа необязательно замещена, как определено выше в отношении R8h, в присутствии подходящего восстановителя (например, цианоборогидрида натрия или триацетоксиборогидрида натрия), например, в условиях, известных специалистам в данной области, таких как температура окружающей среды, в присутствии каталитического количества карбоновой кислоты (например, С2-4 алкановой кислоты, такой как уксусная кислота) и подходящего растворителя (например, 1,2-дихлорэтана);
(f) для соединений формулы I, где R3 представляет собой или включает заместитель -OR8a, где R8a необязательно замещается С1-10 алкилом, конденсацию соответствующего соединения формулы I, где R3 представляет собой или включает заместитель -OH, с соединением формулы VIII,

где R8a1 представляет собой С1-10 алкильную группу, которая необязательно замещена, как определено выше в отношении R8а, и L3 определен в данном документе ранее, например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, 120°С), где реакционную смесь необязательно нагревают, используя микроволны, в присутствии основания (например, гидрида щелочного металла, такого как гидрид натрия, или карбоната щелочного металла, такого как карбонат цезия) и подходящего растворителя (например, DMF); или
(g) для соединений формулы I, где R1 представляет собой или -N(H)-R4а, где R4а представляет собой арил, взаимодействие соединения формулы IХ,
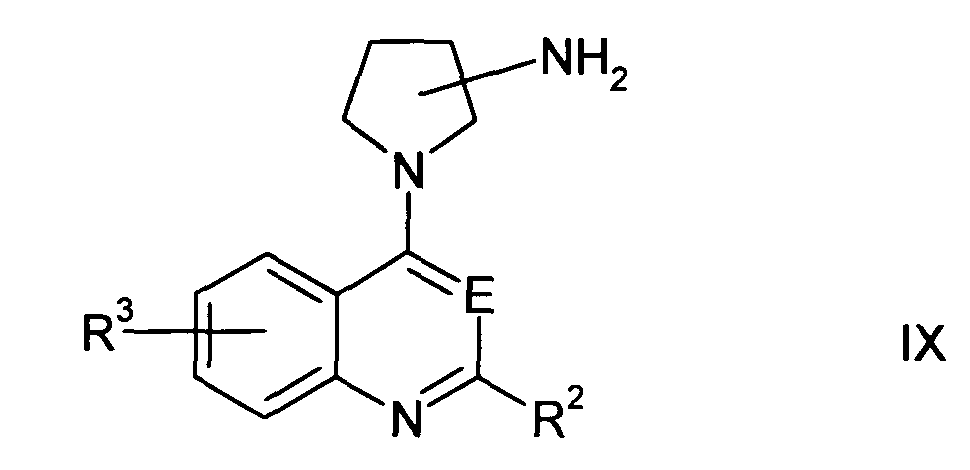
где Е, R2 и R3 определены в данном документе ранее, с соединением формулы Х

где R4а1 представляет собой арил, а L3 и арил определены в данном документе ранее, в присутствии перекрестно связывающего катализатора палладия (например, трис-(дибензилиденацетон) дипалладия), например, в условиях, известных специалистам в данной области, таких как повышенная температура (например, 150°С), где реакционную смесь необязательно нагревают, используя микроволны, в присутствии подходящего фосфина (например, 2-дициклогексилфосфино-2'-диметиламинобифенил), подходящего основания (например, трет-бутоксида натрия) и органического растворителя (например, толуола).
Соединения формулы II, где L1 представляет собой галоген, могут быть получены взаимодействием соответствующего соединения формулы IV, определенного в данном документе ранее, с подходящим галогенирующим реагентом (например, оксихлоридом фосфора), например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 100 до 120°С), необязательно в присутствии подходящего органического растворителя (например, толуола или ксилена).
Соединения формулы II, где R3 представляет собой заместитель -NH2, могут быть получены восстановлением соответствующего соединения формулы II, где R3 представляет собой заместитель -NО2, например, каталитической гидрогенизацией в присутствии подходящего катализатора (такого как Pd/C, Pt2O или никель Ренея) в условиях, известных специалистам в данной области, таких как температура окружающей среды в присутствии подходящего органического растворителя (например, этанола).
Соединения формулы II, где R3 представляет собой заместитель -NО2, могут быть получены согласно или по аналогии с процедурами, известными специалистам в данной области (например, описанными в J. Chem. Soc. 1367 (1949)), такими как взаимодействие соответствующего соединения формулы II, где R3 представляет собой Н, с подходящим агентом нитрования (например, смесью азотной и серной кислот), например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 50 до 75°С).
Соединения формулы III, где R1 представляет собой единственный заместитель в положении 3 пирролидинового кольца, может быть получен способами, известными специалистам в данной области (например, согласно или по аналогии с соответствующими способами, описанными в: J. Org. Chem. 55, 270 (1990); Synthesis 1023 (1991); J. Am. Chem. Soc. 124 (2002); J. Org. Chem. 64, 4273 (1999); Synlett 2092 (2002); Med. Chem. Res. 7, 76 (1997); или J. Org. Chem. 60, 4743 (1995); или одним из следующих способов.
(i) Восстановление соответствующего соединения формулы ХI
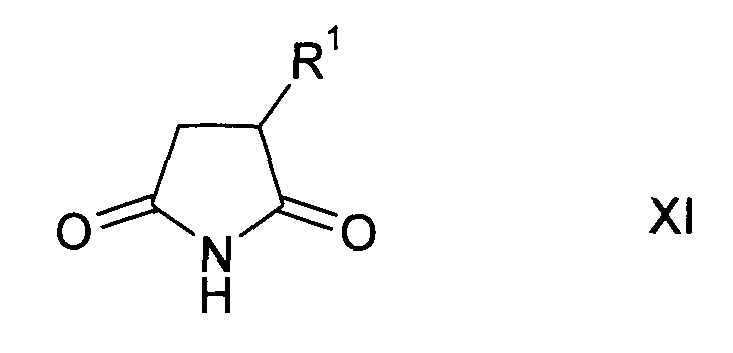
где R1 определен в данном документе ранее, в присутствии подходящего восстановителя (например, литий-алюминий гидрида), например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 50 до 75°С), в присутствии подходящего органического растворителя (например, тетрагидрофурана).
(ii) Взаимодействие соответствующего соединения формулы ХII
где L3 и R1 определены в данном документе ранее, с аммонием или соединением формулы ХIII

где Rа представляет собой подходящую защитную группу (например, -СН2Ph или -ОН), например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 50 до 65°С), в присутствии подходящего органического растворителя (например, тетрагидрофурана) и подходящего основания (например, основания Хюнига или 4-диметиламинопиридина) с последующим (при необходимости) удалением защитной группы Rа в условиях, известных специалистам в данной области (например, каталитической гидрогенизацией, используя в качестве катализатора Pd/C, например, при температуре окружающей среды или повышенной температуре (например, от 50 до 65°С) в присутствии подходящего органического растворителя, такого как этанол или метанол).
Соединения формулы IV могут быть получены взаимодействием соединения формулы ХIV,
где R3 определен в данном документе ранее, с соединением формулы ХV,
где Rb представляет собой С1-4 алкил (такой как этил), в присутствии кислоты (например, полифосфорной кислоты), например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 90 до 105°С) в присутствии подходящего органического растворителя (например, диоксана).
Соединения формулы IV альтернативно могут быть получены циклизацией соединения формулы ХVI или соединения формулы ХVII,
где R2 и R3 определены в данном документе ранее, например, в условиях, известных специалистам в данной области, таких как повышенная температура (например, от 70 до 250°С, например, путем нагрева в микроволновой печи) в присутствии подходящего растворителя (например, дихлорбензола или дифенилового эфира).
Соединения формулы ХI могут быть получены взаимодействием соответствующего соединения формулы ХVIII,
где Rс представляет собой галоген, ОН или С1-9 алкокси, с соединением формулы ХIII, определенным в данном документе ранее, например, в условиях, известных специалистам в данной области. Например, если Rс представляет собой ОН, то реакция может быть осуществлена в присутствии подходящего связующего реагента и необязательно в присутствии подходящего основания, подходящего растворителя и/или катализатора (например, гидрата 1-гидроксибензтриазола). Альтернативно, если Rс представляет собой галоген (например, хлор), то реакция может быть осуществлена, например, при температуре окружающей среды (или ниже) в присутствии подходящего основания и/или подходящего растворителя.
Применительно к реакции между соединениями формул XVIII и XIII к подходящим связующим реагентам относятся, например:
1,1'-карбонилдиимидазол; N,N'-дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этилкарбодиимид (или их гидрохлорид); N,N'-дисукцинимидил карбонат; бензотриазол-1-илокситрис (диметиламино)фосфония гексафторфосфат; 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат; бензотриазол-1-илокситрис-пирролидинфосфония гексафторфосфат; бром-трис-пирролидинфосфония гексафторфосфат; 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторкарбонат; 1-циклогексилкарбодиимид-3-пропилоксиметил полистирол; О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат; и О-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат.
Кроме того, к подходящим основаниям относятся, например, гидрид натрия, бикарбонат натрия, карбонат калия, пиридин, триэтиламин, диметиламинопиридин, диизопропиламин, гидроксид натрия, трет-бутоксид калия и/или диизопропиламид лития. Также к подходящим растворителям, которые могут быть указаны, относятся тетрагидрофуран, пиридин, толуол, дихлорметан, хлороформ, ацетонитрил, диметилформамид, трифторметилбензол, диоксан или триэтиламин.
Соединения формулы XII, где L3 представляет собой OS(O)2R8f, могут быть получены:
восстановлением соответствующего соединения формулы XVIII, где Rс представляет собой С1-9 алкокси в присутствии подходящего восстановителя (например, литий-алюминий гидрида или диизобутилалюминий гидрида), например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 50 до 70°С) в присутствии подходящего органического растворителя (например, тетрагидрофурана); с последующим
взаимодействием полученного диола с соединением формулы XIХ

где L3 и R8f определены в данном документе ранее, например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или пониженная температура (например, от 0 до 5°С) в присутствии подходящего органического растворителя (например, тетрагидрофурана или дихлорметана) и подходящего основания (например, триэтиламина или 4-диметиламинопиридина).
Соединения формулы XVI могут быть получены взаимодействием соответствующего соединения формулы XIV, определенного в данном документе ранее, с соединением формулы XV, определенным в данном документе ранее, например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 100 до 120°С), необязательно в присутствии растворителя.
Соединения формулы XVII могут быть получены согласно или по аналогии с процедурами, известными специалистам в данной области (например, описанными в журнале Synthesis 482 (1987)), такими как взаимодействие соответствующего соединения формулы XIV, определенного в данном документе ранее, с соединением формулы XХ,
где L4 представляет собой подходящую удаляемую группу (например, этилтио) и R2 определен в данном документе ранее, например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 100 до 120°С), необязательно в присутствии подходящего растворителя.
Соединения формулы XVIII, где R1 представляет собой -СН2-арил и Rс представляет собой С1-9 алкокси, могут быть получены взаимодействием соответствующего соединения формулы XХI,
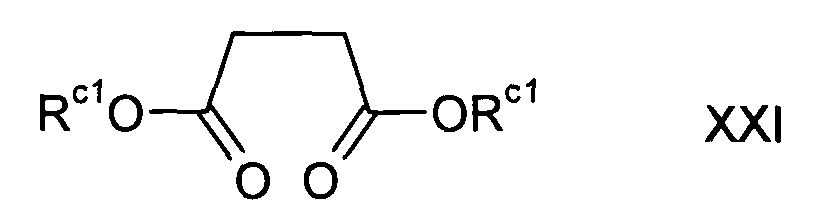
где Rс1 представляет собой С1-9 алкокси, с соединением формулы XХII,

где арил определен в данном документе ранее, например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 60 до 80°С) в присутствии подходящего основания (например, трет-BuOK) и подходящего органического растворителя (например, трет-бутанола) с последующим восстановлением полученного промежуточного продукта алкенила, например, каталитической гидрогенизацией в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 50 до 65°С) в присутствии катализатора (например, Pd/C) и подходящего органического растворителя (например, этанола или метанола).
Соединения формулы XVIII, где R1 представляет собой -СН2-арил и Rс представляет собой ОН, могут быть получены взаимодействием соответствующего соединения формулы XХIII,
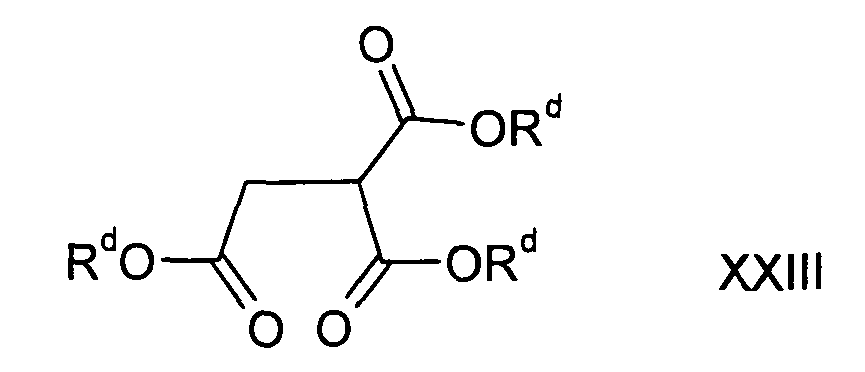
где каждый Rd независимо представляет собой С1-9 алкил, с соединением формулы XХIV,

где арил и L3 определены в данном документе ранее, например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 40 до 120°С) в присутствии подходящего основания (например, K2CO3, NaOH, NaH, триэтиламина или 4-диметиламинопиридина) и подходящего органического растворителя (например, DMF, тетрагидрофурана, дихлорметана или этанола) с последующим гидролизом трех сложноэфирных групп (т.е. превращением каждого Rd в Н) и монодекарбоксилированием, например, в условиях, известных специалистам в данной области, таких как повышенная температура (например, от 50 до 65°С) в присутствии подходящей водной кислоты (например, серной или хлористоводородной кислоты) и подходящего органического растворителя (например, этанола или метанола).
Соединения формулы XVIII, где Rс представляет собой С1-9 алкокси, могут быть получены взаимодействием соединения формулы XХV,
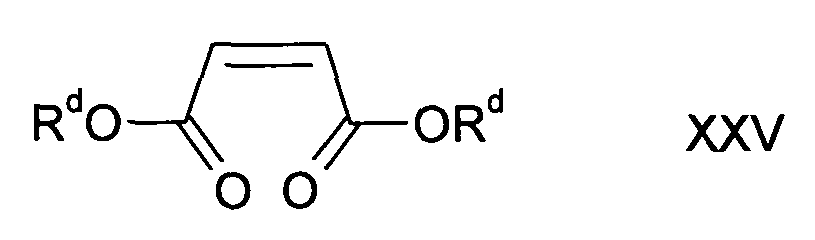
где Rd определен в данном документе ранее, с соединением формулы XХVI,

где R1 и галоген определены в данном документе ранее, например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 60 до 120°С) в присутствии подходящего катализатора на основе палладия для сочетания Хека и подходящего органического растворителя (например, диметилформамида, толуола, ацетонитрила или тетрагидрофурана) и необязательно в присутствии подходящего основания (например, K2CO3, Ag2CO3, NAOAc или триэтиламина) и/или сокатализатора (например, н-Bu4NBr или Nal) с последующим каталитическим гидрогенированием полученного промежуточного продукта алкенила, например, в условиях, известных специалистам в данной области, таких как температура окружающей среды или повышенная температура (например, от 50 до 65°С) в присутствии подходящего катализатора гидрогенирования (например, Pd/C, [(R)- или (S)-DIPAMP]RhCl или [(R)- или (S)-BINAP]Ru(OAc)2) и подходящего органического растворителя (например, этанола или метанола).
Катализатор на основе палладия для сочетания Хека может содержать источник палладия (0) (например, Pd(OAc)2, Pd(OCOCF3)2(PPh3)2, Pd(dba)2, Pd(PPh3)4) и необязательно подходящий лиганд для координации палладия (например, PPh3, P(Oi-Pr)3 или три-(о-толул)фосфин).
Соединения формул II, III, IV, V, VI, VII, VIII, IX, X, XII, XIII, XIV, XV, XIX, XX, XXI, XXII, XXIII, XXIV, XXV и XXVI либо коммерчески доступны, что известно из литературы, либо могут быть получены по аналогии со способами, описанными в данном документе, либо общепринятыми процедурами синтеза в соответствии со стандартными методами из легко доступных исходных материалов, используя подходящие реагенты и условия проведения реакций.
Заместители по алкилу, алкенилу, алкинилу, циклоалкилу, циклоалкенилу, арилу и гетероциклическим группам в соединениях формул I, II, III, IV, V, VI, VII, VIII, IX, X, XI, XII, XIII, XIV, XV, XVI, XVII, XVIII, XIX, XX, XXI, XXII, XXIII, XXIV, XXV и XXVI могут быть введены и/или взаимно превращены друг в друга, используя методики, хорошо известные специалистам в данной области, путем стандартных взаимных превращений функциональных групп в соответствии со стандартными методиками из легко доступных исходных материалов, используя подходящие реагенты и условия проведения реакции. Например, бензилокси может быть превращен в гидрокси и т.д.
Соединения формулы I могут быть выделены из их реакционных смесей, используя общепринятые методики. Например, соединения формулы I могут быть выделены путем превращения в кислую (например, солянокислую) соль (например, путем добавления кислоты к сырому продукту) и затем перекристаллизации соли из подходящего растворителя (например, метанола или, особенно, этанола). Альтернативно, для выделения чистой кислой соли соединения формулы I соль может быть без труда отмыта или суспендирована в присутствии такого подходящего растворителя.
По настоящему изобретению к фармацевтически приемлемым производным соединений формулы I также относятся «защищенные» производные соединений формулы I и/или соединения, которые действуют как пролекарства.
У соединений формулы I может наблюдаться таутомеризм. Изобретение охватывает все таутомерные формы и их смеси.
Соединения формулы I также могут содержать один или несколько асимметричных атомов углерода и поэтому у них может наблюдаться оптический и/или диастереоизомеризм. Диастереоизомеры могут быть разделены, используя общепринятые методики, например хроматографию. Большое число стереоизомеров может быть выделено разделением рацемической или другой смеси соединений, используя общепринятые методики, например, HPLC. Альтернативно, желаемые оптические изомеры могут быть созданы взаимодействием подходящих оптически активных исходных веществ в условиях, которые не будут вызывать рацемизации или эпимеризации, или дериватизацией (например, с гомохиральной кислотой) с последующим разделением диастереомерных производных общепринятыми способами (например, фракционированной кристаллизацией, HPLC, хроматографией на силикагеле). Изобретение охватывает все стереоизомеры.
Специалистам в данной области будет понятно, что в способах, описанных в данном документе выше и далее, может потребоваться защитить функциональные группы промежуточных соединений с помощью защитных групп.
К функциональным группам, которые желательно защитить, относятся гидрокси, амино и карбоновая кислота. К подходящим защитным группам для гидрокси относятся необязательно замещенные и/или ненасыщенные алкильные группы (например, метил, аллил, бензил или трет-бутил), триалкилсилильные или диарилалкилсилильные группы (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил) и тетрагидропиранил. К подходящим защитным группам для карбоновой кислоты относятся С1-6 алкил или бензилэфиры. К подходящим защитным группам для амино относятся трет-бутилоксикарбонил и бензилоксикарбонил.
Защита и снятие защиты функциональных групп могут происходить до или после конденсации или перед или после любой другой реакции в вышеуказанных схемах.
Защитные группы могут быть удалены в соответствии с методиками, которые хорошо известны специалистам в данной области, и как описано в данном документе далее.
Специалисту в данной области будет понятно, что для альтернативного получения соединений формулы I и в некоторых случаях более подходящим способом отдельные стадии способа, указанные в данном документе ранее, могут быть осуществлены в другом порядке и/или отдельные реакции могут быть осуществлены на отличной стадии целого пути (т.е. заместители могут быть добавлены и/или химические трансформации осуществлены, исходя из иных промежуточных продуктов чем те, которые указаны в данном документе ранее в связи с определенной реакцией). Это может отвергнуть или подтвердить необходимость защитных групп.
Характер задействованной химии будет диктоваться необходимостью и типом защитных групп, а также последовательностью осуществления синтеза.
Применение защитных групп описывается в книгах “Protective Groups in Organic Chemistry” под редакцией J. W. F. McOmie, Plenum Press (1973) и “Protective Groups in Organic Synthesis”, 3е издание, T. W. Greene & P. G. M. Wutz, Wiley-Interscience (1999).
Защищенные производные соединений формулы I могут быть превращены химическим путем в соединения по изобретению, используя стандартные методики снятия защиты (например, гидрогенирование). Специалистам также должно быть понятно, что некоторые соединения формулы I также могут обозначаться как «защищенные производные» других соединений формулы I.
Специалистам в данной области также должно быть понятно, что некоторые соединения формулы I можно будет использовать в качестве промежуточных соединений в синтезе некоторых других соединений формулы I.
При использовании в описанном выше способе лечения соединения формулы I (например, соединения формулы Iа или Ib) могут находиться в смеси для введения пациенту. В этой связи согласно еще одному дополнительному аспекту изобретения предлагается фармацевтическая композиция, включающая соединение формулы I (например, соединения формулы Iа или, особенно, Ib), в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Указанные выше лекарственные средства, комбинированные продукты и фармацевтические композиции (их компоненты) могут быть получены согласно способам, известным специалистам в данной области, например смешиванием соединений формул I, Iа или Ib с эксципиентом или эксципиентами.
При смешивании с эксципиентами соединения формул I, Iа или Ib могут присутствовать в указанных выше лекарственных средствах, комбинированных продуктах и фармацевтических композициях (их компонентах) в концентрации от 0,1 до 99,5% (например, от 0,5 до 95%) масс. от всей смеси.
При введении пациентам какого-либо из указанных выше лекарственных средств, комбинированных продуктов и фармацевтических композиций (их компонентов) соединения формул I, Iа или Ib, как правило, должны вводиться перорально, любым парентеральным способом или посредством ингаляции.
В случае применения на животных, соединения формул I, Iа или Ib также могут быть введены за счет включения соединения формул I, Iа или Ib в продукты питания или питьевую воду.
Одним из предпочтительных способов введения соединений по изобретению является пероральный.
К подходящим ежедневным дозам соединений по изобретению в профилактическом и/или терапевтическом лечении млекопитающих (например, людей) относятся, например, дозы 0,001-100 мг/кг массы тела при пероральном введении и 0,001-50 мг/кг массы тела при парентеральном введении.
В конкретном варианте осуществления изобретения соединения формул I, Iа или Ib применяются местно. Таким образом, по изобретению предлагается:
(I) фармацевтическая композиция для местного применения, содержащая соединение формулы I, Iа или Ib в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем;
(II) комбинированный продукт для местного применения, содержащий
(А) соединение формулы I, Iа или Ib, определенное в данном документе ранее, и
(В) общепринятый антимикробный агент, определенный в данном документе ранее,
где каждый из компонентов (А) и (В) находятся в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем.
При использовании в данном документе под термином «местный» понимают композиции, которые адаптированы для нанесения на поверхности тела (например, кожу или слизистые оболочки). К слизистым оболочкам, которые могут быть указаны в этом отношении, относятся слизистая влагалища, пениса, уретры, мочевого пузыря, ануса, ротовой полости (включая слизистую щек, мягкого неба, под поверхностью языка и дна ротовой полости), носа, глотки (включая слизистую зева, гортани, трахеи и пищевода), бронхов, легких, глаза и уха.
В отношении пункта (II) выше, комбинированный продукт обеспечивает введение компонента (А) вместе с компонентом (В), и может, таким образом, быть представленным либо в виде отдельных композиций для местного применения, в которых по меньшей мере одна из композиций содержит компонент (А) и по меньшей мере одна содержит компонент (В), либо может быть представленным (т.е. находиться в смеси) в виде комбинированного препарата для местного применения (т.е. быть представленным в виде одной композиции для местного применения, включающей компонент (А) и компонент (В)).
К композициям для местного применения, которые можно использовать для лечения расстройств кожи или слизистых оболочек (например, оболочек, достижимых пальцем, таких как оболочки ротовой полости, влагалища, цервикального канала, ануса и прямой кишки), относятся кремы, мази, лосьоны, спреи, гели и стерильные водные растворы или суспензии. По существу, к композициям для местного применения относятся композиции, где активный(е) ингредиент(ы) растворен(ы) или диспергирован(ы) в дерматологическом носителе, известном в данной области (например, водных или неводных гелях, мазях, эмульсиях вода-в-масле или масло-в-воде). Состав таких носителей может содержать воду, водные буферные растворы, неводные растворители (такие как этанол, изопропанол, бензиловый спирт, 2-(2-этоксиэтокси) этанол, пропиленгликоль, пропиленгликоля монолаурат, гликофурол или глицерин), масла (например, минеральное масло, такое как жидкий парафин, природные или синтетические триглицериды, такие как МиглиолТМ, или силиконовые масла, такие как диметикон). В зависимости, среди прочего, от природы композиции, а также намеченного для нее применения и места нанесения используемый дерматологический носитель может содержать один или несколько компонентов (например, если композиция представляет собой гель на водной основе, компоненты, добавленные к воде), выбранных из следующего списка:
солюбилизирующий агент или растворитель (например, β-циклодекстрин, такой как гидроксипропил β-циклодекстрин, или спирт или многоатомный спирт, такой как этанол, пропиленгликоль или глицерин);
загуститель (например, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, карбоксиметилцеллюлоза или карбомер);
желеобразующий агент (например, сополимер полиоксиэтилен-полиоксипропилен);
консервант (например, бензиловый спирт, хлорид бензалкония, хлоргексидин, хлорбутол, бензоат, сорбат калия или EDTA или их соли); и
рН забуферивающий(е) агент(ы) (такой(ие) как смесь первичного кислого фосфата и вторичного кислого фосфата или смесь лимонной кислоты и вторичного кислого фосфата).
Количество соединения формул I, Iа или Ib, используемого в композициях для местного применения или комбинированных продуктах, будет зависеть в числе прочего от конкретной природы композиции или комбинированного продукта, а также намеченного для них применения. В любом случае специалист в данной области сможет определить общепринятыми и несложными способами количества соединения формул I, Iа или Ib, которые могут быть использованы. Как правило, тем не менее, соединение формул I, Iа или Ib должно находиться в композиции для местного применения или комбинированном продукте в количестве от 0,01 до 25% масс. (например, от 0,1 до 10% масс., таком как от 0,1 до 5% масс. или, в частности, от 0,5 до 3% масс. (например, 2% или 1%)) от композиции или продукта.
Конкретные композиции для местного применения, которые могут быть указаны, представляют собой такие композиции, которые содержат соединение формулы I (например, в количестве от 0,5 до 3%, таком как 2% или 1% масс.) и:
(а) воду;
(b) один или несколько полярных неводных растворителей (например, спирт или многоатомный спирт, такой как этанол, пропиленгликоль и/или глицерин);
(c) консервант (например, бензиловый спирт);
(d) загуститель (например, гидроксиэтилцеллюлозу); и необязательно
(e) рН забуферивающий(е) агент(ы) (такой(ие) как смесь солей первичного кислого фосфата и вторичного кислого фосфата).
В конкретных композициях и в зависимости, помимо прочего, от количества соединения формулы I присутствуют (как правило, для солюбилизации соединения требовались большее количество соединения формулы I, большее количество полярных неводных растворителей):
(i) вода может находиться в количестве от 55 до 75% (например, от 60 до 72,5%) масс.;
(ii) один или несколько полярных неводных растворителей могут (вместе) находиться в количестве от 15 до 40% (например, от 24 до 35%) масс.;
(iii) глицерин, если он используется, может находиться в количестве от 5 до 25% (например, от 15 до 20%) масс.;
(iv) этанол, если он используется, может находиться в количестве от 3 до 10% (например, от 5 до 8%) масс.;
(v) пропиленгликоль, если он используется, может находиться в количестве от 2 до 15% (например, от 4 до 6%) масс.;
(vi) консервант может находиться в количестве от 0,1 до 3% (например, около 1%) масс.;
(vii) загуститель может находиться в количестве от 1 до 5% (например, около 2% масс.).
В дополнительных конкретных композициях для местного применения рН забуферивающий(е) агент(ы) при использовании и растворении в водном компоненте композиции может(гут) обеспечивать величину рН в диапазоне от 5 до 7 (например, величину рН около 5,5).
Способы получения фармацевтических композиций для местного применения, таких как кремы, мази, лосьоны, спреи и стерильные водные растворы или суспензии, хорошо известны в данной области. Подходящие способы получения фармацевтических композиций для местного применения описываются, например, в WO 95/10999, US 6974585, WO 2006/048747, а также в документах, приведенных в любом из этих источников.
Фармацевтические композиции для местного применения и комбинированные продукты по настоящему изобретению могут использоваться для лечения большого числа расстройств кожи или слизистых оболочек, таких как инфекционные заболевания кожи или слизистых (например, инфекционные заболевания слизистой носа, подмышечной впадины, паховой области, промежности, прямой кишки, кожный дерматит, кожные язвы и участки введения медицинского оборудования, такого как иглы для внутривенного введения, катетеры и трубки для трахеостомии или кормления), вызванные любыми бактериями, грибами, описанными в данном документе ранее (например, любыми организмами стафилококков, стрептококков, микобактерий или псевдомонад, указанными в данном документе ранее, такими как S. aureus (например, метициллин-резистентными S. aureus (MRSA))).
К конкретным состояниям, вызванным бактериальной инфекцией, которые можно лечить с помощью фармацевтических композиций для местного применения и комбинированных продуктов по настоящему изобретению также относятся состояния, связанные с кожей и слизистыми, описанные в данном документе ранее, а также: вульгарные угри; розовые угри; розацеа (включая эритематотелеангиэктатическую розацеа, папулопустулярную розацеа, фиматозную розацеа и окулярную розацеа), рожистое воспаление, эритразма, эктима, прободающая эктима, импетиго; паронихия; целлюлит; фолликулит (включая джакузи фолликулит), фурункулез; карбункулез; стафилококковый токсический эпидермальный некролиз, хирургическая скарлатина, перианальное стрептококковое заболевание, стрептококковый синдром токсического шока, мелкоточечный кератолиз, подмышечный трихомикоз, пиодермия; инфекции наружного слухового прохода, синдром зеленых ногтей, спирохеты, некротизирующий фасцит, микобактериальные инфекции кожи (такие как волчанка обыкновенная, скрофулодерма, бородавчатый туберкулез, туберкулиды, узловатая эритема, индуративная эритема, кожные проявления туберкулоидной лепры или лепроматозной лепры, лепрозная узловатая эритема, кожные инфекционные заболевания, вызванные M. kansasii, M. malmoense, M. szulgai, M. simiae, M. gordonae, M. haemophilum, M. avium, M. intracellulare, M. chelonae (включая M. abscessus) или M. fortuitum, гранулема пловцов (или аквариумная), лимфаденит и язва Бурули (язва Бэрнсдейла, язва Сирлеса, язва Какерифу или язва Торо)); интертриго; атопическая экзема со стафилококковым носительством; а также инфекционная экзема, ожоговые раны, царапины и кожные раны.
К конкретным состояниям, вызванным грибковой инфекцией, которые можно лечить с помощью фармацевтических композиций для местного применения и комбинированных продуктов по настоящему изобретению также относятся состояния, связанные с кожей и слизистыми, описанные в данном документе ранее, а также: кандидоз (например, орофарингеальный кандидоз, вагинальный кандидоз или баланит), споротрихоз; дерматомикоз (например, дерматофития стоп, паховая дерматофития, стригущий лишай, дерматофития ногтей или трихофития гладкой кожи); разноцветный лишай; и инфекционные заболевания, вызванные грибами Trichophyton, Microsporum, Epidermophyton или Pityrosporum ovale (Malassezia furfur).
Помимо указанного выше, композиции для местного применения и комбинированные продукты по настоящему изобретению могут использоваться для эффективного очищения (например, профилактического очищения) от:
(a) стафилококков (например, MRSA);
(b) пропионобактерий, таких как Propionibacterium acnes; или
(c) грибов (таких как Candida albicans, Cryptococcus neoformans, Histoplasma capsulatum, Epidermophyton floccosum, Malassezia (например, Malassezia furfur) или, особенно, Trichophyton (например, Trichophyton violaceum, Trichophyton mentagrophytes или, особенно, Trichophyton rubrum),
с кожи или слизистых пациента, нуждающегося в таком очищении.
В случае стафилококков очищение может быть эффективным, в частности, с кожи (например, перед хирургическим вмешательством или введением медицинского оборудования, такого как иглы для внутривенного введения, катетеры и трубки для трахеостомии или кормления), из носа (например, ноздрей), ран или атопической экземы (атопического дерматита).
Таким образом, по дополнительному аспекту изобретения предлагается способ лечения любого состояния и инфекционного заболевания, указанных выше, применительно к композициям для местного применения или эффективного очищения от микроорганизмов, описанных выше, включающий введение пациенту, нуждающемуся в этом, эффективного количества композиции для местного применения, определенной в данном документе ранее, или комбинированного продукта, определенного в данном документе ранее.
Аналогично, предлагается композиция для местного применения, определенная в данном документе ранее, или комбинированный продукт для местного применения, определенный в данном документе ранее, для использования в лечении любого состояния и инфекционного заболевания, указанных выше, применительно к композициям для местного применения или в эффективном очищении от микроорганизмов, описанных выше.
Микроорганизмы, уничтожаемые нанесением композиции для местного применения или комбинированного продукта, могут быть клинически латентными. Таким образом, изобретение также охватывает способ уничтожения клинически латентных микроорганизмов у млекопитающего, инфицированного такими латентными микроорганизмами, включающий введение указанному млекопитающему микробицидно эффективного количества композиции для местного применения по первому аспекту изобретения или комбинированного продукта по второму аспекту изобретения.
При использовании для лечения микробной инфекции соединения формул I, Ia или Ib, вводимые либо самостоятельно, либо в сочетании с общепринятым антимикробным агентом, предпочтительно применяют в меньшем количестве доз, чем требуется для лечения той же микробной инфекции, используя лишь общепринятые антимикробные агенты (например, менее чем 7, 6, 5, 4 или 3 доз, например, 2 дозы или, в частности, 1 доза).
В этом отношении еще один дополнительный аспект изобретения относится к способу снижения дозы общепринятого антимикробного агента, необходимой для лечения микробной инфекции, включающему совместное введение соединения формулы I, Ia или Ib.
Соединения формул I, Ia или Ib обладают преимуществом, поскольку их можно использовать для уничтожения клинически латентных микроорганизмов. Кроме того, при лечении микробных инфекций соединения формул I, Ia или Ib могут обладать дополнительным преимуществом, они дают возможность сократить время проведения терапии (либо самостоятельно, либо в сочетании с общепринятым антимикробным агентом), таким образом повышая соблюдение пациентом схемы лечения (например, через необходимость получать меньшие дозы антимикробных агентов) и/или минимизируя риск возникновения субпопуляций микроорганизмов, которые (генетически) резистентны к общепринятым антимикробным агентам.
Кроме того, соединения по изобретению могут обладать преимуществом, заключающимся в том, что они могут быть более эффективными, менее токсичными, обладать более широким диапазоном активности, быть более сильными, создавать меньше побочных эффектов или обладать другими используемыми фармакологическими свойствами по сравнению с соединениями, известными из предшествующего уровня техники.
Биологические испытания
К процедурам испытаний, которые могут быть использованы для определения биологической (например, бактерицидной или антибактериальной) активности соединений формул I, Ia или Ib, относятся процедуры, известные специалистам в данной области для определения:
(а) бактерицидной активности против бактерий в стационарной фазе или «персистирующих» (т.е. «клинически латентных» бактерий); и
(b) антибактериальной активности против бактерий в log-фазе.
В отношении пункта (b) выше, к способам определения активности против бактерий в log-фазе относится определение в стандартных условиях (т.е. условиях, известных специалистам в данной области, таких как условия, описанные в WO 2005/014585, описание этого документа приводится в настоящем документе в качестве ссылки) минимальной ингибирующей концентрации (“MIC”) или минимальной бактерицидной концентрации (“MBC”) испытываемого соединения.
В отношении пункта (а) выше, к способам определения активности против клинически латентных бактерий относится определение в условиях, известных специалистам в данной области (таких как условия, описанные в статье Nature Reviews, Drug Discovery 1, 895-910 (2002), описание которой приводится в данном документе в качестве ссылки) минимальной бактерицидной концентрации в отношении бактерий в стационарной фазе (“MSC”) или минимальной бактерицидной концентрации в отношении «дремлющих» бактерий (“MDC”) испытываемого соединения. Ниже описываются конкретные примеры таких способов.
Протокол для пиогенных бактерий
Бактериальные штаммы
В следующей таблице представлены штаммы, используемые для скрининга.
|
Рост бактерий
Бактерии (за исключением стрептококков и H. Influenzae и P. аcnes) выращивали в 10 мл питательного бульона (№ 2 (продукция фирмы Oxoid)) в течение ночи при 37°С при непрерывном встряхивании при 120 об/мин. Стрептококки и H. influenzae выращивали в течение ночи в бульоне Todd-Hewitt (продукция фирмы Sigma) без встряхивания. P. acnes выращивали в течение ночи в 10 мл питательного бульона без встряхивания. Ночные культуры разводили (в 1000 раз) в 100 мл среды для роста и затем инкубировали со встряхиванием или без него в течение 10 дней. Жизнеспособность бактерий оценивали путем подсчета колониеобразующих единиц (КОЕ) с интервалом 2 часа в первые 24 часа и с интервалом 12-24 часа впоследствии. Из серийных 10-кратных разведений экспериментальных культур на чашки с питательным агаром (продукция фирмы Oxoid) и чашки с кровяным агаром (продукция фирмы Oxoid) в трех повторах добавляли образцы в количестве 100 мкл. После инкубации чашек при 37°С в течение 24 часов подсчитывали колониеобразующие единицы (КОЕ). Количество КОЕ P. acnes оценивали после инкубации чашек в анаэробных условиях в течение 48 часов.
Культуры в log-фазе: Описанные выше ночные культуры разводили (в 1000 раз) средой изосенситест. Культуры затем инкубировали при 37°С, встряхивая в течение 1-2 часов, до достижения величины log КОЕ 6, за исключением стрептококков, H. Influenzae и P. аcnes, которых инкубировали при 37°С, не встряхивая. Эти культуры служили в качестве культур в log-фазе.
Культуры в стационарной фазе: Культуры, инкубированные в течение более чем 24 часов, находятся в стационарной фазе. Для скрининга лекарственного средства используют 5-6 дневные культуры в стационарной фазе, как показано на фиг.1 (отрезки между двумя стрелками). Культуры разводили фосфатно-забуференным физиологическим раствором до величины log 6, такие культуры использовали для инкубации с испытываемыми соединениями.
Измерения бактерицидной активности против культур в log-фазе
Различные концентрации каждого испытываемого соединения инкубировали с культурами в log-фазе в 96-луночных планшетах в течение различных периодов времени (2, 4, 6, 12, 24 часа). Бактерицидную активность затем оценивали с помощью спектрофотометрии (используя плашечный ридер) полученных культур, а также по количеству КОЕ, как описано выше.
Измерения бактерицидной активности против культур в стационарной фазе
Различные концентрации каждого испытываемого соединения инкубировали с культурами в стационарной фазе (5-6-дневные культуры) в 96-луночных планшетах в течение 24 или 48 часов. Бактерицидную активность затем определяли по количеству КОЕ полученных культур, как описано выше.
Измерения бактерицидной активности против персистирующих бактерий
К 5-6-дневным культурам в стационарной фазе добавляли антибиотик (например, гентамицин) до конечной концентрации от 50 до 100 мкг/мл в течение 24 часов. После 24 часового воздействия антибиотика клетки 3 раза отмывают фосфатно-забуференным солевым раствором (PBS) и затем ресуспендируют в PBS. Жизнеспособные бактериальные клетки используют в качестве персистирующих бактерий. Жизнеспособность оценивают подсчетом КОЕ. Персистирующие бактерии затем использовали в измерениях бактерицидной активности испытываемых соединений.
Различные концентрации каждого испытываемого соединения инкубировали с суспензией (персистирующих) клеток в 96-луночных планшетах в течение различных периодов времени (24 и 48 часов). Бактерицидную активность затем определяли подсчетом КОЕ полученных культур, как описано выше.
Протокол для M. tuberculosis
Культивирование M. tuberculosis
M. tuberculosis H37Rv выращивали в 10 мл среды Middlebrook 7H9, содержащей 0,05% Tween 80, дополненной 10% ADC без разрушения в течение до 100 дней. Для получения равномерно диспергированных культур до экспериментального воздействия скопления в культурах разбивали, перемешивая культуры на вортексе в присутствии стеклянных шариков размером 2 мм (продукция фирмы Philip Harris Scientific, Staffordshire, UK) в течение 2 минут с последующим разрушением ультразвуком в водяной ультразвуковой бане (продукция фирмы Branson Ultrasonic B.V.) в течение 5 минут. Количество жизнеспособных M. tuberculosis в культурах определяли подсчетом колониеобразующих единиц (КОЕ) на агаре Middlebrook 7H11. На среде Middlebrook 7H9, дополненной 0,05% об. Tween 80, но без ADC, осуществляют серии 10-кратных разведений культур. Затем на сегменты размером одна треть чашек с агаром в двух повторах добавляли 100 мкл образцов. Чашки инкубировали в полиэтиленовых пакетах в течение 3 недель при 37°С.
Измерения бактерицидной активности в отношении культур в log-фазе
Различные концентрации каждого испытываемого соединения инкубировали с культурами в log-фазе (4-дневные культуры) в течение различных периодов времени (4, 8, 16, 24 дня). Бактерицидную активность затем определяли подсчетом КОЕ полученных культур, как описано выше.
Измерения бактерицидной активности в отношении культур в стационарной фазе и персистирующих бактерий
Модель 1 - Культуры в стационарной фазе. Различные концентрации каждого испытываемого соединения инкубировали со 100-дневными культурами, обработанными ультразвуком, каждая концентрация для отдельной культуры объемом 10 мл. После инкубации в течение 5 дней определяли количества жизнеспособных КОЕ, инокулируя пару чашек со средой 7Н11 10-кратными серийными разведениями полученных культур в объеме 100 мкл.
Модель 2 - персистирующие бактерии, отобранные с помощью рифампицина. К каждой культуре из ряда 100-дневных культур, обработанных ультразвуком, добавляли рифампицин (100 мг/л), эти культуры затем инкубировали в течение 5 дней. После первого дня инкубации на чашках, инокулированных культурой, колонии не могли быть получены. После двукратной отмывки с помощью PBS посредством центрифугирования для создания объема 10 мл добавляли свежую (и не содержащую рифампицин) среду 7Н9, и испытываемое соединение добавляли в тех же концентрациях, как в модели 1. После дополнительной инкубации в течение 7 дней определяли количество КОЕ, инокулируя 1 мл из каждого контейнера на чашку со средой 7Н11. Эти чашки затем инкубировали в течение 2 недель и очень небольшие колонии подсчитывали и отмечали. После дополнительных 2 недель инкубации к учтенным колониям добавляли любые дополнительные непомеченные колонии (т.е. колонии, которые росли медленно). Контрольные исследования показали, что после около 4 дней инкубации культур без рифампицина при подсчете на чашке начинают появляться колонии субкультуры.
Модель 3. Процедура аналогична модели 2, но только различные концентрации испытываемого соединения добавляли к 100-дневной культуре на третий день после обработки рифампицином. В конце 7-дневного периода инкубации (4 дня с кандидатными лекарственными средствами плюс рифампицин) все культуры отмывали, заменяя средой, не содержащей испытываемого соединения, и затем инкубировали в течение дополнительных 7 дней перед определением количества КОЕ.
Протокол для Candida albicans
Использовали клинический изолят Candida albicans. Штамм выращивали в 10 мл картофельно-декстрозной питательной среды (продукция фирмы Sigma-Aldrich) при 24°С с непрерывным встряхиванием при 120 об/мин в течение 24 часов. Затем 1 мл культуры инокулировали в 100 мл свежей питательной среды, которую инкубировали при тех же условиях в течение 6 дней.
Культуры в log-фазе: Описанную выше 24-часовую культуру разводили (в 100 раз) картофельно-глюкозной питательной средой. Культуры затем инкубировали при 24°С со встряхиванием в течение 20-24 часов, они служили в качестве культур в log-фазе. Культуры в log-фазе разводили свежей питательной средой до величины log КОЕ 6, их использовали для испытания активности соединений.
Культуры в стационарной фазе: Для скрининга лекарственного средства использовали 5-6 дневные культуры в стационарной фазе. Культуры в стационарной фазе разводили фосфатно-забуференным солевым раствором до величины log КОЕ 6, такие культуры использовали для оценки активности испытываемых соединений.
Измерения активности в отношении культур в log-фазе
Различные концентрации каждого испытываемого соединения инкубировали с культурами в log-фазе в 96-луночных планшетах в течение различных периодов времени (2, 4, 6, 12, 24 часа). Активность лекарственных средств затем оценивали с помощью спектрофотометрии (используя плашечный ридер) полученных культур, а также по количеству КОЕ, как описано выше.
Измерения активности в отношении культур в стационарной фазе
Различные концентрации каждого испытываемого соединения инкубировали с культурами в стационарной фазе (5-6-дневные культуры) в 96-луночных планшетах в течение 24 или 48 часов. Активность затем определяли, получая количества КОЕ полученных культур, как описано выше.
Модели на коже (локальные)
Помимо испытания против бактерий в стационарной и log-фазе in vitro, соединения формул I, Ia или Ib также могут быть испытаны в большом числе моделей in vivo, включая модели, известные специалистам в данной области. Например, для определения активности соединения против бактерий в или на коже к протоколам, которые могут быть предложены, относятся протоколы, описанные в журнале Antimicrobial Agents and Chemotherapy 49(8), 3435-41 (2005), а также следующие.
Поверхностная кожная бактериальная модель мышей (интактная кожа)
Мышей ICR или BALB/c в возрасте 6-8 недель получали от фирмы Harlan UK. Мышам проводили анестезию внутрибрюшной инъекцией 200 мкл раствора кетамина гидрохлорида/ксилазина. Шерсть на спине мыши удаляли, используя электрическую машинку для стрижки. Участок кожи размером 2 см2 (2 см × 1 см) помечали с помощью маркера. Для оценки количества бактерий на коже помеченный участок кожи 3 раза протирали, используя одноразовый тампон. Бактерии на тампоне растирали на чашки с кровяным агаром (продукция фирмы OxoidTM).
Использовали бактериальные или дрожжевые культуры в log-фазе или стационарной фазе. Культуры концентрировали центрифугированием, чтобы получить от 109 до 1010 КОЕ/мл. Клеточный осадок ресуспендировали с помощью питательного бульона или PBS и глицерина (50%). 15-20 мкл суспензии клеток добавляли к участку кожи (2 см2), в результате получив на коже 106-7 КОЕ. Кожу оставляли для высыхания в течение около 15 мин. Растворы испытываемого соединения в различных концентрациях наносили на участок кожи в течение разных периодов времени.
Количество бактерий или дрожжей на коже оценивали согласно следующему: после того, как мышь умертвляли, кожу на помеченном участке срезали и добавляли в пробирку объемом 2 мл, содержащую 1 мл воды и стеклянные шарики (размером 1 мм). Кожу гомогенизировали, используя возвратно-поступательный шюттель-аппарат (продукция фирмы Hybaid Ltd, UK) в течение 45 секунд (настройка оборотов 6,5) или перемешивая на вортексе в течение 1 мин. Оставшееся испытываемое соединение удаляли отмывкой 3 раза водой или PBS (при преципитации испытываемого соединения в буферной системе для отмывки использовали одну воду). Подсчет КОЕ осуществляли после серии 10-кратного разведения гомогенатов. На одну треть чашек с кровяным агаром (продукция фирмы OxoidTM) в двойном повторе добавляли образцы в количестве 100 мкл. Затем после инкубации бактериальных чашек при 37°С в течение 24 часов или дрожжевых чашек при 24°С в течение 48 часов подсчитывали колониеобразующие единицы (КОЕ), используя aCoLye (счетчик колоний).
Инфекционная модель поверхности кожи мыши (инфекционная модель со сдиранием полосами)
Мышей ICR или BALB/c в возрасте 6-8 недель получали от фирмы Harlan UK. Мышам проводили анестезию внутрибрюшной инъекцией 200 мкл раствора кетамина гидрохлорида/ксилазина. Шерсть мышей на спине удаляли с помощью электрической машинки для стрижки. Участок кожи размером 2 см2 сдирали полосами, используя индикаторную ленту для автоклавов. Кожу последовательно сдирали 10 раз. После этой процедуры кожа стала визуально повреждена и отличалась покраснением и блеском, но без постоянного кровоизлияния. Для уменьшения длительного болевого синдрома во время периода анестезии и каждые 12 часов вплоть до 3 дней давали бупренорфин. После сдирания кожи бактериальную инфекцию инициировали нанесением на поврежденный участок кожи 10 мкл бактериальной клеточной суспензии, содержащей 107 клеток, из ночной культуры или культуры в стационарной фазе. На час 0 и через 4 часа после инфицирования 3 мышей забивали, чтобы оценить количество КОЕ на коже. Через 24 часа растворы испытываемого соединения в различных концентрациях наносили на участок кожи в течение различных периодов времени. Эксперименты заканчивали через 18 ч после последней местной обработки.
Количество бактерий ран оценивали согласно следующему: после эвтаназии мыши раны размером примерно 2 см2 вырезали и добавляли в пробирку объемом 2 мл, содержащую 1 мл воды и стеклянные шарики (размером 1 мм). Кожу гомогенизировали, используя возвратно-поступательный шюттель-аппарат (продукция фирмы Hybaid Ltd, UK) в течение 45 секунд (настройка оборотов 6,5). Оставшееся испытываемое соединение удаляли отмывкой 3 раза водой. Подсчет КОЕ осуществляли после серии 10-кратного разведения гомогенатов. На одну треть чашек с кровяным агаром (OxoidTM) в двойном повторе добавляли образцы в количестве 100 мкл. После инкубации чашек при 37°С в течение 24 часов подсчитывали колониеобразующие единицы (КОЕ), используя aCoLye (счетчик колоний).
Изобретение иллюстрируется, но не ограничивается следующими примерами и фигурами, которые представляют данные, относящиеся помимо прочего к биологическим исследованиям, описанным выше.
На фигуре 1 иллюстрируется влияние НТ230 на Staphylococcus aureus в стационарной фазе на инфицированной коже мыши. Соединение НТ230 вводили в виде раствора в воде, солюбилизированного 10% масс. гидроксипропил β-циклодекстрином.
На фигуре 2 иллюстрируется влияние НТ230 на Staphylococcus aureus в стационарной фазе на интактной коже мыши. Соединение НТ230 вводили в виде раствора в воде, солюбилизированного 10% масс. гидроксипропил β-циклодекстрином.
На фигуре 3 иллюстрируется влияние НТ230 на Candida albicans в стационарной фазе на интактной коже мыши. Соединение НТ230 вводили в виде раствора в воде, солюбилизированного 10% масс. гидроксипропил β-циклодекстрином.
Символы
НТ230: 4-(3-бензилпирролидин-1-ил)-2-метил-6-феноксихинолин
С: контроль (без обработки)
С+CD: контрольная группа, обработанная (путем местного нанесения) системой растворителей, использованной для растворения НТ230 (т.е. водным раствором 10% масс. гидроксипропил β-циклодекстрина).
ПРИМЕРЫ
Основные экспериментальные процедуры
Спектр 1H NMR регистрировали при температуре окружающей среды, используя либо спектрометр Varian Unity Inova (400 МГц), либо спектрометр Bruker Advance DRX (400 МГц), оба оснащенные зондом тройного резонанса размером 5 мм. Химические сдвиги выражают в м.д. относительно тетраметилсилана. Были использованы следующие сокращения: с = синглет, д = дублет, дд = двойной дублет, т = триплет, кв. = квартет, м = мультиплет.
Эксперименты по высокоэффективной жидкостной хроматографии - масс-спектрометрии (LCMS) для определения времен удерживания и ионов в зависимости от массы, осуществляли, используя следующие способы:
Способ А: Эксперименты осуществляли на спектрометре Micromass Platform LCT с ионизацией электрораспылением и регистрацией положительных ионов и детекцией при одной длине волны UV 254 нм, используя колонку Higgins Clipeus C18 размером 100×3,0 мм с размером частиц 5 микрон и скорость потока 1 мл/минута. Исходная система растворителей представляла собой воду в концентрации 95%, содержащую 0,1% муравьиную кислоту (растворитель А), и ацетонитрил в концентрации 5%, содержащий 0,1% муравьиную кислоту (растворитель В), в течение первой минуты с последующим градиентом до 5% растворителя А и 95% растворителя В в течение следующих 14 минут. Конечную систему растворителей оставляли без изменений в течение дополнительных 5 минут.
Способ В: Эксперименты осуществляли на квадрупольном спектрометре Micromass Platform ZQ с ионизацией электрораспылением и регистрацией положительных ионов и детекцией при одной длине волны UV 254 нм, используя колонку Higgins Clipeus C18 размером 100×3,0 мм с размером частиц 5 микрон и скорость потока 1 мл/минута. Исходная система растворителей представляла собой растворитель А в концентрации 95% и растворитель В в концентрации 5% в течение первой минуты с последующим градиентом до 5% растворителя А и 95% растворителя В в течение следующих 14 минут. Конечную систему растворителей оставляли без изменений в течение дополнительных 5 минут.
Микроволновые эксперименты осуществляли, используя либо синтезатор Рersonal Chemistry Smith SynthesizerТМ, либо Еmrys OptimizerТМ, в которых используется одномодовый резонатор и динамическая настройка поля, оба дают воспроизводимость и контроль. Могут быть получены температуры 40-250°С, и может быть достигнуто давление вплоть до 20 бар.
Препаративную HPLC осуществляли, используя колонку Genesis C18 размером 150х20,6 мм с размером частиц 7 микрон, элюируя при 10 мл/мин градиентом вода/MeCN (+0,1% муравьиная кислота или 0,1% трифторуксусная кислота). Фракции, содержащие желаемый продукт, концентрировали. В некоторых случаях соединение затем превращали в хлористоводородную соль обработкой 1М соляной кислотой с последующим выпариванием.
Препаративную хиральную HPLC осуществляли, если не указано иного, используя колонку Chiralpak IA размером 250х20,6 мм с размером частиц 5 микрон, элюируя при 18 мл/мин смесью диэтиламина (0,1%) и этанола (7%) в гептане.
Получение
Получение 1
6-бензилокси-4-хлор-2-метилхинолин
(i) сложный этиловый эфир 3-(4-бензилоксифениламино)бут-2-еновой кислоты
4-бензилоксианилин (10 г) и этилацетоацетат (6,9 г) нагревали при 120°С в течение 3 часов. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметана и пентана. Желаемые фракции концентрировали, и образец выпаривали для получения обозначенного в пункте (i) соединения (7,8 г).
1H ЯМР (D6-ДМСО) δ 10,2 (с, 1H), 7,5-7,3 (м, 7H), 7,2 (д, 2H), 7,0 (д, 2H), 5,2 (с, 1H), 4,1 (кв., 2H), 1,8 (с, 3H), 1,4 (т, 3H)
(ii) 6-бензилокси-4-гидрокси-2-метилхинолин
Сложный этиловый эфир 3-(4-бензилоксифениламино)бут-2-еновой кислоты (3,1 г; см. стадию (i) выше) в дихлорбензоле (12 мл) нагревали в микроволновой печи при 220°С в течение 45 минут. Реакционную смесь разбавляли пентаном и полученный осадок фильтровали, отмывали пентаном и высушивали для получения 6-бензилокси-4-гидрокси-2-метилхинолина.
1H ЯМР (D6-ДМСО) δ 7,6 (с, 1H), 7,5-7,3 (м, 8H), 5,7 (с, 1H), 5,2 (с, 2H), 2,3 (с, 3H)
(iii) 6-бензилокси-4-хлор-2-метилхинолин
6-бензилокси-4-гидрокси-2-метилхинолин (2,6 г; см. стадию (ii) выше) в оксихлориде фосфора (40 мл) нагревали при кипении с обратным холодильником в течение 3,5 часов. Смесь затем осторожно добавляли к системе лед/вода и добавляли твердый карбонат натрия до достижения раствором величины рН 8,0. Смесь экстрагировали этилацетатом, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали. Полученную твердую фазу порошковали диэтиловым эфиром для получения соединения, указанного в заголовке, (6,4 г) в виде белой твердой фазы.
1H ЯМР (СDСl3) δ 8,0 (д, 1H), 7,5-7,4 (м, 8H), 5,2 (с, 2H), 2,7 (с, 3H)
Получение 2
4-хлор-2-метил-6-(пиридин-3-илметокси)хинолин
4-хлор-6-йод-2-метилхинолин (0,61 г; см. получение 6(ii) ниже), 3-пиридилкарбинол (0,26 г), йодид меди (I) (0,038 г), карбонат цезия (0,78 г), 1,10-фенантролин (0,072 г) в толуоле (3 мл) нагревали в микроволновой печи при 160°С в течение 40 минут. Реакционную смесь разбавляли водой и экстрагировали этилацетатом, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали. Остаток очищали хроматографией на силикагеле, элюируя смесью метанола и дихлорметана. Выпаривание желаемых фракций привело к получению соединения, указанного в заголовке, в виде бледно-розовой твердой фазы.
1H ЯМР (СDСl3) δ 8,7 (с, 1H), 8,6 (д, 1H), 7,9 (д, 1H), 7,8 (д, 1H), 7,5 (с, 1H), 7,4 (д, 1H), 7,3 (м, 2H), 5,3 (с, 2H), 2,7 (с, 3H)
Получение 3
4-хлор-2-метил-6-феноксихинолин
(i) 4-гидрокси-2-метил-6-феноксихинолин
Названное соединение получали, используя процедуры, аналогичные описанным в пункте Получение 6(i) ниже, но используя 4-феноксианилин вместо 4-йоданилина.
1H ЯМР (D6-ДМСО) δ 7,5 (д, 1H), 7,4 (м, 5H), 7,2 (т, 1H), 7,1 (д, 2H), 2,3 (с, 3H)
(ii) 4-хлор-2-метил-6-феноксихинолин
Соединение, указанное в заголовке, получали, используя процедуры, аналогичные описанным в пункте Получение 1((iii) выше, но используя 4-гидрокси-2-метил-6-феноксихинолин (см. стадию (i) выше) вместо 6-бензилокси-4-гидрокси-2-метилхинолина.
1H ЯМР (СDСl3) δ 8,0 (д, 1H), 7,6 (с, 1H), 7,5 (д, 1H), 7,4 (м, 3H), 7,2 (т, 1H), 7,1 (д, 2H), 2,7 (с, 3H)
Получение 4
Бензил-(4-хлор-2-метилхинолин-6-ил)амин
(i) N-(4-гидрокси-2-метилхинолин-6-ил)ацетамид
Названное соединение получали, используя процедуры, аналогичные описанным в пункте Получение 6(i) ниже, но используя 4-аминоацетанилид вместо 4-йоданилина.
1H ЯМР (D6-ДМСО) δ 10,2 (с, 1H), 8,2 (с, 1H), 7,8 (д, 1H), 7,4 (д, 1H), 5,8 (с, 1H), 3,4 (с, 3H), 2,3 (с, 3H)
(ii) 6-амино-4-хлорхинолин
N-(4-гидрокси-2-метилхинолин-6-ил)ацетамид (0,05 г; см. стадию (i) выше), метанол (2 мл) и 5 н соляную кислоту (6 мл) нагревали при кипении с обратным холодильником в течение 90 минут. Реакционную смесь выпаривали и остаток растворяли в этилацетате и растворе карбоната натрия. Органическую фазу отмывали водой, высушивали (Na2SO4), фильтровали и концентрировали, получая указанное в пункте (ii) соединение в виде бледно-желтой твердой фазы.
1H ЯМР (D6-ДМСО) δ 7,7 (д, 1H), 7,4 (с, 1H), 7,2 (д, 1H), 7,0 (с, 1H), 5,8 (с, 2H), 2,5 (с, 3H)
(iii) Бензил-(4-хлор-2-метилхинолин-6-ил)амин
6-амино-4-хлорхинолин (0,1 г; см. стадию (ii) выше), бензальдегид (0,055 г) и триацетоксиборгидрид натрия (0,22 г) в 1,2-дихлорэтане перемешивали в течение ночи. Смесь разбавляли дихлорметаном и отмывали водой, после чего высушивали (MgSO4), фильтровали и выпаривали. Остаток очищали посредством хроматографии на силикагеле, элюируя смесью этилацетата и пентана. Желаемые фракции концентрировали, и образец выпаривали до сухого состояния, получая соединение, указанное в заголовке, в виде масла.
1H ЯМР (СDСl3) δ 7,8 (д, 1H), 7,5-7,2 (м, 6H), 7,2 (д, 1H), 7,1 (с, 1H), 4,5 (с, 2H), 2,6 (с, 3H)
Получение 5
N-(4-хлор-2-метилхинолин-6-ил)бензамид
(i) N-(4-гидрокси-2-метилхинолин-6-ил)бензамид
Названное соединение получали, используя процедуры, аналогичные описанным в пункте Получение 6 (i) ниже, но используя N-(4-аминофенил) бензамид вместо 4-йоданилина.
(ii) N-(4-хлор-2-метилхинолин-6-ил)бензамид
Соединение, указанное в заголовке, получали, используя процедуры, аналогичные описанным в пункте Получение 1 (iii) выше, но используя N-(4-гидрокси-2-метилхинолин-6-ил)бензамид (см. стадию (i) выше) вместо 6-бензилокси-4-гидрокси-2-метилхинолина.
1H ЯМР (D6-ДМСО) δ 10,6 (с, 1H), 8,7 (с, 1H), 8,2 (д, 1H), 8,0-7,5 (м, 5H), 5,6 (с, 1H), 2,6 (с, 3H)
Получение 6
1-(4-хлор-2-метилхинолин-6-ил)пирролидин-2-он
(i) 4-гидрокси-6-йод-2-метилхинолин
4-йоданилин (25 г), этилацетоацетат (17,8 г) и полифосфорную кислоту (112,5 г) в диоксане (500 мл) нагревали при кипении с обратным холодильником в течение 20 часов. Реакционную смесь разбавляли водой (2 л) и добавляли твердый карбонат натрия до тех пор, пока рН раствора не достигал величины 10,0. Полученный осадок выделяли фильтрацией, отмывали водой и высушивали в вакууме. Порошкование с простым эфиром приводило к получению обозначенного соединения (10 г) в виде белой твердой фазы.
1H ЯМР (СDСl3) δ 8,3 (с, 1H), 7,8 (д, 1H), 7,3 (д, 1H), 5,9 (с, 1H), 2,3 (с, 3H)
(ii) 4-хлор-6-йод-2-метилхинолин
4-гидрокси-6-йод-2-метилхинолин (10 г; см. стадию (i) выше) в оксихлориде фосфора (70 мл) нагревали при 80°С в течение 1 часа. Реакционную смесь затем осторожно добавляли к системе лед/вода и добавляли твердый карбонат натрия до тех пор, пока рН раствора не достигал величины 8,0. Смесь экстрагировали этилацетатом, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали. Полученную твердую фазу порошковали диэтиловым эфиром, получая названное соединение (6,4 г) в виде твердой фазы белого цвета.
1H ЯМР (СDСl3) δ 8,5 (с, 1H), 8,0 (д, 1H), 7,7 (д, 1H), 7,4 (с, 1H), 2,7 (с, 3H)
(iii) 1-(4-хлор-2-метилхинолин-6-ил)пирролидин-2-он
4-хлор-6-йод-2-метилхинолин (0,61 г; см. стадию (ii) выше). 2-пирролидинон (0,24 г), йодид меди (I) (0,038 г), фосфат калия (0,5 г) и N,N'-диметилэтилендиамин (0,035 г) в диметилформамиде (3 мл) нагревали в микроволновой печи при 100°С в течение 1 часа. Реакционную смесь разбавляли 1 н. гидроксидом натрия и экстрагировали этилацетатом, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметана и метанола. Желаемые фракции концентрировали и образец выпаривали до сухого состояния. Порошкование из простого эфира приводило к получению соединения, указанного в заголовке, в виде белого порошка (0,2 г).
1H ЯМР (СDСl3) δ 8,4 (д, 1H), 8,1 (с, 1H), 8,0 (д, 1H), 7,4 (с, 1H), 4,0 (т, 2H), 2,7 (с, 3H), 2,6 (т, 2H), 2,3 (кв., 2H)
Получение 7
2-метил-6-нитро-4-(3-фенилпирролидин-1-ил)хинолин
4-хлор-2-метил-6-нитрохинолин (0,2 г), 3-фенилпирролидин (0,14 г) и диизопропилэтиламин (0,27 мл) в 2-этоксиэтаноле (4 мл) нагревали в микроволновой печи до 200°С в течение 15 минут. Реакционную смесь разбавляли водой и экстрагировали дихлорметаном, отмывали водой, высушивали (Na2SO4), фильтровали и выпаривали, получая масло желтого цвета. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметана и этанола и аммония (200:8:1). Желаемые фракции концентрировали, получая соединение, указанное в заголовке, в виде оранжевого масла.
1H ЯМР (СDСl3) δ 9,3 (с, 1H), 8,4 (д, 1H), 8,0 (с, 1H), 7,4-7,3 (м, 5H), 6,5 (с, 1H), 4,2-3,5 (м, 5H), 2,7 (с, 3H), 2,6 (м, 1H), 2,4 (м, 1H)
Примеры
Пример 1
6-хлор-2-метил-4-(3-фенилпирролидин-1-ил)хинолин
4,6-дихлор-2-метилхинолин (0,1 г) и 3-фенилпирролидин (0,15 г) в 2-этоксиэтаноле (1,5 мл) нагревали в микроволновой печи при 240°С в течение 10 минут. Смесь разбавляли водой и экстрагировали этилацетатом, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали. Остаток очищали хроматографией на силикагеле, элюируя смесью метанола и дихлорметана. Выпаривание желаемых фракций приводило к получению соединения, указанного в заголовке, в виде твердой фазы белого цвета.
1H ЯМР (СDСl3) δ 8,1 (с, 1H), 7,8 (д, 1H), 7,5 (д, 1H), 7,4 (т, 2H), 7,3 (м, 3H), 6,4 (с, 1H), 4,0 (т, 1H), 3,9 (м, 1H), 3,8 (м, 2H), 3,5 (м, 1H), 2,6 (с, 3H), 2,4 (м, 1H), 2,3 (м, 1H)
LCMS (способ А), время удерживания 7,90 минут; (М+Н+) 323
Пример 2
6-бензилокси-2-метил-4-(3-фенилпирролидин-1-ил)хинолин
Названное соединение получали, используя процедуры, аналогичные описанным в примере 1 выше, но используя 6-бензилокси-4-хлор-2-метилхинолин (см. Получение 1 выше) вместо 4,6-дихлор-2-метилхинолина.
1H ЯМР (СDСl3) δ 8,0 (м, 1H), 7,5 (с, 1H), 7,4-7,2 (м, 11H), 6,4 (с, 1H), 5,1 (с, 2H), 3,9 (т, 1H), 3,8 (м, 1H), 3,7 (м, 2H), 3,5 (м, 1H), 2,6 (с, 3H), 2,4 (м, 1H), 2,2 (м, 1H)
LCMS (способ 7), время удерживания 8,9 минут; M+ = 396 (М+Н+)
Пример 3
2-метил-4-(3-фенилпирролидин-1-ил)-6-(пиридин-3-илметокси) хинолина гидрохлорид
Свободное основание получали, используя процедуры, аналогичные описанным в примере 1 выше, но используя 4-хлор-2-метил-6-(пиридин-3-илметокси)хинолин (см. Получение 2 выше) вместо 4,6-дихлор-2-метилхинолина. Соединение, указанное в заголовке, (соответствующую гидрохлоридную соль) получали обработкой свободного основания соляной кислотой с последующим выпариванием растворителя.
1H ЯМР (D6-ДМСО) δ 14,0 (с, 1H), 8,8 (с, 1H), 8,6 (с, 1H), 8,1 (д, 1H), 8,0 (д, 1H), 7,9 (с, 1H), 7,7 (д, 1H), 7,5 (м, 1H), 7,4 (м, 4H), 7,3 (м, 1H), 6,7 (с, 1H), 5,4 (с, 2H), 4,3 (т, 1H), 4,1 (м, 2H), 3,9 (т, 1H), 3,6 (м, 1H), 2,6 (с, 3H), 2,4 (м, 1H), 2,2 (м, 1H)
LCMS (способ B), время удерживания 6,13 минут (М+Н+) 396
Пример 4
6-(4-метансульфонилбензилокси)-2-метил-4-(3-фенилпирролидин-1-ил)хинолин
2-Метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ол (0,05 г; см. пример 42 ниже), 1-бромметил-4-метансульфонилбензол (0,08 г), карбонат цезия (0,1 г) в DMF (2 мл) нагревали в микроволновой печи при 120°С в течение 15 минут. Реакционную смесь разбавляли водой и экстрагировали с помощью дихлорметана, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали для получения масла. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметана и метанола. Выпаривание желаемых фракций приводило к получению соединения, указанного в заголовке, в виде бледно-желтой твердой фазы.
1H ЯМР (СDСl3) δ 8,0-7,8 (м, 3H), 7,6 (д, 2H), 7,5 (с, 1H), 7,4-7,2 (м, 6H), 6,5 (с, 1H), 5,2 (д, 2H), 3,9-3,6 (м, 4H), 3,5 (м, 1H), 3,0 (с, 3H), 2,6 (с, 3H), 2,4 (м, 1H), 2,2 (м, 1H)
LCMS (способ A); время удерживания 7,77 минут (М+Н+) 473
Пример 5
6-(4-метоксибензилокси)-2-метил-4-(3-фенилпирролидин-1-ил)хинолин
2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ол (0,05 г; см. пример 42 ниже) перемешивали с гидридом натрия (60% дисперсия в минеральном масле; 0,035 г) в DMF (2 мл) в течение 15 минут, после чего добавляли 4-метоксибензилбромид (0,12 г). Через 18 часов реакционную смесь разбавляли водой и экстрагировали с помощью дихлорметана, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали для получения коричневого масла. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметана и метанола. Выпаривание желаемых фракций приводило к получению соединения, указанного в заголовке, в виде кремовой твердой фазы.
1H ЯМР (СDСl3) δ 8,6 (д, 1H), 7,6 (с, 1H), 7,4-7,2 (м, 8H), 6,8 (д, 2H), 6,2 (с, 1H), 5,1 (д, 2H), 4,1 (т, 1H), 3,9 (м, 2H), 3,8 (т, 1H), 3,7 (с, 3H), 3,6 (м, 1H), 2,8 (с, 3H), 2,5 (м, 1H), 2,3 (м, 1H)
LCMS (способ A); время удерживания 8,82 минут (М+Н+) 425
Пример 6
2-метил-6-фенэтилокси-4-(3-фенилпирролидин-1-ил)хинолина гидрохлорид
Свободное основание получали, используя процедуры, аналогичные описанным в примере 5 выше, но используя (2-бромэтил)бензол вместо 4-метоксибензилбромида. Соединение, указанное в заголовке, (соответствующую гидрохлоридную соль) получали обработкой свободного основания с помощью HCl (водн.) в метаноле с последующим выпариванием растворителя.
1H ЯМР (D6-ДМСО) δ 13,8 (с, 1H), 7,9 (д, 1H), 7,8 (с, 1H), 7,6 (д, 1H), 7,4-7,2 (м, 10H), 6,7 (с, 1H), 4,4 (т, 2H), 4,4-3,8 (м, 4H), 3,6 (м, 1H), 3,1 (т, 2H), 2,6 (с, 3H), 2,5 (м, 1H), 2,2 (м, 1H)
LCMS (способ A); время удерживания 9,1 минут (М+Н+) 409
Пример 7
2-метил-6-(5-метилизоксазол-3-илметокси)-4-(3-фенилпирролидин-1-ил)хинолина гидрохлорид
Свободное основание получали, используя процедуры, аналогичные описанным в примере 5 выше, но используя 3-бромметил-5-метилизоксазол вместо 4-метоксибензил бромида. Соединение, указанное в заголовке, (соответствующую гидрохлоридную соль) получали обработкой свободного основания с помощью HCl (водн.) в метаноле с последующим выпариванием растворителя.
1H ЯМР (D6-ДМСО) δ 14,1 (с, 1H), 8,0 (д, 1H), 7,9 (с, 1H), 7,7 (д, 1H), 7,4 (м, 4H), 7,3 (т, 1H), 6,7 (с, 1H), 6,4 (с, 1H), 5,4 (с, 2H), 4,4-3,9 (м, 4H), 3,6 (м, 1H), 2,6 (с, 3H), 2,5 (м, 1H), 2,4 (с, 3H), 2,2 (м, 1H)
LCMS (способ A); время удерживания 8,0 минут (М+Н+) 400
Пример 8
4-(3-бензилпирролидин-1-ил)-2-метил-6-феноксихинолина гидрохлорид
4-хлор-2-метил-6-феноксихинолин (0,2 г; см. Получение 3 выше) и 3-бензилпирролидин (0,3 г) в 2-этоксиэтаноле (4 мл) нагревали в микроволновой печи до 200°С в течение 20 минут. Смесь разбавляли 1 н. гидроксидом натрия и экстрагировали этилацетатом, высушивали (MgSO4), фильтровали и выпаривали. Остаток очищали препаративной HPLC, нужные фракции объединяли и выпаривали для получения прозрачного масла, которое подкисляли концентрированной соляной кислотой и затем выпаривали. Порошкование простым эфиром приводило к получению соединения, указанного в заголовке, в виде белого порошка.
1H ЯМР (D6-ДМСО) δ 14,3 (с, 1H), 8,1 (д, 1H), 7,9 (с, 1H), 7,7 (д, 1H), 7,5 (т, 2H), 7,3 (т, 2H), 7,2 (м, 4H), 7,1 (д, 2H), 6,6 (с, 1H), 3,8 (м, 3H), 3,5 (м, 1H), 2,8-2,5 (м, 6H), 2,0 (м, 1H), 1,7 (м, 1H)
LCMS (способ A); время удерживания 9,02 минут (М+Н+) 395
В альтернативном получении 4-хлор-2-метил-6-феноксихинолин (1 экв.) и 3-бензилпирролидин (1 экв.) нагревали в атмосфере азота до 150-170°С в присутствии от 3 до 4 эквивалентов 2,4,6-триметилпиридина. В результате получили 4-(3-бензилпирролидин-1-ил)-2-метил-6-феноксихинолин в виде свободного основания.
Пример 9
4-[3-(4-метоксифенил)пирролидин-1-ил]-2-метил-6-феноксихинолина гидрохлорид
Соединение, указанное в заголовке, получали, используя процедуры, аналогичные описанным в примере 8 выше, но используя 3-(4-метоксифенил)пирролидин вместо 3-бензилпирролидина.
1H ЯМР (D6-ДМСО) δ 14,1 (с, 1H), 8,1 (д, 1H), 7,9 (с, 1H), 7,7 (д, 1H), 7,4 (т, 2H), 7,3 (д, 2H), 7,2 (т, 1H), 7,1 (д, 2H), 6,9 (д, 2H), 6,7 (с, 1H), 4,2 (м, 1H), 3,9 (м, 2H), 3,8 (м, 4H), 3,5 (м, 1H), 2,6 (с, 3H), 2,4 (м, 1H), 2,1 (м, 1H)
LCMS (способ B); время удерживания 8,2 минут (М+Н+) 411
Пример 10
4-[3-(4-хлорфенил)пирролидин-1-ил]-2-метил-6-феноксихинолина гидрохлорид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 8 выше, но используя 3-(4-хлорфенил)пирролидин вместо 3-бензилпирролидина.
1H ЯМР (D6-ДМСО) δ 14,2 (с, 1H), 8,1 (д, 1H), 7,9 (с, 1H), 7,7 (д, 1H), 7,4 (м, 6H), 7,2 (т, 1H), 7,1 (д, 2H), 6,7 (с, 1H), 4,2 (м, 1H), 3,9 (м, 2H), 3,8 (м, 1H), 3,5 (м, 1H), 2,6 (с, 3H), 2,4 (м, 1H), 2,1 (м, 1H)
LCMS (способ B); время удерживания 8,9 минут (М+Н+) 416
Пример 11
[1-(2-метил-6-феноксихинолин-4-ил)пирролидин-3-ил]фениламин
1-(2-метил-6-феноксихинолин-4-ил)пирролидин-3-иламин (0,107 г; см. пример 43 ниже), бромбензол (0,058 г), 2-дициклогексилфосфин-2'-диметиламинобифенил (0,023 г), трис-(дибензилиденацетон)дипалладий (0,03 г), трет-бутоксид натрия (0,044 г) и толуол (3 мл) нагревали в микроволновой печи при 150°С в течение 20 минут. Реакционную смесь разбавляли водой и экстрагировали с помощью этилацетата, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали для получения коричневого масла. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметана и метанола. Выпаривание желаемых фракций приводило к получению после порошкования простым эфиром соединения, указанного в заголовке, в виде белой твердой фазы.
1H ЯМР (СDСl3) δ 7,8 (д, 1H), 7,7 (с, 1H), 7,4-7,2 (м, 3H), 7,2 (т, 2H), 7,1 (т, 1H), 7,0 (д, 2H), 6,8 (т, 1H), 6,6 (д, 2H), 6,4 (с, 1H), 4,2 (м, 1H), 3,9 (кв., 1H), 3,8 (м, 1H), 3,6 (м, 1H), 3,4 (м, 1H), 2,6 (с, 3H), 2,3 (м, 1H), 2,1 (м, 1H)
LCMS (способ A); время удерживания 8,4 минут (М+Н+) 396
Пример 12
N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]бензамида гидрохлорид
2-метил-6-амино-4-(3-фенилпирролидин-1-ил)хинолин (0,07 г; см. пример 45 ниже), бензоилхлорид (0,035 г) и диизопропиламин (0,065 г) перемешивали в дихлорметане (3 мл). Реакционную смесь разбавляли 1 н. гидроксидом натрия и экстрагировали с помощью этилацетата, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали для получения коричневого масла. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметана и метанола. Желаемые фракции концентрировали, после чего добавляли соляную кислоту и образец выпаривали до сухого состояния. Порошкование простым эфиром приводило к получению соединения, указанного в заголовке, в виде твердой фазы белого цвета (0,03 г).
1H ЯМР (D6-ДМСО) δ 13,95 (с, 1H), 10,8 (с, 1H), 9,1 (с, 1H), 8,3 (д, 1H), 8,0 (м, 3H), 7,6 (м, 3H), 7,4 (м, 4H), 7,3 (т, 1H), 6,8 (с, 1H), 3,8-4,4 (м, 4H), 3,7 (м, 1H), 2,6 (с, 3H), 2,1 (м, 1H)
LCMS (способ B); время удерживания 7,75 минут (М+Н+) 408
Пример 13
N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]-2-фенилацетамид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 12 выше, но используя фенилацетилхлорид вместо бензоилхлорида. Кроме того, конечный продукт не превращали в гидрохлоридную соль.
1H ЯМР (СDСl3) δ 8,95 (с, 1H), 7,8 (д, 1H), 7,2-7,5 (м, 11H), 7,1 (д, 1H), 6,4 (с, 1H), 4,0 (м, 2H), 3,9 (м, 1H), 3,8 (с, 2H), 3,7 (м, 1H), 3,5 (м, 1H), 2,6 (с, 3H), 2,5 (м, 1H), 2,1 (м, 1H)
LCMS (способ A); время удерживания 8,32 минут (М+Н+) 422
Пример 14
4-хлор-N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] бензамида гидрохлорид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 12 выше, но используя 4-хлорбензоилхлорид вместо бензоилхлорида.
1H ЯМР (D6-ДМСО) δ 10,6 (с, 1H), 9,1 (с, 1H), 8,3 (д, 1H), 8,1 (д, 2H), 7,9 (д, 1H), 7,6 (д, 2H), 7,4 (м, 4H), 7,3 (т, 1H), 6,7 (с, 1H), 4,4 (м, 1H), 4,1 (м, 2H), 4,0 (т, 1H), 3,7 (м, 1H), 2,6 (с, 3H), 2,5 (м, 1H), 2,2 (м, 1H)
LCMS (способ B); время удерживания 8,50 минут (М+Н+) 442
Пример 15
4-метокси-N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] бензамид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 12 выше, но используя 4-метоксибензоилхлорид вместо бензоилхлорида. Конечный продукт выделяли в виде свободного основания.
1H ЯМР (D6-ДМСО) δ 10,6 (с, 1H), 8,8 (с, 1H), 8,0 (м, 3H), 7,7 (д, 1H), 7,4 (м, 4H), 7,3 (т, 1H), 7,1 (д, 2H), 6,5 (с, 1H), 4,0 (м, 2H), 3,9 (с, 3H), 3,7 (м, 2H), 3,5 (м, 1H), 2,3 (с, 3H), 2,4 (м, 1H), 2,2 (м, 1H)
LCMS (способ A); время удерживания 8,30 минут (М+Н+) 438
Пример 16
2-метил-N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] бензамид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 12 выше, но используя 2-метилбензоилхлорид вместо бензоилхлорида. Конечный продукт выделяли в виде свободного основания.
1H ЯМР (D6-ДМСО) δ 10,5 (с, 1H), 8,0 (д, 1H), 7,7 (д, 1H), 7,5 (д, 1H), 7,4-7,2 (м, 9H), 6,5 (с, 1H), 3,9 (м, 2H), 3,8 (м, 2H), 3,5 (м, 1H), 2,6 (с, 3H), 2,3 (м, 4H), 2,2 (м, 1H)
LCMS (способ B); время удерживания 8,14 минут (М+Н+) 422
Пример 17
[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид пиразин-2-карбоновой кислоты гидрохлорид
2-метил-6-амино-4-(3-фенилпирролидин-1-ил)хинолин (0,07 г; см. пример 45 ниже), 2-пиразинкарбоновую кислоту (0,037 г), HATU (0,113 г) и диизопропиламин (0,116 г) перемешивали в N,N-диметилформамиде (4 мл) в течение 15 часов. Реакционную смесь разбавляли 1 н. гидроксидом натрия и экстрагировали этилацетатом, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали для получения коричневого масла. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметана и метанола. Желаемые фракции концентрировали, после чего добавляли соляную кислоту и образец выпаривали до сухого состояния. Порошкование простым эфиром приводило к получению соединения, указанного в заголовке, в виде твердой фазы белого цвета (0,045 г).
1H ЯМР (D6-ДМСО) δ 11,0 (с, 1H), 9,4 (с, 1H), 8,95 (м, 2H), 8,9 (с, 1H), 8,1 (д, 1H), 7,7 (д, 1H), 7,4 (м, 4H), 7,3 (т, 1H), 6,5 (с, 1H), 4,0 (м, 2H), 3,8 (м, 2H), 3,6 (м, 1H), 2,5 (с, 3H), 2,4 (м, 1H), 2,1 (м, 1H)
LCMS (способ A); время удерживания 7,39 минут (М+Н+) 410
Пример 18
[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид 1H-пиразол-4-карбоновой кислоты гидрохлорид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 17 выше, но используя 4-пиразолкарбоновую кислоту вместо 2-пиразинкарбоновой кислоты.
1H ЯМР (D6-ДМСО) δ 13,8 (с, 1H), 10,3 (с, 1H), 9,2 (с, 1H), 8,3 (с, 1H), 8,2 (д, 1H), 7,9 (д, 1H), 7,4 (м, 4H), 7,3 (т, 1H), 6,6 (с, 1H), 4,4 (м, 1H), 4,2 (м, 2H), 4,0 (м, 2H), 3,6 (м, 1H), 2,6 (с, 3H), 2,5 (м, 1H), 2,2 (м, 1H)
LCMS (способ B); время удерживания 6,40 минут (М+Н+) 398
Пример 19
[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид фуран-2-карбоновой кислоты гидрохлорид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 17 выше, но используя 2-фуранкарбоновую кислоту вместо 2-пиразинкарбоновой кислоты.
1H ЯМР (D6-ДМСО) δ 13,7 (с, 1H), 10,6 (с, 1H), 9,2 (с, 1H), 8,5 (с, 1H), 8,2 (д, 1H), 7,9 (д, 1H), 7,8 (с, 1H), 7,4 (м, 4H), 7,3 (т, 1H), 7,1 (с, 1H), 6,7 (с, 1H), 4,4-3,8 (м, 4H), 3,7 (м, 1H), 2,6 (с, 3H), 2,5 (м, 1H), 2,2 (м, 1H)
LCMS (способ A); время удерживания 7,64 минут (М+Н+) 398
Пример 20
N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] никотинамида гидрохлорид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 17 выше, но используя никотиновую кислоту вместо 2-пиразинкарбоновой кислоты.
1H ЯМР (D6-ДМСО) δ 14,0 (с, 1H), 11,1 (с, 1H), 9,3 (с, 1H), 9,2 (с, 1H), 8,8 (д, 1H), 8,5 (д, 1H), 8,3 (д, 1H), 8,0 (д, 1H), 7,7 (м, 1H), 7,4 (м, 4H), 7,3 (т, 1H), 6,8 (с, 1H), 4,4-3,8 (м, 4H), 2,6 (с, 3H), 2,5 (м, 1H), 2,2 (м, 1H)
LCMS (способ B); время удерживания 6,74 минут (М+Н+) 409
Пример 21
[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид 3-метил-3Н-имидазол-4-карбоновой кислоты гидрохлорид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 17 выше, но используя 1-метил-5-имидазолкарбоновую кислоту вместо 2-пиразинкарбоновой кислоты.
1H ЯМР (D6-ДМСО) δ 13,8 (с, 1H), 10,5 (с, 1H), 9,0 (с, 1H), 8,2 (д, 1H), 7,8 (м, 3H), 7,5-7,4 (м, 4H), 7,4 (т, 1H), 6,6 (с, 1H), 4,4-3,8 (м, 4H), 3,8 (с, 3H), 3,6 (м, 1H), 2,6 (с, 3H), 2,5 (м, 1H), 2,2 (м, 1H)
LCMS (способ B); время удерживания 5,63 минут (М+Н+) 412
Пример 22
[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид 5-метил-1Н-пиразол-3-карбоновой кислоты гидрохлорид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 17 выше, но используя 5-метил-3-пиразолкарбоновую кислоту вместо 2-пиразинкарбоновой кислоты.
1H ЯМР (D6-ДМСО) δ 13,8 (с, 1H), 10,6 (с, 1H), 9,1 (с, 1H), 8,4 (д, 1H), 7,9 (д, 1H), 7,5-7,4 (м, 4H), 7,3 (т, 1H), 6,7 (с, 1H), 6,6 (с, 1H), 4,4-3,4 (м, 5H), 2,6 (с, 3H), 2,5 (м, 1H), 2,3 (м, 4H)
LCMS (способ B); время удерживания 7,19 минут (М+Н+) 412
Пример 23
[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид пиридазин-4-карбоновой кислоты гидрохлорид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 17 выше, но используя пиридазин-4-карбоновую кислоту вместо 2-пиразинкарбоновой кислоты.
1H ЯМР (D6-ДМСО) δ 13,8 (с, 1H), 11,4 (с, 1H), 9,7 (с, 1H), 9,5 (с, 1H), 9,2 (с, 1H), 8,4 (д, 1H), 8,2 (с, 1H), 8,0 (д, 1H), 7,5-7,4 (м, 4H), 7,3 (т, 1H), 6,8 (с, 1H), 4,4-3,8 (м, 4H), 3,6 (м, 1H), 2,6 (с, 3H), 2,2 (м, 1H)
LCMS (способ B); время удерживания 6,52 минут (М+Н+) 410
Пример 24
2-(4-метоксифенил)-N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]ацетамид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 17 выше, но используя 4-метоксифенилуксусную кислоту вместо 2-пиразинкарбоновой кислоты.
1H ЯМР (СDСl3) δ 10,4 (с, 1H), 8,8 (с, 1H), 7,6 (м, 3H), 7,4-7,2 (м, 6H), 6,8 (д, 2H), 6,5 (с, 1H), 3,9 (м, 2H), 3,7 (м, 5H), 3,5 (м, 3H), 2,6 (с, 3H), 2,5 (м, 1H), 2,1 (м, 1H)
LCMS (способ A); время удерживания 8,15 минут (М+Н+) 452
Пример 25
2-(4-[хлорфенил)-N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]ацетамид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 17 выше, но используя 4-хлорфенилуксусную кислоту вместо 2-пиразинкарбоновой кислоты.
1H ЯМР (СDСl3) δ 10,4 (с, 1H), 8,7 (с, 1H), 7,7 (с, 2H), 7,4-7,3 (м, 8H), 7,3 (т, 1H), 6,5 (с, 1H), 3,9 (м, 2H), 3,7 (м, 4H), 3,5 (м, 1H), 2,6 (с, 3H), 2,4 (м, 1H), 2,1 (м, 1H)
LCMS (способ A); время удерживания 8,73 минут (М+Н+) 456
Пример 26
[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид 3,5-диметилизоксазол-4-карбоновой кислоты гидрохлорид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 17 выше, но используя 3,5-диметилизоксазол-4-карбоновую кислоту вместо 2-пиразинкарбоновой кислоты.
1H ЯМР (D6-ДМСО) δ 13,5 (с, 1H), 10,5 (с, 1H), 9,0 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 7,4-7,3 (м, 4H), 7,3 (т, 1H), 6,7 (с, 1H), 4,3 (м, 1H), 4,1 (м, 2H), 3,9 (м, 1H), 3,6 (м, 1H), 2,6 (с, 3H), 2,5 (с, 3H), 2,4 (с, 3H), 2,3 (м, 1H)
LCMS (способ B); время удерживания 7,42 минут (М+Н+) 427
Пример 27
2-(3-метилизоксазол-5-ил)-N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]ацетамида гидрохлорид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 17 выше, но используя 3-метил-5-изоксазолуксусную кислоту вместо 2-пиразинкарбоновой кислоты.
1H ЯМР (D6-ДМСО) δ 13,7 (с, 1H), 10,9 (с, 1H), 9,0 (с, 1H), 8,1 (д, 1H), 7,9 (д, 1H), 7,4-7,3 (м, 4H), 7,3 (т, 1H), 6,7 (с, 1H), 6,3 (с, 1H), 4,3 (м, 1H), 4,1 (м, 2H), 4,0 (с, 2H), 3,9 (м, 1H), 3,6 (м, 1H), 2,6 (с, 3H), 2,2 (м, 4H)
LCMS (способ A); время удерживания 7,30 минут (М+Н+) 427
Пример 28
N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] бензолсульфонамида гидрохлорид
2-метил-6-амино-4-(3-фенилпирролидин-1-ил)хинолин (0,07 г; см. пример 45 ниже), бензолсульфонилхлорид (0,041 г) и пиридин (0,04 г) перемешивали в дихлорметане (4 мл). Реакционную смесь разбавляли 1 н. гидроксидом натрия и экстрагировали этилацетатом, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали для получения коричневого масла. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметана и метанола. Желаемые фракции концентрировали, добавляли соляную кислоту и образец выпаривали до сухого состояния. Порошкование простым эфиром приводило к получению соединения, указанного в заголовке, в виде твердой фазы белого цвета (0,035 г).
1H ЯМР (D6-ДМСО) δ 10,5 (с, 1H), 7,8 (с, 1H), 7,7 (д, 2H), 7,6 (д, 1H), 7,5 (т, 1H), 7,4-7,3 (м, 9H), 6,5 (с, 1H), 3,8-3,4 (м, 5H), 2,4 (с, 3H), 2,4 (м, 1H), 2,1 (м, 1H)
LCMS (способ B); время удерживания 7,53 минут (М+Н+) 444
Пример 29
Бензил-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амин
Бензил-(4-хлор-2-метилхинолин-6-ил)амин (0,041 г; см. Получение 4 выше) и 3-фенилпирролидин в 2-этоксиэтаноле (1 мл) нагревали в микроволновой печи до 240°С в течение 10 минут. Реакционную смесь разбавляли водой и экстрагировали этилацетатом, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметана и метанола. Желаемые фракции концентрировали, и образец выпаривали до сухого состояния. Порошкование простым эфиром приводило к получению соединения, указанного в заголовке.
1H ЯМР (СDСl3) δ 7,8 (д, 1H), 7,4-7,2 (м, 11H), 7,1 (д, 1H), 7,0 (с, 1H), 6,4 (с, 1H), 4,4 (с, 2H), 3,7 (т, 1H), 3,6-3,3 (м, 4H), 2,6 (с, 3H), 2,3 (м, 1H), 2,1 (м, 1H)
LCMS (способ A); время удерживания 8,9 минут (М+Н+) 394
Пример 30
(R- или S-)бензил-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амин
Бензил-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амин (см. Пример 29 выше) очищали хиральной HPLC, элюируя градиентом раствора ацетонитрил/вода, содержащим 0,1% муравьиную кислоту. Названное в заголовке соединение примера 30 элюировалось с колонки первым. Растворитель удаляли из соответствующих образцов для получения отделенного энантиомера в виде желтого порошка.
1H ЯМР (СDСl3) δ 7,8 (д, 1H), 7,4-7,2 (м, 11H), 7,1 (д, 1H), 7,0 (с, 1H), 6,4 (с, 1H), 4,4 (с, 2H), 3,7 (т, 1H), 3,6-3,3 (м, 4H), 2,6 (с, 3H), 2,3 (м, 1H), 2,1 (м, 1H)
LCMS (способ A); время удерживания 8,6 минут (М+Н+) 394
Пример 31
(S- или R-)бензил-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амин
Названное соединение примера 31 получали согласно процедуре, приведенной в примере 30 выше, и это соединение элюировалось с колонки вторым. Растворитель удаляли из соответствующих образцов для получения отделенного энантиомера в виде желтого порошка.
1H ЯМР (СDСl3) δ 7,9 (д, 1H), 7,4-7,2 (м, 11H), 7,1 (д, 1H), 7,0 (с, 1H), 6,4 (с, 1H), 4,4 (с, 2H), 3,7 (т, 1H), 3,6-3,3 (м, 4H), 2,6 (с, 3H), 2,3 (м, 1H), 2,1 (м, 1H)
LCMS (способ A); время удерживания 8,8 минут (М+Н+) 394
Пример 32
(4-метоксибензил)-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амин
2-Метил-6-амино-4-(3-фенилпирролидин-1-ил)хинолин (0,08 г; см. пример 45 ниже), 4-метоксибензальдегид (0,071 г), триацетоксиборгидрид натрия (0,165 г) и уксусную кислоту (0,05 мл) в 1,2-дихлорэтане (5 мл) нагревали при кипении с обратным холодильником в течение 4 часов. Реакционную смесь разбавляли 1 н. гидроксидом натрия и экстрагировали этилацетатом, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметана и метанола. Желаемые фракции концентрировали, и образец выпаривали до сухого состояния. Порошкование с простым эфиром приводило к получению соединения, указанного в заголовке, в виде белого порошка (0,01 г).
1H ЯМР (СDСl3) δ 7,8 (д, 1H), 7,4-7,2 (м, 7H), 7,1 (д, 2H), 6,8 (д, 2H), 6,4 (с, 1H), 4,4 (с, 2H), 3,8 (м, 1H), 3,7 (с, 3H), 3,7-3,4 (м, 4H), 2,6 (с, 3H), 2,3 (м, 1H), 2,1 (м, 1H)
LCMS (способ B); время удерживания 8,42 минут (М+Н+) 424
Пример 33
4-{[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-иламино] метил}бензонитрил
Названное соединение получали, используя процедуры, аналогичные описанным в примере 32 выше, но используя 4-цианобензальдегид вместо 2-пиразинкарбоновой кислоты.
1H ЯМР (D6-ДМСО) δ 7,6-7,5 (м, 4H), 7,4 (т, 2H), 7,3-7,2 (м, 3H), 7,1 (д, 1H), 6,7 (с, 1H), 6,6 (т, 1H), 6,4 (с, 1H), 4,4 (м, 2H), 3,6-3,2 (5H), 2,4 (с, 3H), 2,2 (м, 1H), 2,1 (м, 1H)
LCMS (способ A); время удерживания 8,23 минут (М+Н+) 419
Пример 34
1-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил] пирролидин-2-он
Смесь 1-(4-хлор-2-метилхинолин-6-ил)пирролидин-2-она (0,2 г; см. получение 6 выше) и 3-фенилпирролидина (0,282 г) в 2-этоксиэтаноле нагревали в микроволновой печи при 250°С в течение 20 минут. Реакционную смесь разбавляли 1 н. гидроксидом натрия и экстрагировали этилацетатом, отмывали водой, высушивали (MgSO4), фильтровали и выпаривали. Порошкование с простым эфиром давало соединение, указанное в заголовке, в виде белого порошка (0,08 г).
1H ЯМР (D6-ДМСО) δ 8,6 (с, 1H), 7,8 (д, 1H), 7,7 (д, 1H), 7,4-7,3 (м, 4H), 7,2 (т, 1H), 6,5 (с, 1H), 3,9 (м, 4H), 3,7 (т, 2H), 3,5 (м, 1H), 2,5 (м, 1H), 2,4 (м, 1H), 2,1 (м, 1H)
LCMS (способ B); время удерживания 6,7 минут (М+Н+) 372
Пример 35
N-[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]-3-фенилпропионамид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 12 выше, но используя 3-фенилпропионилхлорид вместо бензоилхлорида. Конечный продукт выделяли в виде свободного основания.
1H ЯМР (D6-ДМСО) δ 10,4 (с, 1H), 10,1 (с, 1H), 8,7 (с, 1H), 7,7 (с, 2H), 7,4-7,1 (м, 9H), 6,5 (с, 1H), 3,9 (м, 1H), 3,7 (м, 2H), 3,5 (м, 1H), 2,8 (т, 2H), 2,6 (т, 2H), 2,5 (с, 3H), 2,4 (м, 1H), 2,2 (м, 1H)
LCMS (способ B); время удерживания 8,18 минут (М+Н+) 436
Пример 36
[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид 5-метилизоксазол-3-карбоновой кислоты
Названное соединение получали, используя процедуры, аналогичные описанным в примере 17 выше, но используя 5-метил-3-изоксазолкарбоновую кислоту вместо 2-пиразинкарбоновой кислоты. Конечный продукт выделяли в виде свободного основания.
1H ЯМР (D6-ДМСО) δ 10,7 (с, 1H), 8,8 (с, 1H), 8,0 (д, 1H), 7,7 (д, 1H), 7,5-7,3 (м, 4H), 7,3 (м, 1H), 6,7 (с, 1H), 6,5 (с, 1H), 3,9 (м, 2H), 3,7 (т, 2H), 3,5 (м, 1H), 2,5 (м, 6H), 2,4 (м, 1H), 2,2 (м, 1H)
LCMS (способ A); время удерживания 7,90 минут (М+Н+) 413
Пример 37
[2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ил]амид пиридин-2-карбоновой кислоты гидрохлорид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 17 выше, но используя пиридин-2-карбоновую кислоту вместо 2-пиразинкарбоновой кислоты.
1H ЯМР (D6-ДМСО) δ 14,0 (с, 1H), 11,3 (с, 1H), 9,2 (с, 1H), 8,9 (д, 1H), 8,5 (д, 1H), 8,2 (д, 1H), 8,1 (т, 1H), 8,0 (д, 1H), 7,7 (м, 1H), 7,5-7,4 (м, 4H), 7,3 (т, 1H), 6,7 (с, 1H), 4,4-4,0 (м, 4H), 3,6 (м, 1H), 2,6 (с, 3H), 2,2 (м, 1H)
LCMS (способ A); время удерживания 7,95 минут (М+Н+) 409
Пример 38
N-[4-(3-бензилпирролидин-1-ил)-2-метилхинолин-6-ил]бензамид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 1 выше, но используя N-(4-хлор-2-метилхинолин-6-ил)бензамид (см. получение 5 выше) вместо 4,6-дихлор-2-метилхинолина и 3-бензилпирролидин вместо 3-фенилпирролидина.
1H ЯМР (D6-ДМСО) δ 10,5 (с, 1H), 8,9 (с, 1H), 8,0 (м, 2H), 7,9 (д, 1H), 7,7 (д, 1H), 7,5-7,4 (м, 3H), 7,3 (м, 4H), 7,2 (м, 1H), 6,4 (с, 1H), 3,8 (м, 3H), 3,5 (т, 1H), 2,8 (м, 2H), 2,5 (м, 1H), 2,4 (с, 3H), 2,1 (м, 1H), 1,7 (м, 1H)
LCMS (способ B); время удерживания 8,19 минут (М+Н+) 422
В альтернативном получении названное соединение получали нагревом N-(4-хлор-2-метилхинолин-6-ил) бензамида (1 экв.) и 3-бензилпирролидина (1 экв.) вместе в атмосфере азота до 150-170°С в присутствии 3-4 эквивалентов 2,4,6-триметилпиридина.
Пример 39
2-метил-6-фенокси-4-(3-фенилпирролидин-1-ил)хинолина гидрохлорид
Названное соединение получали, используя процедуры, аналогичные описанным в примере 8 выше, но используя 3-фенилпирролидин вместо 3-бензилпирролидина.
1H ЯМР (D6-ДМСО) δ 14,0 (с, 1H), 8,0 (д, 1H), 7,9 (с, 1H), 7,7 (д, 1H), 7,4-7,2 (м, 7H), 7,2 (т, 1H), 7,1 (д, 2H), 6,7 (с, 1H), 4,2 (м, 1H), 3,9 (м, 2H), 3,8 (м, 1H), 3,5 (м, 1H), 2,7 (с, 3H), 2,5 (м, 1H), 2,1 (м, 1H)
LCMS (способ B); время удерживания 8,7 минут (М+Н+) 381
Пример 40
Форму свободного основания названного соединения примера 8 подвергали аналитической хиральной HPLC в следующих условиях.
Колонка: ChiralpakТМ IB с размером частиц 5 мкм размером 250×4,6 мм
Подвижная фаза: гептан/изопропанол/диэтиламин 70/30/0,1
Скорость потока: 1 мл/мин
Детекция: UV 250 нм
Температура: 25°С
С помощью аналитической HPLC выявили два основных продукта:
(а) время удерживания 7,59 минут (49,63% всей площади под кривой); и
(b) время удерживания 12,94 минут (50,30% всей площади под кривой).
Используя эту информацию, 100 мг формы свободного основания соединения, указанного в заголовке примера 8, подвергали препаративной HPLC в следующих условиях.
Колонка: ChiralpakТМ IB 5 мкм размером 250×20 мм
Подвижная фаза: гептан/изопропанол/диэтиламин 70/30/0,1
Скорость потока: 20 мл/мин
Детекция: UV 250 нм
Температура: 25°С
Продукты, элюирующиеся первым и вторым (энантиомеры) собирали раздельно, получая:
(а) 40,5 мг элюирующегося первым энантиомера (время удерживания 7,6 минут); и
(b) 41,4 мг элюирующегося вторым энантиомера (время удерживания 12,9 минут).
(а) 4-((R- или S-)-3-бензилпирролидин-1-ил)-2-метил-6-феноксихинолин
Энантиомер, элюирующийся первым.
Анализ этого продукта с помощью аналитической HPLC (в условиях, подходящих для аналитической хиральной HPLC, указанных выше) показал следующее:
Продукт: время удерживания 7,51 минут (99,96% общей площади под кривой).
Минорная примесь: время удерживания 6,48 минут (0,03% общей площади под кривой).
Рассчитанный энантиомерный избыток >99,5%.
1H ЯМР: спектр, идентичный рацемату (см. пример 8 выше).
(b) 4-((S- или R-)-3-бензилпирролидин-1-ил)-2-метил-6-феноксихинолин
Энантиомер, элюирующийся первым.
Анализ этого продукта с помощью аналитической HPLC (в условиях, подходящих для аналитической хиральной HPLC, указанных выше) показал следующее:
Продукт: время удерживания 12,86 минут (99,95% общей площади под кривой);
Минорная примесь: время удерживания 7,18 минут (0,05% общей площади под кривой).
Рассчитанный энантиомерный избыток >99,5%;
1H ЯМР: спектр, идентичный рацемату (см. пример 8 выше).
Пример 41
Форму свободного основания соединения, указанного в заголовке, примера 9 подвергали аналитической хиральной HPLC в следующих условиях.
Колонка: ChiralpakТМ IА 5 мкм размером 250×4,6 мм
Подвижная фаза: гептан/изопропанол/этилендиамин 70/30/0,1
Скорость потока: 1 мл/мин
Детекция: UV 280 нм
Температура: 25°С
С помощью аналитической HPLC выявили два основных продукта:
(а) время удерживания 8,63 минут (50,58% всей площади под кривой); и
(b) время удерживания 10,42 минут (49,42% всей площади под кривой).
Используя эту информацию, 100 мг формы свободного основания соединения, указанного в заголовке примера 9, подвергали препаративной HPLC в следующих условиях.
Колонка: ChiralpakТМ AD-H 5 мкм размером 250×30 мм
Подвижная фаза: гептан/изопропанол/диэтиламин 70/30/0,1
Скорость потока: 42,5 мл/мин
Детекция: UV 250 нм
Температура: 25°С
Продукты, элюирующиеся первым и вторым (энантиомеры) собирали раздельно, получая:
(а) 50,1 мг энантиомера, элюирующегося первым (время удерживания 8,6 минут); и
(b) 50,3 мг энантиомера, элюирующегося вторым (время удерживания 10,4 минут).
(a) 4-[(R- или S-)-3-(4-метоксифенил)пирролидин-1-ил]-2-метил-6-феноксихинолин
Энантиомер, элюирующийся первым.
Анализ этого продукта с помощью аналитической HPLC (в условиях, подходящих для аналитической хиральной HPLC, указанных выше) показал следующее:
Продукт: время удерживания 8,50 минут (100,00% общей площади под кривой).
Рассчитанный энантиомерный избыток >99,5%;
1H ЯМР: спектр, идентичный рацемату (см. пример 9 выше).
(b) 4-[(S- или R-)-3-(4-метоксифенил)пирролидин-1-ил]-2-метил-6-феноксихинолин
Энантиомер, элюирующийся вторым.
Анализ этого продукта с помощью аналитической HPLC (в условиях, подходящих для аналитической хиральной HPLC, указанных выше) показал следующее:
Продукт: время удерживания 10,38 минут (100,00% общей площади под кривой).
Рассчитанный энантиомерный избыток >99,5%;
1H ЯМР: спектр, идентичный рацемату (см. пример 9 выше).
Пример 42
Форму свободного основания соединения, указанного в заголовке примера 22, подвергали аналитической хиральной HPLC в следующих условиях.
Колонка: ChiralpakТМ IА 5 мкм размером 250×4,6 мм
Подвижная фаза: гептан/этанол/этилендиамин 70/30/0,1
Скорость потока: 1 мл/мин
Детекция: UV 280 нм
Температура: 25°С
С помощью аналитической HPLC выявили два основных продукта:
(а) время удерживания 10,47 минут (50,20% всей площади под кривой); и
(b) время удерживания 14,15 минут (49,80% всей площади под кривой).
Используя эту информацию, 100 мг формы свободного основания соединения, указанного в заголовке примера 22, подвергали препаративной HPLC в следующих условиях.
Колонка: ChiralpakТМ IА 5 мкм размером 250×20 мм
Подвижная фаза: гептан/этанол/диэтиламин 80/20/0,1
Скорость потока: 20 мл/мин
Детекция: UV 290 нм
Температура: 25°С
Продукты, элюирующиеся первым и вторым (энантиомеры) собирали раздельно, получая:
(а) 52,1 мг энантиомера, элюирующегося первым (время удерживания 10,5 минут); и
(b) 44,0 мг энантиомера, элюирующегося вторым (время удерживания 14,1 минут).
(а) [2-метил-4-((R- или S-)-3-фенилпирролидин-1-ил)хинолин-6-ил]амид 5-метил-1Н-пиразол-3-карбоновой кислоты
Энантиомер, элюирующийся первым.
Анализ этого продукта с помощью аналитической HPLC (в условиях, подходящих для аналитической хиральной HPLC, указанных выше) показал следующее:
Продукт: время удерживания 10,44 минут (99,95% общей площади под кривой);
Минорная примесь: время удерживания 14,30 минут (0,05% общей площади под кривой).
Рассчитанный энантиомерный избыток >99,5%;
1H ЯМР: спектр, идентичный рацемату (см. пример 22 выше).
(b) [2-метил-4-((S- или R-)-3-фенилпирролидин-1-ил)хинолин-6-ил]амид 5-метил-1Н-пиразол-3-карбоновой кислоты
Энантиомер, элюирующийся вторым.
Анализ этого продукта с помощью аналитической HPLC (в условиях, подходящих для аналитической хиральной HPLC, указанных выше) показал следующее:
Продукт: время удерживания 14,04 минут (99,95% общей площади под кривой);
Минорная примесь: время удерживания 10,62 минут (0,05% общей площади под кривой).
Рассчитанный энантиомерный избыток >99,5%;
1H ЯМР: спектр, идентичный рацемату (см. пример 22 выше).
Пример 43
Соединение, указанное в заголовке примера 38, подвергали аналитической хиральной HPLC в следующих условиях.
Колонка: ChiralpakТМ IС 5 мкм размером 250×4,6 мм
Подвижная фаза: гептан/изопропанол/этилендиамин 75/25/0,1
Скорость потока: 1 мл/мин
Детекция: UV 280 нм
Температура: 25°С
Посредством аналитической HPLC выявили два основных продукта:
(а) время удерживания 14,28 минут (49,52% всей площади под кривой); и
(b) время удерживания 17,56 минут (50,48% всей площади под кривой).
Используя эту информацию, 100 мг соединения, указанного в заголовке примера 38, подвергали препаративной HPLC в следующих условиях.
Колонка: ChiralpakТМ IС 5 мкм размером 250×50 мм
Подвижная фаза: гептан/изопропанол/диэтиламин 75/25/0,1
Скорость потока: 100 мл/мин
Детекция: UV 250 нм
Температура: 25°С
Продукты, элюирующиеся первым и вторым (энантиомеры) собирали раздельно, получая:
(а) 44,8 мг энантиомера, элюирующегося первым (время удерживания 14,3 минут); и
(b) 43,4 мг энантиомера, элюирующегося вторым (время удерживания 17,6 минут).
(а) N-[4-((R- или S-)-3-бензилпирролидин-1-ил)-2-метилхинолин-6-ил]бензамид
Энантиомер, элюирующийся первым.
Анализ этого продукта с помощью аналитической HPLC (в условиях, подходящих для аналитической хиральной HPLC, указанных выше) показал следующее:
Продукт: время удерживания 14,16 минут (100,00% общей площади под кривой).
Рассчитанный энантиомерный избыток >99,5%;
1H ЯМР: спектр, идентичный рацемату (см. пример 38 выше).
(b) N-[4-((S- или R-)-3-бензилпирролидин-1-ил)-2-метилхинолин-6-ил]бензамид
Энантиомер, элюирующийся вторым.
Анализ этого продукта с помощью аналитической HPLC (в условиях, подходящих для аналитической хиральной HPLC, указанных выше) показал следующее:
Продукт: время удерживания 17,52 минут (99,85% общей площади под кривой);
Минорная примесь: время удерживания 14,40 минут (0,15% общей площади под кривой).
Рассчитанный энантиомерный избыток >99,5%;
1H ЯМР: спектр, идентичный рацемату (см. пример 38 выше).
Пример 44
2-метил-4-(3-фенилпирролидин-1-ил)хинолин-6-ол
6-бензилокси-2-метил-4-(3-фенилпирролидин-1-ил)хинолин (0,3 г; см. пример 2 выше) и палладий на углероде (10%; 0,2 г) в этаноле (8 мл) перемешивали в атмосфере водорода в течение 3 часов. Смесь фильтровали и затем концентрировали для получения соединения, указанного в заголовке, в виде желтого масла, которое использовали без дополнительной очистки.
Пример 45
1-(2-метил-6-феноксихинолин-4-ил)пирролидин-3-иламин
(i) Сложный трет-бутиловый эфир [1-(2-метил-6-феноксихинолин-4-ил)-пирролидин-3-ил] карбаминовой кислоты
Названное соединение получали, используя процедуры, аналогичные описанным в примере 8 выше, но используя 3-(трет-бутилоксикарбониламино)пирролидин вместо 3-бензилпирролидина. Продукт использовали непосредственно на следующей стадии.
(ii) 1-(2-метил-6-феноксихинолин-4-ил)пирролидин-3-иламин
Продукт со стадии (i) выше обрабатывали трифторуксусной кислотой в дихлорметане (1:1) для получения после выпаривания соединения, указанного в заголовке, в виде оранжевого масла, которое использовали без дополнительной очистки.
Пример 46
2-метил-6-амино-4-(3-фенилпирролидин-1-ил)хинолин
2-Метил-6-нитро-4-(3-фенилпирролидин-1-ил)хинолин (0,29 г; см. получение 7 выше) и палладий на углероде (10%; 0,2 г) в этаноле (10 мл) и дихлорметане (4 мл) перемешивали в атмосфере водорода в течение 3 часов. Реакционную смесь фильтровали и концентрировали для получения соединения, указанного в заголовке, в виде вязкого желтого масла, которое использовали без дополнительной очистки.
Пример 47
Было обнаружено, что соединения примеров с 1 по 46 выше обладают активностью в биологических испытаниях, описанных выше. Определяемая биологическая активность включала величину log уничтожения при 20, 10 или 5 мкг/мл испытываемого соединения выше 0,5 (например, выше 3) в отношении бактерий в log фазе, стационарной фазе и/или персистирующих бактерий видов Staph. аureus, метициллин-резистентных Staph. aureus (MRSA), коагулазо-негативного стафилококка(CNS), Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus agalactiae, Enterococcus, E. Coli, Candida albicans, Propionibacterium acnes и Mycobacterium tuberculosis.
В действительности следующие соединения обладали указанной активностью.
(а) У соединения примера 6 при испытании против бактерий Staph. аureus в стационарной фазе при концентрации испытываемого соединения 5 мкг/мл наблюдалась величина log уничтожения, равная 6,16.
(b) У соединения примера 8 при испытании в концентрации испытываемого соединения 10 мкг/мл наблюдались:
(i) величина log уничтожения 6,34 в отношении бактерий метициллин-резистентного Staph. аureus в стационарной фазе;
(ii) величина log уничтожения 0,97 в отношении бактерий Streptococcus agalactiae в стационарной фазе;
(iii) величина log уничтожения 3,70 в отношении Candida albicans в стационарной фазе; и
(iv) величина log уничтожения 5,76 и 2,26 в отношении Mycobacterium tuberculosis, соответственно, в стационарной фазе и персистирующих.
(с) У соединения примера 9 при испытании против бактерий Streptococcus pyogenes в стационарной фазе при концентрации испытываемого соединения 20 мкг/мл наблюдалась величина log уничтожения, равная 6,42.
(d) У соединения примера 22 при испытании в концентрации испытываемого соединения 5 мкг/мл наблюдались:
(i) величина log уничтожения 5,99 в отношении коагулазонегативного стафилококка в стационарной фазе; и
(ii) величина log уничтожения 3,22 в отношении бактерий Enterococcus в стационарной фазе.
(e) У соединения примера 39 при испытании в концентрации испытываемого соединения 10 мкг/мл наблюдались:
(i) величина log уничтожения 7,32 в отношении бактерий Streptococcus pneumoniae в стационарной фазе;
(ii) величина log уничтожения 6,80 в отношении бактерий E. coli К12 в стационарной фазе; и
(iii) величина log уничтожения 6,34 в отношении бактерий Propionibacterium acnes в стационарной фазе.
(f) У обоих энантиомеров примера 40, а также обоих энантиомеров примера 43 при испытании в концентрации испытываемого соединения 20 мкг/мл наблюдались:
(i) величина log уничтожения 6,26 в отношении бактерий Staph. аureus в стационарной фазе;
(ii) величина log уничтожения 6,22 в отношении бактерий MRSA в стационарной фазе; и
(iii) величина log уничтожения 6,27 в отношении Candida albicans в стационарной фазе.
(g) У обоих энантиомеров примера 41, а также обоих энантиомеров примера 42 при испытании в концентрации испытываемого соединения 5 мкг/мл наблюдались:
(i) величина log уничтожения 6,26 в отношении бактерий Staph. аureus в стационарной фазе; и
(ii) величина log уничтожения 6,22 в отношении бактерий MRSA в стационарной фазе.
Список сокращений
|
Префиксы н-, втор-, изо-, трет- имеют обычные для них значения: нормальный, вторичный, изо и третичный.