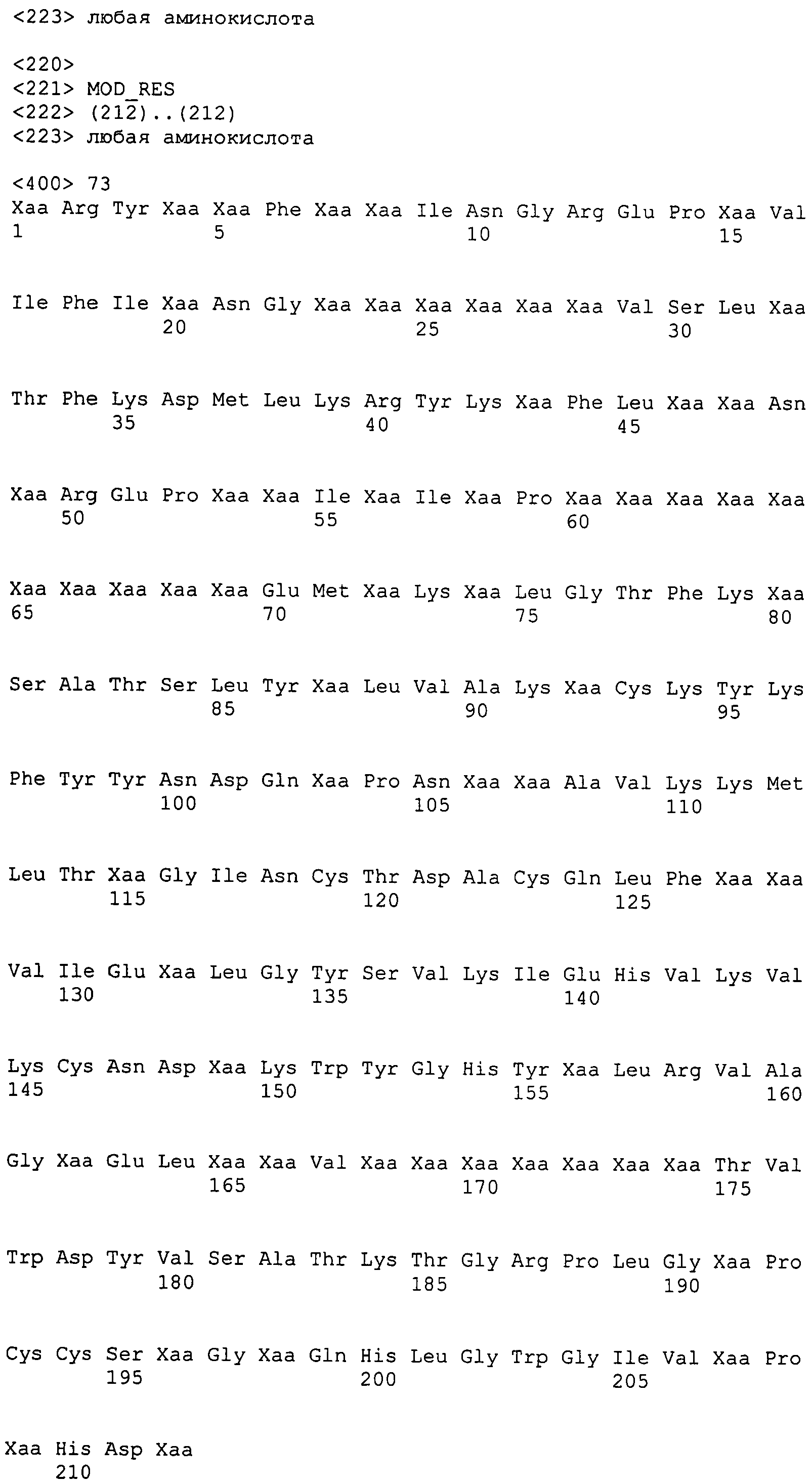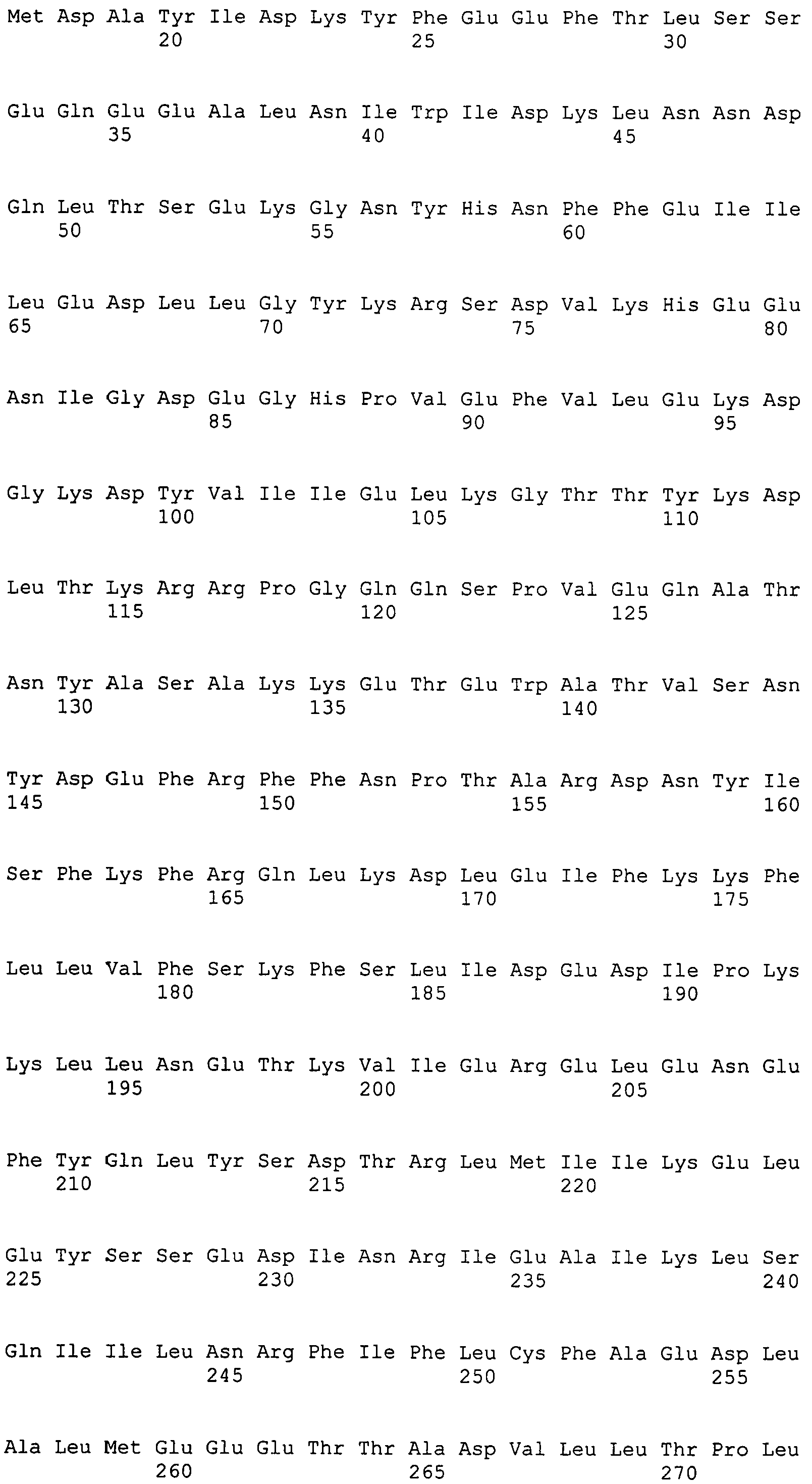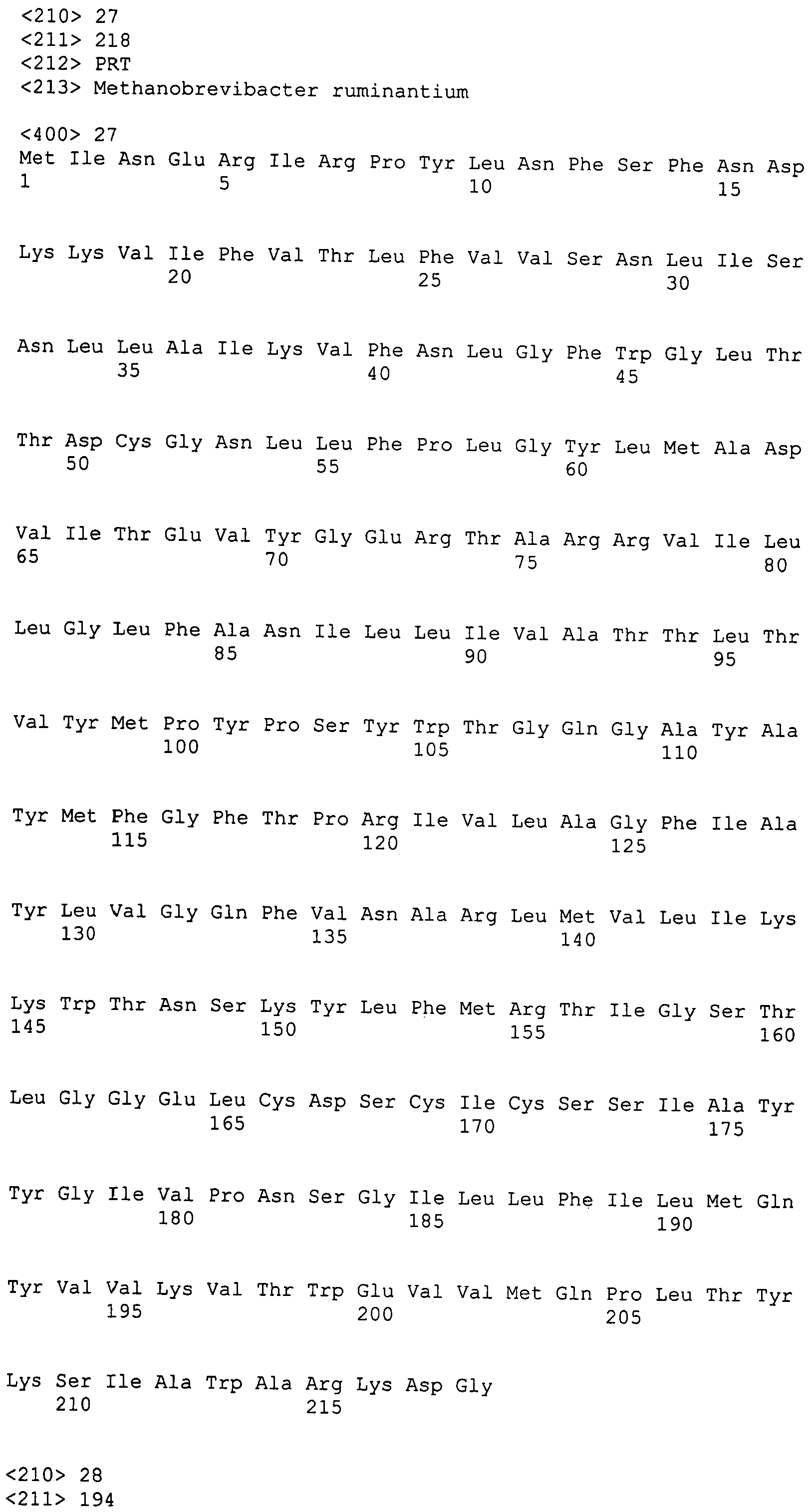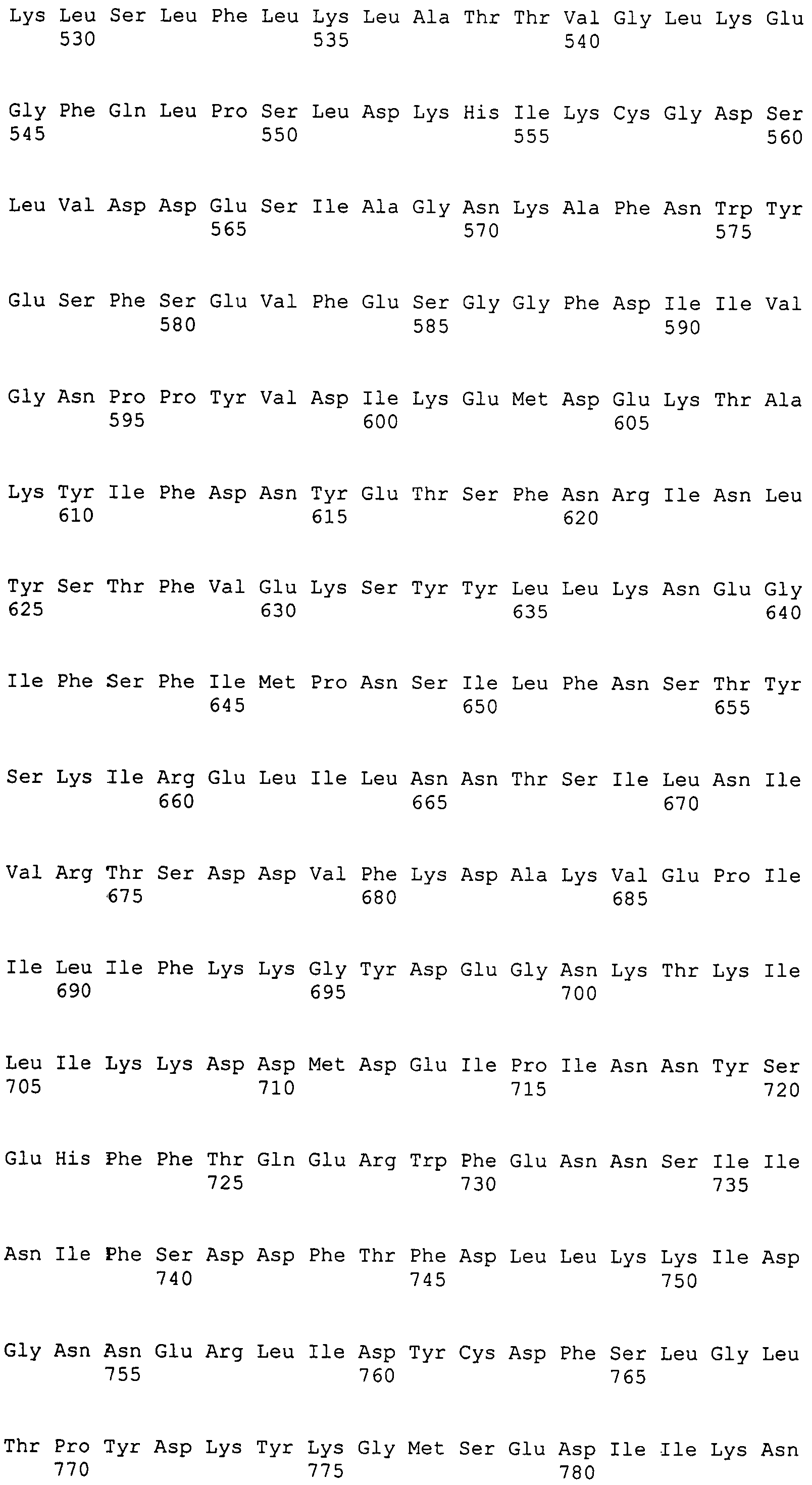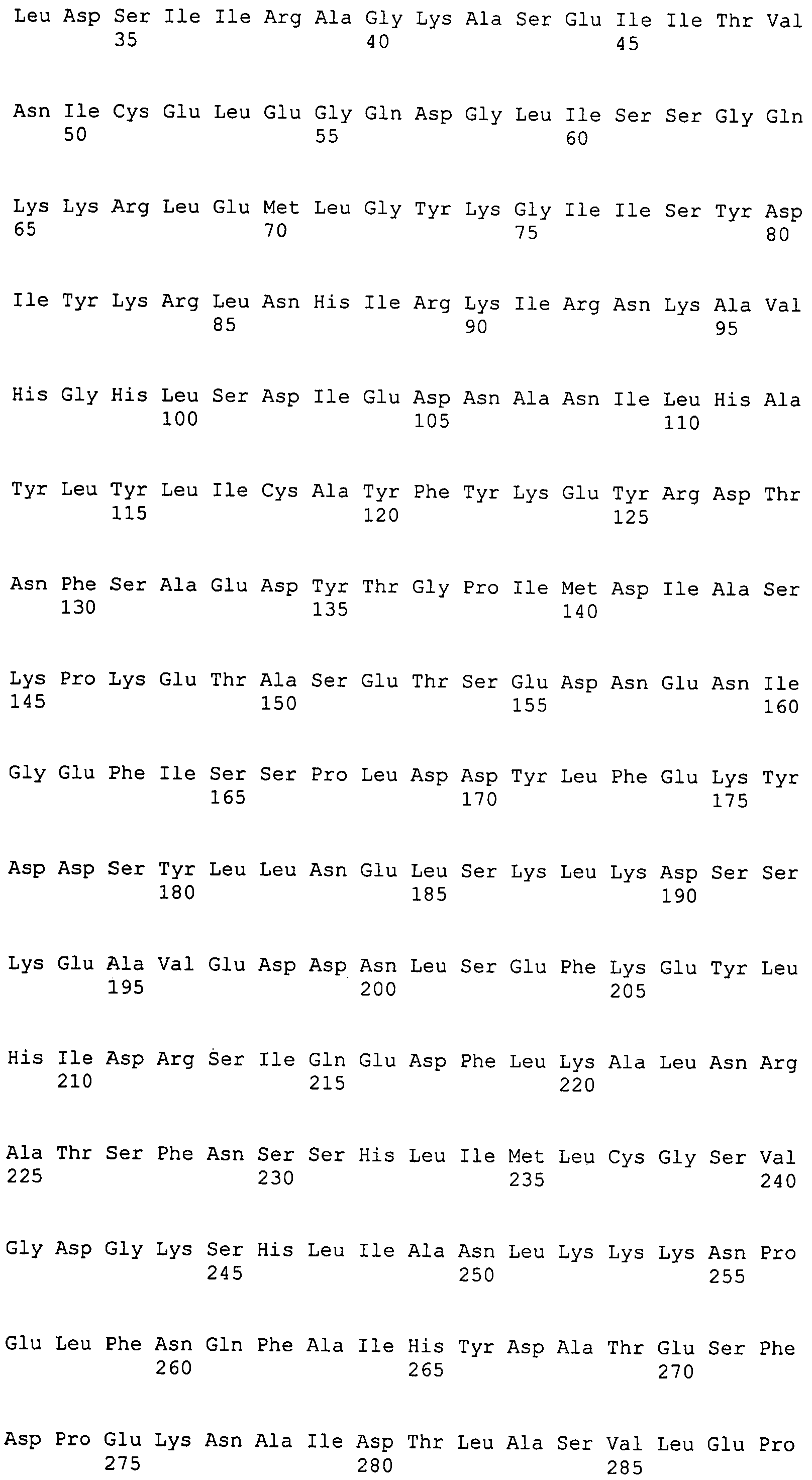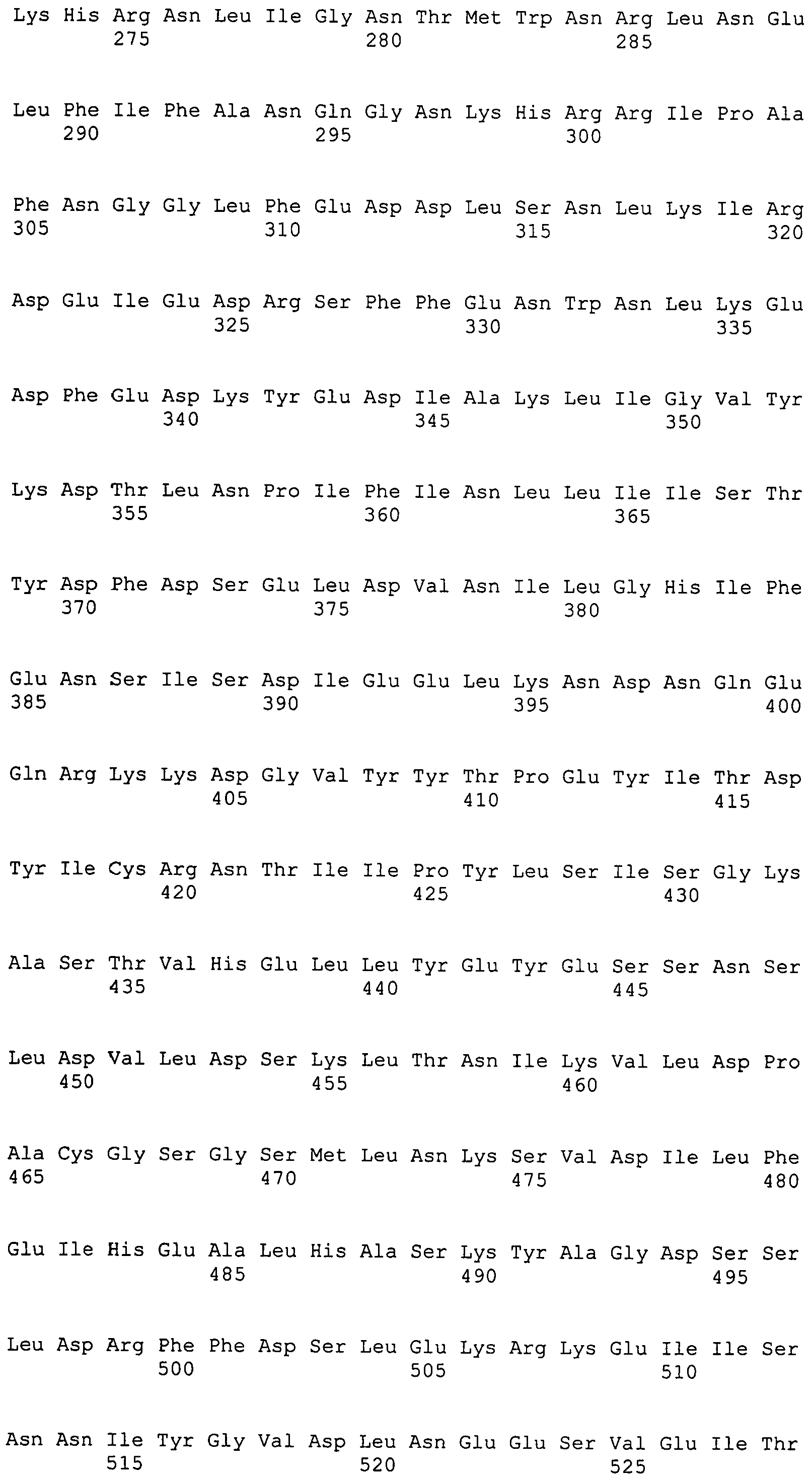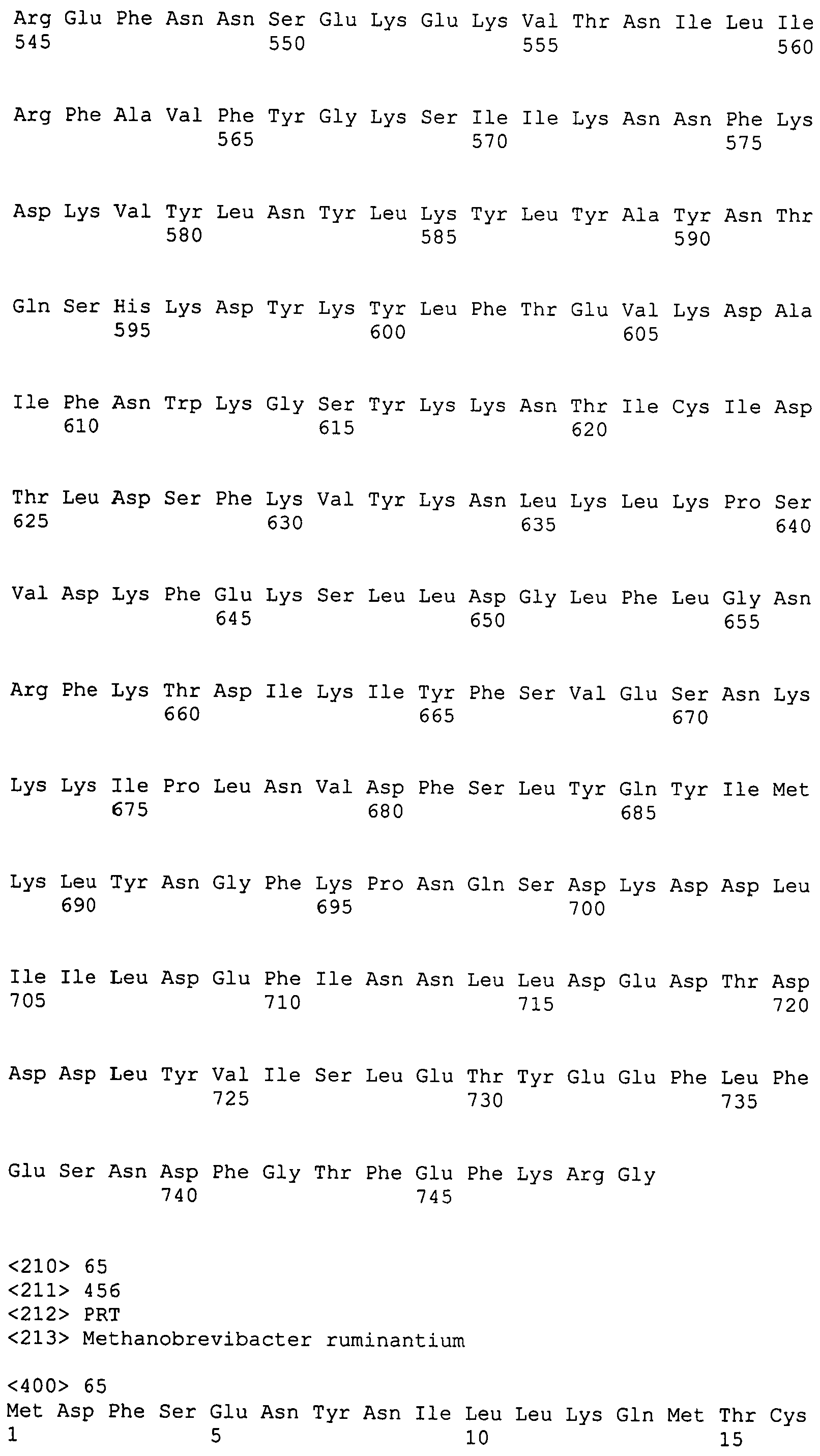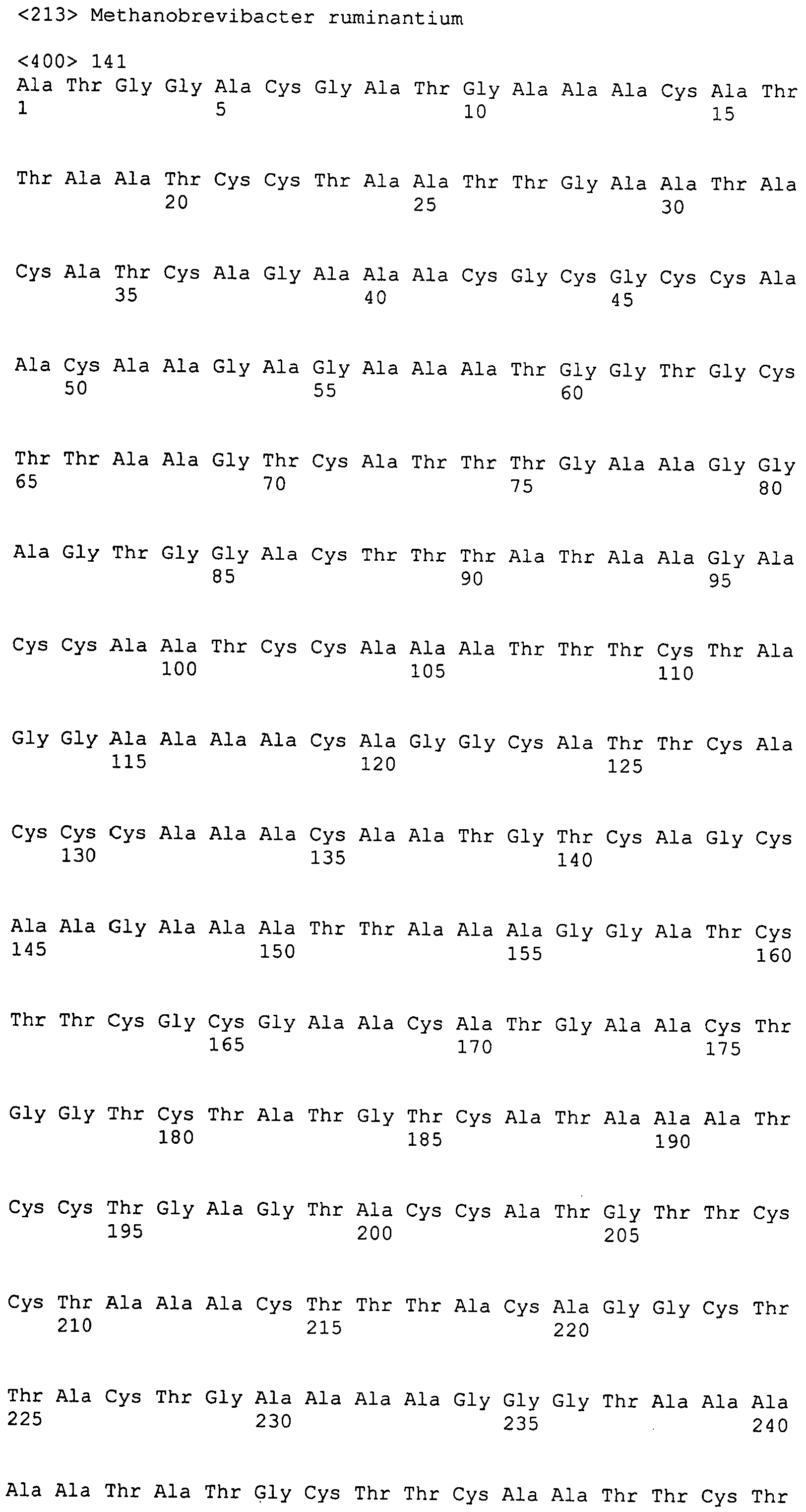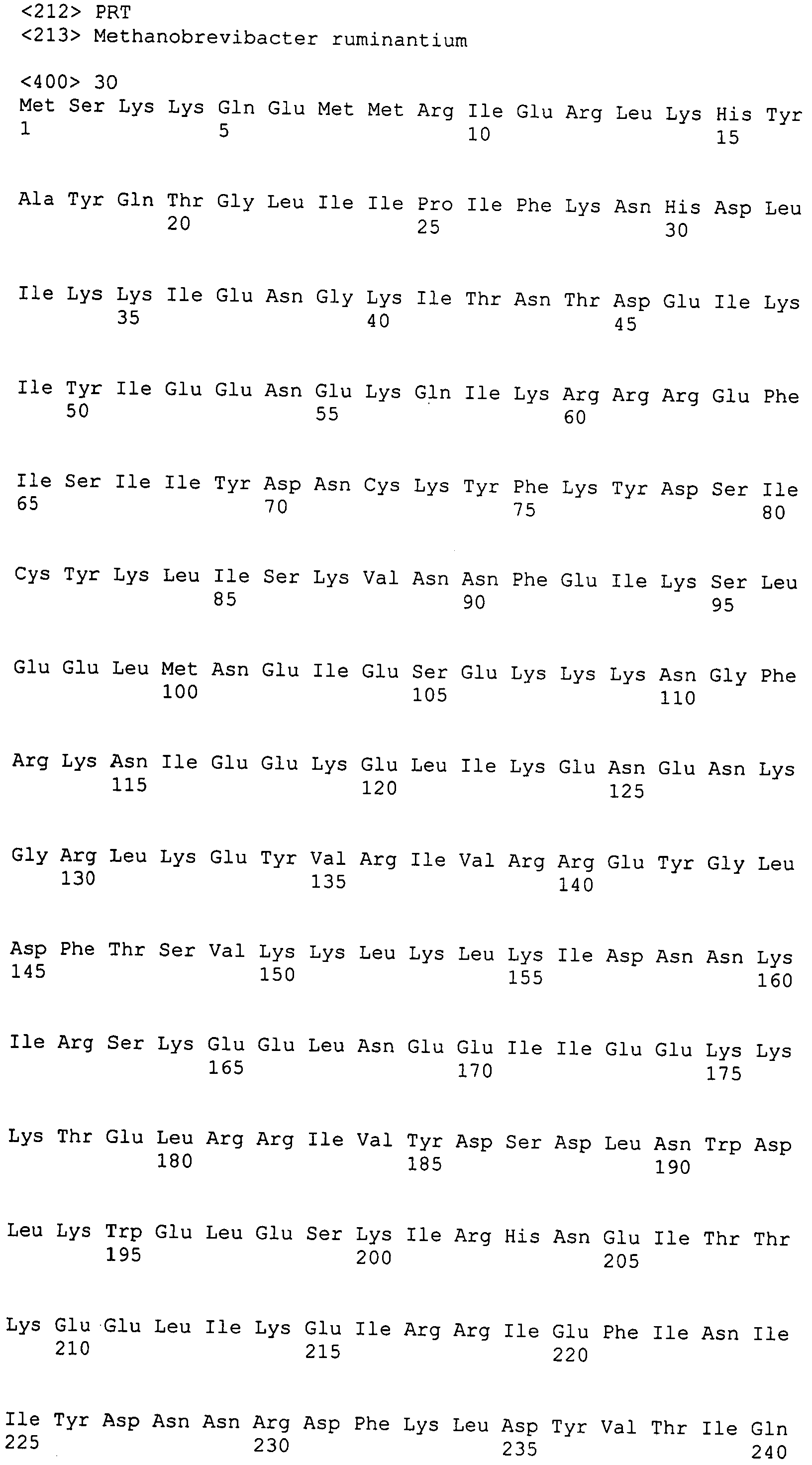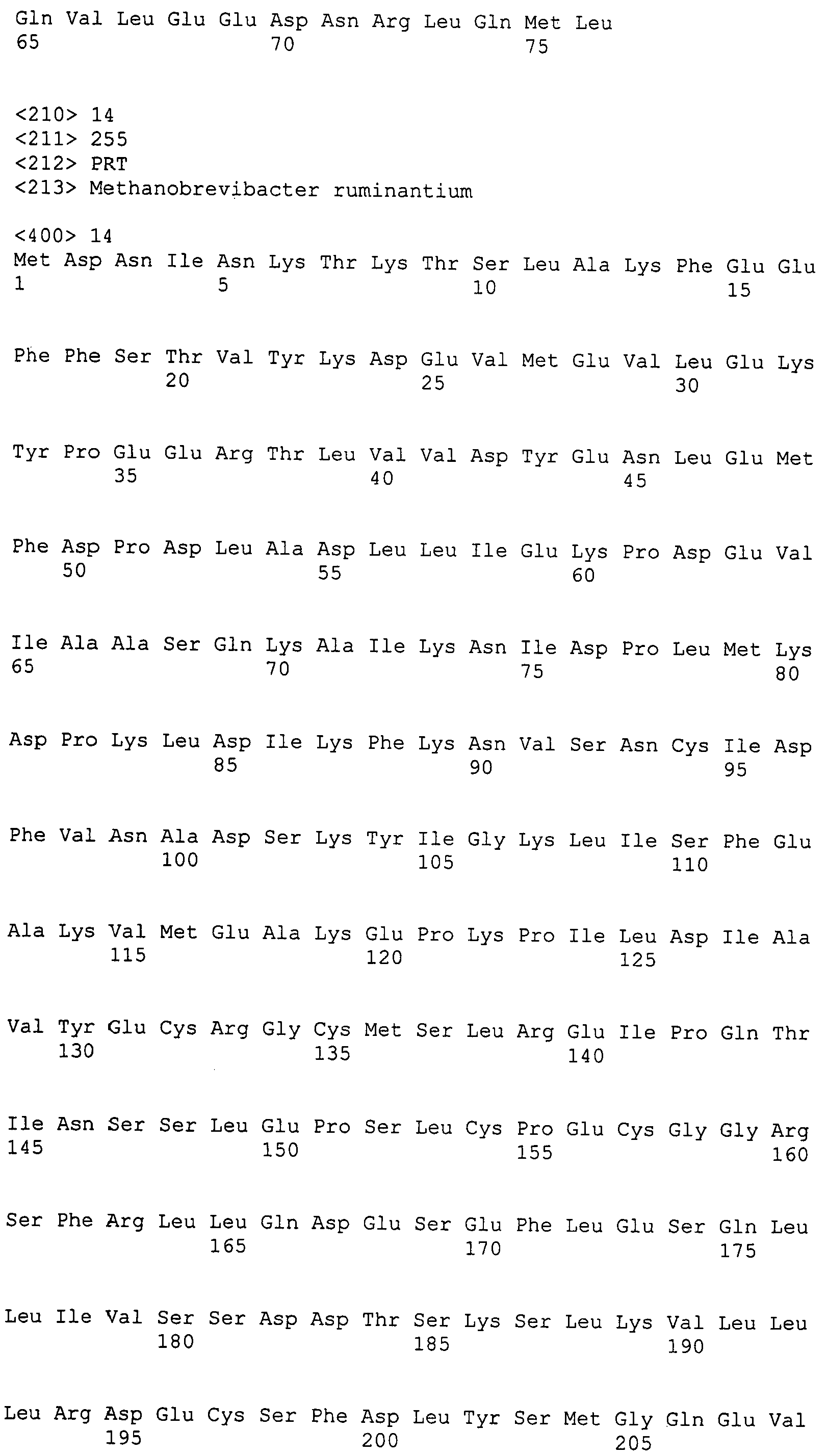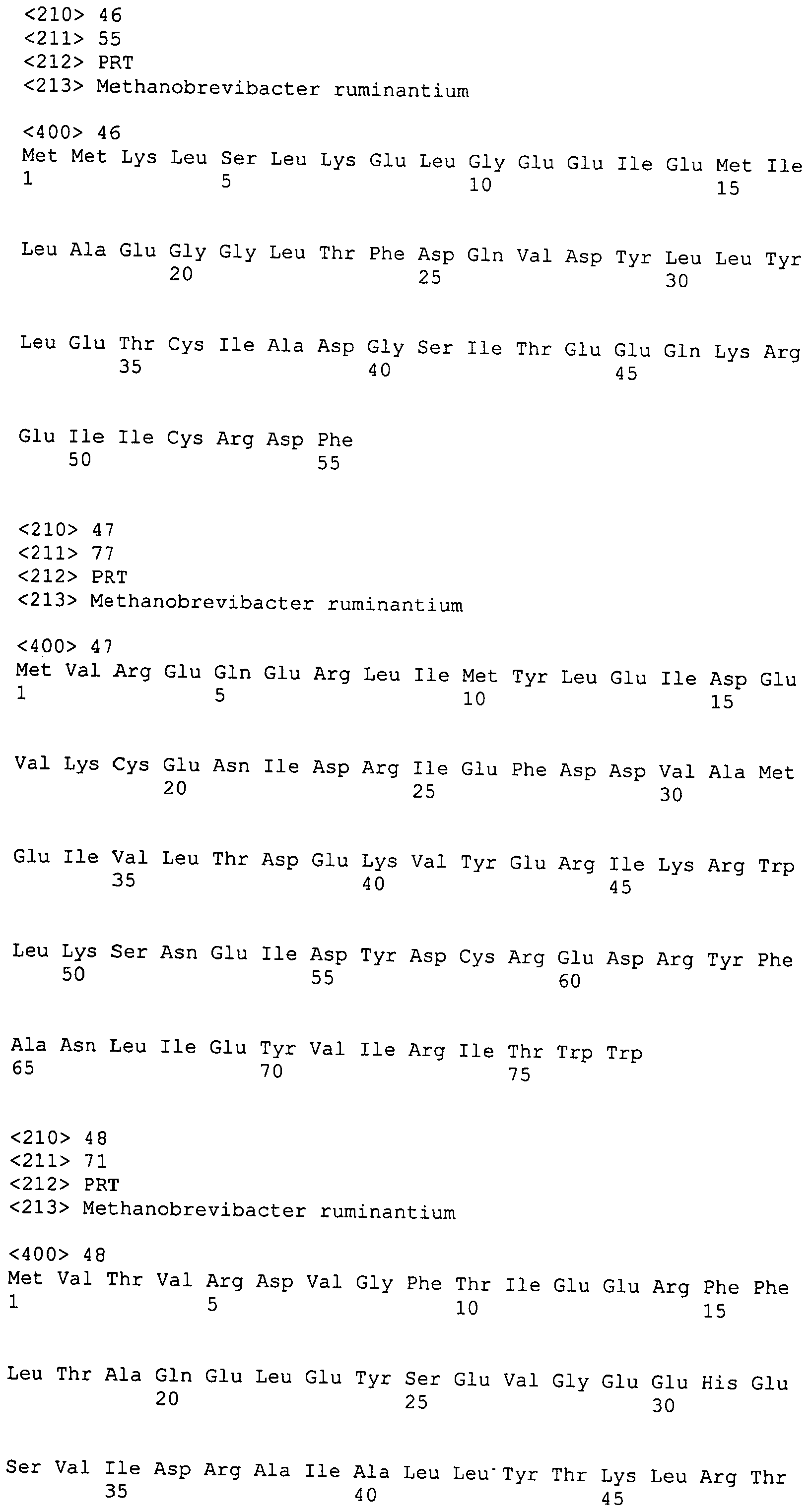ПОЛИНУКЛЕОТИДЫ И ПОЛИПЕПТИДЫ ФАГА φ-mru, И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по заявке США № 60/975104, поданной 25 сентября 2007, заявке США № 60/989840, поданной 22 ноября 2007, и заявке США № 60/989841, поданной 22 ноября 2007, содержания каждой из которых включено в настоящее описание в качестве ссылки в полном объеме.
Область, к которой относится изобретение
Настоящее изобретение относится к композициям и способам доставки ингибирующих молекул в микробные клетки, в частности метанопродуцирующие клетки. В особенности настоящее изобретение относится к новому фагу φmru, в том числе к индукции фага, фаговым частицам и фаговому геному, а также полипептидам фага, также как и полинуклеотидам, которые кодируют эти полипептиды. Настоящее изобретение также относится к векторам экспрессии и клеткам-хозяевам для получения этих полипептидов. Настоящее изобретение дополнительно относится к способам определения направленной доставки и ингибирования микробных клеток, в особенности метанопродуцирующих клеток, с использованием описанного фага, полипептидов, полинуклеотидов, векторов экспрессии и клеток-хозяев.
Предпосылки к созданию изобретения
В Новой Зеландии сельскохозяйственная деятельность является причиной большинства выбросов парниковых газов. Следовательно, уменьшение сельскохозяйственного выброса парниковых газов является важным для соблюдения обязательств Новой Зеландией Киотского протокола. В соответствии с этим протоколом требуется сократить парниковые газы до уровней 1990 к концу первого периода обязательства (2008-2012). К концу этого срока группы аграрного сектора и правительство Новой Зеландии утвердили исследовательский консорциум по парниковым газам (Pastoral Greenhouse Gas Research Consortium (PGGRC)) для установления способов уменьшения выбросов парниковых газов сельского хозяйства Новой Зеландии.
Важной частью деятельности PGGRC было исследование в отношении уменьшения выбросов метана с новозеландских пастбищ. Уменьшение выбросов метана от жвачных животных представляет коммерческий интерес по двум причинам. Во-первых, не соблюдение обязательств по Киотскому протоколу заставит правительство приобретать квоты на выброс углерода. В настоящее время стоимость этого оценивается в 350 миллионов $. Во-вторых, образование метана приводит к потере 8-12% общей энергии, производимой в рубце. Эта энергия могла быть использована вместо этого для улучшения продуктивности жвачного животного.
Метан продуцируется в рубце микроорганизмами, называемыми метанопродуцентами, которые являются частью таксономического типа Euryarchaeota в царстве Archaea. Большинство метаногенов растут в CO2 и H2, как единственных источниках энергии, но некоторые могут использовать для роста ацетат или метильные соединения. В рубце существует несколько различных родов метанопродуцентов archaea, но виды рода Methanobrevibacter, в особенности M. ruminantium и M. Smithii, считаются преобладающими метанопродуцентами у жвачных животных Новой Зеландии. M. ruminantium в настоящее время является предметом проекта секвенирования генома, финансируемого PGGRC. Этот проект представляет собой первое секвенирование генома метанопродуцентов рубца, и его целью является улучшение понимания биологии Methanobrevibacter для обнаружения мишеней для ингибирования образования метана.
Для уменьшения продукции метана в рубце требуется ингибирование метанопродуцентов или инактивация их пути образования метана. Способом ингибирования образования метана является доставка специфических ингибирующих молекул в клетки метанопродуцентов. Это может достигаться, например, путем применения таких средств, как бактериофаг, который специфически направлен на метанопродуценты. Были охарактеризованы некоторые фаги для метанопродуцентов нежвачных животных, но не было опубликованных сообщений о способности фага инфицировать или лизировать метанопродуценты рубца. Следовательно, было бы очень предпочтительным идентифицировать фаг, который обладает способностью инфицировать клетки метанопродуцентов и/или доставлять ингибиторы.
Краткое изложение сущности изобретения
Изобретение относится к выделенному фагу φmru, в том числе фаговой частице и/или фаговому геному, полученному целиком или частично, а также к выделенным полинуклеотидам и полипептидам этого фага, описанным подробно в настоящей заявке.
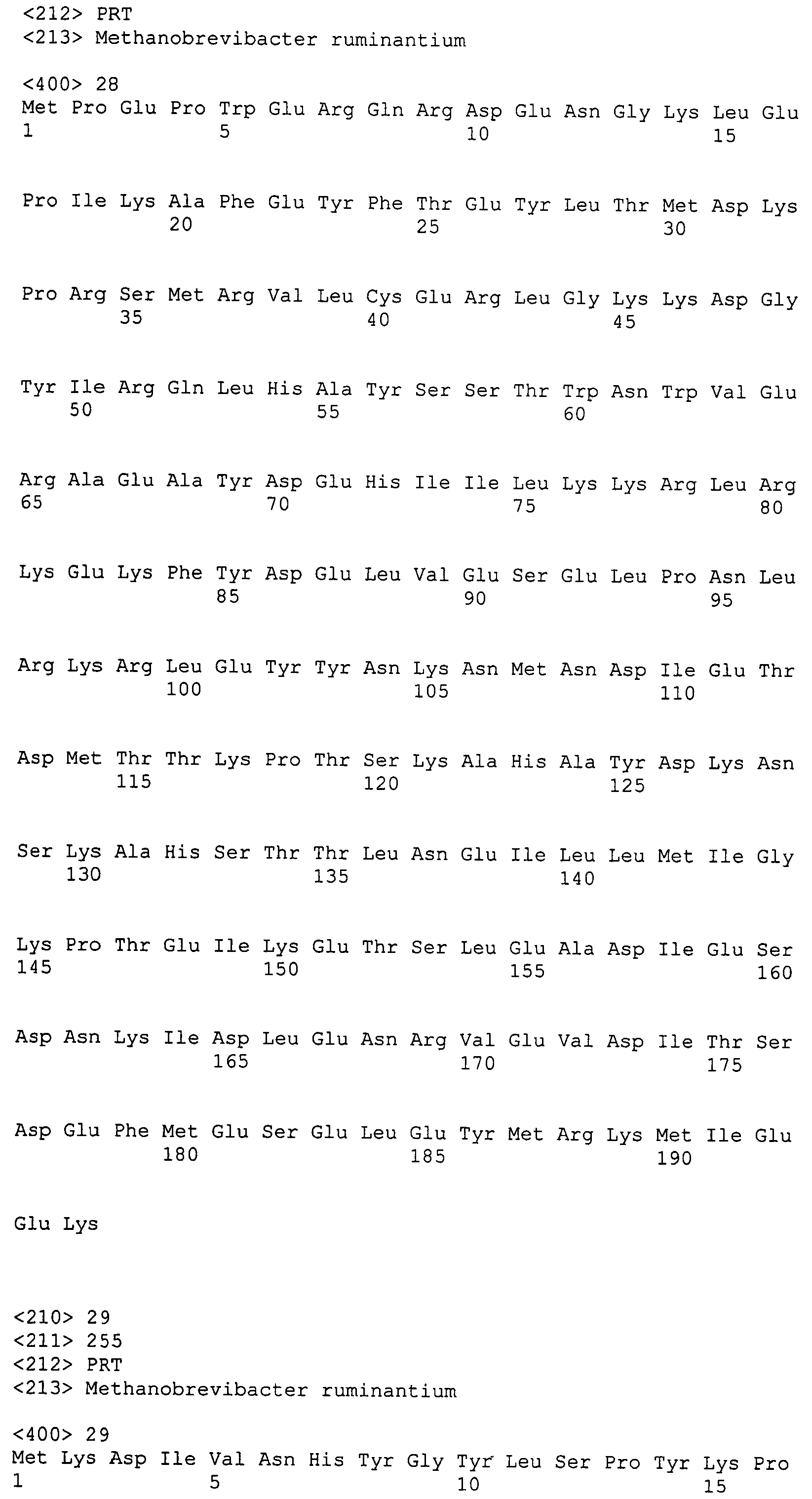
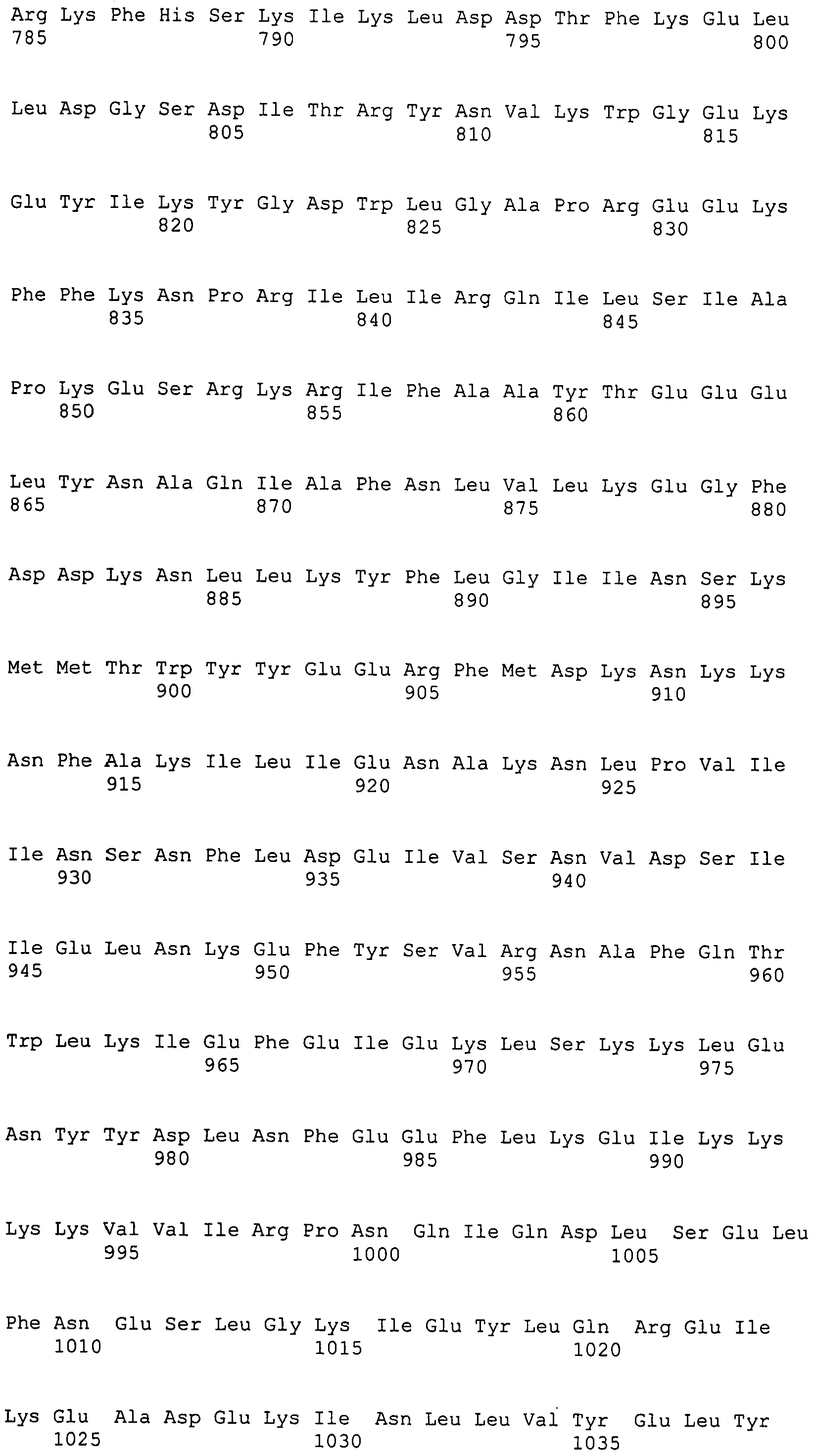
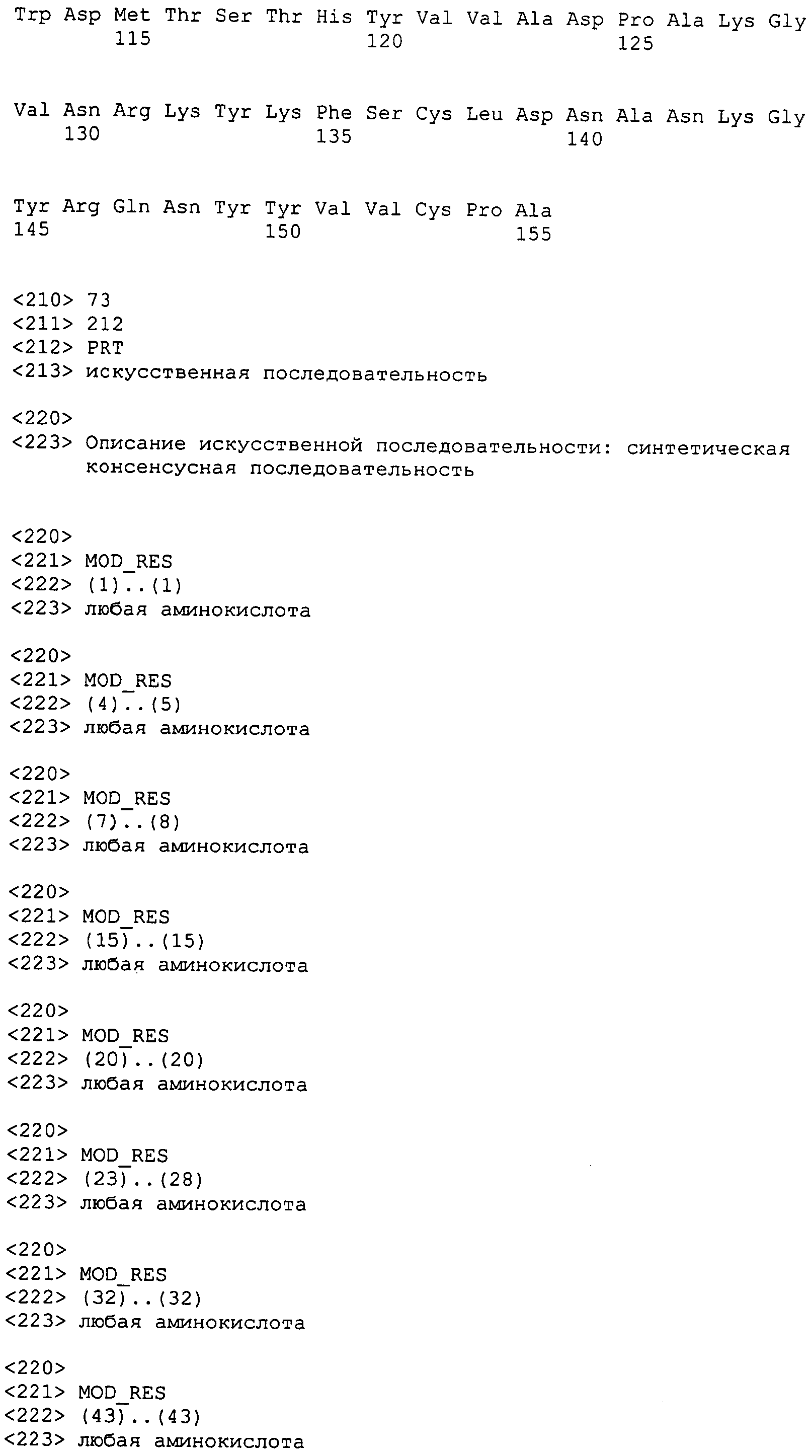
Настоящее изобретение также относится к выделенному полипептиду, содержащему по меньшей мере одну фаговую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-69. В отдельном аспекте, этот полипептид содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:2-5 и 62-68. В дополнительном аспекте этот полипептид содержит аминокислотную последовательность SEQ ID NO:63. В другом аспекте, этот полипептид представляет собой фрагмент, например, содержащий по меньшей мере одну аминокислотную последовательность, продолжающуюся от остатков 32-186 последовательности SEQ ID NO:63.
Настоящее изобретение дополнительно относится к выделенному полинуклеотиду, содержащему кодирующую последовательность по меньшей мере одного фагового полипептида. В одном аспекте, этот полинуклеотид содержит кодирующую последовательность по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-69. В особом аспекте, полинуклеотид содержит кодирующую последовательность для последовательности, выбранной из группы, состоящей из SEQ ID NO:2-5 и 62-68. В дополнительном аспекте этот полинуклеотид содержит кодирующую последовательность для SEQ ID NO:63. В другом аспекте, полинуклеотид содержит фрагмент кодирующей последовательности, например по меньшей мере одну аминокислотную последовательность, продолжающуюся от остатков 32-186 последовательности SEQ ID NO:63.
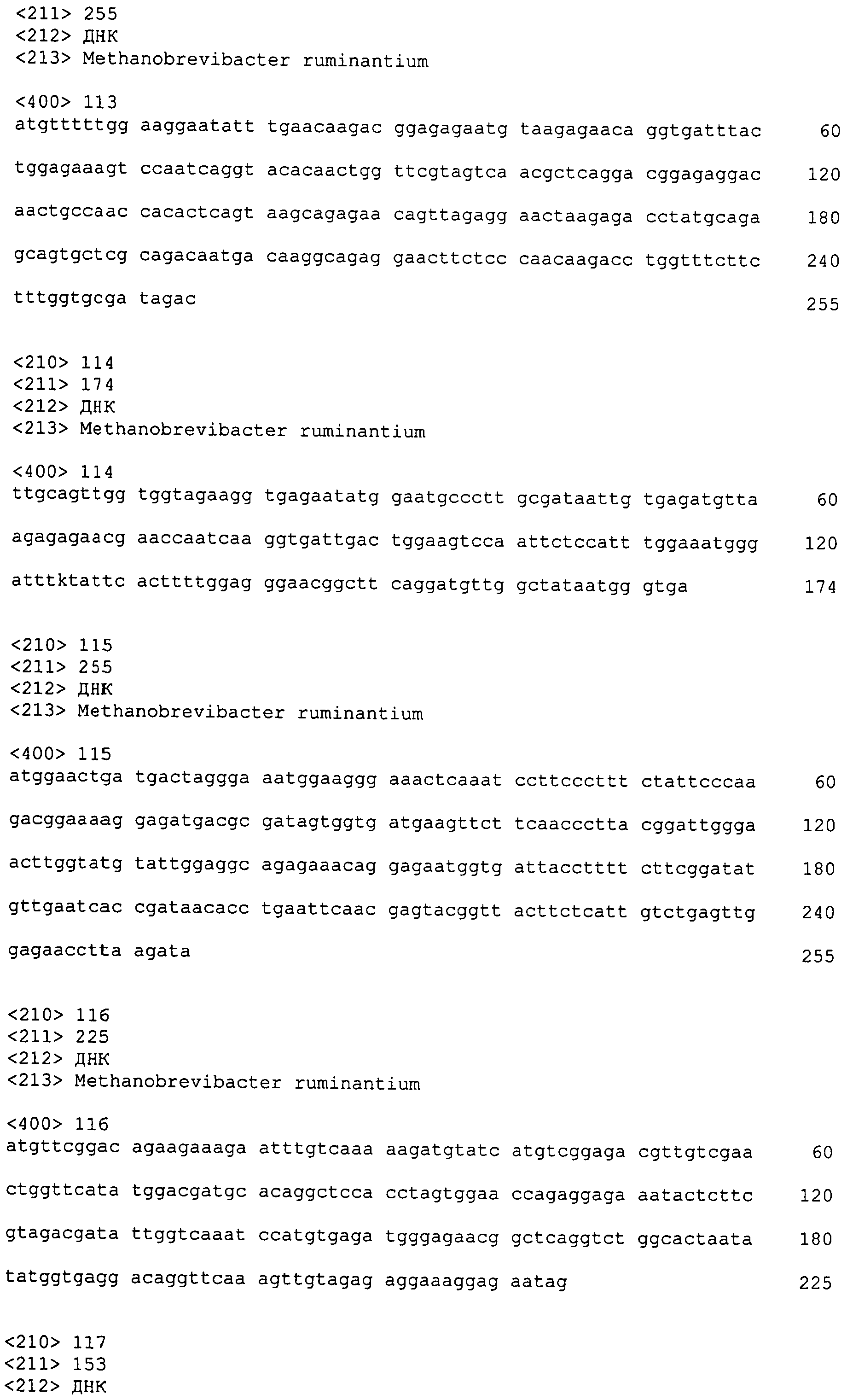
В дополнительном аспекте, настоящее изобретение относится к выделенному полинуклеотиду, содержащему последовательность нуклеиновой кислоты фага, выбранную из группы, состоящей из SEQ ID NO:74-142. В особом аспекте, этот полинуклеотид содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:75-78 и 135-141, или в частности представляет собой SEQ ID NO:136. В другом аспекте, полинуклеотид представляет собой фрагмент или олигонуклеотид, содержащий, например, последовательность нуклеиновой кислоты, протяженностью от нуклеотидов 94-558 последовательности SEQ ID NO:136. Кроме того, изобретение охватывает выделенный полинуклеотид или его фрагмент, который гибридизируется с любой из последовательностей нуклеиновой кислоты SEQ ID NO:74-142. Настоящее изобретение дополнительно охватывает выделенный полинуклеотид, содержащий комплементарную, обратно комплементарную, обратную последовательность или их фрагменты, любой из последовательностей нуклеиновой кислоты.
Настоящее изобретение относится к вектору экспрессии, содержащему полинуклеотид, содержащий кодирующую последовательность по меньшей мере одного фагового полипептида. В одном аспекте, вектор экспрессии содержит кодирующую последовательность по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO:1-69. В особом аспекте, вектор экспрессии содержит кодирующую последовательность по меньшей мере одной аминокислотной последовательности SEQ ID NO:2-5 и 62-68. В дополнительном аспекте, вектор экспрессии содержит кодирующую последовательность по меньшей мере одной аминокислотной последовательности SEQ ID NO:63. В другом аспекте, вектор экспрессии содержит кодирующую последовательность по меньшей мере одной аминокислотной последовательности, протяженностью от остатков 32-186 последовательности SEQ ID NO:63.
В качестве особого аспекта, настоящее изобретение относится к вектору экспрессии, который продуцирует фаг φmru, целиком или частично, как подробно описано в настоящей заявке. В частности, вектор экспрессии может продуцировать фаговые частицы, фаговый геном или модифицированный фаг, содержащий любые его изменения, производные, варианты или фрагменты.
Настоящее изобретение также относится к клетке-хозяину, например микробной клетке-хозяину, содержащей по меньшей мере один вектор экспрессии.
Настоящее изобретение в частности относится к антителу, индуцируемому в отношении полипептида, или полинуклеотида, описанного в настоящей заявке. В определенных аспектах, это антитело направлено по меньшей мере на одну полипептидую последовательность, выбранную из группы, состоящей из SEQ ID NO:1-69 или его модифицированной последовательности. В альтернативных аспектах, антитело индуцировано в отношении по меньшей мере фрагмента полинуклеотида, выбранного из группы, состоящей из SEQ ID NO:74-142, или его комплементарной или модифицированной последовательности. В другом аспекте, антитело содержит один или несколько слияний или конъюгатов по меньшей мере с одним клеточным ингибитором, например соединениями против образования метана (например, бромэтансульфоновой кислотой), антителами и фрагментами антител, литическими ферментами, пептид-нуклеиновыми кислотами, антимикробными пептидами и другими антибиотиками, описанными подробно в настоящей заявке.
Настоящее изобретение дополнительно относится к модифицированным фаговым полипептидам, например по меньшей мере одному из SEQ ID NO:1-69, включая биологически активные изменения, фрагменты, варианты и производные, описанные в настоящей заявке. Настоящее изобретение дополнительно относится к модифицированным антителам, например, направленным по меньшей мере на одну из последовательностей SEQ ID NO:1-69, включая биологически активные изменения, фрагменты, варианты и производные, описанные в настоящей заявке. Также описаны полинуклеотиды, кодирующие эти модифицированные полипептиды, а также изменения, фрагменты, варианты и производные описанных полинуклеотидов, векторы экспрессии, содержащие эти полинуклеотиды, и клетки-хозяева, содержащие эти векторы. В особых аспектах, в композициях и способах по изобретению используются эти модифицированные полинуклеотиды, или полипептиды, или соответствующие векторы экспрессии, или клетки-хозяева.
Кроме того, настоящее изобретение относится к фаговым полипептидам, например по меньшей мере к полипептиду SEQ ID NO:1-69 или его модифицированным последовательностям, которые включают слияния или конъюгаты по меньшей мере с одним клеточным ингибитором, например соединениями против образования метана (например, бромэтансульфоновой кислотой), антителами и фрагментами антител, литическими ферментами, пептид-нуклеиновыми кислотами, антимикробными пептидами и другими антибиотиками, описанными подробно в настоящей заявке.
Изобретение относится к композиции, содержащей выделенный полипептид, например по меньшей мере полипептид SEQ ID NO:1-69, или его модифицированную последовательность. Настоящее изобретение дополнительно относится к композиции, содержащей антитело, например, направленное по меньшей мере на одну из SEQ ID NO:1-69, или их модифицированную последовательность. Также описана композиция, содержащая выделенный полинуклеотид, например по меньшей мере один из SEQ ID NO:74-142, или их комплементарную или модифицированную последовательность. Дополнительно описана композиция, которая содержит вектор экспрессии, или клетка-хозяин, содержащая вектор экспрессии, в соответствии с настоящим изобретением. Композиция может содержать любые биологически активные изменения, фрагменты, варианты и производные, описанные в настоящей заявке. Композиции могут содержать по меньшей мере один клеточный ингибитор (например, в виде слияния или конъюгата), и могут быть получены, например, в виде фармацевтических композиций или в виде добавок к пище, в частности компонентов кормов для жвачных животных.
Изобретение также относится к композиции по изобретению как части набора для направленной доставки, и/или ингибирования микробных клеток, в особенности клеток метанопродуцентов, в соответствии с описанными способами. Эти наборы содержат: a) по меньшей мере одну композицию, описанную в настоящей заявке; и b) необязательно, инструкции по применению, например, по направленной доставке в клетки или ингибированию клеточного роста, или репликации для метанопродуцентов или других микроорганизмов.
Настоящее изобретение относится к способу получения фага, указанный способ предусматривает: a) культивирование вектора экспрессии или клетки-хозяина, содержащей вектор экспрессии, который содержит по меньшей мере часть фагового генома в условиях, подходящих для получения этого фага; и b) извлечение этого фага из культуры. В особых аспектах, этот фаг содержит по меньшей мере один полипептид, выбранный из группы, состоящей из SEQ ID NO:1-69, или их модифицированные последовательности. В дополнительных аспектах, этот фаг содержит по меньшей мере один полинуклеотид, выбранный из группы, состоящей из SEQ ID NO:74-142, или их модифицированных последовательностей.
Настоящее изобретение также относится к способу получения фагового полипептида, указанный способ предусматривает: a) культивирование вектора экспрессии или клетки-хозяина, содержащей вектор экспрессии, который содержит по меньшей мере часть кодирующей последовательности по меньшей мере одного фагового полипептида в условиях, подходящих для экспрессии этого полипептида; и b) извлечение этого полипептида из культуры. В особых аспектах, этот полипептид содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-69, или их модифицированных последовательностей.
Настоящее изобретение дополнительно относится к способу получения фагового полипептида, например по меньшей мере одного из SEQ ID NO:1-69, который содержит слияние или конъюгат по меньшей мере с одним клеточным ингибитором, например соединениями против образования метана (например, бромэтансульфоновой кислотой), антителами и фрагментами антител, литическими ферментами, пептид-нуклеиновыми кислотами, противомикробными пептидами и другими антибиотиками, подробно описанными в настоящей заявке. Такой способ предусматривает: a) культивирование вектора экспрессии или клетки-хозяина, содержащей вектор экспрессии, который содержит кодирующую последовательность по меньшей мере одного фагового полипептида в условиях, подходящих для экспрессии полипептида; b) образование фагового слияния или конъюгата (например, путем экспрессии слитой последовательности или химического конъюгата с клеточным ингибитором); и c) извлечение слияния или конъюгата. В особых аспектах, этот полипептид содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-69, или их модифицированные последовательности.
Кроме того, настоящее изобретение относится к способу ингибирования (например, роста или репликации) микробной клетки, в частности клетки метанопродуцента, предусматривающему: a) необязательно, получение или выделение по меньшей мере одного фагового полипептида; и b) контактирование клетки с фаговым полипептидом. В особом аспекте, полипептид содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-69, или ее модифицированную последовательность.
В качестве дополнительного признака настоящее изобретение также охватывает способ ингибирования (например, ингибирования роста или репликации) микробной клетки, в частности клетки метанопродуцентов, предусматривающий: a) необязательно, получение или выделение по меньшей мере одного фагового полипептида, который дополнительно содержит по меньшей мере один клеточный ингибитор; и b) контактирование клетки с фаговым полипептидом. В особом аспекте, полипептид содержит по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-69, или ее модифицированной последовательности.
Настоящее изобретение также относится к способу определения и/или измерения уровней фага или соответствующего фагового полипептида или полинуклеотида, предусматривающему: 1) контактирование образца, полученного от индивида, с антителом, индуцированным в отношении фагового полипептида (например, по меньшей мере, одного из SEQ ID NO:1-69, или их модифицированных последовательностей) или соответствующего полинуклеотида; и 2) определение наличия или уровней антительного комплекса, образованного с полипептидом или полинуклеотидом в образце. Такие способы также могут быть использованы для определения и/или измерения уровней микробных клеток, в частности клеток метанопродуцентов.
Настоящее изобретение также относится к способу определения и/или измерения уровней фага или соответствующего фагового полинуклеотида (например, кодирующей последовательности фага), предусматривающему: 1) контактирование образца, полученного от индивида, с комплементарным полинуклеотидом (например, последовательностью, комплементарной любой из последовательностей SEQ ID NO:74-142, или их модифицированным последовательностям); и 2) определение наличия или уровней гибридизационного комплекса, образованного с фаговым полинуклеотидом в этом образце. Такие способы также могут быть использованы для определения и/или измерения уровней микробных клеток, в частности клеток метанопродуцентов.
В особых аспектах, в способах по изобретению используются in vivo или in vitro компоненты экспрессии. В других аспектах, в способах используются полипептиды, продуцируемые рекомбинантными, синтетическими или полусинтетическими способами, или полипептиды, продуцируемые эндогенными способами.
Другие аспекты и варианты осуществления настоящего изобретения описаны ниже.
Краткое описание чертежей
Настоящее изобретение описано со ссылкой на конкретные варианты его осуществления и со ссылкой на чертежи.
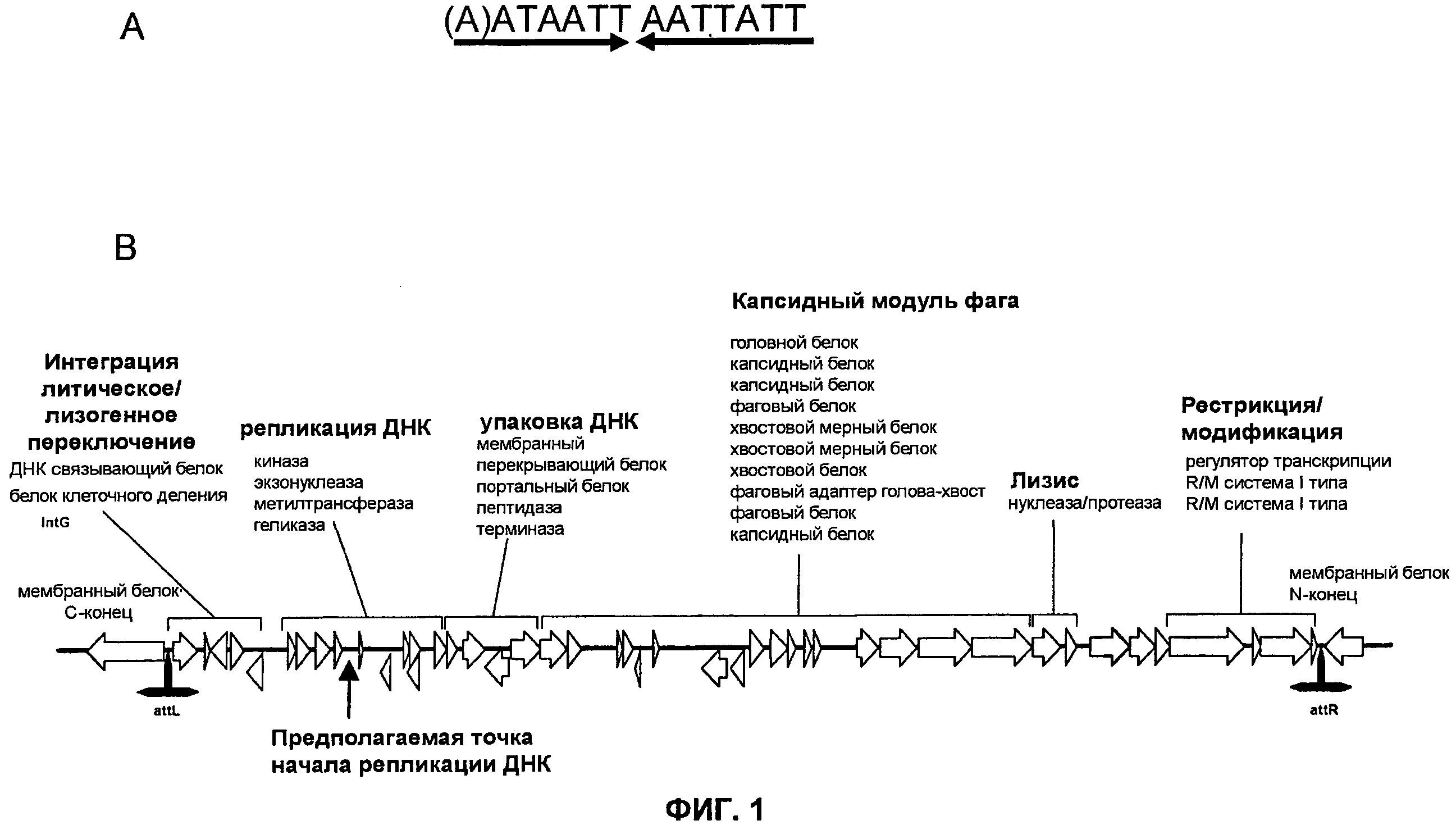
ФИГ. 1A-1B. M. ruminantium профаг φmru, демонстрирующий предполагаемые последовательности сайта интеграции attL и attR (ФИГ. 1A), прогнозируемые функциональные модули фага и генная структура (ФИГ. 1B).
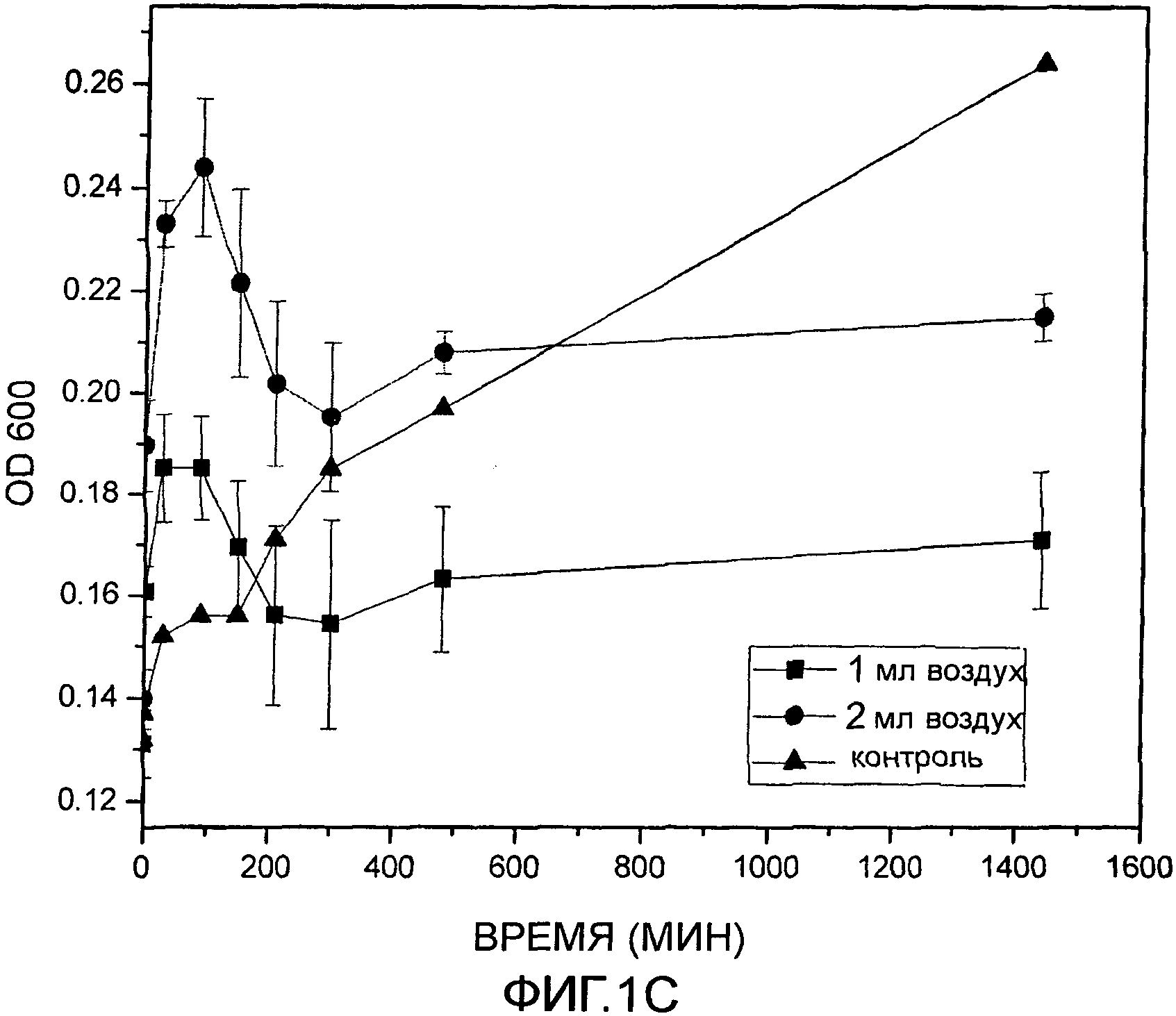
Фиг. 1C: Индукция фага с помощью стерильного воздуха (окислительный стресс).
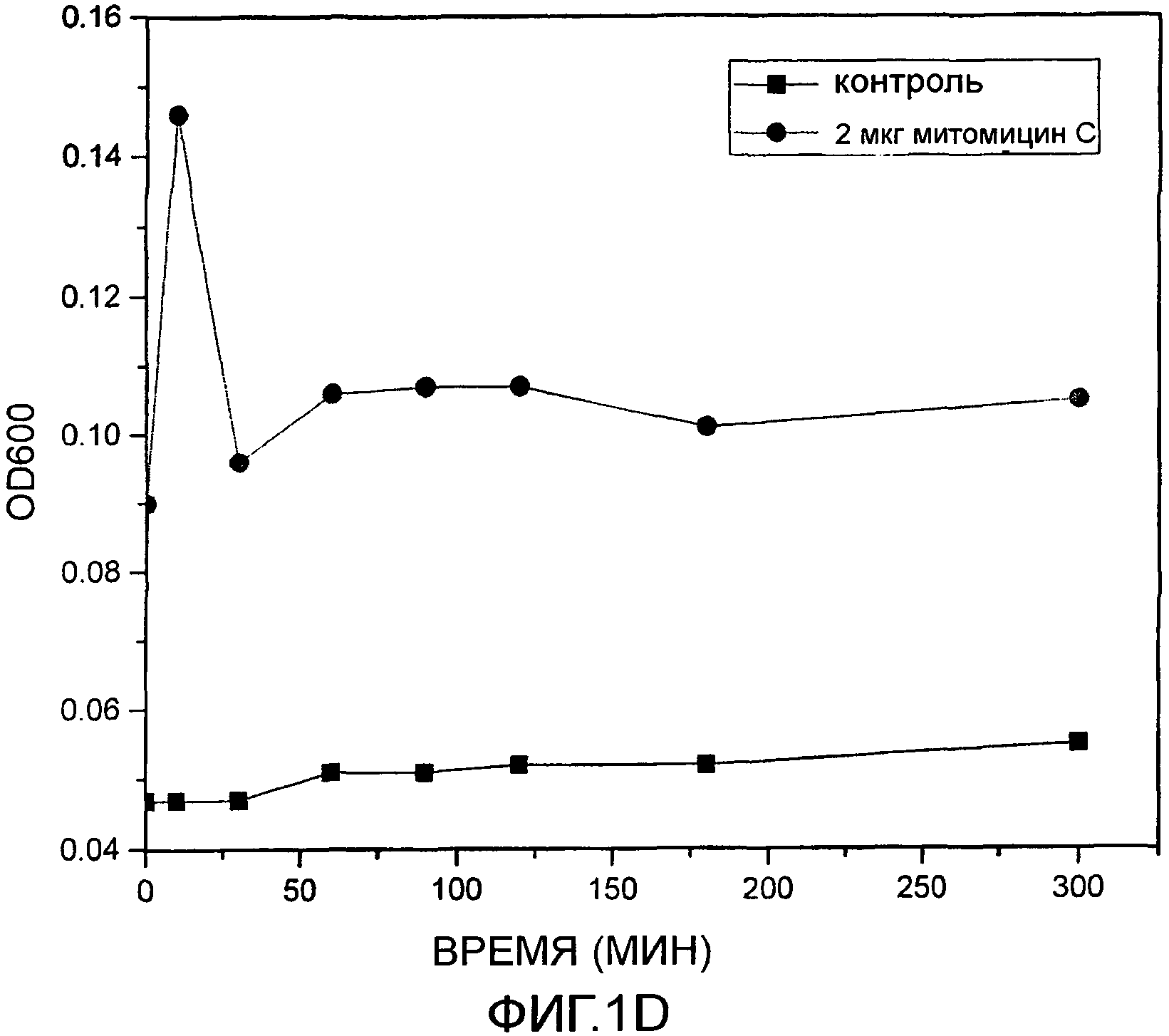
Фиг. 1D: Начальная индукция фага с использованием митомицина C.
Фиг. 1E: Агарозный гель-электрофорез ПЦР ампликонов индуцированного (кислородный стимул) и неиндуцированного M. ruminantium. Дорожки 2 и 4: 1 k.b. лестничный ДНК маркер от Invitrogen. Дорожки 1 и 3 представляют ПЦР с использованием пары праймеров R1F-L2R на ДНК, выделенной из индуцированных и неиндуцированных культур M. ruminantium, соответственно.
ФИГ. 2. Открытая рамка считывания профага φmru, пояснения и комментарии.
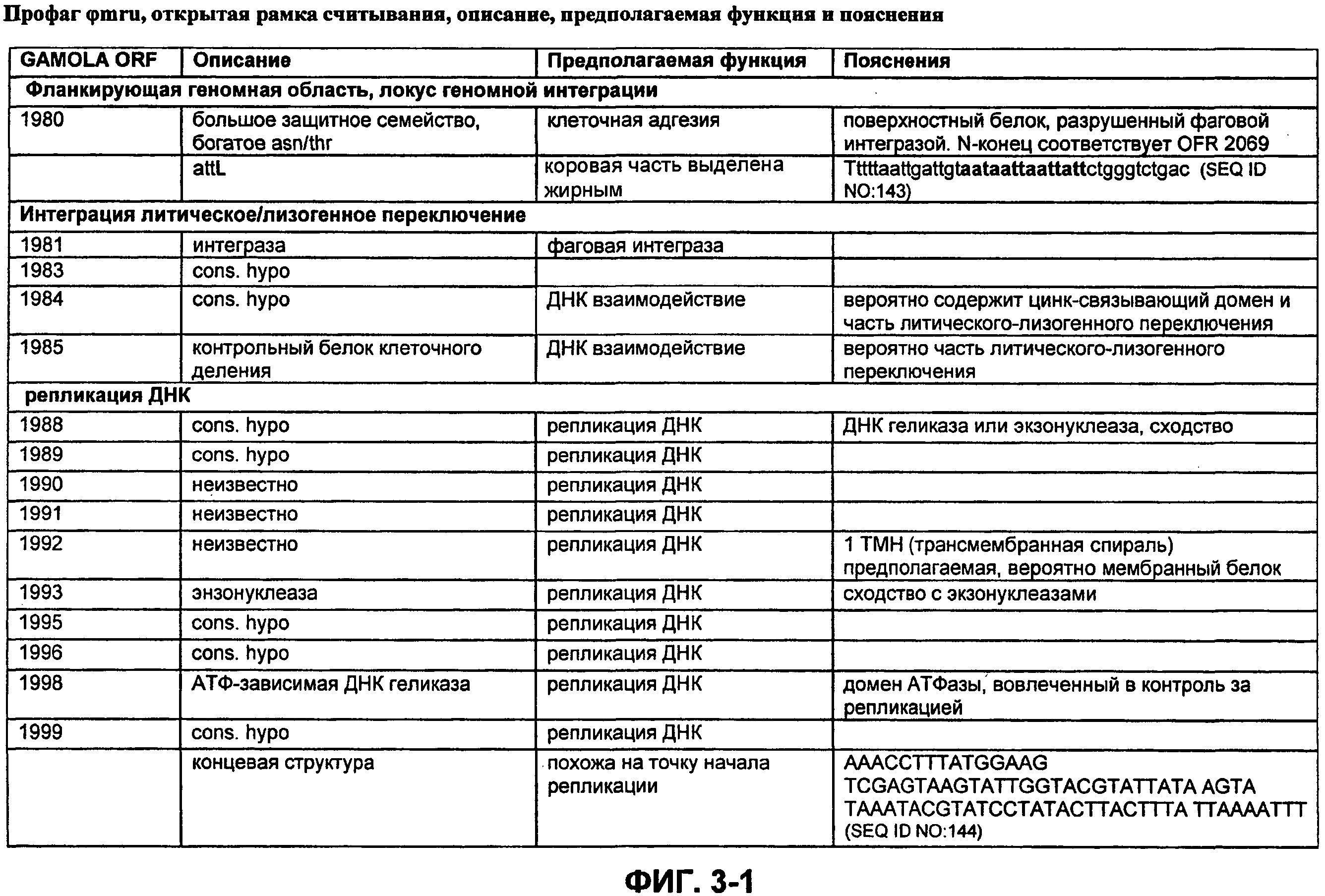
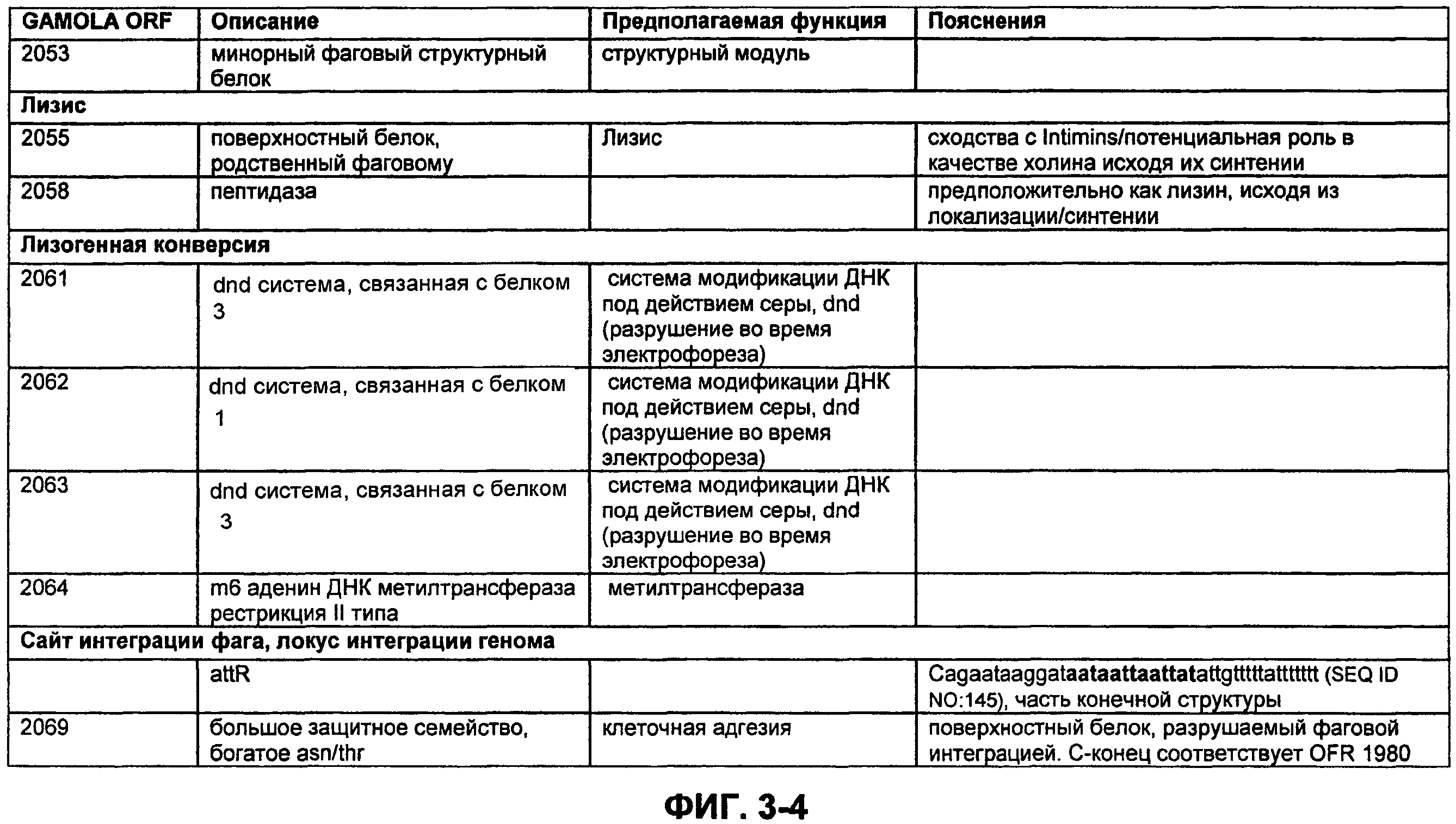
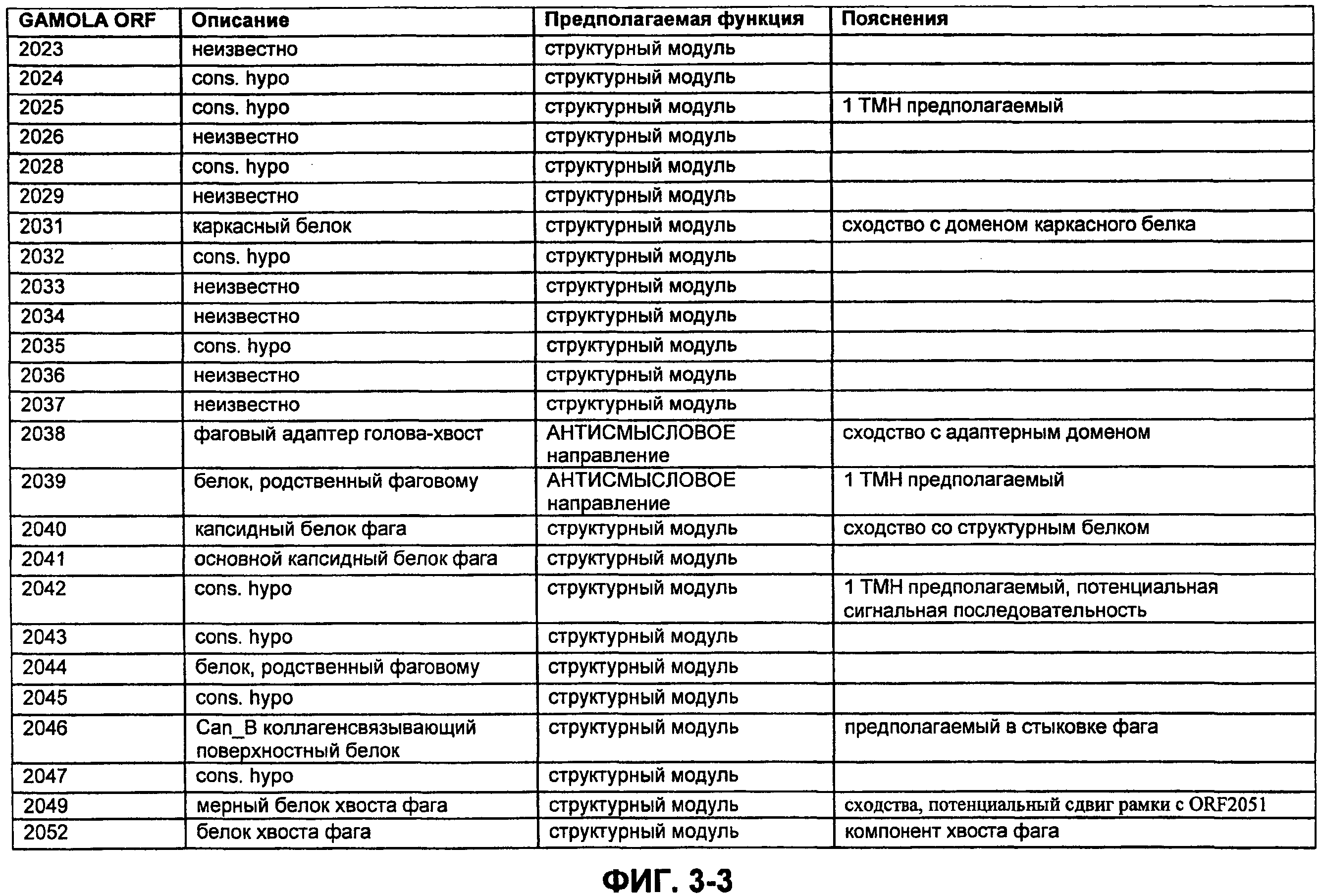
ФИГ. 3. Открытая рамка считывания профага φmru, пояснения, прогнозируемая функция и комментарии.
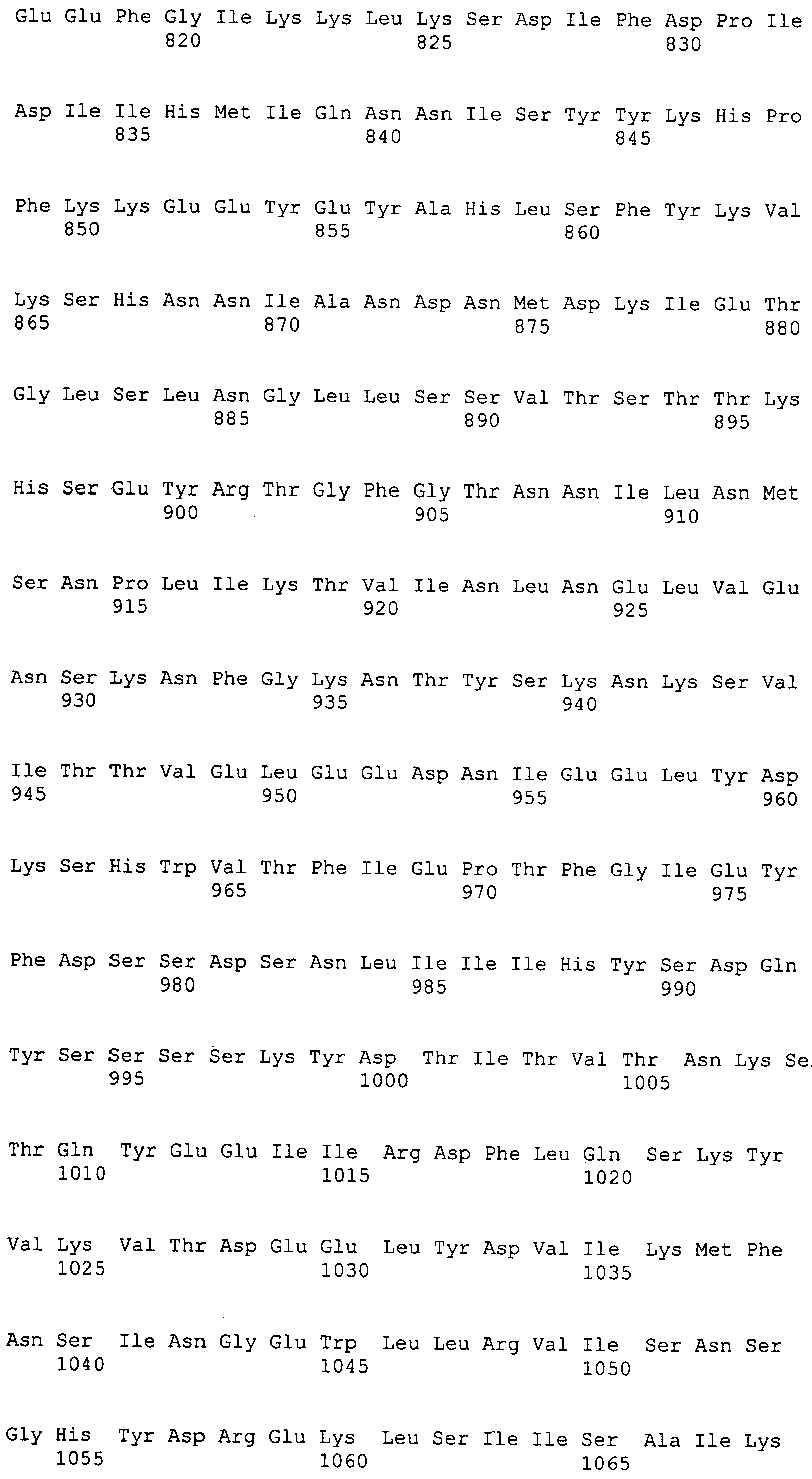
ФИГ. 4A-4B. M. ruminantium профаг φmru, информация о последовательности, включая кодирующие последовательности фага φmru (ФИГ. 4A), и аминокислотные последовательности фага φmru (ФИГ. 4B).
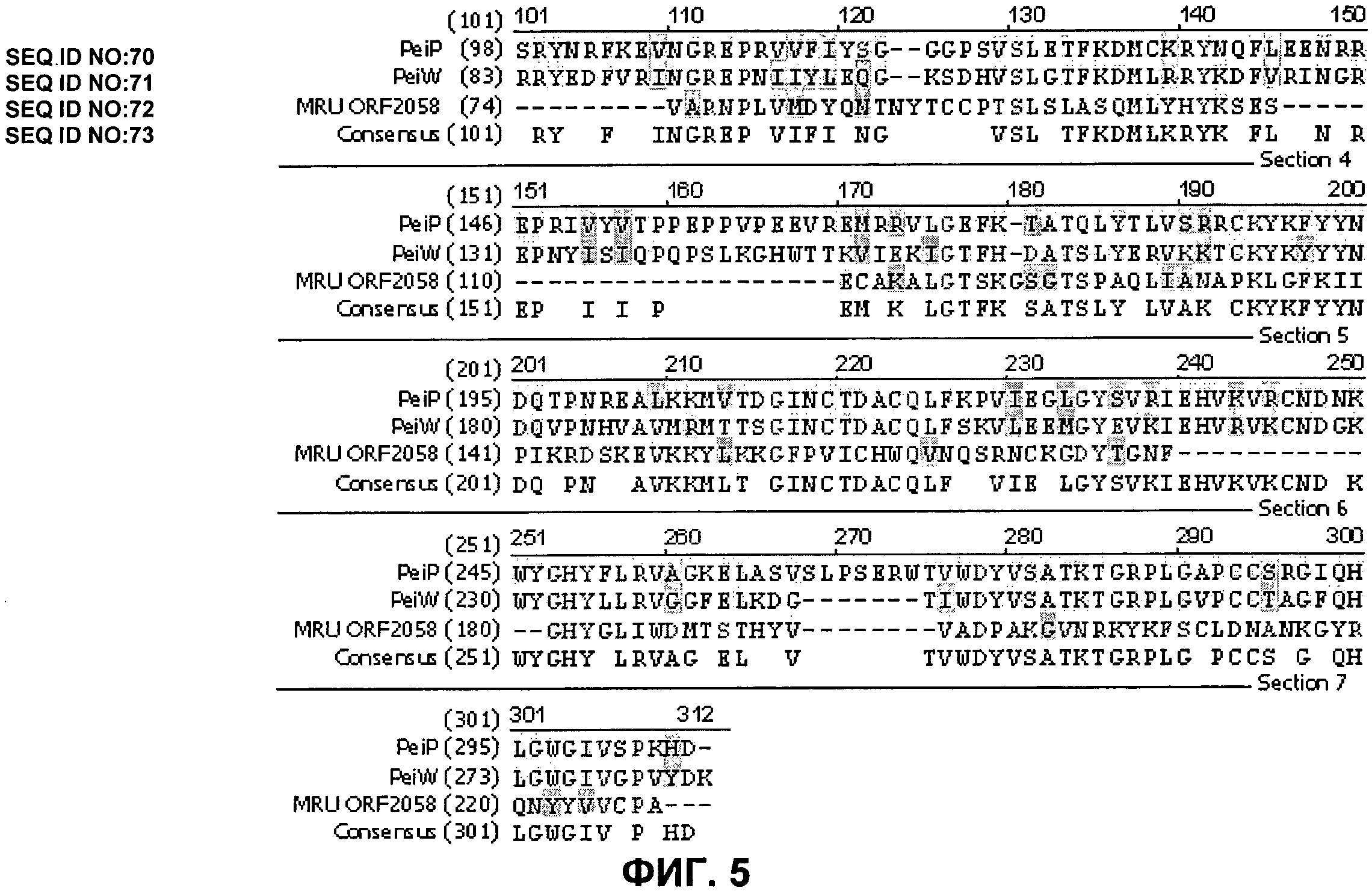
ФИГ. 5. Выравнивание последовательностей фага φmru ORF 2058 с PeiP из M. marburgensis и PeiW из M. wolfeii.
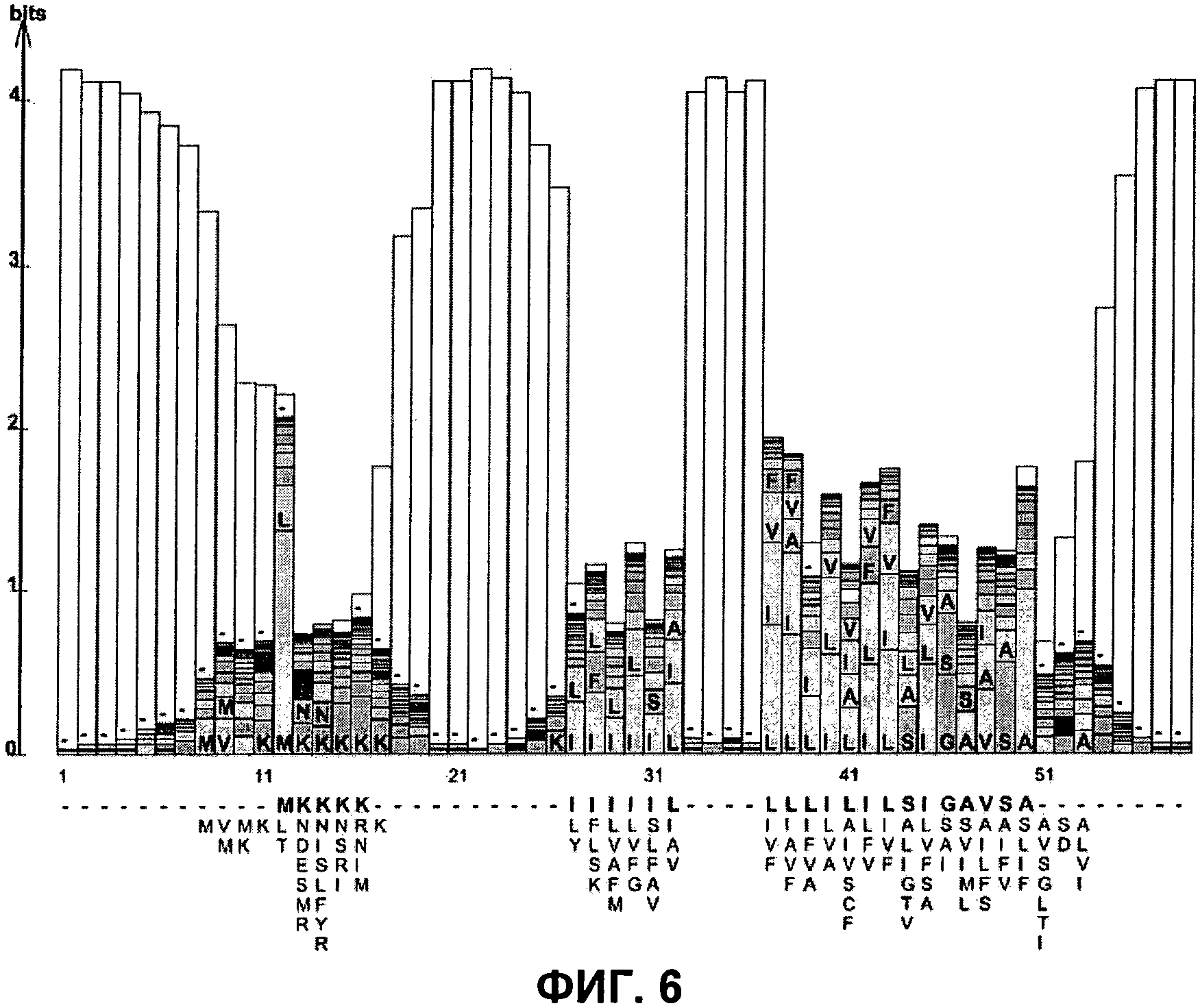
ФИГ. 6: Белковая последовательность logo последовательностей сигнального пептида из M. ruminantium, полученная с помощью LogoBar, демонстрирующая коровый консенсусный сигнал.
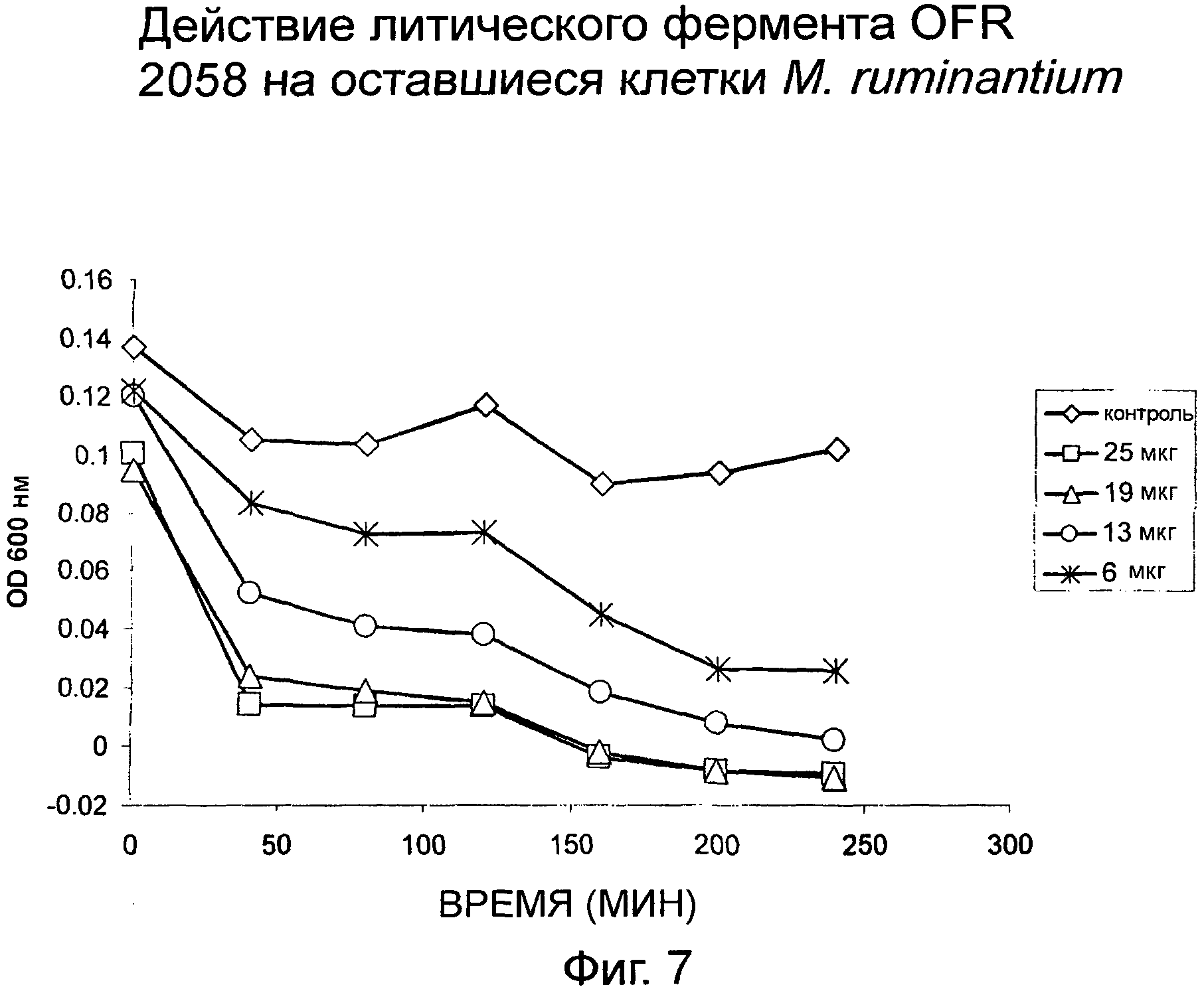
ФИГ. 7: Ингибирующее действие ORF 2058 на оставшиеся клетки M. ruminantium.
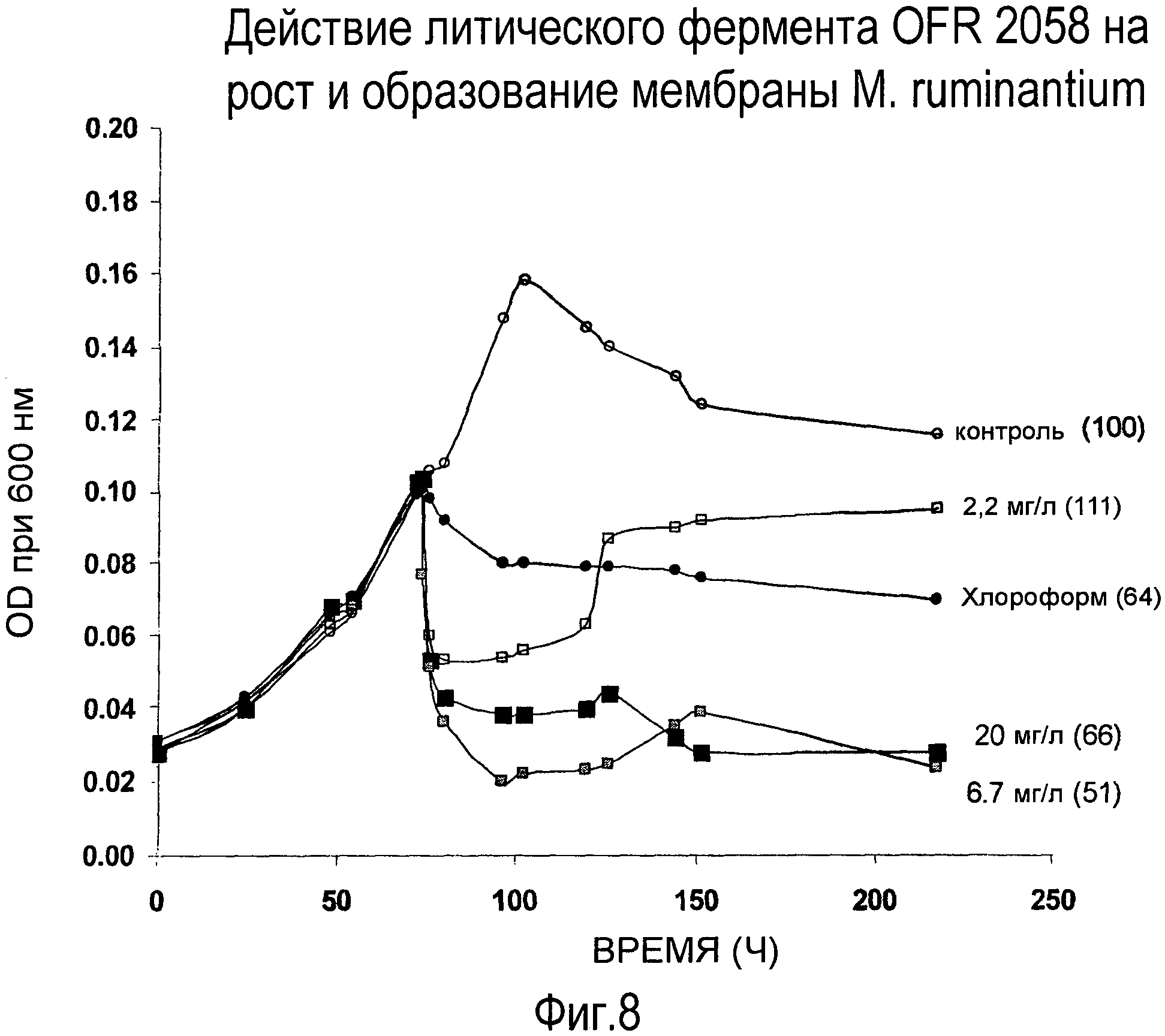
ФИГ. 8: Ингибирующее действие ORF 2058 на рост клеток M. ruminantium и продукцию метана.
Подробное описание изобретения
Определения
«Измененные» последовательности нуклеиновых кислот, кодирующие фаговые полипептиды, в контексте настоящего изобретения, включают последовательности с делециями, вставками или заменами различных нуклеотидов, приводящие в результате к полинуклеотиду, который предпочтительно кодирует те же или функционально эквивалентные полипептиды. Кодируемый полипептид или антитело также может быть «измененным» и содержать делеции, вставки или замены аминокислотных остатков, которые дают молчащее изменение и приводят к функционально эквивалентному полипептиду. Преднамеренные аминокислотные замены могут быть сделаны на основе сходства в полярности, заряде, растворимости, гидрофобности, гидрофильности, и/или амфипатической природы остатков, при условии сохранения биологической активности (например, ассоциации с клеткой или проникновения в клетку или лизиса клетки), или иммунологической активности (например, одного или нескольких антителосвязывающих сайтов) этого полипептида. Например, отрицательно заряженные аминокислоты могут включать аспарагиновую и глутаминовую кислоту; положительно заряженные аминокислоты могут включать лизин и аргинин; и аминокислоты с незаряженными полярными концевыми группами, имеющими сходные значения гидрофобности, могут включать лейцин, изолейцин и валин, глицин и аланин, аспарагин и глутамин, серин и треонин, и фенилаланин и тирозин.
«Аминокислотная последовательность» в контексте настоящего изобретения, относится к олигопептиду, пептиду, полипептиду или белковой последовательности, или любым их фрагментам, и к природным, рекомбинантным, синтетическим или полусинтетическим молекулам. Последовательности по изобретению содержат по меньшей мере 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 100, 150, 200, 250 аминокислот, предпочтительно по меньшей мере 5-10, от 10-20, от 20-30, 30-40, 40-50, 50-100, 100-150, 150-200, или 200-250, или 250-4000 аминокислот, и предпочтительно сохраняют биологическую активность (например, ассоциацию с клеткой, проникновение в клетку или лизис клетки) или иммунологическую активность (например, один или несколько сайтов связывания с антителом) исходной последовательности. В тех случаях, когда «аминокислотная последовательность», цитируемая в настоящем описании, относится к аминокислотной последовательности молекулы природного полипептида, считается, что аминокислотная последовательность и подобные термины не ограничивают аминокислотную последовательность до полной, исходной аминокислотной последовательности, связанной с полноразмерной молекулой.
«Амплификация» в контексте настоящего изобретения относится к получению дополнительных копий последовательности нуклеиновой кислоты и в основном проводится с помощью методик полимеразной цепной реакции (ПЦР), хорошо известных из уровня техники (Dieffenbach, C. W. and G. S. Dveksler (1995) PCR Primer, a Laboratory Manual, Cold Spring Harbor Press, Plainview, NY).
Термин «антитело» следует понимать в самом широком смысле и предполагается включение интактных моноклональных антител и поликлональных антител. Этот термин также охватывает фрагменты и производные антител, при условии, что они демонстрируют желаемую биологическую активность. Антитела охватывают молекулы иммуноглобулинов и иммунологически активные части молекул иммуноглобулинов (Ig), т.е. молекулы, которые содержат антигенсвязывающий сайт, который специфически связывается (иммунологически взаимодействует) с антигеном. Антитела включают, но не только, поликлональные, моноклональные, химерные, одноцепочечные, Fc, Fab, Fab', и Fab2 фрагменты и экспрессионную библиотеку Fab.
Молекулы антитела относятся к любому из классов IgG, IgM, IgA, IgE, и IgD, которые отличаются друг от друга природой тяжелой цепи, находящейся в молекуле. Эти молекулы также включают подклассы, такие как IgG1, IgG2, и другие. Легкая цепь может представлять собой каппа цепь или лямбда цепь. Ссылка в настоящем описании на антитела включает ссылку на все классы, подклассы и типы. Также включены химерные антитела, например моноклональные антитела или их фрагменты, которые специфичны более чем к одному источнику, например одной или более, последовательностям мыши, человека или жвачного животного. Дополнительно включены антитела верблюдовых или нанотела. Будет понятно, что каждая ссылка на «антитела» или любой подобный термин в настоящем описании включает интактные антитела, а также любые их фрагменты, измерения, производные или варианты.
Термины «биологически активный» или «функциональный», в контексте настоящего описания, относятся к полипептиду, сохраняющему одну или несколько структурных, биологических или биохимических функций (например, ассоциацию с клеткой, проникновение в клетку или лизис клетки) последовательности.
Термины «клеточный ингибитор» или «ингибитор», в контексте настоящего писания, относятся к средствам, которые снижают или блокируют рост или репликацию микробных клеток, в особенности клеток метанопродуцентов. Клеточный ингибитор может действовать для снижения или блокировки, например, клеточного деления. Ингибитор может снижать или блокировать, например, синтез ДНК, синтез РНК, синтез белка, или посттрансляционные модификации. Ингибитор также может снижать или блокировать активность ферментов, вовлеченных в каскад образования метана. Ингибитор может делать мишенью клетку для распознавания компонентами иммунной системы. Ингибирование клетки также включает уничтожение клетки и клеточную гибель, например, в результате лизиса, апоптоза, некроза, и т.д. Подходящие ингибиторы включают, но не только, соединения против образования метана (например, бромэтансульфоновую кислоту), антитела и фрагменты антител, лизирующие ферменты, пептид-нуклеиновые кислоты, антимикробные пептиды и другие антибиотики, подробно описанные в настоящей заявке.
Термины «комплементарный» или «комплементарность», в контексте настоящего изобретения, относятся к природному связыванию полинуклеотидов в пермиссивных солевых и температурных условиях путем спаривания оснований. Для последовательности A-G-T комплементарной последовательностью является T-C-A, обратно комплементарная последовательность представляет собой A-C-T, и обратная последовательность представляет собой T-G-A. Комплементарность между двумя одноцепочечными молекулами может быть частичной, при которой только некоторые из нуклеиновых кислот связываются, или может быть полной, когда существует абсолютная комплементарность между одноцепочечными молекулами. Степень комплементарности между цепями нуклеиновых кислот оказывает существенные воздействия на эффективность и прочность гибридизации между цепями нуклеиновых кислот. Это имеет особое значение в реакциях амплификации, которые зависят от связывания между цепями нуклеиновых кислот, и в создании и применении молекул ПНК.
Термин «производное» в контексте настоящего изобретения относится к химической модификации нуклеиновой кислоты, кодирующей фаговый полипептид, или нуклеиновой кислоты, комплементарной ей. Такие модификации включают, например, замену водорода алкилом, ацилом, или аминогруппой. В предпочтительных аспектах, производное нуклеиновой кислоты кодирует полипептид, который сохраняет биологическую или иммунологическую функцию природной молекулы. Производный полипептид представляет собой полипептид, который модифицирован путем гликозилирования, пэгилирования или любым аналогичным способом, который сохраняет одну или несколько биологических функций (например, ассоциацию с клеткой, проникновение в клетку или лизис клетки) или иммунологическую функцию последовательности, производным которой он является.
Термин «гомология» в контексте настоящего изобретения относится к степени комплементарности. Гомология может быть частичной (т.е. идентичность менее 100%) или полной (т.е. 100% идентичность). Частично комплементарную последовательность, которая по меньшей мере частично ингибирует гибридизацию идентичной последовательности с целевой нуклеиновой кислотой, называют с использованием функционального термина «по существу гомологичная». Ингибирование гибридизации полностью комплементарной последовательности с целевой последовательностью может быть исследовано с помощью гибридизационного анализа (Саузерн или нозерн блот, гибридизация в растворе и подобное) в условиях низкой жесткости. По существу гомологичная последовательность или гибридизационный зонд будет конкурировать за связывание или ингибировать связывание полностью гомологичной последовательности с целевой последовательностью в условиях низкой жесткости. Нельзя сказать, что условия низкой жесткости таковы, что допускается неспецифическое связывание; условия низкой жесткости требуют, чтобы связывание двух последовательностей друг с другом было специфичным (т.е. селективным) взаимодействием.
Термин «гибридизация» в контексте настоящего изобретения относится к любому процессу, посредством которого цепь нуклеиновой кислоты связывается с комплементарной цепью посредством спаривания оснований.
«Вставка» или «добавление» в контексте настоящего изобретение относится к изменению в аминокислотной или нуклеотидной последовательности, приводящему к добавлению одного или нескольких аминокислотных остатков или нуклеотидов, соответственно, по сравнению с природной молекулой.
«Метанопродуцент» в контексте настоящего изобретения относится к микроорганизмам, которые продуцируют газ метан, которые включают Methanobrevibacter, Methanothermobacter, Methanomicrobium, Methanobacterium, и Methanosarcina. Характерные метанопродуценты включают, но не только, Methanobrevibacter ruminantium, Methanobrevibacter smithii, Methanobrevibacter acididurans, Methanobrevibacter thaueri, Methanobacterium bryantii, Methanobacterium formicicum, Methanothermobacter marburgensis, Methanothermobacter wolfeii, Methanosphaera stadtmanae, Methanomicrobium mobile, Methanosarcina barkeri, Methanosarcina mazei, Methanococcoides burtonii, и Methanolobus taylorii. Все рода и виды метанопродуцентов охватываются этим термином.
«Микробные» клетки в контексте настоящего изобретения относятся к природным или генетически модифицированным микробным клеткам, в том числе архебактериям, таким как метанопродуценты, галофилы и термоацидофилы, и эубактериям, таким как цианобактерии, спирохеты, протеобактерии, а также грамположительным и грамотрицательным бактериям.
Термин «модифицированная» относится к измененным последовательностям и к фрагментам, вариантам и производным последовательностей, описанных в настоящем изобретении.
«Последовательность нуклеиновой кислоты» или «нуклеотидная последовательность» в контексте настоящего изобретения относится к последовательности полинуклеотида, олигонуклеотида или их фрагментам, и к ДНК или РНК природного, рекомбинантного, синтетического или полусинтетического происхождения, которая может быть односпиральной или двухспиральной, и может представлять смысловую или антисмысловую цепь, и кодирующие или некодирующие области. Последовательности по настоящему изобретению наиболее предпочтительно включают последовательности, кодирующие полипептид, которые содержат по меньшей мере 12, 15, 30, 45, 60, 75, 90, 105, 120, 135, 150, 300, 450, 600, 750 нуклеотидов, предпочтительно по меньшей мере 15-30, 30-60, 60-90, 90-120, 120-150, 150-300, 300-450, 450-600, или 600-750 нуклеотидов, или по меньшей мере 1000 нуклеотидов, или по меньшей мере 1500 нуклеотидов. Будет понятно, что каждая ссылка на «последовательность нуклеиновой кислоты» или «нуклеотидную последовательность» в настоящем изобретении будет включать исходную полноразмерную последовательность, а также любые ее комплементнарные последовательности, фрагменты, изменения, производные или варианты.
Термин «олигонуклеотид» относится к последовательности нуклеиновой кислоты, содержащей по меньшей мере 6, 8, 10, 12, 15, 18, 21, 25, 27, 30 или 36 нуклеотидов, или по меньшей мере от 12 до 36 нуклеотидов, или по меньшей мере от 15 до 30 нуклеотидов, которая может быть использована, например, в ПЦР амплификации, секвенировании или гибридизационных анализах. В контексте настоящего изобретения олигонуклеотид по существу является эквивалентным терминам «амплимеры», «праймеры», «олигомеры», «олиги» и «зонды», как обычно определено в данной области.
«Полипептид» в контексте настоящего изобретения относится к выделенным полипептидам по изобретению, полученным из любых видов, предпочтительно микробных, из любого источника, природного ли, синтетического, полусинтетического или рекомбинантного. В особенности фаговый полипептид может быть получен из клеток метанопродуцентов, таких как клетки Methanobrevibacter, в частности клеток M. ruminantium, или M. smithii. Для рекомбинантного получения полипептид по настоящему изобретению может быть получен из микробных или эукариотических клеток, например, Escherichia, Streptomyces, Bacillus, Salmonella, дрожжей, клеток насекомых, таких как Drosophila, клеток животных, таких как клетки COS и CHO, или клеток растений. Будет понятно, что каждая ссылка на «полипептид» в контексте настоящего изобретению будет включать исходную, полноразмерную последовательность, а также любые ее изменения, производные или варианты.
Термин «полинуклеотид», используемый в единственном или множественном числе, в основном относится к любой последовательности нуклеиновой кислоты, например любому полирибонуклеотиду или полидезоксирибонуклеотиду, которые могут представлять собой немодифицированную РНК или ДНК, или модифицированную РНК или ДНК. Этот термин включает, без ограничения, одноцепочечную и двухцепочечную ДНК, ДНК, содержащую односпиральные и двухспиральные области, односпиральную и двухспиральную РНК и РНК, содержащую односпиральные и двухспиральные области, гибридные молекулы, содержащие ДНК и РНК, которые могут быть односпиральными или, чаще, двухспиральными, или содержат односпиральные и двухспиральные области. Также включены РНК или ДНК, содержащие трехспиральные области, или как РНК, так и ДНК. В особенности включены мРНК, кДНК и геномные ДНК, и любые их фрагменты. Этот термин включает ДНК и РНК, которые содержат одно или несколько модифицированных оснований, таких как оснований, меченых тритием, или необычных оснований, таких как инозин. Полинуклеотиды по настоящему изобретению могут охватывать кодирующие или некодирующие последовательности, или смысловые или антисмысловые последовательности, или iРНК, такие как siРНК. Будет понятно, что каждая ссылка на «полинуклеотид» или подобный термин в контексте настоящего изобретения будет включать полноразмерные последовательности, а также любые их комплементарные последовательности, фрагменты, измерения, производные или варианты.
«Пептид-нуклеиновая кислота» или «ПНК» в контексте настоящего изобретения относится к антисмысловой молекуле, или противогенному средству, которая содержит основания, связанные через пептидный скелет.
Термин «жвачное животное» в контексте настоящего изобретения относится к животным, у которых имеется рубец как особый тип пищеварительного органа. Жвачные животные включают, но не только, крупный рогатый скот, овец, коз, быков, лосей, карибу и оленей.
Термины «условия жесткости» или «жесткость» в контексте настоящего изобретения относятся к условиям гибридизации, определяемым нуклеиновой кислотой, солью и температурой. Эти условия хорошо известны из уровня техники и могут быть изменены в порядке для идентификации или выявления идентичных или родственных полинуклеотидных последовательностей. Смотри, например, Sambrook, J. et al. (1989) Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press, Plainview, NY, and Ausubel, F. M. et al. (1989) Current Protocols in Molecular Biology, John Wiley & Sons, New York, NY. Многочисленные эквивалентные условия, предусматривающие либо низкую, либо высокую жесткость, зависят от таких факторов, как длина и природа последовательности (ДНК, РНК, нуклеотидный состав), природы мишени (ДНК, РНК, нуклеотидный состав), окружающих условий (в растворе или иммобилизованы на твердом субстрате), концентрации солей или других компонентов (например, формамида, декстран сульфата и/или полиэтиленгликоля), и температуры реакций (в пределах интервала примерно от 5°C ниже температуры плавления зонда примерно до 20°C-25°C ниже температуры плавления). Один или несколько факторов могут быть изменены для создания условий либо низкой, либо высокой жесткости, отличных от перечисленных выше условий, но эквивалентных им.
Термин «индивид» включает людей и животных, не относящихся к людям. Животные, не относящиеся к людям, включают, но не только, птиц и млекопитающих, таких как жвачные животные, и, в частности, мышей, кроликов, кошек, собак, свиней, овец, коз, коров и лошадей.
Термины «по существу очищенный» или «выделенный» в контексте настоящего изобретения относится к последовательностям нуклеиновых или аминокислот, которые выделены из их клеточной, рекомбинантной или синтетической среды, и по меньшей мере на 60% свободны, предпочтительно на 75% свободны, и наиболее предпочтительно по меньшей мере на 90% свободны или по меньшей мере на 99% свободны от других компонентов, с которыми они связаны в клеточной, рекомбинантной или синтетической среде.
«Трансформация» в контексте настоящего изобретения описывает процесс, посредством которого экзогенная ДНК входит и изменяет клетку-реципиент. Это может происходить в природных или искусственных условиях с использованием различных способов, хорошо известных в данной области. Трансформация может основываться на любом известном способе вставки последовательностей чужеродных нуклеиновых кислот в прокариотическую или эукариотическую клетку-хозяина. Способ выбирают, исходя из типа трансформируемой клетки-хозяина, и может включать, но не только, вирусное инфицирование, электропорацию, тепловой шок, липофекцию и бомбардировку частицами. Такие «трансформированные» клетки включают стабильно трансформированные клетки, в которых вставленная ДНК способна к репликации либо в виде автономно реплицирующейся плазмиды, либо как часть хромосомы хозяина. Они также включают клетки, которые транзиторно экспрессируют вставленную ДНК или РНК в течение ограниченных периодов времени.
«Вариант» полипептида в контексте настоящего изобретения относится к аминокислотной последовательности, которая изменена одной или несколькими аминокислотами. Вариант полинуклеотида изменен одним или несколькими нуклеотидами. Вариант может приводить к получению «консервативных» изменений, при которых замещенная аминокислота обладает аналогичными структурными или химическими свойствами, например замена лейцина изолейцином. Реже вариант может приводить к получению «неконсервативных» изменений, например замена глицина триптофаном. Аналогичные незначительные изменения также могут включать аминокислотные делеции или вставки, или и то, и другое. Руководство по определению, какие аминокислотные остатки могут быть заменены, вставлены или удалены без потери биологической или иммунологической активности, можно найти, используя компьютерные программы, хорошо известные в данной области, например программное обеспечение LASERGENE (DNASTAR).
Настоящее изобретение также охватывает варианты, которые по меньшей мере сохраняют одну биологическую активность (например, ассоциацию с клеткой, проникновение в клетку или лизис клетки) или иммунологическую активность полипептида. Предпочтительным вариантом является вариант, имеющий по существу такую же или функционально эквивалентную последовательность, например, по меньшей мере на 80%, и более предпочтительно по меньшей мере на 90%, идентичную описанной последовательности. Наиболее предпочтительным вариантом является вариант, последовательность которого по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5%, по меньшей мере на 99,8%, или по меньшей мере на 99,9% идентична последовательности, описанной в настоящем изобретении. Процент идентичности определяется путем выравнивания двух сравниваемых последовательностей, как описано ниже, определения числа идентичных остатков в выровненной части, деления этого числа на общее число остатков в последовательности по изобретению (искомой), и умножения этого результата на 100. Подходящей программой выравнивания является AlignX (Vector NTI).
Описание изобретения
Метан образуется в передней части пищеварительного тракта жвачных животных метанопродуцентами, которые действуют как конечные восстановители углерода в системе рубца. Многостадийный путь образования метана хорошо освещен, главным образом из изучения метанопродуцентов не жвачных животных, но адаптации, которые позволяют метанопродуцентам расти и персистировать в рубце, не совсем понятны. Methanobrevibacter ruminantium является известным метанопродуцентом у новозеландских жвачных животных. Как описано в настоящей заявке, размер генома M. ruminantium был секвенирован и было показано, что он составляет приблизительно 3,0 Mb, с содержанием GC 33,68%. Неожиданно было обнаружено, что геном M. ruminantium содержит профаговую последовательность (обозначенную φmru) с различными функциональными модулями, кодирующими интеграцию фага, репликацию ДНК и упаковку, капсидные белки, лизис и функции лизогенной конверсии.
Фаг M. ruminantium был идентифицирован во время секвенирования с высокой пропускной способностью, когда было обнаружено, что область генома 30-40 Kb высоко представлена в секвенированных клонах. Это дает возможность предположить, что часть генома была представлена в более высоком числе копий, чем нормальный, и могла быть приписана репликации резидентного фага. Высоко представленная область была изучена, и подробные биоинформационные анализы предполагаемых присутствовавших открытых рамок считывания указывали на то, что она содержала фаг-подобные гены. Было показано, что область с низким содержанием GC, обнаруженная на дистальном конце фаговой последовательности (лизогенная конверсия), содержит прогнозируемую систему модификации ДНК под действием серы (dnd), которая может обеспечивать дополнительную модификацию ДНК хозяина или чужеродной ДНК. Профаговая последовательность M. ruminantium подробно описана в настоящей заявке. В различных аспектах настоящего изобретения профаговые полинуклеотиды и полипептиды могут быть использованы в качестве средств для ингибирования метанопродуцентов и/или образования метана в рубце, и для дальнейшего выяснения роли M. ruminantium в образовании метана.
Настоящее изобретение, следовательно, относится к фаговым полипептидам, в том числе те, которые содержат по меньшей мере одну из последовательностей SEQ ID NO:1-69, и их фрагментам, вариантам и производным. Настоящее изобретение также относится к применению этих полипептидов для направленной доставки и ингибирования микробных клеток, в особенности клетки метанопродуцентов. Настоящее изобретение дополнительно относится к применению полипептидов для ингибирования роста или репликации таких клеток. Полипептиды по настоящему изобретению могут быть экспрессированы и использованы в различных анализах для определения их биологической активности. Эти полипептиды могут быть использованы для крупномасштабного синтеза и протоколов выделения, например, для коммерческого получения. Такие полипептиды могут быть использованы для индукции антител, для выделения соответствующих последовательностей антител, и для количественного определения уровней аминокислотных последовательностей. Полипептиды по настоящему изобретению также могут быть использованы в качестве композиций, например фармацевтических композиций, и в качестве добавок к корму, например компонентов корма для жвачных животных. Полипептиды по настоящему изобретению также приносят пользу здоровью. В аспектах, связанных со здоровьем, ингибиторы метанопродуцентов могут быть использованы для возвращения энергии индивиду, которая обычно теряется в виде метана. В конкретных аспектах, устройства медленного высвобождения в рубце могут быть использованы совместно с полипептидами и композициями (например, фармацевтическими композициями и добавкам к кормам) по настоящему изобретению.
Полипептиды по настоящему изобретению содержат по меньшей мере одну последовательность, выбранную из группы, состоящей из: (a) полипептидов, содержащих по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:1-69, или ее фрагментов, вариантов или производных; (b) полипептидов, содержащих функциональный домен по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-69, и ее фрагментов и вариантов; и (c) полипептидов, содержащих по меньшей мере конкретно указанное количество смежных остатков по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-69, или ее вариантов или производных. В одном варианте осуществления, изобретение относится к выделеному полипептиду, содержащему аминокислотную последовательность, по меньшей мере одну из SEQ ID NO:1-69. Все вместе эти последовательности в настоящем описании называются полипептидами по изобретению.
Настоящее изобретение также относится к полинуклеотидам, которые кодируют по меньшей мере один фаговый полипептид, в том числе SEQ ID NO:1-69, и их фрагментам, вариантам и производным. Настоящее изобретение также относится к применению этих полинуклеотидов для получения векторов экспрессии и клеток-хозяев для направленной доставки и ингибирования микробных клеток, в особенности клетки метанопродуцентов. Настоящее изобретение дополнительно охватывает применение этих полинуклеотидов для ингибирования роста или репликации таких клеток. Выделенные полинуклеотиды по настоящему изобретению также применимы в картировании генома, в физическом картировании и в клонировании генов более или менее родственного фага. Зонды, полученные с использованием полинуклеотидов по настоящему изобретению, могут быть использованы для выявления наличия и изучения профилей экспрессии генов в любом организме, имеющем достаточно гомологичные ДНК и РНК последовательности в их клетках, используя методики, которые хорошо известны в данной области, такие как слот-блоттинг или анализы на микрочипах. Праймеры, полученные с использованием полинуклеотидов по настоящему изобретению, могут быть использованы для секвенирования и ПЦР амплификаций. Полинуклеотиды по настоящему изобретению также могут быть использованы в качестве композиций, например фармацевтических композиций, и в качестве кормовых добавок, например компонентов корма для жвачных животных. Полинуклеотиды по настоящему изобретению также приносят пользу здоровью. Для такого применения полинуклеотиды могут быть представлены в виде векторов экспрессии или клеток-хозяев, содержащих векторы экспрессии. В конкретных аспектах, могут быть использованы устройства медленного высвобождения в рубце совместно с полинуклеотидами, векторами, клетками-хозяевами и композициями (например, фармацевтическими композициями и кормовыми добавками) по настоящему изобретению.
Полинуклеотиды по настоящему изобретению содержат по меньшей мере одну последовательность, выбранную из группы, состоящей из: (a) последовательностей, содержащих кодирующую последовательность по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-69, или ее фрагментов или вариантов; (b) комплементарных последовательностей, обратных последовательностей и обратно комплементарных кодирующим последовательностям по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-69, или ее фрагментов или вариантов; (c) открытых рамок считывания, содержащихся в кодирующей последовательности по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-69, и их фрагментов и вариантов; (d) функциональных доменов кодирующей последовательности по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-69, и ее фрагментов и вариантов; и (e) последовательностей, содержащих по меньшей мере конкретно указанное количество смежных остатков кодирующей последовательности по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-69, или ее вариантов. В одном варианте осуществления, настоящее изобретение охватывает выделенный полинуклеотид, содержащий кодирующую последовательность по меньшей мере одной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-69.
Полинуклеотиды по настоящему изобретению содержат по меньшей мере одну последовательность, выбранную из группы, состоящей из: (a) последовательностей, содержащих по меньшей мере одну последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:74-142, или ее фрагментов или вариантов; (b) комплементарных последовательностей, обратных последовательностей и обратно комплементарных последовательностей кодирующей последовательности по меньшей мере одной последовательности нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO:74-142, или ее фрагментов или вариантов; (c) открытых рамок считывания, содержащихся в последовательности нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO:74-142, и их фрагментов и вариантов; (d) функциональных доменов кодирующей последовательности по меньшей мере одной последовательности нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO:74-142, и ее фрагментов и вариантов; и (e) последовательностей, содержащих по меньшей мере конкретно указанное количество смежных остатков по меньшей мере одной последовательности нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO:74-142, или ее вариантов. Также представлены олигонуклеотидные зонды и праймеры и их варианты, полученные из любой из описанных последовательностей. Все эти полинуклеотиды и олигонуклеотиды в контексте настоящей заявки вместе называются полинуклеотидами по настоящему изобретению.
Специалистам в данной области будет понятно, что как результат вырожденности генетического кода может быть получено множество нуклеотидных последовательностей, кодирующих полипептиды по настоящему изобретению, до некоторой степени несущие минимальную гомологию в отношении нуклеотидных последовательностей любого известного и природного гена. Следовательно, в настоящем изобретении рассматриваются все без исключения возможные варианты нуклеотидной последовательности, которая могла быть получена путем выбора сочетаний, исходя из возможных выборов кодонов. Эти сочетания получают в соответствии со стандартным триплетным генетическим кодом бактерий, применительно к природным аминокислотным последовательностям, и все такие варианты считаются описанными особо.
Нуклеотидные последовательности, которые кодируют фаговые полипептиды, или их фрагменты или варианты, предпочтительно способны гибридизироваться с нуклеотидной последовательностью природной последовательности в соответственно выбранных условиях жесткости. Однако может быть предпочтительным получить нуклеотидные последовательности, кодирующие полипептид или его фрагмент или производное, обладающие по существу иной частотой использования кодона. Кодоны могут быть выбраны для повышения скорости, при которой экспрессия этого полипептида происходит в конкретном прокариотическом или эукариотическом хозяине в соответствии с частотой, с которой конкретные кодоны используются этим хозяином. Например, кодоны могут быть оптимизированы для экспрессии в E. coli в соответствии с известными способами. Другие причины для изменения в значительной степени нуклеотидной последовательности, кодирующей полипептиды и ее производные без изменения кодируемых аминокислотных последовательностей, включают получение РНК транскриптов, обладающих более желаемыми свойствами, такими как более длительный период полужизни, чем у транскриптов, полученных из природной последовательности.
Настоящее изобретение также охватывает получение последовательностей ДНК, или их фрагментов, которые кодируют полипептиды, или их фрагменты или варианты, исключительно путем синтетической химии. После получения синтетическая последовательность может быть встроена в любой из многих доступных векторов экспрессии и клеточные системы с использованием реактивов, которые хорошо известны в данной области. Более того, синтетическая химия может быть использована для введения мутаций в последовательность, кодирующую полипептид, или любые их варианты или фрагменты. Изобретение также охватывает полинуклеотидные последовательности, которые способны гибридизироваться с заявленными нуклеотидными последовательностями, и, в частности, показанными в SEQ ID NO:74-149, или их комплементарными последовательностями, в различных условиях жесткости, как описано у Wahl, G. M. и S. L. Berger (1987; Methods Enzymol. 152:399-407) и Kimmel, A. R. (1987; Methods Enzymol. 152:507-511).
Способы секвенирования ДНК, которые хорошо известны и в основном доступны в данной области, могут быть использованы для практического осуществления любого из вариантов осуществления настоящего изобретения. В способах могут использоваться такие ферменты, как Klenow фрагмент ДНК полимеразы I, SEQUENASE (U.S. Biochemical Corp, Cleveland, OH), Taq полимераза (Perkin Elmer), термостабильная T7 полимераза Amersham Pharmacia Biotech (Piscataway, NJ), или сочетания полимераз и корректирующих экзонуклеаз, таких как находящиеся в системе ELONGASE Amplification System, продаваемой Life Technologies (Gaithersburg, MD). Предпочтительно, этот процесс автоматизирован такими устройствами, как Hamilton Micro Lab 2200 (Hamilton, Reno, NV), Peltier Thermal Cycler (PTC200; MJ Research, Watertown, MA) ABI Catalyst и 373 и 377 DNA Sequencers (Perkin Elmer), или Genome Sequencer 20TM (Roche Diagnostics).
Последовательности нуклеиновой кислоты, кодирующие эти полипептиды, могут быть удлинены с использованием неполной нуклеотидной последовательности и с применением различных способов, известных в данной области для выявления вышележащих последовательностей, таких как промоторы и регуляторные элементы и нижележащие элементы, такие как терминаторы и некодирующие РНК структуры. Например, в одном способе, который может быть применен, ПЦР «сайт-рестрикции», используются универсальные праймеры для поиска неизвестной последовательности, смежной с известным локусом (Sarkar, G. (1993) PCR Methods Applic. 2:318-322). В частности, геномную ДНК сначала амплифицировали в присутствии праймера к линкерной последовательности и праймера, специфичного для известного участка. Амплифицированные последовательности затем подвергали второму раунду ПЦР с тем же линкерным праймером и другим специфичным праймером, находящимся внутри первого. Продукты каждого раунда ПЦР транскрибированы с подходящей РНК-полимеразой с последующим использованием обратной транскриптазы.
Другим подходящим способом является обратная ПЦР, также называемая IPCR (смотри, например, Ochman H, Gerber AS, Hartl DL. Genetics. 1988 Nov;120(3):621-3). Обратная ПЦР может быть использована в тех случаях, когда известна только одна внутренная последовательность целевой ДНК. Метод обратной ПЦР включает серии расщеплений и самолигирований с ДНК, разрезаемой эндонуклеазой рестрикции. Это разрезание приводит к тому, что известная последовательность оказывается на обоих концах неизвестных последовательностей. В соответствии с этим способом целевую ДНК легко разрезать на меньшие фрагменты в несколько тысяч оснований путем расщепления рестриктазами. Затем индуцируют самолигирование при низких концентрациях, вызывая перестройку фосфатного скелета и получение кольцевого ДНК продукта лигирования. Затем целевую ДНК подвергают рестрикционному расщеплению, используя известную эндонуклеазу. В результате в пределах известной внутренней последовательности происходит разрез, порождая линейный продукт с известными терминальными последовательностями. Этот продукт можно затем использовать для стандартной ПЦР, проводимой с праймерами, комплементарными известным внутренним последовательностям.
Системы капиллярного электрофореза, которые являются коммерчески доступными, могут быть использованы для анализа размера или подтверждения нуклеотидной последовательности секвенирования или продуктов ПЦР. В частности, в капиллярном секвенировании могут использоваться текучие полимеры для электрофоретического разделения, четыре различных флуоресцентных красителя (по одному на каждый нуклеотид), которые активируются лазером, и определение испускаемых длин волн с помощью телекамеры на приборах с зарядовой связью. Выходная/интенсивность светового излучения может быть преобразована в электрический сигнал с использованием соответствующего программного обеспечения (например, GENOTYPER и Sequence NAVIGATOR, Perkin Elmer) и весь процесс от загрузки образцов до компьютерного анализа и электронного отображения данных может контролироваться компьютером. Капиллярный электрофорез особенно предпочтителен для секвенирования небольших частей ДНК, которые могут находиться в ограниченных количествах в конкретном образце.
В последнее время появилось пиросеквенирование, как эффективная методика секвенирования. См., например, Ronaghi, M. et al. 1996. Real-time DNA sequencing using detection of pyrophosphate release. Anal. Biochem. 242: 84-89; Ronaghi, M. et al. 1998. A sequencing method based on real-time pyrophosphate. Science 281: 363-365; Ronaghi, M. et al. 1999. Analyses of secondary structures in DNA by pyrosequencing. Anal. Biochem. 267: 65-71; Ronaghi 2001. Genome Res. Vol. 11, Issue 1, 3-11; Nyrén The history of pyrosequencing. Methods Mol Biol. 2007;373:1-14. Пиросеквенирование имеет преимущества в точности, гибкости, параллельной обработке данных, и может быть легко автоматизировано. Более того, эта методика обходится без необходимости в меченых праймерах, меченых нуклеотидах и гель-электрофорезе. В соответствии с этим способом полимераза катализирует включение нуклеотидов в цепь нуклеиновой кислоты. В результате такого включения высвобождаются молекулы пирофосфата и впоследствии превращаются под действием сульфурилазы в АТФ. Свечение образуется в люциферазной реакции, во время которой окисляется молекула люциферина. После добавления каждого нуклеотида проводят стадию промывания для возможности многократного добавления. Нуклеотиды непрерывно разрушаются под действием нуклеотид-разрушающего фермента, позволяя добавлять последующий нуклеотид. Пиросеквенирование с успехом применялось в качестве платформы для крупномасштабного секвенирования, в том числе геномного и метагеномного анализа (см., например, The Genome Sequencer FLX™ от 454 Life Sciences/Roche).
Система “SOLiDTM System” также была разработана для секвенирования (см., например, Applied Biosystems. Application Fact Sheet for the SOLiD™ System. Foster City, CA). Эта методика основана на последовательном лигировании олигонуклеотидов, меченных красителем, с клонально амплифицированными фрагментами ДНК, соединенными с магнитными бусами. В этом способе последовательность ДНК получают путем измерения серийного лигирования. Реакция лигирования основана на распознавании зонда, не последовательного добавления, и, следовательно, менее подвержена накоплению ошибок. Природа химизма фактически устраняет возможность случайных вставок или делеций. Стадия лигирования и обработка фосфатазой нелигированных зондов предотвращает сдвиг фаз. Дополнительно, после семи циклов лигирования исходный праймер удаляют из матрицы и новый праймер гибридизируется в позиции n-1. Использование этой фазы «перезапуска» позволяет снизить системный шум и позволяет читать более длинные последовательности. Кроме того, двухосновное кодирование используют для проведения различия между ошибками измерения в отличие от истинных полиморфизмов. Изменения в одном положении идентифицируются как случайные ошибки и могут быть удалены с помощью программного обеспечения при анализе данных. В качестве аналитической платформы система SOLiDTM System имеет применение в крупномасштабном секвенировании, цифровой генной экспрессии, ChIP и исследованиях метилирования, и особенно применима для выявления геномных вариантов.
В другом варианте осуществления настоящего изобретения, полинуклеотиды или их фрагменты, которые кодируют полипептиды, могут быть использованы в рекомбинантных молекулах ДНК для направления экспрессии полипептидов или их фрагментов или вариантов, в соответствующих клетках-хозяевах. Вследствие присущей генетическому коду вырожденности могут быть получены другие последовательности ДНК, которые кодируют по существу такую же или функционально эквивалентную аминокислотную последовательность, и эти последовательности могут быть использованы для клонирования и экспрессии фаговых полипептидов. Нуклеотидные последовательности по настоящему изобретению могут быть сконструированы с использованием способов, в основном известных в данной области для изменения последовательностей, кодирующих аминокислоты, по целому ряду причин, в том числе, но не только, изменения, которые модифицируют клонирование, процессинг и/или экспрессию генного продукта. ДНК шаффлинг путем случайной фрагментации и ПЦР пересборки фрагментов гена и синтетических олигонуклеотидов могут быть использованы для конструирования нуклеотидных последовательностей. Например, сайт-направленный мутагенез может быть использован для вставки новых сайтов рестрикции, изменения профилей гликозилирования, изменения предпочтения кодонов, введения мутаций, и так далее.
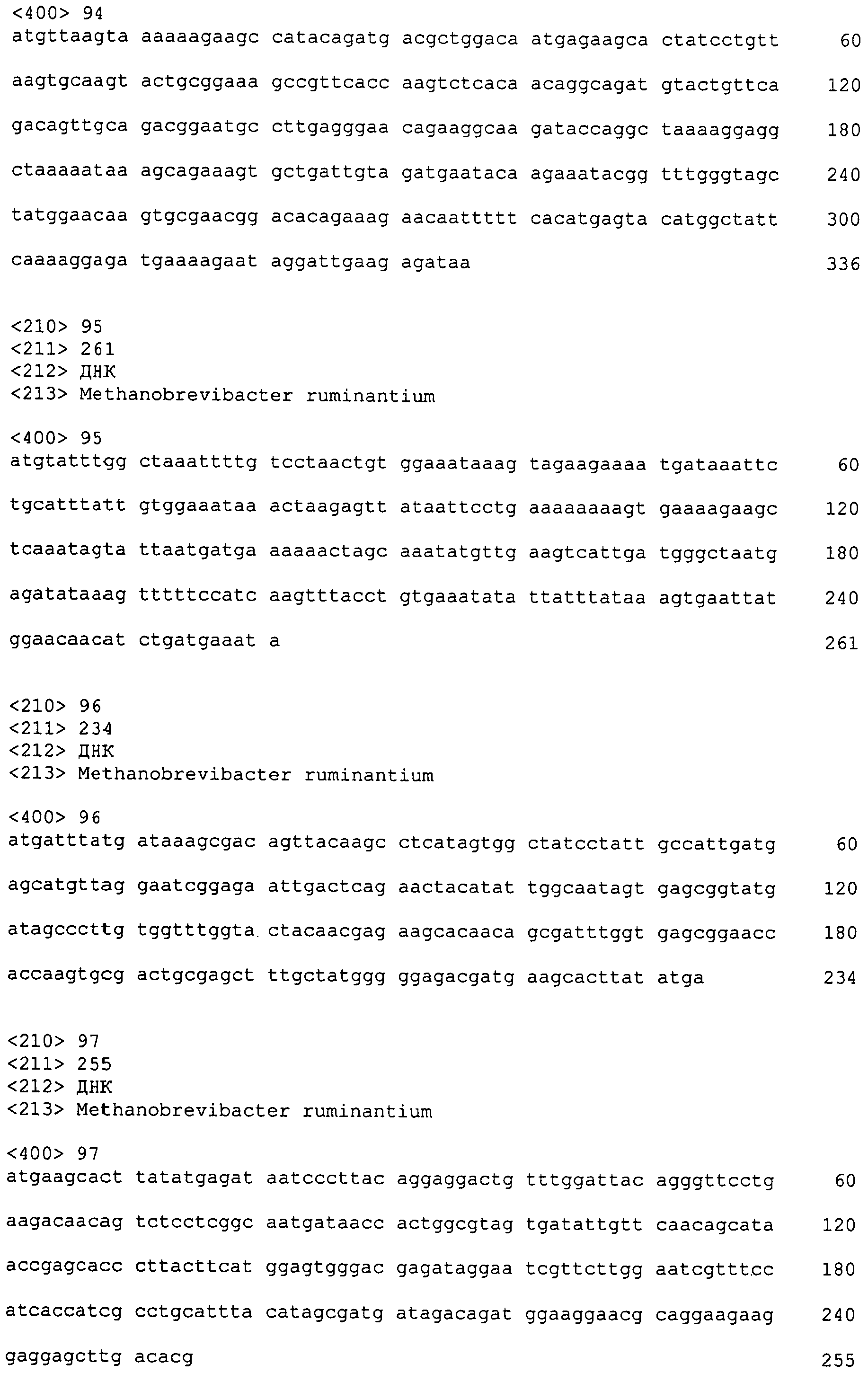
В другом варианте осуществления настоящего изобретения, природные, модифицированные или рекомбинантные последовательности нуклеиновой кислоты, кодирующие полипептиды, могут быть лигированы с гетерологичной последовательностью для кодирования слитого белка. Например, может быть целесообразным кодировать химерную последовательность, которая может распознаваться коммерчески доступным антителом. Слитый белок также может быть сконструирован, таким образом, чтобы содержать сайт расщепления, распложенный между полипептидом по изобретению и гетерологичной последовательностью белка, таким образом, чтобы полипептид можно было отщепить и очистить от гетерологичной части.
В другом варианте осуществления, последовательности, кодирующие полипептиды, могут быть синтезированы, целиком или частично, с помощью химических способов, хорошо известных в данной области (см. Caruthers, M. H. et al. (1980) Nucl. Acids Res. Symp. Ser. 215-223, Horn, T. et al. (1980) Nucl. Acids Res. Symp. Ser. 225-232). Альтернативно, сам полипептид может быть получен с помощью химических способов для синтеза аминокислотной последовательности или ее фрагмента. Например, полипептидный синтез можно проводить с использованием различных твердофазных способов (Roberge, J. Y. et al. (1995) Science 269:202-204; Merrifield J. (1963) J. Am. Chem. Soc. 85:2149-2154) и автоматизированный синтез может достигаться, например, с помощью синтезатора пептидов “ABI 431A Peptide Synthesizer” (Perkin Elmer). Различные фрагменты полипептидов могут быть химически синтезированы отдельно и объединены с использованием химических способов для получения полноразмерной молекулы.
Вновь синтезированный полипептид может быть выделен с помощью препаративной высокоэффективной жидкостной хроматографии (например, Creighton, T. (1983) Proteins Structures and Molecular Principles, WH Freeman and Co., New York, NY). Состав синтетических полипептидов может быть подтвержден с помощью аминокислотного анализа или секвенирования (например, с помощью методики расщепления по Эдману; Creighton, supra). Дополнительно, аминокислотная последовательность полипептида, или любая ее часть, может быть изменена во время прямого синтеза и/или объединена с помощью химических способов с последовательностями из других белков, или любыми их частями, для получения варианта молекулы.
Для экспрессии биологически активных полипептидов нуклеотидные последовательности, кодирующие полипептид или функциональные эквиваленты, могут быть встроены в соответствующий вектор экспрессии, т.е. вектор, который содержит необходимые элементы для транскрипции и трансляции встроенной кодирующей последовательности. Способы, которые хорошо известны специалистам в данной области, могут быть использованы для конструирования векторов экспрессии, содержащих последовательности, кодирующие этот полипептид и соответствующие транскрипционные и трансляционные контрольные элементы. Эти способы включают in vitro технологии рекомбинантных ДНК, синтетические способы, и генетическую рекомбинацию in vivo. Такие технологии описаны у Sambrook, J. et al. (2001) Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press, Plainview, NY, и Ausubel, F. M. et al. (2007) Current Protocols in Molecular Biology, John Wiley & Sons, New York, NY.
Целый ряд векторов экспрессии/систем хозяев может быть использован для содержания и экспрессии последовательностей, кодирующих полипептиды по изобретению. Они включают, но не только, микроорганизмы, такие как бактерии, трансформированные рекомбинантным бактериофагом, плазмиду или векторы экспрессии космидной ДНК; дрожжи, трансформированные дрожжевыми векторами экспрессии; клеточные системы насекомых, инфицированных вирусными векторами экспрессии (например, бакуловирусом); системы клеток растений, трансформированных вирусными векторами экспрессии (например, вирусом мозаики цветной капусты, CaMV; вирусом табачной мозаики, TMV) или бактериальными векторами экспрессии (например, Ti или pBR322 плазмидами); или системы клеток животных. Для бактерий подходящие плазмиды включают pET, pRSET, pTrcHis2, и pBAD плазмиды от Invitrogen, pET и pCDF плазмиды от Novagen, и DirectorTM плазмиды от Sigma-Aldrich. Для метанопродуцентов подходящие плазмиды включают, но не только, pME2001, pMV15, и pMP1. В частности, Escherichia coli может быть использована с вектором экспрессии pET. Настоящее изобретение не ограничивается использованным вектором экспрессии или клеткой-хозяином.
«Контрольные элементы» или «регуляторные последовательности» представляют собой нетранслируемые области векторов-энхансеров, промоторов 5' и 3' нетранслируемых областей, которые взаимодействуют с клеточными белками хозяина для осуществления транскрипции и трансляции. Такие элементы могут варьировать по силе и специфичности. В зависимости от используемой векторной системы и хозяина может быть использовано любое количество подходящих транскрипционных и трансляционных элементов, в том числе конститутивных и индуцибельных промоторов. Например, при клонировании в бактериальные системы, могут быть использованы индуцибельные промоторы, такие как гибридный lacZ промотор BLUESCRIPT фагемиды (Stratagene, LaJolla, CA) или pSPORT1 плазмиды (Life Technologies) и подобные. Полигедриновый промотор бакуловируса может быть использован в клетках насекомых. Промоторы или энхансеры, полученные из геномов клеток растений (например, теплового шока, RUBISCO, и гены запасных белков) или из вирусов растений (например, вирусные промоторы или лидерные последовательности) могут быть клонированы в этот вектор.
В бактериальных системах количество векторов экспрессии может быть выбрано в зависимости от применения этого полипептида. Например, в тех случаях, когда необходимы большие количества полипептида, могут быть использованы векторы, которые направляют высокий уровень экспрессии слитых белков, которые легко очистить. Такие векторы включают, но не только, многофункциональные E. coli клонирующие и экспрессирующие векторы, такие как BLUESCRIPT (Stratagene), в которых последовательность, кодирующая полипептид, может быть лигирована в вектор в рамке с последовательностями для аминоконцевого Met и последующих 7 остатков β-галактозидазы, так, чтобы образовался гибридный белок; pIN векторы (Van Heeke, G. и S. M. Schuster (1989) J. Biol. Chem. 264:5503-5509); и подобные.
pGEX векторы (Promega, Madison, WI) также могут быть использованы для экспрессии полипептидов в виде слитых белков с глутатион S-трансферазой (GST). В основном такие слитые белки являются растворимыми и могут быть легко очищены от лизированных клеток путем адсорбции на глутатион-агарозные бусы с последующей элюцией в присутствии свободного глутатиона. Белки, полученные в таких системах, могут быть созданы содержащими сайты расщепления гепарин, тромбин или фактор Xa протеазой, так, чтобы клонированный полипептид, представляющий интерес, мог быть освобожден от GST части по желанию. В дрожжах, Saccharomyces cerevisiae, может быть использован ряд векторов, содержащих конститутивные или индуцибельные промоторы, такие как альфа фактор, алкогольоксидаза, и PGH. Для обзора смотри Ausubel et al. (supra) и Grant et al. (1987) Methods Enzymol. 153:516-544.
Специфические сигналы инициации также могут быть использованы для достижения более эффективной трансляции последовательностей, кодирующих полипептиды по изобретению. Такие сигналы включают стартовый кодон ATG и смежные последовательности. В случаях, когда последовательности, кодирующие полипептиды, их стартовый кодон и вышележащие последовательности встроены в соответствующий вектор экспрессии, дополнительные транскрипционные или трансляционные контрольные сигналы могут не понадобиться. Однако в случаях, когда встроена только кодирующая последовательность, или ее фрагмент, должны быть предоставлены экзогенные трансляционные контрольные сигналы, включая стартовый кодон ATG. Более того, стартовый кодон должен находиться в правильной рамке считывания для обеспечения трансляции всей вставки. Экзогенные трансляционные элементы и стартовые кодоны могут быть различного происхождения, как природного, так и синтетического. Эффективность экспрессии может быть увеличена путем включения энхансеров, которые соответствуют используемой конкретной клеточной системе, такие, которые описаны в литературе (Scharf, D. et al. (1994) Results Probl. Cell Differ. 20:125-162).
Кроме того, штамм клетки-хозяина может быть выбран по его способности модулировать экспрессию встроенных последовательностей или процессировать экспрессированный полипептид желаемым образом. Такие модификации последовательности включают, но не только, ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидирование и ацилирование. Посттрансляционный процессинг, который расщепляет «препро» форму полипептида, также может быть использован для облегчения правильного встраивания, образования складчатой структуры и/или функции. Различные клетки-хозяева, которые имеют специфический клеточный механизм и характерные механизмы посттрансляционных активностей, доступны из Американской коллекции типовых культур (ATCC; Bethesda, MD) и могут быть выбраны для обеспечения правильной модификации и процессинга последовательности. Особые клетки-хозяева включают, но не только, клетки метанопродуценты, такие как клетки Methanobrevibacter, в частности клетки M. ruminantium, или M. smithii. Клетки-хозяева, представляющие интерес, включают, например, Rhodotorula, Aureobasidium, Saccharomyces, Sporobolomyces, Pseudomonas, Erwinia и Flavobacterium; или другие организмы, такие как Escherichia, Lactobacillus, Bacillus, Streptomyces, и подобные. Особые клетки-хозяева включают Escherichia coli, которая особенно подходит для использования в настоящем изобретении, Saccharomyces cerevisiae, Bacillus thuringiensis, Bacillus subtilis, Streptomyces lividans, и подобные.
Существуют некоторые методики введения нуклеиновых кислот в эукариотические клетки, культивированные in vitro. Эти методики включают химические способы (Felgner et al., Proc. Natl. Acad. Sci., USA, 84:7413 7417 (1987); Bothwell et al., Methods for Cloning and Analysis of Eukaryotic Genes, Eds., Jones and Bartlett Publishers Inc., Boston, Mass. (1990), Ausubel et al., Short Protocols in Molecular Biology, John Wiley and Sons, New York, NY (1992); и Farhood, Annal. NY Acad. Sci., 716:23 34 (1994)), применение протопластов (Bothwell, supra) или электрических импульсов (Vatteroni et al., Mutn. Res., 291:163 169 (1993); Sabelnikov, Prog. Biophys. Mol. Biol., 62: 119 152 (1994); Bothwell et al., supra; и Ausubel et al., supra), применение аттенуированных вирусов (Davis et al., J. Virol. 1996, 70(6), 3781 3787; Brinster et al. J. Gen. Virol. 2002, 83(Pt 2), 369 381; Moss, Dev. Biol. Stan., 82:55 63 (1994); and Bothwell et al., supra), а также физические способы (Fynan et al., supra; Johnston et al., Meth. Cell Biol., 43(Pt A):353 365 (1994); Bothwell et al., supra; and Ausubel et al., supra).
Успешная доставка нуклеиновых кислот в ткани животных может достигаться с помощью катионных липосом (Watanabe et al., Mol. Reprod. Dev., 38:268 274 (1994)), прямой инъекцией “голой” ДНК или РНК в мышечную ткань животного (Robinson et al., Vacc., 11:957 960 (1993); Hoffman et al., Vacc. 12:1529 1533; (1994); Xiang et al., Virol., 199:132 140 (1994); Webster et al., Vacc., 12:1495 1498 (1994); Davis et al., Vacc., 12:1503 1509 (1994); Davis et al., Hum. Molec. Gen., 2:1847 1851 (1993); Dalemans et al. Ann NY Acad. Sci. 1995, 772, 255 256. Conry, et al. Cancer Res. 1995, 55(7), 1397-1400), и эмбрионы (Naito et al., Mol. Reprod. Dev., 39:153 161 (1994); и Burdon et al., Mol. Reprod. Dev., 33:436 442 (1992)), внутримышечной инъекцией самореплицирующихся РНК вакцин (Davis et al., J Virol 1996, 70(6), 3781 3787; Balasuriya et al. Vaccine 2002, 20(11 12), 1609 1617) или внутрикожной инъекцией ДНК, используя технологию «генной пушки» (Johnston et al., supra).
Целый ряд протоколов для определения и измерения экспрессии полипептидов по изобретению, с использованием либо поликлональных, либо моноклональных антител, специфичных к этому белку, известен из уровня техники. Примеры включают твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (RIA), и активированную флуоресценцией сортировку клеток (FACS). Иммунологический анализ на основе моноклональных антител с двумя сайтами может быть использован с моноклональными антителами, реакционно-способными в отношении двух неинтерферирующих эпитопов полипептида, но также может быть использован анализ конкурентного связывания. Эти и другие анализы описаны, среди прочего, у Hampton, R. et al. (1990; Serological Methods, a laboratory Manual, APS Press, St Paul, MN) и Maddox, D. E. et al. (1983; J. Exp. Med. 158:1211-1216).
Целый ряд меток и способов конъюгации известен специалистам в данной области и может быть использован в различных анализах нуклеиновых кислот и аминокислот. Способы получения меченых гибридизационных или ПЦР зондов для выявления последовательностей, связанных с полинуклеотидами, включают олигомечение, ник-трансляцию, концевое мечение или ПЦР амплификацию с использованием меченого нуклеотида. Альтернативно, последовательности, кодирующие полипептиды, или любые их фрагменты или варианты, могут быть клонированы в вектор для получения мРНК зонда. Такие векторы известны в данной области, являются коммерчески доступными и могут быть использованы для синтеза РНК зондов in vitro путем добавления соответствующей РНК полимеразы, такой как T7, T3 или SP6 и меченых нуклеотидов. Эти методики можно проводить, используя целый ряд коммерчески доступных наборов Amersham Pharmacia Biotech, Promega, и US Biochemical. Подходящие репортерные молекулы или метки, которые могут быть использованы для облегчения выявления, включают радионуклиды, ферменты, флуоресцентные, хемилюминесцентные или хромогенные агенты, такие как субстраты, кофакторы, ингибиторы, магнитные частицы и подобные.
Векторы экспрессии или клетки-хозяева, трансформированные векторами экспрессии, могут быть реплицированы в условиях, подходящих для экспрессии и извлечения полипептида из культуры. Эта культура может содержать компоненты для in vitro или in vivo экспрессии. Компоненты in vitro экспрессии включают компоненты для лизатов ретикулоцитов кролика, лизаты E. coli, и экстракты зародышей пшеницы, например системы Expressway™ или RiPs от Invitrogen, системы GenelatorTM от iNtRON Biotechnology, EcoPro™ или системы STP3™ от Novagen, системы TNT® Quick Coupled от Promega, и системы EasyXpress от QIAGEN. Полипептиды, полученные из культуры, могут быть секретированы или содержаться внутриклеточно в зависимости от используемой последовательности и/или вектора. В конкретных аспектах, векторы экспрессии, которые кодируют фаговый полипептид, могут быть сконструированы так, чтобы они содержали сигнальные последовательности, которые непосредственно секретируют этот полипептид через прокариотическую или эукариотическую клеточную мембрану.
Другие конструкции могут включать аминокислотный домен, который будет облегчать очистку полипептида. Такие домены включают, но не только, металл хелатирующие пептиды, такие как модули гистидин-трипрофан (например, 6X-HIS (SEQ ID NO: 150)), которые позволяют проводить очистку на иммобилизованных металлах, домены белка А, которые позволяют проводить очистку на иммобилизованном иммуноглобулине, и домен, используемый в системе удлинения/аффинной очистки FLAG® (Immunex Corp., Seattle, WA). Подходящие эпитопные метки включают 3XFLAG®, HA, VSV-G, V5, HSV, GST, GFP, MBP, GAL4, и β-галактозидазу. Подходящие плазмиды включают плазмиды, содержащие биотиновую метку (например, PinPoint™ плазмиды от Promega), кальмодулин связывающий белок (например, pCAL плазмиды от Stratagene), стрептавидин связывающий белок (например, InterPlay™ плазмиды от Stratagene), метку c-myc или FLAG® (например, плазмиды иммунопреципитации от Sigma-Aldrich), или гистидиновую метку (например, QIAExpress плазмиды от QIAGEN).
Для облегчения очистки векторы экспрессии могут содержать расщепляемую линкерную последовательность, например, специфичную в отношении фактора Xa или энтерокиназы (Invitrogen, San Diego, CA). Например, этот вектор может включать один или более линкеров между доменом очистки и полипептидом. Один такой вектор экспрессии обеспечивает экспрессию слитого белка, содержащего полипептид по настоящему изобретению, и нуклеиновую кислоту, кодирующую 6 остатков гистидина, стоящих впереди тиоредоксина или сайта расщепления энтерокиназой. Остатки гистидина облегчают очистку на IMAC (аффинная хроматография с иммобилизованным ионом металла, описанная у Porath, J. et al. (1992) Prot. Exp. Purif. 3: 263-281), тогда как сайт расщепления энтерокиназой обеспечивает средство очистки полипептида из слитого белка. Рассмотрение векторов, которые содержат слитые белки, представлено у Kroll, D. J. et al. (1993; DNA Cell Biol. 12:441-453).
Антитела по настоящему изобретению могут быть получены с использованием способов, в основном известных из уровня техники, например, для использования в очистке или диагностических способах. В частности, полипептиды или полинуклеотиды могут быть использованы для получения антител в соответствии с общеизвестными протоколами. Такие антитела могут включать, но не только, поликлональные, моноклональные, химерные и одноцепочечные антитела, Fab фрагменты и фрагменты, полученные с помощью Fab экспрессионной библиотеки. Нейтрализующие антитела (т.е., антитела, которые ингибируют функцию) являются особенно предпочтительными для использования в настоящем изобретении.
Для получения антител различные хозяева, в том числе козы, кролики, крысы, мыши, люди и другие, могут быть иммунизированы путем введения полипептида, полинуклеотида или любого их фрагмента, который обладает иммуногенными свойствами. В зависимости от типа хозяина могут быть использованы различные адъюванты для усиления иммунологической реакции. Такие адъюванты включают, но не только, адъювант Фрейнда, минеральные гели, такие как гидроксид алюминия, и поверхностно-активные вещества, такие как лизолецитин, полиолы плюрониловые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки и динитрофенол. Среди адъювантов, используемых у людей, особенно предпочтительными являются БЦЖ (бациллы Кальмета-Герена) и Corynebacterium parvum.
Предпочтительно, чтобы полипептиды или фрагменты, используемые для индукции антител, имели аминокислотную последовательность, содержащую по меньшей мере пять аминокислот, и более предпочтительно по меньшей мере 10 аминокислот. Также предпочтительно, чтобы они были идентичны части аминокислотной последовательности природного белка, и они могли содержать всю аминокислотную последовательность небольшой природной молекулы. Короткие отрезки аминокислот могут быть слиты с таковыми другого белка, например гемоцианином лимфы улитки, и антителом, полученным против этой химерной молекулы.
Моноклональные антитела могут быть получены с использованием любой методики, которая обеспечивает получение молекул антител с помощью стабильной клеточной линии в культуре. Эти методики включают, но не только, гибридомную технологию, гибридомную технологию В-клеток человека и EBV-гибридомную технологию (Kohler, G. et al. (1975) Nature 256:495-497; Kozbor, D. et al. (1985) J. Immunol. Methods 81:31-42; Cote, R. J. et al. (1983) Proc. Natl. Acad. Sci. 80:2026-2030; Cole, S. P. et al. (1984) Mol. Cell Biol. 62:109-120). Антитела также могут быть получены путем индукции in vivo продукции в популяции лимфоцитов или путем скрининга библиотек иммуноглобулинов или панелей высокоспецифичных связывающих реагентов, как описано в литературе (Orlandi, R. et al. (1989) Proc. Natl. Acad. Sci. 86:3833-3837; Winter, G. et al. (1991) Nature 349:293-299).
Кроме того, могут быть использованы методики для очистки «химерных антител», например объединение генов антител для получения молекулы с соответствующей антигенной специфичностью и биологической активностью (Morrison, S. L. et al. (1984) Proc. Natl. Acad. Sci. 81:6851-6855; Neuberger, M.S. et al. (1984) Nature 312:604-608; Takeda, S. et al. (1985) Nature 314:452-454). Альтернативно, методики, описанные для получения одноцепочечных антител, могут быть адаптированы с использованием способов, известных в данной области, для получения специфичных одноцепочечных антител. Антитела с родственной специфичностью, но другого идиотипного состава, могут быть получены путем цепьевого шаффлинга из случайных комбинаторных библиотек иммуноглобулинов (Burton D. R. (1991) Proc. Natl. Acad. Sci. 88:11120-3).
Специалистам в данной области, к которой относится настоящее изобретение, будут понятны термины «диатела» и «триатела». Они представляют собой молекулы, которые содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) коротким пептидным линкером, который является слишком коротким, чтобы была возможность образования пары между двумя доменами на одной и той же цепи. Это способствует спариванию с комплементарными доменами одной или нескольких других цепей, и стимулирует образование димерных или тримерных молекул с двумя или более функциональными антигенсвязывающими сайтами. Полученные в результате молекулы антител могут быть моноспецифичными или мультиспецифичными (например, биспецифичными в случае диател). Такие молекулы антител могут быть получены из двух или более антител с использованием методологии, стандартной в области, к которой относится настоящее изобретение; например, как описано у Todorovska et al. (Design and application of diabodies, triabodies and tetrabodies for cancer targeting. J. Immunol. Methods. 2001 Feb 1;248(1-2):47-66).
Также могут быть получены фрагменты антител, которые содержат специфические сайты связывания. Например, такие фрагменты включают, но не только, F(ab')2 фрагменты, которые могут быть получены путем расщепления пепсином молекулы антитела, и Fab фрагменты, которые могут быть получены путем восстановления дисульфидных мостиков фрагментов F(ab')2. Альтернативно, экспрессионные библиотеки Fab могут быть сконструированы для возможности быстро и несложно осуществлять идентификацию моноклональных Fab фрагментов с желаемой специфичностью (Huse, W. D. et al. (1989) Science 254:1275-1281).
Различные иммуноанализы могут быть использованы для скрининга для идентификации антител, обладающих специфичностью связывания. Многочисленные протоколы для конкурентного связывания или количественных радиоиммуноанализов с использованием либо поликлональных, либо моноклональных антител с установленными специфичностями хорошо известны в данной области. Такие иммуноанализы обычно включают измерение образования комплекса между полипептидом или полинуклеотидом и специфичным к нему антителом. Иммунологический анализ на основе моноклональных антител с двумя сайтами с использованием моноклональных антител, реакционно-способных в отношении двух неинтерферирующих эпитопов, является предпочтительным, но также может быть использован анализ конкурентного связывания (Maddox, supra).
Фаговые полипептиды, описанные в настоящем изобретении, обладают способностью к направленной доставке, проникновению и/или ингибированию клеток, и также подходят в качестве молекул носителей для доставки дополнительных ингибирующих молекул в микробные клетки. Химические реакции для соединения аминокислот и соединений хорошо разработаны и ряд различных типов молекул может быть соединен с полипептидами. Самые распространенные способы соединения основываются на наличии свободных амино (альфа-амино или Lys), сульфгидрильных (Cys), или карбоксильных групп (Asp, Glu, или альфа-карбоксил). Способы соединения могут быть использованы для соединения полипептида с клеточным ингибитором через карбокси- или аминоконцевой остаток. В некоторых случаях последовательность включает многочисленные остатки, которые могут взаимодействовать выбранным химизмом. Это может быть использовано для получения мультимеров, содержащих более одного клеточного ингибитора. Альтернативно, полипептид может быть укорочен или выбран таким образом, чтобы реакционно-способные остатки были расположены либо на амино, либо на карбоксильном конце последовательности.
Например, репортерная молекула, такая как флуоресцеин, может быть специально включена в остаток лизина (Ono et al., 1997) с использованием N-α-Fmoc-Nε-1-(4,4-диметил-2,6 диоксоциклогекс-1-илиден-3-метилбутил)-L-лизина во время полипептидного синтеза. После синтеза сложные эфиры 5- и 6-карбоксифлуоресцеинсукцинимидила могут быть соединены, после чего 4,4-диметил-2,6 диоксоциклогекс-1-илиден удаляют путем обработки гидразином. Следовательно, соединение ингибирующей молекулы с фаговым полипептидом может осуществляться путем включения остатка лизина в полипептидную последовательность, затем взаимодействием с подходящим производным клеточным ингибитором.
Также может быть использован EDC (1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорид) или карбодиимидный способ соединения. Карбодиимиды могут активировать карбоксильные группы боковой цепи аспарагиновой и глутаминовой кислоты, а также карбоксиконцевую группу, чтобы сделать их реакционно-способными участками для соединения с первичными аминами. Активированные полипептиды перемешивают с клеточным ингибитором для получения конечного конъюгата. Если клеточный ингибитор активирован первым, методом EDC клеточный ингибитор будет соединяться через N-концевой альфа-амин и, возможно, через амин в боковой цепи Lys, если присутствует в последовательности.
Сложный эфир м-малеимидобензоил-N-гидроксисукцинимида (MBS) представляет собой гетеробифункциональный реагент, который может быть использован для соединения полипептидов с клеточными ингибиторами через цистеины. Соединение происходит с тиоловой группой остатков цистеина. Если выбранная последовательность не содержит Cys, обычным является расположение остатка Cys на N- или C-конце для получения высококонтролируемого соединения полипептида с клеточным ингибитором. Для целей синтеза для цистеина может быть целесообразным расположение на N-конце полипептида. MBS особенно подходит для использования в настоящем изобретении.
Глутаральдегид может быть использован в качестве бифункционального связующего реагента, который соединяет два соединения через их аминогруппы. Глутаральдегид обеспечивает спейсер высокой гибкости между полипептидом и клеточным ингибитором для подходящей презентации. Глутаральдегид является очень реакционно-способным соединением и будет взаимодействовать с Cys, Tyr, и His до ограниченной степени. Способ глутаральдегидных сшивок особенно подходит в тех случаях, когда полипептид содержит только одну свободную аминогруппу на его аминоконце. В тех случаях, когда полипептид содержит более одной свободной аминогруппы, могут быть образованы крупные мультимерные комплексы.
В одном аспекте, полипептиды по настоящему изобретению могут быть слиты (например, путем клонирования внутри рамки) или сшиты (например, путем химического соединения) с клеточными ингибиторами, такими как антимикробные средства. Среди этих средств включены антимикробные пептиды, например бактерицидный/усиливающий проницаемость белок, катионные антимикробные белки, лизозимы, лактоферрины и кателицидины (например, из нейтрофилов; см., например, Hancock and Chapple, 1999, Antimicrob. Agents Chemother. 43:1317-1323; Ganz and Lehrer, 1997, Curr. Opin. Hematol. 4:53-58; Hancock et al., 1995, Adv. Microb. Physiol. 37:135-175). Антимикробные пептиды дополнительно включают дефенсины (например, из эпителиальных клеток или нейтрофилов) и тромбоцитарные микробиоцидные белки (см., например, Hancock and Chapple, 1999, Antimicrob. Agents Chemother.43:1317-1323). Дополнительные антимикробные пептиды включают, но не только, грамицидин S, бацитрацин, полимиксин B, тахиплезин, бактенецин (например, бактенецин крупного рогатого скота), раналексин, цекропин A, индолицидин (например, индолицидин крупного рогатого скота), и низин (например, бактериальный низин).
В качестве противомикробных средств также включены ионофоры, которые облегчают перенос иона (например, натрия) через липидный барьер, такой как клеточная мембрана. Двумя ионофорными соединениями, особенно подходящими для настоящего изобретения, являются RUMENSINTM (Eli Lilly) и Lasalocid (Hoffman LaRoche). Другие ионофоры включают, но не только, салиномицин, авопарцин, аридцин и актапланин. Другие противомикробные средства включают пенициллин, Monensin™ и азитромицин, метронидазол, стрептомицин, канамицин и пенициллин, а также, в целом, ß-лактамы, аминогликозиды, макролиды, хлорамфеникол, новобиоцин, рифампин и флуорохинолоны (смотри, например, Horn et al., 2003, Applied Environ. Microbiol. 69:74-83; Eckburg et al., 2003, Infection Immunity 71:591-596; Gijzen et al., 1991, Applied Environ. Microbiol. 57:1630-1634; Bonelo et al., 1984, FEMS Microbiol. Lett. 21:341-345; Huser et al., 1982, Arch. Microbiol. 132:1-9; Hilpert et al., 1981, Zentbl. Bakteriol. Mikrobiol. Hyg. 1 Abt Orig. C 2:21-31).
Особенно эффективными ингибиторами являются соединения, которые блокируют или препятствуют образованию метана, в том числе бромэтансульфоновая кислота, например 2-бромэтансульфоновая кислота (BES) или их соли, например натриевая соль. Молибдат натрия (Mo) является ингибитором восстановления сульфата, и может быть использован с бромэтансульфоновой кислотой. Другие соединения против метанообразования включают, но не только, нитрат, формиат, метилфторид, хлороформ, хлоралгидрат, сульфат натрия, этилен и ненасыщенные углеводороды, ацетилен, жирные кислоты, такие как линолевая и цис-олеиновая кислота, насыщенные жирные кислоты, такие как бегеновая и стеариновая кислота, а также лумазин (например, 2,4-птеридиндион). Дополнительные соединения включают 3-бромпропансульфонат (BPS), пропионовую кислоту и этил 2-бутиноат.
Дополнительно включенными в качестве противомикробных агентов являются литические ферменты, в том числе фаговый лизозим, эндолизин, лизоцим, лизин, фаговый лизин, мурализин, мурамидаза, и виролизин. Подходящие ферменты демонстрируют способность к гидролизу специфических связей в клеточной стенке бактерий. Конкретные литические ферменты включают, но не только, глюкозаминидазы, которые гидролизуют гликозидные связи между аминосахарами (например, N-ацетилмураминовой кислотой и N-ацетилглюкозамином) пептидогликана, амидазы, которые расщепляют N-ацетилмурамоил-L-аланинамидную связь между гликановой цепью и поперечно-сшивающим пептидом, и эндопептидазы, которые гидролизуют межпептидную связь (например, цистеиновые эндопептидазы), и эндоизопептидазы, которые воздействуют на псевдомуреин метанопродуцентов семейства Methanobacteriacaea.
Полипептиды, кодируемые ORF 2058 или ORF 2055, подробно описанные в настоящей заявки и ниже, применимы в качестве литических ферментов, специфичных в отношении метанопродуцентов в рубце. Природные ферменты могут быть получены из свежих φmru-лизированных клеток M. ruminantium. Альтернативно, ORF 2058 или ORF 2055 могут быть клонированы в вектор экспрессии в гетероличном хозяине, таком как Escherichia coli. Это осуществлялось ранее с PeiP и PeiW, и было показано, что рекомбинантные белки являются активными в отношении клеточных стенок Methanothermobacter в редуцирующих условиях (Luo et al., 2002). ORF 2058 или ORF 2055 литические ферменты или любые другие литические ферменты могут быть использованы в композициях, например, в качестве кормовой добавки для жвачных животных, или могут быть включены в капсулу медленного высвобождения или болюсное устройство для доставки на протяжении длительного периода времени в рубце. Литические ферменты могут быть использованы либо в сочетании, либо последовательно с другим(и) ингибитором(ами) образования метана во избежание адаптации метанопродуцентов хозяина и резистентности к ферментам. Случайные и/или направленные мутации в ферментах также могут быть использованы во избежание адаптациии. Литические/лизогенные компоненты переключения (например, ORF 1981 и ORF 1983-ORF 1986) могут быть использованы аналогичным образом, что и литические ферменты.
Дополнительно, ПНК включены в качестве противомикробных средств. ПНК представляют собой гибридные пептид-нуклеиновые кислоты, в которых фосфатный скелет был заменен ахиральным и нейтральным скелетом, образованным из N-(2-аминоэтил)-глициновых единиц (смотри, например, Eurekah Bioscience Collection. PNA and Oligonucleotide Inhibitors of Human Telomerase. G. Gavory and S. Balasubramanian, Landes Bioscience, 2003). Основания A, G, T, C присоединяются к аминоазоту скелета через метиленкарбонильные связи (P.E. Nielsen et al., Science 1991. 254: 1497-1500; M. Egholm et al., Nature 1993. 365: 566-568). ПНК связывают комплементарные последовательности с высокой специфичностью и более высокой аффинностью относительно аналогичных ДНК или РНК (M. Egholm et al., supra). Гибриды ПНК/ДНК или ПНК/РНК также демонстрируют более высокую термическую стабильность по сравнению с соответствующими дуплексами ДНК/ДНК или ДНК/РНК (M. Egholm et al., supra). ПНК также обладают высокой химической и биологической стабильностью вследствие неприродного амидного скелета, который не распознается нуклеазами или протеазами (V. Demidov et al., Biochem Pharmacol 1994. 48: 1310-1313). Обычно ПНК представляют собой по меньшей мере 5 оснований в длину, и включают концевой лизин. ПНК могут быть пэгилированы для дополнительного увеличения продолжительности их жизни (Nielsen, P. E. et al. (1993) Anticancer Drug Des. 8:53-63).
В одном конкретном аспекте, полипептиды по изобретению могут быть слиты (например, клонированием внутри рамки) или сшиты (например, путем химического соединения) с клеточными ингибиторами, такими как антитела или их фрагменты. Антитела или фрагменты антител могут быть направлены на микробные клетки или конкретно клетки метанопродуцентов, или один или несколько компонентов клетки. Например, белки клеточной поверхности, например внеклеточные рецепторы, могут быть мишенью. Включены молекулы иммуноглобулинов и иммунологически активные части молекул иммуноглобулинов (Ig), т.е. молекул, которые содержат антигенсвязывающий сайт, который специфически связывается (иммунологически взаимодействует) с антигеном.
Полипептиды по изобретению находят практическое применение в направленной доставке в микробную клетку, в частности клетку метанопродуцента. В некоторых аспектах, полипептиды могут быть использованы для соединения или связывания с клеточной стенкой или мембраной, проникновения в клетку и/или ингибирования роста или репликации клетки. Как таковые полипептиды могут быть использованы для транзиторного или длительного присоединения к клетке, или для пенетрации клеточной стенки или мембраны и/или накопления во внеклеточном окружении. Понятно, что фаговые полипептиды, а также соответствующие полинуклеотиды, векторы экспрессии, клетки-хозяева и антитела по изобретению могут быть использованы для направления на различные микроорганизмы, например Methanobrevibacter ruminantium, который является основным метанопродуцентом у жвачных животных, и Methanobrevibacter smithii, который является основным метанопродуцентом у людей. Для осуществления направленного действия микробную клетку можно привести в контакт с фаговым полипептидом, выделенным из одного или нескольких природных источников, или полученным с помощью векторов экспрессии и/или клеток-хозяев, или синтетической или полусинтетической химии, как подробно описано в настоящей заявке. Для усиления проникновения полипептид может быть слит или сшит с одной или несколькими сигнальными последовательностями (предсказанная консенсусная последовательность: [ML]KKKK[K]{0,1}X{0,9}[IL][IFL][IL][IL][IS][LIA]X{0,4}[LIVF][LIAV][LI][ILV][LAIV][ILFV][LIVF][SAL][ILV][GSA][AS][VAI][SA]A (SEQ ID NO: 151), смотри ФИГ. 6. Смотри также Pérez-Bercoff, Å., Koch, J. and Bürglin, T.R. (2006) LogoBar: bar graph visualization of protein logos with gaps. Bioinformatics 22, 112-114. В конкретных аспектах, полипептид доставляется индивидам в виде композиции, подробно описанной в настоящей заявке, например, посредством использования устройства для медленного высвобождения у жвачных животных.
В некоторых вариантах осуществления, полипептид слит или сшит с клеточным ингибитором, например, соединением против образования метана (например, бромэтансульфоновой кислотой), антителом или фрагментом антитела, литическим ферментом, пептид-нуклеиновой кислотой, антимикробным пептидом, или другим антибиотиком. Этот полипептид-ингибитор доставляется индивиду в виде композиции для ингибирования роста и/или репликации микробных клеток, в частности клеток метанопродуцентов. Эта композиция содержит, например: a) выделенный фаг, фаговую частицу, фаговый геном или их изменение, фрагмент, вариант или производное; b) выделенный фаговый полипептид, или его изменение, фрагмент, вариант или производное; с) выделенный полинуклеотид, или его изменение, фрагмент, вариант или производное; d) вектор экспрессии, содержащий этот полинуклеотид; или e) клетку-хозяина, содержащую этот вектор экспрессии. Композиции по изобретению могут быть особым образом упакованы как часть наборов для направленной доставки, проникновения и/или ингибирования микробных клеток, в особенности клеток метанопродуцентов, в соответствии с описанными способами. Эти наборы содержат по меньшей мере одну композицию, представленную в настоящем описании и инструкции по применению для направленной доставки или проникновения в клетки или ингибирования клеточного роста или репликации метанопродуцентов или других микроорганизмов.
В качестве дополнительного варианта осуществления изобретение относится к фармацевтической композиции в сочетании с фармацевтически приемлемым носителем для использования с любым из способов, описанных выше. Такие фармацевтические композиции могут содержать фаговый полипептид в сочетании с клеточным ингибитором. Альтернативно, фармацевтические композиции могут содержать вектор экспрессии или клетку-хозяина, подробно описанные в настоящей заявке. Композиции могут быть введены отдельно или в сочетании по меньшей мере с одним другим средством, таким как стабилизирующее соединение, которое может быть введено в любом стерильном, биосовместимом фармацевтическом носителе, в том числе, но не только, физиологическом растворе, забуференном физиологическом растворе, декстрозе или воде. Композиции можно вводить индивиду отдельно или в сочетании с другими средствами, лекарствами (например, противомикробными средствами), или гормонами.
Помимо активных ингредиентов эти фармацевтические композиции могут содержать подходящие фармацевтически приемлемые носители, содержащие эксципиенты и вспомогательные вещества, которые облегчают обработку активных соединений в препараты, которые могут быть использованы фармацевтически. Дополнительные подробности по технологии получения и введения можно найти в последней редакции Remington's Pharmaceutical Sciences (Maack Publishing Co., Easton, PA). Фармацевтические композиции, используемые в настоящем изобретении, могут быть введены любыми путями, включая, но не только, пероральный, внутривенный, внутримышечный, внутриартериальный, интрамедуллярный, интратекальный, внутрижелудочковый, чрескожный, подкожный, внутрибрюшинный, интраназальный, энтеральный, местный, подъязычный или ректальный способ.
Фармацевтические композиции для перорального введения могут быть получены с использованием фармацевтически приемлемых носителей, хорошо известных из уровня техники, в дозах, подходящих для перорального введения. Такие носители позволяют получать фармацевтические композиции в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, суспензий и подобного для приема внутрь. Фармацевтические препараты для перорального применения могут быть получены путем объединения активных соединений с твердым эксципиентом, необязательно измельчения полученной в результате смеси, и обработки смеси гранул, с последующим добавлением подходящих вспомогательных веществ, при желании, для получения таблеток или ядер драже. Подходящими эксципиентами являются углеводные или белковые наполнители, такие как сахара, в том числе лактоза, сахароза, маннитол или сорбитол; крахмал из кукурузы, пшеницы, риса, картофеля, или других растений; целлюлоза, например метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза натрия; камеди, в том числе аравийская и трагакантовая; и белки, такие как желатин и коллаген. При желании могут быть добавлены дезинтегранты или солюбилизаторы, такие как поперечносшитый поливинилпирролидон, агар, альгиновая кислота, или ее соль, такая как альгинат натрия.
Фармацевтические препараты, которые могут быть использованы перорально, включают капсулы, удобные для глотания, изготовленные из желатина, а также мягкие, запечатанные капсулы, изготовленные из желатина, и покрытие, такое как глицерин или сорбит. Удобные для глотания капсулы могут содержать активные ингредиенты, смешанные с наполнителем или связующими, такими как лактоза или крахмалы, смазывающие вещества, такие как тальк или стеарат магния, и, необязательно, стабилизаторы. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкость или жидкий полиэтиленгликоль со стабилизаторами или без них. Ядра драже могут быть использованы в сочетании с подходящими покрытиями, такими как концентрированные растворы сахаров, которые также могут содержать аравийскую камедь, тальк, поливинилпирролидон, карбопол гель, полиэтиленгликоль и/или диоксид титана, растворы глазури и подходящие органические растворители или смеси растворителей. Красители или пигменты могут быть добавлены к покрытиям таблеток или драже для идентификации продукта или для характеристики количества активного вещества, т.е. дозы.
Фармацевтические композиции, подходящие для парентерального введения, могут быть получены в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса, раствор Рингера, или физиологически забуференный солевой раствор. Водные инъекционные суспензии могут содержать вещества, которые повышают вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Дополнительно, суспензии активных соединений могут быть получены в виде соответствующих масляных инъекционных суспензий. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или сложные эфиры синтетических жирных кислот, такие как этилолеат или триглицериды, или липосомы. Нелипидные поликатионные аминополимеры также могут быть использованы для доставки. Необязательно суспензия также может содержать подходящие стабилизаторы или средства, которые повышают растворимость соединений для возможности получать растворы высокой концентрации. Для местного или назального введения в композиции используют пенетранты, соответствующие конкретному барьеру, подлежащему пенетрации. Такие пенетранты в основном известны из уровня техники.
Фармацевтические композиции по настоящему изобретению могут быть получены способом, известным в данной области, например путем обычного перемешивания, растворения, грануляции, изготовления драже, отмучивания, эмульгирования, инкапсулирования, включения, или процессами лиофилизации. Фармацевтическая композиция может быть представлена в виде соли и может быть образована со многими кислотами, в том числе, но не только, соляной, серной, уксусной, молочной, винной, яблочной, янтарной и т.д. Соли имеют тенденцию быть более растворимыми в водных или других протонных растворителях, чем соответствующие формы свободных оснований. В других случаях предпочтительным препаратом может быть лиофилизированный порошок, который может содержать любое или все из следующего: 1-50 мМ гистидина, 0,1%-2% сахарозы и 2-7% маннитола, при pH в интервале от 4,5 до 5,5, объединенный с буфером до использования. После получения фармацевтических композиций они могут быть помещены в соответствующий контейнер и снабжены этикеткой для лечения указанного состояния. Для применения композиции по изобретению такая этикетка содержала бы количество, частоту и способ введения.
Фармацевтические композиции, подходящие для использования в настоящем изобретении, включают композиции, в которых активные ингредиенты содержатся в эффективном количестве для достижения заданной цели. Для любого соединения терапевтически эффективную дозу можно определить сначала либо в клеточных исследованиях, например в микробных клетках, или, в частности, в клетках метанопродуцентов, или на животных моделях, обычно мышах, кроликах, собаках или свиньях, или у жвачных видов животных, таких как овцы, крупный рогатый скот, олени и козы. Животная модель также может быть использована для определения подходящего диапазона концентраций и пути введения. Такая информация затем может быть использована для определения подходящих доз и путей введения индивиду. Нормальные количества дозы могут варьировать от 0,1 до 100000 микрограммов, вплоть до суммарной дозы около 1 г, или более, в зависимости от пути введения. Руководство, касающееся конкретных доз и способов доставки, представлено в литературе и в основном доступно для специалистов, практикующих в данной области. Специалисты в данной области будут использовать другие составы для полинуклеотидов, чем для полипептидов. Аналогично, доставка полинуклеотидов или полипептидов будет индивиду для конкретных клеток, условий, локализаций и т.д.
Известны лекарственные средства на основе фагов, и способы получения таких композиций опубликованы в уровне техники. Фаговые лекарственные средства были описаны, например, для направленной доставки к Staphylococcus (например, S. aureus), Pseudomonas (например, P. aeruginosa), Escherichia (например, E. coli), Klebsiella (например, K. ozaenae, K. rhinoscleromatis scleromatis и K. pneumonia), Proteus, Salmonella, Shigella (смотри, например, Carlton, R.M. (1999). Archivum Immunologiae et Therapiae Experimentalis, 47: 267-274; Liu, J. et al. (2004). Nat. Biotechnol. 22, 185-191; Projan, S. (2004). Nat. Biotechnol. 22, 167-168; Sulakvelidze, A., Alavidze, Z. and Morris, J. G. (2001). Antimicrobial Agents and Chemotherapy, 45 (3): 649-659; Weber-Dabrowska, Mulczyk, M. and Gorski, A. (2000). Archivum Immunologiae et Therapiae Experimentalis, 48: 547-551). Фаговые лекарственные средства обладают присущими им преимуществами по сравнению с традиционными противомикробными средствами в том, что фаг является высокоспецифичным и не поражает нормальную микрофлору организма человека; фаг не инфицирует эукариотические клетки, и не имеет известных серьезных побочных эффектов; фаг может локализоваться в месте инфекции; и фаг может реплицироваться экспоненциально, поэтому требуется только небольшая доза лекарственных средств, и в основном низкая стоимость (смотри, например, Sulakvelidze et al., supra). Для текущего обзора смотри Fischetti VA, Nelson D, Schuch R. Reinventing phage therapy: are the parts greater than the sum? Nat Biotechnol. 2006 Dec;24(12):1508-11.
Лекарственные средства на основе пептидов и полипептидов были описаны, например, для денилейкина, дифитокса, октеотида, вапреотида, ланреотида, пептидов серий RC-3940, декапептила, лупрона, золадекса, цетрореликса (см., например, Lu et al., 2006, AAPS J 8:E466-472), гемоцидинов, стафопенов (смотри, например, Dubin et al., 2005, Acta Biochemica Polonica, 52:633-638), а также индолицидина, дефенсинов, лантибиотиков, микроцидина B17, гистатинов и маганина (смотри, например, Yeaman and Yount, 2003, Pharmacol Rev 55:27-55). Общее руководство по пептидным и полипептидным лекарственным средствам также можно найти у Degim et al., 2007, Curr Pharm Des 13:99-117 и Shai et al., 2006, Curr Prot Pept Sci, 7:479-486. Одобренные в последнее время лекарственные средства на основе пептидов включают Hematide™ (синтетическое средство на пептидной основе, стимулирующее эритропоэз, Affymax, Inc.), эксенатид (синтетический экзендин-4, Amylin/Eli Lilly), натрекор (незиритид, натриуретический пептид, Scios), пленаксис (абареликс, Praecis Pharmaceuticals), и SecreFlo (секретин, Repligen).
Точная доза будет определяться практикующим специалистом с учетом факторов, связанных с индивидом, для которого требуется лечение. Дозу и введение устанавливают для обеспечения достаточных уровней активного агента или для поддержания желаемого эффекта. Факторы, которые могут быть приняты во внимание, включают тяжесть патологического состояния, общее состояние здоровья индивида, возраст, массу тела и пол индивида, рацион питания, время и частоту введения, сочетание(я) лекарственных средств, реакции чувствительности и толерантности/ответа на лечение. Фармацевтические композиции длительного действия можно вводить каждые 3 - 4 дня, каждую неделю или однократно каждые две недели в зависимости от периода полужизни и скорости выведения конкретной композиции.
Особенно подходят для композиций по изобретению (например, фармацевтических композиций) составы или механизмы медленного высвобождения. Например, внутрирубцовые устройства включают, но не только, Time Capsule™ Bolus от Agri-Feeds Ltd., New Zealand, первоначально разработанные в AgResearch Ltd., New Zealand, как описано в WO 95/19763 и NZ 278977, и CAPTEC фирмой Nufarm Health & Sciences, отделом Nufarm Ltd., Auckland, New Zealand, как описано в AU 35908178, PCT/AU81/100082, и Laby et al., 1984, Can. J. Anim. Sci. 64 (Suppl.), 337-8, каждая из которых включена в настоящее описание в качестве ссылки. В качестве конкретного примера, устройство может включать пружину и поршень, который проталкивает композицию к отверстию на конце сосуда.
В качестве дополнительного варианта осуществления, настоящее изобретение относится к композиции для водной добавки, например орошающей композиции или кормовой добавки, например добавки к корму для жвачных животных, для использования с любым из способов, рассмотренных выше. В конкретных аспектах, кормовая добавка содержит по меньшей мере одно съедобное растительное вещество и пептид или полипептид по настоящему изобретению. Альтернативно, кормовая добавка содержит по меньшей мере одно съедобное растительное вещество и полипептид или пептид, или полинуклеотид, кодирующий пептид или полипептид, описанный в настоящей заявке, например, в виде вектора экспрессии или клетки-хозяина, содержащей вектор экспрессии. В частности, композиция дополнительно включает клеточный ингибитор, слитый или соединенный с полученной в результате последовательностью. Предпочтительный растительный материал включает любой из сена, травы, зерна или кормовой крупы, например бобовые, сено, травяное сено, кукурузный силос, силос из злаковых культур, бобовый силос, кукурузное зерно, овес, ячмень, дробину, пивную дробину, соевую муку и муку из семян хлопчатника. В частности, силос из злаковых культур применим в качестве кормовой композиции для жвачных животных. Растительный материал может быть генетически модифицирован таким образом, чтобы он содержал один или несколько компонентов по изобретению, например один или несколько полипептидов или пептидов, полинуклеотидов или векторов.
В другом варианте осуществления, антитела, которые индуцируются в отношении полипептидов или полинуклеотидов по настоящему изобретению, могут быть использованы для определения присутствия микроорганизмов, в особенности метанопродуцентов, или в анализах для мониторинга уровней таких микроорганизмов. Антитела, подходящие для диагностических целей, могут быть получены таким же образом, как описано выше. Диагностические исследования включают способы, в которых используется антитело и метка для выявления полипептида в жидкостях организма человека или экстрактах клеток или тканей. Антитела могут быть использованы с модификацией или без модификации и могут быть помечены путем соединения их либо ковалентно, либо нековалентно, с репортерной молекулой. Может быть использован целый ряд репортерных молекул, которые известны из уровня техники, некоторые из которых описаны выше.
Ряд протоколов для измерения уровней полипептида или полинуклеотида известен в данной области (например, ELISA, RIA, FACS, и блоттинг, такой как Саузерн, Нозерн, Вестерн блоттинг), и обеспечивают основу для определения наличия или уровней микроорганизма, в особенности метанопродуцентов. Нормальные или стандартные уровни установлены путем объединения жидкостей организма или клеточных экстрактов, взятых у здоровых индивидов, например здоровых людей или жвачных животных, с антителом в условиях, подходящих для образования комплекса. Величина стандартного комплексообразования может быть определена количественно различными способами, но предпочтительно фотометрическим способом. Количества полипептида или полинуклеотида, экспрессируемого у индивида, и в обработанных образцах (например, образцах от индивидов, прошедших обработку) сравнивают со стандартными значениями. Отклонение между стандартными значениями и значениями, полученными у индивида, устанавливает параметры для определения присутствия или уровней микроорганизма.
В конкретном варианте осуществления настоящего изобретения, полинуклеотиды могут быть использованы для диагностических целей с использованием конкретных гибридизационных и/или амплификационных методик. Полинуклеотиды, которые могут быть использованы, включают олигонуклеотиды, комплементарные РНК и ДНК молекулы и ПНК. Полинуклеотиды могут быть использованы для выявления и количественного анализа генной экспрессии в образцах, в которых экспрессия может коррелировать с присутствием или уровнями микроорганизма. Диагностический анализ может быть использован для проведения различия между отсутствием, присутствием и изменением уровней микроорганизмов и для мониторинга уровней во время терапевтического вмешательства.
В одном аспекте, гибридизация с ПЦР зондами может быть использована для идентификации последовательностей нуклеиновых кислот, в особенности геномных последовательностей, которые кодируют полипептиды по настоящему изобретению. Специфичность зонда, получен ли он из высокоспецифичной области, например 10 уникальных нуклеотидов в 5' регуляторной области, или менее специфичной области, например в 3'-кодирующей области, и жесткости гибридизации или амплификации (максимальной, высокой, промежуточной или низкой) будет определять, идентифицирует ли зонд только природные последовательности, аллели, или родственные последовательности. Зонды также могут быть использованы для выявления родственных последовательностей, и предпочтительно должны содержать по меньшей мере 50% нуклеотидов из любой из кодирующих последовательностей. Гибридизационные зонды предмета изобретения могут представлять собой ДНК или РНК и происходить из нуклеотидной последовательности SEQ ID NO:74-142, или комплементов, или их модифицированных последовательностей, или из геномных последовательностей, включая промотор, энхансерные элементы, и интроны природной последовательности.
Способы получения специфических гибридизационных зондов для ДНК включают клонирование последовательностей нуклеиновой кислоты в векторы для получения зондов мРНК. Такие векторы известны из уровня техники, коммерчески доступны и могут быть использованы для синтеза РНК зондов in vitro путем добавления соответствующих РНК полимераз и соответствующих меченых нуклеотидов. Гибридизационные зонды могут быть мечены рядом репортерных групп, например радионуклидами, такими как 32P или 35S, или ферментными метками, такими как щелочная фосфатаза, соединенная с зондом через системы соединения авидин/биотин, и подобные. Полинуклеотиды могут быть использованы в Саузерн или нозерн анализе, дот-блоттинге или других мембранных методиках; в ПЦР методах; или в тест-полосках, стержнях, ELISA анализах, или микрочипах с использованием жидкостей или тканей из биоптатов индивида для выявления присутствия или уровней микроорганизма. Такие качественные и количественные способы известны в данной области.
В особом аспекте, последовательности нуклеиновой кислоты могут применяться в различных анализах, меченые стандартными способами и добавленные в жидкость или образец ткани от индивида в условиях, подходящих для гибридизации и/или амплификации. После соответствующего периода инкубирования образец промывают, и сигнал измеряют и сравнивают со стандартной величиной. Если величина сигнала в тестируемом образце значительно изменяется по сравнению с величиной сигнала контрольного образца, присутствие измененных уровней нуклеотидных последовательностей в образце указывает на присутствие или уровни микроорганизма. Такие анализы также могут быть использованы для оценки эффективности конкретного режима лечения в исследованиях на животных, в клинических испытаниях или при мониторинге лечения индивида.
Для обеспечения основы для диагностики присутствия или уровней микроорганизма устанавливают нормальный или стандартный профиль экспрессии. Это может осуществляться путем объединения жидкостей организма или клеточных экстрактов, взятых от здоровых индивидов, с полинуклеотидом или его фрагментом, в условиях, подходящих для гибридизации и/или амплификации. Стандартные уровни могут быть количественно определены путем сравнения уровней, полученных от здоровых индивидов, с уровнями из эксперимента, в котором используется известное количество по существу очищенного полинуклеотида. Стандартные значения, полученные из нормальных образцов, можно сравнить со значениями, полученными из образцов от индивидов, прошедших обработку против микробного роста. Отклонение между стандартными значениями и значениями индивида используют для установления присутствия или уровней микроорганизма.
После идентификации микроорганизма и начала осуществления протокола обработки гибридизацию и/или амплификационные анализы можно повторять регулярно для определения начала снижения уровня экспрессии у индивида по сравнению с уровнем, который наблюдается у нормального индивида. Результаты, полученные из последующих анализов, могут быть использованы для демонстрации эффективности лечения на протяжении периода времени в интервале от нескольких дней до месяцев.
Конкретные диагностические применения для олигонуклеотидов, полученных из последовательностей нуклеиновых кислот, могут включать применение ПЦР. Такие олигомеры могут быть синтезированы химически, получены ферментативно или получены in vitro. Олигомеры предпочтительно будут состоять из двух нуклеотидных последовательностей, одной со смысловой ориентацией (5'.→.3') и другой с антисмысловой ориентацией (3'.→.5'), применяемых в оптимизированных условиях для идентификации специфической нуклеотидной последовательности или состояния. Те же два олигомера, набор олигомеров для гнездовой ПЦР или даже вырожденный пул олигомеров можно использовать в менее строгих условиях для выявления и/или количественного анализа близкородственных ДНК или РНК последовательностей.
Способы, которые также могут быть использованы для количественного анализа экспрессии, включают радиоактивно меченные или биотинилированные нуклеотиды, ко-амплификацию контрольной нуклеиновой кислоты и стандартные кривые, на которые интреполированы результаты экспериментов (Melby, P. C. et al. (1993) J. Immunol. Methods, 159:235-244; Duplaa, C. et al. (1993) Anal. Biochem. 229-236). Скорость количественного анализа многочисленных образцов может быть увеличена путем проведения этого исследования в формате ELISA, где олигомер, представляющий интерес, находится в различных разведениях и спектрофотометрический или колориметрический ответ дает быстрое количественное определение.
В дополнительных вариантах осуществления, олигонуклеотиды или более длинные фрагменты, полученные из любых полинуклеотидов, описанных в настоящей заявке, могут быть использованы в качестве мишеней в микрочипе. Микрочип может быть использован для мониторинга уровня экспрессии огромного числа генов одновременно (для получения образа транскрипта), и для идентификации генетических вариантов, мутаций и полиморфизмов. Эта информация может быть использована для определения функции гена, для понимания генетической основы заболевания, для диагностики заболевания и для развития и мониторинга активностей терапевтических средств. В одном варианте осуществления, микрочип получают и используют в соответствии со способами, известными в данной области, например, описанными в заявке PCT WO 95/11995 (Chee et al.), Lockhart, D. J. et al. (1996; Nat. Biotech. 14: 1675-1680) и Schena, M. et al. (1996; Proc. Natl. Acad. Sci. 93: 10614-10619).
В одном аспекте олигонуклеотиды могут быть синтезированы на поверхности микрочипа, с использованием методики химического соединения и прибора чернильно-струйного нанесения, например, описанного в заявке PCT WO95/251116 (Baldeschweiler et al.). В другом аспекте матрица «с координатной сеткой», аналогичная дот или слот блоту (HYBRIDOT apparatus, Life Technologies), может быть использована для систематизирования и соединения фрагментов кДНК или олигонуклеотидов с поверхностью субстрата, с использованием вакуумной системы, термического, УФ, механического способа или способа химического связывания. Еще в одном аспекте матрица может быть получена вручную, или путем использования доступных устройств, материалов и приборов (в том числе многоканальных микродозаторов или робототехнических инструментов; Brinkmann, Westbury, N.Y.) и может содержать, например, 24, 48, 96, 384, 1024, 1536 или 6144 пятен или лунок (например, в виде многолуночного планшета), или более, или любую другую кратную величину от 2 до 1000000, которая подходит для эффективного использования коммерчески доступного применения технических средств.
Для проведения анализа образца с использованием микрочипов полинуклеотиды экстрагируют из биологического образца. Биологические образцы могут быть получены из любой жидкости организма (крови, мочи, слюны, мокроты, желудочного сока и т.д.), культивированных клеток, биоптатов или других тканевых препаратов. Для получения зондов, полинуклеотиды, экстрагированные из образца, используют для получения последовательностей нуклеиновых кислот, которые комплементарны нуклеиновым кислотам на микрочипе. Если микрочип состоит из кДНК, антисмысловые РНК являются подходящими зондами. Следовательно, в одном аспекте, мРНК используют для получения кДНК, которая в свою очередь и в присутствии флуоресцентных нуклеотидов используется для получения фрагментов или антисмысловых РНК зондов. Эти флуоресцентно меченные зонды инкубируют с микрочипом так, чтобы последовательности зонда гибридизировались с кДНК олигонуклеотидами микрочипа. В другом аспекте последовательности нуклеиновых кислот, используемые в качестве зондов, могут содержать полинуклеотиды, фрагменты и комплементарные или антисмысловые последовательности, полученные с использованием ферментов рестрикции, ПЦР способов и наборов олигомечения (Amersham Pharmacia Biotech), хорошо известных в области гибридизационной технологии.
В другом варианте осуществления настоящего изобретения, полипептиды по изобретению или их функциональные или иммуногенные фрагменты или олигопептиды могут быть использованы для скрининга библиотек соединений в любом из целого ряда способов скрининга лекарственных средств. Фрагмент, используемый в таком скрининге, может быть свободным в растворе, фиксирован на твердой подложке, перенесен на клеточную поверхность или расположен внутриклеточно. Можно измерить образование связывающих комплексов между полипептидом и тестируемым веществом.
Одна методика скрининга лекарственных средств, которая может быть использована, предусматривает высокопроизводительный скрининг соединений, имеющих аффинность связывания в отношении полипептида, представляющего интерес, как описано в опубликованной заявке PCT WO 84/03564. В этом способе большое количество различных небольших тестируемых соединений синтезируют на твердом субстрате, например пластиковых штифтах, или некоторых других поверхностях. Тестируемые соединения приводят во взаимодействие с полипептидом, или его фрагментами, и промывают. Связанный полипептид затем выявляют способами, хорошо известными в данной области. Очищенный полипептид также может быть нанесен непосредственно на планшеты для использования в упомянутых выше способах скрининга лекарственных средств. Альтернативно, не нейтрализующие антитела могут быть использованы для захвата полипептида и иммобилизации его на твердой подложке.
В другом способе, можно использовать конкурентные анализы для скрининга лекарственных средств, в которых нейтрализующие антитела, способные связываться с полипептидом, специфически конкурируют с тестируемым соединением за связывание с этим полипептидом. Таким образом, антитела могут быть использованы для выявления присутствия тестируемого соединения, которое делит с антителом один или несколько антигенсвязывающих сайтов.
ПРИМЕРЫ
Примеры, описанные в настоящей заявке, предназначены для иллюстрации вариантов осуществления настоящего изобретения. Другие варианты осуществления, способы и типы анализов находятся в пределах компетенции специалистов в области молекулярной диагностики и не нуждаются в подробном описании. Другие варианты осуществления в объеме уровня техники считаются частью этого изобретения.
ПРИМЕР 1: оценка размера генома
Штамм Methanobrevibacter ruminantium M1T (DSM1093) выращивали в среде BY+ (минимальная среда, Joblin et al., 1990), которая состоит из [г/л] NaCl (1), KH2PO4 (0,5), (NH4)2SO4 (0,25), CaCL2·2H2O (0,13), MgSO4·7H2O (0,2), K2HPO4 (1), осветленной рубцовой жидкости (300 мл) dH2O (360 мл), NaHCO3 (5), резазурина (0,2 мл), L-цистеин-HCl (0,5), экстракта дрожжей (2), и раствора следовых элементов Balch (10 мл) (добавленные следовые элементы; Balch et al., 1979), который состоит из (г/л) нитрилтрехуксусной кислоты (1,5), MgSO4·7H2O (3), MnSO4·H2O (0,5), NaCl (1), FeSO4·7H2O (0,1), CoCl2·6H2O (0,1), CaCl2 (0,1), ZnSO4·7H2O (0,1), CuSO4·5H2O (0,01), AlK(SO4)2·12H2O (0,01), H3BO3 (0,01), Na2MoO4·2H2O (0,01), NiSO4·6H2O (0,03), Na2SeO3 (0,02), и Na2Wo4·2H2O (0,02). Геномную ДНК экстрагировали путем замораживания клеточного дебриса в жидком N2 и измельчали, используя предварительно охлажденную стерильную ступку и пестик. Гомогенаты клеток погружали в агарозные пробки, и последующие манипуляции проводили в этих пробках для уменьшения физической фрагментации геномной ДНК. Расщепления проводили эндонуклеазами рестрикции, и фрагменты ДНК отделяли, используя гель-электрофорез в градиенте пульсирующего поля (PFGE).
ПРИМЕР 2: клонирование и секвенирование ДНК
ДНК генома M. ruminantium была секвенирована Agencourt Biosciences Corporation (Massachusetts, USA) с помощью клонирующего подхода стохастических геномных фрагментов (Fleischmann et al., 1995) и Macrogen Corporation (Rockville, MD, USA) с помощью пиросеквенирования. Вкратце, библиотеки ДНК M. ruminantium конструировали в Escherichia coli путем случайного физического разрушения геномной ДНК и отделения фрагментов гель-электрофорезом. Крупные фрагменты в диапазоне 40 Kb извлекали из геля и использовали для получения крупной вставочной фосмидной библиотеки. Фрагменты ДНК в диапазоне от 2 до 4 Kb извлекали и использовали для получения небольшой вставочной плазмидной библиотеки. Клоны, полученные как из больших, так и из небольших вставочных библиотек, выращивали, и их фосмидную или плазмидную ДНК извлекали и секвенировали, используя технологию высокопроизводительного секвенирования. Достаточное количество клонов секвенировали для получения теоретического 8 кратного охвата генома M. ruminantium. Пиросеквенирование проводили на произвольно расщепленных фрагментах геномной ДНК с получением конечного теоретического 10 кратного охвата.
ПРИМЕР 3: сборка и описание последовательности профага
Последовательности ДНК выравнивали для нахождения перекрываний последовательностей и собирали в непрерывные (контиг) последовательности, используя Paracel Genome Assembler (Paracel Inc, CA, USA) и Staden package (Staden et al., 1998), в сочетании с последовательностью как из стандартных, так и инвертированных ПЦР. Контиги анализировали, используя искатель открытой рамки считывания (ORF) GLIMMER (Gene Locator Interpolated Markov Model ER, Delcher et al., 1999), и каждую ORF анализировали, с помощью BLASTP с разрывами (Basic Local Alignment Search Tool (Altschul et al., 1997) относительно пополняемых нуклеотидных и белковых баз данных Национального центра биотехнологической информации (NCBI). Контиги из 8-кратной предварительной последовательности соединяли случайным образом путем искусственного соединения последовательностей для получения «псевдомолекулы», и представляли на рассмотрение в Институт геномных исследований (TIGR, DC, USA) для автоаннотации. Контиги, собранные в результате 10-кратного пиросеквенирования, повторно анализировали с помощью GLIMMER, и ORF автоаннотировали с использованием GAMOLA (Global Annotation of Multiplexed On-site Blasted DNA sequences; Altermann and Klaenhammer, 2003). ORF классифицировали по функции, используя базу данных кластеров ортологичных белков (COG) (порог 1e-02) (hypertext transfer protocol://world wide web.pnas.org/cgi/content/full/102/11/3906; Tatusov et al., 2001).
Белковые мотивы определяли с помощью HMMER (hypertext transfer protocol://hmmer.wustl.edu), используя библиотеки PFAM HMM и TIGRFAM, и общее и локальное выравнивание (hypertext transfer protocol://pfam.wustl.edu) и стандартные и фрагментарные модели TIGRFAM HMM (hypertext transfer protocol://world wide web.tigr.org/TIGRFAMs), соответственно (порог 1e-02). тРНК идентифицировали, используя TRNASCAN-SE (Lowe and Eddy, 1997), и нуклеотидные повторы идентифицировали, используя пакет программ KODON (Applied Maths, Austin, TX, USA) и REPUTER (Kurtz and Schleiermacher, 1999). Автоматизированные аннотации впоследствии верифицировали вручную. Геномный атлас визуализаций составляли, используя GENEWIZ (Jensen et al., 1999), и структуры ключевых данных получали с помощью специальных алгоритмов собственной разработки. Путь реконструкций из прогнозируемого M. ruminantium ORFеома проводили в сочетании с KEGG (Kyoto Encyclopedia of Genes and Genomes, Kanehisa et al., 2004) базы данных «on-line», используя программное обеспечение собственной разработки (PathwayVoyager; Altermann and Klaenhammer, 2005).
ПРИМЕР 4: результаты сиквенса и анализ
Оценка размера генома M. ruminantium путем расщепления ферментами рестрикции геномной ДНК, и определение размеров фрагментов посредством PFGE, показала одну хромосому приблизительно 2,5-2,9 Mb. Начальное секвенирование больших и маленьких вставочных клонов (6 кратный приблизительный охват) и сборка последовательности в контиги показали, что область генома 40 Kb была высоко представлена (>20 раз), особенно в пределах небольшой вставочной библиотеки. Возможно, это имело место вследствие высокого числа плазмидных копий (хотя внехромосомных ДНК идентифицировано не было) или лизогенного бактериофага, который реплицировался во время роста культуры, используемой для экстрагирования ДНК. Из-за этого большого искажения последовательности проводили дополнительное секвенирование (2-кратный теоретический охват генома) только для небольших вставочных клонов с получением на выходе конечного 8-кратного охвата в результате секвенирования по Сенгеру. 8-кратную фазовую последовательность собирали в 756 контигов, которые соединялись посредством 105 каркасов. Дальнейшее пиросеквенирование проводили до дополнительного ~10-кратного охвата и включения этих последовательностей в сборку, приводящую в результате к количеству контигов, снижающемуся до 27. Последующее закрытие разрывов, с использованием технологий инвертированной ПЦР и ПЦР длинных фрагментов, снижало количество контигов до 14 с оставшейся одной неправильной сборкой.
Во время фазы высокопроизводительного секвенирования стандартная ошибка наблюдалась при охвате последовательности в отношении области (~50 тыс. осн.) значительно более высокого содержания G+C, непосредственно прилегающей к области низкого содержания G+C (~12 Kb). Анализ последовательности генома с помощью GAMOLA и GeneWiz привел к открытию выступающей высоко-GC области, расположенной непосредственно прилегающей к большому низко-GC пику. Подробные анализы области с высоким содержанием G+C показали наличие генных продуктов со сходствами с интегразой, подобной фаговой, большой субъединицей фаговой терминазой, фаговым портальным белком, капсидным белком фага, и прогнозируемой пептидазой, действующей как фаговый лизин (ФИГ. 3). Эти генные продукты использовали в качестве якорных точек для всей структуры предполагаемого профага M. ruminantium, названного φmru. На основе анализа вторичных структур ДНК были идентифицированы вероятные сайты интеграции attL и attR (ФИГ. 1A). Интеграция фага в сайте att по-видимому имеет поврежденный предполагаемый мембранный белок, кодируемый ORF 1980 и 2069, и этот ген может содержать в себе исходный сайт интеграции для генома фага φmru, attB.
Общая структура (ФИГ. 1B) и последовательность ДНК (ФИГ. 4A) φmru были определены исходя из общепризнанной модульной структуры фаговых геномов, объединенных со сходствами с последовательностью и функциональными базами данных. Смотри, например, Altermann E, Klein JR, Henrich B. Primary structure and features of the genome of the Lactobacillus gasseri temperate bacteriophage (phi)adh. Gene. 1999 Aug 20;236(2):333-46; Desiere F, Lucchini S, Canchaya C, Ventura M, Brüssow H. Antonie Van Leeuwenhoek. Comparative genomics of phages and prophages in lactic acid bacteria. 2002 Aug;82(1-4):73-91. Прогнозируемый ORFеом фага φmru был успешно классифицирован на модули, кодирующие фаговую интеграцию, репликацию ДНК и упаковку, фаговые структурные белки и литическую кассету, и приблизительно 40% фаговых ORF были охарактеризованы функционально. Терминатор-подобная структура в большой некодирующей области (244 пар нуклеотидов), фланкированная большим количеством прямых и непрямых повторов, и определенная в модуле репликации ДНК, была охарактеризована как предполагаемая точка начала репликации ДНК. Было прогнозировано несколько генов в пределах геномной последовательности фага на антисмысловой цепи, и они совпадали с областями с низким содержанием GC. Следует определить, инактивируют ли эти гены функцию фага, или указывают на неправильную сборку в фаговом геноме.
Было обнаружено, что область с низким содержанием GC между предполагаемым фаговым лизином и attR содержит в себе систему модификации ДНК под действием серы, dnd (разрушение во время электрофореза), в том числе рестрикцию II типа m6 аденин ДНК метилтрансферазы и транскрипционный регулятор, вероятно являющийся специфичным в отношении системы dnd. Более того, некодирующие структуры РНК были идентифицированы как в пределах фагового генома, так и фланкирующие его. В пределах предполагаемого модуля репликации ДНК был идентифицирован rbcL. rbcL представляет 5' UTR РНК стабилизирующий элемент из Chlamydomonas reinhardtii. Считается, что это семейство вовлечено в стабилизацию гена rbcL, который кодирует большую субъединицу рибулоза-1,5-бифосфаткарбоксилазы. Мутации в этом семействе могут приводить к 50-кратному усилению разрушения транскрипта.
Было идентифицировано три интронных структуры I группы, фланкирующих фаговый геном. Каталитические интроны I группы представляют собой большие рибозимы автономного сплайсинга. Они катализируют свое собственное вырезание из мРНК, тРНК и рРНК предшественников в целом ряде организмов. Вторичная коровая структура состоит из 9 парных областей (P1-P9). Они кратны по существу двум доменам - домену P4-P6 (образованному из стекинга P5, P4, P6 и P6a спиралей) и домену P3-P9 (образованному из P8, P3, P7 и P9 спиралей). Вторичная структура, отмеченная для этого семейства, представляет только это консервативное ядро. Каталитические интроны I группы зачастую имеют длинные ORF, встроенные в петлевые области. Эти некодирующие структуры РНК расположены в некодирующих областях между вышележащей ORF 1980 (SEQ ID NO:74), нижележащей ORF 2065 (SEQ ID NO:141) и attR и выше ORF 2069 (SEQ ID NO:142).
ПРИМЕР 5A: фаговые гены
Открытие профаговой последовательности в пределах геномной последовательности M. ruminantium было неожиданным. Ранее не сообщалось о том, что штамм M1 Methanobrevibacter ruminantium (DSM 1093) является восприимчивым либо к литическому, либо лизогенному фагу, хотя имелись сообщения о фаге, идентифицированном для других видов Methanobrevibacter (Baresi и Bertani, 1984; Knox и Harris, 1986). Последовательность профага φmru существенно выше по содержанию G+C, чем окружающий геном M. ruminantium, что говорит о том, что она происходит из другого организма. Наблюдаемые уровни гомологии не дают возможности предположить очевидного хозяина, из которого она происходит, и указывают на то, что φmru не похож на любой другой фаг, с которым сталкивались до настоящего времени.
ДНК последовательность φmru встроена в пределах предполагаемого мембранного белка M. ruminantium и фланкирована ДНК последовательностями с вторичными структурами, сопоставимыми с сайтами attL и attR. Несмотря на отсутствие строгой гомологии с другими известными белками, все характеристики функциональных модулей фага могли быть идентифицированы в последовательности φmru. Интересной особенностью этой последовательности является область с низким содержанием G+C на 3' конце, которая демонстрирует гомологию с белками, вовлеченными в систему модификации ДНК под действием серы (dnd). Эти гены расположены выше сайта присоединения attR φmru и, следовательно, вероятно внесены в геном M. ruminantium во время интеграции фага. Эта область кодирует несколько dnd ассоциированных ORF (dnd 1, 2 и 3), и субъединицу метилазы II типа наряду с предполагаемым регулятором транскрипции.
Фенотип dnd делает чувствительным его ДНК к разрушению во время электрофореза. Анализы соответствующих функций dnd ORF навели на мысль о включении серы или серусодержащего вещества в геном хозяина. Также было открыто, что фенотип Dnd существует в ДНК широкораспространенных бактериальных видов различного происхождения и различной среды обитания. Аналогично организованные генные кластеры были обнаружены в нескольких бактериальных геномах, представляющих различные роды, и в eДНК морских организмов, давая возможность предположить, что такая модификация является широкораспространенным феноменом. Было продемонстрировано, что совпадение между фенотипом Dnd и модификацией ДНК под действием серы имеет место в нескольких характерных бактериальных геномах при проведении экспериментов in vivo (35)S-мечения (Zhou X, He X, Liang J, Li A, Xu T, Kieser T, Helmann JD, Deng Z. A novel DNA modification by sulphur. Mol Microbiol. 2005 Sep;57(5):1428-38).
Системы R\M II типа являются самыми простыми и наиболее распространенными. Вместо того, чтобы действовать в виде комплекса, метилтрансферазу и эндонуклеазу кодируют в виде двух отдельных белков и они действуют независимо. Отсутствует специфичный белок. Оба белка распознают один и тот же сайт узнавания, и следовательно, конкурируют за активность. Метилтрансфераза действует как мономер, метилирующий дуплекс на одной цепи за один раз. Эндонуклеаза действует как гомодимер, который облегчает расщепление обеих цепей. Расщепление происходит в определенном положении, близком к последовательности распознавания, или в ее пределах. В этот момент не ясно, как предполагаемая функциональная активность действует вместе с системой dnd. Тем не менее, ясно, что фаг подходит в качестве носителя для доставки генов. В частности, область лизогенной конверсии может быть использована в качестве места замещения гена.
Вероятно, что система dnd была перенесена в M. ruminantium посредством фага. Как таковая роль dnd системы φmru в защите или модификации M. ruminantium или чужеродной ДНК неизвестна. Другой интересной особенностью последовательности φmru является число ORF, кодируемых на антисмысловой цепи. Эти ORF соответствуют областям с низким содержанием GC и имеют слабые BLAST соответствия с белками из целого ряда организмов. Это могло навести на мысль, что эти гены были накоплены в пределах генома φmru со времени его интеграции в M. ruminantium. Не ясно, представляют ли эти ORF непрерывное накопление вставок, которые могут случайно приводить к инактивации фага и доместикации, или является ли φmru полностью активным.
Один ген φmru, представляющий особый интерес для минимизации метана, представляет собой ORF2058, расположенную в лизирующей кассете. ORF 2058 описана как пептидаза и обладает соответствием семейства белков (Pfam) (Балл:-13,7, величина E:0,00054) с семейством белков пептидазы C39. Эти белки представляют собой цистеинпептидазы и являются частью более крупной группы CA пептидаз, как определено с помощью базы данных по пептидазам MEROPS (Rawlings et al., 2006). Семейство пептидаз C39 обычно связано с ABC транспортерами, и они функционируют в качестве протеаз созревания во время секреции и процессинга бактериоцинов. Группа CA пептидаз также включает вирусные цистеинэндопептидазы, такие как эндоизопептидазы простейших фагов C71, которые расщепляют поперечносшитые пептиды клеточной стенки простейших. Клеточные стенки метанопродуцирующих простейших, принадлежащие семейству Methanobacteriales, содержат параллельные цепи псевдомуреина, полимер N-ацетил-L-талосаминуриновой кислоты, поперечно-сшитой пептидом. Псевдомуреинэндоизопептидазы C71 способны расщеплять пептидные поперечные сшивки клеточной стенки простейших и лизировать эти клетки.
Исходя из положения и синтении с псевдомуреинэндоизопептидазой из Methanothermobacter marburgensis фага ΨM2 (ФИГ. 3), ORF 2058 может играть роль гена лизина метанопродуцента, который кодирует литический фермент, вовлеченный в лизис клеточной стенки до высвобождения фагового потомства. Выравнивание ORF 2058 с PeiP из M. marburgensis и PeiW из M. wolfeii (ФИГ. 5) показывает низкую общую гомологию между этими белками. Однако существует сохранение остатков гистидина и аспарагиновой кислоты, вовлеченных в каталитическую триаду эндоизопептидазы, и остаток цистеина в ORF 2058 расположен вблизи сохраненного цистеина PeiP и PeiW, который создает третий консервативный сайт каталитической триады (Makarova et al., 1999, Luo et al., 2002). Более того, мотив Gly-His-Tyr, окружающий каталитический остаток His в PeiP и PeiW, также обнаружен в ORF 2058. Эти наблюдения указывают на то, что ORF 2058 представляет собой ген лизина φmru, который функционирует для лизиса клеток M. ruminantium во время литического цикла фага. Различия, наблюдаемые между ORF 2058 и PeiP и PeiW, могут отражать различные пептидные поперечные сшивки клеточной стенки простейших и, следовательно, субстратную специфичность.
ПРИМЕР 5B: индукция фага
Methanobrevibacter ruminantium штамм M1T (DSM1093) выращивали на среде BY+ (основная среда, Joblin et al., 1990), которая состоит из [г/л] NaCl (1), KH2PO4 (0,5), (NH4)2SO4 (0,25), CaCL2·2H2O (0,13), MgSO4·7H2O (0,2), K2HPO4 (1), осветленной жидкости рубца (300 мл), dH2O (360 мл), NaHCO3 (5), резазурина (0,2 мл), L-цистеин-HCl (0.5), экстракта дрожжей (2), и раствора микроэлементов по Balch (10 мл) (добавленные микроэлементы; Balch et al., 1979), который состоит из (г/л) нитрилтрехуксусной кислоты (1,5), MgSO4·7H2O (3), MnSO4·H2O (0,5), NaCl (1), FeSO4·7H2O (0,1), CoCl2·6H2O (0,1), CaCl2 (0,1), ZnSO4·7H2O (0,1), CuSO4·5H2O (0,01), AlK(SO4)2·12H2O (0,01), H3BO3 (0,01), Na2MoO4·2H2O (0,01), NiSO4·6H2O (0,03), Na2SeO3 (0,02), и Na2Wo4·2H2O (0,02).
При оптических плотностях (OD), измеренных при длине волны 600 (OD600), между 0,10 и 0,14, M. ruminantium стимулировали 1 мл и 2 мл стерильного воздуха (~160-320 мкл кислорода), соответственно (Фигура 1C) и 2 мкг/мл митомицина С (Фигура 1D). Характерные кривые лизиса можно было наблюдать для обоих стимулов, с латентным периодом ~90 мин для воздушного стимула. Начальные результаты для стимуляции митомицином С показывают очень короткий латентный период. Для верификации исключения фага из генома хозяина было создано 2 олигонуклеотида, обращенных к обоим сайтам присоединения фага, соответственно (R1F: caaagagagattaaagaagcagacg; SEQ ID NO:146 и L2R agtagtgttggaatcagtgaaaagg; SEQ ID NO:147). Эта пара праймеров только продуцирует ампликон, если фаговый геном рециркулирует после исключения.
На Фигуре 1E показаны эксперименты исходного исключения, когда M. ruminantium стимулировали воздухом. После индукции был обнаружен отчетливый и однозначно идентифицируемый ампликон ожидаемого размера, указывающий на состоявшееся исключение и рециркуляризацию. Аналогичная, хоть и более слабая, полоса также была обнаружена в неиндуцированных клетках M. ruminantium, указывающая на то, что φmru обладает способностью к спонтанному исключению во время нормального нестимулированного роста.
ПРИМЕР 5C: биологические исследования литических ферментов
Полипептид, кодируемый ORF 2058, используется в качестве литического фермента, специфичного в отношении метанопродуцентов рубца, и был субклонирован в векторе экспрессии E. coli для получения рекомбинантного белка. ORF 2058 была амплифицирована с помощью ПЦР с использованием праймеров Mbbrum11for22 (1122For, cac cat ggt tag att cag cag aga c; SEQ ID NO:148) и Mbbrum11rev22 (1122Rev, tca tgc agg aca gac aac ata gta g; SEQ ID NO:149) в объеме реакционной смеси 150 мкл, содержащей: 121,5 нг геномной ДНК штамма М1 M. ruminantium; 0,2 мкМ праймеров 1122For и 1122Rev;15 мкл буфера Accuprime Pfx (с dNTPs, InVitrogen); 2,4 мкл Accuprime Pfx (InVitrogen). Условия ПЦР представляли собой 2 мин при 95°C начальной денатурации с последующими 35 циклами 15 секунд при 95°C, 30 секунд при 55°C и 40 секунд при 68°C. Конечное удлинение не использовалось. Продукт ПЦР очищали и количественно анализировали, используя Nanodrop (Thermo Scientific, GA, USA).
ORF 2058 клонирование: ПЦР-амплифицированную ORF 2058 клонировали либо в pET 100, либо pET 151-D Topo векторы (InVitrogen) в соответствии с рекомендациями производителя, и трансформировали в химически компетентные клетки TOP 10 (InVitrogen). Трансформанты анализировали с помощью метода молекулярных колоний ПЦР, и плазмидную ДНК очищали и секвенировали. Были выбраны клоны с последовательностями ДНК, соответствующими последовательностям ORF 2058.
ORF 2058 экспрессия: плазмидную ДНК из клонов, содержащих верифицированные ORF 2058 вставки, трансформировали путем электропорации в электрокомпетентные клетки BL21* или Rosetta 2. Было обнаружено, что самые лучшие условия роста для экспрессии растворимого белка ORF 2058 в среде LB, с индукцией, проводимой между 0,48-0,6 поглощением при 600 нм, используя 0,5 мМ IPTG и непрерывный рост приблизительно в течение шести часов при 30°C. Затем клетки собирали центрифугированием и замораживали при -20ºC.
Лизис клеток: клеточный дебрис размораживали и ресуспендировали в следующем буфере (pH 7,5): 300 мМ NaCl, 2 мМ DTT, 10 мМ имидазола, 20 мМ Tris, 20% глицерина, 1% Triton-X, 5 мМ CaCl2, и 10 иМ MgCl2. Лизоцим добавляли до конечной концентрации 1 мг/мл, с последующим инкубированием на льду с осторожным перемешиванием в течение 30 мин. ДНазу I и РНазу I добавляли каждую до конечной концентрации 5 мкг/мл с последующим инкубированием на льду с осторожным перемешиванием в течение 30 мин. Клеточный лизат центрифугировали при 12000 об/мин в течение 15 мин, и сырой лизат фильтровали через фильтр 0,8 мкм.
Никель-аффинная хроматография: профильтрованный супернатант в результате процедуры лизиса клеток наносили на 80 мл никель-аффинную колонку и элюировали, используя 20 мМ - 250 мМ градиент имидазола в следующем буфере (pH 7,5): 300 мМ NaCl, 2 мМ DTT, 20 мМ Tris, и 20% глицерина. Фракции, элюированные с колонки, содержащие экспрессированный белок ORF 2058, концентрировали, используя фильтровальную ячейку Millipore ультра с мембраной, отделяющей молекулярную массу 10000 кДа. Конструкцию ORF 2058 в pET100, экспрессированную в клетках E. coli BL21*, элюировали с никелевой колонки следующим буфером для элюции, pH 8,2 (20 мМ Tris, 250 мМ имидазол, 300 мМ NaCl, 10 мМ b-меркаптоэтанол, 10% глицерин), и фермент хранили в буфере, в который добавляли дополнительно глицерин и дитиотреитол до достижения конечной концентрации 40% глицерина, 1 мМ дитиотреитола, pH 8,2.
Обессоливание: обессоливание концентрированного белка, экспрессированного с конструкции pET 151 в клетках Rosetta 2, проводили, используя 250 мл BioGel P6 DG (BioRad, CA, USA) колонку со следующим буфером (pH 7,0):20 мМ MOPS, 1 мМ DTT, 300 мМ NaCl, и 20% глицерина. Фракции с колонки концентрировали, как описано выше, и конечный образец фильтровали и быстро замораживали в жидком азоте до хранения при -20°C.
Лизис полученных в результате клеток M. ruminantium: пять мл культур M. ruminantium M1 (DSM 1093) выращивали в среде BY+ в пробирках Hungate до поздней логарифмической фазы, и клетки собирали центрифугированием пробирок Hungate при 5000×g при комнатной температуре в течение 30 минут. Пробирки перемещали в анаэробную камеру (атмосфера 95% CO2- 5% H2, Coy Laboratory Products, MI, USA), в которой супернатант отбрасывали и клетки из 10 мл культуры ресуспендировали в 1 мл буфера MOPS pH 6,8 (50 мМ MOPS, 5 мМ CaCl2, 1 мМ дитиотреитола). Клеточную суспензию доводили до OD (600 нм) ~0,12 путем разведения дополнительным количеством буфера MOPS.
Стандартизованную клеточную суспензию (50 мкл) помещали в микротитровальный планшет и добавляли различные концентрации литического фермента ORF 2058 (полученного из конструкции pET 100), и общий объем реакционной смеси доводили до 250 мл буфером. Смеси клеток и белка инкубировали при 37ºC и записывали показания OD. Действие добавления фермента (мкг фермента, добавленного на исследование) на оставшиеся клетки M. ruminantium показано на ФИГ. 7. Добавления фермента снижали показатели OD 600 нм суспендированных клеток дозозависимым образом по сравнению с контрольными клетками без добавления фермента. Это указывает на то, что литический фермент ORF 2058 обладает способностью поражать и лизировать оставшиеся клетки M. ruminantium в анаэробных условиях.
Лизис растущих клеток M. ruminantium: M. ruminantium выращивали в среде RM02. Среда RM02 была составлена из следующих ингредиентов (г/л): KH2PO4 (1,4), (NH4)2SO4 (0,6), KCl (1,5), раствор микроэлементов SL10 (1 мл), раствор селенит/вольфрама, (1 мл), 0,1% (масс./об.) раствора резазурина (4 капли). Компоненты перемешивали и кипятили в условиях без O2 100% CO2, и охлаждали на ледяной бане при барботировании 100% CO2. После охлаждения добавляли NaHCO3 (4,2 г) и L-цистеин ·HCl·H2O (0,5 г), и 9,5 мл среды помещали в пробирки Hungate при газировании пробирок 100% CO2. Пробирки автоклавировали и хранили в темноте в течение 24 часов до использования. Перед инокуляцией добавляли NoSubRFV (0,5 мл на пробирку, содержащую субстраты, экстракт дрожжей, витамины). После инокуляции пробирки газировали 80% CO2/20% H2 до 25 фунтов/дюйм2. M. ruminantium выращивали до середины логарифмического роста (OD 600 нм ~0,1), в этой точке к культурам добавляли литический фермент ORF 2058 (полученный из клона pET 151 D Topo) в различных концентрациях. Инкубирование культур продолжали и регистрировали показания OD. Действие добавления фермента на рост и образование мембраны M. ruminantium (% образования мембраны относительно недобавленного контроля после 217 часов роста показан в скобках) показано на ФИГ. 8. Результаты показывают, что литический фермент ORF 2058 значительно влияет на рост M. ruminantium дозозависимым образом, снижая OD 600 нм растущих культур в течение 2 часов добавления. Два самых высоких уровня добавления фермента также снижали образование мембраны до степени, сходной с таковой при добавлении хлороформа (добавлении 100 мкл/10 мл культуры).
ПРИМЕР 6: общие сведения
Неожиданным открытием в результате секвенирования генома M. ruminantium было присутствие последовательности профага. Анализ геномной последовательности идентифицировал область с необычно высоким содержанием GC, которая содержала ряд генов, родственных фаговым. Вся структура предполагаемого профага была идентифицирована с помощью дополнительных биоинформационных анализов и обозначена как φmru. Приблизительно 40% фаговых генов были отнесены к дискретным функциональным группам, включающим интеграцию фага, репликацию и упаковку ДНК, фаговые структурные белки и лизис. Было обнаружено, что последовательности ДНК, фланкирующие фаговый геном, представляют потенциальные сайты для интеграции фага (attL и attR).
По-видимому, фаг сам встроился в предполагаемый мембранный белок M. ruminantium, который, вероятно, содержит первоначальный сайт интеграции метанопродуцента для генома фага φmru, attB. Более того, считается, что структура, подобная терминатору, обнаруженная в пределах модуля репликации ДНК, представляет точку начала репликации ДНК фага. Область с низким содержанием GC на 3' конце фагового генома содержит то, что по-видимому является системой модификации ДНК под действием серы, включая ген, который вероятно контролирует экспрессию системы dnd. Эти гены, вероятно, были внесены в геном M. ruminantium во время интеграции фага и их роль в отношении модификации фага, ДНК хозяина или чужеродной ДНК остается выяснить. Сохранение dnd системы M ruminantium дает возможность предположить, что она приносит пользу хозяину. Однако роль dnd системы φmru в модификации M. ruminantium или чужеродной ДНК остается в стадии исследования.
Другой интересной особенностью последовательности φmru является ряд генов, кодируемых на антисмысловой цепи, которые соответствуют областям с низким содержанием GC, и имеют слабые соответствия с белками из целого ряда организмов. Это дает возможность предположить, что эти гены накопились в пределах генома φmru с момента его интеграции в M. ruminantium и может быть, что эти гены представляют непрерывное накопление вставок, которые могли случайно привести к инактивации фага и доместикации фага. Высокое содержание GC в последовательности фага φmru по сравнению с геномом M. ruminantium дает возможность предположить, что она происходит из другого организма. Однако предыдущий хозяин не является очевидным, поскольку белки φmru оказываются до некоторой степени уникальными по сравнению с другими фагами, встречающимися до настоящего времени.
Гены φmru, представляющие особый интерес в отношении уменьшения метана, представляют собой гены, расположенные в пределах литической кассеты. Один ген в частности кодирует белок, обладающий сходством с семейством пептидаз C39. Это семейство пептидаз включает, среди прочих, вирусные цистеинэндопептидазы, такие как фаговые эндоизопептидазы C71 простейших, которые расщепляют поперечно сшивающие пептиды псевдомуреина, который составляет клеточные стенки Methanobrevibacter. Исходя из локализации гена в пределах фагового генома и синтении с эндоизопептидазами псевдомуреина из других фаговых геномов метанопродуцентов, не находящихся в рубце, этот ген может играть роль в качестве гена лизина, кодирующего литический фермент, вовлеченный в лизис клетки до высвобождения потомства фага. Этот ген и кодируемый им фермент представляют очевидный интерес в качестве контрольного механизма для M. ruminantium и других метанопродуцентов рубца со сходными клеточными стенками.
Фаги жвачных животных и их ферменты, которые вовлечены в лизис клеток-хозяев, представляют большие возможности для контролирования как популяций метанопродуцентов, так и других членов сообщества (бактерий, простейших и грибов) в рубце. Кроме того, возможно идентифицировать ключевые мишени ферментов хозяина, которые чувствительны к ингибированию под действием фаговых белков, через понимание жизненных циклов фага. Авторы изобретения провели исследования состава фага рубца у коров, овец и оленей, и показали, что они демонстрируют изменение во времени в числе и типе. Также были идентифицированы изоляты метанопродуцентов Новой Зеландии, на которые оказывает воздействие фаг. Чистые культуры метанопродуцентов были использованы для оценки литических ферментов фага, и были разработаны методики на основе культур и на основе ПЦР для скрининга нового фага. Было показано, что очищенный фаг из образцов рубца поддается случайному анализу ДНК последовательности, которая позволяет обнаружить ферменты профага.
Существует несколько преимуществ для использования фага или его ферментов в методиках минимизации воздействия на окружающую среду для снижения выбросов метана. Фаги являются природными компонентами микробиологического сообщества в рубце, и, следовательно, не должны рассматриваться как антибактериальное лечение (могли бы легко преодолеть любые регуляторные ограничения). Фаги обычно специфичны в отношении узкого диапазона хозяев, потенциально давая возможность селективно направлять их на метанопродуцентов. Фаговая терапия в настоящее время рассматривается как лечение для организмов, резистентных к антибиотикам, и в основном считается безопасной. После получения фаг обычно является относительно стабильным. Введение штаммов метанопродуцентов в рубец, которые подвергаются воздействию фага, могло бы оказывать длительные лечебные эффекты, в частности, если инокуляция проходит в раннем возрасте (например, у молодых овечек и телят). Известно, что некоторые метанопродуценты либо содержат фаговые геномы, чувствительные к литическому фагу, либо подвергаются автолизису (напоминающие литические ферменты), в том числе Methanobrevibacter smithii (штамм PS), Methanobacterium bryantii и Methanobrevibacter штамм MF-1. Одним заметным примером фага, используемого для ингибирования проблематичных с точки зрения сельского хозяйства, является использование фага для направленной доставки в Escherichia coll. 0157:H7.
Methanobrevibacter ruminantium выбрали для секвенирования генома вследствие доминирования в рубце при различных условиях питания (исходя из данных культивирования и молекулярного определения), доступности культур, удобства для рутинного выращивания в условиях лаборатории, и сравнительно большого количества предварительных исследований и первоисточников, доступных по этому организму. Настоящее изобретение представляет важные данные в отношении генома M. ruminantium и составляет подробную картину этого фага в рубце. Последовательность профага φmru предоставляет специфические реагенты для ингибирования M. ruminantium и для дальнейших генетических манипуляций для содействия в определении функции гена. Этот фаг может быть использован для блокирования консервативных функций/компонентов среди метанопродуцентов для предотвращения или уменьшения образования метана в рубце.
Ссылки
Altermann E, Klaenhammer TR (2005) PathwayVoyager: pathway mapping using the Kyoto Encyclopedia of Genes and Genomes (KEGG) database. BMC Genomics 6:60-66.
Altermann, E Klaenhammer TR (2003) GAMOLA: a new local solution for sequence annotation and analyzing draft and finished prokaryotic genomes. OMICS: A journal of integrative biology 7, 161-169.
Altschul SF, Madden TL, Schaffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ (1997) Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic Acids Research 25, 3389-3402.
Balch WE, Fox GE, Magrum LJ, Woese CR, Wolfe RS (1979) Methanogens: reevaluation of a unique biological group. Microbiological Reviews 43, 260-296.
Baresi, L. and Bertani, G. 1984. Isolation of a bacteriophage for a methanogenic bacterium. In Abstracts of the Annual Meeting of the American Society for Microbiology. Washington DC: American Society for Microbiology, p. 133.
Bickle, T. A. and D. H. Kruger. 1993. Biology of DNA restriction. Microbiol. Rev. 57:434-450.
Bult CJ, et al. (1996) Complete genome sequence of the methanogenic archaeon, Methanococcus jannaschii. Science 273, 1058-1073.
Coutinho PM, Henrissat B (1999) Carbohydrate-active enzymes: an integrated database approach. In 'Recent Advances in Carbohydrate Bioengineering' (Eds HJ Gilbert, G Davies, B Henrissat and B Svensson) pp. 3-12 (The Royal Society of Chemistry, Cambridge) (Carbohydrate Active Enzymes database, http://www.cazy.org/).
Delcher AL, Harmon D, Kasif S, White O, Salzberg SL (1999) Improved microbial gene identification with GLIMMER. Nucleic Acids Research 27, 4636-4641.
Fleischmann, RD, et al. (1995) Whole-genome random sequencing and assembly of Haemophilus influenzae Rd. Science 269, 496-512.
Fricke WF, Seedorf H, Henne A, Kruer M, Liesegang H, Hedderich R, Gottschalk G, Thauer RK (2006) The genome sequence of Methanosphaera stadtmanae reveals why this human intestinal archaeon is restricted to methanol and H2 for methane formation and ATP synthesis. Journal of Bacteriology 188, 642-658.
Godde JS, Bickerton A (2006) The repetitive DNAe called CRISPRs and their associated genes: evidence of horizontal transfer among prokaryotes. Journal of Molecular Evolution 62, 718-729.
Haft DH, Selengut J, Mongodin EF, Nelson KE (2005) A guild of 45 CRISPR-associated (Cas) protein families and multiple CRISPR/Cas subtypes exist in prokaryotic genomes. PLoS Computational Biology 1:474-483
Jansen R, Embden JD, Gaastra W, Schouls LM (2002) Identification of genes that are associated with DNA repeats in prokaryotes. Molecular Microbiology 43, 1565-1575.
Jansen R, van Embden JD, Gaastra W, Schouls LM (2002) Identification of a novel family of sequence repeats among prokaryotes. OMICS: A journal of integrative biology 6, 23-33.
Jensen LJ, Friis C, Ussery DW (1999) Three views of microbial genomes. Research in Microbiology 150, 773-777.
Joblin KN, Naylor GE, Williams AG (1990) Effect of Methanobrevibacter smithii on xylanolytic activity of anaerobic ruminal fungi. Applied and Environmental Microbiology 56, 2287-2295.
Kanehisa M, Goto S, Kawashima S, Okuno Y, Hattori M (2004) The KEGG resource for deciphering the genome. Nucleic Acids Research 32, D277-D280.
Kiener, A., Konig, H., Winter, J. and Leisinger, T. 1987. Purification and use of Methanobacterium wolfeii pseudomurein endopeptidase for lysis of Methanobacterium thermoautotrophicum . J. Bacteriol. 169, 1010-1016.
Knox, M. R. and Harris, J. E. 1986. Isolation and characterisation of a bacteriophage of Methanobrevibacter smithii. In Abstracts of the XIV International Congress on Microbiology. Manchester: International Union of Microbiological Societies.
Kurtz S, Schleiermacher C (1999) REPuter: fast computation of maximal repeats in complete genomes. Bioinformatics 15, 426-427.
Lowe TM, Eddy SR (1997) tRNAscan-SE: a program for improved detection of transfer RNA genes in genomic sequence. Nucleic Acids Research 25, 955-964.
Loenen, W. and N. Murray. 1986. Modification enhancement by restriction alleviation protein (Ra1) of bacteriophage lambda. J. Mol. Biol. 190:11-22.
Lucchini, S., F. Desiere, and H. Brussow. 1999. Comparative genomics of Streptococcus thermophilus phage species supports a modular evolution theory. J. Virol. 73:8647-8656.
Luo, Y. N., Pfister, P., Leisinger, T. and Wasserfallen, A. 2002. Pseudomurein endoisopeptidases PeiW and PeiP, two moderately related members of a novel family of proteases produced in Methanothermobacter strains. FEMS Microbiol. Lett. 208, 47-51.
Makarova, K. S., Aravind, L. and Koonin, E. V. 1999. A superfamily of archaeal, bacterial, and eukaryotic proteins homologous to animal transglutaminases. Protein Sci. 8, 1714-1719.
Makarova KS, Grishin NV, Shabalina, SA, Wolf YI, Koonin EV (2006) A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action. Biology Direct 1:7-32.
New Zealand Statistics 2005 (www.stats.govt.nz)
New Zealand's Greenhouse Gas Inventory 1990 - 2004. The National Inventory Report and Common Reporting Format. (2006) Ministry for the Environment. http://www.mfe.govt.nz/publications/climate/nir-apr06/nir-apr06.pdf.
Reeve JN, Nolling J Morgan RM, Smith DR (1997) Methanogenesis: genes, genomes and who's on first? Journal of Bacteriology 179, 5975-5986.
Rawlings, N. D., Morton, F. R. and Barrett, A. J. 2006. MEROPS: the peptidase database. Nucleic Acids Res. 34, D270-D272.
Samuel BS, Hansen EE, Manchester JK, Coutinho PM, Henrissat B, Fulton R, Latreille P, Kim K, Wilson RK, Gordon JI (2007) Genomic adaptations of Methanobrevibacter smithii to the human gut. Proceedings of the National Academy of Sciences USA 104, 10643-10648.
Smith DR, et al. (1997) Complete genome sequence of Methanobacterium thermoautotrophicum H: Functional analysis and comparative genomics. Journal of Bacteriology 179, 7135-7155.
Smith PH, Hungate RE (1958) Isolation and characterization of Methanobacterium ruminantium n. sp. Journal of Bacteriology 75, 713-718.
Staden R, Beal KF, Bonfield JK (1998) The Staden Package. Methods in Molecular Biology: Bioinformatics Methods and Protocols 132, 115-130.
Tatusov RL, Natale DA, Garkavtsev IV, Tatusova TA, Shankavaram UT, Rao BS, Kiryutin B, Galperin MY, Fedorova ND, Koonin EV (2001) The COG database: new developments in phylogenetic classification of proteins from complete genomes Nucleic Acids Research 29, 22-28.
Все публикации и патенты, упомянутые в представленном выше описании, включены в качестве ссылки.
Там где ссылка представленного выше описания дана к целым числам, имеющим известные эквиваленты, эти эквиваленты включены как отдельно указанные. Хотя настоящее изобретение было описано применительно к особенно предпочтительным вариантам осуществления, должно быть понятно, что настоящее изобретение, как заявлено, не должно ненадлежащим образом ограничиваться такими особыми вариантами осуществления. Понятно, что дополнительные модификации могут быть проведены в отношении настоящего изобретения, как описано в настоящей заявке, без отклонения от сущности и объема изобретения.