Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ГЛИКОПРОТЕИНА И СПОСОБ СКРИНИНГА
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения гликопротеина, имеющего однородные аминокислотную последовательность, структуру сахаридной цепочки и структуру высшего порядка.
Уровень техники
Недавно было проведено исследование относительно применения гликопротеина в качестве различных лекарственных препаратов. Фрагмент сахаридной цепочки в гликопротеине выполняет функцию придания гликопротеину стойкости в отношении протеазы с целью замедления метаболизма гликопротеина в крови, функцию сигнала, регулирующего транспорт гликопротеина к органеллам внутри клетки, и тому подобное. Следовательно, добавление соответствующей сахаридной цепочки обеспечивает регулирование времени полужизни в крови и внутриклеточный транспорт гликопротеина.
Эритропоэтин (ЕРО) представляет собой характерный пример, демонстрирующий, что сахаридная цепочка влияет на физиологическую активность гликопротеина. Этот гликопротеин представляет собой гормон дифференциации гемоцитов, который выполняет функцию поддержания количества эритроцитов в периферической крови под действием эритроидных клеток-предшественников для того, чтобы способствовать их быстрому разрастанию и дифференциации. При исследовании корреляции между структурой сахаридной цепочки ЕРО и его физиологической активностью обнаружено, что, хотя лишенный сахаридной цепочки ЕРО еще демонстрирует физиологическую активность вне организма, он легко выводится из организма через почки, что приводит к недостаточной физиологической активности.
Кроме того, когда гликопротеин обладает несовершенной сахаридной цепочкой, а также, когда другая сахаридная цепочка связана с гликопротеином, такой гликопротеин может быть удален из крови при распознавании макрофагами и тому подобными, которые присутствуют в крови.
Следовательно, когда гликопротеин используется в качестве фармацевтического продукта, желательно, чтобы каждый белок имел сахаридную цепочку с однородной структурой, присоединенную в одном и том же положении.
Традиционно, в качестве способа получения гликопротеина широко применяется метод ферментативного присоединения сахара к белку. Однако в этом способе нельзя присоединить однородную сахаридную цепочку, а также трудно осуществить однородное модифицирование и тримминг после добавления сахаридной цепочки.
Кроме того, хотя белковый препарат обычно оценивают на основе его титра, существует вероятность того, что препараты с одинаковыми титрами могут содержать белки с различными структурами сахаридной цепочки, что может вызвать изменения времени полужизни в крови или привести к проблемам контроля качества.
Авторы настоящего изобретения до сих пор разработали способ, обеспечивающий производство относительно большого количества гликопротеина, имеющего однородную аминокислотную последовательность и сахаридную цепочку из аминокислот, имеющих аминогруппу, защищенную жирорастворимой защитной группой, и сахаридную цепочку, связанную с аспарагином (например, смотрите патентную литературу 1). Кроме того, авторы разработали производную сахаридную цепочку типа аминированного комплекса и гликопротеин, концентрацию которого в крови можно поддерживать на достаточном уровне (например, смотрите патентную литературу 2). Ожидается, что любой из указанных выше гликопротеинов может быть использован в качестве фармацевтического продукта.
Между тем для того, чтобы полученный гликопротеин можно было использовать в качестве фармацевтического продукта, он должен обладать постоянной физиологической активностью. Считается, что не только аминокислотная последовательность и структура сахаридной цепочки, но также и структура высшего порядка белкового фрагмента непосредственно связана с функцией гликопротеина.
Структура высшего порядка белка стабилизируется водородной связью, ионной связью, и гидрофобным взаимодействием между аминокислотными остатками, а также S-S связью между цистеиновыми остатками и тому подобным, причем каждый из большинства белков имеет своеобразную структуру высшего порядка. Однако связи, отличающиеся от S-S связи, являются относительно слабыми, и таким образом, структура высшего порядка белка разрушается под действием относительно слабого нагревания, давления и тому подобного, в результате чего физиологическая активность белка уменьшается и теряется. Это называется денатурацией белка. Кроме того, особенно при длинной цепочке аминокислоты, может возникать аномальная структура высшего порядка (неправильное укладывание), поскольку образуется более одной структуры, обеспечивающей минимальное значение энергии. В этом случае сообщается, что активность белка также может измениться или исчезнуть.
На основе изложенных фактов обычно считается, что правильная структура высшего порядка является существенной для того, чтобы белок проявлял свои функции, причем, когда белки укладываются, они разделяются на правильно уложенные белки, обладающие физиологической активностью, а также на неправильно уложенные белки, не обладающие физиологической активностью.
Хотя различные авторы провели исследования связи между структурой высшего порядка белка и физиологической активностью, отсутствуют сведения о том, как сахаридная цепочка может влиять на укладывание и физиологическую активность искусственно-синтезированного гликопротеина.
Авторы настоящего изобретения синтезировали фрагменты гликопротеина согласно методу патентной литературы 1 и присоединили их к другим пептидным фрагментам с использованием метода нативного химического лигирования (NCL), чтобы получить хемотаксический белок-3 моноцитов. Синтезированный таким образом, хемотаксический белок-3 моноцитов подвергается укладыванию, и положение дисульфидной связи подтверждают путем обработки химотрипсином. В результате было обнаружено, что, хотя дисульфидная связь образуется в правильном положении, приблизительно в 90% гликопротеина, дисульфидная связь также образуется в положении, отличающемся от нормального положения, приблизительно в 10% гликопротеина (непатентная литература 1).
Однако, согласно приведенной выше литературе, такое изменение положения дисульфидной связи не наблюдается, когда укладываются два или больше различных типов гликопротеинов. С учетом того, что в ходе химотрипсиновой обработки может произойти перестройка дисульфидной связи, нельзя отметать возможность того, что два или более типов укладывания вообще не возникло, а просто при обработке химотрипсином образуются два или более видов продукта. Соответственно, следует отметить, что не были проведены исследования различной физиологической активности гликопротеина, имеющего дисульфидную связь, образовавшуюся в правильном положении, а также гликопротеина, имеющего дисульфидную связь, образовавшуюся в положении, отличающемся от нормального положения.
Кроме того, относительно хорошо изучены функции и структура овомукоидного белка, который является одним из гликопротеинов. Овомукоидный белок представляет собой тип белков, которые содержатся в яичном белке и имеют молекулярную массу приблизительно 28000. В его молекуле имеется три домена, каждый из которых обладает ингибирующей активностью в отношении различных протеаз. Особенно подробно исследован третий домен, поскольку он обладает даже собственной ингибирующей активностью. В настоящее время известна структура третьего домена, происходящего из 100 или больше видов птиц, причем конформация домена также установлена методом рентгеновской кристаллографии.
Что касается, например, стереоструктуры химически синтезированного третьего домена овомукоида сообщается, что третий домен овомукоида с модифицированным пептидным каркасом синтезирован методом NCL и затем проанализирован с помощью рентгеновской кристаллографии (смотрите непатентную литературу 2).
Кроме того, также известно, что, когда проводят укладку третьего домена овомукоида, синтезированного с использованием последовательного синтеза и NCL, полученный результат надежно подтверждает, что третий домен уложен правильно, как показал анализ термической стабильности (смотрите непатентную литературу 3).
Патентная литература
Патентная литература 1 - WO 2004/005330
Патентная литература 2 - WO 2005/010053
Непатентная литература
Непатентная литература 1 - Yamamoto и др., Journal of American Chemical Society, 2008, т.130, с.501-510.
Непатентная литература 2 - Bateman и др., Journal of Molecular Biology, 2001, т.305, с.839-849.
Непатентная литература 3 - Lu и др., Journal of American Chemical Society, 1996, т.118, с.8518-8523.
Раскрытие изобретения
Проблема, решаемая изобретением
Однако, согласно вышеупомянутой традиционной технологии, в синтезированный белок не включается сахаридная цепочка, и таким образом, неизвестно, каким образом сахаридная цепочка влияет на укладывание и физиологическую активность гликопротеина.
С учетом указанного выше, одним объектом настоящего изобретения является обеспечение гликопротеина, имеющего не только однородную функцию на основе сахаридной цепочки, такую как время полужизни в крови, но также однородную физиологическую активность, то есть гликопротеина, имеющего однородные аминокислотную последовательность, структуру сахаридной цепочки, и структуру высшего порядка.
Кроме того, другим объектом настоящего изобретения является обеспечение способа скрининга для отбора гликопротеина, имеющего заданную активность, среди множества типов гликопротеинов с различной интенсивностью физиологической активности, и получения смеси гликопротеинов, имеющей желательную активность.
Средства решения проблемы
Авторы настоящего изобретения обнаружили, что путем синтеза третьего домена овомукоидного белка, имеющего однородные аминокислотную последовательность и структуру сахаридной цепочки, и укладывания полученного таким образом продукта, может быть получена смесь, содержащая множество типов структур высшего порядка в постоянном соотношении, с хорошей воспроизводимостью. Кроме того, когда авторы выделили образовавшийся продукт и измерили его физиологическую активность, в отличие от традиционных представлений, было надежно установлено, что имеется множество видов структур высшего порядка, которые обладают однотипной физиологической активностью на уровне, который считается относительно высоким, и хотя активность является достаточно высокой, она изменяется в зависимости от структуры высшего порядка, и что гликопротеины с различными структурами высшего порядка могут быть выделены индивидуально и очищены с использованием колоночной хроматографии.
Кроме того, авторы обнаружили, что гликопротеин, отличающийся от гликопротеина, имеющего заданную активность, может быть превращен в структуру высшего порядка, которая получается в постоянном соотношении, как описано выше, путем однократного разворачивания и затем повторного укладывания, и, таким образом, может быть получен с максимальным выходом гликопротеин, имеющий структуру высшего порядка, демонстрирующий заданную активность, путем повторения стадий разворачивания/повторного укладывания.
Таким образом, в настоящем изобретении разработан способ получения гликопротеина, имеющего однородные аминокислотную последовательность, структуру сахаридной цепочки, и структуру высшего порядка, который включает следующие стадии от (а) до (с):
(a) укладывание гликопротеина, имеющего однородные аминокислотную последовательность и сахаридную цепочку;
(b) фракционирование уложенного гликопротеина с использованием колоночной хроматографии; и
(c) сбор фракции, имеющей заданную активность.
Предпочтительно, вышеупомянутый способ после стадии (с) дополнительно включает стадии:
(d) разворачивание гликопротеина, содержащегося во фракции, не собранной на стадии (с);
(e) повторное укладывание развернутого гликопротеина;
(f) фракционирование повторно уложенного гликопротеина с использованием колоночной хроматографии и сбор фракции, имеющей заданную активность; и
(g) повторение стадий от (d) до (f), в случае необходимости.
Кроме того, в настоящем изобретении разработан способ тестирования гликопротеина, имеющего заданную физиологическую активность, который включает следующие стадии: (i) - (iii):
(i) укладывание гликопротеина, имеющего однородную аминокислотную последовательность и сахаридную цепочку;
(ii) фракционирование уложенного гликопротеина с использованием колоночной хроматографии; и
(iii) измерение активности каждой фракции с целью определения, обладает ли фракция заданной активностью.
В настоящем изобретении разработан способ получения смеси гликопротеинов, имеющей желательную физиологическую активность, который включает следующие стадии от (А) до (D):
(A) укладывание гликопротеина, имеющего однородные аминокислотную последовательность и сахаридную цепочку;
(B) фракционирование уложенного гликопротеина с использованием колоночной хроматографии; и
(C) измерение активности каждой фракции; и
(D) определение соотношения фракций в смеси, с целью получения желательной активности, и смешивание полученных таким образом фракций в соответствии с этим соотношением.
Предпочтительно, согласно способу получения гликопротеина, способу тестирования гликопротеина, или способу получения смеси гликопротеинов, имеющей желательную физиологическую активность настоящего изобретения,
по меньшей мере, часть гликопротеинов, имеющих однородные аминокислотную последовательность и сахаридную цепочку, получают по способу, который включает в себя следующие стадии (1) - (6):
(1) этерификация гидроксильной группы смолы, имеющей гидроксильную группу, и карбоксильной группы аминокислоты, имеющей аминогруппу, защищенную жирорастворимой защитной группой, или карбоксильной группы гликозилированной аминокислоты, имеющей аминогруппу, защищенную жирорастворимой защитной группой;
(2) удаление жирорастворимой защитной группы для того, чтобы образовалась свободная аминогруппа;
(3) амидирование свободной аминогруппы и карбоксильной группы аминокислоты, имеющей аминогруппу, защищенную жирорастворимой защитной группой, или карбоксильной группы гликозилированной аминокислоты, имеющей аминогруппу, защищенную жирорастворимой защитной группой;
(4) после стадии (3), удаление жирорастворимой защитной группы для того, чтобы образовалась свободная аминогруппа;
(5) повторение стадий (3) и (4) несколько раз; и
(6) расщепление сложноэфирной связи, образовавшейся на стадии (1), с помощью кислоты.
Кроме того, согласно указанному выше способу получения гликопротеина, имеющего однородную аминокислотную последовательность и сахаридную цепочку, предпочтительно,
чтобы часть гликопротеина, имеющего однородные аминокислотную последовательность и сахаридную цепочку, получалась на стадиях (1) - (6), причем гликопротеин получался по способу, который дополнительно включает следующую стадию (7):
(7) связывание части гликопротеина, полученного на стадии (6), с другими пептидами или гликопептидами с использованием метода лигирования.
Преимущества изобретения
Согласно способу получения гликопротеина настоящего изобретения может быть произведен гликопротеин, имеющий не только однородные аминокислотную последовательность и структуру сахаридной цепочки, но также однородную структуру высшего порядка. Таким образом, может быть получен гликопротеин, демонстрирующий однородную заданную физиологическую активность, в дополнение к постоянному времени полужизни в крови и внутриклеточному транспорту.
Кроме того, согласно способу тестирования гликопротеина настоящего изобретения, может быть выбран гликопротеин, демонстрирующий однородную заданную физиологическую активность, среди группы гликопротеинов, демонстрирующих различную физиологическую активность из-за различия структур высшего порядка. Поскольку этот гликопротеин имеет однородную структуру сахаридной цепочки, он также имеет однородную функцию, связанную с сахаридной цепочкой, такую как время полужизни в крови и внутриклеточный транспорт.
Кроме того, согласно настоящему изобретению можно регулировать состав смеси гликопротеинов с целью достижения желательной активности.
Описанные выше преимущества настоящего изобретения являются особенно выгодными, когда гликопротеин используется в качестве фармацевтического продукта.
Краткое описание чертежей
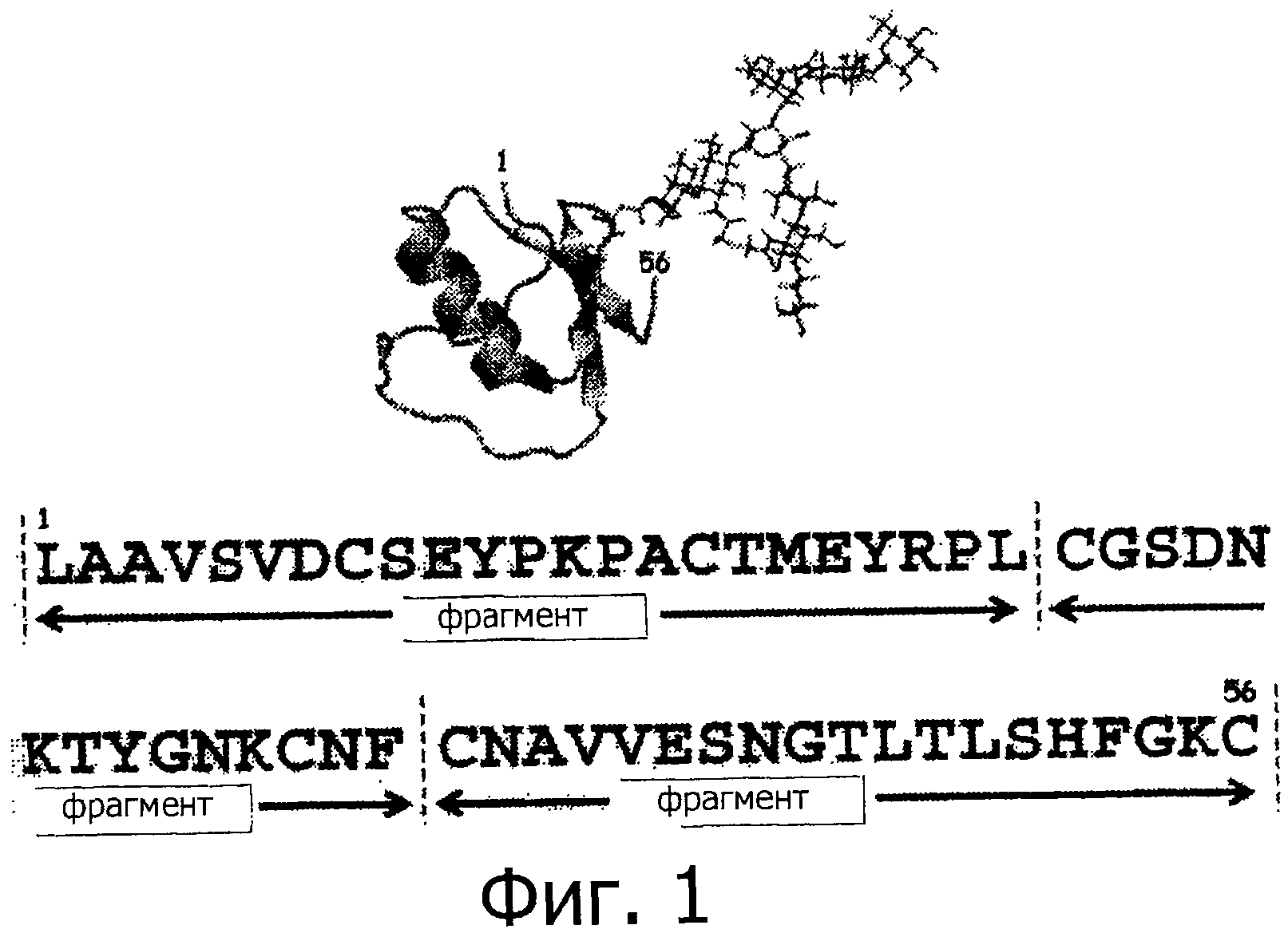
На фигуре 1 показан третий домен овомукоида серебряного фазана (OMSVP3) и аминокислотные последовательности фрагментов 1-3, которые используются для химического синтеза OMSVP3.
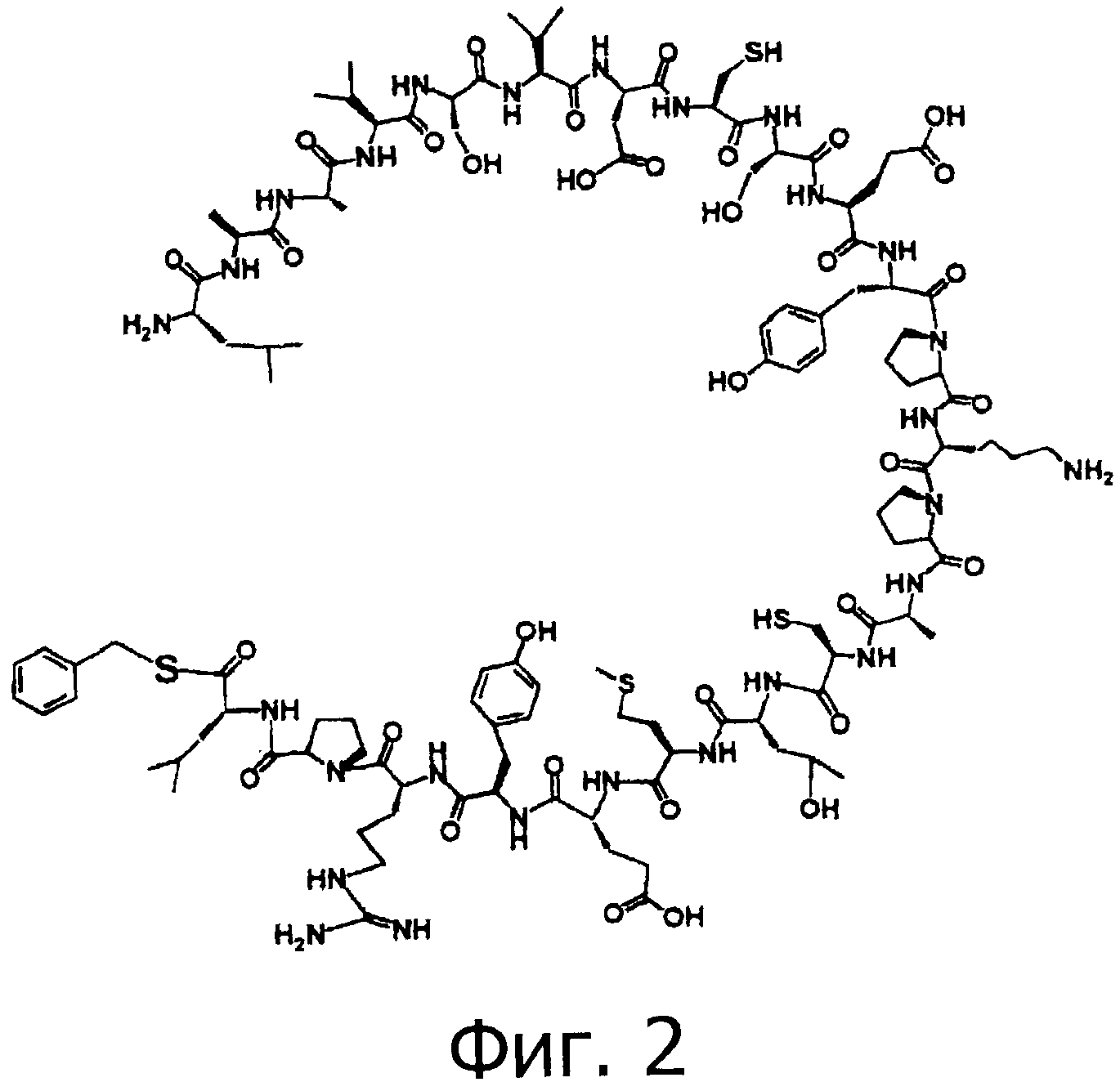
На фигуре 2 показан фрагмент 1 (тиоэтерифицированный), который используется для химического синтеза OMSVP3.
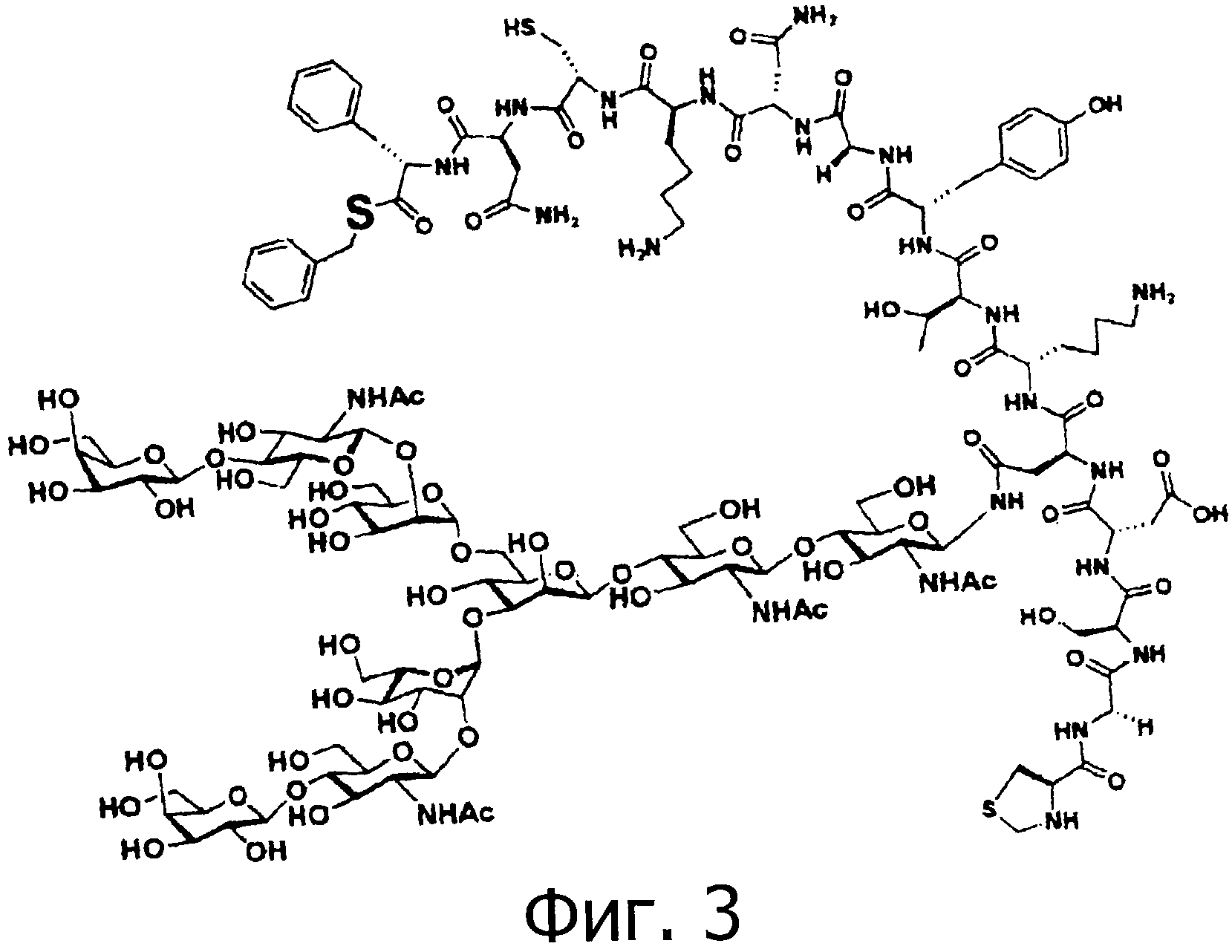
На фигуре 3 показан фрагмент 2 (тиоэтерифицированный), который используется для химического синтеза гликозилированного OMSVP3.
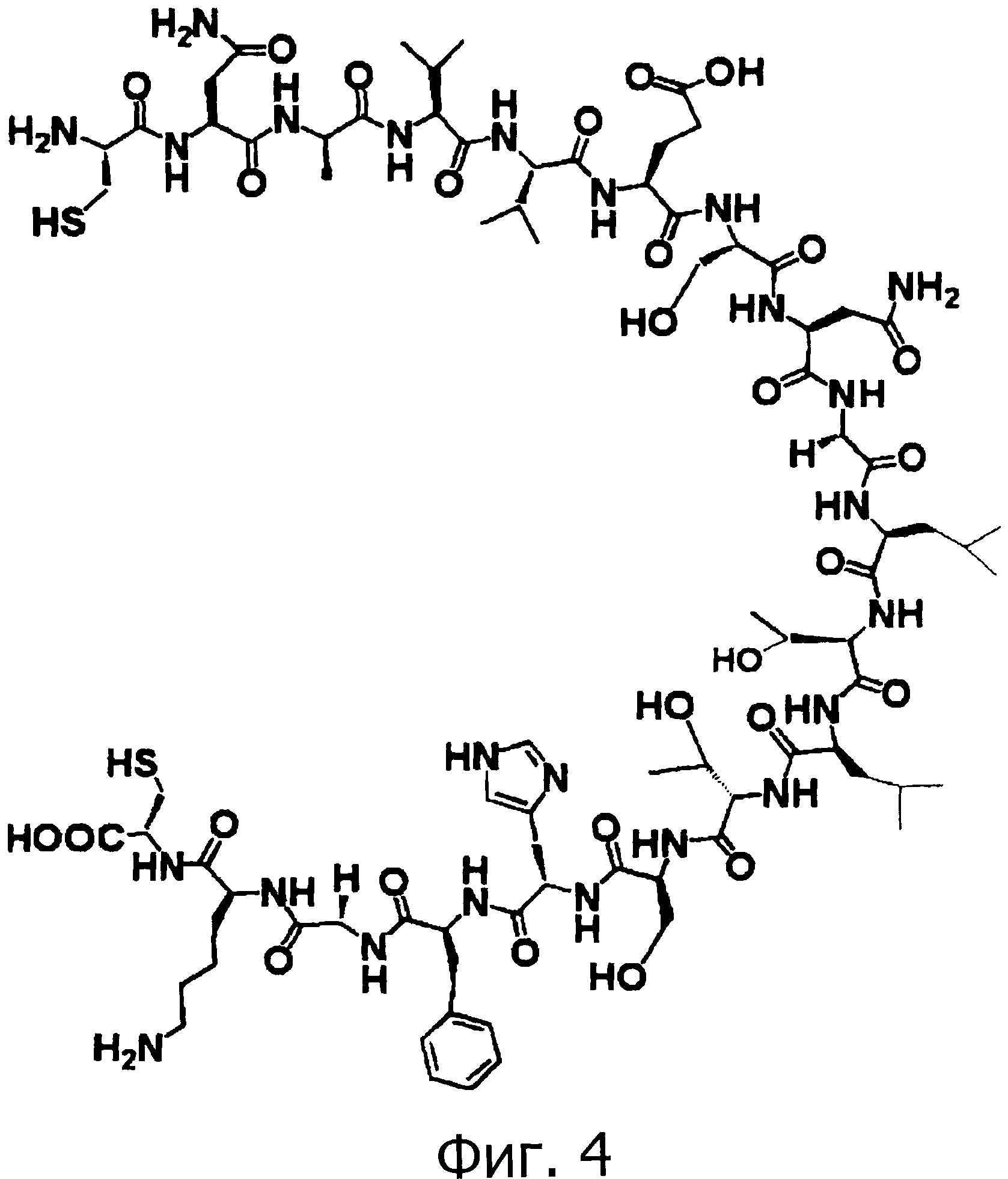
На фигуре 4 показан фрагмент 3, который используется для химического синтеза OMSVP3.
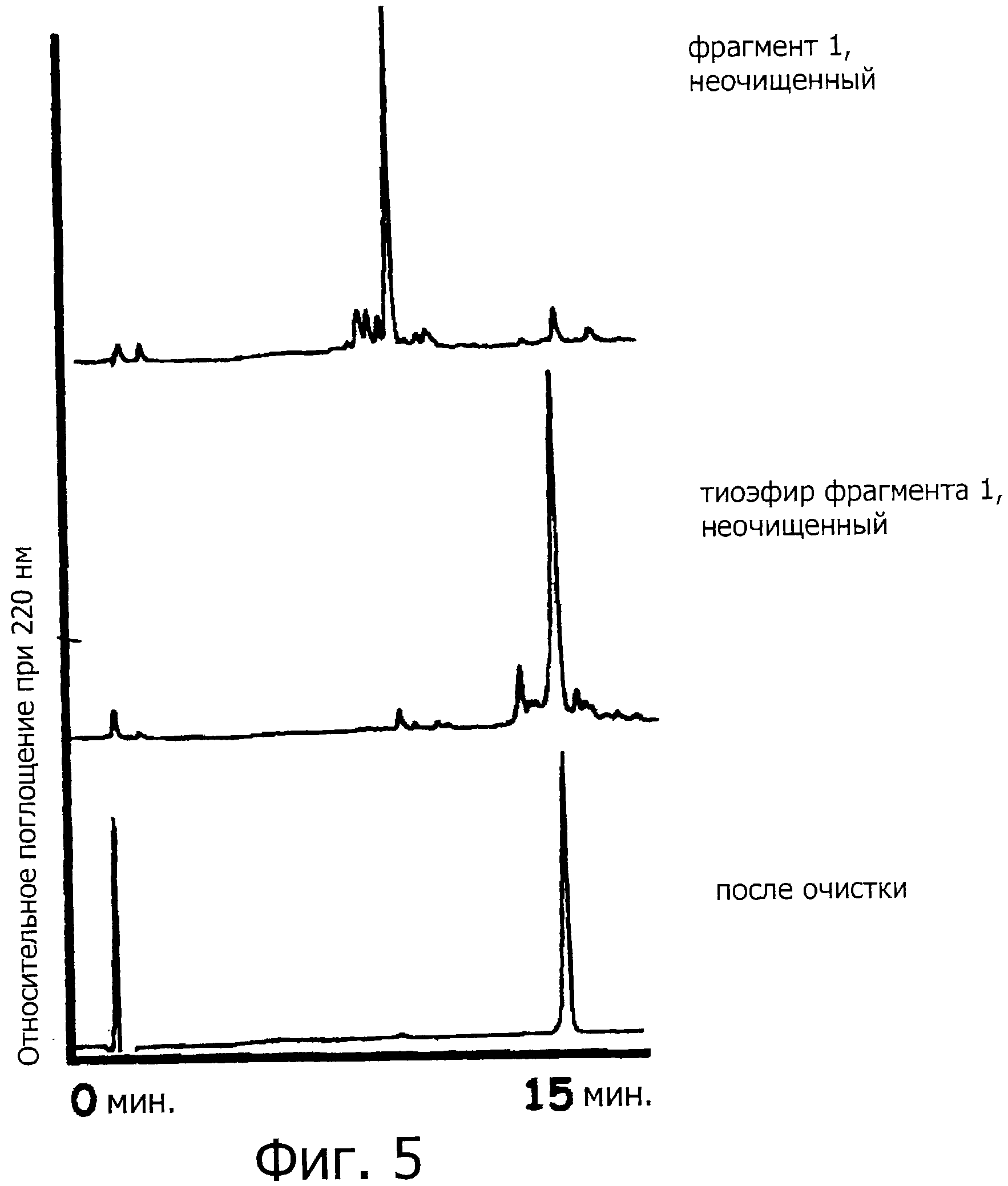
Фигура 5 представляет собой хроматограмму (детектор с длиной волны 220 нм) на каждой стадии синтеза фрагмента 1.
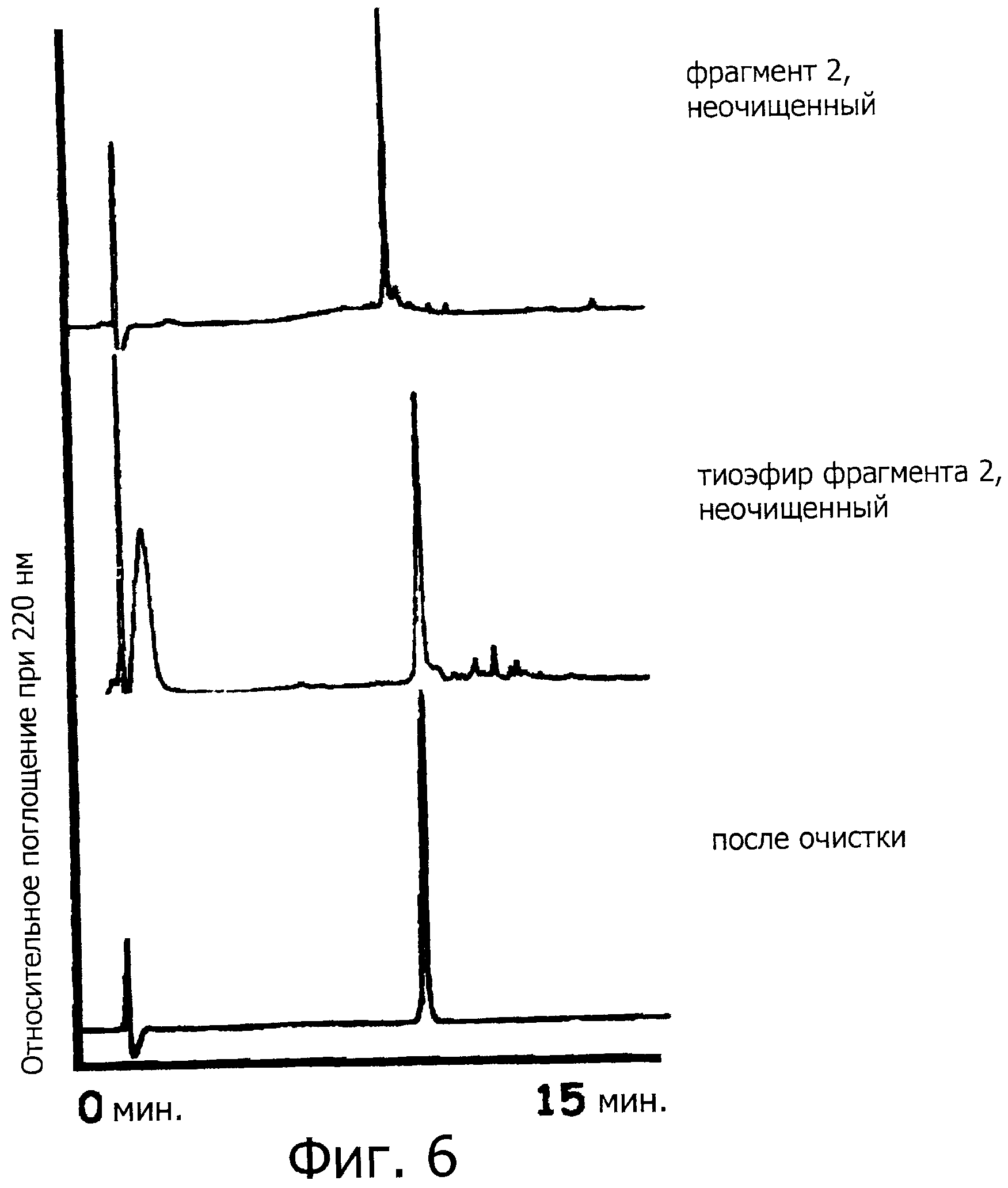
Фигура 6 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии синтеза фрагмента 2.
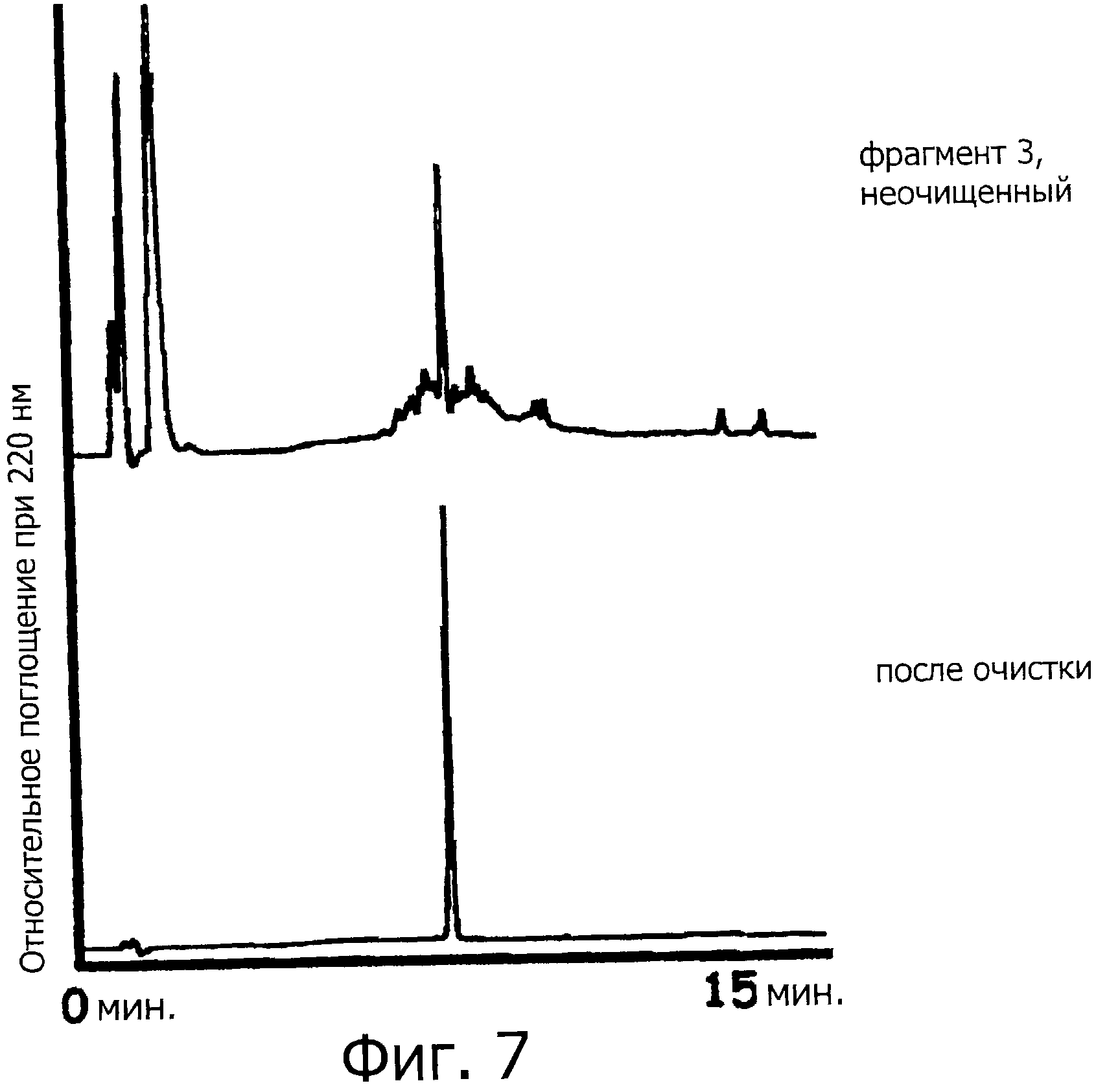
Фигура 7 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии синтеза фрагмента 3.
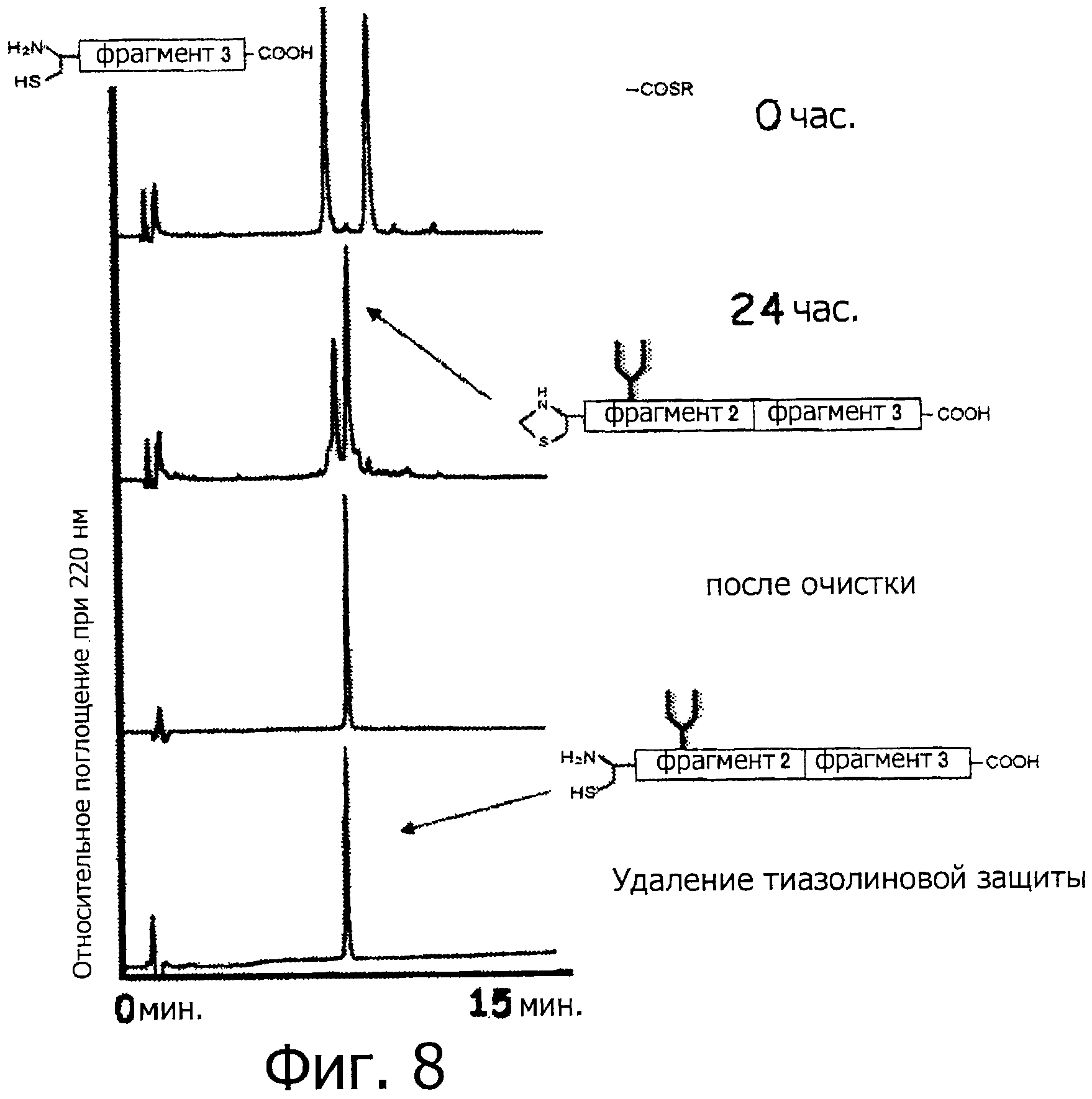
Фигура 8 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии связывания фрагментов 2 и 3 с использованием NCL.
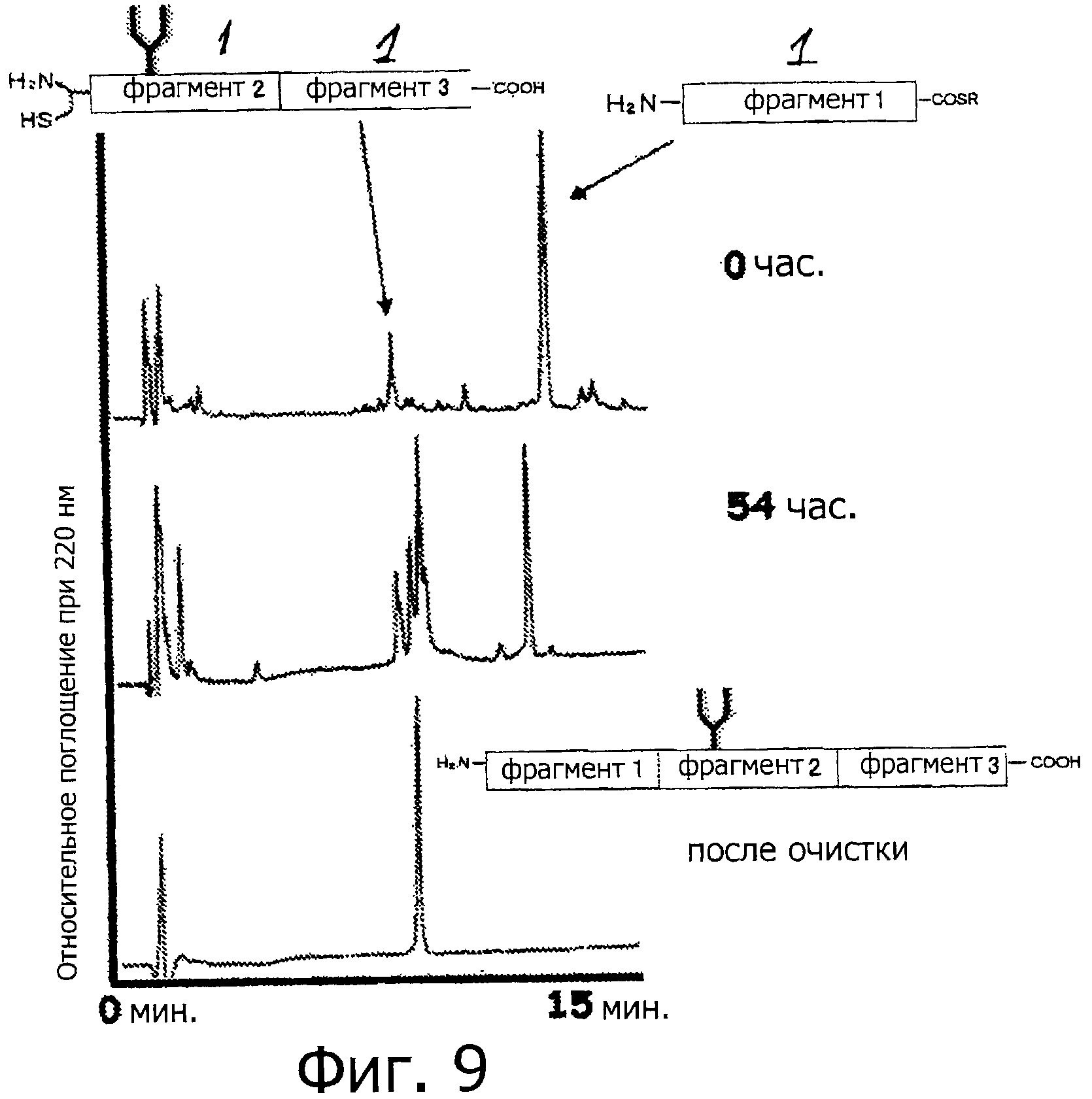
Фигура 9 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии связывания фрагментов 2 и 3 и фрагмента 1 с помощью NCL.
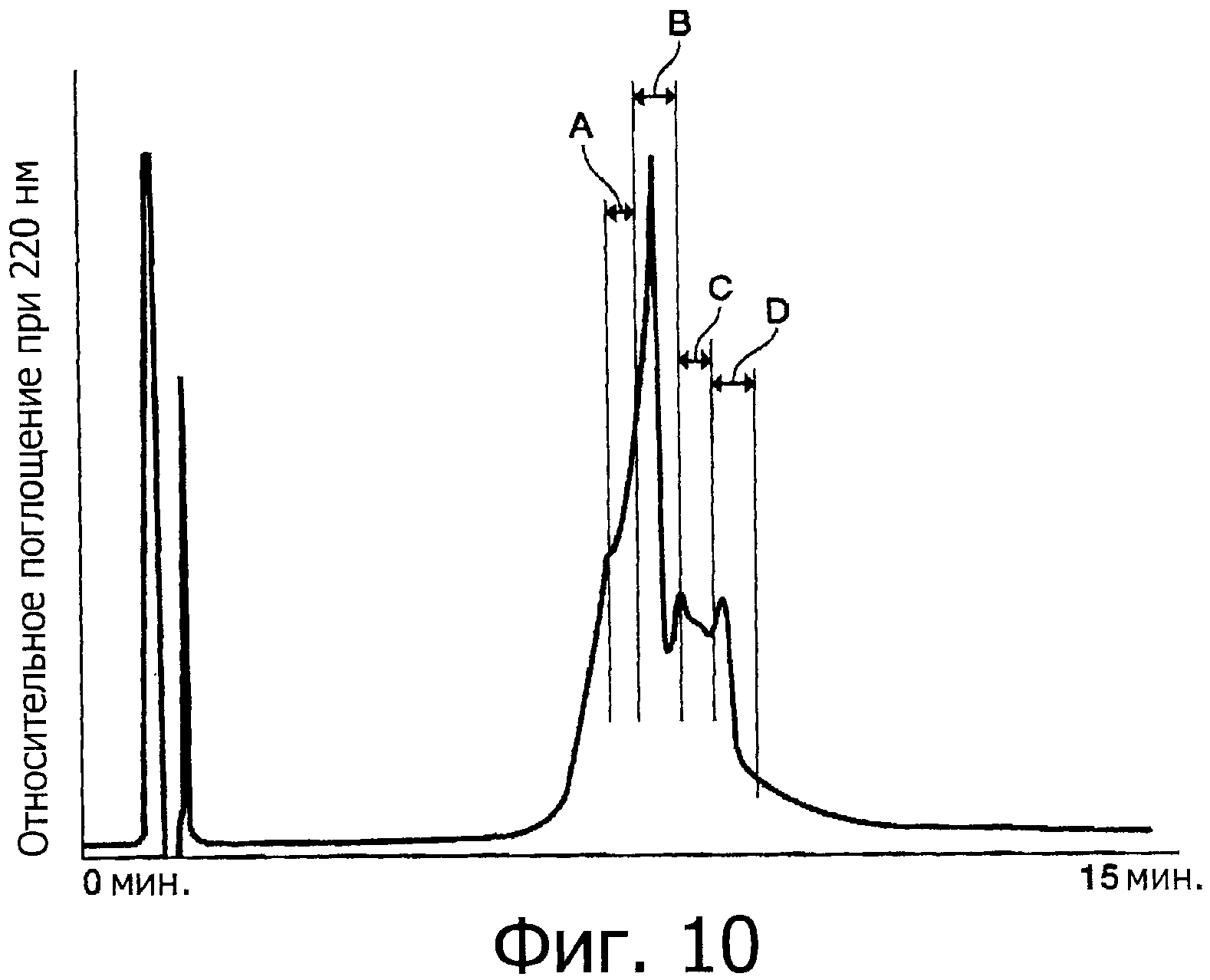
Фигура 10 представляет собой хроматограмму (при длине волны 220 нм) при выделении уложенного гликозилированного OMSVP3 методом высокоэффективной жидкостной хроматографии (ВЭЖХ).
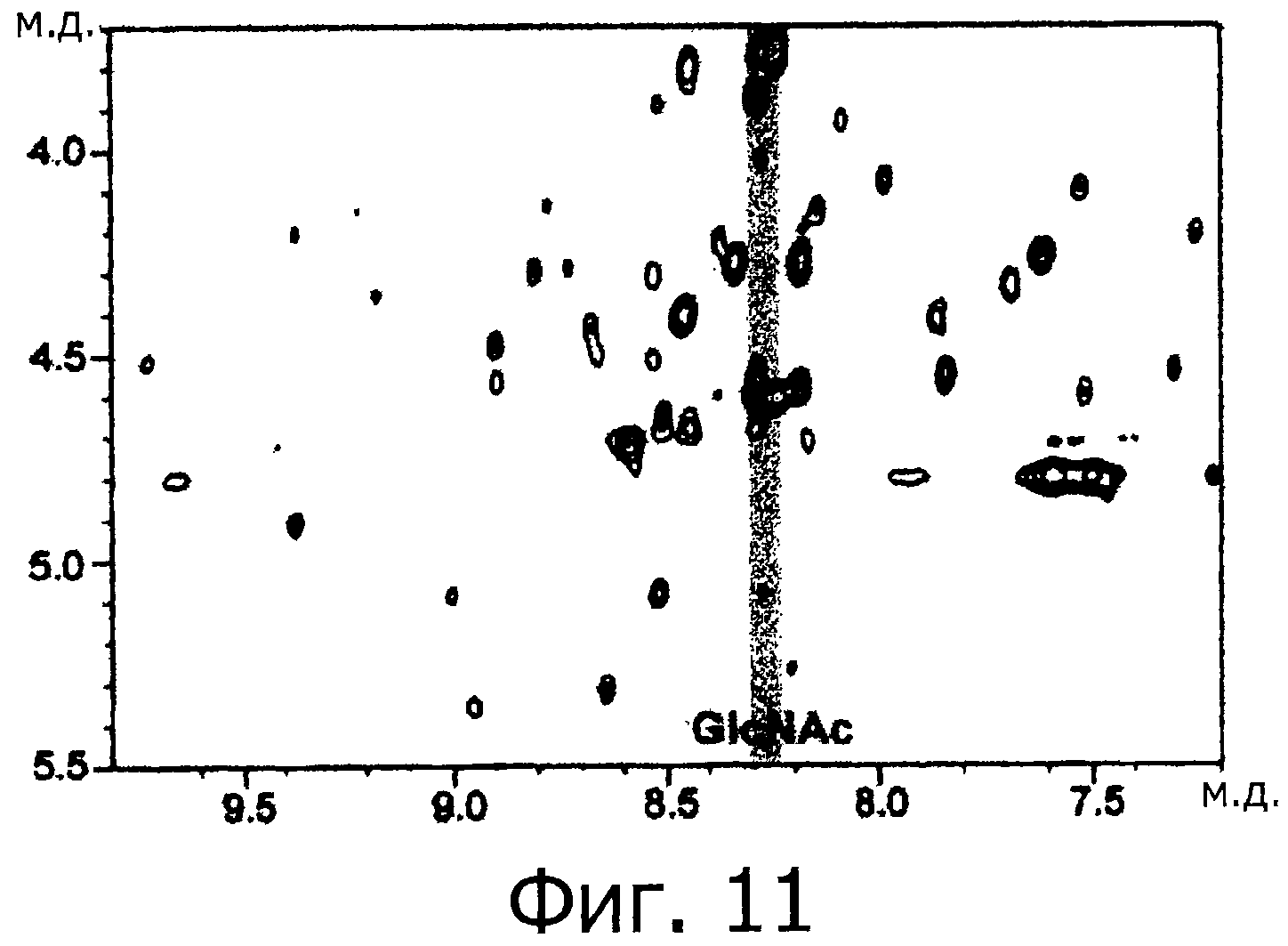
Фигура 11 представляет собой ЯМР - спектр для фракции В на фигуре 10.
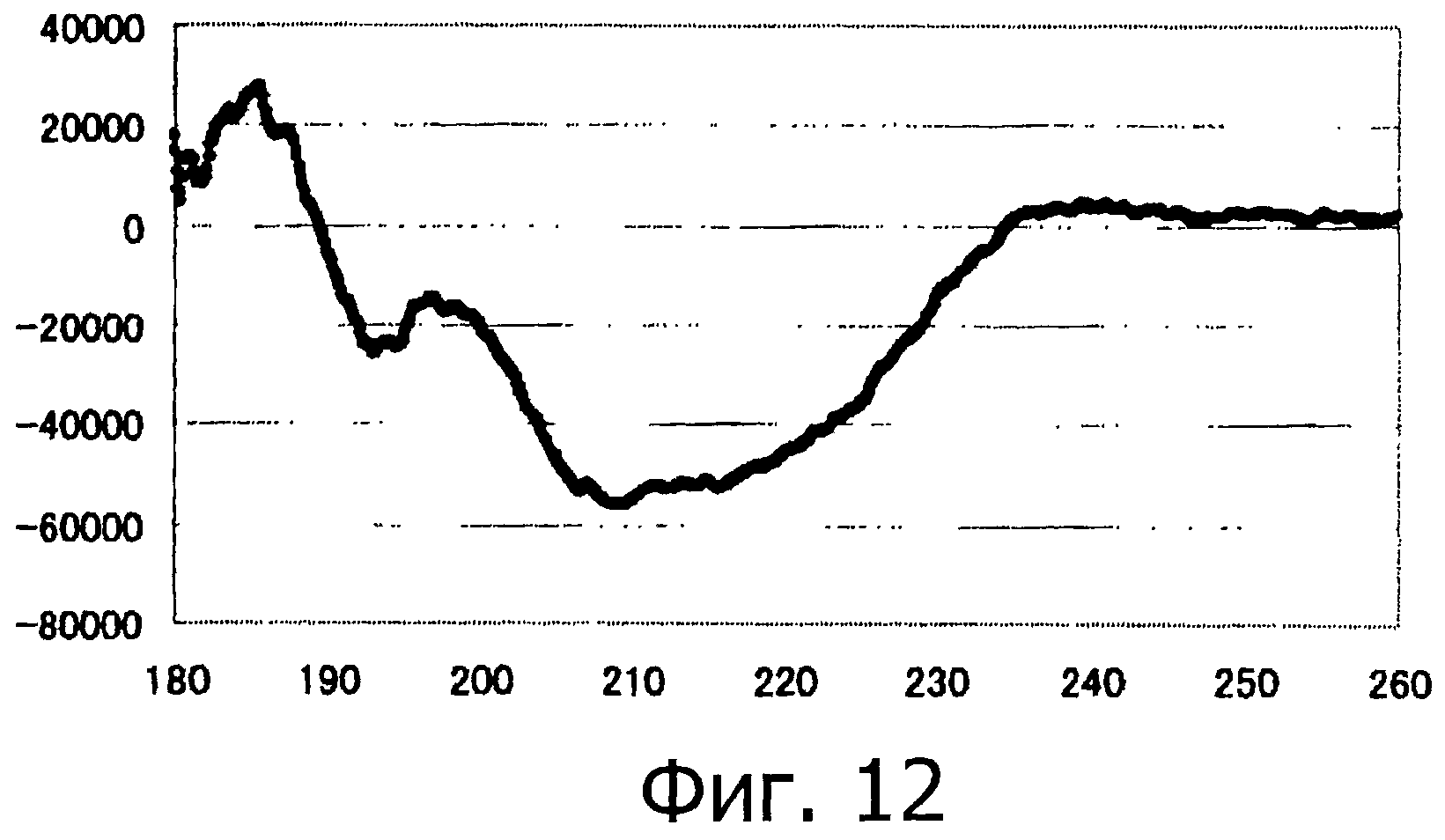
Фигура 12 представляет собой спектр кругового дихроизма (КД) для фракции В на фигуре 10.
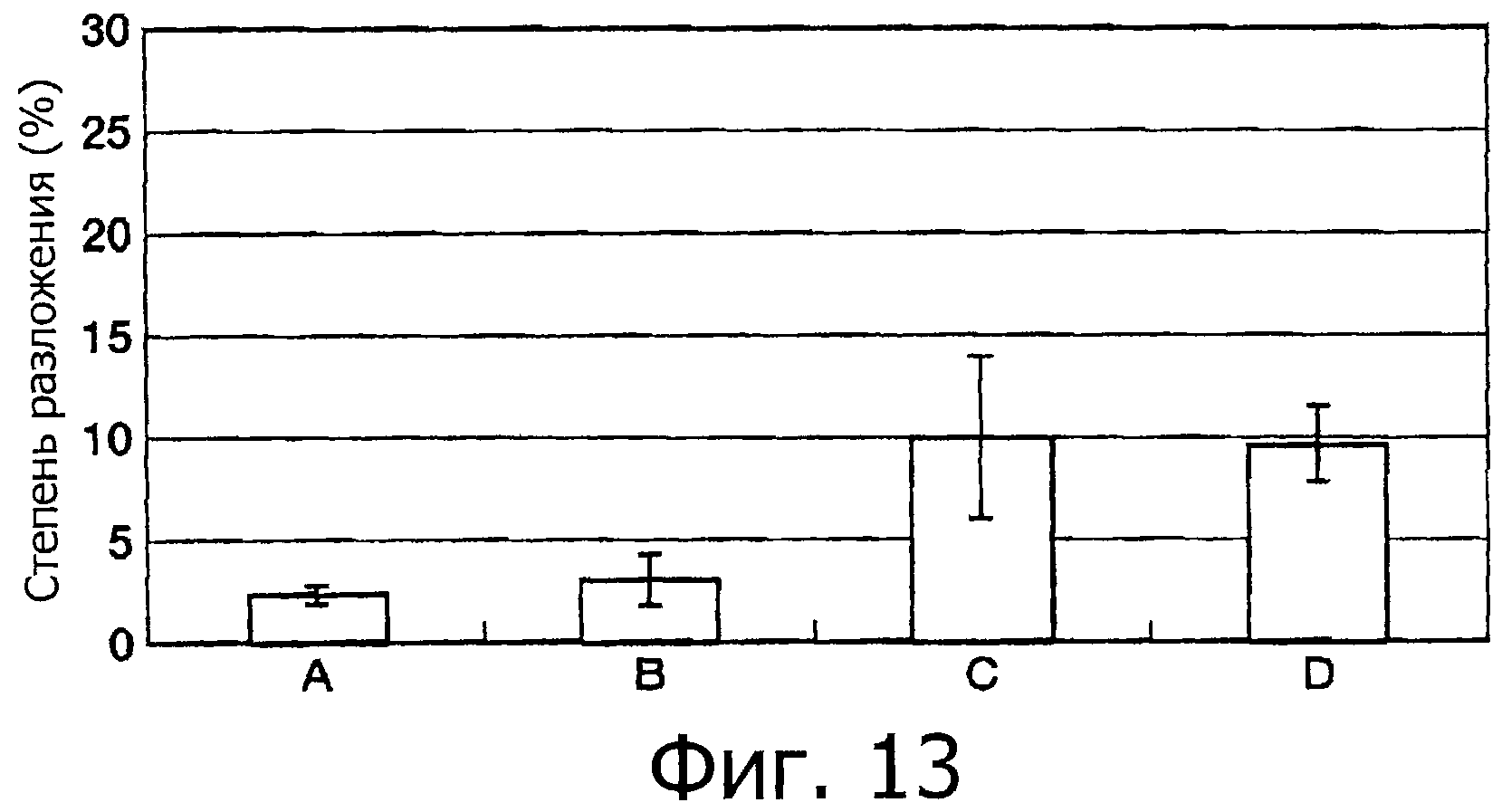
На фигуре 13 показаны результаты измерения ингибирующей активности каждой фракции на фигуре 10 против химотрипсина.
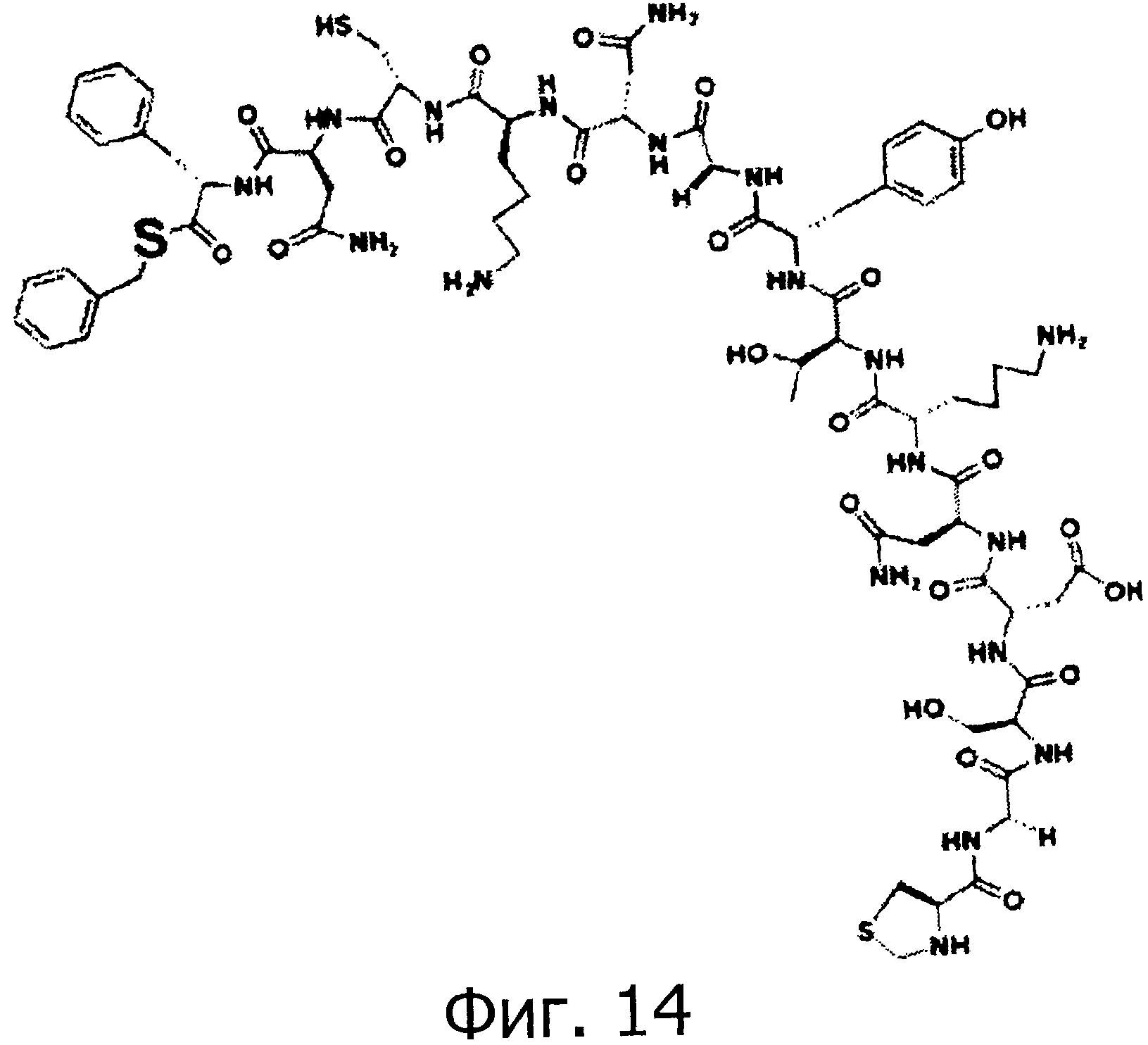
На фигуре 14 показан фрагмент 2' (тиоэтерифицированный), который используются для химического синтеза не-гликозилированного OMSVP3.
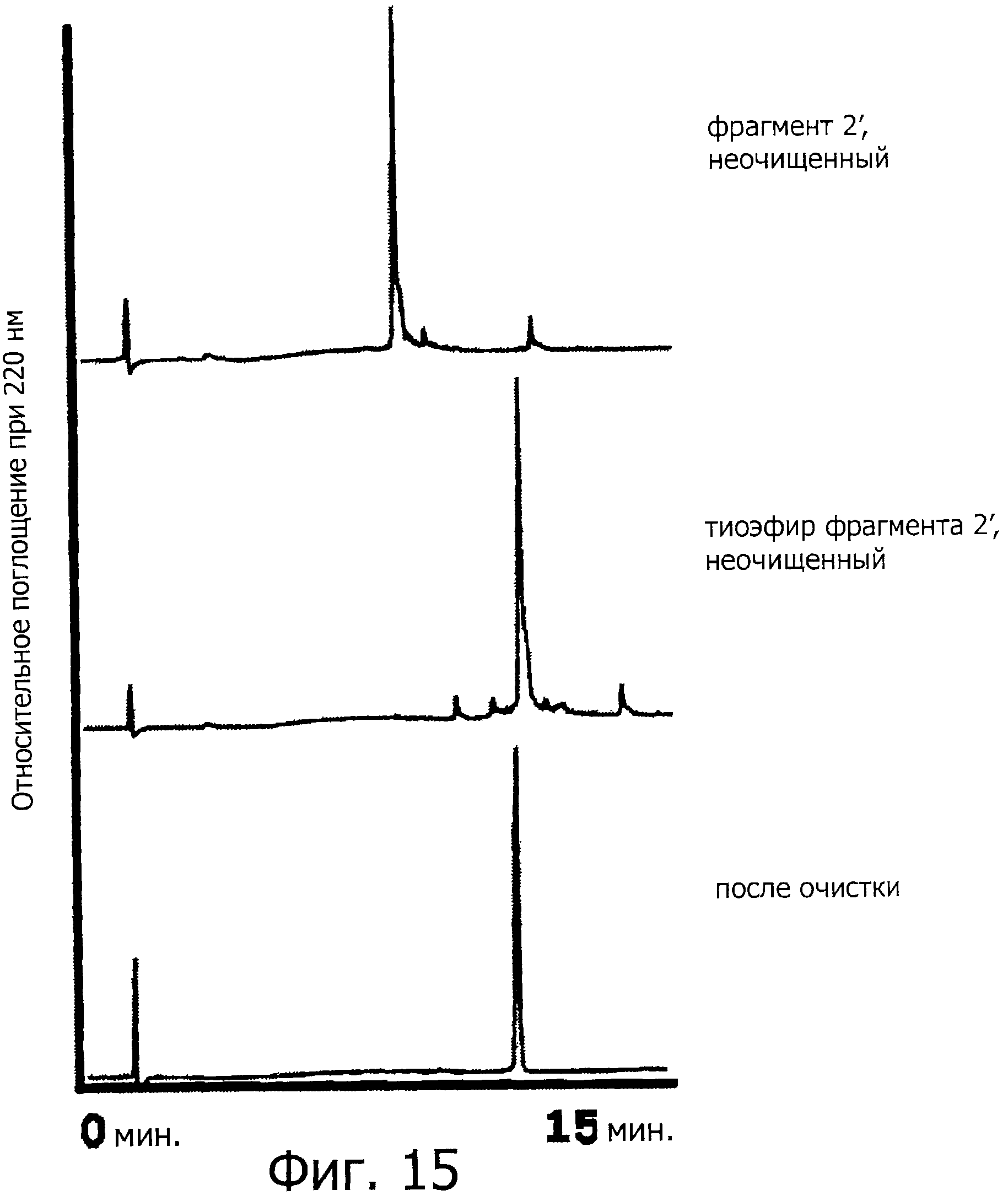
Фигура 15 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии синтеза фрагмента 2'.
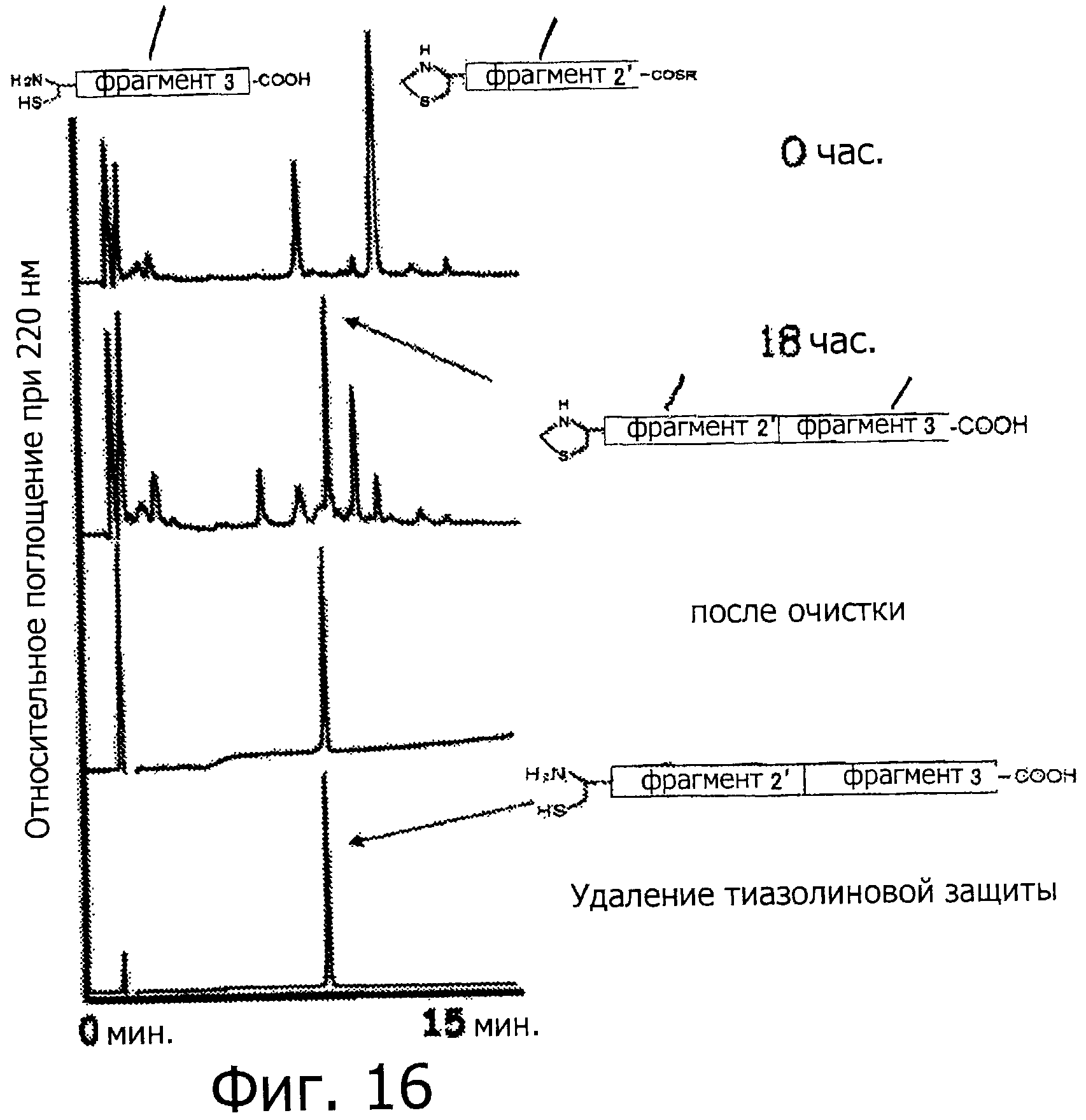
Фигура 16 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии связывания фрагмента 2' и фрагмента 3 с использованием NCL.
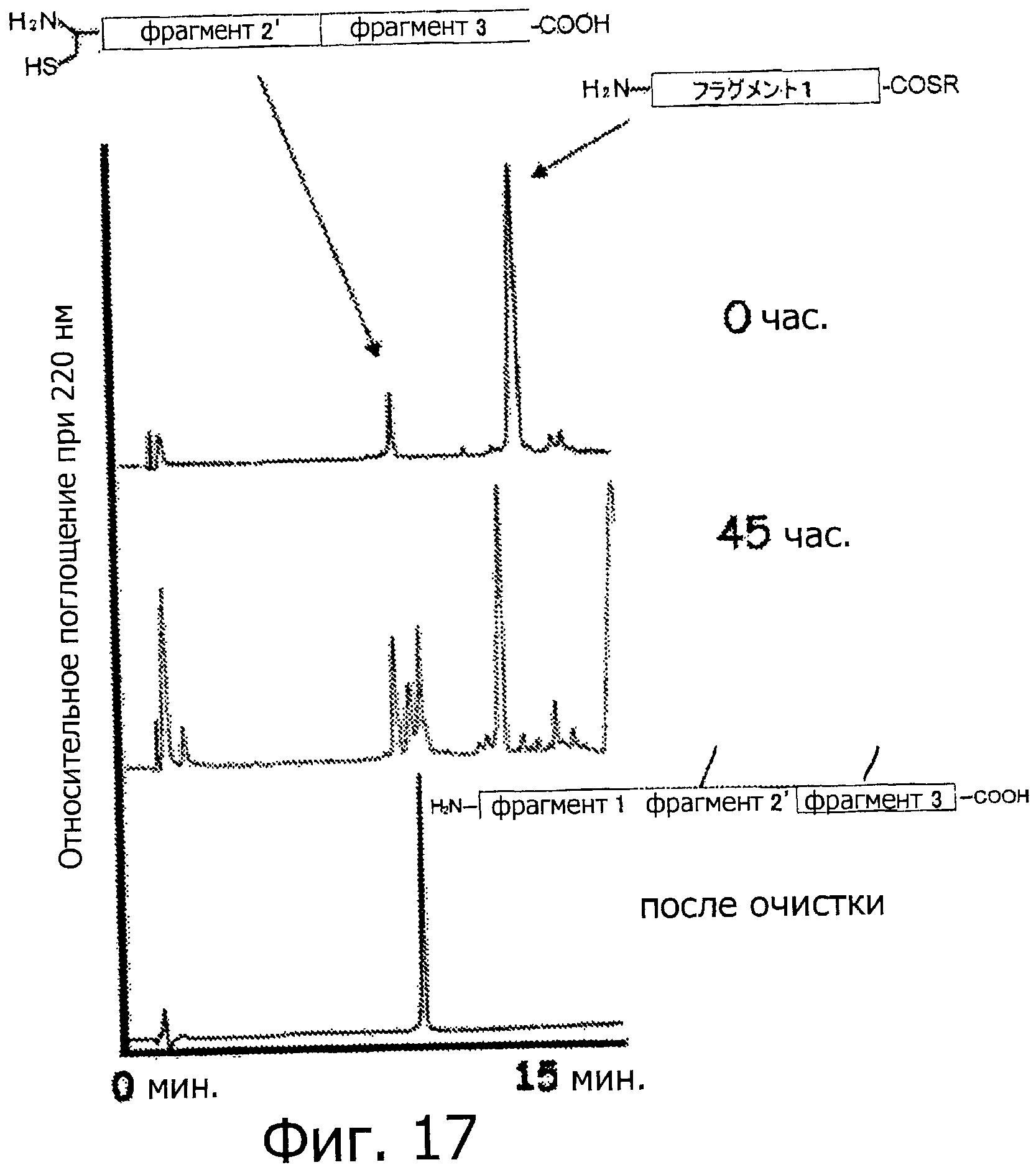
Фигура 17 представляет собой хроматограмму (при длине волны 220 нм) на каждой стадии связывания фрагментов 2' и 3 и фрагмента 1 с использованием NCL.
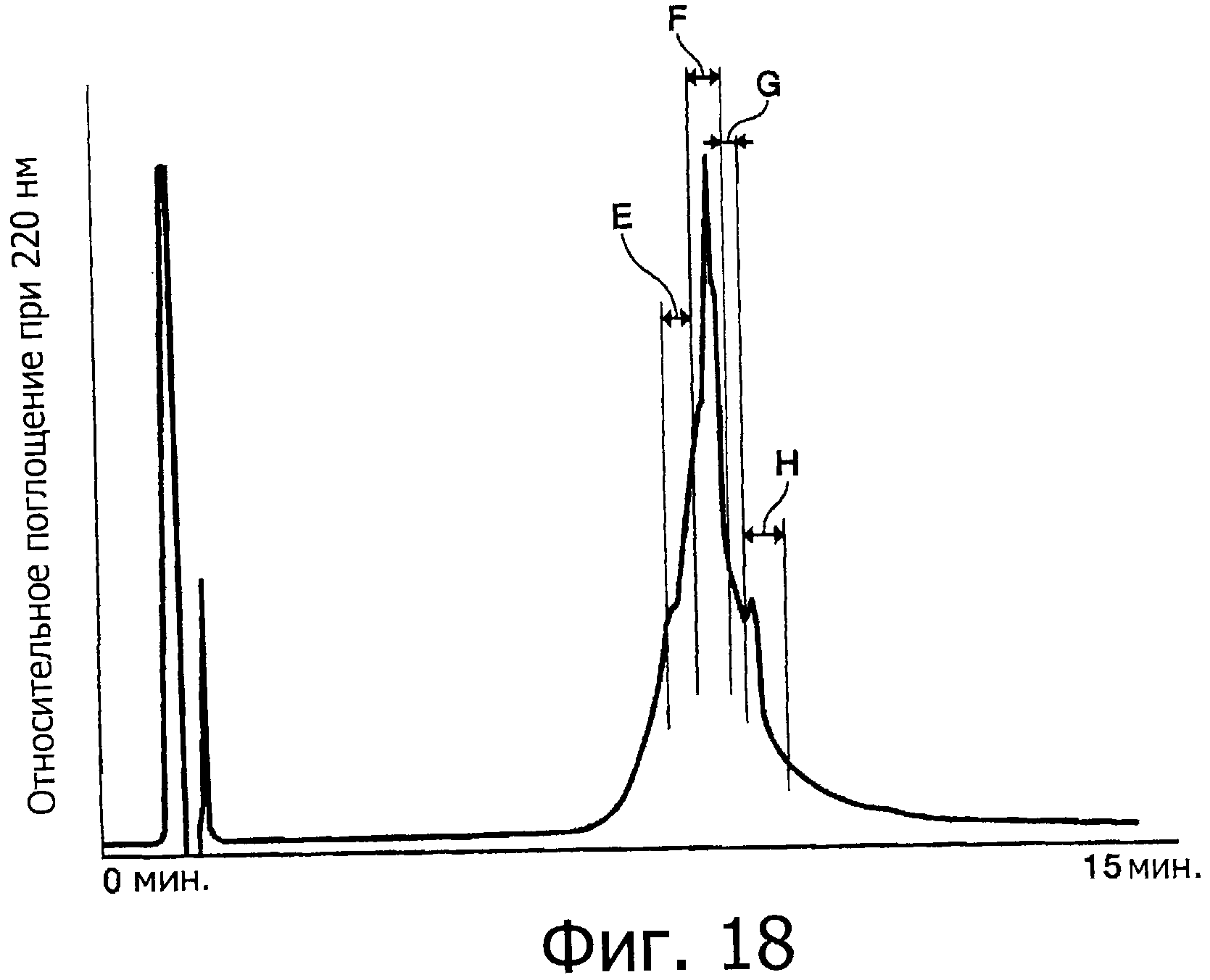
Фигура 18 представляет собой хроматограмму (при длине волны 220 нм) при выделении уложенного негликозилированного OMSVP3 методом ВЭЖХ.
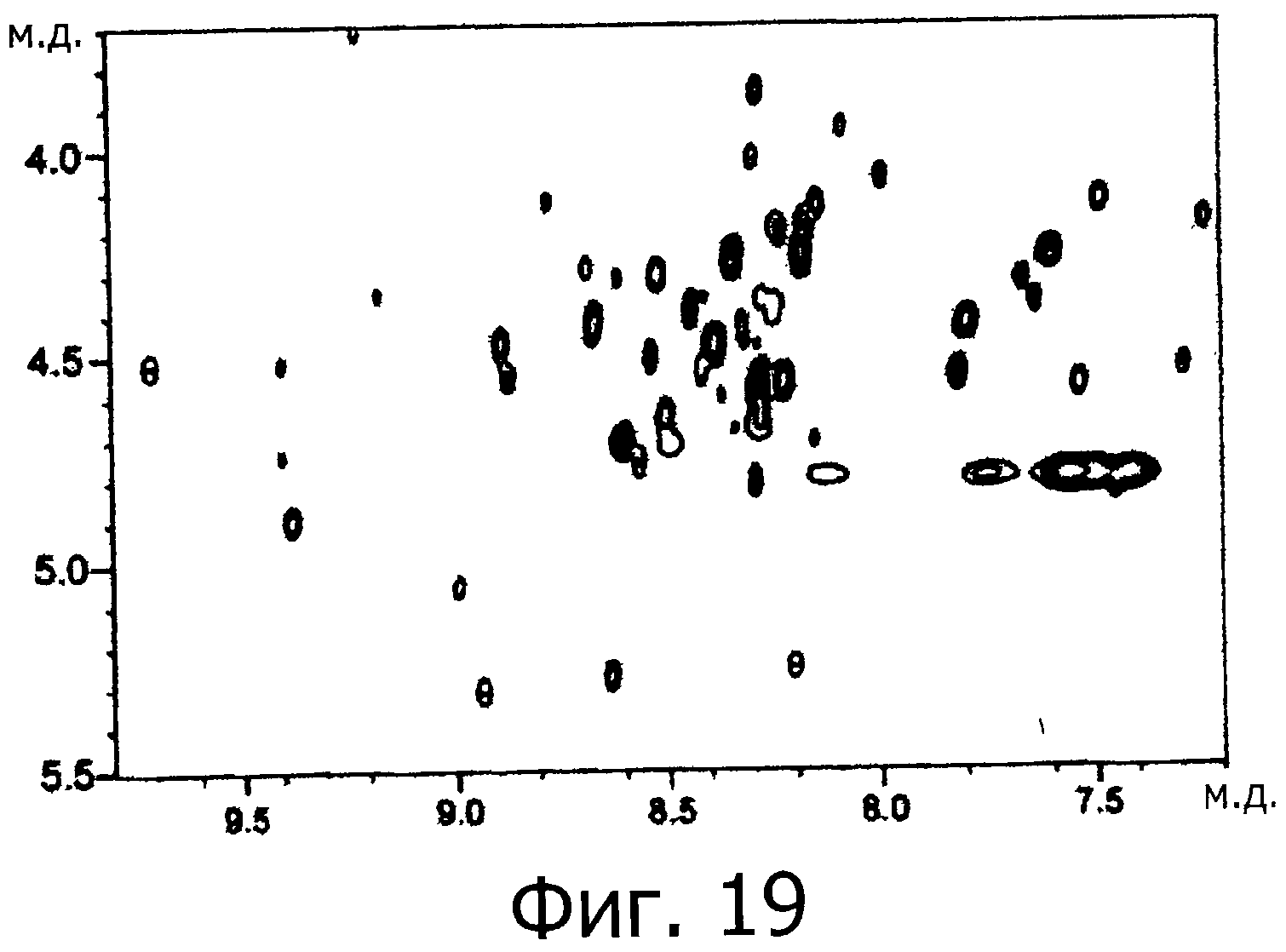
Фигура 19 представляет собой ЯМР-спектр для фракции F на фигуре 18.
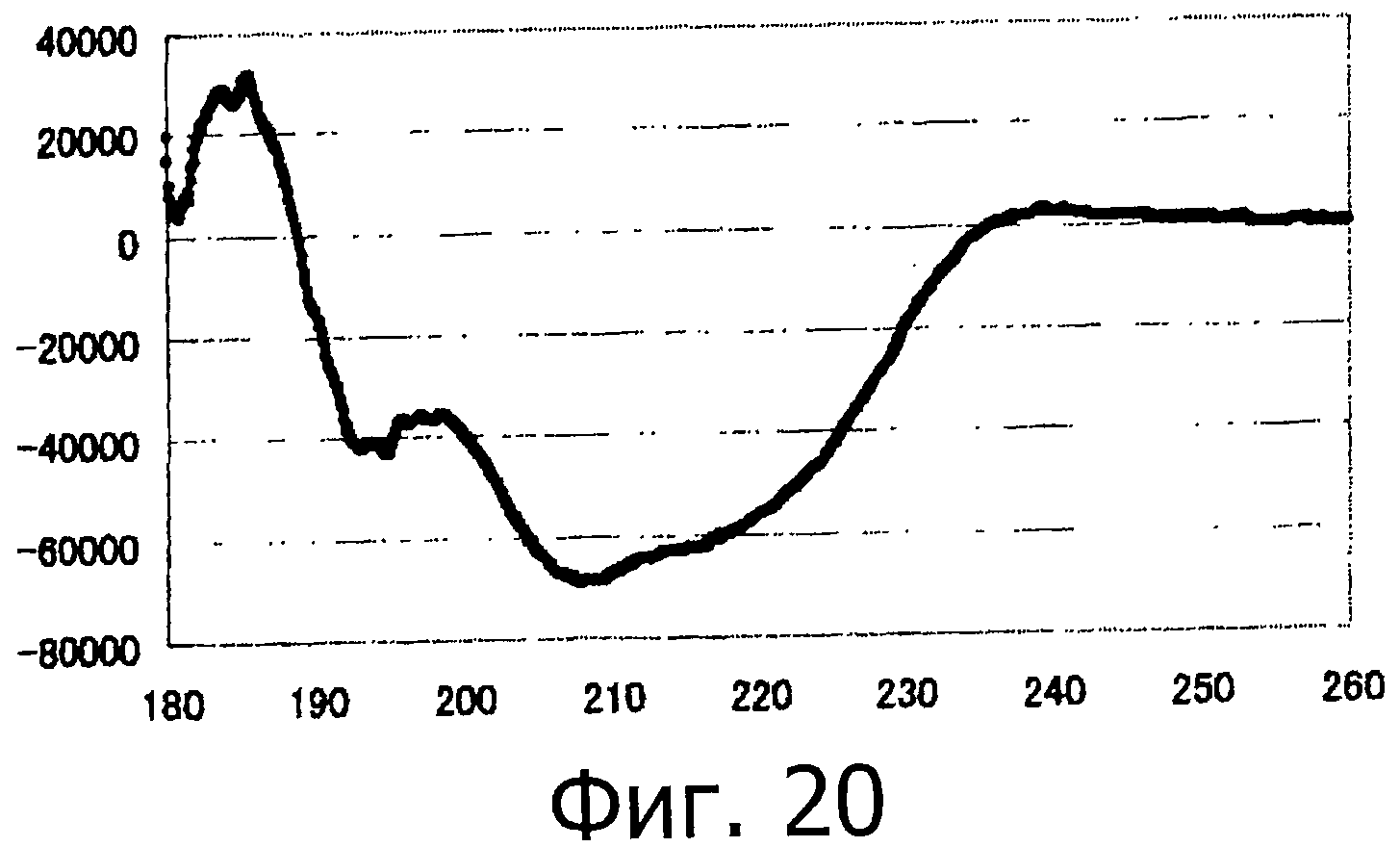
Фигура 20 представляет собой спектр КД для фракции F на фигуре 18.
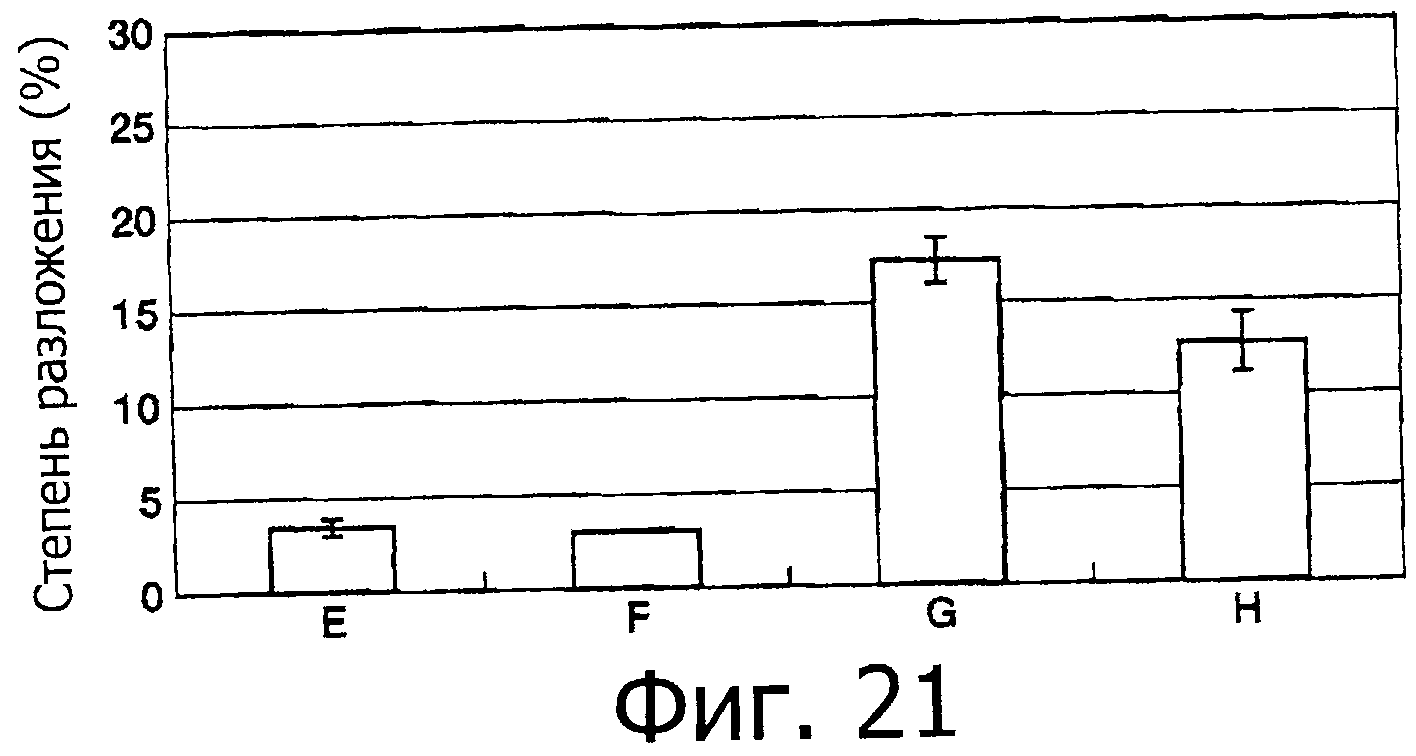
На фигуре 21 показаны результаты измерения ингибирующей активности каждой фракции на фигуре 18 относительно химотрипсина.
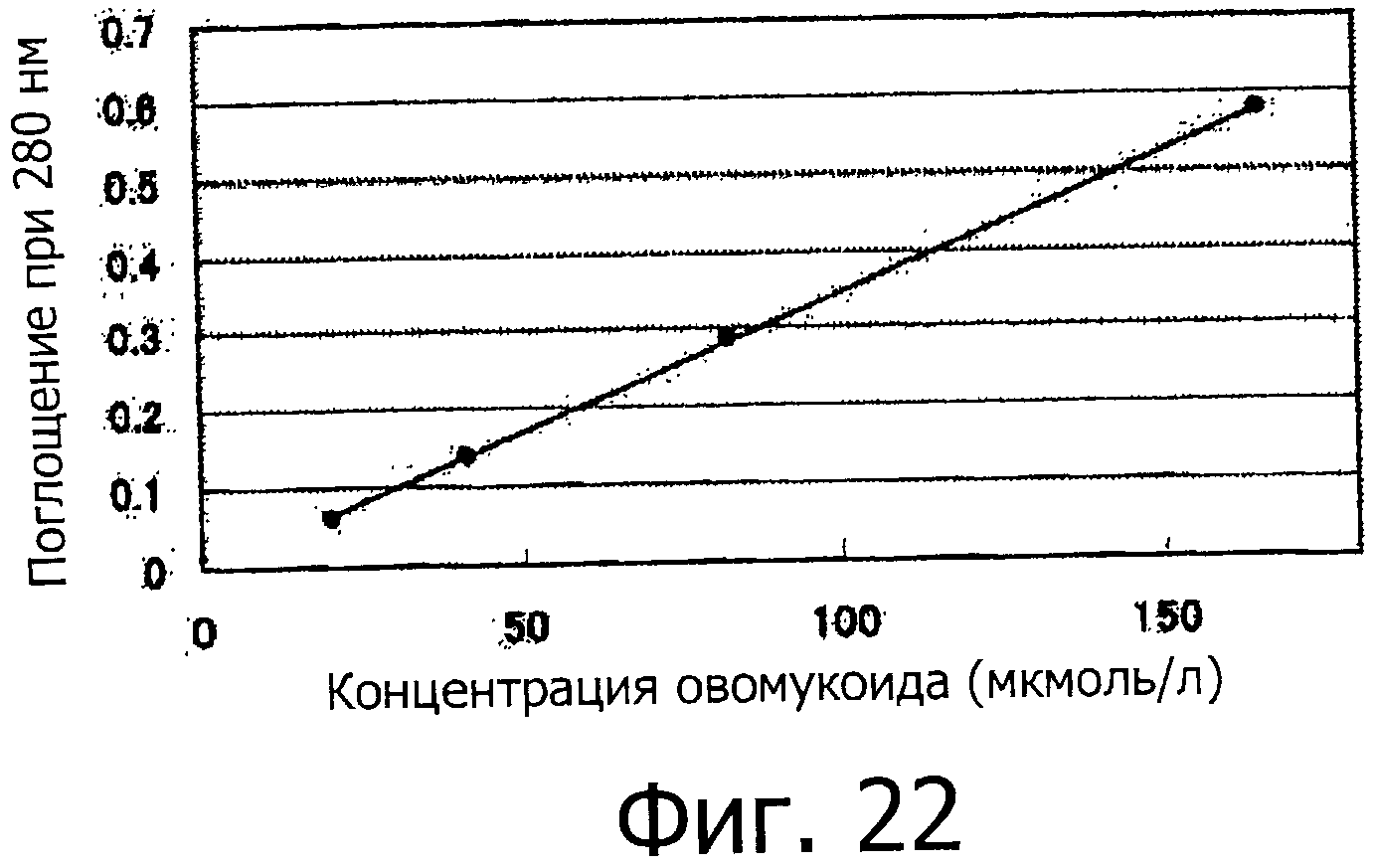
На фигуре 22 показана калибровочная кривая для фракции F.
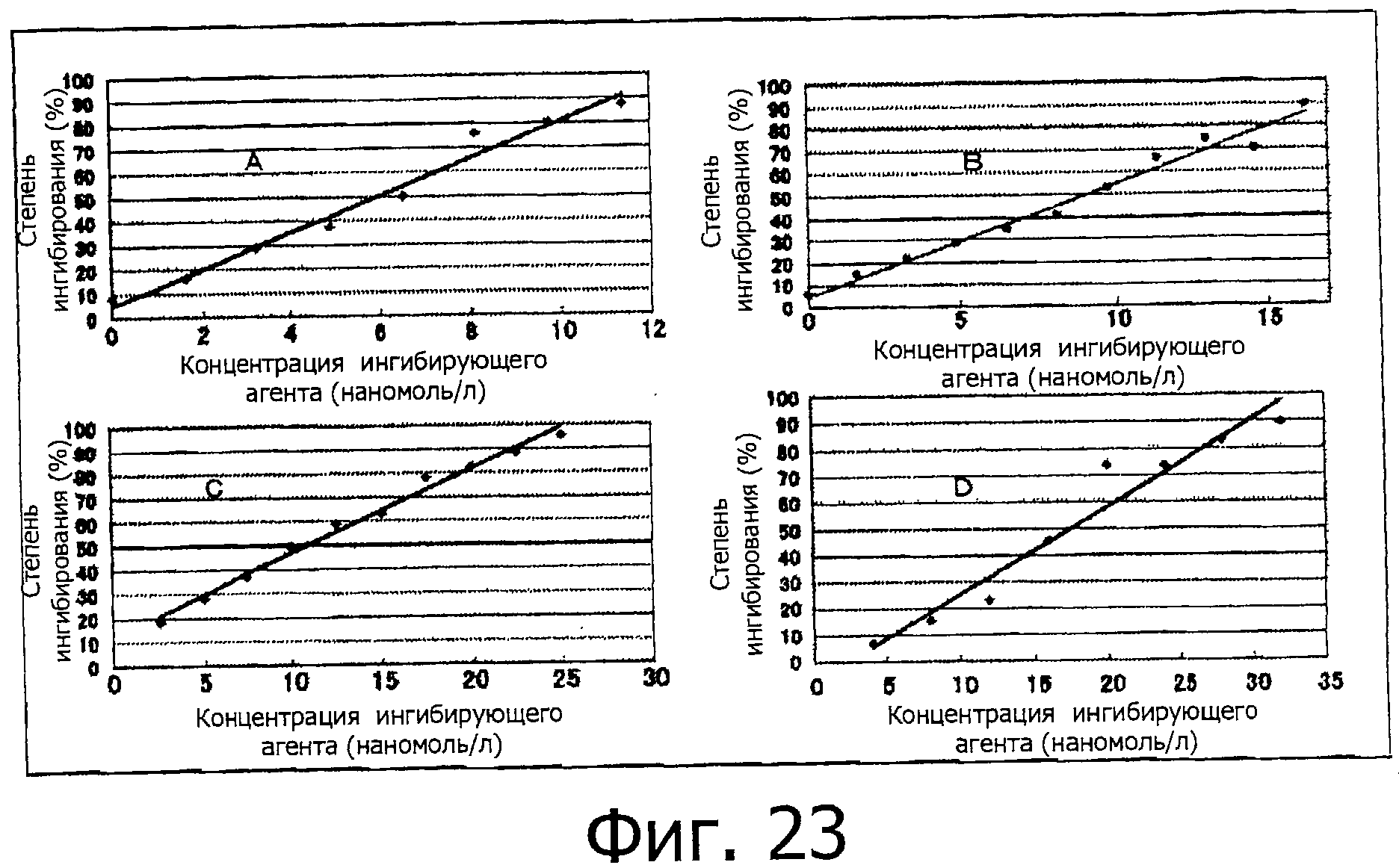
На фигуре 23 показана степень ингибирования для фракций A-D относительно химотрипсина.
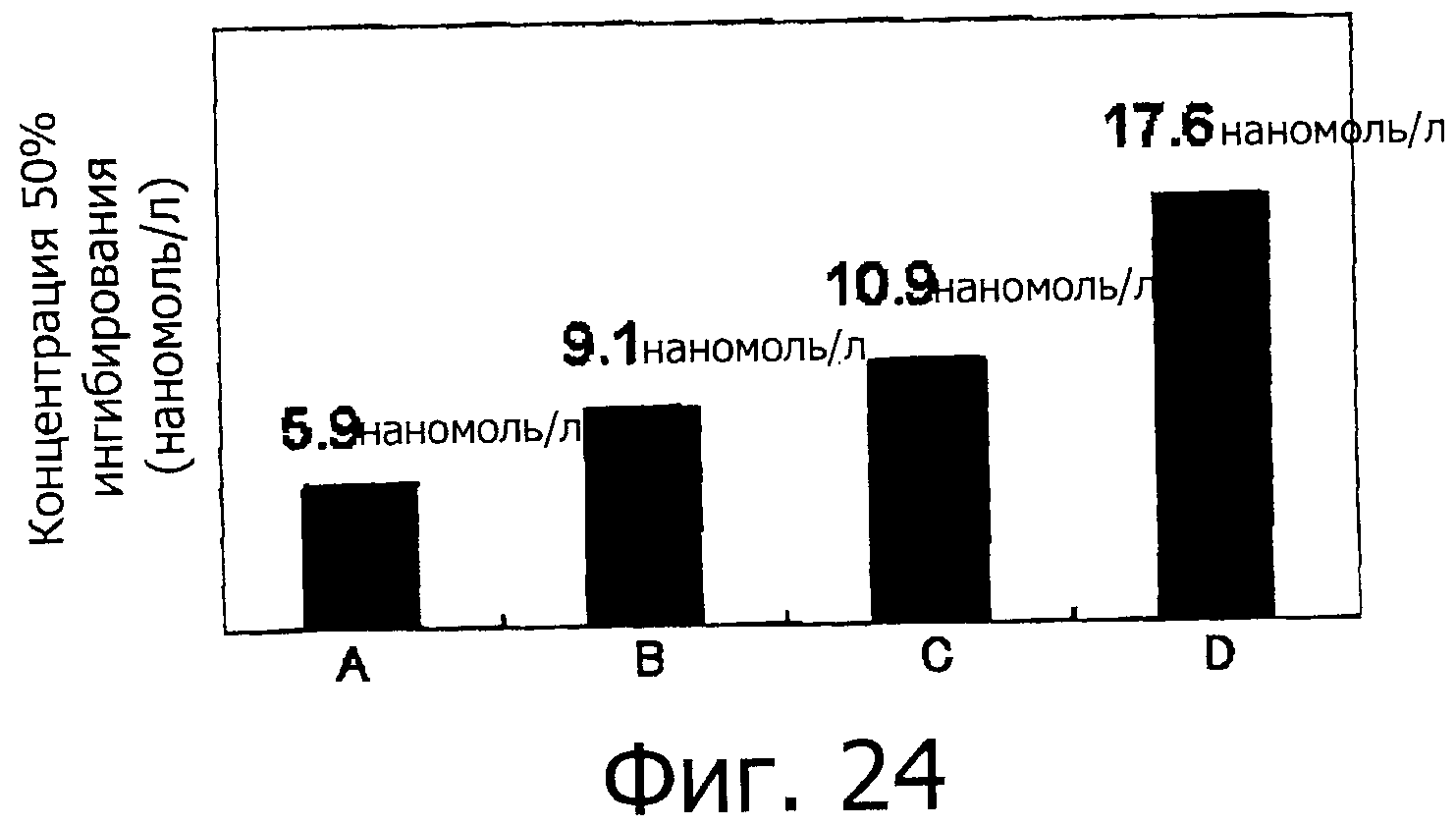
На фигуре 24 показаны значения концентрации 50% ингибирования для фракций A-D.
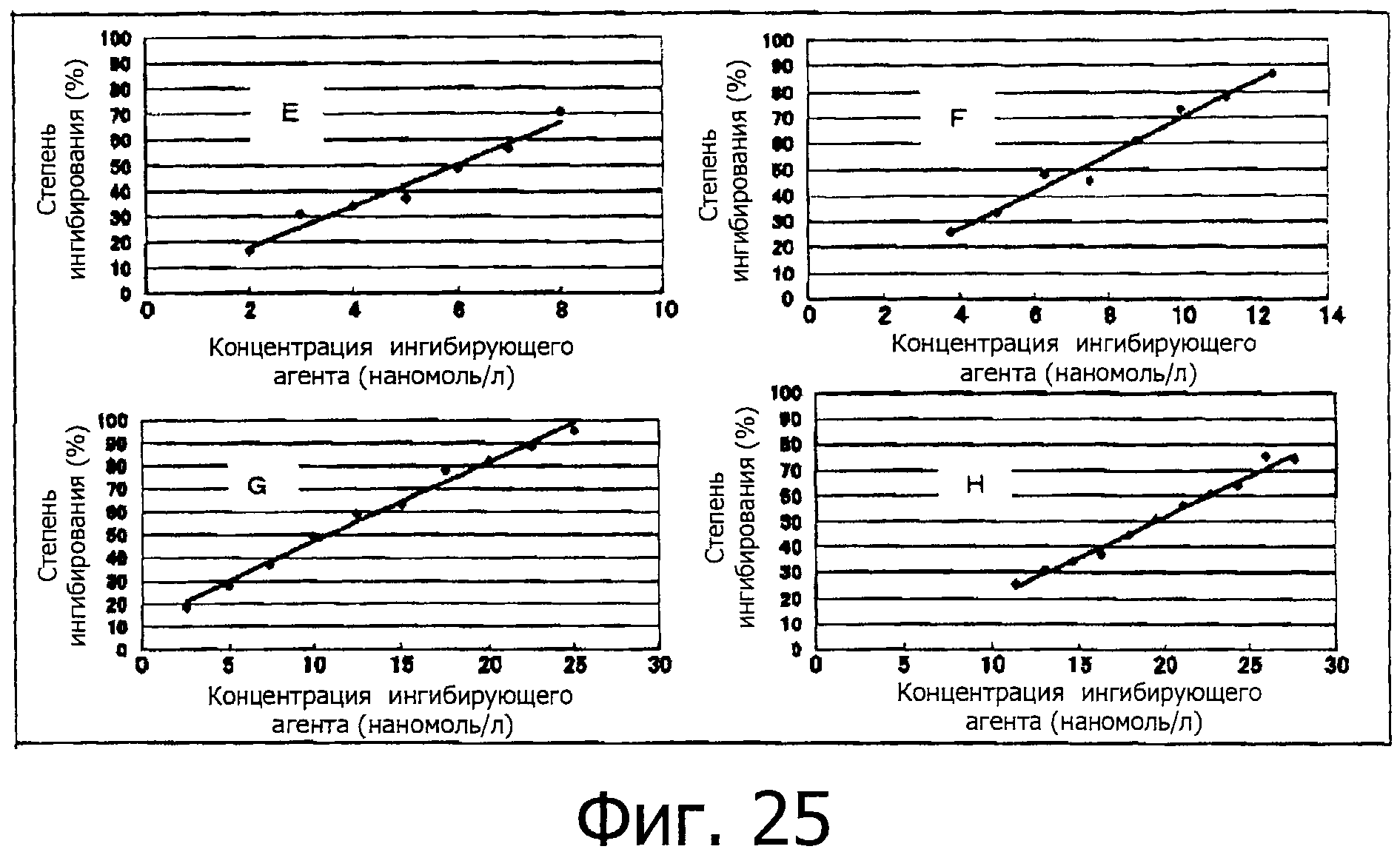
На фигуре 25 показана степень ингибирования для фракций Е-Н относительно химотрипсина.
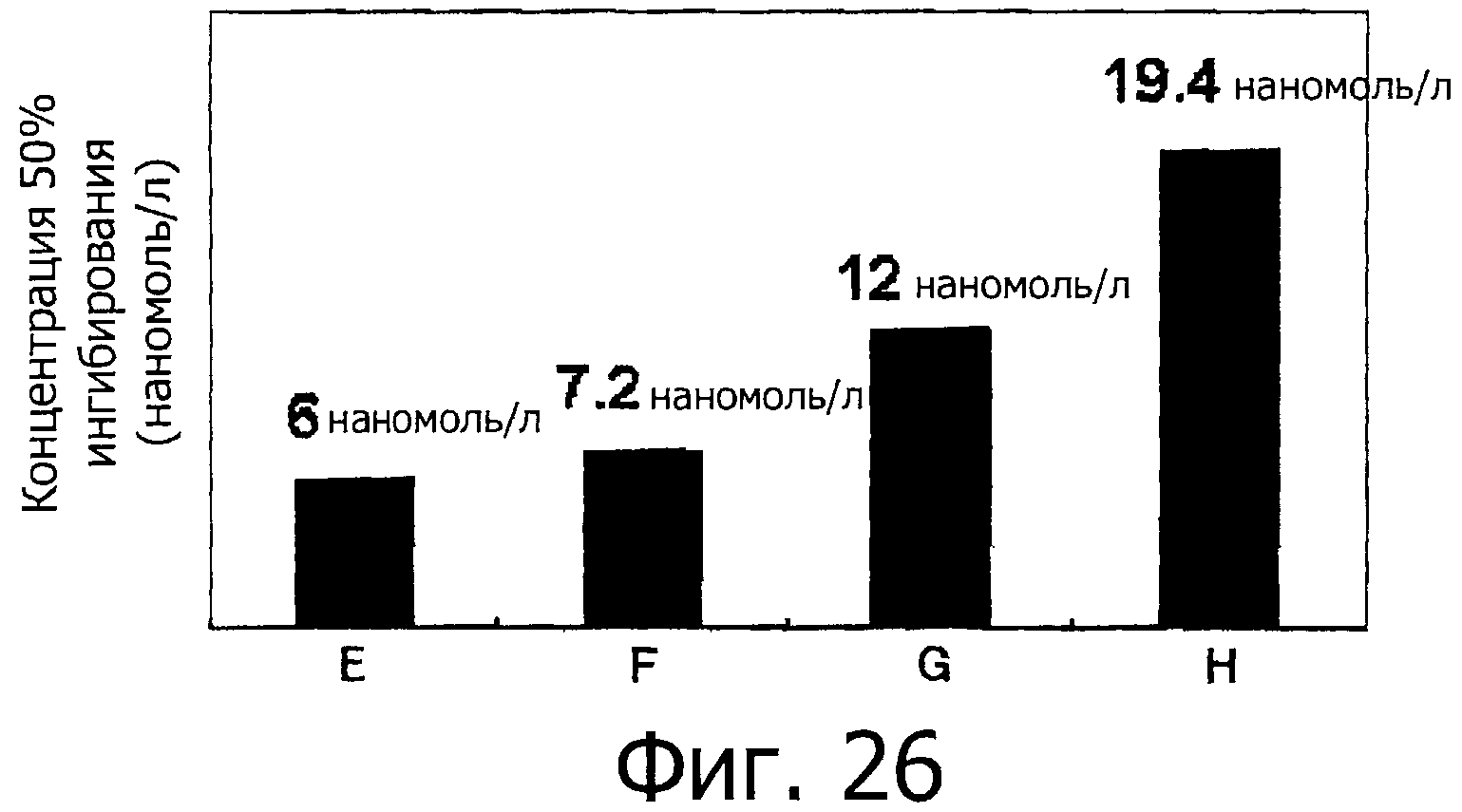
На фигуре 26 показаны значения концентрации 50% ингибирования для фракций Е-Н.
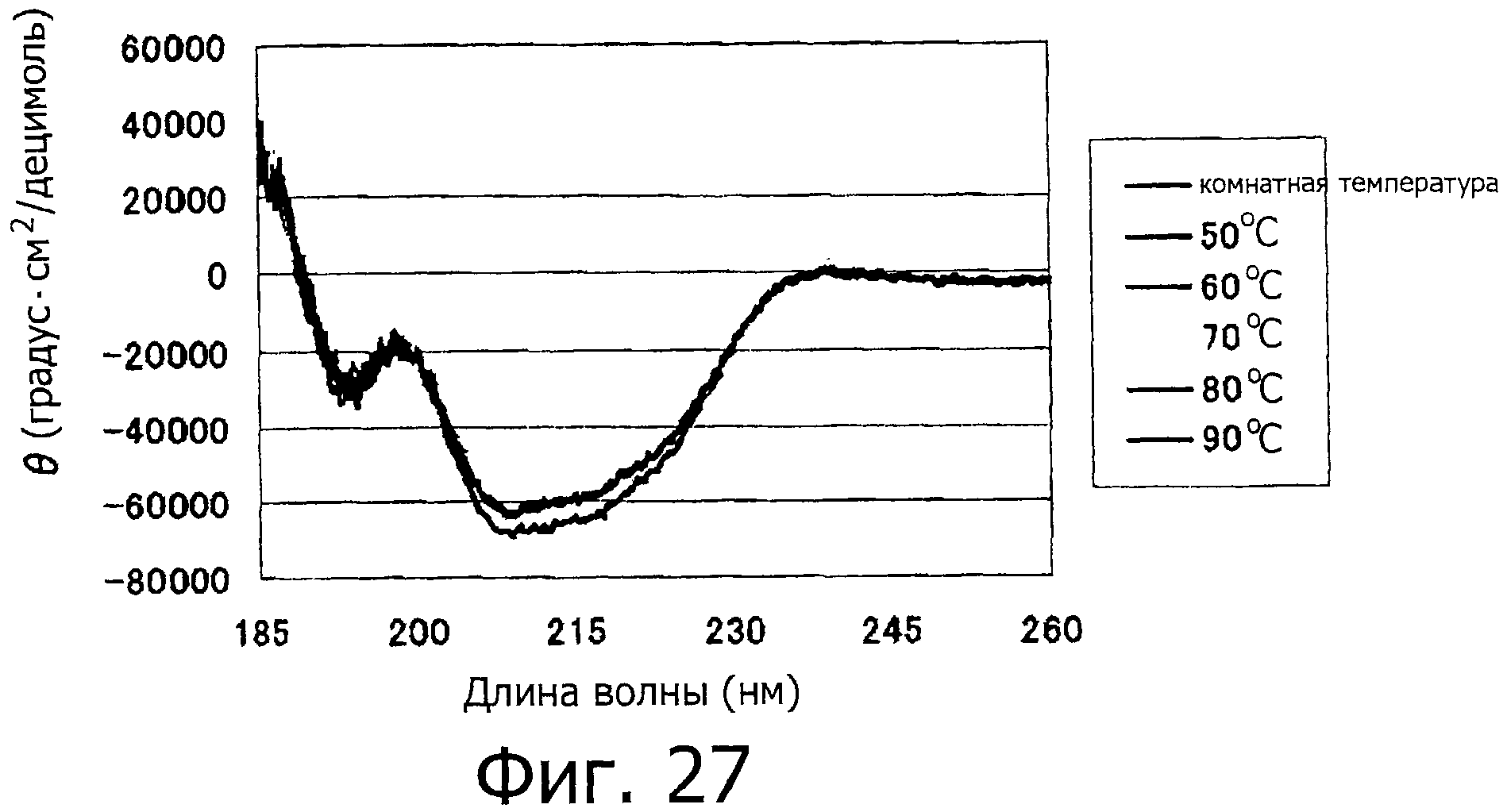
На фигуре 27 показан спектр КД для фракции В при различных температурах.
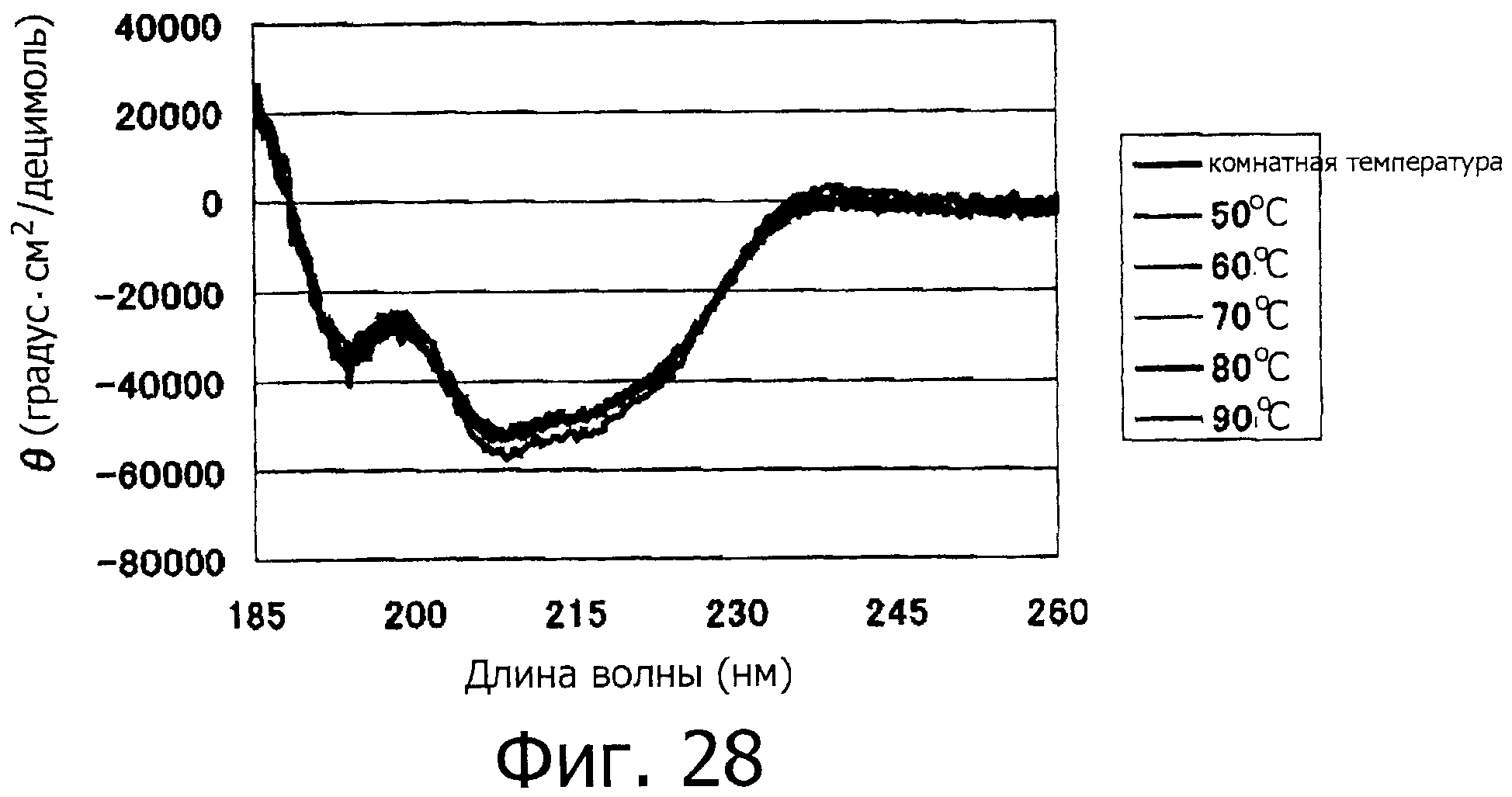
На фигуре 28 показан спектр КД для фракции F при различных температурах.
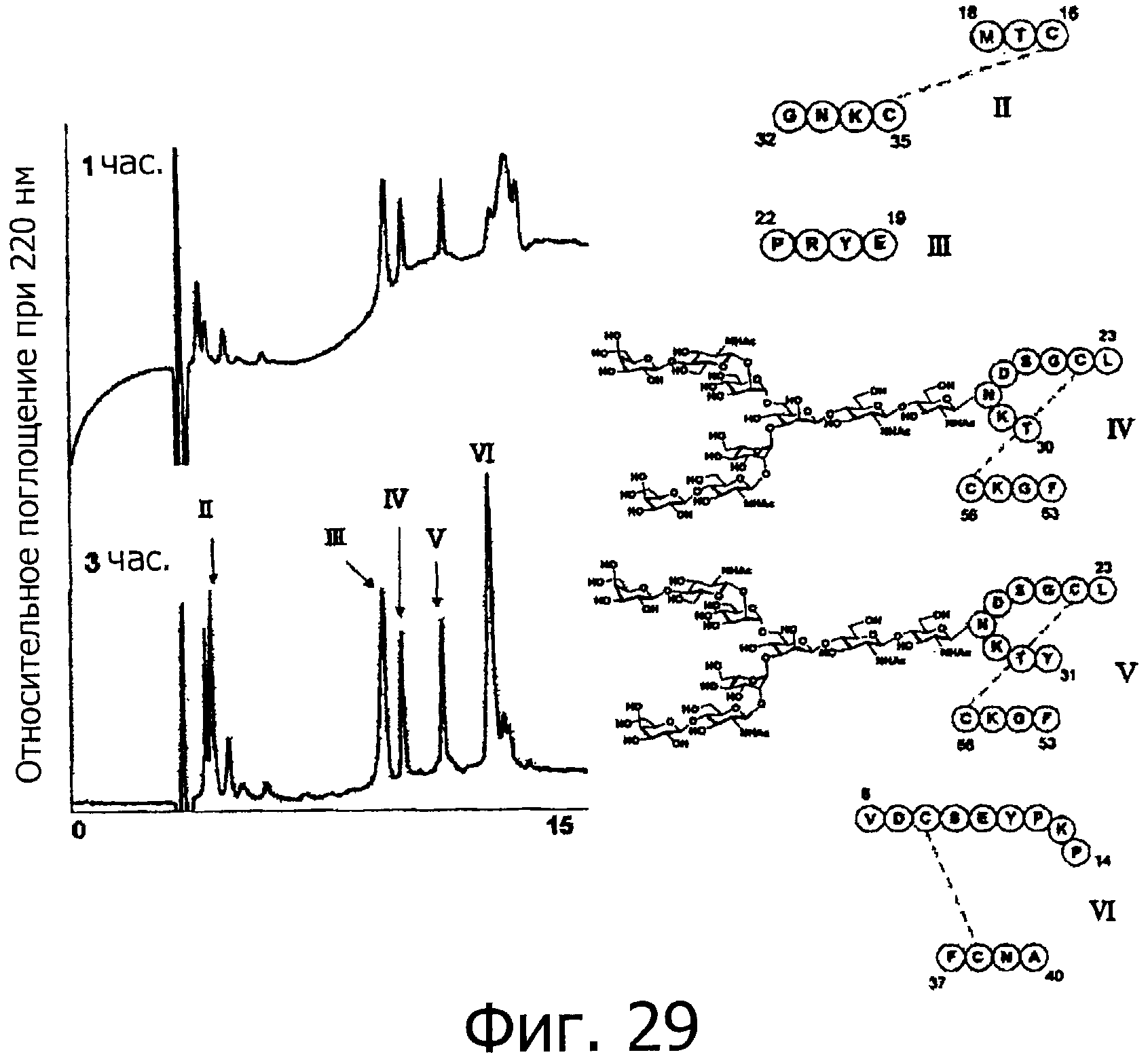
Фигура 29 представляет собой хроматограмму (при длине волны 220 нм) при гидролизе фракции В под действием термолизина.
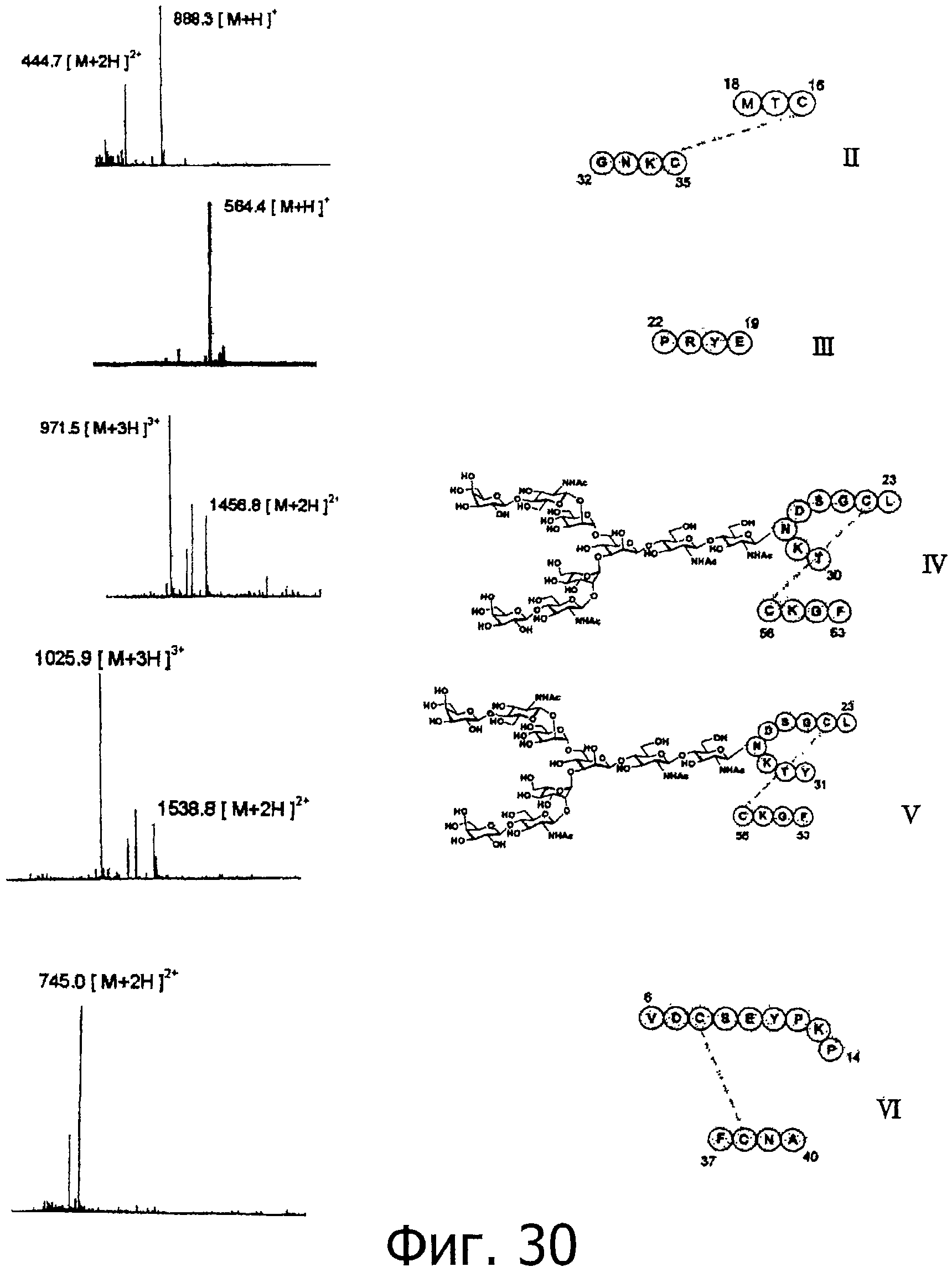
На фигуре 30 показаны результаты масс-спектрометрического анализа пептидных фрагментов, полученных при гидролизе фракции В под действием термолизина.
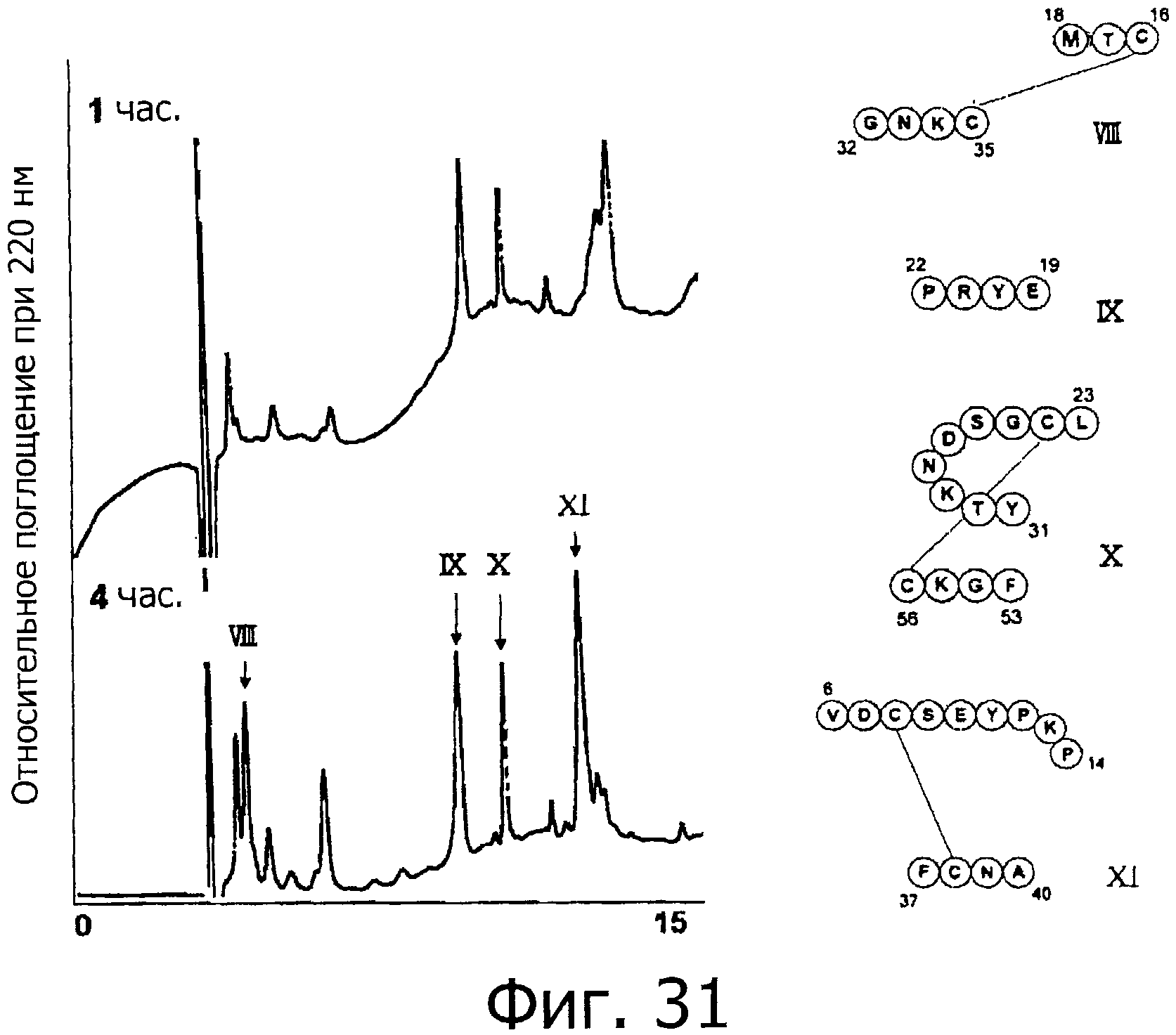
Фигура 31 представляет собой хроматограмму (при длине волны 220 нм) при гидролизе фракции F под действием термолизина.
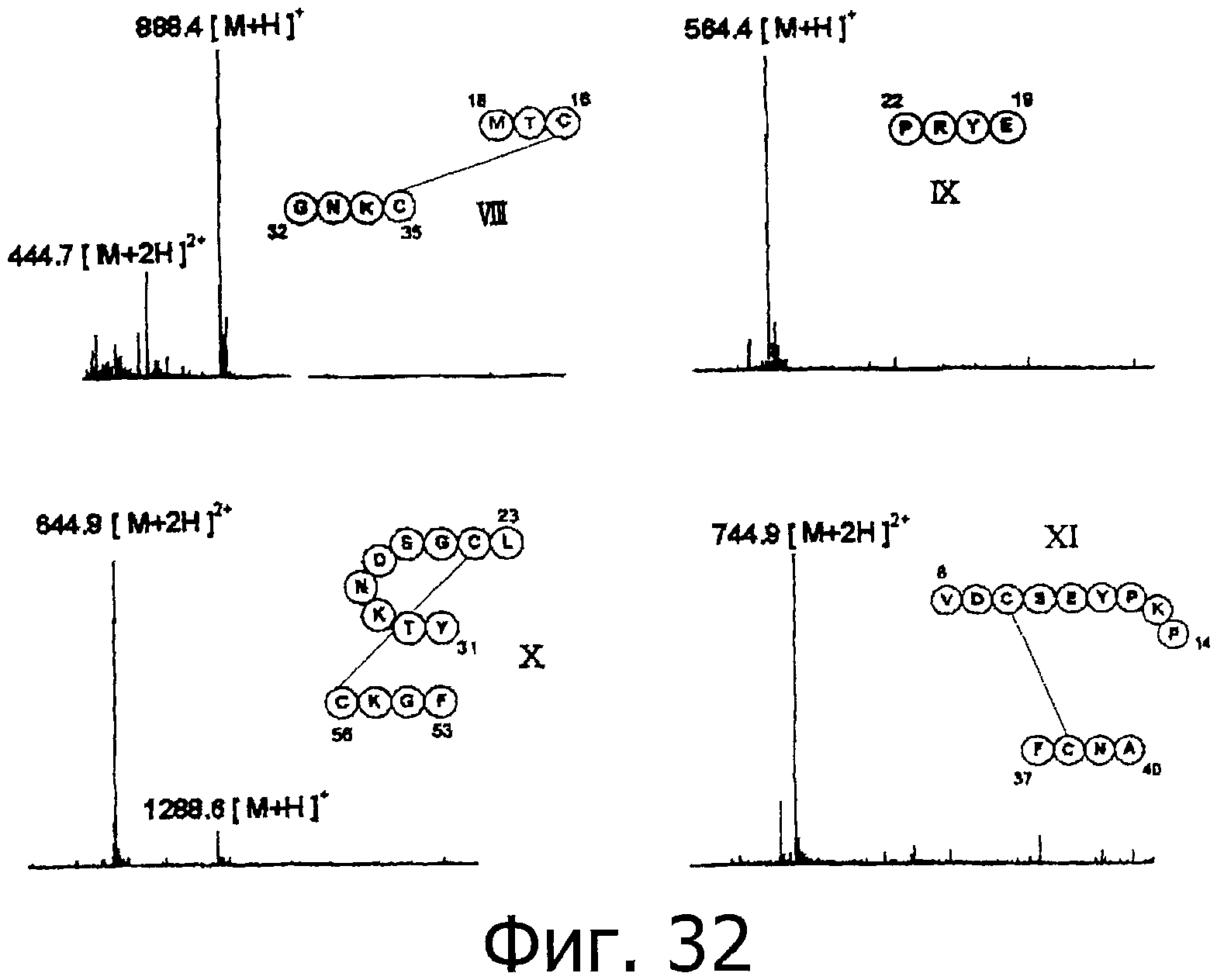
На фигуре 32 показаны результаты масс-спектрометрического анализа пептидных фрагментов, полученных при гидролизе фракции F под действием термолизина.
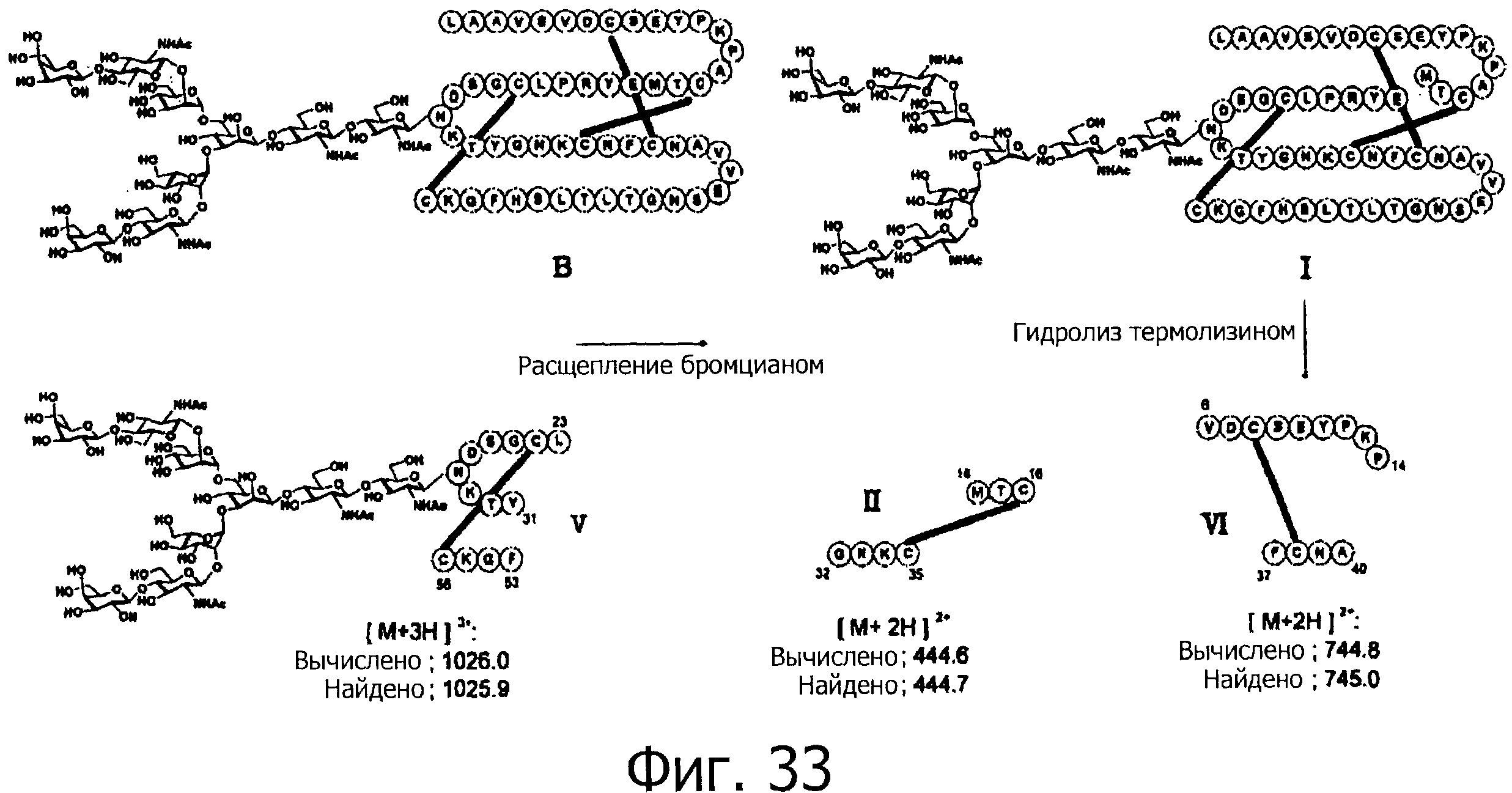
На фигуре 33 показаны результаты определения положения дисульфидной связи при гидролизе фракции В под действием термолизина.
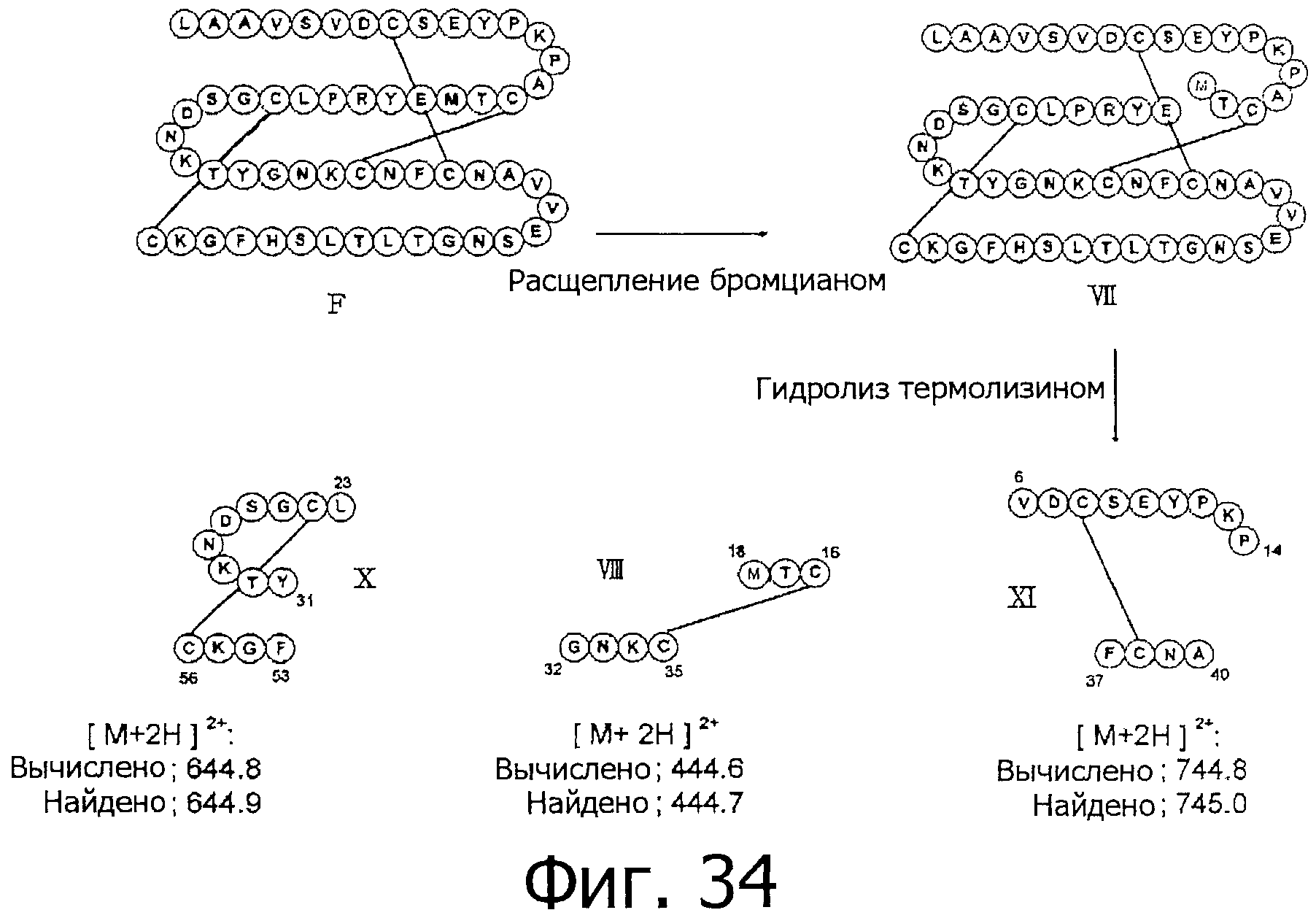
На фигуре 34 показаны результаты определения положения дисульфидной связи при гидролизе фракции F под действием термолизина.
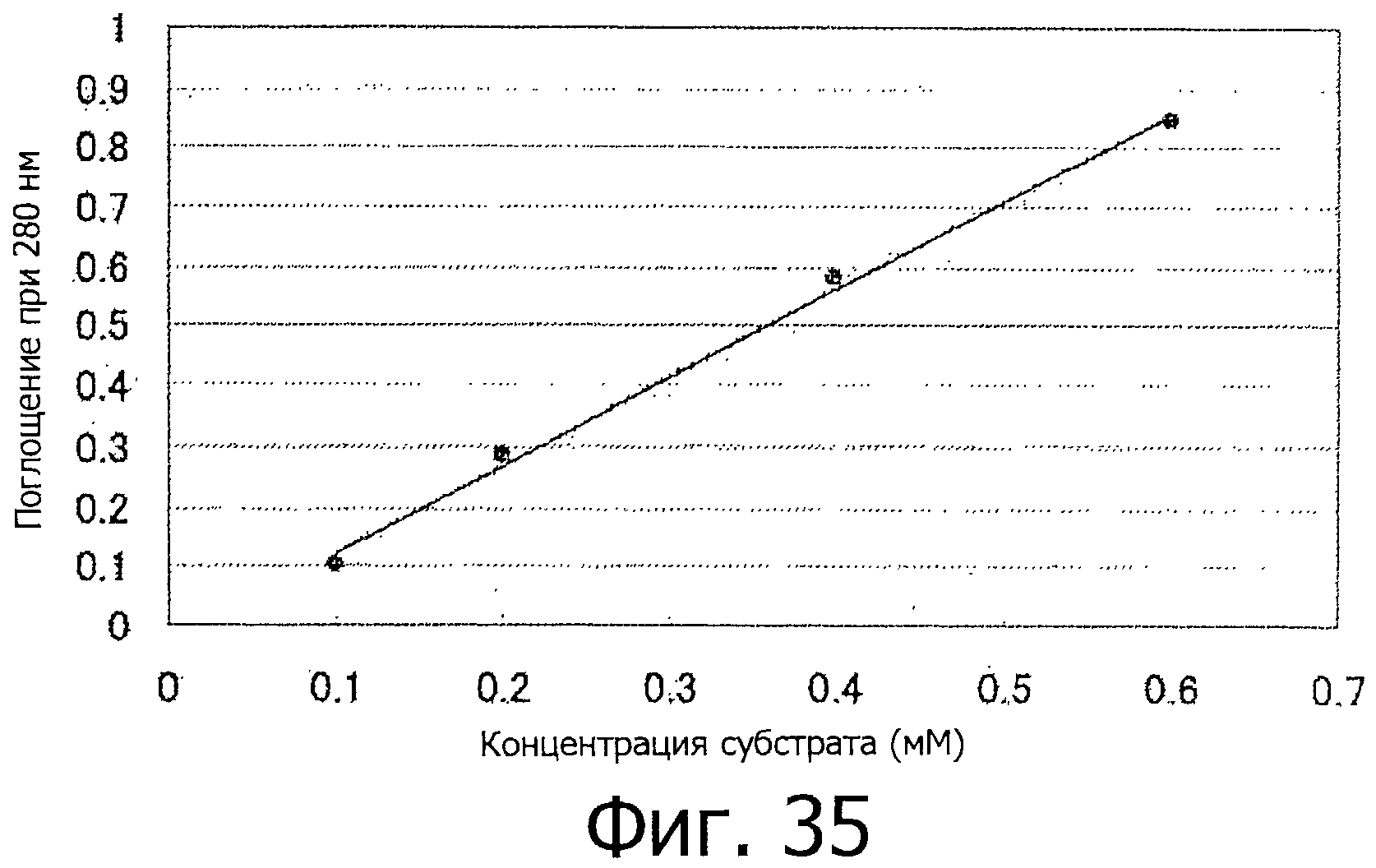
На фигуре 35 показана калибровочная кривая для субстрата - пептида.
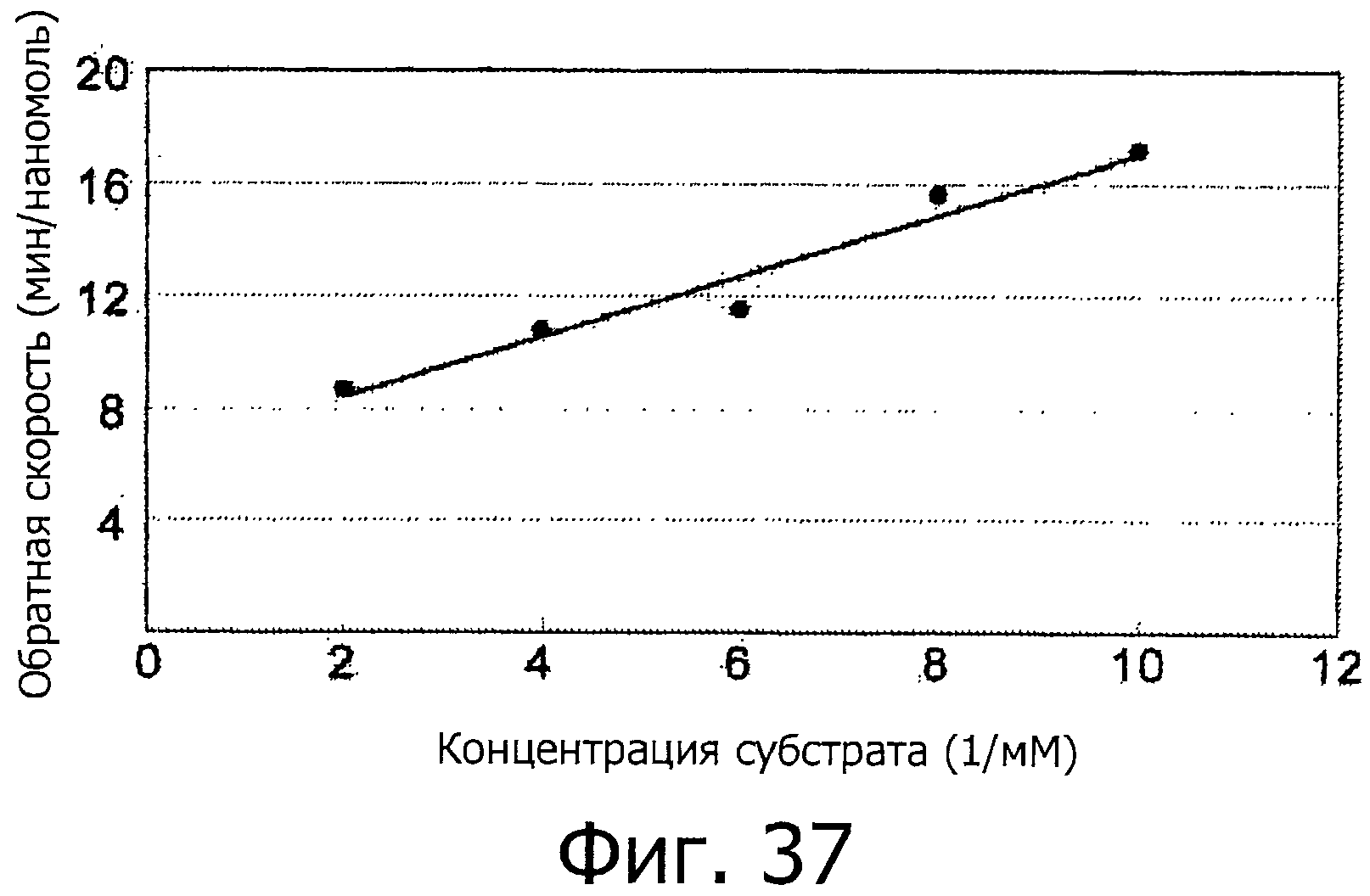
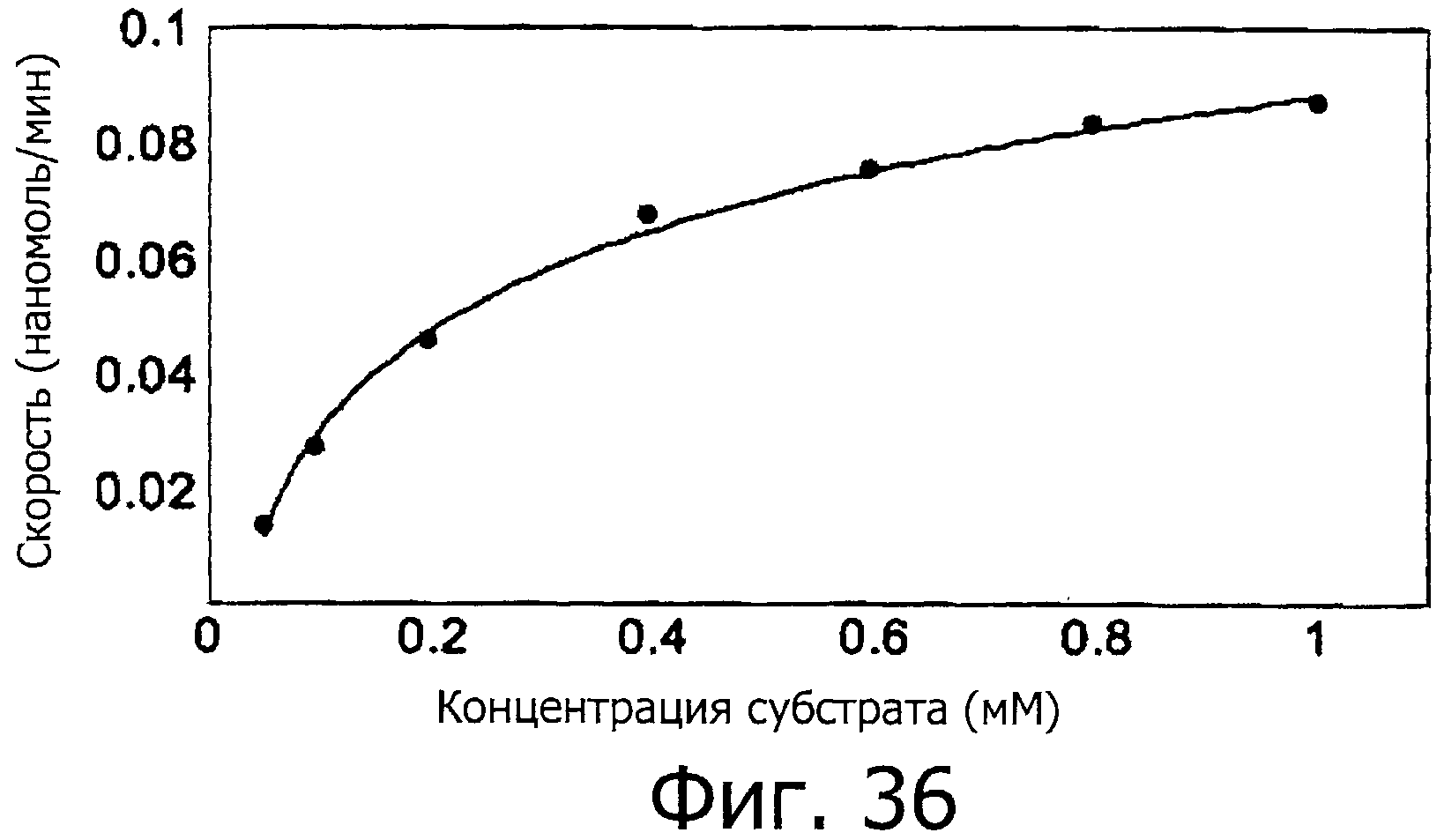
На фигуре 36 показана зависимость скорости реакции от концентрации субстрата - пептида.
На фигуре 37 показана зависимость скорости от концентрации субстрата - пептида в координатах уравнения Михаэлиса-Ментен.
Подробное описание предпочтительных вариантов осуществления
Далее будут описаны предпочтительные варианты осуществления настоящего изобретения.
Используемый в описании термин "белок" конкретно не ограничивается до тех пор, пока он означает ансамбль из множества аминокислот, связанных амидной связью, и включает известные белки, новые белки и модифицированные белки. В предпочтительном варианте осуществления, в белковом фрагменте гликопротеина, произведенного по способу получения настоящего изобретения, множество аминокислот связаны такой же амидной связью, как в белках природного происхождения (пептидная связь). Применяемые в изобретении белковые молекулы имеют длину, достаточную для того, чтобы складываться в заданную структуру высшего порядка.
Используемый в описании термин "модифицированный белок" относится к белкам, модифицированным естественным или искусственным путем. Примеры такого модифицирования включают алкилирование, ацилирование (например, ацетилирование), амидирование (например, амидирование С-конца молекулы белка), карбоксилирование, образование сложного эфира, образование дисульфидной связи, гликозилирование, липидирование, фосфорилирование, гидроксилирование и присоединение меченого соединения, причем модифицирование применяется к одному или нескольким аминокислотным остаткам белка.
Используемый в описании термин "пептид" обычно применяется в качестве синонима белка. Однако этот термин также может быть использован для обозначения части белка и относительно короткой цепочки аминокислоты, которая не образует структуру высшего порядка.
Используемый в описании термин "аминокислота" применяется в самом широком смысле, и примеры аминокислот включают, кроме аминокислот природного происхождения, таких как серин (Ser), аспарагин (Asn), валин (Val), лейцин (Leu), изолейцин (Не), аланин (Ala), тирозин (Tyr), глицин (Gly), лизин (Lys), аргинин (Arg), гистидин (His), аспарагиновая кислота (Asp), глутаминовая кислота (Glu), глутамин (Gln), треонин (Thr), цистеин (Cys), метионин (Met), фенилаланин(Phe), триптофан (Trp), и пролин (Pro), аминокислоты неприродного происхождения, такие как мутантные аминокислоты и производные аминокислот. При рассмотрении указанного выше широкого определения специалисты в этой области техники могут понять, что примеры аминокислот, используемых в настоящем изобретении, включают L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты, такие как мутантные и производные аминокислоты; небелковые составляющие аминокислот в живом организме, такие как норлейцин, β-аланин, и орнитин; и химически синтезированные соединения, имеющие характеристики аминокислот, которые известны специалистам в этой области техники. Примеры аминокислот неприродного происхождения, включают α-метиламинокислоты (например, α-метилаланин), D-аминокислоты, аминокислоты, наподобие гистидина (например, 2-аминогистидин, β-гидроксил-гистидин, гомогистидин, α-фторметил-гистидин, и α-метилгистидин), аминокислоты, имеющие дополнительную метиленовую группу в боковой цепи ("гомо"-аминокислоты), и аминокислоты, в которых функциональная группа карбоновой кислоты в боковой цепи замещена группой сульфоновой кислоты (например, цистеиновая кислота).
В предпочтительном варианте осуществления белковый фрагмент гликопротеина, произведенного по способу получения настоящего изобретения, полностью состоит из аминокислот, которые присутствуют в живом организме как составляющие аминокислоты белка или гликопротеина.
Используемый в описании термин "гликопротеин" конкретно не ограничивается до тех пор, пока он означает соединение, полученное путем присоединения, по меньшей мере, одной сахаридной цепочки к вышеупомянутому белку, и включает известные гликопротеины и новые гликопротеины. Используемый в описании термин "гликопептид" обычно применяется в качестве синонима гликопротеина. Однако этот термин также может быть использован для обозначения части гликопротеина и пептида, полученного путем связывания сахаридной цепочки с вышеупомянутым пептидом.
В предпочтительном варианте осуществления гликопротеин, произведенный по способу получения настоящего изобретения, представляет собой белок, имеющий N-связанную сахаридную цепочку или O-связанную сахаридную цепочку, и примеры гликопротеинов включают часть или весь пептид, такой как эритропоэтин, интерлейкин, интерферон-β, антитело, хемотаксический белок-3 моноцитов (МСР-3) и овомукоидный белок.
В гликопротеине сахаридная цепочка и аминокислотный остаток белка могут быть связаны непосредственно или с помощью линкера. Хотя не устанавливаются какие-либо ограничения относительно места связывания сахаридной цепочки и аминокислоты, предпочтительно аминокислота присоединяется к восстанавливающему концу сахаридной цепочки.
Относительно вида аминокислоты, к которой присоединяется сахаридная цепочка, не устанавливаются какие-либо ограничения, и сахаридная цепочка может присоединяться к аминокислоте природного происхождения, а также неприродного происхождения. Исходя из того, что гликопротеин имеет такую же или аналогичную структуру, как и гликопротеин, присутствующий в живом организме, сахаридная цепочка предпочтительно присоединяется к аспарагину (Asn) в виде N-связанной сахаридной цепочки, или к Ser или Thr в виде O-связанной сахаридной цепочки. В частности, в случае N-связанной сахаридной цепочки, гликопротеин, произведенный по способу получения настоящего изобретения, предпочтительно представляет собой гликопротеин, имеющий структуру, в которой сахаридная цепочка присоединяется к Asn, a аминокислота (X), отличающаяся от пролина, присоединяется к С-концу Asn с помощью амидной связи (пептидная связь), и далее Thr или Ser присоединяются к С-концу аминокислоты Х с помощью амидной связи (пептидная связь) (-гликозилированный Asn-X-Thr/Ser-). Когда сахаридная цепочка и аминокислота связаны с помощью линкера, с точки зрения свойства легкого присоединения к линкеру, аминокислота, с которой связывается сахаридная цепочка, предпочтительно является аминокислотой, в молекуле которой имеются две или больше карбоксильных групп, такой как аспарагиновая кислота и глутаминовая кислота; аминокислотой, в молекуле которой имеются две или больше аминогрупп, такой как лизин, аргинин, гистидин и триптофан; аминокислотой, в молекуле которой имеются две или больше гидроксильных групп, такой как серии, треонин и тирозин; аминокислотой, в молекуле которой имеются две или больше тиоловых групп, такой как цистеин; или аминокислотой, в молекуле которой имеются две или больше амидных групп, такой как аспарагин и глутамин. С точки зрения реакционной способности, особенно предпочтительной является аспарагиновая кислота, глутаминовая кислота, лизин, аргинин, серии, треонин, цистеин, аспарагин или глутамин.
Когда сахаридная цепочка и аминокислота связаны с помощью линкера в гликопротеине, в качестве линкера могут быть использованы соединения, которые хорошо известны из уровня техники, и их примеры включают:
-NH-(CO)-(CH2)a-CH2-
где а представляет собой целое число, и хотя не устанавливаются какие-либо ограничения на это число до тех пор, пока а не мешает предназначенной функции линкера; предпочтительно это целое число от 0 до 4;
С1-10 полиметиленовую группу; и
-CH2-R3-
где R3 означает группу, образовавшуюся при удалении одного атома водорода из группы, выбранной из группы, состоящей из алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, циклической углеродной группы, замещенной циклической углеродной группы, гетероциклической группы и замещенной гетероциклической группой.
Используемый в описании термин "сахаридная цепочка" включает в себя, кроме соединений, состоящих из цепочки из двух или больше блоков сахаридов (моносахариды и/или их производные), соединения, содержащих один блок сахаридов (моносахариды и/или их производные). Примеры таких сахаридных цепочек в значительной степени включают (но не ограничиваются указанным) моносахариды и полисахариды, содержащиеся в живом организме (глюкоза, галактоза, манноза, фуккоза, ксилоза, N-ацетилглюкозамин, N-ацетилгалактозамин, сиаловая кислота, а также комплексы и производные этих моносахаридов и полисахаридов), и, кроме того, продукт распада полисахарида, гликопротеин, протеогликан, гликозаминогликан, и сахаридные цепочки, являющиеся продуктом распада или происходящие из сложных биологических молекул, таких как гликолипид. Когда в цепочке соединяются два или больше блоков сахаридов, эти блоки сахаридов соединены между собой путем дегидратационной конденсации гликозидной связи. Сахаридная цепочка может быть линейной или разветвленной.
Кроме того, используемый в описании термин "сахаридная цепочка" включает в себя производные сахаридной цепочки. Примеры производных сахаридной цепочки включают (но не ограничиваются) сахаридную цепочку, имеющую, в качестве компонента сахара в сахаридной цепочке, сахар, содержащий карбоксильную группу (например, альдоновые кислоты, которые превращаются в карбоновые кислоты путем окисления в положении С-1 (например, D-глюконовая кислота, образующаяся при окислении D-глюкозы), уроновая кислота, содержащая концевой атом С, превращенный в карбоновую кислоту (например, D-глюкуроновая кислота, образующаяся при окислении D-глюкозы), сахар, имеющий аминогруппу или производную аминогруппы (например, ацетилированную аминогруппу) (например, N-ацетил-D-глюкозамин и N-ацетил-D-галактозамин), сахар, имеющий аминогруппу, а также карбоксильную группу (например, N-ацетилнейраминовая кислота (сиаловая кислота) и N-ацетилмураминовая кислота), деоксилированный сахар (например, 2-деокси-D-рибоза), сульфатированный сахар, содержащий группу серной кислоты, и фосфорилированный сахар, содержащий фосфатную группу.
Сахаридная цепочка в настоящем изобретении предпочтительно представляет собой сахаридную цепочку, которая присутствует в виде комплексного сахара в живом организме (такой как гликопротеин (или гликопептид), протеогликан и гликолипид), и предпочтительно N-связанную сахаридную цепочку, O-связанную сахаридную цепочку, и тому подобное, которые являются сахаридными цепочками, связанными с белком (или пептидом) с образованием гликопротеина (или гликопептида) в живом организме. В гликопротеине, имеющем O-связанную сахаридную цепочку, N-ацетилгалактозамин (GalNAc), N-ацетилглюкозамин (GlcNAc), ксилоза, фуккоза, и тому подобное присоединяются к Ser или Thr пептида с помощью O-гликозидной связи, и туда же дополнительно присоединяется сахаридная цепочка. Примеры N-связанной сахаридной цепочки включают тип высшей маннозы, комплексный тип и гибридный тип, среди которых комплексный тип является предпочтительным.
В настоящем изобретении примером предпочтительной сахаридной цепочкой является цепочка, представленная следующей формулой (4):
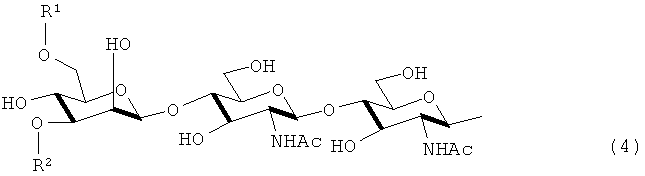
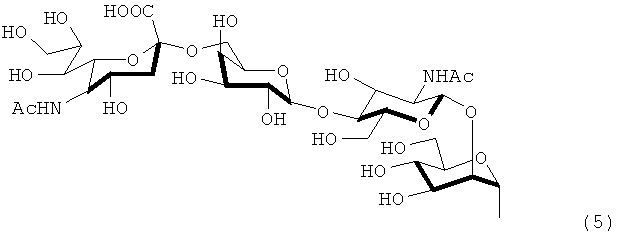
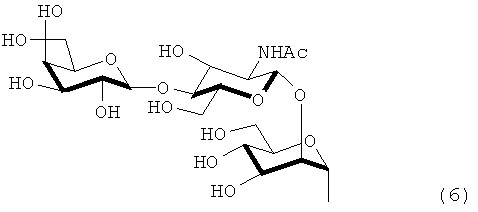
в которой каждый радикал R1 и R2 независимо означает атом водорода или группу, представленную формулами (5) - (8).
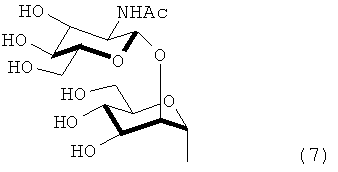
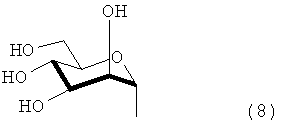
При рассмотрении аспекта применения способа получения гликопротеина настоящего изобретения для области производства фармацевтического продукта и тому подобного, с точки зрения устранения возможной проблемы антигенности и тому подобного, примеры предпочтительной сахаридной цепочки включают сахаридную цепочку, имеющую такую же структуру, как сахаридная цепочка, которая присоединяется к белку и находится в человеческом организме в виде гликопротеина (например, сахаридная цепочка, описанная в журнале FEBS LETTERS том 50, №3, февр. 1975) (сахаридная цепочка, имеющая такой же тип компонентов сахара и такой же характер связывания указанных компонентов сахара) или сахаридная цепочка, полученная путем удаления одной или нескольких молекул сахара из невосстанавливающего конца указанной выше сахаридной цепочки.
Не устанавливаются какие-либо ограничения относительно числа сахаридных цепочек, которые могут быть добавлены в гликопротеин до тех пор, пока это одна или несколько цепочек; однако с точки зрения обеспечения гликопротеина, имеющего структуру, аналогичную гликопротеину, присутствующему в живом организме, может быть более предпочтительно, чтобы число сахаридных цепочек, которые могут быть добавлены, приблизительно будет таким же, как для гликопротеина, присутствующего в организме.
В способе получения гликопротеина настоящего изобретения используется гликопротеин, имеющий однородную аминокислотную последовательность и сахаридную цепочку. В настоящем изобретении однородная структура сахаридной цепочки в гликопротеине означает, что при сопоставлении гликопротеинов между собой, место присоединения сахаридной цепочки в пептиде, тип каждого компонента сахара в сахаридной цепочке, порядок связывания и характер связывания сахаров являются такими же, по меньшей мере, для 90% или более, предпочтительно 95% или больше, более предпочтительно для 99% или более сахаридных цепочек.
Кроме того, в настоящем изобретении однородная аминокислотная последовательность в гликопротеине означает, что при сопоставлении гликопротеинов между собой, тип аминокислот в белке, порядок связывания и характер связывания аминокислот являются одинаковыми. Однако до тех пор, пока уложенный гликопротеин обладает заданной активностью, приведенные выше свойства могут быть такими же, по меньшей мере, для 90% или более, предпочтительно 95% или больше, более предпочтительно для 99% или более гликопротеинов.
Гликопротеин, имеющий однородную аминокислотную последовательность и сахаридную цепочку, который может быть использован в настоящем изобретении, может быть получен путем введения стадии присоединения сахаридной цепочки в способ получения пептида, который известен специалистам в этой области техники, такой как твердофазный синтез, жидкофазный синтез, синтез с помощью клеток, и по способу выделения и экстракции гликопротеина природного происхождения. Что касается способа получения сахаридной цепочки, которая будет использована на стадии присоединения сахаридной цепочки, можно сослаться, например, на международные публикации №№ WO 03/008431, WO 2004/058984, WO 2004/008431, WO 2004/058824, WO 2004/070046, WO 2007/011055, и тому подобное.
В предпочтительном варианте осуществления настоящего изобретения, по меньшей мере, часть гликопротеина, имеющего однородную аминокислотную и сахаридную цепочку, получается следующим способом. Можно сослаться на проспект документа WO 2004/005330, где также описан способ, изложенный ниже.
Во-первых, (1) гидроксильную группу смолы, имеющей гидроксильную группу, этерифицируют с использованием карбоксильной группы аминокислоты, в которой аминогруппа защищена жирорастворимой защитной группой, или карбоксильной группы гликозилированной аминокислоты, имеющей аминогруппу, защищенную жирорастворимой защитной группой. В этом случае, поскольку аминогруппа аминокислоты защищена жирорастворимой защитной группой, предотвращается автоконденсация аминокислоты, и будет происходить процесс этерификации между гидроксильной группой смолы и карбоксильной группой аминокислоты.
Затем (2) удаляют жирорастворимую защитную группу сложного эфира, полученного на стадии (1), для того, чтобы образовалась свободная аминогруппа,
(3) вышеупомянутую свободную аминогруппу амидируют с использованием карбоксильной группы аминокислоты, имеющей аминогруппу, защищенную жирорастворимой защитной группой, или карбоксильной группы гликозилированной аминокислоты, имеющей аминогруппу, защищенную жирорастворимой защитной группой,
(4) после стадии (3) жирорастворимую защитную группу удаляют для того, чтобы образовалась свободная аминогруппа, и
(5) стадии (3) и (4) повторяют один или несколько раз, в случае необходимости, и таким образом, может быть получен гликопротеин, имеющий желательное число аминокислот, связанных вместе и имеющих одну или несколько сахаридных цепочек, присоединенных в желательном положении. Примеры гликозилированной аминокислоты включают аспарагин-связанную сахаридную цепочку, в которой сахаридная цепочка присоединяется к атому азота в амидной группе в боковой цепи аспарагина посредством N-гликозидной связи, и серин-связанную сахаридную цепочку или треонин-связанную сахаридную цепочку, в которой сахаридная цепочка присоединяется к гидроксильной группе в боковой цепи серина или треонина посредством O-гликозидной связи.
Гликопротеин, полученный на стадии (5), присоединяется к смоле с одного конца, в которой имеется свободная аминогруппа на другом конце. Таким образом, (6) желательный гликопротеин может быть получен путем кислотного расщепления сложноэфирной связи, образовавшейся на стадии (1).
В качестве твердофазной смолы может быть использована смола, обычно применяемая в твердофазном синтезе, и ее примеры включают смолу Amino-PEGA (продукт фирмы Merck), смолу Wang (продукт Merck), смолу HMPA-PEGA (продукт Merck) и смолу Trt Chloride (продукт Merck).
Кроме того, между смолой Amino-PEGA и аминокислотой может находиться линкер, и примеры такого линкера включают 4-гидроксиметилфеноксиуксусную кислоту (НМРА) и 4-(4-гидроксиметил-3-метоксифенокси)-бутилуксусную кислоту (НМРВ).
Примеры жирорастворимой защитной группы включают (но специально не ограничиваются) такую защитную группу, которая содержит карбонильную группу, такую как 9-флуоренилметоксикарбонильная (Fmoc) группа, трет-бутилоксикарбонильная (Boc) группа, и аллилоксикарбонильная (Alloc) группа, ацильная группа, такая как ацетильная (Ас) группа, аллильная группа и бензильная группа.
С целью введения жирорастворимой защитной группы, например, когда вводится Fmoc-группа, она может быть введена путем проведения реакций с добавлением 9-флуоренилметил-N-сукцинимидилкарбоната и гидрокарбоната натрия. Указанную выше реакцию можно проводить при температуре 0-50°С, предпочтительно при комнатной температуре, приблизительно в течение одного - пяти часов.
В качестве аминокислоты, защищенной жирорастворимой защитной группой, может быть использована аминокислота, полученная путем защиты вышеупомянутой аминокислоты с использованием описанного выше способа. Кроме того, могут быть использованы также промышленно доступные аминокислоты. Их примеры включают Fmoc-Ser, Fmoc-Asn, Fmoc-Val, Fmoc-Leu, Fmoc-Ile, Fmoc-Ala, Fmoc-Tyr, Fmoc-Gly, Fmoc-Lys, Fmoc-Arg, Fmoc-His, Fmoc-Asp, Fmoc-Glu, Fmoc-Gln, Fmoc-Thr, Fmoc-Cys, Fmoc-Met, Fmoc-Phe, Fmoc-Trp и Fmoc-Pro.
В качестве катализатора этерификации могут быть использованы известные агенты дегидратационной конденсации, такие как 1-мезитиленсульфонил-3-нитро-1,2,4-триазол (MSNT), дициклогексилкарбодиимид (ДЦК) и 1,3-диизопропилкарбодиимид (DIPCDI). Что касается применяемого соотношения аминокислоты и агента дегидратационной конденсации, в расчете на весовую часть аминокислоты, обычно агент составляет от 1 до 10 частей, предпочтительно от двух до пяти весовых частей.
Предпочтительно, процесс этерификации проводят, например, путем размещения смолы в колонке для твердой фазы, и смолу промывают растворителем, после чего добавляют раствор аминокислоты. Примеры растворителей для промывки включают диметилформамид (ДМФА), 2-пропанол и метилендихлорид. Примеры растворителей для растворения аминокислоты включают диметилсульфоксид (ДМСО), ДМФА и метилендихлорид. Процесс этерификации может быть осуществлен при температуре 0-50°С, предпочтительно при комнатной температуре, приблизительно от 10 минут до 30 часов, предпочтительно от 15 минут до 24 часов.
В это время также предпочтительно предохраняют любые не реагирующие функциональные группы в твердой фазе путем ацетилирования безводной уксусной кислотой и тому подобным.
Удаление жирорастворимой защитной группы может быть осуществлено, например, путем обработки основанием. Примеры основания включают пиперидин и морфолин. Причем эту реакцию предпочтительно проводят в присутствии растворителя. Примеры растворителя включают ДМСО, ДМФА и метанол.
Предпочтительно, процесс амидирования свободной аминогруппы и карбоксильной группы любой аминокислоты, в которой атом азота в аминогруппе защищен жирорастворимой защитной группой, проводят в присутствии активатора и растворителя.
Примеры активаторов включают дициклогексилкарбодиимид (ДЦК), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (WSC/HCl), дифенилфосфорилазид (DPPA), карбонилдиимидазол (CDI), диэтилцианофосфонат (DEPC), 1,3-диизопропилкарбодиимид (DIPCI), бензотриазол-1-ил-окси-трис-пирролидинофосфоний гексафторфосфат (РуВОР), 3-диэтоксифосфорилокси-1,2,3-бензотриазин-4(3Н)-он (DEPBT), 1-гидроксибензотриазол (HOBt), гидроксисукцинимид (HOSu), диметиламинопиридин (DMAP), 1-гидрокси-7-азабензотриазол (HOAt), 3-гидрокси-4-оксо-3,4-дигидро-5-азабензо-1,2,3-триазин (HODhbt), гидроксифталимид (HOPht), пентафторфенол (Pfp-OH), 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат (HBTU), O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфонат (HATU) и O-бензотриазол-1-ил-1,1,3,3-тетраметилуроний тетрафторборат (TBTU).
Предпочтительно активатор используется в количестве от одного до 20 эквивалентов, предпочтительно от одного до 10 эквивалентов, более предпочтительно от одного до пяти эквивалентов относительно любой аминокислоты, в которой азот аминогруппы защищен жирорастворимой защитной группой.
Хотя эти процессы протекают только с использованием вышеупомянутых активаторов, предпочтительно амин используется в сочетании в качестве дополнительного реагента. Примеры аминов включают диизопропилэтиламин (DIPEA), N-этилморфолин (NEM), N-метилморфолин (NMM) и N-метилимидазол (NMI). Предпочтительно дополнительный реагент используется в количестве от одного до 20 эквивалентов, предпочтительно от одного до 10 эквивалентов, более предпочтительно от одного до пяти эквивалентов относительно любой аминокислоты, в которой азот аминогруппы защищен жирорастворимой защитной группой.
Примеры растворителей включают ДМСО, ДМФА и метилендихлорид. Этот процесс может быть осуществлен при температуре от 0 до 50°С, предпочтительно при комнатной температуре, приблизительно в течение от 10 минут до 30 часов, предпочтительно приблизительно от 15 минут до 24 часов. Кроме того, в то же время предпочтительно защищают любую не реагирующую аминогруппу в твердой фазе путем ацетилирования безводной уксусной кислотой и тому подобным. Жирорастворимая защитная группа может быть удалена таким же образом, как описано выше.
Отщепление пептидной цепи от смолы предпочтительно проводится с использованием кислоты. Примеры кислот включают трифторуксусную кислот (ТФУ) и фтористый водород (HF). В то же время линкер между жирорастворимой защитной группой в аминокислоте и смолой может образовать катионные частицы с высокой реакционной способностью. Таким образом, с целью улавливания таких катионных частиц, предпочтительно добавляют нуклеофильный реагент. Примеры нуклеофильных реагентов включают триизопропилсилан (TIS), фенол, тиоанизол и этандиол (EDT).
Гликопротеин, имеющий однородную аминокислотную последовательность и сахаридную цепочку, может быть получен следующим образом; разделение его на несколько пептидных блоков или гликопептидных блоков, и синтез каждого блока с использованием стадий (1) - (6), с последующим связыванием блоков, синтезированных таким образом, вместе с методом лигирования.
Используемый в описании термин "метод лигирования" включает в себя метод Естественного химического лигирования (NCL), который описан в международной публикации № WO 96/34878, и кроме того, охватывает применение Естественного химического лигирования к пептиду, содержащему аминокислоты и аминокислотные производные не-природного происхождения. В соответствии с методом лигирования может быть получен белок, имеющий природную амидную связь (пептидную связь) в месте связывания.
Связывание путем лигирования может быть использовано для того, чтобы образовать связь между любой из пар: пептид-пептид, пептид-гликопептид и гликопептид-гликопептид; однако необходимо, чтобы один из двух пептидов или гликопептидов, подлежащих связыванию, имел цистеиновый остаток на своем N-конце, а другой имел функциональную группу α-карбоксисложного тиоэфира на своем С-конце.
Для того чтобы каждый пептид или гликопептиды имели цистеиновый остаток на своем N-конце, например, при конструировании каждого пептидного или гликопептидного блока, может быть создан участок в N-концевой стороне цистеинового остатка, содержащегося в гликопротеине, который будет произведен в качестве конечного продукта.
Пептид или гликопептид, имеющий функциональную группу α-карбоксисложного тиоэфира на своем С-конце, может быть получен способом, который известен специалисту в этой области техники, например, по методу, описанному в Международной публикации № WO 96/34878.
Например, как позже будет описано в примерах, защищенный пептид (или гликопептид), в котором защищены аминокислота в боковой цепи и N-концевая аминокислота, получаются с использованием способа твердофазного синтеза, причем карбоксильная группа на С-конце этого защищенного пептида (или гликопептида) конденсируется с бензилмеркаптаном в жидкой фазе, с использованием бензотриазол-1-илокси-трис-пирролидино-фосфоний гексафторфосфата (PyBOP)/DIPEA в качестве конденсирующего реагента, и затем из образовавшегося пептида (или гликопептидов) удаляют защиту, применяя 95%й раствор ТФУ, и таким образом, может быть получен пептид (или гликопептид), имеющий группу α-карбоксисложного тиоэфира на своем С-конце.
Метод лигирования может быть осуществлен по способу, который известен специалистам в этой области техники, таким как способ, описанный в патентной литературе 1, или описанный в примерах, которые, будут приведены позже. Например, первый пептид, имеющий функциональную группу α-карбоксисложного тиоэфира, представленную группой -C(=O)-SR, на своем С-конце и второй пептид, имеющий аминокислотный остаток, включающий -SH группу на своем N-конце, получают в ссылке на вышеупомянутое описание. Хотя не устанавливаются конкретные ограничения относительно R в первом пептиде до тех пор, пока этот радикал не блокирует реакцию тиолового обмена и не становится отщепляемой группой в реакции нуклеофильного замещения, осуществляемой при карбонильной группе, предпочтительно R выбирают из бензильного типа, такой как бензилмеркаптан, арильного типа, такой как тиофенол, 4-(карбоксиметил)тиофенол, алкильного типа, такой как 2-меркаптоэтансульфонат и 3-меркаптопропионамид и тому подобное. Кроме того, хотя -SH группа на N-конце второго пептида по желанию может быть защищена защитной группой, эта защитная группа удаляется в желательный момент процесса, прежде чем наступит описанная ниже реакция лигирования, и второй пептид, имеющий -SH группу на своем N-конце, прореагирует с первым пептидом. Например, когда защитная группа представляет собой такую, которая будет самопроизвольно удаляться в условиях протекания реакции лигирования, например, дисульфидную группу, второй пептид, защищенный защитной группой, может быть использован как есть, в следующей реакции лигирования.
Эти два пептида смешиваются в растворе, таком как 100 мМ (0,1 моль/л) фосфатный буфер в присутствии каталитического тиола, такого как 4-меркаптофенил-уксусная кислота, бензилмеркаптан и тиофенол. Предпочтительно это взаимодействие проводится при соотношении от 0,5 до двух эквивалентов второго пептида и пяти эквивалентов каталитического тиола относительно одного эквивалента первого пептида. Предпочтительно взаимодействие проводится в условиях: рН приблизительно от 6,5 до 7,5 и температуре приблизительно от 20 до 40°С, приблизительно в течение от одного до 30 часов. Развитие реакции можно контролировать, используя известные сочетания методов ВЭЖХ, масс-спектрометрии (МС), и тому подобное.
В описанную выше реакционную смесь добавляют восстанавливающий реагент, такой как дитиотреитол (DTT) и гидрохлорид трис-2-карбоксиэтилфосфина (ТСЕР), чтобы подавить побочные реакции, и образовавшийся продукт по желанию подвергают очистке, и таким образом, могут быть связаны первый пептид и второй пептид.
Когда пептид, включающий карбокситиоэфирную функциональную группу (-С=O-SR) на своем С-конце, имеет различные радикалы R, можно контролировать порядок реакции лигирования (см. журнал Protein Science (2007), 16: 2056-2064, и тому подобное), что можно принимать во внимание, когда лигирование проводится множество раз. Например, когда в качестве R присутствует арильная группа, бензильная группа и алкильная группа, обычно реакция лигирования протекает в указанном порядке.
Используемый в описании термин "структура высшего порядка" белка относится к конформации белка, включающей в себя вторичную структуру, такую как α-спираль и β-пластинчатая структура или такая структура, как статистический клубок, третичная структура, в которой вторичная структура пространственно складывается с помощью водородной связи, дисульфидной связи, ионной связи, гидрофобного взаимодействия и тому подобного, для того чтобы образовалась стабильная конформация, и четвертичная структура, которая образуется путем компоновки множества полипептидных цепей как субъединиц. Структура высшего порядка белка предпочтительно представляет собой необходимую структуру для того, чтобы белок осуществлял свои функции в живом организме. Анализ структуры высшего порядка белка может быть выполнен методом рентгеновской кристаллографии, ЯМР и тому подобное.
Используемый в описании термин гликопротеин, имеющий однородную структуру высшего порядка, означает, что при сопоставлении гликопротеинов между собой, структура высшего порядка для белкового фрагмента гликопротеина является практически одинаковой. Выражение «структура высшего порядка является практически одинаковой» означает, что, по меньшей мере, 90% или более, предпочтительно 95% или больше, более предпочтительно 99% или более структур являются однородными. Гликопротеин, имеющий однородную структуру высшего порядка, имеет стабильное качество, и таким образом, является предпочтительным особенно в такой области как получение фармацевтического продукта и биологическое испытание. Является ли однородной структура высшего порядка гликопротеина, содержащегося в произвольной фракции, можно установить, например, методом ЯМР, измерением кругового дихроизма и дисульфидного картирования.
Используемый в описании термин "укладывание" означает, что белковый фрагмент гликопротеина укладывается в специфическую структуру высшего порядка. Хотя специалисты в этой области техники могут соответствующим образом осуществить укладывание гликопротеина, используя известный или эквивалентный способ, примеры таких способов включают метод диализа, метод разведения и метод инактивации. Метод диализа представляет собой способ укладывания пептида в заданную структуру высшего порядка, в которой реагент, денатурирующий белок (разворачивающий реагент), добавляется заранее, после чего образовавшуюся смесь постепенно разбавляют путем диализа для того, чтобы заменить ее буфером и тому подобным. Примеры разворачивающего реагента включают гидрохлорид гуанидина и мочевину. Кроме того, метод разведения представляет собой способ укладывания пептида в структуру высшего порядка, в которой после добавления реагента, денатурирующего белок, образовавшуюся смесь разбавляют буфером и тому подобным, последовательным образом или сразу. Метод инактивации представляет собой способ укладывания пептида в структуру высшего порядка, в которой после добавления реагента, денатурирующего белок, добавляют второй реагент, инактивирующий денатурирующий реагент последовательным образом или сразу.
В настоящем изобретении "заданная физиологическая активность" может быть выбрана среди различной физиологической активности гликопротеина, имеющего структуру высшего порядка, которая при укладывании получается с хорошей воспроизводимостью в постоянном соотношении. Такая физиологическая активность может быть получена путем предварительного укладывания целевого гликопротеина по способу, аналогичному стадиям (а) и (b), которые будут описаны позже, и фракционирования гликопротеина с использованием колоночной хроматографии, и собирания элюента, соответствующего основному пику, и затем измерения физиологической активности гликопротеина, содержащегося в этой фракции. Здесь выражение основной пик означает пик, полученный с хорошей воспроизводимостью при неоднократном осуществлении стадий (а) и (b). Физиологическая активность может быть измерена методом, который известен специалистам в этой области техники, в зависимости от целевого гликопротеина.
В "способе получения гликопротеина, имеющего однородную аминокислотную последовательность, структуру сахаридной цепочки и структуру высшего порядка" согласно настоящему изобретению, во-первых, на стадии (а) осуществляют укладку гликопротеина, имеющего однородные аминокислотную последовательность и сахаридную цепочку. В растворе, содержащем уложенный гликопротеин, присутствует смесь гликопротеинов с различными структурами высшего порядка, содержащими гликопротеины с заданной активностью или без нее.
Затем, на стадии (b), уложенный гликопротеин фракционируют с использованием колоночной хроматографии. Хотя не устанавливаются конкретные ограничения относительно колоночной хроматографии до тех пор, пока в ней можно разделить гликопротеины, имеющие различные структуры высшего порядка, может быть использована, например, высокоэффективная жидкостная хроматография (ВЭЖХ). Хотя специалисты в этой области техники могут выбрать соответствующие условия, такие как тип твердой фазы и подвижной фазы и скорость истечения из хроматографической колонки, соответствующие разделяемым гликопротеинам, например, могут быть использованы методы хроматографии в обращенных фазах ODS-типа, с нормальной фазой, аффинной колонкой, гель-фильтрационной колонкой, ионообменной колонкой и тому подобное.
На стадии (с), измеряют активность гликопротеина, который содержится в каждой фракции продукта элюирования из хроматографической колонки, и собирают фракцию, имеющую заданную активность, таким образом, может быть получен гликопротеин, имеющий однородные аминокислотную последовательность, структуру сахаридной цепочки и структуру высшего порядка.
В качестве альтернативы, способ получения гликопротеина настоящего изобретения предпочтительно включает, после стадии (с), стадии:
(d) - разворачивание гликопротеина, содержащегося во фракции, не собранной на вышеупомянутой стадии (с),
(e) повторное укладывание не уложенного гликопротеина;
(f) фракционирование повторно уложенного гликопротеина с использованием колоночной хроматографии и сбора фракции, имеющей вышеупомянутую желательную активность; и
(g) повторение стадий (d) - (f), в случае необходимости.
Фракция, содержащая гликопротеин, который будет разворачиваться на стадии (d), также содержит структуру высшего порядка, не имеющую заданной активности. Кроме того, поскольку фракция, содержащая смесь двух или больше видов гликопротеинов, имеющих заданную активность, один из которых не обладает заданным уровнем активности, такую фракцию также вводят во фракцию, которая будет подвергнута разворачиванию.
Хотя гликопротеин может разворачиваться по способу, который известен специалистам в этой области техники, примеры таких способов включают метод присоединения разворачивающего реагента (реагент, денатурирующий белок), такого как гидрохлорид гуанидина и мочевина, и метод добавления, дополнительно к указанному выше реагенту, восстанавливающего реагента, такого как дитиотреитол (DTT) и меркаптоэтанол.
Стадии (е) и (f) могут быть осуществлены способом, который аналогичен вышеупомянутым стадиям от (а) до (с).
Как описано выше, путем проведения стадий от (d) до (f), гликопротеин, содержащийся во фракции, не обладающей заданной активностью, один раз разворачивается и затем повторно складывается, за счет чего гликопротеин может быть превращен в структуру высшего порядка, имеющую заданную активность в постоянном соотношении. Таким образом, можно собрать максимальное количество гликопротеина со структурой высшего порядка, имеющей заданную активность.
Способ тестирования гликопротеина согласно настоящему изобретению включает:
(i) укладывание гликопротеина, имеющего однородные аминокислотную последовательность и сахаридную цепочку,
(ii) фракционирование уложенного гликопротеина с использованием колоночной хроматографии, и
(iii) измерение активности каждой фракции с целью определения, имеет ли фракция заданную активность.
Стадии (i) и (ii) могут быть проведены аналогично вышеупомянутым стадиям (а) и (b). Как описано выше, в растворе, содержащем уложенный гликопротеин, имеющий однородную аминокислотную последовательность и сахаридную цепочку, присутствует смесь гликопротеинов с различными структурами высшего порядка. Следовательно, после фракционирования с использованием колоночной хроматографии, измеряется активность каждой фракции для того, чтобы определить, имеет ли фракция заданную активность, в результате чего может быть выбран и очищен гликопротеин, имеющий однородную структуру высшего порядка и имеющий заданную физиологическую активность.
Кроме того, в настоящем изобретении разработан способ получения смеси гликопротеинов, имеющих желательную физиологическую активность. Этот способ включает:
(A) укладывание гликопротеина, имеющего однородную аминокислотную последовательность и сахаридную цепочку,
(B) фракционирование уложенного гликопротеина с использованием колоночной хроматографии,
(C) измерение активности каждой фракции, и
(D) определение соотношения компонентов смеси фракций, для которой может быть получена желательная активность, и смешивание фракций в соответствии с полученным таким образом соотношением.
Стадии (А) и (В) могут быть проведены аналогично вышеупомянутым стадиям (а) и (b). На стадиях (А) и (В) образуется гликопротеин, имеющий однородную аминокислотную последовательность, структуру сахаридной цепочки и структуру высшего порядка и имеющий заданную активность. Следовательно, гликопротеин может смешиваться в заданном соотношении для того, чтобы получить смесь гликопротеинов, имеющую заданную активность.
Используемые в описании термины представлены для того, чтобы объяснить конкретные варианты осуществления без какого-либо намерения ограничить изобретение.
Кроме того, если только по контексту ясно не следует другое, термины "включает в себя, содержит, включает или охватывает," которые используются в описании, относятся к наличию желательного объекта (элемент, стадия, фактор, число и тому подобное) и эти термины не исключают наличие других объектов (элемент, стадия, фактор, число и тому подобное).
Если отсутствует другое определение, все используемые в описании термины (включая технические термины и научные термины) имеют такие же значения, которые общеприняты специалистами в этой области техники, к которым имеет отношение настоящее изобретение. Если определенно не указано другое определение, все используемые в описании термины следует истолковывать в том смысле, который согласуется как со значением в настоящем изобретении, так и в соответствующей области техники, однако не следует это идеализировать или воспринимать исключительно в формализованном смысле.
Варианты осуществления настоящего изобретения могут быть объяснены со ссылкой на принципиальную схему; однако в случае принципиальной схемы, эта схема может быть представлена в увеличенном масштабе для того, чтобы ясно объяснить изобретение.
Хотя такие термины, как первый и второй используются для выражения различных факторов, следует понимать, что эти факторы не ограничиваются такими терминами. Эти термины используются с единственной целью - отличать один фактор от другого, и например, возможно описать первый фактор как второй фактор, и аналогично, описать второй фактор как первый, без отклонения от объема настоящего изобретения.
В дальнейшем настоящее изобретение будет описано более подробно со ссылкой на примеры. Однако настоящее изобретение может быть осуществлено в различных вариантах, и следует понимать, что оно не ограничивается примерами, приведенными в описании.
Осуществление изобретения
Примеры
Пример 1. Химический синтез третьего домена овомукоида серебряного фазана (в дальнейшем может быть назван OMSVP3)
1. Химический синтез третьего домена овомукоида серебряного фазана, имеющего однородные аминокислотную последовательность и сахаридную цепочку.
Три фрагмента, которые показаны на фигуре 1, были синтезированы и затем каждый подвергали лигированию с использованием NCL для того, чтобы синтезировать третий домен овомукоида серебряного фазана, имеющего однородные аминокислотную последовательность и сахаридную цепочку. Фрагменты 1-3 показаны на фигурах 2-4.
Применяемые приборы
Спектры 1Н-ЯМР регистрировали с использованием AVANCE 600 (при частоте 600 МГц) фирмы Bruker Corporation. Для записи масс-спектров ESI использовали прибор Esquire 3000 plus. фирмы Brucker Daltonics Corporation.
Спектры КД регистрировали с использованием приборов J-820 и J-805 фирмы JASCO Corporation.
В качестве ВЭЖХ с обращенной фазой использовали аналитический прибор, произведенный фирмой Waters Corporation, и в качестве УФ-детектора использовали Waters 486, матричный фотодиодный детектор (Waters 2996), и Waters 2487, которые все произведены фирмой Waters Corporation, и в качестве колонки использовали колонку Cadenza (фирма Imtakt Corp., 3 мкм, 4,6×75 мм), VydacC-18 (5 мкм, 4.6×250 мм, 10×250 мм), Vydac-8 (5 мкм, 10×250 мм), и VydacC-4 (5 мкм, 4,6×250 мм).
Синтез фрагмента 1
В колонку для твердофазного синтеза помещают 2-хлоротритиловую смолу (143 мг, 200 микромоль), которую затем промывают достаточным количеством метилендихлорида (МДХ). Отдельно готовят раствор, содержащий Fmoc-Leu (212,1 мг, 0,6 ммоль) и диизопропилэтиламин (DIPEA; 272,1 мкл, 1,6 ммоль) в МДХ (1,2 мл), и выливают этот раствор в колонну для твердофазного синтеза с загруженной смолой; затем смесь перемешивают при комнатной температуре в течение двух часов. После перемешивания смолу промывают смесью МДХ:метанол:DIPEA=17:2:1, метилендихлоридом и ДМФА. В последующем удаляют защитную группу Fmoc с использованием 2 мл раствора 20% пиперидина в ДМФА, в течение 20 минут. Образовавшийся продукт промывают ДМФА, причем взаимодействие подтверждается тестом Kaiser Test. После этого проводят удлинение пептидной цепи путем последовательной конденсации аминокислот, с использованием описанного ниже метода.
Аминокислоту, имеющую аминогруппу, защищенную группой Fmoc и HOBt (135,1 мг, 1 ммоль), и диизопропилкарбодиимид (DIPCI; 153,9 мкл, 1 ммоль) растворяют в ДМФА (4 мл), и образовавшийся раствор активируют в течение 15 минут. Затем раствор выливают в колонну для твердофазного синтеза, с последующим перемешиванием при комнатной температуре в течение одного часа. После перемешивания смолу промывают МДХ и ДМФА. Удаляют защитную группу Fmoc с использованием раствора 20% пиперидина в ДМФА (2 мл) в течение 20 минут. Описанную выше процедуру повторяют с целью последовательной конденсации аминокислот. В качестве аминокислот, имеющих защищенную аминогруппу, используют Fmoc-Pro, Pmoc-Arg(Pbf), Fmoc-Tyr(трет-бутил), Fmoc-Glu(О-трет-бутил), Fmoc-Met, Fmoc-Thr(трет-бутил), Fmoc-Cys(Trt), Fmoc-Ala, Fmoc-Pro, Fmoc-Lys(Boc), Fmoc-Pro, Fmoc-Tyr(трет-бутил), Fmoc-Glu(O-трет-бутил), Fmoc-Ser(трет-бутил), Fmoc-Cys(Trt), Fmoc-Asp(O-трет-бутил), Fmoc-Val, Fmoc-Ser(трет-бутил), Fmoc-Val, Fmoc-Ala и Fmoc-Ala, и в качестве последней аминокислоты используют Вос-Leu-OH·H2O (249,3 мг, 1 ммоль), из которой защитную группу можно удалить с помощью кислоты. На этой твердофазной смоле получают пептид с 23-остатками, имеющий защитную группу, - Вос-Leu-Ala-Ala-Val-Ser(трет-бутил)-Val-Asp(O-трет-бутил)-Cys(Trt)-Ser(трет-бутил)-Glu(O-трет-бутил)-Tyr(трет-бутил)-Pro-Lys(Вос)-Pro-Ala-Cys(Trt)-Thr(трет-бутил)-Met-Glu(O-трет-бутил)-Tyr(трет-бутил)-Arg(Pbf)-Pro-Leu (SEQ ID NO:1). К образовавшемуся пептиду добавляют смесь - уксусная кислота: МДХ: метанол=5:4:1 (2 мл), затем перемешивают при комнатной температуре в течение трех часов. После перемешивания смолу отделяют путем фильтрации и промывают метанолом. Фильтрат добавляют в отдельно подготовленный гексан для кристаллизации. После фильтрации полученные таким образом кристаллы три раза обрабатывают азеотропной смесью с избыточным количеством бензола, и затем образовавшийся пептид подвергают лиофильной сушке (фигура 5, вверху. Примечание: измерение проведено после удаления защиты).
Полученный таким образом пептид (пептид с 23-остатками, имеющий защитную группу, как показано на SEQ ID NO:1) (39 мг, 10 микромоль), MS4A, бензилмеркаптан (35,5 мкл, 0,3 ммоль) перемешивают в растворе ДМФА (1,35 мл) в токе аргона при -20°С в течение одного часа. Впоследствии, к образовавшейся смеси добавляют бензотриазол-1-илокси-трис-пирролидинофосфоний гексафторфосфат (РуВОР; 26 мг, 50 микромоль) и DIPEA (8,5 мкл, 50 микромоль), и после этого перемешивают в течение двух часов. После перемешивания, в реакционную смесь добавляют избыточное количество диэтилового эфира для того, чтобы осадить соединение, затем следует фильтрация. Затем полученный таким образом осадок растворяют в ДМФА. Образовавшийся раствор концентрируют при пониженном давлении, и к концентрату добавляют раствор 95% ТФУ, 2,5% TIPS, и 2,5% Н2О (1 мл), после этого смесь перемешивают при комнатной температуре в течение двух часов (фигура 5, средняя хроматограмма). Образовавшуюся реакционный раствор концентрируют при пониженном давлении и затем очищают методом ВЭЖХ (колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин) для того, чтобы получить пептид с 23-остатками, имеющий на своем С-конце бензиловый сложный тиоэфир, который представляет собой Leu-Ala-Ala-Val-Ser-Val-Asp-Cys-Ser-Glu-Tyr-Pro-Lys-Pro-Ala-Cys-Thr-Met-Glu-Tyr-Arg-Pro-Leu-SBn (SEQ ID NO:2) (фигура 5, внизу).
Масс-спектрометрия с ионизацией распылением в электрическом поле (ESI-MS): Вычислено для C118H181N27O34S4: [М+2Н]2+ 1326,0. Найдено: 1325,8.
Синтез фрагмента 2
Затем, в отдельную колонну для твердофазного синтеза помещают смолу Амино-PEGA (продукт фирмы Merck) (1 г, 50 микромоль), которую промывают достаточным количеством метилендихлорида (МДХ) и ДМФА. Образовавшуюся смолу подвергают достаточному набуханию в ДМФА. Затем растворяют в 1 мл ДМФА 4-гидроксиметил-3-метоксифеноксимасляную кислоту (НМРВ) (0,125 ммоль), TBTU (0,125 ммоль), и N-этилморфолин (0,125 ммоль), и образовавшуюся смесь выливают в колонку, после этого смесь перемешивают при комнатной температуре в течение двух часов. Смолу промывают достаточным количеством ДМФА и МДХ, и протекание реакции подтверждают тестом Kaiser. Установлено, что эта смола является отрицательной (-) по тесту Kaiser, и ее подвергают набуханию в МДХ в течение одного часа. Получают смолу HMPB-PEGA, которую используют в качестве твердой матрицы для твердофазного синтеза.
Растворяют в МДХ (1 мл) Pmoc-Phe (96,9 мг, 0,25 ммоль), MSNT (74 мг, 0,25 ммоль) и N-метилимидазол (14,9 мкл, 0,188 ммоль), и образовавшуюся смесь выливают в колонку твердофазного синтеза, затем перемешивают при комнатной температуре в течение двух часов. После перемешивания смолу промывают метилендихлоридом и ДМФА, и защитные группы Fmoc удаляют путем обработки раствором 20% пиперидина в ДМФА (1 мл) в течение 20 минут. Образовавшийся продукт промывают диметилформамидом, и протекание реакции подтверждают тестом Kaiser. После этого проводят удлинение пептидной цепи путем последовательной конденсации аминокислот с использованием показанного ниже метода.
Аминокислоту, имеющую аминогруппу, защищенную группой Fmoc, и 1-гидроксибензотриазол (HOBt; 33,8 мг, 0,25 ммоль), и диизопропилкарбодиимид (38,5 мкл, 0,25 ммоль) растворяют в ДМФА (1 мл), и образовавшийся раствор активируют в течение 15 минут. После этого раствор выливают в колонну для твердофазного синтеза, с последующим перемешиванием при комнатной температуре в течение одного часа. После перемешивания смолу промывают МДХ и ДМФА. Удаляют защитную группу Fmoc с использованием раствора 20% пиперидина в ДМФА (1 мл) в течение 20 минут. Приведенную выше процедуру повторяют с целью последовательной конденсации аминокислот. В качестве аминокислоты, имеющей защищенную аминогруппу, используют Fmoc-Asn, Fmoc-Cys(Trt), Fmoc-Lys(Boc), Fmoc-Asn, Fmoc-Gly, Fmoc-Tyr(трет-бутил), Fmoc-Thr(трет-бутил) и Fmoc-Lys(Boc), и получают пептид с девятью остатками, имеющий защитную группу, который представляет собой Fmoc-Lys(Boc)-Thr(трет-бутил)-Tyr(трет-бутил)-Gly-Asn-Lys(Boc)-Cys(Trt)-Asn-Phe (SEQ ID NO:3) на твердофазной смоле. Затем эквивалент пептида (3 микромоль) с 9-остатками на твердофазной смоле переносят на другую колонку твердофазного синтеза, и защитные группы Fmoc удаляют, используя раствор 20% пиперидина в ДМФА (1 мл) в течение 20 минут. Эту смолу промывают достаточным количеством ДМФА и переносят в эппендорфовскую пробирку. Впоследствии растворяют аспарагин-связанную сахаридную цепочку, представленную следующей ниже формулой (1) (12 мг, 6 микромоль), и 3-диэтоксифосфорилокси-1,2,3-бензотриазин-4(3Н)-он (DEPBT; 3 мг, 10 микромоль) в 0,20 мл смеси ДМФА:ДМСО=4:1, и образовавшуюся смесь переносят в эппендорфовскую пробирку. В эту пробирку добавляют DIPEA (1,02 мкл, 6 микромоль), затем перемешивают при комнатной температуре в течение 20 часов.
Формула 6
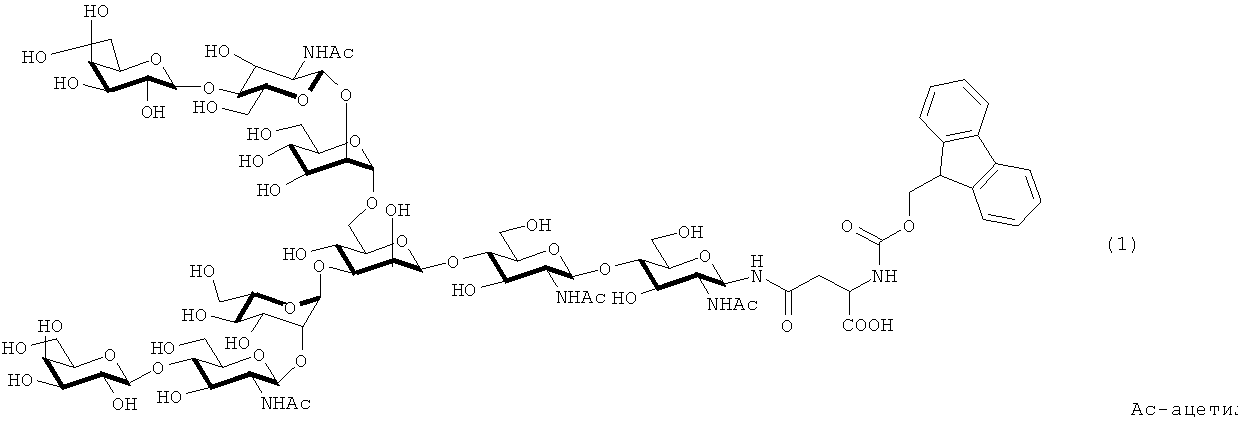
После перемешивания смолу переносят в колонку твердофазного синтеза и промывают МДХ и ДМФА. Защитные группы Fmoc удаляют путем обработки раствором 20% пиперидина в ДМФА (1 мл) в течение 20 минут. Образовавшийся продукт промывают ДМФА. После этого проводят удлинение гликопептидной цепи путем последовательной конденсации аминокислот, используя показанный ниже метод. Аминокислоту, имеющую аминогруппу, защищенную группой Fmoc, и HOBt (2 мг, 0,015 ммоль), и DIPCI (2,3 мкл, 0,015 ммоль) растворяют в ДМФА (0,375 мл), и образовавшийся раствор активируют в течение 15 минут. Затем этот раствор выливают в колонну для твердофазного синтеза, и после этого смесь перемешивают при комнатной температуре в течение двух часов. После перемешивания смолу промывают МДХ и ДМФА. Удаляют защитную группу Fmoc с использованием раствора 20% пиперидина в ДМФА (1 мл) в течение 20 минут. Описанную выше процедуру повторяют с целью последовательной конденсации аминокислот. В качестве аминокислот, имеющих защищенную аминогруппу, используют Fmoc-Asp(O-трет-бутил), Fmoc-Ser(трет-бутил), Fmoc-Gly, и Boc-Cys(Thz), и получают гликозилированный пептид с 14-остатками, имеющий защитную группу, который представляет собой Вос-Cys(Thz)-Gly-Ser(трет-бутил)-Asp(O-трет-бутил)-Asn(олигосахарид)-Lys(Вос)-Thr(трет-бутил)-Tyr(трет-бутил)-Gly-Asn-Lys(Boc)-Cys(Trt)-Asn-Phe (SEQ ID NO:4) на твердофазной смоле. К гликозилированному пептиду добавляют 1 мл смеси уксусной кислоты и трифторэтанола (1:1), затем перемешивают при комнатной температуре в течение 20 часов. Смолу удаляют с помощью фильтрации и промывают метанолом, и фильтрат концентрируют при пониженном давлении. Концентрированный фильтрат подвергают тройной азеотропной перегонке с бензолом. Полученный таким образом остаток растворяют и затем подвергают сублимационной сушке (фигура 6, вверху. Примечание: измерение проведено после удаления защиты).
Полученный таким образом пептид (гликозилированный пептид с 14-остатками, имеющий защитную группу, как показано в SEQ ID NO:4) (11,7 мг, 3 микромоль), MS4A (10 мг), и бензилмеркаптан (10,6 мкл, 0,09 ммоль) перемешивают в растворе ДМФА (0,41 мл) в токе аргона при -20°С в течение одного часа. Впоследствии, к образовавшейся смеси добавляют РуВОР (7,8 мг, 15 микромоль) и DIPEA (2,6 мкл, 15 микромоль), смесь перемешивают в течение двух часов. После перемешивания в реакционный раствор добавляют избыточное количество диэтилового эфира, чтобы осадить соединение, затем следует фильтрация. Затем полученный таким образом осадок растворяют в ДМФА. Образовавшийся раствор концентрируют при пониженном давлении, добавляют к нему раствор 95% ТФУ, 2,5% TIPS и 2,5% H2O (1 мл), затем следует перемешивание при комнатной температуре в течение двух часов (фигура 6, средняя хроматограмма). Образовавшийся реакционный раствор концентрируют при пониженном давлении и затем очищают методом ВЭЖХ (колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут, при скорости потока 1,0 мл/мин), чтобы получить гликозилированный пептид с 14-остатками, имеющий бензиловый сложный тиоэфир на своем С-конце, который представляет собой Cys(Thz)-Gly-Ser-Asp-Asn(олигосахарид)-Lys-Thr-Tyr-Gly-Asn-Lys-Cys-Asn-Phe-SBn (SEQ ID NO:5) (фигура 6, внизу).
ESI-MS: Вычислено для C133H203N23O67S3: [M+2H]2+ 1647,1. Найдено: 1646,6
Синтез фрагмента 3
В колонку твердофазного синтеза помещают 2-хлоротритиловую смолу (200 микромоль), которую затем промывают достаточным количеством метилендихлорида (МДХ). Отдельно готовят раствор МДХ (1,2 мл), содержащий Fmoc-Cys(Trt) (351,4 мг, 0,6 ммоль) и диизопропилэтиламин (DIPEA; 272,1 мкл, 1,6 ммоль), и выливают этот раствор в колонну для твердофазного синтеза с загруженной смолой; затем смесь перемешивают при комнатной температуре в течение двух часов. После перемешивания смолу промывают смесью МДХ:метанол:DIPEA=17:2:1, метилендихлоридом и ДМФА. В последующем удаляют защитную группу Fmoc с использованием 2 мл раствора 20% пиперидина в ДМФА, в течение 20 минут. Образовавшийся продукт промывают ДМФА, причем взаимодействие подтверждается тестом Kaiser. После этого проводят удлинение пептидной цепи путем последовательной конденсации аминокислот, с использованием описанного ниже метода.
Аминокислоту, имеющую аминогруппу, защищенную группой Fmoc, и HOBt (135,1 мг, 1 ммоль) и DIPCI (153,9 мкл, 1 ммоль) растворяют в ДМФА (4 мл) и образовавшийся раствор активируют в течение 15 минут. После этого раствор выливают в колонну для твердофазного синтеза, затем следует перемешивание при комнатной температуре в течение одного часа. После перемешивания смолу промывают МДХ и ДМФА. Защитные группы Fmoc удаляют путем обработки раствором 20% пиперидина в ДМФА (2 мл) в течение 20 минут. Приведенную выше процедуру повторяют с целью последовательной конденсации аминокислот. В качестве аминокислоты, имеющей защищенную аминогруппу, используют Fmoc-Lys(Boc), Fmoc-Gly, Fmoc-Phe, Fmoc-His(Trt), Fmoc-Ser(трет-бутил), Fmoc-Leu, Fmoc-Thr(трет-бутил), Fmoc-Leu, Fmoc-Thr(трет-бутил), Fmoc-Gly, Fmoc-Asn, Fmoc-Ser(трет-бутил), Fmoc-Glu(O-трет-бутил), Fmoc-Val, Fmoc-Val, Fmoc-Ala, Fmoc-Asn, и Fmoc-Cys(Trt), и получают пептид с 19-остатками, имеющий защитную группу, который представляет собой Cys(Trt)-Asn-Ala-Val-Val-Glu(O-трет-бутил)-Ser(трет-бутил)-Asn-Gly-Thr(трет-бутил)-Leu-Thr(трет-бутил)-Leu-Ser(трет-бутил)-His(Trt)-Phe-Gly-Lys(Boc)-Cys(Trt) (SEQ ID NO:6) на твердофазной смоле. К пептиду добавляют раствор 95% ТФУ, 2,5% TIPS и 2,5% Н2О (3 мл), затем следует перемешивание при комнатной температуре в течение двух часов. Впоследствии, смолу удаляют путем фильтрации, и фильтрат концентрируют при пониженном давлении (фигура 7, верхняя хроматограмма). Концентрированный фильтрат очищают методом ВЭЖХ (колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин), чтобы получить пептид с 19-остатками, который представляет собой Cys-Asn-Ala-Val-Val-Glu-Ser-Asn-Gly-Thr-Leu-Thr-Leu-Ser-His-Phe-Gly-Lys-Cys (SEQ ID NO:7) (фигура 7, внизу).
ESI-MS: Вычислено для C83H134N24O28S2: [M+2H]2+ 991,1. Найдено: 991,0
Лигирование фрагментов 2 и 3 методом NCL
Два типа пептидов, а именно 1,9 мг (1 микромоль) фрагмента 3 (пептид с 19-остатками, как показано в SEQ ID NO:7) и 3,2 мг (1 микромоль) фрагмента 2 (гликозилированный пептид с 14-остатками и защитной группой, имеющий бензиловый сложный тиоэфир на своем С-конце, как показано на фигуре 5), помещают в такую же эппендорфовскую пробирку и растворяют в 485 мкл 0,1% фосфатного буфера (рН 7,5, содержащий 6М гидрохлорида гуанидина). Впоследствии, в образовавшуюся смесь добавляют тиофенол (15 мкл) при 25°С, и обеспечивают протекание реакции при комнатной температуре (0 час на фигуре 8). Спустя 24 часа, завершение реакции подтверждается методом ВЭЖХ (24 час на фигуре 8). Впоследствии, реакционную смесь очищают методом ВЭЖХ (Колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин) (фигура 8, после очистки). Затем образовавшийся пептид подвергают лиофильной сушке, чтобы получить гликозилированный пептид с 33-остатками, имеющий защитную группу, который представляет собой Cys(Thz)-Gly-Ser-Asp-Asn(олигосахарид)-Lys-Thr-Tyr-Gly-Asn-Lys-Cys-Asn-Phe-Cys-Asn-Ala-Val-Val-Glu-Ser-Asn-Gly-Thr-Leu-Thr-Leu-Ser-His-Phe-Gly-Lys-Cys (SEQ ID NO:8).
ESI-MS: Вычислено для C209H329N47O95S4: [M+4H]4+ 1287,28. Найдено: 1287,6
Полученный таким образом пептид (гликозилированный пептид с 33-остатками, имеющий защитную группу, как показано в SEQ ID NO:8) растворяют в 0,2 М водном растворе метоксиамина (рН=4,0). Спустя четыре часа, завершение реакции подтверждается методом ВЭЖХ, и образовавшийся продукт очищают методом ВЭЖХ (Колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин) (фигура 8, удалена защитная тиазолиновая группа). После этого образовавшийся пептид подвергают лиофильной сушке, чтобы получить гликозилированный пептид с 33-остатками, который представляет собой Cys-Gly-Ser-Asp-Asn(олигосахарид)-Lys-Thr-Tyr-Gly-Asn-Lys-Cys-Asn-Phe-Cys-Asn-Ala-Val-Val-Glu-Ser-Asn-Gly-Thr-Leu-Thr-Leu-Ser-His-Phe-Gly-Lys-Cys (SEQ ID NO:9).
ESI-MS: Вычислено для C208H329N47O95S4: [М+4Н]4+ 1284,28. Найдено: 1284,5
Гликозилированный пептид с 33-остатками, который показан в SEQ ID NO:9, получают аналогичным образом, в следующих условиях.
Каждый из двух типов пептидов, а именно 1,9 мг (1 микромоль) фрагмента 3 (пептид с 19-остатками, как показано в SEQ ID NO:7) и 3,2 мг (1 микромоль) фрагмента 2 (гликозилированный пептид с 14-остатками, имеющий защитную группу и бензиловый сложный тиоэфир на своем С-конце, как показано на фигуре 5), помещают в отдельные эппендорфовские пробирки и растворяют в 247,5 мкл 0,1% фосфатного буфера (рН 7,5, содержит 6М гидрохлорид гуанидина). Затем содержимое пробирок объединяют в одной эппендорфовской пробирке. Впоследствии, добавляют 1% тиофенола (5 мкл) в образовавшуюся смесь при 25°С, и обеспечивают протекание реакции при комнатной температуре. Протекание реакции прослеживают методами ВЭЖХ и масс-спектрометрии, и исчезновение фрагмента 3 подтверждается методом ВЭЖХ через семь часов. После этого добавляют 0,2 М водный раствор метоксиамина, доводя значение рН системы приблизительно до 4, чтобы удалить защиту у N-концевого цистеина (Cys). Через 6 часов завершение реакции подтверждается масс-спектрометрически, и образовавшийся реакционный раствор очищают методом ВЭЖХ (Колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10 градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин). Образовавшийся пептид подвергают лиофильной сушке, чтобы получить гликозилированный пептид с 33-остатками, как показано в SEQ ID NO:9.
ESI-MS: Вычислено для C208H329N47O95S4: [M+4H]4+ 1284,28. Найдено: 1284,5
Лигирование фрагмента 1 и фрагментов 2 и 3 методом NCL
Два типа пептидов, а именно 1,3 мг (0,25 микромоль) гликозилированного пептида с 33-остатками, приготовленного дотированием фрагментов 2 и 3, и 1,3 мг (0,50 микромоль) фрагмента 1 (пептид с 23-остатками, имеющий бензиловый сложный тиоэфир на своем С-конце, как показано в SEQ ID NO:2), помещают в одну эппендорфовскую пробирку и растворяют в 485 мкл 0,1% фосфатного буфера (рН 7,5, содержит 8 М гидрохлорида гуанидина). Впоследствии, добавляют в образовавшуюся смесь тиофенол (15 мкл) при 25°С, и обеспечивают протекание реакции при комнатной температуре (0 час на фигуре 9). Спустя 54 часа, завершение реакции подтверждается методом ВЭЖХ (54 часа на фигуре 9). Впоследствии, реакционный раствор очищают методом ВЭЖХ (Колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин) (фигура 9, внизу). Затем образовавшийся пептид подвергают лиофильной сушке, чтобы получить гликозилированный пептид с 56-остатками: Leu-Ala-Ala-Val-Ser-Val-Asp-Cys-Ser-Glu-Tyr-Pro-Lys-Pro-Ala-Cys-Thr-Met-Glu-Tyr-Arg-Pro-Leu-Cys-Gly-Ser-Asp-Asn(олигосахарид)-Lys-Thr-Tyr-Gly-Asn-Lys-Cys-Asn-Phe-Cys-Asn-Ala-Val-Val-Glu-Ser-Asn-Gly-Thr-Leu-Thr-Leu-Ser-His-Phe-Gly-Lys-Cys (SEQ ID NO:10).
ESI-MS: Вычислено для C319H502N74O129S7: [М+5Н]5+ 1532,46. Найдено: 1532,7
Кроме того, гликозилированный пептид с 56-остатками (SEQ ID NO:10) получают аналогично в следующих условиях.
Каждый из двух типов пептидов, а именно 1,3 мг (0,25 микромоль) гликозилированного пептида с 33-остатками, как показано в SEQ ID NO:9, и 1,3 мг (0,50 микромоль) фрагмента 1 (пептид с 23-остатками, имеющий бензиловый сложный тиоэфир на своем С-конце, как показано в SEQ ID NO:2), помещают в отдельные эппендорфовские пробирки и растворяют в 247,5 мкл 0,1% фосфатного буфера (рН 7,5, содержит 8М гидрохлорида гуанидина). Затем содержимое, пробирок объединяют в одной эппендорфовской пробирке. Протекание реакции прослеживают методами ВЭЖХ и масс-спектрометрии, и спустя 30 часов, образовавшийся реакционный раствор очищают методом ВЭЖХ (Колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин).
Укладывание гликопротеина
В эппендорфовскую пробирку переносят 0,5 мг (65,2 наномоль) гликозилированного пептида с 56-остатками (SEQ ID NO:10), приготовленного, как описано выше, затем этот пептид растворяют в 100 мкл 0,6М трис-буфера (рН=8,7, содержит 0,6 М гидрохлорида гуанидина и 6 ммоль/л ЭДТА). Образовавшуюся смесь разбавляют 500 мкл дистиллированной воды для того, чтобы сложить гликозилированный третий домен овомукоида.
Фракционирование методом ВЭЖХ
Спустя 36 часов, развитие реакции подтверждается методом ВЭЖХ и масс-спектрометрии, и образовавшийся продукт очищают методом ВЭЖХ (Колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин). В результате получают четыре фракции А - D, содержащие гликозилированный пептид с 56-остатками, имеющий структуру высшего порядка Leu-Ala-Ala-Val-Ser-Val-Asp-Cys-Ser-Glu-Tyr-Pro-Lys-Pro-Ala-Cys-Thr-Met-Glu-Tyr-Arg-Pro-Leu-Cys-Gly-Ser-Asp-Asn(олигосахарид)-Lys-Thr-Tyr-Gly-Asn-Lys-Cys-Asn-Phe-Cys-Asn-Ala-Val-Val-Glu-Ser-Asn-Gly-Thr-Leu-Thr-Leu-Ser-His-Phe-Gly-Lys-Cys (SEQ ID NO:10) (фигура 10). [0133] ESI-MS: Вычислено для C319H502N74O129S7: [M+5H]5+ 1532,2. [M+4H]4+ 1915,0. [М+3Н]3+ 2553,0.
А; Найдено: 1532,5, 1915,2, 2553,2
В; Найдено: 1532,5, 1915,2,2553,2
С; Найдено: 1532,6, 1915,3, 2553,2
D; Найдено: 1532,7, 1915,4, 2553,3
Сдвиг пика и уменьшение массы от нижней части фигуры 9 до фигуры 10 указывает на образование дисульфидной связи в ходе вышеупомянутой стадии укладывания.
Время взаимодействия можно изменить соответствующим образом (например, 24 часа) путем слежения за реакцией методами ВЭЖХ и масс-спектрометрии и подтверждения изменения молекулярной массы и изменения времени удерживания пика по данным масс-спектрометрии и ВЭЖХ, соответственно.
Измерение ЯМР-спектра фракции В:
После сублимационной сушки фракцию В растворяют в 5% D2O/H2O (300 мкл) и 2D спектр TOCSY (двумерный ЯМР всех сопряженных протонов в системе спинов полисахаридов) регистрируют при 25°С, 60 мс, и 600 МГц. Полученный спектр ЯМР показан на фигуре 11.
Запись спектра КД для фракции В: сублимационно высушенную фракцию В растворяют в дистиллированной воде и проводят запись спектра КД. В качестве прибора используют J-820 фирмы JASCO Corporation. Измерение проводят в спектральном диапазоне от 180 нм до 260 нм. Полученный спектр КД показан на фигуре 12.
Данные фигуры 11 подтверждают, что гликопептид, имеющий такую же структуру высшего порядка, может быть получен в очень чистом виде только путем выделения ВЭЖХ.
2. Химический синтез негликозилированного третьего домена овомукоида серебряного фазана
Так же, как в примерах, был синтезирован каждый из трех фрагментов и затем фрагменты лигировали методом NCL, чтобы синтезировать негликозилированный третий домен овомукоида серебряного фазана. Фрагменты 1 и 3 были синтезированы так же, как в примерах. Как показано на фигуре 14, фрагмент, соответствующий фрагменту 2 в примерах (в последующем называется "фрагмент 2"), не имеет сахаридной цепочки, как в сравнительном примере.
Синтез фрагмента 2'
В колонку для твердофазного синтеза помещают 2-хлоротритиловую смолу (143 мг, 200 микромоль), которую затем промывают достаточным количеством метилендихлорида (МДХ). Отдельно готовят раствор Fmoc-Phe (232,4 мг, 0,6 ммоль) и диизопропилэтиламин (DIPEA; 272,1 мкл, 1,6 ммоль) в МДХ (1,2 мл), и выливают этот раствор в колонку для твердофазного синтеза с загруженной смолой; затем смесь перемешивают при комнатной температуре в течение двух часов. После перемешивания смолу промывают смесью МДХ:метанол:DIPEA=17:2:1, метилендихлоридом и ДМФА. В последующем удаляют защитную группу Fmoc путем обработки 2 мл раствора 20% пиперидина в ДМФА, в течение 20 минут. Образовавшийся продукт промывают ДМФА, причем взаимодействие подтверждается тестом Kaiser. После этого проводят удлинение пептидной цепи путем последовательной конденсации аминокислот, с использованием описанного ниже метода.
Аминокислоту, имеющую аминогруппу, защищенную группой Fmoc и HOBt (135,1 мг, 1 ммоль), и диизопропилкарбодиимид (DIPCI; 153,9 мкл, 1 ммоль) растворяют в ДМФА (0,4 мл), и образовавшийся раствор активируют в течение 15 минут. Затем раствор выливают в колонку для твердофазного синтеза, с последующим перемешиванием при комнатной температуре в течение одного часа. После перемешивания смолу промывают МДХ и ДМФА. Удаляют защитную группу Fmoc путем обработки раствором 20% пиперидина в ДМФА (1 мл) в течение 20 минут. Описанную выше процедуру повторяют с целью последовательной конденсации аминокислот. В качестве аминокислот, имеющих защищенную аминогруппу, используют Fmoc-Asn, Fmoc-Cys(Trt), Fmoc-Lys(Boc), Fmoc-Asn, Fmoc-Gly, Fmoc-Tyr(трет-бутил), Fmoc-Thr(трет-бутил), Fmoc-Lys(Boc), Fmoc-Asn, Fmoc-Asp(O-трет-бутил), Fmoc-Ser(трет-бутил), и Fmoc-Gly, и в качестве последней аминокислоты используют Boc-Cys(Thz)-OH (233,3 мг, 1 ммоль), из которой защитную группу можно удалить с помощью кислоты. На этой твердофазной смоле получают пептид с 14-остатками, имеющий защитную группу Boc-Cys(Thz)-Gly-Ser(трет-бутил)-Asp(O-трет-бутил)-Asn-Lys(Boc)-Thr(трет-бутил)-Tyr(трет-бутил)-Gly-Asn-Lys(Boc)-Cys(Trt)-Asn-Phe (SEQ ID NO:11). К образовавшемуся пептиду добавляют смесь уксусная кислота:МДХ:метанол=5:4:1 (2 мл), затем перемешивают при комнатной температуре в течение трех часов. После перемешивания смолу отделяют путем фильтрации и промывают метанолом. Фильтрат концентрируют при пониженном давлении. Концентрированный фильтрат подвергают тройной азеотропной перегонке с избыточным количеством бензола, и затем образовавшийся пептид подвергают лиофильной сушке (фигура 15, верхняя хроматограмма. Примечание: измерение проведено после удаления защиты).
Полученный таким образом пептид (110 мг, 50 микромоль; пептид с 14-остатками, имеющий защитную группу, как показано в SEQ ID NO:11), MS4A (10 мг), бензилмеркаптан (177,4 мкл, 1,5 ммоль) в растворе ДМФА (6,8 мл) перемешивают в токе аргона при -20°С в течение одного часа. Впоследствии, в образовавшуюся смесь добавляют РуВОР (130 мг, 250 микромоль) и DIPEA (42,5 мкл, 250 микромоль), затем перемешивают в течение двух часов. После перемешивания добавляют избыточное количество диэтилового эфира в реакционный раствор, чтобы осадить соединение, затем следует фильтрация. Впоследствии, полученный таким образом осадок растворяют в ДМФА. Образовавшийся раствор концентрируют при пониженном давлении, к концентрату добавляют раствор 95% ТФУ, 2,5% TIPS и 2,5% H2O (5 мл), затем перемешивают при комнатной температуре в течение двух часов (фигура 15, средняя хроматограмма). Образовавшийся реакционный раствор концентрируют при пониженном давлении и затем очищают методом ВЭЖХ (Колонка Cadenza CD 18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 9%→27%) в течение 15 минут при скорости потока 1,0 мл/мин) чтобы получить 269,6 мг пептида с 14-остатками и с защитной группой, имеющего бензиловый сложный тиоэфир на своем С-конце, который представляет собой Cys(Thz)-Gly-Ser-Asp-Asn-Lys-Thr-Tyr-Gly-Asn-Lys-Cys-Asn-Phe-SBn (SEQ ID NO:12) (фигура 15, внизу).
ESI-MS: Вычислено для C71H101N19O22S3: [M+2H]2+ 834,8, Найдено: 834,7
Лигирование фрагмента 2' и фрагмента 3 методом NCL
Два типа пептидов, а именно 1,6 мг (0,96 микромоль) фрагмента 2', приготовленного выше (пептид с 14-остатками, с защитной группой, имеющий бензиловый сложный тиоэфир на своем С-конце, как показано в SEQ ID NO:12), и 1,9 мг (0,96 микромоль) фрагмента 3, синтезированного в примерах, помещают в одну эппендорфовскую пробирку и растворяют в 495 мкл 0,1% фосфатного буфера (рН 7,5, содержит 6М гидрохлорида гуанидина). Впоследствии, добавляют в образовавшуюся смесь тиофенол (5 мкл) и обеспечивают протекание реакции при комнатной температуре (0 час на фигуре 16). Спустя 18 часов, завершение реакции подтверждается методом ВЭЖХ (18 час на фигуре 9). Впоследствии, реакционный раствор очищают методом ВЭЖХ (Колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин) (фигура 16, после очистки). Затем образовавшийся пептид подвергают лиофильной сушке, чтобы получить пептид с 33-остатками, имеющий защитную группу, который представляет собой Cys(Thz)-Gly-Ser-Asp-Asn-Lys-Thr-Tyr-Gly-Asn-Lys-Cys-Asn-Phe-Cys-Asn-Ala-Val-Val-Glu-Ser-Asn-Gly-Thr-Leu-Thr-Leu-Ser-His-Phe-Gly-Lys-Cys (SEQ ID NO:13).
ESI-MS: Вычислено для C147H227N43O50S4: [М+3Н]3+ 1175,9. Найдено: 1175,4
Полученный таким образом пептид с 33-остатками, имеющий защитную группу, растворяют в 0,2М водном растворе метоксиамина (рН=4,0). Спустя четыре часа, завершение реакции подтверждается методом ВЭЖХ, и образовавшийся продукт очищают методом ВЭЖХ (Колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин) (фигура 16, удалена защитная тиазолиновая группа). После этого образовавшийся пептид подвергают лиофильной сушке, чтобы получить пептид с 33-остатками Cys-Gly-Ser-Asp-Asn-Lys-Thr-Tyr-Gly-Asn-Lys-Cys-Asn-Phe-Cys-Asn-Ala-Val-Val-Glu-Ser-Asn-Gly-Thr-Leu-Thr-Leu-Ser-His-Phe-Gly-Lys-Cys (SEQ ID NO:14).
ESI-MS: Вычислено для C146H227N43O50S4: [M+3H]3+ 1171,9. Найдено: 1171,5
Кроме того, аналогично получают пептид с 33-остатками, как показано в SEQ ID NO:14, в следующих условиях.
Каждый из двух типов пептидов, а именно 1,6 мг (0,96 микромоль) фрагмента 2' (пептид с 14-остатками, имеющий бензиловый сложный тиоэфир на своем С-конце, как показано в SEQ ID NO:12) и 1,9 мг (0,96 микромоль) фрагмента 3, синтезированного в примерах, помещают в отдельные эппендорфовские пробирки и растворяют в 247,5 мкл 0,1% фосфатного буфера (рН 7,5, содержит 6М гидрохлорида гуанидина). Затем содержимое пробирок объединяют в одной эппендорфовской пробирке. Впоследствии, добавляют 1% тиофенола (5 мкл) в образовавшуюся смесь и обеспечивают протекание реакции при комнатной температуре. Протекание реакции прослеживают методами ВЭЖХ и масс-спектрометрии, и исчезновение фрагмента 3 подтверждается методом ВЭЖХ через шесть часов. После этого добавляют 0,2М водный раствор метоксиамина, доводя значение рН системы приблизительно до 4, чтобы удалить защиту у N-концевого цистеина (Cys). Через 6 часов завершение реакции подтверждается масс-спектрометрически, и образовавшийся реакционный раствор очищают методом ВЭЖХ (Колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10 градиент А:В=80:20 → 40:60 (градиент ацетонитрила; 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин).
ESI-MS: Вычислено для C146H227N43O50S4: [M+3H]3+ 1171,9. Найдено: 1171,5
Лигирование фрагмента 1 и фрагментов 2' и 3 методом NCL
Два типа пептидов, а именно 0,6 мг (0,17 микромоль) пептида с 33-остатками, полученного, как описано выше, и 1,1 мг (0,41 микромоль) фрагмента 1, синтезированного в примерах (пептид с 23-остатками, имеющий бензиловый сложный тиоэфир на своем С-конце, как показано в SEQ ID NO:2), помещают в одну эппендорфовскую пробирку и растворяют в 485 мкл 0,1% фосфатного буфера (рН 7,5, содержит 8М гидрохлорида гуанидина). Впоследствии, добавляют в образовавшуюся смесь тиофенол (15 мкл), и обеспечивают протекание реакции при комнатной температуре (0 час на фигуре 17). Спустя 45 часов, завершение реакции подтверждается методом ВЭЖХ (45 часов на фигуре 17). Затем реакционный раствор очищают методом ВЭЖХ (Колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин). Затем образовавшийся пептид подвергают лиофильной сушке, чтобы получить пептид с 56-остатками:
Leu-Ala-Ala-Val-Ser-Val-Asp-Cys-Ser-Glu-Tyr-Pro-Lys-Pro-Ala-Cys-Thr-Met-Glu-Tyr-Arg-Pro-Leu-Cys-Gly-Ser-Asp-Asn-Lys-Thr-Tyr-Gly-Asn-Lys-Cys-Asn-Phe-Cys-Asn-Ala-Val-Val-Glu-Ser-Asn-Gly-Thr-Leu-Thr-Leu-Ser-His-Phe-Gly-Lys-Cys (SEQ ID NO:15) (фигура 17, внизу).
ESI-MS: Вычислено для C257H400N70O84S7: [М+4H]4+ 1510,7. Найдено: 1510,6
Кроме того, указанный пептид с 56-остатками, который показан в SEQ ID NO:15, получен аналогично в следующих условиях.
Каждый из двух типов пептидов, а именно 0,6 мг (0,17 микромоль) пептида с 33-остатками, который показан в SEQ ID NO:14, и 1,1 мг (0,41 микромоль) фрагмента 1 (пептид с 23-остатками, имеющий бензиловый сложный тиоэфир на своем С-конце, как показано в SEQ ID NO:2) помещают в отдельные эппендорфовские пробирки и растворяют в 247,5 мкл 0,1% фосфатного буфера (рН 7,5, содержит 8М гидрохлорида гуанидина). Затем содержимое пробирок объединяют в одной эппендорфовской пробирке. Впоследствии, добавляют 1% тиофенола (5 мкл) в образовавшуюся смесь и обеспечивают протекание реакции при комнатной температуре. Протекание реакции прослеживают методами ВЭЖХ и масс-спектрометрии, и через 30 часов образовавшийся реакционный раствор очищают методом ВЭЖХ (Колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10 градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин). Образовавшийся продукт подвергают лиофильной сушке, чтобы получить пептид с 56-остатками, как показано в SEQ ID NO:15.
ESI-MS: Вычислено для C257H400N70O84S7: [M+4H]4+ 1510,7. Найдено: 1510,6
Укладывание белка
В эппендорфовскую пробирку переносят 0,4 мг (66,2 нмоль) пептида с 56-остатками (SEQ ID NO:15), полученного как показано выше, который затем растворяют в 100 мкл 0,6М трис-буфера (рН=8,7, содержит 0,6 М гидрохлорида гуанидина и 6 мм ЭДТА). Образовавшуюся смесь разбавляют 500 мкл дистиллированной воды, с целью укладывания негликозилированного третьего домена овомукоида.
Фракционирование методом ВЭЖХ
Спустя 36 часов, развитие реакции подтверждается методом ВЭЖХ и масс-спектрометрии, и образовавшийся продукт очищают методом ВЭЖХ (Колонка Cadenza CD18 (Imtakt Inc.), 3 мм, 75×4,6 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10 градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 15 минут при скорости потока 1,0 мл/мин). В результате получают четыре фракции от Е до Н, содержащие пептид с 56-остатками, имеющий структуру высшего порядка Leu-Ala-Ala-Val-Ser-Val-Asp-Cys-Ser-Glu-Tyr-Pro-Lys-Pro-Ala-Cys-Thr-Met-Glu-Tyr-Arg-Pro-Leu-Cys-Gly-Ser-Asp-Asn-Lys-Thr-Tyr-Gly-Asn-Lys-Cys-Asn-Phe-Cys-Asn-Ala-Val-Val-Glu-Ser-Asn-Gly-Thr-Leu-Thr-Leu-Ser-His-Phe-Gly-Lys-Cys (SEQ ID NO:15) (фигура 18).
ESI-MS: Вычислено для C257H394N70O84S7: [M+5Н]5+ 1207,5, [M+4H]4+ 1509,1, [М+3Н]3+ 2011,9.
Е; Найдено: 1207,7, 1509,3,2012,0
F; Найдено: 1207,6, 1509,3, 2012,0
G; Найдено: 1207,7, 1509,3, 2012,0
Н; Найдено: 1207,8, 1509,3, 2012,0
Сдвиг пика и уменьшение массы с нижней части фигуры 17 до фигуры 18 указывает на образование дисульфидной связи в ходе вышеупомянутой стадии укладывания.
Время взаимодействия можно изменить соответствующим образом (например, 24 часа) путем слежения за реакцией методами ВЭЖХ и масс-спектрометрии и подтверждения изменения молекулярной массы и изменения времени удерживания пика по данным масс-спектрометрии и ВЭЖХ, соответственно.
Измерение ЯМР-спектра фракции:
После сублимационной сушки фракцию F растворяют в 5% D2O/H2O (300 мкл) и 2D спектр TOCSY (двумерный ЯМР всех сопряженных протонов в системе спинов полисахаридов) регистрируют при 25°С, 80 мс, и 600 МГц. Полученный спектр ЯМР показан на фигуре 19.
Запись спектра КД для фракции F: сублимационно высушенную фракцию В растворяют в дистиллированной воде и проводят запись спектра КД. Используют прибор J-820 фирмы JASCO Corporation. Измерение проводят в спектральном диапазоне от 180 нм до 260 нм. Полученный спектр КД показан на фигуре 20.
Данные фигуры 19 подтверждают, что гликопептид, имеющий такую же структуру высшего порядка, может быть получен в очень чистом виде только путем выделения ВЭЖХ.
Получение калибровочной кривой для фракции F
Фракцию F (1 мг) растворяют в 0,1 М фосфатного буфера (рН 8,0), содержащего BSA (бычий сывороточный альбумин 0,1 мг/мл). Образовавшийся раствор разбавляют, чтобы приготовить фрагмент F, имеющий концентрации 165 мкМ, 82,5 мкМ, 41,3 мкМ и 20,6 мкМ. Для раствора каждой концентрации измеряют 3 раза оптическую плотность (OD) при 280 нм. Полученные таким образом усредненные значения приведены в таблице 1 и на фигуре 22.
|
Пример 2. Измерение физиологической активности
Измерение физиологической активности гликозилированного OMSVP3 (фракции А - D)
Готовят раствор фермента в 0,1 М фосфатного буфера (рН=8,0, содержит 0,01% α-химотрипсина и 0,01% бычьего сывороточного альбумина) и раствор субстрата в 0,1 М фосфатного буфера (рН=8,0, содержит 517 мкМ пептида с 14-остатками, имеющего защитную группу; синтезирован в сравнительном примере 1 (будет приведен ниже) (SEQ ID NO:16) и 0,01% бычьего сывороточного альбумина), и переносят 20 мкл каждого раствора в эппендорфовскую пробирку. Каждую фракцию А - D, полученную в примере 1, подвергают лиофильной сушке и растворяют в 0,1 М фосфатного буфера (рН=8,0, содержит 0,01% бычьего сывороточного альбумина), и измеряют значение OD280 каждого полученного раствора с целью приготовления растворов проб с постоянной концентрацией белка. Затем 20 мкл каждого раствора пробы добавляют в приготовленный выше раствор и определяют ингибирующую активность. В этом эксперименте, в конце реакции были получены следующие концентрации: концентрация пробы 2,5 мкМ, концентрация фермента 0,33 мкг/мл, и концентрация субстрата 172 мкМ. Образовавшиеся реакционные растворы культивируют при 37°С в течение 10 минут, после чего реакцию прекращают за счет добавления 5 мкл 4 н. хлористоводородной кислоты. Указанные операции повторяют три раза, и для каждой пробы рассчитывают среднюю степень разложения и стандартное отклонение. Полученные таким образом результаты показаны на фигуре 13.
Измерение физиологической активности не-гликозилированного OMSVP3 (фракции Е - Н)
Готовят раствор фермента в 0,1 М фосфатного буфера (рН=8,0, содержит 0,01% α-химотрипсина и 0,01% бычьего сывороточного альбумина) и раствор субстрата в 0,1 М фосфатного буфера (рН=8,0, содержит 517 мкМ пептида с 14-остатками, имеющего защитную группу; синтезирован в сравнительном примере 1 (будет приведен ниже) (SEQ ID NO:16) и 0,01% бычьего сывороточного альбумина), и переносят 20 мкл каждого раствора в эппендорфовскую пробирку. Каждую фракцию Е - Н, полученную в примере 1, подвергают лиофилыюй сушке и растворяют в 0,1 М фосфатного буфера (рН=8,6, содержит 0,01% бычьего сывороточного альбумина), и измеряют значение OD280 каждого полученного раствора с целью приготовления растворов проб с постоянной концентрацией белка. Затем 20 мкл каждого раствора пробы добавляют в приготовленный выше раствор и определяют ингибирующую активность. В этом эксперименте были получены следующие концентрации в конце реакции: концентрация пробы 2,5 мкМ, концентрация фермента 0,33 мкг/мл, и концентрация субстрата 172 мкМ. Образовавшиеся реакционные растворы культивируют при 37°С в течение 10 минут, после чего реакцию прекращают за счет добавления 5 мкл 4 н. хлористоводородной кислоты. Указанные операции повторяют три раза, и для каждой пробы рассчитывают среднюю степень разложения и стандартное отклонение. Полученные таким образом результаты показаны на фигуре 21.
Пример 3. Измерение физиологической активности (расчет IC50)
Расчет концентрации 50% ингибирования (IC50) гликозилированного OMSVP3
Растворяют пептид с 14-остатками, имеющий защитную группу, синтезированный в сравнительном примере 1 (будет описан ниже) (SEQ ID NO:16), (1,5 мг) в 1 мл 0,1 М фосфатного буфера (рН 8,0, содержит 0,1 мг/мл BSA), чтобы приготовить 1 мМ раствор. Полученный таким образом раствор разбавляют до 0,34 мМ, используя абсорбционный спектрометр (раствор 1). Химотрипсин (1 мг) растворяют в 1 мл 0,1 М фосфатного буфера (рН 8,0, содержит 0,1 мг/мл BSA). Образовавшийся раствор разбавляют в 10 раз, и дополнительно разбавляют в 10 раз. Приведенную выше процедуру повторяют для того, чтобы приготовить раствор 0,2 мкг/мл (раствор 2). Фракцию В растворяют в 100 мкл 0,1 М фосфатного буфера (рН 8,0, содержит 0,1 мг/мл BSA), и полученный таким образом раствор разбавляют до концентрации 65 нМ, используя абсорбционный спектрометр. Образовавшийся раствор разбавляют, чтобы приготовить растворы 58,5 нМ, 52 нМ, 45,5 нМ, 39 нМ, 32,5 нМ, 26 нМ, 19,5 нМ, 13 нМ, и 6,5 нМ (раствор 3). В ту же эппендорфовскую пробирку переносят 80 мкл раствора 1, который был достаточно охлажден на льду, и по 40 мкл каждого раствора 2 и 3, затем проводят культивирование в течение одного часа при 37°С. Через один час реакцию прекращают, добавляя 16 мкл 1 н. хлористоводородной кислоты. Затем смешивают 20 мкл образовавшегося реакционного раствора с 80 мкл буфера, чтобы получить суммарный объем 100 мкл, который затем анализируют методом ВЭЖХ. Степень разложения в единицу времени (скорость реакции) рассчитывают по площади пика на хроматограмме ВЭЖХ продукта реакции. На фигуре 23 приведены данные степени ингибирования (в процентах) для каждой концентрации ингибирующего реагента. Аналогично, в отношении фракций А, С и D также строят графики таким образом, чтобы концентрации ингибирующего реагента находились в промежутке концентраций, при которых активность фермента ингибируется на 50% (IC50). Получившиеся графики приведены на фигуре 23. На основе этих графиков были рассчитаны значения IC50 для гликозилированного OMSVP3 (фракции А - D), показанные графически на фигуре 24.
Расчет IC50 для не-гликозилированного OMSVP3
Растворяют пептид с 14-остатками, имеющий защитную группу, синтезированный в сравнительном примере 1 (будет описан ниже) (SEQ ID NO:16), (1,5 мг) в 1 мл 0,1 М фосфатного буфера (рН 8,0, содержит 0,1 мг/мл BSA), чтобы приготовить 1 мМ раствор. Полученный таким образом раствор разбавляют до 0,34 мМ, используя абсорбционный спектрометр (раствор 1). Химотрипсин (1 мг) растворяют в 1 мл 0,1 М фосфатного буфера (рН 8,0, содержит 0,1 мг/мл BSA). Образовавшийся раствор разбавляют в 10 раз, и дополнительно разбавляют в 10 раз. Приведенную выше процедуру повторяют для того, чтобы приготовить раствор 0,2 мкг/мл (раствор 2). Фракцию F растворяют в 100 мкл 0,1 М фосфатного буфера (рН 8,0, содержит 0,1 мг/мл BSA), и полученный таким образом раствор разбавляют до концентрации 65 нМ, используя абсорбционный спектрометр. Образовавшийся раствор разбавляют, чтобы приготовить растворы 58,5 нМ, 52 нМ, 45,5 нМ, 39 нМ, 32,5 нМ, 26 нМ, 19,5 нМ, 13 нМ и 6,5 нМ (раствор 3). В ту же эппендорфовскую пробирку переносят 80 мкл раствора 1, который был достаточно охлажден на льду, и по 40 мкл каждого раствора 2 и 3, затем проводят культивирование в течение одного часа при 37°С. Через один час реакцию прекращают, добавляя 16 мкл 1 н. хлористоводородной кислоты. Затем смешивают 20 мкл образовавшегося реакционного раствора с 80 мкл буфера, чтобы получить суммарный объем 100 мкл, который затем анализируют методом ВЭЖХ. Степень разложения в единицу времени (скорость реакции) рассчитывают по площади пика на хроматограмме ВЭЖХ продукта реакции. На фигуре 25 приведены данные степени ингибирования (в процентах) для каждой концентрации ингибирующего реагента. Аналогично, в отношении фракций Е, G и Н также строят графики таким образом, чтобы концентрации ингибирующего реагента находились в промежутке концентраций, при которых активность фермента ингибируется на 50%. Получившиеся графики приведены на фигуре 25. На основе этих графиков были рассчитаны значения IC50 для не-гликозилированного OMSVP3 (фракции Е - F), показанные графически на фигуре 26.
Пример 4. Определение термической стабильности
Ячейку для записи спектра КД заполняют дистиллированной водой и проводят измерение при комнатной температуре. Полученные таким образом данные измерений представляют собой спектр фона, причем все полученные в дальнейшем данные измерений рассчитывают путем вычитания значений для спектра фона.
Термическая стабильность гликозилированного OMSVP3 (фракция В)
Фракцию В растворяют в 300 мкл дистиллированной воды и затем проводят измерение при комнатной температуре. После измерения ячейку, содержащую образец, погружают в баню с постоянной температурой для того, чтобы провести эксперимент с изменяющейся температурой. Сначала ячейку погружают в баню с постоянной температурой 50°С в течение 10 минут, затем выдерживают при комнатной температуре в течение 10 минут, и затем проводят измерение. После этого, аналогичным образом регистрируют спектр КД вплоть до 90°С. Полученные таким образом результаты показаны на фигуре 27.
Термическая стабильность не-гликозилированного OMSVP3 (фракция F)
Фракцию F растворяют в 300 мкл дистиллированной воды и затем проводят измерение при комнатной температуре. После измерения ячейку, содержащую образец, погружают в баню с постоянной температурой для того, чтобы провести эксперимент с изменяющейся температурой. Сначала ячейку погружают в баню с постоянной температурой 50°С в течение 10 минут, затем выдерживают при комнатной температуре в течение 10 минут, и затем проводят измерение. После этого, аналогичным образом регистрируют спектр КД вплоть до 90°С. Полученные таким образом результаты показаны на фигуре 28.
Пример 5. Дисульфидное картирование третьего домена овомукоида
Синтезированный OMSVP3 содержит три дисульфидных связи. Дисульфидная связь образуется в ходе укладывания белка, причем процесс образования дисульфидной связи является равновесной реакцией. Таким образом, полагают, что дисульфидная связь, вероятно, образуется в положении, отличающемся от положения в белке природного происхождения.
Из результатов ЯМР и оценки ингибирующей активности прогнозировалось, что синтезированный в изобретении OMSVP3 (фракция 3) представляет собой индивидуальное соединение, и таким образом, дисульфидная связь образуется в том же положении, что в белке природного происхождения. Учитывая указанное выше, было проведено следующее исследование с целью подтверждения, действительно ли дисульфидная связь во фракции В образуется в том же положении, что и в белке природного происхождения.
Дисульфидное картирование OMSVP3, имеющего однородную аминокислотную последовательность и сахаридную цепочку (фракция В)
Бромциан (1 мг/мл) взаимодействует с фракцией В, полученной в примере 1 (0,4 мг), в водном растворе 40% ацетонитрила и 2% ТФУ, при 37°С в течение ночи, в защищенных от света условиях. Образовавшийся продукт подвергают лиофильной сушке и очищают методом ВЭЖХ (колонка VyDAC C4 (Imtakt Inc.), 3 мкм, 4,5×250 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 30 минут при скорости потока 1,0 мл/мин, чтобы получить фракцию I.
ESI-MS: Вычислено для C318H494N74O130S6: [M+4H]4+, 1907,5. Найдено: 1907,4.
Затем фракцию I (0,1 мг) растворяют в 50 мМ трис-буфера (рН 7,6, содержит 10 мМ CaCl2), содержащем растворенный термолизин (50 мкг/мл), и затем культивируют при 37°С. Спустя три часа, образовавшуюся смесь очищают методом ВЭЖХ (колонка VyDAC C4 (Imtakt Inc.), 3 мкм, 4,5×250 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=95:5 → 50:50 (градиент ацетонитрила: 4,5%→45%) в течение 15 минут при скорости потока 1,0 мл/мин), чтобы получить фракции II - VI (фигуры 29 и 30).
фракция II; Вычислено для C35H54N10O13S2: [М+2Н]2+, 444,8. Найдено 444,7
фракция III; Вычислено для C25H37N7O8: [M+H]+, 564,4. Найдено 564,4
фракция IV; Вычислено для C114H187N19O64S2: [М+3Н]3+, 971,6. Найдено 971,5
фракция V; Вычислено для C123H196N20O66S2: [М+3Н]3+, 1026,0. Найдено 1025,9
фракция VI; Вычислено для C64H93N15O22S2: [М+2Н]2+, 744,8. Найдено 745,0
Дисульфидное картирование не-гликозилированного OMSVP3 (фракция F)
Бромциан (1 мг/мл) взаимодействует с фракцией F, полученной в примере 1 (0,4 мг), в водном растворе 40% ацетонитрила и 2% ТФУ, при 37°С в течение ночи, в защищенных от света условиях. Образовавшийся продукт подвергают лиофильной сушке и очищают методом ВЭЖХ (колонка VyDAC C4 (Imtakt Inc.), 3 мкм, 4,5×250 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=80:20 → 40:60 (градиент ацетонитрила: 18%→54%) в течение 30 минут при скорости потока 1,0 мл/мин, чтобы получить фракцию VII.
ESI-MS: Вычислено для C256H392N70O85S6: [M+4H]4+, 1501,6. Найдено: 1501,5.
Затем фракцию VII (0,1 мг) растворяют в 50 мМ трис-буфера (рН 7,6, содержит 10 мМ CaCl2), содержащем растворенный термолизин (50 мкг/мл), и затем культивируют при 37°С. Спустя четыре часа, образовавшуюся смесь очищают методом ВЭЖХ (колонка VyDAC C4 (Imtakt Inc.), 3 мкм, 4,5×250 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=95:5 → 50:50 (градиент ацетонитрила: 4,5%→45%) в течение 15 минут при скорости потока 1,0 мл/мин), чтобы получить фракции VIII - XI (фигуры 31 и 32).
ESI-MS: Фракция VIII; Вычислено для C35H54N10O13S2: [M+2H]2+, 444,8. Найдено 444,7
фракция IX; Вычислено для C25H37N7O8: [М+Н]+, 564,4. Найдено 564,4
фракция X; Вычислено для C52H85N15O19S2: [M+2H]2+, 644,8. Найдено 644,9
фракция XI; Вычислено для C64H93N15O22S2: [M+2H]2+, 744,8. Найдено 744,9.
Пептидную цепь специально расщепляют в положении метионина в последовательности гликозилированного OMSVP3 (фракция В), путем обработки бромцианом CNBr (фракция I), и впоследствии гидролизуют под действием термолизина. В результате получают пептидные фрагменты, связанные дисульфидной связью (фигура 29). Каждый пептидный фрагмент очищают и определяют молекулярную массу методом ESI-MS. Впоследствии проводят анализ для того, чтобы выяснить, какому фрагменту OMSVP3 соответствует найденная таким образом масса. Полученная таким образом предложенная структура показана внизу фигуры 33. С использованием аналогичного метода не-гликозилированный OMSVP3 (фрагмент F) анализируют таким же образом (смотрите фигуры 31 и 34), и полученная таким образом предложенная структура показана внизу фигуры 34. Подтверждено, что дисульфидная связь образуется в том же положении, как в OMSVP3 природного происхождения (фигуры 31 и 34). Положение дисульфидной связи во фракциях B и F, предложенное с помощью дисульфидного картирования, соответствуют положению дисульфидной связи в OMSVP3 природного происхождения, который уже проанализирован.
На основе полученных выше данных предполагается, что гликопротеин, имеющий однородную аминокислотную последовательность, структуру сахаридной цепочки и структуру высшего порядка, может быть получен с помощью стадий укладывания, фракционирования и собирания настоящего изобретения. Кроме того, в случае OMSVP3 фракция, полученная в виде максимального пика на стадии фракционирования настоящего изобретения, имеет такую же дисульфидную связь, как в OMSVP3 природного происхождения. Кроме того, фракция обладает высокой активностью, и с использованием этой фракции можно успешно получить гликопротеин, имеющий желательную структуру и активность. Кроме того, вышеупомянутый результат указывает, что с учетом возможности получения другого гликопротеина, даже когда фракция в виде максимального пика не обладает ни желательной активностью, ни желательной структурой, все же образуется гликопротеин, имеющий однородную аминокислотную последовательность, структуру сахаридной цепочки и структуру высшего порядка, и имеющий заданную активность путем соответствующего собирания других фракций, имеющих желательную активность; и это ни в коей мере не порочит целесообразность настоящего изобретения.
В примерах настоящего изобретения, в обоих хроматограммах, полученных путем фракционирования уложенного третьего домена овомукоида, содержащего гликопротеин, с помощью ВЭЖХ (фигура 10), и полученной путем фракционирования уложенного негликозилированного третьего домена методом ВЭЖХ (фигура 18), имеются четыре пика, причем они являются довольно похожими. Кроме того, учитывая, что обе области также проявляют близкий уровень активности, то есть, в каждом случае найден ряд активности фракция А > фракция В > фракция D > фракция С и фракция F > фракция Е > фракция Н > фракция G (фигуры 13 и 21) в примере 2, и фракция А > фракция В > фракция С > фракция D и фракция Е > фракция F > фракция G > фракция Н (фигуры 23-26) в примере 3, можно полагать, что белок, имеющий однородную структуру высшего порядка, элюируется в таком же порядке. Тот результат, что положение дисульфидной связи во фракциях B и F, которые обе обладают высокой активностью и были получены в виде максимального пика среди других фракций, является одинаковым, также согласуется с вышеупомянутыми данными.
Однако спектры КД для фракций B и F несравнимы; это означает, что эти фракции имеют различные структуры высшего порядка (фигуры 12 и 20). Поэтому можно предположить, что добавление сахаридной цепочки, вероятно, изменяет структуру высшего порядка белка за счет искажения при укладывании не-гликозилированного белка и тому подобное.
Прогнозируется, что такое изменение в структуре высшего порядка белка могло бы повлиять на физиологическую активность, с учетом факта, что оно также влияет на способность связывания белка с субстратом и т.п., и кроме того, оно также могло бы повлиять на время полужизни в крови, с учетом факта, что оно также влияет на проницаемость гломерулярной фильтрации, и т.п. На основе приведенного выше понятно, что при использовании гликопротеина в качестве фармацевтического продукта важно только очистить и выделить белок, имеющий постоянную структуру высшего порядка в гликозилированном состоянии, чтобы получить лекарственный препарат, проявляющий постоянную физиологическую активность и время полужизни в крови. В этом аспекте, настоящее изобретение обеспечивает такую возможность.
Сравнительный пример 1. Синтез субстрата для испытания ингибирующей активности
Синтез субстратного пептида
В колонку для твердофазного синтеза помещают 2-хлоротритиловую смолу (143 мг, 200 микромоль), которую затем промывают достаточным количеством метилендихлорида (МДХ). Отдельно готовят раствор Fmoc-Phe (232,4 мг, 0,6 ммоль) и диизопропилэтиламин (DIPEA; 272,1 мкл, 1,6 ммоль) в МДХ (1,2 мл), и выливают этот раствор в колонку для твердофазного синтеза с загруженной смолой; затем смесь перемешивают при комнатной температуре в течение двух часов. После перемешивания смолу промывают смесью МДХ:метанол:DIPEA=17:2:1, метилендихлоридом и ДМФА. В последующем удаляют защитную группу Fmoc путем обработки 2 мл раствора 20% пиперидина в ДМФА, в течение 20 минут. Образовавшийся продукт промывают ДМФА, причем взаимодействие подтверждается тестом Kaiser. После этого проводят удлинение пептидной цепи путем последовательной конденсации аминокислот, с использованием описанного ниже метода.
Аминокислоту, имеющую аминогруппу, защищенную группой Fmoc и HOBt (135,1 мг, 1 ммоль), и диизопропилкарбодиимид (DIPCI; 153,9 мкл, 1 ммоль) растворяют в ДМФА (0,4 мл), и образовавшийся раствор активируют в течение 15 минут. Затем раствор выливают в колонку для твердофазного синтеза, с последующим перемешиванием при комнатной температуре в течение одного часа. После перемешивания смолу промывают МДХ и ДМФА. Удаляют защитную группу Fmoc путем обработки раствором 20% пиперидина в ДМФА (1 мл) в течение 20 минут. Описанную выше процедуру повторяют с целью последовательной конденсации аминокислот. В качестве аминокислот, имеющих защищенную аминогруппу, используют Fmoc-Asn, Fmoc-Cys(Trt), Fmoc-Lys(Boc), Fmoc-Asn, Fmoc-Gly, Fmoc-Tyr(трет-бутил), Fmoc-Thr(трет-бутил), Fmoc-Lys(Boc), Fmoc-Asn, Fmoc-Asp(О-трет-бутил), Fmoc-Ser(трет-бутил) и Fmoc-Gly, и в качестве последней аминокислоты используют Boc-Cys(Thz)-OH (233,3 мг, 1 ммоль). На этой твердофазной смоле получают пептид с 14-остатками, имеющий защитную группу Boc-Cys(Thz)-Gly-Ser(трет-бутил)-Asp(O-трет-бутил)-Asn-Lys(Вос)-Thr(трет-бутил)-Tyr(трет-бутил)-Gly-Asn-Lys(Boc)-Cys(Trt)-Asn-Phe (SEQ ID NO:11). К образовавшемуся пептиду добавляют раствор, содержащий 95% ТФУ, 2,5% TIPS и 2,5% H2O (3 мл), затем смесь перемешивают при комнатной температуре в течение двух часов. После перемешивания смолу отделяют путем фильтрации, и фильтрат концентрируют при пониженном давлении. Концентрированный фильтрат очищают методом ВЭЖХ (колонка VyDAC C4 (Imtakt Inc.), 3 мкм, 4,5×250 мм, проявляющий растворитель А: 0,09% водный раствор ТФУ; В: 0,1% ТФУ, ацетонитрил:вода=90:10, градиент А:В=95:5 → 50:50 (градиент ацетонитрила: 4,5%→45%) в течение 15 минут при скорости потока 1,0 мл/мин. Образовавшийся продукт подвергают лиофильной сушке, чтобы получить пептид с 14-остатками, имеющий защитную группу Cys(Thz)-Gly-Ser-Asp-Asn-Lys-Thr-Tyr-Gly-Asn-Lys-Cys-Asn-Phe (SEQ ID NO:16).
ESI-MS: Вычислено для C64H95N19O23S2: [М+2Н]2+, 782,34. Найдено: 782,2.
Получение калибровочной кривой для субстратного пептида
В 1 мл 0,1 М фосфатного буфера (рН 8,0, содержит BSA (0,1 мг/мл)), растворяют 1,5 мг пептида с 14-остатками, синтезированного таким образом. Образовавшуюся смесь разбавляют для того, чтобы приготовить растворы, имеющие концентрации субстрата 0,6 мМ, 0,4 мМ, 0,2 мМ и 0,1 мМ. Для раствора каждой концентрации измеряют оптическую плотность (OD) при 280 нм. Полученные таким образом усредненные значения приведены в таблице 2 и на фигуре 35.
|
Сбор данных для субстратного пептида с целью построения зависимости Михаэлиса-Ментен
В 1 мл 0,1 М фосфатного буфера (рН 8,0, содержит BSA (0,1 мг/мл)), растворяют 3,1 мг синтезированного таким образом пептида с 14-остатками (SEQ ID NO:16), чтобы приготовить 2 мМ раствор. Этот раствор разбавляют для того, чтобы приготовить растворы субстрата, имеющие концентрации: 1,6 мМ, 1,2 мМ, 0,8 мМ, 0,4 мМ, 0,2 мМ, 0,1 мМ и 0,05 мМ. Отдельно химотрипсин (1 мг) растворяют в 1 мл 0,1 М фосфатного буфера (рН 8,0, содержит 0,1 мг/мл BSA). Образовавшийся раствор разбавляют в 10 раз, и дополнительно разбавляют в 10 раз. Приведенную выше процедуру повторяют для того, чтобы приготовить раствор с концентрацией 0,1 мкг/мл. В ту же эппендорфовскую пробирку переносят по 50 мкл раствора (для каждой концентрации) субстрата, который был достаточно охлажден на льду, и по 50 мкл раствора фермента, затем проводят культивирование в течение 30 минут при 37°С. Через 30 минут реакцию прекращают, добавляя 10 мкл 1 н. хлористоводородной кислоты. Затем смешивают 20 мкл образовавшегося реакционного раствора с 80 мкл буфера, чтобы получить суммарный объем 100 мкл, который затем анализируют методом ВЭЖХ. Степень разложения в единицу времени (скорость реакции) рассчитывают по площади пика на хроматограмме ВЭЖХ продукта реакции (фигура 36). В таблице 3 приведены данные скорости реакции для каждой концентрации субстрата.
|
Сбор данных для субстратного пептида с целью построения зависимости Лайнуивера-Бэрка.
В 1 мл 0,1 М фосфатного буфера (рН 8,0, содержит BSA (0,1 мг/мл)), растворяют 1,5 мг синтезированного таким образом пептида с 14-остатками (SEQ ID NO:16), чтобы приготовить 1 мМ раствор. Этот раствор разбавляют для того, чтобы приготовить растворы субстрата, имеющие концентрации: 1 мМ, 500 мкМ, 333 мкМ, 250 мкМ и 200 мкМ. Отдельно химотрипсин (1 мг) растворяют в 1 мл 0,1 М фосфатного буфера (рН 8,0, содержит 0,1 мг/мл BSA). Образовавшийся раствор разбавляют в 10 раз, и дополнительно разбавляют в 10 раз. Приведенную выше процедуру повторяют для того, чтобы приготовить раствор с концентрацией 0,1 мкг/мл. В ту же эппендорфовскую пробирку переносят по 50 мкл раствора (для каждой концентрации) субстрата, который был достаточно охлажден на льду, и по 50 мкл раствора фермента, затем проводят культивирование в течение 30 минут при 37°С. Через 30 минут реакцию прекращают, добавляя 10 мкл 1 н. хлористоводородной кислоты. Затем смешивают 20 мкл образовавшегося реакционного раствора с 80 мкл буфера, чтобы получить суммарный объем 100 мкл, который затем анализируют методом ВЭЖХ. Степень разложения в единицу времени (скорость реакции) рассчитывают по площади пика на хроматограмме ВЭЖХ продукта реакции (фигура 37). В таблице 4 приведены данные обратной скорости реакции, соответствующие каждой обратной концентрации субстрата.
|
Промышленная применимость
Способ получения настоящего изобретения обеспечивает получение гликопротеина, имеющего однородную аминокислотную последовательность и структуру сахаридной цепочки, а также однородную структур высшего порядка. Поскольку гликопротеин, произведенный по способу получения настоящего изобретения, обладает однородной структурой высшего порядка, он имеет не только постоянное время полужизни в крови и внутриклеточный транспорт, но также и однородную физиологическую активность. Кроме того, согласно настоящему изобретению можно регулировать состав смеси гликопротеинов таким образом, чтобы иметь желательную физиологическую активность. Следовательно, способ получения настоящего изобретения особенно применим для разработки фармацевтического продукта с использованием гликопротеина.
Свободный текст перечня последовательностей
SEQ ID NO:1 представляет собой аминокислотную последовательность, имеющую защитную группу фрагмента 1.
SEQ ID NO:2 представляет собой аминокислотную последовательность, имеющую группу бензилового сложного тиоэфира фрагмента 1.
SEQ ID NO:3 представляет собой аминокислотную последовательность, имеющую защитную группу фрагмента 2.
SEQ ID NO:4 представляет собой гликозилированную аминокислотную последовательность, имеющую защитную группу фрагмента 2.
SEQ ID NO:5 представляет собой гликозилированную аминокислотную последовательность, имеющую группу бензилового сложного тиоэфира и защитную группу фрагмента 2.
SEQ ID NO:6 представляет собой аминокислотную последовательность, имеющую защитную группу фрагмента 3.
SEQ ID NO:7 является аминокислотой фрагмента 3.
SEQ ID NO:8 представляет собой гликозилированную аминокислотную последовательность, имеющую защитную группу.
SEQ ID NO:9 является гликозилированной аминокислотной последовательностью.
SEQ ID NO:10 является гликозилированной аминокислотной последовательностью гликозилированного OMSVP3.
SEQ ID NO:11 представляет собой аминокислотную последовательность, имеющую защитную группу фрагмента 2'.
SEQ ID NO:12 представляет собой аминокислотную последовательность, имеющую группу бензилового сложного тиоэфира и защитную группу фрагмента 2'.
SEQ ID NO:13 представляет собой аминокислотную последовательность, имеющую защитную группу.
SEQ ID NO:14 является аминокислотной последовательностью.
SEQ ID NO:15 является аминокислотной последовательностью негликозилированного OMSVP3.
SEQ ID NO:16 представляет собой аминокислотную последовательность, имеющую защитную группу, которая является субстратом химотрипсина.