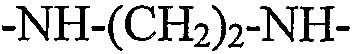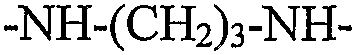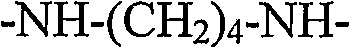Результат интеллектуальной деятельности: RGD-СОДЕРЖАЩИЕ ПЕПТИДОМИМЕТИКИ И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым содержащим аргинин-глицин-аспарагиновую кислоту (RGD) циклическим пептидомиметикам и к их применению, например, в диагностике и лечении злокачественной опухоли.
Сокращения: AcOH, уксусная кислота; Alloc, аллилоксикарбонил; Bpheide, бактериофеофорбид; BTA, (тауринамид BPheide), 131-(2-сульфоэтил)амид 31-оксо-15-метоксикарбонилметилродобактериохлорина; BTC, бис(трихлорметил)карбонат; Dab, диаминомасляная кислота; Dap, диаминопропионовая кислота; ДХМ, дихлорметан; Dde, 1-(4,4-диметил-2,6-диоксоциклогексилиден)этил; DIC, диизопропилкарбодиимид; DIEA, диизопропилэтиламин; DMBA, диметилбарбитуровая кислота; ДМФА, N,N-диметилформамид; ДМСО, диметилсульфоксид; DOTA, 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота; DTPA, диэтилентриаминпентауксусная кислота; Et2O, диэтиловый эфир; FITC, флуоресцеинизотиоцианат; Fmoc, флуоренилметоксикарбонил; GABA, γ-аминомасляная кислота; HATU, гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония; HOAt, 1-гидрокси-7-азабензотриазол; HOBt, N-гидроксибензотриазол; Lys, лизин; MeOH, метанол; Nal, нафтилаланин; Orn, орнитин; Pbf, 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил; PyBOP, гексафторфосфат бензотриазол-1-илокси-трис-пирролидинофосфония; ОФ-ВЭЖХ, обращенно-фазовая высокоэффективная жидкостная хроматография; КТ, комнатная температура; ТФА, трифторуксусная кислота, TFE, трифторэтанол; TIS, триизопропилсилан.
УРОВЕНЬ ТЕХНИКИ
Последовательность аргинин-глицин-аспарагиновая кислота (Arg-Gly-Asp; RGD) компонентов внеклеточного матрикса (ECM), таких как фибронектин (Pierschbacher and Ruoslahti, 1984) и витронектин, связывается с интегринами (Ruoslahti and Pierschbacher, 1987; D'Souza SE et al, 1991; Joshi et al, 1993; Koivunen et al, 1994). Опосредуемая интегринами адгезия приводит к внутриклеточной передаче сигнала, которая регулирует выживаемость, пролиферацию и миграцию клеток. Известно приблизительно 25 интегринов и по меньшей мере восемь из них связывают последовательность RGD в качестве основной последовательности для распознавания в их лигандах.
Данные, полученные скринингом способами фагового дисплея (Pasqualini and Ruoslahti, 1996) для RGD-содержащих пептидов, показали их селективное связывание с эндотелиальной выстилкой кровеносных сосудов опухоли (Ruoslahti, 1996; Pasqualini et al., 1997).
Поскольку описано, что экспрессия интегринов является высокой на активированных, но более ограничена на покоящихся эндотелиальных клетках (EC), небольшие синтетические RGD-содержащие пептиды были предложены в качестве антагонистов, снижающих рост клеток эндотелия сосудов и опухолевых клеток. Пептиды RGD также замедляют передачу сигнала, влияют на миграцию клеток и индуцируют регрессию опухолевых клеток или апоптоз (Su et al., 2002). Аналоги RGD используют при визуализации опухоли (Haubner et al., 2001), в антиангиогенных подходах (Kawaguchi et al., 2001; Pasqualini et al., 2000) и в нацеливании на опухоль радионуклидов (van Hagen et al., 2000) и в химиотерапевтических лекарственных средствах (Arap et al., 1998; Zitzmann et al., 2002).
Интегрины также экспрессируются на злокачественных клетках и играют важную роль в инвазии, метастазировании, пролиферации и апоптозе злокачественных клеток. Метастатическая инвазия опухолевых клеток в предпочтительные для них органы может отражать явление хоминга клеток, которое зависит от адгезионного взаимодействия между опухолевыми клетками и органоспецифическими эндотелиальными маркерами (Ruoslahti and Rajotte, 2000). Путем связывания интегрина либо эндотелиальных, либо опухолевых клеток, RGD-пептиды способны модулировать клеточное движение in vivo путем ингибирования связывания клетка опухоли-ECM и клетка опухоли-EC, которое необходимо для процессов метастазирования. Несколько исследований показали, что RGD-содержащие соединения могут препятствовать метастатическим процессам в опухолевых клетках in vitro (Goligorsky et al., 1998; Romanov and Goligorsky 1999) и in vivo (Saiki et al., 1989; Hardan et al., 1993).
Значительный интерес представляют пептиды, которые являются специфичными для отдельных интегринов, и они имеют возможное медицинское значение. αvβ3 интегрин был первым интегрином, для которого было показано, что он ассоциирован с ангиогенезом опухоли. RGD-пептиды, которые специфично блокируют αvβ3 интегрин, являются перспективными в качестве ингибиторов ангиогенеза опухоли и сетчатки, остеопороза и в лекарственных средствах, направленных на сосуды опухоли (Assa-Munt et al., 2001). Связывание лекарственного средства против злокачественной опухоли доксорубицина или проапоптотического пептида со связывающим αvβ3 интегрин RGD-пептидом приводит к соединениям, которые являются более активными и менее токсичными, чем немодифицированные лекарственные средства, при тестировании против ксенотрансплонтатов опухолей у мышей (Ruoslahti, 2000; Arap et al., 1998; Arap et al., 2002; Ellerby et al., 1999). Следовательно, большая работа была проведена для конструирования и продукции связывающих интегрины пептидов и пептидомиметиков (Haubner et al., 1996; Locardi et al., 1999; Lark et al., 1999; Raboisson et al., 2006; Belvisi et al., 2005; Dijkgraaf et al., 2006; Banfi et al., 2007; US 5849692).
В US 6576239, EP 0927045 и WO 98/010795 описан конъюгат, содержащий нацеленный на опухоль пептид, содержащий аминокислотную последовательность RGD или NGR, причем указанный пептид связан с терапевтической или диагностической структурой, при условии что указанная структура не является фаговой частицей. Терапевтическая структура может быть цитотоксическим агентом или химиотерапевтическим средством против злокачественной опухоли, таким как доксорубицин. Конъюгат селективно нацеливается на ангиогенные сосуды при введении in vivo. Нацеленный на опухоль пептид может представлять собой линейный или циклический пептид длиной вплоть до 20 или 30 аминокислот или 50-100 аминокислот. Одним предпочтительным пептидом является циклический нонапептид CDCRGDCFC или H-Cys*-Asp-Cys*-Arg-Gly-Asp-Cys*-Phe-Cys*-NH2.
В WO 2008/023378 описан конъюгат RGD-содержащего пептида или RGD-пептидомиметика и фотосенсибилизатора, выбранного из порфирина, хлорофилла или бактериохлорофилла.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
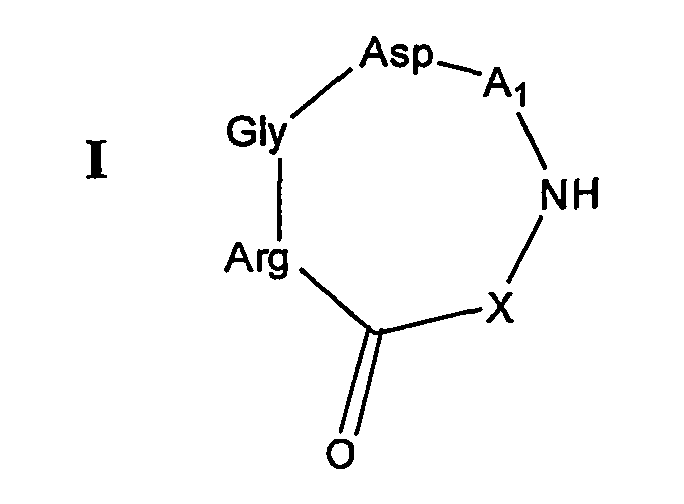
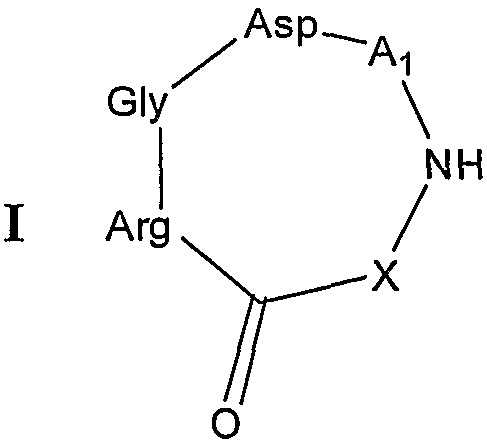
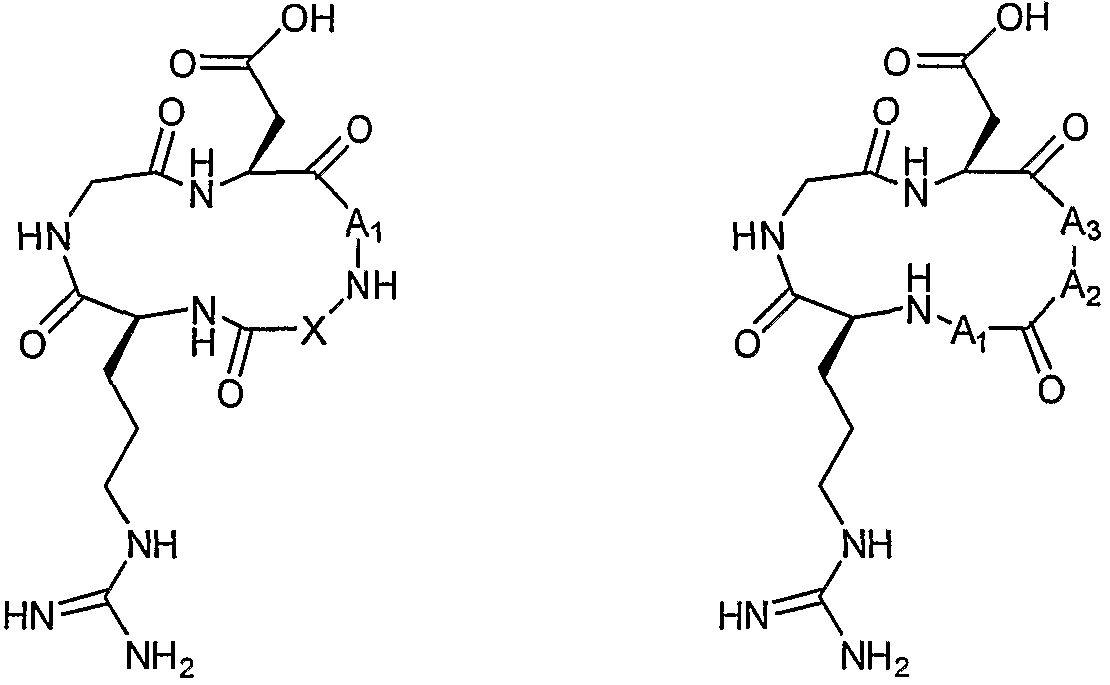
В одном аспекте настоящее изобретение относится к RGD-содержащему циклическому пептидомиметику общей формулы I:
где
остаток аргинина связан через его α-аминогруппу с C=O основной цепи;
X представляет собой -NH-, -NH-R-, -O-R-, -S- или -S-R-, R представляет собой гидрокарбиленовый радикал, образованный из C1-C6алкана, C2-C6алкена, C2-C6алкина, C3-C10циклоалкана, C3-C10циклоалкена, C6-C14моно- или полициклического ароматического углеводорода, или C6-C14моно- или полициклического ароматического углеводорода, замещенного одним или двумя C1-C2алкилами, C2алкенилами или C2алкинилами, или R вместе с атомом азота, к которому он присоединен, образуют 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, необязательно содержащее 1-2 дополнительных гетероатома, выбранных из кислорода, азота или серы; и
A1 представляет собой природный или неприродный аминокислотный остаток, содержащий либо аминогруппу, либо карбоксильную группу, на его боковой цепи, связанный через его α-карбоксильную группу или карбоксильную группу боковой цепи с NH основной цепи и через его α-аминогруппу или аминогруппу боковой цепи с α-карбоксильной группой остатка аспарагиновой кислоты,
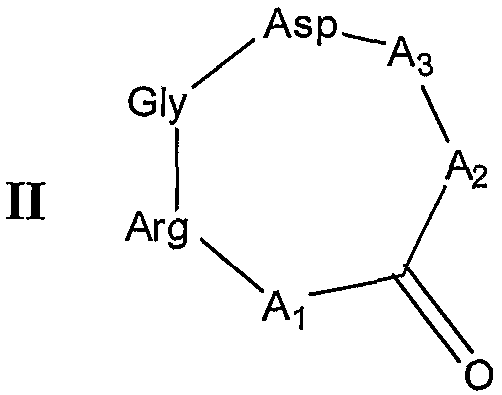
или общей формулы II:
где
A1 представляет собой природный или неприродный аминокислотный остаток, имеющий либо аминогруппу, либо карбоксильную группу, на его боковой цепи, связанный через его α-карбоксильную группу или карбоксильную группу боковой цепи с α-аминогруппой остатка аргинина и через его α-аминогруппу или аминогруппу боковой цепи с C=O основной цепи;
A2 представляет собой природный или неприродный аминокислотный остаток, связанный через его α-аминогруппу с C=O основной цепи и через его α-карбоксильную группу с α-аминогруппой или аминогруппой боковой цепи A3; и
A3 представляет собой природный или неприродный аминокислотный остаток, имеющий аминогруппу на его боковой цепи и амидированный по его С-концу, связанный через одну из его α-аминогруппы или аминогруппы его боковой цепи с карбоксильной группой A2 и через другую из его α-аминогруппы или аминогруппы боковой цепи с α-карбоксильной группой остатка аспарагиновой кислоты.
В другом аспекте настоящее изобретение относится к конъюгату RGD-содержащего циклического пептидомиметика, определенного выше, и функциональной группы, выбранной из флуоресцентного зонда, фотосенсибилизатора, хелатирующего агента или цитотоксического агента, связанной с аминокислотным остатком A1 в пептидомиметике, при условии, что когда A1 имеет аминогруппу боковой цепи, указанная функциональная группа связана либо с α-аминогруппой, либо с аминогруппой боковой цепи A1, необязательно через спейсер, и когда A1 представляет собой остаток дикарбоновой аминокислоты, указанная функциональная группа связана либо с α-карбоксильной группой, либо с карбоксильной группой боковой цепи A1, необязательно через спейсер.
В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей конъюгат RGD-содержащего циклического пептидомиметика и функциональной группы, как определено выше, или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель.
Фармацевтические композиции по настоящему изобретению можно использовать для различных целей, например, (i) для диагностических целей, в частности, для визуализации органов и тканей и для диагностики опухолей, когда функциональная группа представляет собой флуоресцентный зонд; (ii) для фотодинамической терапии (PDT), в частности, для PDT опухолей или неопухолевых тканей, когда функциональная группа представляет собой фотосенсибилизатор; (iii) для радиовизуализации или лучевой терапии, когда функциональная группа представляет собой хелатирующий агент; и (iv) для направленной химиотерапии, когда функциональная группа представляет собой цитотоксический агент.
Таким образом, в другом аспекте настоящее изобретение относится к применению конъюгата RGD-содержащего циклического пептидомиметика и функциональной группы, как определено выше, или его фармацевтически приемлемой соли, для получения фармацевтической композиции для диагностических целей, фотодинамической терапии (PDT), радиовизуализации или лучевой терапии, или направленной химиотерапии.
В следующем аспекте настоящее изобретение относится к конъюгату RGD-содержащего циклического пептидомиметика и функциональной группы, как определено выше, или его фармацевтически приемлемой соли, для диагностических целей, фотодинамической терапии (PDT), радиовизуализации или лучевой терапии, или направленной химиотерапии.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
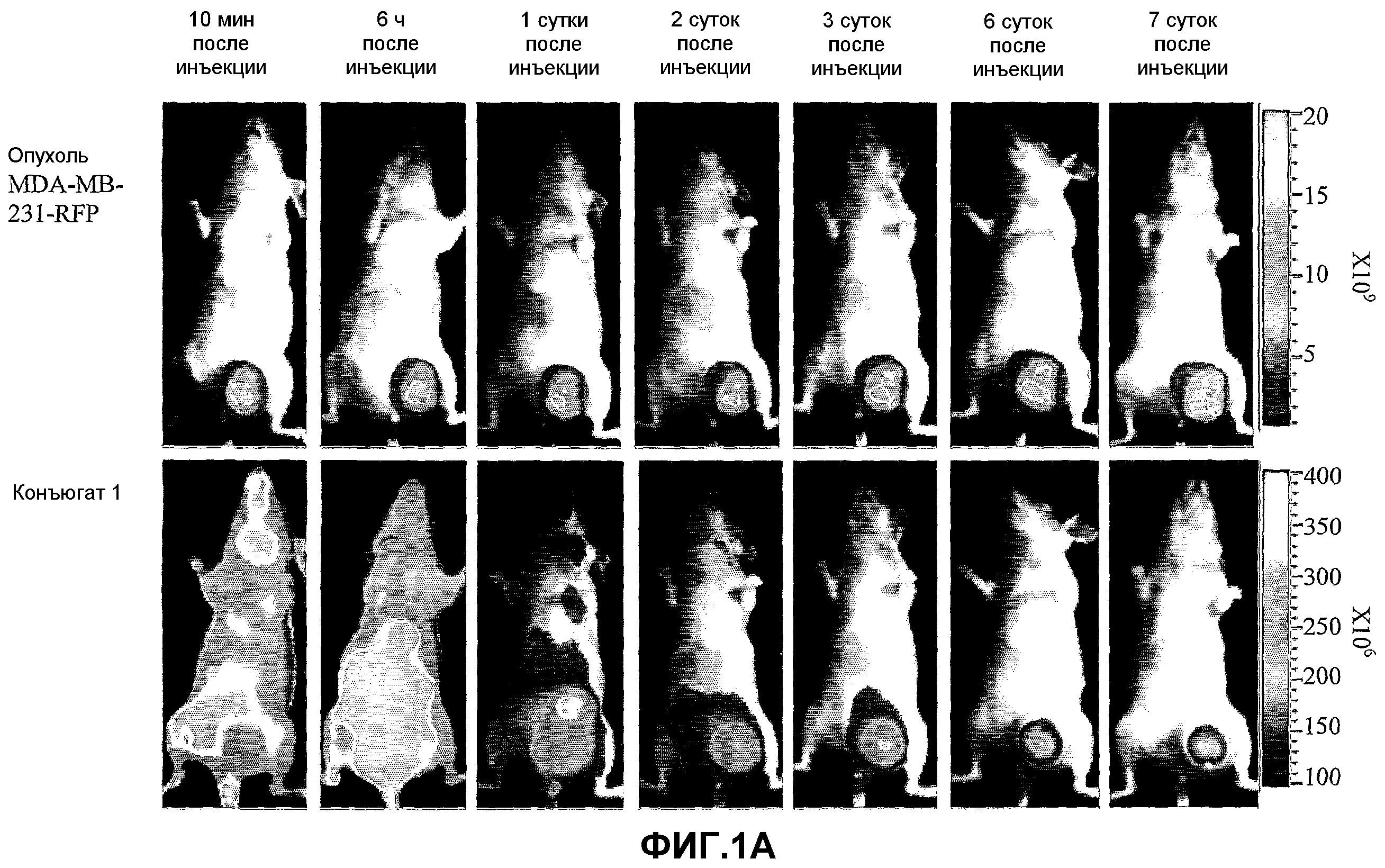
На фиг.1A-1C представлены паттерны накопления конъюгатов 1, 4 и 41 (1A, 1B и 1C, соответственно) в ортотопной первичной крупной опухоли молочной железы человека MDA-MB-231-RFP в жировой ткани молочной железы мышей CD-1 nude. Мышам проводили введение, как описано в разделе "Материалы и методы", и мониторинг флуоресценции как опухолевых клеток, так и конъюгата, проводили с 1 по 7 сутки с использованием системы Xenograph IVIS (шкала цветности в единицах фотон/с/см2/стерадиан). На верхней панели представлены флуоресцентные сигналы, сгенерированные опухолью (красное флуоресцентное изображение), а на нижней панели представлен флуоресцентный сигнал, сгенерированный конъюгатом (изображение флуоресценции в ближней инфракрасной области). Сопоставление сигналов, сгенерированных опухолью и конъюгатом, указывает на накопление конъюгата в опухолях.
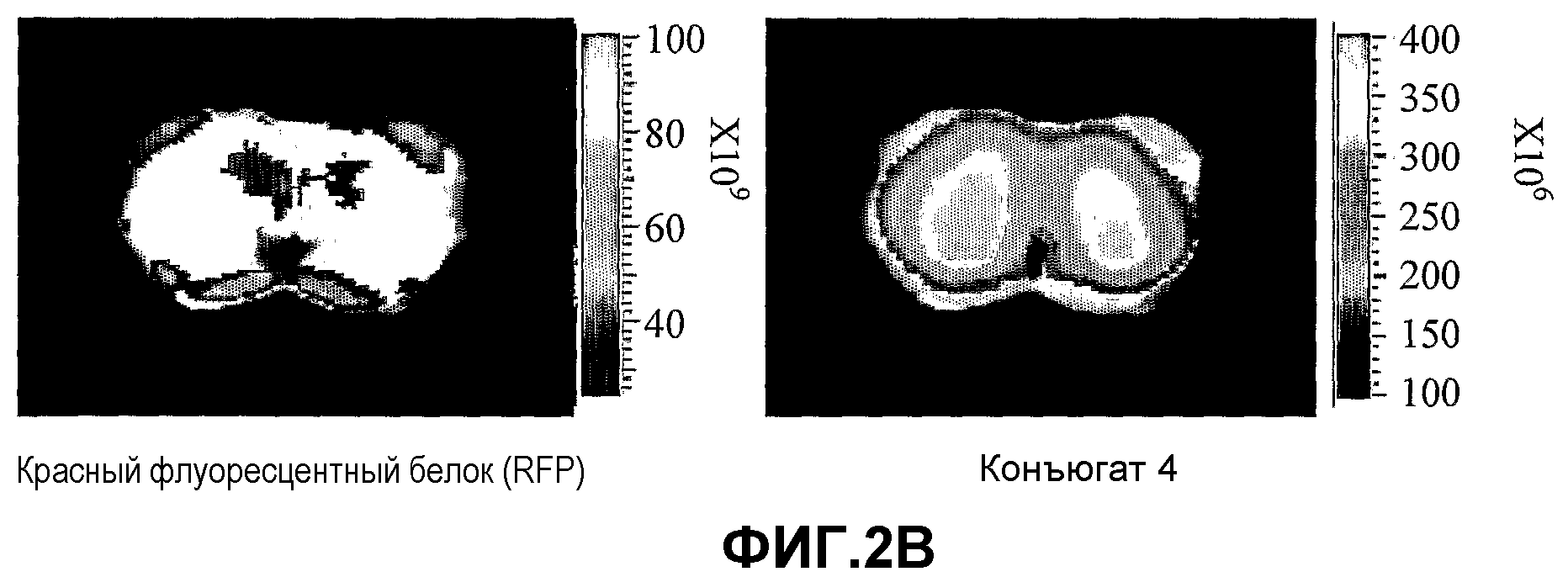
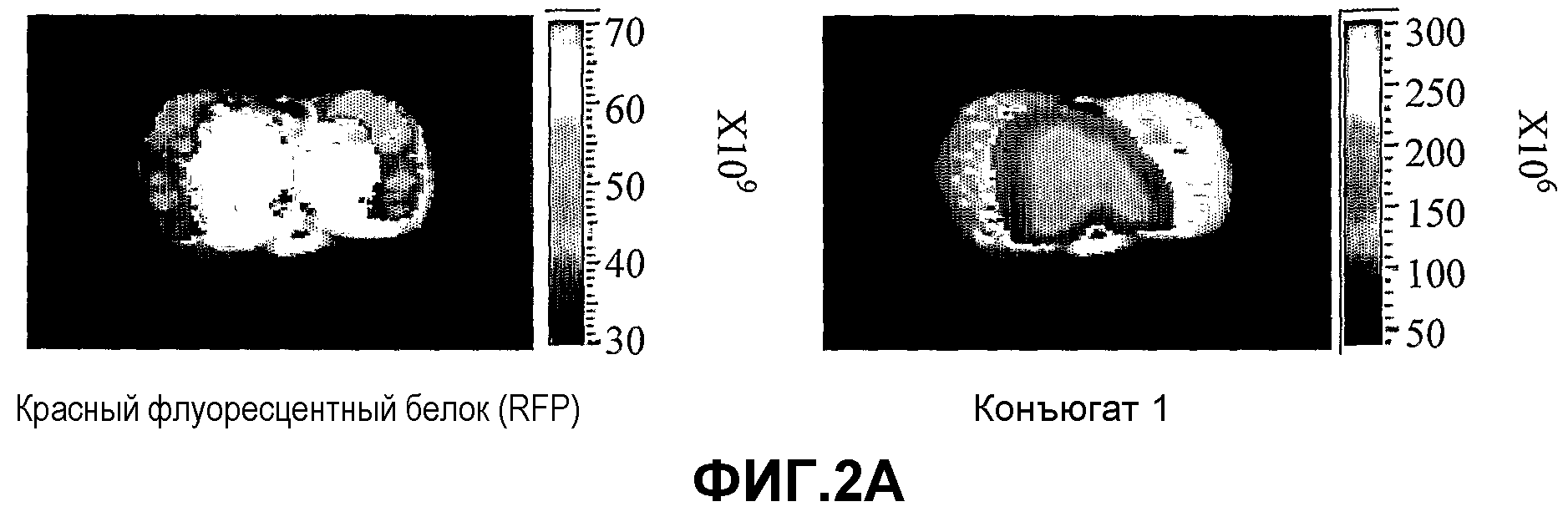
На фиг.2A-2C представлено накопление конъюгатов 1, 4 и 41 (2A, 2B и 2C, соответственно) в некротической области злокачественной опухоли молочной железы. Мышам проводили введение, как описано в разделе "Материалы и методы", и мониторинг флуоресценции проводили через шесть суток после инъекции с использованием системы Xenograph IVIS (шкала цветности в единицах фотон/с/см2/стерадиан). Как показано, некротическая область в центральной части опухоли устраняет красную флуоресценцию (левая панель), но демонстрирует скопление конъюгата (правая панель).
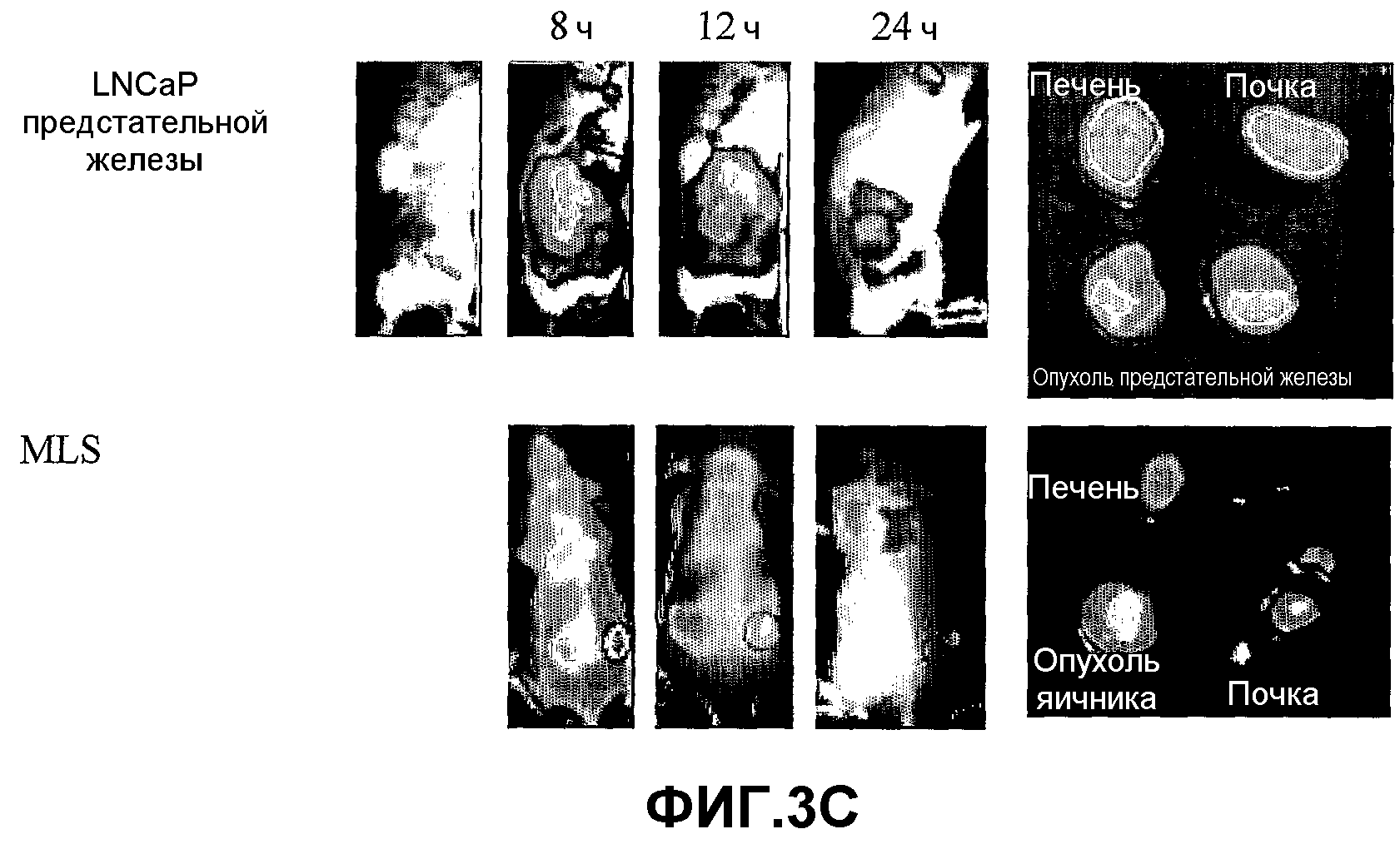
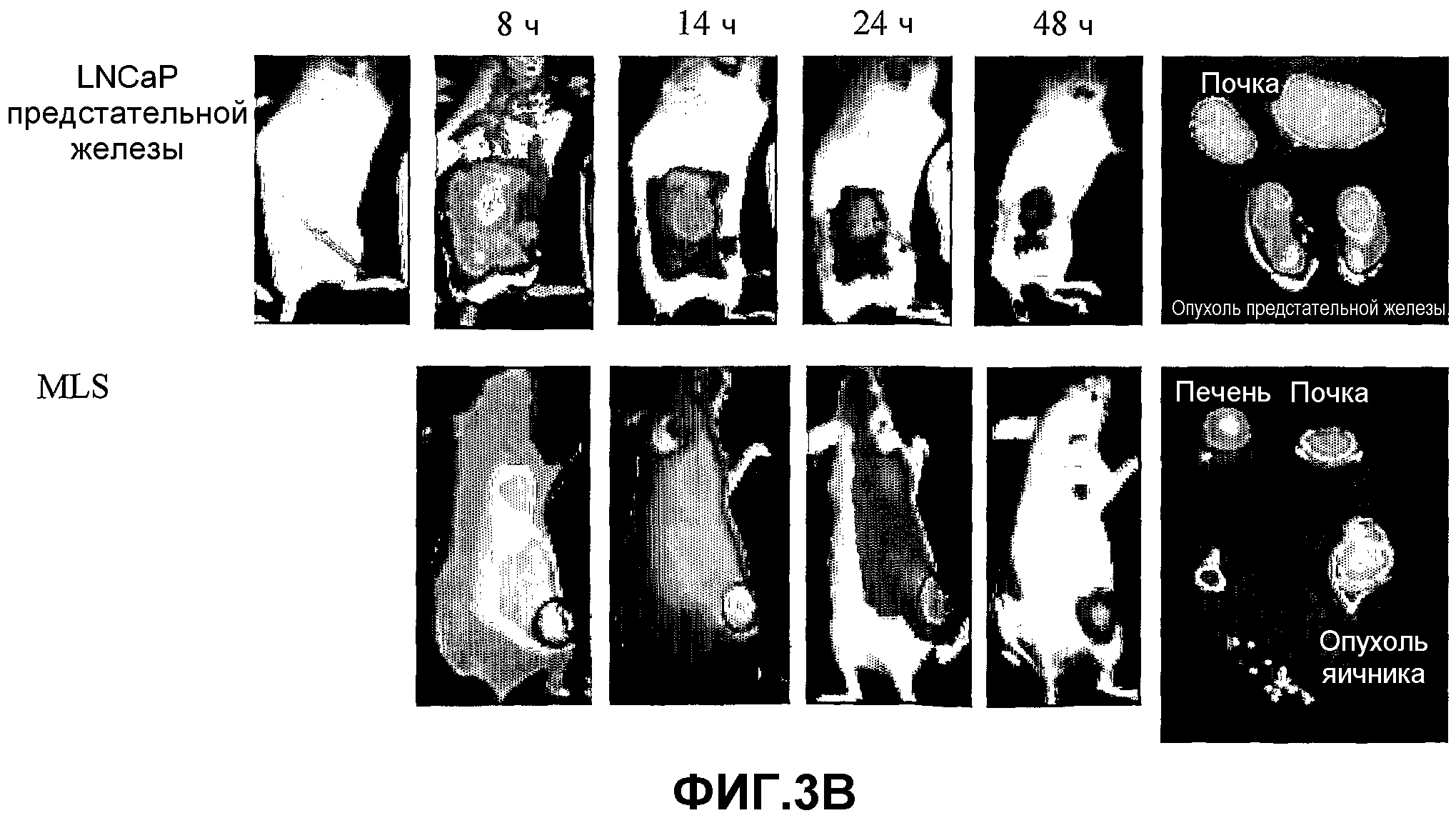
На фиг.3A-3C представлено накопление конъюгатов 1, 4 и 41 (3A, 3B и 3C, соответственно) в злокачественной опухоли предстательной железы LNCaP по сравнению с опухолью яичника MLS. Мышам проводили введение, как описано в разделе "Материалы и методы", и мониторинг накопления конъюгата проводили в имплантированной опухоли в определенные моменты времени (8, 11, 14, 24 и 48 ч для конъюгата 1; 8, 14, 24 и 48 ч для конъюгата 4; и 8, 12 и 24 ч для конъюгата 41) после инъекции с использованием системы Xenograph IVIS®. Профили накопления конъюгатов в опухолях предстательной железы (верхняя панель) и яичника (нижняя панель) были практически одинаковыми, причем в обоих случаях наиболее высокий уровень флуоресценции наблюдали через 8-11 (конъюгат 1), 8-14 (конъюгат 4) или 8-12 (конъюгат 41) ч после инъекции, и конъюгат оставался в опухоли вплоть до 48 ч в случае конъюгатов 1 и 4, или 24 ч в случае конъюгата 41. Стрелка на верхнем левом изображении указывает на область опухоли предстательной железы. На правом изображении каждой панели представлены извлеченные органы через 14 ч после инъекции, где высокий уровень флуоресценции, наблюдаемый в печени и почках, указывает на выведение конъюгата через эти органы.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к новым циклическим пептидомиметикам, содержащим аргинин-глицин-аспарагиновую кислоту (Arg-Gly-Asp; RGD), которые являются лигандами αvβ3 и αvβ5 интегринов, как определено выше.
Термины "RGD-содержащий циклический пептидомиметик", "циклический пептидомиметик" и "лиганд αvβ3 и αvβ5 интегрина", используемые в настоящем документе взаимозаменяемо, относятся к циклическому непептидному соединению, содержащему последовательность RGD, также называемую последовательностью RGD, которое имитирует пептиды, имеющие последовательность RGD. Циклический пептидомиметик по настоящему изобретению может представлять собой любое циклическое соединение либо общей формулы I, либо общей формулы II, как определено выше.
Как подробно показано на схеме 1 ниже, RGD-содержащий циклический пептидомиметик общей формулы I представляет собой циклическое соединение, содержащее последовательность RGD, в котором остаток либо дикарбоновой аминокислоты, либо аминокислоты, имеющей аминогруппу боковой цепи (A1), связан амидными связями с α-карбоксильной группой остатка аспарагиновой кислоты в последовательности RGD по одному концу и с NH основной цепи по другому концу, и указанный NH основной цепи связан с α-аминогруппой остатка аргинина в последовательности RGD через различные возможные соединительные элементы. Как показано далее, RGD-содержащий циклический пептидомиметик общей формулы II представляет собой циклическое соединение, содержащее последовательность RGD, в котором остаток либо дикарбоновой аминокислоты, либо аминокислоты, имеющей аминогруппу боковой цепи (A1), связан амидной связью с α-аминогруппой остатка аргинина в последовательности RGD по одному концу и через его аминогруппу с C=O основной цепи по другому концу, где C=O связан с α-аминогруппой другого аминокислотного остатка (A2), который связан амидной связью с остатком следующей аминокислоты, имеющей аминогруппу боковой цепи и амидированной по ее С-концу (A3), который связан амидной связью с α-карбоксильной группой остатка аспарагиновой кислоты в последовательности RGD.
Термин "гидрокарбилен" относится к двухвалентному радикалу, содержащему только атомы углерода и водорода, который может быть насыщенным или ненасыщенным, линейным или разветвленным, циклическим или ациклическим или ароматическим, который может быть образован из C1-C6алкана, C2-C6алкена, C2-C6алкина, C3-C10циклоалкана, C3-C10циклоалкена, C6-C14моно- или полициклического ароматического углеводорода, или C6-C14моно- или полициклического ароматического углеводорода, замещенного одним или двумя C1-C2алкилами, C2алкенилами или C2алкинилами.
Схема 1: Детальные структуры циклического пептидомиметика общей формулы I (слева) и II (справа)
Термин "C1-C6алкан", как правило, означает прямой или разветвленный углеводород, имеющий 1-6 атомов углерода, и включает, например, метан, этан, н-пропан, изопропан, н-бутан, изобутан, н-пентан, 2,2-диметилпропан, н-гексан и т.п. Предпочтительными являются C1-C4алканы, более предпочтительно этан. Термины "C2-C6алкен" и "C2-C6алкин", как правило, означают прямой и разветвленный углеводород, имеющий 2-6 атомов углерода и одну двойную или тройную связь, соответственно, и включают этен, 3-бутен, 2-этенилбутен и т.п., и пропин, 2-бутин, 3-пентин и т.п. Термин "C3-C10циклоалкан" означает циклический или бициклической углеводород, такой как циклопропан, циклобутан, циклопентан, циклогексан и т.п., а термин "C6-C14моно- или полициклический ароматический углеводород" обозначает карбоциклическую ароматическую молекулу, такую как бензол, нафталин и антрацен.
В группе NHR R представляет собой гидрокарбилен, как определено выше, или R вместе с атомом азота, к которому он присоединен, образует насыщенное, предпочтительно 5- или 6-членное гетероциклическое кольцо, необязательно содержащее 1 или 2 дополнительных гетероатома, выбранных из кислорода, азота или серы. Такие кольца могут быть замещены, например, одной или двумя C1-C6алкильными группами, или одной алкильной или гидроксиалкильной группой на втором атоме азота кольца, например, в пиперазиновом кольце.
Термин "аминокислота" относится как к природным, так и неприродным аминокислотам в форме их L- и D-стереоизомеров и включает, среди прочего, аминокислоты, имеющие аминогруппу боковой цепи, а также дикарбоновые аминокислоты. Неограничивающие примеры аминокислот, имеющих аминогруппу боковой цепи, включают лизин (Lys), диаминопропионовую кислоту (Dap), диаминомасляную кислоту (Dab) и орнитин (Orn); и примеры дикарбоновых кислот включают, но не ограничиваются ими, глутаминовую кислоту (Glu), аспарагиновую кислоту (Asp) и аминоадипиновую кислоту.
В одном варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -NH- или -NH-R-, т.е. α-аминогруппа остатка аргинина образует группу мочевины, и R представляет собой гидрокарбилен, образованный из линейного C2-C6алкана, C2-C6алкена или C2-C6алкина, предпочтительно из C2-C4алкана, C2-C4алкена или C2-C4алкина, более предпочтительно из этана.
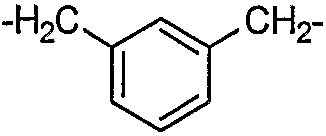
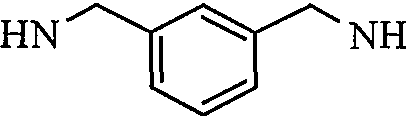
В другом варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -NH-R-, и R представляет собой гидрокарбилен, образованный из C6-C14моно- или полициклического ароматического углеводорода, замещенного двумя C1-C2алкилами, предпочтительно 1,3-диметилбензол-1,3-диил, т.е. м-ксилол, связанный через метильные группы.
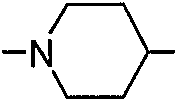
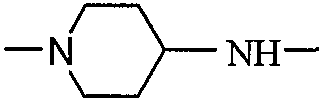
В следующем варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -NH-R-, и R вместе с атомом азота, к которому он присоединен, образует 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, предпочтительно пиперидин-1,4-диил, т.е. пиперидин, связанный через положения 1 и 4.
В другом варианте осуществления, RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -O-R-, т.е. α-аминогруппа остатка аргинина образует карбаматную группу, и R представляет собой гидрокарбилен, образованный из линейного C2-C6алкана, C2-C6алкена или C2-C6алкина, предпочтительно из C2-C4алкана, C2-C4алкена или C2-C4алкина, более предпочтительно из этана.
В другом варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -S- или -S-R-, т.е. α-аминогруппа остатка аргинина образует карбамотиогруппу, и R представляет собой гидрокарбилен, образованный из линейного C2-C6алкана, C2-C6алкена или C2-C6алкина, предпочтительно из C2-C4алкана, C2-C4алкена или C2-C4алкина, более предпочтительно из этана.
В следующем варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы II, где A1 представляет собой остаток аминокислоты, имеющей аминогруппу боковой цепи, такой как Lys, Dap, Dab и Orn, предпочтительно Lys, или остаток дикарбоновой аминокислоты, такой как Glu, Asp и аминоадипиновая кислота.
В следующем варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы II, где A2 представляет собой остаток аминокислоты, такой как фенилаланин (Phe), D-фенилаланин (D-Phe), валин (Val), Gly и Asp.
В другом варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы II, где A3 представляет собой аминокислотный остаток, имеющий аминогруппу боковой цепи, такой как Lys, Dap, Dab и Orn, амидированный по его С-концу.
RGD-содержащие циклические пептидомиметики по настоящему изобретению можно получать любым способом, известным в данной области, например, как описано в разделе "Материалы и методы" ниже.
В одном предпочтительном варианте осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -NH-, и A1 представляет собой Dap.
В других предпочтительных вариантах осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -NH-R-, R представляет собой гидрокарбилен, образованный из этана, и A1 представляет собой Dap, Dab, Orn или Lys.
В следующих предпочтительных вариантах осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -NH-R-, R представляет собой гидрокарбилен, образованный из пропана, н-бутана или н-гексана, и A1 представляет собой Orn.
В других предпочтительных вариантах осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы I, где X представляет собой -O-R-, R представляет собой гидрокарбилен, образованный из этана, и A1 представляет собой Dap или Lys.
В следующих предпочтительных вариантах осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы II, где A1 представляет собой Lys, A2 представляет собой Phe, Val, D-Phe или Asp, и A3 представляет собой Dap, амидированную по ее C-концу.
В следующих предпочтительных вариантах осуществления RGD-содержащий циклический пептидомиметик по настоящему изобретению представляет собой циклическое соединение общей формулы II, где A1 представляет собой Lys, A2 представляет собой Phe, и A3 представляет собой Dab, Orn или Lys, амидированные по их C-концам.
Лиганды αvβ3 и αvβ5 интегринов по настоящему изобретению накапливаются в опухолях, экспрессирующих αvβ3 и αvβ5, таких как карцинома яичника, рак толстого кишечника, молочной железы и предстательной железы, и, таким образом, их можно использовать как в диагностических, так и в терапевтических способах, посредством конъюгации с различными "функциональными" группами.
Таким образом, в другом аспекте настоящее изобретение относится к конъюгату RGD-содержащего циклического пептидомиметика, определенного выше, т.е. циклического пептидомиметика общей формулы I или II, и функциональной группы, выбранной из флуоресцентного зонда, фотосенсибилизатора, хелатирующего агента или цитотоксического агента, связанной с аминокислотным остатком A1 в пептидомиметике, при условии, что когда A1 имеет аминогруппу боковой цепи, указанная функциональная группа связана либо с α-аминогруппой, либо с аминогруппой боковой цепи A1, необязательно через спейсер, и когда A1 представляет собой дикарбоновый аминокислотный остаток, указанная функциональная группа связана либо с α-карбоксильной группой, либо с карбоксильной группой A1, необязательно через спейсер.
В одном варианте осуществления функциональная группа конъюгата связана непосредственно с аминокислотным остатком A1 циклического пептидомиметика.
В другом варианте осуществления функциональная группа связана с аминокислотным остатком A1 циклического пептидомиметика через спейсер.
Спейсер, связывающий функциональную группу с аминокислотным остатком A1 в циклическом пептидомиметике по настоящему изобретению, может быть выбран из группы природной или неприродной аминокислоты, группы небольшого пептида, имеющего не более 8 аминокислот, остатка диамина, C1-C25гидрокарбилена или растворимого полимера.
В одном варианте осуществления спейсер представляет собой группу природной или неприродной аминокислоты, такую как, но не ограничиваясь ими, Gly, β-аланин (β-Ala), Phe, D-Phe, 1-нафтилаланин (1-Nal), D-1-нафтилаланин (D-1-Nal), γ-аминомасланая кислота (GABA) и 3-(аминометил)бензойная кислота. В случаях, когда A1 циклического пептидомиметика представляет собой остаток аминокислоты, содержащей аминогруппу боковой цепи, эти спейсеры связаны через их α-карбоксильную группу с α-аминогруппой или аминогруппой боковой цепи A1 и через их α-аминогруппу с карбоксильной группой функциональной группы. Альтернативно, в случаях, когда A1 представляет собой остаток дикарбоновой аминокислоты, спейсеры связаны через их α-аминогруппу с α-карбоксильной группой или карбоксильной группой боковой цепи A1 и через их α-карбоксильную группу с аминогруппой функциональной группы.
В другом варианте осуществления спейсер представляет собой группу небольшого пептида, имеющего не более восьми аминокислот. В случаях, когда A1 циклического пептидомиметика представляет собой остаток аминокислоты, несущей аминогруппу боковой цепи, эти спейсеры связаны через их C-концевую карбоксильную группу с α-аминогруппой или аминогруппой боковой цепи A1 и через их N-концевую аминогруппу с карбоксильной группой функциональной группы. Альтернативно в случаях, когда A1 представляет собой остаток дикарбоновой аминокислоты, спейсеры связаны через их N-концевую аминогруппу с α-карбоксильной группой или карбоксильной группой боковой цепи A1 и через их C-концевую карбоксильную группу с аминогруппой функциональной группы.
В следующем варианте осуществления спейсер представляет собой остаток диамина общей формулы -HN-R'-NH-, где R' отсутствует или представляет собой двухвалентный радикал, содержащий только атомы углерода и водорода, который может быть насыщенным или ненасыщенным, линейным или разветвленным, циклическим или нециклическим или ароматическим и который может быть образован из C1-C12алкана, C2-C12алкена, C2-C12алкина, C3-C10циклоалкана, C3-C10циклоалкена, C6-C14моно- или полициклического ароматического углеводорода, или C6-C14моно- или полициклического ароматического углеводорода, замещенного одним или двумя C1-C2алкилами, C2алкенилами или C2алкинилами. Неограничивающие примеры диаминов, из которых могут быть получены такие остатки, включают гидразин, 1,2-этилендиамин, 1,3-пропилендиамин, 1,4-диаминобутан, 1,5-диаминопентан, 1,6-диаминогексан, 1,7-диаминогептан, 1,8-диаминооктан, 1,9-диаминононан, 1,10-диаминодекан, 1,11-диаминоундекан, 1,12-диаминододекан, п-фенилендиамин, циклопентан-1,3-диамин, циклогексан-1,4-диамин, циклогептан-1,4-диамин, циклооктан-1,5-диамин, нафталин-2,6-диамин и 9H-флуорен-3-6-диамин.
В следующем варианте осуществления спейсер представляет собой C1-C25гидрокарбилен, предпочтительно C1-C10алкилен или фенилен, замещенный двумя концевыми функциональными группами, через которые спейсер связан либо с α-аминогруппой или α-карбоксилом, либо с аминогруппой или карбоксилом боковой цепи, аминокислоты A1 циклического пептидомиметика с одной стороны и с функциональной группой с другой стороны. Такие концевые функциональные группы могут быть выбраны из OH, COOH, SO3H, COSH или NH2, таким образом, образующих простую эфирную, сложноэфирную, амидную группу, группу мочевины, тиоамидную или сульфонамидную группу.
В другом варианте осуществления спейсер представляет собой растворимый полимер, такой как, но не ограничиваясь ими, линейный или разветвленный полиэтиленгликоль (PEG) или его сополимеры, полилактид (PLA) или его сополимеры, сложные полиэфиры, имеющие пригодные функциональные группы на основе PLA, полигликолида (PGA), поликапролактона (PCL) или их сополимеры, или полиамиды на основе полиметкриламида или их сополимеры, причем указанные полимеры имеют пригодные функциональные группы для связывания с аминокислотным остатком A1 циклического пептидомиметика и с функциональной группой, причем функциональные группы представляют собой, например, гидроксигруппу, аминогруппу, карбоксильную группу, меркаптогруппу, группу сульфоновой кислоты и т.п.
В примере 1 далее описан синтез различных конъюгатов, указанных в настоящем документе под арабскими номерами 1-36 полужирным шрифтом, в которых различные лиганды αvβ3 и αvβ5 интегринов общей формулы I связаны либо непосредственно, либо через спейсер, с флуоресцентным зондом, в частности, BTA, FITC или дансилом; производным бактериохлорофилла, в частности, Pd-BTA; или хелатирующим агентом, в частности, DTPA или DOTA. Перечень полученных конъюгатов, а также их структурные характеристики, обобщенно представлены в таблице 1. В примере 2 описан синтез различных конъюгатов, указанных в настоящем документе арабскими номерами 41-48 полужирным шрифтом, в которых различные лиганды αvβ3 и αvβ5 интегринов общей формулы II связаны непосредственно с группой флуоресцентного зонда BTA в качестве модельной функциональной группы. Перечень полученных конъюгатов, а также их структурные характеристики, обобщенно представлены в таблице 2. Химические структуры различных используемых функциональных групп, когда они связаны с циклическим пептидомиметиком, представлены на схеме 2.
Конъюгаты 1-36 тестировали в отношении связывания с клетками карциномы яичника человека MLS, с использованием как анализа связывания интегринов in vitro, так и модели карциномы яичника in vivo. Некоторые из этих конъюгатов также тестировали в отношении связывания с клетками карциномы толстого кишечника человека HT29 как in vivo, так и in vitro и конъюгаты 1 и 4 далее тестировали в отношении связывания с клетками рака предстательной железы LNCaP как in vitro, так и in vivo. Конъюгаты 41-48 тестировали в отношении связывания с клетками карциномы яичника человека MLS с использованием анализа связывания интегринов in vitro и активные конъюгаты также тестировали с использованием модели карциномы яичника in vivo. Конъюгаты 41 и 42 тестировали в отношении связывания с клетками карциномы толстого кишечника человека HT29 как in vivo, так и in vitro и конъюгат 41 далее тестировали в отношении связывания с клетками рака предстательной железы LNCaP, как in vitro, так и in vivo.
При скрининге в отношении биологической активности различных конъюгатов на основе RGD-содержащих циклических пептидомиметиков общей формулы I, было выявлено, что определенные структурные характеристики циклического пептидомиметика, т.е. размер кольца циклического соединения и размер и структура остатка диамина, присутствующего в некоторых из циклических соединений, а также спейсер, связывающий циклическое соединение и функциональную группу, могут влиять на биологическую активность конъюгата, как описано в настоящем документе ниже.
В примере 3 показана биологическая активность различных конъюгатов с флуоресцентным зондом, содержащих циклические пептидомиметики общей формулы I с различными размерами кольца. Размер кольца циклического пептидомиметика изменяли путем изменения двух структурных параметров циклического соединения, в частности, (i) аминокислотный остаток, связанный через его α-карбоксильную группу или карбоксильную группу боковой цепи с NH основной цепи и через его α-аминогруппу или аминогруппу боковой цепи с α-карбоксильной группой остатка аспарагиновой кислоты, т.е. A1 в общей формуле I; и (ii) радикал, связывающий карбонил основной цепи и NH основной цепи, т.е. радикал X в общей формуле I. Конкретные используемые аминокислотные остатки A1 представляли остатки Dap, Dab, Orn или Lys, имеющие от одного до четырех элементов метилена в боковой цепи, соответственно; и различные используемые радикалы X представляли собой -NH-, -NH(CH2)2-4- и -NH(CH2)6-, которые вместе с NH основной цепи образуют группу либо гидразина, либо определенного алкилдиамина. Как конкретно показано, биологическая активность протестированных конъюгатов возрастала при увеличении размера кольца циклического пептидомиметика от 16 атомов до 19-20 атомов; однако она снижалась при дальнейшем увеличении размера кольца. Эти результаты указывают на то, что в то время как связь через мочевину, связывающая α-аминогруппу остатка аргинина и радикал X, делает циклическое соединение более жестким, более крупное кольцо, имеющее вплоть до 19-20 атомов, является более гибким для принятия желательной конформации для связывания интегрина. С другой стороны, в случаях, где размер кольца циклического пептидомиметика превышает 20 атомов, циклическое соединение, вероятно, не может принять желательную конформацию для связывания интегрина.
В примере 4 показана биологическая активность различных конъюгатов BTA, содержащих циклические пептидомиметики общей формулы I, имеющие различные остатки диаминов, связанные амидными связями либо с α-карбоксильной группой, либо с карбоксильной группой боковой цепи аминокислотного остатка A1 и через C=O основной цепи с α-аминогруппой остатка аргинина. Конкретные протестированные конъюгаты представляли собой конъюгаты, в которых аминокислотный остаток A1 представляет собой Orn, группа BTA непосредственно связана с N-концом кольца пептидомиметика, и радикал, обозначенный как X, представляет собой радикал формулы -NH(CH2)2-4-, 1,3-диметилбензол-1,3-диил или пиперидин-1,4-диил. Как конкретно показано, биологическая активность конъюгатов, в которых остаток алкилдиамина связывает A1 и C=O основной цепи, снижалась при увеличении длины алкильной цепи. Более того, в случаях, когда радикал, обозначенный как X, был образован из м-ксилола или пиперидина, биологическая активность не определялась, указывая на то, что кольца пептидомиметика в таких конъюгатах являются жесткими и принимают конформацию, нежелательную для взаимодействия с интегрином.
В примере 5 показана биологическая активность различных конъюгатов с флуоресцентным зондом, содержащих циклические пептидомиметики общей формулы I, имеющие различные спейсеры, связывающие N-конец циклического пептидомиметика и группу флуоресцентного зонда. Конкретные используемые спейсеры представляли собой группы различных природных или неприродных аминокислот, в частности, Gly, β-Ala, Phe, D-Phe, 1-Nal, D-1-Nal, GABA и 3-(аминометил)бензойной кислоты, или остатки различных диаминов, в частности, 1,2-этилендиамина и 1,4-диаминобутана. Как показано, конъюгаты с BTA, в которых группа флуоресцентного зонда непосредственно связана с циклическим пептидомиметиком, продемонстрировали высокую биологическую активность, вероятно вследствие того, что группа BTA не препятствует связыванию циклического соединения с интегрином. В противоположность этому, конъюгаты, в которых в качестве спейсеров использовали группы Gly или β-Ala, имеющие увеличенное расстояние между циклическим пептидомиметиком и группой BTA, продемонстрировали более низкую активность, вероятно вследствие большого объема группы BTA. Интересно, что когда расстояние между циклическим пептидомиметиком и группой BTA далее увеличивали с использованием группы GABA в качестве спейсера, биологическая активность конъюгата была выше, чем у конъюгатов, в которых в качестве спейсеров использовали группы Gly или β-Ala, возможно указывая на то, что GABA является достаточно длинной для обеспечения большей свободы для связывания циклического пептидомиметика с интегрином; однако не является слишком длинной для обеспечения укладки группы BTA над кольцом пептидомиметика. В случаях, когда использовали FITC и дансил, которые являются меньшими, чем BTA, расстояние между группой флуоресцентного зонда и N-концом циклического пептидомиметика не влияло на биологическую активность конъюгата. Как показано далее, конъюгаты с BTA, в которых в качестве спейсеров использовали группы Phe, 1-Nal, D-Phe или D-1-Nal, были более активными, чем соответствующий конъюгат, в котором использовали группу Gly, возможно вследствие ароматической боковой цепи фенилаланина или нафтилаланина, которая обеспечивает взаимодействие с гидрофобным карманом интегрина. Следует отметить, что биологическая активность конъюгата, в котором в качестве спейсера использовали группу D-Phe, была больше, чем у конъюгатов, в которых использовали группы Phe или 1-Nal, указывая на то, что D-конфигурация может соответствовать гидрофобному карману интегрина лучше, чем L-конфигурация. D-1-Nal является менее реакционноспособным, чем D-Phe, указывая на то, что фенильное кольцо соответствует гидрофобному карману лучше, чем нафтил. Следует отметить, что конъюгаты 32 и 33, в которых в качестве спейсеров использовали остатки 1,2-этилендиамина или 1,4-диаминобутана, соответственно, и между циклическим пептидомиметиком и спейсером образована связь через мочевину, имели биологическую активность, сходную с активностью конъюгатов 10 и 11, указывая на то, что связь через мочевину имеет практически такую же активность, что и амидная связь, и она не влияет на конформацию пептидомиметика. Сильная биологическая активность конъюгата 33, по сравнению с активностью конъюгата 32, может быть следствием расстояния, составляющего четыре элемента метилена, между кольцом пептидомиметика и функциональной группы, что дает больше свободы для взаимодействия кольца пептидомиметика с участком связывания на интегрине.
С другой стороны, в примере 6 показано, что конъюгаты с BTA, содержащие циклические пептидомиметики общей формулы I, в которых группа мочевины образована с α-аминогруппой остатка аргинина, имели биологическую активность, сходную с активностью соответствующих конъюгатов, в которых образована группа карбамата, указывая на то, что природа группы, образованной с α-аминогруппой остатка аргинина, не имеет эффекта на биологическую активность конъюгата.
В примере 7 описан синтез четырех конъюгатов не содержащего металла производного бактериохлорофилла, указанных в настоящем документе под арабскими номерами 37-40, состоящих из различных лигандов αvβ3 и αvβ5 интегринов общей формулы I, связанных непосредственно с группой производного BTA, в которой таурин заменен другим нуклеофилом. Как показано, биологическая активность этих конъюгатов, измеренная с использованием анализа связывания интегринов in vitro, была сходной, указывая на то, что в этих случаях аминогруппа не имеет эффекта на биологическую активность и ее поведение является практически таким же, как и поведение сульфоната в таурине.
При скрининге в отношении биологической активности различных конъюгатов на основе RGD-содержащих циклических пептидомиметиков общей формулы II было выявлено, что определенные структурные характеристики циклического пептидомиметика, т.е. размер кольца циклического соединения и характеристики аминокислотного остатка A2, могут влиять на биологическую активность конъюгата, как описано в настоящем документе ниже.
В примерах 8-9 ниже показана биологическая активность различных конъюгатов с BTA, содержащих циклические пептидомиметики общей формулы II с различным размером кольца. Размер кольца циклического пептидомиметика изменяли путем изменения двух структурных параметров циклического соединения, в частности, (i) аминокислотный остаток, связанный с α-карбоксильной группой остатка аспарагиноой кислоты и с карбоксильной группой A2, т.е. аминокислотный остаток A3; и (ii) аминокислотный остаток, связанный через его α-аминогруппу с C=O основной цепи и через его α-карбоксильную группу с аминокислотным остатком A3, т.е. аминокислотный остаток A2. Для исследования эффекта A3 на активность конъюгата тестировали конъюгаты с BTA, имеющие одинаковые аминокислотные остатки A1 и A2, но отличающийся аминокислотный остаток A3, в частности, Dap, Dab, Orn и Lys, имеющий от одного до четырех элементов метилена в боковой цепи, соответственно. Аналогично, для исследования эффекта A2 на активность конъюгата тестировали конъюгаты с BTA, имеющие одинаковые аминокислотные остатки A1 и A3, но отличающийся аминокислотный остаток A2, в частности, Phe, Val, D-Phe, Gly и Asp. Как показано в примере 8, биологическая активность протестированных конъюгатов снижалась при увеличении размера кольца циклического пептидомиметика от 20 атомов до 23 атомов, указывая на то, что оптимальный размер кольца составляет 20 атомов и что больший размер кольца не соответствует участку связывания интегрина. В примере 9 показано, что биологическая активность конъюгатов с гидрофобным аминокислотным остатком A2 была выше, чем биологическая активность конъюгатов, которые являются более полярными, вероятно, вследствие гидрофобных взаимодействий с гидрофобным карманом в участке связывания интегрина, и, кроме того, показано, что D-конфигурация не полностью соответствует гидрофобному карману.
В примере 10 показан уровень конкурентного связывания определенных конъюгатов по настоящему изобретению с интегрином αvβ5 человека, с использованием анализа in vitro, и, в частности, продемонстрировано, что конъюгаты 1, 4, 7, 28 и 41, имеющие количественно одинаковое связывание in vitro, являются более активными, чем конъюгаты 5 и 11.
В примере 11 описано исследование, в котором проводили мониторинг паттернов накопления конъюгатов 1, 4 и 41 в крупных опухолях рака молочной железы с 1 по 7 сутки после инъекции. Как показано, эти конъюгаты накапливались в некротической области опухоли, указывая на то, что конъюгаты по настоящему изобретению можно использовать для диагностических применений, поскольку детекция некротических центров является важным прогностическим маркером при различных типах злокачественной опухоли, например, при раке молочной железы, и детекция краев опухоли является необходимой для полного удаления опухоли.
В примере 12 описано исследование, в котором проводили мониторинг паттернов накопления конъюгатов 1, 4 и 41 в клетках рака предстательной железы, экспрессирующих αvβ3 интегрин вплоть до 2 суток после инъекции. Как показано, наиболее высокий уровень флуоресценции наблюдали в областях опухоли через от 8 до 11-14 ч после инъекции, и конъюгат оставался в опухоли в течение вплоть до 48 ч в случаях конъюгатов 1 и 4, и вплоть до 24 в случае конъюгата 41. Как показано далее, профили накопления этих конъюгатов в опухолях предстательной железы и яичника были практически одинаковыми.
В примере 13 описано исследование токсичности конъюгатов 1, 4 и 41, в котором показано, что через 5 суток после инъекции указанных конъюгатов в дозе 50 мг/кг, не наблюдали признаков некроза или воспаления в печени или почке, указывая на то, что эти конъюгаты не являются токсичными в протестированной дозе.
Ввиду всего вышесказанного, в одном варианте осуществления функциональная группа конъюгата по настоящему изобретению представляет собой группу флуоресцентного зонда, такую как, но не ограничиваясь ими, BTA, FITC, дансил, родамин, эозин и эритрозин.
В одном предпочтительном варианте осуществления конъюгат по настоящему изобретению представляет собой RGD-содержащий циклический пептидомиметик общей формулы I и группу флуоресцентного зонда, где указанный флуоресцентный зонд представляет собой BTA, связанный непосредственно, т.е. без спейсера, с аминокислотным остатком A1, X представляет собой -NH- и A1 представляет собой Dap (обозначенный в настоящем документе как конъюгат 2).
В других предпочтительных вариантах осуществления конъюгат по настоящему изобретению представляет собой конъюгат RGD-содержащего циклического пептидомиметика общей формулы I и группы флуоресцентного зонда, где указанный флуоресцентный зонд представляет собой BTA, связанный непосредственно с A1, X представляет собой -NH-R-, и (i) R представляет собой гидрокарбилен, образованный из этана, и A1 представляет собой Dap, Dab, Orn или Lys, связанный через его α-аминогруппу или аминогруппу боковой цепи с BTA (обозначенные в настоящем документе как конъюгаты 1, 3, 4, 5 и 6, соответственно); (ii) R представляет собой гидрокарбилен, образованный из пропана, н-бутана или н-гексана, и A1 представляет собой Orn (обозначенные в настоящем документе как конъюгаты 24, 25 и 26, соответственно); или (iii) R представляет собой 1,3-диметилбензол-1,3-диил или пиперидин-1,4-диил, и A1 представляет собой Orn (обозначенные в настоящем документе как конъюгаты 15 и 23, соответственно).
В следующих предпочтительных вариантах осуществления конъюгат по настоящему изобретению представляет собой конъюгат RGD-содержащего циклического пептидомиметика общей формулы I и группы флуоресцентного зонда, где указанный флуоресцентный зонд представляет собой дансил, связанный непосредственно с A1, X представляет собой -NH-R-, и (i) R представляет собой гидрокарбилен, образованный из этана, и A1 представляет собой Dap, Orn или Lys (обозначенные в настоящем документе как конъюгаты 19, 18 и 16, соответственно); или (ii) R представляет собой гидрокарбилен, образованный из н-бутана, и A1 представляет собой Orn (обозначенный в настоящем документе как конъюгат 21).
В следующих предпочтительных вариантах осуществления конъюгат по настоящему изобретению представляет собой конъюгат RGD-содержащего циклического пептидомиметика общей формулы I и группы флуоресцентного зонда, где указанный флуоресцентный зонд представляет собой BTA, связанный непосредственно с A1, X представляет собой -O-R-, R представляет собой гидрокарбилен, образованный из этана, и A1 представляет собой Dap или Lys (обозначенные в настоящем документе как конъюгаты 7 и 8, соответственно).
В следующих предпочтительных вариантах осуществления конъюгат по настоящему изобретению представляет собой конъюгат RGD-содержащего циклического пептидомиметика общей формулы I и группы флуоресцентного зонда, где указанный флуоресцентный зонд представляет собой BTA, связанный через спейсер с A1, X представляет собой -NH-R-, R представляет собой гидрокарбилен, образованный из этана, A1 представляет собой Dap, и спейсер представляет собой группу Gly, β-Ala, GABA, Phe, D-Phe, 1-Nal, D-1-Nal или 3-(аминометил)бензойной кислоты, или остаток 1,2-этилендиамина или 1,4-диаминобутана (обозначенные в настоящем документе как конъюгаты 9, 10, 11, 27, 28, 29, 30, 31, 32 и 33, соответственно).
В следующих предпочтительных вариантах осуществления конъюгат по настоящему изобретению представляет собой конъюгат RGD-содержащего циклического пептидомиметика общей формулы I и группы флуоресцентного зонда, где указанный флуоресцентный зонд представляет собой FITC, связанный через спейсер с A1, X представляет собой -NH-R-, R представляет собой гидрокарбилен, образованный из этана, и (i) A1 представляет собой Dap, и спейсер представляет собой группу β-Ala (обозначенный в настоящем документе как конъюгат 12); или (ii) A1 представляет собой Lys, и спейсер представляет собой группу β-Ala или GABA (обозначенные в настоящем документе как конъюгаты 13 и 14, соответственно).
В следующих предпочтительных вариантах осуществления конъюгат по настоящему изобретению представляет собой конъюгат RGD-содержащего циклического пептидомиметика общей формулы I и группы флуоресцентного зонда, где указанный флуоресцентный зонд представляет собой дансил, связанный через спейсер с A1, X представляет собой -NH-R-, и (i) R представляет собой гидрокарбилен, образованный из этана, A1 представляет собой Dap или Lys, и спейспер представляет собой группу Gly (обозначенные в настоящем документе как конъюгаты 20 и 17, соответственно); или (ii) R представляет собой гидрокарбилен, образованный из н-бутана, A1 представляет собой Orn, и спейспер представляет собой группу β-Ala (обозначенный в настоящем документе как конъюгат 22).
В других предпочтительных вариантах осуществления конъюгат по настоящему изобретению представляет собой конъюгат RGD-содержащего циклического пептидомиметика общей формулы II и группы флуоресцентного зонда, где указанный флуоресцентный зонд представляет собой BTA, связанный непосредственно с A1, A1 представляет собой Lys, A2 представляет собой Phe, Val, D-Phe, Gly или Asp, и A3 представляет собой Dap, амидированую по ее C-концу (обозначенные в настоящем документе как конъюгаты 41, 42, 43, 44 и 45, соответственно).
В следующих предпочтительных вариантах осуществления конъюгат по настоящему изобретению представляет собой конъюгат RGD-содержащего циклического пептидомиметика общей формулы II и группы флуоресцентного зонда, где указанный флуоресцентный зонд представляет собой BTA, связанный непосредственно с A1, A1 представляет собой Lys, A2 представляет собой Phe, и A3 представляет собой Dab, Orn или Lys, амидированные по их С-концу (обозначенные в настоящем документе как конъюгаты 46, 47 и 48, соответственно).
Фотодинамическая терапия (PDT) представляет собой нехирургический способ лечения опухолей, при котором вводят нетоксические лекарственные средства, называемые фотосенсибилизирующими средствами, вместе с подачей света для генерирования цитотоксических реакционноспособных активных форм кислорода in situ, которые могут инактивировать клетка. Являясь двойным способом лечения, PDT обеспечивает более высокую специфичность и имеет потенциал к тому, чтобы быть более селективной, и в тоже время менее деструктивной, по сравнению с обычно используемой химиотерапией или лучевой терапией.
В клинике в качестве основных фотосенсибилизирующих средств используют порфирины. Оптимальное проникновение в ткани под действием света происходит, по-видимому, при 650-800 нм. Порфимер натрий (Photofrin®, Axcan Pharma Inc.) представляет собой комплексную и неразделимую смесь мономеров, димеров и олигомеров высшего порядка, полученную из гематопорфирина-IX путем обработки кислотами, которая получила одобрение FDA для лечения рака пищевода и эндобронхиального немелкоклеточного рака легкого.
Вследствие интенсивного поглощения в подходящих областях спектра (650-850 нм) и их легкой деградации после обработки производные хлорофилла и бактериохлорофилла идентифицированы в качестве превосходных сенсибилизаторов для PDT опухолей и они имеют лучшие свойства по сравнению с порфиринами. В частности, бактериохлорофиллы имеют потенциальное преимущество по сравнению с хлорофиллами, поскольку они демонстрируют интенсивные полосы поглощения в инфракарсной области, т.е. при значительно больших длинах волн, чем производные хлорофилла.
Нацеливание фотодинамических реагентов на разрушение сосудов опухоли в противоположность самим опухолевым клеткам может обеспечить терапевтическое преимущество, поскольку рост и развитие клеток опухоли клинически зависят от непрерывного поступления кислорода и питательных веществ. Более того, ожидается, что нацеливание на слой эндотеликальных клеток (EC) сосудов позволит обойти плохое проникновение в строму опухоли терапевтических макромолекул. Хотя на кровеносные сосуды опухоли может влиять микроокружение опухоли и они приобретают ассоциированные с опухолью "признаки", они не являются злокачественными и в меньшей вероятности приобретут устойчивость к лекарственным средствам. Более того, когда направленное против сосудов средство также активно против клеток опухоли, можно ожидать дополнительного увеличения эффективности. Таким образом, комбинируя направленные против сосудов свойства с противоопухолевой цитотоксической активностью в одном лекарственном средстве, можно ожидать повышения его эффективности и, следовательно, требуемая эффективная цитотоксическая доза может снизится.
Селективное нацеливание на сосуды может основываться на отличающейся чувствительности и связанного с этим ответа на лекарственные средства у опухолевых и нормальных кровеносных сосудов. Альтернативно отличающийся эндоцитоз может обеспечить селективный захват цитотоксических или других лекарственных средств. Интегрины αvβ3, αvβ5 и α5β1 идентифицированы в паттернах экспрессии, типичных для ангиогенных эндотелиальных клеток сосудов, ассоциированных, например, с опухолями.
Для достижения этой цели следуют различным стратегиям. Циркулирующие пептиды, пептидомиметики или антитела, которые нацелены на конкретные участки в сосудах, являются привлекательными в качестве переносчиков для терапевтических и диагностических средств, обеспечивающих теоретические преимущества над такими конъюгатами, которые непосредственно нацелены на опухолевые клетки, главным образом расположенные позади физиологических барьеров, таких как стенка кровеносного сосуда.
Chaleix et al. (2003) описали синтез конъюгатов RGD-порфирин в качестве потенциальных кандидатов для применения в PDT, в которых не содержащий металл макроцикл порфирина замещен в каждом из положений 10, 15, 20 4-метилфенилом или ацетилированным глюкозилоксифенилом и в положении 5 остатком линейного RGD-содержащего пептида, связанным с макроциклом через спейсерное звено.
Таким образом, в другом варианте осуществления функциональная группа конъюгата по настоящему изобретению представляет собой группу фотосенсибилизатора, такую как, но не ограничиваясь ими, порфирин, хлорофилл или бактериохлорофилл.
Задачей настоящего изобретения является предоставление конъюгатов фотосенсибилизатора, которые специфично нацеливают сенсибилизатор на сосуды опухоли. Существуют некоторые преимущества для нацеливания фотосенсибилизатора на сосуды над нацеливанием на сосуды общепринятых химиотерапевтических средств. Во-первых, в процессе накопления направленного общепринятого лекарственного средства, оно часто является активным, если оно не является пролекарством, в то время как нацеленный фотосенсибилизатор не является активным до тех пор, пока его локально не облучат. Во-вторых, направленное общепринятое лекарственное средство связывает и действует также на нежелательные мишени, предоставляющие адрес для нацеливания, в то время направленный фотосенсибилизатор активируется только в надлежащем облученном участке. Более того, PDT с фотосенсибилизаторами, нацеленные на признаки эндотелия новых сосудов в опухоли, могут быть исключительно селективными в отношении индукции фотодинамического повреждения эндотелиальных клеток.
Поскольку было описано, что αvβ3 интегрин играет важную роль в метастазировании и ангиогенезе опухоли, которые вовлекают рост новых кровеносных сосудов из ранее существующих сосудов в процессе роста опухоли, он может быть пригодным маркером для роста и распространения опухоли. Таким образом, неинвазивные способы визуализации для визуального мониторинга экспрессии αvβ3 интегрина в реальном времени обеспечивают возможности для оценки терапевтического вмешательства, а также для детекции метастазов.
Интегрины связывают внутриклеточный цитоскелет клеток с внеклеточным матриксом путем распознавания последовательности RGD. RGD-пептиды взаимодействуют с участками рецепторов интегринов, которые могут инициировать процессы передачи сигнала и влиять на многие различные заболевания. Таким образом, участок связывания интегрина RGD является привлекательной фармацевтической мишенью. αvβ3 интегрин имеет участок связывания RGD, и пептиды или пептидомиметики, содержащие последовательность RGD, нацеливаются на αvβ3 интегрин и действуют в качестве его антагонистов.
В бифункциональных конъюгатах по настоящему изобретению свойство нацеливания обеспечивается RGD-содержащим циклическим пептидомиметиком, а эффект PDT обеспечивается фотосенсибилизатором. Эти конъюгаты должны быть способны к нацеливанию сенсибилизатора на новые сосуды первичных солидных опухолей и, возможно, соответствующие метастазы для цели диагностики и для фотодинамического разрушения. Кроме того, они могут действовать в качестве антиангиогенных средств и инициировать апоптотическое разрушение нового эндотелия и доступных для крови клеток опухоли.
В предпочтительных вариантах осуществления функциональная группа представляет собой производное порфирина, хлорофилла или бактериохлорофилла, которое может быть металлсодержащим или не содержащим металл и необязательно замещено на периферии различными заместителями, такими как алкильные, арильные, гетероарильные и/или функциональные группы. Эти функциональные группы могут быть выбраны из положительно заряженных групп, отрицательно заряженных групп, основных групп, которые в физиологических условиях превращаются в положительно заряженные группы, и кислотных групп, которые в физиологических условиях превращаются в отрицательно заряженные группы.
Термин "положительно заряженная группа" относится к катиону, образованному из N-содержащей группы или ониевой группы, не содержащей N. Поскольку эндотелий опухоли характеризуется увеличенным количеством анионных участков, положительно заряженные группы или основные группы, которые превращаются в положительно заряженные группы в физиологических условиях, могут усиливать эффективность нацеливания конъюгатов по настоящему изобретению.
Термин "отрицательно заряженная группа" относится к аниону, образованному из кислоты, и включает карбоксилат (COO-), тиокарбоксилат (COS-), сульфонат (SO3 -) и фосфонат (PO3 2-), и "кислотная группа, которая в физиологических условиях превращается в отрицательно заряженную группу," включает группы карбоновых (-COOH), тиокарбоновых (-COSH), сульфоновых (-SO3H) и фосфоновых (-PO3H2) кислот.
В более предпочтительных вариантах осуществления функциональная группа представляет собой производное хлорофилла или, наиболее предпочтительно, производное бактериохлорофилла, которое может быть природным или синтетическим неприродным производным хлорофилла или бактериохлорофилла, включая соединения, в которых внесены модификации в макроцикл и/или на периферии, и/или центральный атом Mg может отсутствовать или может быть заменен другим атомом металла, пригодным для диагностики и/или для PDT. Примеры таких металлов включают, но не ограничиваются ими, Pd, Pt, Co, Ni, Sn, Cu, Zn, Mn, In, Eu, Fe, Au, Al, Gd, Er, Yb, Lu, Ga, Y, Rh, Ru, Si, Ge, Cr, Mo, Re, Tl и Tc и их изотопы.
В одном конкретном предпочтительном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат RGD-содержащего циклического пептидомиметика общей формулы I и группы производного бактериохлорофилла, где указанное производное бактериохлорофилла представляет собой Pd-BTA, связанное непосредственно с A1, X представляет собой -NH-R-, R представляет собой гидрокарбилен, образованный из этана, и A1 представляет собой Dap (обозначенный в настоящем документе как 34).
В следующем варианте осуществления функциональная группа конъюгата по настоящему изобретению представляет собой хелатирующий агент, т.е. агент, способный хелатировать радионуклид, такой как технеций-99m (99mTc). Неограничивающие примеры таких хелатирующих агентов включают DTPA и DOTA. Такие конъюгаты могут быть пригодны в качестве средств для радиовизуализации и средств для лучевой терапии.
В предпочтительных вариантах осуществления конъюгат по настоящему изобретению представляет собой конъюгат RGD-содержащего циклического пептидомиметика общей формулы I и группы хелатирующего агента, где указанный хелатирующий агент представляет собой DTPA или DOTA, связанный непосредственно с A1, X представляет собой -NH-R-, R представляет собой гидрокарбилен, образованный из этана, и A1 представляет собой Dap (обозначенные в настоящем документе как конъюгаты 35 и 36, соответственно).
Поскольку большинство из используемых в настоящее время химиотерапевтических средств также являются токсичными для нормальных клеток, разработка направленной химиотерапии, т.е. химиотерапевтических лекарственных средств, специфично нацеленных на клетки опухоли, имеет высокое значение. Нацеленные цитотоксические конъюгаты пептида представляют собой гибридные молекулы, состоящие из пептидного носителя, который связывается с рецепторами на опухолевых клетках, и цитотоксической группы. Такой подход эффективно повышает специфичность и эффективность цитотоксического агента при химиотерапии, и также он должен снизить токсические побочные эффекты.
Таким образом, в следующих вариантах осуществления функциональная группа конъюгата по настоящему изобретению представляет собой цитотоксический агент.
В одном предпочтительном варианте осуществления цитотоксический агент по настоящему изобретению представляет собой антрациклиновое химиотерапевтическое средство. Антрациклиновое химиотерапевтическое средство может представлять собой любое химиотерапевтическое средство семейства антрациклинов, включая доксорубицин (также известный как адриамицин), даунорубицин, эпирубицин, идарубицин и митоксантрон. В более предпочтительном варианте осуществления антрациклиновое химиотерапевтическое средство представляет собой доксорубицин, который представляет собой хининсодержащий антрациклин и является наиболее широко назначаемым и эффективным химиотерапевтическим средством, применяемым в онкологии. Доксорубицин показан при широком диапазоне злокачественных опухолей человека, включая опухоли мочевого пузыря, желудка, яичника, легкого и щитовидной железы, и является одним из наиболее активных средств, доступных для лечения рака молочной железы и других показаний, включая острые лимфобластные и миелогенные лейкозы, лимфому Ходжкина и неходжскинские лимфомы, опухоль Юинга и остеогенные опухоли костей, саркомы мягких тканей и детские злокачественные опухоли, такие как нейробластома и опухоль Вильмса.
В других предпочтительных вариантах осуществления цитотоксический агент представляет собой ингибитор митоза, такой как паклитаксел, в настоящее время используемый для лечения пациентов с раком легких, яичника, молочной железы, головы и шеи и развернутых форм саркомы Капоши, а также для профилактики рестеноза, ингибитор топоизомеразы I, такой как камптотецин, или ингибитор топоизомеразы II, такой как эллиптицин.
В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей конъюгат RGD-содержащего циклического пептидомиметика и функциональной группы, как определено выше, или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель.
В одном варианте осуществления фармацевтическая композиция содержит конъюгат циклического пептидомиметика, как определено выше, т.е. циклического пептидомиметика общей формулы I или II, и группы флуоресцентного зонда. В предпочтительных вариантах осуществления фармацевтическая композиция содержит конъюгат, выбранный из группы конъюгатов, состоящей из конъюгатов 1-33 и 41-48, определенных выше. Такие фармацевтические композиции можно использовать в диагностических целях, предпочтительно, для визуализации органов и тканей, например, в способах нацеленной на сосуды визуализации (VTI), более предпочтительно, для диагностики опухолей.
В другом варианте осуществления фармацевтическая композиция содержит конъюгат циклического пептидомиметика, как определено выше, т.е. циклического пептидомиметика общей формулы I или II, и группы фотосенсибилизатора, как определено выше. В предпочтительном варианте осуществления фармацевтическая композиция содержит конъюгат, выбранный из группы конъюгатов, состоящей из конъюгатов 34 и 37-40, определенных выше. Такие композиции можно использовать в фотодинамической терапии (PDT). В одном варианте осуществления фармацевтическая композиция предназначена для применения в онкологии, в частности, для PDT опухолей. Изобретение охватывает любую пригодную солидную опухоль, как первичные опухоли, так и метастазы опухолей, выбранные из, но не ограничиваясь ими, меланомы, рака толстого кишечника, молочной железы, легкого, предстательной железы, головного мозга или головы и шеи. В другом варианте осуществления фармацевтическая композиция предназначена для применения при неонкологических заболеваниях, для PDT неопухолевой ткани или органа. В одном варианте осуществления фармацевтическую композицию используют для лечения сосудистых заболеваний, таких как связанная со старением дегенерация желтого пятна (AMD) или нарушения, такие как ожирение, путем ограничения снабжения сосудами жировой ткани и, таким образом, ингибирования ее роста.
В следующем варианте осуществления фармацевтическая композиция содержит конъюгат циклического пептидомиметика, как определено выше, т.е. циклического пептидомиметика общей формулы I или II, и группы средства, способного хелатировать радионуклид. В предпочтительном варианте осуществления фармацевтическая композиция содержит конъюгат 35 или 36, определенный выше. Такие композиции, когда они являются меченными пригодными радионуклидами, можно использовать для радиовизуализации или лучевой терапии.
В другом варианте осуществления фармацевтическая композиция содержит конъюгат циклического пептидомиметика, как определено выше, т.е. циклического пептидомиметика общей формулы I или II, и группы цитотоксического агента, как определено выше. Такие композиции можно применять для направленной химиотерапии.
Фармацевтическую композицию по настоящему изобретению можно получать общепринятыми способами, например, как описано в Remington: The Science and Practice of Pharmacy, 19th Ed., 1995. Композиция может быть в твердой, полутвердой или жидкой форме и, кроме того, она может включать фармацевтически приемлемые наполнители, носители или разбавители и другие инертные ингредиенты и эксципиенты. Более того, фармацевтическая композиция может быть предназначена для медленного высвобождения конъюгата. Композицию можно вводить любым пригодным путем, например внутривенно, перорально, парентерально, ректально или трансдермально. Дозировка зависит от состояния пациента, а также ее может определить специалист, как сочтет пригодным.
Путь введения может быть любым путем, который эффективно транспортирует активное соединение в соответствующую или желаемую область действия, причем внутривенный путь является предпочтительным. Если для перорального введения используют твердый носитель, препарат может быть таблетированным, помещенным в твердую желатиновую капсулу в порошковой или гранулярной форме, или он может быть в форме пастилки. Если используют жидкий носитель, препарат может быть в форме сиропа, эмульсии или мягкой желатиновой капсулы. Для перорального применения особенно пригодны таблетки, драже или капсулы, содержащие тальк и/или углеводный носитель, или связующее вещество, или сходные с ними. Предпочтительные носители для таблеток, драже или капсул, включают лактозу, кукурузный крахмал и/или картофельный крахмал.
Таким образом, в другом аспекте настоящее изобретение относится к применению конъюгата RGD-содержащего циклического пептидомиметика и функциональной группы, как определено выше, или его фармацевтически приемлемой соли для получения фармацевтической композиции для диагностических целей, фотодинамической терапии (PDT), радиовизуализации или лучевой терапии, или направленной химиотерапии.
В следующем аспекте настоящее изобретение относится к конъюгату RGD-содержащего циклического пептидомиметика и функциональной группы, как определено выше, или его фармацевтически приемлемой соли, для диагностических целей, фотодинамической терапии (PDT), радиовизуализации или лучевой терапии, или направленной химиотерапии.
Изобретение далее проиллюстрировано следующими неограничивающими примерами.
ПРИМЕРЫ
МАТЕРИАЛЫ И МЕТОДЫ
(i) Материалы
2-хлортритилхлоридная смола, Fmoc-Asp-O-аллил, Fmoc-Gly-OH, Fmoc-Arg(Pbf)-OH, Fmoc-β-Ala-OH, Fmoc-GABA-OH, моно-Fmoc-диамины, HOBt, PyBOP, HATU и HOAt были приобретены у Novabiochem (США). Fmoc-Dap(Alloc)-OH, Fmoc-Dab(Alloc)-OH и Fmoc-Lys(Alloc)-OH были приобретены у Bachem (Швейцария). Fmoc-Orn(Alloc)-OH, гидрохлорид 1-Fmoc-4-аминопиперидина и 4-(Boc-аминометил)анилин были приобретены у NeoMPS (Франция). FITC, дансилхлорид, DIEA, DIC, DMBA, натриевая соль диэтилдитиокарбаминовой кислоты, TFE, TIS, ТФА, сухой ДХМ и MeOH были приобретены у Sigma (США). Тетракис(трифенилфосфин)палладий был приобретен у Acros (Бельгия). ДМФА, ДХМ и ацетонитрил были приобретены у J.T. Baker (США). DTPA и DOTA были приобретены у Macrocyclics (США).
Спектры UV-Vis были получены с использованием спектрофотометра Shimadzu 1240UV-Vis. ВЭЖХ-МС анализ проводили с использованием устройства для ВЭЖХ Agilent 1100, оборудованного обращенно-фазовой колонкой YMC Pro-RP-C18, соединенной с масс-спектрометром с одной квадрупольной линзой Applied Biosystems 150EX. Анализы ВЭЖХ проводили (если нет иных указаний) в стандартных условиях: градиент 20-95% ацетонитрила в воде (pH 4,5, поддерживаемый уксусной кислотой) в течение 30 минут при скорости потока 0,2 мл/мин. Препаративную ВЭЖХ проводили с использованием системы Waters Delta Prep 4000, оборудованной настраиваемым детектором поглощения Waters 486 UV-VIS и коллектором фракций Waters, контролируемым программой Millenium v3.05. Скорость потока была установлена на 75 мл/мин с использованием препаративной колонки (Vydac C18, 218TP101550, 50×250 мм, 10-15 мкм). Растворители, используемые в очистке способом ВЭЖХ, представляли собой растворитель A (50 мМ раствора ацетата аммония в H2O) и растворитель B (ацетонитрил). Планшеты для ELISA считывали на устройстве Thermo Labsystems Multiscan Spectrum instrument. Флуоресцентную визуализацию проводили с использованием системы для визуализации Xenogen IVIS® 100 Series Imaging System (Alameda, Калифорния).
(ii) Общий способ присоединения Fmoc-диамина к H-Arg(Pbf)-Gly-Asp( α O-аллил)-2-хлортритиловой смоле
Моно-Fmoc-диамингидрохлорид (1,05 ммоль) растворяли в ДХМ (10 мл). К раствору добавляли DIEA (1,26 ммоль) и перемешивали его в течение 1 мин с последующим добавлением BTC (0,35 ммоль) и DIEA (3,15 ммоль). Полученный раствор добавляли к 0,21 ммоль пептидилсмолы, предварительно промывали ДХМ и ему позволяли взаимодействовать в течение 1 ч. После присоединения смолу промывали ДХМ (3×6 мл, 1 мин каждый раз) и ДМФА (6×6 мл, 1 мин каждый раз). Мониторинг завершения присоединения проводили качественным тестом с нингидрином (тест Кайзера).
(iii) Общий способ присоединения BTA или Pd-BTA к пептидилсмоле
BTA (0,42 ммоль), PyBOP (0,42 ммоль) и HOBt (0,42 ммоль) растворяли в ДМФА (10 мл) и затем в раствор добавляли DIEA (1,89 ммоль) и перемешивали в течение 5 мин. Полученный раствор добавляли к 0,21 ммоль пептидилсмолы и встряхивали в течение 2 ч в атмосфере аргона. После присоединения смолу промывали ДМФА (6-8×6 мл, 1 мин). Мониторинг завершения присоединения проводили качественным тестом с нингидрином. Присоединение Pd-BTA к циклической пептидилсмоле проводили в тех же условиях присоединения, которые описаны для BTA.
(iv) Общий способ присоединения FITC к пептидилсмоле
К 0,21 ммоль пептидилсмолы добавляли раствор FITC (0,63 ммоль) в ДМФА (5 мл) и встряхивали в течение 1,5 ч. После присоединения смолу промывали ДМФА (6×6 мл, 1 мин каждый раз). Мониторинг завершения реакции присоединения проводили качественным тестом с нингидрином.
(v) Общий способ для присоединения дансилхлорида к пептидилсмоле
Раствор дансилхлорида (1,05 ммоль) и DIEA (1,47 ммоль) в ДХМ (5 мл) добавляли к 0,21 ммоль пептидилсмолы, предварительно промытой ДХМ, и позволяли им взаимодействовать в течение 1 ч. После присоединения смолу промывали ДХМ (5×5 мл, 1 мин) и ДМФА (2×5 мл, 1 мин). Мониторинг завершения реакции присоединения проводили качественным тестом с нингидрином.
(vi) Получение защищенного дипептида Fmoc-Arg(Pbf)-Gly-OH, строительного блока для синтеза пептидов
Раствор Fmoc-Gly-OH (4,162 г; 14 ммоль) и DIEA (9,755 г; 56 ммоль) в сухом ДХМ (100 мл) перемешивали с 10 г 2-хлортритилхлоридной смолы (вместо 1,4 ммоль/г) в течение 1 ч при комнатной температуре. Смесь переносили в реактор, оборудованный дном из спеченного стекла и смолу промывали ДХМ/MeOH/DIEA (17:2:1) (3×100 мл), ДХМ (3×100 мл), ДМФА (3×100 мл), ДХМ (2×100 мл), MeOH (2×100 мл) и ДМФА/ДХМ (1:1) (3×100 мл). Группу Fmoc удаляли обработкой 5% пиперидином в ДМФА/ДХМ (1:1) (100 мл, 10 мин), а затем 20% пиперидином в ДМФА (100 мл, 5 мин и 2×15 мин) и промыванием смолы ДМФА (7×100 мл). Fmoc-Arg(Pbf)-OH (18,17 г; 28 ммоль) в ДМФА (130 мл) активировали посредством DIC (4,34 мл; 28 ммоль) и HOBt (4,29 г; 28 ммоль) в течение 15 мин при комнатной температуре и добавляли в реакционную емкость. Затем смесь встряхивали в течение 2 ч при комнатной температуре. Пептидилсмолу промывали ДМФА (5×100 мл), ДХМ (3×100 мл), MeOH (2×100 мл) и ДХМ (3×100 мл) и сушили в вакууме в течение 3 ч. Защищенный дипептид отщепляли от смолы перемешиванием с раствором AcOH/TFE/ДХМ (1:1:3) (250 мл) в течение 1 ч при комнатной температуре. Смолу фильтровали и промывали тем же раствором (3×50 мл). Объединенные фильтраты смешивали с н-гексаном для удаления AcOH в виде азеотропной смеси и выпаривали с получением маслянистого осадка, который отверждался при обработке холодным простым эфиром (1 л). Фильтрация и промывание холодным эфиром (150 мл) привели к белому порошку (8,64 г; 87,5%) с гомогенностью приблизительно 99% (ВЭЖХ). C36H43N5O8S. MS (LC-MS): вычислено m/z=705,84; найдено: 706,30 (M+H). Продукт использовали без дальнейшей очистки.
(vii) Общий способ для отщепления конъюгата пептида от смолы
После конъюгации пептидилсмолу промывали ДМФА (5×3 мл) и ДХМ (5×3 мл), а затем сушили при пониженном давлении в течение 3 ч. Конъюгат пептида отщепляли от смолы с использованием смеси для расщепления ТФА/тиоанизол/H2O/TIS (85:5:5:5) (6 мл) в течение 5 мин при 0°С, а затем в течение 1 ч при комнатной температуре. Смолу фильтровали и промывали той же смесью для расщепления (4 мл). Объединенные фильтраты выпаривали в потоке N2 до приблизительно половины объема и пептид осаждали добавлением холодного простого эфира (25 мл). Центрифугирование и удаление слоя простого эфира и дополнительная обработка холодным простым эфиром (2×25 мл) привели к незащищенному пептиду, который сушили в вакууме в течение 6 ч. Неочищенный продукт очищали посредством ОФ-ВЭЖХ.
(viii) Тест связывания интегринов посредством ELISA
На иммуномодульные стрипы Nunc (Nunclon, по каталогу № 167008, Daniel Biotech, Израиль) наносили в течение ночи 2 мкг/мл αvβ3 интегрина человека (Chemicon, по каталогу № CC1020, Biotest, Израиль), растворенного в 0,06 M карбонатно-бикарбонатном буфере. Стрипы блокировали в течение 2 ч при комнатной температуре 2% бычьим сывороточным альбумином (BSA) (Sigma, по каталогу № A-9647, Израиль) в фосфатно-солевом буфере (PBS) (Biochemical Industries, Израиль). В покрытые стрипы добавляли смесь c[RGDfK]-биотина (10-3 M) и тестируемого соединения в различных концентрациях (10-2, 10-3, 10-4 и 10-5 M), разбавленную в буфере для анализа (50 мМ Tris HCl, pH 7,7, 0,5% BSA, 0,15 M NaCl, 0,01% Tween 20), и инкубировали их в течение ночи при комнатной температуре при встряхивании. После промывания PBS, добавляли антитела против биотина, меченные щелочной фосфатазой (1:200) (Miltenyi Biotec, Almog, Израиль) и инкубировали в течение 1 ч при комнатной температуре. Образцы инкубировали с п-нитрофенилфосфатным субстратом (p-NPP, Calbiochem, Mercury, Израиль) и считывали при 405 нм.
(ix) Модель карциномы яичника in vivo
Самок мышей CD-1 nude (7-9 недель, 23-28 г) подвергали анестезии и им подкожно (SC) имплантировали суспензию клеток карциномы яичника человека MLS (полученных от Prof. M. Neeman, the Weizmann Institute of Science, Израиль) (2-3×106 клеток/мышь). Опухоли достигали размера с диаметром 6-8 мм, пригодного для обработки, в течение 2-3 недель.
Животных подвергали анестезии посредством смеси газов 7:3 N2O:O2, содержащей 2% изофлуран (Medeva, Bethlehem, PA), или посредством внутрибрюшинной (IP) инъекции смеси 5 мг/кг кетамина (Rhone Merieux, Lyon, Франция) и 1 мг/кг ромпуна (Bayer, Leverkusen, Германия) (85:15, об.:об.).
(x) Модель карциномы толстого кишечника in vivo
Эта модель сходна с моделью карциномы яичника in vivo, описанной в (ix) выше, за исключением того факта, что вместо клеток карциномы яичника человека MLS использовали клетки карциномы толстого кишечника человека HT29 (ATCC, США, 2-3×106 клеток/мышь).
(xi) Модель рака предстательной железы in vivo
Клетки LNCaP (3×106 клеток/мышь) подкожно имплантировали на спину мышей с тяжелым комбинированным иммунодефицитом (SCID). Опухолям позволяли расти в течение 60-70 суток. Когда опухоль достигает размера, подходящего для обработки (0,7-0,8 см3), животных подвергали анестезии и им внутривенно (IV) инъецировали раствор тестируемого соединения. Изображения на IVIS получали через 8, 11, 14, 24 и 48 ч после инъекции.
(xii) Модель рака молочной железы in vivo
Самкам мышей CD-1 nude (6-8 недель, 20-25 г, получены от Harlan Biotech Israel, Rehovot, Израиль) имплантировали клетки рака молочной железы человека MDA-MB-231-RFP (4×106 клеток/мышь). Эти клетки, в действительности, представляли собой клетки рака молочной железы MDA-MB-231 (ATCC, США), трансфицированные геном красного флуоресцентного белка (RFP), таким образом, обладающие красной флуоресценцией. Когда опухоли достигали размера 1-1,5 см3 для некротических опухолей, мышей подвергали анестезии посредством внутрибрюшинной инъекции 30 мкл смеси 85:15 кетамин:ксилазин, а затем в хвостовую вену инъецировали тестируемый конъюгат (15 мг/кг).
(xiii) Протокол флуоресцентной визуализации для конъюгатов BTA-RGD
Тестируемые соединения (8 мг/кг) инъецировали в хвостовую вену имеющих опухоль мышей, находящихся под внутрибрюшинной анестезией. Изображения анестезированных газом животных получали через 6, 8, 10, 12, 14 и 24 ч (в некоторых случаях также через 48 и 72 ч) после инъекции с использованием системы IVIS® 100 Series Imaging System. Фильтры возбуждения и испускания были установлены в IVIS на 710-760 нм и 810-860 нм, соответственно. Фильтр испускания с длиной волны, наиболее близкой к пику испускания соединения, был выбран среди доступных фильтров в стандартной конфигурации IVIS.
(xiv) Протокол флуоресцентной визуализации для конъюгатов FITC-RGD
Тестируемые соединения (8 мг/кг) инъецировали в хвостовую вену имеющих опухоль мышей, находящихся под внутрибрюшинной анестезией. Изображения находящихся под анестезией газом животных получали через 6 и 8 ч после инъекции. Животных умерщвляли через 8 ч, извлекали из них органы (опухоль, почка, печень) и получали изображения органов с использованием системы IVIS® 100 Series Imaging System. Фильтры возбуждения и испускания были установлены в IVIS на 445-490 нм и на 515-575 нм, соответственно. Фильтр испускания с длиной волны, наиболее близкой к пику испускания FITC, был выбран среди доступных фильтров в стандартной конфигурации IVIS.
(xv) Анализ связывания in vitro
Клетки карциномы яичника MLS культивировали в качестве монослоев в минимальной необходимой среде (MEM-альфа), содержащей 1 г/л D-глюкозы, pH 7,4, 10% эмбриональную телячью сыворотку (FCS), глутамин (2 мМ), пенициллин (0,06 мг/мл) и стрептомицин (0,1 мг/мл), и выращивали при 37°С в увлажненной атмосфере с 5% CO2. За 48 ч до эксперимента клетки высевали в 6-ячеечные чашки (3×105 клеток/чашка).
Экспрессия α V β 3 интегрина на клетках MLS
Клетки выращивали на покровных стеклах. После прекращения подпитки сыворотки на ночь, фиксации 4% параформальдегидом (Sigma, Израиль) и повышения проницаемости 0,2% Triton X-100 (Sigma, Израиль) клетки инкубировали в блокирующем растворе (10% сыворотка лошади) (Biological Industries, Израиль) в течение 1 ч при комнатной температуре. Затем клетки инкубировали с антителами мыши против интегрина αvβ3 человека (1:100) (Chemicon, Biotest, Израиль) в течение 1 ч при комнатной температуре. Клетки обрабатывали вторичными меченными FITC антителами кролика против IgG мыши (1:200) (Sigma, Израиль) в течение 1 ч при комнатной температуре. Визуализацию проводили под флуоресцентным микроскопом (Nikon Optiphot2, Япония), оборудованным цифровой камерой (DVC Company, Inc., Austin, TX).
Анализ связывания in vitro
RGD-конъюгаты сначала растворяли в ДМСО с получением 4×10-3 M. Затем исходные растворы разбавляли 1:40 в культуральной вреде и добавляли к клеткам MLS или HT29 (100 мкМ/лунка). Клетки инкубировали при 37°С в увлажненной атмосфере с 5% CO2 в течение 3 ч. Затем клетки промывали 3 раза PBS и получали их изображения на системе Xenogen IVIS® 100 Series Imaging System. Фильтры возбуждения и испускания, установленные в IVIS для BTA-RGD, представляли собой 710-760 нм и 810-860 нм, соответственно, и для FITC-RGD они представляли собой 445-490 нм и 515-575 нм, соответственно.
(xvi) Эксперименты по конкурентному связыванию (определение IC 50 )
На иммуномодульные стрипы MAXISORP (Nunc, Danyel Biotech, Израиль) наносили 50 мкл/лунка 2 мкг/мл интегрина αvβ3 человека (Chemicon, США) в течение ночи и блокировали 2% BSA (Sigma, Израиль) в течение 2 ч при комнатной температуре. После промывания забуференным Tris физиологическим раствором с Tween (TBST), добавляли смесь RGD-пептид c[RGDfK]-биотин (10-3 M) и тестируемый RGD-конъюгат в различных концентрациях (10-2, 10-3, 10-4 и 10-5 M) в трех экземплярах и инкубировали в течение ночи при встряхивании при комнатной температуре. После промывания буфером PBS добавляли антитела против биотина, меченные щелочной фосфатазой (1:200) (Miltenyi Biotec, Германия), и инкубировали в течение 1 ч при комнатной температуре. Образцы инкубировали с субстратом p-NPP и считывали при 405 нм Multiscan Spectrum (Labotal, Израиль). Данные наносили на график зависимости процента связывания от концентрации RGD-конъюгата и определяли величину IC50.
Пример 1. Синтез конъюгатов на основе RGD-содержащих циклических пептидомиметиков общей формулы I
1(i) Синтез конъюгатов BTA- и Pd-BTA-циклический пептидомиметик, обозначенных в настоящем документе как конъюгаты 1, 3-6, 15, 23-26 и 34 - способ A
Трипептидную Fmoc-Arg(Pbf)-Gly-Asp(αO-аллил)-2-хлортритильную смолу получали на твердой фазе путем присоединения Fmoc-Arg(Pbf)-Gly-OH к смоле, связанной с H-Asp-O-аллильным остатком.
Присоединение первой аминокислоты проводили путем смешивания 2-хлортритилхлоридной смолы (300 мг, вместо 1,4 ммоль/г) с раствором Fmoc-Asp-O-аллил (83 мг, 0,21 ммоль) и DIEA (147 мкл, 0,84 ммоль) в 5 мл сухого ДХМ в течение 1 ч при комнатной температуре для получения нагрузки приблизительно 0,7 ммоль/г. После завершения присоединения смолу обрабатывали (промывание и удаление Fmoc), как описано в разделе "Материалы и методы" с соответствующими объемами растворителей и растворов реагентов. Fmoc-Arg(Pbf)-Gly-OH (223 мг, 0,315 ммоль), HOBt (48 мг, 0,315 ммоль) и DIG (49 мкл, 0,315 ммоль) растворяли в 5 мл ДМФА и перемешивали при комнатной температуре в течение 20 мин. Полученный раствор добавляли к промытой H-Asp-O-аллилсмоле и смесь встряхивали в течение 2 ч при комнатной температуре. Пептидилсмолу промывали ДМФА (5×5 мл). Удаление группы Fmoc проводили добавлением 20% пиперидина (5 мл) в ДМФА (2×15 мин) с последующим промыванием ДМФА (7×5 мл, 1 мин). Присоединение Fmoc-диамина проводили, как описано в разделе "Материалы и методы" с последующим удалением защитной группы Fmoc и промыванием ДМФА. Присоединение Fmoc-Lys(Alloc)-OH, а также Fmoc-Dap(Alloc)-OH, Fmoc-Dab(Alloc)-OH и Fmoc-Orn(Alloc)-OH, к тетрапептиду проводили добавлением раствора в ДМФА (5 мл) Fmoc-Lys(Alloc)-OH (0,63 ммоль), предварительно активированного (в течение 15 мин) посредством HOBt (0,63 ммоль) и DIC (0,63 ммоль), при времени присоединения 1 ч. После присоединения смолу промывали ДМФА (6×5 мл, 1 мин). Мониторинг завершения реакции присоединения проводили качественным тестом с нингидрином (тест Кайзера). Удаление аллильной защитной группы и Alloc проводили путем перемешивания пептидилсмолы с раствором [(C6H5)3P]4Pd0 (0,252 ммоль) и DMBA (3,57 ммоль) в ДХМ (5 мл) в течение 2 ч при комнатной температуре в атмосфере аргона. Смолу промывали ДХМ (3×5 мл, 1 мин), ДМФА (3×5 мл, 1 мин), натриевой солью диэтилдитиокарбаминовой кислоты (0,5% в ДМФА, 4×5 мл, 2 мин) и, наконец, ДМФА (5×5 мл, 1 мин). Циклизацию на смоле проводили с использованием раствора PyBOP (0,63 ммоль) и DIEA (1,26 ммоль) в ДМФА (4 мл) в течение 2 ч при комнатной температуре. После удаления защитной группы Fmoc, конъюгации BTA с незащищенной пептидилсмолой, а также отщепления пептида смолыпроводили, как описано в разделе "Материалы и методы". Продукты очищали посредством ОФ-ВЭЖХ.
1(ii) Синтез конъюгата BTA-циклический пептидомиметик, обозначенного в настоящем документе как конъюгат 2 - способ B
Синтез H-Arg(Pbf)-Gly-Asp(αO-аллил)-2-хлортритилсмолы проводили, как описано выше для способа A.
Присоединение гидрохлорида Fmoc-NH-NH 2 к незащищенному трипептиду
Гидрохлорид моно-Fmoc-гидразина (1,05 ммоль) растворяли в смеси 1:1 диоксана и 1,3-дихлорпропана (10 мл). К этому раствору добавляли DIEA (1,26 ммоль) и перемешивали в течение 1 минуты, а затем добавляли BTC (0,35 ммоль) и DIEA (3,15 ммоль). Раствор добавляли к пептидилсмоле (0,21 ммоль) (предварительно промытой 1:1 диоксан:1,3-дихлорпропан) и позволяли ему взаимодействовать в течение 1 ч при 55°C. После присоединения смолу промывали ДХМ (3×6 мл, 1 мин), а затем ДМФА (6×6 мл, 1 мин). Мониторинг завершения реакции присоединения проводили качественным тестом с нингидрином (тест Кайзера). Остальную часть синтеза проводили, как описано для способа A. Продукт очищали посредством ОФ-ВЭЖХ.
1(iii) Синтез конъюгатов BTA-циклический пептидомиметик, обозначенных в настоящем документе как 9-11 и 27-33 - способ C
Синтез циклопентапептида проводили, как описано выше для способа A.
Присоединение аминокислотных спейсеров к циклопентапептиду
Fmoc-аминокислоту (0,63 ммоль Fmoc-Gly-OH, Fmoc-β-Ala-OH, Fmoc-GABA-OH, Fmoc-Phe-OH, Fmoc-D-Phe-OH, Fmoc-1-Nal-OH, Fmoc-D-1-Nal-OH или Fmoc-3-аминометилбензойной кислоты) растворяли в ДМФА (5 мл) и затем добавляли HOBt (0,63 ммоль) и DIC (0,63 ммоль) и позволяли им взаимодействовать в течение 15 мин. Раствор добавляли к циклопентапептид-2-хлортритильной смоле с удаленной защитной группой Fmoc (0,21 ммоль) и его встряхивали в течение 1 ч. Смолу промывали ДМФА (6×5 мл, 1 мин) с последующим удалением защитной группы Fmoc. Присоединение BTA и отщепление пептида от смолы проводили, как описано в разделе "Материалы и методы". Продукты очищали посредством ОФ-ВЭЖХ.
Присоединение диаминовых спейсеров к циклопентапептиду
Гидрохлорид моно-Fmoc-диамина (1,05 ммоль гидрохлорид Fmoc-этилендиамина или гидрохлорид Fmoc-диаминобутана) растворяли в ДХМ (10 мл). К раствору добавляли DIEA (1,26 ммоль) и перемешивали его в течение 1 мин с последующим добавлением BTC (0,35 ммоль) и DIEA (3,15 ммоль). Полученный раствор добавляли к 0,21 ммоль пептидилсмолы, предварительно промытой ДХМ, и позволяли ему взаимодействовать в течение 1 ч. После присоединения смолу промывали ДХМ (3×6 мл, 1 мин каждый раз) и ДМФА (6×6 мл, 1 мин каждый раз). Мониторинг завершения реакции присоединения проводили качественным тестом с нингидрином (тест Кайзера). Присоединение BTA и отщепление пептида от смолы проводили, как описано в разделе "Материалы и методы". Продукты очищали посредством ОФ-ВЭЖХ.
1(iv) Синтез конъюгатов BTA-циклический пептидомиметик, обозначенных в настоящем документе как конъюгаты 7 и 8 - способ D
Синтез H-Arg(Pbf)-Gly-Asp(αO-аллил)-2-хлортритильной смолы проводили, как описано выше для способа A.
Присоединение Fmoc-глицинола к трипептиду с удаленной защитной группой Fmoc
Fmoc-глицинол (1,05 ммоль) растворяли в ДХМ (10 мл), а затем к этому раствору добавляли BTC (0,35 ммоль) с последующим добавлением DIEA (3,15 ммоль). После перемешивания в течение 5 мин полученный раствор добавляли к пептидилсмоле (0,21 ммоль), предварительно промытой ДХМ, и позволяли им взаимодействовать в течение 1 ч при комнатной температуре. Смолу промывали ДХМ (3×6 мл, 1 мин) и ДМФА (6×6 мл, 1 мин). Мониторинг завершения реакции присоединения проводили качественным тестом с нингидрином (тест Кайзера). Остальную часть синтеза проводили, как описано для способа A. Отщепление конъюгата пептида от смолы проводили с помощью раствора ТФА (6 мл), содержащего 15% ДХМ+5% TIS и 5% тиоанизол. Продукты очищали посредством ОФ-ВЭЖХ.
1(v) Синтез конъюгатов FITC-циклический пептидомиметик, обозначенных в настоящем документе как конъюгаты 12-14 - способ E
Синтез циклопентапептида проводили, как описано выше для способа A. После удаления защитной группы Fmoc, раствор Fmoc-β-Ala-OH или Fmoc-GABA-OH (0,63 ммоль), HOBt (0,63 ммоль) и DIC (0,63 ммоль) в ДМФА (5 мл) перемешивали в течение 15 мин, добавляли к пептидилсмоле (0,21 ммоль) и позволяли ему взаимодействовать в течение 1 ч. Смолу промывали ДМФА (6×5 мл, 1 мин). Удаление группы Fmoc проводили путем добавления 20% пиперидина в ДМФА (2×15 мл, 15 мин) с последующим промыванием ДМФА (6×5 мл, 1 мин). Присоединение FITC к незащищенной пептидилсмоле и отщепление пептида от смолы проводили, как описано в разделе "Материалы и методы". Продукты очищали посредством ОФ-ВЭЖХ.
1(vi) Синтез конъюгатов дансил-циклический пептидомиметик, обозначенных в настоящем документе как конъюгаты 16-22 - способ F
Синтез циклического пептида проводили, как описано выше для способа A, и после удаления защитной группы Fmoc соединения непосредственно подвергали взаимодействию с дансилхлоридом, как описано в разделе "Материалы и методы".
Соединения, содержащие спейсер, подвергали взаимодействию сначала с Fmoc-Gly-OH или, альтернативно, с Fmoc-β-Ala-OH, в тех же условиях, которые описаны для способа E, с последующим присоединением дансилхлорида. Отщепление пептида от смолы проводили, как описано в разделе "Материалы и методы". Продукты очищали посредством ОФ-ВЭЖХ.
1(vii) Синтез конъюгата DTPA-циклический пептидомиметик, обозначенного в настоящем документе как конъюгат 35 - способ G
Синтез циклического пептида проводили, как описано выше для способа A. После удаления защитной группы Fmoc, к пептидилсмоле (0,14 ммоль) добавляли раствор DTPA-tetra (t-Bu-сложный эфир) (0,42 ммоль) в ДМФА (3 мл), активированного HATU (0,42 ммоль), HOAt (0,42 ммоль) и DIEA (0,42 ммоль) и встряхивали в течение 2 ч при комнатной температуре. Смолу промывали ДМФА (4 мл, 5 раз, 1 мин каждый раз). Отщепление пептида от смолы проводили, как описано в разделе "Материалы и методы".
1(viii) Синтез конъюгата DOTA-циклический пептидомиметик, обозначенного в настоящем документе как конъюгат 36 - способ H
Синтез циклического пептида проводили, как описано выше для способа A. После удаления защитной группы Fmoc к пептидилсмоле (0,14 ммоль) добавляли раствор DOTA-трис (t-Bu-сложный эфир) (0,42 ммоль) в ДМФА (3 мл), активированного HATU (0,42 ммоль), HOAt (0,42 ммоль) и DIEA (0,42 ммоль) и встряхивали в течение 3 ч при 60°С. Смолу промывали ДМФА (4 мл, 5×1 мин). Отщепление пептида от смолы проводили, как описано в разделе "Материалы и методы".
В таблице 1 приведены синтезированные конъюгаты и их структурные характеристики.
Таблица 1
Конъюгаты на основе синтезированных циклических пептидомиметиков общей формулы I и способ синтеза
|
Пример 2. Синтез BTA-конъюгатов на основе RGD-содержащих циклических пептидомиметиков общей формулы II
В реакционной емкости, оборудованной дном из спеченного стекла амидной MBHA-смоле Ринка (300 мг, вместо 0,58 ммоль/г), позволяли набухать в ДМФА путем встряхивания в течение ночи. Группу Fmoc удаляли путем обработки 20% пиперидином в ДМФА в течение 15 мин (3 мл). Это действие повторяли два раза. Смолу промывали ДМФА (4 мл, 2 мин, 5 раз). Присоединение Fmoc-Dap(Alloc)-OH, а также Fmoc-Dab(Alloc)-OH, Fmoc-Orn(Alloc)-OH и Fmoc-Lys(Alloc)-OH к смоле проводили путем добавления раствора ДМФА (2,5 мл) Fmoc-Dap(Alloc)-OH (0,52 ммоль), предварительно активированного (в течение 15 мин) посредством HOBt (0,52 ммоль) и DIC (0,52 ммоль), при времени присоединения 1 ч. После присоединения смолу промывали ДМФА (4 мл, 2 мин, 5 раз). Мониторинг завершения реакции присоединения проводили качественным тестом с нингидрином (тест Кайзера). Удаление защитной группы Fmoc и промывание ДМФА после удаления защитной группы Fmoc проводили, как описано выше. Присоединение Fmoc-Asp(O-tBu)-OH, Fmoc-Gly-OH, Fmoc-Arg(Pbf)-OH и Fmoc-Lys(Dde)-OH и удаление защитной группы Fmoc при каждом присоединения проводили в тех же условиях, которые описаны для Fmoc-Dap(Alloc)-OH.
Общий способ для присоединения аллилового сложного эфира аминокислоты к пентапептиду Lys(Dde)-Arg(Pbf)-Gly-Asp(O-tBu)-X-амидная смола Ринка
Аллиловый сложный эфир аминокислоты в виде соли TsOH (0,87 ммоль) растворяли в ДХМ (7 мл). К раствору добавляли DIEA (1,05 ммоль) и перемешивали его в течение 1 мин, с последующим добавлением BTC (0,29 ммоль) и DIEA (2,6 ммоль). Полученный раствор добавляли к 0,174 ммоль пептидилсмолы, предварительно промытой ДХМ, и позволяли ему взаимодействовать в течение 1 ч. После присоединения смолу промывали ДХМ (3×6 мл, 1 мин каждый раз) и ДМФА (6 раз, 6 мл, 1 мин каждый раз). Мониторинг завершения реакции присоединения проводили качественным тестом с нингидрином.
После присоединения аллилового сложного эфира аминокислоты и промывания ДМФА смолу промывали ДХМ (4 раза, 4 мл, 1 мин каждый раз). Удаление аллильной защитной группы и защитной группы Alloc проводили путем перемешивания пептидилсмолы с раствором [(C6H5)3P]4Pd0 (0,21 ммоль) и DMBA (2,61 ммоль) в ДХМ (5 мл) в течение 2 ч при комнатной температуре в атмосфере аргона. Смолу промывали ДХМ (3×5 мл, 1 мин), ДМФА (3×5 мл, 1 мин), натриевой солью диэтилдитиокарбаминовой кислоты (0,5% в ДМФА, 4×5 мл, 2 мин) и, наконец, ДМФА (5×5 мл, 1 мин). Циклизацию на смоле проводили с использованием раствора PyBOP (0,52 ммоль) и DIEA (1,04 ммоль) в ДМФА (4 мл) в течение 2 ч при комнатной температуре. После циклизации группу Dde удаляли добавлением 2% моногидрата гидразина в ДМФА (3 раза, 3 мин каждый раз) с последующим промыванием ДМФА (4 мл, 6 раз, 2 мин каждый раз). Конъюгацию BTA с незащищенной пептидилсмолой, а также отщепление пептида от смолы проводили, как описано в разделе "Материалы и методы". Продукты очищали посредством ОФ-ВЭЖХ.
В таблице 2 приведены синтезированные конъюгаты и их структурные характеристики.
|
Пример 3. Размер кольца циклического пептидомиметика общей формулы I влияет на биологическую активность конъюгата на его основе
Для исследования того, влияет ли размер кольца RGD-содержащего циклического пептидомиметика общей формулы I на биологическую активность конъюгата, активность различных конъюгатов флуоресцентных зондов на основе циклических пептидомиметиков общей формулы I, имеющих различный размер кольца, тестировали как в модели карциномы яичника in vivo, так и в анализе связывания in vitro с использованием клеток карциномы яичника человека, как описано в разделе "Материалы и методы".
Размер кольца RGD-содержащего циклического пептидомиметика изменяли путем изменения двух структурных параметров циклического соединения, в частности, (i) аминокислотного остатка, связанного амидными связями через его α-карбоксильную группу или карбоксильную группу боковой цепи с NH основной цепи и через его α-аминогруппу или аминогруппу боковой цепи с α-карбоксильной группой остатка аспарагиновой кислоты, т.е. радикала A1 в общей формуле I; и (ii) радикала, связывающего карбонил основной цепи и NH основной цепи, т.е. радикала X в общей формуле I. Конкретные используемые аминокислотные остатки представляли собой остатки диаминопропионовой кислоты (Dap), диаминомасляной кислоты (Dab), орнитина (Orn) и лизина (Lys), имеющие от одного до четырех элементов метилена, соответственно, в боковой цепи; и различные используемые радикалы X представляли собой NH, NH(CH2)2, NH(CH2)3, NH(CH2)4 и NH(CH2)6, которые, вместе с NH основной цепи, образуют группу гидразина, диаминоэтана, диаминопропана, диаминобутана и диаминогексана, соответственно, соединяющую A1 и карбонил основной цепи.
В таблице 3 представлены различные протестированные конъюгаты флуоресцентных зондов и их биологическая активность. Как показано, активность протестированных конъюгатов возрастала при увеличении размера кольца циклического пептидомиметика от 16 атомов до 18-20 атомов; однако она снижалась при дальнейшем увеличении размера кольца. Эти результаты указывают на то, что в то время как связь через мочевину, связывающая α-аминогруппу остатка аргинина и радикал X, делает циклический пептидомиметик более жестким, более крупное кольцо, имеющее вплоть до 18-20 атомов, является более гибким для принятия конформации, желательной для связывания интегрина. С другой стороны, в случаях, где размер кольца циклического пептидомиметика превышает 20 атомов, циклический пептидомиметик, вероятно, не может принимать желательную конформацию для связывания интегрина.
|
Пример 4. Размер и структура остатка диамина в циклическом пептидомиметике общей формулы I влияет на биологическую активность конъюгата на его основе
Для исследования того, влияют ли размер и структура остатка диамина, связанного амидными связями либо с α-карбоксильной группой, либо с карбоксильной группой боковой цепи, аминокислотного остатка A1 в общей формуле I и через карбонил основной цепи с α-аминогруппой остатка аргинина, на биологическую активность конъюгата; активность различных конъюгатов BTA на основе циклических пептидомиметиков общей формулы I, имеющих различные остатки диамина, как определено выше, тестировали как в модели карциномы яичника in vivo и в анализе связывания in vitro с использованием клеток карциномы яичника человека, как описано в разделе "Материалы и методы".
Конкретные протестированные конъюгаты представляли собой конъюгаты 4, 24, 25, 15 и 23, в которых аминокислотный остаток A1 представляет собой орнитин; молекула BTA связана с N-концом кольца пептидомиметика без спейсера; и радикал, обозначенный как X в общей формуле I, представляет собой -NH(CH2)2-4-, 1,3-диметилбензол-1,3-диил или пиперидин-1,4-диил, соответственно.
В таблице 4 представлены различные протестированные конъюгаты и их биологическая активность. Как показано, биологическая активность конъюгата 4 была наиболее высокой среди конъюгатов, в которых остатки алкилдиамина связывают A1 и C=O основной цепи, указывая на то, что биологическая активность этих конъюгатов снижается по мере увеличения алкильной цепи. Более того, когда кольцо пептидомиметика становится жестким, как в случаях конъюгатов 15 и 23, где использовали радикалы, отличные от остатков алкилдиамина, биологическая активность не была определена, что указывает на то, что кольцо пептидомиметика в таких конъюгатах принимает конформацию, которая нежелательна для взаимодействия с интегрином.
|
Пример 5. Спейсер, связывающий функциональную группу с циклическим пептидомиметиком общей формулы I, влияет на биологическую активность конъюгата
В этом эксперименте тестировали биологическую активность различных конъюгатов флуоресцентных зондов на основе циклических пептидомиметиков общей формулы I, имеющих различные спейсеры, связывающие группу флуоресцентного зонда и N-конец циклического пептидомиметика, т.е. либо α-аминогруппу, либо аминогруппу боковой цепи аминокислотного остатка A1 как в модели карциномы яичника in vivo, так и в анализе связывания in vitro с использованием клеток карциномы яичника человека, как описано в разделе "Материалы и методы". Конкретные используемые спейсеры представляли собой группы различных природных или синтетических аминокислот, в частности, глицина, β-аланина, фенилаланина, D-фенилаланина, 1-нафтилаланина (1-Nal), D-1-нафтилаланина (D-1-Nal), γ-аминомасляной кислоты (GABA) и 3-(аминометил)бензойной кислоты.
В таблице 5 показаны различные протестированные конъюгаты и их биологическая активность. Как показано, конъюгат 1, не имеющий спейсера между молекулой BTA и циклическим пептидомиметиком, продемонстрировал высокую биологическую активность, вероятно, вследствие того факта, что молекула BTA не препятствует связыванию циклического пептидомиметика с интегрином. В противоположность этому, конъюгаты, в которых в качестве спейсеров использовали группы глицина или β-аланина, имеющие увеличенное расстояние между циклическим пептидомиметиком и молекулой BTA, продемонстрировали более низкую биологическую активность, вероятно, вследствие большого объема молекулы BTA. В случае конъюгата 11, в котором в качестве спейсера использовали группу GABA, т.е. расстояние между циклическим пептидомиметиком и молекулой BTA было далее увеличено, результаты как vitro, так и in vivo продемонстрировали высокую флуоресценцию, вероятно, указывающую на то, что GABA является достаточно длинной для обеспечения большей свободы кольца пептидомиметика для связывания с интегрином; однако не слишком длинной для укладывания молекулы BTA над кольцом пептидомиметика.
В случаях, когда использовали флуоресцентные зонды меньших размеров, т.е. FITC или дансил, расстояние между флуоресцентным зондом и N-концом кольца пептидомиметика не влияло на биологическую активность конъюгатов.
Конъюгаты 27 и 28, в которых в качестве спейсеров использовали группы фенилаланина и D-фенилаланина, соответственно, были более активными, чем конъюгат 9, в котором в качестве спейсера использовали группу глицина, вероятно, вследствие ароматической боковой цепи фенилаланина, которая обеспечивает взаимодействие с гидрофобным карманом интегрина. Биологическая активность конъюгата 28, которая была выше, чем у конъюгата 27, может далее указывать на то, что D-конфигурация фенилаланина может соответствовать гидрофобному карману интегрина лучше, чем L-конфигурация, таким образом, повышая связывание.
Конъюгаты 32 и 33, в которых в качестве спейсеров использовали остатки 1,2-этилендиамина и 1,4-диаминобутана, соответственно, и между кольцом пептидомиметика группой BTA образовывалась связь через мочевину, имели практически такую же биологическую активность, как и конъюгаты 10 и 11, указывая на то, что связь через мочевину имеет практически такую же активность, как и амидная связь, и не влияет на конформацию пептидомиметика.
|
Пример 6. Биологическая активность конъюгатов на основе циклических пептидомиметиков общей формулы I, в которых α-аминогруппа остатка аргинина образует группу мочевины, сходна с биологической активностью конъюгатов, в которых образуется карбаматная группа
В этом эксперименте биологическую активность конъюгатов, в частности, конъюгатов BTA, на основе циклических пептидомиметиков общей формулы I, в которых α-аминогруппа образует группу мочевины, сравнивали с биологической активностью конъюгатов, в которых образуется карбаматная группа.
Конкретные протестированные конъюгаты представляли собой конъюгаты 1 и 5, в которых аминокислотный остаток A1 общей формулы I представляет собой остаток диаминопропионовой кислоты или лизина, соответственно; молекула BTA связана с N-концом циклического пептидомиметика без спейсера; и радикал, обозначенный как X в общей формуле I, представляет собой -NH(CH2)2-; и конъюгаты 7 и 8, имеющие сходную структуру, где радикал, обозначенный как X, представляет собой -O(CH2)2- вместо -NH(CH2)2-. Биологическую активность конъюгатов тестировали в модели карциномы толстого кишечника, а также как в модели карциномы яичника in vivo, так и в анализе связывания in vitro с использованием клеток карциномы яичника человека, как описано в разделе "Материалы и методы".
Биологическая активность конъюгатов 1 и 5 в модели карциномы яичника описана в таблице 3. Как показано в таблице 6, конъюгаты, в которых α-аминогруппа остатка аргинина образует группу мочевины, имели сходную активность с активностью соответствующих конъюгатов, в которых образуется карбаматная группа, указывая на то, что характер группы, образуемой α-аминогруппой остатка аргинина, не влияет на биологическую активность конъюгата.
|
Пример 7. Биологическая активность конъюгатов производных BTA на основе циклических пептидомиметиков общей формулы I, в которых остаток таурина в BTA заменен различными диаминами, сходна с биологической активностью соответствующих конъюгатов, не являющихся производными
Синтезировали четыре различных конъюгата производных бактериохлорофиллов на основе циклических пептидомиметиков общей формулы I, обозначены в настоящем документе как конъюгаты 37-40, и их биологическую активность в клетках карциномы яичника человека MLS тестировали с использованием анализа связывания интегринов. Эти конъюгаты были основаны на конъюгатах 1 и 4, в которых остаток таурина (-NH-(CH2)2-SO3H) в группе BTA заменен различными нуклеофилами, в частности, -NH-(CH2)2-NH2 и -NH-(CH2)2-NH-CH3.
Циклический пептидомиметик для этих конъюгатов синтезировали способом A, описанным выше. После циклизации и удаления Dde к пептидилсмоле добавляли раствор Bpheide (2 экв.), активированного PyBoP (2 экв.), HOBt (2 экв.), DIEA (6 экв.) в ДМФА, и встряхивали в течение 2 ч в атмосфере аргона. Смолу промывали ДМФА восемь раз (мониторинг с помощью теста с нингидрином). К пептидилсмоле добавляли раствор диамина (30 экв.) в ДМФА добавляли и встряхивали в течение 1 ч в атмосфере аргона с последующим промыванием ДМФА. Пептид отщепляли от смолы, как описано в разделе "Материалы и методы" и неочищенные конъюгаты очищали посредством ОФ-ВЭЖХ. Как показано в таблице 7, биологическая активность всех этих конъюгатов была сходной, указывая на то, что в этих случаях аминогруппа не имела эффекта на биологическую активность и ее поведение является практически таким же, как и поведение сульфоната в таурине.
Таблица 7 Биологическая активность различных конъюгатов замещенного BTA на основе циклических пептидомиметиков общей формулы I
|
Пример 8: Размер кольца циклического пептидомиметика общей формулы II влияет на биологическую активность конъюгата на его основе
Для исследования того, влияет ли размер кольца циклического пептидомиметика общей формулы II на биологическую активность конъюгата, тестировали активность различных конъюгатов BTA на основе циклических пептидомиметиков общей формулы II, имеющих одинаковые аминокислотные остатки A1 (Lys) и A2 (Phe), но отличающиеся аминокислотные остатки A3, в частности, Dap, Dab, Orn и Lys, имеющие от одного до четырех элементов метилена, соответственно, в боковой цепи, как в модели карциномы яичника in vivo, так и в анализе связывания in vitro, с использованием клеток карциномы яичника человека, как описано в разделе "Материалы и методы".
В таблице 8 представлены различные протестированные конъюгаты BTA и их биологическая активность. Как показано, биологическая активность протестированных конъюгатов снижалась при увеличении размера кольца циклического пептидомиметика от 20 атомов до 23 атомов, указывая на то, что размер кольца, превышающий 20 атомов, не соответствует участку связывания интегрина.
|
Пример 9: Характеристики аминокислотного остатка A 2 в циклическом пептидомиметике общей формулы II влияют на биологическую активность конъюгата на его основе
Для исследования того, влияют ли размер и структура аминокислотного остатка A2 в циклическом пептидомиметике общей формулы II, связанного через его α-аминогруппу с C=O основной цепи и через его α-карбоксильную группу с аминокислотным остатком A3, на биологическую активность конъюгата, активность различных конъюгатов BTA на основе циклических пептидомиметиков общей формулы II, имеющих одинаковые аминокислотные остатки A1 (Lys) и A3 (Dap), но отличающиеся аминокислотные остатки A2, в частности, Phe, Val, D-Phe, Gly и Asp, тестировали как в модели карциномы яичника in vivo, так и в анализе связывания in vitro, с использованием клеток карциномы яичника человека, как описано в разделе "Материалы и методы".
В таблице 9 представлены различные протестированные конъюгаты BTA и их биологическая активность. Как показано, биологическая активность конъюгатов 41, 42 и 43, имеющих гидрофобные аминокислотные остатки A2, была выше, чем у конъюгатов 44 и 45, которые являются более полярными, возможно вследствие гидрофобных взаимодействий с гидрофобным карманом в участке связывания интегрина. Тот факт, что конъюгат 43 был менее активным, чем конъюгат 41, может быть следствием конфигурации первого из них, указывая на то, что D-конфигурация не полностью соответствует гидрофобному карману.
|
Пример 10. Конкурентное связывание различных конъюгатов BTA по настоящему изобретению с интегрином α V β 3 человека
В этом исследовании тестировали уровень конкурентного связывания, т.е. IC50, различных конъюгатов BTA по настоящему изобретению с интегрином αVβ3 против биотин-c[RGDfK], как описано в разделе "Материалы и методы". Конкретные протестированные конъюгаты представляли собой конъюгаты 1, 4, 5, 7, 11 и 28 (на основе RGD-содержащих циклических пептидомиметиков общей формулы I, смотрите пример 1), а также конъюгат 41 (на основе RGD-содержащего циклического пептидомиметика общей формулы II, смотрите пример 2), и величины IC50, измеренные для этих конъюгатов, представлены в таблице 10.
Как показано, конъюгаты 1, 7, 28 и 41 продемонстрировали наиболее низкую IC50 (10-4 M), т.е. наиболее высокую биологическую активность; IC50 конъюгата 4 была несколько выше (3×10-4 M); и IC50 конъюгатов 5 и 11 была наиболее высокой (3×10-3 M).
|
Пример 11. Конъюгаты 1, 4 и 41 накапливаются в некротическом ядре некротических опухолей MDA
В этом исследовании исследовали паттерн специфического накопления конъюгатов 1, 4 и 41 в ортотопных первичных очагах повреждения в модели карциномы молочной железы, мониторинг которого проводили по флуоресцентному сигналу, сгенерированному опухолью, и флуоресцентному сигналу, сгенерированному этими исследованными конъюгатами. Также определяли локализацию конъюгатов в опухолях с течением времени. Животным проводили введение, как описано в разделе "Материалы и методы", и мониторинг флуоресценции как опухолевых клеток, так и конъюгатов 1, 4 и 41 проводили с помощью системы визуализации IVIS® 100 с 1 по 7 сутки.
На фиг.1A, 1B и 1C представлены паттерны накопления конъюгатов 1, 4 и 41, соответственно, в ортотопной первичной крупной опухоли молочной железы человека MDA-MB-231-RFP в жировом слое молочной железы самок мышей CD-1, с использованием системы Xenogen IVIS®. Полные изображения животных регистрировали одновременно с использованием наборов фильтров, включающих фильтр возбуждения 500-550 нм и фильтр испускания 575-650 нм. Набор фоновых фильтров для вычитания аутофлуоресценции ткани: фильтр возбуждения 460-490 нм и фильтр испускания 575-650 нм. Главный набор фильтров для визуализации фотосенсибилизатора: фильтр возбуждения 665-695 нм, фильтр испускания 810-875 нм.
Все конъюгаты накапливались в опухоли при одновременном полном выведении из печени, обеспечивая селективную визуализацию опухоли через от ≥3 до конца периода наблюдения через 7 суток после инъекции и крайне медленное выведение после этого. Размер и расположение опухоли не изменялись на протяжении эксперимента, как можно видеть из красных изображений всего организма in vivo. Как показано на фиг.2A, 2B и 2C, эти конъюгаты через шесть суток после инъекции локализовались в некротической области опухоли.
Пример 12. Биологическая активность конъюгатов 1, 4 и 41 в клетках рака предстательной железы
В этом исследовании изучали биологическую активность конъюгатов 1, 4 и 41 в отношении клеток рака предстательной железы LNCaP, экспрессирующих интегрин αvβ3. Как показано выше, эти конкретные конъюгаты продемонстрировали активность в отношении карциномы яичника, карциномы толстого кишечника и клеток рака молочной железы.
Мониторинг накопления конъюгатов в имплантированной опухоли проводили через 8, 11, 14, 24 и 48 ч после инъекции с использованием системы Xenograph IVIS®, и как показано на фиг.3A, 3B и 3C, в отношении конъюгатов 1, 4 и 41, соответственно, наиболее высокий уровень флуоресценции наблюдали в области опухоли от 8 до 11-14 ч после инъекции, и конъюгат оставался в опухоли вплоть до 48 ч в случае конъюгатов 1 и 4, и вплоть 24 ч в случае конъюгата 41. Как показано далее, профили накопления этих конъюгатов в опухолях предстательной железы и яичника были практически одинаковыми.
Пример 13. Токсичность конъюгатов 1, 4 и 41 на крысах
Исследование токсичности конъюгатов 1, 4 и 41 проводили на крысах Wistar (5 самок, 170-190 г, и 5 самцов, 288-315 г). Различные конъюгаты в дозе 50 мг/кг инъецировали в хвостовую вену в течение 1-2 мин. Животные выжили и не продемонстрировали каких-либо проблем с поведением или подвижностью. Через пять суток не было выявлено признаков некроза или воспаления в печени или почках этих животных, что указывает на то, что эти конъюгаты не являются токсичными в протестированной дозе.
Схема 2: Химические структуры различных используемых функциональных групп, связанных с циклическим пептидомиметиком (обозначенным как "пептид") по настоящему изобретению
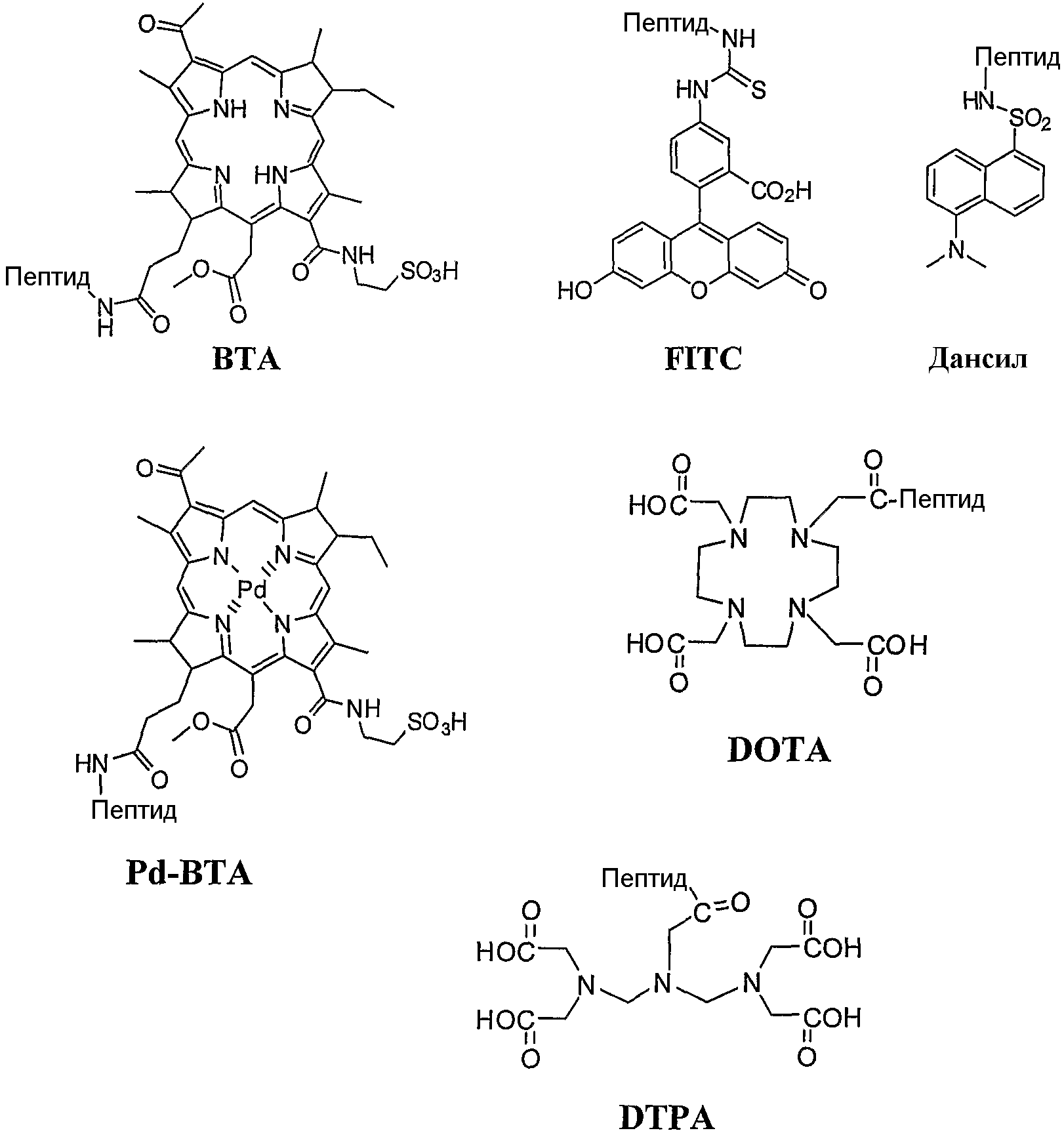
ССЫЛОЧНАЯ ЛИТЕРАТУРА
Arap W., Haedicke W., Bernasconi M., Kain R., Rajotte D., Krajewski S., Ellerby H.M., Bredesen D.E., Pasqualini R, Ruoslahti E., Proc. Natl. Acad. Sci. U.S.A., 2002, 99, 1527-1531.
Arap W., Pasqualini R., Ruoslahti E., Science, 1998, 279, 377-380.
Assa-Munt N., Jia X., Laakkonen P., Ruoslahti E., Biochemistry, 2001, 40, 2373-2378.
Banfi, L. Basso A., Damonte G., De Pellegrini F., Galatini A., Guanti G., Monfardini I., Riva R., Scapolla C, Bioorganic & Medicinal Chemistry Letters, 2007, 17, 1341-1345.
Belvisi L., Riccioni T., Marcellini M., Vesci L., Chiarucci I., Efrati D., Potenza D., Scolastico C, Manzoni L., Lombardo K., Stasi M.A., Orlandi A., Ciucci A., Nico B., Ribatti D., Giannini G., Presta M., Carminati P., Pisano C, Mol. Cancer Ther., 2005, 4, 11.
Chaleix V., Sol V., Huang Y.M., Guilloton M., Granet R., Blais J.C., Krausz P., Eur. J. Org. Chem., 2003, 1486-1493.
Dijkgraaf I., Kruijtzer J. A.W., Frielink C, Soede A.C., Hilbers H.W., Oyen W.J.G., Corstens F.H.M., Liskamp R.M.J., Boerman O.C., Nuclear Medicine and Biology, 2006, 33, 953-961.
D'Souza S.E., Ginsberg M.H., Plow E.F., Trends Biochem. Sci, 1991, 16, 246-250.
Ellerby H.M., Arap W., Ellerby L.M., Kain R., Andrusiak R.5 Del Rio G., Krajewski S., Rao R., Ruoslahti E., Bredesen D.E., Pasqualini R., Nat. Med., 1999, 5, 1032-1038.
Goligorsky M.S., Kessler H., Romanov V.I., Nephrol. Dial. Transplant., 1998, 13, 254-263.
Hardan I., Weiss L., Hershkovitz R., Greenspoon N., Alon R., Cahalon L., Reich S., Slavin S., Lider O., Int. J. Cancer, 1993, 55, 1023-1028.
Haubner R., Gratias R., Diefenbach B., Goodman S. L., Jonczyk A., Kessler H., J. Am. Chem. Soc, 1996, 118, 7461-7472.
Haubner R., Wester H.J., Weber W.A., Mang C, Ziegler S.L., Goodman S.L., Senekowitsch-Schmidtke R., Kessler H., Schwaiger M., Cancer res., 2001, 61, 1781-1785.
Joshi P., Chung C.Y., Aukhil I., Erickson H.P., J. Cell Set, 1993, 106, 389-400.
Kawaguchi M., Hosotani R., Ohishi S., Fujii N., Tulachan S.S., Koizumi M., Toyoda E., Masui T., Nakajima S., Tsuji S., Ida J., Fujimoto K., Wada M., Doi R., Imamura M., Biochem. Biophys. res. com., 2001, 288, 711-717.
Koivunen E., Wang B., Dickinson CD., Ruoslahti E., Methods Enzymol, 1994, 245, 346-369.
Lark M.W., Stroup G.B., Hwang S.M., James I.E., Rieman D J., Drake F.H., Bradbeer J.N., Mathur A., Erhard K.F., Newlander K.A., Ross S.T., Salyers K.L., Smith B.R, Miller W.H., Huffman W.F., Gowen M., JPET, 1999, 291, 612-617.
Locardi E., Mullen D.G., Mattern R., Goodman M., J. Peptide Scl, 1999, 5, 491-506.
Pasqualini R., Ruoslahti E., Nature, 1996, 380, 364-366.
Pasqualini R., Koivunen E., Ruoslahti E., Nat. Biotechnol, 1997, 15, 542-546.
Pasqualini R., Koivunen E., Kain R., Lahdenranta J., Sakamoto M., Stryhn A., Ashmun R.H., Shapiro L.H., Arap W., Rouslahti E., Cancer res., 2000, 60, 722-727.
Pierschbacher M., Ruoslahti E., Nature, 1984, 309, 30-33.
Pierschbacher M.D., Rouslahti E., J. Biol. Chem., 1987, 262, 17294-17298.
Raboisson P., Manthey C.L., Chaikin M., Lattanze J., Crysler C, Leonard K., Pan W., Tomczuk B.E., Marugan J.J., Eur. J. Med. Chem., 2006, 41, 847-861.
Romanov V.I., Goligorsky M.S., The prostate, 1999, 39, 108-118.
Ruoslahti E., Annual Rev. CellDev. Biol, 1996, 12, 697-715.
Ruoslahti E., Seminars in cancer biology, 2000, 10, 435-442.
Ruoslahti E., DDT, 2002, 7, 1138-1143.
Ruoslahti E., Pierschbacher M.D., Science, 1987, 238, 4826, 491-497.
Ruoslahti E., Rajotte D., Annu. Rev. Immunol, 2000, 18, 813-827.
Saiki I., Murata J., Iida J., Sakurai T., Nishi N, Matsuno K., Azuma I., Br. J. Cancer, 1989, 60, 722-728.
Su Z.F., Liu G., Gupta S., Zhu Z., Rusckowski M., Hnatowich D.J., Bioconjug. Chem., 2002, 13, 561-570.
van Hagen P.M., Breeman W.A, Bernard H.F, Schaar M, Mooij CM, Srinivasan A, Schmidt M.A, Krenning E.P., de Jong M, Int. J. Cancer, 2000, 90, 186-198.