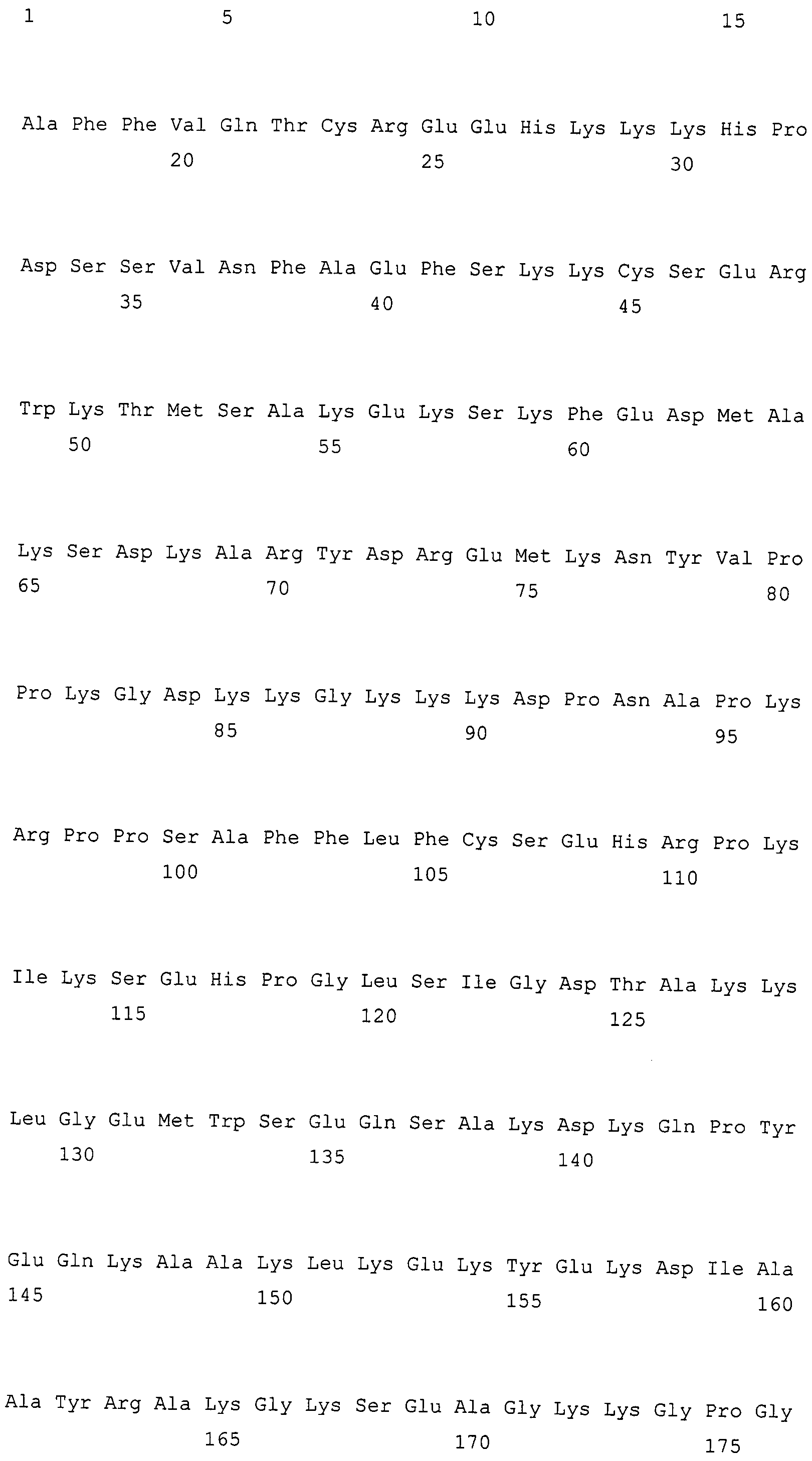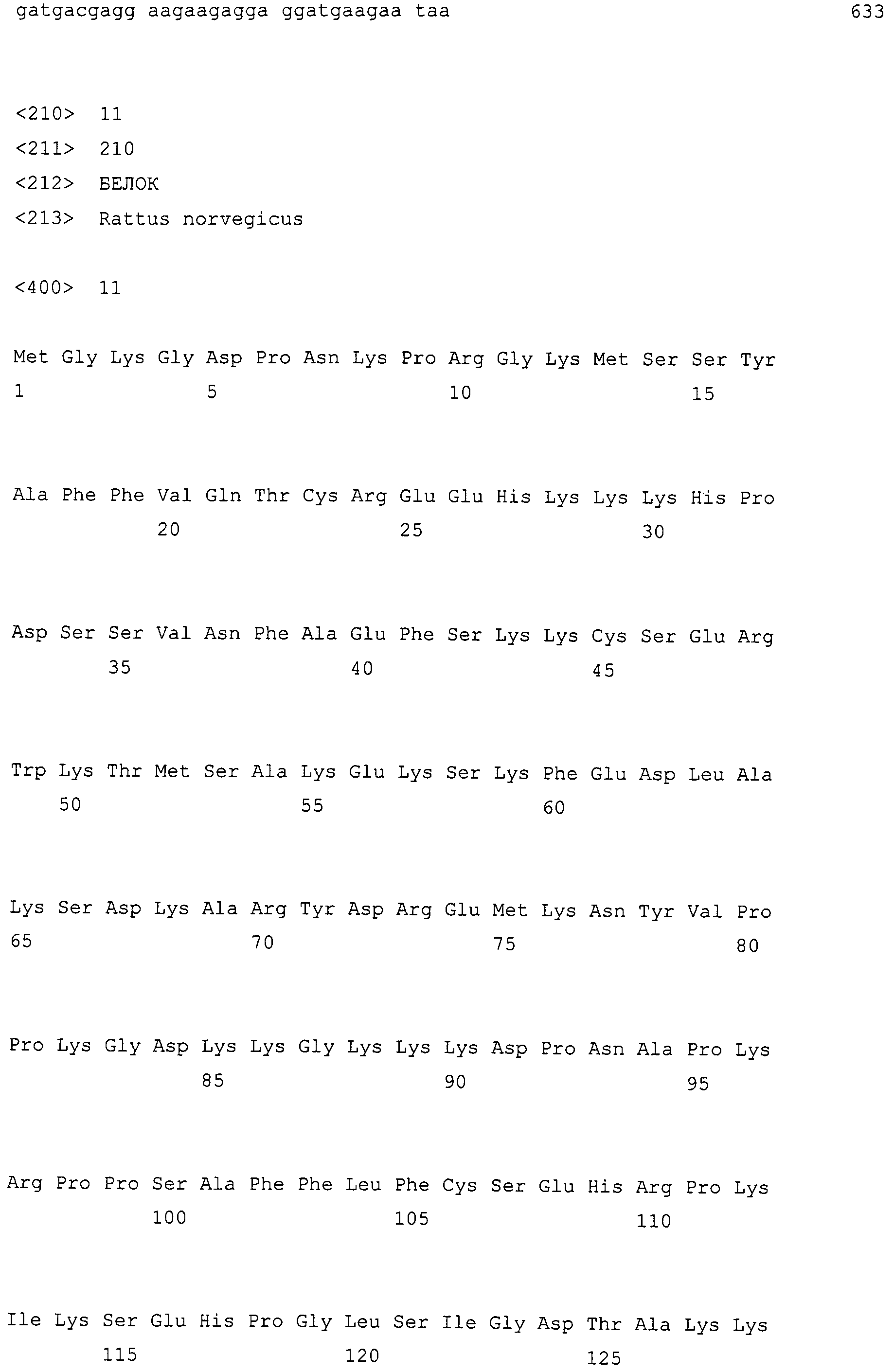Результат интеллектуальной деятельности: СРЕДСТВО ДЛЯ ВОВЛЕЧЕНИЯ ПРОИСХОДЯЩЕЙ ИЗ КОСТНОГО МОЗГА ПЛЮРИПОТЕНТНОЙ СТВОЛОВОЙ КЛЕТКИ В ПЕРИФЕРИЧЕСКИЙ КРОВОТОК
Вид РИД
Изобретение
Техническая область
Настоящее изобретение относится к средствам, которые вовлекают происходящие из костного мозга плюрипотентные стволовые клетки в периферический кровоток.
Уровень техники
В последние годы было выявлено, что в процессе репарации поврежденных тканей участвуют различные стволовые клетки, и в настоящее время проводится разработка новых регенеративных лекарственных средств, которые индуцируют регенерацию функциональных тканей путем привлечения большого количества стволовых клеток в области повреждения. Для реализации этих новых регенеративных лекарственных средств, (i) стволовые клетки, которые могут быть привлечены в области повреждения, должны присутствовать in vivo в большом количестве; и (ii) должны быть выделены/идентифицированы факторы, которые привлекают стволовые клетки в области повреждения.
Примеры стволовых клеток, которые могут привлекаться в области повреждения, включают тканевые стволовые клетки, присутствующие в области повреждения или в соседних тканях, и происходящие из костного мозга стволовые клетки, присутствующие в периферической крови. В последние годы было описано, что происходящие из костного мозга клетки участвуют во многих типах регенерации поврежденной ткани, однако механизм привлечения происходящих из костного мозга клеток в области повреждения неизвестен. Происходящие из костного мозга клетки, как используют в настоящем документе, отличаются от гемопоэтических стволовых клеток, которые обладают потенциалом к дифференцировке в клетки крови (лейкоциты и эритроциты), и включают стволовые клетки, которым соответствуют клетки, называемые мезенхимальными стволовыми клетками костного мозга, или клеточными группами предшественников тканей, присутствующими в костном мозге. Мезенхимальные стволовые клетки костного мозга представляют собой недифференцированные стволовые клетки с потенциалом к дифференцировке в остеобласты, адипоциты и хондроциты, и, кроме того, они могут дифференцироваться в другие мезенхимальные клетки, такие как фибробласты, мышечные клетки, стромальные клетки и клетки сухожилий. Недавно было показано, что мезенхимальные стволовые клетки костного мозга дифференцируются в нервные клетки и, кроме того, в эпителиальные клетки (такие как кератиноциты кожи) и сосудисто-эндотелиальные клетки (непатентный документ 9). Клетки-предшественники тканей определяют как недифференцированные клетки, имеющие однонаправленный потенциал к дифференцировке в конкретные ткани/клетки, отличные от тканей/клеток кровеносной системы, и включают недифференцированные клетки с потенциалом к дифференцировке в мезенхимальную ткань, эпителиальную ткань, нервную ткань, паренхиматозные органы и эндотелий сосудов, как упоминалось выше.
HMGB1 (High Mobility Group Box 1: белок 1 группы с высокой подвижностью) представляет собой белок с молекулярной массой приблизительно 25000, который существует практически во всех типах клеток in vivo. Согласно недавним отчетам, известны следующие функции:
1) HMGB1 регулирует экспрессию генов путем внутриклеточного связывания с ДНК для контроля структуры хроматина (непатентный документ 1);
2) HMGB1 секретируется из моноцитов или макрофагов, присутствующих в воспалительных тканях, под действием воспалительных цитокинов TNF-α, IL-1 и LPS, и внеклеточно связывается с RAGE (рецептор для поздних продуктов гликирования) (непатентный документ 2), индуцируя сильные воспалительные реакции (непатентный документ 3);
3) HMGB1 высвобождается из индуцируемых гипоперфузией некротизированных клеток в окружающие ткани (непатентный документ 4);
4) HMGB1 ассоциирован с прогрессированием воспаления у пациентов с септицемией, тяжелым инфекционным заболеванием (непатентный документ 5);
5) введение HMGB1 в области инфаркта в модели инфаркта миокарда обеспечивает деление/пролиферацию стволовых клеток, присутствующих в миокарде, и, таким образом, регенерацию/функциональное восстановление миокарда (патентный документ 1);
6) введение HMGB1 модельному животному с гипоперфузионной печеночной недостаточностью перед индукцией гипоперфузионных состояний смягчает степень нарушения печени (непатентный документ 6);
7) введение HMGB1 в области повреждения в модели повреждения мышц направляет одновременно вводимые клетки-предшественники сосудов в области повреждения, и, таким образом, стимулирует регенерацию мышечной ткани (непатентный документ 7); и
8) HMGB1 индуцирует образование нейритов в нервных клетках (непатентный документ 8). Однако в предыдущих сообщениях не показано, что происходящие из костного мозга стволовые клетки, в частности мезенхимальные стволовые клетки, которые могут дифференцироваться в остеобласты, хондроциты, адипоциты и т.п., привлекаются в поврежденные ткани.
Традиционно полагали, что центральные нервные клетки в головном мозге и спинном мозге не могут регенерировать после повреждения. Однако недавно стало известно о существовании нервных стволовых клеток, и стала возможной индукция этих клеток. Также идентифицирована ниша нервных стволовых клеток в нормальной нервной системе. Таким образом, восстановление поврежденных центральных нейронов, которое долго считали невозможным, в настоящее время считается осуществимым. В настоящее время исследования, связанные с нейрональной регенерацией при повреждении головного и спинного мозга, дегенеративных заболеваниях и т.п., расширяются.
Основными причинами повреждения ткани (клеток) головного мозга являются травматический ушиб головного мозга и ишемические заболевания головного мозга. Другими причинами могут быть повреждение вследствие хирургической операции головного мозга, такой как удаление опухоли головного мозга. В частности, полное удаление нейроглиомы, развившейся из клеток паренхимы головного мозга, является трудным, и нет другого выхода, кроме того, как остановиться на частичном удалении, чтобы избежать повреждения двигательных и речевых функций. Более того, злокачественная нейроглиома имеет плохой прогноз, и ни один из способов лечения, активно исследованных в последние годы, от химиотерапии и лучевой терапии до иммунотерапии/генной терапии, не имел удовлетворительных эффектов. Таким образом, идеальным способом лечения может быть лечение, которое может удалять столько клеток опухоли, сколько возможно, и восстанавливать повреждение функций головного мозга вследствие этого удаления.
Документы уровня техники
Патентные документы
Патентный документ 1: Публикация патентной заявки Японии Kohyo No. (JP-A) 2005-537253 (нерассмотренная публикация национальной фазы Японии, соответствующая не японской международной публикации)
Непатентные документы
Непатентный документ 1: Bustin et al., Mol. Cell Biol., 19: 5237-5246, 1999.
Непатентный документ 2: Hori et al., J. Biol. Chem., 270, 25752-25761, 1995.
Непатентный документ 3: Wang et al., Science, 285: 248-251, 1999.
Непатентный документ 4: Muller et al., EMBO J, 20: 4337-4340, 2001.
Непатентный документ 5: Wang et al., Science, 285: 248-251, 1999.
Непатентный документ 6: Germani et al., J. Leukoc. Biol., Jan; 81(1): 41-5, 2007.
Непатентный документ 7: Palumbo et al., J. Cell Biol., 164: 441-449, 2004.
Непатентный документ 8: Merenmies et al., J. Biol. Chem., 266: 16722-16729, 1991.
Непатентный документ 9: Wu Y. et al., Stem. cells, 25: 2648-2659, 2007.
Описание изобретения
Задачи, решаемые изобретением
Известно, что мезенхимальные стволовые клетки, способные дифференцироваться в костные ткани, хрящевые ткани и жировые ткани, существуют среди стволовых клеток в костном мозге. В последние годы было выявлено, что существуют плюрипотентные стволовые клетки, которые дифференцируются в эпителиальные клетки и нервные клетки.
Тем временем, способы лечения трудноизлечимой язвы кожи включают лечение трансплантацией кожи. Исследования авторов настоящего изобретения показали, что кожа регенерирует посредством реконструкции эпидермиса, дермы, волосяных фолликулов (ткани, образующей волос), и т.п., из происходящих из костного мозга клеток в пересаженной коже после лечения язвы. Таким образом, ожидается, что может быть создан простой и эффективный способ взятия таких популяций клеток со способностью к репарации тканей из костного мозга. Однако до настоящего времени такой способ все еще не разработан.
Таким образом, задачей настоящего изобретения является предоставление способов вовлечения большого количества происходящих из костного мозга плюрипотентных стволовых клеток в периферическую кровь.
Средства для решения задач
Существует возможность, что в процессе приживления пересаженной кожи на биологической ткани в трансплантат кожи привлекаются происходящие из костного мозга клетки из ткани, не являющейся кожей, и, таким образом, участвуют в регенерации ткани кожи. Это предполагает потенциальный механизм вовлечения таких плюрипотентных происходящих из костного мозга клеток в периферическую кровь. Настоящее изобретение обеспечивает вовлечение большого количества происходящих из костного мозга плюрипотентных стволовых клеток в периферическую кровь путем внутривенного введения экстракта ткани кожи или индуктора происходящих из костного мозга плюрипотентных стволовых клеток. Конкретно, с помощью настоящего изобретения впервые в мире выявлено, что
(1) происходящие из ткани костного мозга плюрипотентные стволовые клетки можно индуцировать в периферической крови путем внутривенного введения экстракта ткани, полученного из выделенных фрагментов кожи;
(2) вещество в выделенных фрагментах кожи, которое ответственно за вовлечение происходящих из ткани костного мозга плюрипотентных стволовых клеток в периферическую кровь, представляет собой HMGB1; и
(3) HMGB1, который обладает активностью вовлечения происходящих из костного мозга плюрипотентных стволовых клеток в периферическую кровь, можно легко очищать из культивированных клеток.
Исходя из открытий, описанных выше, настоящее изобретение относится к следующим изобретениям:
[1] средство для вовлечения клетки костного мозга в периферическую кровь из костного мозга, которое вводят в кровеносный сосуд или мышцу и которое содержит любой из компонентов:
(a) белок HMGB1;
(b) клетка, которая секретирует белок HMGB1;
(c) вектор, в который встроена ДНК, кодирующая белок HMGB1;
(d) белок HMGB2;
(e) клетка, которая секретирует белок HMGB2;
(f) вектор, в который встроена ДНК, кодирующая белок HMGB2;
(g) белок HMGB3;
(h) клетка, которая секретирует белок HMGB3; и
(i) вектор, в который встроена ДНК, кодирующая белок HMGB3;
[2] средство для вовлечения клетки костного мозга в периферическую кровь из костного мозга, которое продуцируют способом, включающим стадию погружения клетки или ткани в растворитель, и которое вводят в кровеносный сосуд или мышцу;
[3] средство для вовлечения клетки костного мозга в периферическую кровь из костного мозга, которое вводят в кровеносный сосуд или мышцу и которое содержит гепарин-связывающую фракцию, полученную способом, включающим стадии
(a) погружения клетки или ткани в растворитель;
(b) контактирования иммобилизованного гепарина с экстрактом, полученным на стадии (a); и
(c) элюирования гепарин-связывающей фракции с иммобилизованного гепарина;
[4] способ оценки того, содержится ли фактор, который вовлекает клетку костного мозга в периферическую кровь из костного мозга, в экстракте клетки или ткани, и, когда активность вовлечения клетки костного мозга в периферическую кровь из костного мозга на стадии (b) превышает активность контроля, определения того, что фактор содержится в экстракте клетки или ткани, где способ включает стадии, указанные ниже:
(a) получение экстракта клетки; и
(b) измерение активности вовлечения клетки костного мозга в периферическую кровь из костного мозга в экстракте, полученном на стадии (a);
[5] способ скрининга экстракта клетки или ткани, содержащего фактор, который вовлекает клетку костного мозга в периферическую кровь из костного мозга, который включает стадии
(a) оценки множества экстрактов способом согласно [4] в отношении того, содержится ли в экстракте фактор, который вовлекает клетку костного мозга в периферическую кровь; и
(b) выбора экстракта, который согласно оценке на стадии (a) содержит фактор, который вовлекает клетку костного мозга в периферическую кровь из костного мозга;
[6] способ идентификации фактора, вовлекающего клетку костного мозга в периферическую кровь из костного мозга, который включает стадию очистки фактора, вовлекающего клетку костного мозга в периферическую кровь из костного мозга, из экстракта, который определен как содержащий фактор, вовлекающий клетку костного мозга в периферическую кровь из костного мозга, способом согласно [4] или [5], с использованием активности вовлечения клетки костного мозга в периферическую кровь из костного мозга в качестве индикатора;
[7] набор для вовлечения клетки костного мозга в периферическую кровь из костного мозга, содержащий композицию, подлежащую введению в кровеносный сосуд или мышцу, и который содержит любое из веществ:
(a) белок HMGB1;
(b) клетка, которая секретирует белок HMGB1;
(c) вектор, в который встроена ДНК, кодирующая белок HMGB1;
(d) белок HMGB2;
(e) клетка, которая секретирует белок HMGB2;
(f) вектор, в который встроена ДНК, кодирующая белок HMGB2;
(g) белок HMGB3;
(h) клетка, которая секретирует белок HMGB3; и
(i) вектор, в который встроена ДНК, кодирующая белок HMGB3;
[8] набор для вовлечения клетки костного мозга в периферическую кровь из костного мозга, содержащий экстракт клетки или ткани, подлежащий введению в кровеносный сосуд или мышцу и который получают способом, включающим стадию погружения клетки или ткани в растворитель;
[9] набор для вовлечения клетки костного мозга в периферическую кровь из костного мозга, содержащий гепарин-связывающую фракцию, подлежащую введению в кровеносный сосуд или мышцу и которую получают способом, включающим стадии
(a) погружения клетки или ткани в растворитель;
(b) контактирования иммобилизованного гепарина с экстрактом, полученным на стадии (a); и
(c) элюирования гепарин-связывающей фракции с иммобилизованного гепарина;
[10] способ вовлечения клетки костного мозга в периферическую кровь из костного мозга, включающий стадию введения в кровеносный сосуд или мышцу любого из следующих веществ:
(a) белок HMGB1;
(b) клетка, которая секретирует белок HMGB1;
(c) вектор, в который встроена ДНК, кодирующая белок HMGB1;
(d) белок HMGB2;
(e) клетка, которая секретирует белок HMGB2;
(f) вектор, в который встроена ДНК, кодирующая белок HMGB2;
(g) белок HMGB3;
(h) клетка, которая секретирует белок HMGB3; и
(i) вектор, в который встроена ДНК, кодирующая белок HMGB3;
[11] способ вовлечения клетки костного мозга в периферическую кровь из костного мозга, который включает стадию введения в кровеносный сосуд или мышцу экстракта клетки или ткани, полученного способом, включающим стадию погружения клетки или ткани в растворитель;
[12] способ вовлечения клетки костного мозга в периферическую кровь из костного мозга, включающий стадию введения в кровеносный сосуд или мышцу гепарин-связывающей фракции, полученной способом, включающим стадии
(a) погружения клетки или ткани в растворитель;
(b) контактирования иммобилизованного гепарина с экстрактом, полученным на стадии (a); и
(c) элюирования гепарин-связывающей фракции с иммобилизованного гепарина;
[13] применение любого из следующих веществ (a)-(i) при изготовлении средства для вовлечения клетки костного мозга в периферическую кровь из костного мозга, которое вводят в кровеносный сосуд или мышцу:
(a) белок HMGB1;
(b) клетка, которая секретирует белок HMGB1;
(c) вектор, в который встроена ДНК, кодирующая белок HMGB1;
(d) белок HMGB2;
(e) клетка, которая секретирует белок HMGB2;
(f) вектор, в который встроена ДНК, кодирующая белок HMGB2;
(g) белок HMGB3;
(h) клетка, которая секретирует белок HMGB3; и
(i) вектор, в который встроена ДНК, кодирующая белок HMGB3;
[14] применение экстракта клетки или ткани, полученного способом, включающим стадию погружения клетки или ткани в растворитель, для получения средства для вовлечения клетки костного мозга в периферическую кровь из костного мозга, которое подлежит введению в кровеносный сосуд или мышцу;
[15] применение гепарин-связывающей фракции, полученной способом, включающим стадии
(a) погружения клетки или ткани в растворитель;
(b) контактирования иммобилизованного гепарина с экстрактом, полученным на стадии (a); и
(c) элюирования гепарин-связывающей фракции с иммобилизованного гепарина;
для получения средства для вовлечения клетки костного мозга в периферическую кровь из костного мозга, которое подлежит введению в кровеносный сосуд или мышцу;
[16] любое вещество из следующих:
(a) белок HMGB1;
(b) клетка, которая секретирует белок HMGB1;
(c) вектор, в который встроена ДНК, кодирующая белок HMGB1;
(d) белок HMGB2;
(e) клетка, которая секретирует белок HMGB2;
(f) вектор, в который встроена ДНК, кодирующая белок HMGB2;
(g) белок HMGB3;
(h) клетка, которая секретирует белок HMGB3; и
(i) вектор, в который встроена ДНК, кодирующая белок HMGB3;
которое используют в способе вовлечения клетки костного мозга в периферическую кровь из костного мозга, которое подлежит введению в кровеносный сосуд или мышцу;
[17] экстракт клетки или ткани, получаемый способом, включающим стадию погружения клетки или ткани в растворитель, который используют в способе вовлечения клетки костного мозга в периферическую кровь из костного мозга и который подлежит введению в кровеносный сосуд или мышцу; и
[18] гепарин-связывающая фракция, полученная способом, включающим стадии
(a) погружения клетки или ткани в растворитель;
(b) контактирования иммобилизованного гепарина с экстрактом, полученным на стадии (a); и
(c) элюирования гепарин-связывающей фракции с иммобилизованного гепарина;
которую используют в способе вовлечения клетки костного мозга в периферическую кровь из костного мозга и которая подлежит введению в кровеносный сосуд или мышцу.
Краткое описание фигур
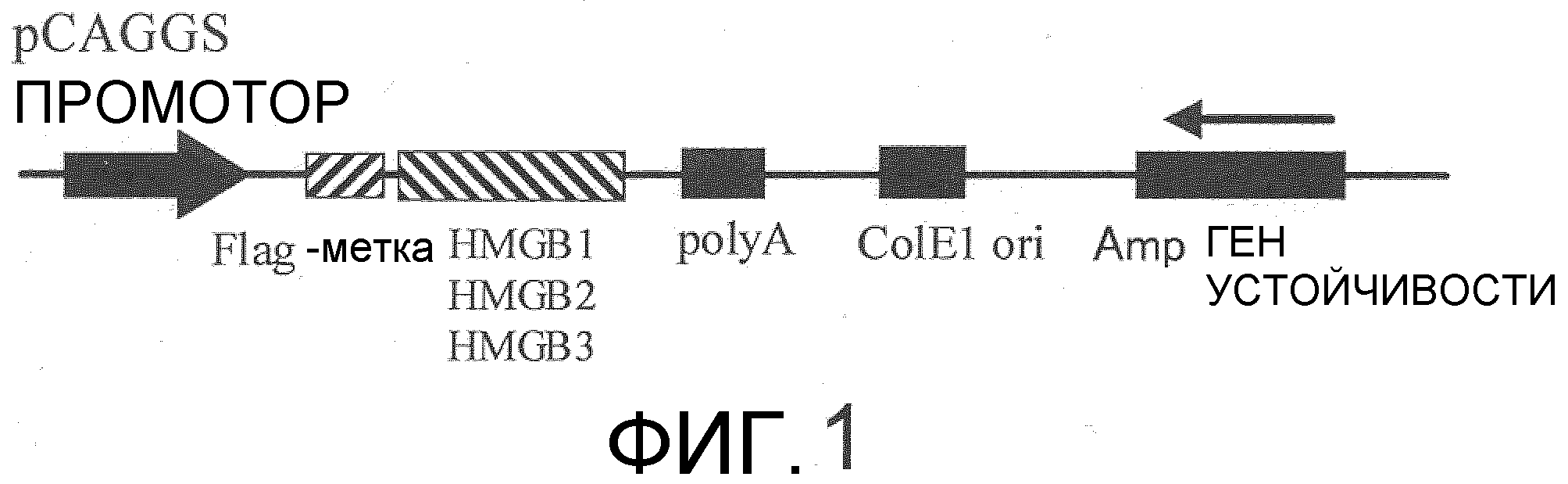
На фиг.1 представлена схема, на которой показан экспрессирующий вектор HMGB1.
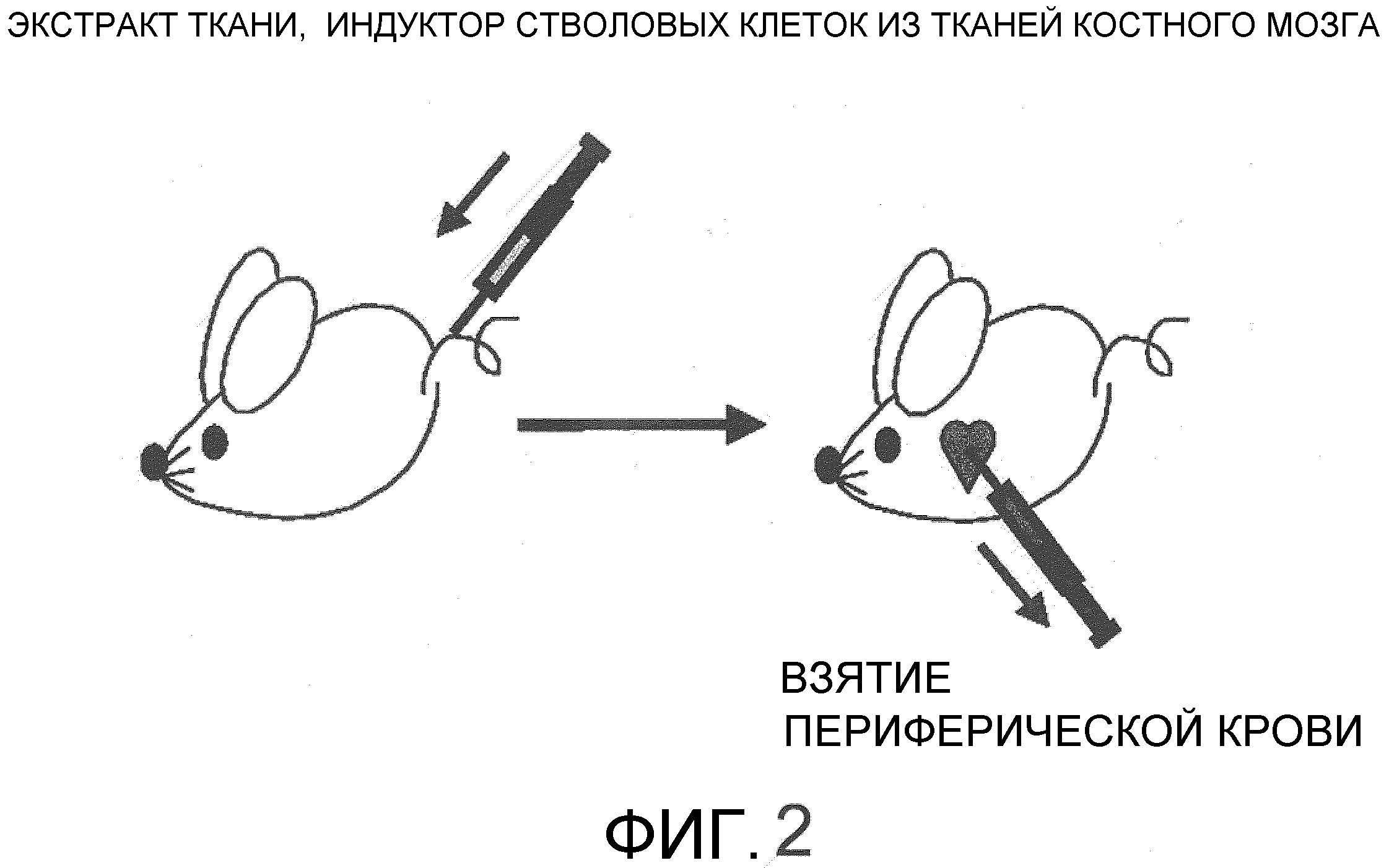
На фиг.2 представлена схема, на которой показано введение экстракта кожи (SE) мыши через хвостовую вену с последующим сбором периферической крови.
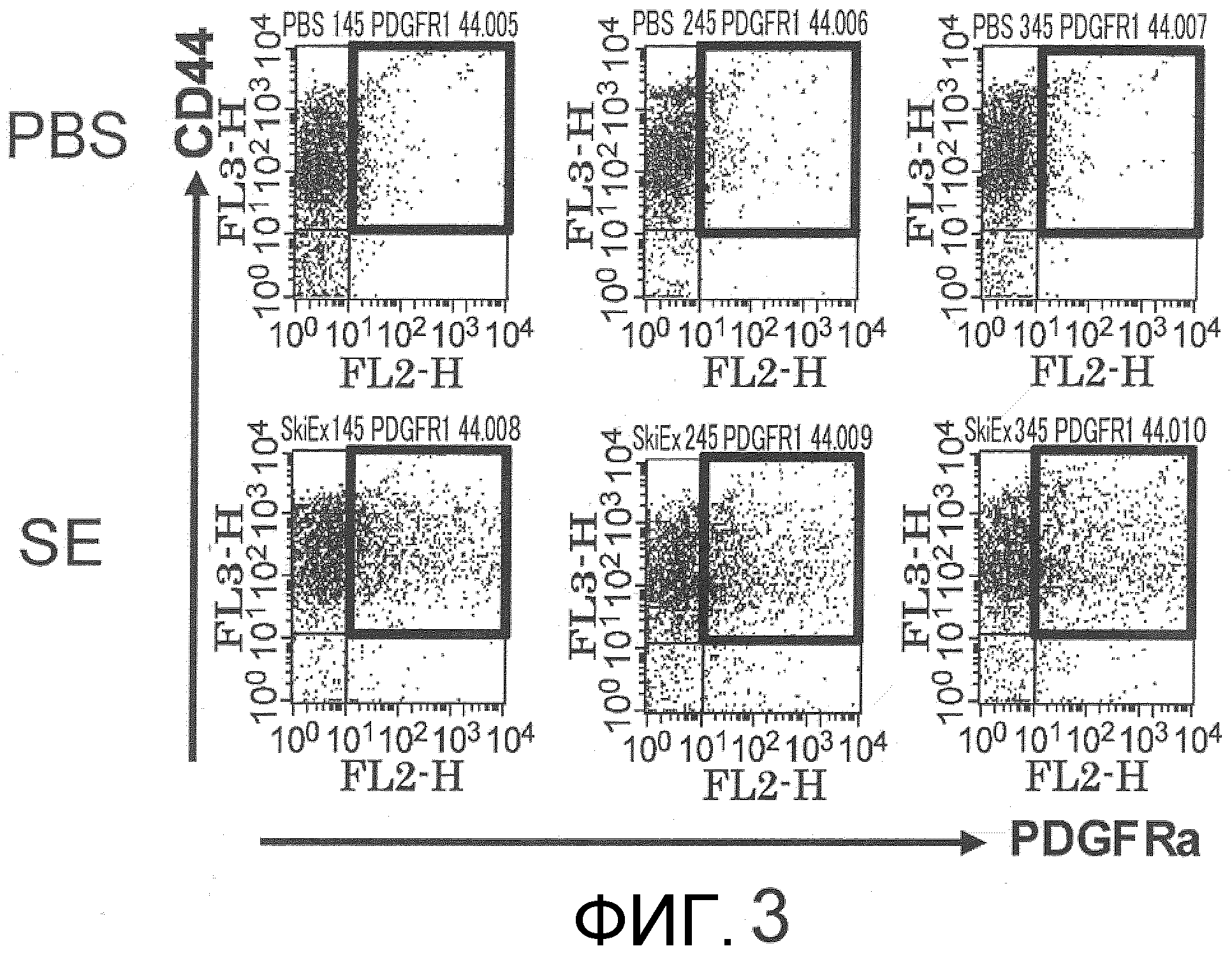
На фиг.3 представлена схема фракционирования проточной цитометрией фракции мононуклеарных клеток периферической крови мыши, флуоресцентно меченных антителом против PDGFRα мыши и антителом против CD44 мыши через 12 часов после введения экстракта кожи (SE). Верхние три диаграммы соответствуют группе введения PBS (n=3) в качестве отрицательного контроля, а нижние три диаграммы соответствуют группе введения экстракта кожи (SE) (n=3). Вертикальная ось указывает на уровень экспрессии CD44, а горизонтальная ось указывает на уровень экспрессии PDGFRα. Область, заключенная в рамку, соответствует популяции двойных положительных по CD44 и PDGFRα клеток. Популяция была увеличена в группе введения экстракта кожи (SE) по сравнению с группой введения PBS.
На фиг.4 представлена схема введения HMGB1 мыши через хвостовую вену с последующим взятием периферической крови.
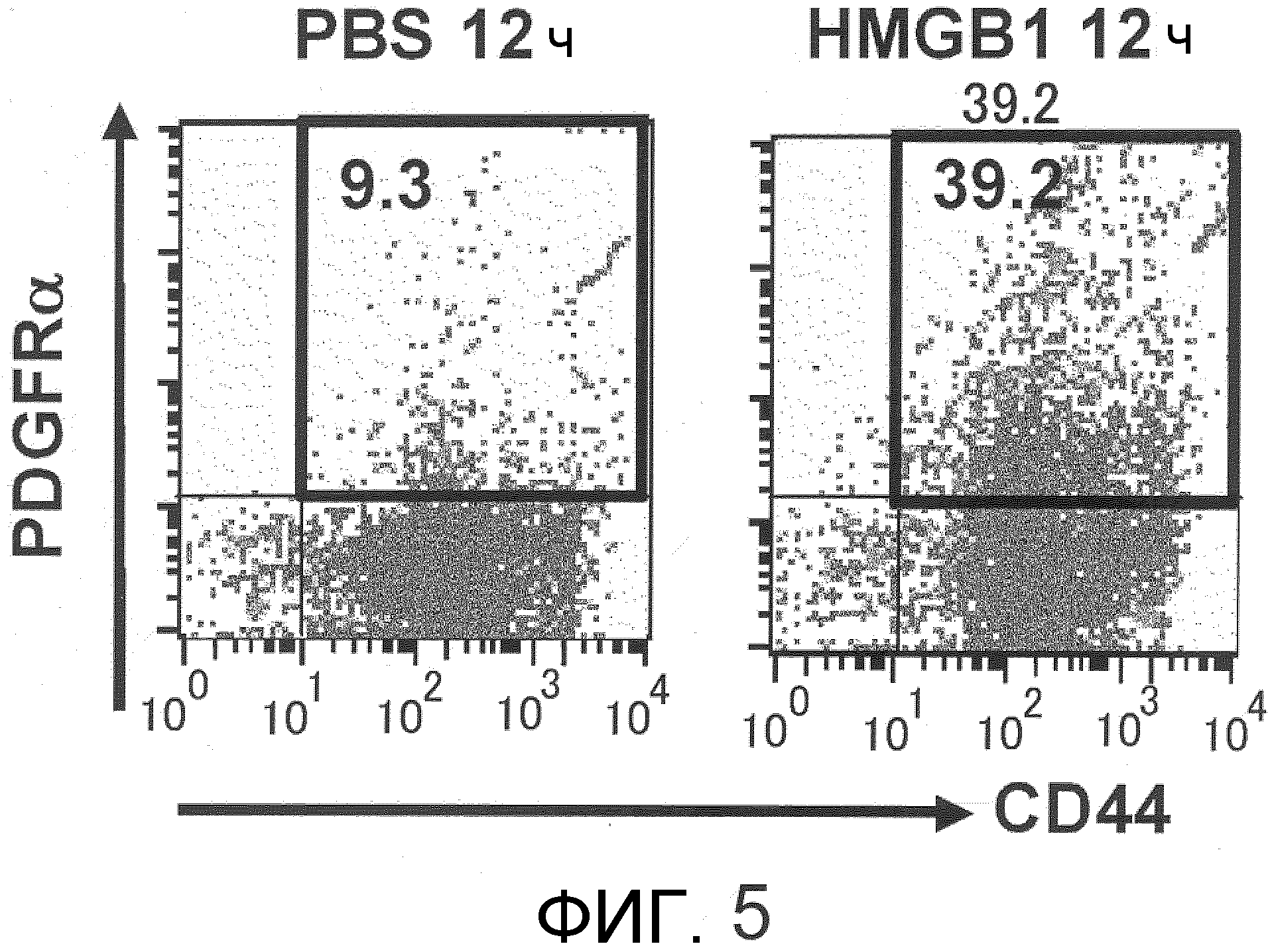
На фиг.5 представлена схема, на которой показано фракционирование проточной цитометрией фракции мононуклеарных клеток периферической крови, флуоресцентно меченных антителом против PDGFRα мыши и антителом против CD44 мыши через 12 часов после введения HMGB1. Левая диаграмма соответствует мышам, которым вводили PBS в качестве отрицательного контроля, а правая диаграмма соответствует мышам, которым вводили HMGB1. Вертикальная ось указывает на уровень экспрессии CD44, а горизонтальная ось указывает на уровень экспрессии PDGFRα. Область, заключенная в рамку, соответствует популяции двойных положительных по CD44 и PDGFRα клеток. У мышей, которым вводили HMGB1, популяция была увеличена по сравнению с мышами, которым вводили PBS.
На фиг.6 представлен набор фотографий, на которых показана детекция вестерн-блоттингом семейства HMGB в экстракте кожи новорожденной мыши.
На фиг.7 представлен набор фотографий результатов вестерн-блоттинга для семейства очищенных рекомбинантных слитых белков метка Flag-HMGB, экспрессированных в клетках HEK293.
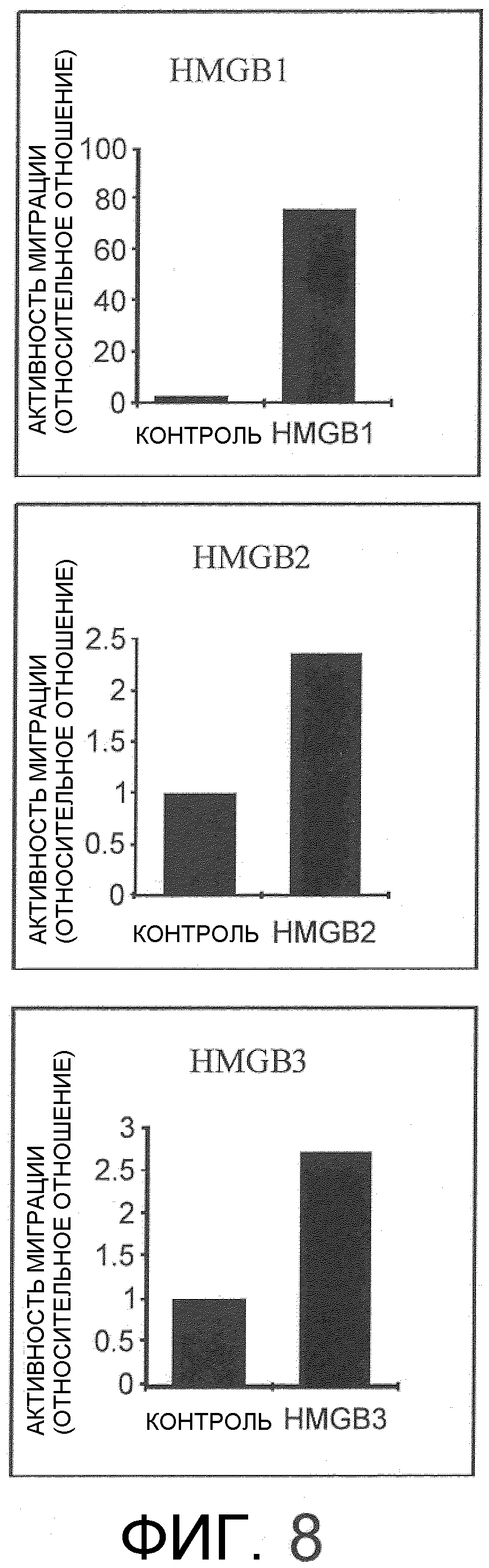
На фиг.8 представлен набор графиков, на которых показана активность рекомбинантного HMGB1/HMGB2/HMGB3 в отношении миграции костномозговых мезенхимальных стволовых клеток с использованием камеры Бойдена. Все рекомбинантные белки показали более высокую активность в отношении миграции по сравнению с контрольными группами.
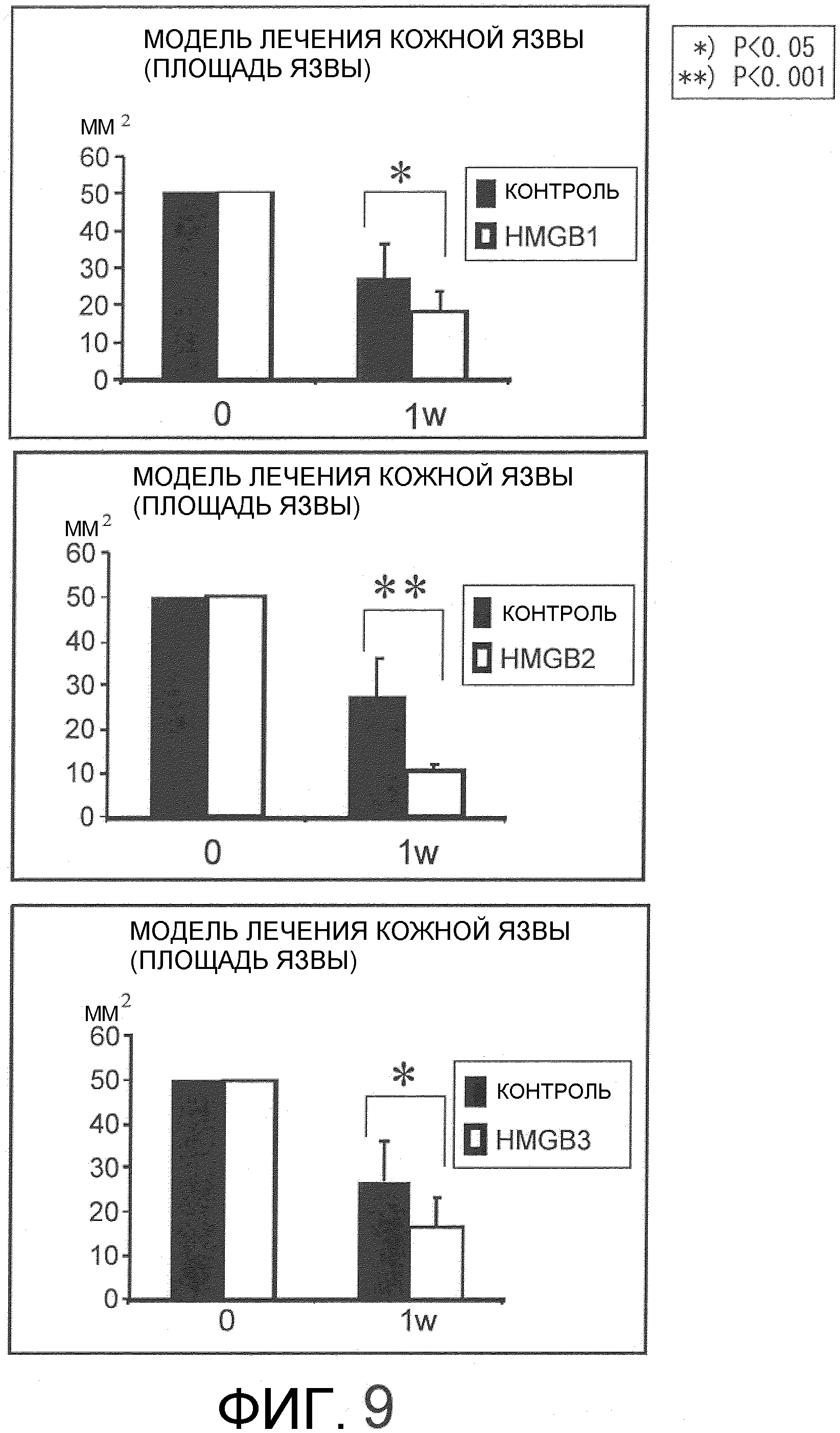
На фиг.9 представлен набор графиков, на которых показан результат лечения в модели лечения кожных язв у мышей с использованием белков семейства HMGB. Все из HMGB1, HMGB2 и HMGB3 показали значимые эффекты в отношении снижения площади язвы по сравнению с контрольными группами.
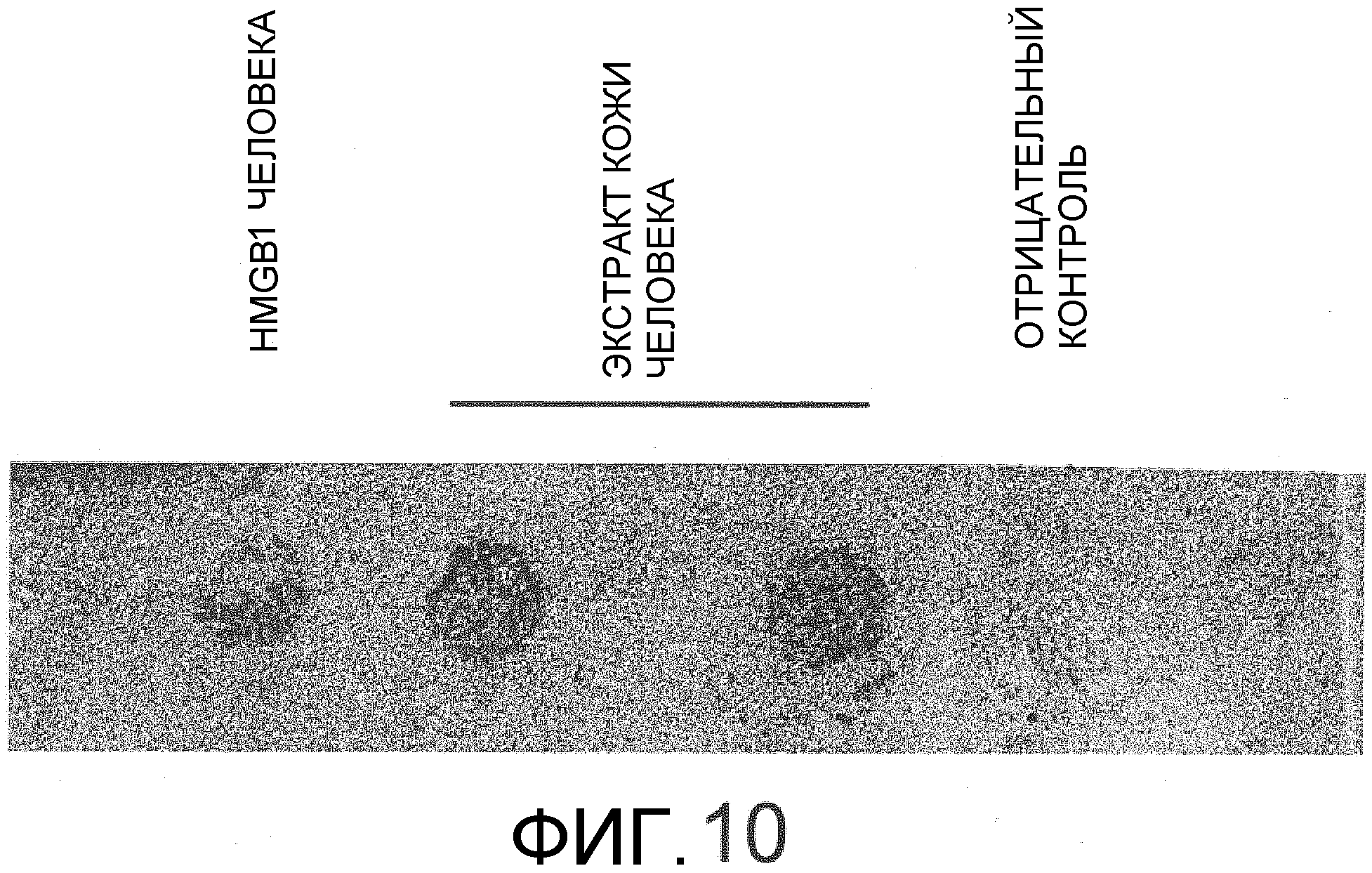
На фиг.10 представлена фотография, на которой показана активность HMGB1 человека и экстракта кожи человека в отношении индукции миграции происходящих из костного мозга человека мезенхимальных стволовых клеток, подтвержденная с использованием камеры Бойдена.
На фиг.11 представлен набор фотографий, на которых показана активность активаторов, очищенных на колонке с гепарином, из экстрактов сердца, головного мозга и кожи мыши в отношении индукции мезенхимальных стволовых клеток костного мозга, подтвержденная с использованием камеры Бойдена.
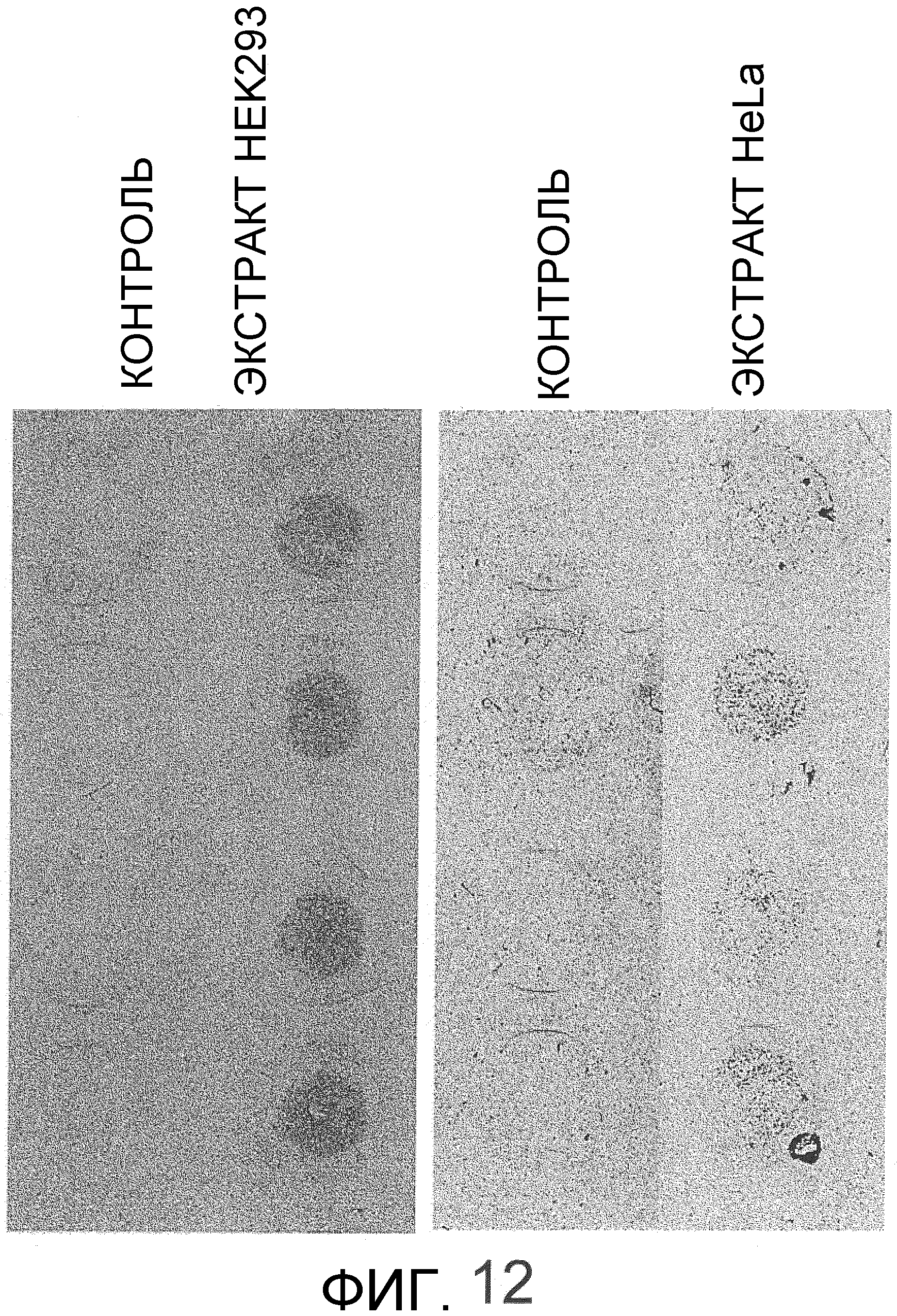
На фиг.12 представлен набор фотографий, на которых показана активность экстракта культивированной клеточной линии HEK293 и экстракта HeLa в отношении индукции миграции мезенхимальных стволовых клеток костного мозга человека, подтвержденная с использованием камеры Бойдена. Обе культивированные клеточные линии показали хемотаксическую активность в отношении мезенхимальных стволовых клеток костного мозга человека.
На фиг.13A представлена фотография, на которой показана мышь, фиксированная к стереотаксическому устройству для головного мозга с разрезом головы по средней линии скальпелем, с последующей трепанацией с использованием бура. На фиг.13B представлена фотография, на которой показан головной мозг, к которому применяют отрицательное давление с использованием шприца для отсасывания части ткани головного мозга. На фиг.13C представлена фотография мыши после инъекции 5 мкл очищенной на колонке с гепарином фракции экстракта кожи, растворенного в фибриновом адгезивном составе (фибриноген), и последующей инъекции 5 мкл состава фибринового клея (тромбин). На фиг.13D и 13E представлены фотографии модели повреждения головного мозга, полученные через 2 недели после лечения. Более высокое накопление положительных по GFP клеток наблюдали в группе лечения с использованием очищенной на колонке с гепарином фракции экстракта кожи, на E, по сравнению с контролем, на D. На фиг.13F и 13G представлены фотографии модели повреждения головного мозга, полученные через 6 недель после лечения. Более высокое накопление GFP-положительных клеток наблюдали в группе лечения с использованием очищенной на колонке с гепарином фракции экстракта кожи, на G, по сравнению с контролем, на F.
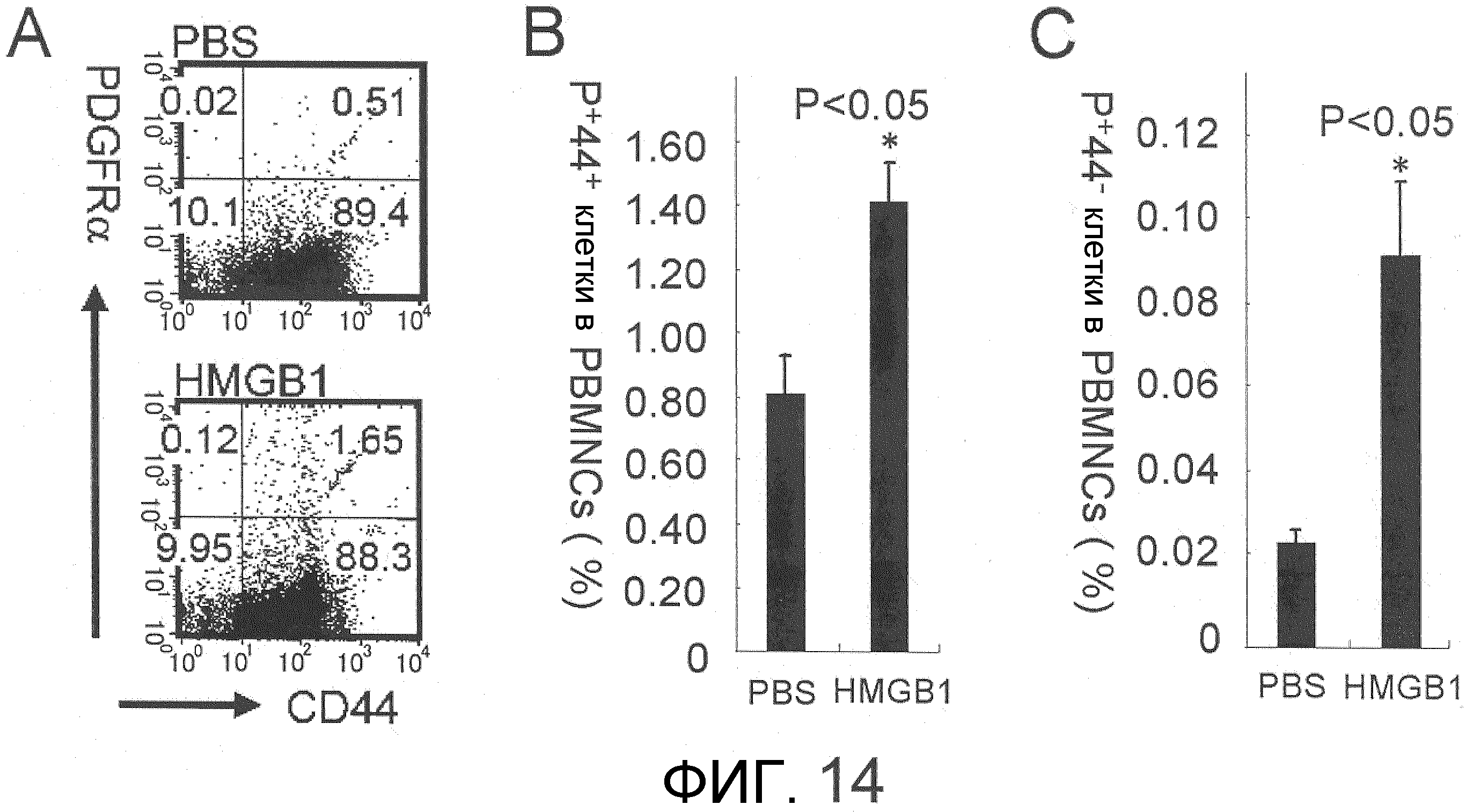
На фиг.14A представлена диаграмма результата проточной цитометрии, на которой показано присутствие клеток, имеющих CD44 и PDGFRα. Введение HMGB1 приводило к увеличению популяций как двойных положительных по PDGFRα и CD44 клеток, так и положительных PDGFRα, отрицательных по CD44 клеток, в периферической крови. На фиг.14B и 14C представлены результаты сравнения между группами введения PBS и HMGB1 в отношении присутствия двойных положительных по PDGFRα и CD44 клеток, положительных по PDGFRα и отрицательных по CD44 клеток в периферической крови соответственно. Обе популяции клеток были на статистически значимом уровне увеличены в группе введения HMGB1.
Способы осуществления изобретения
Настоящее изобретение относится к фармацевтическим средствам для вовлечения клеток костного мозга в периферическую кровь из костного мозга, включающим один из следующих ингредиентов (a)-(i), которые подлежат введению в периферическую кровь или мышцу:
(a) белок HMGB1;
(b) клетка, секретирующая белок HMGB1;
(c) вектор, в который встроена ДНК, которая кодирует белок HMGB1;
(d) белок HMGB2;
(e) клетка, секретирующая белок HMGB2;
(f) вектор, в который встроена ДНК, которая кодирует белок HMGB2;
(g) белок HMGB3;
(h) клетка, секретирующая белок HMGB3; и
(i) вектор, в который встроена ДНК, которая кодирует белок HMGB3.
При введении описанных выше фармацевтических средств в кровеносный сосуд или мышцу стволовые клетки ткани костного мозга вовлекаются в периферический кровоток, и, таким образом, можно стимулировать регенерацию поврежденной ткани. Кроме того, помимо применения указанного выше фармацевтического средства в качестве индуктора/промотора функциональной регенерации ткани, ожидается его применение в качестве так называемого профилактического лекарственного средства, которое предотвращает повреждение функций ткани/органа, вызываемое уменьшением количества тканевых стволовых клеток, или в качестве лекарственного средства против старения, которое замедляет прогрессирование связанных с возрастом изменений.
Альтернативно такое лечение можно осуществлять введением указанного выше фармацевтического средства, сбором и концентрированием плюрипотентных стволовых клеток, вовлеченных в периферическую кровь из организма, и введением клеток в области повреждения. Общепринятая терапия с использованием мезенхимальных стволовых клеток костного мозга является инвазивной, поскольку клетки отбирают из костного мозга, расположенного глубоко в организме. Тем временем, с использованием фармацевтических средств по настоящему изобретению, мезенхимальные стволовые клетки костного мозга можно собирать из периферической крови менее инвазивным способом и использовать для трансплантации клеток или сходных с ней.
Настоящее изобретение относится к фармацевтическим средствам для вовлечения клеток костного мозга в периферическую кровь из костного мозга, которые содержат экстракты клеток или тканей, подлежащие введению в кровеносный сосуд или мышцу, и которые получают способами, включающими стадию погружения клеток или тканей в растворитель.
Клетки или ткани, подлежащие погружению в растворитель, конкретно не ограничены, но включают, например, происходящие из ткани клетки, клетки клеточных линий, полученных из происходящих из ткани клеток (включая, но не ограничиваясь ими, например, HeLa и HEK293), выделенные клетки, невыделенные клетки (например, клетки в выделенных тканях) и клетки, трансфицированные ДНК, кодирующей белок HMGB1, HMGB2 или HMGB3. В качестве описанной выше ткани можно использовать любую ткань. Например, такие ткани включают, но не ограничиваются ими, живые ткани кожи или ткани, полученные внутренней биопсией (хирургической операцией) (такие как головной мозг, легкое, сердце, печень, желудок, тонкий и толстый кишечник, поджелудочная железа, почка, мочевой пузырь, селезенка, матка, семенники и кровь).
Примеры указанного выше растворителя включают, но не ограничиваются ими, физиологический раствор, PBS (фосфатно-солевой буфер) и TBS (забуференный солевой раствор Tris). Более того, время погружения клеток или ткани в растворитель должно иметь продолжительность, необходимую и достаточную для индукции некроза клеток, т.е. от 1 часа до 48 часов (например, от 6 до 48 часов), и предпочтительно от 12 до 24 часов, но оно не ограничивается этим. Таким образом, "стадию погружения клеток в растворитель" можно перефразировать как "стадию погружения клеток в растворитель на период времени, необходимый и достаточный для индукции некроза" или "стадию обеспечения некроза клеток". Более того, примеры температуры для погружения клеток или ткани в растворитель включают, но не ограничиваются этим, от 4°C до 25°C (например, от 4°C до 8°C), и предпочтительно 4°C. Кроме того, примеры pH для погружения клеток или ткани в растворитель включают, но не ограничиваются этим, pH от 7 до 8, предпочтительно pH 7,5. Примеры буфера включают, но не ограничиваются этим, фосфатно-солевой буфер в концентрации от 10 мМ до 50 мМ, предпочтительно от 10 до 20 мМ.
Более того, в настоящем изобретении, после погружения клеток или тканей в растворитель их можно извлекать из растворителя, содержащего их. Способ извлечения клеток или тканей из растворителя конкретно не ограничен, при условии, что способ хорошо известен специалистам в данной области. Например, клетки или ткани можно удалять из растворителя центрифугированием при гравитационном ускорении от 10 G до 100000 G (например, 440 G) при от 4°C до 25°C (например, 4°C) с последующим отделением супернатанта, однако способ удаления не ограничивается этим способом. Супернатант можно использовать в качестве экстракта клеток или тканей.
Экстракты клеток или тканей по настоящему изобретению, полученные способами, включающими стадию погружения клеток или тканей в растворитель, включают, например, но не ограничиваются ими, экстракт кожи и экстракт мононуклеарных клеток периферической крови (экстракт периферической крови).
Экстракт периферической крови получают следующим способом: после сбора крови шприцом или сходными с ним, клетки замораживают в морозильной камере или в жидком азоте, на сухом льду, или сходными способами, а затем размораживают при температуре 0°C или более. Затем для удаления нерастворимых клеточных компонентов образец центрифугируют, например, при силе тяжести от 10 до 100000 G (например, при 440 G) и при от 4°C до 25°C (например, при 4°C) и полученный супернатант собирают. Нерастворимые клеточные компоненты можно удалять из растворителя способом, описанным выше. Однако способы удаления нерастворимых клеточных компонентов не ограничены указанным выше примером. Полученный супернатант можно использовать в качестве экстракта клеток или тканей. Альтернативно вместо центрифугирования нерастворимые клеточные компоненты можно удалять фильтрацией через фильтр из нитроцеллюлозы с микропорами 0,45 мкм, или т.п. Альтернативно, собранной периферической крови можно позволять стоять в течение от трех до 48 часов при 4°C для индукции некроза клеток. При такой обработке из клеток периферической крови могут высвобождаться внутриклеточные компоненты. Затем, для удаления из растворителя нерастворимых клеточных компонентов, образец центрифугируют при силе тяжести от 10 до 100000 G (например, при 440 G), и полученный супернатант собирают. Нерастворимые клеточные компоненты можно удалять из растворителя способом, описанным выше, но не ограничиваясь им. Полученный супернатант можно использовать в качестве экстракта клеток или тканей. Альтернативно вместо центрифугирования нерастворимые клеточные компоненты можно удалять фильтрацией через фильтр из нитроцеллюлозы с микропорами 0,45 мкм или т.п.
Тем временем экстракты из мононуклеарных клеток периферической крови получают следующим способом: проводят взятие цельной периферической крови с использованием шприца или сходных с ним, а затем весь образец разбавляют вплоть до 4 мл посредством PBS. После помещения 3 мл Ficoll-Paque Plus (GE) в центрифужную пробирку разбавленную кровь наслаивают на слой Ficoll. Пробирку центрифугируют при 400 G и 18°C в течение 40 минут. Полученный средний слой, содержащий мононуклеарные клетки, переносят в свежую центрифужную пробирку и в нее добавляют 45 мл PBS. Образец центрифугируют при 800 G и 18°C в течение пяти минут и полученный супернатант удаляют. К клеткам снова добавляют 45 мл PBS и образец центрифугируют при 800 G и 18°C в течение пяти минут. Полученный супернатант удаляют. К осажденным клеткам добавляют 200 мкл PBS и их суспендируют. Суспензии клеток позволяют стоять при -80°C в морозильной камере в течение 30 минут. Замороженную суспензию извлекают из морозильной камеры и размораживают на льду. Обработку замораживанием-размораживанием повторяют три раза. Затем образец центрифугируют при 800 G и 4°C в течение 15 минут и супернатант собирают. Альтернативно вместо замораживания клеток образцу клеток можно позволять стоять при 4°C в течение от трех до 48 часов для индукции некроза клеток. Посредством этой обработки можно высвобождать внутриклеточные компоненты. Альтернативно клетки можно разрушать обработкой ультразвуком при охлаждении на льду. Посредством этой обработки можно высвобождать внутриклеточные компоненты. В любом случае после высвобождения внутриклеточных компонентов из клеток образец центрифугируют при силе тяжести от 440 до 1000000 G, предпочтительно от 20000 до 100000 G. Полученный супернатант собирают в качестве экстракта клеток. Альтернативно вместо центрифугирования нерастворимые компоненты можно удалять фильтрацией через фильтр из нитроцеллюлозы или ацетата целлюлозы с микропорами 0,45 мкм или т.п. Полученный фильтрат используют в качестве экстракта клеток.
Кроме того, настоящее изобретение относится к фармацевтическим средствам, подлежащим введению в кровеносный сосуд или мышцу, для применения для вовлечения клеток костного мозга в периферическую кровь из костного мозга, включающим гепарин-связывающую фракцию, продуцируемую способом, который включает следующие стадии:
(a) погружение клетки или ткани в растворитель;
(b) контактирование экстракта, полученного на стадии (a), с иммобилизованным гепарином; и
(c) элюирование гепарин-связывающей фракции (также она может называться очищенной гепарином фракцией или очищенной на колонке с гепарином фракцией) с иммобилизованного гепарина.
"Иммобилизованный гепарин" относится к гепарину, ковалентно связанному с нерастворимым носителем. Примеры нерастворимого носителя включают, но не ограничиваются ими, гранулы сефарозы (такие как сефароза 4B, сефароза 6B и т.п.: GE Healthcare). В настоящем изобретении также можно использовать коммерчески доступный иммобилизованный гепарин (колонка Hitrap Heparin HP: GE Healthcare).
Примеры условий для контактирования экстракта клеток или тканей с иммобилизованным гепарином включают, но не ограничиваются ими, pH приблизительно от 7 до 8 (предпочтительно pH 7,5) и концентрацию соли от 0 до 200 мМ, предпочтительно приблизительно от 100 до 200 мМ. Время, в течение которого экстракт контактируют с иммобилизованным гепарином, конкретно не ограничено, однако контакт предпочтительно продолжается в течение 5 минут или более для достаточной адсорбции гепарин-связывающей фракции на иммобилизованный гепарин. Примеры температуры включают, но не ограничиваются ими, от 4 до 8°C, предпочтительно 4°C. Кроме того, примеры условий элюирования гепарин-связывающей фракции, адсорбированной на иммобилизованный гепарин, включают, но не ограничиваются ими, pH приблизительно от 7 до 8 и концентрацию соли от 200 до 1000 мМ (предпочтительно приблизительно 1000 мМ).
При введении в кровеносный сосуд или мышцу фармацевтические средства, содержащие экстракт или фракцию, описанную выше, вовлекают стволовые клетки ткани костного мозга в периферический кровоток и могут стимулировать регенерацию поврежденных тканей. Более того, предполагается, что описанные выше фармацевтические средства можно использовать не только в качестве индукторов/промоторов для функциональной регенерации ткани, но также в качестве так называемого профилактического лекарственного средства для профилактики функционального нарушения тканей/органов, вызываемого уменьшением количества тканевых стволовых клеток, или лекарственного средства против старения для замедления прогрессирования связанных со старением изменений.
Альтернативно такое лечение можно осуществлять введением указанного выше фармацевтического средства, сбором и концентрированием плюрипотентных стволовых клеток, вовлеченных в периферическую кровь из организма, и затем введением клеток в области повреждения. Общепринятая терапия с использованием мезенхимальных стволовых клеток костного мозга является инвазивной, поскольку клетки собирают из костного мозга, расположенного глубоко в организме. Тем временем, с использованием фармацевтических средств по настоящему изобретению, мезенхимальные стволовые клетки костного мозга можно собирать из периферической крови менее инвазивным способом и использовать для трансплантации клеток или сходных с ней.
Настоящее изобретение относится к наборам для вовлечения клеток костного мозга в периферическую кровь из костного мозга, которые состоят из композиций, подлежащих введению в кровеносный сосуд или мышцу, и которые содержат любой из следующих материалов:
(a) белок HMGB1;
(b) клетка, которая секретирует белок HMGB1;
(c) вектор, в который встроена ДНК, кодирующая белок HMGB1;
(d) белок HMGB2;
(e) клетка, которая секретирует белок HMGB2;
(f) вектор, в который встроена ДНК, кодирующая белок HMGB2;
(g) белок HMGB3;
(h) клетка, которая секретирует белок HMGB3; и
(i) вектор, в который встроена ДНК, кодирующая белок HMGB3.
Более того, настоящее изобретение относится к наборам для вовлечения клеток костного мозга в периферическую кровь из костного мозга, которые содержат экстракты клеток или тканей, продуцируемые способом, включающим стадию погружения клеток или тканей в растворитель, и которые подлежат введению в кровеносный сосуд или мышцу.
Также настоящее изобретение относится к наборам для вовлечения клеток костного мозга в периферическую кровь из костного мозга, которые содержат гепарин-связывающую фракцию, подлежащую введению в кровеносный сосуд или мышцу и которую получают способом, включающим стадии
(a) погружения клетки или ткани в растворитель;
(b) контактирования иммобилизованного гепарина с экстрактом, полученным на стадии (a); и
(c) элюирования гепарин-связывающей фракции с иммобилизованного гепарина.
Описанные выше наборы для вовлечения клеток костного мозга в периферическую кровь характеризуются тем, что введение в кровеносный сосуд или мышцу вовлекает стволовые клетки ткани костного мозга в периферический кровоток.
Примеры описанных выше наборов включают наборы для стимуляции регенерации ткани, включающие (1) указанный выше экстракт или указанную выше фракцию или сходные с ними, растворенные в фибриногене, и (2) тромбин; или альтернативно наборы для стимуляции регенерации ткани, содержащие (1) указанный выше экстракт или указанную выше фракцию или сходные с ними, (2) фибриноген и (3) тромбин. В настоящем изобретении можно использовать коммерчески доступный фибриноген и тромбин. Их примеры включают, но не ограничиваются ими, фибриноген HT-Wf (Benesis-Mitsubishi Pharma), Beriplast (ZLB Behring), Tisseel (Baxter), Bolheal (Kaketsuken) и TachoComb (ZLB Behring).
Происходящие из костного мозга клетки, которые привлекаются в поврежденную ткань, дифференцируются в различные типы клеток, которые участвуют в функциональной регенерации поврежденной ткани и поддержании/усилении функций. В настоящем изобретении примеры поврежденной ткани включают, но не ограничиваются ими, ткани, поврежденные различными физиологическими состояниями, травмами, ожогами, воспалением, аутоиммунитетом, генетическими нарушениями и т.п., вызывающими состояния ишемии/гипоперфузии/гипоксии. Также поврежденная ткань включает некротизированные ткани.
Ткани по настоящему изобретению конкретно не ограничены, при условии, что в них могут дифференцироваться клетки костного мозга. Их примерами могут быть все типы тканей в живом организме, такие как ткани кожи, костные ткани, хрящевые ткани, мышечные ткани, жировые ткани, ткани сердечной мышцы, нервные ткани, легочные ткани, ткани желудочно-кишечного тракта, ткани печени/желчевыводящих путей/поджелудочной железы и органов мочеполовой системы. Более того, с использованием описанных выше промоторов регенерации тканей, становятся возможными способы лечения для индукции функциональной регенерации тканей не только кожных заболеваний, таких как трудноизлечимая кожная язва, кожные раны, буллез и алопеция, но также повреждений тканей, таких как повреждения вследствие инфаркта головного мозга, инфаркта миокарда, перелома кости, инфаркта легких, язвы желудка и энтерита. Виды животных, подлежащих введению описанных выше промоторов регенерации тканей, включают, но не ограничиваются ими, человека и не являющихся человеком животных, например человека, мышей, крыс, обезьян, свиней, собак, кроликов, хомяков и морских свинок.
Клетки костного мозга по настоящему изобретению представляют собой клетки, отличные от гемопоэтических стволовых клеток, или клеток, происходящих из них, таких как лейкоциты, эритроциты и тромбоциты, и они включают стволовые клетки, которым соответствуют клетки, до настоящего времени называемые мезенхимальными стволовыми клетками костного мозга, стромальными плюрипотентными стволовыми клетками костного мозга или плюрипотентными стволовыми клетками костного мозга, и популяции клеток-предшественников, существующие в костном мозге. Клетки костного мозга по настоящему изобретению можно выделять из экстрактов костного мозга (экстрактов клеток костного мозга) или коллекции периферической крови. Гемопоэтические стволовые клетки являются неприкрепяющимися, в то время как клетки костного мозга по настоящему изобретению получают в качестве прикрепляющихся клеток посредством клеточной культуры фракции мононуклеарных клеток крови, полученных из экстрактов костного мозга (экстрактов клеток костного мозга) или коллекции периферической крови. Более того, клетки костного мозга по настоящему изобретению включают мезенхимальные стволовые клетки, и они обладают потенциалом к дифференцировке, предпочтительно, в остеобласты (эту индукцию дифференцировки можно идентифицировать путем выявления кальцификации), хондроциты (которые можно идентифицировать по положительному окрашиванию альциановым синим, по положительному окрашиванию сафранином O, или сходными с ними), адипоциты (которые можно идентифицировать по положительному окрашиванию суданом III), и другие мезенхимальные клетки, такие как фибробласты, гладкомышечные клетки, стромальные клетки и клетки сухожилий; и, кроме того, нервные клетки, эпителиальные клетки (например, эпидермальные кератиноциты и эпителиальные клетки кишечника экспрессируют семейство цитокератинов), и сосудисто-эндотелиальные клетки. Однако клетки, в которые может происходить дифференцировка, не ограничиваются указанными выше клетками, и также они включают клетки, имеющие потенциал к дифференцировке в клетки паренхиматозных органов, таких как печень, почка и поджелудочная железа.
В настоящем изобретении происходящие из костного мозга мезенхимальные стволовые клетки, плюрипотентные стромальные стволовые клетки костного мозга или плюрипотентные стволовые клетки костного мозга относятся к клеткам, существующим в костном мозге, которые непосредственно получают из костного мозга или опосредованно получают из других тканей (крови, кожи, жировой ткани и других тканей), и их можно культивировать/они могут пролиферировать в качестве прикрепляющихся клеток на культуральной чашке (изготовленной из пластмассы или стекла). Эти клетки характеризуются наличием потенциала к дифференцировке в мезенхимальные ткани (мезенхимальные стволовые клетки), такие как кость, хрящ и жировая ткань, или скелетные мышцы, сердечная мышца, кроме того, нервные ткани, эпителиальные ткани (плюрипотентные стволовые клетки), и их можно получать из коллекции крови костного мозга, периферической крови или мезенхимальных тканей, таких как жировая ткань, эпителиальные ткани, такие как кожа, нервные ткани, такие как головной мозг. Происходящие из костного мозга мезенхимальные стволовые клетки, происходящие из костного мозга плюрипотентные стволовые клетки или плюрипотентные стволовые клетки костного мозга также характеризуются наличием потенциала к дифференцировке в эпителиальные ткани, такие как кератиноциты, которые образуют кожу, или в нервные ткани, которые образуют головной мозг, путем введения клеток, которые прикрепились к культуральной чашке, в область повреждения живого организма.
Мезенхимальные стволовые клетки костного мозга, стромальные плюрипотентные стволовые клетки костного мозга или плюрипотентные стволовые клетки костного мозга по настоящему изобретению представляют собой мультипотентные стволовые клетки, и они способны дифференцироваться предпочтительно в остеобласты (индукцию дифференцировки можно идентифицировать путем выявления кальцификации), хондроциты (которые можно идентифицировать по положительному окрашиванию альциановым синим, по положительному окрашиванию сафранином O, или сходными с ними), адипоциты (которые можно идентифицировать по положительному окрашиванию суданом III и т.п.), и другие мезенхимальные клетки, такие как фибробласты, гладкомышечные клетки, стромальные клетки и клетки сухожилий; нервные клетки, пигментные клетки, эпидермальные клетки, клетки волосяного фолликула (которые экспрессируют семейство цитокератинов, семейство кератина волос или сходные с ними), эпителиальные клетки (например, эпидермальные кератиноциты и эпителиальные клетки кишечника экспрессируют семейство цитокератинов или сходные с ним) и эндотелиальные клетки; и, кроме того, предпочтительно в клетки паренхиматозных органов, таких как печень, почка и поджелудочная железа. Однако дифференцированные клетки не ограничены указанными выше клетками.
Более того, мезенхимальные стволовые клетки костного мозга, стромальные плюрипотентные стволовые клетки костного мозга или плюрипотентные стволовые клетки костного мозга человека могут быть проиллюстрированы, но не ограничиваясь ими, клетками, которые непосредственно получают сбором костного мозга (экстрактов клеток костного мозга), периферической крови или жировой ткани, или получают в качестве прикрепляющихся клеток посредством культивирования выделенной фракции мононуклеарных клеток. Маркеры мезенхимальных стволовых клеток костного мозга, стромальных плюрипотентных стволовых клеток костного мозга или плюрипотентных стволовых клеток костного мозга человека могут представлять собой, например, но не ограничиваться ими, все или некоторые из следующих маркеров: Lin-отрицательный, CD45-отрицательный и CD44-положительный.
Более того, мезенхимальные стволовые клетки костного мозга, стромальные плюрипотентные стволовые клетки костного мозга или плюрипотентные стволовые клетки костного мозга мыши могут быть проиллюстрированы, но не ограничиваясь ими, клетками, которые непосредственно получают способами, описанными в разделе "Примеры". Маркеры мезенхимальных стволовых клеток костного мозга, стромальных плюрипотентных стволовых клеток костного мозга или плюрипотентных стволовых клеток костного мозга мыши могут представлять собой, например, но не ограничиваться ими, все или некоторые из следующих маркеров: CD44-положительный, PDGFRα-положительный, PDGFRβ-положительный, CD45-отрицательный, Lin-отрицательный, Sca-1-положительный и c-kit-отрицательный.
Клетки-предшественники тканей определяют как недифференцированные клетки, имеющие однонаправленный потенциал к дифференцировке в конкретные клетки тканей, отличные от кровеносной системы, и включают недифференцированные клетки с потенциалом к дифференцировке в мезенхимальную ткань, эпителиальную ткань, нервную ткань, паренхиматозные органы и эндотелий сосудов, как упоминалось выше.
Для фармацевтических средств по настоящему изобретению не существует конкретного ограничения в отношении компонентов, отличных от экстракта, гепарин-связывающей фракции, и по меньшей мере одного из ингредиентов (a)-(i), упомянутых выше, при условии, что компонент не ингибирует привлечение клеток костного мозга и стимуляцию регенерации тканей. Например, в дополнение к экстракту, гепарин-связывающей фракции, и по меньшей мере одному из веществ (a)-(i), упомянутых выше, фармацевтические средства по настоящему изобретению могут содержать молекулы (молекулярные группы), связанные с усилением функции HMGB1, HMGB2 или HMGB3 для индукции функциональной регенерации тканей; молекулы (молекулярные группы), которые ингибируют непредвиденные действия HMGB1, HMGB2 или HMGB3; факторы, которые регулируют пролиферацию и дифференцировку клеток костного мозга; и другие факторы, которые усиливают/поддерживают эти факторы или клеточные функции.
Типы животных, которые служат в качестве источника экстракта, гепарин-связывающей фракции, белка HMGB1, HMGB2 или HMGB3 для фармацевтических средств по настоящему изобретению, включают человека и не являющихся человеком животных, примерами которых могут быть люди, мыши, крысы, обезьяны, свиньи, собаки, кролики, хомяки и морские свинки, однако предпочтительно тип животного является таким же, как и животное, которому намереваются вводить указанный выше экстракт или сходные с ним.
Белок HMGB1 в фармацевтических средствах по настоящему изобретению может быть проиллюстрирован, но не ограничиваясь этим, белками, содержащими аминокислотную последовательность SEQ ID NO: 1, 3 или 5. Белки HMGB1 по настоящему изобретению также могут включать белки, которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3 или 5. Примеры таких белков включают 1) выделенные белки, которые содержат аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, инсерциями и/или вставками в аминокислотной последовательности SEQ ID NO: 1, 3 или 5 и которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3 или 5; и 2) выделенные белки, которые кодируются ДНК, которые гибридизуются в строгих условиях с ДНК, содержащими нуклеотидную последовательность SEQ ID NO: 2, 4 или 6 и которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3 или 5.
Белок HMGB2 в фармацевтических средствах по настоящему изобретению может быть проиллюстрирован, но не ограничиваясь этим, белками, содержащими аминокислотную последовательность SEQ ID NO: 7, 9 или 11. Белки HMGB2 по настоящему изобретению также могут включать белки, которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 7, 9 или 11. Примеры таких белков включают 1) выделенные белки, которые содержат аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, инсерциями и/или вставками в аминокислотной последовательности SEQ ID NO: 7, 9 или 11 и которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 7, 9 или 11; и 2) выделенные белки, которые кодируются ДНК, которые гибридизуются в строгих условиях с ДНК, содержащими нуклеотидную последовательность SEQ ID NO: 8, 10 или 12, и которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 7, 9 или 11.
Белок HMGB3 в фармацевтических средствах по настоящему изобретению может быть проиллюстрирован, но не ограничиваясь этим, белками, содержащими аминокислотную последовательность SEQ ID NO: 13 или 15. Белки HMGB3 по настоящему изобретению также могут включать белки, которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 13 или 15. Примеры таких белков включают 1) выделенные белки, которые содержат аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, инсерциями и/или вставками в аминокислотной последовательности SEQ ID NO: 13 или 15 и которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 13 или 15; и 2) выделенные белки, которые кодируются ДНК, которые гибридизуются в строгих условиях с ДНК, содержащими нуклеотидную последовательность SEQ ID NO: 14 или 16, и которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 13 или 15.
Выделенные белки, которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15, могут быть гомологами или паралогами белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15. Специалисты в данной области могут выделять белки, которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15, известными способами (дополнительный том "Jikken Igaku (Experimental Medicine), Idenshi Kougaku Handbook (Genetic Engineering Handbook)", pp. 246-251, опубликованный Yodosha Co., Ltd., 1991).
Примеры белков, которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15, включают белки, обладающие активностью индукции происходящих из костного мозга клеток.
Белки, которые содержат аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, инсерциями и/или вставками в аминокислотной последовательности SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15 и которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15, включают встречающиеся в природе белки. Как правило, эукариотические гены имеют полиморфизм, как известно для генов интерферонов и сходных с ними. Изменения нуклеотидной последовательности, вызванное полиморфизмом, может привести к одной или нескольким аминокислотным заменам, делециям, инсерциям и/или вставкам. Встречающиеся в природе белки, такие как белки, содержащие аминокислотную последовательность с одной или несколькими аминокислотными заменами, делециями, инсерциями и/или вставками в аминокислотной последовательности SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15 и которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15, включены в белки HMGB1, HMGB2 или HMGB3 по настоящему изобретению.
Настоящее изобретение также включает искусственно продуцированные мутантные белки при условии, что они функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15. Известные способы, которые приводят к случайной мутации данной нуклеотидной последовательности, включают замену(ы) пары(пар) оснований посредством обработки ДНК азотистой кислотой (Hirose, S. et al., Proc. Natl. Acad. Sci. USA., 79: 7258-7260, 1982). Этот способ обеспечивает случайное внесение замены(замен) пары(пар) оснований в конкретный сегмент посредством обработки азотистой кислотой желательного для мутации сегмента. Альтернативно технологии для сайт-направленной мутации мишени включают способ дуплекса с брешью (Kramer W. and Fritz H.J., Methods in Enzymol., 154: 350-367, 1987) и т.п. Замкнутый двухцепочечный вектор, в который клонируют ген, подлежащий встраиванию мутации, клонируют и разделяют на отдельные цепи. Эти отдельные цепи гибридизуют с синтетическим олигонуклеотидом с мутацией в участке-мишени. Происходящую из вектора комплементарную отдельную цепь ДНК, линеаризованную ферментом рестрикции, подвергают отжигу с циклическим одноцепочечным вектором и разрыв между олигонуклеотидом и вектором достраивают с использованием ДНК-полимеразы, которую затем преобразовывают в полный двухцепочечный вектор лигированием.
Количество аминокислот, подлежащих модификации, как правило, находится в пределах 50, предпочтительно в пределах 30, более предпочтительно в пределах 5 аминокислот (например, одна аминокислота).
Когда аминокислоту заменяют искусственно, замена аминокислотой, имеющей сходные свойства, приводит к сохранению активности исходного белка. Белки по настоящему изобретению включают белки, полученные в результате консервативной замены при указанной выше замене аминокислоты(аминокислот) и которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15. Консервативную замену считают важной в случае замены аминокислоты(аминокислот) доменов, важных для активности белка. Такая консервативная замена аминокислоты(аминокислот) хорошо известна специалистам в данной области.
Примеры групп аминокислот, пригодных для консервативной замены, включают основные аминокислоты (такие как лизин, аргинин и гистидин), кислотные аминокислоты (такие как аспарагиновая кислота и глутаминовая кислота), незаряженные полярные аминокислоты (такие как глицин, аспарагин, глутамин, серин, треонин, тирозин и цистеин), неполярные аминокислоты (такие как аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин и триптофан), β-разветвленные аминокислоты (такие как треонин, валин и изолейцин) и ароматические аминокислоты (такие как тирозин, фенилаланин, триптофан и гистидин).
Более того, неконсервативная замена может повышать активность белка (например, конститутивно активированные белки).
Кроме того, белки, которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15, можно получать способами, в которых используется гибридизация. Иными словами, ДНК, кодирующую белок HMGB1, HMGB2 или HMGB3 по настоящему изобретению, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14 или 16, или ее фрагмент используют в качестве зонда и затем выделяют ДНК, которые могут гибридизоваться с ними. Реакция гибридизации, проведенная в строгих условиях, приводит к выбору высоко гомологичной ДНК в качестве нуклеотидной последовательности. Это повышает вероятность того, что выделенные белки содержат белки, которые функционально эквивалентны белку HMGB1, HMGB2 или HMGB3. Примеры высоко гомологичной нуклеотидной последовательности включают последовательности, обладающие 70% или более, желательно 90% или более идентичностью.
В конкретном примере термин "строгие условия" относится к условиям гибридизации с 6×SSC, 40% формамидом при 25°C и последующему промыванию 1×SSC при 55°C. Строгость зависит от таких условий, как концентрация соли, концентрация формамида или температура; однако специалистам в данной области понятно, как устанавливать условия, чтобы получить необходимую строгость.
С использованием гибридизации, например, можно выделять ДНК, кодирующие гомологи белков HMGB1, HMGB2 или HMGB3, отличные от белков, содержащих аминокислотную последовательность SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15.
Белки, которые функционально эквивалентны белку, содержащему аминокислотную последовательность SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15, обычно имеют высокую гомологию с аминокислотной последовательностью SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15. Термин "высокая гомология" относится к идентичности последовательностей, составляющей по меньшей мере 30% или более, предпочтительно 50% или более, более предпочтительно 80% или более (например, 95% или более). Идентичность нуклеотидных последовательностей и аминокислотных последовательностей можно определять с использованием сайта поиска гомологии через интернет (например, программы поиска гомологии, такие как FASTA, BLAST, PSI-BLAST и SSEARCH, можно использовать в DNA Data Bank of Japan (DDBJ) [примеры которого включают страницу поиска гомологии (Search and Analysis) на web-сайте DNA Data Bank of Japan (DDBJ); http://www.ddbj.nig.ac.jp/E-mail/homology-j.html]). Более того, поиск с использованием BLAST можно проводить через web-сайт National Center for Biotechnology Information (NCBI) (примеры которого включают страницу BLAST на домашней странице web-сайта NCBI; http://www.ncbi.nlm.nih.gov/BLAST/; Altschul, S.F. et al., J. Mol. Biol., 1990, 215(3): 403-10; Altschul, S.F. & Gish, W., Meth. Enzymol., 1996, 266: 460-480; Altschul, S.F. et al., Nucleic Acids Res., 1997, 25: 3389-3402)).
Например, при вычислении идентичности аминокислотных последовательностей с использованием Advanced BLAST 2.1 величину идентичности (%) можно получить следующим образом: в качестве программы используют blastp, ожидаемое значение устанавливают на 10, все фильтры устанавливают на OFF, в качестве матрицы используют BLOSUM62 и штраф за пропуск, штраф за пропуск остатка и отношение лямбда устанавливают на 11, 1 и 0,85 соответственно (параметры по умолчанию) (Karlin, S. and S.F. Altschul (1990) Proc. Natl. Acad. Sci. USA 87: 2264-68; Karlin, S. и S.F. Altschul (1993) Proc. Natl. Acad. Sci. USA 90: 5873-7).
Белки по настоящему изобретению или белки, функционально эквивалентные им, могут представлять собой белки, подвергнутые различным модификациям, таким как физиологическая модификация сахарными цепями и т.п., мечение флуоресцентными или радиоактивными веществами или слияние с другими белками. В частности, в рекомбинантных молекулах, описанных ниже, модификация сахарной цепи может варьировать в зависимости от хозяев, используемых для экспрессии. Однако даже если существуют отличия в модификации сахарных цепей, все белки, имеющие свойства, сходные со свойствами белков HMGB1, HMGB2 или HMGB3, описанных в настоящем документе, представляют собой белки HMGB1, HMGB2 или HMGB3 по настоящему изобретению или белки, функционально эквивалентные им.
Белки HMGB1, HMGB2 или HMGB3 можно получать не только из материалов живых организмов, но также в форме рекомбинантных белков путем встраивания генов, которые кодируют эти белки, в соответствующую экспрессирующую систему. Для получения белков HMGB1, HMGB2 или HMGB3 способами генной инженерии, указанные выше ДНК, которые кодируют белки HMGB1, HMGB2 или HMGB3, можно встраивать в соответствующую экспрессирующую систему, а затем они могут экспрессироваться. Примеры систем хозяин/вектор, применимых для настоящего изобретения, включают экспрессирующий вектор pGEX и E. coli. В случае pGEX чужеродные гены могут быть экспрессированы в качестве слитого с глутатион-S-трансферазой белка (GST) (Gene, 67: 31-40, 1988). pGEX, в который встроен ген, кодирующий белок HMGB1, HMGB2 или HMGB3, вводят в штамм E. coli, такой как BL21, посредством теплового шока, инкубируют в течение подходящего периода времени, а затем добавляют изопропилтио-β-D-галактозид (IPTG) для индукции слитого с GST белка HMGB1, слитого с GST белка HMGB2 или слитого с GST белка HMGB3. Поскольку GST по настоящему изобретению адсорбируется на глутатион-сефарозу 4B, продукт экспрессии легко выделять и очищать аффинной колоночной хроматографией.
Кроме того, в качестве систем хозяин/вектор для получения рекомбинантных белков HMGB1, HMGB2 или HMGB3 можно использовать следующее. Прежде всего, когда в качестве хозяев используют бактерии, экспрессирующие векторы для слитых белков, в которых используется гистидиновая метка, HA-метка, FLAG-метка и сходные с ними, являются коммерчески доступными. Что касается дрожжей, известно, что дрожжи, относящиеся к роду Pichia, являются эффективными для экспрессии содержащих сахарную цепь белков. С точки зрения добавления сахарных цепей, также являются пригодными экспрессирующие системы, в которых используется бакуловирусный вектор с клетками насекомых в качестве клеток-хозяев (Bio/Technology, 6: 47-55, 1988). Кроме того, при использовании клеток млекопитающих, трансфекцию вектора проводят с использованием промоторов, таких как CMV, RSV и SV40. Любые из этих систем хозяин/вектор можно использовать в качестве экспрессирующей системы для белков HMGB1, HMGB2 или HMGB3. Более того, гены также можно вводить с использованием вирусных векторов, таких как ретровирусные векторы, аденовирусные векторы и векторы на основе аденоассоциированных вирусов.
Полученные таким образом белки по настоящему изобретению можно выделять из внутреннего содержимого клетки или извне клеток (среда и т.п.), и их можно очищать в качестве белков, которые являются по существу чистыми и гомогенными. Белки можно разделять и очищать с использованием способов разделения и очистки, которые обычно используют при очистке белков, и они конкретно не ограничены. Например, белки можно разделять и очищать путем надлежащего выбора и комбинирования хроматографических колонок, фильтров, ультрафильтрации, высаливания, осаждения растворителем, экстракции растворителем, дистилляции, иммунопреципитации, SDS-полиакриламидного гель-электрофореза, электрофореза с изоэлектрическим фокусированием, диализа, перекристаллизации и т.п.
Примеры хроматографии включают аффинную хроматографию, ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрацию, обращенно-фазовую хроматографию и адсорбционную хроматографию (Marshak et al., Strategies for Protein Purification and Characterization: A Laboratory Course Manual. Ed Daniel R. Cold Spring Harbor Laboratory Press, 1996). Эти типы хроматографии можно проводить с использованием жидкофазной хроматографии, такой как ВЭЖХ и FPLC.
Более того, белки по настоящему изобретению предпочтительно представляют собой по существу очищенные белки. В настоящем документе термин "по существу очищенный" означает, что чистота белка по настоящему изобретению (доля белка по настоящему изобретению в общих белковых компонентах) составляет 50% или более, 60% или более, 70% или более, 80% или более, 90% или более, 95% или более, 100% или близко к 100%. Верхний предел для выражения "близко к 100%" зависит от способов очистки и аналитических способов специалистов в данной области, и его примерами являются 99,999%, 99,99%, 99,9%, 99% и т.п.
Более того, по существу очищенный белок включает любой белок, очищенный любым способом очистки при условии, что чистота белка является такой, как указано выше. Примеры включают, но не ограничиваются ими, белки, по существу очищенные посредством надлежащего выбора и комбинирования указанных выше хроматографических колонок, фильтров, ультрафильтрации, высаливания, осаждения растворителем, экстракции растворителем, дистилляции, иммунопреципитации, SDS-полиакриламидного гель-электрофореза, электрофореза с изоэлектрическим фокусированием, диализа, перекристаллизации и т.п.
Клетки, где высвобождаются или секретируются белки HMGB1, HMGB2 или HMGB3 фармацевтических средств по настоящему изобретению, в основном включают все типы происходящих из тканей клеток in vivo. Примерами клеток, которые можно легко собирать и культивировать, являются, но они не ограничиваются ими, фибробласты (такие как нормальные фибробласты кожи и клеточные линии, происходящие из них). Более того, клетки, секретирующие белки HMGB1, HMGB2 или HMGB3 также можно получать следующим образом. Получают вектор встраиванием ДНК, кодирующей белок HMGB1, HMGB2 или HMGB3, или ДНК, кодирующей HMGB1, HMGB2 или HMGB3, связанной с ДНК, кодирующей сигнальную последовательность для секреции (ATG CAG ACA GAC ACA CTC CTG CTA TGG GTA CTG CTG CTG TGG GTT CCA GGT TCC ACT GGT GAC; SEQ ID NO: 17), в известный экспрессирующий вектор или вектор генной терапии. Полученный вектор вводят в клетки млекопитающих, такие как фибробласты (такие как нормальные фибробласты кожи и клеточные линии, происходящие из них), клетки насекомых и другие клетки. Примеры ДНК, кодирующих сигнальные последовательности для секреции, включают, но не ограничиваются ими, ДНК с описанными выше последовательностями. Не существует конкретных ограничений типа животных, из которых эти клетки происходят, хотя предпочтительно используют клетки из типа животных, к которому относится животное-мишень, которое подвергают регенерации ткани, клетки из самого животного-мишени, или клетки, происходящие из близкого родственника животного-мишени, которого подвергают регенерации ткани.
ДНК, которые кодируют белки HMGB1, HMGB2 или HMGB3 фармацевтических средств по настоящему изобретению могут представлять собой кДНК, геномные ДНК, природные ДНК или искусственно синтезированные ДНК, при условии, что они кодируют белок HMGB1, HMGB2 или HMGB3. ДНК, которые кодируют белки HMGB1, HMGB2 или HMGB3, обычно содержатся в фармацевтических средствах по настоящему изобретению в форме, встроенной в векторы (такие как векторы генной терапии).
Примеры векторов генной терапии по настоящему изобретению включают, но не ограничиваются ими, плазмидные векторы, ретровирусные векторы, лентивирусные векторы, аденовирусные векторы, векторы на основе аденоассоциированного вируса, векторы на основе вируса Сендай, векторы на основе оболочки вируса Сендай и векторы на основе вируса папилломы. Векторы генной терапии могут содержать промоторные последовательности ДНК, которые эффективно индуцируют экспрессию генов, факторы, которые регулируют экспрессию генов, и молекулы, которые необходимы для поддержания стабильности ДНК.
Фармацевтические средства по настоящему изобретению также могут содержать неполные пептиды белка HMGB1, HMGB2 или HMGB3, которые обладают активностью вовлечения клеток костного мозга в периферическую кровь из костного мозга; клетки, секретирующие эти неполные пептиды; или векторы, в которые встроена ДНК, кодирующая эти неполные пептиды.
Способами введения фармацевтических средств по настоящему изобретению является парентеральное введение в кровеносный сосуд или мышцу. Конкретные примеры способов введения включают введение посредством инъекции. Например, фармацевтические средства по настоящему изобретению можно вводить в кровеносный сосуд или мышцу посредством внутрисосудистой инъекции (внутриартериальная инъекция, внутривенная инъекция или сходные с ними) или внутримышечной инъекции.
Способ введения можно пригодным образом выбирать согласно возрасту и симптомам пациента. Когда вводят белок HMGB1, HMGB2 или HMGB3, дозу белка на применение можно выбирать из диапазона от 0,0000001 мг до 1000 мг на кг массы тела пациента. Альтернативно дозу можно выбирать, например, из диапазона от 0,00001 мг до 100000 мг массу тела пациента. При введении клеток, секретирующих белки HMGB1, HMGB2 или HMGB3, или векторов для генной терапии, в которые встроена ДНК, кодирующая белки HMGB1, HMGB2 или HMGB3, их можно вводить так, чтобы количества белка HMGB1, HMGB2 или HMGB3 находились в пределах указанного выше диапазона. Однако дозировка фармацевтических средств по настоящему изобретению не ограничивается этим.
Фармацевтические средства по настоящему изобретению можно изготавливать согласно обычным способам (например, Remington's Pharmaceutical Science, последнее издание, Mark Publishing Company, Easton, U.S.A), и они могут содержать фармацевтически приемлемые носители и добавки. Их примеры включают поверхностно-активные вещества, эксципиенты, красители, отдушки, консерванты, стабилизаторы, буферы, суспендирующие вещества, обеспечивающие изотоничность средства, связующие вещества, дезинтегрирующие вещества, смазывающие вещества, средства, обеспечивающие текучесть, и вкусовые добавки, хотя они не ограничены ими, и можно надлежащим образом использовать другие распространенные носители. Конкретные примеры включают легкую безводную кремниевую кислоту, лактозу, кристаллическую целлюлозу, маннит, крахмал, кармеллозу кальция, кармеллозу натрия, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилацетальдиэтиламиноацетат, поливинилпирролидон, желатин, триглицерид жирной кислоты средней длины цепи, полиоксиэтилен-гидрогенизированное касторовое масло 60, белый сахар, карбоксиметилцеллюлозу, кукурузный крахмал и неорганические соли.
Более того, применения указанных выше экстрактов клеток или тканей, гепарин-связывающих фракций, белков HMGB1, HMGB2 или HMGB3, клеток, секретирующих белки HMGB1, HMGB2 или HMGB3, векторов, в которые встроены ДНК, кодирующие белки HMGB1, HMGB2 или HMGB3, неполных пептидов белков HMGB1, HMGB2 или HMGB3, клеток, секретирующих эти неполные пептиды; или векторов, в которые встроены ДНК, кодирующие эти неполные пептиды, могут быть такими, как указано в (1)-(3), ниже:
(1) способы вовлечения клеток костного мозга в периферическую кровь из костного мозга, которые включают стадию введения в кровеносный сосуд или мышцу экстрактов клеток или тканей, гепарин-связывающих фракций, белков HMGB1, HMGB2 и HMGB3, клеток, которые секретируют белки, векторов, в которые встроены ДНК, кодирующие белки, неполных пептидов белков, клеток, которые секретируют неполные пептиды, или векторов, в которые встроены ДНК, кодирующие неполные пептиды;
(2) применение экстрактов клеток или тканей, гепарин-связывающих фракций, белков HMGB1, HMGB2 и HMGB3, клеток, которые секретируют белки, векторов, в которые встроены ДНК, кодирующие белки, неполных пептидов белков, клеток, которые секретируют неполные пептиды, или векторов, в которые встроены ДНК, кодирующие неполные пептиды, для получения фармацевтических средств, вводимых в кровеносный сосуд или мышцу, для вовлечения клеток костного мозга в периферическую кровь из костного мозга; и
(3) экстракты клеток или тканей, гепарин-связывающие фракции, белки HMGB1, HMGB2 и HMGB3, клетки, которые секретируют белки, векторы, в которые встроены ДНК, кодирующие белки, неполные пептиды белков, клетки, которые секретируют неполные пептиды, и векторы, в которые встроены ДНК, кодирующие неполные пептиды, которые вводят в кровеносный сосуд или мышцу, для применения в способах вовлечения клеток костного мозга в периферическую кровь из костного мозга.
Также настоящее изобретение относится к способам оценки того, содержатся ли в экстрактах клеток или тканей факторы, которые вовлекают клетки костного мозга в периферическую кровь из костного мозга, которые включают следующие стадии:
(a) получение экстрактов клеток или тканей; и
(b) определение активности в отношении вовлечения клеток костного мозга в периферическую кровь из костного мозга экстрактов, полученных на стадии (a).
Если активность вовлечения клеток костного мозга в периферическую кровь из костного мозга на стадии (b) превышает активность контроля, способ также можно использовать для определения того, что экстракты клеток или тканей содержат факторы, которые вовлекают клетки костного мозга в периферическую кровь из костного мозга.
В указанном выше способе, прежде всего, клетки или ткани погружают в растворитель. Эти клетки конкретно не ограничены, и их примеры включают происходящие из ткани клетки и клеточные линии, полученные из происходящих из тканей клеток (таких как HeLa и HEK293, но не ограничиваясь ими), выделенные клетки, невыделенные клетки (такие как клетки, существующие в выделенных тканях), клетки, в которые введена ДНК, кодирующая белок HMGB1, HMGB2 или HMGB3. В качестве ткани, описанной выше, можно использовать любую ткань, и ее примеры включают, но не ограничиваются ими, живые ткани кожи, ткани для внутренней биопсии (хирургической операции) (такие как головной мозг, легкое, сердце, печень, желудок, тонкий кишечник, толстый кишечник, поджелудочная железа, почка, мочевой пузырь, селезенка, матка, семенники и кровь) и поврежденные ткани. Более того, примеры растворителя включают, но не ограничиваются ими, физиологический раствор, PBS и TBS. Кроме того, время погружения клеток или ткани в растворитель предпочтительно представляет собой время, необходимое и достаточное для индукции некроза клеток (обычно 24 часа или более), но оно не ограничивается этим. Более того, в настоящем изобретении, клетки или ткань погружают в растворитель, а затем клетки или ткань можно извлекать из растворителя, содержащего клетки или ткань. Способ извлечения клеток или ткани из растворителя конкретно не ограничен при условии, что способ известен специалистам в данной области.
Далее, измеряют активность вовлечения клеток костного мозга в периферическую кровь из костного мозга полученными экстрактами клеток или ткани. Контроль включает, например, растворитель до погружения в него клеток или тканей. Активность привлечения клеток костного мозга можно измерять, например, способами, описанными в разделе Примеры; однако способы не ограничиваются ими.
Активность вовлечения клеток костного мозга в периферический кровоток из костного мозга можно оценивать следующим образом. Полученный экстракт клеток или тканей вводят внутривенно, подкожно, внутримышечно или внутрибрюшинно; через период времени от одной минуты до четырех недель после введения, предпочтительно через период времени от одного часа до 24 часов после введения, и более предпочтительно через 12 часов после введения, периферическую кровь собирают и популяцию мононуклеарных клеток в периферической крови оценивают проточной цитометрией для измерения двойных положительных по PDGFRα и CD44 клеток, или двойных положительных по PDGFRβ и CD44 клеток. Способ анализа активности не ограничивается этим примером.
Настоящее изобретение также относится к способам скрининга экстрактов клеток или тканей, включающих факторы, которые вовлекают клетки костного мозга в периферическую кровь из костного мозга, которые включают стадии:
(a) анализа ряда экстрактов описанным выше способом оценки того, содержат ли экстракты факторы, которые вовлекают клетки костного мозга в периферическую кровь из костного мозга; и
(b) выбора экстрактов, которые определены на стадии (a) как содержащие факторы, которые вовлекают клетки костного мозга в периферическую кровь из костного мозга.
Также настоящее изобретение относится к способам идентификации факторов, которые вовлекают клетки костного мозга в периферическую кровь из костного мозга, которые включают стадию очистки факторов с использованием активности привлечения клеток костного мозга в качестве индикатора, из экстрактов, которые определены в качестве содержащих факторы способами оценки и скрининга, описанными выше. Факторы, которые вовлекают клетки костного мозга в периферическую кровь из костного мозга, можно очищать с использованием общепринятых способов выделения/очистки белка. Не существует ограничения типа способа выделения/очистки. Например, для выделения и очистки белков можно надлежащим образом выбирать и комбинировать хроматографические колонки, фильтры, ультрафильтрацию, высаливание, осаждение растворителем, экстракцию растворителем, дистилляцию, иммунопреципитацию, SDS-полиакриламидный гель-электрофорез, электрофорез с изоэлектрическим фокусированием, диализ, перекристаллизацию и т.п. Очищенные факторы можно идентифицировать способами, известными специалистам в данной области, например, масс-спектрометрией. Идентифицированные факторы можно использовать для вовлечения клеток костного мозга в периферическую кровь из костного мозга. Такие факторы могут быть названы "кандидатами для вовлечения клеток костного мозга в периферическую кровь из костного мозга" или "кандидатами для участия в вовлечении клеток костного мозга в периферическую кровь из костного мозга".
Все документы уровня техники, цитированные в настоящем документе, включены в настоящий документ в качестве ссылок.
Примеры
Ниже в настоящем документе настоящее изобретение конкретно описано с помощью примеров, но его не следует истолковывать как ограниченное ими.
Пример 1
Задача: Вовлечение стволовых клеток ткани костного мозга в периферическую кровь с использованием факторов индукции происходящих из ткани костного мозга стволовых клеток в экстракте ткани кожи.
Способы: для достижения указанной выше задачи, проводили исследование способом, описанным ниже.
(1) Получение индуктора происходящих из ткани костного мозга стволовых клеток. Свободные фрагменты кожи, полученные от 25 новорожденных мышей (в возрасте двух суток) погружали в 25 мл фосфатно-солевого буфера (PBS), pH 7,4. После инкубации в течение 24 часов при 4°C образец центрифугировали при 440 G при 4°C в течение десяти минут для удаления ткани. Супернатант собирали в качестве экстракта кожи (SE).
Тем временем, из кожи новорожденных мышей C57/Bl6 экстрагировали РНК с использованием Trizol (Invitrogen), а затем синтезировали кДНК с использованием набора SuperScript III cDNA Synthesis Kit (Invitrogen). С использованием этой кДНК в качестве матрицы проводили полимеразную цепную реакцию (ПЦР) для амплификации кДНК HMGB1. кДНК HMGB1 встраивали в плазмидный вектор для экспрессии белков клеток млекопитающих, pCAGGS, для экспрессии белка, в котором с N-концом аминокислотной последовательности связана последовательность Flag-метки (Asp-Tyr-Lys-Asp-Asp-Asp-Lys, SEQ ID NO: 18) (фиг.1). Плазмидный вектор трансфицировали в HEK293 (культивированная клеточная линия, происходящая из клеток почки эмбриона человека). Клетки культивировали в течение 48 часов для экспрессии белка. Каждый образец клеток, экспрессирующих белок HMGB1, и культуральный супернатант инкубировали при 4°C в течение 16 часов, а затем центрифугировали при 4400×g в течение пяти минут. Супернатант собирали и к нему добавляли гель с антителом против Flag (Sigma) в количестве 100 мкл на 50 мл супернатанта. Смесь инкубировали при 4°C в течение 16 часов. Гель собирали центрифугированием, а затем пять раз промывали PBS. Затем гель элюировали 3× пептидом Flag (конечная концентрация 100 мкг/мл). Концентрацию элюированного белка определяли с использованием набора HMGB1 ELISA Kit (Shino-Test Co.). После лиофилизации концентрацию белка доводили до 200 мкг/мл с помощью PBS.
(2) Мышам в возрасте восьми недель (C57/Bl6) вводили 500 мкл описанного выше экстракта кожи (SE), или 500 мкл PBS в качестве группы отрицательного контроля, через хвостовую вену с использованием шприцов, к которым присоединена игла для инъекций 30G 1/2 (фиг.2). Через шесть, 12, 24 и 48 часов после введения из сердца мышей отбирали 1 мл периферической крови под ингаляционной анестезией с помощью изофлурана с использованием покрытого гепарином 1-мл шприца. Каждый из образцов крови смешивали с 3 мл PBS, а затем осторожно наслаивали на 3 мл Ficoll (GE healthcare). Полученные образцы центрифугировали с использованием центрифуги при 400×g при 25°C в течение 40 минут. Клетки мутного среднего слоя собирали в качестве фракции мононуклеарных клеток. К собранным клеткам добавляли 1 мл раствора HLB (Immuno-Biological Laboratories Co., Ltd.), гемолитического средства. Клетки инкубировали при комнатной температуре в течение пяти минут. Эту гемолитическую обработку повторяли дважды. После добавления 10 мл PBS клетки центрифугировали при 440×g при 25°C в течение пяти минут. Супернатанты удаляли и клетки собирали. 1000000 клеток инкубировали при комнатной температуре в течение 20 минут с антителами, каждое из которых разбавлено 100-кратно PBS, включающим меченное PE антитело против PDGFRα мыши (e-Bioscience), меченное PE антитело против PDGFRβ мыши (e-Bioscience) и меченное PerCy5 антитело против CD44 мыши (BD biosciences). После инкубации клетки центрифугировали при 440×g при 25°C в течение пяти минут. Супернатант удаляли. К клеткам добавляли 400 мкл PBS, содержащего 1% параформальдегид, для подготовки образцов для анализа проточной цитометрией.
Мышам в возрасте восьми недель (C57/Bl6) вводили 250 мкл HMGB1 мыши (1 мкг/мкл), или 250 мкл PBS в качестве группы отрицательного контроля, через хвостовую вену с использованием шприцов, к которым присоединена игла для инъекций 30G 1/2 (фиг.4). Через 12 часов после введения отбирали 1 мл периферической крови из сердца мышей под ингаляционной анестезией с помощью изофлурана с использованием покрытого гепарином 1-мл шприца. Каждый из образцов крови смешивали с 3 мл PBS, а затем осторожно наслаивали на 3 мл Ficoll (GE healthcare). Полученные образцы центрифугировали с использованием центрифуги при 400×g при 25°C в течение 40 минут. Клетки мутного среднего слоя собирали в качестве фракции мононуклеарных клеток. К собранным клеткам добавляли 1 мл раствора HLB (Immuno-Biological Laboratories Co., Ltd.), гемолитического средства. Клетки инкубировали при комнатной температуре в течение пяти минут. Эту гемолитическую обработку повторяли дважды. После добавления 10 мл PBS клетки центрифугировали при 440×g при 25°C в течение пяти минут. Супернатанты удаляли и клетки собирали. 1000000 клеток инкубировали при комнатной температуре в течение 20 минут с антителами, каждое из которых разбавлено 100-кратно PBS, включающим меченное PE антитело против PDGFRα мыши (e-Bioscience) и меченное PerCy5 антителом против CD44 мыши (BD biosciences). После инкубации клетки центрифугировали при 440×g при 25°C в течение пяти минут. Супернатант удаляли. К клеткам добавляли 400 мкл PBS, содержащего 1% параформальдегид, для подготовки образцов для анализа проточной цитометрией.
Результаты: было показано, что двойные положительные по PDGFRα и CD44 клетки в значительной степени вовлекаются в периферическую кровь через 12 часов после инъекции экстракта кожи (SE) (фиг.3). Более того, было показано, что двойные положительные по PDGFRα и CD44 клетки в значительной степени вовлекаются в периферическую кровь через 12 часов после инъекции HMGB1 (фиг.5).
Пример 2
Задача: тестирование того, вовлекаются ли мезенхимальные стволовые клетки в периферическую кровь посредством внутривенного введения рекомбинантного белка HMGB1.
Способы: мышам C57BL6 (возраст от восьми до десяти недель, самцы) вводили 400 мкл физиологического раствора, содержащего 100 мкг/мл рекомбинантного белка HMGB1 (40 мкг HMGB1) или 400 мкл физиологического раствора отдельно через хвостовую вену. Через 12 часов у мышей проводили взятие периферической крови. Образцы крови разбавляли PBS до общего объема 4 мл. Разбавленные образцы крови наслаивали на 3 мл Ficoll-Paque Plus (GE), помещенного в центрифужные пробирки. Образцы центрифугировали при 400 G при 18°C в течение 40 минут. Средний слой, содержавший мононуклеарные клетки, переносили в свежую центрифужную пробирку, и в нее добавляли 45 мл PBS. Пробирку центрифугировали при 800 G при 18°C в течение пяти минут. Супернатант удаляли. Снова добавляли 45 мл PBS и пробирку центрифугировали при 800 G при 18°C в течение пяти минут. Супернатант удаляли. Полученные мононуклеарные клетки инкубировали с меченным фикоэритробилином (PE) антителом против PDGFRα мыши и меченным флуоресцеинизотиоцианатом (FITC) антителом против CD44 мыши. Затем оценивали увеличение содержания двойных положительных по PDGFRα и CD44 клеток во фракции мононуклеарных клеток с помощью проточной цитометрии (Facscan; Becton, Dickinson and Company).
Результаты: было показано, что количество двойных положительных по PDGFRα и CD44 клеток, PDGFRα-положительных и CD44-отрицательных клеток во фракции мононуклеарных клеток периферической крови значительно возрастало через 12 часов после введения HMGB1 (фиг.14). Конкретно, было продемонстрировано, что HMGB1 обладает активностью вовлечения PDGFRα-положительных клеток в периферическую кровь из костного мозга. PDGFRα известен в качестве маркера мезенхимальных стволовых клеток.
Обсуждение: PDGFRα и CD44 известны в качестве поверхностных маркеров мезенхимальных стволовых клеток костного мозга, которые являются иллюстративными для происходящих из костного мозга плюрипотентных стволовых клеток. Мезенхимальные стволовые клетки костного мозга представляют собой плюрипотентные стволовые клетки, способные дифференцироваться в нервные клетки, эпителиальные клетки или сходные с ними, а также в остеоциты, хондроциты и адипоциты. Тем временем, фрагменты кожи, использованные в этом эксперименте, находятся в ишемизированном состоянии. Таким образом, происходит постепенный некроз тканей и внутриклеточные белки, такие как ядерные белки, а также белки клеточной поверхности, высвобождаются наружу. HMGB1 представляет собой белок, содержащийся в экстракте кожи. При трансплантации кожи или сходных с ней, такие белки служат в качестве сигнала для привлечения происходящих из ткани костного мозга стволовых клеток в пересаженную кожу. Таким образом, предполагается, что функциональная регенерация кожи в трансплантате кожи достигается восстановлением эпидермиса, гиподермы, фолликулярных тканей или сходных с ними, обусловленным клетками костного мозга. Исходя из этого эксперимента, в настоящем изобретении было успешно открыто, что происходящие из ткани костного мозга стволовые клетки вовлекаются в периферический кровоток внутривенным введением HMGB1 или экстракта кожи, как описано выше. Это открытие обеспечивает новые терапевтические способы для лечения трудноизлечимых заболеваний с повреждениями тканей, таких как инфаркт головного мозга, инфаркт миокарда, перелом кости и кожная язва, которые основаны на вовлечении происходящих из костного мозга плюрипотентных стволовых клеток в периферическую кровь. Кроме того, клетки, вовлеченные в периферическую кровь, можно собирать общепринятым способом сбора крови. Таким образом, настоящее изобретение обеспечивает более простые и более безопасные способы сбора происходящих из ткани костного мозга стволовых клеток по сравнению с общепринятым способом лечения инфаркта головного мозга, в случае которого клетки собирают из костного мозга.
Справочный пример 1
Задача: идентификация семейства HMGB1 в экстракте кожи и исследование активности индукции мезенхимальных стволовых клеток.
Способы: Наличие или отсутствие в неонатальном экстракте кожи мыши семейства белков HMGB подтверждали с использованием способа вестерн-блоттинга. Свободные фрагменты кожи от 400 новорожденных мышей погружали в 400 мл физиологического фосфатно-солевого буфера (PBS; pH 7,4) и раствор инкубировали при 4°C в течение 24 часов. Для удаления тканей образцы центрифугировали при 440 G при 4°C в течение 10 минут и супернатант собирали в качестве экстракта кожи. Десять мкл полученного экстракта кожи использовали в качестве образца и подвергали SDS-PAGE электрофорезу. Белки, разделенные в геле, переносили на PVDF-мембрану с использованием устройства для блоттинга (ATTO). Мембрану инкубировали с PBS, содержащим 3% обезжиренное молоко и 0,1% Tween20 (S-T-PBS) при комнатной температуре в течение одного часа, и затем ей позволяли реагировать с каждым из антитела кролика против HMGB1 мыши, антитела кролика против HMGB2 мыши, или антитела кролика против HMGB3 мыши, которые разбавляли в 1000 раз посредством S-T-PBS, при 4°C в течение 16 часов. После реакции мембрану PVDF промывали посредством S-T-PBS пять раз в течение 5 минут. Затем мембрану PVDF инкубировали с разбавленным в 2000 раз (разбавленным посредством S-T-PBS) меченным пероксидазой антителом козы против IgG кролика (GE Healthcare) при 25°C в течение 1 часа. Кроме того, после промывания посредством S-T-PBS пять раз в течение 5 минут мембране PVDF позволяли реагировать с системой для детекции вестерн-блоттингом ECL (GE Healthcare). Пленку ECL экспонировали и проявляли для детекции присутствия белков HMGB1, HMGB2 и HMGB3.
РНК экстрагировали из кожи новорожденной мыши с использованием Trizol (Invitrogen) и далее синтезировали кДНК с использованием набора SuperScript III cDNA Synthesis Kit (Invitrogen). С использованием этой кДНК в качестве матрицы амплифицировали кДНК HMGB1, HMGB2 и HMGB3 способом полимеразной цепной реакции (ПЦР). кДНК встраивали в плазмидный вектор pCAGGS для экспрессии белков в клетках млекопитающих, так чтобы могли экспрессироваться белки с дополнительной последовательностью Flag-метки (Asp-Tyr-Lys-Asp-Asp-Asp-Lys; SEQ ID: 18) на N-конце аминокислотной последовательности. Эти плазмидные векторы трансфицировали в HEK293 (культуру клеточной линии, происходящую из почки эмбриона человека) и культивировали в течение 48 часов для экспрессии белков. Клетки, экспрессирующие каждый из белков HMGB1, HMGB2 и HMGB3 и культуральный супернатант, инкубировали при 4°C в течение 16 часов, а затем их центрифугировали при 4400 g в течение 5 минут для сбора супернатанта. 100 мкл геля антитела против Flag (Sigma) смешивали с 50 мл этого супернатанта, а затем инкубировали при 4°C в течение 16 часов. Затем проводили центрифугирование для сбора геля и промывание посредством PBS пять раз. Кроме того, белок элюировали с использованием пептида 3× Flag (конечная концентрация 100 мкг/мл). Экспрессию рекомбинантных белков исследовали способом вестерн-блоттинга с использованием разбавленного в 1000 раз (разбавленного S-T-PBS) антитела мыши против Flag и разбавленного в 2000 раз (разбавленного S-T-PBS) меченного пероксидазой антитела против IgG мыши (GE Healthcare). Активность миграции мезенхимальных стволовых клеток костного мозга мыши в этих очищенных рекомбинантных белках оценивали с использованием камеры Бойдена. Более того, для исследования лекарственной эффективности средства на основе семейства HMGB in vivo, из кожи спины мышей C57BL/6 в возрасте 8 недель вырезали круг, имеющий диаметр 8 мкм, для осуществления моделей кожных язв. Каждый из очищенных HMGB1, HMGB2 и HMGB3 (100 нг/мкл) смешивали с тем же количеством раствора гиалуроновой кислоты в концентрации 1 г/100 мл PBS, и 100 мкл его вводили на поверхность язвы. Поверхность язвы покрывали прозрачной клейкой повязкой на рану/защитным материалом Tegaderm (3M Healthcare), чтобы избежать высыхания, и площадь раны измеряли с течением времени для определения терапевтического эффекта.
Кроме того, для исследования того, обладает ли экстракт кожи человека и очищенный HMGB1 человека активностью обеспечения миграции мезенхимальных стволовых клеток костного мозга человека, использовали камеру Бойдена. Кожу человека, имеющую площадь 1 см2, погружали в 1 мл PBS, а затем инкубировали при 4°C в течение 16 часов, а затем центрифугировали при 440 G при 4°C в течение 10 минут. Супернатант отдельно собирали для применения в качестве экстракта кожи человека. Более того, мезенхимальные стволовые клетки костного мозга человека (Cambrex) использовали в качестве клеток, помещаемых в верхнее отделение камеры Бойдена (в результате анализа поверхностных антигенов проточной цитометрией было подтверждено, что эти клетки являются CD105-положительными, CD166-положительными, CD29-положительными, CD44-положительными, CD34-отрицательными и CD45-отрицательными. Также с помощью тестов индукции дифференцировки было выявлено, что они дифференцируются в адипоциты, хондроциты и остеоциты). Более того, в нижнее отделение помещали 100 нг/лунка HMGB1 человека (R&D) и экстракта кожи человека, разбавленного в 10 раз PBS. В качестве контроля использовали PBS.
Результаты: в результате вестерн-блоттинга, были выявлены полосы HMGB2 и HMGB3, а также полоса HMGB1. Таким образом, было подтверждено, что экстракт кожи новорожденной мыши содержит, помимо HMGB1, белки семейства HMGB2 и HMGB3 (фиг.6). Получали экспрессирующие векторы HMGB1/HMGB2/HMGB3, имеющих Flag-метку, добавленную на N-конец каждого белка (фиг.1). Эти экспрессирующие векторы трансфицировали в клетки HEK293, и экспрессированные белки очищали с использованием Flag-метки, и для выявления этих белков проводили вестерн-блоттинг (фиг.7). Активность миграции мезенхимальных стволовых клеток костного мозга мыши определяли с использованием этих очищенных белков, и активность была подтверждена для всех из этих белков (фиг.8). Площадь язвы, сформированной на спине мыши, измеряли каждые 7 суток, и в группах введения HMGB1, 2 и 3 был подтвержден значительный эффект в отношении снижения площади язвы по сравнению с группой без введения (фиг.9). Аналогично случаю с мышью было выявлено, что HMGB1 человека и экстракт кожи человека обладают активностью индукции миграции мезенхимальных стволовых клеток костного мозга (фиг.10).
Обсуждение: HMGB2 и HMGB3 известны в качестве белков, обладающих высокой гомологией с HMGB1. Также предполагается, что эти белки имеют свойства, сходные с HMGB1. Было подтверждено, что HMGB2 и HMGB3 семейства HMGB также выделяются из экстракта свободного среза кожи. Кроме того, продуцировали рекомбинантные белки HMGB1/HMGB2/HMGB3, и также были подтверждены их активность в отношении миграции мезенхимальных стволовых клеток костного мозга in vitro и терапевтический эффект на кожную язву in vivo. Было выявлено, что семейство HMGB (HMGB1/HMGB2/HMGB3) и рекомбинантное семейство HMGB в свободном срезе кожи новорожденной мыши обладают активностью индукции мезенхимальных стволовых клеток костного мозга и активностью локальной индукции происходящих из костного мозга стволовых клеток, которые могут дифференцироваться в эпителий, и таким образом индуцированная группа происходящих из костного мозга клеток дифференцируется в различные клетки, такие как эпидермальные кератиноциты, волосяные фолликулы и фибробласты в поврежденной ткани, обеспечивая восстановление поврежденной ткани. Более того, поскольку мезенхимальные стволовые клетки костного мозга представляют собой мультипотентные стволовые клетки, авторы настоящего изобретения полагают, что также аналогично можно ожидать терапевтических эффектов путем систематического введения или местного введения семейства HMGB для лечения повреждений в других тканях, например повреждений тканей, таких как повреждение головного мозга, инфаркт миокарда и перелом кости.
Более того, известно, что между человеком и мышью гомология аминокислотных последовательностей для HMGB1 составляет 98% (213/215), 96% (202/210) для HMGB2, и 97% (195/200) для HMGB3. Таким образом, считается, что HMGB человека и HMGB мыши имеют сходную активность, и результаты показали, что экстракт кожи человека и HMGB1 человека обладают такой же активностью индукции мезенхимальных стволовых клеток костного мозга, как и экстракт кожи мыши и HMGB1 мыши.
Справочный пример 2
Задача: установление способа продукции экстракта тканей, содержащего факторы, индуцирующие мезенхимальные стволовые клетки костного мозга.
Способы: головной мозг, сердце, кишечник, почку и печень мыши C57BL6 в возрасте 6 недель и кожу новорожденной мыши погружали в 1 мл раствора физиологического фосфатно-солевого буфера (PBS) при pH 7,4. Растворы инкубировали при 4°C в течение 24 часов, а затем центрифугировали при 440 G при 4°C в течение 10 минут для удаления тканей. Супернатанты собирали с получением экстрактов тканей. Для подтверждения того, обладает ли полученный таким образом экстракт активностью индукции происходящих из костного мозга мезенхимальных стволовых клеток, исследовали активность миграции происходящих из костного мозга мезенхимальных стволовых клеток с использованием камеры Бойдена. Более того, измеряли концентрацию HMGB1, содержащегося в этих образцах, с использованием набора HMGB1 ELISA Kit (Shino-Test). Кроме того, экстрактам тканей головного мозга, сердца и кожи позволяли связываться с аффинной колонкой с гепарином и активность индукции происходящих из костного мозга мезенхимальных стволовых клеток в связанной с белком фракции подтверждали с использованием камеры Бойдена.
Результаты: экстракт головного мыши содержал количество HMGB1, эквивалентное экстракту кожи новорожденной мыши. Кроме того, активность индукции мезенхимальных стволовых клеток костного мозга также наблюдали в головном мозге мыши, как и в коже. Хотя экстракт кишечника мыши и экстракт сердца мыши содержали мало HMGB1, также наблюдали активность индукции мезенхимальных стволовых клеток костного мозга. Более того, связанные с колонкой с гепарином фракции головного мозга мыши и сердца мыши, а также связанная с колонкой с гепарином фракция кожи мыши, показали активность индукции мезенхимальных стволовых клеток костного мозга (фиг.11). В таблице 1 представлены результаты измерения концентрации HMGB1 и активности индукции мезенхимальных стволовых клеток костного мозга в каждом из экстрактов тканей мыши.
|
Обсуждение: разработан способ, которым HMGB1 можно удобным образом экстрагировать не только из кожи, но также из головного мозга посредством непосредственного погружения этих органов в физиологический буфер. Этот способ также применим к другим органам, таким как печень и почка. Более того, хотя экстракты из кишечника и сердца содержат мало HMGB1, наблюдали активность индукции мезенхимальных стволовых клеток костного мозга. Это указывает на то, что эти экстракты содержат другое вещество(а), индуцирующее мезенхимальные стволовые клетки костного мозга, помимо HMGB1. Такие вещества, содержавшиеся в этих экстрактах, исходно присутствуют в каждой ткани, и полагают, что они в физиологических условиях привлекают мезенхимальные стволовые клетки костного мозга в поврежденную ткань, когда ткань повреждена. С помощью настоящего изобретения разработан новый способ удобной и функциональной экстракции из различных органов множества веществ, индуцирующих мезенхимальные стволовые клетки костного мозга, включая HMGB1. Кроме того, также разработан способ очистки веществ, индуцирующих мезенхимальные стволовые клетки костного мозга, из экстракта ткани с использованием связывания с колонкой с гепарином. Эти вещества, обладающие активностью индукции мезенхимальных стволовых клеток костного мозга, можно очищать из головного мозга и сердца, также как и из кожи, с использованием колонки с гепарином.
Справочный пример 3
Задача: установление способа экстракции активаторов миграции мезенхимальных стволовых клеток из культивированных клеток.
Способы: происходящую из почки эмбриона человека клеточную линию HEK293 и клеточную линию карциномы шейки матки человека HeLa, каждую, культивировали в D-MEM, содержащей 10% эмбриональную телячью сыворотку (Nacalai). Эти клетки промывали посредством PBS, а затем 107 клеток погружали в 5 мл PBS (Nacalai) при 4°C в течение 16 часов. Раствор центрифугировали при 440 G (гравитационное ускорение) при 4°C в течение 5 минут, а затем супернатант собирали. Мезенхимальные стволовые клетки костного мозга человека помещали в верхнее отделение камеры Бойдена и разбавленный в 5 раз (посредством DMEM) экстракт клеток помещали в нижнее отделение для подтверждения миграционной активности мезенхимальных стволовых клеток костного мозга человека.
Результаты: как экстракт HEK293, так и экстракт HeLa, показали сходную активность в отношении миграции мезенхимальных стволовых клеток костного мозга (фиг.12).
Обсуждение: активаторы миграции мезенхимальных стволовых клеток костного мозга успешно экстрагированы удобным способом погружения культивируемых клеток в PBS.
Справочный пример 4
Задача: исследование того, можно ли индуцировать регенерацию нервных клеток путем создания моделей дефекта головного мозга мышей, которым вводят очищенную на колонке с гепарином фракцию экстракта кожи способом замедленного высвобождения локально в область повреждения, обеспечивая миграцию стволовых клеток, содержащихся в миелоидной системе, локально в область повреждения.
Способы:
(1) Получение очищенной на колонке с гепарином фракции экстракта кожи
Вырезанный срез кожи новорожденной мыши инкубировали в PBS (мышь/мл) при 4°C в течение 16 часов и получали экстракт кожи. Экстракт кожи разбавляли в 10 раз 9 объемами 20 мМ фосфатного буфера при pH 7,5 при 4°C. Предварительно для уравновешивания колонки в колонку HiTrap Hepalin HP (объем колонки: 5 мл, GE Healthcare) выливали 20 мМ фосфатный буфер, pH 7,5 (30 мл). Затем разбавленному раствору позволяли связаться с колонкой. Затем колонку промывали 20 мМ фосфатным буфером при pH 7,5 и 100 мМ NaCl (30 мл). Для элюирования адсорбированных белков в колонку выливали 20 мМ фосфатный буфер с pH 7,5 и 1000 мМ NaCl и фракции элюировали в пробирки. Каждую из адсорбированных фракций оценивали путем определения активности миграции происходящих из костного мозга клеток мыши с использованием способа с камерой Бойдена и собирали фракцию(и), имеющую активность в отношении миграции. Раствор(ы), обладающий активностью, использовали в качестве очищенной на гепарине фракции(ий) экстракта кожи в следующем справочном примере.
(2) Получение мышей с подавлением костного мозга
Мышей облучали однократной дозой рентгеновского излучения, составляющей 10 Гр, для получения мышей с подавлением костного мозга.
(3) Трансплантация костного мозга мыши с GFP мышам с подавлением костного мозга
Клетки костного мозга собирали из обеих бедренных костей и костей голени мышей GFP. Эти клетки вводили мышам с подавлением костного мозга через хвостовую вену через 24 часа после облучения. Введение проводили под ингаляционной анестезией с использованием изофлурана.
(4) Получение модели дефекта головного мозга (дефекта тканей головного мозга) на мышах
Мышей с подавлением костного мозга, которым трансплантировали клетки костного мозга мыши с GFP, подвергали ингаляционной анестезии с использованием изофлурана и пентобарбитала (45 мг/кг), которые мышам инъецировали внутрибрюшинно. Мышей фиксировали к стереотактическому устройству для головного мозга и проводили срединный разрез головы скальпелем. Трепанацию проводили на 2,5 мм латерально справа и 12,5 мм спереди брегмы с использованием бура (фиг.13A). На глубине 3 мм от этого участка, помещали и фиксировали иглу 20G Surflow. Затем применяли отрицательное давление с использованием шприца для отсасывания части ткани головного мозга (фиг.13B).
(5) Введение очищенной на колонке с гепарином фракции экстракта кожи в область дефекта ткани головного мозга
Пять микролитров очищенной на колонке с гепарином фракции экстракта кожи, растворенной в адгезивном составе для тканей на основе фибрина (фибриноген) (Bolheal (Kaketsuken)), инъецировали в указанную выше область, а затем инъецировали 5 мкл адгезивного состава для тканей на основе фибрина (тромбин) (Bolheal (Kaketsuken)) с использованием шприца Hamilton и шприца 26G (фиг.13C). Задачей этого действия было обеспечения эффекта замедленного высвобождения для очищенной на колонке с гепарином фракции экстракта кожи.
(6) Оценка эффекта регенерации нервных клеток в областях дефекта тканей головного мозга
Для оценки использовали мышей контрольной группы и группы введения. Определяли параметры в соответствующие периоды времени (с течением времени), мышам проводили перфузию 4% параформальдегидом, а затем их фиксировали и вырезали головной мозг. Кроме того, проводили наружную фиксацию 4% параформальдегидом. Затем его дегидратировали в 15% и 30% градиенте сахарозы с получением замороженных срезов.
Ядра окрашивали раствором DAPI (4',6-диамидино-2-фенилиндол, дигидрохлорид) и срез закрывали с использованием ингибитора фотообесцвечивания. Накопление GFP-положительных клеток в области повреждения (области дефекта ткани головного мозга) оценивали с использованием конфокального лазерного микроскопа.
Результаты: качественно показано накопление GFP-положительных клеток в течение 2 недель и в течение 6 недель после введения. Накопление GFP-положительных клеток имеет тенденцию к тому, чтобы быть более высоким в областях повреждения группы введения, а не в контрольной группе, как через 2 недели (контроль; фиг.13D, фракция очищенного на колонке с гепарином экстракта кожи; фиг.13E), так и через 6 недель (контроль; фиг.13F, фракция очищенного на колонке с гепарином экстракта кожи; фиг.13G) после введения.
Обсуждение: введение очищенной на колонке с гепарином фракции экстракта кожи приводило к накоплению происходящих из костного мозга клеток в области дефекта ткани головного мозга, которые имели форму нервных клеток. Известно, что происходящие из костного мозга мезенхимальные стволовые клетки также дифференцируются в нервные клетки и результат показал, что очищенная на колонке с гепарином фракция экстракта кожи способна индуцировать регенерацию нервных клеток поврежденной области головного мозга. Более того, это также применимо к регенерации нейронов поврежденных областей в тканях головного мозга при ишемических заболеваниях головного мозга и контузиях головного мозга.
Промышленная применимость
Настоящее изобретение относится к новым терапевтическим способам лечения трудноизлечимых заболеваний с повреждениями тканей, таких как инфаркт головного мозга, инфаркт миокарда, перелом кости и кожная язва. Кроме того, клетки, вовлеченные в периферическую кровь, можно получать общепринятым способом взятия крови. Таким образом, настоящее изобретение обеспечивает более простые и более безопасные способы взятия происходящих из ткани костного мозга стволовых клеток по сравнению с общепринятым способом, используемым для лечения инфаркта головного мозга, в котором клетки отбирают из костного мозга.