ЛЕЧЕНИЕ БОЛЕЗНИ АЛЬЦГЕЙМЕРА ЦИТОКИНАМИ
Вид РИД
Изобретение
Настоящее изобретение относится к применению цитокинов для диагностики, лечения или профилактики заболеваний. Более конкретно, настоящее изобретение относится к применению цитокинов для диагностики или лечения не неопластических или нелейкозных заболеваний, таких как аутоиммунные заболевания или нейродегенеративные расстройства.
В последующем описании настоящее изобретение будет описано с особой ссылкой на наиболее предпочтительный вариант его осуществления, который относится к применению цитокина интерлейкина-10 для диагностики, лечения или профилактики нейродегенеративного расстройства - болезни Альцгеймера. Данный один вариант осуществления не предназначен для ограничения объема настоящего изобретения, поскольку настоящее изобретение в равной степени применимо и к другим расстройствам, таким как аутоиммунные заболевания, например, рассеянный склероз, тяжелая псевдопаралитическая миастения, другим нейродегенеративным расстройствам, например, болезни Паркинсона, заболеванию двигательных нейронов и болезни Альцгеймера; хроническим воспалительным заболеваниям, таким как ревматоидный артрит, и другим заболеваниям, при которых желательна модуляция функции Т-клеток, таким как ВИЧ-инфекция и СПИД.
Сходным образом, настоящее изобретение пригодно для использования всех цитокинов, не только интерлейкина-10, а следовательно, такие цитокины как интерлейкин-1 (α или β), интерлейкин-2, интерлейкин-3, интерлейкин-4, интерлейкин-5, интерлейкин-6, интерлейкин-7, интерлейкин-8, интерлейкин-9, интерлейкин-10, интерлейкин-11, интерлейкин-12, интерлейкин-13, интерлейкин-14, интерлейкин-15, интерлейкин-16, интерлейкин-17, интерферон-α, интерферон-β, интерферон-γ, TNF-α, TNF-β, G-CSF, GM-CSF, M-LSF и TGF-β входят в объем настоящего изобретения.
Главной причиной ухудшения познавательной способности у людей старшего возраста является болезнь Альцгеймера (БА). В связи с увеличением продолжительности жизни во всем мире ожидается, что количество людей, которые будут поражены БА, утроится в течение следующих 50 лет (1). БА представляет собой клинический синдром, который характеризуется сложными и гетерогенными механизмами. Признанные генетические факторы включают в себя мутации гена, кодирующего белок-предшественник амилоида (2), презенилин 1 и 2 (3, 4), которые являются причиной малой части наследственных и обычно рано начинающихся случаев БА. Генетические факторы также связаны со спорадической или ненаследственной формой заболевания, а аллель е4 аполипопротеина Е (Аро Е) значимо повышает риск БА, но не является ни необходимым, ни достаточным для развития заболевания (5-7). Таким образом, вероятно, в этом участвуют другие генетические факторы и факторы окружающей среды, которые активно изучаются.
Молекулы, которые принимают участие в каскаде воспаления, представляют большой интерес, поскольку, как вновь предполагают, воспаление связано с нейродегенеративным процессом, характерным для головного мозга при БА (8). Так, реактивный астроцитоз наблюдается как в коре головного мозга, так и в гиппокампе указанных пациентов, и глиальные клетки также активируются внутри или вблизи невритических бляшек. Избыточная экспрессия цитокинов и других молекул воспаления также является общим признаком в патогенезе головного мозга при БА (9). Кроме того, эпидемиологические исследования показали, что длительное применение нестероидных противовоспалительных лекарственных средств связано с понижением частоты БА в контрольном исследовании на близнецах (10), и несколько других клинических исследований подтвердили уменьшенную связь с БА у индивидуумов, которых лечили противовоспалительными лекарственными средствами (11), включая специфические ингибиторы СОХ2 (12). Эти данные подтверждают гипотезу о том, что воспаление может вносить свой вклад в нейродегенеративный процесс, связанный с БА (13).
В попытке лучше понять биологию БА недавно исследовали возможную роль нескольких цитокинов и хемокинов. Фактически все медиаторы, включая IL-1b, IL-6, TNF-α, IL-8, TNF-β и воспалительный белок 1а макрофагов (MIP-1a), изучавшиеся в данных исследованиях, как предполагают, при БА образуются в избыточных количествах по сравнению с контролями, не страдающими деменцией (14-18). Напротив, противоречивые результаты были получены в отношении иммуномодулирующего цитокина IL-10, цитокина 2 типа, который подавляет Т-лимфоциты и клеточный иммунитет у людей и мышей и обладает мощным противовоспалительным действием (19-21).
В данных исследованиях рассматривали каждый цитокин в отдельности как генные полиморфизмы и/или как продукцию генов, но никогда не изучали связь между факторами, способствующими и препятствующими воспалению, такими как IL-10 и IL-6, в одной и той же популяции.
Уместно вспомнить, что отдельные нуклеотидные полиморфизмы (SNP) в промоторной области данных двух генов известны. Ген, кодирующий IL-10, картированный на хромосоме 1 между 1q31 и 1q32, является высокополиморфным. Продукция IL-10 коррелирует с биаллельными полиморфизмами в положениях: -1082 (замена гуанина на аденин), -819 (замена тимина на цитозин) и -592 (замена аденина на цитозин). Полиморфизм в положении -1082 лежит в пределах участка распознавания Ets (Е-двадцать шесть-специфичного) и может влиять на связывание данного фактора транскрипции и, следовательно, на активацию после транскрипции; аллель -1082 А коррелирует с продукцией IL-10 после стимуляции Т-клеток in vitro (57), в то время как полиморфизмы в положениях -819 и -592, как представляется, в этом не участвуют. Ген IL-6 у человека организован с пятью экзонами и четырьмя интронами и картирован на коротком плече хромосомы 7 (7р21) (50, 73). Участие IL-6 во многих биологических функциях параллельно связано с генетическими ассоциациями его аллельных вариантов с несколькими физиологическими и патофизиологическими состояниями. Два из его полиморфных сайтов часто использовались для генетических ассоциативных исследований: полиморфизма мультиаллельного вариабельного количества тандемных повторов (VNTR) во фланкирующей области 3' (AT-повторы) и биаллельного полиморфизма G на C промотора в положении -174. Единичный нуклеотидный полиморфизм G/С (SNP), как представляется, связан с варьирующими уровнями в крови и скоростями транскрипции IL-6 (54, 56, 68).
В свете указанных рассуждений и на основе ассоциативного исследования методом «случай-контроль», проведенного в Италии на пациентах со спорадической БА с поздним началом и парных им здоровых контролях (НС), авторы оценивали возможную связь SNP в случае IL-10 и IL-6 с развитием БА. Полученные результаты пролили дополнительный свет на гипотезу воспалительного патогенеза БА и дали возможность предположить наличие независимой от метаболической гипотезы генетической предрасположенности.
Указанные аллельные вариации связаны с измеримыми различиями в продукции IL-10 и IL-6 антиген- и митоген-стимулированными лимфоцитами периферической крови. Фактически данные полиморфизмы наблюдаются в регуляторной области гена и связаны с высокой, промежуточной или низкой продукцией IL-10 (22).
Авторы изучили продукцию лимфоцитами периферической крови (РВМС) IL-10 и IL-6, стимулированную бета-амилоидом, у пациентов с БА и у подходящих по возрасту парных здоровых контролей. Поскольку продукция данного цитокина у пациентов с БА была значимо снижена, у тех же самых индивидуумов анализировали полиморфизмы IL-10. Результаты показали, что аллель, продуцирующий большое количество IL-10, у пациентов с БА наблюдался крайне редко.
Конкретно, генотипы IL-10 распределяются по-разному, когда БА сравнивают с НС (χ2 = 16,007; р=0,007). Таким образом, генотипы, соответствующие сниженной продукции IL-10, имеют значимо более высокое распространение среди субъектов с БА (таблица I). Наличие генотипов низкой продукции IL-10 связано с ухудшением клинических результатов БА следующим образом: 1) начало заболевания в более раннем возрасте (таблица II) и 2) более быстрое прогрессирование заболевания) (сумма баллов MMSE) (таблица III).
|
Частота различных генотипов среди пациентов с болезнью Альцгеймера (БА) статистически достоверно отличается от такового у здоровых контролей (НС). (χ2 = 16,007, df=5, p=0,007. В скобках (с) указан соответствующий фенотип: высокий (Н), промежуточный (М) и низкий (L).
|
|
Корреляция между различными генотипами у пациентов с болезнью Альцгеймера и возрастом начала заболевания. ANOVA: p=0,042.
|
Корреляция между различными генотипами у пациентов с болезнью Альцгеймера и MMSE. ANOVA: p=0,010.
Хроническое воспаление, как полагают, участвует в нейродегенеративном процессе, характерном для БА (24, 25); данное предположение основано на критериях in vivo и ex adjuvantibus. Следовательно, медиаторы воспаления и активированные глиальные клетки, по наблюдениям, тесно связаны с нейритными бляшками in vivo. Кроме того, недавние данные указывают, что противовоспалительная терапия может быть полезной для модулирования прогрессирования заболевания (10-12). Несмотря на указанный большой объем данных, биологические корреляции БА все еще не ясны. Для того, чтобы пролить свет на данную проблему, внимание было сосредоточено на IL-10. Данный цитокин является главным регуляторным цитокином, участвующим во многих аспектах иммунного ответа, и регуляция его нарушена при аутоиммунных (26), злокачественных (27-31) и инфекционных (32-35) заболеваниях человека. Недавно было показано, что наличие генетически детерминированных высоких уровней секреции IL-10 является важным компонентом генетического фона для развития системной красной волчанки (36) и исхода инфекционного заболевания (37). Было показано также, что секреция IL-10, полученная в результате in vitro стимуляции лейкоцитов периферической крови человека липополисахаридом LPS, выражено варьирует между индивидуумами, и что гаплотипы цитокина связаны с различными уровнями секреции (38). Помимо этого, различия в сывороточной продукции IL-10 клетками пациентов и их родственников первой степени (37, 39), а также различия в распределении аллелей IL-10, предполагают вовлечение различных изоформ гена IL-10 как локусов важных количественных признаков для инфекционных (37, 40), аутоиммунных (26, 36, 41, 42) и злокачественных заболеваний (43).
Авторы первоначально анализировали продукцию IL-2 и IL-10, специфичную для LPS, Flu и амилоидного пептида, мононуклеарными клетками периферической крови (РВМС) пациентов с БА и подобранных по возрасту НС. Результаты показали, что 1) продукция IL-2 РВМС у пациентов с БА и в контроле была сходной при всех измерявшихся состояниях и 2) продукция IL-10 РВМС, стимулированными LPS и Flu, была сравнимо сходной у двух групп индивидуумов. Напротив, амилоид-специфическое иммунное нарушение, характеризующееся сниженной продукцией IL-10, имело место при БА. Наблюдение, что данный дисбаланс цитокинов не имел место в митоген-стимулированных РВМС, показывает, что амилоид-специфические иммунные ответы избирательно нарушаются у пациентов с БА. Кроме того, результаты, показывающие, что flu-стимулированная пролиферация была сходной у пациентов и в контроле, указывают на то, что процессинг и презентация антигенов в ассоциации с молекулами HLA класса II и ауторестриктивный путь активации иммунной системы CD4-HLA класса II (44) не являются дефектными у данных пациентов.
Следующие полиморфизмы гена IL-10 анализировали в одной и той же группе субъектов. Результаты, полученные путем анализа распределения аллелей IL-10 в данной итальянской выборке здоровых индивидуумов, показали близкое сходство с результатами, полученными для других популяций кавказоидов (45). Напротив, авторы наблюдали достоверно более высокую частоту генотипов, соответствующих пониженной продукции IL-10 (АСС/АСС, АСС/АТА и АТА/АТА), у пациентов с БА. Так, было установлено аномально повышенное преобладание изоформ низкой продукции IL-10 в популяции БА; фенотипическая корреляция данных изоформ стала очевидной, когда были определены амилоид-специфеские иммунные ответы.
Последующий анализ был сфокусирован на возможных корреляциях между нарушенной продукцией IL-10 и клиническими проявлениями БА посредством изучения связи наличия генотипов с низкой/промежуточной продукцией IL-10 с различными исходами заболевания. Результаты подтвердили наличие указанной связи. Так, наличие генотипов АТА/АТА и GCC/ATA коррелировало с более ранним возрастом начала заболевания. Кроме того, аллели АСС/АТА и АСС/АСС (все они представляют собой генотипы низкой/промежуточной продукции IL-10) были связаны с более тяжелым расстройством познавательной способности, о чем свидетельствовала более низкая сумма баллов MMSE.
Интересно, что недавнее сообщение о лицах в возрасте 100 лет и старше в Италии, которые, по определению, менее склонны к развитию возрастных заболеваний, показало, что крайне высокая продолжительность жизни связана с достоверно более высокой частотой генотипов, соответствующих высокой продукции IL-10 (46).
Известно, что IL-10 обладает мощным противовоспалительным действием (47); таким образом, можно предположить биологический сценарий, при котором снижение продукции амилоид-специфического IL-10 должно благоприятствовать запуску хронического воспалительного процесса, который наблюдается при прогрессировании БА. Указанные результаты наводят на мысль, что амилоид-специфическая и IL-10-опосредованная ингибирующая цепочка обратной связи может быть активной у индивидуумов, не страдающих БА; разрыв данной цепочки может быть связан или служить прогностическим признаком развития БА. Недавно проведенное исследование убедительно показало, что IL-10/провоспалительная цепочка, которая сопряжена с клетками врожденной иммунной системы, регулирует склонность к аутоиммунным заболеваниям (48). Данные результаты расширены за счет того, что было показано наличие изменения данной цепочки у пациентов с БА.
Авторы идентифицировали полиморфные области; указанные полиморфы являются показателями дисфункции продукции цитокинов и, следовательно, связаны с предрасположенностью к аутоиммунному, нейродегенеративному или хроническому воспалительному заболеванию.
В настоящее время болезнь Альцгеймера диагностируют на основании общепризнанных критериев, таких как DMS IV или NINCDS-БАRDA (23), часто в сочетании с ядерно-магнитным резонансом (ЯМР) или компьютерной томографией (КТ) головного мозга для идентификации характерных амилоидных бляшек и нейрофибриллярных сплетений, вместе с атрофией области гиппокампа головного мозга.
Определенный подтверждающий диагноз болезни Альцгеймера возможен только по визуальной инспекции пораженных областей головного мозга во время вскрытия или по биопсии головного мозга (не рекомендованной из-за отсутствия эффективных лекарственных средств).
Происходит интенсивный поиск лекарственных средств и способ мониторинга при болезни Альцгеймера. По мере развития попыток предотвращения или замедления нейродегенерации и прогрессирования заболевания, раннее выявление болезни Альцгеймера и идентификация склонных к ней пациентов будет приобретать особую важность, поскольку это позволит принимать превентивные меры настолько рано, насколько это возможно. Таким образом, существует потребность в существовании прогностических и надежных тестов для определения предрасположенности к болезни Альцгеймера, без необходимости осуществления длительных и субъективных оценок познавательной способности.
Соответственно, настоящее изобретение относится к способу определения существования или предрасположенности к болезни Альцгеймера, аутоиммунному заболеванию или другим нейродегенеративным заболеваниям; способ включает в себя стадии отбора образца, содержащего ДНК, у животного и анализа образца для определения аллельных вариантов, присутствующих в одном или более локусов SNP в положениях -1082, -819 и -592 гена, кодирующего IL-10, или, по-другому, анализа образца на наличие или отсутствие аллелей, представленных на фигуре 2.
Предпочтительно, определяют генотип по всем трем положениям -1082, -819 и -592.
В то время как идентификация аллелей, представленных на фигуре 2, как было установлено, является пригодной или прогностической для идентификации болезни Альцгеймера, комбинация аллелей IL-10 и IL-6, как было установлено, является более надежным прогностическим признаком предрасположенности к болезни Альцгеймера или диагностическим критерием наличия болезни Альцгеймера.
Аполипопротеин Е (Аро-Е) связывают со спорадической или ненаследственной БА. Следовательно, в одном аспекте настоящего изобретения, способ диагностики болезни Альцгеймера включает в себя стадии получения образца, содержащего ДНК, от животного и идентификации наличия полиморфного аллеля IL-10, IL-6 и Аро-Е.
Предпочтительно, полиморфный аллель представляет собой один из аллелей, представленных на фигуре 2.
Кроме того, образец можно исследовать на наличие/отсутствие полиморфизмов или других аллельных вариаций других цитокинов, помимо IL-10 и IL-6, например, IL-10 и IL-6 плюс IL-4 и/или IL-1.
Альтернативно, образец можно исследовать на наличие/отсутствие полиморфизмов или других аллельных вариаций IL-10 плюс Аро-Е или IL-6 плюс Аро-Е.
Полиморфизм интерлейкина 1 альфа (IL-1 альфа) связывают с болезнью Альцгеймера. Следовательно, в еще одном аспекте настоящего изобретения, способ диагностики болезни Альцгеймера включает в себя стадии получения образца, содержащего ДНК, от животного и идентификации наличия полиморфного аллеля IL-10, IL-6, Аро-Е и IL-1.
Обычно оптимальную прогностическую величину будут получать путем объединения как можно большего количества прогностических факторов в тесте. Способы, описанные в настоящем документе, вместе с маркерами, такими как Аро-Е и IL-1, делают возможной разработку эффективного диагностического способа, который будет включать в себя все биологические маркеры, которые, как было установлено, имеют прогностическую ценность в отношении развития БА.
Настоящее изобретение относится также к способу лечения болезни Альцгеймера, аутоиммунных заболеваний или других нейродегенеративных расстройств путем модулирования, т.е. усиления или снижения, функции гена, имеющего один из аллельных полиморфизмов IL-10, представленных в таблице I, или, по-другому, гена, имеющего аллельные полиморфизмы, представленные на фигуре 2.
Например, продукцию IL-6 предпочтительно понижать, но продукцию IL-10 предпочтительно повышать. Более предпочтительно, продукцию IL-6 понижают одновременно с повышением продукции IL-10.
Альтернативно, фармацевтические композиции, которые ингибируют нужные цитокины или снабжают нужными цитокинами, можно вводить пациенту, который нуждается в лечении. Например, вместо понижения продукции IL-6 на генетическом уровне пациента можно снабжать соединениями, которые ингибируют или блокируют действие IL-6. Указанное ингибирование или блокирование может происходить на стадии синтеза, в месте действия или на какой-либо стадии метаболического пути. Подобно этому, IL-10 можно поставлять непосредственно, в качестве промежуточного соединения, в качестве предшественника или пре-предшественника, путем стимуляции синтеза IL-10 ab initio или путем введения фармакологических композиций, которые усиливают или ингибируют антиген-специфическую продукцию интерлейкина-10 и, необязательно, одного или более других цитокинов.
Другой цитокин предпочтительно выбирают из группы, состоящей из интерлейкина-1 (α или β), интерлейкина-2, интерлейкина-3, интерлейкина-4, интерлейкина-5, интерлейкина-6, интерлейкина-7, интерлейкина-8, интерлейкина-9, интерлейкина-11, интерлейкина-12, интерлейкина-13, интерлейкина-14, интерлейкина-15, интерлейкина-16, интерлейкина-17, интерферона-α, интерферона-β, интерферона-γ, TNF-α, TNF-β, G-CSF, GM-CSF, M-LSF и TGF-β.
Фармакологические агенты, которые могут модулировать продукцию цитокинов, известны специалистам, например, белок теплового шока (HSP) и/или иммуномодулирующие олигонуклеотиды, содержащие мотив CpG. Вакцинация ДНК-конструктами, кодирующими 60 кДа белок теплового шока человека hsp60 (phsp60), приводит к повышению продукции IL-10 (71). Было показано, что CpG-ДНК может индуцировать синтез супрессора цитокин-сигнальных (SOC) белков. CpG-ДНК-индуцированные SOC-белки ингибируют продукцию IL-6 (72). Кроме того, CpG-ДНК через путь, опосредованный внеклеточной сигнал-регулируемой киназой (ERK), как было показано, запускает продукцию IL-10 (73). Олигонуклеотиды CpG могут быть структурно модифицированы для получения воздействия на нужный профиль типов клеток и стимулирования нужного профиля цитокинов; для достижения направленности по пути клеток Т-хелперов Th1 (опосредованная клетками продукция интерферона гамма) или Th2 (антитело, продукция IL-10 и IL-4) (74). Примерами указанных различных модуляций являются ориентированное на Th1 соединение 7909 производства Coley Pharmaceuticals и ориентированные на Th2 соединения производства Dynavax (75). Помимо этого, CpG-подобные иммуномодулирующие олигонуклеотиды, в которых мотив CpG заменен на мотивы YpG или CpR, но у которых предполагается модификация их иммуномодулирующего потенциала через химическую структуру, также можно использовать в качестве фармакологических агентов для влияния на желательный профиль продукции цитокинов (76).
В еще одном аспекте настоящее изобретение относится к способу лечения болезни Альцгеймера у животного, которое нуждается в лечении; указанный способ включает в себя уменьшение синтеза IL-6 одновременно с усилением синтеза IL-10.
Настоящее изобретение относится также к применению ингибиторов IL-6 и промоторов IL-10 для производства лекарственного средства для лечения или профилактики болезни Альцгеймера.
В еще одном аспекте настоящее изобретение относится к фрагментам ДНК и фрагментам кДНК, кодирующим аллельный полиморфизм, представленный в таблице I, или, по-другому, аллельные полиморфизмы, представленные на фигуре 2, для применения в описанном выше способе.
Указанные фрагменты ДНК являются пригодными для скрининга и идентификации соединений, которые связываются, регулируют или каким-либо другим образом оказывают модулирующее действие на указанные аллели и, следовательно, стимулируют или ингибируют синтез генного продукта.
Соответственно, настоящее изобретение относится также к способу скрининга соединений, которые модулируют хемокины, участвующие в болезни Альцгеймера; указанный способ включает в себя введение соединения, подлежащего скринингу, в ДНК или фрагмент ДНК, кодирующий аллельные полиморфизмы, представленные в таблице I, или, по-другому, аллельные полиморфизмы, представленные на фигуре 2. И оценку гибридизации между соединением и фрагментом.
Следовательно, настоящее изобретение относится также к соединениям, которые модулируют болезнь Альцгеймера, идентифицированным указанным способом.
Предпочтительно, животное представляет собой млекопитающее, и более предпочтительно - человека.
Данные, представленные в настоящем документе, доказывают роль воспалительных процессов в патогенезе БА; они подтверждают гипотезу о том, что нейродегенерация у пациентов с БА тесно связана с аберрантным антиген-специфическим иммунным ответом; они также служат дополнительным основанием для применения противовоспалительных соединений для лечения указанного заболевания.
Соответственно, в еще одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей цитокин, для изготовления лекарственного средства для лечения или профилактики заболевания, исключая неопластические заболевания, лейкозы и острое воспаление. Предпочтительно, заболевание представляет собой нейродегенеративное расстройство или аутоиммунное заболевание. Наиболее предпочтительно, если заболевание выбрано из группы, включающей в себя рассеянный склероз, тяжелую псевдопаралитическую миастению, системную красную волчанку, сахарный диабет, астму, болезнь Паркинсона, заболевание двигательных нейронов, болезнь Альцгеймера, хроническое воспаление, ревматоидный артрит, ВИЧ-инфекцию и СПИД.
Цитокины предпочтительно выбраны из группы, состоящей из интерлейкина-1 (α или β), интерлейкина-2, интерлейкина-3, интерлейкина-4, интерлейкина-5, интерлейкина-6, интерлейкина-7, интерлейкина-8, интерлейкина-9, интерлейкина-10, интерлейкина-11, интерлейкина-12, интерлейкина-13, интерлейкина-14, интерлейкина-15, интерлейкина-16, интерлейкина-17, интерферона-α, интерферона-β, интерферона-γ, TNF-α, TNF-β, G-CSF, GM-CSF, M-LSF и TGF-β или их комбинаций или смесей. Предпочтительно используют два или более цитокинов.
Наиболее предпочтительно, когда каждый цитокин представляет собой интерлейкин, особенно IL-10 или IL-6.
Варианты осуществления настоящего изобретения далее описаны только в качестве примера, со ссылкой на прилагаемые рисунки, где
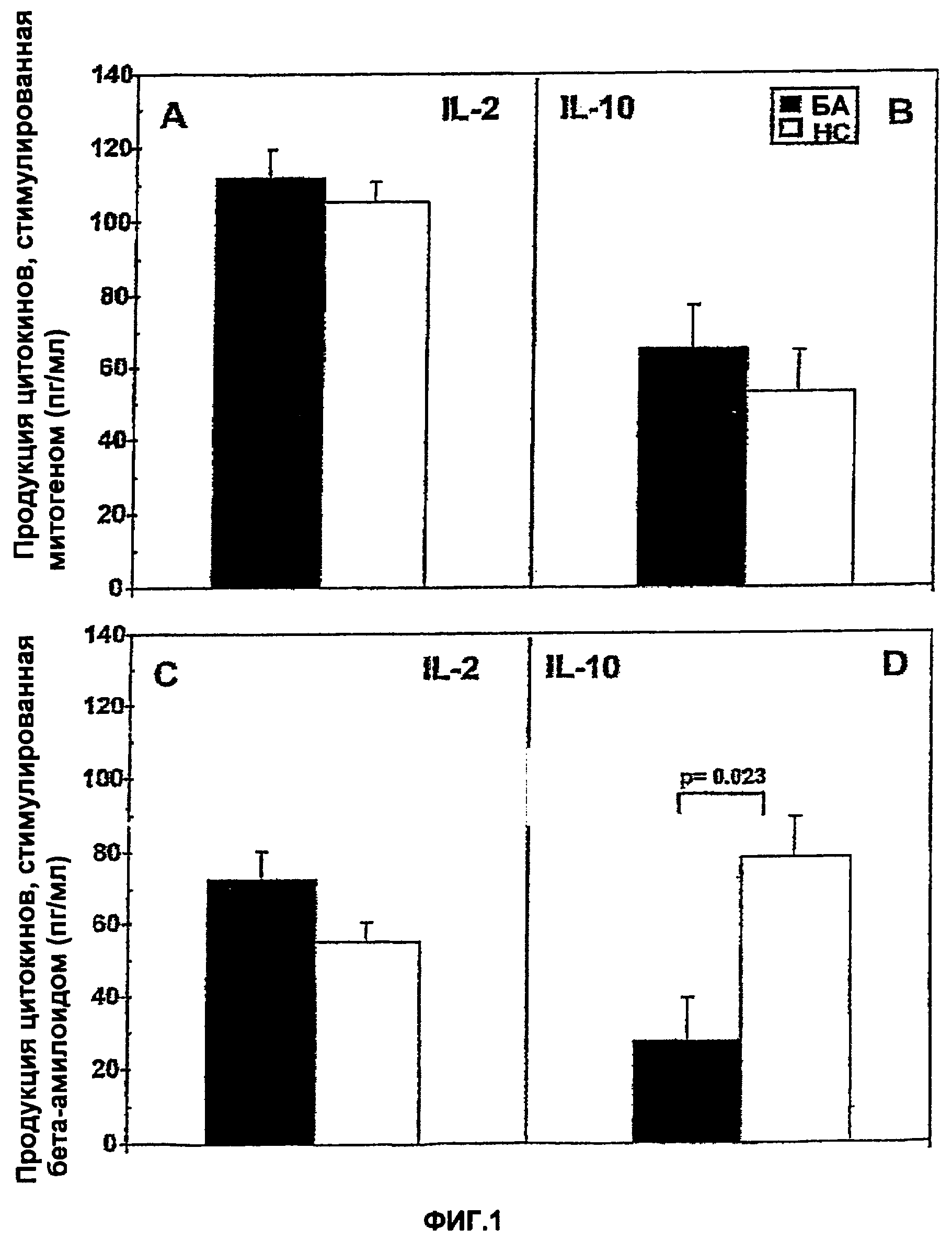
Фигуры 1A-1D представляют собой диаграмму, на которой показана продукция в РВМС IL-2 (панели А и С) и IL-10 (панели В и D), стимулированная LPS и β-амилоидом (пул из 3β-амилоидных пептидов: βА: фрагмент 25-35; βВ: фрагмент 1-40 и βС: фрагмент 1-16), у 47 пациентов с БА (О) и у 25-летних, подобранных по полу, здоровых контролей (О). Представлены средние величины ± стандартные ошибки. р≤0,023;
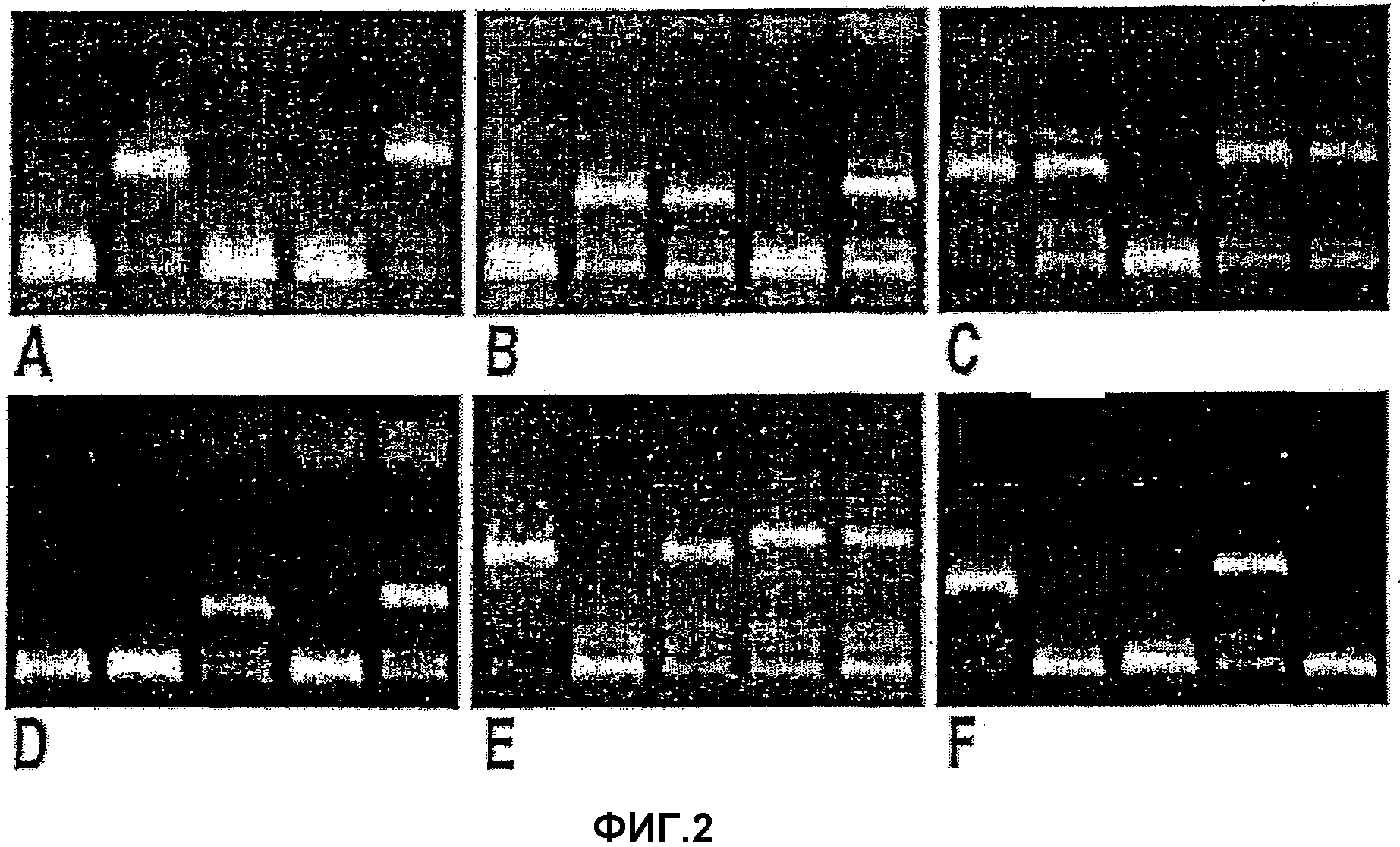
На фигуре 2 показан характерный пример генотипирования IL-10 для шести различных образцов. В каждом геле самые тяжелые полосы соответствуют ампликонам человеческого гена β-глобина, которые использовались в качестве внутренних контролей. Другие специфичные амплифицированные фрагменты ДНК соответствуют полиморфизмам гена IL-10: GCC/GCC (A), GCC/ACC (B), GCC/ATA (C), ACC/ACC (D), ACC/ATA (E), ATA/ATA (F), и
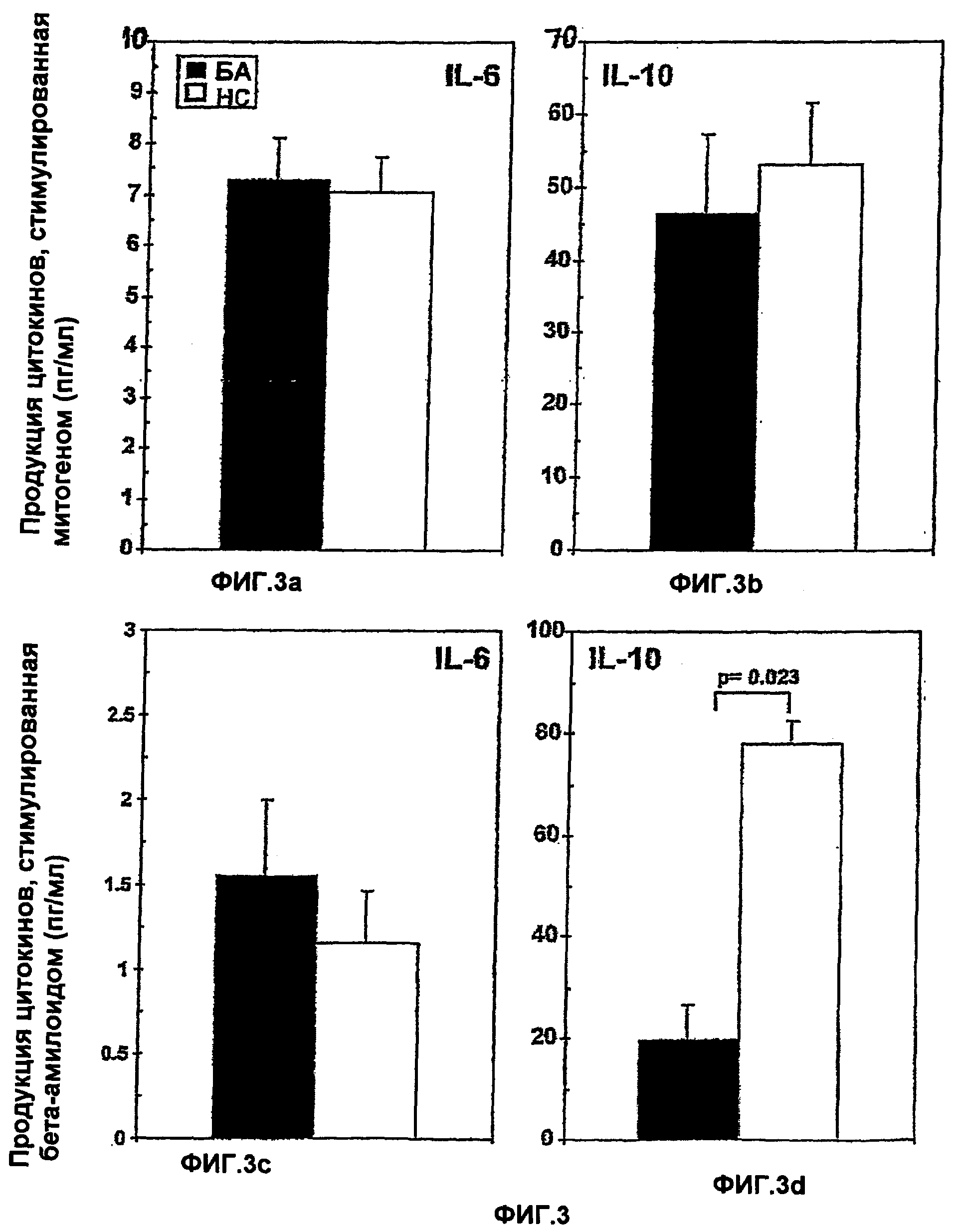
Фигуры 3A-3D представляют собой диаграмму, на которой показана продукция в РВМС IL-6 (панели А и С) и IL-10 (панели В и D), стимулированная LPS и β-амилоидом (пул из 3β-амилоидных пептидов: βА: фрагмент 25-35; βВ: фрагмент 1-40 и βС: фрагмент 1-16), у 47 пациентов с БА (О) и у 25-летних подобранных по полу здоровых контролей (О). Представлены средние величины ± стандартные ошибки. р≤0,023.
Пример 1
Пациенты и контроли
Сорок семь пациентов с БА и 25 субъектов, не страдающих деменцией (НС), были включены в исследование болезни Альцгеймера. Указанных пациентов выбирали из более обширной популяционной выборки под наблюдением гериатрического отделения клиники Ospedale Maggiore IRCCS миланского университета, Италия. Критерии DMS IV и NINCDS-БАRDA (23) были приняты для постановки клинического диагноза БА. Познавательные способности и их изменения оценивали в соответствии со шкалой оценки психического статуса Mini-Mental State Evaluation (MMSE). Пациенты с БА и НС жили у себя дома и подвергались тщательному медицинскому осмотру в день взятия анализа крови, и их клинические показатели анализировались. С целью сведения к минимуму риска клинических или субклинических воспалительных процессов всех пациентов отбирали следующим образом: в исследование включали только БА и НС без клинических признаков воспаления (например, с нормальной температурой тела или отсутствием сопутствующих воспалительных заболеваний). Оценивали также биохимические показатели крови, и исключали субъектов с патологической скоростью оседания эритроцитов или с измененным профилем альбумина в крови и трансферрина в плазме крови. Дальнейший отбор пациентов с БА осуществляли в соответствии с уровнями С-реактивного белка (CRP) в плазме крови, и в исследование не включали тех пациентов, у которых CRP превышал 5 мг/л (средняя величина ± 2 стандартных отклонения от контрольных величин).
От контролей и родственника каждого пациента с БА получали согласие на участие в исследовании на основе предоставленной полной информации.
Отбор образцов крови
Цельную кровь брали из вены в пробирки Вакутайнера, содержащие EDTA (Becton Dickinson Co., Rutherford, NJ). Мононуклеарные клетки периферической крови (РВМС) отделяли путем центрифугирования в среде для отделения лимфоцитов (Organon Teknika Corp., Durham, NC) и дважды промывали в PBS. Количество жизнеспособных лимфоцитов определяли с помощью трипанового синего и гемоцитометра.
Продукция цитокинов in vitro
РВМС ресуспендировали в RPMI 1640 в количестве 3×106 на мл и стимулировали их или не стимулировали LPS (Sigma, St. Louis, MI)(10 г/мл), пулом из трех различных β-амилоидных пептидов следующим образом: b-A: фрагмент 25-35 (25 мг/мл); b-В: фрагмент 1-40 (150 нг/мл); b-С: фрагмент 1-16 (150 нг/мл) (Sigma, St. Louis, MI); или вакциной против вируса гриппа (А/Тайвань + А/Шанхай + В/Виктория) (24 г/л; конечное разведение 1:1000) (Flu)(контрольный антиген) при 37°С, во влажной атмосфере с содержанием СО2 7%. Надосадочную жидкость собирали спустя 48 часов в случае стимуляции LPS и спустя 5 дней в случае культивирования с b-амилоидными белковыми пептидами и Flu. Продукцию IL-2 и IL-10 в РВМС оценивали с помощью коммерчески доступных наборов ELISA (ACCUCYTE, Cytimmune Sciences, Inc., College Park, MD). Все тест-наборы использовали согласно процедурам, предложенным производителем.
Генотипирование IL-10
Геномную ДНК экстрагировали из периферической крови, обработанной EDTA (10 мл), с использованием способа стандартной протеиназы К и фенола/хлороформа. Концентрацию и чистоту ДНК определяли спектрофотометрически. Для оценки генотипов IL-10 использовали методику полимеразной цепной реакции - праймеров со специфической последовательностью (PCR-SSP). Амплификацию последовательности в промоторной области гена IL-10 (полиморфные положенич -1082, -812, -592) осуществляли с использованием способа генотипирования цитокинов Cytokine genotyping Tray Method (One Lambda, Canoga Park, CA, USA); ген человеческого β-глобина амплифицировали в качестве внутреннего контроля препарата геномной ДНК. Условия PCR были указаны программой One Lambda PCR (OLI-1); продукты PCR затем визуализировали путем электрофореза в 2,5% агарозном геле.
Статистический анализ
Статистический анализ осуществляли с использованием статистического пакета программ SPSS (SPSS, Chicago, IL). Различия в продукции IL-10 выводили из аналитических процедур, основанных на непараметрическом анализе (Mann-Whitney); сравнения между различными группами пациентов проводили с использованием точного 2-стороннего критерия Фишера. Частоту генотипов сравнивали между экспериментальными группами с помощью с2-критерия с наблюдаемым уровнем значимости теста ниже 0,05. Сравнения между средними величинами возраста начала и MMSE в шести различных группах БА осуществляли с помощью однофакторного дисперсионного анализа ANOVA.
Возраст, пол и суммы баллов MMSE у пациентов с БА и у НС
В исследовании участвовали сорок семь пациентов с БА и 25 парных по возрасту здоровых контролей. Оценка по шкале психического статуса Mini-Mental State Evaluation (MMSE) позволила выявить наличие у пациентов с БА расстройства познавательной способности от легкого до тяжелого. Указанные данные представлены в таблице I.
Стимулированная МВР продукция IL-10 снижена у пациентов с БА
РВМС 47 пациентов с БА и 25 парных по возрасту и полу НС стимулировали митогеном (LPS); пулом из 3 амилоидных пептидов: (A: фрагмент 25-35, В: фрагмент 1-40 и С: фрагмент 1-16) (амилоид) или Flu (использовали в качестве контрольного антигена), и измеряли продукцию IL-2 и IL-10 способами ELISA. Не наблюдалось различий, когда стимулированную LPS или Flu продукцию IL-2 и IL-10 сравнивали у пациентов с БА и НС. Стимулированная амилоидом продукция IL-2 также была сходной в двух группах изучавшихся индивидуумов. В противоположность указанным результатам, стимулированная амилоидом продукция IL-10 была достоверно снижена (р=0,023) у пациентов с БА по сравнению с контролями. Указанные данные представлены на фигуре 1.
Распределение генотипов высокой, промежуточной и низкой продукции IL-10 асимметрично у пациентов с БА
Образцовый пример шести различных генотипов IL-10 по оценке PCR-SSP показан на фиг. 2, а их относительное распределение в выборке типичных представителей кавказоидов показано в таблице II. В противоположность распределению, наблюдающемуся у НС, частота различных генотипов IL-10 у пациентов с БА была достоверно асимметричной (с2=16,007 при р=0,007) (таблица II). Таким образом, генотипы, соответствующие сниженной продукции IL-10 (генотипы АСС/АСС, АСС/АТА и АТА/АТА), имели значимо более высокое распространение среди субъектов с БА (17%, 26% и 11%, соответственно, против 4%, 16% и 4% у НС). Более того, соотношение GCC/ACC и GCC/ATA (промежуточный фенотип) составляло 1:1 у пациентов с БА, в то время как у НС оно составляло 3:1.
Низкая продукция IL-10 коррелирует с ухудшением клинического исхода БА
Для анализа возможных клинических корреляций при наличии генотипа низкой продукции IL-10 авторы изучали шесть генотипов в связи с возрастом начала БА (таблица III) и прогрессирования расстройства познавательной способности (таблица IV). Результаты подтвердили, что наличие генотипов, соответствующих низкой продукции IL-10, действительно связано с ухудшением клинического исхода БА. Так, наличие генотипов АТА/АТА и GCC/ATA было связано с более ранним возрастом начала заболевания (ANOVA: p=0,042) (таблица III); кроме того, была выявлена обратная связь между АСС/АТА и АСС/АСС, генотипами с низкой продукцией IL-10, и суммой баллов MMSE (ANOVA: p=0,010) (таблица IV).
|
|
|
|
|
|
|
|
Пример 2
Пациенты и контроли
Шестьдесят пять пациентов с БА (44Ж/21М, средний возраст 80±2) и 65 подобранных по полу и возрасту здоровых контролей, не страдающих деменцией (НС), были включены в исследование. Пациентов выбирали из более обширной популяционной выборки под наблюдением гериатрического отделения клиники Ospedale Maggiore IRCCS миланского университета, Италия. Критерии DMS IV и NINCDS-БАRDA (23) были приняты для постановки клинического диагноза БА; у каждого субъекта имелось недавнее исследование с помощью ядерно-магнитного резонанса (ЯМР)/компьютерной томографии (КТ). Познавательные способности и их изменения оценивали в соответствии со шкалой оценки психического статуса Mini-Mental State Evaluation (MMSE). Пациенты с БА и НС жили у себя дома и подвергались тщательному медицинскому осмотру в день взятия анализа крови, и их клинические показатели анализировались.
С целью сведения к минимуму риска клинических или субклинических воспалительных процессов всех пациентов отбирали следующим образом: в исследование включали только БА и НС без клинических признаков воспаления (например, нормальная температура тела, отсутствие сопутствующего воспалительного состояния). Оценивали также биохимические показатели крови, и исключали субъектов с патологической скоростью оседания эритроцитов или с измененным профилем альбумина в крови и трансферрина в плазме крови. Дальнейший отбор пациентов с БА осуществляли в соответствии с уровнями С-реактивного белка (CRP) в плазме крови, и в исследование не включали тех пациентов, у которых CRP превышал 5 мг/л (средняя величина ± 2 стандартных отклонения контрольных величин).
У всех субъектов или их родственников получали согласие на участие в исследовании на основе предоставленной полной информации. Протокол исследования был одобрен комитетом по этике университетской клиники.
Отбор образцов крови
Цельную кровь брали из вены в пробирки Вакутайнера, содержащие EDTA (Becton Dickinson Co., Rutherford, NJ). Мононуклеарные клетки периферической крови (РВМС) отделяли путнм центрифугирования в среде для отделения лимфоцитов (Organon Teknika Corp., Durham, NC) и дважды промывали в PBS. Количество жизнеспособных лимфоцитов определяли с помощью трипанового синего и гемоцитометра.
Генотипирование
Геномную ДНК экстрагировали с использованием способа стандартной протеиназы К и фенола/хлороформа. Концентрацию и чистоту ДНК определяли спектрофотометрически. Для оценки генотипов IL-10 и IL-6 использовали методику полимеразной цепной реакции - праймеров со специфичной последовательностью (PCR-SSP). Последовательность в промоторной области генов IL-10 (полиморфные положения -1082, -812, -592) и IL-6 (полиморфное положение -174) амплифицировали с использованием способа генотипирования цитокинов (One Lambda, Canoga Park, CA, USA); ген человеческого β-глобина амплифицировали в качестве внутреннего контроля препарата геномной ДНК. Условия PCR были указаны программой One Lambda PCR (OLI-1); продукты PCR затем визуализировали путем электрофореза в 2,5% агарозном геле.
Генотипы АроЕ определяли PCR-амплификацией фрагмента экзона 4 гена АроЕ длиной 234 пары нуклеотидов, с последующим ферментативным расщеплением Cfo1. Образцы рестрикции получали путем гель-электрофореза.
Продукция цитокинов in vitro
РВМС ресуспендировали в RPMI 1640 в количестве 3×106 на мл и стимулировали их или не стимулировали LPS (Sigma, St. Louis, MI)(10 мкг/мл), пулом из трех различных β-амилоидных пептидов следующим образом: β-A, фрагмент 25-35 (25 г/мл); β-В, фрагмент 1-40 (150 нг/мл); β-С, фрагмент 1-16 (150 нг/мл) (Sigma, St. Louis, MI); или вакциной против вируса гриппа (А/Тайвань + А/Шанхай + В/Виктория) (24 мкг/л; конечное разведение 1:1000) (Flu)(контрольный антиген) при 37°С, во влажной атмосфере с содержанием СО2 7%. Надосадочную жидкость собирали спустя 48 часов в случае стимуляции LPS и спустя 5 дней в случае культивирования с β-амилоидными белковыми пептидами. Продукцию IL-10 и IL-6 в РВМС оценивали с помощью коммерчески доступных наборов ELISA (ACCUCYTE, Cytimmune Sciences, Inc., College Park, MD). Все тест-наборы использовали согласно указаниям производителя.
Статистический анализ
Статистический анализ осуществляли с использованием статистического пакета программ SPSS (SPSS, Chicago, IL). Частоту генотипов сравнивали между экспериментальными группами с помощью χ2-критерия с уровнем значимости ниже 0,05. Рассчитывали также odds ratio (OR) и 95% доверительные интервалы (CI). Приведенные OR оценивали логистической регрессией, для контроля статуса носителя АроЕ 4. Однородность OR между слоями оценивали включением в модель подходящим условий взаимодействия. Различия в продукции IL-10 и IL-6 выводили из аналитических процедур, основанных на непараметрическом анализе (Mann-Whitney); сравнения между различными группами пациентов проводили с использованием точного двустороннего критерия Фишера.
Распределение генотипов высокой, промежуточной и низкой продукции IL-10 асимметрично у пациентов с БА
Генотип и частоты аллелей биаллельного полиморфизма в положении -1082 представлены в таблице 5. Указанный SNP изменяет активацию транскрипции, в зависимости от дозы гена; таким образом, генотип GG коррелирует в высокой, GA - с промежуточной и АА - с низкой продукцией IL-10 после стимуляции Т-клеток in vitro (57). У пациентов с БА наблюдалась достоверно более высокая частота аллеля, соответствующего низкой продукции -1082, которая создает сдвиг в распределении генотипов при БА по сравнению с НС, со значительным уменьшением генотипа с высокой продукцией -1082GG (таблица V).
|
а Соответствующие фенотипы: высокий (Н), промежуточный (М), низкий (L) показаны в скобках
Генотип: χ2 = 7,946, df = 2, p = 0,019
Аллель: χ2 = 6,817, df = 1, p = 0,009
Некоторые из SNP связаны с двумя другими SNP в положениях -819 и -592. Они объединяются с микросателлитными аллелями с образованием гаплотипов, в которых различия в продукции IL-10, происходя главным образом за счет -1082 SNP (38, 42). Частоты генотипов и аллелей -819 C→T и -592 C→A SNP распределялись сходным образом в выборках БА и НС (данные не представлены).
Аллель -174С в гене IL-6 представлен у пациентов с БА с избыточном количестве
Распределение генотипов и аллелей IL-6 среди НС и БА показано в таблице 6. Данный функциональный полиморфизм также, как представляется, связан с концентрацией IL-6 в плазме; однако не ясно, каким образом данный SNP влияет на уровни IL-6 в плазме (54). Результаты распределения генотипов в выборках БА и НС свидетельствуют о более низкой частоте генотипа GG среди пациентов с БА. Подобно этому, распределение аллелей достоверно отличалось в двух группах; аллель С был достоверно выше при БА (таблица VI).
|
а Высокий (Н) и низкий (L) фенотипы показаны в скобках
Генотип: χ2 = 5,894, df = 2, p = 0,052
Аллель: χ2 = 4,300, df = 1, p = 0,038
Комбинация аллелей IL-10 и IL-6 и относительный риск развития БА
Авторы изучали то, влияет ли любая комбинация аллелей IL-10 GA и IL-6 GC на риск БА. Одновременное наличие аллелей IL-10 А и IL-6 С достоверно повышала данный риск, независимо от статуса АроЕ4 (таблица VII). Генотип IL-10 А/А в отдельности или IL-6 С/С в отдельности соответствовали более незначительному повышению риска заболевания (OR 5,8, CI 1,7-20, p=0,005; OR 3,0, CI 0,9-10,6, p=0,087).
|
7*p>0,05;
OR: odds ratio как они есть; приведенные OR: приведенные odds ratio для аполипопротеина Е ε4;
CI: доверительный интервал
Продукция IL-10 и IL-6, стимулированная LPS, Flu и амилоидным пептидом, снижена у пациентов с БА
РВМС 47 пациентов с БА и 25 подобранных по возрасту и полу НС стимулировали митогеном (LPS), пулом из трех β-амилоидных пептидов (βA, фрагмент 25-35; βВ, фрагмент 1-40; βС, фрагмент 1-16) или Flu, и измеряли продукцию IL-10 и IL-6 с помощью методов ELISA. Не наблюдалось разницы между продукцией IL-6 и IL-10, стимулированной LPS или Flu, у БА и НС. Напротив, когда анализировали продукцию IL-6 и IL-10, стимулированную β-амилоидом, наблюдалось маргинальное повышение продукции IL-6 и достоверное уменьшение генерации IL-10 (р=0,023) у пациентов с БА по сравнению с НС, что наводит на мысль об антиген-специфическом нарушении продукции указанных цитокинов. Указанные данные представлены на фигуре 3.
Причинная роль хронического воспаления в патогенезе БА все еще остается преимущественно спекулятивной (24, 25). Тем не менее, предполагают существование «цитокинового цикла», в котором (19) противовоспалительные цитокины (IL-4, IL-10 и IL-13) регулируют микроглиальные/макрофагальные воспалительные ответы, индуцированные β-амилоидом, и модифицируют активность микроглии, окружающей амилоидные нейритные бляшки (52).
Указанные цитокины могут ингибировать индукцию IL-1, TNF-α и МСР-1 в дифференцированных человеческих моноцитах и, кроме всего прочего, IL-10 вызывает дозозависимое ингибирование секреции IL-6, индуцированной β-амилоидом в данных клетках и в микроглии мышей (19).
С клинической точки зрения, IL-10 участвует в аутоиммунных заболеваниях (41, 42, 26) и в злокачественных опухолях (31, 27, 43), при которых повышенные уровни цитокина зависят от генетического фона (59), но также влияют на исход инфекций (34, 40, 37).
Более последовательными являются данные о роли IL-6 в патогенезе БА. Повышенная IL-6 иммунореактивность наблюдалась вблизи амилоидных бляшек в головном мозге указанных пациентов (67); IL-6 индуцирует синтез белка-предшественника β-амилоида (69), а у трансгенных мышей повышенные уровни IL-6 в ЦНС приводят к нейропатогенным эффектам и дефициту познавательной способности (51).
С-аллель VNTR в гене IL-6, как сообщается, уменьшает активность цитокинов (61). С-аллель VNTR IL-6 коррелирует с отсроченным началом и уменьшенным риском БА в популяции, проживающей в Германии (63). Функциональный полиморфизм -178 промоторной области также может быть вовлечен в развитие фенотипа БА, в силу своей связи с концентрациями цитокина в плазме крови (54). Однако в двух клинических испытаниях на людях различной этнической принадлежности результаты были спорными (49).
В выборке авторов данные анализа SNP показали, что НС имеют распределение аллелей IL-10 и IL-6, сходное с указанным распределением в итальянской популяции (65). Более важно, что настоящие результаты указывают на достоверно более высокий процент носителей IL-10 -1082А среди людей, страдающих БА. Недавнее сообщение о людях в возрасте ста лет и старше в Италии, которые были четко менее склонными, чем более молодые лица, к возрастным заболеваниям, показало, что чрезвычайное долголетие достоверно связано с генотипами высокой продукции IL-10 (58).
Как ранее сообщали авторы, результаты по IL-6 SNP являются более противоречивыми. G-аллель IL-6 представляется значимым при БА у японцев (66), а также у людей родом из южной Италии (64), в то время как в выборке, полученной авторами изобретения, представлен в избыточном количестве, как оказалось, аллель С.
Для того чтобы связать между собой указанные различные результаты, следует рассмотреть несколько вопросов.
Национальность может сильно влиять на роль генетических факторов риска, как и распределение генных вариантов в популяциях различных Европейских стран или даже между различными областями одной и той же страны (53, 55, 60, 62, 70). Кроме того, связь между БА и IL-6 SNP может быть ограничена определенными возрастами, и в выборках, полученных авторами изобретения, субъекты с БА и НС были очень старыми людьми.
И, наконец, следует учитывать роль, которую играет ген или несколько генов в дисбалансе связи по данной мутации: выраженный дисбаланс между -174 SNP и VNTR полиморфизмом 3'-фланкирующей области гена IL-6 описан у немцев (49).
Главным открытием данного исследования была идентификация группы субъектов с высоким риском БА с поздним началом за счет одновременного наличия аллелей IL-10 -1082А и IL-6 -174С. Авторы также изучили взаимодействия между генами Аро Е и IL-10 или IL-6, но не нашли никаких доказательств синергических эффектов, что наводит на мысль, что указанные связанные с воспалением аллели являются дополнительным и независимым фактором риска БА.
Для того, чтобы пролить дополнительный свет на генетические результаты, авторы также проанализировали продукцию IL-10 и IL-6 мононуклеарными клетками периферической крови (РВМС), стимулированную β-амилоидным пептидом, LPS и Flu, у ряда пациентов с БА и подобранных по возрасту НС. Результаты показали, что 1) продукция IL-6 в РВМС у пациентов с БА и контролей значимо не отличалась ни при каких условиях и 2) продукция IL-10 в РВМС, стимулированная LPS и Flu, была сравнимой в двух группах, в то время как при БА отмечалось специфическое для β-амилоида иммунное нарушение, характеризующееся сниженной генерацией IL-10. Тот факт, что данный дисбаланс цитокинов не наблюдался в стимулированных митогеном РВМС, указывает на то, что специфические в отношении β-амилоида иммунные ответы при БА нарушены избирательно. Кроме того, факт, что стимулированная flu пролиферация была сходной у пациентов и в контроле, указывает на то, что процессинг и презентация антигенов в ассоциации с молекулами HLA класса II, а также ауторестриктивный путь активации иммунной системы CD4-HLA класса II (44) не являются дефектными при БА. Таким образом, можно предположить биологический сценарий, при котором снижение амилоид-специфической продукции IL-10 способствует запуску хронического воспалительного процесса, который наблюдается в головном мозге при БА. Амилоид-специфическая и IL-10-опосредованная ингибирующая цепочка обратной связи может быть активной у индивидуумов, не страдающих БА, а разрыв данной цепочки может быть связан или может служить прогностическим признаком развития БА. Недавно проведенное исследование убедительно показало, что IL-10/провоспалительная цепочка, которая вращается вокруг клеток врожденной иммунной системы, регулирует предрасположенность к аутоиммунным заболеваниям (48). Результаты авторов расширяют данную концепцию, показывая, что данная цепочка у пациентов с БА изменена. Данные в целом поддерживают теорию о том, что общий риск развития БА может управляться «профилем предрасположенности», который отражает комбинированное влияние наследственных множественных аллелей высокого риска и проливает свет на центральную роль IL-10 и IL-6 SNP в данном профиле.
Воспаление участвует в патогенезе болезни Альцгеймера (БА), противовоспалительный цитокин интерлейкин-10 (IL-10) может противодействовать активности IL-6 в головном мозге. Поскольку промотор данных генов является полиморфным, 65 пациентов с БА и 65 здоровых контролей (НС) изучали на предмет аллелей IL-10 -1082 GA и IL-6 -174 GC. В нескольких случаях у них оценивали также продукцию IL-10 и IL-6 в РВМС. Для IL-10 наблюдался значимо более высокий уровень генотипа -1082GG (p=0,019) при БА, чем у НС, в то время как для IL-6 генотип G/G был ниже, а аллель С - выше (p<0,005). Сосуществование аллелей IL-10 и IL-6 значимо повышало риск БА (odds ratio: OR 11,2; доверительный интервал: CI 1,3-97,3; p<0,05), независимо от АроЕ4 (приведенный OR 10,3, CI 1-108; p<0,05). Только продукция IL-10, стимулированная амилоидом, различалась у БА и НС (р=0,023). Данные результаты вступают в противоречие с воспалительной теорией БА, указывая на центральную роль полиморфизмов IL-10 и IL-6 и избирательное чередование в данной сети.
Пример 3
Анализы генотипов интерферона-γ и TNF-α
Способы, описанные в предыдущих примерах, использовали для проведения анализа генотипов интерферона-γ и TNF-α у пациентов с болезнью Альцгеймера и у здоровых контролей. Суммарные данные представлены в таблицах VIII и IX.
|
|
Частоты различных генотипов среди пациентов с болезнью Альцгеймера (БА) не отличались достоверно от генотипов среди здоровых контролей (НС).
χ2 = 0,305, df=2, p=0,859.
В скобках (с) указан соответствующий фенотип: высокий (Н), промежуточный (М) и низкий (L).
Аллель:
χ2 = 0,174, df=1, p=0,676.
|
Частоты различных генотипов среди пациентов с болезнью Альцгеймера (БА) не отличались достоверно от генотипов среди здоровых контролей (НС).
а Высокий (Н) и низкий (L) фенотипы в скобках
Генотип: χ2 = 2,568, df=2, p=0,277
Аллель: χ2 = 1,792, df=1, p=0,181
Не наблюдалось статистически значимой разницы, когда сравнивали пациентов с болезнью Альцгеймера и контроли, что указывает на то, что ни интерферон-γ, ни TNF-α не связаны с вероятностью развития болезни Альцгеймера.
Напротив, настоящее изобретение показывает, что IL-10 и IL-6 являются в высокой степени прогностическими для развития болезни Альцгеймера и, возможно, также предсказывают прогрессирование заболевания. Наилучшая прогностическая ценность будет достигаться объединением тестов на генотип для множественных генных полиморфизмов, например, IL-10, IL-6, Аро-Е и другие, которые, как было показано, связаны с болезнью Альцгеймера.