Результат интеллектуальной деятельности: IL-1бета-СВЯЗЫВАЮЩИЕ АНТИТЕЛА И ИХ ФРАГМЕНТЫ
Вид РИД
Изобретение
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет предварительной заявки США с регистрационным номером 60/692830, поданной 21 июня 2005 года, описание которой включено в описание посредством ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к IL-1β-связывающим антителам, включая их фрагменты, и нуклеиновым кислотам, кодирующим такие антитела, а также к векторам, клеткам и композициям, содержащим антитела или нуклеиновые кислоты, и к их применениям.
Уровень техники
Полагают, что цитокиновое семейство интерлейкина-1 (IL-1) вовлечено в патологию таких заболеваний, как ревматоидный артрит (RA), остеоартрит, болезнь Крона, язвенный колит (UC), септический шок, хроническая обструктивная болезнь легких (ХОБЛ), астма, реакция трансплантат против хозяина, атеросклероз, Т-клеточный лейкоз взрослых, множественная миелома, рассеянный склероз, геморрагический инсульт и болезнь Aльцгеймера. Члены семейства IL-1 включают IL-1α, IL-1β и IL-1Ra. Хотя их связывает способность связываться с IL-1-рецепторами (IL-1R1 и IL-1R2), каждый из указанных цитокинов экспрессируется различными геномами и имеет отличающуюся первичную аминокислотную последовательность. Кроме того, физиологическая активность цитокинов может различаться.
Соединения, которые нарушают передачу сигнала рецептора IL-1, рассматривались как терапевтические средства для лечения IL-1-опосредованных заболеваний. Такие соединения включают рекомбинантный IL-1Ra (Amgen Inc., Thousand Oaks, CA) и “trap”-пептид IL-1-рецептора (Regeneron Inc., Tarrytown, NY). Также были исследованы моноклональные антитела животных, которые связывают цитокины IL-1. Однако их клиническое значение может быть ограничено вследствие их иммуногенности. Например, известно, что у пациентов, получавших моноклональные антитела мыши, продуцируются антимышиные антитела человека (НАМА). Сообщалось, что НАМА уменьшают эффективность терапии моноклональными антителами и вызывают побочные реакции, включая поражающие почки. Другие IL-1β-антитела могут быть ограничены аффинностью связывания и/или активностью. Таким образом, требуются дополнительные соединения, которые нарушают передачу сигнала IL-1-рецептора. Настоящее изобретение относится к таким соединениям, а также к способам их получения и применения.
Сущность изобретения
Настоящее изобретение относится к IL-1β-связывающему антителу или его IL-1β-связывающему фрагменту, содержащему аминокислотную последовательность SEQ ID NO:2. Также изобретение относится к нуклеиновой кислоте, кодирующей антитело или фрагмент антитела, а также к вектору, содержащему нуклеиновую кислоту, клетке, содержащей нуклеиновую кислоту или вектор, и композиции, содержащей антитело, нуклеиновую кислоту или вектор.
Настоящее изобретение, кроме того, относится к способу лечения или профилактики заболевания у млекопитающего, включающему введение эффективного количества антитела или фрагмента антитела, нуклеиновой кислоты или вектора по настоящему изобретению млекопитающему, при необходимости, за счет чего происходит лечение или профилактика заболевания у млекопитающего.
Настоящее изобретение относится к способу получения аффинно-зрелого IL-1β-связывающего полипептида, включающему (а) получение первой нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты, кодирующую IL-1β-связывающий полипептид, который содержит аминокислотную последовательность любой из SEQ ID NO:1-26, и второй нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты, которая отличается от последовательности первой нуклеиновой кислоты по меньшей мере одним нуклеотидом, (b) осуществление перетасовки нуклеиновых кислот с получением двух или более мутированных нуклеиновых кислот, (с) отбор мутированной нуклеиновой кислоты, которая кодирует полипептид, который (i) связывается с IL-1β с более высокой аффинностью, чем полипептид, кодируемый первой нуклеиновой кислотой, (ii) обладает селективностью в отношении IL-1β по сравнению с IL-1α, которая выше, чем селективность полипептида, кодируемого первой нуклеиновой кислотой, (iii) имеет константу диссоциации равновесного связывания (KD) в отношении IL-1β, которая ниже, чем константа полипептида, кодируемого первой нуклеиновой кислотой, или (iv) ингибирует IL-1β-индуцированную экспрессию сывороточного IL-6 у животного в большей степени, чем полипептид, кодируемый первой нуклеиновой кислотой, и (d) экспрессию отобранной мутированной нуклеиновой кислоты, за счет чего получают аффинно-зрелый IL-1β-связывающий полипептид.
Настоящее изобретение относится к новым IL-1β-связывающим антителам или к их IL-1β-связывающим фрагментам, которые связываются с IL-1β человека с константной диссоциации менее чем 3 пМ, альтернативно, приблизительно 2 пМ или менее, предпочтительно, приблизительно 1 пМ или менее. Полагают, что такие высокоаффинные антитела могут использоваться в различных способах лечения или профилактики связанных с IL-1 заболеваний или состояний. Альтернативно или дополнительно, IL-1β-связывающие антитела или их IL-1β-связывающие фрагменты связываются с эпитопом IL-1β таким образом, что связанное антитело или связанный фрагмент по существу не препятствуют связыванию IL-1β с IL-1-рецептором типа I. Альтернативно или дополнительно, IL-1β-связывающие антитела или их IL-1β-связывающие фрагменты связываются по существу с таким же эпитопом, что и антитело или несколько антител, приведенных в настоящем описании в качестве примера, например антитело, обозначенное как АВ7, которое содержит вариабельную область тяжелой цепи. Альтернативно или дополнительно, IL-1β-связывающие антитела или их IL-1β-связывающие фрагменты конкурируют за связывание с антителом, имеющим вариабельную область легкой цепи SEQ ID NO:11 и вариабельную область тяжелой цепи SEQ ID NO:15. Альтернативно или дополнительно, настоящее изобретение также относится к IL-1β-связывающим антителам или их IL-1β-связывающим фрагментам, которые связываются с эпитопом, находящимся в последовательности ESVDPKNYPKKKMEKRFVFNKIE (SEQ ID NO:36). IL-1β-связывающие антитела, приведенные в качестве примеров, включают антитела, обозначенные в настоящем описании как АВ5 и АВ7.
Настоящее изобретение также относится к IL-1β-связывающим антителам или их IL-1β-связывающим фрагментам, имеющим константу диссоциации менее чем 3 пМ, альтернативно, приблизительно 1 пМ или менее, альтернативно, любую из других, описанных в настоящем описании констант диссоциации, и содержащим вариабельную область тяжелой цепи, содержащую одну из аминокислотных последовательностей SEQ ID NO:12, 13, 21, 23 или 24, или, альтернативно, аминокислотную последовательность SEQ ID NO:12, 13 или 21, или, альтернативно, аминокислотную последовательность SEQ ID NO:13 или 21, или, альтернативно, аминокислотную последовательность SEQ ID NO:8, 14 или 15 или, альтернативно, аминокислотную последовательность SEQ ID NO:8 или 15. IL-1β-связывающее антитело или его IL-1β-связывающий фрагмент может содержать также вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO:11.
В качестве другого варианта осуществления настоящее изобретение относится к новым IL-1β-связывающим антителам или их IL-1β-связывающим фрагментам, которые связываются с IL-1β с константной диссоциации приблизительно в диапазоне от 6 пМ до приблизительно 50 пМ, альтернативно, в диапазоне приблизительно от 13 пМ до приблизительно 25 пМ, альтернативно, приблизительно от 19 пМ, причем IC50 антитела или его фрагмента составляет менее 0,5 нМ (500 пМ), альтернативно, приблизительно в диапазоне от 5 пМ до приблизительно 200 пМ, альтернативно, приблизительно в диапазоне от 10 пМ до приблизительно 100 пМ, альтернативно, приблизительно 30 пМ, для ингибирования IL-1β-стимулированного высвобождения IL-6 из фибробластов человека. IC50 для ингибирования IL-1β-стимулируемого высвобождения IL-6 из фибробластов человека является концентрацией, необходимой для ингибирования 50% IL-6, высвобождаемого IL-1β-стимуляцией фибробластов человека. Примеры антител включают антитело, обозначенное в настоящем описании как АВ1.
Настоящее изобретение также относится к IL-1β-связывающим антителам или их IL-1β-связывающим фрагментам, имеющим константу диссоциации приблизительно от 6 до приблизительно 50 пМ и содержащим вариабельную область тяжелой цепи, содержащую одну из аминокислотных последовательностей SEQ ID NO:4, 5 или 6, альтернативно, одну из аминокислотных последовательностей SEQ ID NO:4 или 5, альтернативно, аминокислотную последовательность SEQ ID NO:4. Полагают, что в некоторых обстоятельствах могут быть желательными IL-1β-связывающее антитело или его IL-1β-связывающий фрагмент, имеющие относительно более высокую константу диссоциации, например, для некоторых способов лечения или профилактики IL-1-связанных заболеваний или состояний, где желательной является относительно меньшая степень аффинности.
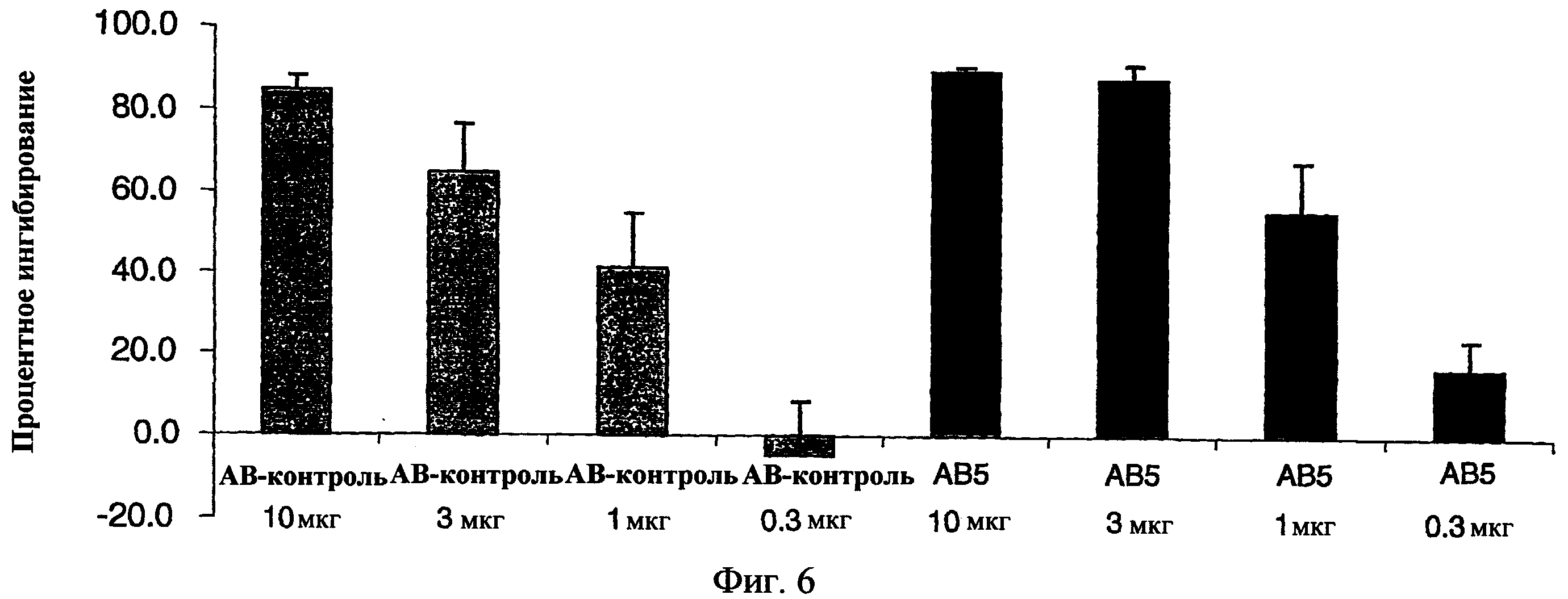
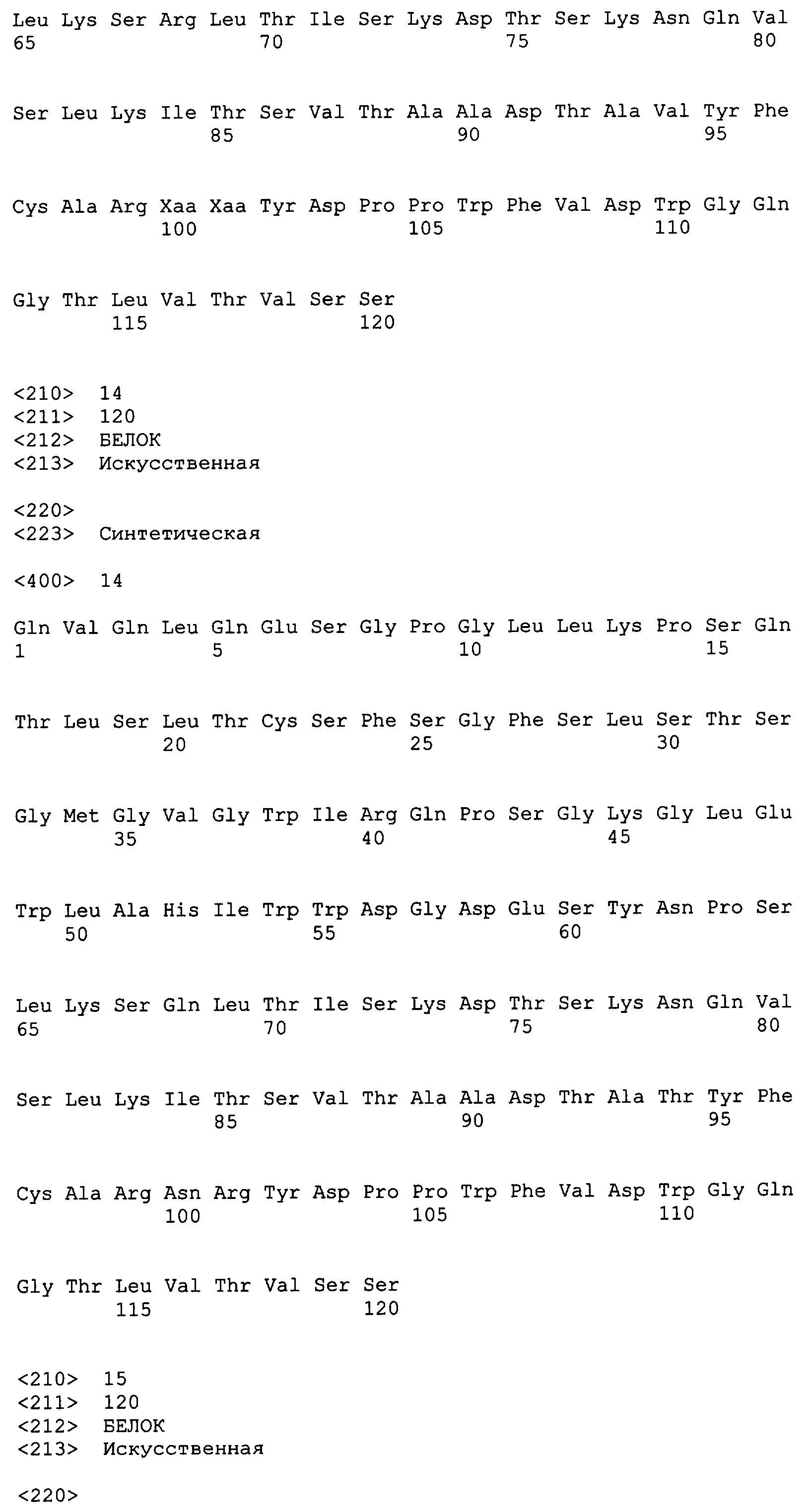
Примеры антител включают антитела, обозначенные АВ1, АВ2, АВ3, АВ4, АВ5, АВ6, АВ7, АВ8 и АВ9. АВ1 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:4, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:9. АВ2 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:5, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:9. АВ3 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:6, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:9. АВ4 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:7, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:9. АВ5 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:8, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:9. АВ6 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:14, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:10. АВ7 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:15, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:11. АВ8 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:25, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:10. АВ9 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:26, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:11.
Настоящее изобретение относится к IL-1β-связывающим антителам или их IL-1β-связывающим фрагментам, имеющим вариабельную область тяжелой цепи, которая содержит любую из последовательностей, представленных в SEQ ID NO:2, 4-8, 12-15, 23-26, 28-35 или 42-57, альтернативно, любую из последовательностей, представленных в SEQ ID NO:21, альтернативно, любую из последовательностей, представленных в SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7 или SEQ ID NO:8, альтернативно, любую из последовательностей, представленных в SEQ ID NO:12 или SEQ ID NO:13, альтернативно, любую из последовательностей, представленных в SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:25 или SEQ ID NO:26.
Настоящее изобретение также относится к IL-1β-связывающим антителам или их IL-1β-связывающим фрагментам, имеющим вариабельную область легкой цепи, которая содержит любую из последовательностей, представленных в SEQ ID NO:1, 9-11 или 27, альтернативно, любую из последовательностей, представленных в SEQ ID NO:1, альтернативно, любую из последовательностей, представленных в SEQ ID NO:9, альтернативно, любую из последовательностей, представленных в SEQ ID NO:10 или SEQ ID NO:11.
Настоящее изобретение также относится к IL-1β-связывающим антителам или их IL-1β-связывающим фрагментам, содержащим одну из вариабельных областей тяжелой цепи последовательностей, представленных в SEQ ID NO:2, 4-8, 12-15, 21, 23-26, 28-35 или 42-57, и одну из вариабельных областей легкой цепи последовательностей, представленных в SEQ ID NO:1, 9-11 или 27.
Настоящее изобретение также относится к IL-1β-связывающим антителам или их IL-1β-связывающим фрагментам, содержащим части, которые не связывают IL-1β, но, вместо этого, ответственны за другие функции, такие как полупериод циркуляции, прямое цитотоксическое действие, детектируемое мечение или активация каскада реакций эндогенного комплемента реципиента или эндогенной клеточной цитотоксичности. Антитела настоящего изобретения могут содержать всю или часть константной области антитела. Константная область может быть выбрана из любого изотипа, включая IgА (например, IgА1 или IgА2), IgD, IgЕ, IgG (например, IgG1, IgG2, IgG3 или IgG4) или IgМ. Например, антитело может содержать область IgG2. Кроме того или вместо этого, содержащие константную область антитела и фрагменты настоящего изобретения могут содержать эпитопную метку, эпитоп рецептора реутилизации, метку для диагностических целей или для целей очистки или цитотоксическую метку, такую как радионуклид или токсин.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим любое из IL-1β-связывающих антител или любой из их IL-1β-связывающих фрагментов и фармацевтически приемлемый носитель, эксципиент или разбавитель. Предпочтительно, антитела и соединения настоящего изобретения могут вводиться в терапевтически эффективном количестве, которое является количеством, достаточным для уменьшения клинического показателя или симптома состояния или заболевания, ассоциированного с экспрессией белка-мишени, субъекту, нуждающемуся в таком лечении. В связанном варианте осуществления фармацевтическая композиция дополнительно содержит второй активный агент. В еще одном варианте осуществления предоставлена фармацевтическая композиция, где вторым активным агентом является антитело против фактора роста или цитокина или антагонист фактора роста или цитокина. В другом варианте осуществления вторым активным агентом является другое антитело.
В другом варианте осуществления настоящего изобретения рассматривается применение IL-1β-связывающих антител или их IL-1β-связывающих фрагментов в производстве лекарственного средства для профилактики или ослабления состояния или нарушения, ассоциированного с IL-1. В любом из указанных применений лекарственное средство может быть координировано с лечением при использовании второго активного агента. В другом варианте осуществления настоящего изобретения рассматривается применение синергической комбинации антитела настоящего изобретения для получения лекарственного средства для лечения пациента, проявляющего симптомы связанного с IL-1 состояния или нарушения, описанного в настоящем описании, где лекарственное средство координировано с лечением при использовании второго активного агента. В связанном варианте осуществления вторым активным агентом является антитело против цитокина или фактора роста или антагонист цитокина или фактора роста. Рассматриваются варианты любого из вышеуказанных применений, где количество IL-1β-связывающего антитела или их IL-1β-связывающего фрагмента в лекарственном средстве находятся в дозе, эффективной для уменьшения дозы второго активного агента, требуемой для достижения терапевтического эффекта.
Настоящее изобретение также относится к наборам. В одном варианте осуществления набор содержит терапевтически или профилактически эффективное количество соединения или композиции настоящего изобретения (например, антитела, фрагмента, нуклеиновой кислоты, вектора или клетки), упакованное в контейнер, например, флакон или склянку, и дополнительно содержащее ярлык, прикрепленный к контейнеру или упакованный с контейнером и описывающий содержимое контейнера и предоставляющий указания и/или инструкции по применению содержимого данного контейнера для профилактики или ослабления состояния или заболевания, ассоциированного с экспрессией белка-мишени.
Краткое описание рисунков
На фиг.1 представлена пара аминокислотных последовательностей, соответствующих легким цепям и тяжелым цепям вариабельной области некоторых из описанных в настоящем описании антител. Подчеркнутые части аминокислотных последовательностей показывают определяющие комплементарность области (CDR).
На фиг.2 представлен набор аминокислотных последовательностей, соответствующих вариабельным областям легкой цепи и тяжелой цепи антител АВ1, АВ2, АВ3 и АВ4. Подчеркнутые части аминокислотных последовательностей показывают определяющие комплементарность области (CDR).
На фиг.3 представлен набор аминокислотных последовательностей, соответствующих вариабельным областям легкой цепи и тяжелой цепи антител АВ5, АВ5.1 и АВ5.2. Подчеркнутые части аминокислотных последовательностей показывают определяющие комплементарность области (CDR).
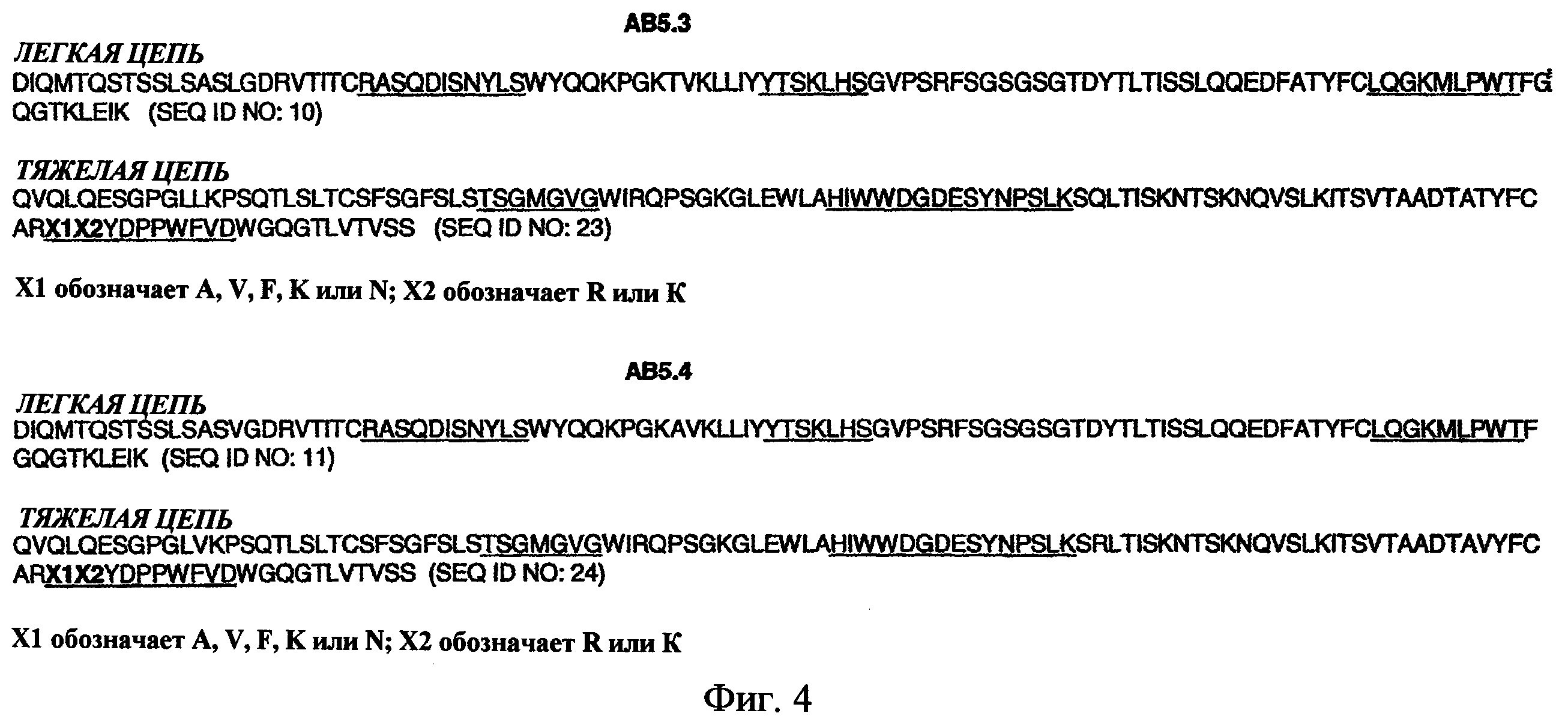
На фиг.4 представлен набор аминокислотных последовательностей, соответствующих вариабельным областям легкой цепи и тяжелой цепи антител АВ5.3 и АВ5.4. Подчеркнутые части аминокислотных последовательностей показывают определяющие комплементарность области (CDR).
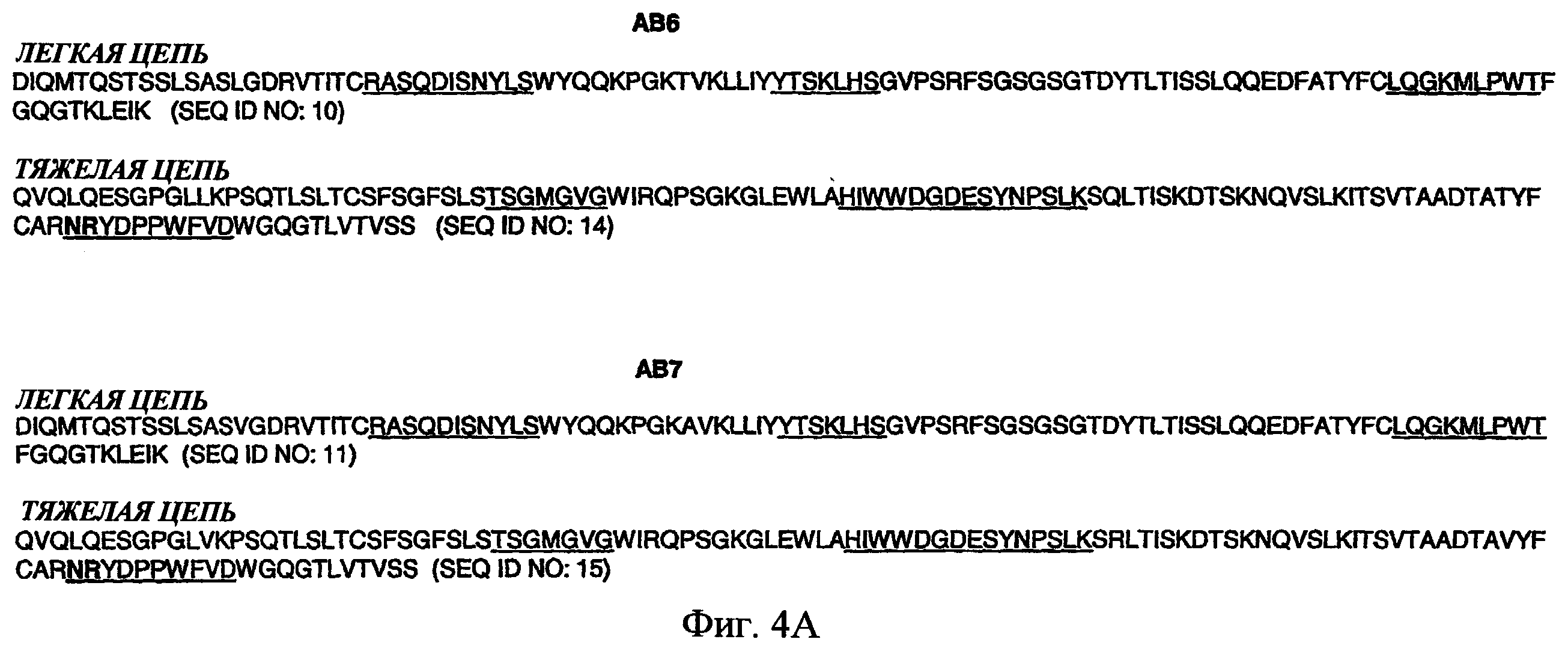
На фиг.4А представлен набор аминокислотных последовательностей, соответствующих вариабельным областям легкой цепи и тяжелой цепи антител АВ6 и АВ7. Подчеркнутые части аминокислотных последовательностей показывают определяющие комплементарность области (CDR).
На фиг.4В представлен набор аминокислотных последовательностей, соответствующих вариабельным областям легкой цепи и тяжелой цепи антител АВ8 и АВ9. Подчеркнутые части аминокислотных последовательностей показывают определяющие комплементарность области (CDR).
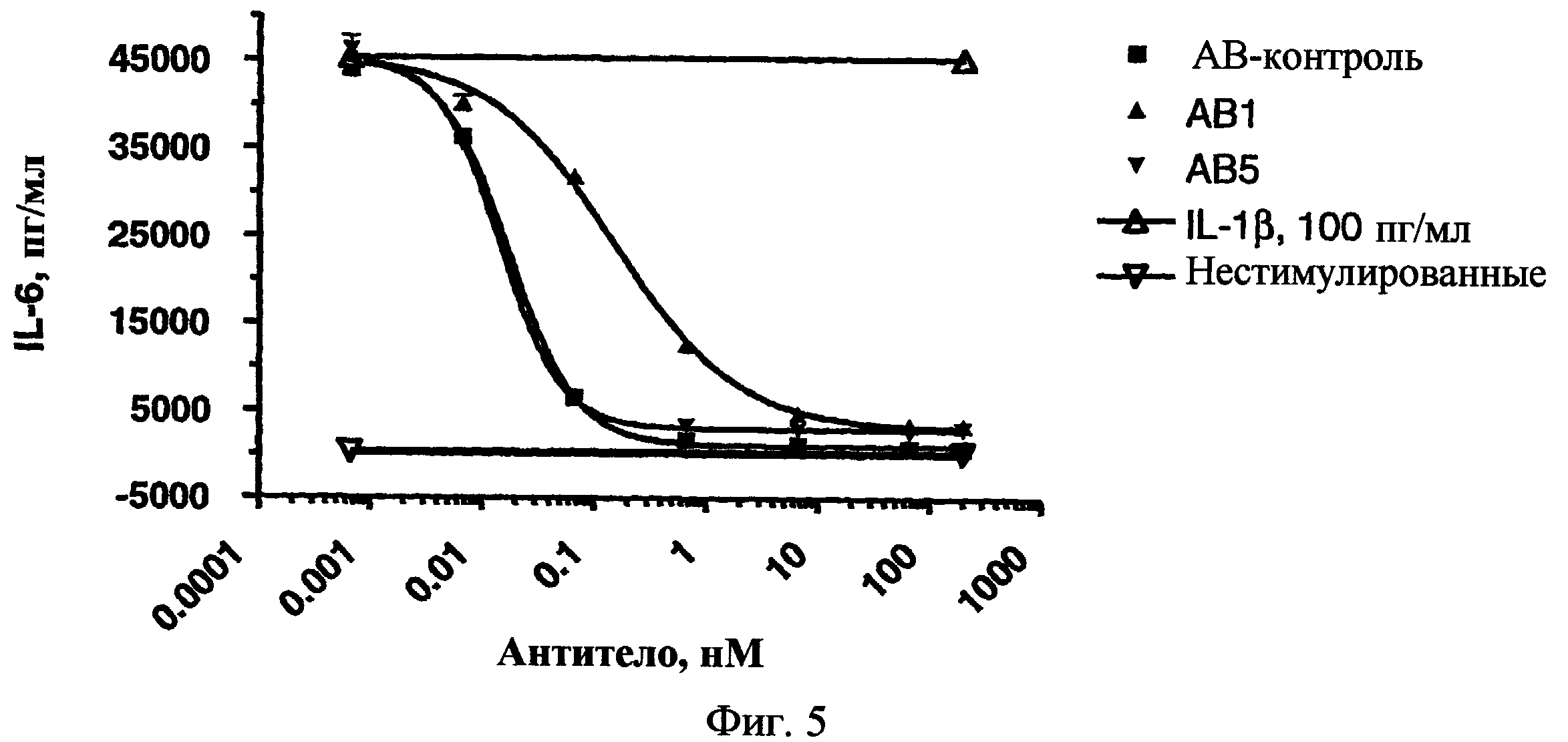
На фиг.5 представлен график, показывающий результаты эксперимента in vitro стимуляции IL-1β.
На фиг.6. представлена гистограмма, показывающая результаты эксперимента in vitro стимуляции IL-1β.
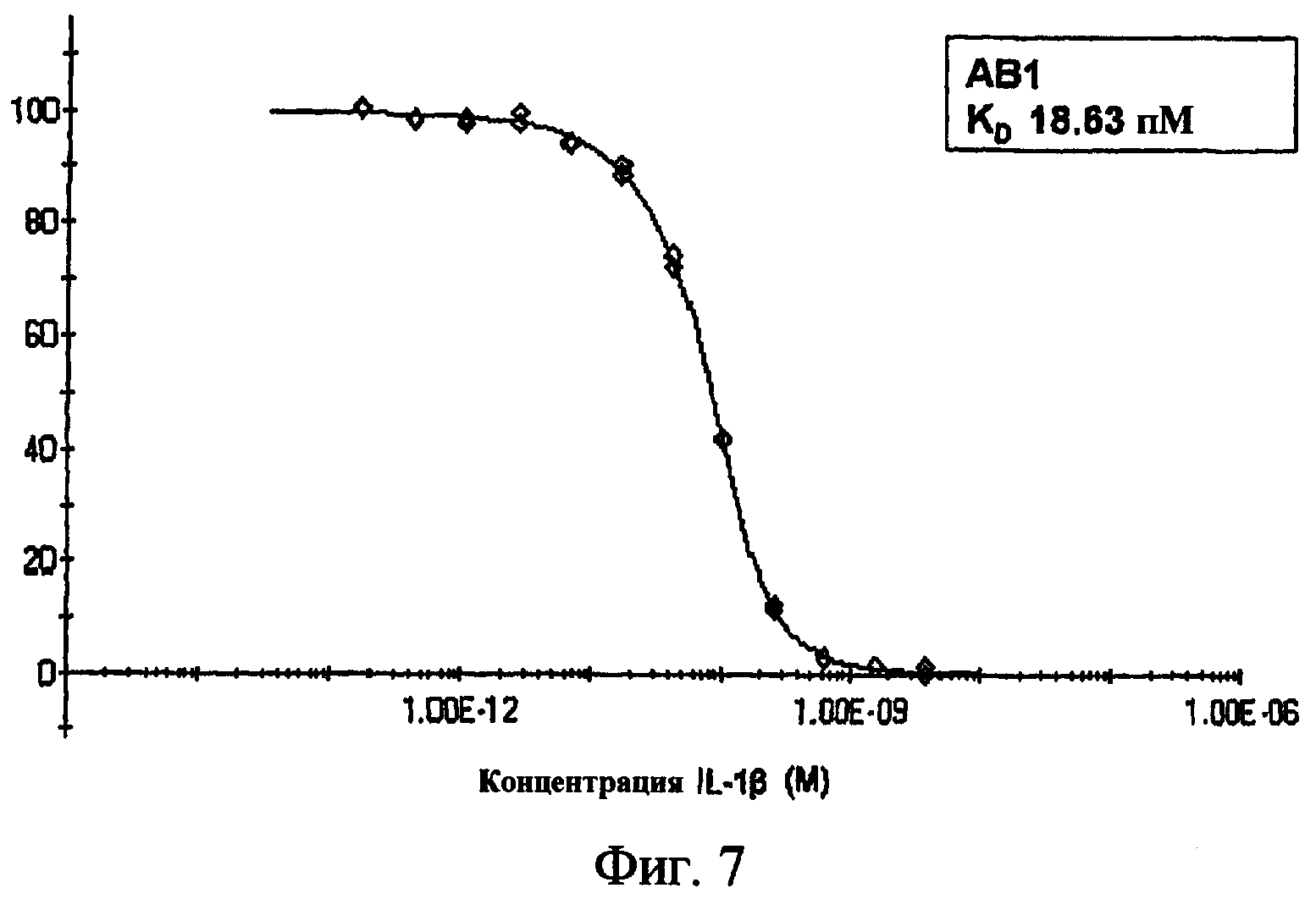
На фиг.7 представлен график, показывающий результаты кинетического анализа исключения для антитела, обозначенного как АВ1.
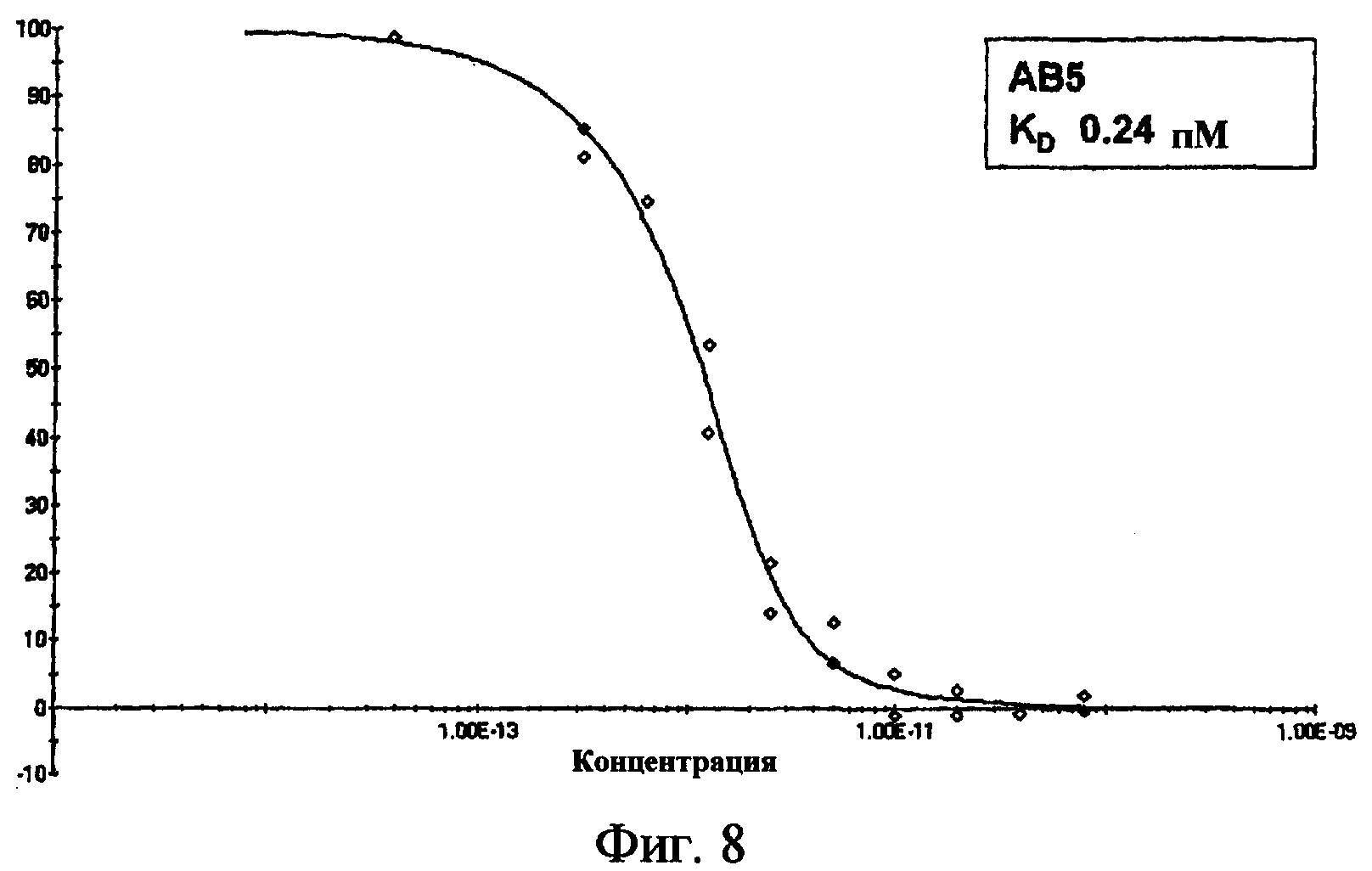
На фиг.8 представлен график, показывающий результаты кинетического анализа исключения для антитела, обозначенного как АВ5.
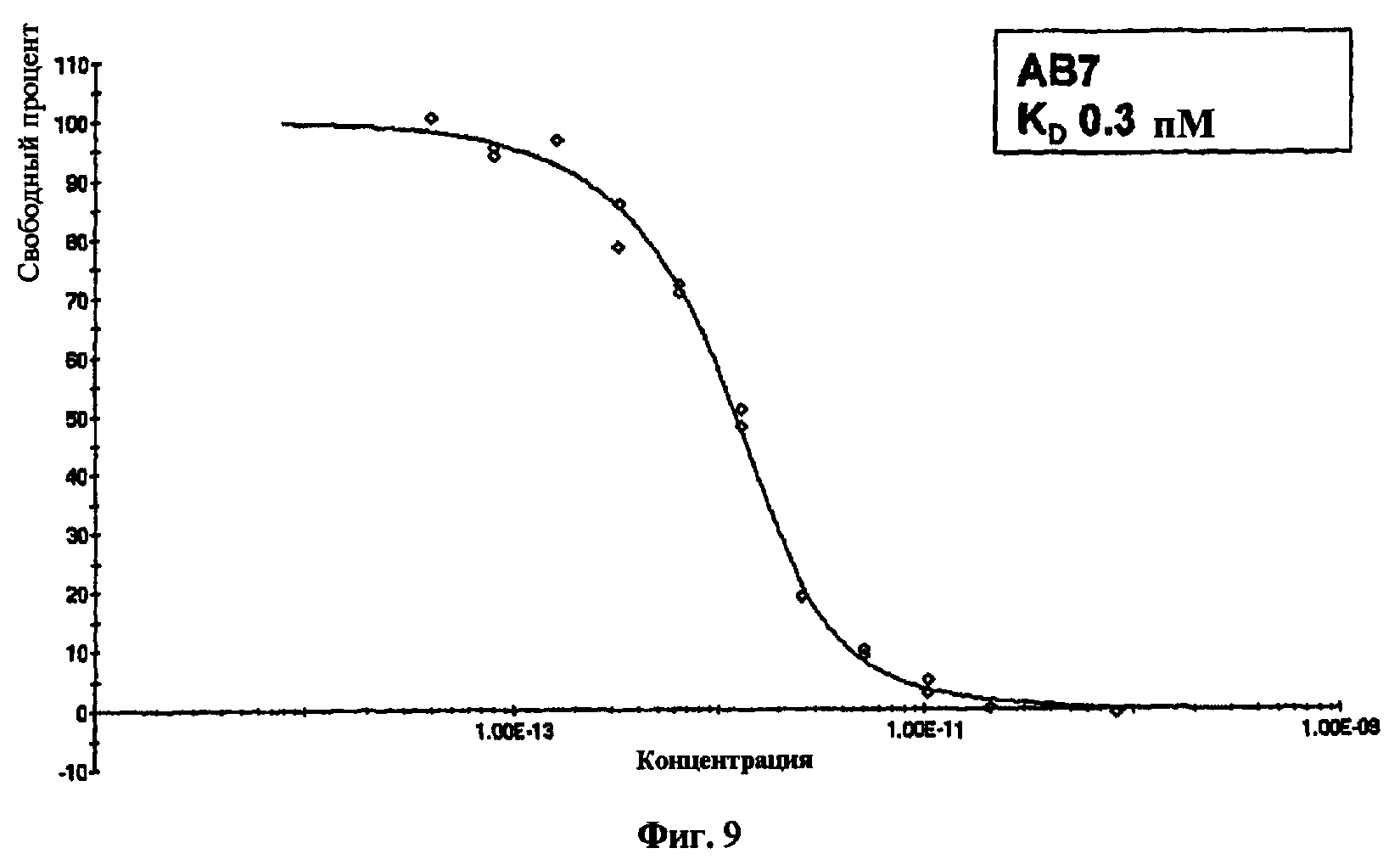
На фиг.9 представлен график, показывающий результаты кинетического анализа исключения для антитела, обозначенного как АВ7.
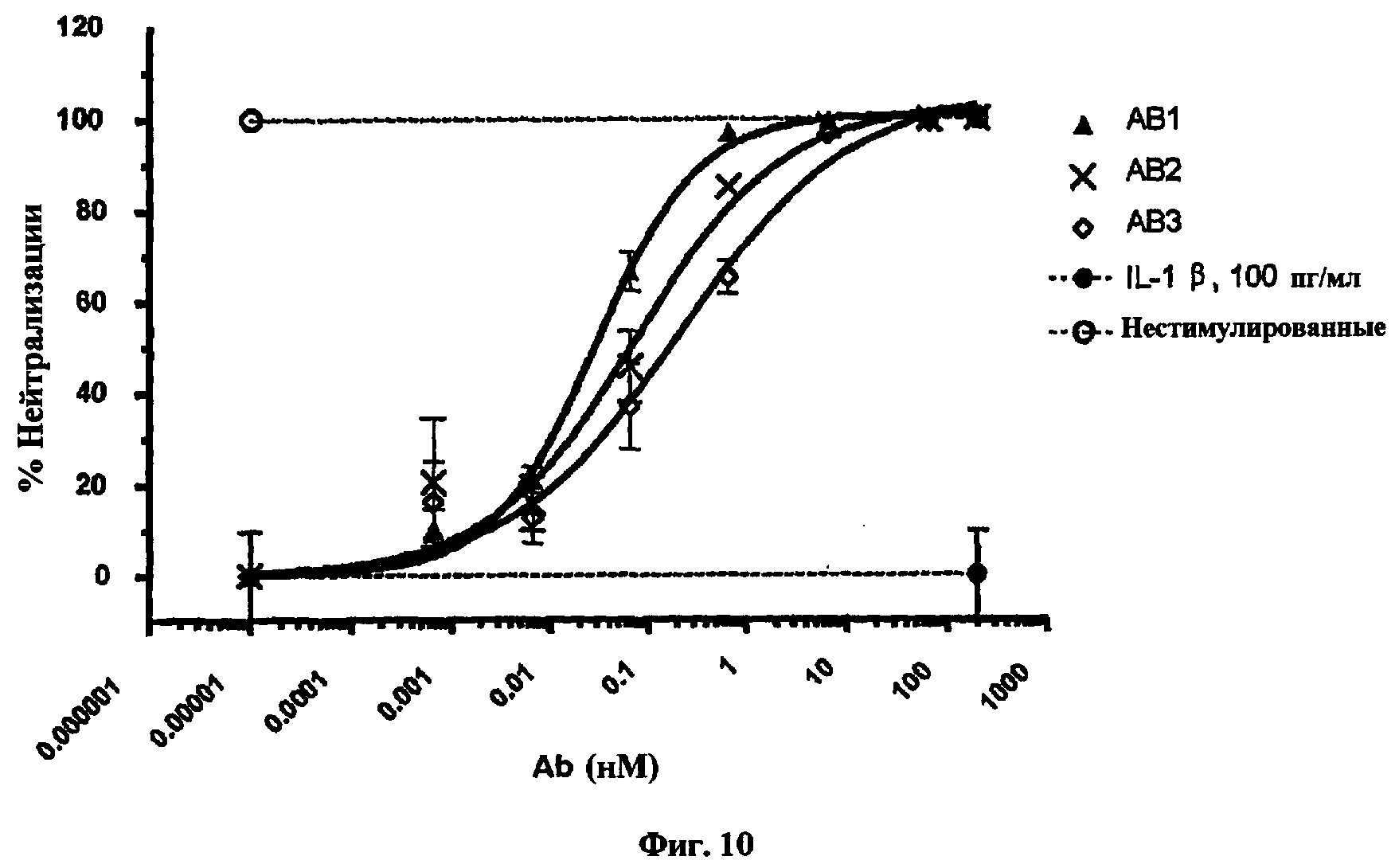
На фиг.10 представлен график, показывающий результаты эксперимента in vitro стимуляции IL-1β для антител, обозначенных как АВ1, АВ2 и АВ3.
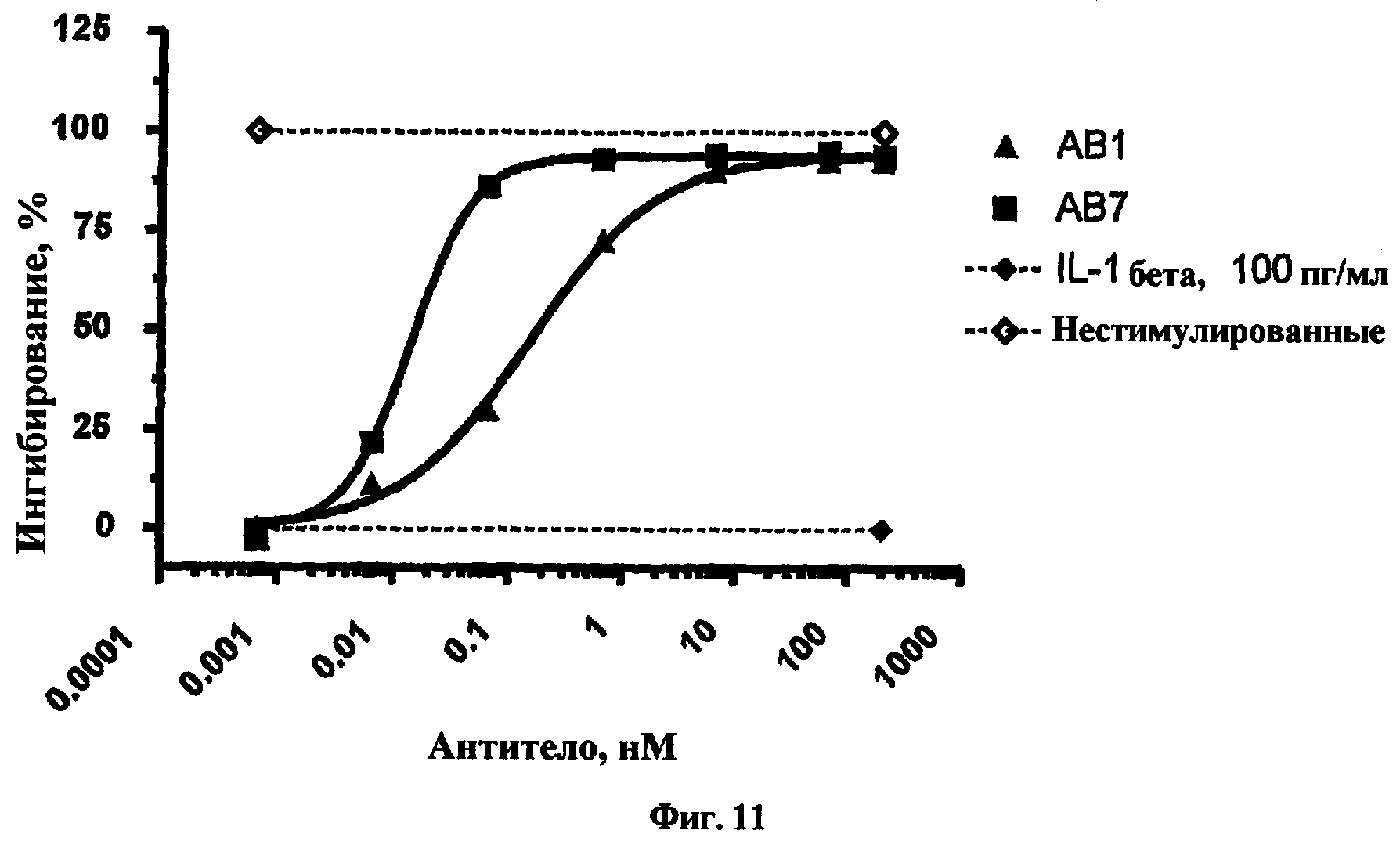
На фиг.11 представлен график, показывающий результаты эксперимента in vitro стимуляции IL-1β для антител, обозначенных как АВ1 и АВ7.
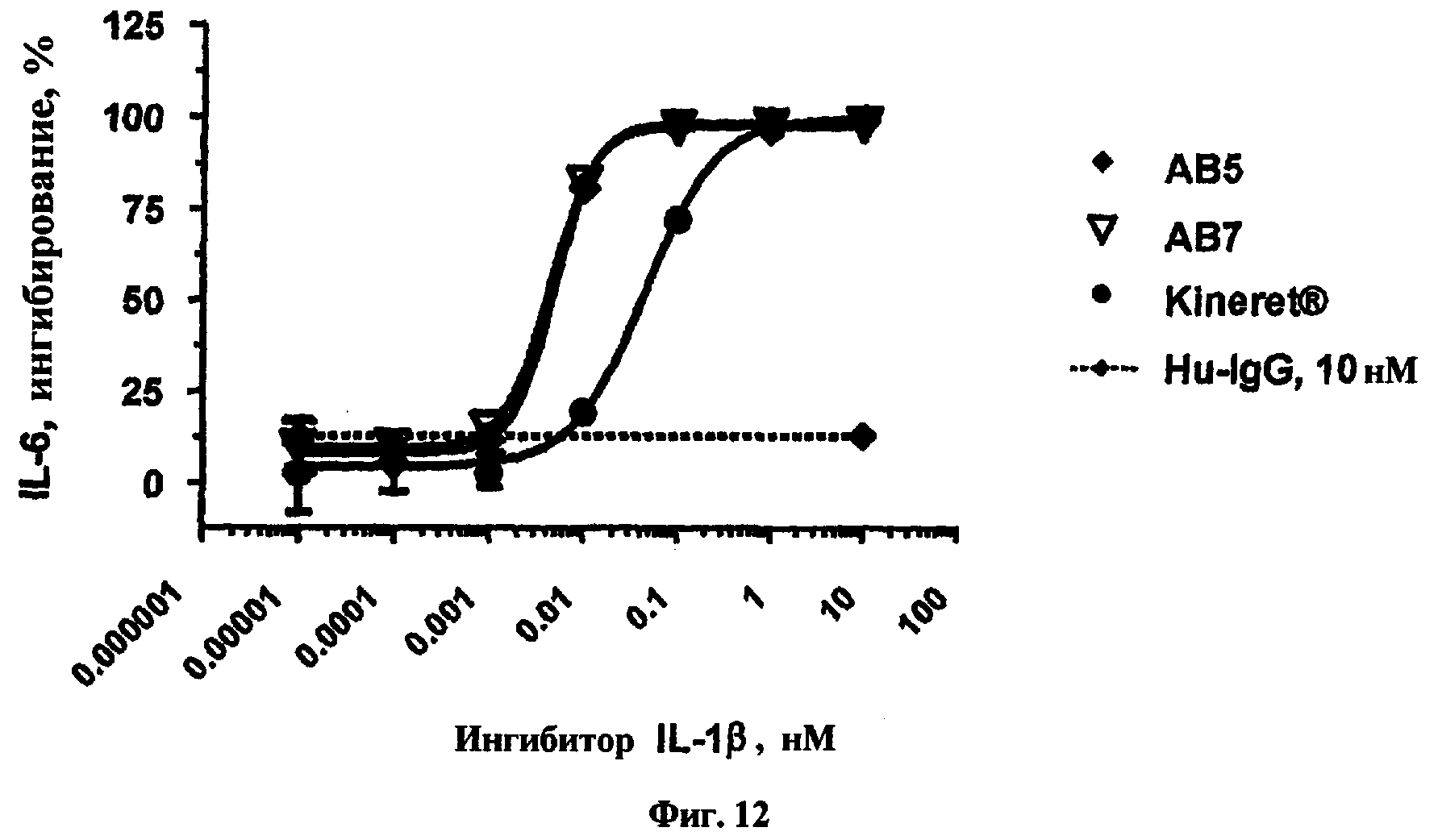
На фиг.12 представлен график, показывающий результаты эксперимента in vitro стимуляции IL-1β для антител, обозначенных как АВ5 и АВ7, а также для Kineret®.
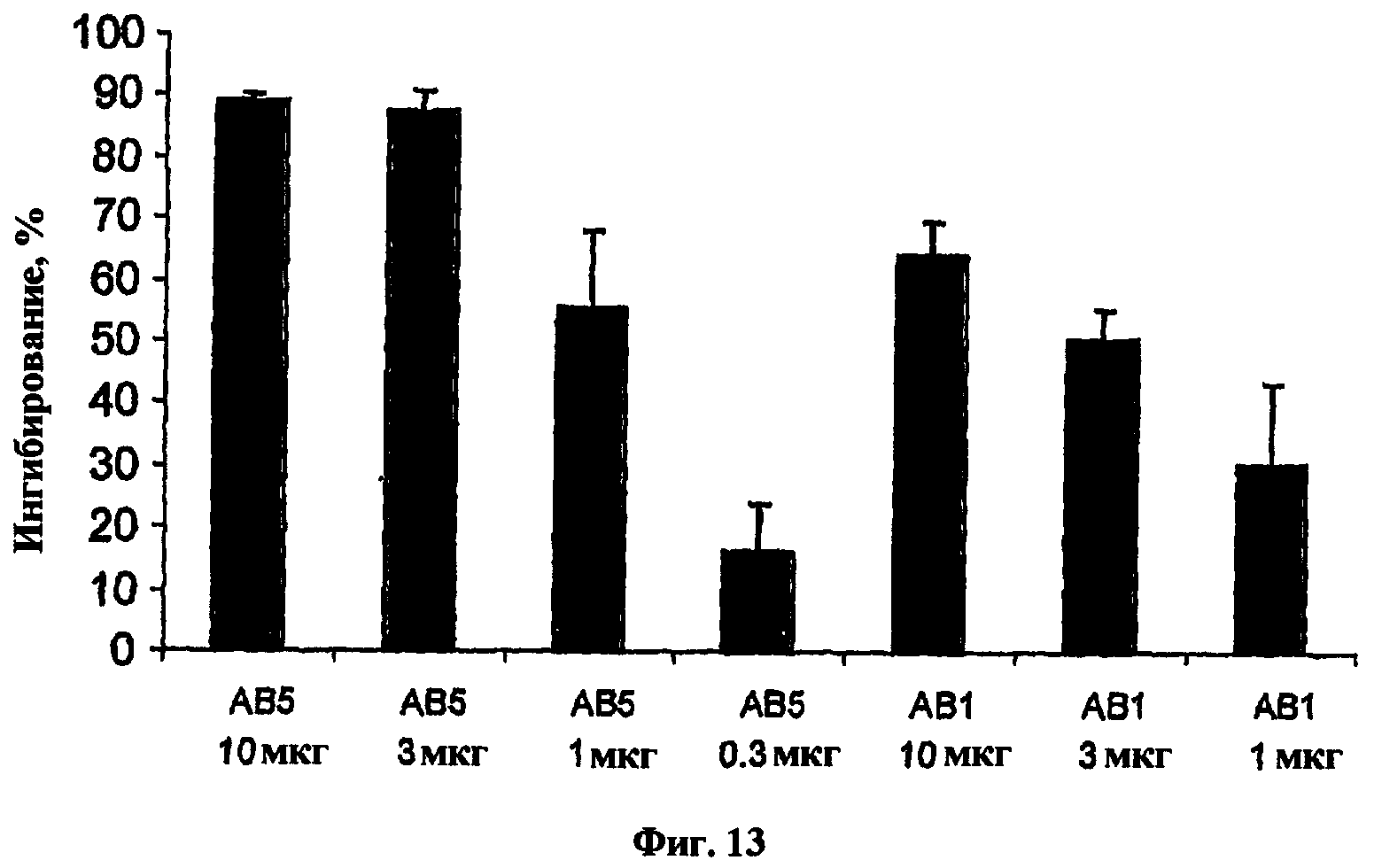
На фиг.13 представлена гистограмма, показывающая результаты эксперимента in vivo стимуляции IL-1β для антител, обозначенных как АВ5 и АВ1.
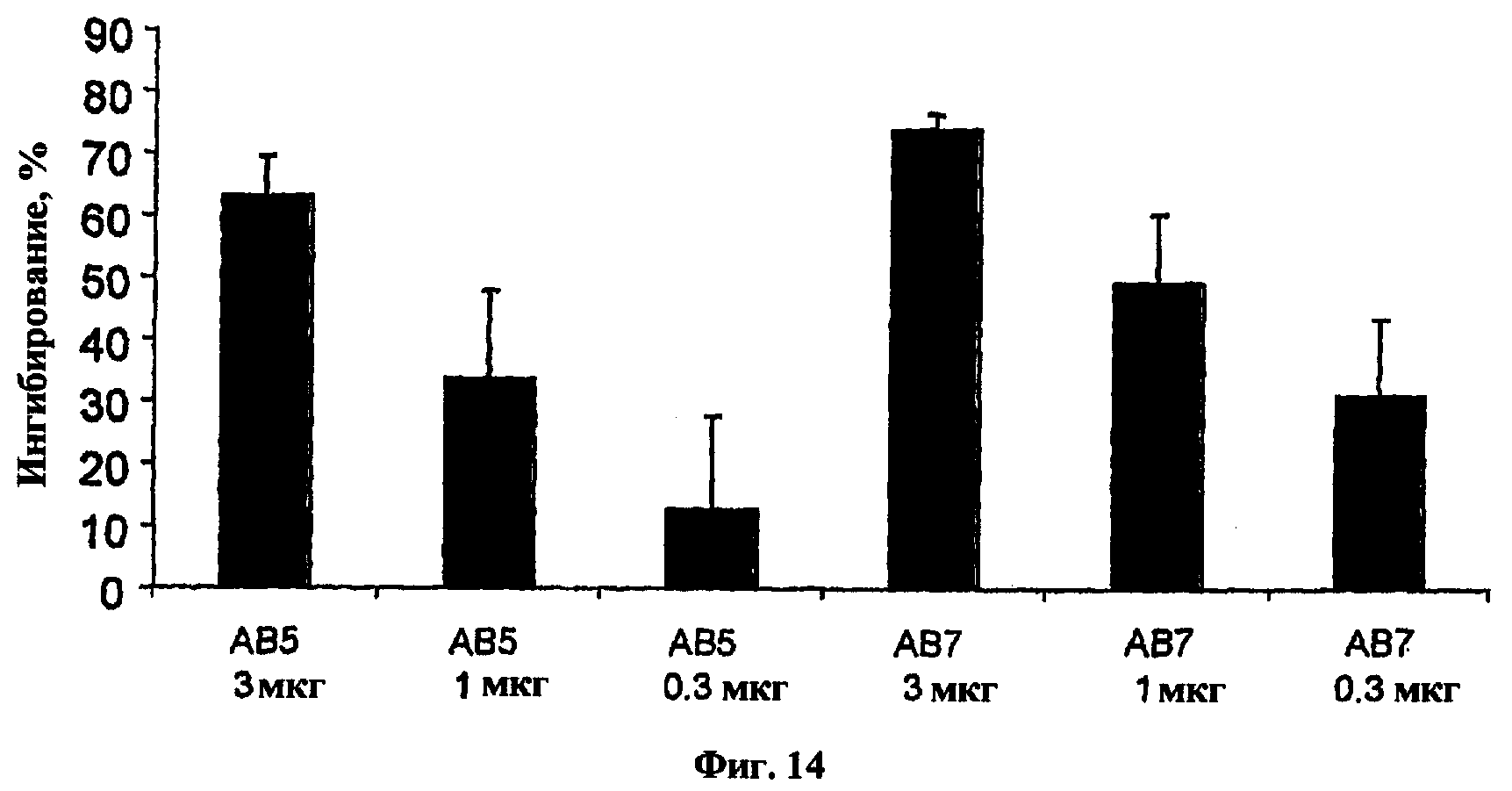
На фиг.14 представлена гистограмма, показывающая результаты эксперимента in vivo стимуляции IL-1β для антител, обозначенных как АВ5 и АВ7.
На фиг.15 представлен Вестерн-блот, показывающий результаты экспериментов по перекрестной реактивности антитела, обозначенного как АВ7, в отношении IL-1β собакоподобной обезьяны и макаки резус.
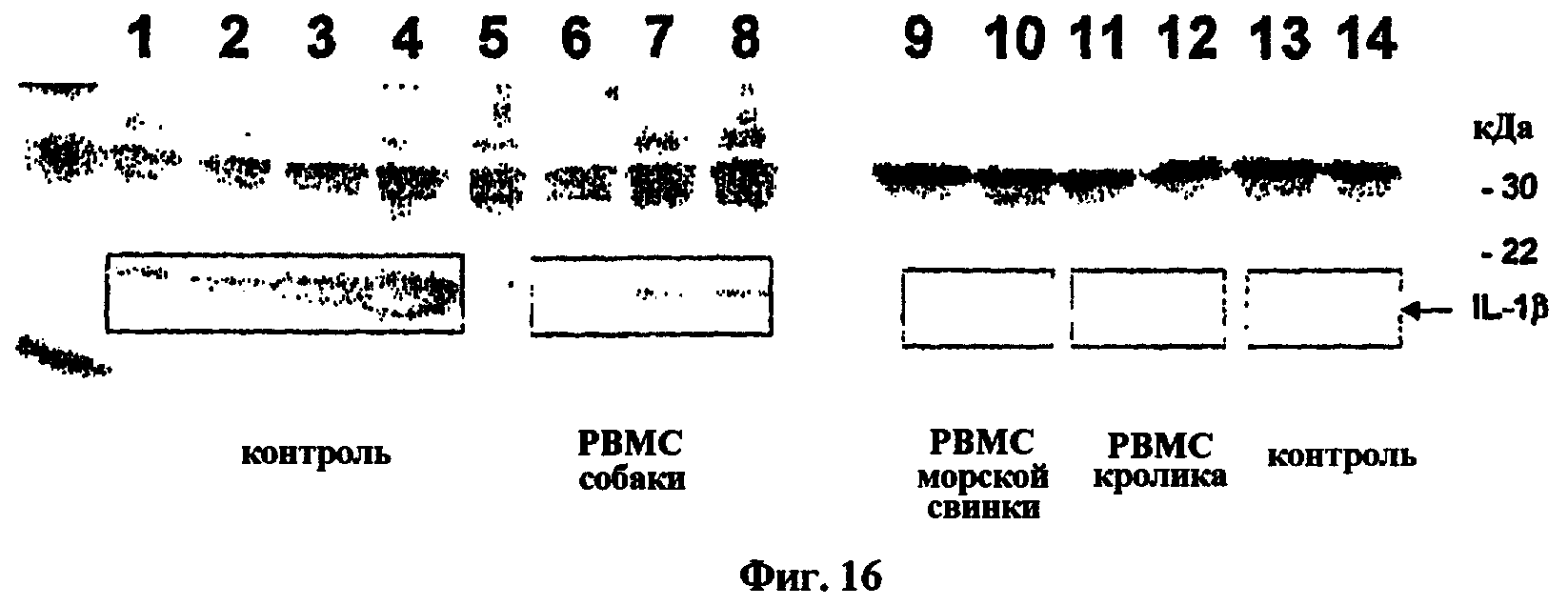
На фиг.16 представлен Вестерн-блот, показывающий результаты экспериментов по перекрестной реактивности антитела, обозначенного как АВ7, в отношении IL-1β собаки, морской свинки, свиньи и кролика.
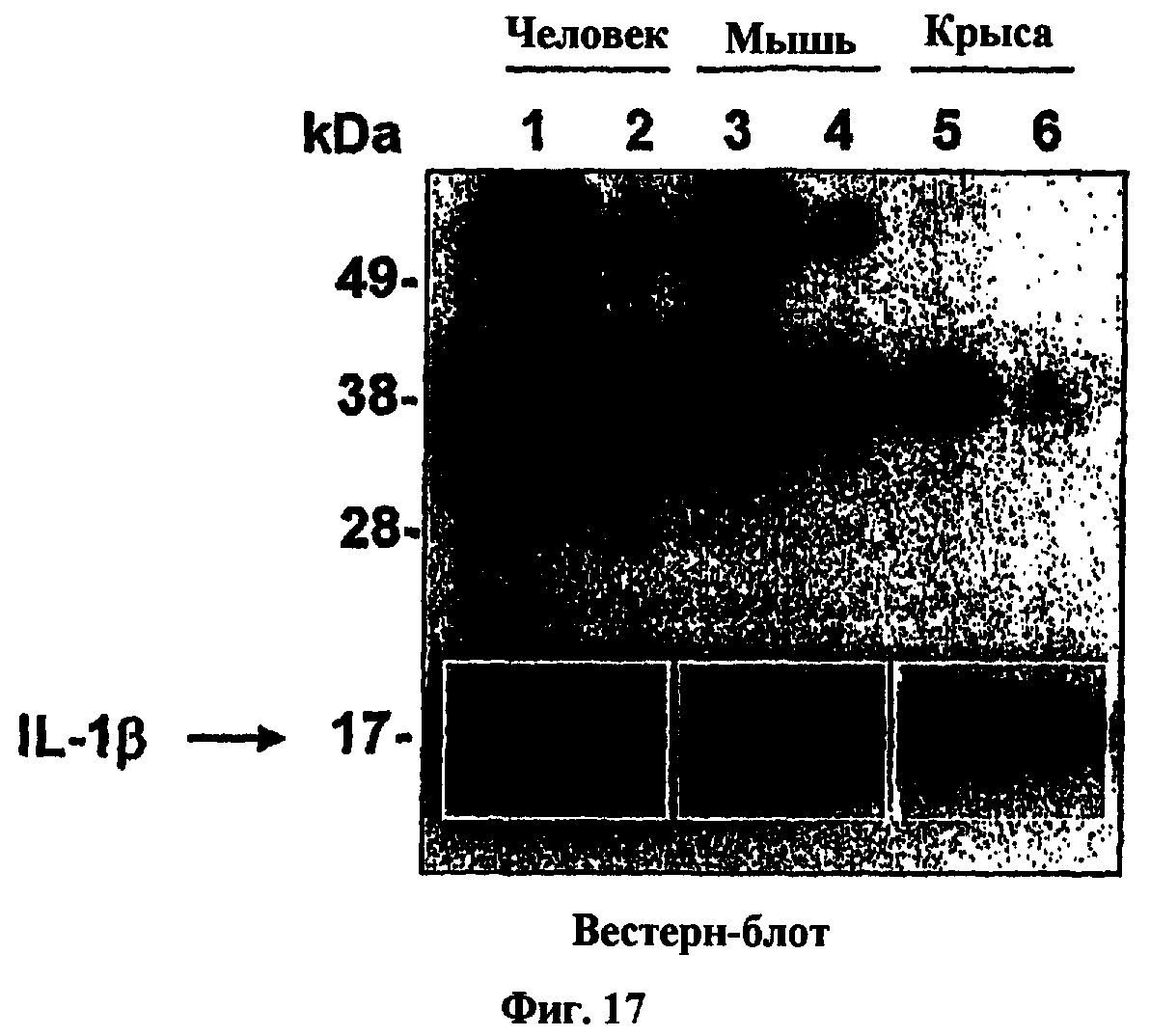
На фиг.17 представлен Вестерн-блот, показывающий результаты экспериментов по перекрестной реактивности для антитела, обозначенного как АВ7, в отношении рекомбинантного IL-1β человека, мыши и крысы.
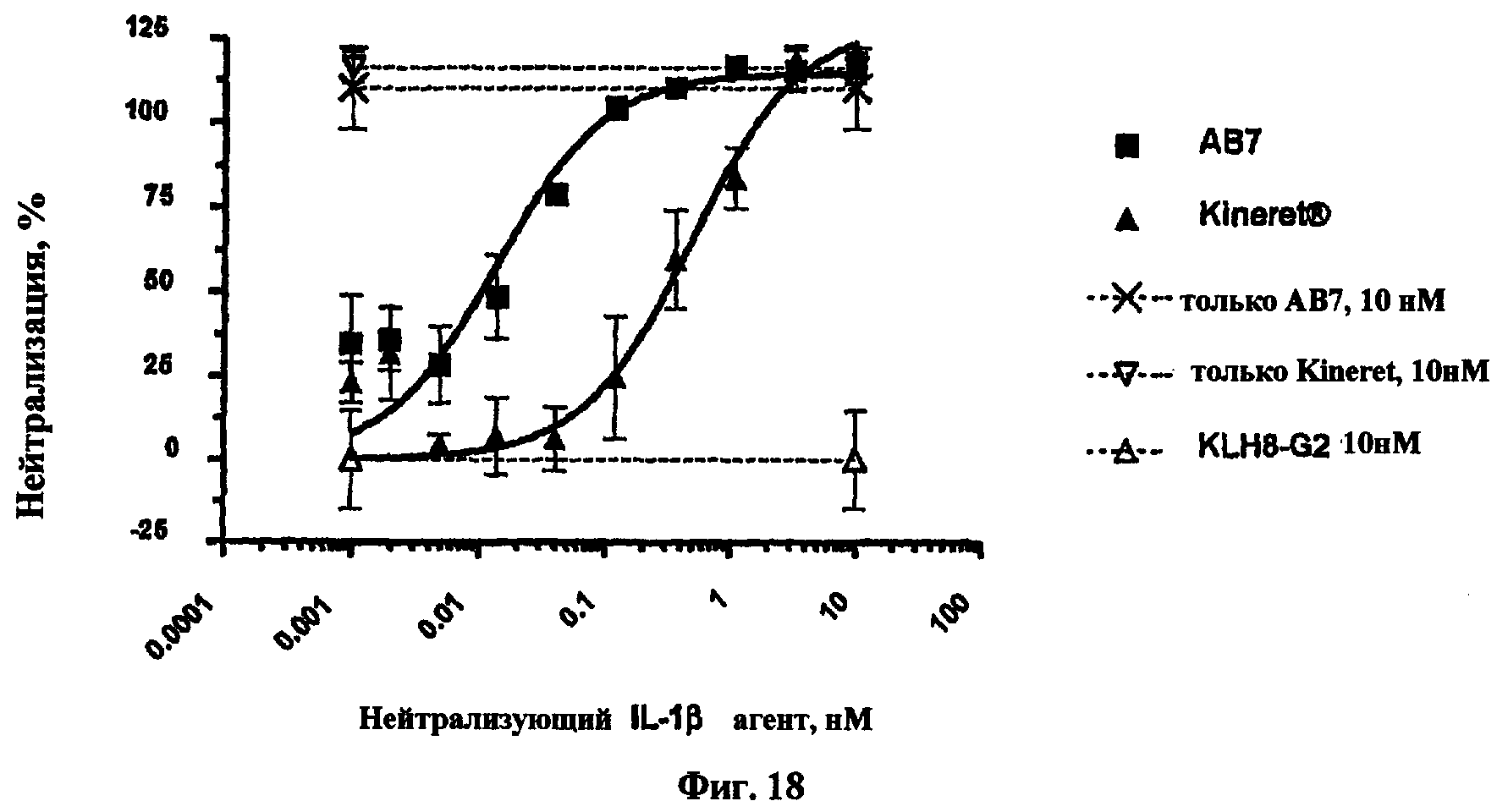
На фиг.18 представлен график, показывающий результаты эксперимента in vitro для антитела, обозначенного как АВ7, и для Kineret, включающего IL-1-индуцированное продуцирование IL-8.
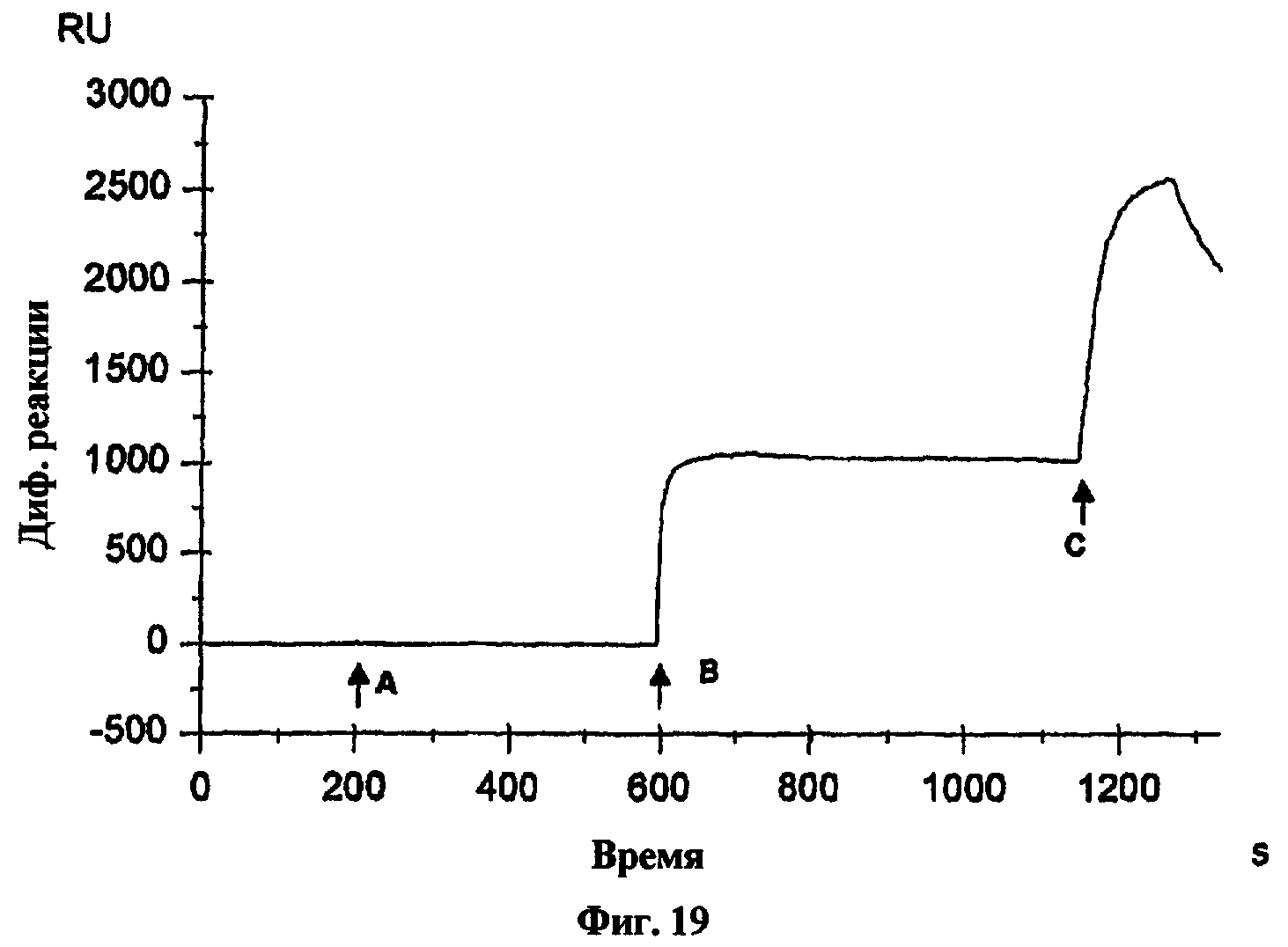
На фиг.19 представлен график, показывающий результаты анализа испытания, предотвращают ли данные антитела связывание IL-1β в отношении IL-1-рецептора типа I.
Подробное описание
Настоящее изобретение относится к новым IL-1β-связывающим антителам или их IL-1β-связывающим фрагментам, обладающим желаемой аффинностью и активностью. В качестве одного аспекта настоящего изобретения предоставлены IL-1β-связывающие антитела, которые обладают неожиданно высокой аффинностью и низкими константами диссоциации (например, менее чем 3 пМ, альтернативно, приблизительно 1 пМ или менее) по сравнению с известными IL-1β-связывающими антителами. Примеры антител включают антитела, обозначенные в настоящем описании как АВ5 и АВ7. В качестве другого аспекта настоящего изобретения предоставлены IL-1β-связывающие антитела, имеющие желаемую константу диссоциации (например, в диапазоне приблизительно от 6 пМ до приблизительно 50 пМ) и желаемую IC50 (например, менее чем 500 пМ) для ингибирования IL-1β-стимулируемого высвобождения IL-6 из фибробластов человека. Примеры антител включают антитело, обозначенное в настоящем описании как АВ1.
Настоящее изобретение также относится к IL-1β-связывающим антителам или IL-1β-связывающим фрагментам, которые связываются селективно с IL-1β, причем они связываются с IL-1β с большей аффинностью, чем с другими антигенами. IL-1β-связывающие антитела или IL-1β-связывающие фрагменты могут селективно связываться с IL-1β человека, а также детектируемо связываются с IL-1β не человека. Альтернативно или дополнительно, антитела или их фрагменты могут связываться с IL-1β человека и с IL-1β одного другого млекопитающего (первого млекопитающего) и не связываться с IL-1β по меньшей мере одного другого млекопитающего (второго млекопитающего). Например, антитела или их фрагменты могут связываться с одним или несколькими IL-1β грызуна, IL-1β примата, IL-1β собаки и IL-1β кролика и/или не связываться с IL-1β морской свинки. Альтернативно или дополнительно, антитела или их фрагменты могут связываться с IL-1β мыши с более высокой аффинностью, чем с IL-1β крысы. Альтернативно или дополнительно, IL-1β-связывающие антитела или их IL-1β-связывающие фрагменты могут обладать одной и той же или по существу одной и той же активностью против IL-1β человека и IL-1β примата. Альтернативно или дополнительно, IL-1β-связывающие антитела или их IL-1β-связывающие фрагменты могут обладать одной и той же или по существу одной и той же активностью против рекомбинантного IL-1β человека и эндогенного IL-1β человека. Альтернативно или дополнительно, IL-1β-связывающие антитела или их IL-1β-связывающие фрагменты могут нейтрализовать IL-1β мыши.
Как использовано в настоящем описании, антителом или фрагментом, которые специфически связываются с антигеном-мишенью, называют антитело, которое связывает антиген-мишень с большей аффинностью, чем другие сходные антигены. Например, антитело или его фрагмент является специфическим в отношении его когнатного антигена, когда вариабельные области данного антитела или фрагмента распознают и связывают когнатный антиген с детектируемым предпочтением (отличая антиген от других известных полипептидов того же самого семейства измеримыми различиями в аффинности связывания, несмотря на возможное существование локализованной идентичности, гомологии или локализованного сходства между членами семейства). Следует понимать, что специфические антитела и фрагменты могут также взаимодействовать с другими белками (например, белком А S. aureus или другими антителами в способах ELISA) посредством взаимодействия с последовательностями вне вариабельной области данных антител и, в частности, в константной области антитела или фрагмента. Скрининг-анализы для определения специфичности связывания антитела хорошо известны, см. Harlow et al. “Antibodies: A Laboratory Manual,” Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1988), Chapter 6.
Один аспект настоящего изобретения относится к IL-1β-связывающим антителам и их IL-1β-связывающим фрагментам, имеющим неожиданно низкие константы диссоциации (KD), например, менее чем 3 пМ, альтернативно, 2 пМ или менее, альтернативно, 1 пМ или менее, альтернативно, 0,8 пМ или менее, альтернативно, 0,74 пМ или менее, альтернативно, 0,72 пМ или менее, альтернативно, 0,7 пМ или менее, альтернативно, 0,6 пМ или менее, альтернативно, 0,56 пМ или менее, альтернативно, 0,5 пМ или менее, альтернативно, 0,3 пМ или менее, альтернативно, 0,26 пМ или менее, альтернативно, 0,24 пМ или менее, альтернативно, 0,2 пМ или менее. Таким образом, в некоторых вариантах осуществления настоящего изобретения IL-1β-связывающие антитела и фрагменты могут быть описаны со ссылкой на верхнюю границу диапазона констант диссоциации. Альтернативно или дополнительно, в некоторых вариантах осуществления настоящего изобретения IL-1β-связывающие антитела и фрагменты могут быть описаны со ссылкой на нижнюю границу диапазона констант диссоциации, например антитело или фрагмент, имеющий константу диссоциации 0,07 пМ или более, альтернативно, 0,1 пМ или более, альтернативно, 0,11 пМ или более, альтернативно, 0,15 пМ или более, альтернативно, 0,2 пМ или более, альтернативно, 0,24 пМ или более, альтернативно, 0,26 пМ или более, альтернативно, 0,3 пМ или более, альтернативно, 0,5 пМ или более, альтернативно, 0,7 пМ или более. Любая более высокая константа диссоциации и более низкая константа диссоциации, как указано выше, могут быть комбинированы для определения диапазона констант диссоциации, при условии, что нижняя выбранная величина равна верхней выбранной величине или меньше, чем верхняя выбранная величина.
В другом аспекте настоящего изобретения предоставлены новые IL-1β-связывающие антитела или их IL-1β-связывающие фрагменты, которые связываются с IL-1β с константной диссоциации, больше, чем 6 пМ и меньше, чем 50 пМ, или равной 50 пМ, альтернативно, в диапазоне приблизительно от 13 пМ до приблизительно 25 пМ, и где IC50 антитела или фрагмента для ингибирования IL-1β-стимулированного высвобождения IL-6 из фибробластов человека составляет менее чем 0,5 нМ (500 пМ), альтернативно, приблизительно от 5 пМ до приблизительно 200 пМ, альтернативно, приблизительно от 10 пМ до приблизительно 100 пМ, альтернативно, приблизительно 30 пМ. Полагают, что может быть желательно получение IL-1β-связывающего антитела или фрагмента, обладающего вышеуказанной аффинностью связывания и активностью, для некоторых способов лечения или профилактики IL-1β-опосредованных состояний или заболеваний. Примеры антител включают антитело, обозначенное в настоящем описании как АВ1.
Настоящие антитела и фрагменты связываются с IL-1β с высокой аффинностью, как показано константами диссоциации, представленными в настоящем описании. Константы аффинности, характеризующие аффинность антител в отношении антигенов, могут быть константами ассоциации, измеряемыми по кинетике образования комплекса антиген-антитело. Альтернативно, аффинность связывания может быть охарактеризована константой диссоциации, которая является обратной величиной константы ассоциации. Полагают, что термин KD, в настоящем описании, означает константу диссоциации взаимодействия антитело-антиген.
Настоящее изобретение также относится к нейтрализующим антителам или их нейтрализующим фрагментам, которые связываются с IL-1β таким образом, что они нейтрализуют биологическую активность IL-1β. Нейтрализация биологической активности IL-1β может быть оценена анализами на один или несколько индикаторов биологической активности IL-1β, таких как IL-1β-стимулируемое высвобождение IL-6 из фибробластов или других клеток человека, IL-1β-индуцируемое высвобождение IL-8 из клеток крови или IL-1β-индуцируемая пролиферация Т-хелперных клеток. Предпочтительно, IL-1β-связывающие антитела и фрагменты настоящего изобретения нейтрализуют биологическую активность IL-1β, связанную с функцией передачи сигнала IL-1-рецептора типа I (IL-1-1RI), связанного IL-1β.
Как правило, нейтрализующие антитела и фрагменты настоящего изобретения могут нейтрализовать биологическую активность IL-1β, независимо от того, является ли связывание IL-1β с рецептором IL-1 типа I блокированным. Более предпочтительно, IL-1β-связывающие антитела или их IL-1β-связывающие фрагменты нейтрализуют биологическую активность IL-1β связыванием с IL-1β, по существу без предотвращения связывания, связанного IL-1β с IL-1-рецептором типа I. Потенциальным преимуществом таких антител и фрагментов является то, что они могут связывать и нейтрализовать IL-1β, все еще давая возможность IL-1β связываться с IL-1RI. Это может приводить к эффективному снижению биологической активности IL-1α, а также биологической активности IL-1β, поскольку имеется меньше несвязанных сайтов IL-1RI в отношении IL-1α для связывания с ним. Таким образом, IL-1β-связывающие антитела и фрагменты настоящего изобретения можно использовать в способах, в которых желательна нейтрализация биологической активности IL-1 in vitro и in vivo.
Данные антитела или фрагменты могут быть нейтрализующими антителами или фрагментами, которые специфически связываются с эпитопом IL-1β, который влияет на биологическую активность IL-1β. Антитела или их фрагменты могут связываться с чувствительным к нейтрализации эпитопом IL-1β. При связывании чувствительного к нейтрализации эпитопа IL-1β одним из настоящих антител или фрагментов результатом является потеря биологической активности IL-1β, содержащего данный эпитоп.
В некоторых вариантах осуществления IL-1β-связывающие антитела или IL-1β-связывающие фрагменты могут иметь IC50 для ингибирования IL-1β-стимулированного высвобождения IL-1β из клеток крови менее чем 50 пМ, альтернативно, приблизительно 25 пМ или менее, альтернативно, приблизительно 10 пМ или менее, альтернативно, приблизительно 25 пМ или менее, альтернативно, приблизительно 10 пМ или менее, альтернативно, приблизительно 2 пМ или менее. IC50 для ингибирования IL-1β-стимулированного высвобождения IL-1β из клеток крови является концентрацией, необходимой для ингибирования 50% IL-8, высвобождаемого IL-1β-стимуляцией клеток крови. Примеры антител включают антитело, обозначенное в настоящем описании как АВ7.
Настоящее изобретение также относится к IL-1β-связывающему антителу или его IL-1β-связывающему фрагменту, содержащему измененную аминокислотную последовательность, где измененная аминокислотная последовательность имеет одну или по меньшей мере одну замену, одно добавление или одну делецию из исходной аминокислотной последовательности, выбранной из SEQ ID NO:27 или 28 (или любой из других описанных в настоящем описании последовательностей), причем измененное антитело или измененный фрагмент обладает такой же или по существу такой же аффинностью и специфичностью связывания эпитопа, что и исходная аминокислотная последовательность. Предполагают, что одна или несколько замен, делеций или одно или несколько добавлений могут быть произведены в отношении IL-1β-связывающих антител или IL-1β-связывающих фрагментов, предоставленных в настоящем описании, таких как антитела или фрагменты, содержащие SEQ ID NO:28 и/или SEQ ID NO:27, при сохранении той же самой аффинности и специфичности связывания эпитопа исходного антитела или фрагмента. Например, настоящее изобретение относится к IL-1β-связывающему антителу или его IL-1β-связывающему фрагменту, содержащему измененную аминокислотную последовательность, где измененная аминокислотная последовательность имеет одну или по меньшей мере одну замену, добавление или делецию из исходной аминокислотной последовательности, содержащей SEQ ID NO:8 (или любая из других, описанных в настоящем описании последовательностей, может быть использована в качестве исходной последовательности), где измененное антитело или измененный фрагмент обладает такой же или по существу такой же аффинностью и специфичностью связывания эпитопа, что и исходная аминокислотная последовательность SEQ ID NO:8 (или конкретная последовательность, которая используется в качестве исходной аминокислотной последовательности). Под фразой «по существу такая же» аффинность имеется в виду, что аффинность или константа диссоциации, определенные, как описано в настоящем описании, не увеличивается или не уменьшается более чем свойственная анализу вариация в анализе на антитело или фрагмент, содержащие SEQ ID NO:28 или 27, такой как вариация, наблюдаемая при проведении данного анализа три или более раз в независимых временных точках. Под фразой «по существу такая же» специфичность эпитопа имеется в виду, что связывание аминокислотной последовательности, содержащей эпитоп, как определено в настоящем описании, находится в пределах присущей анализу вариации в анализе на антитело или фрагмент, содержащие SEQ ID NO:28 или 27, такой как вариация, наблюдаемая при проведении анализа три или более раз в независимых временных точках. При сравнении с антителом или фрагментом, содержащим SEQ ID NO:28 или 27, имеется в виду, что такое сравнение должно проводиться между измененной аминокислотной последовательностью и исходной аминокислотной последовательностью, из которой произведена одна или несколько замен, делеций или добавлений, причем такая исходная последовательность идентична во всех других аминокислотах.
Антитела, гуманизированные антитела и сконструированные антитела человека
IL-1β-связывающие антитела настоящего изобретения могут быть предоставлены в виде поликлональных антител, моноклональных антител (mAb), рекомбинантных антител, химерных антител, CDR-привитых антител, полностью человеческих антител, одноцепочечных антител и/или биспецифических антител, а также фрагментов, включая их варианты и производные, полученные известными способами, включающими, но не ограничивающимися ими, ферментативное расщепление, пептидный синтез или рекомбинантные способы.
Антитела обычно содержат два полипептида тяжелой цепи и два полипептида легкой цепи, хотя рассматриваются также однодоменные антитела, имеющие одну тяжелую цепь и одну легкую цепь, и антитела с тяжелыми цепями, лишенные легких цепей. Имеется пять типов тяжелых цепей, называемых альфа, дельта, эпсилон, гамма и мю, на основе аминокислотной последовательности константной области тяжелой цепи. Такие различные типы тяжелых цепей образуют пять классов антител IgА (включая IgА1 и IgА2), IgD, IgЕ, IgG и IgМ, соответственно, включая четыре подкласса IgG, а именно IgG1, IgG2, IgG3 и IgG4. Существует также два типа легких цепей, называемых каппа (κ) или лямбда (λ), на основе аминокислотной последовательности константных доменов. Полноразмерное антитело включает в себя константный домен и вариабельный домен. Константный домен не должен присутствовать в антигенсвязывающем фрагменте антитела. Антигенсвязывающие фрагменты антитела, описанного в настоящем описании, могут включать в себя фрагменты антител Fab, F(ab')2 и F(v). Как обсуждается более подробно ниже, IL-1β-связывающие фрагменты включают фрагменты антител и антигенсвязывающие полипептиды, которые будут связываться с IL-1β.
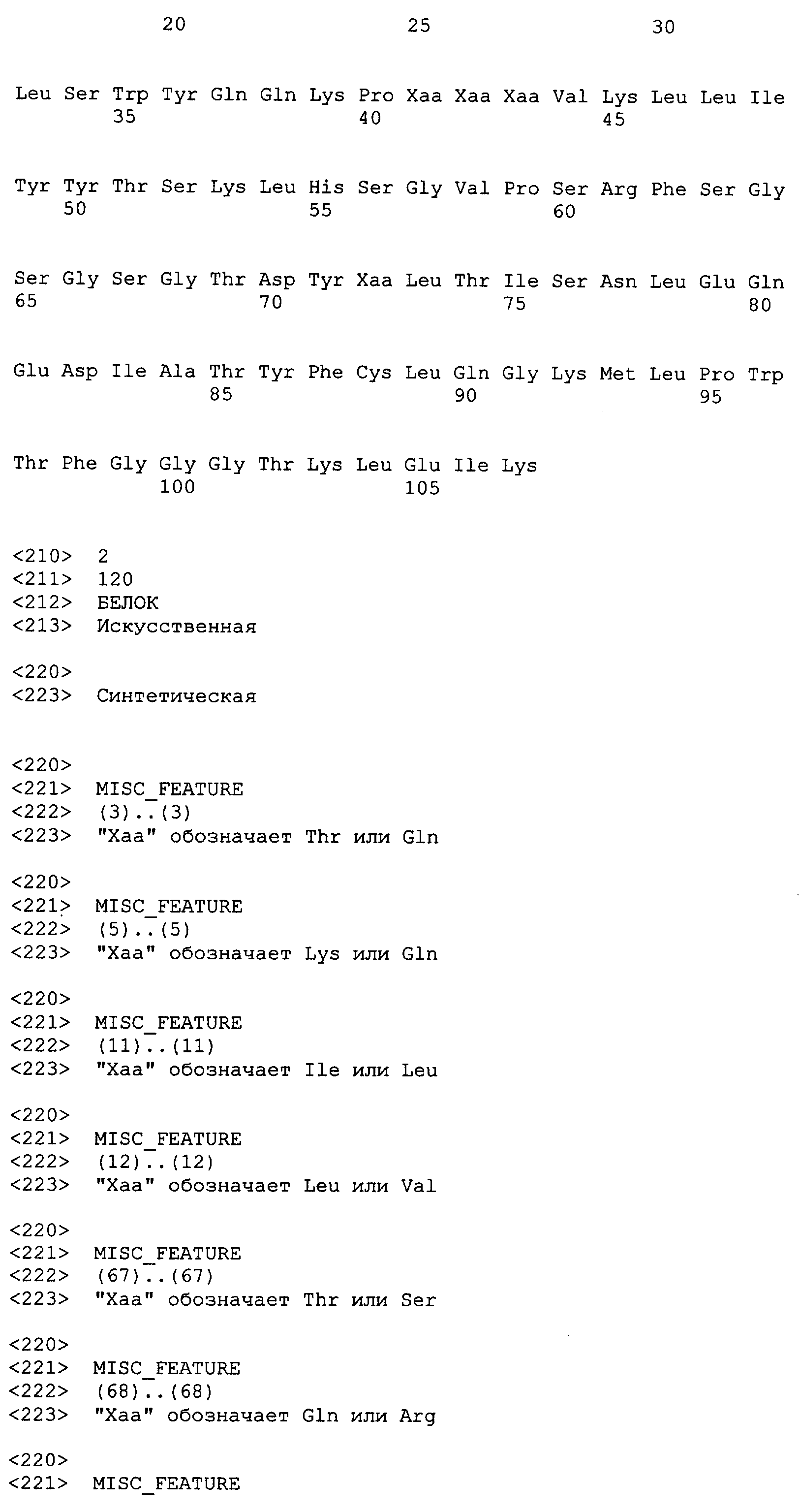
Каждая из последовательностей тяжелой цепи и легкой цепи антитела или его антигенсвязывающего фрагмента включает в себя вариабельную область с тремя определяющими комплементарность областями (CDR), а также не-CDR каркасными областями (FR). Термины «тяжелая цепь» и «легкая цепь» в настоящем описании означают вариабельную область тяжелой цепи и вариабельную область легкой цепи, соответственно, если не указано иное. CDR тяжелой цепи обозначены в настоящем описании как CDR-Н1, CDR-Н2 и CDR-Н3. CDR легкой цепи обозначены в настоящем описании как CDR-L1, CDR-L2 и CDR-L3. Вариабельные области и CDR в последовательности антитела могут быть идентифицированы (i) в соответствии с общими правилами, которые были разработаны в данной области, или (b) сопоставлением таких последовательностей с базой данных известных вариабельных областей. Способы идентификации указанных областей описаны Kontermann and Dubel, eds., Antibody Engineering, Springer, New York, NY, 2001 и Dinarello et al., Current Protocols in Immunology, John Wiley and Sons Inc., Hoboken, NJ, 2000. Базы данных последовательностей антител описаны и могут быть доступны через базу данных “The Kabatman” в (поддерживаемую А.С. Martin в Depаrtment of Biochemistry & Molecular Biology University College London, England) и VBASE2 в http://www.vbase2.org, как описано Retter et al., Nucl. Acids Res., 33(Database issue): D671-D674 (2005). Веб-сайт базы данных “Kabatman” также включает общие правила thumb для идентификации CDR. Термин “CDR” в настоящем описании имеет значение, определенное Kabat et al., Sequences of Immunological Interest, 5th ed., U.S. Department of Health and Human Services, 1991, если не указано иное.
Настоящее изобретение относится к IL-1β-связывающим антителам, которые содержат две полноразмерные тяжелые цепи и две полноразмерные легкие цепи. Альтернативно, IL-1β-связывающие антитела могут быть конструкциями, такими как одноцепочечные антитела или «мини» антитела, которые сохраняют активность связывания с IL-1β. Такие конструкции могут быть получены способами, известными в данной области, такими как, например, ПЦР-опосредованные клонирование и сборка одноцепочечных антител для экспрессии в E. coli (как описано в Antibody Engineering, The practical approach series, J. McCafferty, H.R. Hoogenboom, and D.J. Chiswell, editors, Oxford University Press, 1996). В таком типе конструкции вариабельные части тяжелых и легких цепей молекулы антитела ПЦР-амплифицируют из кДНК. Затем полученные ампликоны собирают, например, на второй стадии ПЦР, посредством линкерной ДНК, которая кодирует гибкий белковый линкер, состоящий из аминокислот Gly и Ser. Данный линкер дает возможность вариабельным частям тяжелой и легкой цепей укладываться таким образом, что восстанавливается антигенсвязывающий карман, и антиген связывается с аффинностью, часто сравнимой с аффинностью исходной полноразмерной димерной молекулы иммуноглобулина.
IL-1β-связывающие антитела и фрагменты настоящего изобретения включают варианты антител, фрагментов и последовательностей, описанных в настоящем описании в качестве примеров. Варианты включают пептиды и полипептиды, содержащие одну или несколько аминокислотных замен, делеций и/или добавлений, которые обладают такой же или по существу такой же аффинностью и специфичностью связывания эпитопа, что и одно или несколько антител, фрагментов и последовательностей, приведенных в настоящем описании в качестве примеров. Таким образом, варианты включают пептиды и полипептиды, содержащие одну или несколько аминокислотных замен, делеций и/или добавлений к антителам, фрагментам и последовательностям, описанным в настоящем описании в качестве примеров, где такие замены, делеции и/или добавления не вызывают существенных изменений в отношении аффинности и специфичности связывания эпитопа. Например, вариант антитела или фрагмента может быть получен из одного или нескольких изменений антитела или фрагмента, содержащего одну или несколько из аминокислотных последовательностей SEQ ID NO:1-35 или 42-57, где измененные антитело или его фрагмент обладают такой же или по существу такой же аффинностью и специфичностью связывания эпитопа, что и исходная последовательность. Варианты могут быть природными, такими как аллельные или сплайсинговые варианты, или могут быть искусственно сконструированы. Варианты могут быть получены из соответствующих молекул нуклеиновых кислот, кодирующих указанные варианты. Варианты настоящих антител и IL-1β-связывающих фрагментов могут иметь изменения в аминокислотных последовательностях легкой и/или тяжелой цепи, которые являются природными или введены конструированием in vitro нативных последовательностей с использованием способов рекомбинантных ДНК. Природные варианты включают «соматические» варианты, которые генерируются in vivo в соответствующих нуклеотидных последовательностях зародышевой линии во время генерирования ответной реакции в виде антител на чужеродный антиген.
Варианты IL-1β-связывающих антител или их IL-1β-связывающих фрагментов могут быть получены способами мутагенеза. Например, аминокислотные изменения могут быть введены случайным образом через область кодирования антитела, и полученные варианты могут быть подвергнуты скринингу на аффинность связывания в отношении IL-1β или на другое свойство. Альтернативно, аминокислотные изменения могут быть введены в выбранные области IL-1β-антитела, такие как CDR легкой и/или тяжелой цепи, и/или в каркасные области, и полученные антитела могут быть подвергнуты скринингу на связывание с IL-1β или на некоторую другую активность. Аминокислотные изменения включают одну или несколько аминокислотных замен в CDR, в диапазоне от различия в единственную аминокислоту до введения множественных пермутаций аминокислот в пределах конкретного CDR, такого как CDR3. В другом способе вклад каждого остатка в пределах CDR в связывание с IL-1β может быть оценен заменой по меньшей мере одного остатка в CDR аланином. Lewis et al. (1995), Mol. Immunol. 32: 1065-72. Остатки, которые не являются оптимальными для связывания с IL-1β, могут быть затем изменены для определения более оптимальной последовательности. В настоящее изобретение включены также варианты генерируемых инсерцией аминокислот для увеличения размера CDR, такой как CDR3. Например, большинство последовательностей CDR3 легкой цепи имеют длину в девять аминокислот. Последовательности легкой цепи, которые являются более короткими, чем девять остатков, могут быть оптимизированы в отношении связывания с IL-1β инсерцией подходящих аминокислот для увеличения длины CDR.
Варианты могут быть также получены «перетасовкой цепи» легкой и тяжелой цепей. (Marks et al. (1992), Biotechnology 10: 779-83. Единственная легкая (или тяжелая) цепь может быть комбинирована с библиотекой, имеющей репертуар тяжелых (или легких) цепей, и полученная популяция подвергнута скринингу на желаемую активность, например на связывание с IL-1β. Это делает возможным скрининг большей пробы различных тяжелых (или легких) цепей в комбинации с единственной легкой (или тяжелой) цепью, чем это возможно с библиотеками, содержащими репертуары как тяжелых, так и легких цепей.
IL-1β-связывающие антитела и фрагменты настоящего изобретения включают производные антител, фрагментов и последовательностей, приведенных в настоящем описании в качестве примеров. Производные включают полипептиды или пептиды или их варианты, фрагменты или производные, которые были химически модифицированы. Примеры включают ковалентное присоединение одного или нескольких полимеров, таких как водорастворимые полимеры, N-связанных или О-связанных углеводов, сахаров, фосфатов и/или других подобных молекул. Производные модифицированы таким образом, что отличаются от природных или исходных пептидов или полипептидов либо по типу, либо по местоположению присоединенных молекул. Производные дополнительно включают делецию одной или нескольких химических групп, которые природно присутствуют на данном пептиде или полипептиде.
IL-1β-связывающие антитела и фрагменты настоящего изобретения могут быть биспецифическими. Биспецифические антитела или фрагменты могут иметь несколько конфигураций. Например, биспецифические антитела могут быть похожими на одиночные антитела (или фрагменты антител), но иметь два разных сайта связывания антигена (вариабельные области). Биспецифические антитела могут быть получены химическими способами (Kranz et al. (1981), Proc. Natl. Acad. Sci. USA, 78: 5807), способами «полидомы» (патент США № 4474893) или способами рекомбинантных ДНК. Биспецифические антитела настоящего изобретения могут обладать специфичностью связывания в отношении по меньшей мере двух различных эпитопов, по меньшей мере одним из которых является эпитоп IL-1β. IL-1β-связывающие антитела и фрагменты также могут представлять собой гетероантитела. Гетероантитела являются двумя или несколькими антителами или антигенсвязывающими фрагментами (Fab), связанными вместе, причем каждое антитело или фрагмент обладает отличающейся специфичностью.
Способы создания рекомбинантных версий ДНК антигенсвязывающих областей молекул антител, которые дают возможность избежать генерирования моноклональных антител, обсуждаются для IL-1β-связывающих антител и фрагментов настоящего изобретения. ДНК клонируют в бактериальную систему экспрессии. В одном примере такого способа, подходящего для применения на практике настоящего изобретения, используют векторную систему бактериофага лямбда, имеющую лидерную последовательность, которая заставляет экспрессируемый Fab-белок мигрировать в периплазматическое пространство (между мембраной бактериальной клетки и клеточной стенкой) или секретироваться. Можно быстро генерировать и подвергнуть скринингу большие количества функциональных Fab-фрагментов на фрагменты, которые связываются с IL-1β. Такие IL-1β-связывающие агенты (Fab-фрагменты со специфичностью в отношении полипептида IL-1β) специально включены в IL-1β-связывающие антитела и фрагменты настоящего изобретения.
Настоящие IL-1β-связывающие антитела и фрагменты могут быть гуманизированными или сконструированными человеком антителами. В настоящем описании гуманизированное антитело или его антигенсвязывающий фрагмент представляет собой рекомбинантный полипептид, который содержит часть антигенсвязывающего сайта из антитела не человека и часть каркасной и/или константной области антитела человека. Сконструированное антитело или фрагмент антитела человека является антителом не человека (например, мыши), которое было сконструировано модификацией (например, делецией, инсертированием или заменой) аминокислот в специфических положениях таким образом, чтобы уменьшить или элиминировать любую детектируемую иммуногенность данного модифицированного антитела у человека.
Гуманизированные антитела включают в себя химерные антитела и CDR-привитые антитела. Химерные антитела являются антителами, которые содержат вариабельную область не человека, связанную с константной областью человека. Таким образом, в химерных антителах вариабельная область является в большинстве случаев вариабельной областью не человека, и константная область является константной областью человека. Химерные антитела и способы их получения описаны Morrison, et al., Proc. Natl. Acad. Sci. USA, 81: 6841-6855 (1984), Boulianne, et al., Nature, 312: 643-646 (1984), и публикации заявки PCT WO 86/01533. Хотя они могут быть менее иммуногенными, чем моноклональное антитело мыши, введение химерных антител было ассоциировано с иммунными реакциями человека (НАМА) на часть антитела не человека. Химерные антитела могут быть также получены сплайсингом генов из молекулы антитела мыши подходящей антигенсвязывающей специфичности вместе с генами из молекулы антитела человека подходящей биологической активности, такой как способность активировать комплемент человека и опосредовать ADCC. Morrison, et al. (1984), Proc. Natl. Acad. Sci. USA, 81: 6841, Neuberger et al., Nature, 312: 604. Одним примером является замена Fc-области Fc-областью другого изотипа.
CDR-привитые антитела являются антителами, которые включают в себя CDR из «донорского» антитела не человека, связанный с каркасной областью из «реципиентного» антитела человека. Обычно CDR-привитые антитела содержат больше последовательностей антитела человека, чем химерные антитела, так как они содержат как последовательности константной области, так и последовательности вариабельной области (каркасные области) антител человека. Так, например, CDR-привитое антитело настоящего изобретения может содержать тяжелую цепь, которая содержит смежную аминокислотную последовательность (например, приблизительно 5 или более, 10 или более или даже 15 или более смежных аминокислотных остатков) каркасной области антитела человека (например, FR-1, FR-2 или FR-3 антитела человека) или, необязательно, большую часть или всю полную каркасную область антитела человека. CDR-привитые антитела и способы их получения описаны, например, Jones et al., Nature, 321: 522-525 (1986), Riechmann et al., Nature, 332: 323-327 (1988) и Verhoeyen et al., Science, 239: 1534-1536 (1988)). Способы, которые могут быть использованы для получения гуманизированных антител, описаны также в патентах США 4816567, 5721367, 5837243 и 6180377. Считается, что CDR-привитые антитела с меньшей вероятностью, чем химерные антитела, индуцируют иммунную реакцию против частей антитела не человека. Однако сообщалось, что каркасные последовательности донорских антител необходимы для аффинности и/или специфичности связывания донорского антитела, предположительно вследствие того, что указанные каркасные последовательности влияют на укладку антигенсвязывающей части донорского антитела. Таким образом, при прививке (трансплантации) CDR-последовательностей антитела не человека на неизмененные каркасные последовательности антитела человека, полученное CDR-привитое антитело может проявлять, в некоторых случаях, потерю авидности связывания в отношении исходного донорского антитела не человека. См., например, Riechmann et al., Nature, 332: 323-327 (1988) и Verhoeyen et al., Science, 239: 1534-1536 (1988).
Сконструированные антитела человека включают «облицованные» антитела и антитела, полученные с использованием технологии HUMAN ENGINEERING™ (XOMA (US) LLC, Berkeley, CA). Технология HUMAN ENGINEERING™ является коммерчески доступной и включает изменение антитела или фрагмента антитела не человека, такого как мышиное или химерное антитело или фрагмент антитела, введением специфических изменений в аминокислотную последовательность данного антитела таким образом, чтобы получить модифицированное антитело с уменьшенной иммуногенностью у человека, которое, тем не менее, сохраняет желаемые свойства связывания исходных антител не человека. Обычно данный способ включает классификацию аминокислотных остатков антитела не человека (например, мыши) как остатки «низкого риска», «умеренного риска» или «высокого риска». Такую классификацию осуществляют с использованием расчета отношения глобальный риск/глобальная выгода, которое оценивает предсказанные преимущества получения конкретной замены (например, в отношении иммуногенности у людей) по сравнению с риском, что такая замена будет влиять на укладку и/или антигенсвязывающие свойства полученного антитела. Таким образом, положением низкого риска является положение, для которого предсказано, что замена является предпочтительной, так как предсказано, что она будет уменьшать иммуногенность без значимого влияния на свойства связывания антигена. Положение умеренного риска является положением, для которого предсказано, что замена будет уменьшать иммуногенность, но с большей вероятностью будет влиять на укладку и/или связывание антигена. Положения высокого риска содержат остатки, которые с наибольшей вероятностью участвуют в правильной укладке или связывании антигена. Обычно положения низкого риска в антителе не человека заменяют остатками антитела человека, положения высокого риска редко заменяют и гуманизирующие замены выполняют иногда в положениях умеренного риска, хотя и не беспорядочно. Положения с пролинами в последовательности вариабельной области антитела не человека обычно классифицируют как по меньшей мере умеренные положения риска.
Конкретный аминокислотный остаток для замены в конкретном положении низкого риска или умеренного риска последовательности антитела человека (например, мыши) может быть выбран сопоставлением аминокислотной последовательности вариабельных областей антитела не человека с соответствующей областью специфической или консенсусной последовательности антитела человека. Аминокислотными остатками в положениях низкого или умеренного риска в последовательности не человека могут быть заменены соответствующие остатки в последовательности антитела человека в соответствии с таким сопоставлением. Способы получения сконструированных белков человека описаны более подробно Studnicka et al., Protein Engineering, 7: 805-814, патентах США 5766886, 5770196, 5821123 и 5869619 и публикации заявки PCT WO 93/11794.
«Облицованные» антитела являются антителами не человека или гуманизированными антителами (например, химерными или CDR-привитыми антителами), которые были сконструированы для замены определенных растворитель-экспонированных аминокислотных остатков таким образом, чтобы дополнительно уменьшить их иммуногенность или усилить их функцию. Поскольку полагают, что поверхностные остатки химерного антитела имеют меньшую вероятность влияния на правильную укладку антитела и большую вероятность индукции иммунной реакции, облицовка химерного антитела может включать, например, идентификацию растворитель-экспонированных остатков в каркасной области не человека химерного антитела и замену по меньшей мере одного из них остатками из каркасной области антитела человека. Облицовка может быть выполнена любым подходящим способом конструирования, включая использование технологии HUMAN ENGINEERING™.
В другом подходе восстановление авидности связывания может быть достигнуто «дегуманизацией» CDR-привитого антитела. Дегуманизация может включать возвращение остатков из каркасных областей донорского антитела CDR-привитому антителу, с восстановлением, таким образом, правильной укладки. Сходная «дегуманизация» может быть достигнута (i) включением частей «донорской» каркасной области в антитело «реципиента» или (ii) прививкой частей каркасной области «донорского» антитела в реципиентное антитело (вместе с привитыми донорскими CDR).
В отношении дополнительного обсуждения антител, гуманизированных антител, сконструированных антител человека и способов их получения см. Kontermann and Dubel, eds., Antibody Engineering, New York, NY, 2001.
Примеры гуманизированных или сконструированных антител человека включают антитела IgG, IgМ, IgЕ, IgА и IgD. Настоящие антитела могут быть антителами любого класса (IgG, IgА, IgМ, IgЕ и IgD и т.д.) или изотипа и могут содержать легкую цепь каппа или лямбда. Например, антитело человека может содержать тяжелую цепь IgG или определенный фрагмент, например, по меньшей мере один из изотипов, IgG, IgG2, IgG3 или IgG4. В качестве другого примера, настоящие антитела или фрагменты могут содержать тяжелую цепь IgG1 и легкую цепь IgG1.
Антитела и фрагменты настоящего изобретения могут быть антителами человека, такими как антитела, которые связывают полипептиды с IL-1β и кодируются последовательностями нуклеиновых кислот, которые являются природными соматическими вариантами последовательности нуклеиновой кислоты иммуноглобулина зародышевой линии человека, и их фрагменты, синтетические варианты, производные и слияния. Такие антитела могут быть получены любым способом, известным в данной области, таким как способ с использованием трансгенных млекопитающих (таких как трансгенные мыши), в которых репертуар нативного иммуноглобулина заменен V-генами человека в хромосоме млекопитающего. Такие млекопитающие, по-видимому, несут рекомбинацию VDJ и соматическую гипермутацию генов антител зародышевой линии человека в нормальном виде, продуцируя таким образом высокоаффинные антитела с полностью человеческими последовательностями.
Антитела человека также могут быть генерированы посредством in vitro скрининга библиотек антител фагового дисплея. См. Hoogenboom et al., J. Mol. Biol. 227: 381; и Marks et al. (1991), J. Mol. Biol. 222:: 581. Различные антитело-содержащие библиотеки фагового дисплея были описаны и могут быть легко получены. Библиотеки могут содержать разнообразие последовательностей антител человека, таких как фрагменты Fab, Fv и scFv, которые могут быть подвергнуты скринингу против подходящей мишени. Библиотеки фагового дисплея могут содержать пептиды и белки, отличные от антител, которые могут быть подвергнуты скринингу для идентификации селективных агентов связывания IL-1β.
IL-1β-связывающие антитела и фрагменты могут содержать одну или несколько частей, которые не связываются с IL-1β, но вместо этого ответственны за другие функции, такие как полупериод циркуляции, прямое цитотоксическое действие, детектируемое мечение или активация каскада реакций эндогенного комплемента реципиента или эндогенная клеточная цитотоксичность. Антитела или фрагменты настоящего изобретения могут содержать всю или часть константной области антитела и могут быть антителами любого изотипа, включая IgА (например, IgА1 или IgА2), IgD, IgЕ, IgG (например, IgG1, IgG2, IgG3 или IgG4) или IgМ. Кроме того или вместо этого, содержащие константную область антигенсвязывающие соединения настоящего изобретения могут содержать эпитопную метку, эпитоп рецептора реутилизации, метку для диагностических целей или для целей очистки или цитотоксическую метку, такую как радионуклид или токсин.
Константная область (когда она присутствует) антител и фрагментов настоящего изобретения может быть типа γ1, γ2, γ3, γ4, µ, β2 или δ или ε, предпочтительно γ типа, более предпочтительно y типа, тогда как константная часть легкой цепи человека может быть типа κ или λ (включая подтипы λ1, λ2 и λ3), но предпочтительно является κ-типа.
Варианты также включают антитела или фрагменты, содержащие модифицированную Fc-область, где модифицированная Fc-область содержит по меньшей мере модификацию одной аминокислоты относительно Fc-области дикого типа. Вариантная Fc-область может быть сконструирована относительно сравнимой молекулы, содержащей Fc-область дикого типа, таким образом, что она связывается с Fc-рецепторами с большей или меньшей аффинностью.
Например, настоящие IL-1β-связывающие антитела и фрагменты могут содержать модифицированную Fc-область. Fc-областью называют природные или синтетические полипептиды, гомологичные С-концевому домену IgG, которые получают после расщепления папаином IgG. Fc IgG имеет молекулярную массу приблизительно 50 кД. В настоящих антителах и фрагментах может быть использована полная Fc-область или только увеличивающая полупериод существования часть. Кроме того, приемлемы многие модификации в аминокислотной последовательности, так как природная активность не во всех случаях является необходимой или желательной.
Fc-область может быть мутирована, если желательно, для ингибирования ее способности фиксировать комплемент и связывать Fc-рецептор с высокой активностью. Для мышиного Fc IgG замена остатками Ala остатков Glu 318, Lys 320 и Lys 322 делает данный белок неспособным управлять ADCC. Замена остатком Glu Leu 235 ингибирует способность белка связывать Fc-рецептор с высокой активностью. Различные мутации в отношении IgG также известны (см., например, Morrison et al., 1994, The Immunologist 2: 119 124 и Brekke et al., 1994, The Immunologist 2: 125).
В некоторых вариантах осуществления предоставлены антитела или фрагменты настоящего изобретения с модифицированной Fc-областью, где природная Fc-область модифицирована для увеличения полупериода существования настоящего антитела или фрагмента в биологическом окружении, например, полупериода существования в сыворотке или полупериода существования, измеренного при помощи анализа in vitro. Способы изменения исходной формы Fc-области IgG также описаны в патенте США № 6998253.
В некоторых вариантах осуществления может быть желательным модифицировать антитело или фрагмент для увеличения его полупериода существования в сыворотке, например, добавлением молекул, таких как PEG или другие водорастворимые полимеры, включая полисахаридные полимеры, к фрагментам антител для увеличения полупериода существования. Это может быть достигнуто, например, включением эпитопа связывания рецептора реутилизации в данный фрагмент антитела (например, мутацией подходящей области во фрагменте антитела или включением эпитопа в пептидную метку, которую затем сливают с фрагментом антитела на любом конце или в середине, например, синтезом ДНК или пептидным синтезом) (см. международную публикацию № WO96/32478). Эпитопом связывания рецептора реутилизации называют эпитоп Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), которая ответственна за увеличение полупериода существования в сыворотке молекулы IgG.
Эпитоп связывания рецептора реутилизации может включать в себя область, в которой любой один или несколько аминокислотных остатков из одной или двух петель Fc-домена перенесены в аналогичное положение фрагмента антитела. Даже более предпочтительно, перенесены три или более остатков из одной или двух петель Fc-домена. Еще более предпочтительно, эпитоп берут из СН2-домена Fc-области (например, IgG) и переносят в СН1-, СН3- или VH-область или более чем в одну такую область данного антитела. Альтернативно, эпитоп берут из СН2-домена Fc-области и переносят в СL-область, или VL-область, или в обе данного фрагмента антитела. См. также международные публикации WO 97/34631 и WO 96/32478, в которых описаны Fc-варианты и их взаимодействие с рецептором реутилизации.
Мутации остатков в сайтах связывания Fc-рецептора могут приводить к измененной функции эффектора, такой как измененная активность ADCC или CDC, или измененный полупериод существования. Потенциальные мутации включают инсерцию, делецию или замену одного или нескольких остатков, включая замену аланином, консервативную замену, неконсервативную замену или замену соответствующим аминокислотным остатком в том же самом положении из другого подкласса IgG (например, замену остатка IgG1 соответствующим остатком IgG2 в данном положении). Например, сообщалось, что мутация серина в положении аминокислоты 241 в IgG4 пролином (обнаруживаемый в данном положении в IgG1 и IgG2) приводила к получению гомогенного антитела, а также увеличению полупериода существования в сыворотке и улучшению распределения в ткани по сравнению с исходным химерным IgG4 (Angal et al., Mol Immunol. 30:105-8, 1993).
Предпочтительно, антитело или фрагмент антитела настоящего изобретения не реагирует перекрестно с любой мишенью, иной, чем IL-1β. Например, настоящие антитела и фрагменты предпочтительно детектируемо не связываются с IL-1α.
IL-1β-связывающее антитело или фрагмент антитела
Фрагменты антител являются частями интактного полноразмерного антитела, такими как антигенсвязывающая или вариабельная область интактного антитела. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела; одноцепочечные молекулы антител (например, scFv); мультиспецифические фрагменты антител, такие как биспецифические, триспецифические и мультиспецифические антитела (например, диатела, триатела, тетратела); минитела; хелатообразующие рекомбинантные антитела; тритела или битела; интратела; нанотела; малые модулярные иммунофармацевтические соединения (SMIP), слитые белки домена связывания иммуноглобулина; «верблюдизированные» антитела; VHH-содержащие антитела и любые другие полипептиды, образованные из фрагментов антител.
Настоящее изобретение относится к IL-1β-связывающему антителу или его IL-1β-связывающему фрагменту, содержащим SEQ ID NO:2. Фиг.1 иллюстрирует аминокислотную последовательность SEQ ID NO:2. Предпочтительно, настоящее антитело или фрагмент антитела содержит аминокислотную последовательность SEQ ID NO:21 и более предпочтительно содержит аминокислотную последовательность SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7 или SEQ ID NO:8. Антитела настоящего изобретения могут также содержать аминокислотную последовательность SEQ ID NO:12 или SEQ ID NO:13 и предпочтительно содержат SEQ ID NO:14 или SEQ ID NO:15. Конкретно, настоящее антитело или фрагмент антитела содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи, и вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO:2 (например, содержит аминокислотную последовательность SEQ ID NO:4-8, 12-15 или 21). Легкая цепь данного антитела предпочтительно содержит последовательность SEQ ID NO:1, по существу состоит или состоит из аминокислотной последовательности SEQ ID NO:1. Так, например, легкая цепь данного антитела может содержать аминокислотную последовательность SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO:11 или по существу состоит или состоит из аминокислотной последовательности SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO:11. Предпочтительным также является антитело или фрагмент антитела (например, вариабельная область тяжелой цепи антитела или фрагмента антитела, которая содержит, по существу состоит или состоит из аминокислотной последовательности SEQ ID NO:23 или SEQ ID NO:24 (например, SEQ ID NO:25 или SEQ ID NO:26).
Настоящее изобретение относится к IL-1β-связывающему антителу или его IL-1β-связывающему фрагменту, содержащим вариабельную область тяжелой цепи, содержащую одну из аминокислотных последовательностей SEQ ID NO:2, 23 или 24, альтернативно, одну из аминокислотных последовательностей SEQ ID NO:12, 13, 21, 23 или 24, или, альтернативно, аминокислотную последовательность SEQ ID NO: 12, 13 или 21, или, альтернативно, аминокислотную последовательность SEQ ID NO:13 или 21, или, альтернативно, аминокислотную последовательность SEQ ID NO:8, 14 или 15, или, альтернативно, аминокислотную последовательность SEQ ID NO:8 или 15. Конкретно, данное антитело или фрагмент антитела содержит вариабельную область легкой цепи, предпочтительно содержащую аминокислотную последовательность SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO:11. В качестве одного примера, предпочтительное антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:8, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:11.
Настоящее изобретение также относится к IL-1β-связывающему антителу или его IL-1β-связывающему фрагменту, содержащим одну из аминокислотных последовательностей SEQ ID NO:28. Предпочтительно, данное антитело или его фрагмент содержит одну из аминокислотных последовательностей SEQ ID NO:27.
Настоящее изобретение также относится к IL-1β-связывающему антителу или его IL-1β-связывающему фрагменту, который содержит, по существу состоит или состоит из SEQ ID NO:29. Предпочтительно, данное антитело или фрагмент антитела содержит, по существу состоит или состоит из аминокислотной последовательности SEQ ID NO:31-35, или, альтернативно, аминокислотной последовательности SEQ ID NO:31, 32 или 33, или, альтернативно, аминокислотной последовательности SEQ ID NO:32 или 33. Предпочтительно, данное антитело или фрагмент антитела дополнительно содержит вариабельную область легкой цепи, содержащую одну из аминокислотных последовательностей SEQ ID NO:27, альтернативно, одну из аминокислотных последовательностей SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO:11.
На фиг.2, 3 и 4 представлены вариабельные области легкой цепи примеров антител настоящего изобретения, последовательности которых соответствуют антителам, обозначенным в настоящем описании как АВ1, АВ2, АВ3, АВ4, АВ5, АВ5.1, АВ5.2, АВ5.3 и АВ5.4. Последовательности АВ5.1, АВ5.2, АВ5.3 и АВ5.4 содержат вариабельные положения, обозначенные как Х1 и Х2 в области CDR3 тяжелой цепи. Такие вариабельные положения могут быть в любой из указанных аминокислот. Предпочтительно, Х1 и Х2 являются, соответственно, аланином и аргинином, валином и аргинином, фенилаланином и аргинином, лизином и лизином или аспарагином и аргинином.
АВ5.1 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:12, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:10. АВ5.2 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:13, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:11. АВ5.3 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:10. АВ5.4 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:24, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:11.
Настоящее изобретение относится к IL-1β-связывающим фрагментам антител, которые содержат любые из предыдущих последовательностей тяжелой или легкой цепи и которые связывают IL-1β. Термин «фрагменты» в настоящем описании относится к любым 3 или более смежным аминокислотам (например, 4 или более, 5 или более, 6 или более, 8 или более или даже 10 или более смежным аминокислотам) данного антитела и включает фрагменты Fab, Fab', F(ab')2 и F(v) или отдельные вариабельные области легкой или тяжелой цепи или их часть. IL-1β-связывающие фрагменты включают, например, Fab, Fab', F(ab')2, Fv и scFv. Такие фрагменты лишены Fc-фрагмента интактного антитела, выводятся более быстро из кровотока и могут обладать меньшим неспецифическим связыванием с тканями, чем интактное антитело. См. Wahl et al. (1983), J. Nucl. Med., 24: 316-25. Указанные фрагменты могут быть получены из интактных антител с использованием хорошо известных способов, например, протеолитическое расщепление ферментами, такими как папаин (для получения Fab-фрагментов) или пепсин (для получения F(ab')2-фрагментов).
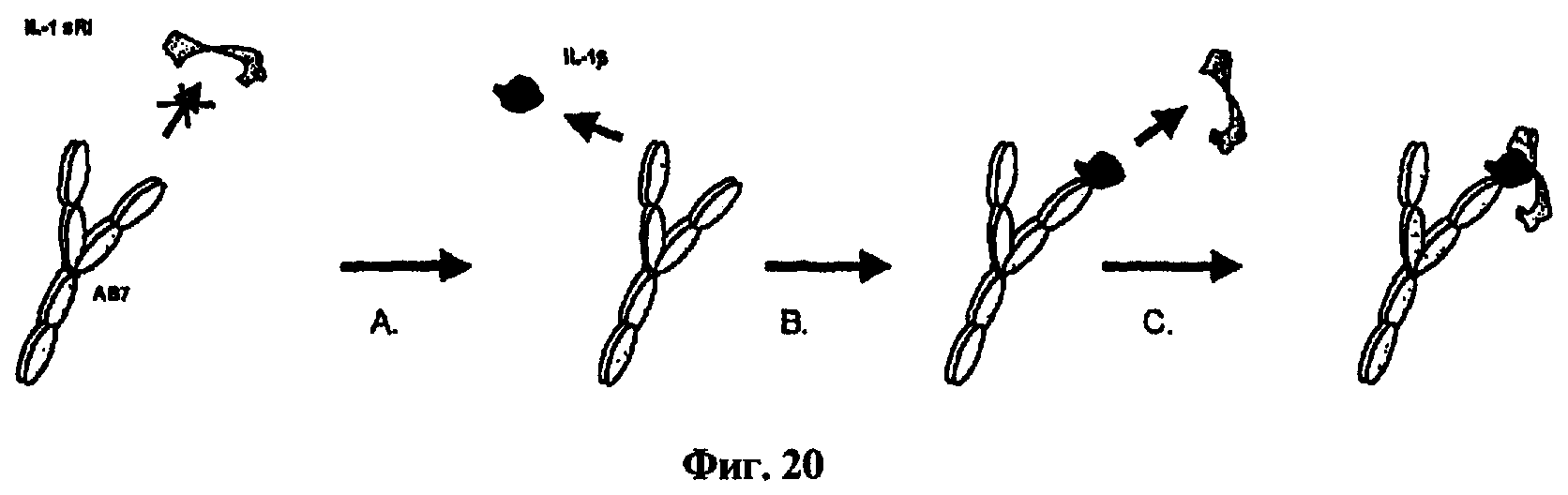
Настоящее изобретение относится к IL-1β-связывающим антителам или их IL-1β-связывающим фрагментам, которые селективно связываются с лигандом IL-1β, но дают возможность или по существу дают возможность связывания указанного связанного лиганда IL-1β с IL-1-рецептором типа I (IL-1RI) (см. пример 14 и фиг.19 и 20). В отличие от многих антител, включая несколько известных IL-1β-связывающих антител, антитела, обозначенные в настоящем описании как АВ5 и АВ7, селективно связываются с лигандом IL-1β, но они не блокируют или по существу не блокируют связывание IL-1β с IL-1RI, как показано в примере 14. Например, антитело, обозначенное в настоящем описании как АВ7, связывается с эпитопом IL-1β, но все еще дает возможность связывания IL-1β с IL-1RI. Таким образом, настоящее изобретение относится к IL-1β-связывающим антителам и их фрагментам, которые связываются с эпитопом IL-1β таким образом, что связанное антитело или фрагмент дает возможность IL-1β связываться с IL-1-рецептором (IL-1RI), и антитело или фрагмент связывается с IL-1β человека с константой диссоциации менее чем 3 пМ.
Анализы in vitro и на основе клеток хорошо описаны в данной области для применения в определении связывания IL-1β с IL-1-рецептором типа I, включая анализы, которые допускают определение в присутствии молекул (таких как антитела, антагонисты или другие ингибиторы), которые связываются с IL-1β или IL-1RI (см., например, Evans et al., (1995), J. Biol. Chem. 270:11477-11483); Vigers et al., (2000), J. Biol. Chem. 275:36927-36933; Yanofsky et al., (1996), Proc. Natl. Acad. Sci. USA 93:7381-7386; Fredericks et al., (2004), Protein Eng. Des. Sel. 17:95-106; Slack et al., (1993), J. Biol. Chem. 268:2513-2524; Smith et al., (2003), Immunity 18:87-96; Vigers et al., (1007), Nature 386:190-194; Ruggiero et al., (1997), J. Immunol. 158:3881-3887; Guo et al., (1995), J. Biol. Chem. 270:27562-27568; Svenson et al., (1995), Eur. J. Immunol. 25:2842-2850; Arend et al., (1994), J. Immunol. 153:4766-4774). Рекомбинантный IL-1-рецептор типа I, включая IL-1-рецептор типа I человека, для таких анализов легко доступен из различных коммерческих источников (см., например, R&D Systems, Sigma). IL-1-рецептор типа I может быть также экспрессирован из экспрессионной конструкции или вектора, введенных в подходящую клетку-хозяина, с использованием стандартных способов молекулярной биологии и трансфекции, известных в данной области. Затем экспрессированный IL-1-рецептор типа I может быть выделен и очищен для применения в анализах связывания или, альтернативно, использован непосредственно в ассоциированной с клеткой форме.
Например, связывание IL-1β с IL-1-рецептором типа I может быть определено иммобилизацией IL-1β-связывающего антитела, контактированием IL-1β с иммобилизованным антителом и определением, связался ли IL-1β с антителом, и контактированием растворимой формы IL-1RI с комплексом связанный IL-1β/антитело, и определением, связался ли растворимый IL-1RI с данным комплексом. Данный протокол также может включать контактирование растворимого IL-1RI с иммобилизованным антителом перед контактированием с IL-1β для подтверждения того, что растворимый IL-1RI не связывается с иммобилизованным антителом. Данный протокол может быть выполнен с использованием прибора Biacore® для кинетического анализа взаимодействий связывания. Такой протокол также может быть использован для определения, дает ли возможность или блокирует антитело или другая молекула связывание IL-1β с IL-1-рецептором типа I.
Для других анализов связывания IL-1β/IL-1RI возможность или блокирование связывания IL-1β с IL-1-рецептором типа I могут быть определены сравнением связывания IL-1β с IL-1RI в присутствии или в отсутствие IL-1β-антител или их IL-1β-связывающих фрагментов. Блокирование идентифицируют в анализе считывания в виде показателей уменьшения связывания IL-1β с IL-1-рецептором типа I в присутствии анти-IL-1β-антител или их IL-1β-связываемых фрагментов, по сравнению с контрольной пробой, которая содержит соответствующий буфер или разбавитель, но не IL-1β-связывающее антитело или его IL-1β-связывающий фрагмент. Анализ считывания может быть количественным в виде указания процентного или кратного уменьшения (уменьшения в указанное число раз) связывания вследствие присутствия данного антитела или фрагмента.
Альтернативно или дополнительно, когда IL-1β-связывающее антитело или его IL-1β-связывающий фрагмент по существу блокирует связывание IL-1β с IL-1RI, IL-1β-связывание с IL-1RI уменьшается по меньшей мере в 10 раз, альтернативно, по меньшей мере приблизительно в 20 раз, альтернативно, по меньшей мере приблизительно в 50 раз, альтернативно, по меньшей мере приблизительно в 100 раз, альтернативно, по меньшей мере приблизительно в 1000 раз, альтернативно, по меньшей мере приблизительно в 10000 раз или более, по сравнению со связыванием таких же концентраций IL-1β и IL-1RI в отсутствие данного антитела или фрагмента. В качестве другого примера, когда IL-1β-связывающее антитело или его IL-1β-связывающий фрагмент по существу дает возможность связывания IL-1β с IL-1RI, IL-1β-связывание с IL-1RI составляет по меньшей мере приблизительно 90%, альтернативно, по меньшей мере приблизительно 95%, альтернативно, по меньшей мере приблизительно 99%, альтернативно, по меньшей мере приблизительно 99,9%, альтернативно, по меньшей мере приблизительно 99,99%, альтернативно, по меньшей мере приблизительно 99,999%, альтернативно, по меньшей мере приблизительно 99,9999%, альтернативно, по существу идентично связыванию таких же концентраций IL-1β и IL-1RI в отсутствие данного антитела или фрагмента.
Настоящее изобретение относится к IL-1β-связывающим антителам или их IL-1β-связывающим фрагментам, которые связываются с таким же или по существу таким же эпитопом, что и одно или несколько антител, приведенных в настоящем описании в качестве примеров. Альтернативно или дополнительно, IL-1β-связывающие антитела или их IL-1β-связывающие фрагменты конкурируют за связывание антитела, имеющего вариабельную область легкой цепи SEQ ID NO:11 и вариабельную область тяжелой цепи SEQ ID NO:15. Альтернативно или дополнительно, настоящее изобретение относится к IL-1β-связывающим антителам и их фрагментам, которые связываются с эпитопом, находящимся в аминокислотной последовательности ESVDPKNYPKKKMEKRFVFNKIE (SEQ ID NO:36), эпитопом, с которым связываются антитела, обозначенные в настоящем описании как АВ5 и АВ7. Как обсуждается в настоящем описании, можно легко определить, связывается ли IL-1β-связывающее антитело или фрагмент с таким же эпитопом или по существу таким же эпитопом, что и одно или несколько антител, приведенных в качестве примеров, таких как, например, антитело, обозначенное в настоящем описании как АВ7, с использованием любого из нескольких известных в данной области способов.
Например, ключевые аминокислотные остатки (эпитоп), связанные IL-1β-связывающим антителом или фрагментом, могут быть определены с использованием пептидной матрицы (массива), подобно способу, описанному в примере 11. Пептидную матрицу, такую как, например, пептидная матрица PepSpot™ (JPT Peptide Technology, Berlin, Germany), в которой скан состоящих из двенадцати аминокислот пептидов, охватывающий всю аминокислотную последовательность IL-1β, причем каждый пептид перекрывается 11 аминокислотными остатками с предыдущим пептидом, синтезируют непосредственно на мембране. Затем мембрану, несущую пептиды, зондируют антителом, для которого ищут информацию в отношении связывания эпитопа, например, при концентрации 2 мкг/мл, в течение 2 часов при комнатной температуре. Связывание антитела с мембраносвязанными пептидами может быть детектировано с использованием вторичного HRP-конъюгированного козьего (или мышиного, при необходимости) антитела против иммуноглобулина человека с последующей усиленной хемилюминесценцией (ECL). Пятно (пятна) пептидов, которые соответствуют конкретным аминокислотным остаткам или последовательностям зрелого белка IL-1β и которые оцениваются как положительные в отношении связывания антитела, являются показателями эпитопа, связанного с конкретным антителом.
Альтернативно или дополнительно, могут быть выполнены эксперименты по конкуренции антител, и такие анализы хорошо известны в данной области. Например, для определения, связывается ли антитело или фрагмент с эпитопом, находящимся в пептидной последовательности, содержащей аминокислоты ESVDPKNYPKKKMEKRFVFNKIE, которая соответствует остаткам 83-105 зрелого белка IL-1β, антитело неизвестной специфичности можно сравнить с любым из антител, приведенных в качестве примеров (например, АВ7) настоящего изобретения, о которых известно, что они связывают эпитоп, находящийся в данной последовательности. Могут быть выполнены конкурентные анализы связывания, например, с использованием прибора Biacore® для кинетического анализа взаимодействий связывания или с использованием ELISA. В таком анализе антитело с неизвестной специфичностью в отношении эпитопа оценивают на его способность конкурировать за связывание против известного соединения-компаратора (например, АВ7). Конкуренцию за связывание с конкретным эпитопом определяют по уменьшению связывания с эпитопом IL-1β по меньшей мере приблизительно на 50%, или по меньшей мере приблизительно на 70%, или по меньшей мере приблизительно на 80%, или по меньшей мере приблизительно на 90%, или по меньшей мере приблизительно на 95%, или по меньшей мере приблизительно на 99%, или по меньшей мере приблизительно на 100% относительно известного антитела-компаратора (например, АВ7), и такая конкуренция свидетельствует о связывании по существу с таким же эпитопом.
С целью идентификации в настоящем описании IL-1β-связывающих областей в антителах и/или эпитопах, приведенных в качестве примеров, распознаваемых описанными антителами, полагают, что могут быть генерированы дополнительные антитела со сходными характеристиками связывания и терапевтической или диагностической применимостью, которые сравнимы с вариантами настоящего изобретения.
Кроме того, IL-1β-связывающие антитела и фрагменты настоящего изобретения включают в себя любые из предыдущих аминокислотных последовательностей легкой или тяжелой цепей с одной или несколькими консервативными заменами (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативными заменами). В свете настоящего изобретения, можно определить положения аминокислотной последовательности, которые являются кандидатами на консервативные замены, и можно выбрать синтетические и природные аминокислоты, которые осуществляют консервативные замены для любых конкретных аминокислот. При выборе консервативных замен следует учитывать контекст, по которому осуществляют конкретную аминокислотную замену, гидрофобность или полярность боковой цепи, общий размер боковой цепи и величину рК боковых цепей с кислотной или основной (щелочной) природой в физиологических условиях. Например, лизин, аргинин и гистидин часто являются подходящими для замены друг другом. Как известно в данной области, это связано с тем, что все три аминокислоты имеют основные боковые цепи, тогда как величины рК для боковых цепей лизина и аргинина гораздо более близки друг к другу (приблизительно 10 и 12), чем величина рК для гистидина (приблизительно 6). Аналогичным образом, глицин, аланин, валин, лейцин и изолейцин часто являются подходящими для замены друг другом, при условии, что глицин часто не подходит для замены других членов данной группы. Это связано с тем, что каждая из аминокислот относительно гидрофобна при включении в полипептид, но отсутствие у глицина α-углерода дает углам вращения фи и пси (вокруг α-углерода) такую большую свободу конформации, что остатки глицина могут запускать изменения в конформации или вторичной структуре, которые нечасто встречаются при замене других аминокислот друг другом. Другие группы аминокислот, часто подходящим образом заменяемые друг другом, включают, но не ограничиваются ими, группу, состоящую из глутаминовой и аспарагиновой кислот; группу, состоящую из фенилаланина, тирозина и триптофана; и группу, состоящую из серина, треонина и, необязательно, тирозина.
Проводя консервативные модификации аминокислотной последовательности или соответствующие модификации кодирующих нуклеотидов, можно получать IL-1β-связывающие антитела или IL-1β-связывающие фрагменты, имеющие химические характеристики, сходные с химическими характеристиками приведенных в настоящем описании в качестве примеров антител и фрагментов. В противоположность этому, существенные модификации в функциональных и/или химических характеристиках IL-1β-связывающих антител или IL-1β-связывающих фрагментов могут быть осуществлены выбором замен, которые значимо отличаются в их действии на поддержание (а) структуры молекулярного скелета в области замены, например, в виде складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы в сайте-мишени или (с) объема боковой цепи.
Антигенсвязывающие фрагменты антитела включают фрагменты, которые сохраняют способность специфически связываться с антигеном, обычно посредством сохранения антигенсвязывающей части антитела. Полностью установлено, что антигенсвязывающая функция антитела может выполняться фрагментами полноразмерного антитела. Примеры антигенсвязывающих частей включают (i) Fab-фрагмент, который является моновалентным фрагментом, состоящим из доменов VН, CL и СН1; (ii) F(ab')2-фрагмент, который является бивалентным фрагментом, содержащим два Fab-фрагмента, связанные дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, который является доменами VН и СН1; (iv) Fv-фрагмент, который является доменами VL и VH единственного плеча антитела, (v) dAB-фрагмент (Ward et al., (1989) Nature 341:544-546), который является доменом VH; и (vi) выделенная определяющая комплементарность область (CDR). Одноцепочечные антитела также включены в термин антигенсвязывающей части антитела. IL-1β-связывающие антитела и фрагменты настоящего изобретения включают также моновалентные, или мультивалентные, или мономерные, или мультимерные (например, тетрамерные), полученные из CDR домены связывания с каркасом или без каркаса (например, с белковым или углеводным каркасом).
Настоящие IL-1β-связывающие антитела или фрагменты могут быть частью более крупных иммуноадгезионных молекул, образованных ковалентной или нековалентной ассоциацией антитела или части антитела с одним или несколькими другими белками или пептидами. Примеры таких иммуноадгезионных молекул включают использование стрептавидинового кора (сердцевинной части) для образования тетрамерной scFv-молекулы (Kipriyanov, S.M., et al. (1995) Human Antidodies and Hybridomas 6:93-101) и использование остатка цистеина, маркерного пептида и С-концевой полигистидиновой метки для образования бивалентных и биотинилированных молекул scFv (Kipriyanov, S.M., et al. (1994) Mol. Immunol. 31:1047-1058). Антитела и фрагменты, содержащие иммуноадгезионные молекулы, могут быть получены с использованием стандартных способов рекомбинантных ДНК, описанных в настоящем описании. Предпочтительными антигенсвязывающими частями являются полные домены или пары полных доменов.
IL-1β-связывающие антитела и фрагменты настоящего изобретения включают также фрагменты состоящего из домена антитела (dAB) (Ward et al., Nature 341:544-546, 1989), которые состоят из VH-домена. IL-1β-связывающие антитела и фрагменты настоящего изобретения также включают диатела, которые являются бивалентными антителами, в которых домены VH и VL экспрессируются в виде единственной полипептидной цепи, но используют линкер, который является настолько коротким, чтобы было возможным спаривание между двумя доменами на одной и той же цепи, что заставляет такие домены спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих сайта (см., например, ЕР 404097; WO 93/11161; Holliger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448, 1993 и Poljak et al., Structure 2:1121-1123, 1994). Диатела могут быть биспецифическими или моноспецифическими.
IL-1β-связывающие антитела и фрагменты настоящего изобретения включают также одноцепочечные фрагменты (scFv), которые связываются с IL-1β. scFv содержит вариабельную область тяжелой цепи антитела (VH), функционально связанную с вариабельной областью легкой цепи (VL), где вариабельная область тяжелой цепи и вариабельная область легкой цепи, вместе или по отдельности, образуют сайт связывания, который связывает IL-1β. scFv может содержать VH-область на стороне амино-конца и VL-область на стороне карбокси-конца. Альтернативно, scFv может содержать VL-область на стороне амино-конца и VH-область на стороне карбокси-конца. Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, они могут быть соединены с использованием рекомбинантных способов синтетическим линкером, который дает возможность им образоваться в виде единой белковой цепи, в которой VL и VH-области спариваются с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426 и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883).
scFv может необязательно дополнительно содержать полипептидный линкер между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи. Такие полипептидные линкеры обычно содержат от 1 до 50 аминокислот, альтернативно, от 3 до 12 аминокислот, альтернативно, 2 аминокислоты. Пример линкерного пептида для связывания тяжелой и легкой цепей в scFv содержит аминокислотную последовательность из 5 аминокислот Gly-Gly-Gly-Gly-Ser (SEQ ID NO:37). Другие примеры содержат один или несколько тандемных повторов такой последовательности (например, полипептид, содержащий два-четыре повтора Gly-Gly-Gly-Gly-Ser (SEQ ID NO:37)) для создания линкеров.
IL-1β-связывающие антитела и фрагменты настоящего изобретения включают также антитела тяжелых цепей (HCAb). Исключения в отношении структуры Н2L2 общепринятых антител встречаются в некоторых изотипах иммуноглобулинов, обнаруженных в семействе верблюдовых (Camelidae) (верблюдах, дромедарах (одногорбых верблюдах и ламах; Hamers-Casterman et al., 1993 Nature 363: 446; Nguyen et al., 1998 J. Mol. Biol. 275: 413), ковровых акулах (воббегонгах) (Nuttal et al., Mol Immunol. 38:313-26, 2001), усатых акулах-няньках (Greenberg et al., Nature 374:164-73, 1995; Roux et al., Proc. Natl. Acad. Sci. USA 95: 11804) и пятнистых химерах (Nguyen et al., “Heavy-chain antibodies in Camelidae; a case of evolutionary innovation,” 2002 Immunogenetics 54(1): 39-47)). Такие антитела, очевидно, могут образовывать антигенсвязывающие области с использованием только вариабельной области тяжелой цепи, так что функциональные антитела являются димерами только тяжелых цепей (называемыми «антителами тяжелых цепей» или обозначенными как “HCAb”). Таким образом, некоторые варианты данных IL-1β-связывающих антител и фрагментов могут быть антителами тяжелых цепей (НСАb), которые специфически связываются с IL-1β. Например, антитела тяжелых цепей, которые являются антителами класса IgG и лишены легких цепей, продуцируются животными семейства Camelidae, которое включает в себя верблюдов, дромедаров и лам (Hamers-Casterman et al., Nature 363: 446-448 (1993)). HCAb имеют молекулярную массу приблизительно 95 кДа вместо молекулярной массы приблизительно 160 кДа общепринятых IgG-антител. Их связывающие домены состоят только из вариабельных доменов тяжелой цепи, часто обозначаемые в настоящем описании как VHН, чтобы отличить их от общепринятых VH. Muyldermans et al., J. Mol. Recognit. 12:131-140 (1999). Вариабельный домен антител тяжелой цепи иногда называют нанотелом (Cortez-Retamozo et al., Cancer Research 64:2853-57, 2004). Библиотека нанотел может быть генерирована из иммунизированного дромедара, как описано Conrath et al., Antimicrob Agents Chemother 45: 2807-12, 2001, или с использованием рекомбинантных способов.
Поскольку первый константный домен (СH1) отсутствует (сплайсирован во время процессинга мРНК вследствие утраты сигнала сплайсингового консенсуса), за вариабельным доменом VHН следует непосредственно шарнирная область, домены СН2 и СН3 (Nguyen et al., Mol. Immunol. 36:515-524 (1999); Woolven et al., Immunogenetics 50:98-101 (1999)). VHН верблюдовых рекомбинируется с константными областями IgG2 и IgG3, которые содержат шарнирную область, домены СН2 и СН3 и лишены домена СН1 (Hamers-Casterman et al., supra). Например, IgG1 ламы является общепринятым изотипом антитела (Н2L2), в котором VH рекомбинируется с константной областью, которая содержит шарнирную область, домены СН1, СН2 и СН3, тогда как IgG2 и IgG3 ламы являются изотипами только тяжелой цепи, которая лишена доменов СН1 и которая не содержит легких цепей.
Хотя НСАb лишены легких цепей, они имеют антигенсвязывающий репертуар. Механизм генетического генерирования НСАb обсуждается в Nguyen et al., Adv. Immunol 79:261-296 (2001) и Nguyen et al., Immunogenetics 54:39-47 (2002). Акулы, включая усатую акулу-няньку, обнаруживают сходные содержащие рецептор антигена отдельные мономерные V-домены. Irving et al., J. Immunol. Methods 248:31-45 (2001); Roux et al., Proc. Natl. Acad. Sci. USA 95:11804 (1998).
VHН содержат малые интактные антигенсвязывающие фрагменты (например, фрагменты, которые имеют молекулярную массу 15 кДа, 118-136 остатков). Было обнаружено, что VHН-домены верблюдовых связываются с антигеном с высокой аффинностью (Desmyter et al., J. Biol. Chem. 276:26285-90, 2001), с VHН-аффинностью обычно в наномолярном диапазоне и сравнимыми с аффинностью фрагментов Fab и scFv. VHН являются высокорастворимыми и более стабильными, чем соответствующие производные фрагментов scFv и Fab. VH-фрагменты было относительно трудно получить в растворимой форме, но могут быть получены улучшения в растворимости и специфическом связывании, когда каркасные остатки изменяют таким образом, чтобы они были более VHН-подобными. (См., например, Reichman et al., J Immunol Methods 1999, 231:25-38). VHН несут аминокислотные замены, которые делают их более гидрофильными и предотвращают пролонгированное взаимодействие с BiP (связывающий белок тяжелой цепи иммуноглобулина), который обычно связывается с Н-цепью в эндоплазматическом ретикулуме (ER) во время укладки и сборки, пока он не вытесняется L-цепью. Вследствие увеличенной гидрофильности VHН секреция из ER улучшается.
Функциональные VHН могут быть получены протеолитическим расщеплением НСАb иммунизированного животного семейства верблюдовых, прямым клонированием генов VHН из В-клеток иммунизированного верблюда с получением рекомбинантных VHН, или из наивных («необученных») или синтетических библиотек. VHН с желаемой антигенной специфичностью могут быть также получены с использованием метода фагового дисплея. Использование VHН в фаговом дисплее является гораздо более простым и более эффективным по сравнению с Fab или scFv, так как только один домен должен быть клонирован и экспрессирован для получения функционального антигенсвязывающего фрагмента. Muyldermans, Biotechnol. 74:277-302 (2001); Chahroudi et al., FEBS Lett. 441:521-526 (1997) и van der Linden et al., J. Biotechnol. 80:261-270 (2000). Способы получения антител, имеющих тяжелые цепи верблюдовых, описаны также в публикациях патентов США No. 20050136049 и 20050037421.
Способы рибосомного дисплея могут быть использованы для идентификации и выделения молекул scFv и/или VHН, имеющих желаемые активность и аффинность связывания. Irving et al., J. Immunol. Methods 248:31-45 (2001). Рибосомный дисплей и отбор имеет потенциал для генерирования больших библиотек дисплея (1014).
В других вариантах осуществления предоставлены VHН-подобные молекулы, генерируемые посредством способа «верблюдизации», модификацией не-верблюдовых VH, таких как VHН человека, для улучшения их растворимости и предотвращения неспецифического связывания. Это достигается заменой остатков на VL-стороне VH VHН-подобными остатками, имитируя, таким образом, более растворимые VHН-фрагменты. Ожидается, что «верблюдизированные» VH-фрагменты, в частности фрагменты, основанные на каркасной области антитела человека, должны проявлять в значительной степени уменьшенную иммунную реакцию при введении in vivo пациенту, и, следовательно, ожидается, что они будут иметь значимые преимущества для терапевтических применений. Davies et al., FEBS Lett. 339:285-290 (1994); Davies et al., Protein Eng. 9:531-537 (1996); Tanha et al., J. Biol. Chem. 276:24774-24780 (2001) и Riechmann et al., Immunol. Methods 231:25-38 (1999).
Большое разнообразие экспрессионных систем доступны для получения IL-1β-фрагментов, включая фрагменты Fab, scFv и VHН. Например, экспрессионные системы как прокариотического, так и эукариотического происхождения могут быть использованы для крупномасштабного получения фрагментов антител и слитых белков антител. Особенно предпочтительными являются экспрессионные системы, которые делают возможной секрецию больших количеств фрагментов антител в культуральную среду.
Получение биспецифического Fab-scFv («битела») и триспецифического Fab-(scFv)(2) («тритела») описано Schoonjans et al., (J Immunol. 165:7050-57, 2000) и Willems et al., (J Chromatogr B Analyt Technol Biomed Life Sci. 786:161-76, 2003). Для бител или трител молекулу scFv сливают с одной или обеими из цепей VL-CL (L) и VH-CH1 (Fd); например для получения тритела два scFv сливают с С-концом Fab, тогда как в бителе один scFv слит с С-концом Fab. «Минитело», состоящее из scFv, слитого с СН3 через пептидный линкер (без шарнирной области) или через шарнирную область IgG, было описано Olafsen, et al., Protein Eng Des Sel. 2004 Apr; 17(4): 315-23.
Интратела являются одноцепочечнными антителами, которые демонстрируют внутриклеточную экспрессию и могут влиять на внутриклеточную функцию белков (Biocca, et al., EMBO J. 9:101-108, 1990; Colby et al., Proc Natl Acad Sci USA, 101:17616-21, 2004). Интратела, которые содержат сигнальные последовательности клетки, которые сохраняют конструкцию антитела во внутриклеточных областях, могут быть получены, как описано Mhashilkar et al., (EMBO J. 14:1542-51, 1995) и Wheeler et al., (FASEB J. 17:1733-5, 2003). Транстела представляют собой проницаемые в клетку антитела, в которых домены трансдукции белка (PTD) слиты с одноцепочечным вариабельным фрагментом (scFv) (Heng et al., Med Hypotheses, 64:1105-8, 2005).
IL-1β-связывающие антитела и фрагменты настоящего изобретения включают также антитела, которые являются SMIP или слитыми белками домена связывания иммуноглобулина, специфическими в отношении белка-мишени. Такие конструкции являются одноцепочечными полипептидами, содержащими антигенсвязывающие домены, слитые с доменами иммуноглобулина, необходимыми для осуществления эффекторных функций антител. См., например, WO03/041600, публикацию патента США 20030133939 и публикацию патента США 20030118592.
IL-1β-связывающие антитела и фрагменты настоящего изобретения включают также иммуноадгезины. Один или несколько CDR могут быть включены в молекулу либо ковалентно, либо нековалентно, чтобы сделать ее иммуноадгезином. Иммуноадгезин может включать в себя CDR в виде части большей полипептидной цепи, может ковалентно связывать CDR с другой полипептидной цепью или может включать в себя CDR нековалентно. Описанные в настоящем описании CDR делают возможным специфическое связывание иммуноадгезина с IL-1β.
IL-1β-связывающие антитела и фрагменты настоящего изобретения включают также миметики антител, содержащие одну или несколько IL-1β-связывающих частей, помещенных на органическом или молекулярном каркасе (скелете) (например, на белковом или углеводном каркасе). Белки, обычно имеющие относительно определенные трехмерные структуры, обычно называемые белковыми каркасами, могут быть использованы в качестве реагентов для конструирования миметиков антител. Каркасы обычно содержат одну или несколько областей, которые поддаются специфическому или случайному изменению последовательности, и такую рандомизацию последовательности часто проводят для получения библиотек белков, из которых могут быть выбраны желаемые продукты. Например, миметик антитела может содержать химерный неиммуноглобулиновый связывающий полипептид, имеющий иммуноглобулин-подобный домен, содержащий каркас, имеющий две или более растворитель-экспонированных петли, содержащие различные CDR из исходного антитела, встроенные в каждую из петель и проявляющие селективную связывающую активность в отношении лиганда, связанного с исходным антителом. Неиммуноглобулиновые белковые каркасы были предложены для получения белков с новыми связывающими свойствами (Tramontano et al., J. Mol. Recjgnit. 7:9, 1994; McConnel and Hoess, J. Mol. Biol. 250:460, 1995). Другие белки были испытаны в качестве каркасов и были использованы для демонстрации рандомизированных остатков на альфа-спиральных поверхностях (Nord et al., Nat. Biotechnol. 15:772, 1997; Nord et al., Protein Eng. 8:601, 1995), петлях между спиралями в пучках альфа-спиралей (Ku and Schultz, Proc. Natl. Acad. Sci. USA 92:6552, 1995) и петлях, стесненных дисульфидными мостиками, таких как петли малых ингибиторов протеаз (Markland et al., Biochemistry 35:8045, 1996; Markland et al., Biochemistry 35:8058, 1996; Rottgen and Collins, Gene 164:243, 1995; Wang et al., J. Biol. Chem. 270:12250, 1995). Способы использования каркасов для миметиков антител описаны в патенте США 5770380 и публикациях патентов США 2004/0171116, 2004/0266993 и 2005/0038229.
Таким образом, может быть получено разнообразие IL-1β-связывающих антител и фрагментов, содержащих один, два и/или три CDR вариабельной области тяжелой цепи и вариабельной области легкой цепи антитела (предпочтительно один или несколько CDR SEQ ID NO:1-26).
Предпочтительные антитела или фрагменты настоящего изобретения связываются с IL-1β с (i) IC50 приблизительно 0,5 нМ или менее (например, приблизительно 0,4 или менее, приблизительно 0,3 или менее или даже приблизительно 0,2 или менее), как определено твердофазным иммуноферментным анализом (ELISA), (ii) по меньшей мере приблизительно в 100 раз (например, по меньшей мере приблизительно в 150 раз, по меньшей мере приблизительно в 200 раз или даже по меньшей мере приблизительно в 250 раз) большей аффинностью в отношении их связывания с IL-1α (т.е. обладают селективностью в отношении IL-1β, превышающей селективность в отношении IL-1α по меньшей мере приблизительно в 100 раз (например, по меньшей мере приблизительно в 150 раз, по меньшей мере приблизительно в 200 раз или даже по меньшей мере приблизительно в 250 раз)) и/или (iii) константой диссоциации равновесного связывания (KD) в отношении IL-1β приблизительно 20 пМ или менее (например, приблизительно 15 пМ или менее, приблизительно 10 пМ или менее или даже приблизительно 5 пМ или менее). Предпочтительными также являются антитела или фрагменты настоящего изобретения, которые могут ингибировать IL-1β-индуцированную экспрессию IL-6 сыворотки у животного по меньшей мере на 50% (например, по меньшей мере на 60%, по меньшей мере на 70% или даже по меньшей мере на 80%) по сравнению с уровнем IL-6 сыворотки у IL-1β-стимулированного животного, которому не вводили антитело или фрагмент настоящего изобретения. Таким образом, в родственном аспекте настоящее изобретение относится к IL-1β-связывающему антителу или IL-1β-связывающему фрагменту, которые обладают по меньшей мере одной из вышеуказанных характеристик.
Хотя настоящее изобретение было описано в отношении IL-1β-связывающих антител и их фрагментов (например, содержащих легкую и тяжелую цепь), настоящее изобретение также относится к полипептидам, иным, чем IL-1β-связывающие антитела или фрагменты антител, таким как одноцепочечные полипептиды (включая слитые полипептиды, химерные полипептиды, конъюгаты и т.п.). Таким образом, в этом отношении настоящее изобретение относится к полипептиду, содержащему аминокислотную последовательность любой из SEQ ID NO:1-26 или ее функционально эквивалентный фрагмент или вариант. Настоящее изобретение также относится к полипептиду, содержащему аминокислотную последовательность любой из SEQ ID NO:27-35 или 42-57 или ее функционально эквивалентный фрагмент или вариант.
Описанные в настоящем описании антитела и фрагменты антител могут быть получены любым подходящим способом. Подходящие способы получения таких антител и фрагментов антител известны в данной области. Другие способы получения антител и фрагментов антител описаны в настоящем описании в виде части настоящего изобретения. Антитело, фрагмент антитела или полипептид настоящего изобретения, описанные в настоящем описании, могут быть выделены или очищены в любой степени. В настоящем описании выделенным соединением является соединение, которое было удалено из его природного окружения. Очищенным соединением является соединение, которое стало обладать увеличенной чистотой, так что данное соединение существует в форме, которая является более чистой, чем форма, в которой оно существует (i) в его природном окружении или (ii) при начальном синтезе и/или при начальной амплификации в лабораторных условиях, причем «чистота» является относительным термином и необязательно означает «абсолютную чистоту».
Любые из вышеуказанных антител, фрагментов антител или полипептидов настоящего изобретения могут быть гуманизированными антителами или сконструированными человеком антителами, как описано в настоящем описании.
Способ получения IL-1β-антител или фрагментов
Настоящее изобретение относится к способу получения аффинно-зрелого IL-1β-связывающего полипептида, такого как антитело или фрагмент антитела (включая область антитела (например, вариабельную область легкой или тяжелой цепи или любой ее части, например, CDR)), включающий (а) получение первой нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты, кодирующую IL-1β-связывающий полипептид, который содержит аминокислотную последовательность любой из SEQ ID NO:1-26, и второй нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты, которая отличается от первой последовательности нуклеиновой кислоты по меньшей мере одним нуклеотидом, (b) выполнение перетасовки нуклеиновой кислоты для получения двух или более мутированных нуклеиновых кислот и (с) отбор мутированной нуклеиновой кислоты, которая кодирует полипептид, который либо (i) связывается с IL-1β с большей аффинностью, чем полипептид, кодируемый первой нуклеиновой кислотой, (ii) обладает селективностью в отношении IL-1β, относительно IL-1α, которая выше селективности полипептида, кодируемого первой нуклеиновой кислотой, (iii) имеет константу диссоциации равновесного связывания (KD) в отношении IL-1β, которая ниже константы диссоциации равновесного связывания полипептида, кодируемого первой нуклеиновой кислотой, либо (iv) ингибирует IL-1β-индуцированную экспрессию IL-6 сыворотки у животного в большей степени, чем полипептид, кодируемый первой нуклеиновой кислотой, и (d) экспрессию отобранной мутированной нуклеиновой кислоты с получением аффинно зрелого IL-1β-связывающего полипептида. Предпочтительно, таким полипептидом является антитело или фрагмент антитела, например антитело или фрагмент антитела, описанные в настоящем описании в виде части настоящего изобретения.
Способ получения аффинно-зрелого IL-1β-связывающего полипептида необязательно дополнительно включает повторение стадий (b) и (с) один или несколько раз, причем перетасовку нуклеиновой кислоты стадии (b) выполняют с использованием (i) по меньшей мере одной отобранной мутированной нуклеиновой кислоты стадии (с) и (ii) по меньшей мере одной нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, которая отличается от отобранной мутированной нуклеиновой кислоты по меньшей мере одним нуклеотидом. Предпочтительно, стадии (b) и (с) повторяют, пока не будет отобрана оптимизированная нуклеиновая кислота. Оптимизированную нуклеиновую кислоту отбирают, когда далее невозможно отобрать нуклеиновую кислоту, кодирующую полипептид, который обладает характеристиками связывания в отношении IL-1β (например, характеристики (i)-(iv) стадии (с)), которые превосходят характеристики полипептида, кодируемого ранее отобранной нуклеиновой кислотой.
Желательно повторять стадии (b) и (с), пока не будет отобрана нуклеиновая кислота, которая кодирует полипептид, обладающий по меньшей мере одним из следующих свойств: (i) связывается с IL-1β с IC50 приблизительно 0,5 нМ или менее (например, приблизительно 0,4 или менее, приблизительно 0,3 или менее или даже приблизительно 0,2 или менее), как определено твердофазным иммуноферментным анализом (ELISA), (ii) связывается с IL-1β по меньшей мере приблизительно в 100 раз (например, по меньшей мере приблизительно в 150 раз, по меньшей мере приблизительно в 200 раз или даже по меньшей мере приблизительно в 250 раз) большей аффинностью в отношении его связывания с IL-1α (т.е. обладает селективностью в отношении IL-1β, превышающей селективность в отношении IL-1α по меньшей мере приблизительно в 100 раз (например, по меньшей мере приблизительно в 150 раз, по меньшей мере приблизительно в 200 раз или даже по меньшей мере приблизительно в 250 раз)), (iii) связывается с IL-1β с константой диссоциации равновесного связывания (KD) для IL-1β приблизительно 20 пМ или менее (например, приблизительно 15 пМ или менее, приблизительно 10 пМ или менее, 5 пМ или менее, 3 пМ или менее, 2 пМ или менее, 1 пМ или менее, 0,7 пМ или менее, 0,5 пМ или менее, 0,3 пМ или менее или 0,2 пМ или менее) или (iv) ингибирует IL-1β-индуцированную экспрессию IL-6 сыворотки у животного по меньшей мере на 50% (например, по меньшей мере на 60%, по меньшей мере на 70% или даже по меньшей мере на 80%) по сравнению с уровнем IL-6 сыворотки у IL-1β-стимулированного животного, которому не вводили антитело или фрагмент настоящего изобретения.
Отбор мутированной нуклеиновой кислоты, которая кодирует полипептид в сыворотке, обладающий желаемыми свойствами, может выполняться любым подходящим способом. Методики экспрессии кодируемых полипептидов и анализа данных полипептидов на аффинность связывания, селективность связывания, константы равновесного связывания и ингибирование IL-1β-индуцированной экспрессии IL-6 описаны в настоящем описании (см. примеры). Другие подходящие способы известны в данной области. Когда полипептид, кодируемый мутированной нуклеиновой кислотой, полученной на стадии (b), не является антителом или фрагментом целого антитела (например, Fab), может быть необходимым получение антитела, содержащего указанный полипептид, чтобы определить, соответствует ли данный полипептид критериям отбора. Таким образом, способ получения аффинно-зрелого IL-1β-связывающего полипептида может дополнительно включать стадию получения антитела, содержащего полипептид, кодируемый мутированной нуклеиновой кислотой, причем стадию отбора мутированной нуклеиновой кислоты, кодирующей полипептид, обладающий желаемыми свойствами, выполняют анализом указанного антитела.
Перетасовка нуклеиновых кислот означает в настоящем описании фрагментирование двух или более последовательностей нуклеиновых кислот для получения пула случайных фрагментов нуклеиновых кислот и повторную сборку данных фрагментов для создания двух или более мутированных нуклеиновых кислот. В этом отношении, мутированной нуклеиновой кислотой является только нуклеиновая кислота, которая имеет последовательность нуклеиновой кислоты, которая была изменена. Перетасовка нуклеиновых кислот может быть выполнена любым подходящим способом. Многие подходящие способы известны в данной области, такие как способы, описанные в патентах США 6489145; 6773900; 6764835; 6740506; 6713282; 6713281; 6713279; 6709841; 6696275; 6677115; 6673552; 6656677; 6605449; 6566050; 6562594; 6555315; 6537776; 6528249; 6479258; 6455254; 6440668; 6368798; 6361974; 6358709; 6352842; 6344328; 6335179; 6280926; 6238884; 6174673; 6171820; 6168919; 6057103; 6054267; 6030779; 6001574; 5965408; 5958672; 5939250; 5763239; 6395547; 6376246; 6372497; 6368861; 6365408; 6365377; 6358740; 6358742; 6355484; 6344356; 6337186; 6335160; 6323030; 6319714; 6319713; 6303344; 6297053; 6291242; 6287861; 6277638; 6180406; 6165793; 6132970; 6117679; 5834252; 5830721; 5811238; 5605793.
Нуклеиновые кислоты
Антитела, фрагменты антител и полипептиды настоящего изобретения могут кодироваться единственной нуклеиновой кислотой (например, единственной нуклеиновой кислотой, содержащей нуклеотидные последовательности, которые кодируют полипептиды легкой и тяжелой цепи данного антитела) или двумя или более отдельными нуклеиновыми кислотами, каждая из которых кодирует отличающуюся часть данного антитела или фрагмента антитела. В этой связи настоящее изобретение относится к одной или нескольким нуклеиновым кислотам, которые кодируют любые из предыдущих антител, фрагментов антител или полипептидов (например, любые из вышеуказанных вариабельных областей легкой и тяжелой цепи).
Согласно одному аспекту настоящего изобретения, изобретение относится к нуклеиновой кислоте, которая кодирует вариабельную область тяжелой цепи антитела или его части. Примеры последовательностей нуклеиновых кислот представлены в SEQ ID NO:39 и 40, которые соответственно кодируют вариабельную область тяжелой цепи SEQ ID NO:15 и вариабельную область легкой цепи SEQ ID NO:11. В этом отношении, настоящее изобретение относится к нуклеиновой кислоте, кодирующей полипептид (например, вариабельную область тяжелой цепи антитела), содержащий аминокислотную последовательность SEQ ID NO:2, альтернативно, последовательность SEQ ID NO:28, и желательно кодирует полипептид, содержащий аминокислотную последовательность SEQ ID NO:21 (например, полипептид, содержащий аминокислотную последовательность любой из SEQ ID NO:4-8). Более предпочтительными являются последовательности нуклеиновых кислот, кодирующие полипептид (например, вариабельную область тяжелой цепи), содержащий аминокислотную последовательность SEQ ID NO:12 или SEQ ID NO:13 (например, полипептид, содержащий аминокислотную последовательность любой из SEQ ID NO:14-15), или содержащий аминокислотную последовательность SEQ ID NO:23 или SEQ ID NO:24 (например, SEQ ID NO:25 или SEQ ID NO:26).
Альтернативно или дополнительно, нуклеиновая кислота настоящего изобретения может содержать последовательность нуклеиновой кислоты, которая кодирует вариабельную область легкой цепи антитела или его части. В этом отношении, настоящее изобретение относится к нуклеиновой кислоте, которая кодирует полипептид (например, вариабельную область легкой цепи), содержащий аминокислотную последовательность SEQ ID NO:1. Например, последовательность нуклеиновой кислоты может кодировать полипептид, содержащий аминокислотную последовательность SEQ ID NO:9. Более предпочтительно, нуклеиновая кислота кодирует полипептид (например, вариабельную область легкой цепи), который содержит аминокислотную последовательность SEQ ID NO:10 или 11.
В настоящее изобретение включены также нуклеиновые кислоты любой из предыдущих последовательностей легкой и тяжелой цепей, которые содержат одну или несколько консервативных замен (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 консервативных замен), как обсуждалось в отношении антитела и фрагмента антитела настоящего изобретения, где настоящее антитело или фрагмент, содержащие данную замену, обладают такой же или по существу такой же аффинностью и специфичностью связывания эпитопа, что и одно или несколько антител, фрагментов и последовательностей, приведенных в настоящем описании в качестве примеров.
Последовательности нуклеиновых кислот могут быть определены из аминокислотных последовательностей антител, фрагментов антител и вариабельных областей легких и тяжелых цепей, описанных в настоящем описании, любым подходящим способом, например, превращением таких аминокислотных последовательностей в соответствующие последовательности нуклеиновых кислот с использованием генетического кода. Нуклеиновые кислоты, кодирующие аминокислотные последовательности (такие как аминокислотные последовательности, описанные в настоящем описании), могут быть получены (например, выделенные или синтезированные последовательности нуклеиновых кислот) с использованием способов, известных в данной области, таких как способы, описанные, например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 3rd edition, Cold Spring Harbor Press, NY, 2001; Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley and Sons, New York, NY, 1994 и Herdewijn, ed., Oligonucleotide Synthesis: Methods and Applications (Methods in Molecular Biology), Humana Press, Totowa, NJ, 2004. Описанные в настоящем описании нуклеиновые кислоты могут быть выделены или очищены в любой степени. В настоящем описании выделенным соединением является соединение, которое было удалено из его природного окружения. В настоящем описании, очищенным соединением является соединение, которое стало обладать увеличенной чистотой, так что данное соединение существует в форме, которая является более чистой, чем форма, в которой оно существует (i) в его природном окружении или (ii) при начальном синтезе и/или при начальной амплификации в лабораторных условиях, причем «чистота» является относительным термином и необязательно означает «абсолютную чистоту».
Нуклеиновые кислоты могут быть очищены с использованием любого из различных методов, включая, но без ограничений, препаративный гель-электрофорез или изоэлектрическое фокусирование, аффинную, иммуноаффинную или ионообменную хроматографию, хроматографию с использованием молекулярных сит, хроматофокусирование или высокоэффективную жидкостную хроматографию.
Векторы
Описанные в настоящем описании нуклеиновые кислоты могут быть встроены в векторы, например векторы экспрессии нуклеиновых кислот и/или нацеливающие векторы. Такие векторы могут быть использованы в различных способах, например, для экспрессии IL-1β-связывающего антитела или фрагмента антитела в клетке или трансгенном животном. Таким образом, настоящее изобретение относится к вектору, содержащему любую одну или несколько нуклеиновых кислот настоящего изобретения. «Вектор» представляет собой любую молекулу или композицию, которая способна переносить последовательность нуклеиновой кислоты в подходящую клетку-хозяина, где может иметь место синтез кодируемого полипептида. Обычно и предпочтительно, вектор представляет собой нуклеиновую кислоту, которая была сконструирована с использованием способов рекомбинантных ДНК, которые известны в данной области, для включения желаемой последовательности нуклеиновой кислоты (например, нуклеиновой кислоты настоящего изобретения). Желательно, данный вектор состоит из ДНК. Примеры подходящих векторов переноса генов на основе ДНК включают плазмиды и вирусные векторы. Подходящие вирусные векторы включают, например, векторы на основе парвовируса (например, векторы на основе аденоассоциированного вируса (AAV)), ретровирусные векторы, векторы на основе вируса простого герпеса (HSV), AAV-аденовирусные химерные векторы, векторы на основе вируса ВИЧ и векторы на основе аденовируса. Любой из таких векторов может быть получен с использованием стандартных способов рекомбинантных ДНК, описанных, например, Sambrook et al., supra и Ausubel et al., supra. Однако в данной области известны также векторы, которые не основаны на нуклеиновых кислотах, такие как липосомы, и они могут быть использованы в связи с настоящим изобретением. Вектор настоящего изобретения может быть основан на единственном типе нуклеиновой кислоты (например, плазмиде) или на молекуле, не являющейся нуклеиновой кислотой (например, липиде или полимере). Альтернативно, вектор может представлять собой комбинацию нуклеиновой кислоты и не-нуклеиновой кислоты (т.е. «химерный» вектор). Например, плазмида, захватывающая нуклеиновую кислоту, может быть получена с липидом или полимером в качестве доставляющего носителя. Такой вектор называют в настоящем описании комплексом «плазмида-липид» и комплексом «плазмида-полимер», соответственно. Вектор переноса генов настоящего изобретения может быть интегрирован в геном клетки-хозяина или может присутствовать в клетке-хозяине в форме эписомы.
Нуклеиновые кислоты настоящего изобретения могут быть встроены в векторы экспрессии иммуноглобулина, например векторы, описанные McLean et al., Mol. Immunol., 37: 837-45 (2000); Walls et al., Nucleic Acids Res., 21: 2921-9 (1993) и Norderhaug et al., J. Immunol. Meth., 204: 77-87 (1997).
Обычно выбирают векторы, которые должны быть функциональными в клетке-хозяине, в которой будет использован вектор (вектор совместим с механизмом клетки-хозяина, так что может происходить амплификация гена и/или экспрессия гена). Молекула нуклеиновой кислоты, кодирующая IL-1β-связывающее антитело или его IL-1β-связывающий фрагмент, может быть амплифицирована/экспрессирована в прокариотических, дрожжевых клетках, клетках насекомых (бакуловирусные системы) и/или эукариотических клетках. Выбор клетки-хозяина будет зависеть отчасти от того, должны ли IL-1β-связывающее антитело или фрагмент быть модифицированы после переноса (например, гликозилированы и/или фосфорилированы). Если они должны быть модифицированы, предпочтительными в качестве клеток-хозяев являются клетки дрожжей, насекомых или млекопитающих. Дополнительная информация, касающаяся экспрессирующих векторов, может быть найдена в Meth. Enz. V. 185 (1990); Goeddel, ed.), Academic Press Inc., San Diego, Calif.
Экспрессирующие векторы обычно содержат один или несколько компонентов: промотор, одну или несколько энхансерных последовательностей, сайт инициации репликации, последовательность терминации транскрипции, полную интронную последовательность, содержащую донорный и акцепторный сайт сплайсинга, лидерную последовательность для секреции, сайт связывания рибосом, последовательность полиаденилирования, полилинкерную область для встраивания нуклеиновой кислоты, кодирующей подлежащий экспрессии полипептид, и селектируемый маркерный элемент.
Компоненты вектора могут быть гомологичными (из одного и того же вида и/или штамма, что и клетка-хозяин), гетерологичными (из вида, иного, чем вид или штамм клетки-хозяина), гибридными (комбинацией различных последовательностей из более чем одного источника), синтетическими или нативными последовательностями, которые обычно действуют в качестве регуляторов экспрессии иммуноглобулина. Источниками компонентов вектора могут быть любой прокариотический или эукариотический организм, любой позвоночный или беспозвоночный организм или любое растение, при условии, что данные компоненты являются функциональными в механизме клетки-хозяина и могут быть активированы механизмом клетки-хозяина.
Сайт инициации репликации выбирают на основе типа клетки-хозяина, используемой для экспрессии. В качестве примера, сайт инициации репликации из плазмиды pBR322 (Product No. 303-3s, New England Biolabs, Beverly, Mass) применим для большинства грамотрицательных бактерий, тогда как различные сайты инициации репликации из SV40, полиомавируса, аденовируса, вируса везикулярного стоматита (VSV) или папилломавирусов (таких как HPV или BPV) могут быть использованы для клонирования векторов в клетках млекопитающих. Обычно компонент, сайт инициации репликации, не является необходимым в экспрессирующих векторах млекопитающих (например, часто используют сайт инициации репликации SV40, так как он содержит ранний промотор).
Последовательность терминации транскрипции обычно локализована 3' (справа) от конца кодирующих областей полипептида и служит для терминации транскрипции. Последовательности терминации транскрипции в прокариотических клетках часто содержат G-C-богатый фрагмент, за которым следует поли Т-последовательность. Последовательности терминации транскрипции могут быть клонированы из библиотеки, приобретенной коммерчески, в виде части вектора, или синтезированы с использованием способов синтеза нуклеиновых кислот, таких как способы, описанные выше.
Элемент гена селектируемого маркера кодирует белок, необходимый для выживания и роста клетки-хозяина, выращиваемой в селективной культуральной среде. Обычные гены селектируемого маркера кодируют белки, которые (а) придают устойчивость к антибиотикам или другим токсинам, например ампициллину, тетрациклину или канамицину для прокариотических клеток-хозяев, (b) дополняют ауксотрофные недостаточности клетки; или (с) поставляют решающие нутриенты, недоступные из сложных сред. Предпочтительными селектируемыми маркерами являются ген устойчивости к канамицину, ген устойчивости к ампициллину и ген устойчивости к тетрациклину. Ген устойчивости к неомицину может быть также использован для отбора в прокариотических и эукариотических клетках-хозяевах.
Другие гены отбора могут быть использованы для амплификации гена, который будет экспрессироваться. Амплификация является процессом, где гены, в которых существует большая потребность, чем в отношении получения белка, критического для роста, повторяются в тандеме в хромосомах последовательных генераций рекомбинантных клеток. Примеры селектируемых маркеров для клеток млекопитающих включают дигидрофолатредуктазу (DHFR) и тимидинкиназу. Трансформанты клеток млекопитающих помещают в условия давления отбора, к которому адаптированы для выживания только трансформанты, благодаря маркеру, присутствующему в векторе. Давление отбора накладывается культивированием трансформированных клеток в условиях, в которых концентрация агента отбора в среде последовательно изменяется, что приводит к амплификации как гена отбора, так и ДНК, которая кодирует IL-1β-антитело или фрагмент. В результате из этой амплифицированной ДНК синтезируются увеличенные количества антитела.
Сайт связывания рибосом обычно присутствует для инициации трансляции мРНК. Например, такой сайт характеризуется последовательностью Шайна-Далгарно (прокариоты) или последовательностью Козака (эукариоты). Данный элемент обычно расположен 3' (справа) от промотора и 5' (слева) от кодирующей последовательности экспрессируемого полипептида. Последовательность Шайна-Далгарно варьируется, но обычно представляет собой полипурин (имеющий высокое содержание A-G). Были идентифицированы многие последовательности Шайна-Далгарно, каждая из которых может быть легко синтезирована с использованием способов, представленных выше и используемых в прокариотическом векторе.
Лидерная, или сигнальная, последовательность может быть использована для запуска секреции полипептида. Сигнальная последовательность может быть расположена в 5'-конце или непосредственно на 5'-конце кодирующей области полипептида. Многие сигнальные последовательности были идентифицированы и могут быть выбраны на основе клетки-хозяина, используемой для экспрессии. Сигнальная последовательность может быть гомологичной (природной) или гетерологичной относительно последовательности нуклеиновой кислоты, кодирующей подлежащий экспрессии белок (такой как антитело или антигенсвязывающий фрагмент). Выбранная гетерологичная сигнальная последовательность должна представлять собой последовательность, которая распознается и процессируется (расщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не распознают и не процессируют нативную сигнальную последовательность антитела, такую сигнальную последовательность заменяют выбранной прокариотической сигнальной последовательностью, например, из группы лидеров щелочной фосфатазы, пенициллиназы или термостойкого энтеротоксина II. Для дрожжевой секреции, сигнальная последовательность нативного антитела может быть заменена лидерами дрожжевой инвертазы, альфа-фактора или кислой фосфатазы. В клетке млекопитающего экспрессия нативной сигнальной последовательности является обычно удовлетворительной, хотя могут быть пригодными сигнальные последовательности других млекопитающих.
В большинстве случаев секреция антитела или антигенсвязывающего фрагмента из клетки-хозяина будет приводить к удалению сигнального пептида из антитела или фрагмента. Таким образом, зрелое антитело или зрелый фрагмент будут лишены лидерной или сигнальной последовательности.
В некоторых случаях, например, в таких, когда является желательным гликозилирование в системе экспрессии эукариотической клетки-хозяина, можно манипулировать различными пре-последовательностями для улучшения гликозилирования или выхода. Например, можно изменить сайт расщепления пептидазы сигнального пептида или добавить про-последовательности, которые также могут влиять на гликозилирование. Конечное антитело или фрагмент могут иметь в положении -1 (относительно первой аминокислоты зрелого белка) одну или несколько дополнительных аминокислот, несущественных для экспрессии, которые могут быть не полностью удаленными. Например, конечные антитело или фрагмент могут иметь одну или несколько аминокислот в сайте расщепления пептидазы, присоединенных к N-концу. Альтернативно, использование сайтов расщепления некоторых ферментов может приводить к слегка укороченной форме желаемого антитела или фрагмента, если данный фермент разрезает в такой зоне в зрелом антителе или фрагменте.
Экспрессирующие векторы будут, конкретно, содержать промотор, который распознается организмом-хозяином и функционально связан с молекулой нуклеиновой кислоты, кодирующей IL-1β-связывающее антитело или антигенсвязывающий фрагмент. Может быть использован либо нативный, либо гетерологичный промотор в зависимости от клетки-хозяина, используемой для экспрессии, и желаемого выхода.
Промоторы для использования с прокариотическими хозяевами, включают промоторные системы бета-лактамазы и лактозы; промоторную систему щелочной фосфтазы, триптофана (trp); и гибридные промоторы, такие как промотор tac. Другие известные бактериальные промоторы также могут быть использованы. Их последовательности были опубликованы, и они могут быть лигированы с желаемой последовательностью нуклеиновой кислоты с использованием линкеров или адапторов, когда желательным является добавление сайтов рестрикции.
Промоторы для использования с дрожжевыми хозяевами также известны в данной области. Дрожжевые энхансеры предпочтительно используют с дрожжевыми промоторами. Подходящие промоторы для использования с клетками-хозяевами млекопитающих хорошо известны и включают промоторы из геномов вирусов, таких как полиомавирусы, вирусы оспы (дифтерита) птиц, аденовирус (например, аденовирус 2), вирус бычьей папилломы, вирус птичьей саркомы, цитомегаловирус, ретровирус, вирус гепатита В и наиболее предпочтительно обезьяний (вакуолизирующий) вирус-40 (SV40). Другие подходящие промоторы млекопитающих включают гетерологичные промоторы млекопитающих, например промотор белка теплового шока и промотор актина.
Дополнительные промоторы, которые могут быть использованы для экспрессии агентов селективного связывания настоящего изобретения, включают, но не ограничиваются ими: область раннего промотора SV40 (Bernoist and Chambon, Nature, 290:304-310, 1981); промотор CMV; промотор, содержащийся в 3'-длинном концевом повторе вируса саркомы Рауса (Yamamoto et al., (1980), Cell 22: 787-97); промотор тимидинкиназы герпесвируса (Wagner et al. (1981) Proc. Natl. Acad. Sci. USA, 78: 1444-5); регуляторные последовательности гена металлотионина (Brinster et al., Nature, 296: 39042, 1982); промотор прокариотических экспрессирующих векторов, такой как промотор бета-лактамазы (Villa-Kamaroff, et al., Proc. Natl. Acad. Sci. USA, 75: 3727-3731, 1978) или промотор tac (DeBoer et al. (1983) Proc. Natl. Acad. Sci. USA, 80: 21-5). Представляют интерес также следующие области регуляции транскрипции животных, которые проявляет тканевую специфичность и были использованы в трансгенных животных: регуляторная область гена эластазы I, которая является активной в панкреатических ацинарных клетках (Swift et al. (1984), Cell 38: 639-46; Ornitz et al. (1986), Cold Spring Harbor Symp. Quant. Biol. 50: 399-409; MacDonald (1987), Hepatology 7: 425-515); регуляторная область гена инсулина, которая является активной в панкреатических бета-клетках (Hanahan (1985), Nature 315: 115-22); регуляторная область гена иммуноглобулина, которая является активной в лимфоидных клетках (Grosscheldl et al. (1984), Cell 38: 647-58; Adames et al. (1985), Nature 318: 533-8; Alexander et al. (1987), Mol. Cell. Biol. 7: 1436-44); регуляторная область вируса опухоли молочной железы мыши, которая является активной в тестикулярных клетках, клетках молочной железы, лимфоидных и тучных клетках (Leder et al. (1986), Cell 45: 485-95), регуляторная область гена альбумина, которая является активной в печени (Pinkert et al. (1987), Genes and Devel. 1: 268-76); регуляторная область гена альфа-фетопротеина, которая является активной в печени (Krumlauf et al. (1985), Mol. Cell. Biol. 5: 1639-48; Hammer et al. (1987), Science, 235: 53-8); регуляторная область гена альфа-1-антитрипсина, которая является активной в печени (Kelsey et al. (1987), Genes and Devel. 1: 161-71; регуляторная область гена бета-глобина, которая является активной в миелоидных клетках (Mogram et al., Nature, 315: 338-340, 1985; Kollias et al. (1986), Cell 46: 89-94); регуляторная область гена миелинового основного белка, которая является активной в олигодендроцитных клетках в головном мозге (Readhead et al. (1987), Cell, 48: 703-12); регуляторная область гена легкой цепи-2 миозина, которая является активной в скелетной мышце (Sani (1985), Nature, 314: 283-6); и регуляторная область гена гонадотропин высвобождающего гормона, которая является активной в гипоталамусе (Mason et al. (1986), Science 234: 1372-8).
Энхансерная последовательность может быть встроена в вектор для увеличения транскрипции в эукариотических клетках-хозяевах. Известны несколько энхансерных последовательностей генов млекопитающих (например, глобина, эластазы, альбумина, альфа-фетопротеина и инсулина). Однако обычно следует использовать энхансер из вируса. Энхансер SV40, энхансер раннего промотора цитомегаловируса, энхансер полиомавируса и энхансеры аденовируса являются примерами энхансерных элементов для активации эукариотических промоторов.
Хотя энхансер может быть сплайсирован в вектор в положении 5' или 3' относительно кодирующей области полипептида, обычно он расположен в сайте 5' (слева) от промотора.
Векторы для экспрессии нуклеиновых кислот включают векторы, которые совместимы с бактериальными клетками-хозяевами, клетками-хозяевами насекомых и млекопитающих. Такие векторы включают inter alia, pXRII, pCR3 и pcDNA3.1 (Invitrogen Company, San Diego, Calif.), pBSII (Stratagene Company, La Jolla, Calif.), pET15 (Novagen, Madison, Wis.), pGEX (Pharmacia Biotech, Piscataway, N.J.), pEGFP-N2 (Clontech, Palo Alto, Calif.), pETL (BlueBacII; Invitrogen), pDSR-альфа (PCT публикация No. WO90/14363) и pFastBacDual (Gibco/BRL, Grand Island, N.Y.).
Дополнительные возможные векторы включают, но не ограничиваются ими, космиды, плазмиды или модифицированные вирусы, но векторная система должна быть совместимой с выбранной клеткой-хозяином. Такие векторы включают, но не ограничиваются ими, плазмиды, такие как производные плазмиды BlueScript® (высококопийной фагмиды на основе ColE1, Stratagene Cloning System Inc., La Jolla Calif.), ПЦР-клонирующие плазмиды, предназначенные для клонирования Taq-амплифицированных ПЦР-продуктов (например, TOPO ™, TA Cloning ® Kit, PCR2.1 plasmid derivatives, Invitrigen, Carlsbad, Calif.), и векторы млекопитающих, дрожжей или вирусные векторы, такие как бакуловирусная система экспрессии (pBacPAK plasmid derivatives, Clontech, Palo Alto, Calif). Рекомбинантные молекулы могут быть введены в клетки-хозяева трансформацией, трансфекцией, инфицированием, электропорацией или другими известными способами.
Клетки-хозяева и их применение
Настоящее изобретение дополнительно относится к клетке (например, выделенной или очищенной клетке), содержащей нуклеиновую кислоту или вектор настоящего изобретения. Данная клетка может представлять собой клетку любого типа, способную трансформироваться нуклеиновой кислотой или вектором настоящего изобретения таким образом, чтобы она могла продуцировать кодируемый ими полипептид. Данная клетка предпочтительно является клеткой млекопитающего, такого как человек, и более предпочтительно является клеткой гибридомы, эмбриональной стволовой клеткой или оплодотворенной яйцеклеткой.
Для экспрессии IL-1β-связывающего антитела или фрагмента ДНК кодирующие частичные или полноразмерные легкие и тяжелые цепи, полученные, как описано выше, встраивают в экспрессирующие векторы таким образом, чтобы гены были функционально связаны с регуляторными последовательностями транскрипции и трансляции. В настоящем описании термин «функционально связанные» означает, что ген антитела лигирован в вектор таким образом, что регуляторные последовательности транскрипции и трансляции в векторе выполняют их предполагаемую функцию регуляции транскрипции и трансляции гена антитела. Экспрессирующий вектор и регуляторные последовательности экспрессии выбирают таким образом, чтобы они были совместимыми с экспрессией используемой клетки-хозяина. Ген легкой цепи антитела и ген тяжелой цепи антитела могут быть инсертированы в отдельные векторы или, чаще, оба гена инсертируют в один и тот же экспрессирующий вектор. Гены антитела инсертируют в экспрессирующий вектор стандартными способами (например, лигированием комплементарных сайтов рестрикции на фрагменте гена антитела и векторе, или лигированием тупых концов, если сайты рестрикции не присутствуют). Перед встраиванием последовательностей легкой или тяжелой цепи экспрессирующий вектор может уже нести последовательности константной области антитела. Например, одним подходом превращения выбранных последовательностей VН и VL в гены полноразмерного антитела является встраивание их в экспрессирующие векторы, уже кодирующие константные области тяжелой цепи и легкой цепи, соответственно, так что VH-сегмент функционально связывается с СН-сегментом (сегментами) в данном векторе, и VL-сегмент функционально связывается с CL-сегментом в данном векторе. Дополнительно или альтернативно, рекомбинантный экспрессирующий вектор может кодировать сигнальный пептид, который облегчает секрецию цепи антитела из клетки-хозяина. Ген цепи антитела может быть клонирован в вектор таким образом, чтобы сигнальный пептид был связан в рамке считывания с амино-концом гена цепи антитела. Таким сигнальным пептидом может быть сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (т.е. сигнальный пептид из белка, не являющегося иммуноглобулином).
Кроме генов цепей антитела, рекомбинантные экспрессирующие векторы настоящего изобретения могут нести регуляторные последовательности, которые регулируют экспрессию генов цепей антитела в клетке-хозяине. Термин «регуляторная последовательность» включает промоторы, энхансеры и другие элементы регуляции экспрессии (например, сигналы полиаденилирования), которые регулируют транскрипцию или трансляцию генов цепей антитела. Такие регуляторные последовательности описаны, например, в Goeddel; Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990). Следует понимать, что конструирование экспрессирующего вектора, включающее отбор регуляторных последовательностей, может зависеть от таких факторов, как выбор клетки-хозяина для трансформации, желаемый уровень экспрессии белка, а также другие соображения. Предпочтительные регуляторные последовательности для экспрессии клеток-хозяев млекопитающих включают вирусные элементы, которые индуцируют высокие уровни экспрессии белка в клетках млекопитающих.
Кроме генов цепей антитела и регуляторных последовательностей, рекомбинантные экспрессирующие векторы настоящего изобретения могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например, сайты инициации репликации), и селектируемые маркерные гены. Селектируемый маркерный ген облегчает отбор клеток-хозяев, в которые был введен вектор (см., например, патенты США с номерами 4399216, 4634665 и 5179017, все, выданные на имя Axel et al.). Например, обычно селектируемый маркерный ген придает устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат, клетке-хозяину, в которую был введен данный вектор. Предпочтительные селектируемые маркерные гены включают ген дигидрофолатредуктазы (DHFR) (для использования в dhfr- клетках-хозяевах с отбором с использованием метотрексата/амплификации) и ген neo (для отбора с использованием G418).
Способы введения нуклеиновых кислот и векторов в выделенные клетки и культивирования и отбора трансформированных клеток-хозяев in vitro, известны в данной области и включают использование опосредованной хлоридом кальция трансформации, опосредованной DEAE-декстраном трансфекции, инфицирования, мембранного слияния с липосомами, бомбардировки высокой скорости покрытыми ДНК микроснарядами, прямой микроинъекции в отдельные клетки и электропорации (см., например, Sambrook et al., supra; Davis et al., Basic Methods in Molecular Biology, 2nd ed., McGraw-Hill Professional, 1995; и Neumann et al., EMBO J., 1: 841 (1982)).
Клетка, содержащая нуклеиновую кислоту или вектор настоящего изобретения, может быть использована для получения IL-1β-связывающего антитела, его фрагмента или его части (например, последовательности тяжелой цепи или последовательности легкой цепи, кодируемой нуклеиновой кислотой или вектором). После введения нуклеиновой кислоты или вектора настоящего изобретения в клетку данную клетку культивируют в условиях, подходящих для экспрессии кодируемой последовательности. Затем антитело, антигенсвязывающий фрагмент или часть данного антитела могут быть выделены из указанной клетки.
В некоторых вариантах осуществления два или более векторов, которые вместе кодируют IL-1β-связывающее антитело или его антигенсвязывающий фрагмент, могут быть введены в клетку. Например, первый вектор, кодирующий вариабельную область тяжелой цепи или полную последовательность тяжелой цепи, может быть введен в клетку-хозяина, и второй вектор, кодирующий вариабельную область легкой цепи или полную последовательность легкой цепи, также может быть введен в данную клетку-хозяина. Затем клетку культивируют в условиях, подходящих для экспрессии двух последовательностей, кодируемых первым и вторым векторами, и кодируемые полипептиды могут быть выделены из клетки-хозяина. Если необходимо, выделенные полипептиды могут быть затем объединены в условиях, которые стимулируют их ассоциацию и организацию в IL-1β-связывающее антитело или его антигенсвязывающий фрагмент. Альтернативно, первый и второй векторы могут быть введены в отдельные клетки, и продукты могут быть выделены из соответствующих клеток и объединены для получения IL-1β-связывающего антитела или его антигенсвязывающего фрагмента. Способы стимуляции ассоциации и организации компонентов антитела в антигенсвязывающие полипептиды были описаны в данной области. Подобным образом, способы выделения антитела, его антигенсвязывающего фрагмента или фрагментов тяжелой цепи и легкой цепи известны специалисту в данной области.
Эмбриональные стволовые клетки или оплодотворенные яйцеклетки, которые содержат нуклеиновую кислоту или вектор настоящего изобретения, могут быть использованы для генерирования трансгенного животного не человека. Способы получения трансгенных животных описаны Hofker et al., Transgenic Mouse: Methods and Protocols (Methods in Molecular Biology), Humana Press, Clifton, NJ, 2002. Трансгенные животные, не являющиеся человеком, которые содержат нуклеиновую кислоту или вектор, описанные в настоящем описании, могут быть использованы для экспрессии кодируемого антитела, антигенсвязывающего фрагмента или части данного антитела. Затем антитело, антигенсвязывающий фрагмент или часть данного антитела могут быть выделены из данного животного. Затем части антитела могут быть воссозданы (в комбинации с дополнительными частями антитела) в IL-1β-связывающее антитело или фрагмент антитела настоящего изобретения.
Клетки-хозяева могут быть прокариотическими клетками-хозяевами (такими как E. coli) или эукариотическими клетками-хозяевами (такими как клетка дрожжей, клетка насекомого или клетка позвоночного животного). Клетка-хозяин, при культивировании в подходящих условиях, экспрессирует IL-1β-связывающее антитело или фрагмент, которые могут быть затем собраны из культуральной среды (если клетка-хозяин секретирует их в среду) или непосредственно из клетки-хозяина, продуцирующей их (если они не секретируются). Отбор подходящей клетки-хозяина будет зависеть от различных факторов, таких как желаемые уровни экспрессии, модификации полипептида, которые являются желательными или необходимыми для активности, такие как гликозилирование или фосфорилирование, и легкость укладки в биологически активную молекулу. Ряд подходящих клеток-хозяев известны в данной области и многие доступны из Американской Коллекции Типовых Культур (АТСС), Manassas, Va. Примеры включают клетки млекопитающих, такие как клетки яичника китайского хомячка (СНО) (АТСС No. CCL61), СНО DHFR- клетки (Urlaub et al., Proc. Natl. Acad. Sci. USA 97, 4216-4220 (1980)), клетки почки эмбриона человека (НЕК) 293 или 293Т (АТСС No. СRL1573), клетки 3Т3 (АТСС No. CCL92) или клетки PER.C6. Отбор подходящих клеток-хозяев человека и способы трансформации, культивирования, амплификации, скрининга и получения и очистки продукта известны в данной области. Другими подходящими линиями клеток млекопитающих являются клеточные линии обезьяны COS-1 (ANCC No. CRL1650) и COS-7 (ANCC No. CRL1651) и клеточная линия CV-1 (ANCC No. CCL70). Кроме того, примеры клеток-хозяев млекопитающих включают линии клеток приматов, линии клеток птиц и линии клеток грызунов, включая трансформированные клеточные линии. Подходящими являются также нормальные диплоидные клетки, клеточные штаммы, полученные из культуры in vitro первичной ткани, а также первичных эксплантатов. Кандидатные клетки могут быть генотипически недостаточными в отношении гена для отбора или могут содержать ген доминантно действующего отбора. Другие подходящие линии клеток млекопитающих включают, но не ограничиваются ими, клетки нейробластомы N2A мыши, HeLa, клетки L-929 мыши, линии 3Т3, полученные из мышей Swiss, Balb-c или NIH, клеточные линии хомячка BHK или HaK, которые доступны из Американской Коллекции Типовых Культур (АТСС), Manassas, Va. Каждая из указанных клеточных линий известна специалистам в области экспрессии белков и доступна для указанных специалистов.
Бактериальные клетки также могут быть использованы в качестве клеток-хозяев, подходящих для настоящего изобретения. Например, различные штаммы E. coli (например, HB101 (ATCC No. 33694), DH5α, DH10 и МС1061 (ANCC No. 53338)) хорошо известны в качестве клеток-хозяев в области биотехнологии. Различные штаммы Bacillus subtilis, Pseudomonas spp., другие виды Bacillus spp., Streptomyces spp. и т.п. также могут быть использованы в данном способе.
Для экспрессии легкой и тяжелой цепей экспрессирующий вектор (векторы), кодирующие тяжелую и легкую цепи, трансфицируют в клетку-хозяина стандартными способами. Трансфекция включает большое разнообразие способов, обычно используемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, электропорацию, осаждение фосфатом кальция, опосредованную DEAE-декстраном трансфекцию и т.п. Хотя теоретически возможно экспрессировать IL-1β-связывающие антитела и фрагменты либо в прокариотических, либо в эукариотических клетках-хозяевах, экспрессия антител или фрагментов в эукариотических клетках и, наиболее предпочтительно, клетках-хозяевах млекопитающих является наиболее предпочтительной, так как такие эукариотические клетки и, в частности, клетки млекопитающих, с большей вероятностью, чем прокариотические клетки, могут быть собраны и могут секретировать правильно уложенное и иммунологически активное антитело. Клетки-хозяева млекопитающих для экспрессии рекомбинантных антител настоящего изобретения включают клетки яичника Китайского хомячка (СНО-клетки) (включая dhfr- СНО-клетки, описанные Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA 77:42164220, используемые с DHFR селектируемым маркером, например, как описано R.J. Kaufman and P.A. Sharp (1982) Mol. Biol. 159:601-621), клетки миеломы NS0, клетки COS и клетки SP2. При введении рекомбинантных экспрессирующих векторов, кодирующих гены антител, в клетки-хозяева млекопитающих антитела получают культивированием клеток-хозяев в течение периода времени, достаточного для осуществления экспрессии данного антитела в клетках-хозяевах или, более предпочтительно, секреции антитела в культуральную среду, в которой растут клетки-хозяева. Антитела могут быть извлечены из культуральной среды с использованием стандартных методов очистки белков.
Многие штаммы клеток дрожжей, известные в данной области, также доступны в качестве клеток-хозяев для экспрессии антител и фрагментов. Предпочтительные клетки дрожжей включают, например, Saccharomyces cerevisiae. Кроме того, если желательно, могут быть использованы системы клеток насекомых. Такие системы описаны, например, Kitts et al. (Biotechniques, 14, 810-817 (1993)), Lucklow (Curr. Opin. Biotechnol., 4, 564-572 (1993) и Lucklow et al. (J. Virol., 67, 4566-4579 (1993)). Предпочтительными клетками насекомых являются SF-9 и Hi5 (Inviyrogen, Carlsbad, Calif.).
Трансформация или трансфекция молекулы нуклеиновой кислоты, кодирующей IL-1β-связывающее антитело или фрагмент, в выбранную клетку-хозяина могут выполняться хорошо известными способами, включающими способы с использованием хлорида кальция, способы электропорации, способы микроинъекции, способы липофекции или способы с использованием DEAE-декстрана. Избранный способ будет зависеть отчасти от типа клетки-хозяина, которая будет использована. Такие способы и другие подходящие способы хорошо известны и представлены, например, Sambrook et al., supra.
Трансгенные животные также могут быть использованы для экспрессии гликозилированных антител и фрагментов. Например, можно использовать продуцирующих молоко трансгенных животных (например, корову или козу) и получать гликозилированные агенты связывания в молоке животного. Альтернативно, можно использовать растения для получения гликозилированных агентов селективного связывания.
Клетки-хозяева, содержащие экспрессирующий вектор, кодирующий IL-1β-связывающее антитело или фрагмент, могут культивироваться с использованием сред, известных в данной области. Такие среды обычно должны содержать все нутриенты, необходимые для роста и выживания этих клеток. Примеры сред для культивирования клеток E. coli включают бульон Луриа (LB) и/или Terrific («Потрясающий») бульон (ТВ). Подходящими средами для культивирования эукариотических клеток являются RPMI 1640, МЕМ, DMEM, которые могут быть дополнены сывороткой и/или факторами роста, в соответствии с конкретной культивируемой клеточной линией. Примером среды для культур клеток насекомых является среда Grace, необязательно дополненная гидролизатом дрожжей, гидролизатом лактальбумина и/или фетальной телячьей сывороткой.
К данным средам могут быть добавлены в качестве добавки антибиотик или другое соединение, полезное для селективного роста трансфицированных или трансформированных клеток. Соединение выбирают на основе селектируемого маркерного элемента, присутствующего на плазмиде, которой была трансформирована клетка-хозяин. Например, если селектируемым маркерным элементом является устойчивость к канамицину, соединением, добавляемым в культуральную среду, будет канамицин. Другие соединения для селективного роста включают ампициллин, тетрациклин и неомицин.
Количество IL-1β-связывающего антитела или фрагмента, продуцируемого клеткой-хозяином, может быть оценено с использованием известных в данной области способов. Такие способы включают, но без ограничения, Вестерн-блот-анализ, электрофорез в ДСН-полиакриламидном геле, неденатурирующий гель-электрофорез, ВЭЖХ-разделение, иммунопреципитация и/или анализы на активность.
Очистка IL-1β-связывающего антитела или фрагмента, которые были секретированы в клеточную среду, может быть выполнена с использованием различных методов, включающих аффинную, иммуноаффинную или ионообменную хроматографию, хроматографию с использованием молекулярных сит, препаративный гель-электрофорез или изоэлектрическое фокусирование, хроматофокусирование и высокоэффективную жидкостную хроматографию. Например, антитела, содержащие Fc-область, могут быть очищены аффинной хроматографией с белком А, который селективно связывается с Fc-областью. Модифицированные формы антитела или антигенсвязывающего фрагмента могут быть получены с аффинными метками, такими как гексагистидин или другой малый пептид, такой как FLAG (Eastman Kodak Co., New Haven, Conn.) или myc (Invitrogen), либо на их карбокси-, либо на амино-конце и очищены с использованием одностадийной аффинной колонки. Например, полигистидин связывается с высокой аффинностью и специфичностью с никелем, и, следовательно, аффинная колонка никеля (например, Qiagen® nickel columns) может быть использована для очистки имеющих полигистидиновую метку агентов связывания. (См., например, Ausubel et al., eds., Current Protocols in Molecular Biology, Section 10.11.8, John Wiley and Sons, New York (1993)). В некоторых случаях могут быть использованы более чем одна стадия очистки.
IL-1β-связывающие антитела или фрагменты, которые экспрессируются в прокариотических клетках-хозяевах, могут присутствовать в растворимой форме либо в периплазматическом пространстве, либо в цитоплазме или в нерастворимой форме в виде части внутриклеточных телец включения. IL-1β-связывающие антитела или фрагменты могут быть экстрагированы из клетки-хозяина с использованием любого подходящего метода, известного в данной области. Например, клетки-хозяева могут быть лизированы для высвобождения содержимого периплазмы/цитоплазмы Френч-прессом, гомогенизацией и/или обработкой ультразвуком с последующим центрифугированием.
Растворимые формы IL-1β-связывающего антитела или фрагмента, либо присутствующие в цитоплазме, либо высвобожденные из периплазматического пространства, могут быть дополнительно очищены с использованием известных в данной области методов, например, Fab-фрагменты высвобождают из бактериального периплазматического пространства способами осмотического шока.
Если образовались тельца включения, содержащие антитело или фрагмент, они часто связываются с наружной и/или внутренней клеточными мембранами и, следовательно, будут обнаруживаться прежде всего в материале осадка после центрифугирования. Затем материал осадка может быть обработан при крайних рН или хаотропным агентом, таким как детергент, гуанидин, производные гуанидина, мочевина или производные мочевины, в присутствии восстанавливающего агента, такого как дитиотреитол при щелочном рН или трискарбоксиэтилфосфин при кислом рН, для высвобождения, разрушения и солюбилизации телец включения. Затем растворимые антитело или фрагмент могут быть подвергнуты анализу с использованием гель-электрофореза, иммунопреципитации или т.п. Если желательным является выделение солюбилизированного антитела или антигенсвязывающего фрагмента, выделение может быть выполнено с использованием стандартных способов, таких как способы, представленные ниже и Marston et al. (Meth. Enz., 182:264-275 (1990)).
В некоторых случаях, IL-1β-связывающее антитело или фрагмент может не быть активным после выделения. Различные способы «рефолдинга» или превращения полипептида в его третичную структуру и генерирования дисульфидных связей могут быть использованы для восстановления биологической активности. Такие способы включают подвергание солюбилизированного полипептида действию рН, обычно более 7, и в присутствии конкретной концентрации хаотропа. Выбор хаотропа очень похож на способы выбора, используемые для солюбилизации телец включения, но обычно хаотроп используют при более низкой концентрации и он необязательно является таким же хаотропом, который использовали для солюбилизации. В большинстве случаев раствор для рефолдинга/окисления будет также содержать восстанавливающий агент или восстанавливающий агент плюс его окисленная форма в конкретном соотношении для генерирования конкретного окислительно-восстановительного потенциала, делающего возможным перетасовку дисульфидов при образовании цистеинового мостика (цистеиновых мостиков) белка. Некоторые из обычно используемых окислительно-восстановительных пар включают цистеин/цистамин, глутатион (GSH)/дитиобис GSH, хлорид двухвалентной меди, дитиотреитол (DTT)/дитиан DTT и 2-меркаптоэтанол (bME)/дитио-b(ME). Во многих случаях, может быть использован сорастворитель для увеличения эффективности рефолдинга, и обычные реагенты, используемые для этой цели, включают глицерин, полиэтиленгликоль различных молекулярных масс, аргинин и т.п.
IL-1β-связывающие антитела или фрагменты настоящего изобретения могут быть также получены способами химического синтеза (например, твердофазным пептидным синтезом) с использованием способов, известных в данной области, таких как способы, представленные Merryfield et al. (1963), J. Am. Chem. Soc., 85: 2149, Houghten et al. (1985) Proc. Natl. Acad. Sci. USA, 82: 5132 и Stewart and Young (1984), Solid Phase Peptide Synthesis, Pierce Chemical Co., Rockford, Ill. Такие антитела или фрагменты могут быть синтезированы с метионином или без метионина на амино-конце. Химически синтезированные антитела и антигенсвязывающие фрагменты могут быть окислены с использованием способов, представленных в указанных ссылках, с образованием дисульфидных мостиков. Полученные таким образом антитела и фрагменты будут сохранять по меньшей мере одну биологическую активность, ассоциированную с нативным или рекомбинантно полученным IL-1β-связывающим антителом или фрагментом.
Фармацевтические композиции
IL-1β-связывающие антитела, фрагменты антител, нуклеиновые кислоты или векторы настоящего изобретения могут быть приготовлены в виде композиций, в частности фармацевтических композиций. Такие композиции содержат терапевтически или профилактически эффективное количество IL-1β-связывающего антитела, фрагмента антитела, нуклеиновой кислоты или вектора настоящего изобретения в смеси с подходящим носителем, например фармацевтически приемлемым агентом. Как правило, IL-1β-связывающие антитела, фрагменты антител, нуклеиновой кислоты или векторы настоящего изобретения являются достаточно очищенными для введения животному перед приготовлением в виде фармацевтической композиции.
Фармацевтически приемлемые агенты для использования в данных фармацевтических композициях включают носители, эксципиенты, разбавители, антиоксиданты, консерванты, красящие, ароматизирующие и разбавляющие агенты, эмульгирующие агенты, суспендирующие агенты, растворители, наполнители, объемные агенты, буферы, носители доставки, агенты тоничности, сорастворители, увлажняющие агенты, комплексообразующие агенты, буферирующие агенты, антимикробные вещества и поверхностно-активные вещества.
Нейтральный забуференный солевой раствор или солевой раствор, смешанный с сывороточным альбумином, являются примерами подходящих носителей. Фармацевтические композиции могут содержать антиоксиданты, такие как аскорбиновая кислота; низкомолекулярные полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахароспирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как Твин, плуроники или полиэтиленгликоль (ПЭГ). Также в качестве примера, подходящие увеличивающие тоничность агенты включают галогениды щелочных металлов (предпочтительно хлорид натрия или калия), маннит, сорбит и т.п. Подходящие консерванты включают бензалконийхлорид, тимеросал, фенетиловый спирт, метилпарабен, пропилпарабен, хлорексидин, сорбиновую кислоту и т.п. В качестве консерванта также может быть использован пероксид водорода. Подходящие сорастворители включают глицерин, пропиленгликоль и ПЭГ. Подходящие комплексообразующие агенты включают кофеин, поливинилпирролидон, бета-циклодекстрин или гидроксипропил-бета-циклодекстрин. Подходящие поверхностно-активные вещества или увлажняющие агенты включают сложные эфиры сорбитана, полисорбаты, такие как полисорбат 80, трометамин, лецитин, холестерин, тилоксапал и т.п. Буферы могут быть общепринятыми буферами, такими как ацетатный, цитратный, фосфатный, бикарбонатный буферы или Трис-HCl. Ацетатный буфер может иметь рН приблизительно 4-5,5, и Трис-буфер может иметь рН приблизительно 7-8,5. Дополнительные фармацевтические агенты представлены в Remington's Pharmaceutical Sciences, 18th Edition, A.R. Gennaro, ed., Mack Publishing Company, 1990.
Композиция может быть в жидкой форме или в лиофилизированной или высушенной замораживанием форме и может содержать один или несколько лиопротекторов, эксципиентов, поверхностно-активных веществ, высокомолекулярных структурных добавок и/или наполнителей (см., например, патенты США 6685940, 6566329 и 6372716). В одном варианте осуществления используют лиопротектор, который является нередуцирующим сахаром, таким как сахароза, лактоза или трегалоза. Количество обычно включаемого лиопротектора является таким, что, после воссоздания, полученная готовая форма является изотонической, хотя гипертонические или слегка гипотонические готовые формы также могут быть подходящими. Кроме того, количество лиопротектора должно быть достаточным для предотвращения неприемлемого количества деградации и/или агрегации белка после лиофилизации. Примеры концентраций лиопротекторов для сахаров (например, сахарозы, лактозы, трегалозы) в предварительно лиофилизированной композиции составляют приблизительно от 10 мМ до приблизительно 400 мМ. В другом варианте осуществления включено поверхностно-активное вещество, такое как, например, неионогенные поверхностно-активные вещества и ионогенные поверхностно-активные вещества, такие как полисорбаты (например, полисорбат 20, полисорбат 80); полоксамеры (например, полоксамер 188); фениловые эфиры поли(этиленгликоля) (например, Тритон); додецилсульфат натрия (ДСН); лаурилсульфат натрия; октилгликозид натрия; лаурил-, миристил-, линолеил- или стеарилсульфобетаин; лаурил-, миристил-, линолеил- или стеарилсаркозин; линолеил-, миристил- или цетилбетаин; лауроамидопропил-, кокамидопропил-, линолеамидопропил-, миристамидопропил-, пальмидопропил- или изостеарамидопропилбетаин (например, лауроамидопропил); миристамидопропил-, пальмидопропил- или изостеарамидопропилдиметиламин; натрийметилкокоил- или динатрийметилолеилтаурат; и MONAQUAT™, series (Mona Industries, Inc., Paterson, N.J.), полиэтилгликоль, полипропилгликоль и сополимеры этилена и пропиленгликоля (например, Pluronics, PF68 и т.д.). Количества поверхностно-активных веществ, приведенных в качестве примеров в настоящем описании, которые могут присутствовать в предварительно лиофилизированной композиции, составляют приблизительно 0,001-0,5%. Высокомолекулярные структурные добавки (например, наполнители, связующие вещества) могут включать в себя, например, аравийскую камедь, альбумин, альгиновую кислоту, фосфат кальция (двухосновный), целлюлозу, карбоксиметилцеллюлозу, натрийкарбоксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу, декстран, декстрин, декстраты, сахарозу, тилозу, предварительно желатинизированный крахмал, сульфат кальция, амилозу, глицин, бентонит, мальтозу, сорбит, этилцеллюлозу, динатрийгидрофосфат, динатрийфосфат, динатрийпиросульфит, поливиниловый спирт, желатин, глюкозу, гуаровую камедь, жидкую глюкозу, прессуемый сахар, силикат магния-алюминия, мальтодекстрин, полиэтиленоксид, полиметакрилаты, повидон, альгинат натрия, трагакант, микрокристаллическую целлюлозу, крахмал и зеин. Концентрации высокомолекулярных структурных добавок, приведенных в качестве примеров в настоящем описании, находятся в диапазоне приблизительно от 0,1 до 10% масс. В других вариантах осуществления может быть включен наполнитель (например, маннит, глицин).
Композиции могут быть подходящими для парентерального введения. Композиции, приведенные в качестве примеров в настоящем описании, пригодны для инъекции или инфузии животному любым способом, доступным квалифицированному работнику, таким как внутрисуставный, подкожный, внутривенный, внутримышечный, внутрибрюшинный, интрацеребральный (интрапаренхимный), интрацеребровентрикулярный, внутримышечный, внутриглазной, внутриартериальный способы или способ введения внутрь повреждения. Парентеральная готовая форма будет обычно стерильным, апирогенным, изотоническим водным раствором, необязательно содержащим фармацевтически приемлемые консерванты.
Примеры неводных растворителей включают пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая солевой раствор и забуференные среды. Парентеральные носители включают раствор хлорида натрия, раствор декстрозы Рингера, декстрозу и хлорид натрия, содержащий лактат раствор Рингера или нелетучие масла. Внутривенные носители включают вещества-пополнители жидкости и нутриентов, электролитов, такие как вещества-пополнители на основе декстрозы Рингера и т.п. Могут также присутствовать консерванты и другие добавки, такие как, например, антимикробные агенты, антиоксиданты, хелатообразующие агенты, инертные газы и т.п. См. справочник Remington's Pharmaceutical Sciences, 16th Ed., Mack Rds., 1980, который включен в настоящее описание посредством ссылки.
Описанные в настоящем описании фармацевтические композиции могут быть приготовлены для регулируемой или непрерывной доставки таким образом, чтобы обеспечивалась локальная концентрация данного продукта (например, эффект болюса, депо), и/или увеличенная стабильность или увеличенный полупериод существования в конкретном локальном окружении. Композиции могут содержать готовую форму IL-1β-связывающих антител, фрагментов антител, нуклеиновых кислот или векторов настоящего изобретения с состоящими из частиц препаратами полимерных соединений, таких как полимолочная кислота, полигликолевая кислота и т.д., а также такими агентами, как биодеградируемый матрикс, инъецируемые микросферы, микрокапсулярные частицы, микрокапсулы, гранулы из биоразрушаемых частиц, липосомы и имплантируемые средства доставки, которые обеспечивают регулируемое или непрерывное высвобождение активного агента, который затем может доставляться в виде депо-инъекции. Способы приготовления таких средств непрерывной или регулируемой доставки известны, и были разработаны различные полимеры и использованы для регулируемого высвобождения и доставки лекарственных средств. Такие полимеры являются обычно биодеградируемыми и биосовместимыми. Полимерные гидрогели, включая полимерные гидрогели, образованные комплексообразованием энантиомерного полимера или полипептидных сегментов, и гидрогели с чувствительными к температуре или рН свойствами, могут быть желательными для обеспечения эффекта депо лекарственного средства вследствие мягких и водных условий, используемых при включении биологически активных белковых агентов (например, антител). См., например, описание пористых полимерных микрочастиц регулируемого высвобождения для доставки фармацевтических композиций в публикации заявки PCT WO 93/15722.
Подходящие материалы для этой цели включают полилактиды (см., например, патент США 3773919), полимеры поли(а-гидроксикарбоновых кислот), такие как поли-D-(-)-3-гидроксимасляная кислота (ЕР 133988А), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата (Sidman et al., Biopolymers, 22: 547-556 (1983)), поли(2-гидроксиэтилметакрилат) (Langer et al., J. Biomed. Mater. Res., 15: 167-277 (1981) и Langer, Chem. Tech., 12: 98-105 (1982)), этиленвинилацетат или поли-D-(-)-3-гидроксимасляную кислоту. Другие биодеградируемые полимеры включают поли(лактоны), поли(ацетали), поли(ортоэфиры) и поли(ортокарбонаты). Композиции непрерывного высвобождения могут также содержать липосомы, которые могут быть приготовлены с использованием любого из нескольких способов, известных в данной области (см., например, Eppstein et al., Proc. Natl. Acad. Sci. USA, 82: 3688-92 (1985)). Сам носитель или продукты его деградации должны быть нетоксичными в ткани-мишени и не должны дополнительно ухудшать данное состояние. Это может быть определено рутинным скринингом на моделях нарушения-мишени у животных или, если такие модели недоступны, здоровых животных.
Микроинкапсулирование рекомбинантных белков для непрерывного высвобождения успешно проводилось с гормоном роста человека (rhGH), интерфероном (rhIFN--), интерлейкином-2 и MN rgp120. Johnson et al., Nat. Med., 2: 795-799 (1996); Yasuda, Biomed. Ther., 27:1221-1223 (1993); Hora et al., Bio/Technology, 8:755-758 (1990); Cleland, “Design and Production of Single Immunization Vaccines Using Polylactide Polyglycolide Microspere Systems,” in Vaccine Design: The Subunit and Adjuvant Approach, Powell and Newman, eds., (Plenum Press: New York, 1995), pp. 439-462; WO 97/03692, WO 96/40072, WO 96/07399 и патент США № 5654010. Готовые формы непрерывного высвобождения таких белков были развиты с использованием сополимера молочной кислоты и гликолевой кислоты (PLGA) вследствие его биосовместимости и широкого диапазона биодеградируемых свойств. Продукты деградации PLGA, молочной и гликолевой кислот могут быстро выводиться из организма человека. Кроме того, деградируемость такого полимера может зависеть от его молекулярной массы и состава. Lewis, “Controlled release of bioactive agents from lactide/glycolide polymer,” in: M. Chasin and R. Langer (Eds.), Biodegradable Polymers as Drug Delivery Systems (Marcel Dekker: Yew York, 1990), pp. 1-41. Дополнительные примеры композиций непрерывного высвобождения включают, например, ЕР 58481А, патент США № 3887699, ЕР 158277А, Canadian Patent No. 1176565, U. Sidman et al., Biopolymers 22, 547 [1983], R. Langer et al., Chem. Tech. 12, 98 [1982], Sinha et al., J. Cotrol. Release 90, 261 [2003], Zhu et al., Nat. Biotechnol. 18, 24 [2000] и Dai et al., Colloids Surf B Biointerfaces 41, 117 [2005].
Биоадгезивные полимеры также обсуждаются для использования в композициях или с композициями настоящего изобретения. Биоадгезивы являются синтетическими и природными материалами, способными прикрепляться к биологическим субстратам на продолжительные периоды времени. Например, карбопол и поликарбофил, оба являются синтетическими сшитыми производными поли(акриловой кислоты). Биоадгезивные системы доставки на основе природных веществ включают, например, гиалуроновую кислоту, также известную как гиалуронан. Гиалуроновая кислота является природным мукополисахаридом, состоящим из остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина. Гиалуроновая кислота обнаруживается во внеклеточном тканевом матриксе позвоночных, включая соединительные ткани, а также в синовиальной жидкости и в жидкой и водной части стекловидного тела глаза. Этерифицированные производные гиалуроновой кислоты использовали для получения микросфер для использования в доставке, которые являются биосовместимыми и биодеградируемыми (см., например, Cortivo et al., Biomaterials (1991) 12:727-730; Европейская публикация № 517565; международная публикация № WO 96/29998; Illum et al., J. Controlled Rel. (1994) 29:133-141). Примеры содержащих гиалуроновую кислоту композиций настоящего изобретения содержат полимер эфира гиалуроновой кислоты в количестве приблизительно от 0,1% до приблизительно 40% (масса/масса) IL-1β-связывающего антитела или фрагмента относительно полимера гиалуроновой кислоты.
Как биодеградируемые, так и небиодеградируемые полимерные матриксы могут быть использованы для доставки композиций настоящего изобретения, и такие полимерные матриксы могут содержать природные или синтетические полимеры. Предпочтительными являются биодеградируемые матриксы. Период времени, на протяжении которого происходит высвобождение, основан на выборе полимера. Обычно наиболее желательным является высвобождение на протяжении периода в диапазоне от нескольких часов до трех-двенадцати месяцев. Примеры синтетических полимеров, которые могут быть использованы для образования биодеградируемой системы доставки, включают: полимеры молочной кислоты и гликолевой кислоты, полиамиды, поликарбонаты, полиалкилены, полиалкиленгликоли, полиалкиленоксиды, полиалкилентерефталаты, поливиниловые спирты, поливиниловые простые эфиры, поливиниловые сложные эфиры, поливинилгалогениды, поливинилпирролидон, полигликодиды, полисилоксаны, полиангидриды, полиуретаны и их сополимеры, поли(масляную кислоту), поли(валериановую кислоту), алкилцеллюлозу, гидроксиалкилцеллюлозы, простые эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, полимеры эфиров акриловой и метакриловой кислот, метилцеллюлозу, этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксибутилметилцеллюлозу, ацетат целлюлозы, пропионат целлюлозы, ацетатбутират целлюлозы, ацетатфталат целлюлозы, карбоксиэтилцеллюлозу, триацетат целлюлозы, натриевую соль сульфата целлюлозы, поли(метилметакрилат), поли(этилметакрилат), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат), поли(октадецилакрилат), полиэтилен, полипропилен, поли(этиленгликоль), поли(этиленоксид), поли(этилентерефталат), поли(виниловые спирты), поливинилацетат, поливинилхлорид, полистирол и поливинилпирролидон. Примеры природных полимеров включают альгинат и другие полисахариды, включая декстран и целлюлозу, коллаген, его химические производные (замены, добавления химических групп, например, алкила, алкилена, гидроксилирования, окисления и другие модификации, рутинно выполняемые специалистами в данной области), альбумин и другие гидрофильные белки, зеин и другие проламины и гидрофобные белки, сополимеры и их смеси. Обычно материалы разрушаются либо ферментативным гидролизом, либо под воздействием воды in vivo, поверхностной эрозией или эрозией в массе. Данный полимер необязательно находится в форме гидрогеля (см., например, WO 04/009664, WO 05/087201, Sawhney, et al., Macromolecules, 1993, 26, 581-587), который может абсорбировать приблизительно до 90% его массы в воде и, кроме того, необязательно сшит с мультивалентными ионами или другими полимерами.
Системы доставки включают также неполимерные системы, которые являются липидами, включая стерины, такие как холестерин, сложные эфиры холестерина и жирных кислот или нейтральными жирами, такими как моно-, ди- и триглицериды; гидрогелевые системы высвобождения; системы из силастика (органосиликонового эластомера); системы на основе пептидов; восковые покрытия; прессованные таблетки, использующие общепринятые связующие агенты и эксципиенты; частично слитые имплантаты; и т.п. Конкретные примеры включают, но не ограничиваются ими: (а) эрозионные системы, в которых продукт содержится в матриксе, такие как системы, описанные в патентах США с номерами 4452775, 4675189 и 5736152, и (b) диффузионные системы, в которых продукт проникает при регулируемой скорости из полимера, такие как системы, описанные в патентах США с номерами 3854480, 5133974 и 5407686. Липосомы, содержащие этот продукт, могут быть приготовлены известными способами, такими как, например, (DE 3218121; Epstein et al., Proc. Natl. Acad. Sci. USA, 82: 3688-3692 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA, 77: 4030-4034 (1980; EP 52322; EP 36676; EP 88046; EP 143949; EP 142641; заявка на патент Японии 83-11808; патенты США с номерами 5585045 и 4544545 и ЕР 102324).
Альтернативно или дополнительно, композиции могут вводиться локально посредством имплантации в пораженную зону мембраны, губки или другого подходящего материала, на котором могут быть абсорбированы или в котором могут быть инкапсулированы IL-1β-связывающее антитело, фрагмент антитела, нуклеиновая кислота или вектор настоящего изобретения. При использовании устройства имплантации данное устройство может быть имплантировано в любые подходящие ткань или орган, и доставка IL-1β-связывающего антитела, фрагмента антитела, нуклеиновой кислоты или вектора настоящего изобретения могут происходить непосредственно через данное устройство посредством болюса или посредством непрерывного введения, или с использованием катетера для непрерывной инфузии.
Фармацевтическая композиция, содержащая IL-1β-связывающее антитело, фрагмент антитела, нуклеиновую кислоту или вектор настоящего изобретения, может быть приготовлена для ингаляции, например ингаляции в виде сухого порошка. Ингаляционные растворы могут быть также приготовлены в ожиженном пропелленте для аэрозольной доставки. Еще в одном приготовлении растворы могут быть распыляемыми. Дополнительные фармацевтические композиции для легочного введения включают композиции, описанные, например, в публикации заявки PCT WO 94/20069, в которой описана легочная доставка химически модифицированных белков. Для легочной доставки размер частиц должен быть подходящим для доставки в дистальное легкое. Например, размер частиц может составлять от 1 мкм до 5 мкм; однако могут быть использованы более крупные частицы, например, если каждая частица является достаточно пористой.
Некоторые готовые формы, содержащие IL-1β-связывающие антитела, фрагменты антител, нуклеиновые кислоты или векторы настоящего изобретения, могут вводиться перорально. Готовые формы, вводимые таким способом, могут быть приготовлены с носителями или без носителей, которые обычно используются в компаундировании твердых дозированных форм, таких как таблетки и капсулы. Например, капсула может быть предназначена для высвобождения активной части готовой формы в некоторой точке в желудочно-кишечном тракте, когда биодоступность является максимизированной, и предварительная системная деградация минимизирована. Для облегчения абсорбции агента селективного связывания могут быть включены дополнительные агенты. Могут быть также использованы разбавители, ароматизирующие вещества, воски с низкой точкой плавления, растительные масла, лубриканты, суспендирующие агенты, дезинтегрирующие таблетку агенты и связующие агенты.
Другой препарат может содержать эффективное количество IL-1β-связывающего антитела, фрагмента антитела, нуклеиновой кислоты или вектора настоящего изобретения в смеси с нетоксичными эксципиентами, которые пригодны для приготовления таблеток. Растворением таблеток в стерильной воде или другом подходящем носителе могут быть получены растворы в единичной дозированной форме. Подходящие эксципиенты включают, но не ограничиваются ими, инертные разбавители, такие как карбонат кальция, карбонат или бикарбонат натрия, лактоза или фосфат кальция; или связующие агенты, такие как крахмал, желатин или аравийская камедь; или лубриканты, такие как стеарат магния, стеариновая кислота или тальк.
Подходящие и/или предпочтительные фармацевтические композиции могут быть определены согласно настоящему изобретению и общего знания технологии получения, в зависимости от предполагаемого способа введения, формата доставки и желаемой дозы. Независимо от способа введения, эффективные дозы могут быть рассчитаны в соответствии с массой тела пациента, площадью поверхности тела или размера органа. Дополнительное уточнение расчетов для определения подходящей дозы для лечения, включающее каждую из описываемых готовых форм, выполняют рутинным, известным в данной области образом, и оно входит в пределы задач, рутинно решаемых в данной области. Подходящие дозы могут быть получены с использованием соответствующих данных зависимости доза-ответ.
Дополнительные готовые формы будут очевидными в свете настоящего описания, включая готовые формы, содержащие IL-1β-связывающие антитела, фрагменты антител, нуклеиновые кислоты или векторы настоящего изобретения в комбинации с одним или несколькими другими терапевтическими агентами. Например, в некоторых готовых формах IL-1β-связывающее антитело, фрагмент антитела, нуклеиновую кислоту или вектор настоящего изобретения готовят со вторым ингибитором пути передачи сигнала IL-1. Репрезентативные вторые ингибиторы включают, но не ограничиваются ими, антитела, фрагменты антител, пептиды, полипептиды, соединения, нуклеиновые кислоты, векторы и фармацевтические композиции, такие как, например, компоненты, описанные в US 6899878, US 2003022869, US 20060094663, US 20050186615, US 20030166069, WO/04022718, WO/05084696, WO/05019259. Например, композиция может содержать IL-1β-связывающее антитело, фрагмент антитела, нуклеиновую кислоту или вектор настоящего изобретения в комбинации с IL-1β-связывающим антителом, фрагментом или нуклеиновой кислотой или вектором, кодирующими такое антитело или фрагмент.
Фармацевтические композиции могут содержать IL-1β-связывающие антитела и фрагменты в комбинации с другими активными агентами. Такими комбинациями являются комбинации, которые можно использовать для их предполагаемой цели. Активные агенты, представленные ниже, являются иллюстративными для указанных целей и не ограничивающими настоящее изобретение. Комбинации, которые являются частью настоящего изобретения, могут представлять собой антитела и фрагменты настоящего изобретения и по меньшей мере один дополнительный агент, выбранный из приведенных ниже перечней. Такая комбинация может также включать более одного дополнительного агента, например, два или три дополнительных агента, если комбинация является такой, что образованная композиция может выполнять предполагаемую для нее функцию
Активные агенты или комбинации с антителами или фрагментами настоящего изобретения включают нестероидное противовоспалительное лекарственное средство (NSAID), такое как аспирин, ибупрофен и другие производные пропионовой кислоты (алминопрофен, беноксапрофен, буклоксовую кислоту, карпрофен, фенбуфен, фенпрофен, флупрофен, флубипрофен, индопрофен, кетопрофен, миропрофен, напроксен, оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновую кислоту и тиоксапрофен), производные уксусной кислоты (индометацин, ацеметацин, алклофенак, клиданак, диклофнак, фенклофенак, фенклозовую кислоту, фентиазак, фуирофенка, ибуфенак, изоксепак, окспинак, сулиндак, тиопинак, толметин, зидометацин и зомепирак), производные фенамовой кислоты (флуфенамовую кислоту, меклофенамовую кислоту, мефенамовую кислоту, нифлумовую кислоту и толфенамовую кислоту), производные бифенилкарбоновой кислоты (дифлунисал и флуфенисал), оксикамы (изоксикам, пироксикам, судоксикам и теноксикам), салицилаты (ацетилсалициловую кислоту, сульфасалазин) и пиразолоны (апазон, безпиперилон, фепразон, мофебутазон, оксифенбутазон, фенилбутазон). Другие комбинации включают ингибиторы циклооксигеназы-2 (СОХ-2). Другие активные агенты для комбинации включают стероиды, такие как преднизолон, преднизон, метилпреднизолон, бетаметазон, дексаметазон или гидрокортизон. Такая комбинация может быть особенно полезной, так как одно или несколько побочных действий стероида могут быть уменьшены или даже элиминированы снижением дозы стероида, необходимой при лечении пациентов в комбинации с данными антителами и фрагментами.
Дополнительные примеры активных агентов для комбинаций с IL-1β-связывающими антителами или фрагментами для ревматоидного артрита включают цитокин-супрессивные противовоспалительные лекарственные средства (CSAID); антитела против других цитокинов или факторов роста человека или антагонисты других цитокинов или факторов роста человека, например TNF, LT, IL-1β, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF или PDGF. IL-1β-связывающие антитела и фрагменты могут быть комбинированы с антителами против молекул клеточной поверхности, таких как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (В7.2) CD90 или их лиганды, включая CD154 (gp39 или CD40L).
Предпочтительные комбинации активных агентов могут создавать препятствие в различных точках в аутоиммунном и последующем воспалительном каскаде; предпочтительные примеры включают антагонисты TNF, такие как химерные, гуманизированные или человеческие TNF-антитела, D2E7, сА2 (Remiсade™), CDP 571, фрагменты анти-TNF-антитела (например, CDР870) и растворимые рецепторы TNF р55 и р75, их производные (p75TNFRIgG (Enbrel™) или р55TNFRIgG (Lenercept), растворимый рецептор IL-13 (sIL-13), а также ингибиторы TNFα-превращающего фермента (TAGE); подобным образом, ингибиторы IL-1 (например, ингибиторы интерлейкин-1-превращающего фермента, такие как Vx740 или IL-1Ra и т.д.) могут быть эффективными по той же причине. Другие предпочтительные комбинации содержат интерлейкин-11, анти-Р7 и гликопротеиновый лиганд р-селектина (PSGL). Еще одной комбинацией являются другие ключевые участники аутоиммунной реакции, которые могут действовать параллельно функции IL-1β, в зависимости от функции IL-1β или вместе с функцией IL-1β.
Активные агенты для болезни Крона, в которых антитело или антигенсвязывающая часть могут быть комбинированы, включают антагонисты TNF, например анти-TNF-антитела, D2E7, сА2 (Remiсade™), CDP 571, фрагменты анти-TNF-антитела (например, CDР870), TNFR-Ig-конструкции (p75TNFRIgG (Enbrel™) и р55TNFRIgG (Lenercept), анти-Р7, гликопротеиновый лиганд р-селектина (PSGL), растворимый рецептор IL-13 (sIL-13) и ингибиторы PDE4. IL-1β-связывающие антитела или фрагменты могут быть комбинированы с кортикостероидами, например буденозидом и дексаметазоном. IL-1β-связывающие антитела или фрагменты также могут быть комбинированы с такими агентами, как сульфасалазин, 5-аминосалициловая кислота и олсалазин, и агентами, которые препятствуют синтезу или действию провоспалительных цитокинов, таких как IL-1, например, ингибиторами превращающего IL-1 фермента (например, Vx740) и IL-1Ra. IL-1β-связывающие антитела или фрагменты также могут быть использованы с ингибиторами передачи сигнала Т-клеток, например ингибиторами тирозинкиназы 6-меркаптопуринами. IL-1β-связывающие антитела или фрагменты могут быть комбинированы с IL-11.
Другие примеры активных агентов для рассеянного склероза, с которыми могут быть комбинированы IL-1β-связывающие антитела или фрагменты, включают кортикостероиды; преднизолон; метилпреднизолон; азатиоприн; циклофосфамид; циклоспорин; метотрексат; 4-аминопурин; тизанидин; интерферон-β1а (Avonex; Biogen); интерферон-β1b (бетасерон; Chiron/Berlex); сополимер 1 (Cop-1; Copaxon; Teva Pharmaceutical Industries, Inc.); гипербарический кислород; внутривенный иммуноглобулин; клабрибин; антитела против других цитокинов или факторов роста человека или антагонисты других цитокинов или факторов роста человека, например TNF, LT, IL-1β, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF или PDGF. IL-1β-связывающие антитела или фрагменты могут быть комбинированы с антителами против молекул клеточной поверхности, таких как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90 или их лиганды. IL-1β-связывающие антитела или фрагменты могут быть комбинированы с такими агентами, как метотрексат, циклоспорин, FK506, рапамицин, микофенолат-мофетил, лефлуномид, NSAID, например ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонист аденозина, антитромботические агенты, ингибиторы комплемента, адренергические агенты, агенты, которые препятствуют передаче сигнала провоспалительными цитокинами, такими как TNFα или IL-1 (например, IRAK, NIK, IKK, p38 или ингибиторы киназы МАР), ингибиторы превращающего IL-1 фермента (например, Vx740), анти-Р7, гликопротеиновый лиганд р-селектина (PSGL), ингибиторы ТАСЕ, ингибиторы передачи сигнала Т-клеток, такие как ингибиторы киназ, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензинпревращающего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые рецепторы TNF р55 или р75, sIL-1RI, sIL-1RII, sIL-6R, растворимый рецептор IL-13 (sIL-13)) и противовоспалительные цитокины (например, IL-4, IL-10, IL-13 и TGFβ).
Предпочтительные примеры активных агентов для рассеянного склероза, в которых могут быть комбинированы IL-1β-связывающие антитела или фрагменты, включают интерферон-β, например IFNβ1а и IFNβ1b; копаксон, кортикостероиды, ингибиторы IL-1, ингибиторы TNF и антитела против лиганда CD40 и лиганда CD80.
Фармацевтические композиции могут содержать терапевтически эффективное количество или профилактически эффективное количество IL-1β-связывающих антител или фрагментов. Терапевтически эффективным количеством называют количество, эффективное в дозах и в течение необходимых периодов времени, для достижения желаемого терапевтического результата. Терапевтически эффективное количество антитела или части антитела может варьироваться в соответствии с такими факторами, как состояние болезни, возраст, пол и масса индивидуума и способность антитела или части антитела индуцировать желаемую реакцию у данного индивидуума. Терапевтически эффективное количество является также количеством, в котором любые токсичные или вредные эффекты данного антитела или части антитела перевешиваются терапевтически благоприятными эффектами. Профилактически эффективным количеством называют количество, эффективное в дозах и в течение необходимых периодов времени, для достижения желаемого профилактического результата. Обычно, поскольку профилактическую дозу используют у субъектов до или на более ранней стадии заболевания, профилактически эффективное количество будет меньше, чем терапевтически эффективное количество.
IL-1β-связывающие антитела, фрагменты антител, нуклеиновые кислоты или векторы настоящего изобретения могут быть использованы отдельно или в комбинации с другими активными агентами, которые могут находиться в той же самой фармацевтической композиции или в другой фармацевтической композиции. Например, такие другие активные агенты могут содержать (i) антагонист IL-1 (например, рекомбинантный IL-1Ra или IL-trap), (ii) антагонист рецептора интерлейкина-1, (iii) растворимый TNFα-рецептор-1, (iv) растворимый TNF-рецептор-2 (например, этанерцепт), (v) ингибитор TNF (например, антитело, такое как D2E7) и/или (vi) агент противораковой терапии. Так, например, один или несколько из указанных компонентов могут быть включены в композицию настоящего изобретения с IL-1β-связывающим антителом, фрагментом антитела, нуклеиновой кислотой или вектором настоящего изобретения.
В некоторых случаях может быть желательным использование фармацевтической композиции, содержащей IL-1β-связывающее антитело, фрагмент антитела, нуклеиновую кислоту или вектор настоящего изобретения, в способе ex vivo. В этом случае клетки, ткани или органы, которые были извлечены у пациента, подвергают действию фармацевтических композиций, содержащих IL-1β-связывающее антитело, фрагмент антитела, нуклеиновую кислоту или вектор настоящего изобретения, после чего указанные клетки, ткани и/или органы имплантируют затем обратно данному пациенту.
В некоторых случаях, композиция, содержащая IL-1β-связывающее антитело, фрагмент антитела, нуклеиновую кислоту или вектор, может быть доставлена имплантацией пациентам клеток, которые были генетически сконструированы, как описано в настоящем описании, для экспрессии и секреции полипептидов, агентов селективного связывания, фрагментов, вариантов или производных. Такие клетки могут быть клетками животного или человека и могут быть получены из собственной ткани пациента или из другого источника либо человека, либо не человека. Необязательно, клетки могут быть иммортализованными клетками. Однако для уменьшения шансов иммунологической реакции предпочтительно, чтобы клетки были инкапсулированы во избежание инфильтрации окружающих тканей. Материалы инкапсулирования обычно представляют собой биосовместимые, полупроницаемые полимерные покрытия или мембраны, которые делают возможным высвобождение белкового продукта (белковых продуктов), но предотвращают деструкцию этих клеток иммунной системой пациента или другими вредными факторами из окружающих тканей.
Способы, используемые для мембранного инкапсулирования клеток, известны, и приготовление инкапсулированных клеток и их имплантация пациентам были описаны, например, в патентах США 4892538, 5011472 и 5106627. Система для инкапсулирования живых клеток описана в публикации заявки PCT WO 91/10425. Способы образования различных других средств непрерывной или регулируемой доставки, таких как липосомные носители, биоэродируемые частицы или гранулы, также известны специалистам в данной области и описаны. Клетки с инкапсулированием или без инкапсулирования могут быть имплантированы в подходящие ткани или органы организма пациента.
Терапевтически или профилактически эффективное количество фармацевтической композиции, содержащей IL-1β-связывающее антитело, фрагмент антитела, нуклеиновую кислоту или вектор настоящего изобретения, будет зависеть, например, от терапевтических целей, таких как показание, для которого используются композиция, способ введения и состояние субъекта. Фармацевтические композиции вводят в терапевтически или профилактически эффективном количестве для лечения связанного с IL-1 состояния. «Терапевтически или профилактически эффективное количество» IL-1β-связывающего антитела, фрагмента антитела, нуклеиновой кислоты или вектора настоящего изобретения является количеством, которое может лечить или предотвращать один или несколько симптомов связанного с IL-1 заболевания у субъекта.
Таким образом, может быть желательным титрование дозы IL-1β-связывающего антитела, фрагмента антитела, нуклеиновой кислоты или вектора настоящего изобретения и модификация способа введения таким образом, чтобы получить оптимальный терапевтический эффект. Диапазоны доз составляют приблизительно от 0,1 нг/кг до приблизительно 100 мг/кг (единицах количества активного агента на единицу массы тела субъекта, которому вводят активный агент), в зависимости от вышеуказанных факторов. В других вариантах осуществления диапазоны доз составляют приблизительно от 0,1 мкг/кг до приблизительно 100 мг/кг, приблизительно от 1 мкг/кг до приблизительно 100 мг/кг, приблизительно от 5 мкг/кг до приблизительно 100 мг/кг, приблизительно от 0,5 мг/кг до приблизительно 100 мг/кг или приблизительно от 1 мг/кг до приблизительно 100 мг/кг. Могут быть подходящими и другие дозы. Композицию можно вводить в виде единственной дозы или в виде двух или более доз (которые могут содержать или могут не содержать одно и то же количество IL-1β-связывающего антитела, фрагмента антитела, нуклеиновой кислоты или вектора настоящего изобретения) на протяжении времени или в виде непрерывной инфузии, например, посредством имплантационного устройства или с использованием катетера.
Способы применения
Антитела, фрагменты антител, нуклеиновые кислоты, векторы, клетки и композиции настоящего изобретения (вместе «соединения и композиции настоящего изобретения») могут быть использованы для любой цели. Например, соединения и композиции настоящего изобретения могут быть использованы для исследования связанных с IL-1 механизмов, а также заболеваний и состояний, ассоциированных со связанными с IL-1 механизмами. Однако соединения и композиции настоящего изобретения особенно полезны для лечения субъекта (например, млекопитающего или человека), нуждающегося в лечении в отношении связанного с IL-1 состояния, например аутоиммунного или воспалительного заболевания или нарушения. Таким образом, настоящее изобретение относится к способу лечения или профилактики заболевания у млекопитающего, включающему введение эффективного количества антитела или фрагмента антитела, нуклеиновой кислоты или вектора настоящего изобретения млекопитающему, нуждающемуся в этом, за счет чего происходит лечение или предотвращение заболевания у данного млекопитающего. Термин «эффективное количество» относится к количеству антитела или фрагмента антитела, нуклеиновой кислоты или вектора настоящего изобретения, необходимому для получения профилактического или терапевтического действия. В настоящем описании, лечение заболевания или состояния определяется как временное или перманентное уменьшение или устранение симптомов или прогрессирования заболевания или состояния. Подобным образом, предотвращение заболевания или состояния означает временное или перманентное ингибирование, замедление или предупреждение начала заболевания или состояния (или симптомов заболевания или состояния).
Способ настоящего изобретения может быть использован для лечения или профилактики любого связанного с IL-1 заболевания или состояния. Например, данные антитела и фрагменты обсуждаются в отношении применения для профилактики и лечения IL-1-опосредованных заболеваний или медицинских состояний, например воспалительных состояний, аллергий и аллергических состояний, раковых заболеваний, гиперчувствительности, аутоиммунных заболеваний, тяжелых инфекций и отторжения трансплантатов органов и тканей. Связанные с IL-1 состояния включают ревматоидный артрит (RA), остеоартрит, болезнь Крона, язвенный колит (UC), септический шок, хроническую обструктивную болезнь легких (ХОБЛ), астму, болезнь трансплантат против хозяина, атеросклероз, Т-клеточный лейкоз взрослых, множественную миелому, рассеянный склероз, геморрагический инсульт, болезнь Альцгеймера. Данные антитела и фрагменты могут быть также использованы для лечения или профилактики неонатального мультисистемного воспалительного нарушения (NOMID/CINCA), системного ювенильного идиопатического артрита, болезни Стилла, CAPS или синдрома Мукле-Уэллса.
Обычно заболевание или состояние может считаться связанным с IL-1 заболеванием или состоянием, если оно ассоциировано с повышенными уровнями IL-1β в биологических жидкостях или ткани или если клетки или ткани, взятые из организма, продуцируют повышенные уровни IL-1β в культуре.
Например, данные способы могут быть использованы для лечения или профилактики неонатального мультисистемного воспалительного нарушения (NOMID/CINCA), системного ювенильного идиопатического артрита, CIAS1-ассоциированных периодических синдромов (CAPS), болезни Стилла или синдрома Мукле-Уэллса.
В качестве другого примера, данные способы могут быть использованы для лечения или профилактики ревматоидного артрита, остеоартрита, болезни Крона, язвенного колита, септического шока, хронической обструктивной болезни легких, астмы, болезни трансплантат против хозяина, атеросклероза, Т-клеточного лейкоза взрослых, множественной миеломы, рассеянного склероза, геморрагического инсульта или болезни Альцгеймера.
Еще в одном примере данные способы могут быть использованы для лечения или профилактики системного ювенильного идиопатического артрита, ревматоидного артрита, остеоартрита, атеросклероза или тяжелой псевдопаралитической миастении.
Другими примерами связанных с IL-1β состояний являются острый панкреатит; ALS; кахексия/анорексия, включая индуцированнаую СПИДом кахексию; астма и другие легочные заболевания; аутоиммунный васкулит; CIAS1-ассоциированные периодические синдромы (CAPS); синдром хронической усталости; ассоциированные с Clostridium болезни, включая ассоциированную с Clostridium диарею; коронарные состояния и показания, включая застойную сердечную недостаточность, коронарный рестеноз, инфаркт миокарда, миокардиальную дисфункцию (например, связанную с сепсисом) и обходной сосудистый шунт коронарной артерии; раковые заболевания, такие как множественная миелома и миелогенные (например, AML и CML) и другие лейкозы, а также метастазирование опухолей; диабет (например, инсулинзависимый сахарный диабет); эндометриоз; семейный простудный аутовоспалительный синдром (FCAS); семейная средиземноморская лихорадка (FMF); фибромиалгия; гломерулонефрит; болезнь трансплантат против хозяина/отторжение трансплантата; геморрагический шок; гипералгезия; воспалительное заболевание пищеварительного тракта; воспалительные состояния суставов, включая псориатический артрит (а также остеоартрит и ревматоидный артрит); воспалительное глазное заболевание, которое может быть ассоциировано, например, с трансплантатом роговицы; ишемия, включая церебральную ишемию (например, повреждение головного мозга вследствие травмы, эпилепсия, кровоизлияние или геморрагический инсульт, каждое из которых может приводить к нейродегенерации); болезнь Кавасаки; ухудшение обучаемости; легочные заболевания (например, респираторный дистресс-синдром у взрослых, ARDS); миопатии (например, белковый метаболизм мышц, в частности, при сепсисе); нейротоксичность (например, индуцируемая ВИЧ); остеопороз; боль, включая боль, связанную с раком; болезнь Паркинсона; периодонтальное заболевание; преждевременные роды; псориаз; реперфузионное повреждение; побочные действия лучевой терапии; нарушения сна; временное заболевание нижнечелюстного сустава; синдром ассоциированной с фактором некроза опухолей периодической лихорадки (TRAPS); увеит; или воспалительное состояние, происходящее от деформации, растяжения, повреждения хряща, травмы, ортопедической хирургии, инфекции или других патологических процессов.
Антитела и фрагменты настоящего изобретения рассматриваются в отношении применения при лечении реципиентов с трансплантатами сердца, легкого, сердца-легкого одновременно, печени, почки, поджелудочной железы, кожи или роговицы, включая отторжения аллотрансплантата или ксенотрансплантата, или в отношении предотвращения реакции трансплантат против хозяина, например, после трансплантации костного мозга, или ассоциированного с трансплантацией органа артериосклероза.
Антитела и фрагменты настоящего изобретения рассматриваются в отношении применения при лечении или предупреждении аутоиммунного заболевания или воспалительных состояний, в частности воспалительных состояний с этиологией, включающей аутоиммунный компонент, такой как артрит (например, ревматоидный артрит, хронический прогредиентный артрит и артрит) и ревматические заболевания, включающие воспалительные состояния, и ревматические заболевания, включающие разрежение кости, воспалительную боль, гиперчувствительность (включая как гиперчувствительность дыхательных путей, так и дермальную гиперчувствительность) или аллергии. Конкретные аутоиммунные заболевания, для которых могут быть использованы антитела и фрагменты настоящего изобретения, включают аутоиммунные гематологические нарушения (включая, например, гемолитическую анемию, апластическую анемию, истинную эритроцитарную анемию и идиопатическую тромбоцитопению), системную красную волчанку, полихондрит, склеродермию, гранулематоз Вегенера, хронический активный гепатит, тяжелую псевдопаралитическую миастению, псориаз, синдром Стевена-Джонсона, идиопатические спру (тропические афты), аутоиммунное воспалительное заболевание кишечника (включая язвенный колит, болезнь Крона и синдром раздраженного кишечника), эндокринную болезнь Грейвса, саркоидоз, рассеянный склероз, первичный билиарный цирроз, ювенильный диабет (сахарный диабет типа I), увеит (передний и задний), обезвоживающий кератоконъюнктивит и весенний конъюнктивит, интерстициальный фиброз легких, псориатический артрит или гломерулонефрит (с нефротическим синдромом или без нефротического синдрома, например, включающий идиопатический нефропатический синдром или нефропатию с минимальным изменением).
Антитела и фрагменты настоящего изобретения обсуждаются также для применения при лечении, предупреждении или уменьшении симптомов астмы, бронхита, пневмокониоза, эмфиземы легких и других обструктивных или воспалительных заболеваний дыхательных путей. Эти антитела или фрагменты обсуждаются для лечения нежелательных острых и сверхострых воспалительных реакций, которые опосредуются IL-1 или включают продуцирование TNF или стимуляцию высвобождения TNF интерлейкином-1 (IL-1), например острые инфекции, такие как септический шок (например, эндотоксический шок и респираторный дистресс-синдром взрослых), менингит, пневмонию; и тяжелые ожоги; и для лечения кахексии или синдрома истощения, ассоциированного с патологическим высвобождением TNF после инфекции, рака или дисфункции органа, в частности, связанной со СПИДом кахексии, например, ассоциированной с ВИЧ-инфекцией или сопровождающей ВИЧ-инфекцию.
Антитела и фрагменты антител настоящего изобретения обсуждаются также для применения при лечении заболеваний, связанных с метаболизмом кости, включая остеоартрит, остеопороз и другие воспалительные поражения кожи, ревматического или подагрического происхождения, и разрежения кости в целом, включая связанное со старением разрежение кости и, в частности, периодонтальное заболевание.
Антитела и фрагменты настоящего изобретения обсуждаются также для применения при лечении или предотвращении CIAS1-ассоциированных периодических синдромов (CAPS), включая неонатальное мультисистемное воспалительное нарушение (NOMID), синдром Мукле-Уэллса (MWS) и семейный простудный аутовоспалительный синдром (FCAS). В настоящее время признано, что мутации в гене CIAS1 ответственны за три редких генетических синдрома: неонатальное мультисистемное воспалительное нарушение (NOMID), синдром Мукле-Уэллса (MWS) и семейный простудный аутовоспалительный синдром (FCAS). (Hoffman et al. 2001 Nature 29:301-305; Feldmann et al. 2002 Am J Hum Genet 71:198-203; Aksentijevich et al. 2002 Arthritis Rheum 46:3340-3348). В сокращенном виде, такие состояния известны как “CAPS”. Ген CIAS1 кодирует белок, обозначенный как NALP3, который является компонентом «инфламмасомы», субклеточного ферментного комплекса, который регулирует активность каспазы 1. Каспаза 1 представляет собой фермент, который расщепляет неактивную про-форму про-воспалительного цитокина, IL-1, до его биологически активной формы (Agostini et al. 2004 supra). Мутации в гене CIAS1 приводят к увеличенному продуцированию IL-1.
Антитело или фрагмент антитела, нуклеиновую кислоту или вектор настоящего изобретения обычно вводят млекопитающему или человеку в виде фармацевтической композиции, содержащей антитело или фрагмент антитела, нуклеиновую кислоту или вектор настоящего изобретения и фармацевтически приемлемый носитель. Фармацевтические композиции, подходящие для применения вместе со способом лечения или профилактики заболевания, являются композициями, описанными выше.
Антитело или фрагмент антитела, нуклеиновая кислота или вектор настоящего изобретения могут вводиться млекопитающему в виде единственного активного агента или вместе с одним или несколькими другими агентами, которые разрушают передачу сигнала IL-1-рецептора. Агентом, который разрушает передачу сигнала IL-1-рецептора, может быть любое соединение или любая композиция, которые ингибируют взаимодействие IL-1β и IL-1-рецептора. Например, агенты, которые разрушают передачу сигнала IL-1-рецептора, включают антитела, которые связываются с IL-1β или с IL-1-рецептором, рекомбинантный IL-1Ra (например, из Amgen Inc., Thousand Oaks, CA) и “trap”-пептиды IL-1-рецептора (например, из Regeneron Inc., Tarrytown, NY). При использовании двух или более агентов, которые разрушают передачу сигнала IL-1-рецептора, они могут вводиться вместе (например, в единой фармацевтической композиции) или каждый из них может вводиться по отдельности (например, в отдельных фармацевтических композициях).
Антитело или фрагмент антитела, нуклеиновая кислота или вектор настоящего изобретения могут вводиться млекопитающему в комбинации или вместе с одним или несколькими другими активными агентами для лечения или профилактики опосредованных IL-1 состояний или заболеваний, которые описаны выше.
Диагностическое применение
Кроме терапевтических применений, антитела и фрагменты настоящего изобретения могут быть использованы в диагностических способах для детектирования IL-1β (например, в биологической пробе, такой как сыворотка или плазма), с использованием общепринятого иммуноанализа, такого как твердофазные иммуноферментные анализы (ELISA), радиоиммуноанализ (RIA) или иммуногистохимия ткани. Способ детектирования IL-1β в биологической пробе может включать стадии контактирования биологической пробы с одним или несколькими антителами или фрагментами настоящего изобретения и детектирования либо антитела, либо фрагмента, связанного с IL-1β4, либо несвязанного антитела или фрагмента, для детектирования, таким образом, IL-1β в данной биологической пробе. Антитело или фрагмент могут быть прямо или опосредованно помечены детектируемым веществом для облегчения детектирования связанного или несвязанного антитела. Подходящие детектируемые вещества включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилходинэстеразу; примеры подходящих комплексов простетической группы включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных материалов включают умбеллиферон, флуоресцеин, изотиоцианат флуоресцеина, родамин, дихлортриазининиламин-флуоресцеин, дансилхлорид или фикоэритрин; примером люминесцентного материала является люминол и примеры радиоактивного материала включают 125I, 131I, 35S или 3Н.
Более предпочтительно, чем использование мечения антитела, IL-1β может быть проанализировано в биологических жидкостях конкурентным иммуноанализом связывания с использованием IL-1β-стандартов, меченных детектируемым веществом, и немеченого анти-IL-1β-антитела. В данном анализе биологическую пробу, меченые rIL-1β-стандарты и анти-IL-1β-антитело объединяют и определяют количество меченого IL-1β-стандарта, связанного с немеченым антителом. Количество IL-1β в биологической пробе обратно пропорционально количеству IL-1β-стандарта, связанного с анти-IL-1β-антителом.
Примеры
Следующие примеры дополнительно иллюстрируют настоящее изобретение, но, конечно, они не должны рассматриваться как ограничивающие каким-либо образом объем изобретения.
В следующих примерах делается ссылка на различные антитела настоящего изобретения, включая антитела, обозначенные как АВ1, АВ5 и АВ7. Как указано выше, АВ1 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:4, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:9. АВ5 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:8, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:9. АВ7 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:15, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:11.
Для различных сравнений в следующих примерах делается ссылка на антитело, обозначенное как АВ-контроль, коммерчески доступное антитело с относительно высокой аффинностью в отношении IL-1β. АВ-контроль представляет собой мышиное антитело, которое, как считается, имеет тяжелую цепь, содержащую последовательность SEQ ID NO:40, и легкую цепь, содержащую последовательность SEQ ID NO:41. Такие мышиные последовательности представлены в публикации заявки на патент США № 2003/0026806, на фиг.6А и 6В.
В нескольких из примеров, которые следуют ниже, показано, что АВ5 и АВ7 имеют неожиданно более высокую аффинность в отношении IL-1β человека, чем АВ-контроль.
Пример 1
Данный пример иллюстрирует аффинность связывания некоторых антител настоящего изобретения в отношении IL-1β.
Антитела, обозначенные как АВ1 и АВ5, анализировали на свойства связывания IL-1β с использованием устройства KINEXA™ (из Sapidyne Instruments Inc., Boise, ID). Аминокислотные последовательности вариабельных областей тяжелой цепи и легкой цепи антител АВ1 и АВ5 представлены на фиг.2 и 3. Коммерчески доступное антитело с относительно высокой аффинностью в отношении IL-1β (в настоящем описании АВ-контроль) анализировали для сравнения.
Результаты анализа связывания IL-1β суммированы в таблице 1. Величины KD представляют константы диссоциации связывания для соответствующих комплексов антитело-IL-1β. KD рассчитывали в виде отношения “off rate” (скорости диссоциации» для комплекса антитело-IL-1β) к “on rate” (скорости ассоциации для комплекса антитело-IL-1β). Более низкое отношение KD свидетельствует о более высокой аффинности антитела.
|
Результаты данных экспериментов показывают, что АВ1 и АВ5 связываются с IL-1β с высокой аффинностью. Аффинность в отношении IL-1β антител настоящего изобретения сравнима с аффинностью связывания АВ-контроля в отношении IL-1β или лучше, чем аффинность связывания АВ-контроля в отношении IL-1β.
Пример 2
Данный пример иллюстрирует ингибирование in vitro IL-1β с использованием антител настоящего изобретения.
Ингибирующию IL-1β активность антител АВ1 и АВ5 (см. пример 1) оценивали с использованием биоанализа, который измеряет IL-1β-стимулируемое высвобождение IL-6 из фибробластов человека. Как и в примере 1, в качестве сравнительной пробы использовали АВ-контроль. Детали данного анализа описаны у Dinarello et al., Current Protocols in Immunology, Ch. 6.2.1-6/2/7, John Wiley and Sons Inc., Hoboken, NJ, 2000. Кратко, фибробласты MRC5 человека из Американской Коллекции Типовых Культур (АТСС) Manassas, VA (ATCC #CCL-171) выращивали до конфлюэнтности в многолуночных планшетах. Клетки обрабатывали титрованными дозами антитела АВ5. Затем клетки контактировали с (i) 100 пг/мл IL-1β или (ii) 100 пг/мл IL-1β и антителом АВ1 или АВ5 (из примера 1). Клетки отрицательного контроля не стимулировали IL-1β. Количества IL-6, высвобожденного в каждой группе обработанных клеток, измеряли с использованием набора ELISA для IL-6 из BD Pharmingen (Franklin Lakes, NJ) в соответствии с инструкциями изготовителя. Результаты ELISA изображены на фиг.5 и суммированы в таблице 2. IC50 является концентрацией антитела, требуемой для ингибирования 50% IL-6, высвобождаемого IL-1β-стимуляцией.
|
Полученные результаты демонстрируют активность in vitro антител настоящего изобретения в отношении ингибирования IL-1β. Кроме того, было показано, что ингибирование стимулируемого IL-1β высвобождения цитокина в MRC 5 коррелирует со способностью данного агента ингибировать IL-1-опосредованную активность in vivo. Таким образом, полученные результаты указывают на то, что антитела настоящего изобретения будут обладать ингибирующей IL-1β эффективностью in vivo.
Пример 3
Данный пример иллюстрирует ингибирование in vivo IL-1β с использованием антител настоящего изобретения.
Для подтверждения эффективности in vivo способности АВ5 блокировать биологическую активность IL-1β человека испытывали на мышах. Детали данного анализа описаны у Economides et al., Nature Med. 9: 47-52 (2003). Кратко, самцов мышей С57/В16 (Jackson Laboratory Bar Harbor, Maine) инъецировали внутрибрюшинно титрованными дозами АВ5 (пример 1), АВ-контролем (пример 1) или контрольным IgG ((Jackson ImmunoResearch Laboratories, West Grove, PA). Спустя двадцать четыре часа после инъекции антител мышей инъецировали подкожно рекомбинантным IL-1β человека (rhIL-1β) (из Perрo Tech Inc., Rocky Hill, NJ) в дозе 1 мкг/кг. Спустя два часа после инъекции rhIL-1β (время максимальной реакции IL-6) мышей умерщвляли и кровь собирали и обрабатывали для получения сыворотки. Уровни IL-6 в сыворотке анализировали при помощи ELISA (BD Pharmingen, Franklin Lakes, NJ) в соответствии с протоколом изготовителя. Процентное ингибирование рассчитывали из отношения IL-6, детектированного в сыворотке экспериментальных животных, к IL-6, детектированному в контроле (умноженного на 100).
Полученные результаты представлены на фиг.6. Способность ингибирования активности in vivo IL-1β оценивают как функцию IL-1β-стимулированных уровней IL-6 в сыворотке. Как показано на фиг.6, антитело АВ5 было таким же эффективным, если не более эффективным, чем АВ-контроль, в отношении ингибирования активности in vivo IL-1β человека. 3 мкг АВ5 были такими же эффективными, что и 10 мкг АВ-контроля в данном анализе.
Таким образом, полученные результаты указывают на то, что испытанные антитела могут быть использованы для ингибирования активности IL-1β in vivo. Полученные результаты также показывают, что единственная инъекция АВ5 может блокировать системное действие в отношении IL-1β-стимуляции на протяжении пролонгированного периода времени.
Пример 4
Следующий пример иллюстрирует получение антитела в соответствии с настоящим изобретением.
Ряд сконструированных последовательностей антител человека генерировали с использованием технологии Human Engineering™, как описано Studnicka et al., Protein Engineering, 7: 805-814 (1994) и в патентах США 5766886, 5770196, 5821123 и 5869619 и публикации заявки PCT WO 93/11794. Генерированные сконструированные последовательности антител человека включают АВ5.1, АВ5.2, АВ5.3 и АВ5.4. Как показано на фиг.3 и 4, каждая из указанных последовательностей содержит два вариабельных положения в области CDR-3Н, показанных как Х1 и Х2. Таким образом, в некоторых примерах каждого из таких сконструированных антител человека Х1 и Х2 CDR3 соответствуют аланину и аргинину, валину и аргинину, фенилаланину и аргинину, лизину и лизину или аспарагину и аргинину, соответственно.
Пример 5
Антитела, обозначенные как АВ5 и АВ7 (сконструированная последовательность антитела человека), анализировали на свойства связывания IL-1β с использованием кинетического анализа исключения, выполняемого на устройстве KINEXA™, как описано в примере 1. Дополнительное описание в отношении устройств KINEXA™ и методики характеристики антител доступны от изготовителя и может быть найдено в опубликованной литературе, например, в патенте США № 6664114 (Sapidyn, Inc.) и Darking et al., “Kinetic Exclusion Assay Technology: Characterization of Molecular Interactions.” ASSAY and Drug Development Technologies, 2004, 2, 647-657. Устройство KINEXA™ выполняет кинетический анализ исключения и подгоняет полученные данные к различным теоретическим кривым и, таким образом, определяет KD, а также другие свойства, такие как 95% доверительные интервалы для KD. Устройство KINEXA™ обычно является более чувствительным, чем другие устройства (например, устройство BiaCore) для анализа характеристик аффинности, таких как константы диссоциации и скорости диссоциации.
Аминокислотные последовательности вариабельных областей тяжелой и легкой цепей АВ5 и АВ7 представлены на фиг.3 и 4А, соответственно. Результаты анализа связывания IL-1β суммированы в таблице 3. Как и в примере 1, KD рассчитывали в виде отношения скорости диссоциации (“off rate”) к скорости ассоциации (“on rate”), и более низкая скорость KD свидетельствует о более высокой аффинности антитела.
|
Результаты данных экспериментов показывают, что АВ5 (в соответствии с результатами, наблюдаемыми в примере 1) и АВ7 связывают IL-1β с неожиданно высокой аффинностью, которая представлена неожиданно низкими величинами их констант диссоциации.
На фиг.7, 8 и 9 показана аффинность связывания антител, обозначенных как АВ1, АВ5 и АВ7, соответственно, определенные из одного репрезентативного эксперимента для каждого из них с использованием анализа KINEXА. Фиг.7 отражает результаты, представленные в таблице 1, тогда как фиг.8 и 9 отражает результаты, представленные в таблице 3.
Кроме величин, представленных в таблице 3, результаты анализа KINEXА также показывают низкий и высокий 95% доверительные интервалы (KD-низкая и KD-высокая). Для АВ5 KD-низкая составляет 0,07 пМ и KD-высокая составляет 0,72 рМ. Для ВА7 KD-низкая составляет 0,11 пМ и KD-высокая составляет 0,74 рМ.
Сходные величины KD-низкая и KD-высокая были обнаружены в анализе, представленном в примере 1. Для АВ-контроля KD-низкая составляет 1,62 пМ и KD-высокая составляет 5,23 рМ. Для АВ1 KD-низкая составляет 13,38 пМ и KD-высокая составляет 24,84 рМ. Для АВ5 KD-низкая составляет 0,11 пМ и KD-высокая составляет 0,56 рМ.
Полученные результаты анализа KINEXА указывают на то, что АВ5 и АВ7 имели неожиданно более низкую константу диссоциации, чем АВ-контроль.
Пример 6
Данный пример иллюстрирует ингибирование in vitro IL-1β-стимулированного высвобождения IL-6. IC50 для ингибирования IL-1β-стимулированного высвобождения IL-6 из фибробластов человека анализировали для нескольких антител настоящего изобретения следующим образом.
IL-1β-ингибирующую активность АВ5 и АВ7 оценивали способом, который описан в примере 2, с использованием биоанализа, измеряющего IL-1β-стимулированное высвобождение IL-6 из фибробластов человека. На фиг.10-12 показаны кривые связывания для отдельных анализов на различных антителах. На фиг.19 показано ингибирование высвобождения IL-6 из фибробластов человека антителами, обозначенными как АВ1, АВ2 и АВ3, и результаты этих трех отдельных анализов указывают на то, что АВ1 имел IC50 0,029 нМ (29 пМ), АВ2 имел IC50 0,076 нМ (76 пМ) и АВ3 имел IC50 0,214 нМ (214 пМ). На фиг.11 показано ингибирование высвобождения IL-6 из фибробластов человека антителами, обозначенными как АВ1 и АВ7, в дополнительном анализе. На фиг.12 показано ингибирование высвобождения IL-6 из фибробластов человека антителами АВ5 и АВ7, а также коммерчески доступным Kineret®. Полученные результаты показали, что АВ5 и АВ7 обладали существенно лучшей активностью в отношении ингибирования IL-1β, чем Kineret®, на основе определений IC50 в данных анализах. Kineret® представляет собой изготовленный человеком белок, который аналогичен природному белку, называемому антагонистом рецептора интерлейкина-1 (IL-1Ra), обнаруживаемому в организме. На фиг.10-12 показаны результаты отдельных анализов на активность указанных антител или Kineret® в виде процентного ингибирования IL-6 без антитела, и в таблице 4 представлены IC50, рассчитанная из результатов отдельных анализов. IC50 является концентрацией антитела или Kineret®, необходимой для ингибирования 50% IL-6, высвобождаемого IL-1β-стимуляцией.
|
Кроме результатов отдельных анализов, сообщенных в таблицах 2 и 4, показанных на фиг.6, 10, 11 и 12, проводили другие отдельные анализы для каждого из АВ1, АВ7 и АВ-контроля. Среднюю IC50 рассчитывали из результатов отдельных анализов. Средняя IC50 для АВ1 66,7 пМ была рассчитана из результатов отдельных анализов 35 пМ, 30 пМ, 150 пМ (эта величина показана также в таблице 2) и 52 пМ. Средняя IC50 для АВ7 5,6 пМ была рассчитана из результатов отдельных анализов 7,3 пМ, 4,2 пМ, 4,4 пМ (эта величина показана также в таблице 4), 6,0 пМ, 5,0 пМ и 7,8 пМ. Средняя IC50 для АВ-контроля 8,8 пМ была рассчитана из результатов отдельных анализов 5,0 пМ, 17,0 пМ (эта величина показана также в таблице 2) и 4,9 пМ.
Полученные результаты демонстрируют активность in vitro АВ1, АВ5 и АВ7 в отношении ингибирования IL-1β. Кроме того, было показано, что ингибирование IL-1β-стимулированного высвобождения цитокина в фибробластах человека коррелирует со способностью данного ингибирующего агента ингибировать IL-1-опосредованную активность in vivo. Таким образом, полученные результаты показывают, что антитела настоящего изобретения будут обладать IL-1β-ингибирующей эффективностью in vivo.
Пример 7
Данный пример иллюстрирует ингибирование in vivo IL-1β с использованием IL-1β-связывающих антител.
Эффективность in vivo АВ5, АВ1 и АВ7 и их способность блокировать биологическую активность IL-1β человека испытывали на мышах, как описано в примере 3. Результаты испытания АВ5 и АВ1 представлены на фиг.13, и результаты испытания АВ5 и АВ7 представлены на фиг.14. Способность ингибирования активности in vivo IL-1β оценивали как функцию IL-1β-стимулированных уровней IL-6 в сыворотке. Как показано на фиг.13 и 14, антитела АВ1, АВ5 и АВ7 были эффективны в отношении ингибирования in vivo активности IL-1β человека.
Полученные результаты показывают, что испытанные антитела могут быть использованы для ингибирования активности IL-1β in vivo.
Пример 8
Данный пример показывает, что по меньшей мере некоторые IL-1β-связывающие антитела в соответствии с настоящим изобретением являются перекрестно реактивными с IL-1β некоторых млекопитающих, иных, чем человек, и не являются перекрестно реактивными с IL-1β других млекопитающих, не являющихся человеком. Антитело, обозначенное как АВ7 (антитело, которое связывается с IL-1β человека с высокой аффинностью), анализировали на связывание с IL-1β млекопитающих, иных, чем человек, а именно макаки резус, собакоподобной обезьяны, собаки, морской свинки и кролика.
Свежую гепаринизированную цельную кровь макаки резус, собакоподобной обезьяны, собаки, морской свинки и кролика получали из Charles River Labs. Цельную кровь разделяли центрифугированием в градиенте плотности Фиколла и выделяли мононуклеарные клетки периферической крови (PBMC). Для PBMC каждого вида 2,5×105 клеток/мл инкубировали в средах RPMI 1640 для клеток периферической крови с 50 нг/мл липополисахарида LPS (E. coli 055:В5) или без него и супернатанты собирали через 24 часа после стимуляции. LPS предназначается для стимуляции продуцирования IL-1β клетками PBMC. 2 мл каждого супернатанта инкубировали в течение 3 часов с 2 мкг АВ7 с последующим добавлением 50 мкл суспензии гранул елок А-сефарозы для иммунопреципитации комплекса АВ7/IL-1β. IL-1β человека (Peprotech) вводили в RPMI 1640 и использовали в качестве контролей иммунопреципитации/Вестерн-блотов. После центрифугирования и промывания гранул белок А-сефарозы все пробы наносили на ДСН-гель для электрофореза в ПААГ и подвергали электрофорезу при 120 В в течение 1 часа. После переноса на мембрану Immobilon-P при 22 В в течение ночи и блокирования 5% обезжиренным молоком АВ7 инкубировали при 2 мкг/мл с мембраной в течение 2 часов. Вторичное козье антитело против IgG человека, конъюгированное с пероксидазой хрена (HRP), добавляли после стадий промывок и детектировали в одну стадию с раствором тетраметилбензидина (ТМВ).
На фиг.15 и 16 показаны Вестерн-блоты, полученные по данной методике. На левой стороне блота, показанного на фиг.15 (дорожки 1-3), находятся контроли, в которых различные количества (5 нг, 10 нг и 20 нг) IL-1β человека добавляли к среде RPMI 1640. Вблизи нижней части блота можно видеть полосы на каждой из дорожек в области, соответствующей молекулярной массе приблизительно 17 кДа. Данные полосы свидетельствуют о связывании АВ7 с IL-1β человека. Средняя дорожка (дорожка 4) является средой RPMI 1640. На правой стороне блота, показанного на фиг.15 (дорожки 5-8), показаны результаты для проб собакоподобной обезьяны и макаки резус. Дорожки 5 и 6 являются пробами собакоподобной обезьяны без LPS и с 50 нг LPS, добавленными в среду RPMI, соответственно. Дорожки 7 и 8 являются пробами макаки резус без LPS и с 50 нг LPS, добавленными в среду RPMI, соответственно. Вблизи нижней части Вестерн-блота можно видеть полосы на дорожках 6 и 8 (пробы, к которым был добавлен LPS) в области, соответствующей молекулярной массе приблизительно 17 кДа. Данные полосы на дорожках 6 и 8 свидетельствуют о перекрестной реактивности АВ7 с IL-1β приматов, а именно IL-1β собакоподобной обезьяны и макаки резус.
На фиг.16 показаны Вестерн-блоты для контролей и проб из PBMC собаки, морских свинок и кроликов. На левой стороне блотов, показанных на фиг.16 (дорожки 1-4), находятся контроли, в которых различные количества (5 нг, 10 нг, 50 нг и 200 нг) были добавлены к среде RPMI 1640. Вблизи нижней части Вестерн-блота можно видеть полосы в области, соответствующей молекулярной массе приблизительно 17 кДа. Данные полосы свидетельствуют о связывании АВ7 с IL-1β человека. Дорожка 5 на фиг.15 является средой RPMI 1640. Дорожки 6-8 являются результатами для проб из PBMC собаки, без LPS, 50 нг LPS и 200 нг LPS, соответственно. Дорожки 9 и 10 являются результатами для проб PBMC морской свинки, без LPS и 50 нг LPS, соответственно. Дорожки 11 и 12 являются результатами для проб из PBMC кролика, без LPS и 50 нг LPS, соответственно. Вблизи нижней части Вестерн-блота можно видеть полосы на дорожках 7, 8 и 12 (пробы собаки и кролика, к которым был добавлен LPS) в области, соответствующей молекулярной массе приблизительно 17 кДа. Данные полосы на дорожках 7, 8 и 12 свидетельствуют о перекрестной реактивности АВ7 с IL-1β собаки и IL-1β кролика. Отсутствие видимой полосы на дорожке 10 (PBMC морской свинки с 50 нг добавленного LPS) свидетельствует о том, что АВ7 не был перекрестно реактивным с IL-1β морской свинки.
Полученные результаты показывают, что АВ7 является перекрестно реактивным с IL-1β нескольких млекопитающих, иных, чем человек, а именно макаки резус, собакоподобной обезьяны и кролика, но не является перекрестно реактивным с IL-1β по меньшей мере одного млекопитающего, иного, чем человек, а именно морской свинки.
Пример 9
Данный пример дополнительно иллюстрирует, что по меньшей мере некоторые IL-1β-связывающие антитела в соответствии с настоящим изобретением являются перекрестно реактивными с IL-1β иных, чем человек, млекопитающих. Антитело АВ7 анализировали на связывание с IL-1β иных, чем человек, млекопитающих, а именно мыши и крысы.
Рекомбинантный IL-1β человека, мыши и крысы (Peprotech) наносили в восстановленном и не восстановленном состоянии на ДСН-гель электрофореза в ПААГ и подвергали электрофорезу при 120 В в течение 1 часа. После переноса на мембрану Immobilon-P при 22 В в течение ночи и блокирования 5% обезжиренным молоком АВ7 инкубировали при 2 мкг/мл с мембраной в течение 2 часов. Вторичное козье антитело против IgG человека, конъюгированное с пероксидазой хрена (HRP), добавляли после стадий промывок и детектировали в одну стадию с раствором тетраметилбензидина (ТМВ).
На фиг.17 показан Вестерн-блот, полученный с использованием следующих методик. Дорожки 1 и 2 являются дорожками для невосстановленного и восстановленного IL-1β человека, соответственно. Дорожки 3 и 4 являются дорожками для невосстановленного и восстановленного IL-1β мыши, соответственно. Дорожки 5 и 6 являются дорожками для невосстановленного и восстановленного IL-1β крысы, соответственно. В нижней части можно видеть полосы на каждой из указанных дорожек в области, соответствующей молекулярной массе приблизительно 17 кДа. Данные полосы свидетельствуют о присутствии IL-1β, что, в свою очередь, свидетельствует о связывании АВ7 с IL-1β человека, IL-1β мыши и IL-1β крысы. Полученные результаты свидетельствуют о том, что АВ7 является перекрестно реактивным с IL-1β грызунов.
Пример 10
Данный пример дополнительно показывает, что по меньшей мере некоторые IL-1β-связывающие антитела в соответствии с настоящим изобретением являются ингибиторами IL-1β человека и по меньшей мере некоторых млекопитающих, иных, чем человек. Антитело АВ7 анализировали на ингибирование пролиферации клеток D10, стимулируемой IL-1β человека, макаки резус, мыши и крысы.
Клетки D10/G4/1 (D10) являются мышиными Т-хелперными клетками со специфичностью в отношении антигена кональбумина из белка яйца. Данная клеточная линия была получена из мыши AKR/J (гаплотипа H-2k MHC), и она требует IL-1 и активации рецептора антигена для роста, пролиферации и выживания. Клеточная линии D10 является высокочувствительной к IL-1 и может отвечать на IL-1 нескольких видов (включая человека, обезьяны, мыши и крысы), что дает возможность тестировать потенциал перекрестно реактивной нейтрализации IL-1β-связывающего антитела или фрагмента, такого как АВ7. На пролиферацию D10 не влияют LPS или продуцируемые макрофагами цитокины, такие как IL-6 и TNF-α. Благодаря этому анализы D10 могут быть использованы для оценки специфической IL-1-активности из эндогенных источников (т.е. LPS-активированных макрофагов).
Клетки D10 активировали конканавалином А (ConA) и постоянным уровнем рекомбинантного или нативного источника IL-1 в присутствии или в отсутствие нескольких концентраций АВ7. Клетки высевали при 2×104 клеток на лунку и стимулировали 2,5 мкг/мл Con A и различными концентрациями IL-1β. Клетки культивировали в течение 72 часов и пролиферацию измеряли добавлением красителя аламарового синего на редокс-жизнеспособность в течение последних 8-14 часов культуры и оцениванием OD560-600.
Для тестирования активности и видовой перекрестной реактивности АВ7 проводили биоанализ D10 с использованием следующих концентраций рекомбинантного или нативного IL-1β: 10 пг/мл рекомбинантного IL-1β человека; 10 пг/мл рекомбинантного IL-1β макаки резус; 10 пг/мл IL-1β мыши и 100 пг/мл IL-1β крысы. Для анализа D10, использующего IL-1β человека, применяли разведение 1:369 супернатанта из LPS-активированных PBMC человека. Различные концентрации АВ7 тестировали с каждым из IL-1β. Измерения IC50 выполняли с использованием Graphpad Prism. Среднее, стандартное отклонение (SD) и стандартную ошибку (SEM) для IC50 рассчитывали с использованием Microsoft Excel.
Результаты анализа D10 суммированы в таблице 5, которая содержит среднее IC50 и SEM (на основе 4 экспериментов для рекомбинантного IL-1β человека и 3 экспериментов для IL-1β из других источников). Антитело АВ7 было очень активным в нейтрализации рекомбинантного IL-1β человека и эндогенно продуцируемого (нативного) IL-1β человека. Антитело АВ7 было также высокоактивным в нейтрализации рекомбинантного IL-1β макаки резус. Антитело АВ7 нейтрализовало также рекомбинантный IL-1β мыши с меньшей активностью, с IC50 в 1000 раз выше по сравнению с IC50, полученной для человека. АВ7 не имело значимой активности против IL-1β крысы в данном анализе.
|
Полученные результаты указывают на то, что АВ7 является высокоактивным нейтрализующим антителом против IL-1β человека, имеющим сходную активность против рекомбинантных и нативных форм цитокина. Активность против IL-1β примата (не человека), макаки резус, была аналогично активности против IL-1β человека. Таким образом, по меньшей мере некоторые антитела и фрагменты настоящего изобретения включают антитела и фрагменты, обладающие по существу одинаковой активностью против IL-1β человека и IL-1β примата и/или обладающие по существу одинаковой активностью против рекомбинантного IL-1β человека и эндогенного IL-1β человека. Полученные результаты показывают также, что АВ7 нейтрализует IL-1β мыши.
Пример 11
Данный пример иллюстрирует картирование эпитопа IL-1β, с которым связываются по меньшей мере некоторые антитела настоящего изобретения (например, антитело, обозначенное как АВ7).
Матрицу (массив) пептидов PepSpot™ (JPT Peptide Technology, Berlin, Germany) использовали для идентификации ключевых аминокислотных остатков (эпитопа) IL-1β, участвующих в связывании АВ7. Скан содержащих двенадцать аминокислот пептидов, простирающийся вдоль всей аминокислотной последовательности IL-1β, причем каждый пептид перекрывается 11 аминокислотами с предыдущей аминокислотой, синтезировали непосредственно на мембране. Мембрану, несущую данные пептиды, зондировали с использованием АВ7 при концентрации 2 мкг/мл в течение 2 часов при комнатной температуре. Связывание АВ7 с мембраносвязанными пептидами детектировали с использованием вторичного конъюгированного с пероксидазой хрена (HRP) козьего антитела против иммуноглобулина человека с последующей усиленной хемилюминесценцией (ECL). Пятна пептидов, соответствующие остаткам 83-105, оценивали как положительные в отношении связывания АВ7.
Такое картирование указывает на то, что АВ7 связывается с эпитопом, находящимся в данной последовательности, соответствующим остаткам 83-105 зрелого белка IL-1β. Данная последовательность содержит аминокислоты ESVDPKNYPKKKMEKRFVFNKIE, и АВ7 является примером антител, которые связываются с эпитопом, находящимся в данной последовательности. Ожидается, что антитела, обозначенные как АВ6, АВ8, АВ9, и другие, такие как антитела, имеющие тяжелую цепь SEQ ID NO:29 и легкую цепь SEQ ID NO:27, также связываются с эпитопом, находящимся в указанной последовательности.
Пример 12
Данный пример иллюстрирует ингибирование in vitro IL-1β с использованием антитела настоящего изобретения в анализе IL-8 на основе клеток.
Свежую гепаринизированную периферическую кровь собирали от здоровых доноров. 180 мкл цельной крови высевали в 96-луночном планшете и инкубировали с различными концентрациями антитела АВ7 и 100 пМ rhIL-1β. В случае Kineret®-обработанных проб, Kineret® и rhIL-1β объединяли 1:1 перед смешиванием с кровью. Пробы инкубировали в течение 6 часов при 37ºС в 5% СО2. Затем клетки цельной крови лизировали 50 мкл 2,5% Тритона Х-100. Концентрацию интерлейкина-8 (IL-8) в осветленных лизатах анализировали при помощи ELISA (Quantikine human IL-8 ELISA kit, R&D Systems) в соответствии с инструкциями изготовителя. Концентрации IL-8 в обработанных АВ7 и Kineret® пробах сравнивали с контрольной пробой, обработанной анти-KLH-контролем. Полученные результаты изображены на фиг.18 и суммированы в таблице 6. IC50 является концентрацией антитела, требуемой для ингибирования 50% IL-8, высвобождаемого IL-1β-стимуляцией.
|
Полученные результаты демонстрируют активность in vitro АВ7, измеренную по ингибированию IL-1β-стимулируемого высвобождения IL-8. Полученные результаты, показывающие более высокую активность по сравнению с Kinaret®, указывают на то, что антитела настоящего изобретения будут обладать ингибирующей IL-1β эффективностью in vivo.
Пример 13
Данный пример иллюстрирует, что антитела настоящего изобретения имеют удивительно высокую аффинность по сравнению с антителом, имеющим сходную последовательность.
АВ5 сравнивали с АВ-контролем в отношении последовательности и аффинности связывания. АВ5 содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO:9. Считается, что АВ-контроль содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO:38, и вариабельную область легкой цепи, представленную в SEQ ID NO:39. Указанные последовательности представлены в публикации заявки на патент РСТ № 2003/0026806 на фиг.6А и 6В. АВ5 и АВ-контроль имеют одинаковые определяющие комплементарность области в вариабельных областях их тяжелой и легкой цепей. Их тяжелые цепи различаются тремя аминокислотными остатками в каркасной области 3, расположенных в положениях 68, 74 и 86 в SEQ ID NO: 8 и 38. Их соответствующие легкие цепи различаются одним аминокислотным остатком в каркасной области 3, расположенным в положении 72 в SEQ ID NO:9 и 39. Несмотря на сходства в последовательностях вариабельных областей их тяжелой и легкой цепей, включающих в себя одинаковые CDR, АВ5 и АВ-контроль, значимо и неожиданно различаются по их аффинности связывания. Как обсуждалось в примерах 1 и 5 выше, было обнаружено, что АВ5 имеет константу диссоциации менее 0,3 пМ (с KD-низкой 0,11 пМ и KD-высокой 0,56 пМ), и было обнаружено, что АВ-контроль имеет константу диссоциации менее 3 пМ (с KD-низкой 1,62 пМ и KD-высокой 5,23 пМ). При сходствах в аминокислотной последовательности удивительно, что АВ5 обладает на порядок более высокой аффинностью.
АВ7 генерировали с использованием технологии Human Engineering™, как описано в примере 4. Вариабельные области легкой и тяжелой цепи АВ7 включают положения низкого и среднего риска в последовательностях вариабельных областей легкой и тяжелой цепей АВ5. АВ7 содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO:15, и вариабельную область легкой цепи, представленную в SEQ ID NO:11.
АВ7 сравнивали с АВ-контролем и АВ5 в отношении последовательности и аффинности связывания. АВ7 и АВ-контроль имеют одни и те же определяющие комплементарность области в вариабельных областях их тяжелой и легкой цепей. Их тяжелые цепи различаются в двух из трех положениях в каркасной области 3 (положения 74 и 86 в SEQ ID NO:15 и 38), где АВ5 отличается от АВ-контроля; однако в положении 68 в SEQ ID NO:15 АВ7 имеет такую же аминокислоту, что и АВ-контроль. В легкой цепи АВ7 положение 72 в SEQ ID NO:11 отличается как от АВ-контроля, так и от АВ5. АВ7 включает несколько других различий в вариабельных областях легкой и тяжелой цепи. АВ7 включает несколько других последовательностей в вариабельных областях легкой и тяжелой цепи по сравнению с АВ-контролем и АВ5 вследствие использования способа Human Engineering™. Несмотря на включение изменений в положениях среднего риска и, в частности, благодаря изменениям в АВ7, по сравнению с АВ5 в положении 68 вариабельной области тяжелой цепи и в положении 72 вариабельной области легкой цепи, АВ7 и АВ5 имеют сходные константы диссоциации, и АВ7 значимо и неожиданно отличается от АВ-контроля в отношении аффинности связывания. Как обсуждается в примере 5 выше, было обнаружено, что АВ7 имеет константу диссоциации 0,3 пМ (с KD-низкой 0,11 пМ и KD-высокой 0,74 пМ). Было обнаружено, что АВ5 имеет константу диссоциации 0,24 пМ (с KD-низкой 0,07 пМ и KD-высокой 0,72 пМ). При условии изменений, произведенных в положениях среднего риска, и общих сходств в аминокислотной последовательности, в частности в CDR, удивительно, что АВ7 обладает аффинностью, сходной с аффинностью АВ5 и на порядок более высокой аффинностью, чем аффинность АВ-контроля.
Пример 14
Данный пример показывает, что по меньшей мере одно антитело настоящего изобретения связывается с эпитопом IL-1β таким образом, что связанное антитело по существу не предотвращает связывание связанного с антителом IL-1β с IL-1-рецептором типа I. В данном примере использует прибор для кинетического анализа Biacore® для испытания, может ли IL-1β, связанный с одним из обсуждаемых антител (АВ7) все еще связываться с IL-1-рецептором типа I.
Для данного примера АВ7 иммобилизовали на поверхности сенсорного чипа СМ-5 в приборе Biacore® следующим образом. С использованием HBS-EP (Biacore®, Inc.) в качестве рабочего буфера температуру устанавливали 25ºС, скорость потока устанавливали 10 мкл/мин и путь потока направляли только к проточной кювете 2. 135 мкл каждого из растворов NHS и ECD (Biacore®, Inc.) смешивали и 70 мкл раствора NHS/ECD немедленно инжектировали в путь потока. Затем инжектировали 91 мкл раствора АВ7 (~20 мкг/мл в 10 мМ натрий-ацетатном буфере (Biacore®, Inc.)) с последующим добавлением 70 мкг 1М этаноламина (Biacore®, Inc.). Таким образом иммобилизовали приблизительно 5660 RU АВ7. Для приготовления ссылочной поверхности путь потока изменяли на путь только к кювете 1. 135 мкл каждого из растворов NHS и ECD (Biacore®, Inc.) смешивали и 70 мкл раствора NHS/ECD немедленно вводили в путь потока с последующим добавлением 70 мкл 1М этаноламина (Biacore®, Inc.).
Затем прибор Biacore® был готов для анализа, мог ли IL-1β, связанный с АВ7, все еще связываться с IL-1-рецептором типа I. Для данного анализа использовали растворимый IL-1-рецептор типа I (IL-1 sRI) и связывание IL-1 sRI с комплексом АВ7/IL-1β тестировали следующим образом. IL-1 sRI (RnDSystems cat#269-1R-100/CF) и IL-1β (Peprotech), cat#200-01B) по отдельности разводили до 10 мкг/мл в HBS-EP. Скорость потока устанавливали 10 мкл/мин. Путь потока для прибора Biacore® устанавливали к проточным кюветам 1 и 2 и использовали вычитание стандарта проточной кюветы 2 из кюветы 1 для определения дифференциала реакции. На фиг.19 показан измеренный дифференциал реакции прибором Biacore® по ходу анализа. На фиг.20 представлена иллюстрация стадий, используемых в данном анализе, показывающих отдельные добавления в проточную кювету (А) IL-1 sRI, (В) IL-1β и (С) IL-1 sRI, в указанном порядке.
На 200 секунде инжектировали 20 мкл IL-1 sRI для подтверждения отсутствия связывания непосредственно перед иммобилизацией АВ7 (инжекция А на фиг.19 и 20). Как показано на фиг.19, IL-1 sRI не увеличивал единицы реакции, что указывает на то, что IL-1 sRI не связывается непосредственно с иммобилизованным АВ7. На 600 секунде, приблизительно 1000 RU IL-1β связывались АВ7, образуя комплекс АВ7/IL-1β на поверхности чипа (инжекция В на фиг.19 и 20). Увеличение в единицах реакции указывает на то, что IL-1β связывался с иммобилизованным АВ7. Затем 20 мкл IL-1 sRI инжектировали на 1200 секунде для тестирования связывания IL-1 sRI с комплексом АВ7 и IL-1β. Приблизительно 1500 RU IL-1 sRI связывались с комплексом АВ7/IL-1β (инжекция С на фиг.19 и 20). Увеличение в единицах реакции свидетельствует о том, что IL-1 sRI связывался с комплексом IL-1β/АВ7.
Данный пример показывает, что IL-1 sRI связывается с IL-1β, но не связывается с АВ7, и что АВ7 связывается с эпитопом IL-1β таким образом, что связанное антитело АВ7 по существу не мешает связыванию IL-1β с IL-1 sRI.
Все цитируемые ссылки, включающие публикации, заявки на патент и патенты, включены тем самым в настоящее описание посредством ссылки в такой же степени, как если бы каждая ссылка была отдельно и особо указана как являющаяся включенной в качестве ссылки и была представлена во всей ее полноте.
Использование терминов “a” и “an” (неопределенный артикль) и “the” (определенный артикль) и сходных символов в контексте настоящего изобретения (в частности, в контексте следующей формулы изобретения) должно пониматься таким образом, что они включают как единственное число, так и множественное число, если не указано иное в настоящем описании или нет явного противоречия с контекстом. Термины «включающий в себя», «имеющий» и «содержащий» должны пониматься как не окончательные (допускающие поправки) (т.е. имеющие в виду «включающие, но не ограничивающиеся ими»), если не указано иное. Специально рассматривается, что где бы ни использовался термин «не окончательный» (не допускающий поправки), термин «окончательный» может быть использован вместо термина «не окончательный» без отклонения от идеи и объема настоящего изобретения. Указание диапазонов величин в настоящем описании предназначено только в качестве стенографического способа для ссылки по отдельности на каждую отдельную величину, находящуюся в пределах указанного диапазона, если не указано иное, и каждая отдельная величина включена в настоящее описание, как если бы она была отдельно указана в настоящем описании. Все описанные в настоящем описании способы могут выполняться в любом подходящем порядке, если в настоящем описании не указано иное или если нет явного противоречия с контекстом. Применение любого и всех примеров или примеров формулировок (например, «такие как»), приведенных в настоящем описании, предназначено только для лучшего разъяснения настоящего изобретения и не налагает ограничения на объем настоящего изобретения, если не указано иное. Никакая формулировка в настоящем описании не должна пониматься как указывающая на то, что любой незаявленный элемент является важным для практики настоящего изобретения.
В настоящем описании описаны предпочтительные варианты осуществления настоящего изобретения, включая лучший способ, известный авторам изобретения, для осуществления настоящего изобретения. Для лиц, работающих в данной области, при чтении предшествующего описания могут стать очевидными вариации таких предпочтительных вариантов осуществления. Авторы изобретения ожидают, что квалифицированные работники будут использовать такие вариации по необходимости, и авторы изобретения предполагают применение настоящего изобретения на практике иным образом, чем описано в настоящем описании. Таким образом, настоящее изобретение включает все модификации и эквиваленты объекта, описанного в прилагаемой формуле изобретения, как это допускается патентным законодательством. Кроме того, любая комбинация вышеуказанных элементов изобретения во всех возможных вариациях охватывается настоящим изобретением, если не указано иное или нет явных противоречий с контекстом.