УСТРОЙСТВО И СПОСОБ ЛЕЧЕНИЯ ПАТОЛОГИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
Вид РИД
Изобретение
Родственные заявки
Приоритет настоящей заявки основан на предварительных заявках US 61/019,968, поданной 9 января 2008 г., и US 61/019,997, поданной 18 июля 2008 г., содержание которых во всей полноте в порядке ссылки включено в настоящую заявку.
Область техники
Настоящее изобретение относится к устройству и способу лечения тканей центральной нервной системы с использованием пониженного давления (субатмосферного), в частности, но не исключительно, к устройству и способу лечения ткани головного мозга с использованием субатмосферного давления.
Уровень техники
Анатомия, физиология, патологические процессы с участием центральной нервной системы (ЦНС) отличают ЦНС от всех остальных тканей. Для выживания и сохранения функционирования тканей центральной нервной системы крайне важны как сохранение трехмерной структурной анатомии и микроанатомических взаимосвязей нейронов (функция которых зависит от специфичных пространственных взаимоотношений с другими нейронами и другими поддерживающими клетками), так и поддержание кровотока с достаточно высоким содержанием кислорода и однородность основного вещества матрикса, в котором существуют нейроны. Кроме того, неспособность клеток центральной нервной системы к регенерации также подчеркивает необходимость максимально сохранять жизнеспособность как можно большего числа нейронов. По указанным причинам лечение и открытых, и закрытых поражений центральной нервной системы представляет особенные трудности.
Среди клинических состояний, которые могут ухудшить выживаемость ткани ЦНС, центральное место занимают контроль выраженности отека центральной нервной системы, инфекции, сохранение кровотока. При травме и повреждении головного мозга в нем развивается выраженный интерстициальный отек. Поскольку головной мозг расположен в закрытом пространстве (твердая мозговая оболочка и череп), отек приводит к сдавлению ЦНС, нарушению кровотока в ней и ухудшению поступления в нее питательных веществ, что значительно ухудшает условия физиологического восстановления центральной нервной системы и нередко само по себе вызывает прогрессирование нарушений и гибель паренхимы ЦНС. Существующие в настоящее время методы лечения, направленные на уменьшение отека, включают лекарственную терапию препаратами, снижающими сосудистую проницаемость (глюкокортикоидами: дексаметазоном, преднизоном, метилпреднизолоном), диуретиками, механическое дренирование желудочков мозга, обширную хирургическую декомпрессию полости черепа. Однако недостатками этих методов становятся низкая эффективность, развитие осложнений лекарственной терапии, нестабильность результата.
Потребность в быстродействующей и эффективной терапии также крайне важна вследствие инвалидизирующих последствий и высокого риска быстрого распространения по ЦНС инфекций и отека. В настоящее время эффективных методов лечения патологических процессов, поражающих внутричерепное и внутриспинальное пространство, паренхиму ЦНС и окружающие ее структуры, немного. Если в других частях тела ткани можно лечить сменными повязками, для ЦНС, учитывая трудность доступа, непрочность ее структуры, склонность к инфицированию, риск прогрессирования повреждений, этот метод лечения непригоден. Получены данные, что воспаление и иммунологические реакции на травму и другие виды поражений центральной нервной системы сопровождаются, по сравнению с первичной травмой или поражением, не меньшими либо даже более выраженными отдаленными осложнениями. Реакция ЦНС на снижение кровотока вследствие отека приводит к развитию гипоксии и ишемически-реперфузионного повреждения. Эти повреждения способствуют развитию нейропатологических осложнений, вносящих значительный вклад в неблагоприятный исход черепно-мозговых повреждений.
Кроме того, головному мозгу для сохранения функции и жизнеспособности требуется постоянное поступление оксигенированной крови. После полного прекращения притока крови к головному мозгу в течение трех минут развивается его необратимое повреждение. Однако жизнеспособность головного мозга и его способность к восстановлению после снижения притока крови могут сохраняться более длительно. Показано, что участки головного мозга могут находиться в состоянии ишемии и относительной утраты функциональных способностей в течение нескольких дней и восстанавливаться после этого. Эти данные привели к разработке концепции ишемической зоны, называемой пенумброй ("ишемической полутенью", зоной гало), которая окружает область необратимого повреждения. В ишемической зоне развиваются вторичные поражения: местное выделение эксцитотоксинов из поврежденных нейронов, нарушение местного кровотока, отек.
Поражение сосудов головного мозга может быть обусловлено недостаточным кровоснабжением клеток мозга вследствие снижения перфузионного давления, разрывом кровеносных сосудов в результате непосредственного повреждения участка головного мозга, сдавлением окружающих тканей. Эндогенные поражения кровеносных сосудов головного мозга, например атеросклероз, аневризмы, воспаление и т.д., или отложение в кровеносных сосудах головного мозга тромбов, образовавшихся в других участках организма, например в сердце, могут вызвать развитие цереброваскулярных заболеваний. Неврологическое повреждение, развивающееся в результате некоторых из этих патологических процессов, называют инсультом. От цереброваскулярных заболеваний страдают пять процентов населения старше 65 лет; эти заболевания в развитых странах мира являются третьей по значимости причиной смерти. Кроме того, они часто осложняются пожизненной инвалидизацией, утратой трудоспособности, нарушением социальных и семейных функций, необходимостью обеспечивать пациенту амбулаторный уход. После инсульта у пациентов, как правило, на всю оставшуюся жизнь сохраняются значительные нарушения.
Развивающимся, или прогрессирующим, инсультом называют неврологическое дефицитарное состояние, после исходного события прогрессирующее или протекающее нестабильно. Причиной развития инсульта считают прогрессирующие спазм или сужение пораженной артерии, развитие отека мозга вокруг исходного участка повреждения, распространение тромба в результате снижения кровотока или выделения цитокинов в участке повреждения клеток мозга. К счастью, сосуды мозга между собой соединены - так называемое коллатеральное кровообращение. Поступление крови из этих коллатеральных сосудов может предотвратить смерть клеток мозга в зоне ишемии.
Внутримозговое кровоизлияние обычно вначале выглядит как небольшое объемное образование, под действием артериального давления увеличивающееся и приводящее к смещению и сдавлению прилежащей ткани головного мозга. Отек в прилежащей к участку кровоизлияния сдавленной ткани может приводить к массивному поражению и ухудшению клинического состояния с поражением более значительной области ткани головного мозга. Отек в прилежащих отделах головного мозга может вызывать прогрессирующее ухудшение состояния, обычно выявляемое в течение 12-72 часов. Развитие отека в течение нескольких недель после внутримозгового кровоизлияния нередко ухудшает прогноз, особенно у пожилых больных. Ткань, окружающая область кровоизлияния, смещается и сдавливается, но ее поражение не всегда фатальное. При рассасывании кровоизлияния отек прилежащей ткани спадает и функция пораженной ткани восстанавливается.
Результаты лечения при этом состоянии разочаровывают. Хирургическая декомпрессия области кровоизлияния в ряде случаев позволяет предотвратить развитие необратимого сдавления. Ряд лекарственных препаратов, например маннитол и другие осмотически действующие препараты, могут уменьшить внутримозговое давление, повышающееся при отеке. Эффективность стероидов в этих случаях неизвестна; недавно предложено применять гипербарическую оксигенацию.
Таким образом, хотя в поврежденной кожной и подкожной тканях применение отрицательного (или субатмосферного) давления обеспечило более высокую частоту заживления по сравнению с традиционными методами лечения (как показано в патентах US 5645081, 5636643, 7198046, 7216651, а также в опубликованных заявках US 2003/0225347, 2004/0039391, 2004/0122434, содержание которых включено в настоящую заявку путем ссылки), потребность в устройствах и способах, предназначенных для применения при лечении специализированных тканей центральной нервной системы, сохраняется.
Раскрытие изобретения
Настоящее изобретение относится к устройству и способу лечения тканей центральной нервной системы с использованием пониженного давления (субатмосферного), в частности, но не исключительно, к устройству и способу лечения ткани головного мозга с использованием субатмосферного давления. Согласно одному из аспектов настоящее изобретение представляет способ лечения повреждений ткани центральной нервной системы с помощью субатмосферного давления, в котором пористый материал размещают в непосредственной близости (проксимальнее) от поврежденной ткани центральной нервной системы, чтобы обеспечить между одной или несколькими порами пористого материала и поврежденной тканью центральной нервной системы сообщение с возможностью прохождения газа. В некоторых случаях пористый материал может быть расположен непосредственно над поврежденной тканью центральной нервной системы. Пористый материал можно размещать по месту вблизи поврежденной ткани центральной нервной системы, чтобы обеспечить сохранение в (у) поврежденной ткани центральной нервной системы субатмосферного давления. Пористый материал можно функционально соединить с источником разрежения (также называемым далее "вакуумной системой") для формирования в поврежденной ткани центральной нервной системы субатмосферного давления, и активировать эту систему для его формирования. Субатмосферное давление может сохраняться в поврежденной ткани в течение срока, достаточного для снижения выраженности отека в центральной нервной системе.
В соответствии с другим аспектом настоящего изобретения предлагается устройство для лечения поврежденной ткани центральной нервной системы. Устройство может содержать пористый материал, подвергающийся биологическому рассасыванию (биоабсорбции), например воздухопроницаемый (с открытыми порами) коллаген, имеющий пористую структуру, обеспечивающую возможность перемещения газов между одной или несколькими порами пористого материала и тканью центральной нервной системы, лечение которой производится. Свойство материала, подвергающегося биологическому рассасыванию, встраиваться в биологические среды может избавить от необходимости проводить второе вмешательство для удаления пористого материала. Устройство также содержит источник разрежения (вакуумную систему) для создания субатмосферного давления, который может быть размещен с обеспечением газового сообщения с пористым материалом для подвода к ткани центральной нервной системы субатмосферного давления. Пористый материал может иметь, по крайней мере на выбранной определенной поверхности, поры, достаточно мелкие для предотвращения прорастания в них ткани. Кроме того, пористый материал может иметь, по крайней мере на определенной поверхности, поры размером меньше размера фибробластов и клеток центральной нервной системы и может иметь поры, расположенные в других, помимо указанной определенной поверхности, участках, размером, превышающим размер фибробластов и клеток центральной нервной системы. Размер пор пористого материала может быть достаточно крупным, чтобы обеспечить движение через них белков, размером соответствующих молекуле альбумина. Кроме того, пористый материал, подвергающийся биологическому рассасыванию, может содержать по крайней мере одну поверхность, уплотненную (герметизированную) для предотвращения распространения через нее субатмосферного давления. Устройство может также содержать покрытие, приспособленное для закрытия поврежденной ткани центральной нервной системы для поддержания под покрытием над поврежденной тканью центральной нервной системы субатмосферного давления.
При использовании данное изобретение может создавать градиент давления, позволяющий обеспечивать устранение отека центральной нервной системы, таким образом сохраняя неврологические функции для повышения вероятности восстановления ткани и ее выживания в более физиологически сохранном состоянии. Снижение выраженности отека ткани центральной нервной системы может, в свою очередь, снижать интраспинальное давление, минимизируя риск образования грыжи и сдавления ткани центральной нервной системы. Кроме устранения отека, данное изобретение может обеспечить выведение медиаторов, продуктов разрушения ткани и токсинов, усиливающих вызываемые повреждением в тканях центральной нервной системы воспалительные и нейропатологические процессы.
Настоящее изобретение может защитить центральную нервную систему от экзогенной инфекции и загрязнения, а также облегчает и увеличивает степень заживления внутричерепных и прилежащих структур при абсцессах в центральной нервной системе, менингите, вентрикулите, инфекциях в мозговой ткани. Ткань центральной нервной системы может также быть защищена от прилежащих очагов инфекции, например, субклинических придаточных пазух носа, полости рта, других потенциально инфицированных в физиологических условиях областей, путем либо увеличения притока крови, либо непосредственного снижения бактериальной обсемененности. Кроме того, устройство и способ по настоящему изобретению может способствовать достижению тканью центральной нервной системы стадии заживления и уменьшению числа бактерий, благодаря чему может быть повышена вероятность эффективного проведения вторичных методов лечения (например, наложения кожного лоскута, пересадки кожи).
Данное изобретение также может способствовать закрытию патологических отверстий, соединяющих центральную нервную систему с экстрадуральным пространством, например, между экстрадуральным пространством и субдуральным/эпидуральным и/или субарахноидальным пространствами. Кроме того, могут быть сведены к минимуму прогрессирование патологических процессов, нарушение физиологической целостности центральной нервной системы, изменение кровообращения и питания центральной нервной системы.
Устройства и способы, описываемые в данном изобретении, могут быть использованы для следующих видов лечения: коррекции поражения центральной нервной системе вследствие травмы, операций, инфекций или любых других патологических процессов, лечебного воздействия на любые из пространств и тканей, окружающих центральную нервную систему, в том числе субдуральное/эпидуральное и внутрижелудочковое пространства; лечения отека паренхимы центральной нервной системы, развившегося по любым причинам, в том числе вследствие кровоизлияния, травмы, опухоли, инфекции или любого другого патологического состояния, лечения повышенного внутричерепного и интраспинального давления в связи с любой из вышеупомянутых причин; лечения патологических изменений ликвора, связанных с патологическим сообщением ликвора с любыми анатомически и физиологически измененными пространствами организма. Кроме того, изобретение может быть использовано для содействия формированию грануляционной ткани в областях поражения центральной нервной системы и для устранения утечки ликвора. Кроме того, модифицированный представляемый материал может быть использован для контроля или закрытия патологических анатомических соотношений между центральной нервной системой, кожными покровами, интраназальным пространством и пространством пазух носа.
Краткое описание чертежей
Вышеприведенное краткое и приводимое ниже подробное описание предпочтительных вариантов осуществления данного изобретения наиболее полно можно понять, рассматривая их в сочетании с прилагаемыми фигурами, на которых:
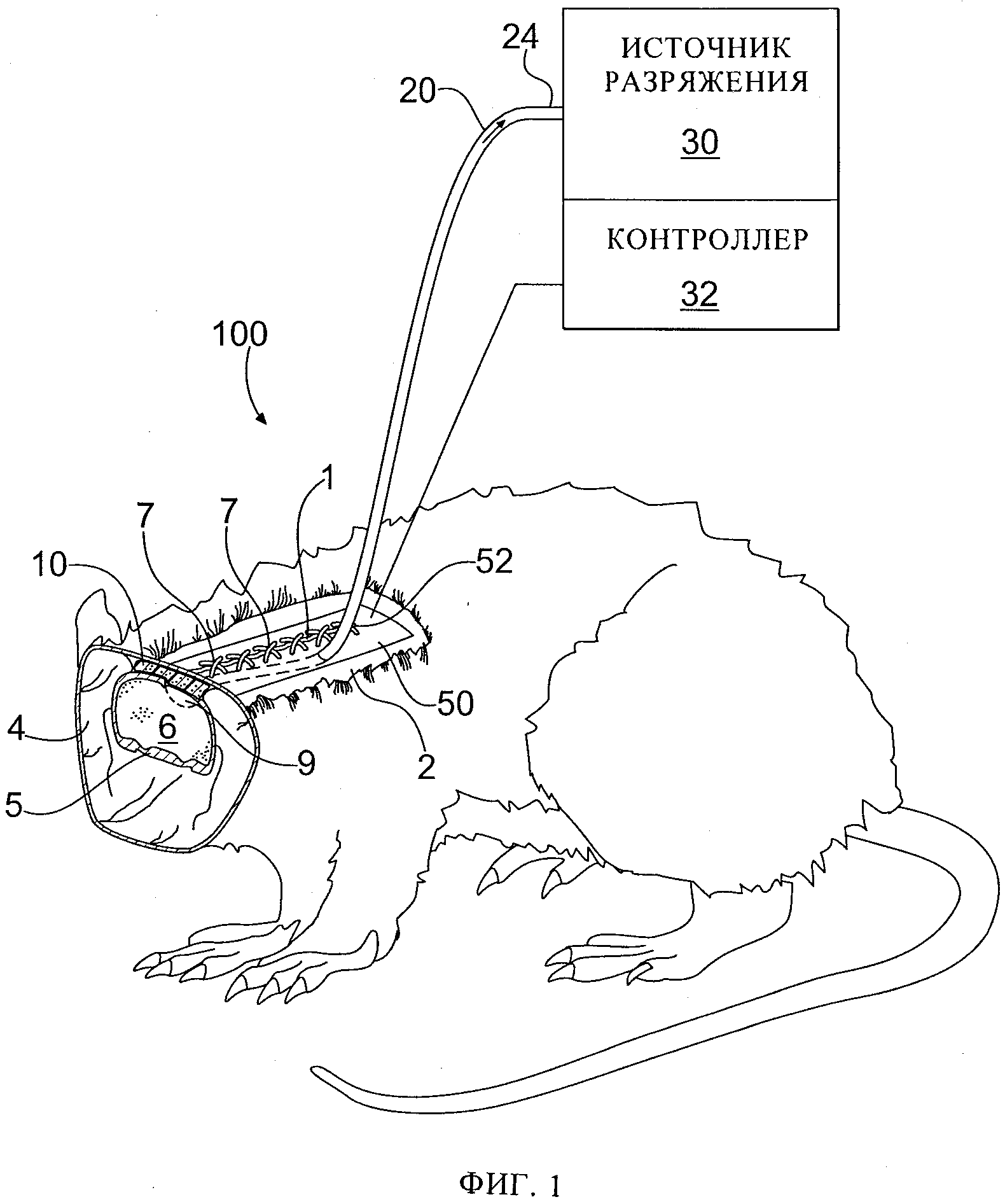
фиг.1 схематически иллюстрирует перспективное изображение с поперечным разрезом примера конфигурации представляемого в данном изобретении устройства, расположенного по месту при проведении лечения повреждения головного мозга;
фиг.2 и 3 иллюстрируют МРТ-изображения, полученные у контрольного животного с черепно-мозговой травмой, которому не проводили лечения с созданием субатмосферного давления;
фиг.4 иллюстрирует МРТ-изображения, полученные у животного с черепно-мозговой травмой, в течение 8 часов получавшего лечение с созданием субатмосферного давления;
фиг.5 иллюстрирует МРТ-изображения, полученные у контрольного животного с черепно-мозговой травмой, которому не проводили лечения с созданием субатмосферного давления;
фиг.6 и 7 иллюстрируют МРТ-изображения, полученные у животного с черепно-мозговой травмой, которых в течение 24 часов лечили с созданием субатмосферного давления;
фиг.8 иллюстрирует МРТ-изображения у контрольного животного с черепно-мозговой травмой, которому не проводили лечения с созданием субатмосферного давления;
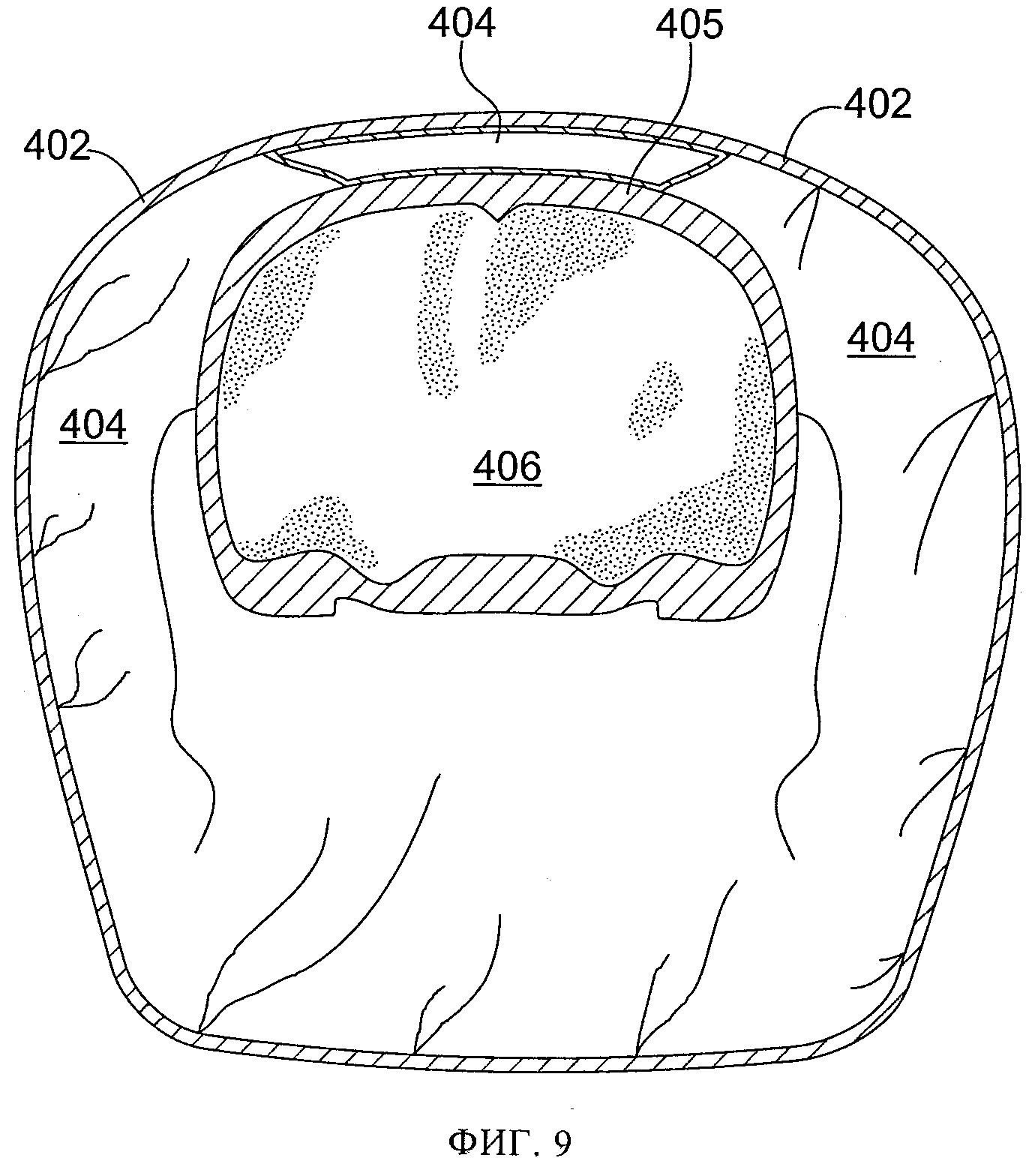
фиг.9 схематически иллюстрирует нормальную анатомию черепа крысы в частичном поперечном разрезе, включая головной мозг и расположенные вокруг него мышцы, кости и другие ткани;
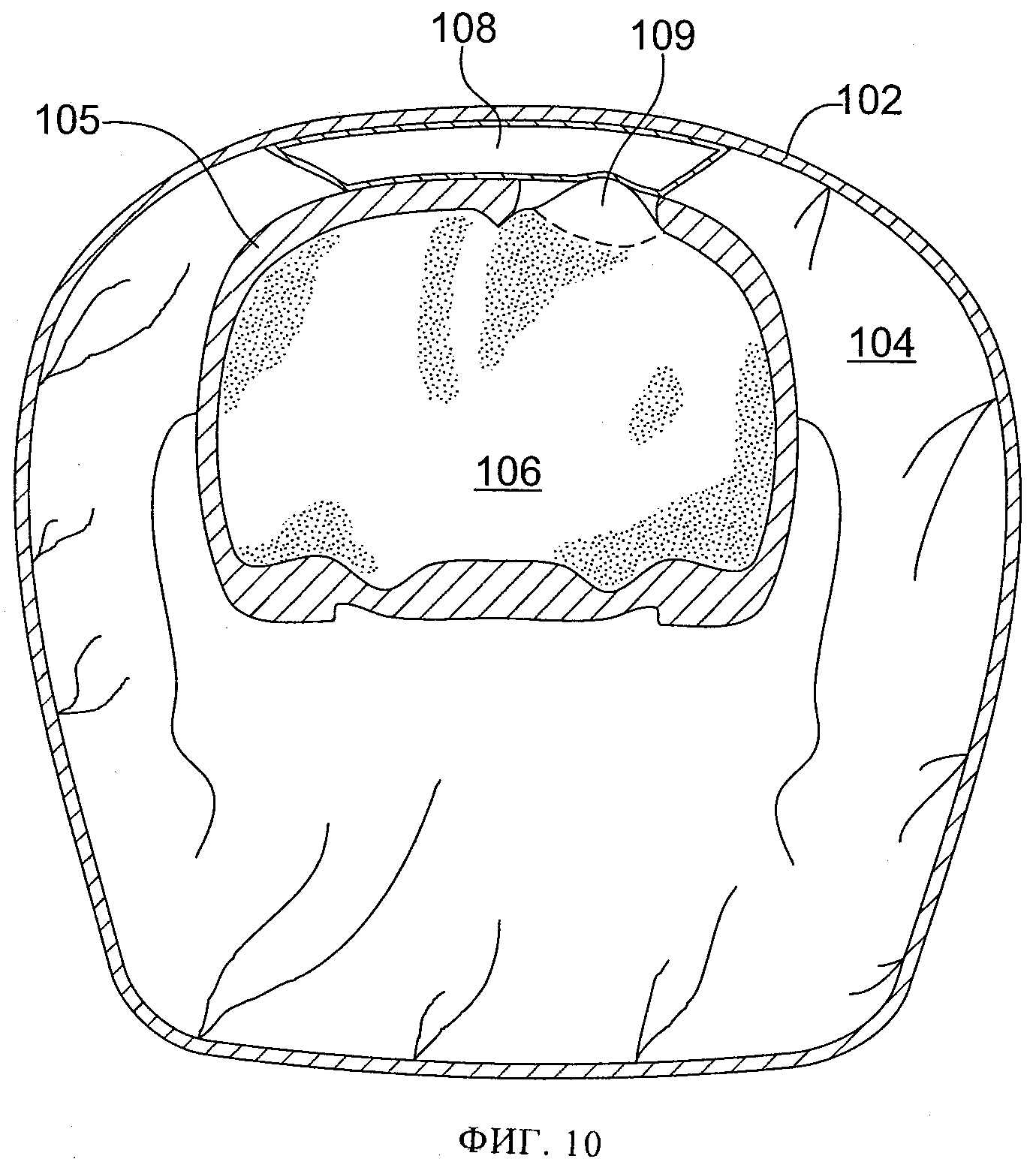
фиг.10 схематически иллюстрирует в частичном поперечном разрезе срез 12/26 у животного с фиг.2; показана область повреждения и накопления крови или ликвора;
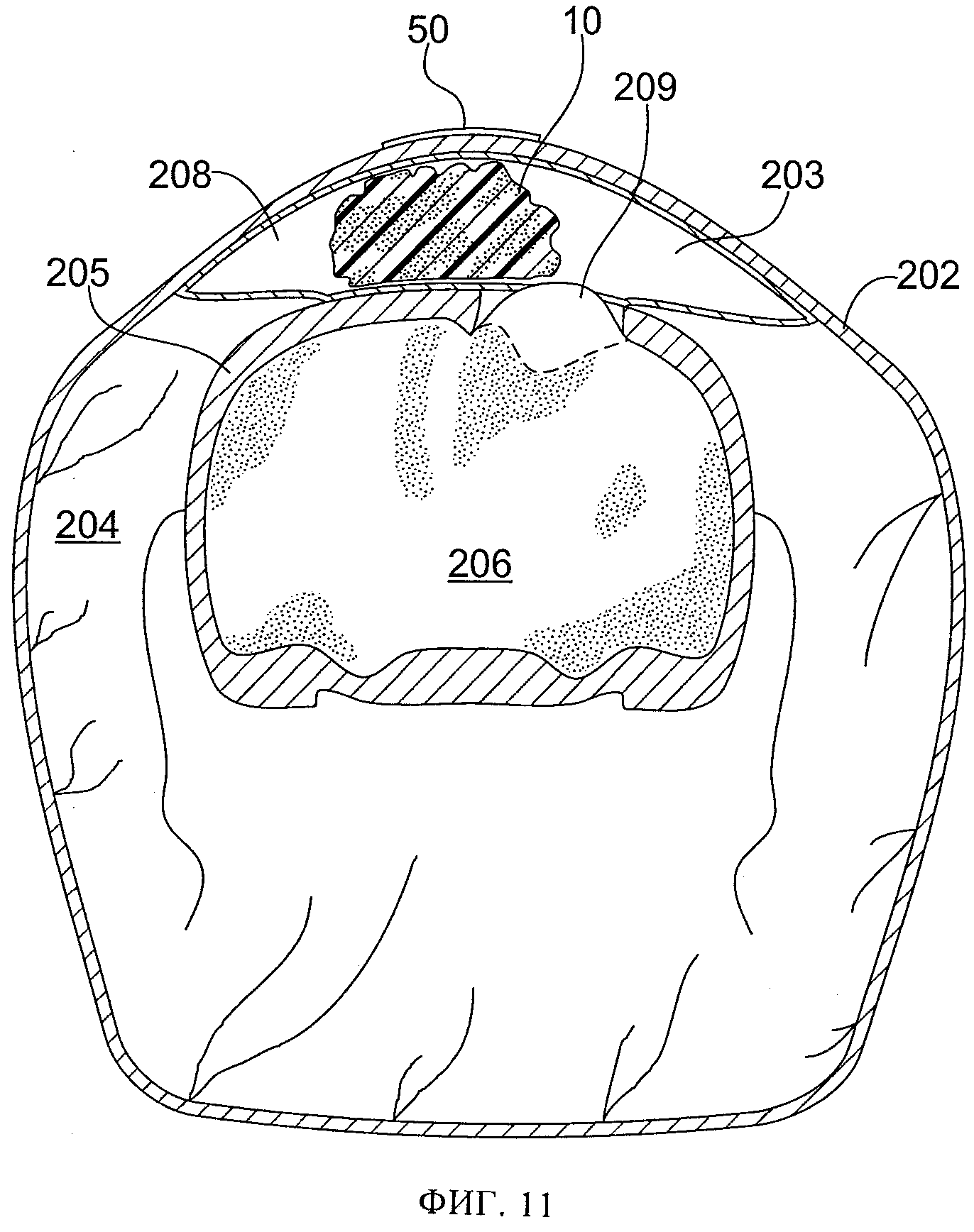
фиг.11 схематически иллюстрирует в частичном поперечном разрезе срез 12/24 у животного с фиг.4; показана область повреждения с размещенными по месту пористым материалом и салфеткой;
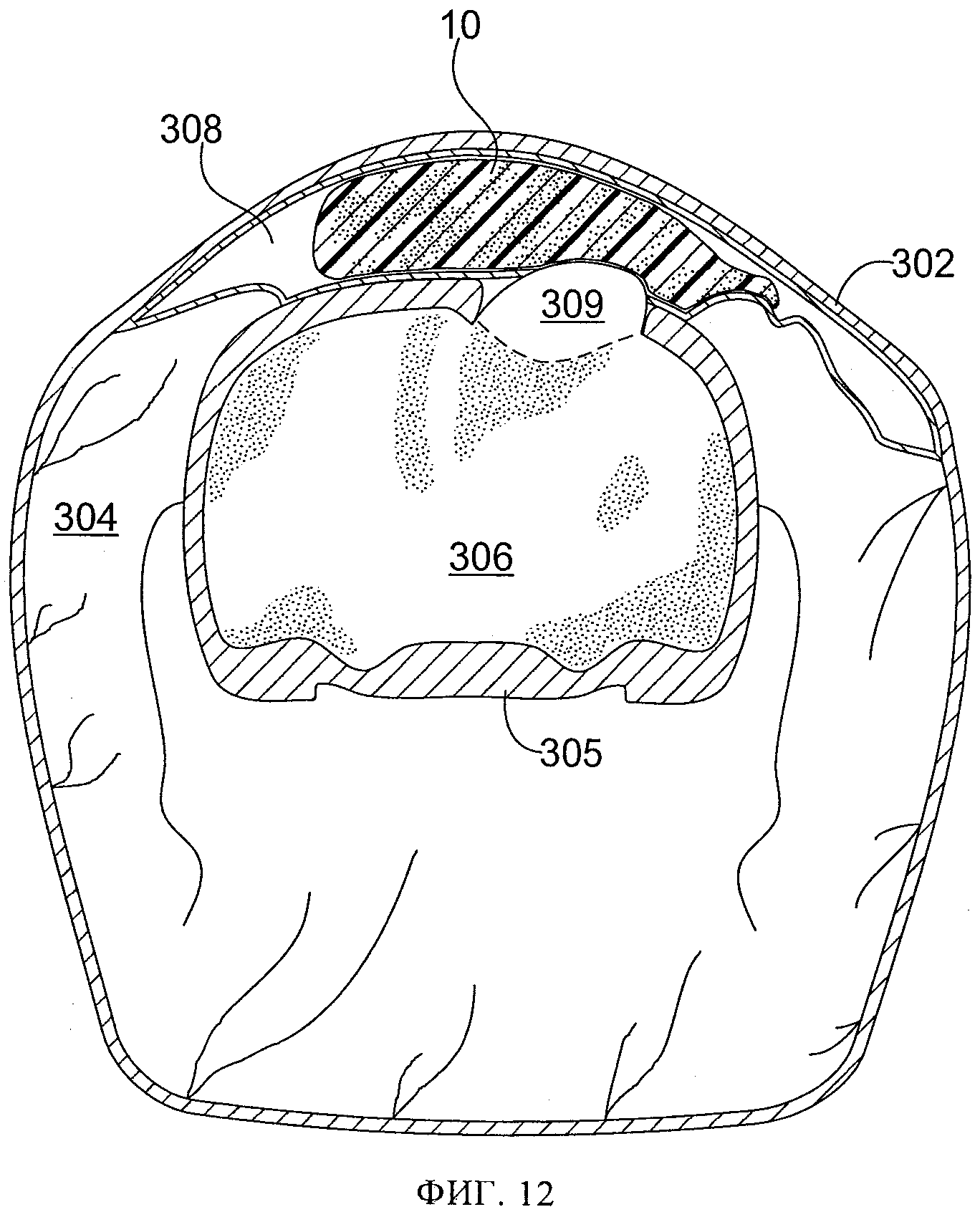
фиг.12 схематически иллюстрирует в частичном поперечном разрезе срез 12/24 у животного с фиг.5; показана область повреждения с размещенным по месту пористым материалом;
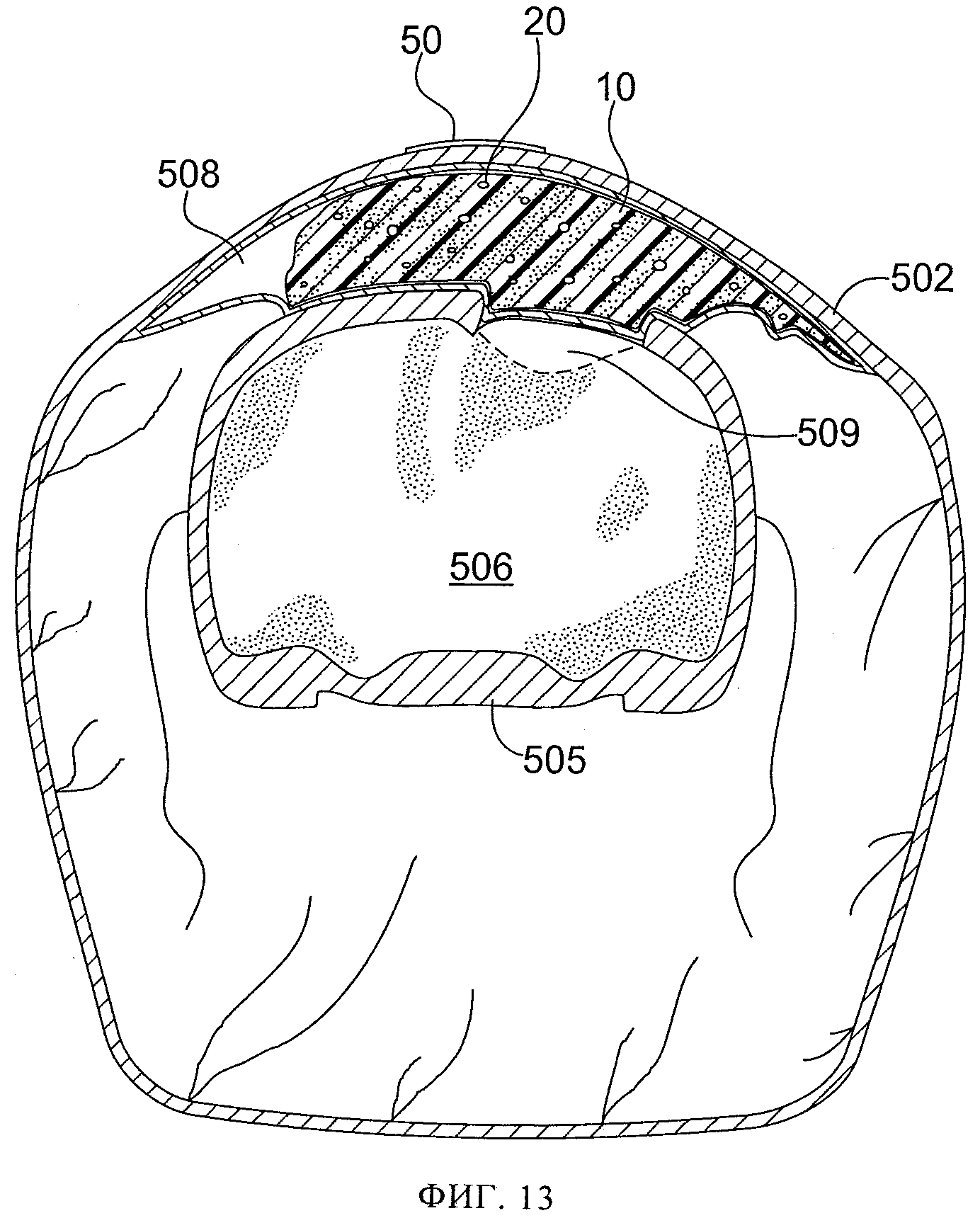
фиг.13 схематически иллюстрирует в частичном поперечном разрезе срез 12/24 у животного с фиг.6; показана область повреждения с размещенными по месту пористым материалом и салфеткой;
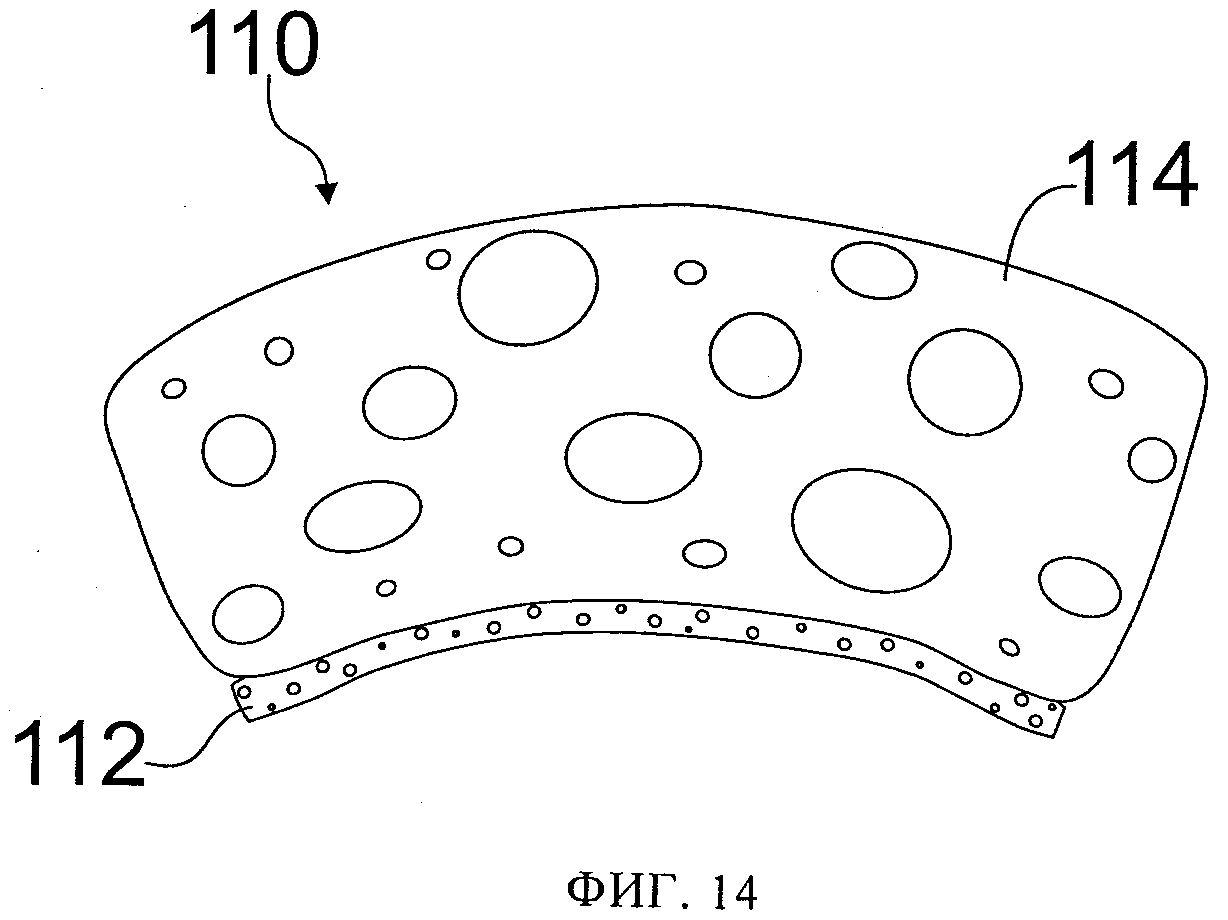
фиг.14 схематически иллюстрирует многослойный пористый материал в рамках данного изобретения;
фиг.15А и 15Б иллюстрируют правую нижнюю панели МРТ-изображений с фиг.5 и 6 соответственно, увеличенных, чтобы показать относительно большее содержание воды в мозге животных после повреждения в отсутствие лечения;
фиг.16 иллюстрирует Т2-взвешенные МРТ-изображения в осевых плоскостях, иллюстрирующие локализацию вокселов МР-спектров, полученных при визуализации мозга крысы в естественных условиях;
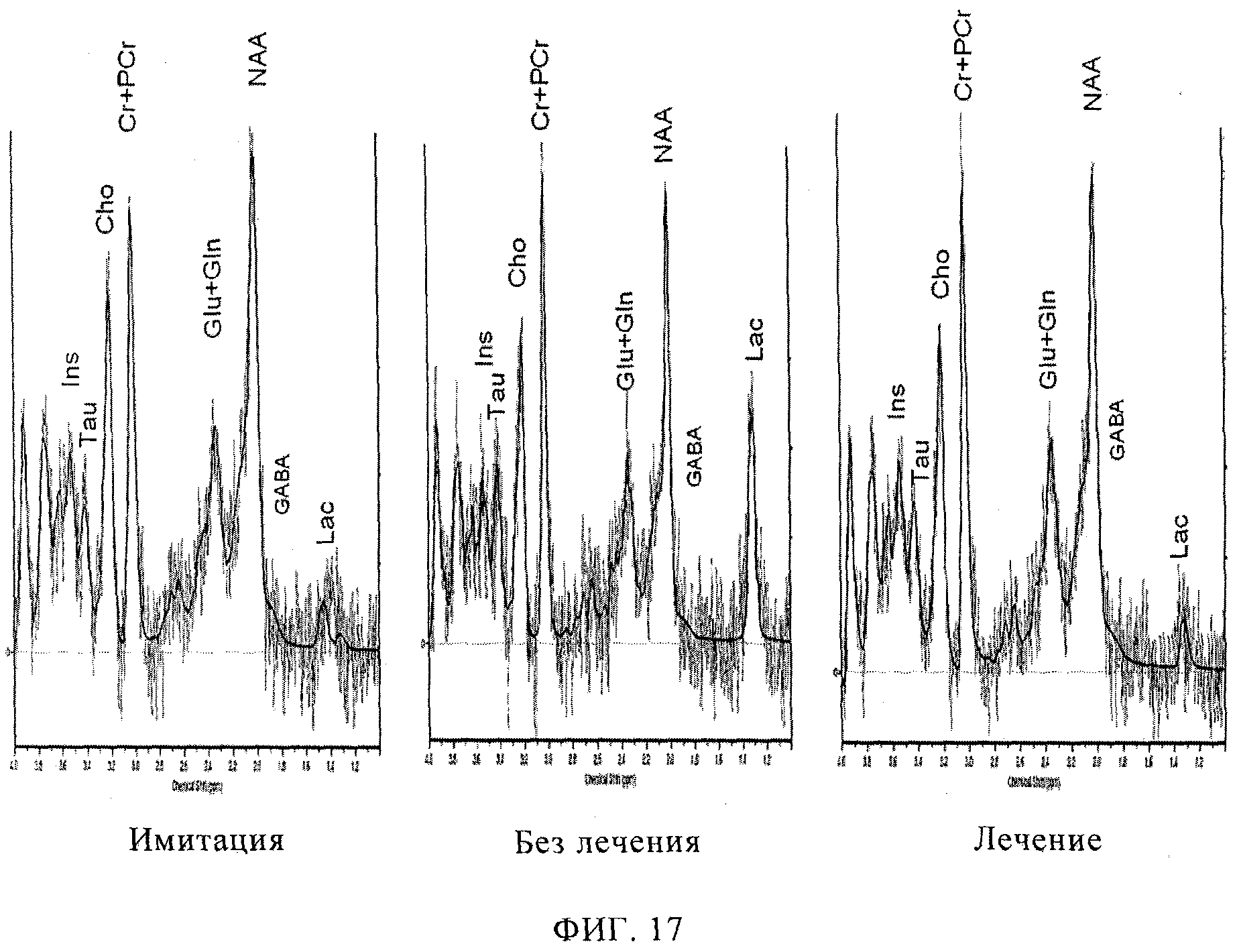
фиг.17 иллюстрирует одновоксельные МР-спектры, полученные при визуализации мозга после имитации хирургического вмешательства, при повреждении головного мозга и при леченом повреждении головного мозга. Метаболиты помечены как Ins (миоинозитол), Таи (таурин), Cho (холин-содержащие соединения), Сr+РСr (креатин и фосфокреатин), Glu+Gln (глутамат и глутамин), NAA (N-ацетиласпартат), GABA (γ-аминомасляная кислота), Lac (лактат);
фиг.18А и 18Б иллюстрируют результаты иммуногистохимического анализа разрушения и гибели нейронов при окрашивании на нитротирозин образцов головного мозга, полученных через 72 часов после повреждения в группе лечения, подвергнутой действию субатмосферного давления в течение всех 72 часов; темно-коричневые пятна обозначают погибшие и отмирающие клетки.
Осуществление изобретения
Рассмотрим фигуры, на которых сходные элементы пронумерованы одинаково на всех иллюстрациях. Данное изобретение относится к устройствам и способам применения субатмосферного (отрицательного) давления для лечения поврежденной ткани центральной нервной системы. Здесь "поврежденная" ткань определяется как травмированная, с нарушением функции, либо иным образом деградировавшая, например поврежденная вследствие травмы, заболевания, инфекции, осложнения хирургического вмешательства, другого патологического процесса. На фиг.1 представлен пример конфигурации устройства 100 для лечения поврежденной ткани центральной нервной системы субатмосферным давлением в данном изобретении. Устройство 100 для лечения субатмосферным давлением центральной нервной системы может включать пористый материал 10, размещенный вблизи поврежденной ткани центральной нервной системы, например, такой как ткань головного мозга 9, для подачи и распределения субатмосферного давления на поврежденные ткани мозга 9. Устройство 100 для лечения поврежденной ткани центральной нервной системы может также включать источник разрежения (вакуумную систему) 30, сообщающийся по газу с пористым материалом 10 через трубку 20 для обеспечения воздействия субатмосферного давления на поврежденные ткани головного мозга 9.
Рассматривая фиг.1 более подробно, пример конфигурации устройства 100 для лечения поврежденной ткани центральной нервной системы субатмосферным давлением, предлагаемого в настоящем изобретении, проиллюстрирован частичным поперечным разрезом окружающих тканей на месте. Проиллюстрированные ткани включают кожу 2, мышечную ткань 4, кости черепа 5, поврежденные ткани головного мозга 9, выше которого часть кости черепа 5 отсутствует, чтобы обеспечить доступ для лечения поврежденной ткани мозга 9. Пористый материал 10 может быть размещен в пространстве вблизи ткани головного мозга 9, чтобы обеспечить лечение субатмосферным давлением поврежденной ткани головного мозга 9. Лечение может включать снижение внутричерепного давления, уменьшение отека, удаление патологически действующих жидкостей или нежелательных веществ и так далее, например.
Пористый материал 10 может иметь поры достаточно крупные, чтобы обеспечить прохождение нежелательных веществ, которые нужно удалить из ткани головного мозга 9 и окружающего пространства/ткани(ей), и достаточно мелкие, чтобы сдержать или предотвратить врастание ткани головного мозга в пористый материал 10. В связи с этим размер пор может быть достаточно крупным, чтобы обеспечить перенос таких материалов, как цитокины, токсичные вещества или другие медиаторы, от ткани головного мозга 9, чтобы снизить содержание таких материалов до клинически желаемого уровня. Например, размер пор может быть достаточно крупным, чтобы обеспечить прохождение через пористый материал 10 альбумина. Кроме того, поры могут быть достаточно небольшими (по крайней мере в области, где пористый материал 10 контактирует с тканью головного мозга 9) для сдерживания или предотвращения роста тканей в пористый материал 10, чтобы при удалении пористый материал 10 не прикреплялся и не вызывал повреждения ткани головного мозга 9. Например, чтобы свести к минимуму врастание и избежать избыточного образования грануляционной ткани, которая может препятствовать физиологическому функционированию головного мозга, размер пор может быть меньше, чем размер фибробластов и клеток мозга.
Пористый материал 10 может быть однородным по составу и/или морфологии, однако внутри пористого материала 10 или в любом другом участке пористого материала 10, который не находится в контакте с тканью головного мозга 9, размер соответствующих пор может быть больше. Например, пористый материал 110 может включать в себя не врастающий в ткань слой 112 с размером пор, достаточно небольшим, чтобы предотвратить врастание в них ткани, в области размещения материала над головным мозгом, и может иметь дополнительный слой 114, изготовленный из другого материала, имеющего относительно крупные размеры пор (например, превышающие размер фибробластов и клеток мозга), который будет контактировать с не врастающим слоем 112, но не с головным мозгом, фиг.14. Например, пористый материал 10 может иметь размер пор, достаточно крупный, чтобы способствовать формированию грануляционной ткани в других тканях в пространствах, окружающих поврежденные ткани головного мозга 9. Кроме того, одна или более сторон или поверхностей пористого материала 10 могут быть герметичны, чтобы предотвратить передачу через них субатмосферного давления, в то же время по меньшей мере одна поверхность будет обеспечивать возможность передачи субатмосферного давления. Такая конфигурация пористого материала 10 может обеспечить преимущественное воздействие на ткань на одной стороне пористого материала 10, но отсутствие такого воздействия на герметичной стороне. Например, такой пористый материал 10 может быть использован с размещением в паренхиме головного мозга на границе с желудочками мозга. На паренхиму можно воздействовать через поверхность на одной стороне пористого материала 10, в то же время герметичная поверхность(и) пористого материала 10 не будет дренировать внутрижелудочковое пространство, поэтому жидкость из внутрижелудочкового пространства удаляться не будет. Аналогичным образом, пористый материал 10, проницаемость которого по длине изменяется, позволит применять субатмосферное давление к паренхиме головного мозга, в то же время не вызывая развития субатмосферного давления в пространствах, заполненных спинномозговой жидкостью (СМЖ), таких как борозды, желудочки, субарахноидальное пространство, и, следовательно, не будет стимулировать выделение СМЖ из этих пространств.
Пористый материал 10 может включать материал, подвергающийся биологическому рассасыванию или безвредному разрушению в течение некоторого времени, такого как коллаген, и может включать материал, который после формирования субатмосферного давления должен быть удален. Пористый материал 10 может четко соответствовать поверхности головного мозга или стенок полости, без чрезмерного упаковывания, и не требовать избыточных обрезки и придания формы. Например, пористый материал 10 может быть представлен в виде ленты или полоски, которые могут быть размещены на поверхности или внутри головного мозга/черепа. Ленты или полоска может иметь достаточную прочность, так что она может быть извлечена из полости черепа, не разрушаясь и не оставляя фрагментов. Например, лента или полоска из пористого материала 10 может быть постепенно и поступательно извлечена из полости, которую заполнила при размещении. Таким образом, пористый материал 10 может быть изготовлен в виде ленты, или пленки, или полоски (например, 5×5×200 мм) с достаточной устойчивостью, позволяющей вытягивать материал через небольшое отверстие в черепе 5 после лечения без необходимости проводить повторную операцию. Пористый материал 10 может быть изготовлен в виде гибкого листа, который можно сложить и разместить в конкретных участках центральной нервной системы, например непосредственно в паренхиме головного мозга или системе желудочков мозга, после травмы.
Кроме того, пористый материал 10 может быть достаточно мягким (податливым), чтобы не давить на поврежденную ткань головного мозга с силой, нарушающей функционирование мозга. Тем не менее, пористый материал 10 может быть достаточно жестким, чтобы не деформироваться настолько, чтобы потянуть или деформировать ткань головного мозга до степени, которая может нарушать функционирование головного мозга. Примеры материалов, которые могут быть использованы в составе пористого материала 10, могут включать коллаген с открытыми порами, материал из полигликоля и/или полимолочной кислоты, синтетический полимер, гибкую листовую сетку, полимерную пену с открытыми порами, пенистый сегмент, пористый лист, пену из поливинилового спирта, материал из полиэтилена и/или полиэстера, эластин, гиалуроновую кислоту, альгинаты, полидиолцитраты, полигидроксибутират, полигидроксифумарат, политриметиленкарбонат, полиглицеролсебацинат, алифатические/ароматические полиангидриды или другие подходящие материалы, а также комбинации из вышеизложенного, любые из которых могут быть изготовлены, например, методами электропрядения, литья, печати. Такие материалы включают в себя раствор хитозана (1,33 маc./объем.% в 2% уксусной кислоте, общим объемом 20 мл), который может быть залит в соответствующего размера форму. Затем раствор замораживают в течение 2 часов при температуре -70°С, после чего переносят в лиофилизатор и обеспечивают разрежение в течение 24 часов. В материале могут быть сформированы поперечные сшивки путем обработки парами 2,5-5% глутаральдегида в течение 12-24 часов (или под воздействием ультрафиолетового излучения в течение 8 часов), чтобы сформировать литой пористый материал 10.
Кроме того, пористый материал 10 может быть изготовлен путем литья из поликапролактона (PCL). Поликапролактон может быть смешан с хлоридом натрия (1 часть капролактона на 10 частей натрия хлорида) и для растворения компонентов помещен в достаточный объем хлороформа. Например, можно загрузить 8 мл раствора в емкость соответствующего размера и формы и высушить в течение двенадцати часов. Хлорид натрия может быть затем вымыт водой в течение 24 часов.
Кроме того, для получения пористого материала 10 можно использовать электроспряденные материалы. Один из примеров формы и способа получения электроспряденного пористого материала 10 включал его изготовление с использованием сочетания коллагена I типа: хондроитин-6-сульфата (CS): 1,8-полиоктандиолцитрата (РОС) в соотношении 76%:4%:20% по весу. Коллаген/CS/POC растворяли в двух растворителях. CS растворяли в воде, а коллаген и РОС растворяли в 2,2,2-трифторэтаноле (ТФЭ). Затем использовали раствор 20% воды/80% ТФЭ (по объему). Для электропрядения раствор, содержащий смесь коллаген:CS:РОС, помещали в шприц емкостью 3 мл с установленной иглой 18 калибра (Ga). Для введения раствора в кончик иглы со скоростью 2,0 мл/час был использован шприцевой насос (производства New Era Pump Systems, Wantaugh, Нью-Йорк, США). С помощью источника высокого напряжения (HV Power Supply, Gamma High Voltage Research, Ormond Beach, Флорида, США) создавалось напряжение 10-20 кВ, прикладываемое между иглой (анод) и заземленным коллектором (катод) с расстояния 15-25 см.
Дополнительным методом создания пористых материалов 10 является использование технологий струйной термопечати. Печати можно подвергать материалы, подвергающиеся биологическому рассасыванию, такие как коллаген, эластин, гиалуроновая кислота, альгинаты, сополимеры полимолочной/полигликолевой кислоты. В качестве примера, коллаген I типа (Elastin Products Co., Owensville, Миссури, США) растворяли в 0,05% уксусной кислоте, затем разводили в воде до 1 мг/мл, что позволяло подвергать его печати, как и альгинат натрия (Dharma Trading Co., San Raphael, Калифорния, США) в концентрации 1 мг/мл в воде. Также возможно подвергать печати смеси коллагена I типа (2,86 мг/мл в 0,05% уксусной кислоты) и полимолочной/полигликолевой кислоты (PURAC America, Blair, Небраска, США) (14,29 мг/мл в тетрагликоле (Sigma Aldrich, St. Louis, Миссури, США)). Необходимое оборудование - принтер производства компании Hewlett Packard 660 с, в том числе шаговые двигатели и каретка для картриджей - может быть установлено на платформе. Затем можно скорректировать высоту платформы с оборудованием для послойной печати. Пористый материал 10 может включать МРТ-совместимый материал, позволяющий проводить МРТ без извлечения пористого материала 10.
Для передачи субатмосферного давления к пористому материалу 10, чтобы оно могло распространиться в поврежденной ткани головного мозга 9, с помощью трубки 20 может быть обеспечен прямой или косвенный контакт газа с пористым материалом 10 в области дистального конца 22 трубки 20. Например, дистальный конец 22 трубки 20 может быть вложен в пористый материал 10 или может быть размещен над пористым материалом 10. Дистальный конец 22 трубки 20 может также иметь одно или несколько отверстий, способствующих передаче субатмосферного давления к пористому материалу 10 и поврежденной ткани головного мозга 10. Трубка 20 может проходить через отверстие в коже и подкожной ткани 2, к которой может быть фиксирована швом, чтобы способствовать герметизации трубки 20. Проксимальный конец 24 трубки 20 может быть функционально связан с источником 30 разрежения, таким как вакуумный насос, чтобы обеспечить формирование субатмосферного давления, которое посредством трубки 20 передается до пористого материала 9 и поврежденной ткани головного мозга 7.
Источник 30 разрежения может содержать контроллер 32 для регулирования величины субатмосферного давления. Например, источник 30 разрежения может быть настроен для получения субатмосферного давления непрерывно или с перерывами, например, чтобы чередованием включения и выключения обеспечить периодическую генерацию субатмосферного давления. Рабочий цикл периодического формирования субатмосферного давления может составлять от 1 до 10 (вкл/выкл) до 10 к 1 (вкл/выкл). Кроме того, периодическое формирование субатмосферного давления может иметь форму периодической или циклической волны, такой как синусоида. После первичного воздействия источник 30 разрежения может работать циклически, чтобы точнее имитировать физиологическое состояние, например, несколько раз в минуту. Субатмосферное давление может формироваться циклически путем включения-выключения по мере необходимости, определяемой на основе мониторинга давления в головном мозге 9. В целом, источник 30 разрежения может быть настроен для обеспечения величин субатмосферного давления, лежащих между атмосферным давлением и величиной на 75 мм рт.ст. ниже атмосферного давления (например, около примерно 20 мм рт.ст.), чтобы минимизировать риск иных вредных воздействий субатмосферного давления на паренхиму головного мозга. (Избыточное отрицательное давление может вызвать кровоизлияние в паренхиму). Формирование такого субатмосферного давления может обеспечивать устранение отека ткани головного мозга 9, таким образом сохраняя неврологические функции для повышения вероятности восстановления ткани и ее выживания в более физиологически сохранном состоянии. Кроме того, приложение субатмосферного давления может нормализовать внутричерепное давление до клинически желательного уровня, нормализовать объем и плотность ткани до клинически желаемого уровня и/или нормализовать по крайней мере один из показателей, таких как артериальное давление и частоту пульса, до клинически желаемого уровня. Например, приложение субатмосферного давления может нормализовать внутричерепное давление до физиологического состояния, аналогичного существовавшему до повреждения, нормализовать объем и плотность ткани до физиологического состояния, аналогичного существовавшему до повреждения, и/или нормализовать по крайней мере артериальное давление или частоту пульса до физиологического состояния, аналогичного существовавшему до повреждения.
Чтобы облегчить поддержание субатмосферного давления в (у) поврежденной ткани головного мозга 9, рядом с поврежденной тканью головного мозга 9 могут быть установлены гибкое покрытие/лист 50 или жесткое (или полужесткое) покрытие, чтобы в этой области сохранялось субатмосферное давление. В частности, в отношении фиг.1, 11, 13, над поврежденной тканью головного мозга 9 и пористым материалом 10 может быть размещено покрытие 50, прикрепленное к тканям, например коже 2, 202, 502, вблизи поврежденной ткани головного мозга 9 с образованием герметичной области вокруг поврежденной ткани головного мозга 9 и пористого материала 10. Например, покрытие 50 может быть приклеено к коже 2, 202, 502 и/или другим соответствующим тканям с использованием клея, такого как фибриновый клей. Клей может состоять из самополимеризующегося клея и/или, что желательно, может содержать наполнитель, обеспечивающий клею достаточный объем, чтобы обеспечить соответствие формы области, заполненной клеем, тем потенциально неровным поверхностям, с которыми он контактирует. Клей может быть предоставлен отдельно или в составе покрытия 50, которое в этом случае будет самоклеящимся. Например, покрытие 50 может включать гибкий самоклеящийся лист, содержащий на одной или нескольких поверхностях соответствующий клей.
Субатмосферное давление может быть сформировано под покрытием 50 путем обеспечения связи между покрытием 50 и трубкой 20. В частности, покрытие 50 может иметь отверстие для вакуумирования, к которому подведен дистальный конец 22 трубки 20 для обеспечения контакта газа между трубкой 20 и пространством под покрытием 40 выше поврежденной ткани головного мозга 9. С другой стороны, покрытие 50 может содержать сквозное отверстие 52, через которое проходит трубка 20 так, что дистальный конец 22 трубки 20 расположен внутри пространства под покрытием 50 над поврежденной тканью головного мозга 9, и обеспечивает газовое сообщение между ними, фиг.1. Кроме того, покрытие 50 может дополнительно защищать поврежденную ткань головного мозга 9 от экзогенной инфекции и загрязнения, помимо защиты, уже обеспечиваемой пористым материалом 10 и кожным швом 2. Кроме того, покрытие 50 может дополнительно защищать окружающие ткани от распространения инфекции от поврежденной ткани головного мозга 9, например от абсцессов мозга, менингита, инфекций ткани спинного мозга. В качестве альтернативы, покрытие 50 использовать не требуется, и кожу 2 и/или твердую мозговую оболочку можно ушить, соединить скрепками, или клипировать для формирования области вокруг поврежденной ткани головного мозга 9, в которой может быть сформировано субатмосферное давление.
В другом аспекте данного изобретения представлен способ лечения повреждений ткани головного мозга с помощью субатмосферного давления. В частности, способ может предусматривать размещение пористого материала 10 вблизи поврежденной ткани головного мозга 9 с обеспечением газового сообщения между одной или несколькими порами материала 10 и областью повреждения ткани головного мозга 9. Пористый материал 10 может быть герметизирован в месте вблизи поврежденной ткани головного мозга 9, чтобы обеспечить поддержание в области вблизи поврежденной ткани головного мозга 9 субатмосферного давления. Трубка 20 может быть подключена к пористому материалу 10 на дистальном конце 22 трубки 20, и пористый материал 10 может быть подшит на месте швами 7 к коже 2 и подкожной ткани, чтобы обеспечить поддержание субатмосферного давления в области поврежденной ткани головного мозга 9. Затем над областью шва для обеспечения герметичности уплотнения опционально может быть наложена герметичная повязка. Шаг герметизации покрытия может включать адгезивную герметизацию и адгезивное прикрепление покрытия 50 к ткани, например к коже 2, окружающей поврежденную ткань головного мозга 9. Покрытие 50 может быть представлено в форме адгезивной пленки 50, которая может быть размещена поверх поврежденной ткани головного мозга 9. В таком случае шаг герметизации покрытия 50 может включать адгезивную герметизацию и прикрепление адгезивной пленки 50 к ткани, окружающей поврежденную ткань головного мозга 9, с образованием между пленкой и этой тканью герметичного соединения. Кроме того, шаг функционального подключения вакуумной системы 30 с формированием газового сообщения с пористым материалом 10 может предусматривать подключение вакуумной системы 30 к отверстию для вакуумирования в покрытии 40.
Проксимальный конец 24 трубки 20 может быть подключен к вакуумной системе 30, чтобы обеспечить в поврежденной ткани головного мозга 9 субатмосферное давление путем активации вакуумной системы 30. Например, субатмосферное давление может поддерживаться на уровне примерно на 20-75 мм рт.ст. ниже атмосферного. Субатмосферное давление может быть сохранено в поврежденной ткани головного мозга 9 в течение достаточного времени, чтобы: 1) нормализовать внутричерепное давление до практически нормального, существовавшего в нормальном физиологическом состоянии до повреждения; 2) нормализовать объем и плотность ткани до практически нормальных, существовавших в физиологическом состоянии до повреждения; 3) нормализовать по крайней мере артериальное давление или сердечный ритм до практически нормального, существовавшего в физиологическом состоянии до повреждения; 4) снизить уровень цитокинов, токсичных веществ, других медиаторов до клинически желаемого уровня и/или 5) улучшить познавательную способность, сознание, двигательные или сенсорные функции организма пациента, что может быть указано по шкале Глазго. Кроме того, субатмосферное давление может поддерживаться в поврежденной ткани головного мозга 9 в течение времени, достаточного для достижения тканью головного мозга 9 стадии заживления и уменьшения числа бактерий, благодаря чему может быть повышена вероятность эффективного проведения вторичных методов лечения (например, наложения кожного лоскута).
Метод может применяться в течение по крайней мере трех часов или в течение многих дней. В конце периода наложения субатмосферного давления швы 7 могут быть удалены и разрез кожи 2 открыт повторно. Пористый материал 10 может быть удален, и разрез кожи 2 закрыт повторным ушиванием.
Примеры
Экспериментальные повреждения головного мозга и воздействие субатмосферного давления у крыс
Эксперимент 1
Был проведен эксперимент по разработке модели ушиба головного мозга и применения к контуженной ткани головного мозга субатмосферного давления. Заранее были закуплены двенадцать крупных (300 грамм) крыс линии Sprague Dawley, которым обеспечили возможность акклиматизироваться к условиям содержания. Двум животным до проведения каких-либо процедур проводили МРТ головного мозга (Сканер для мелких животных Bruker BioSpin с горизонтальным внутренним пространством магнита мощностью 7 Тесла, Эттлинген, Германия). Животным проводили седацию изофлураном (2% в ингаляции) и проводили сканирования головного мозга. Далее, животным обеспечивали восстановление после анестезии и возвращали их в клетки. Перед формированием повреждения в день операции животным проводили седацию изофлураном (2-2,5% в ингаляции). Верхнюю часть головы выбривали и удаляли волосы с помощью депиляционного препарата. По средней линии проводили разрез 1 до кости 5, фиг.1. Правую сторону черепа удаляли, открывая правую половину головного мозга; твердая мозговая оболочка оставалась нетронутой. Животных помещали в стереотаксической держатель ударного устройства (пневматическое (корковое) ударное устройство; компания AmScien Instruments, Ричмонд, США). Затем воздействовали на правую половину переднего мозга каждого животного. У первого животного наносили удар стержнем диаметром 3 мм на глубину 2,0 мм. (Табл. 1, крыса №1). Это повреждение было признано недостаточно существенным. У животного 2 была предпринята попытка увеличить тяжесть повреждения. Второму животному наносили удар стержнем диаметром 6 мм на глубину до 2,5 мм в ткань головного мозга. (Табл. 1, крыса №2). Это повреждение было признано слишком тяжелым. У остальных животных наносили удар стержнем диаметром 3 мм в правую половину переднего мозга на глубину 2,0 мм. (Табл. 1, крысы №№3-12). Из двух животных, которым до операции проводили МРТ, оба умерли в течение 5 минут после воздействия. (Табл. 1, крысы №№3 и 8).
Двум нелеченым контрольным животным эффективно провели воздействие, разместили их в отапливаемой клетке и дожидались, пока они восстановятся после анестезии. (Табл. 1, крысы №№4 и 5). Восемь часов спустя животным вновь проводили наркоз и МРТ для визуализации выраженности отека и наличия воды (Т2-взвешенные МРТ изображения). Двум животным после приложения субатмосферного давления успешно нанесли повреждение и наложили над головным мозгом небольшую повязку для создания разрежения с поливиниловым спиртом (VersaFoam, Kinetic Concepts, Inc., San Antonio, Техас, США), размером соответствующую удаленному фрагменту кости (Табл. 1, крысы №№6 и 7). В верхней части повязки под кожей вывели дренажную трубку небольшого диаметра. Конец трубки был обрезан под углом и расположен так, что устье на конце трубки упиралось в повязку. Также сбоку дренажной трубки вырезали боковое отверстие, обеспечивая его контакт с повязкой, содержавшей пену из поливинилового спирта. Трубку выводили через разрез и закрывали разрез ушиванием. Над областью разреза для обеспечения герметичного уплотнения размещали повязку из тонкой пленки (loban, 3M, St. Paul, Миннесота, США). Животных разместили в отапливаемой клетке и дожидались, пока они восстановятся после анестезии. Дренажная трубка небольшого диаметра была связана с вакуумной системой. У этих двух животных в поврежденной области в течение 8 часов накладывали небольшой уровень субатмосферного давления, на 25 мм ртутного столба ниже атмосферного давления. Затем животным повторно проводили наркоз изофлураном (2% в ингаляции), а затем МРТ. У одного животного при его размещении в МРТ-сканер область повреждения сдавливали, вызывая дополнительное, но не оцениваемое количественно, повреждение мозга. (Табл. 1, крыса №6). Сканирование у этого животного показало, что ткань головного мозга сдавливалась вокруг одного края повязки для создания разрежения.
Еще двум контрольным животным успешно нанесли повреждение и наложили над удаленной костью небольшую повязку для создания разрежения с поливиниловым спиртом. (Табл.1, крысы №№9 и 12). Площадь повязки для создания разрежения была больше, чем удаленной кости, и немного (на 1-2 мм) выходила за периферию отверстия, созданного для обнажения мозга. Кожу затем закрыли швами, и животных разместили в отапливаемой клетке, и дожидались, пока они восстановятся после анестезии. Через 24 часа животных повторно наркотизировали и проводили МРТ. Дополнительно двум животным, подвергнутым воздействию субатмосферного давления, успешно нанесли повреждение и наложили более крупную повязку для создания разрежения, немного (на 1-2 мм) выведя ее за периферию отверстия, созданного для обнажения мозга. Через разрез вывели дренажную трубку небольшого диаметра и ушили разрез. Дренажную трубки вывели через разрез параллельно неповрежденной коже в хвостовом направлении. На кожу 2 шеи наложили шов 7 и прикрепили к коже 2 дренажную трубку 20 этим швом 7, чтобы предотвратить смещение дренажной трубки 20 при активизации животного. (Табл. 1, крысы №№10 и 11). Вновь накладывали повязку из небольшого куска тонкой пленки 50 для обеспечения герметичного уплотнения. На 24 часа накладывали небольшой уровень субатмосферного давления, на 25 мм ртутного столба ниже атмосферного давления. Затем животных повторно наркотизировали и проводили МРТ. В это время было обнаружено, что у одного из этих животных дренажная трубка забилась сгустком крови, и было неясно, воздействовало ли субатмосферное давление на поврежденную область на самом деле. (Табл. 1, крыса №11). Фиг.2-8 иллюстрируют МРТ-изображения у крыс, указанных в колонке 5 таблицы 1, а на фиг.10-13 схематически проиллюстрирован частичный поперечный разрез выбранного фрагмента МРТ-изображений, где ссылочные цифры, заканчивающиеся на "2" (т.е. 102, 202, 302, 502), относятся к коже, цифры, заканчивающиеся на "3" (например, 203), относятся к воздушному карману, цифры, заканчивающиеся на "4", относятся к мышцам, цифры, заканчивающиеся на "5", относятся к костям черепа, цифры, заканчивающиеся на "б", относятся к головному мозгу, цифры, заканчивающиеся на "8", относятся к крови или другим биологическим жидкостям, цифры, заканчивающиеся на "9", относятся к области ударного повреждения головного мозга. На фиг.9 схематически показан частичный поперечный разрез с той же точки, как на фиг.10-13, с использованием той же нумерации (например, кожа 402, мышцы 404, кости черепа 405, головной мозг 406), но у животного до проведения любых процедур, применяемых в этих экспериментах.
Результаты исследования на животных показали, что у контрольных животных развивались выраженные отеки с избыточным содержанием воды в пораженной ткани 109, 309 как через 8, так и через 24 часа после ударного повреждения. (Табл. 1, крысы №№4, 5, 9, 12, фиг.2, 10, 3, 5, 12, 8). У животных, подвергнутых воздействию субатмосферного давления, выявлена значительно меньшая выраженность отека и значительно меньшее избыточное накопление воды в поврежденной области 209, 509 как через 8, так и через 24 часа после ударного повреждения (через 8 часов и 24 часа после воздействия субатмосферного давления). (Табл. 1, крысы №№7 и 10, фиг.4, 11, 6, 13. Также крыса №9, фиг.15, по сравнению с крысой 10, фиг.15Б). На основании этих результатов был сделан вывод, что ударное повреждение головного мозга крыс стержнем диаметром 6 мм на глубину до 2,0 мм вызывало набухание значительной степени, более выраженное через 24 часа, чем через 8 часов. Применение субатмосферного давления на 25 мм рт.ст. ниже атмосферного в области повреждения головного мозга значительно уменьшило его отек, особенно резко - через 24 часа после повреждения при применении субатмосферного давления в течение 24 часов.
* МРТ-изображения проведены в Т2-взвешенном режиме, в котором жидкость имеет белый цвет.
|
|
Комментарии:
Крыса 1 - животное, использованное для разработки модели, для ударного повреждения использован стержень малого диаметра (3 мм) - данные не включены в результаты.
Крыса 2 - животное, использованное для разработки модели, значительное повреждение обеспечивали повреждением поршнем диаметром 6 мм на глубину 2,5 мм, у остальных животных глубину снизили до 2 мм - данные не включены в результаты.
Крыса 3 - перед повреждением проводили МРТ для сравнения с результатами сканирования после повреждения, но животное умерло в течение нескольких минут после повреждения.
Крыса 4 - контрольное животное, которому МРТ проводили через 8 часов после повреждения; выявлены отек и выбухание головного мозга в области повреждения.
Крыса 5 - контрольное животное, которому МРТ проводили через 8 часов после повреждения; выявлены отек и выбухание головного мозга в области повреждения.
Крыса 6 - воздействие субатмосферным давлением на животное, у которого до этого отмечалось постоянное кровотечение. Небольшую повязку для создания разрежения с поливиниловым спиртом, закрепленную в отверстии в черепе. Через 8 часов после повреждения/лечения провели МРТ. Лаборант, проводивший МРТ, при размещении животного в МРТ-сканере нажимал/сжимал ткань мозга, причинив головному мозгу дополнительное повреждение, не включенное в результаты, поскольку вызвано ошибкой исполнителя.
Крыса 7 - животное, получавшее лечение субатмосферным давлением с помощью небольшой повязки для создания разрежения с поливиниловым спиртом, закрепленной в отверстии в черепе. МРТ проводили через 8 часов после повреждения/лечения.
Крыса 8 - перед повреждением проводили МРТ для сравнения с результатами сканирования после воздействия, но животное умерло в течение нескольких минут после повреждения.
Крыса 9 - контрольное животное, которому над дефектом костей черепа разместили губку большого диаметра, выходившую за края дефекта. Кожу ушили над губкой. Губку устанавливали, чтобы определить, не станет ли губка под ушитой кожей механическим препятствием для набухания ткани. МРТ провели через 24 часа после повреждения.
Крыса 10 - животное, леченое субатмосферным давлением, с расположением над дефектом черепа губки большого диаметра, выходившей за края дефекта. Кожу ушили над губкой. Субатмосферное давление прикладывали немедленно после повреждения в течение 24 часов, затем проводили МРТ.
Крыса 11 - животное, леченое субатмосферным давлением, с расположением над дефектом черепа губки большого диаметра, выходившей за края дефекта. Кожу ушили над губкой. Субатмосферное давление прикладывали немедленно после повреждения в течение 24 часов, затем проводили МРТ. Трубка оказалась закупорена сгустком крови, и было неясно, воздействовало ли субатмосферное давление на поврежденную область на самом деле. Данные не были включены в результаты.
Крыса 12 - контрольное животное, которому над дефектом костей черепа разместили губку большого диаметра, выходившую за края дефекта. Кожу ушили над губкой. Губку устанавливали, чтобы определить, не станет ли губка под ушитой кожей механическим препятствием для набухания ткани. МРТ провели через 24 часа после повреждения.
Эксперимент 2
Гибель клеток после черепно-мозговой травмы происходит двухфазно, вначале вследствие самого по себе повреждения, а затем, длительно - вследствие выделения возбуждающих аминокислот, накопления лактата и т.д. Выделение возбуждающих аминокислот (глутамата, аспартата) вызывает нарушение ионного гомеостаза путем открытия каналов под действием агонистов, что приводит к увеличению энергетических потребностей и повышению выработки лактата. Показано, что с повышенными уровнями лактата коррелируют повышенные уровни глутамата. Это увеличение уровней лактата отражает увеличение энергетических потребностей в периоды нарушения питания (ишемии) и обратно пропорционально с клиническими исходами. Выработка лактата приводит к апоптозу - гибели нейронов.
В этом предварительном исследовании наркотизированным крысам проводили удаление фрагментов костей черепа диаметром 8 мм между точками брегмой и лямбдой, на 1 мм латеральнее средней линии. Контролируемое ударное повреждение коры при неповрежденной твердой мозговой оболочке проводили с использованием аппарата из Примера 1. Использовали ударный наконечник диаметром 6 мм, глубина воздействия составляла 2 мм. В группе с имитацией вмешательства проводили только удаление фрагментов костей черепа; нелеченому контролю наносили повреждение; в группе наносили повреждение и применяли субатмосферное давление, сниженное на 25 мм ртутного столба, в течение 48 или 72 часов.
Через двадцать четыре часа после повреждения головного мозга крысам проводили наркоз изофлураном и размещали их внутри объемной катушки (38 мм в диаметре) в клетке Litz. Все эксперименты с МРТ и МРС проводили с использованием горизонтального магнита на 7Т (аппарат Bruker BioSpin из Примера 1). Т2-взвешенные изображения получали с помощью импульсной последовательности с быстрым получением сигнала, усиленного при релаксации (Rapid Acquisition with Relaxation Enhancement - RARE) при коэффициенте RARE, равном 8. Время повторения (Repetition Time - TR) было принято равным 1500 мс, время эхо (Echo Time - ТЕ) составило 41 мс, число возбуждений (Number of Excitations - NEX) 1, поле зрения (FOV) было равно 4, а размер матрицы 128×128.
Была использована спектроскопическая последовательность с точечным разрешением (Point Resolved Spectroscopy Sequence - PRESS) с временем повторения (TR) 2500 мс, временем эхо (ТЕ) 20 мс, числом возбуждений (NEX) 256 и кубическими вокселами с длиной стороны 4 мм. Во время получения спектра метаболитов была использована методика подавления сигнала от воды с переменной радиочастотной мощностью и с оптимизированной задержкой релаксации (Variable Power Radio frequency with Optimized Relaxation Delays - VAPOR).
По данным МРТ через 24 часа после повреждения были рассчитаны объем ткани и комплексный показатель плотности поврежденных (ударом) областей столкновения, причем в качестве эталона для измерения использован дорсальный третий желудочек. Результаты представлены в таблице 2, причем объем ткани и комплексный показатель плотности поврежденных областей определены по Т2-взвешенной МРТ. Объем и плотность ткани в нелеченых поврежденных областях головного мозга оказались значительно большими (Р<0,01), чем в соответствующих участках головного мозга при имитации вмешательства и при лечении. Объем тканей и комплексный показатель плотности в участках головного мозга при имитации вмешательства и при лечении существенно не различались. Дополнительным показателем отека служит содержание воды. В таблице 3 показано содержание воды (сырой вес -сухой вес/сырой вес в %) в тканях головного мозга с/без выжидания 48 часов после операции/повреждения. Содержание воды в леченых участках значительно ниже, чем у нелеченых животных, р<0,05.
|
|
Т2-взвешенные МРТ изображения в осевых плоскостях, иллюстрирующие локализацию МР-спектральных векселей, показаны на фиг.16, где спектральные вокселы выделены белой рамкой. На фиг.17 показаны примеры одновоксельных МР спектров, полученных у животных с имитацией вмешательства (слева), нелеченых (в центре) и леченых (справа) животных. Спектры свидетельствуют о низком уровне лактата в группе животных с имитацией вмешательства (стрелка), высоком у нелеченых животных и низком - у леченых животных. Все показатели для метаболитов приведены в таблице 4. Уровень лактата в областях имитации вмешательства были значительно ниже, чем у других нелеченых животных. Уровни лактата между животными с имитацией вмешательства и лечеными существенно не различались. У леченых животных выявлена тенденция к более низким уровням лактата по сравнению с нелечеными. Остальные метаболиты, уровни которых существенно различались (по значениям р), указаны в таблице 5, где значимых отличий для леченых животных от животных с имитацией вмешательства не выявлено.
|
|
Нитротирозин - маркер деградации и гибели клеток. Анализ деградации и гибели нейронов проводили с помощью иммуногистохимического окрашивания на нитрозин образцов ткани мозга, полученных через 72 часа после операции/повреждения. Подопытных животных подвергали воздействию субатмосферного давления в течение всех 72 часов. На фиг.18А показаны гистологические срезы нелеченых отделов головного мозга, а на фиг.18В - срез леченых отделов головного мозга. Черные точки представляют собой клетки, подвергающиеся деградации и гибели. В нелеченом отделе количество деградирующих и погибающих клеток выше, чем в леченом, что свидетельствует об эффективности лечения.
Эти и другие преимущества настоящего изобретения будут понятны из вышеизложенного описания для специалистов в данной области. Соответственно, специалисты в данной области поймут, что в описанные выше варианты осуществления данного изобретения могут быть внесены изменения и модификации, не нарушающие его изобретательской концепции. Поэтому следует понимать, что это изобретение не ограничивается описанными здесь конкретными вариантами, но может включать все изменения и модификации, не противоречащие изложенным в формуле объему и смыслу изобретения.