Результат интеллектуальной деятельности: ПИПЕРИДИНОВЫЕ СОЕДИНЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЕЕ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
ТЕХНИЧЕСКАЯ ОБЛАСТЬ
Настоящее изобретение в общем относится к пиперидиновому соединению и его фармацевтически приемлемым солям, фармацевтической композиции, содержащей эффективное количество рацемических или энантиомерно обогащенных пиперидиновых соединений, для лечения желудочно-кишечных заболеваний и к способу лечения желудочно-кишечных заболеваний у млекопитающего. Более конкретно, настоящее изобретение относится к рацемическим или энантиомерно обогащенным О-карбамоильным и гидроксильным пиперидиновым соединениям и их фармацевтически приемлемым солям, которые пригодны для лечения синдрома раздраженного кишечника (IBS), нарушения двигательной функции желудка и висцеральной боли.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Во многих сообщениях указано, что пиперидиновые соединения эффективно используются для лечения различных желудочно-кишечных заболеваний, особенно синдрома раздраженного кишечника (IBS) и нарушений двигательной функции желудка.
Например, цис-4-амино-5-хлор-N-[1-[3-(4-фторфенокси)-пропил]-3-метокси-4-пиперидинил]-2-метоксибензамид (общее наименование: цизаприд (Cisapride)) широко применялся в клинике в качестве усилителя перистальтики желудочно-кишечного тракта или в качестве желудочно-кишечного прокинетического агента, а другие пиперидиновые соединения были описаны в многочисленных патентных документах (WO 2005/092882, WO 1999/055674, WO 2005/021539, WO 04/026868, WO 04/094418, WO 99/02494) в качестве терапевтических лекарственных средств для лечения желудочно-кишечных заболеваний.
Продолжались активные исследования и попытки создания, направенные на использование пиперидиновых соединений для лечения желудочно-кишечных заболеваний.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В некоторых воплощениях предложены пиперидиновое соединение и/или его фармацевтически приемлемая соль, фармацевтическая композиция, содержащая эффективное количество пиперидинового соединения и/или его фармацевтически приемлемой соли, для лечения желудочно-кишечного заболевания, а также способ лечения заболеваний у млекопитающего, таких как синдром раздраженного кишечника (IBS), нарушение двигательной функции желудка и/или висцеральной боли.
В некоторых воплощениях предложены способ лечения расстройств у млекопитающего путем введения эффективного количества рацемического или энантиомерно обогащенного пиперидинового соединения, представленного приведенной ниже структурной формулой (I), в частности соединений, представленных приведенными ниже структурными формулами (IV) и (V), и фармацевтически приемлемого носителя млекопитающему, нуждающемуся в терапии синдрома раздраженного кишечника (IBS) или нарушения двигательной функции желудка.
В некоторых воплощениях предложено применение пиперидинового соединения и/или его фармацевтически приемлемой соли для предупреждения и/или лечения желудочно-кишечного заболевания, такого как синдром раздраженного кишечника (IBS), нарушение двигательной функции желудка, запор и/или висцеральная боль, у млекопитающего.
В некоторых воплощениях предложено применение пиперидинового соединения и/или его фармацевтически приемлемой соли в изготовлении фармацевтической композиции для предупреждения и/или лечения желудочно-кишечного заболевания, такого как синдром раздраженного кишечника (IBS), нарушение двигательной функции желудка, запор и/или висцеральная боль, у млекопитающего.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Более полное понимание изобретения и многие присущие ему преимущества будут очевидны в результате лучшего его понимания со ссылкой на следующее далее его подробное описание.
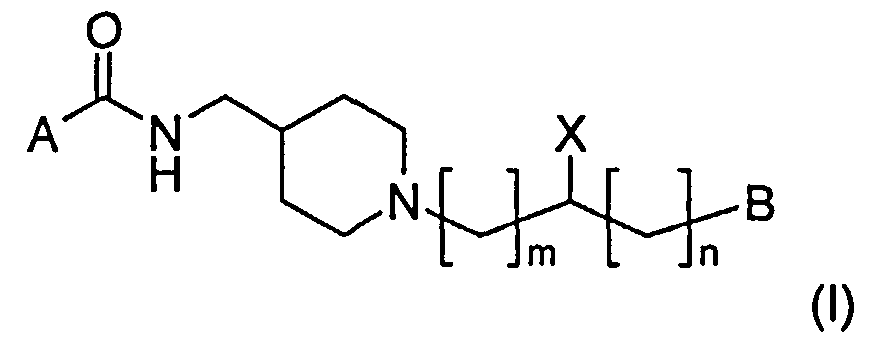
В одном воплощении предложены пиперидиновое соединение, представленное следующей структурной формулой (I), и его фармацевтически приемлемые соли
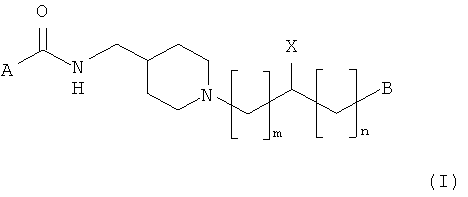
Где m представляет собой целое число 1 или 2;
n представляет собой целое число от 0 до 2, предпочтительно 0;
A выбран из группы, состоящей из фенильной группы и бензимидазольной группы, где фенильная группа может быть замещена одной или более одинаковыми или разными группами, независимо выбранными из группы, состоящей из водорода, С1-С6 линейной или разветвленной алкильной группы, C1-С6 линейной или разветвленной алкоксигруппы, аминогруппы и галогена, а бензимидазольная группа может быть замещена одной или более одинаковыми или разными группами, независимо выбранными из группы, состоящей из водорода, С1-С6 линейной или разветвленной алкильной группы, С1-С6 линейной или разветвленной алкоксигруппы, C3-С7 циклической алкильной группы, аминогруппы, галогена и оксогруппы;
X представляет собой гидрокси или OCONR1R2, где R1 и R2 могут быть одинаковыми или разными и независимо выбраны из группы, состоящий из водорода, С1-С6 линейной или разветвленной алкильной группы, бензильной группы и 5-7-членного циклического или гетероциклического соединения, которое может быть замещено одной или более одинаковыми или разными группами, независимо выбранными из группы, состоящей из С1-С6 алкила, либо Ri и R2 могут образовывать 5-7-членное гетероциклическое кольцо вместе с атомом азота, к которому они присоединены; и
В выбран из группы, состоящей из фенильной группы, феноксигруппы, тиенильной группы и нафтильной группы, где фенильная группа, феноксигруппа, тиенильная группа или нафтильная группа могут быть замещены одной или более одинаковыми или разными группами, независимо выбранными из группы, состоящей из водорода, галогена, нитро, циано, метансульфонила, трифторметила, трифторметокси, дифторметокси, фенила, С1-С6 линейной или разветвленной алкильной группы и С1-С6 линейной или разветвленной алкоксигруппы.
В определении заместителей алкильная группа может быть выбрана из группы, состоящей из метила, этила, линейного или разветвленного пропила, линейного или разветвленного бутила, циклопропила, циклобутила, циклопентила, циклогексила и бензила. Галоген выбран из атомов фтора, хлора, брома и йода.
В одном воплощении заместитель A в структурной формуле (I) может представлять собой фенильную группу, которая может быть замещена одной или более одинаковыми или разными группами, независимо выбранными из группы, состоящей из водорода, галогена, аминогруппы, С1-С6 линейной или разветвленной алкильной группы или С1-С6 линейной и разветвленной алкоксигруппы.
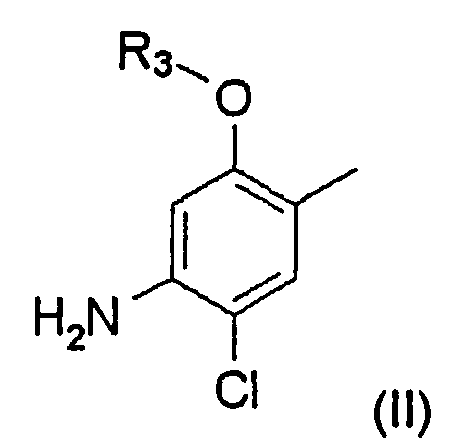
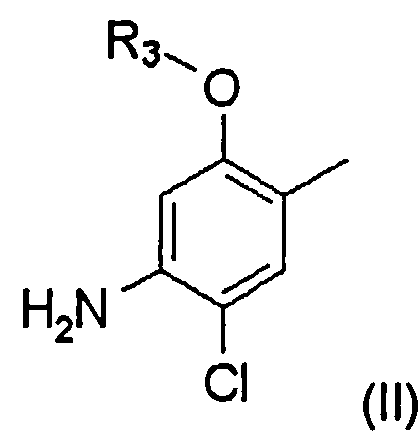
Заместитель A может быть представлен структурной формулой (II):
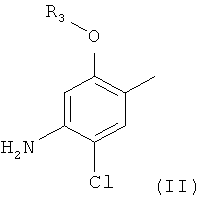
где R3 представляет собой замещенный или незамещенный С1-С6 линейный или разветвленный алкил.
Когда заместитель A в структурной формуле (I) имеет структурную формулу (II), пиперидиновое соединение представлено следующей структурной формулой (IV):
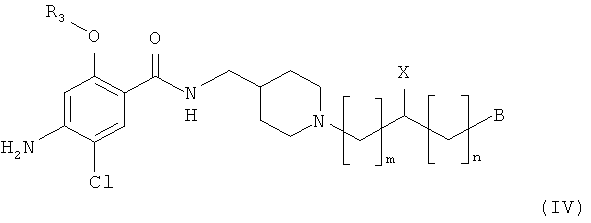
где m, n, X, B и R3 являются такими, как определено выше.
Примеры соединения, имеющего химическую формулу (IV), могут включать 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамид;
4-амино-5-хлор-N-[[1-[2-(4-фторфенил)-2-гидроксиэтил]пиперидин-4-ил]-метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[2-гидрокси-2-(4-метилфенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[2-гидрокси-2-(4-метоксифенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[2-(4-хлорфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[2-(3,4-дихлорфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[2-гидрокси-2-[4-(трифторметил)фенил]этил]-пиперидин-4-ил]метил]-2-метоксибензамид : гидрохлорид;
4-амино-5-хлор-N-[[1-[2-(3,4-дифторфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-фенилэтил]карбамат:гидрохлорид;
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)этил]карбамат:гидрохлорид;
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(3,4-дихлорфенил)этил]карбамат:гидрохлорид;
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(3,4-дифторфенил)зтил]карбамат:гидрохлорид;
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-[4-(трифторметил)фенил]этил]карбамат:гидрохлорид;
4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамид:гидрохлорид;
4-амино-5-хлор-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[3-(3,4-дихлорфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид : гидрохлорид;
4-амино-5-хлор-N-[[1-(3-гидрокси-3-тиофен-2-илпропил)пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[4-(4-фторфенил)-3-гидроксибутил]пиперидин-4-ил]метил]-2-метоксибензамид: гидрохлорид;
4-амино-5-хлор-N-[[1-[5-(4-фторфенил)-3-гидроксипентил]пиперидин-4-ил]метил]-2-метоксибензамид:гидрохлорид;
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-хлорфенил)пропил]карбамат:гидрохлорид;
[4-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)бутан-2-ил]карбамат:гидрохлорид;
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-5-(4-фторфенил)пентан-3-ил]карбамат:гидрохлорид;
4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]-метил]-2-метоксибензамид:гидрохлорид;
4-амино-5-хлор-N-[[1-[3-(4-хлорфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид : гидрохлорид;
4-амино-5-хлор-N-[[1-[2-гидрокси-3-[4-(трифторметил)фенокси]пропил]-пиперидин-4-ил]метил]-2-метоксибензамид:гидрохлорид;
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-феноксипропан-2-ил]карбамат:гидрохлорид;
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(4-фторфенокси)пропан-2-ил]-3,5-диметилпиперидин-1-карбоксилат гидрохлорид;
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(4-метоксифенокси)пропан-2-ил]карбамат:гидрохлорид;
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(2,3-дихлорфенокси)пропан-2-ил]азепан-1-карбоксилат: гидрохлорид;
4-амино-5-хлор-N-[[1-[(2S)-2-гидрокси-2-фенилэтил]пиперидин-4-ил]-метил]-2-метоксибензамид;
4-амино-5-хлор-М-[[1-[(2К)-2-гидрокси-2-фенилэтил]пиперидин-4-ил]-метил]-2-метоксибензамид;
4-амино-5-хлор-N-[[1-[3-(4-хлорфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид;
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)пропил]карбамат;
(R)-[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)пропил]карбамат;
(S)-[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)пропил]карбамат;
4-амино-5-хлор-N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-2-метоксибензамид;
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-феноксипропан-2-ил]пиперидин-1-карбоксилат; и
4-амино-5-хлор-N-[[1-[3-(2,5-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид.
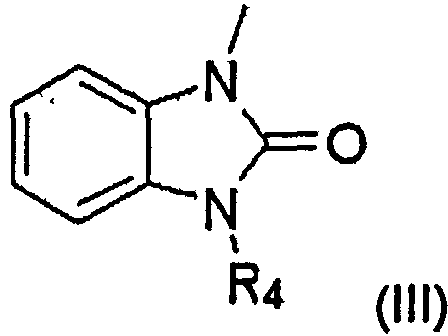
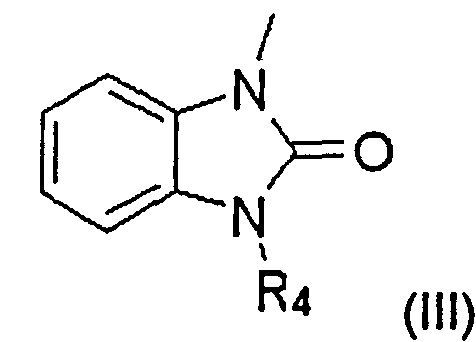
В другом воплощении заместитель A может представлять собой бензимидазольную группу, которая может быть замещена одной или более одинаковыми или разными группами, независимо выбранными из группы, состоящей из водорода, С1-С6 линейной или разветвленной алкильной группы, С1-С6 линейной или разветвленной алкоксигруппы, СЗ-С7 циклической алкильной группы, аминогруппы, галогена и оксогруппы.
Заместитель A в структурной формуле (I) представлен структурной формулой (III):
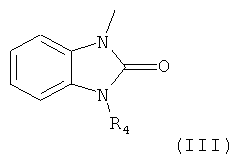
где R4 представляет собой C1-С6 линейную или разветвленную алкильную группу или C3-С7 циклический алкил, который может быть замещенным или незамещенным.
Когда заместитель A в структурной формуле (I) имеет структурную формулу (III), пиперидиновое соединение представлено следующей структурной формулой (V):
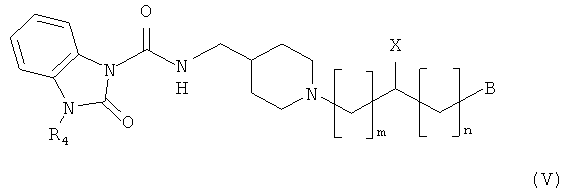
Примеры соединения, имеющего химическую формулу (V), могут включать [1-(2-метилфенокси)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат;
N-[[1-[2-гидрокси-3-(4-нитрофенокси)пропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид: гидрохлорид;
N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид:гидрохлорид;
N-[[1-[3-(4-фторфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-3-метил-2-оксобензимидазол-1-карбоксамид: гидрохлорид;
3-этил-N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид:гидрохлорид;
[1-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1 -карбонил)амино]-метил]пиперидин-1-ил]-3-феноксипропан-2-ил]карбамат: гидрохлорид;
[1-(4-фторфенокси)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат: гидрохлорид;
[1-(4-метоксифенокси)-3-[4-[[(3-метил-2-оксобензимидазол-1-карбонил)-амино]метил]пиперидин-1-ий-1-ил]пропан-2-ил]карбамат: гидрохлорид;
[1-[4-[[(3-этил-2-оксобензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]-3-феноксипропан-2-ил]карбамат: гидрохлорид;
[1-(4-хлорфенокси)-3-[4-[[(3-этил-2-оксобензимидазол-1-карбонил)-амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат: гидрохлорид;
3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид:гидрохлорид;
3-циклопропил-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-1-ий-4-ил]метил]-2-оксобензимидазол-1-карбоксамид:гидрохлорид;
[3-[4-[[(3-циклопропил-2-оксобензимидазол-1-карбонил)амино]метил]-пиперидин-1-ий-1-ил]-1-фенилпропил]карбамат: гидрохлорид;
[1-(4-фторфенил)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ий-1-ил]пропил]карбамат: гидрохлорид;
[1-(4-метоксифенил)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ий-1-ил]пропил]карбамат: гидрохлорид;
М-[[1-[2-(4-фторфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид:гидрохлорид;
[1-(4-фторфенил)-2-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1 -карбонил)амино]метил]пиперидин-1-ий-1-ил]этил]карбамат: гидрохлорид;
[[2-[4-[[(3-циклопропил-2-оксобензимидазол-1-карбонил)амино]метил]-пиперидин-1-ий-1-ил]-1-(3-метоксифенил)этил]карбамат:гидрохлорид;
[1-[4-[[(3-метил-2-оксобензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]-3-феноксипропан-2-ил]карбамат;
N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; и
[3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]-пиперидин-1-ил]-1-фенилпропил]карбамат.
В соответствии с одним воплощением настоящего изобретения соединение, представленное структурной формулой (I), и его фармацевтически приемлемые соли могут быть получены согласно следующим стадиям, начиная с аминоспиртовых соединений, представленных следующей общей структурной формулой (VI):
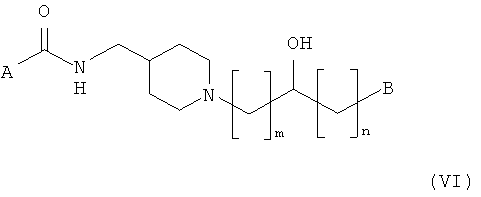
где A, B, m и n такие, как описано выше.
Способ получения О-карбамоильных соединений, представленных следующей общей структурной формулой (VII):
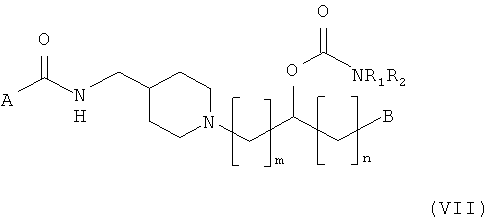
где A, B, R1, R2, m и n такие, как описано выше, подробно описан ниже.
О-карбамоильные соединения, представленные общей структурной формулой (VII), получают взаимодействием аминоспирта, представленного общей структурной формулой (VI), с 1,1'-карбонилдиимидазолом (CDI) и затем с аминным основанием, представленным следующей общей структурной формулой (VIII):
 где R1 и R2 такие, как описано выше.
где R1 и R2 такие, как описано выше.
Эта процедура суммирована, как представлено на Реакционной схеме I ниже.
Реакционная схема I
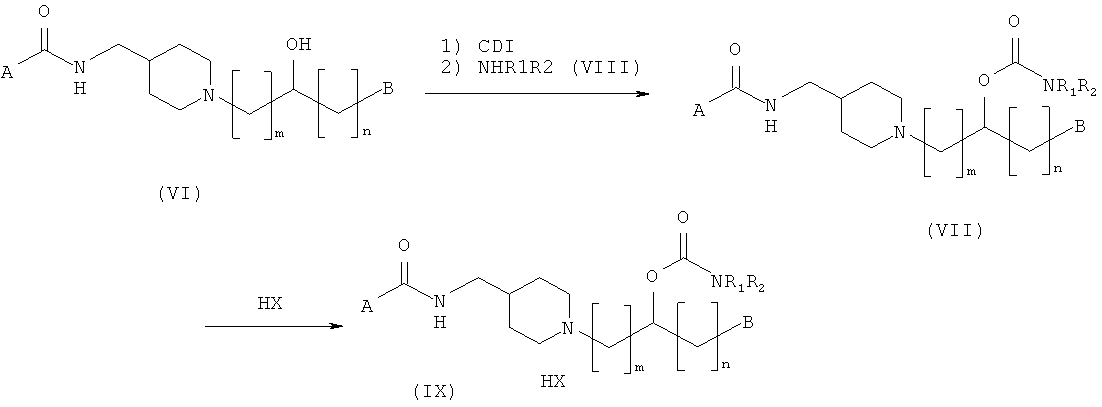
Реакционные условия, описанные на Реакционной схеме I, раскрыты подробно ниже. Для превращения соединения (VI) в соединение (VII) концентрация исходного вещества (VI) составляет приблизительно от 0,005 до 0,1 моль, с количеством 1,1'-карбонилдиимидазола (CDI), варьирующим приблизительно от 2,0 до 3,0 эквивалентов. Эту реакцию предпочтительно осуществляют при температуре от 10 до 30°С. Без очистки полученное промежуточное соединение обрабатывают от 1 до 1000 эквивалентов аминного основания, представленного общей структурной формулой (VIII), при температуре от 10 до 30°С с получением соединения общей структурной формулы (VII). Для такого карбамоилирования могут быть использованы растворители, представляющие собой простые эфиры, такие как диэтиловый эфир и тетрагидрофуран, растворитель, представляющий собой галогенированный углеводород, такой как дихлорметан и хлороформ, или их смесь.
На Реакционной схеме I НХ представляет собой кислоту, которая способна образовывать фармацевтически приемлемую соль с основным атомом азота. Конкретные примеры кислот, используемых для получения соединения (IX) из соединения (VII), включают соляную кислоту, серную кислоту, фосфорную кислоту, уксусную кислоту, бензойную кислоту, лимонную кислоту, малоновую кислоту, салициловую кислоту, яблочную кислоту, фумаровую кислоту, щавелевую кислоту, янтарную кислоту, винную кислоту, молочную кислоту, глюконовую кислоту, аскорбиновую кислоту, малеиновую кислоту, аспарагиновую кислоту, бензолсульфоновую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, гидроксиметансульфоновую кислоту, гидроксиэтансульфоновую кислоту и тому подобное. Дополнительные кислоты могут быть найдены в "Pharmaceutical Salts", J. Pharm. Sci., 1977; 66 (1): 1-19. Это получение осуществляют в реакционной среде, примером которой может служить растворитель, представляющий собой простой эфир, такой как тетрагидрофуран, спиртовой растворитель, такой как метанол, сложно-эфирный растворитель, такой как этилацетат, растворитель, представляющий собой галогенированный углеводород, и их смеси. Растворитель, представляющий собой простой эфир, рекомендуется в качестве добавляемого раствора, включая этиловый эфир, пропиловый эфир, изопропиловый эфир, бутиловый эфир и изобутиловый эфир. Концентрация соединения (VII) составляет порядка приблизительно от 0,01 до 5 моль.
Пиперидиновые соединения структурной формулы (I), имеющие все возможные изомерные формы, такие как рацемические, энантиомерные и диастереоизомерные формы, и фармацевтически приемлемые соли присоединения с неорганическими и/или органическими кислотами или с неорганическими и/или органическими основаниями указанного соединения структурной формулы (I), могут быть использованы для получения лекарственных средств, предназначенных для предупреждения и/или лечения желудочно-кишечных заболеваний, таких как синдром раздраженного кишечника (IBS), нарушение двигательной функции желудка и/или висцеральная боль.
Способ получения амино-спиртовых бензамидных соединений, представленных следующей структурной формулой (X)
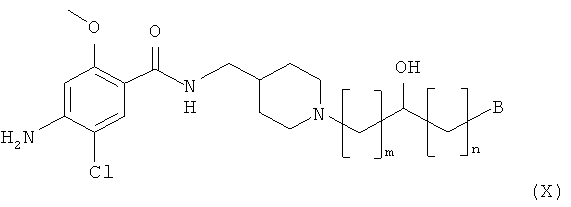
где B, m и n являются такими, как описано выше, подробно описан ниже.
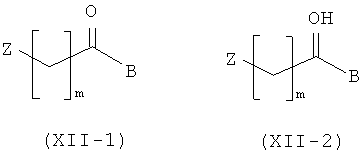
Амино-спиртовые бензамидные соединения, представленные общей структурной формулой (X), получают посредством взаимодействия перидинбензамида, представленного общей структурной формулой (XI), с алкилгалогенидом, представленным следующей общей структурной формулой (XII), эпоксидом, представленным следующей общей структурной формулой (XIII), или амидом Вейнрауба, представленным следующей общей структурной формулой (XIV):
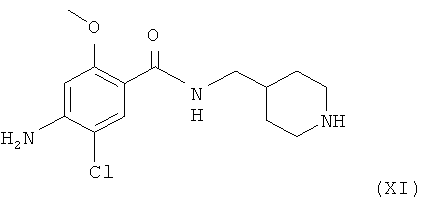
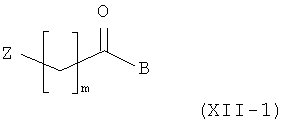
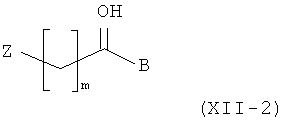
где m представляет собой целое число 1 или 2, Z представляет собой галоген, и B является таким, как определено выше;
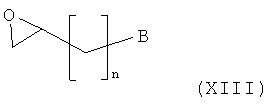 ,
,
где n представляет собой целое число от 0 до 2, предпочтительно 0, и B является таким, как определено выше; и
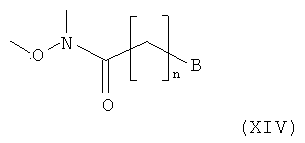 ,
,
где n представляет собой целое число от 0 до 2, предпочтительно 0, и B является таким, как определено выше.
Эта процедура суммирована так, как представлено на Реакционной схеме II ниже.
Реакционная схема II
Стадия II-1
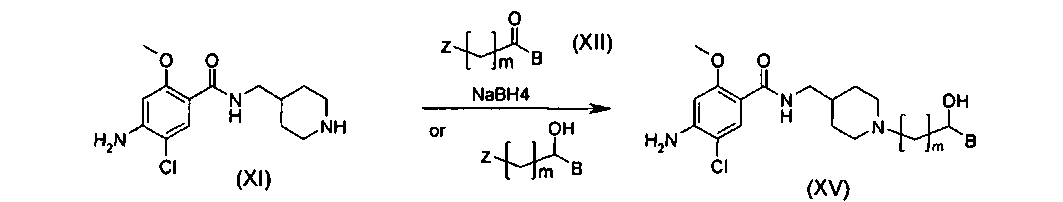
Стадия II-2
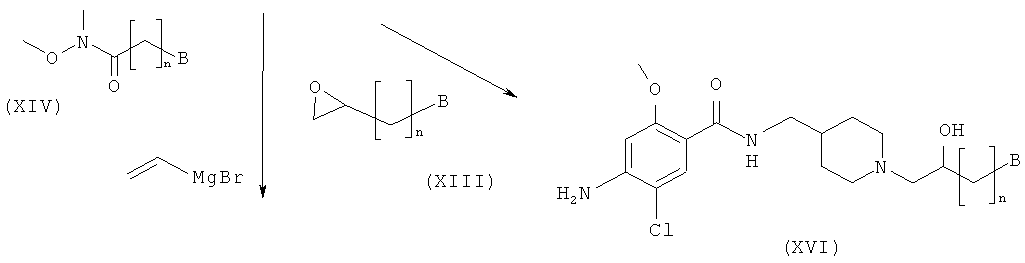
Стадия II-3
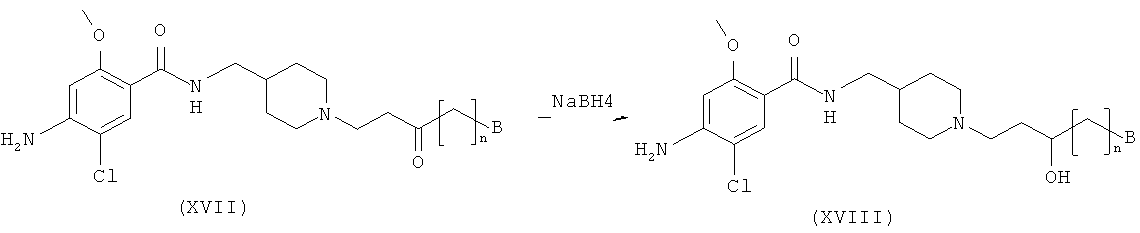
Стадия II-1
На этой стадии целевое пиперидиновое соединение структурной формулы (XV) получают посредством алкилирования соединения структурной формулы (XI) с помощью алкилгалогенида (XII) и восстановления полученного кетона. Подробности реакционных условий, описанных на Стадии II-1, являются следующими. Для превращения соединения (XI) в соединения (XV) концентрация исходного вещества (XI) составляет приблизительно от 0,005 до 0,1 моль, с количеством соединения (XII-1), варьирующим от приблизительно 1,1 до 3,0 эквивалентов, и основания, такого как карбонат калия, карбонат цезия и триэтиламин, варьирующим от приблизительно 1,5 до 5,0 эквивалентов. Эту реакцию предпочтительно проводят при температуре от 20 до 80°C. Без очистки полученный промежуточный кетон обрабатывают от 1,0 до 10,0 эквивалентов NaBH4 при температуре от 0 до 30°C с получением соединения общей структурной формулы (XV).
Для альтернативного превращения соединения (XI) в соединение (XV), где алкилгалогенид представлен структурной формулой (XII-2), концентрация исходного вещества (XI) составляет приблизительно от 0,005 до 0,1 моль, с количеством соединения (XII-2), варьирующим от приблизительно 1,1 до 3,0 эквивалентов, и основания, такого как карбонат калия, карбонат цезия и триэтиламин, варьирующим от приблизительно 1,5 до 5,0 эквивалентов. Эту реакцию предпочтительно проводят при температуре от 20 до 80°C. Для этой реакции могут быть использованы растворитель, представляющий собой простой эфир, такой как диэтиловый эфир и тетрагидрофуран, растворитель, представляющий собой галогенированный углеводород, такой как дихлорметан и хлороформ, спиртовой растворитель, такой как метанол, этанол и изопропанол, или ацетонитрил.
Стадия II-2
На этой стадии пиперидиновое соединение (XVI) получают посредством реакции раскрытия эпоксидного кольца.
Подробности реакционных условий, описанных на Стадии 11-2, являются следующими. Для првращения соединения (XI) в соединение (XVI) концентрация исходного вещества (XI) составляет приблизительно от 0,005 до 0,1 моль, с количеством соединения (XIII), варьирующим приблизительно от 1,1 до 3,0 эквивалентов. Эту реакцию предпочтительно проводят при температуре от 20 до 80°C. Для этой реакции могут быть использованы растворитель, представляющий собой простой эфир, такой как диэтиловый эфир и тетрагидрофуран, растворитель, представляющий собой галогенированный углеводород, такой как дихлорметан и хлороформ, спиртовой растворитель, такой как метанол, этанол и изопропанол, или ацетонитрил.
Стадия II-3
На этой стадии пиперидиновое соединение (XVIII) получают посредством реакции сочетания соединения структурной формулы (XI) с соединением, представляющим собой амид Вейнрауба, структурной формулы (XIV) и восстановления полученного кетонного соединения структурной формулы (XVII). Подробности реакционных условий, описанных на Стадии II-3, являются следующими. Для превращения соединений (XI) в соединения (XVIII) концентрация амида Вейнрауба (XIV) составляет приблизительно от 0,005 до 0,1 моль, с количеством бромида винилмагния, варьирующим приблизительно от 1,1 до 2.0 эквивалентов. Затем полученное промежуточное соединение обрабатывают пиперидиновым соединением, представленным общей формулой (XI), и избытком воды при температуре от 0 до 30°C с получением соединения общей структурной формулы (XVII). Без очистки полученное промежуточное кетонное соединение обрабатывают от 1,0 до 10,0 эквивалентов NaBH4 при температуре от 0 до 30°C с получением соединения общей структурной формулы (XVIII). Для этой реакции могут быть использованы растворитель, представляющий собой простой эфир, такой как диэтиловый эфир и тетрагидрофуран, растворитель, представляющий собой галогенированный углеводород, такой как дихлорметан и хлороформ, спиртовой растворитель, такой как метанол, этанол и изопропанол, или ацетонитрил.
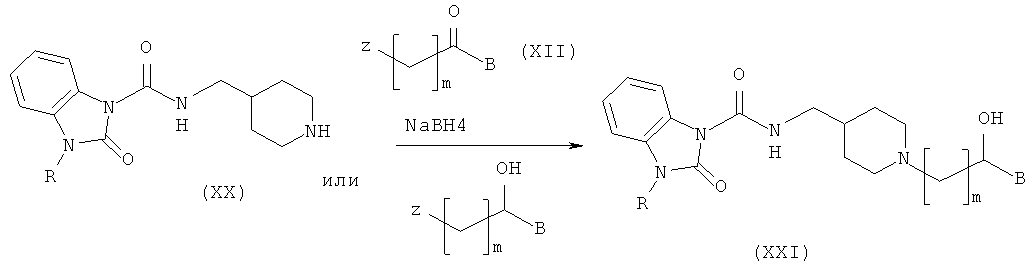
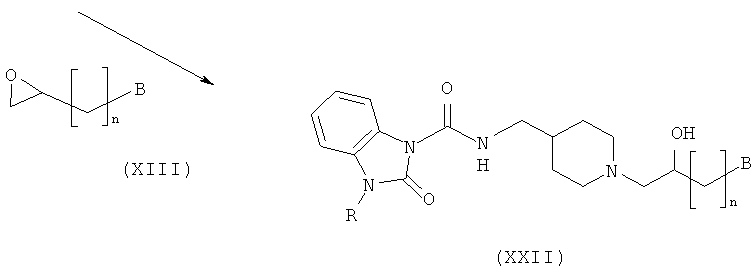
Способ получения амино-спиртовых бензимидазольных соединений, представленных следующей общей структурной формулой (XIX), будет подробно описан ниже.
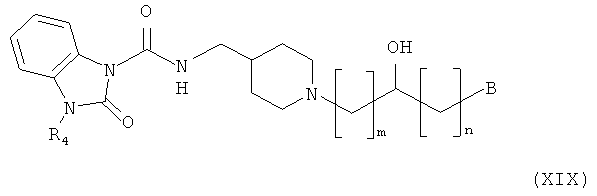
здесь B, R4, m и n являются такими, как определено выше.
Амино-спиртовые бензимидазольные соединения, представленные общей структурной формулой (XIX), получают посредством взаимодействия пиперидинового бензимидазола, представленного общей структурной формулой (XX), с алкилгалогенидом, представленным следующей общей структурной формулой (XII), или эпоксидом, представленным следующей общей структурной формулой (XIII):
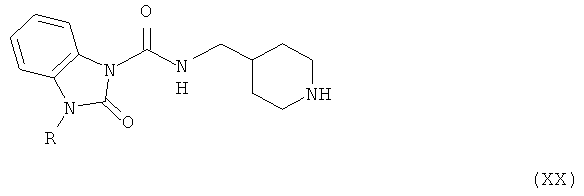
где m представляет собой целое число 1 или 2, Z представляет собой галоген, и B является таким, как определено выше; и
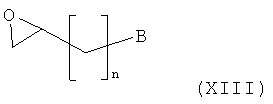
где n представляет собой целое число от 0 до 2, и В является таким, как определено выше.
Эта процедура суммирована так, как представлено на Реакционной схеме III ниже.
Реакционная схема III
Стадия II1-1
Стадия III-2
Стадия III-1
На этой стадии пиперидиновое соединение структурной формулы (XXI) получают посредством алкилирования соединения структурной формулы (XX) с помощью алкилгалогенида и восстановления. Реакция может быть осуществлена при тех же самых условиях, что и описанные на Стадии 11-1.
Стадия III-2
На этой стадии пиперидиновое соединение структурной формулы (XXII) получают посредством реакции раскрытия эпоксидного кольца. Реакция может быть проведена в тех же условиях, что и описанные на Стадии II-2.
Следует отметить, что стереохимия продукта (I, IV или V) зависит исключительно от стереохимии исходного вещества (XII или XIII); исходное вещество (XII или XIII) в виде (S)-энантиомера дает только продукт в виде (S)-энантиомера, а исходное вещество (XII или XIII) в виде (R)-энантиомера дает только продукт в виде (R)-энантиомера.
На основе терапевтических активностей новых пиперидиновых соединений, как показано в следующих примерах, в другом воплощении предложена фармацевтическая композиция, содержащая в качестве активного ингредиента пиперидиновые соединения, представленные структурной формулой (I), в частности соединения, представленные структурными формулами (IV) и (V).
В другом воплощении предложена фармацевтическая композиция, содержащая эффективное количество пиперидиновых соединений, представленных структурной формулой (I), в частности соединений, представленных структурными формулами (IV) и (V), для лечения расстройств желудочно-кишечного тракта, таких как синдром раздраженного кишечника (IBS), нарушение перистальтики желудочно-кишечного тракта (например, нарушение двигательной функции желудка), запор, висцеральная боль и тому подобное.
В другом воплощении предложен способ лечения расстройств желудочно-кишечного тракта, таких как синдром раздраженного кишечника (IBS), нарушение перистальтики желудочно-кишечного тракта (например, нарушение двигательной функции желудка), запор и висцеральная боль, у млекопитающего, включающий введение композиции соединения структурной формулы (I) млекопитающему, нуждающемуся в терапии расстройства желудочно-кишечного тракта.
Соединения структурной формулы (I) полезны в лечении IBS, особенно IBS с преобладанием запоров, запора и других желудочно-кишечных расстройств, ассоциированных с нарушением перистальтики желудочно-кишечного тракта, поскольку они могут усиливать перистальтику желудочно-кишечного тракта.
Кроме того, соединения структурной формулы (I) полезны в ослаблении висцеральной боли, вызываемой IBS и/или другими желудочно-кишечными расстройствами, поскольку они могут уменьшать висцеральную боль и дискомфорт, ассоциированные с IBS и тому подобным.
Соединения структурной формулы (I) могут вводиться перорально или парентерально, сами по себе или в комбинации с традиционными фармацевтическими носителями. Приемлемые твердые носители могут включать одно или более веществ, которые также могут действовать в качестве корригентов, смазывающих агентов, солюбилизаторов, суспендирующих агентов, наполнителей, скользящих веществ, веществ, облегчающих прессование, связующих агентов, агентов, обеспечивающих распадаемость таблеток, или инкапсулирующих материалов. В порошках носитель может представлять собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным активным ингредиентом. В таблетках активный ингредиент в соответствующих пропорциях смешан с носителем, обладающим необходимыми компрессионными свойствами, и представлен в желаемой форме необходимого размера. Порошки и таблетки могут содержать вплоть до 99% активного ингредиента.
Подходящие твердые носители включают, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, метилцеллюлозу, натриевую карбоксиметилцеллюлозу, поливинилпирролидон, низкоплавкие воски и ионообменные смолы. Жидкие носители могут быть использованы в приготовлении растворов, суспензий, эмульсий, сиропов и эликсиров.
Активный ингредиент может быть растворен или суспендирован в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель, их смесь или фармацевтически приемлемые масла или жиры. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферные агенты, консерванты, подсластители, корригенты, суспендирующие агенты, загустители, красители, регуляторы вязкости, стабилизаторы или регуляторы осмоса. Подходящие примеры жидких носителей для перорального и парентерального введения включают воду (в частности, содержащую вышеописанные добавки, например производные целлюлозы, предпочтительно раствор натриевой карбоксиметилцеллюлозы), спирты (включая одноатомные спирты и многоатомные спирты, например гликоли) и их производные и масла (например, фракционированное кокосовое масло и арахисовое масло).
Носитель для парентерального введения также может представлять собой эфир жирной кислоты, такой как этилолеат и изопропилмиристат. В стерильных композициях в жидкой форме для парентерального введения используются стерильные жидкие носители. Жидкие фармацевтические композиции, которые представляют собой стерильные растворы или суспензии, могут быть введены посредством, например, внутримышечной, внутрибрюшинной или подкожной инъекции. Стерильные растворы также могут вводиться внутривенно.
Пероральное введение может быть осуществлено в виде композиции в жидкой или твердой форме. Предпочтительно фармацевтические композиции, содержащие настоящие соединения, представлены в стандартной лекарственной форме, например в виде таблеток или капсул. В такой форме композиция подразделена на единичные дозировки, содержащие соответствующие количества активных ингредиентов. Стандартные лекарственные формы могут представлять собой упакованные композиции, например упакованные порошки, флаконы, ампулы, предварительно заполненные шприцы или саше, содержащие жидкости. Альтернативно стандартная лекарственная форма может представлять собой, например, саму капсулу или таблетку, или она может представлять собой соответствующее количество любых таких композиций в упакованной форме. Применяемая терапевтически эффективная дозировка может варьироваться или корректироваться осуществляющим введение врачом, и в общем варьирует от 0,5 мг до 750 мг, в соответствии с конкретным(и) состоянием(ями), подлежащим(и) лечению, и габаритами, возрастом и типом ответной реакции пациента.
Соединения структурной формулы (I) могут быть введены пациентам в дозировке от 0,7 до 7000 мг в сутки. Для нормального взрослого человека с массой тела приблизительно 70 кг вводимое количество составляет суточную дозу от 0,01 до 100 мг на 1 кг массы тела. Конкретная применяемая доза, однако, может варьировать в зависимости от требований пациента, тяжести состояния пациента и активности соединения. Определение оптимальных дозировок для конкретной ситуации должно осуществляться в клинических условиях и находится в компетенции специалиста в данной области.
В другом воплощении предложено применение пиперидинового соединения и/или его фармацевтически приемлемой соли в предупреждении и/или лечении желудочно-кишечного заболевания, такого как синдром раздраженного кишечника (IBS), нарушение двигательной функции желудка, запор и/или висцеральная боль, у млекопитающего. В еще одном воплощении предложено применение пиперидинового соединения и/или его фармацевтически приемлемой соли в изготовлении фармацевтической композиции для предупреждения и/или лечения желудочно-кишечного заболевания, такого как синдром раздраженного кишечника (IBS), нарушение двигательной функции желудка, запор и/или висцеральная боль, у млекопитающего.
Лучшее понимание сущности настоящего изобретения может быть достигнуто в свете следующих далее примеров, которые представлены в качестве иллюстрации и не предназначены для ограничения настоящего изобретения.
ПРИМЕР 1
4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Смесь 4-амино-5-хлор-2-метокси-N-((пиперидин-4-ил)метил)бензамида (5,0 ммоль), 2-бромацетофенона (6,0 ммоль) и карбоната калия (7,6 ммоль) перемешивали в 15 мл ацетонитрила в течение 2 ч. Этот раствор затем концентрировали в роторном испарителе и разбавляли этилацетатом. Эту смесь затем промывали рассолом и полученный органический слой сушили и очищали колоночной хроматографией. Ее растворяли в этаноле (10 мл) и добавляли борогидрид натрия (10,0 ммоль) при 0°C и перемешивали при 25°C в течение 2 ч. Этот раствор концентрировали на роторном испарителе и разбавляли этилацетатом. Эту смесь промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали колоночной хроматографией. Полученный 4-амино-5-хлор-N-((1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил)метил)-2-метоксибензамид растворяли в метиленхлориде (MC) и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.4-7.2 (m, 5Н), 6.35 (s, 1Н), 4.95 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4-3.3 (m, 3H), 3.0 (m, 1Н), 2.6 (т, 2Н), 2.4 (m, 1Н), 2.2 (m, 1Н), 1.9-1.6 (m, 3H), 1.6-1.4 (m, 2Н).
ПРИМЕР 2
4-амино-5-хлор-N-[[1-[2-(4-фторфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-фторфцетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.15 (m, 2Н), 7.1-6.95 (m, 2Н), 6.35 (s, 1Н), 4.9 (m, 1Н), 4.4 (s, 2Н), 3.9 (m, 3H), 3.4-3.2 (m, 3H), 3.1-2.9 (m, 1Н), 2.6-2.3 (m, 3H), 2.3-2.1 (m, 1Н), 1.9-1.7 (m, 3H), 1.6-1.4 (m, 2Н).
ПРИМЕР 3
4-амино-5-хлор-N-[[1-[2-гидрокси-2-(4-метилфенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-метилацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3-7.1 (m, 4Н), 6.35 (s, 1Н), 4.9 (m, 1Н), 4.4 (s, 2Н), 3.9 (m, 3H), 3.5-3.3 (m, 3H), 3.3-3.1 (m, 1H), 2.7 (m, 2H), 2.6-2.5 (m, 1H), 2.4 (m, 4H), 1.9-1.7 (m, 3H), 1.6-1.5 (m, 2H).
ПРИМЕР 4
4-амино-5-хлор-N-[[1-[2-гидрокси-2-(4-метоксифенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-метоксиацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.2 (m, 2Н), 6.95-6.85 (m, 2Н), 6.35 (s, 1Н), 4.9 (m, 1Н), 4.4 (s, 2Н), 3.9 (m, 3H), 3.8 (s, 3H), 3.4-3.2 (m, 3H), 3.1-3.0 (m, 1Н), 2.6 (m, 2Н), 2.5 (m, 1Н), 2.3-2.1 (m, 1Н), 1.9-1.7 (m, 3H), 1.6-1.4 (m, 2Н).
ПРИМЕР 5
4-амино-5-хлор-N-[[1-[2-(4-цианофенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-цианоацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.65 (m, 2Н), 7.55 (m, 2Н), 6.35 (s, 1Н), 4.9 (m, 1Н), 4.45 (s, 2Н), 3.9 (m, 3H), 3.4 (m, 2Н), 3.2 (m, 1Н), 2.95 (m, 1Н), 2.7-2.33 (m, 3H), 2.2 (m, 1Н), 1.9-1.7 (m, 3Н), 1.6-1.4 (m, 2Н).
ПРИМЕР 6
4-амино-5-хлор-N-[[1-[2-(4-хлорфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-хлорацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (m, 1Н), 7.8 (m, 1Н), 7.3 (m, 4Н), 6.35 (s, 1Н), 4.8 (т, 1Н), 4.4 (s, 2Н), 3.9 (s, ЗН), 3.4-3.2 (m, 3H), 3.05-2.9 (m, 1Н), 2.6-2.3 (m, 3H), 2.2 (m, 1Н), 1.9-1.6 (m, 3H), 1.6-1.4 (m, 2Н).
ПРИМЕР 7
4-амино-5-хлор-N-[[1-[2-гидрокси-2-(4-фенилфенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-фенилацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (m, 1Н), 7.85 (m, 1Н), 7.6-7.3 (m, 9Н), 6.35 (s, 1Н), 5.3 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.8-3.4 (m, 4Н), 3.2-3.0 (m, 2Н), 3.0-2.7 (m, 2Н), 2.4-1.6 (m, 3H), 1.6-1.4 (m, 2Н).
ПРИМЕР 8
4-амино-5-хлор-N-[[1-[2-гидрокси-2-(2-метоксифенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-2'-метоксиацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (m, 1Н), 7.85 (m, 1Н), 7.6 (m, 1Н), 7.3 (m, 1Н), 7.0 (m, 1Н), 6.9 (m, 1Н), 6.35 (s, 1Н), 5.25 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.8 (s, 3H), 3.6 (m, 2Н), 3.1-3.0 (m, 2Н), 2.9-2.7 (m, 4Н), 1.9-1.7 (m, 3H), 1.7-1.4 (m, 2Н).
ПРИМЕР 9
4-амино-5-хлор-N-[[1-[2-гидрокси-2-(3-метоксифенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-3'-метоксиацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (m, 1Н), 7.85 (т, 1Н), 7.3-7.2 (m, 1Н),7.0-6.9 (m, 2Н), 6.85 (m, 1Н), 6.35 (s, 1Н), 4.8 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.8 (s, 3H), 3.4-3.2 (m, 3H), 3.0 (m, 1Н), 2.6 (m, 2Н), 2.4 (m, 1Н), 2.2 (m, 1Н), 1.9-1.6 (m, 3H), 1.6-1.4 (m, 2Н).
ПРИМЕР 10
4-амино-5-хлор-N-[[1-[2-(3,4-дихлорфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-3',4'-дихлорацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.5 (s, 1Н), 7.45 (m, 1Н), 7.2 (m, 1Н), 6.35 (s, 1Н), 4.8 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4 (m, 2Н), 3.3-3.2 (m, 1H), 3.0 (m, 1H), 2.6-2.3 (m, 3H), 2.2 (m, 1H), 1.9-1.6 (m, 3H), 1.6-1.3 (m, 2H).
ПРИМЕР 11
4-амино-5-хлор-N-[[1-[2-(2,4-дифторфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-2',4'-дифторацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.85 (m, 1Н), 7.65 (m, 1Н), 7.0-6.7 (m, 2Н), 6.35 (s, 1Н), 5.3 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.5 (m, 1Н), 3.4 (m, 2Н), 3.2 (m, 2Н), 2.9-2.2 (m, 4Н), 2.7-2.4 (m, 2Н), 2.0-1.8 (m, 3H), 1.8-1.6 (m, 2Н).
ПРИМЕР 12
4-амино-N-[[1-[2-(4-трет-бутилфенил)-2-гидроксизгил]пиперидин-4-ил]метил]-5-хлор-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-трет-бутилацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.45-7.3 (m, 4Н), 6.35 (s, 1Н), 4.8 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4-3.2 (m, 3H), 3.0 (m, 1Н), 2.6 (m, 2Н), 2.4 (m, 1Н), 2.15 (m, 1Н), 1.9-1.6 (m, 3H), 1.55 (m, 2Н), 1.3 (s, 9Н).
ПРИМЕР 13
4-амино-5-хлор-N-[[1-[2-(2-хлорфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-2'-хлорацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.85 (m, 1Н), 7.75 (m, 1Н), 7.3 (m, 3H), 6.35 (s, 1Н), 5.3 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4 (m, 3H), 3.05 (m, 1Н), 2.85 (m, 1Н), 2.5 (m, 2Н), 2.3 (m, 1Н), 1.9-1.7 (m, 3H), 1.6 (m, 2Н).
ПРИМЕР 14
4-амино-5-хлор-N-[[1-[2-(2,4-диметилфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-2',4'-диметилацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.45 (m, 1Н), 7.05 (m, 1Н), 6.95 (m, 1Н), 6.35 (m, 1Н), 5.05 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4-3.3 (m, ЗН), 3.0 (m, 1Н), 2.6-2.4 (m, 3H), 2.35 (m, 6Н), 2.2 (m, 1Н), 1.9-1.6 (m, 3H), 1.55 (m, 2Н).
ПРИМЕР 15
4-амино-5-хлор-N-[[1-[2-(2,5-диметоксифенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-2',5'-диметоксиацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.2 (m, 1Н), 6.8 (s, 2Н), 6.35 (m, 1Н), 5.2 (m, 1Н), 4.45 (s, 2Н), 3.9 (s, 3H), 3.8 (m, 6Н), 3.35 (m, 2Н), 3.0 (m, 1Н), 2.8 (m, 1Н), 2.55 (m, 2Н), 2.2 (m, 1Н), 1.9-1.7 (m, 3H), 1.5 (m, 2Н).
ПРИМЕР 16
4-амино-5-хлор-N-[[1-[2-[4-(дифторметокси)фенил]-2-гидроксиэтил]-пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-(дифторметокси)ацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.4 (m, 2Н), 7.1 (m, 2Н), 6.35 (m, 1Н), 4.85 (m, 1Н), 4.45 (s, 2Н), 3.9 (s, 3H), 3.4-3.2 (m, 3H), 3.0 (m, 1Н), 2.7-2.4 (m, 3H), 2.2 (m, 1Н), 1.9-1.7 (m, 3H), 1.5 (m, 2Н).
ПРИМЕР 17
4-амино-5-хлор-N-[[1-[2-(3,4-дифторфенил)-2-гидроксизгил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-3',4'-дифторацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.3-7.1 (m, 3H), 6.35 (m, 1Н), 4.85 (m, 1Н), 4.45 (s, 2Н), 3.9 (s, 3H), 3.5-3.2 (m, 3H), 3.0 (m, 1Н), 2.7-2.4 (m, 3H), 2.2 (m, 1Н), 1.9-1.7 (m, 3H), 1.5 (m, 2Н).
ПРИМЕР 18
4-амино-5-хлор-N-[[1-[2-гидрокси-2-[4-(трифторметил)фенил]этил]-пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-4'-(трифторметил)ацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.6 (m, 2Н), 7.5 (m, 2Н), 6.35 (m, 1Н), 4.9 (m, 1Н), 4.45 (s, 2Н), 3.9 (s, 3H), 3.4 (m, 2Н), 3.3 (m, 1Н), 3.0 (m, 1Н), 2.7-2.3 (m, 3H), 2.2 (m, 1Н), 1.9-1.7 (m, 3H), 1.5 (m, 2Н).
ПРИМЕР 19
4-амино-5-хлор-N-[[1-[2-(2,4-дихлорфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 1, используя в качестве реагента 2-бром-2',4'-дихлорацетофенон вместо 2-бромацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.65 (m, 2Н), 7.35 (m, 2Н), 6.35 (m, 1Н), 5.25 (m, 1Н), 4.45 (s, 2Н), 3.9 (s, 3H), 3.4 (m, 2Н), 3.0 (m, 1Н), 2.8 (m, 1Н), 2.6-2.2 (m, 3H), 1.9-1.7 (m, 3H), 1.5 (m, 2Н).
ПРИМЕР 20
4-амино-5-хлор-N-[[1-[(28)-2-гидрокси-2-фенилэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Смесь 4-амино-5-хлор-2-метокси-N-((пиперидин-4-ил)метил)-бензамида (5,0 ммоль), (З)-стиреноксида (6,0 ммоль) кипятили с обратным холодильником в 30 мл изопропанола в течение 4 ч. Этот раствор затем концентрировали на роторном испарителе и разбавляли этилацетатом. Эту смесь затем промывали рассолом и полученный органический слой сушили и очищали колоночной хроматографией.
Полученный 4-амино-5-хлор-N-[[1-[(28)-2-гидрокси-2-фенилэтил]пиперидин-4-ил]метил]-2-метоксибензамид растворяли в MC и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (m, 1Н), 8.0-7.9 (br, 1Н), 7.5-7.3 (m, 5Н), 6.35 (s, 1Н), 5.45 (br, 1Н), 4.4 (s, 2Н), 3.9 (s, ЗН), 3.5-2.7 (m, 6Н), 2.2-2.0 (m, 2Н), 1.9-1.4 (m, 5Н).
ПРИМЕР 21
4-амино-5-хлор-N-[[1-[(2R)-2-гидрокси-2-фенилэтил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 20, используя в качестве реагента (R)-стиреноксид вместо (S)-стиреноксида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (m, 1Н), 8.0-7.9 (br, 1Н), 7.5-7.3 (m, 5Н), 6.35 (s, 1Н), 5.2 (br, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.5-2.7 (m, 6Н), 2.2-2.0 (m, 2Н), 1.9-1.4 (m, 5Н).
ПРИМЕР 22
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-фенилэтил]карбамат; гидрохлорид
4-Амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамид (1,5 ммоль) из Примера 1 при 0°C растворяли в 10 мл THF и добавляли 1,1'-карбонилдиимидазол (12 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем добавляли избыток гидроксида аммония (3 мл) при комнатной температуре. После 2 ч перемешивания при комнатной температуре для завершения реакции добавляли воду. Органический слой экстрагировали 3 раза дихлорметаном, сушили и концентрировали в вакууме. Полученный карбамат растворяли в МС и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.2 (m, 5Н), 6.35 (s, 1Н), 5.9 (m, 1Н), 4.7 (m, 2Н), 4.4 (s, 2Н), 3.9 (m, 3H), 3.3 (m, 2Н), 3.1-2.8 (m, 3H), 2.6-2.5 (m, 1Н), 2.2-2.0 (m, 2Н), 1.8-1.3 (m, 5Н).
ПРИМЕР 23
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-(4-фторфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 2 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.2 (m, 2Н), 7.15-7.0 (m, 2Н), 6.35 (s, 1Н), 5.9-5.8 (m, 1Н), 5.1-4.8 (br, 2Н), 4.4 (s, 2Н), 3.9 (m, 3H), 3.4 (m, 2Н), 3.3-3.0 (m, 3H), 2.8-2.6 (m, 2Н), 2.5-2.3 (m, 2Н), 1.9-1.5 (m, 5Н).
ПРИМЕР 24
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-метилфенил)этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-гидрокси-2-(4-метилфенил)-этил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 3 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамида, с
получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3-7.1 (m, 4Н), 6.35 (s, 1Н), 5.9-5.8 (m, 1Н), 4.9 (m, 2Н), 4.4 (s, 2Н), 3.9 (m, 3H), 3.4 (m, 2Н), 3.2-2.9 (m, 3H), 2.6 (m, 1Н), 2.35 (s, 3H), 2.3-2.1 (m, 2Н), 1.9-1.5 (m, 5Н).
ПРИМЕР 25
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-цианофенил)этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-(4-цианофенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 5 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.7 (m, 2Н), 7.5 (m, 2Н), 6.35 (s, 1Н), 5.9-5.8 (m, 1Н), 5.0-4.8 (br, 2Н), 4.4 (s, 2Н), 3.9 (m, 3H), 3.4 (m, 2Н), 3.1-2.9 (m, 3H), 2.7-2.6 (m, 1Н), 2.4-2.2 (m, 2Н), 1.9-1.7 (m, 3H), 1.5 (m, 2Н).
ПРИМЕР 26
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фенилфенил)этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-гидрокси-2-(4-фенилфенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 7 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (DMSO-d6, 200 МГц) δ 10.2 (br, 1Н), 8.05 (s, 1Н), 7.7 (m, 5Н), 7.5-7.3 (m, 4Н), 6.9-6.8 (m, 2Н), 6.5 (s, 1Н), 6.05 (m, 1Н), 3.9 (s, 3H), 3.6 (m, 2Н), 3.4 (m, 3H), 3.2 (m, 1Н), 3.0 (m, 2Н), 1.9-1.4 (m, 5Н).
ПРИМЕР 27
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(3-метоксифенил)этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-гидрокси-2-(3-метоксифенил)этил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 9 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (DMSO-d6, 200 МГц) δ 10.1 (br, 1Н), 8.05 (s, 1Н), 7.65 (m, 1Н), 7.4-7.3 (m, 1Н), 7.0-6.8 (m, 5Н), 6.5 (s, 1Н), 6.0 (m, 1Н), 3.9 (s, 3H), 3.85 (s, 3H), 3.6 (m, 2Н), 3.4 (m, 3H), 3.2 (m, 1Н), 3.0 (m, 2Н), 1.9-1.4 (m, 5Н).
ПРИМЕР 28
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(3,4-дихлорфенил)этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-(3,4-дихлорфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 10 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.85 (m, 1Н), 7.5 (m, 2Н), 7.3 (m, 1Н), 6.35 (s, 1Н), 5.95 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4 (m, 2Н), 3.3-3.0 (m, 3H), 2.7 (m, 1Н), 2.6-2.3 (m, 2Н), 1.9-1.6 (m, 5Н).
ПРИМЕР 29
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(2-хлорфенил)этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-(2-хлорфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 13 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.5-7.2 (m, 4Н), 6.35 (m, 1Н), 6.3 (m, 1Н), 5.1 (m, 2Н), 4.45 (s, 2Н), 3.9 (s, 3H), 3.4-3.2 (m, 3H), 3.0 (m, 1Н), 2.9 (m, 1Н), 2.7 (m, 1Н), 2.3 (m, 2Н), 1.9-1.6 (m, 3H), 1.55 (m, 2Н).
ПРИМЕР 30
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(2,4-диметилфенил)этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-(2,4-диметилфенил)-2-гидроксиэтил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 14 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибенз-амида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.05 (m, 1Н), 7.0 (m, 2Н), 6.35 (s, 1Н), 6.1 (m, 1Н), 4.9 (br, 2Н), 4.45 (s, 2Н), 3.9 (s, ЗН), 3.4 (m, 2Н), 3.2 (m, 1Н), 3.05-2.9 (m, 2Н), 2.6 (m, 2Н), 2.5-2.1 (m, 7Н), 1.9-1.5 (m, 5Н).
ПРИМЕР 31
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(2,5-диметоксифенил)этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-(2,5-диметоксифенил)-2-гидроксиэтил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 15 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибенз-амида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 6.95 (s, 1Н), 6.8 (s, 2Н), 6.35 (s, 1Н), 6.3 (m, 1Н), 4.95 (br, 2Н), 4.45 (s, 2Н), 3.9 (s, 3H), 3.8 (d, 6Н), 3.4-3.2 (m, 3H), 3.0 (m, 1Н), 2.9 (m, 1Н), 2.7 (m, 1Н), 2.4-2.2 (m, 2Н), 1.9-1.7 (m, 3H), 1.5 (m, 2Н).
ПРИМЕР 32
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-[4-(дифторметокси)фенил]этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-[4-(дифторметокси)фенил]-2-гидроксиэтил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 16 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибенз-амида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.4 (m, 2Н), 7.15 (m, 2Н), 6.65 (s, 1Н), 6.35 (s, 1Н), 5.9 (m, 1Н), 5.1-4.8 (br, 2Н), 4.45 (s, 2Н), 3.9 (s, 3H), 3.4-3.2 (m, 2Н), 3.3-3.0 (m, 3H), 2.7 (m, 1Н), 2.5-2.2 (m, 2Н), 1.9-1.5 (m, 5Н).
ПРИМЕР 33
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(3,4-дифторфенил)этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-(3,4-дифторфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 17 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.3-7.0 (m, 3H), 6.35 (s, 1Н), 5.8 (m, 1Н), 5.1-4.8 (br, 2Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 3.2-2.9 (m, 2Н), 2.6 (m, Н), 2.4-2.1 (m, 3H), 1.9-1.4 (m, 5Н).
ПРИМЕР 34
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-[4-(трифторметил)фенил]этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-гидрокси-2-[4-(трифторметил)фенил]этил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 18 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибенз-амида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.65 (m, 2Н), 7.5 (m, 2Н), 6.35 (s, 1Н), 5.9 (m, 1Н), 5.1-4.8 (br, 2Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 3.2-2.9 (m, 3H), 2.6 (m, Н), 2.4-2.1 (m, 2Н), 1.9-1.4 (m, 5Н).
ПРИМЕР 35
[2-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(2,4-дихлорфенил)этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 22, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-(2,4-дихлорфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 19 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-2-фенилэтил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.5-7.2 (m, 3H), 6.35 (s, 1Н), 6.2 (m, 1Н), 5.1-4.8 (br, 2Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 3.2 (m, 1Н), 3.0 (m, 1Н), 2.8 (m, 1Н), 2.65 (m, 1Н), 2.35 (m, 2Н), 1.9-1.4 (m, 5Н).
ПРИМЕР 36
4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Смесь 4-амино-5-хлор-2-метокси-N-((пиперидин-4-ил)метил)бензамида (5,0 ммоль), 3-хлорпропиофенона (6,0 ммоль), карбоната калия (7,6 ммоль) и йодида калия (7,6 ммоль) кипятили с обратным холодильником в 15 мл ацетонитрила в течение 12 ч. Этот раствор затем концентрировали на роторном испарителе и разбавляли этилацетатом. Эту смесь затем промывали рассолом и полученный органический слой сушили и очищали колоночной хроматографией. Ее растворяли в этаноле (10 мл) и при 0°C добавляли борогидрид натрия (10,0 ммоль) и перемешивали при 25°C в течение 2 ч. Этот раствор концентрировали на роторном испарителе и разбавляли этилацетатом. Эту смесь промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали колоночной хроматографией. Полученный 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамид растворяли в MC и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.4-7.2 (m, 5Н), 6.35 (s, 1Н), 4.95 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4-3.1 (m, 4Н), 2.75 (m, 2Н), 2.3-1.7 (m, 7Н), 1.5 (m, 2Н).
ПРИМЕР 37
4-амино-5-хлор-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 36, используя в качестве реагента 3-хлор-4'-фторпропиофенон вместо 3-хлорпропиофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.3 (m, 2Н), 7.1-7.0 (m, 2Н), 6.35 (s, 1Н), 4.9 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4-3.1 (m, 4Н), 2.9-2.7 (m, 2Н), 2.4-2.0 (m, 2Н), 1.9-1.7 (m, 5Н), 1.7-1.5 (m, 2Н).
ПРИМЕР 38
4-амино-5-хлор-N-[[1-[3-(4-хлорфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 36, используя в качестве реагента 3-хлор-4'-хлорпропиофенон вместо 3-хлорпропиофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.4-7.35 (m, 2Н), 7.1-6.9 (m, 2Н), 6.35 (s, 1Н), 4.9 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, ЗН), 3.4 (m, 2Н), 3.3-3.1 (m, 2Н), 2.8-2.6 (m, 2Н), 2.3-1.7 (m, 7Н), 1.5 (m, 2Н).
ПРИМЕР 39
4-амино-5-хлор-N-[[1-[3-гидрокси-3-(4-метилфенил)пропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 36, используя в качестве реагента 3-хлор-4'-метилпропиофенон вместо 3-хлорпропиофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (m, 1Н), 7.85 (m, 1Н), 7.3 (m, 2Н), 7.2 (m, 2Н), 6.35 (s, 1Н), 4.95 (t, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4 (m, 2Н), 3.2 (m, 2Н), 2.8-2.7 (m, 2Н), 2.4 (s, 3H), 2.2 (m, 1Н), 2.05-1.7 (m, 6Н), 1.4-1.2 (m, 2Н).
ПРИМЕР 40
4-амино-5-хлор-N-[[1-[3-гидрокси-3-(4-метоксифенил)пропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 36, используя в качестве реагента 3-хлор-4'-метоксипропиофенон вместо 3-хлорпропиофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3) 200 МГц) δ 8.15 (m, 1Н), 7.85 (т, 1Н), 7.3 (m, 2Н), 6.9 (m, 2Н), 6.35 (s, 1Н), 4.95 (t, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.8 (s, 3H), 3.4 (m, 2Н), 3.3-3.1 (m, 2Н), 2.8-2.6 (m, 2Н), 2.2 (m, 1Н), 2.2-1.7 (m, 6Н), 1.6-1.4 (m, 2Н).
ПРИМЕР 41
4-амино-5-хлор-N-[[1-[3-(2-хлорфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Смесь 2-хлорбензойной кислоты (5 ммоль) и 1,1'-карбонилдиимидазола перемешивали в 30 мл THF (тетрагидрофуран) в течение 30 минут и добавляли гидрохлорид N,O-диметилгидроксиламина (6,5 ммоль) и триэтиламин (5 ммоль). После 12 ч перемешивания для завершения реакции при комнатной температуре добавляли воду. Органический слой экстрагировали 2 раза этилацетатом и органический слой промывали 5%-ным раствором HCl и рассолом, сушили и концентрировали в вакууме. Неочищенный продукт растворяли в THF (30 мл) и при 0°C добавляли 1 M раствор бромида винилмагния (5,5 ммоль) в THF. После 10 минут перемешивания смесь нагревали до комнатной температуры и перемешивали в течение 1 ч, после чего добавляли 4-амино-5-хлор-2-метокси-N-((пиперидин-4-ил)метил)бензамид (7,5 ммоль) и воду (7,5 мл) при комнатной температуре. После 30 минут перемешивания при комнатной температуре добавляли воду и этилацетат и органический слой промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали колоночной хроматографией. Его растворяли в этаноле (10 мл) и при 0°C добавляли борогидрид натрия (10,0 ммоль) и перемешивали при 25°C в течение 2 ч. Этот раствор концентрировали на роторном испарителе и разбавляли этилацетатом. Эту смесь промывали рассолом, сушили и концентрировали в вакууме. Полученный 4-амино-5-хлор-N-[[1-[3-(2-хлорфенил)-3-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид растворяли в MC и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.05 (s, 1Н), 7.8 (m, 1Н), 7.7 (m, 1Н), 7.4-7.1 (m, 3H), 5.3 (s, 1Н), 4.5 (s, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 3.1 (m, 2Н), 2.6 (m, 2Н), 2.2-1.6 (m, 7Н), 1.5-1.3 (m, 2Н).
ПРИМЕР 42
4-амино-5-хлор-N[[1-[3-(3-хлорфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 41, используя в качестве реагента 3-хлорбензойную кислоту вместо 2-хлорбензойной кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl, 200 МГц) δ 8.05 (s, 1Н), 7.8 (m, 1Н), 7.4 (s, 1Н), 7.3-7.1 (m, 3H), 6.3 (s, 1Н), 4.9 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 3.1 (m, 2Н), 2.6 (m, 2Н), 2.1-1.9 (m, 1Н), 1.9-1.5 (m, 6Н), 1.5-1.3 (m, 2Н).
ПРИМЕР 43
4-амино-5-хлор-N-[[1-[3-(2-фторфенил)-3-гидроксипропил]пилеридин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 41, используя в качестве реагента 2-фторбензойную кислоту вместо 2-хлорбензойной кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.05 (s, 1Н), 7.8 (m, 1Н), 7.6 (m, 1Н), 7.2 (m, 2Н), 6.95 (m, 1Н), 6.3 (s, 1Н), 5.2 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.3 (m, 2Н), 3.1 (m, 2Н), 2.6 (m, 2Н), 2.2-1.5 (m, 7Н), 1.5-1.1 (m, 2Н).
ПРИМЕР 44
4-амино-5-хлор-N-[[1-[3-(3-фторфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 41, используя в качестве реагента 3-фторбензойную кислоту вместо 2-хлорбензойной кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.05 (s, 1Н), 7.8 (m, 1Н), 7.3 (m, 1Н), 7.1 (m, 2Н), 6.9 (m, 1Н), 6.3 (s, 1Н), 4.9 (m, 1Н), 4.6 (s, 2Н), 3.9 (s, 3H), 3.3 (m, 2Н), 3.1 (m, 2Н), 2.6 (m, 2Н), 2.2-1.5 (m, 7Н), 1.5-1.2 (m, 2Н).
ПРИМЕР 45
4-амино-5-хлор-N-[[1-[3-(2,3-дихлорфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 41, используя в качестве реагента 2,3-дихлорбензойную кислоту вместо 2-хлорбензойной кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.6 (m, 1Н), 7.3 (m, 4Н), 6.35 (s, 1Н), 5.2 (m, 1Н), 4.5 (m, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 3.1 (m, 2Н), 2.8-2.5 (m, 2Н), 2.2-1.6 (m, 7Н), 1.4 (m, 2Н).
ПРИМЕР 46
4-амино-5-хлор-N-[[1-[3-(2,4-дихлорфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 41, используя в качестве реагента 2,4-дихлорбензойную кислоту вместо 2-хлорбензойной кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.6 (m, 1Н), 7.4-7.2 (m, 2Н), 6.35 (s, 1Н), 5.3 (m, 1Н), 4.5 (s, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 3.1 (m, 2Н), 2.8-2.5 (m, 2Н), 2.2-1.6 (m, 7Н), 1.4 (m, 2Н).
ПРИМЕР 47
4-амино-5-хлор-N-[[1-[3-(3,4-дихлорфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 41, используя в качестве реагента 3,4-дихлорбензойную кислоту вместо 2-хлорбензойной кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.5-7.3 (m, 2Н), 7.2 (m, 1Н), 6.35 (s, 1H), 4.95 (m, 1H), 4.5 (s, 2H), 3.9 (s, 3H), 3.35 (m, 2H), 3.2 (m, 2H), 2.8-2.6 (m, 2H), 2.2-1.6 (m, 7H), 1.5 (m, 2H).
ПРИМЕР 48
4-амино-5-хлор-N-[[1-[3-(4-изопропилфенил)-3-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 41, используя в качестве реагента 4-изопропилбензойную кислоту вместо 2-хлорбензойной кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3-7.15 (m, 4Н), 7.2 (m, 2Н), 6.3 (s, 1Н), 4.9 (m, 1Н), 4.5 (s, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 3.2 (m, 2Н), 2.9 (m, 1Н), 2.6 (m, 2Н), 2.2-1.6 (m, 7Н), 1.4 (m, 2Н), 1.3 (m, 6Н).
ПРИМЕР 49
4-амино-5-хлор-N-[[1-[3-(3-метоксифенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 41, используя в качестве реагента 3-метоксибензойную кислоту вместо 2-хлорбензойной кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3-7.2 (m, 1Н), 6.9 (m, 2Н), 6.8 (m, 1Н), 6.3 (s, 1Н), 5.7 (br, 1Н), 4.9 (m, 1Н), 4.55 (s, 2Н), 3.9 (s, 3H), 3.85 (s, 3H), 3.3 (m, 2Н), 3.1 (m, 2Н), 2.65 (m, 2Н), 2.1 (m, 2Н), 2.0 (m, 1Н), 1.9-1.6 (m, 3H), 1.45 (m, 2Н).
ПРИМЕР 50
4-амино-5-хлор-N-[[1-(3-гидрокси-3-тиофен-2-илпропил)пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 41, используя в качестве реагента 2-тиофенкарбоновую кислоту вместо 2-хлорбензойной кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3-7.2 (m, 1Н), 6.9 (m, 2Н), 6.8 (m, 1Н), 6.3 (s, 1Н), 5.2 (m, 1Н), 4.9 (br, 1Н), 4.55 (s, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 3.2 (m, 2Н), 2.7 (m, 2Н), 2.2 (m, 1Н), 2.1 (m, 3H), 1.9-1.6 (m, 3H), 1.45 (m, 2Н).
ПРИМЕР 51
4-амино-5-хлор-N-[[1-[4-(4-фторфенил)-3-гидроксибутил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 41, используя в качестве реагента 4-фторфенилуксусную кислоту вместо 2-хлорбензойной кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.2 (m, 2Н), 7.0 (m, 2Н), 6.3 (s, 1Н), 4.4 (s, 2Н), 4.0 (m, 1Н), 3.9 (s, 3H), 3.3 (m, 2Н), 3.0 (m, 1Н), 2.9-2.6 (m, 4Н), 2.3-1.3 (m, 11Н).
ПРИМЕР 52
4-амино-5-хлор-N-[[1-[5-(4-фторфенил)-3-гидроксипентил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 41, используя в качестве реагента 3-(4-фторфенил)пропионовую кислоту вместо 2-хлорбензойной кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCI3) 200 МГц) δ 8.1 (s, 1Н), 7.75 (m, 1Н), 7.15 (m, 2Н), 7.0 (m, 2Н), 6.3 (s, 1Н),4.4 (s, 2Н), 3.85 (s, 3H), 3.8 (m, 4Н), 3.3 (m, H), 3.2 (m, 1Н), 3.0-2.6 (m, 6Н), 2.1 (m, 1Н), 2.0-1.6 (m, 4Н), 1.6-1.3 (m, 2Н).
ПРИМЕР 53
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-фенилпропил]карбамат; гидрохлорид
4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамид (1,5 ммоль) из Примера 34 при 0°C растворяли в 10 мл THF и добавляли 1,1'-карбонилдиимидазол (12 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, после чего добавляли избыток гидроксида аммония (3 мл) при 0°C. После 2 ч перемешивания при комнатной температуре для завершения реакции добавляли воду. Органический слой экстрагировали 3 раза дихлорметаном, сушили и концентрировали в вакууме. Полученный карбамат растворяли в дихлорметане и раствор обрабатывали раствором HCI в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.75 (m, 1Н), 7.4-7.3 (m, 5Н), 6.3 (s, 1Н), 5.7 (m, 1Н), 4.6 (m, 2Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 2.9 (m, 2Н), 2.4-2.3 (m, 2Н), 2.0-1.8 (m, 2Н), 1.8-1.5 (m, 3H), 1.4-1.2 (m, 2Н).
ПРИМЕР 54
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 35 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.2 (m, 2Н), 7.1-7.0 (m, 2Н), 6.35 (s, 1Н), 5.7 (m, 1Н), 4.6 (m, 2Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4-3.2 (m, 2Н), 3.0-2.8 (m, 2Н), 2.4-2.1 (m, 4Н), 2.0-1.5 (m, 5Н), 1.5-1.3 (m, 2Н).
ПРИМЕР 55
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-хлорфенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(4-хлорфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 36 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.4-7.2 (т, 2Н), 7.1-7.0 (m, 2Н), 6.35 (s, 1Н), 5.7 (m, 1Н), 4.7 (m, 2Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4 (m, 2Н), 3.1-2.9 (m, 2Н), 2.4 (m, 2Н), 2.3-1.6 (m, 7Н), 1.5-1.3 (m, 2Н).
ПРИМЕР 56
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(2-хлорфенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(2-хлорфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 39 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.5-7.1 (m, 4Н), 6.3 (s, 1Н), 6.05 (m, 1Н), 5.0 (m, 2Н), 4.5 (m, 2Н), 3.9 (s, 3H), 3.3 (m, 2Н), 3.0 (m, 2Н), 2.55 (m, 2Н),2.1 (m, 2Н), 1.8-1.2 (m, 5Н), 0.9 (m, 2Н).
ПРИМЕР 57
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(2-фторфенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(2-фторфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 41 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-6.9 (m, 4Н), 6.3 (s, 1Н), 5.95 (m, 1Н), 5.0 (s, 2H), 4.5 (m, 2H), 3.85 (s, ЗН), 3.3 (m, 2H), 2.95 (m, 2H), 2.45 (m, 2H), 2.1 (m, 2H), 1.8-1.2 (m, 5H), 0.9 (m, 2H).
ПРИМЕР 58
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(3-фторфенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(3-фторфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 42 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3 (m, 1Н), 7.1-6.9 (m, 3H), 6.3 (s, 1Н), 5.65 (m, 1Н), 4.9 (s, 2Н), 4.5 (s, 2Н), 3.85 (s, 3H), 3.3 (m, 2Н), 2.9 (m, 2Н), 2.35 (m, 2Н), 2.2-1.8 (m, 2Н), 1.8-1.2 (m, 5Н), 0.9 (m, 2Н).
ПРИМЕР 59
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(2,3-дихлорфенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(2,3-дихлорфенил)-3-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 43 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.15 (m, 3H), 6.3 (s, 1Н), 6.05 (m, 1Н), 5.05 (m, 2Н), 4.5 (s, 2Н), 3.9 (s, 3H), 3.3 (m, 2Н), 2.95 (m, 2Н), 2.5 (m, 2Н), 2.1-1.8 (m, 4Н), 1.8-1.5 (m, 3H), 1.3 (m, 2Н).
ПРИМЕР 60
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(2,4-дихлорфенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(2,4-дихлорфенил)-3-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 44 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.15 (m, 3H), 6.3 (s, 1Н), 6.05 (m, 1Н), 5.05 (br, 2Н), 4.5 (s, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 3.05 (m, 2Н), 2.6 (m, 2Н), 2.1-1.8 (m, 4Н), 1.8-1.5 (m, 3H), 1.3 (m, 2Н).
ПРИМЕР 61
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(3,4-дихлорфенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(3,4-дихлорфенил)-3-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 45 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.45 (m, 2Н), 7.2 (m, 1Н), 6.3 (s, 1Н), 5.6 (m, 1Н), 4.95 (br, 2Н), 4.45 (s, 2Н), 3.9 (s, 3H), 3.53 (m, 2Н), 2.9 (m, 2Н), 2.3 (m, 4Н), 2.2-1.5 (m, 5Н), 1.3 (m, 2Н).
ПРИМЕР 62
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-изопропилфенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(4-изопропилфенил)-3-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 46 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3-7.1 (m, 4Н), 6.3 (s, 1Н), 5.65 (s, 1Н), 4.95 (s, 2Н), 4.5 (s, 2Н), 3.85 (s, 3H), 3.3 (m, 2Н), 3.1-2.8 (m, 3H), 2.4 (m, 2Н), 2.2-1.8 (m, 4Н), 1.8-1.5 (m, 3H), 1.4-1.2 (m, 8Н).
ПРИМЕР 63
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(3-метоксифенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(3-метоксифенил)-3-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 47 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.25 (m, 1Н), 6.9 (m, 3H), 6.3 (s, 1Н), 5.7 (m, 1Н), 4.9 (s, 2Н), 4.55 (s, 2Н), 3.9 (s, 3H), 3.8 (s, 3H), 3.35 (m, 2Н), 2.95 (m, 2Н), 2.4 (m, 2Н), 2.2-1.9 (m, 4Н), 1.8-1.5 (m, 3H), 1.45-1.2 (m, 2Н).
ПРИМЕР 64
[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-тиофен-2-илпропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-(3-гидрокси-3-тиофен-2-илпропил)пиперидин-4-ил]метил]-2-метоксибензамид из Примера 48 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3 (m, 1Н), 7.1-6.9 (m, 2Н), 6.35 (s, 1Н), 4.75 (s, 2Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 3.1 (m, 2Н), 2.55 (m, 1Н), 2.5-2.0 (m, 5Н), 1.9-1.2 (m, 5Н).
ПРИМЕР 65
[4-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)бутан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Пример 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-[4-(4-фторфенил)-3-гидроксибутил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 51 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.75 (m, 1Н), 7.15 (m, 2Н), 7.0 (m, 2Н), 6.3 (s, 1Н), 4.9 (m, 1Н), 4.8 (s, 2Н), 4.5 (s, 2Н), 3.85 (s, 3H), 3.3 (m, 2Н), 2.9-2.8 (m, 4Н), 2.4 (m, 2Н), 1.9 (m, 2Н), 1.8-1.5 (m, 5Н), 1.3 (m, 2Н).
ПРИМЕР 66
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пилеридин-1-ил]-5-(4-фторфенил)пентан-3-ил]карбамат гидрохлорид
Следовали процедуре, приведенной в Примере 53, используя в качестве реагента 4-амино-5-хлор-N-[[1-[5-(4-фторфенил)-3-гидроксипентил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 52 вместо 4-амино-5-хлор-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.75 (m, 1Н), 7.15 (m, 2Н), 6.95 (m, 2Н), 6.3 (s, 1Н), 4.8 (m, 1Н), 4.75 (s, 2Н), 4.45 (s, 2Н), 3.85 (s, 3H), 3.35 (m, 2Н), 2.95 (m, 2Н), 2.65 (m, 2Н), 2.4 (m, 2Н), 2.0-1.5 (m, 9Н), 1.3 (m, 2Н).
ПРИМЕР 67
(8)-4-амино-5-хлор-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Раствор 3-хлор-4'-фторпропиофенона (5,4 ммоль) медленно добавляли к 1,6 М раствору (-)-хлордиизодиизопинокамфеилборану в гексане (8,1 ммоль) при -25°C. Эту реакционную смесь перемешивали при комнатной температуре в течение 16 ч. После 16 ч перемешивания при -25°C для завершения реакции добавляли MeOH, затем ее промывали рассолом и полученный органический слой сушили и концентрировали в вакууме. Неочищенный продукт растворяли в 20 мл ацетонитрила и при 25°C добавляли 4-амино-5-хлор-2-метокси-N-[(пиперидин-4-ил)метил]бензамид (3,6 ммоль), карбонат калия (5,4 ммоль) и йодид калия (5,4 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 12 ч. Этот раствор затем концентрировали на роторном испарителе и разбавляли этилацетатом, промывали рассолом, полученный органический слой сушили и очищали колоночной хроматографией. Полученный (S)-4-амино-5-хлор-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид растворяли в MC и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.3 (m, 2Н), 7.1-7.0 (m, 2Н), 6.35 (s, 1Н), 4.9 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4-3.1 (m, 4Н), 2.9-2.7 (m, 2Н), 2.4-2.0 (m, 2Н), 1.9-1.7 (m, 5Н), 1.7-1.5 (m, 2Н).
ПРИМЕР 68
(S)-[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)пропил]карбамат; гидрохлорид
(S)-4-амино-5-хлор-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид (1,5 ммоль) из Примера 62 растворяли в 10 мл THF и добавляли 1,1'-карбонилдиимидазол (12 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, затем при 0°C добавляли избыток гидроксида аммония (3 мл). После 2 ч перемешивания при комнатной температуре добавляли воду для завершения реакции. Органический слой экстрагировали 3 раза дихлорметаном, сушили и концентрировали в вакууме. Полученный (S)-[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)пропил]-карбамат растворяли в MC и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.2 (m, 2Н), 7.1-7.0 (m, 2Н), 6.3 (s, 1Н), 5.7 (m, 1Н), 4.6 (m, 2Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4-3.1 (m, 4Н), 2.8-2.6 (m, 2Н), 2.3-2.0 (m, 2Н), 2.0-1.6 (m, 5Н), 1.5-1.3 (m, 2Н).
ПРИМЕР 69
(R)-4-амино-5-хлор-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Пример 67, используя в качестве реагента (+)-хлордиизопинокамфеилборан вместо (-)-хлордиизопинокамфеилборана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.4-7.3 (m, 2Н), 7.1-7.0 (m, 2Н), 6.35 (s, 1Н), 4.9 (m, 1Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4-3.1 (m, 4Н), 2.9-2.7 (m, 2Н), 2.4-2.0 (m, 2Н), 1.9-1.7 (m, 5Н), 1.7-1.5 (m, 2Н).
ПРИМЕР 70
(R)-[3-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-1-(4-фторфенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 68, используя в качестве реагента (R)-4-амино-5-хлор-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]-пиперидин-4-ил]-метил]-2-метоксибензамид вместо (3)-4-амино-5-хлор-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (m, 1Н), 7.8 (m, 1Н), 7.4-7.3 (m, 4Н), 6.35 (s, 1Н), 4.9 (m, 2Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.4 (m, 2Н), 3.3-3.1 (m, 2Н), 2.7 (m, 2Н), 2.2 (m, 1Н), 2.1-1.6 (m, 6Н), 1.5-1.3 (m, 2Н).
ПРИМЕР 71
4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Смесь 4-амино-5-хлор-2-метокси-N-[(пиперидин-4-ил)метил]бензамида (3 ммоль) и 1,2-эпокси-3-феноксипропана (3 ммоль) кипятили с обратным холодильником в 10 мл изопропанола в течение 3 ч. Этот раствор концентрировали на роторном испарителе и смесь очищали колоночной хроматографией. Полученный 4-амино-5-хлор-N-((1-(2-гидрокси-3-феноксипропил)-пиперидин-4-ил)метил)-2-метоксибензамид растворяли в MC и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н ЯМР (DMSO (диметилсульфоскид), 200 МГц), м.д. (δ): (в форме HCl соли) 9.75 (br, 1Н), 8.0 (m, 1Н), 7.66 (s, 1Н), 7.30 (m, 2Н), 6.96 (m, 3H), 6.48 (s, 1Н), 5.96 (s, 2Н), 4.35 (m, 1Н), 3.95 (m, 2Н), 3.83 (m, 3H), 3.54 (m, 2Н), 3.17 (m, 4Н), 3.0 (m, 2Н), 1.9-1.5 (m, 5Н).
ПРИМЕР 72
4-амино-5-хлор-N-[[1-[3-(4-фторфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента 4-фторфенилглицидиловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 500 МГц), м.д. (δ): (в форме соли HCl) 9.3 (m, 1Н), 8.0 (s, 1Н), 7.67 (s, 1Н), 7.13 (m, 2Н), 6.96 (m, 2Н), 6.48 (s, 1Н), 5.93 (s, 2Н), 4.3 (m, 1Н), 3.92 (s, 2Н), 3.83 (s, 3H), 3.55 (m, 2Н), 3.3-3.2 (m, 4Н), 3.0 (m, 2Н), 1.77 (m, 3H), 1.6 (m, 1Н), 1.5 (m, 1H).
ПРИМЕР 73
4-амино-5-хлор-N-[[1-[3-(4-хлорфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента 4-хлорфенилглицидиловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме свободного амина) 7.9 (m, 1Н), 7.65 (s, 1Н), 7.3 (m, 2Н), 6.95 (m, 2Н), 6.46 (s, 1Н), 5.93 (s, 2Н), 4.85 (m, 1Н), 4.0-3.8 (m, 5Н), 3.3-3.1 (m, 4Н), 2.9 (m, 2Н), 2.4 (m, 1Н), 2.0 (m, 2Н), 1.7-1.4 (m, 3H), 1.2 (m, 2Н).
ПРИМЕР 74
4-амино-5-хлор-N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента глицидил-4-метоксифениловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 500 МГц), м.д. (δ): (в форме соли HCl) 9.4 (m, 1Н), 8.00 (m, 1Н), 7.67 (s, 1Н), 6.86 (m, 4Н), 6.48 (m, 1Н), 5.91 (m, 2Н), 4.29 (m, 1Н), 3.9 (m, 2Н), 3.83 (s, 3H), 3.52 (m, 2Н), 3.21 (m, 4Н), 2.90 (m, 2Н), 1.75 (m, 3H), 1.56 (m, 1Н), 1.47 (m, 1Н).
ПРИМЕР 75
4-амино-5-хлор-N-[[1-[3-(2,3-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента 2,3-дихлорфенилглицидиловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7,9-7.85 (m, 1Н), 7.25 (s, 1Н), 7.20-7.05 (m, 2Н), 6.95 (m, 1Н), 6.35 (s, 1Н), 4.4 (m, 2Н), 4.2 (m, 1Н), 4.05 (m, 2Н), 3.9 (s, 3H), 3.3 (m, 2Н), 3.1 (m, 1Н), 3.0 (m, 1Н), 2.7 (m, 2Н), 2.4 (m, 1Н), 2.2 (m, 1Н), 1.97-1.8 (m, 3H), 1.6-1.4 (m, 2Н).
ПРИМЕР 76
4-амино-5-хлор-N-[[1-[3-(2,4-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента 2,4-дихлорфенилглицидиловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7,9-7.85 (m, 1Н), 7.4 (s, 1Н), 7.20 (m, 1Н), 6.9 (m, 1Н), 6.35 (s, 1Н), 4.4 (m, 2Н), 4.2 (m, 1Н), 4.05 (m, 2Н), 3.9 (s, 3H), 3.4 (m, 2Н), 3.1 (m, 1Н), 2.9 (m, 1Н), 2.65 (m, 2Н), 2.4 (m, 1Н), 2.1 (m, 1Н), 1.9-1.65 (т, 3H), 1.6-1.25 (m, 2Н).
ПРИМЕР 77
4-амино-5-хлор-N-[[1-[3-(2,5-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента 2,5-дихлорфенилглицидиловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3 (m, 1Н), 6.95 (m, 2Н), 6.3 (s, 1Н), 4.4 (s, 2Н), 4.2 (m, 1Н), 4.0 (m, 2Н), 3.9 (s, 3H), 3.4 (t, 2Н), 3.1 (m, 1Н), 2.9 (m, 1Н), 2.6 (t, 2Н), 2.4 (m, 1Н), 2.1 (m, 1Н), 1.9-1.8 (m, 3H), 1.5-1.3 (m, 2Н).
ПРИМЕР 78
4-амино-5-хлор-N-[[1-[3-(2,6-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента 2,6-дихлорфенилглицидиловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.8 (m, 1Н), 8.1 (s, 1Н), 7.3 (2Н), 7.0 (t, 1Н), 6.35 (s, 1Н), 4.4 (s, 2Н), 4.2 (s, 1Н), 4.1 (t, 2Н), 3.95 (s, 3H), 3.4 (t, 2Н), 3.15 (m, 1Н), 3.0 (m, 1Н), 2.75 (m, 2Н), 2.4 (m, 1Н), 2.2 (m, 1Н), 1.8 (m, 3H), 1.6-1.3 (m, 2Н).
ПРИМЕР 79
4-амино-5-хлор-N-[[1-[3-(3,4-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента 3,4-дихлорфенилглицидиловый эфир вместо 1,2-эпокси-З-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (m, 1Н), 7.8 (m, 1Н), 7.4-7.3 (m, 1Н), 7.1 (m, 1Н), 6.9 (m, 1Н), 6.3 (m, 1Н), 4.4 (s, 2Н), 4.1 (m, 1Н), 4.0-3.9 (m, 5Н), 3.4 (m, 2Н), 3.1 (m, 1Н), 2.9 (m, 1Н), 2.6 (m, 2Н), 2.4 (m, 1Н), 2.2-2.05 (m, 1Н), 1.9-1.6 (m, 3H), 1.5-1.3 (m, 2Н).
ПРИМЕР 80
4-амино-5-хлор-N-[[1-[3-(2-хлорфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента 2-хлорфенилглицидиловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (m, 1Н), 7.8 (т, 1Н), 7.4-7.2 (m, 2Н), 7.0-6.9 (m, 2Н), 6.9-6.8 (m, 1Н), 6.4 (s, 1Н), 4.5-4.4 (m, 2Н), 4.3-4.1 (m, 3H), 3.9 (m, 3H), 3.4 (m, 2Н), 3.1 (m, 1H0), 2.9 (m, 1Н), 2.6 (m, 2Н), 2.4 (m, 1Н), 2.1 (m, 1Н) 1,9-1.6 (m, 3H), 1.5-1.3 (m, 2Н).
ПРИМЕР 81
4-амино-5-хлор-N-[[1-[3-(4-метилфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента глицидил-4-метилфениловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (m, 1Н), 7.8 (т, 1Н), 7.1 (m, 2Н), 6.8 (m, 2Н), 6.4 (s, 1Н), 4.4 (m, 2Н), 4.1 (m, 1Н), 4.0-3.9 (m, 5Н), 3.4 (m, 2Н), 3.1 (m, 1Н), 2.9 (m, 1Н), 2.6 (m, 2Н), 2.3 (m, 4Н), 2.1 (m, 1Н), 1.9-1.6 (m, 3H), 1.4 (m, 2Н).
ПРИМЕР 82
4-амино-5-хлор-N-[[1-[3-(3,4-дифторфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента 3,4-дифторфенилглицидиловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.2-7.0 (m, 1Н), 6.9-6.6 (m, 2Н), 6.35 (s, 1Н), 4.4 (s, 2Н), 4.1 (m, 1Н), 3.9 (m, 5Н), 3.4 (m, 2Н), 3.1-2.9 (m, 2Н), 2.6 (m, 2Н), 2.4 (m, 1Н), 2.1 (m, 1Н), 1.9-1.6 (m, 3H), 1.5-1.3 (m, 2Н).
ПРИМЕР 83
4-амино-5-хлор-N-[[1-[2-гидрокси-3-[4-(трифторметил)фенокси]пропил]-пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента глицидил-4-трифторметилфениловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.75 (m, 1Н), 7.6-7.5 (m, 2Н), 7.0 (m, 2Н), 6.3 (s, 1Н), 4.4 (s, 2Н), 4.2-4.0 (m, 3H), 3.9 (s, 3H), 3.35 (m, 2Н), 3.1 (m, 1Н), 2.9 (m, 1Н), 2.5 (m, 2Н), 2.35 (m, 1Н), 2.1 (m, 1Н), 1.9-1.6 (m, 3H), 1.5-1.3 (m, 2Н).
ПРИМЕР 84
4-амино-5-хлор-N-[[1-[2-гидрокси-3-(4-фенилфенокси)пропил]пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента глицидил-4-фенилфениловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.75 (m, 1Н), 7.5-6.9 (m, 9Н), 6.3 (s, 1Н), 5.7 (m, 1Н), 4.6 (m, 2Н), 4.4 (s, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 2.9 (m, 2Н), 2.4-2.3 (m, 2H), 2.0-1.8 (m, 2H), 1.8-1.5 (m, ЗН), 1.4-1.2 (m, 2H).
ПРИМЕР 85
4-амино-5-хлор-N-[[1-(2-гидрокси-3-нафталин-2-илоксипропил)пиперидин-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента 2-(нафталин-2-илоксиметил)-оксиран вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8 (m, 1Н), 7.6-7.3 (m, 5Н), 7.0 (m, 2Н), 6.3 (s, 1Н), 4.4 (s, 2Н), 4.3 (m, 1Н), 4.1-4.0 (m, 2Н), 3.9 (s, 3H), 3.3 (m, 1Н), 3.1 (m, 1Н), 2.7 (m, 2Н), 2.5 (m, 1Н), 2.35 (m, 1Н), 1.9-1.6 (m, 3H), 1.6-1.4 (m, 2Н).
ПРИМЕР 86
4-амино-5-хлор-N-[[1-(2-гидрокси-3-фенилпропил)пиперидин-1-ий-4-ил]метил]-2-метоксибензамид; гидрохлорид
Следовали процедуре, приведенной в Примере 71, используя в качестве реагента (2,3-эпоксипропил)бензол вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3 (m, 5Н), 6.35 (s, 1Н), 4.45 (s, 2Н), 4.0 (m, 1Н), 3.95 (s, 3H), 3.35 (m, 2Н), 3.05 (m, 1Н), 2.9 (m, 2Н), 2.7 (m, 1Н), 2.5-2.3 (m, 3H), 2.0 (m, 1Н), 1.8-1.6 (m, 3H), 1.4 (m, 2Н).
ПРИМЕР 87
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-феноксипропан-2-ил]карбамат; гидрохлорид
4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]-метил]-2-метоксибензамид (1 ммоль) при 0°C растворяли в 10 мл THF и добавляли 1,1'-карбонилдиимидазол (1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, после чего добавляли избыток гидроксида аммония (3 мл) при комнатной температуре. После 2 ч перемешивания при комнатной температуре для завершения реакции добавляли воду. Органический слой экстрагировали 3 раза дихлорметаном, сушили и концентрировали в вакууме. Полученный карбамат растворяли в MC и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 8.0 (m, 1Н), 7.66 (s, 1Н), 7.29 (m, 2Н), 6.96 (m, 2Н), 6.90 (m, 1Н), 6.48 (s, 1Н), 5.98 (s, 2Н), 5.35 (m, 1Н), 4.15 (m, 2H), 3.83 (s, 3H), 3.3-2.1 (m, 6H), 3.0 (m, 2H), 1.78 (m, 3H), 1.5 (m, 2H).
ПРИМЕР 88
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-феноксипропан-2-ил]пиперидин-1-карбоксилат; гидрохлорид
Указанное в заголовке соединение получали способом, описанным в Примере 87, за исключением того, что использовали пиперидин (2 ммоль) вместо гидроксида аммония.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.95 (m, 1Н), 8.05 (m, 1Н), 7.66 (s, 1Н), 7.31 (m, 2Н), 6.96 (т, 3H), 6.48 (s, 1Н), 6.0 (br, 2Н), 5.4 (m, 1Н), 4.2 (m, 2Н), 3.83 (s, 3H), 3.7-3.4 (m, 6Н), 3.18 (m, 4Н), 3.0 (m, 2Н), 1.77 (m, 3H), 1.7-1.3 (m, 8Н).
ПРИМЕР 89
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(4-фторфенокси)пропан-2-ил]-3,5-диметилпиперидин-1-карбоксилат; гидрохлорид
4-амино-5-хлор-N-[[1-[3-(4-фторфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамид (1 ммоль) при 0°C растворяли в 10 мл THF и добавляли 1,1'-карбонилдиимидазол (1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, после чего добавляли 3,5-диметилпиперидин (2 ммоль) при комнатной температуре. После 2 ч перемешивания при комнатной температуре для завершения реакции добавляли воду. Органический слой экстрагировали 3 раза дихлорметаном, сушили и концентрировали в вакууме. Полученный карбамат растворяли в MC и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCI) 8.0 (s, 1Н), 7.66 (s, 1Н), 7.09 (m, 2Н), 7.01 (m, 2Н), 6.48 (s, 1Н), 5.96 (s, 2Н), 5.35 (br, 1Н), 4.17 (s, 2Н), 4.0-3.8 (m, 7Н), 3.46 (т, 2Н), 3.18 (m, 4Н), 3.0 (m, 2Н), 2.22 (m, 2Н), 1.9-1.3 (m, 7Н), 0.81 (m, 6Н).
ПРИМЕР 90
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(4-хлорфенокси)пропан-2-ил]-3,5-диметилпиперидин-1-карбоксилат; гидрохлорид
Указанное в заголовке соединение получали способом, описанным в Примере 89, за исключением того, что в качестве исходного вещества использовали 4-амино-5-хлор-N-[[1-[3-(4-хлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид вместо 4-амино-5-хлор-N-[[1-[3-(4-фторфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-метоксибензамида.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 10.1 (br, 1Н), 8.0 (m, 1Н), 7.66 (s, 1Н), 7.34 (m, 2Н), 7.00 (m, 2Н), 6.48 (s, 1Н), 5.96 (s, 2Н), 5.35 (m, 1Н), 4.2 (m, 2Н), 4.0-3.7 (m, 7Н), 3.6-3.4 (m, 2Н), 3.18 (m, 4Н), 3.0 (m, 2Н), 2.2 (m, 2Н), 1.9-1.2 (m, 7Н), 0.9-0.6 (m, 6Н).
ПРИМЕР 91
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(4-метоксифенокси)пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 87, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(4-метоксифенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 74 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-метоксибенз-амида, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.95 (m, 1Н), 8.0 (m, 1Н), 7.66 (s, 1Н), 6.88 (m, 6Н), 6.48 (s, 1Н), 5.35 (m, 1Н), 4.07 (m, 2Н), 3.83 (s, 3H),3.69 (s, 3H), 3.6 (m, 2Н), 3.25 (m, 5Н),3.0 (m, 2Н), 2.0-1.5 (m, 5Н).
ПРИМЕР 92
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(2,3-дихлорфенокси)пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 87, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(2,3-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 75 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-метоксибенз-амида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3 (m, 1Н), 7.1 (m, 1Н), 6.9 (m, 1Н), 6.35 (s, 1Н), 5.3 (m, 1Н), 4.4 (m, 2Н), 4.3 (m, 2Н), 3.95 (m, 3H), 3.8 (m, 2Н), 3.4 (m, 2Н), 3.1 (m, 1Н), 2.9 (m, 1Н), 2.3-2.2 (m, 2Н), 1.9-1.3 (m, 5Н).
ПРИМЕР 93
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(2,3-дихлорфенокси)пропан-2-ил]пирролидин-1-карбоксилат; гидрохлорид
4-амино-5-хлор-N-[[1-[3-(2,3-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид (1 ммоль) при 0°C растворяли в 10 мл THF и добавляли 1,1'-карбонилдиимидазол (1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, после чего добавляли пирролидин (2 ммоль) при комнатной температуре. После 2 ч перемешивания при комнатной температуре для завершения реакции добавляли воду. Органический слой экстрагировали 3 раза дихлорметаном, сушили и концентрировали в вакууме. Полученный карбамат растворяли в МС и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.9 (m, 1Н), 7.2-7.1 (m, 2Н), 7.0-6.9 (m, 1Н), 6.4 (s, 1Н), 5.6 (m, 1Н), 4.5-4.3 (m, 2Н), 3.9 (m, 3H), 3.6 (m, 1Н), 3.55-3.3 (m, 5Н), 2.8 (m, 2Н), 2.55 (m, 3H), 2.1 (m, 1Н), 2.0-1.8 (m, 7Н), 1.4-1.2 (m, 2Н).
ПРИМЕР 94
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(2,3-дихлорфенокси)пропан-2-ил]пиперидин-1-карбоксилат; гидрохлорид
Указанное в заголовке соединение получали способом, описанным в Примере 93, за исключением того, что использовали пиперидин вместо пирролидина.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.3 (s, 1Н), 7.2-7.1 (m, 2Н), 7.0 (m, 1Н), 6.4 (s, 1Н), 5.6 (m, 1Н), 4.5 (m, 1Н), 4.3 (m, 1Н), 3.9 (m, 3H), 33.6 (m, 1Н), 3.5-3.3 (m, 5Н), 2.9-2.7 (m, 2Н), 2.5 (m, 4Н), 2.2-1.9 (m, 4Н), 1.8-1.5 (m, 7Н).
ПРИМЕР 95
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(2,3-дихлорфенокси)пропан-2-ил]азепан-1-карбоксилат; гидрохлорид
Указанное в заголовке соединение получали способом, описанным в Примере 93, за исключением того, что использовали гексаметиленамин вместо пирролидина.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.9 (m, 1Н), 7.3 (m, 1Н), 7.2-7.1 (m, 2Н), 7.0-6.9 (m, 1Н), 6.4 (s, 1Н), 5.6 (m, 1Н), 4.5 (m, 1Н), 4.35 (m, 1Н), 4.2-4.0 (m, 2Н), 3.95 (s, 3H), 3.7-3.3 (m, 6Н), 2.8 (m, 2Н), 2.7-2.4 (m, 4Н), 2.2-1.8 (m, 4Н), 1.8-1.5 (m, 9Н).
ПРИМЕР 96
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(2,4-дихлорфенокси)пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 87, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(2,4-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 76 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-метоксибенз-амида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (m, 1Н), 7.9 (m, 1Н), 7.4 (m, 1Н), 7.1 (m, 1Н), 6.9 (m, 1Н), 6.35 (m, 1Н), 5.2 (m, 1Н), 4.8 (m, 2Н), 4.4 (m, 2Н), 4.2 (m, 2Н), 3.9 (m, 3H), 3.4 (m, 2Н), 3.0 (m, 2Н), 2.75 (m, 2Н), 2.2 (m, 2Н), 1.9-1.5 (m, 3H), 1.5-1.3 (m, 2Н).
ПРИМЕР 97
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(2,5-дихлорфенокси)пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 87, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(2,5-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 77 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-метоксибенз-амида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (m, 1Н), 7.8 (m, 1Н), 7.3 (m, 1Н), 7.0-6.9 (m, 2Н), 6.3 (m, 1Н), 5.2 (m, 1Н), 4.8 (m, 2Н), 4.4 (m, 2Н), 4.3-4.1 (m, 2Н), 3.9 (m, 3H), 3.3 (m, 2Н), 3.0 (m, 2Н), 2.7 (m, 2Н), 2.2 (m, 2Н), 1.9-1.6 (m, 3H), 1.4-1.3 (m, 2Н).
ПРИМЕР 98
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(2,6-дихлорфенокси)пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 87, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(2,6-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 78 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-метоксибенз-амида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (m, 1Н), 7.9 (m, 1Н), 7.4 (m, 1Н), 7.05 (m, 1Н), 6.8 (m, 1Н), 6.4 (m, 1Н), 5.2 (m, 1Н), 4.8 (s, 2Н), 4.4 (s, 2Н), 4.2 (m, 2Н), 3.9 (m, 3H), 3.4 (m, 2Н), 3.0 (m, 2Н), 2.8 (m, 2Н), 2.1 (m, 2Н), 1.8-1.5 (m, 3H), 1.4-1.2 (m, 2Н).
ПРИМЕР 99
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(3,4-дихлорфенокси)пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 87, используя в качестве реагента 4-амино-5-хлор-N-[[1-[3-(3,4-дихлорфенокси)-2-гидроксипропил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 79 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-метоксибенз-амида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.9 (m, 1Н), 7.4-7.3 (m, 1Н), 7.1 (m, 1Н), 6.9 (m, 1Н), 6.35 (s, 1Н), 5.2 (m, 1Н), 4.8 (m 2Н), 4.4 (m, 2Н), 4.2-4.0 (m, 2Н), 3.95 (s, 3H), 3.35 (m, 2Н), 3.1-2.9 (m, 2Н), 2.6 (m, 2Н), 2.2-2.1 (m, 2Н), 1.8-1.5 (m, 3H), 1.4-1.2 (m, 3H).
ПРИМЕР 100
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-[4-(трифторметил)фенокси]пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 87, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-гидрокси-3-[4-(трифторметил)фенокси]-пропил]пиперидин-4-ил]метил]-2-метоксибензамид из Примера 83 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.75 (m, 1Н), 7.7-7.5 (m, 2Н), 7.0 (m, 2Н), 6.3 (s, 1Н), 5.2 (m, 1Н), 4.7 (m, 2Н), 4.4 (s, 2Н), 4.2 (m, 2Н), 3.9 (s, 3H), 3.35 (m, 2Н), 2.9 (m, 2Н), 2.7-2.6 (m, 2Н), 2.2-2.05 (m, 2Н), 1.85 (m, 2Н), 1.7 (m, 1Н), 1.4-1.2 (m, 2Н).
ПРИМЕР 101
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-(4-фенилфенокси)пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 87, используя в качестве реагента 4-амино-5-хлор-N-[[1-[2-гидрокси-3-(4-фенилфенокси)пропил]-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 84 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-метоксибенз-амида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.15 (s, 1Н), 7.8-7.7 (m, 5Н), 7.5-7.1 (m, 5Н), 6.3 (s, 1Н), 5.25 (m, 1Н), 4.7 (m, 2Н), 4.4-4.2 (m, 4Н), 3.9 (s, 3H), 3.35 (m, 2Н), 3.1-2.9 (m, 2Н), 2.7 (m, 2Н), 2.2-2.1 (m, 2Н), 1.8-1.5 (m, 3H), 1.4-1.2 (m, 2Н).
ПРИМЕР 102
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-нафталин-2-илоксипропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 87, используя в качестве реагента 4-амино-5-хлор-N-[[1-(2-гидрокси-3-нафталин-2-илоксипропил)-пиперидин-4-ил]метил]-2-метоксибензамид из Примера 85 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-метоксибенз-амида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) 6 8.15 (s, 1Н), 7.8 (m, 1Н), 7.6-7.3 (m, 5Н), 7.0 (m, 2Н), 6.3 (s, 1Н), 5.25 (m, 1Н), 4.9-4.7 (br, 2Н), 4.4 (s, 2Н), 4.2 (m, 2Н), 3.9 (s, 3H), 3.4-3.3 (m, 2Н), 3.2-3.1 (m, 2Н), 2.9-2.8 (m, 2Н), 2.4-2.15 (m, 2Н), 1.9-1.6 (m, 3Н), 1.6-1.4 (m, 2Н).
ПРИМЕР 103
[1-[4-[[(4-амино-5-хлор-2-метоксибензоил)амино]метил]пиперидин-1-ил]-3-фенилпропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 87, используя в качестве реагента 4-амино-5-хлор-N-[[1-(2-гидрокси-З-фенил пропил)пиперидин-1-ий-4-ил]метил]-2-метокси-бензамид из Примера 86 вместо 4-амино-5-хлор-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-метоксибензамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.1 (s, 1Н), 7.8 (m, 1Н), 7.3-7.1 (m, 5Н), 6.3 (s, 1Н), 5.1 (m, 1Н), 4.95 (s, 2Н), 4.6 (s, 2Н), 4.0 (m, 1Н), 3.85 (s, 3H), 3.35 (m, 2Н), 3.0-2.6 (m, 4Н), 2.5-2.2 (m, 2Н), 2.1-1.9 (m, 2Н), 1.8-1.5 (m, 3H), 1.3 (m, 2Н).
ПРИМЕР 104
N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Смесь (пиперидин-4-илметил)-амида 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты (3 ммоль) и 1,2-эпокси-З-феноксипропана (3 ммоль) кипятили с обратным холодильником в 10 мл изопропанола в течение 3 ч. Этот раствор концентрировали на роторном испарителе и смесь очищали колоночной хроматографией. Полученный N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид растворяли в MC и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме свободного амина) 8.83 (m, 1Н), 8.05 (m, 1Н), 7.44 (m, 1Н), 7.4-7.1 (m, 4Н),6.93 (m, 3H), 4.84 (m, 1Н), 4.67 (m, 1Н), 3.88 (m, 2Н), 3.22 (m, 2Н),2.92 (m, 2Н), 2.4 (m, 2Н), 1.99 (m, 2Н), 1.64 (m, 3H), 1.48 (m, 6Н), 1.22 (m, 2Н).
ПРИМЕР 105
N-[[1-[2-гидрокси-3-(4-нитрофенокси)пропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагента глицидил-4-нитрофениловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) 9.0 (m, 1Н), 8.35-8.2 (m, 3H), 7.2 (m, 3H), 7.0 (m, 2Н), 4.75 (m, 1Н), 4.2-4.05 (m, ЗН), 3.4 (t, 2Н), 3.1 (m, 1Н), 2.9 (m, 1Н), 2.55 (m, 2Н), 2.4 (m, 1Н), 2.05 (m, 1Н), 1.85 (m, 2Н), 1.7 (m, 1Н), 1.6 (d, 6Н), 1.4 (m, 2Н).
ПРИМЕР 106
N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагента глицидил-4-метоксифениловый эфир вместо 1,2-эпокси-З-феноксипропана, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме свободного амина) 8.83 (m, 1Н), 8.07 (m, 1Н), 7.44 (m, 1Н), 7.15 (m, 2Н),6.85 (m, 4Н), 4.78 (m, 1Н), 4.66 (m, 1Н), 3.91-3.77 (m, 2Н), 3.68 (s, 3H), 3.22 (m, 2Н), 2.87 (m, 2Н),2.36 (m, 2Н), 1.96 (m, 2Н), 1.60 (m, 2Н), 1.48 (m, 7Н), 1.23 (m, 2Н).
ПРИМЕР 107
N-[[1-[3-(4-фторфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагента 4-фторфенилглицидиловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.65 (m, 1Н), 8.88 (m, 1Н), 8.07 (m, 1Н), 7.45 (m, 1Н), 7.16 (m, 4Н), 6.96 (m, 2Н), 5.96 (m, 1Н), 4.67 (m, 1Н), 4.34 (m, 1Н), 3.94 (m, 2Н), 3.56 (m, 2Н), 3.26 (m, 4Н), 2.99 (m, 2Н), 1.86 (m, 3H), 1.7-1.4 (m, 8Н).
ПРИМЕР 108
N-[[1-[2-гидрокси-3-(2-метилфенокси)пропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Пример 104, используя в качестве реагента глицидил-2-метилфениловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.3 (m, 1Н), 8.87 (m, 1Н), 8.07 (m, 1Н), 7.45 (m, 1Н), 7.18 (m, 5Н), 6.90 (m, 2Н), 5.94 (m, 1Н), 4.7 (m, 1Н), 4.35 (m, 1Н), 3.95 (m, 2Н), 3.59 (m, 2Н), 3.4-2.8 (m, 6Н), 2.18 (s, 3H), 1.87 (m, 3H), 1.7-1.4 (m, 8Н).
ПРИМЕР 109
N-[[1-[3-(4-хлорфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагента 4-хлорфенилглицидиловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.5 (m, 1Н), 8.87 (m, 1Н), 8.07 (m, 1Н), 7.5-6.9 (m, 6Н), 5.97 (m, 1Н), 4.67 (m, 1Н), 4.35 (m, 1Н), 3.96 (m, 2Н), 3.55 (m, 2Н), 3.27 (m, 4Н), 2.99 (m, 2Н), 1.87 (m, 3H), 1.7-1.4 (m, 8Н).
ПРИМЕР 110
N-[[1-[3-(4-трет-бутилфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагента 4-трет-бутилфенилглицидиловый эфир вместо 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.32 (m, 1Н), 8.87 (m, 1Н), 8.07 (m, 1Н), 7.45 (m, 1Н), 7.29 (m, 1Н), 7.19 (m, 2Н), 6.87 (m, 2Н), 5.95 (m, 1Н), 4.65 (m, 1Н), 4.29 (m, 1Н), 3.93 (m, 2Н), 3.54 (m, 2Н), 3.5-3.1 (m, 4Н), 2.99 (m, 2Н), 1.87 (m, 3H), 1.7-1.47 (m, 8Н), 1.25 (s, 9Н).
ПРИМЕР 111
N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-3-метил-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагента (пиперидин-4-илметил)-амид 3-метил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты вместо (пиперидин-4-илметил)-амида 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.3 (m, 1Н), 8.83 (m, 1Н), 8.03 (m, 1Н), 7.29-7.16 (m,5Н), 6.97 (m, 3H), 5.98 (m, 1Н), 4.30 (m, 1Н), 3.96 (m, 2Н), 3.61 (m, 2Н), 3.5-3.1 (m, 5Н), 2.93 (m, 2Н), 2.6 (m, 2Н), 1.87 (m, 3H), 1.6 (m, 2Н).
ПРИМЕР 112
N-[[1-[3-(4-хлорфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-3-метил-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагентов (пиперидин-4-илметил)-амид 3-метил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 4-хлорфенилглицидиловый эфир вместо (пиперидин-4-илметил)-амида 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.6 (m, 1Н), 8.82 (m, 1Н), 8.02 (m, 1Н), 7.4-6.9 (m, 7Н), 5.98 (m, 1Н), 4.35 (m, 1Н), 3.95 (m, 2Н), 3.54 (m, 2Н), 3.4-2.9 (m, 9Н), 1.87 (m, 3H), 1.63 (m, 2Н).
ПРИМЕР 113
N-[[1-[3-(4-трет-бутилфенокси)-2-гидроксипропил]пиперидин-4-ил]-метил]-3-метил-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагентов (пиперидин-4-илметил)-амид 3-метил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 4-трет-бутилфенилглицидиловый эфир вместо (пиперидин-4-илметил)-амида 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 1,2-эпокси-З-феноксипропана, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.64 (m, 1Н), 8.82 (m, 1Н), 8.02 (m, 1Н), 7.4-7.12 (m, 5Н), 6.87 (m, 2Н), 5.95 (m, 1Н), 4.34 (m, 1Н), 3.93 (m, 2Н), 3.58 (m, 2Н), 3.5-3.1 (m, 7Н), 3.0 (m, 2Н), 1.87 (m, 3H), 1.53 (m, 2Н), 1.25 (s, 9Н).
ПРИМЕР 114
N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-3-метил-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагентов (пиперидин-4-илметил)-амид 3-метил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и глицидил-4-метоксифениловый эфир вместо (пиперидин-4-илметил)-амида 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.45 (m, 1Н), 8.82 (m, 1Н), 8.02 (m, 1Н), 7.35-7.1 (m, 3H), 6.88 (m, 4Н), 5.95 (m, 1Н), 4.29 (m, 1Н), 3.89 (m, 2Н),3.69 (s, 3H), 3.6-3.1 (m, 7Н), 2.99 (m, 4Н), 1.87 (m, 3H), 1.6 (m, 2Н).
ПРИМЕР 115
N-[[1-[3-(4-фторфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-3-метил-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагентов (пиперидин-4-илметил)-амид 3-метил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 4-фторфенилглицидиловый эфир вместо (пиперидин-4-илметил)-амида 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 1,2-эпокси-З-феноксипропана, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.5 (m, 1Н), 8.82 (m, 1Н), 8.02 (m, 1Н), 7.35-7.05 (m, 5Н), 6.98 (m, 2Н), 5.94 (m, 1Н), 4.32 (m, 1Н), 3.94 (m, 2Н), 3.55 (m, 2Н), 3.5-3.1 (m, 7Н), 2.98 (m, 2Н), 1.87 (m, 3H), 1.6 (m, 2Н).
ПРИМЕР 116
3-этил-N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагента (пиперидин-4-илметил)-амид 3-этил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты вместо (пиперидин-4-илметил)-амида 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.95 (m, 1Н), 8.25 (m, 1Н), 7.4-7.15 (m, 3H), 7.1-6.9 (m, 5Н), 4.1 (m, 2Н), 4.0 (m, 2Н), 3.55 (m, 1Н), 3.4 (t, 2Н), 3.1 (m, 1Н), 3.0 (m, 1Н), 2.6 (m, 2Н), 2.4 (m, 1Н), 2.1 (m, 1Н), 1.9-1.6 (m, 3H), 1.5-1.3 (m, 5Н).
ПРИМЕР 117
3-этил-N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагентов (пиперидин-4-илметил)-амид 3-этил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и глицидил-4-метоксифениловый эфир вместо (пиперидин-4-илметил)-амида 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 1,2-эпокси-3-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.95 (m, 1Н), 8.2 (m , 1Н), 7.3-7.0 (m, 3H), 6.8 (m, 4Н), 4.25 (m, 1Н), 4.0 (m, 4Н), 3.8 (s, 3H), 3.5-3.3 (m, 4Н), 2.9 (m, 2Н), 2.6 (m, 1Н), 2.4 (m, 1Н), 1.9 (m, 2Н), 1.8-1.6 (m, 3H), 1.4 (t, 3H).
ПРИМЕР 118
3-этил-N-[[1-[2-гидрокси-3-(2-метилфенокси)пропил]пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагентов (пиперидин-4-илметил)-амид 3-этил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и глицидил-2-метилфениловый эфир вместо (пиперидин-4-илметил)-амида 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 1,2-эпокси-З-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.95 (m, 1Н), 8.25 (m, 1Н), 7.3-7.0 (m, 6Н), 6.85 (m, 2Н), 4.3-3,9 (m, 5Н), 3.4 (m, 2Н), 3.2 (m, 1Н), 3.05 (m, 1Н), 2.65 (m, 2Н), 2.4 (m, 1Н), 2.3 (s, 3H), 2.15 (m, 1Н), 1.85 (m, 2Н), 1.75 (m, 1Н), 1.6-1.3 (m, 5Н).
ПРИМЕР 119
N-[[1-[3-(4-хлорфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-3-этил-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 104, используя в качестве реагентов (пиперидин-4-илметил)-амид 3-этил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 4-хлорфенилглицидиловый эфир вместо (пиперидин-4-илметил)-амида 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 1,2-эпокси-З-феноксипропана, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.95 (m, 1Н), 8.25 (m, 1Н), 7.2-7.0 (m, 4Н), 7.05 (m, 1Н), 6.9 (m, 2Н), 4.2 (m, 1Н), 4.0 (m, 4Н), 3.4 (m, 2Н), 3.2 (m, 1Н), 3.05 (m, 1Н), 2.65 (m, 2Н), 2.4 (m, 1Н), 2.0-1.7 (m, 3H), 1.6-1.3 (m, 5Н).
ПРИМЕР 120
[1-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]-пиперидин-1-ил]-3-феноксипропан-2-ил]карбамат: гидрохлорид
N-[[1-(2-Гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид (1 ммоль) при 0°C растворяли в 10 мл THF и добавляли 1,1'-карбонилдиимидазол (1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, после чего добавляли избыток гидроксида аммония (3 мл) при комнатной температуре. После 2 ч перемешивания при комнатной температуре для завершения реакции добавляли воду. Органический слой экстрагировали 3 раза дихлорметаном, сушили и концентрировали в вакууме. Полученный карбамат растворяли в MC и раствор обрабатывали раствором HCI в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 10.2 (m, 1Н), 8.88 (m, 1Н), 8.07 (m, 1Н), 7.6-6.8 (m, 10Н), 5.34 (m, 1Н), 4.66 (m, 1Н), 4.15 (m, 2Н), 3.55 (m, 2Н), 3.26 (m, 4Н),3.04 (m, 2Н), 1.85 (m, 3H), 1.59 (m, 2Н), 1.48 (m, 6Н).
ПРИМЕР 121
[1-(4-метоксифенокси)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид из Примера 106 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.7 (m, 1Н), 8.80 (m, 1Н), 8.07 (m, 1Н), 7.45 (m, 1Н),7.18 (m, 2Н), 6.88 (m, 4Н), 5.28 (m, 1Н), 4.65 (m, 1Н), 4.07 (s, 2Н), 3.69 (s, 3H), 3.58 (m, 2Н), 3.5-3.2 (m, 2Н), 3.03 (m, 4Н), 1.86 (m, 3H), 1.49 (m, 8Н).
ПРИМЕР 122
[1-(4-фторфенокси)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента N-[[1-[3-(4-фторфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид из Примера 107 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.5 (m, 1Н), 8.88 (m, 1Н), 8.07 (m, 1Н), 7.45 (m, 1Н), 7.16 (m, 4Н), 7.0-6.8 (m, 4Н), 5.31 (m, 1Н), 4.66 (m, 1Н), 4.11 (m, 2Н), 3.60 (m, 2Н), 3.5-3.2 (m, 4Н), 3.00 (m, 2Н), 1.87 (m, 3H), 1.7-1.4 (m, 8Н).
ПРИМЕР 123
[1-(2-метилфенокси)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента N-[[1-[2-гидрокси-3-(2-метилфенокси)пропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид из Примера 108 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.8 (m, 1Н), 8.88 (m, 1Н), 8.04 (m, 1Н), 7.45 (m, 1Н), 7.18 (m, 5Н), 6.90 (m, 4Н), 5.35 (m, 1Н), 4.7 (m, 1Н), 4.15 (m, 2Н), 3.56 (m, 2Н), 3.4-2.9 (m, 6Н), 2.18 (s, 3H), 1.86 (m, 3H), 1.7-1.4 (m, 8Н).
ПРИМЕР 124
[1-(4-хлорфенокси)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента N-[[1-[3-(4-хлорфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид из Примера 109 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.35 (m, 1Н), 8.88 (m, 1Н), 8.07 (m, 1Н), 7.5-6.9 (m, 9Н), 5.3 (m, 1Н), 4.65 (m, 1Н), 4.13 (m, 2Н), 3.60 (m, 2Н), 3.0 (m, 4Н),2.84 (m, 2Н), 1.87 (m, 3H), 1.7-1.1 (m, 8Н).
ПРИМЕР 125
[1-(4-трет-бутилфенокси)-3-[4-[[(3-метил-2-оксобензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента N-[[1-[3-(4-трет-бутилфенокси)-2-гидроксипропил]пиперидин-4-ил]-метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид из Примера 110 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCI) 9.64 (m, 1Н), 8.82 (m, 1Н), 8.02 (m, 1Н), 7.3-7.1 (m, 5Н), 6.87 (m, 4Н), 5.35 (m, 1Н), 4.1 (m, 2Н), 3.58 (m, 2Н), 3.5-3.1 (m, 7Н), 3.0 (m, 2Н), 1.87 (m, 3H), 1.53 (m, 2Н), 1.25 (s, 9Н).
ПРИМЕР 126
[1-[4-[[(3-метил-2-оксобензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]-3-феноксипропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-3-метил-2-оксобензимидазол-1-карбоксамид из Примера 111 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.3 (m, 1Н), 8.83 (m, 1Н), 8.02 (m, 1Н), 7.4-6.8 (m, 8Н), 5.31 (m, 1Н), 4.12 (m, 2Н), 3.61 (m, 2Н), 3.5-2.81 (m, 7Н), 2.4-2.1 (m, 2Н), 1.81 (m, 3H), 1.52 (m, 2Н).
ПРИМЕР 127
[1-(4-хлорфенокси)-3-[4-[[(3-метил-2-оксобензимидазол-1-карбонил)-амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента N-[[1-[3-(4-хлорфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-3-метил-2-оксобензимидазол-1-карбоксамид из Примера 112 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.5 (m, 1Н), 8.83 (m, 1Н), 8.02 (m, 1Н), 7.4-6.9 (m, 7Н), 6.87 (m, 2Н), 5.3 (m, 1Н), 4.14 (m, 2Н),3.6 (m, 2Н), 3.4-3.1 (m, 5Н), 3.0 (m, 4Н), 1.87 (m, 3H), 1.63 (m, 2Н).
ПРИМЕР 128
[1-(4-трет-бутилфенокси)-3-[4-[[(3-метил-2-оксобензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента N-[[1-[3-(4-трет-бутилфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-3-метил-2-оксобензимидазол-1-карбоксамид из Примера 113 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (DMSO-d6, 200 МГц, HCl форма) δ 9.64 (m, 1Н), 8.82 (m, 1Н), 8.02 (m, 1Н), 7.3-7.1 (m, 5Н), 6.87 (m, 4Н), 5.35 (m, 1Н), 4.1 (m, 2Н), 3.58 (m, 2Н), 3.5-3.1 (m, 7Н), 3.0 (m, 2Н), 1.87 (m, 3H), 1.53 (m, 2Н), 1.25 (s, 9Н).
ПРИМЕР 129
[1-(4-метоксифенокси)-3-[4-[[(3-метил-2-оксобензимидазол-1-карбонил)-амино]метил]пиперидин-1-ий-1-ил]пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-3-метил-2-оксобензимидазол-1-карбоксамид из Примера 114 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.65 (m, 1Н), 8.82 (m, 1Н), 8.02 (m, 1Н), 7.35-7.1 (m, 3H), 6.88 (m, 6Н), 5.35 (m, 1Н), 4.06 (m, 2Н), 3.69 (s, 3H), 3.6-3.1 (m, 7Н), 3.04 (m, 4Н), 1.87 (m, 3H), 1.6 (m, 2Н).
ПРИМЕР 130
[1-(4-фторфенокси)-3-[4-[[(3-метил-2-оксобензимидазол-1-карбонил)-амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента N-[[1-[3-(4-фторфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-3-метил-2-оксобензимидазол-1-карбоксамид из Примера 115 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н ЯМР (DMSO, 200 МГц), м.д. (δ): (в форме соли HCl) 9.45 (m, 1Н), 8.83 (m, 1H), 8.02 (m, 1H), 7.35-7.05 (m, 5H), 6.99 (m, 2H),6.88 (m, 2H), 5.35 (m, 1H), 4.11 (m, 2H), 3.60 (m, 2H), 3.5-3.1 (m, 7H), 3.04 (m, 2H), 1.87 (m, 3H), 1.49 (m, 2H).
ПРИМЕР 131
[1-[4-[[(3-этил-2-оксобензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]-3-феноксипропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента 3-этил-М-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид из Примера 116 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDC3, 200 МГц) δ 8.9 (m, 1Н), 8.25 (m, 1Н), 7.4-6.9 (m, 8Н), 5.3 (s, 2Н), 5.2 (m, 1Н), 4.15 (m, 2Н), 4.0 (m, 2Н), 3.35 (t, 2Н), 3.0 (m, 2Н), 2.65 (m, 2Н), 2.1 (m, 2Н), 1.75 (m, 2Н), 1.6 (m, 1Н), 1.5-1.2 (m, 5Н).
ПРИМЕР 132
[1-[4-[[(3-этил-2-оксобензимидазол-1-карбонил)амино]метил]пиперидин-1-ий-1-ил]-3-(4-метоксифенокси)пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента 3-этил-N-[[1-[2-гидрокси-3-(4-метоксифенокси)пропил]пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид из Примера 117 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.9 (m, 1Н), 8.25 (m, 1Н), 7.2 (m, 2Н), 7.05 (m, 1Н), 6.85 (m, 4Н), 5.15 (m, 1Н), 5.0 (s, 2Н), 4.15 (m, 2Н), 4.0 (m, 2Н), 3.8 (s, 3H), 3.35 (t, 2Н), 3.0 (m, 2Н), 2.65 (m, 2Н), 2.1 (m, 2Н), 1.75 (m, 2Н), 1.6 (m, 1Н), 1.5-1.2 (m, 5Н).
ПРИМЕР 133
[1-[4-[[(3-этил-2-оксобензимидазол-1-карбонил)амино]метил]пиперидин-1-ил]-3-(2-метилфенокси)пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента 3-этил-N-[[1-[2-гидрокси-3-(2-метилфенокси)пропил]пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид из Примера 118 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.9 (m, 1Н), 8.25 (m, 1Н), 7.3-7.0 (m, 5Н), 6.85 (m, 2Н), 5.25 (m, 1Н), 5.05 (s, 2Н), 4.15 (m, 2Н), 4.0 (m, 2Н), 3.35 (t, 2Н), 3.0 (m, 2Н), 2.7 (d, 2Н), 2.2 (s, 3H), 2.1 (m, 2Н), 1.8 (m, 2Н), 1.6 (m, 1Н), 1.5-1.2 (m, 5Н).
ПРИМЕР 134
[1-(4-хлорфенокси)-3-[4-[[(3-этил-2-оксобензимидазол-1-карбонил)-амино]метил]пиперидин-1-ил]пропан-2-ил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 120, используя в качестве реагента N-[[1-[3-(4-хлорфенокси)-2-гидроксипропил]пиперидин-4-ил]метил]-3-этил-2-оксобензимидазол-1-карбоксамид из Примера 119 вместо N-[[1-(2-гидрокси-3-феноксипропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.9 (m, 1Н), 8.25 (m, 1Н), 7.3-7.0 (m, 5Н), 6.9 (m, 2Н), 5.2 (m, 1Н), 5.0 (s, 2Н), 4.15 (m, 2Н), 4.0 (m, 2Н), 3.35 (t, 2Н), 2.95 (m, 2Н), 2.6 (d, 2Н), 2.1 (m, 2Н), 1.75 (m, 2Н), 1.6 (m, 1Н), 1.5-1.2 (m, 5Н).
ПРИМЕР 135
3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Смесь (пиперидин-4-илметил)-амида 3-циклопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты (5,0 ммоль), 3-хлорпропиофенона (6,0 ммоль), карбоната калия (7,6 ммоль) и йодида калия (7,6 ммоль) кипятили с обратным холодильником в 15 мл ацетонитрила в течение 12 ч. Этот раствор затем концентрировали на роторном испарителе и разбавляли этилацетатом. Эту смесь затем промывали рассолом и полученный органический слой сушили и очищали колоночной хроматографией. Его растворяли в этаноле (10 мл) и при 0°С добавляли борогидрид натрия (10,0 ммоль) и перемешивали при 25°C в течение 2 ч. Этот раствор концентрировали на роторном испарителе и разбавляли этилацетатом. Эту смесь промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали колоночной хроматографией. Полученный 3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид растворяли в MC и раствор обрабатывали раствором HCI в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.95 (m, 1Н), 8.35 (m, 1Н), 7.5-7.1 (m, 9Н), 4.95 (m, 1H), 3.35-3.1 (m, 4H), 2.9 (m, 1H), 2.7 (m, 2H), 2.2 (m, 1H), 2.1-1.6 (m, 5H), 1.5 (m, 2H), 1.3-1.0 (m, 5H).
ПРИМЕР 136
N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 135, используя в качестве реагента (пиперидин-4-илметил)-амид 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты вместо (пиперидин-4-илметил)-амида 3-циклопропил-2-оксо-2,3-дигидро-бензимидазол-1 -карбоновой кислоты, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 9.0 (m, 1Н), 8.25 (m, 1Н), 7.5-7.1 (m, 9Н), 4.95 (m, 1Н), 4.75 (m, 1Н), 3.35 (m, 2Н), 3.15 (m, 2Н), 2.8-2.55 (m, 2Н), 2.1 (m, 1Н), 1.9 (m, 4Н), 1.8-1.4 (m, 10H).
ПРИМЕР 137
N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-1-ий-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 135, используя в качестве реагентов (пиперидин-4-илметил)-амид 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 3-хлор-4'-фторпропиофенон вместо (пиперидин-4-илметил)-амида 3-циклопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 3-хлорпропиофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 500 МГц) δ 9.00 (m, 1Н), 8.28 (s, 1Н), 7.36 (m, 2Н), 7.20 (m, 3H), 7.03 (m, 2Н), 4.95 (m, 1Н), 4.72 (m, 1Н), 3.37 (m, 2Н), 3.35 (m, 1Н), 3.22 (m, 1Н), 2.81 (m, 1Н), 2.71 (m, 1Н), 2.28 (m, 1Н), 2.11 (m, 1Н), 1.93 (m, 4Н), 1.79 (m, 1Н), 1.58 (m, 8Н).
ПРИМЕР 138
3-циклопропил-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-1-ий-4-ил]метил]-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 135, используя в качестве реагента 3-хлор-4'-фторпропиофенон вместо 3-хлорпропиофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 500 МГц) δ 9.00 (m, 1Н), 8.20 (s, 1Н), 7.36 (m, 2Н), 7.20 (m, 3H), 7.05 (m, 2Н), 4.96 (m, 1Н), 3.37 (m, 3H), 3.30 (m, 1Н), 2.92 (m, 2Н), 2.80 (m, 1Н), 2.35 (m, 1Н), 2.2 (m, 1Н), 1.96 (m, 2Н), 1.79 (m, 2Н), 1.65 (m, 3H), 1.20 (m, 2Н), 1.05 (m, 2H).
ПРИМЕР 139
N-[[1-[3-(4-хлорфенил)-3-гидроксипропил]пиперидин-1-ий-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 135, используя в качестве реагентов (пиперидин-4-илметил)-амид 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 3-хлор-4'-хлорпропиофенон вместо (пиперидин-4-илметил)-амида 3-циклопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 3-хлорпропиофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 500МГц) δ 9.00 (m, 1Н), 8.27 (m, 1Н), 7.33 (m, 4Н), 7.18 (m, 3H), 4.96 (m, 1Н), 4.72 (m, 1Н), 3.37 (m, 3H), 3.25 (m, 1Н), 2.87-2.70 (m, 2Н), 2.40 (m, 1Н),2.13 (m, 1Н), 1.95 (m, 5Н), 1.78 (m, 2Н),1.58 (m, 6Н).
ПРИМЕР 140
N-[[1-[3-(4-хлорфенил)-3-гидроксипропил]пиперидин-1-ий-4-ил]метил]-3-циклопропил-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 135, используя в качестве реагента 3-хлор-4'-хлорпропиофенон вместо 3-хлорпропиофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 500 МГц) 5 8.94 (m, 1Н), 8.20 (m, 1Н), 7.33-7.19 (m, 7Н), 4.96 (m, 1Н), 3.37 (m, 3H), 3.26 (m, 1Н), 2.91 (m, 2Н), 2.81 (m, 1Н), 2.32 (m, 1Н), 2.15 (m, 1Н), 1.95 (m, 4Н), 1.77 (m, 2Н), 1.62 (m, 3H), 1.18 (m, 2Н), 1.05 (m, 2Н).
ПРИМЕР 141
N -[[1-[3-гидрокси-3-(4-метилфенил)пропил]пиперидин-1-ий-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 135, используя в качестве реагентов (пиперидин-4-илметил)-амид 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 3-хлор-4'-метилпропиофенон вместо (пиперидин-4-илметил)-амида 3-циклопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 3-хлорпропиофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 500 МГц) δ 9.01 (m, 1Н), 8.26 (m, 1Н), 7.37-7.15 (m, 7Н), 4.95 (m, 1H), 4.75 (m, 1H), 3.38 (m, 4H), 2.90 (m, 2H), 2.36 (s, 3H), 2.10-1.65 (m, 9H), 1.60 (m, 6H).
ПРИМЕР 142
3-циклопропил-N-[[1-[3-гидрокси-3-(4-метилфенил)пропил]пиперидин-1-ий-4-ил]метил]-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 135, используя в качестве реагента 3-хлор-4'-метилпропиофенон вместо 3-хлорпропиофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 500 МГц) δ 8.95 (m, 1Н), 8.20 (m, 1Н), 7.42-7.13 (m, 7Н), 4.75 (m, 1Н), 3.42-3.20 (m, 4Н), 2.90 (m, 1Н), 2.81 (m, 2Н), 2.32 (m, 3H), 2.18 (m, 1Н), 1.95 (m, 3H), 1.80 (m, 2Н), 1.65 (m, 3H), 1.20 (m, 2Н), 1.06 (m, 2Н).
ПРИМЕР 143
N-[[1-[3-гидрокси-3-(4-метоксифенил)пропил]пиперидин-1-ий-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 135, используя в качестве реагентов (пиперидин-4-илметил)-амид 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 3-хлор-4'-метоксипропиофенон вместо (пиперидин-4-илметил)-амида 3-циклопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 3-хлорпропиофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 9.05 (m, 1Н), 8.25 (m, 1Н), 7.35 (m, 3H), 7.2 (m, 3H), 6.9 (m, 2Н), 6.85 (m, 1Н), 5.0 (m, 1Н), 4.7 (m, 1Н), 3.85 (s, 3H), 3.7 (m, 1Н), 3.5 (m, 1Н), 3.4 (m, 2Н), 3.25 (m, 2Н), 3.0 (m, 3H), 2.65 (m, 2Н), 2.3 (m, 2Н), 2.1 (m, 2Н), 1.6 (m, 6Н).
ПРИМЕР 144
3-циклопропил-N-[[1-[3-гидрокси-3-(4-метоксифенил)пропил]пиперидин-1-ий-4-ил]метил]-2-оксобензимидазол-1 -карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 135, используя в качестве реагента 3-хлор-4'-метоксипропиофенон вместо 3-хлорпропиофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.95 (m, 1Н), 8.2 (m, 1Н), 7.4-7.2 (m, 5Н), 6.9 (m, 2Н), 4.9 (m, 1Н), 3.8 (s, 3H), 3.35 (m, 2Н), 3.2 (m, 2Н), 2.9 (m, 1Н), 2.75 (m, 2Н), 2.3-2.0 (m, 2Н), 1.9 (m, 4Н), 1.7 (m, 1Н), 1.55 (m, 2Н), 1.2-1.0 (m, 4Н).
ПРИМЕР 145
[3-[4-[[(3-циклопропил-2-оксобензимидазол-1-карбонил)амино]метил]-пиперидин-1-ий-1-ил]-1-фенилпропил]карбамат; гидрохлорид
3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамид (1 ммоль) при 0°C растворяли в 10 мл THF и добавляли 1,1'-карбонилдиимидазол (1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, после чего добавляли избыток гидроксида аммония (3 мл) при комнатной температуре. После 2 ч перемешивания при комнатной температуре для завершения реакции добавляли воду. Органический слой экстрагировали 3 раза дихлорметаном, сушили и концентрировали в вакууме. Полученный карбамат растворяли в MC и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCb, 200 МГц) δ 9.00 (m, 1Н), 8.20 (m, 1Н), 7.31-7.18 (m, 8Н), 5.71 (m, 1Н), 4.73 (br, 2Н), 3.35 (m, 2Н), 3.12 (br, 2Н), 2.90 (m, 2Н), 2.80 (m, 1Н), 2.30 (m, 2Н), 2.07 (m, 2Н), 1.86 (m, 2Н), 1.75 (m, 1Н), 1.60 (m, 2Н), 1.20 (m, 2Н), 1.05 (m, 2Н).
ПРИМЕР 146
[3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]-пиперидин-1-ил]-1-фенилпропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 145, используя в качестве реагента N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид из Примера 136 вместо 3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 9.0 (m, 1Н), 8.3 (m, 1Н), 7.8 (m, 1Н), 7.4-7.1 (m, 9Н), 5.75 (m, 1Н), 4.8-4.6 (m, 3H), 3.35 (m, 2Н), 3.1 (m, 2Н), 2.55 (m, 3H), 2.4-2.0 (m, 5Н), 1.9-1.6 (m, 4Н), 1.5 (m, 6Н).
ПРИМЕР 147
[1-(4-фторфенил)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)-амино]метил]пиперидин-1-ий-1-ил]пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 145, используя в качестве реагента N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-1-ий-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид из Примера 137 вместо 3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 500 МГц) δ 9.00 (m, 1Н), 8.25 (s, 1Н), 7.36 (m, 2Н), 7.20 (m, 3H), 7.05 (m, 2Н), 5.69 (m, 1Н), 4.72 (m, 1Н), 3.36 (m, 2Н), 3.20 (m, 2Н), 2.65 (m, 2Н), 2.3 (m, 2Н), 1.93 (m, 3H), 1.79 (m, 2Н), 1.65 (m, 2Н), 1.58 (m, 6Н).
ПРИМЕР 148
[3-[4-[[(3-циклопропил-2-оксобензимидазол-1-карбонил)амино]метил]-пиперидин-1-ий-1-ил]-1-(4-фторфенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 145, используя в качестве реагента 3-циклопропил-N-[[1-[3-(4-фторфенил)-3-гидроксипропил]пиперидин-1-ий-4-ил]метил]-2-оксобензимидазол-1-карбоксамид из Примера 138 вместо 3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.89 (m, 1Н), 8.20 (m, 1Н), 7.35-7.19 (m, 5Н), 7.03 (m, 2Н), 5.68 (m, 1Н), 4.78 (br, 2Н), 3.33 (m, 2Н), 3.03 (m, 2Н), 2.90 (m, 1Н), 2.47 (m, 2Н), 2.20 (m, 1Н), 2.06 (m, 3H), 1.81 (m, 2Н), 1.65 (m, 1Н), 1.45 (m, 2Н), 1.17 (m, 2Н), 1.05 (m, 2Н).
ПРИМЕР 149
[1-(4-хлорфенил)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)-амино]метил]пиперидин-1-ий-1-ил]пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 145, используя в качестве реагента N-[[1-[3-(4-хлорфенил)-3-гидроксипропил]пиперидин-1-ий-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид из Примера 139 вместо 3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.98 (m, 1Н), 8.26 (m, 1Н), 7.34-7.17 (m, 7Н), 5.67 (m, 1Н), 4.72 (m, 3H), 3.35 (m, 2Н), 3.06 (m, 2Н), 2.50 (m, 2Н), 2.25 (m, 1Н), 2.12 (m, 1Н), 2.05 (m, 2Н), 1.85 (m, 2Н), 1.80 (m, 1Н), 1.58 (m, 6Н), 1.28 (m, 2Н).
ПРИМЕР 150
[1-(4-хлорфенил)-3-[4-[[(3-циклопропил-2-оксобензимидазол-1-карбонил)-амино]метил]пиперидин-1-ий-1-ил]пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 145, используя в качестве реагента N-[[1-[3-(4-хлорфенил)-3-гидроксипропил]пиперидин-1-ий-4-ил]метил]-3-циклопропил-2-оксобензимидазол-1-карбоксамид из Примера 140 вместо 3-циклопропил-М-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 500 МГц) δ 8.93 (m, 1Н), 8.19 (m, 1Н), 7.35-7.20 (m, 7Н), 5.68 (m, 1Н), 4.78 (m, 2Н), 3.36 (m, 2Н), 3.18 (m, 2Н), 2.91 (m, 2Н), 2.65 (m, 2Н), 2.31 (m, 2Н), 2.15 (m, 2Н), 1.89 (m, 2Н), 1.75 (m, 2Н), 1.63 (m, 3H), 1.19 (m, 2Н), 1.06 (m, 2Н).
ПРИМЕР 151
[1-(4-метилфенил)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)-амино]метил]пиперидин-1-ий-1-ил]пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 145, используя в качестве реагента N-[[1-[3-гидрокси-3-(4-метилфенил)пропил]пиперидин-1-ий-4-ил]-метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид из Примера 141 вместо 3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.97 (m, 1Н), 8.25 (m, 1Н), 7.30-7.13 (m, 7Н), 5.67 (m, 1Н), 4.73 (m, 3H), 3.50 (m, 1Н), 3.32 (m, 2Н), 3.10 (m, 2Н), 2.58 (m, 2Н), 2.37 (m, 3H), 2.28 (m, 1Н), 2.11 (m, 3H), 1.85 ( m, 3H), 1.72 (m, 1Н), 1.58 (m, 6Н).
ПРИМЕР 152
[3-[4-[[(3-циклопропил-2-оксобензимидазол-1-карбонил)амино]метил]-пиперидин-1-ий-1-ил]-1-(4-метилфенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 145, используя в качестве реагента 3-циклопропил-N-[[1-[3-гидрокси-3-(4-метилфенил)пропил]пиперидин-1-ий-4-ил]метил]-2-оксобензимидазол-1-карбоксамид из Примера 142 вместо 3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.90 (m, 1Н), 8.20 (s, 1H), 7.32-7.13 (m, 7H), 5.66 (m, 1H), 4.73 (br, 2H), 3.35 (m, 2H), 3.12 (m, 2H), 2.91 (m, 1H), 2.60 (m, 2H), 2.40 (s, 3H), 2.27 (m, 2H), 1.61 (m, 2H), 1.87 (m, 2H), 1.72 (m, 1H), 1.59 (m, 2H), 1.20 (m, 2H), 1.06 (m, 2H).
ПРИМЕР 153
[1-(4-метоксифенил)-3-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)амино]метил]пиперидин-1-ий-1-ил]пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 145, используя в качестве реагента N-[[1-[3-гидрокси-3-(4-метоксифенил)пропил]пиперидин-1-ий-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид из Примера 143 вместо 3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 9.0 (m, 1Н), 8.25 (m, 1Н), 7.35 (m, 3H), 7.2 (m, 3H), 6.9 (m, 2Н), 5.65 (m, 1Н), 4.95 (m, 2Н), 4.7 (m, 1Н), 3.8 (s, 3H), 3.4 (m, 2Н), 3.2 (m, 2Н), 2.7 (m, 2Н), 2.4-2.1 (m, 4Н), 1.9 (m, 3H), 1.7 (m, 2Н), 1.6 (m, 6Н).
ПРИМЕР 154
[3-[4-[[(3-циклопропил-2-оксобензимидазол-1-карбонил)амино]метил]-пиперидин-1-ий-1-ил]-1-(4-метоксифенил)пропил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 145, используя в качестве реагента 3-циклопропил-N-[[1-[3-гидрокси-3-(4-метоксифенил)пропил]-пиперидин-1-ий-4-ил]метил]-2-оксобензимидазол-1-карбоксамид из Примера 144 вместо 3-цикл опропил-N-[[1-(3-гидрокси-3-фенил пропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.95 (m, 1Н), 8.2 (m, 1Н), 7.4-7.2 (m, 5Н), 6.95 (m, 2Н), 5.65 (m, 1Н), 4.8 (m, 2Н), 3.8 (s, 3H), 3.4 (m, 2Н), 3.2 (m, 2Н), 2.9 (m, 1Н), 2.7 (m, 2Н), 2.5-2.1 (m, 4Н), 1.9 (m, ЗН), 1.75 (m, 2Н), 1.4-1.0 (m, 4Н).
ПРИМЕР 155
N-[[1-[2-(4-фторфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Смесь (пиперидин-4-илметил)-амида 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты (5,0 ммоль), 2-бром-4'-фторацетофенона (6,0 ммоль) и карбоната калия (7,6 ммоль) перемешивали в 15 мл ацетонитрила в течение 2 ч. Этот раствор затем концентрировали на роторном испарителе и разбавляли этилацетатом. Эту смесь затем промывали рассолом и полученный органический слой сушили и очищали колоночной хроматографией. Его растворяли в этаноле (10 мл) и при 0°C добавляли борогидрид натрия (10,0 ммоль) и перемешивали при 25°C в течение 2 ч. Этот раствор концентрировали на роторном испарителе и разбавляли этилацетатом. Эту смесь промывали рассолом, сушили и концентрировали в вакууме. Остаток очищали колоночной хроматографией. Полученный N-[[1-[2-(4-фторфенил)-2-гидроксиэтил]пиперидин-1-ий-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид растворяли в MC и раствор обрабатывали раствором HCl в диэтиловом эфире. Полученный осадок отфильтровывали с получением указанного в заголовке соединения.
1Н-ЯМР (CDCb, 500 МГц) δ 9.01 (m, 1Н), 8.26 (m, 1Н), 7.37 (m, 2Н), 7.20 (m, 3H), 7.05 (m, 2Н), 4.90 (br, 2Н), 3.38 (m, 2Н), 3.30 (m, 1Н), 3.08 (m, 1Н), 2.63 (m, 2Н), 2.50 (m, 1Н), 2.25 (m, 1Н), 1.91 (m, 2Н), 1.80 (m, 1Н), 1.59 (m, 8Н).
ПРИМЕР 156
N-[[1-[2-гидрокси-2-(3-метоксифенил)этил]пиперидин-1-ий-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 155, используя в качестве реагента 2-бром-3'-метоксиацетофенон вместо 2-бром-4'-фторацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 9.05 (m, 1Н), 8.3 (m, 1Н), 7.35-7.1 (m, 5Н), 7.0 (m, 2Н), 6.85 (m, 1Н), 4.9 (m, 1Н), 4.85 (m, 1Н), 3.95 (s, 3H), 3.4 (m, 3H), 3.1 (m, 1Н), 2.85 (m, 2Н), 2.5 (m, 1Н), 2.3 (m, 1Н), 1.95-1.8 (m , 3H), 1.6-1.5 (m, 8Н).
ПРИМЕР 157
3-циклопропил-N-[[1-[2-гидрокси-2-(3-метоксифенил)этил]пиперидин-1-ий-4-ил]метил]-2-оксобензимидазол-1-карбоксамид; гидрохлорид
Следовали процедуре, приведенной в Примере 155, используя в качестве реагентов (пиперидин-4-илметил)-амид 3-циклопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 2-бром-3'-метоксиацетофенон вместо (пиперидин-4-илметил)-амида 3-изопропил-2-оксо-2,3-дигидро-бензимидазол-1-карбоновой кислоты и 2-бром-4'-фторацетофенона, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 8.95 (m, 1Н), 8.25 (m, 1Н), 7.35-7.2 (m, 4Н), 7.0 (m, 2H), 6.85 (m, 1H), 4.85 (m, 1H), 3.95 (s, 3H), 3.35 (m, 3H), 2.95 (m, 2H), 2.6 (m, 2H), 2.45 (m, 1H), 2.2 (m, 1H), 1.9 (m, 2H), 1.85 (m, 1H), 1.5 (m, 2H), 1.3-1.0 (m, 4H).
ПРИМЕР 158
[1-(4-фторфенил)-2-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)-амино]метил]пиперидин-1-ий-1-ил]этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 145, используя в качестве реагента N-[[1-[2-(4-фторфенил)-2-гидроксиэтил]пиперидин-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид из Примера 155 вместо 3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 500 МГц) δ 8.97 (m, 1Н), 8.26 (m, 1Н), 7.37 (m, 2Н), 7.18 (m, 3H), 7.05 (m, 2Н), 5.82 (m, 1Н), 5.00 (m, 1Н), 4.72 (m, 1Н), 3.35 (m, 2Н), 3.15-2.95 (m, 2Н), 2.71 (m, 1Н), 2.62 (m, 1Н), 2.26 (m, 2Н), 1.95 (m, 1Н), 1.85 (m, 2Н), 1.70 (m, 2Н), 1.58 (m, 6Н).
ПРИМЕР 159
[1-(3-метоксифенил)-2-[4-[[(2-оксо-3-пропан-2-илбензимидазол-1-карбонил)-амино]метил]пиперидин-1-ий-1-ил]этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 145, используя в качестве реагента N-[[1-[2-гидрокси-2-(3-метоксифенил)этил]пиперидин-1-ий-4-ил]метил]-2-оксо-3-пропан-2-илбензимидазол-1-карбоксамид из Примера 156 вместо 3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 9.05 (m, 1Н), 8.25 (m, 1Н), 7.35-7.1 (m, 4Н), 7.0-6.85 (m, 3H), 5.9 (m, 1Н), 4.7 (m, 1Н), 3.8 (s, 3H), 3.5-3.1 (m, 4Н), 2.8 (m, 1Н), 2.5 (m, 2Н), 2.1-1.85 (m, 6Н), 1.6 (m, 6Н).
ПРИМЕР 160
[[2-[4-[[(3-циклопропил-2-оксобензимидазол-1-карбонил)амино]метил]-пиперидин-1-ий-1-ил]-1-(3-метоксифенил)этил]карбамат; гидрохлорид
Следовали процедуре, приведенной в Примере 145, используя в качестве реагента 3-циклопропил-N-[[1-[2-гидрокси-2-(3-метоксифенил)этил]пиперидин-1-ий-4-ил]метил]-2-оксобензимидазол-1-карбоксамид из Примера 157 вместо 3-циклопропил-N-[[1-(3-гидрокси-3-фенилпропил)пиперидин-4-ил]метил]-2-оксобензимидазол-1-карбоксамида, с получением указанного в заголовке соединения.
1Н-ЯМР (CDCl3, 200 МГц) δ 9.0 (m, 1Н), 8.2 (m, 1Н), 7.4-7.2 (m, 4Н), 7.05-6.9 (m, 3H), 5.95 (m, 1Н), 3.85 (s, 3H), 3.6-3.4 (m, 3H), 2.95 (m, 2Н), 2.7 (m, 2Н), 2.2-1.8 (m, 5Н), 1.7 (m, 2Н), 1.4-1.0 (m, 4Н).
ПРИМЕР 161: Активность по усилению опорожнения желудка
Самцам мышей линии ICR CD (масса тела приблизительно 25-30 г; 8 мышей на одну группу) оставляли голодными в течение 24 ч, но оставляли им свободный доступ к воде в пределах до 3 часов перед началом теста.
Тестируемые соединения для стимуляции перистальтики желудочно-кишечного тракта инъецировали внутрибрюшинно или давали перорально за 30 минут или 60 минут до введения корма с феноловым красным. Через пятнадцать (15) минут после введения тест-корма (0,5% фенолового красного в 1,5%-ном растворе метил целлюлозы) мышей умерщвляли и желудок (пилорическая часть~кардия) удаляли и помещали во флакон. Желудок вместе с его содержимым гомогенизировали в 0,1 н. NaOH и смесь центрифугировали (700*g) в течение 20 минут. 2,5 мл супернатанта добавляли к 0,25 мл раствора трихлоруксусной кислоты (20% мас./об.) для осаждения белков. После центрифугирования (2600*g) в течение 20 минут 0,5 мл супернатанта добавляли к 0,25 мл 1 н. NaOH. Смесь гомогенизировали и регистрировали ее абсорбцию (Abs) при 560 нм.
В каждом эксперименте одну группу умерщвляли сразу после введения тест-корма и считали ее стандартом (0% опорожнения). Опорожнение желудка (GE) в течение периода 15 минут рассчитывали согласно следующей формуле:
GE(%)=(1-AbSтест/AbSстандарт)×100
Усиление(%)=(СЕ%тест-СЕ%носитель)/СЕ%носитель*100
Как показано в Таблице 1, большинство соединений по данному изобретению проявляют выраженное усиливающее опорожнение желудка действие в дозе 3 мг/кг.
Как очевидно из вышеприведенных экспериментальных результатов, соединения структурной формулы (I) и их фармацевтически приемлемые соли обладают прекрасной активностью по усилению перистальтики желудочно-кишечного тракта и поэтому полезны для лечения заболеваний желудочно-кишечного тракта, таких как синдром раздраженного кишечника (IBS), особенно IBS с преобладанием запоров, и нарушения двигательной функции желудка.
5-Гидрокситриптамин (5-НТ), высвобожденный из энтерохромаффиновых клеток, регулирует желудочно-кишечную функцию либо возбуждающим, либо ингибирующим образом. Активность по усилению желудочно-кишечной перистальтики является характеристикой агонизма в отношении 5-НТ4 рецепторов. Агонисты 5-НТ4 рецепторов могут стимулировать перистальтику верхнего или нижнего отдела кишечника, тогда как 5-НТ4 антагонисты ингибируют усиленную 5-НТ4 агонистами перистальтику кишечника.
Соединения структурной формулы (I) обладают связывающей активностью в отношении 5-НТ4 рецепторов и стимулируют перистальтику кишечника (смотри Таблицу 1). Поэтому полагают, что усиление перистальтики кишечника соединениями структурной формулы (I) опосредовано агонизмом в отношении 5-НТ4 рецепторов.
|
|
Гиперчувствительность к колоректальному растяжению характерна для пациентов с IBS и может быть ответственной за основной симптом висцеральной боли. Для исследования воздействия соединения на висцеральную боль при IBS были разработаны воспалительные и невоспалительные животные модели висцеральной гипералгезии в отношении растяжения, как будет описано в Примерах 162 и 163, соответственно.
ПРИМЕР 162: Тест на TNBS-индуцированную колоректальную гиперчувствительность
Крыс Wistar (масса тела 200-225 г; 8-10 крыс на группу) хирургическим путем готовили для электромиографического контроля согласно ранее описанной методике (Morteau et al., Dig Dis Sci, 1994, 39 (6): 1239-1248). После лапаротомии три группы из трех электродов имплантировали в слоистые мышцы брюшной полости. Электроды выводили на заднюю поверхность шеи и защищали стеклянной трубкой, присоединенной к коже.
Колоректальное растяжение (CRD) осуществляли с помощью баллона, заполнявшегося 5 минутными стадиями по 15 мм Hg (2 кПа) от 0 до 60 мм Hg (8 кПа) путем соединения баллона с компьютеризированным баростатом. Крыс подвергали CRD за 1 сутки перед (основное условия) и через 3 суток после внутриректального введения тринитробензолсульфоновой кислоты (TNBS 80 мг/кг внутриректально). Давление в толстой кишке и объем баллона непрерывно мониторировали на потенциометрическом рекордере (L6514, Linseis, Selb, Germany) со скоростью бумаги 1 см·мин-1.
Через пять дней после введения TNBS крыс обрабатывали тестируемым препаратами или их носителем (карбоксиметилцеллюлоза 0,5 %, 1 мл п./о.) за один час перед растяжением. Количество «острых взрывов», которые соответствуют абдоминальным сокращениям, определяли за 5-минутные периоды. Величины выражали как средние ±SEM (среднеквадратичное отклонение). Статистический анализ осуществляли, используя ″t″-критерий Стьюдента, и критерий для статистической значимости составлял p<0,05.
В Таблице 2 суммированы результаты активности соединения, полученного в Пример 68, как тестируемого соединения в модели TNBS-индуцированной колоректальной гиперчувствительности. Значительное снижение абдоминального сокращения наблюдали при 10 мг/кг и 30 мг/кг тестируемого соединения. Этот результат показывает, что соединение согласно одному воплощению настоящего изобретения обладает активностью по снижению висцеральной боли в крысиной предклинической модели.
|
ПРИМЕР 163: Тест на PRS (стресс, связанный с частичным ограничением подвижности) - индуцированную колоректальную гиперчувствительность
Взрослых самок крыс Wistar (масса тела 225-250 г; 6-7 крыс на группу) готовили для электромиографии. После анестезии три пары электродов из нихромовой проволоки имплантировали билатерально в слоистые мышцы в 3 см латерально от средней линии. Свободные концы электродов выводили на заднюю поверхность шеи и защищали стеклянной трубкой, присоединенной к коже.
PRS, относительно мягкий стресс, осуществляли, как ранее описано в Bradesi S, Eutamene ч, Garcia-Villar R, Fioramonti J, Bueno L; 'Acute и chronic stress differently affect visceral sensitivity to rectal distension in female rats.' Neurogastroenterol. Mot. (2002) 14, 75-82.
Крыс помещали в пластиковый туннель, где им не давали возможности двигаться или убегать за несколько суток до колоректального растяжения (CRD). Баллон, присоединенный к баростату, заполняли прогрессивно стадиями 15 мм Hg, от 0, 15, 30, 45 и 60 мм Hg (0, 2, 4, 6 и 8 кПа), каждая стадия заполнения длилась 5 мин. Для определения антиноцицептивного действия тестируемого соединения на PRS -индуцированную висцеральную гиперчувствительность тестируемое соединение или носитель (CMC 0,5%) вводили перорально (РО), через 1 ч 15 мин после начала PRS. За три часа до и через 15 мин после стрессового сеанса осуществляли CRD.
Количество «острых взрывов», которые соответствуют абдоминальным сокращениям, определяли за 5-минутные периоды для каждого объема растяжения. Давление в толстой кишке и объем баллона непрерывно мониторировали на потенциометрическом рекордере (L6514, Linseis, Selb, Germany). Величины выражали как средние ±SEM.
Статистический анализ осуществляли посредством однофакторного дисперсионного анализа (ANOVA) с последующим тестом Дуннетта. p<0,05 считали значимой.
В Таблице 3 суммированы результаты активности соединения, полученного в Примере 68, как тестируемого соединения в модели PRS-индуцированной колоректальной гиперчувствительности. Значительное снижение абдоминального сокращения наблюдали при 30 мг/кг. Этот результат показывает, что соединение согласно одному воплощению настоящего изобретения обладает активностью по снижению висцеральной боли.
|