ПРИМЕНЕНИЕ КОМПОЗИЦИИ ДЛЯ КУЛЬТИВИРОВАНИЯ БИОЛОГИЧЕСКИХ КЛЕТОК
Вид РИД
Изобретение
Изобретение касается применения коллаген-содержащей композиции для культивирования биологических клеток, способа культивирования биологических клеток, способа имплантации биологического материала в организм и способа усовершенствования пригодности композиции для культивирования биологических клеток.
Носители для культивирования биологических клеток являются общеизвестными в уровне техники. Такие носители часто упоминаются, как матрицы или каркас. Эти носители обеспечивают среду обитания или, в общем, основание, на котором растут клетки в клеточной культуре.
Коллаген-содержащие соединения представляют собой самый известный тип клеточных носителей. Коллаген как животный белок внеклеточной матрицы принадлежит к склеропротеинам и является обычно нерастворимым в воде и волокнистым по структуре. Он представляет собой один из главных компонентов в структуре соединительных тканей, например кожи, кровеносных сосудов, связок, сухожилий и хрящей, и в структуре костей и зубов. Из-за этих свойств основанные на коллагене биоматериалы из животных источников уже применяются в медицине в течение нескольких лет. Особенно в клинически применимых продуктах для гемостаза в качестве замены для твердой мозговой оболочки или в различных областях пластической хирургии коллагены смогли утвердиться как материал-носитель. Эти коллагены, из которых на настоящий момент было идентифицировано 28 различных типов и зарегистрировано по крайней мере 10 дополнительных белков с подобными коллагену доменами, демонстрируют только несущественное различие в зависимости от вида. Поскольку не было обнаружено отличия при идентификации и поскольку в результате их ферментативной деградации не образуется токсических продуктов деградации, коллагены считаются биологически совместимыми.
Коллагеновые матрицы, которые на данный момент предлагаются на рынке, показывают очень большое различие в свойствах. Таким образом, было обнаружено, что при применении in vitro некоторые из коллагеновых матриц, применяемых для культивирования биологических клеток, вызывают воспалительные реакции, приводящие к катаболическим метаболическим процессам. Другой недостаток доступных в настоящее время коллагеновых матриц состоит в том, что они очень толстые - обычно превышают 200 мкм - и что они не могут, таким образом, быть исследованы под микроскопом. В дополнение к этому коллагеновые матрицы, предлагаемые для культивирования биологических клеток, до настоящего времени были очень дорогими.
Альтернативный носитель для культивирования клеток представляет собой так называемые гидрогели. Гидрогель - содержащий воду, но не растворимый в воде полимер, молекулы которого химически (например, через ковалентные или ионные связи) или физически (например, путем поперечного связывания полимерных цепей) связаны для получения трехмерной сети. Благодаря интегральным гидрофильным полимерным компонентам они расширяются в воде при значительном увеличении объема, но не теряя свою материальную когезию. Однако недостаток гидрогелей состоит в том, что, учитывая их огромную водоудерживающую способность, они механически нестабильны.
Кроме того, гидрогели часто конденсируются при колонизации с клетками. Поэтому применение гидрогелей очень ограничено.
Так называемая гиалуроновая кислота представляет собой другую матрицу, подходящую для колонизации с биологическими клетками. Эта матрица состоит из макромолекул матрицы хряща, вот почему в немодифицированной форме она демонстрирует высокую биологическую совместимость. Молекулярные цепи должны быть связаны для того, чтобы получилась подходящая структура с достаточной механической упругостью. Это осуществляется посредством этерификации со спиртом, что может привести к снижению биологической совместимости.
Так называемый альгинат представляет собой другой каркас. Это касается сополимера, полученного из коричневых морских водорослей, который состоит из L-гулуроновой кислоты и D-маннуроновой кислоты. При добавлении EDTA и/или Na-цитрата продукт может быть желатинизирован или сжижен, что наделяет альгинат подобными свойствами для культивирования клеток, как уже описанные для основанных на коллагене гелей, однако с улучшенными возможностями для повторной суспензии для клеточных и молекулярных биологических анализов. Несмотря на преимущества перед другими матрицами-носителями и хорошими свойствами материала in vitro, его применение in vivo оказалось неудачным. In vivo вещество трудно абсорбируется и вызывает значительные иммунные реакции и реакции на инородные тела. Поэтому альгинат еще не подходит для применения в качестве материала-носителя для человеческих имплантов.
Другой материал-носитель для биологических клеток - агароза. Она ведет себя подобно альгинату. Агароза состоит из двух сахаридных цепей и получается из клеточных стенок красных морских водорослей. Как и альгинат, она вызывает иммунные реакции и реакции на инородные тела при применении in vivo, таким образом агароза все еще не может применяться для человеческих имплантов.
Другие каркасы основаны на фибрине. Это касается глобулярного плазменного белка, который, благодаря своей способности к "сеточной" полимеризации, среди других вещей вызывает коагуляцию крови. Однако фибрин также до сих пор не прошел тест на применение in vivo. Применение фибрина в качестве клеточного носителя в значительной степени не исследовано и должно все еще экстенсивно оцениваться. Кроме того, фибрин очень дорогой.
Другие матрицы, применяемые для культивирования биологических клеток, основаны на хитине или хитозане. Хитин формирует основной материал для производства хитозана. Для этого ацетильные группы хитина химически или ферментативно отщепляются. И хитин, и хитозан являются биополимерами, которые не отличаются точно определенным переходом. Обычно хитозан упоминается, когда степень деацетилирования превышает 40-50% и соединение растворимо в органических кислотах. Однако применение хитина и хитозана очень ограничено и аналогичным образом они еще не оправдали себя при применении для культивирования клеток. Хитин не является материалом, который вырабатывается в организме, и поэтому он постоянно представляет собой инородное тело в организме. Применение хитина в качестве клеточного носителя все еще должно быть фундаментально исследовано.
В настоящее время существуют также многочисленные синтетические каркасы, которые проходят испытания. Среди них: полимеры полилактид (PLA) и полигликолид (PGA), а также поли-L-молочная кислота PPLA (также называемая "биостекло"). Особой характеристикой PLA и PGA является их низкая растворимость в водных средах, которая улучшается только через деградацию полимерной цепи, то есть гидролиз, до низкомолекулярных олигомеров или мономеров, что таким образом приводит к эрозии этих материалов. Однако было показано, что эти полимеры не подходят для культивирования биологического материала. Из-за спонтанного гидролиза абсорбируемые полимеры разлагаются и в результате образуются органические кислоты. Остеобласты дифференцируются в кислотных условиях таким образом, что более высокое количество этих полимеров может привести к костному разрушению, а не построению кости.
На основании этих предпосылок цель, лежащая в основе изобретения, состоит в том, чтобы предложить новую композицию для культивирования биологических клеток, которая позволит избежать недостатков, известных для клеточных носителей в уровне техники. В частности должна быть предложена композиция, которая может производиться экономно в больших масштабах и при постоянном высоком качестве. Эта цель решается с помощью композиции для культивирования биологических клеток, включающей следующие параметры:
Коллаген [мас.%]: приблизительно 30-80,
Амидный азот [мас.%]: приблизительно 0,06-0,6,
Полиол [мас.%]: приблизительно 0-50,
Жир [мас.%]: приблизительно 0-20,
Зола [мас.%]: приблизительно 0-10,
Вода [мас.%]: приблизительно 5-40,
Значение рН: приблизительно 3-10,
Масса на единицу площади [г/м2]: приблизительно 10-100,
Предел прочности [Н/мм2]: приблизительно 0,5-100 или 20-100.
Такая композиция уже является коммерчески доступной в виде пленки от Naturin GmbH &Co. KG, Badeniastrasse 13, Weinheim. Номера ссылки, присвоенные этим пленкам компанией «Naturin», например: 400011899, 400023747, 400024203, 400026193, 400019485, 400000084 и 400000109.
Этот результат оказался удивительным. До сих пор это соединение применялось исключительно в пищевой промышленности, например в области производства ветчины в качестве разделяющей пленки между сеткой и мясом. Прежде всего, не ожидалось, что такие композиции особенно подходят для культивирования биологического материала.
Композиция согласно изобретению может быть воспроизведена в больших масштабах и при постоянном высоком качестве. Она выделяется своей хорошей биологической совместимостью, своей очень малой толщиной пленки, ее относительно высокой прозрачностью и ее высокой механической стабильностью, приводящей к широкому диапазону применений.
Кроме того, предпочтительно, когда глицерин или сорбит применяется в качестве полиола, который предоставляется в концентрации, равной 0-50 мас.% (глицерин) и/или 0-40 мас.% (сорбит).
У этой меры есть преимущество, состоящие в том, что применяются полиолы, которые особенно оправдали себя в указанной концентрации в качестве смачивающего агента или связующего воду материала для предотвращения высушивания. Согласно специфической конфигурации композиция включает следующие параметры:
Коллаген [мас.%]: приблизительно 50-70,
Амидный азот [мас.%]: приблизительно 0,14-0,4,
Глицерин [мас.%]: приблизительно 12-35,
Жир [мас.%]: приблизительно 3-7,
Сорбит [мас.%]: приблизительно 0-20,
Зола [мас.%]: приблизительно 0,5-3,
Вода [мас.%]: приблизительно 12-18,
Значение рН: приблизительно 5,5-8,
Масса на единицу площади [г/м2]: приблизительно 20-40,
Предел прочности [Н/мм2]: приблизительно 5-25 или 40-80.
Концентрации индивидуальных компонентов были в дальнейшем оптимизированы этим методом таким образом, чтобы композиция была дополнительно улучшена по своей пригодности для культивирования биологических клеток.
Для этого предпочтительно, чтобы жир представлял собой существенным образом растительное масло.
Применение растительного масла для сохранения композиции согласно изобретению оказалось особенно выгодным. Из-за повышенной эластичности растительное масло, очевидно, расширяет диапазон применения композиции. Применение растительных масел может также предотвратить прогорклость, таким образом, облегчая изготовление и хранение композиции. Ясно, что минимальное количество остаточного животного жира не снижает преимущества растительного масла.
Согласно особенно предпочтительной конфигурации значение рН композиции согласно изобретению составляет приблизительно от 5,0 до 8,0, предпочтительно от 6,8 до 8,0, более предпочтительно приблизительно от 7,0 до 8, наиболее предпочтительно приблизительно от 7,2 до 7,5.
Как обнаружили изобретатели, культивирование биологических клеток особенно успешно при указанных значениях рН. Таким образом, композиция показывает, что значение рН лежит в физиологическом диапазоне и поэтому обеспечивает среду, которая широко напоминает естественную среду биологических клеток. Композиции, коммерчески доступные, например у Naturin GmbH & Со. KG, обычно имеют значение рН, составляющее приблизительно 4,8. В такой кислой среде невозможно, например, культивирование биологического материала, чувствительного к кислотам. Желаемое значение рН может быть откорректировано с помощью инкубации композиции в, например, кальций или магний-содержащих фосфатных буферах, тогда как другие традиционные буферные растворы, известные специалистам, квалифицированным в данной области, являются в равной степени подходящими.
На фоне этих предпосылок другая цель настоящего изобретения также касается способа улучшения композиции со следующими параметрами:
Коллаген [мас.%]: приблизительно 30-80,
Амидный азот [мас.%]: приблизительно 0,06-0,6,
Полиол [мас.%]: приблизительно 0-50,
Жир [мас.%]: приблизительно 0-20,
Зола [мас.%]: приблизительно 0-10,
Вода [мас.%]: приблизительно 5-40,
Значение рН: приблизительно 3-10,
Масса на единицу площади [г/м2]: приблизительно 10-100,
Предел прочности [Н/мм2]: приблизительно 0,5-100, или 20-100, по ее пригодности для культивирования биологических клеток, которое включает следующие шаги:
(1) Предоставление композиции, и
(2) Коррекция значения рН до приблизительно 5,0 или 8,0, предпочтительно до приблизительно 6,8-8,0, более предпочтительно до приблизительно 7,0-7,8, наиболее предпочтительно до приблизительно 7,2-7,5.
Благодаря этому "методу оптимизации" коммерчески доступные пленки такие как, например, предлагаемые Naturin GmbH & Со.KG, демонстрируют четко улучшенную пригодность для применения в качестве носителей клеточной культуры. Шаг (2) предпочтительно выполняется как инкубация композиции в буферном растворе со значением рН, равным приблизительно 7,2-7,5.
Способ оптимизации предпочтительно включает дополнительный шаг (3), во время которого композиция инкубируется с сильно растворимыми в жирах веществами.
У этой меры есть преимущество, состоящее в том, что, например, растворимые в жирах вещества экстрагируются при применении 100%-ного ацетона. Таким образом, может быть дополнительно улучшено качество композиции для культивирования биологических материалов.
Кроме того, во время метода оптимизации согласно изобретению предпочтительно, чтобы шаг (3) включал шаг (3.1), во время которого композиция промывается в буферном растворе.
Во время этого шага (3.1) остающиеся сильно растворимые в жирах вещества и, в случае необходимости, другие загрязняющие остатки удаляются таким образом, чтобы мембрана была затем готова к применению или могла бы быть в дальнейшем обработана.
Предпочтительно метод оптимизации согласно изобретению также включает дополнительный шаг (4), во время которого происходит высушивание композиции.
У этой меры есть преимущество, состоящее в том, что она служит для получения продукта, который прост в обращении и который может храниться почти неопределенное время.
Согласно предпочтительной конфигурации композиция согласно изобретению формируется как плоская пленка.
Благодаря этой мере композиция предоставляется в виде, которая особенно подходит и для применения для культивирования клеток, и для имплантации биологического материала в организм. Композиция согласно изобретению, формируемая в виде пленки, может быть легко разрезана или выдавлена до любой формы или размера.
На фоне этих предпосылок композиция предпочтительно формируется в виде носителя, или матрицы, или "каркаса", соответственно, для применений в области культивирования клеток, или в качестве носителя для имплантации биологического материала в организм, предпочтительно стволовых клеток и клеток-предшественниц либо определенных клеток тканей. Благодаря ее биологической совместимости и поддерживающих сцепление свойств, она может применяться для иммобилизации клеток. Это может иметь большое значение в области регенеративной медицины, например в разработке клеточных культур для связок, сухожилий, костей и хряща. Однако, кроме того, она может также применяться для других тканей. Поэтому она также подходит для применения в качестве повязки для раны. Дополнительно, композиция может применяться, например, в области косметики в качестве повязки для кожи. Кроме того, благодаря химическим композициям коллагенов, она особенно подходит для связывания влияющих на клетку компонентов, таких как, например, факторы роста.
Особое преимущество состоит в том, что плоская пленка согласно изобретению удерживается на плоских синтетических поверхностях после высушивания без любой дополнительной помощи. В результате пленка, например с пластиковой поверхностью клеточной культуры, позволяет получить единицу без пузырей, которая остается неповрежденной даже во время клеточного культивирования низкого уровня штаммов. Таким образом, в клеточной культуре могут быть устранены воздействующие на клетки склеивание и фиксация. Однако, для определенных применений, эта связь может быть разорвана с помощью механических инструментов, например пинцета, не вызывая повреждений, и пленка может быть удалена из чашки с клеточной культурой вместе с клетками, растущими на ней.
В качестве альтернативы композиция согласно изобретению формируется в виде трубчатой оболочки.
Эта конфигурация является особенно подходящей для применения в качестве резервуаров для клеток и вещества для тестов имплантации.
В сухих условиях плоская пленка или трубчатая оболочка согласно изобретению имеет толщину, составляющую приблизительно 5-200 мкм, предпочтительно 10-100 мкм, более предпочтительно 15-30 мкм, более предпочтительно приблизительно 20 мкм и наиболее предпочтительно приблизительно 15 мкм.
У этой меры есть преимущество, состоящее в том, что предоставляется особенно тонкая пленка или оболочка, которая является прозрачной и может также быть исследована под микроскопом. Это не касается основанных на коллагене клеточных носителей, известных в современной технологии. Согласно изобретению толщина определяется в высушенном состоянии. Термин "высушенный" здесь эквивалентен высушенному на воздухе таким образом, чтобы абсолютная остаточная влажность составляла приблизительно 10%-15%.
Согласно предпочтительной дальнейшей разработке композиция стерилизуется облучением, которое предпочтительно производится посредством ионизирующего облучения или, более предпочтительно, посредством бета- и/или гамма-облучения.
У этой меры есть преимущество, состоящее в том, что загрязняющие организмы уничтожаются и можно избежать загрязнений биологического материала, который культивируется. Способ радиационной стерилизации предлагает преимущество, состоящее в том, что чувствительный к повышенной температуре коллаген остается неповрежденным.
На фоне этих предпосылок способ оптимизации согласно изобретению включает дополнительный шаг (5), во время которого имеет место радиационная стерилизация соединения.
Кроме того, предпочтительно, чтобы композиция согласно изобретению также снабжалась красителем, предпочтительно флюоресцентным абсорбирующим красителем.
Для диагностики in vitro композиция может окрашиваться по-разному. При выполнении процесса окрашенные флуоресцентным красителем клетки, которые проникли через пленку, могут быть установлены во время так называемых тестов на пенетрацию для фармакологических, физиологических или биологических тестов, потому что, например, абсорбирующий флюоресценцию цвет композиции покрывает флуоресцентные клетки, которые не пенетрировали. Затем только клетки, которые пенетрируют, светятся во время микроскопического теста на флюоресценцию.
Другой предмет настоящего изобретения представляет собой способ для культивирования биологического материала, использующий следующие шаги:
(1) Обеспечение композиции, подходящей для применения в качестве носителя для биологического материала,
(2) Контакт биологического материала с композицией, и
(3) Инкубирование композиции с биологическим материалом при условиях культивирования,
посредством чего композиция, вышеупомянутая в связи с применением согласно описанному изобретению, применяется в качестве композиции.
Другая цель настоящего изобретения касается способа имплантации биологического материала в организм, включающего следующие шаги:
(1) Обеспечение композиции, подходящей для применения в качестве носителя для биологического материала,
(2) Контакт биологического материала с композицией, и
(3) Введение биологического материала в контакт с композицией в организме, посредством чего композиция, вышеупомянутая в связи с применением согласно описанному изобретению, применяется в качестве композиции.
Другой предмет настоящего изобретения касается применения композиции согласно изобретению для определения инвазии и потенциала к метастазированию опухолевых клеток.
Стандартные методы тестов in vitro на инвазию и потенциал к метастазированию опухолевых клеток основаны на следующем принципе: способность к пенетрации опухолевых клеток определяется с помощью перфорированной и неразлагающейся синтетической пленки. В тестах in vitro эта система, например, служит для измерения эффекта антиканцерогенных фармацевтических препаратов на способность клеток к пенетрации. Однако инвазивность опухолевой клетки зависит не только от миграционной способности через промежутки (поры) в соединительной ткани, но также и от способности клеток к ферментативной деградации или восстановлению компонентов соединительной ткани, которые главным образом состоят из коллагенов. Из-за своей низкой толщины, однородности и стандартизированного производства биологическая коллагеновая пленка могла бы служить для разработки новой системы фарма-теста для определения протеолитической способности культивируемых клеток. Для этой системы клетки культивируются в двухкамерной системе. Эти две камеры отделены с помощью коллагеновой пленки. Клетки, которые будут исследованы, культивируются в верхней камере на пленке. После соответствующего периода культивирования количественно определяется число клеток, мигрировавших через коллагеновую мембрану на нижнюю часть мембраны. Поэтому применение композиции согласно изобретению открывает новую область в диагностике in vitro.
Композиция согласно изобретению может также применяться для определения протеолитической активности неопухолевых клеток и их инвазивного потенциала, например, как тест на витальность для стволовых клеток.
Ясно, что характеристики, и упомянутые выше, и объясненные ниже, не только применимы в соответствующей данной комбинации, но также и в других комбинациях или при изолированном подходе, не уходя из области применения настоящего изобретения.
Изобретение теперь объясняется более подробно на основе вариантов осуществлений, из которых возникают дальнейшие критерии и преимущества, а также характеристики изобретения. Ссылки делаются на приложенные чертежи, которые показывают следующее:
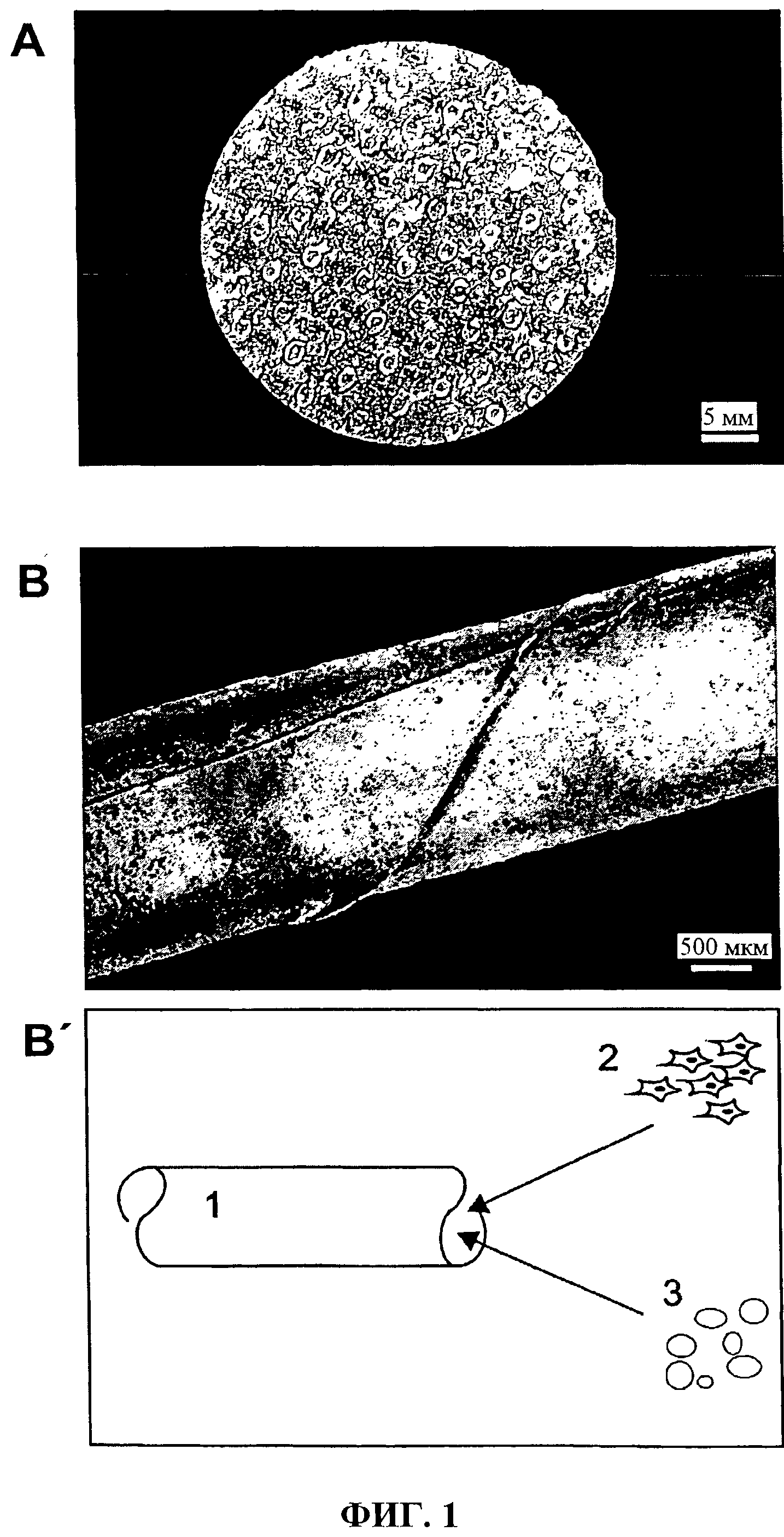
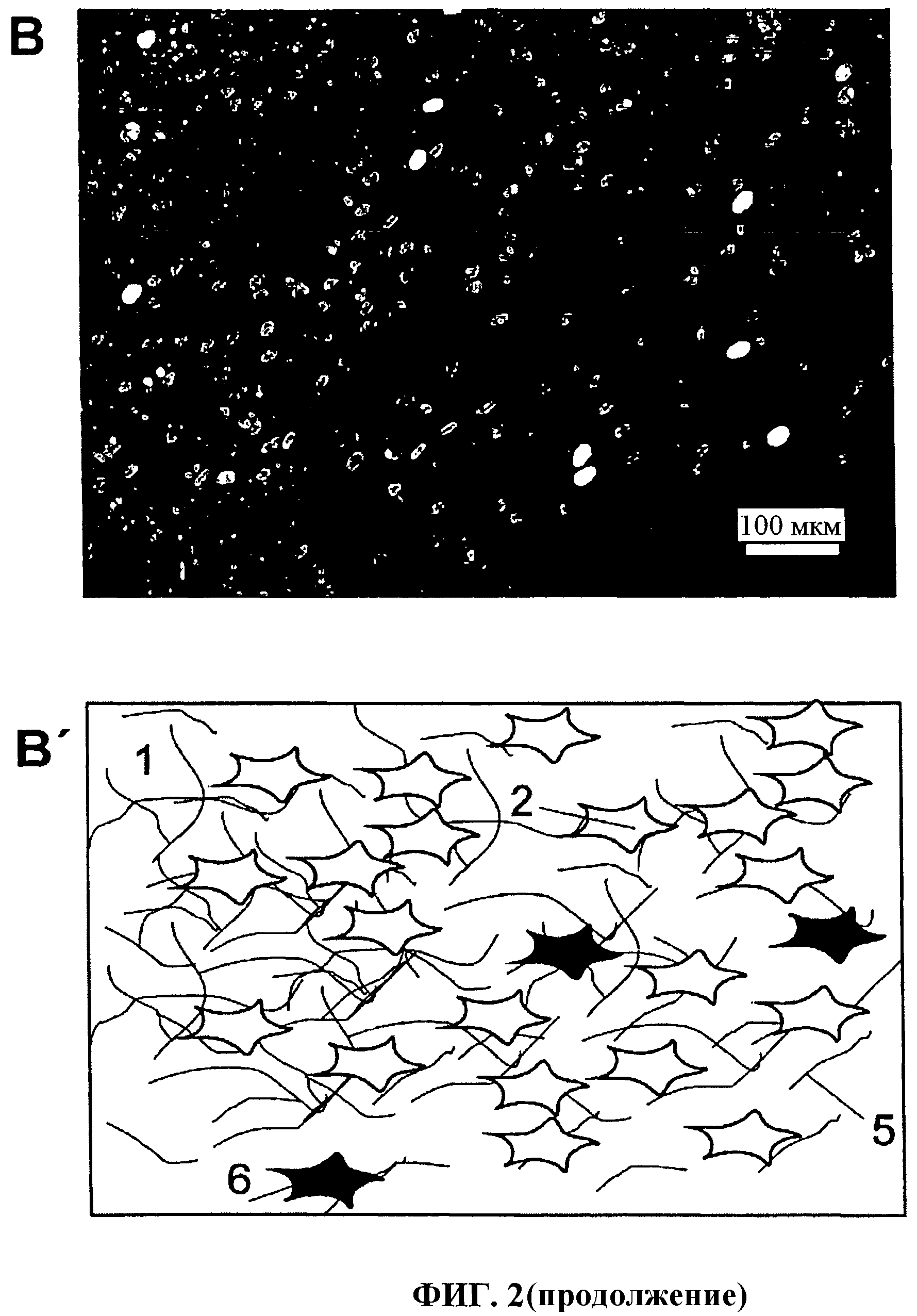
Фиг.1 показывает коллагеновую вкладку с толщиной равной 20 мкм для группы клеточной культуры с шестью полостями (А), трубчатую оболочку согласно изобретению в качестве клеточного резервуара для тестов по имплантации (В, В').
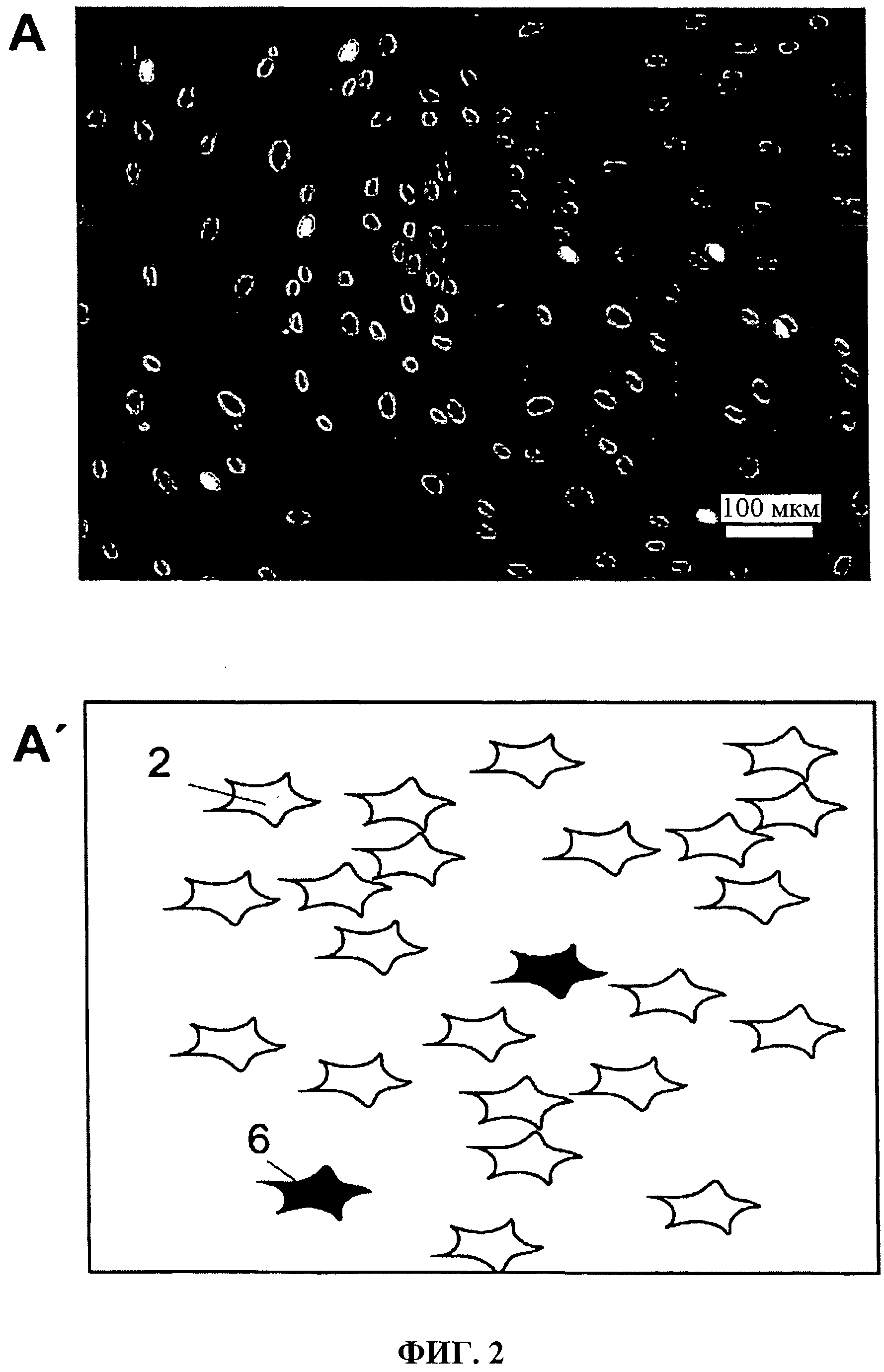
Фиг.2а и 2b показывают результат испытания на пролиферацию BrdU на человеческих мезенхимальных стволовых клетках (hMSC). Иммуноцитохимический анализ BrdU-положительных клеток. Клетки были выращены на обычной синтетической поверхности для культивирования (А, А') и на коллагеновой матрице согласно изобретению и инкубировались с BrdU в течение одного часа (В, В').
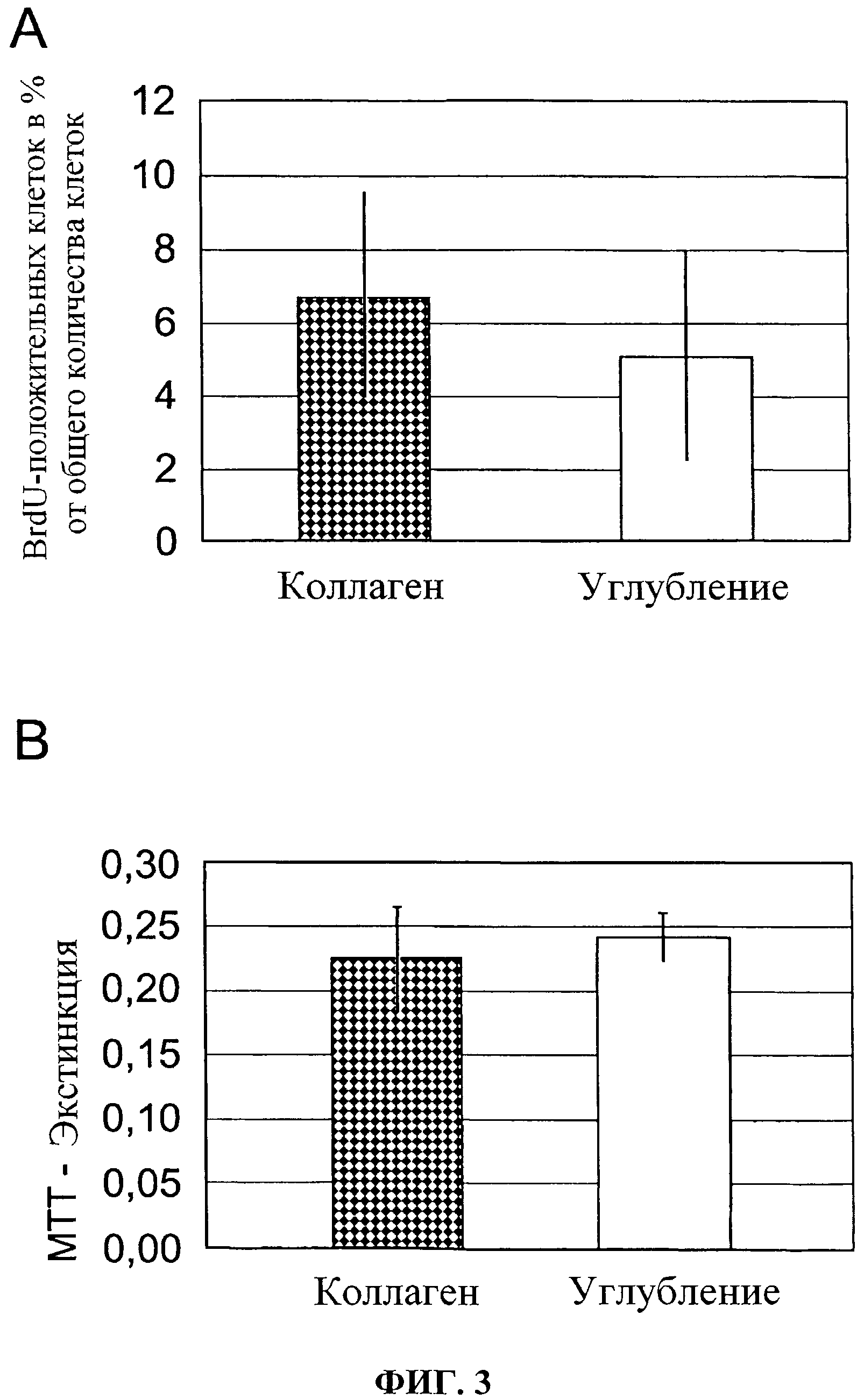
Фиг.3 показывает результат испытания на пролиферацию BrdU (А) и теста МТТ (В) на человеческих мезенхимальных стволовых клетках (hMSC), которые были выращены на коллагеновой матрице и обычной синтетической поверхности для культивирования. Представлены средние значения с соответствующими стандартными отклонениями.
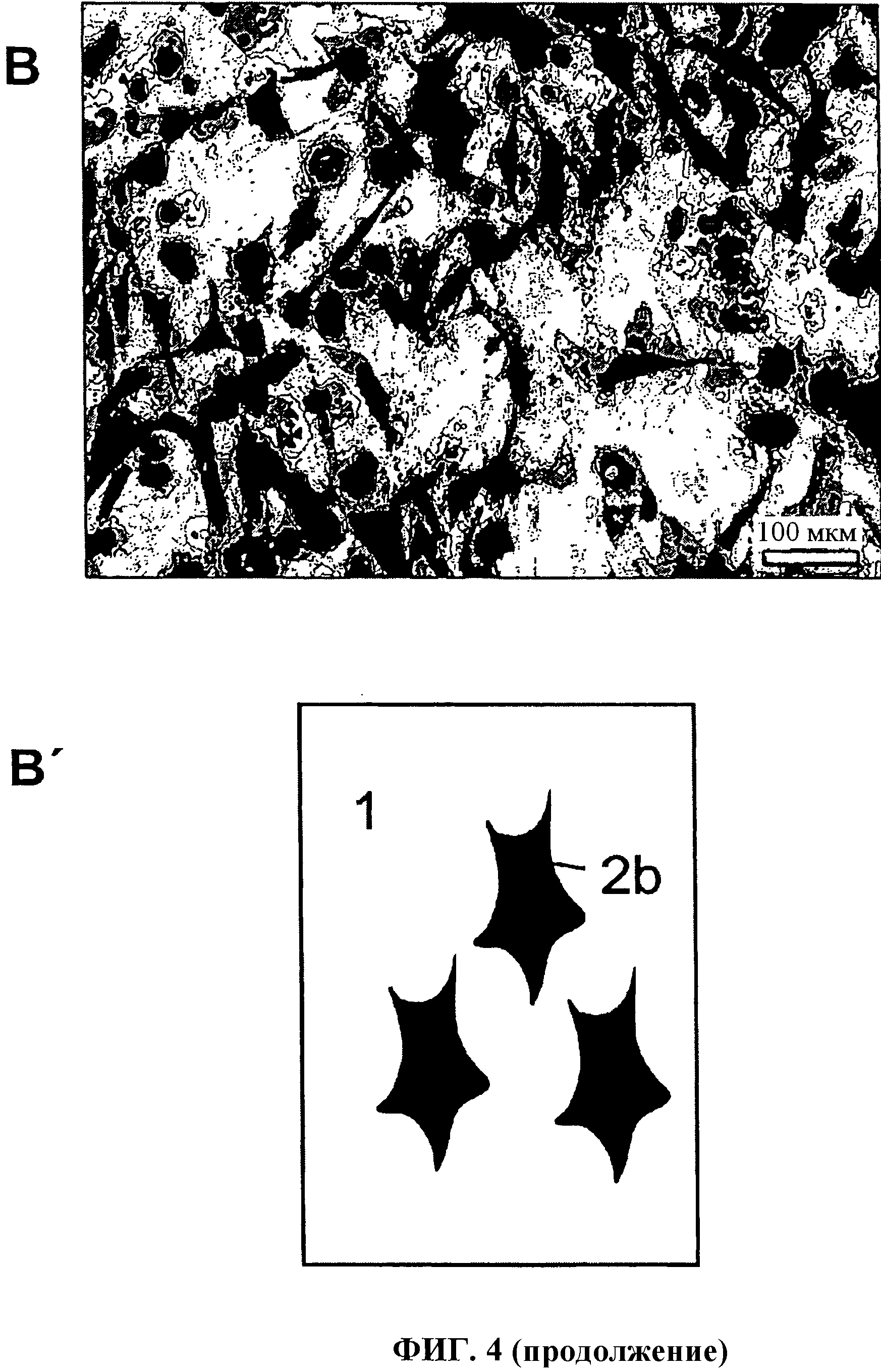
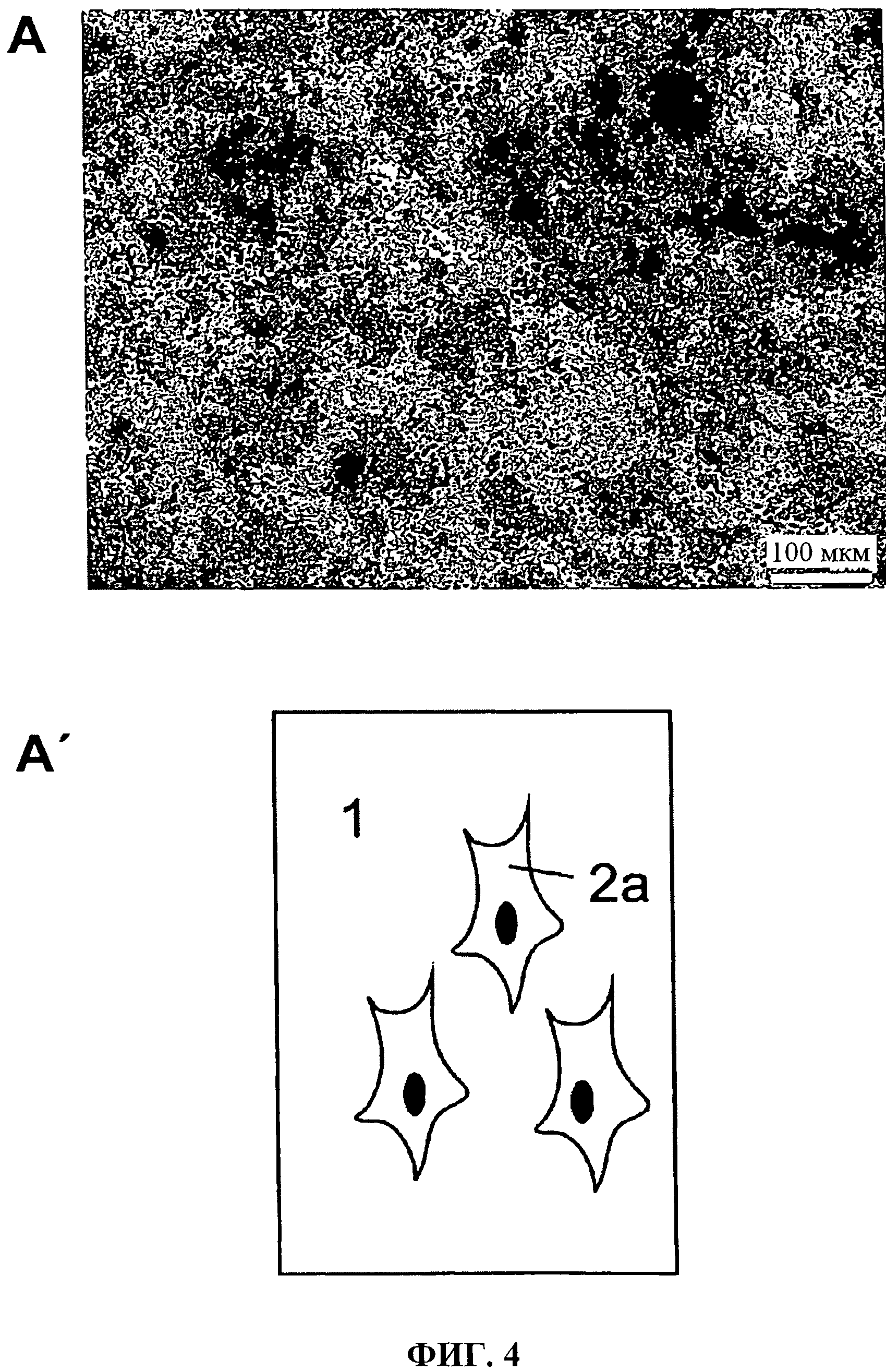
Фиг.4а и 4b показывают: вид сверху минерализованной коллагеновой матрицы, которая была выращена вместе с hMSCs при условиях остеогенного дифференцирования (А, А'); активность щелочной фосфатазы из эмбриональных (Е18) мышиных остеобластов из свода черепа после двухнедельной фазы культивирования на коллагеновой матрице (В, В').
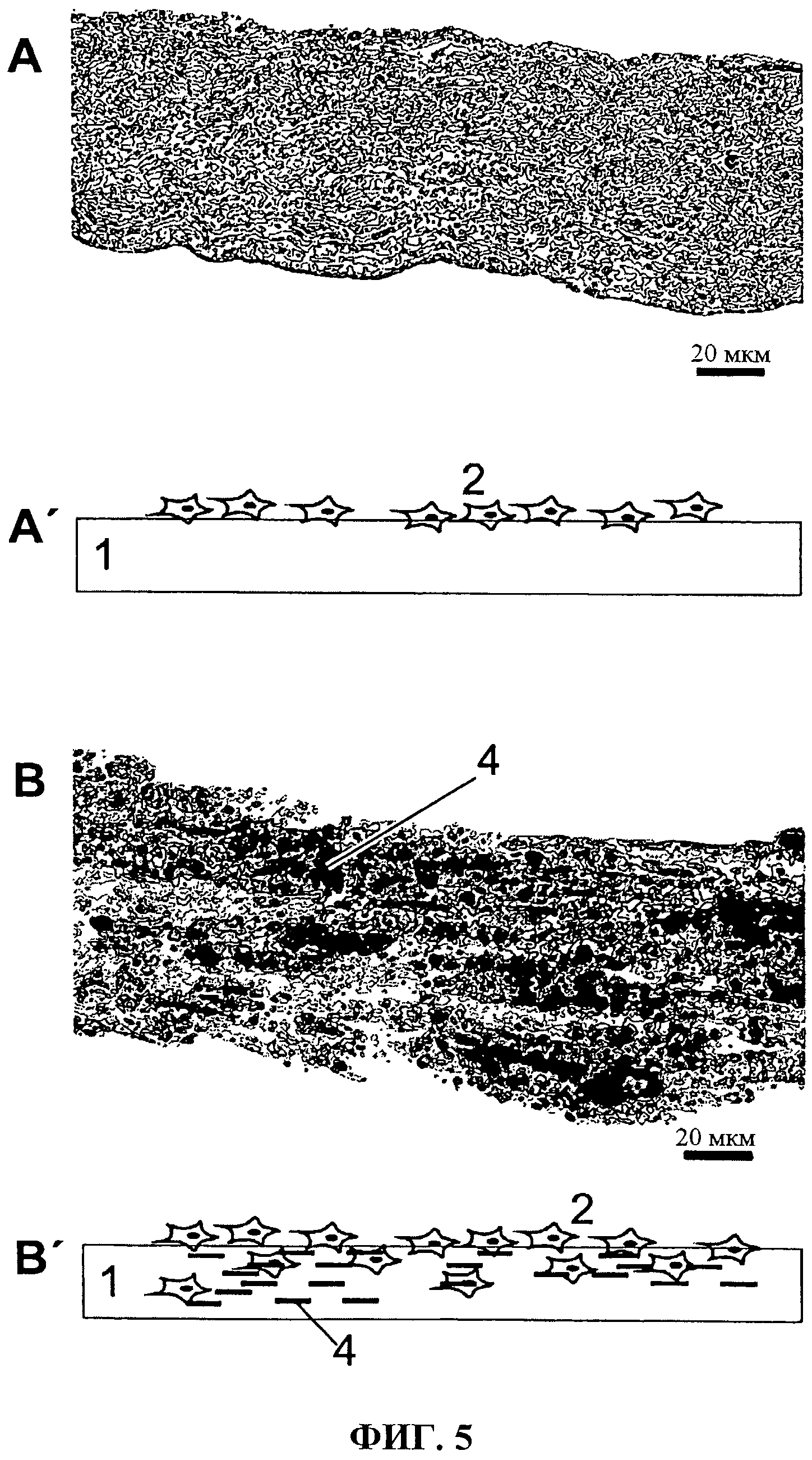
Фиг.5 показывает парафиновое поперечное сечение через коллагеновую матрицу, которая была выращена с эмбриональными (Е18) мышиными остеогенными предшественниками из свода черепа при условиях пролиферации (А, А') и условиях остеогенного дифференцирования (В, В'). Иллюстрации В и В' разъясняют непрерывную минерализацию 3-мерной матрицы. Способность к интеграции и пенетрации зависит от типа клетки.
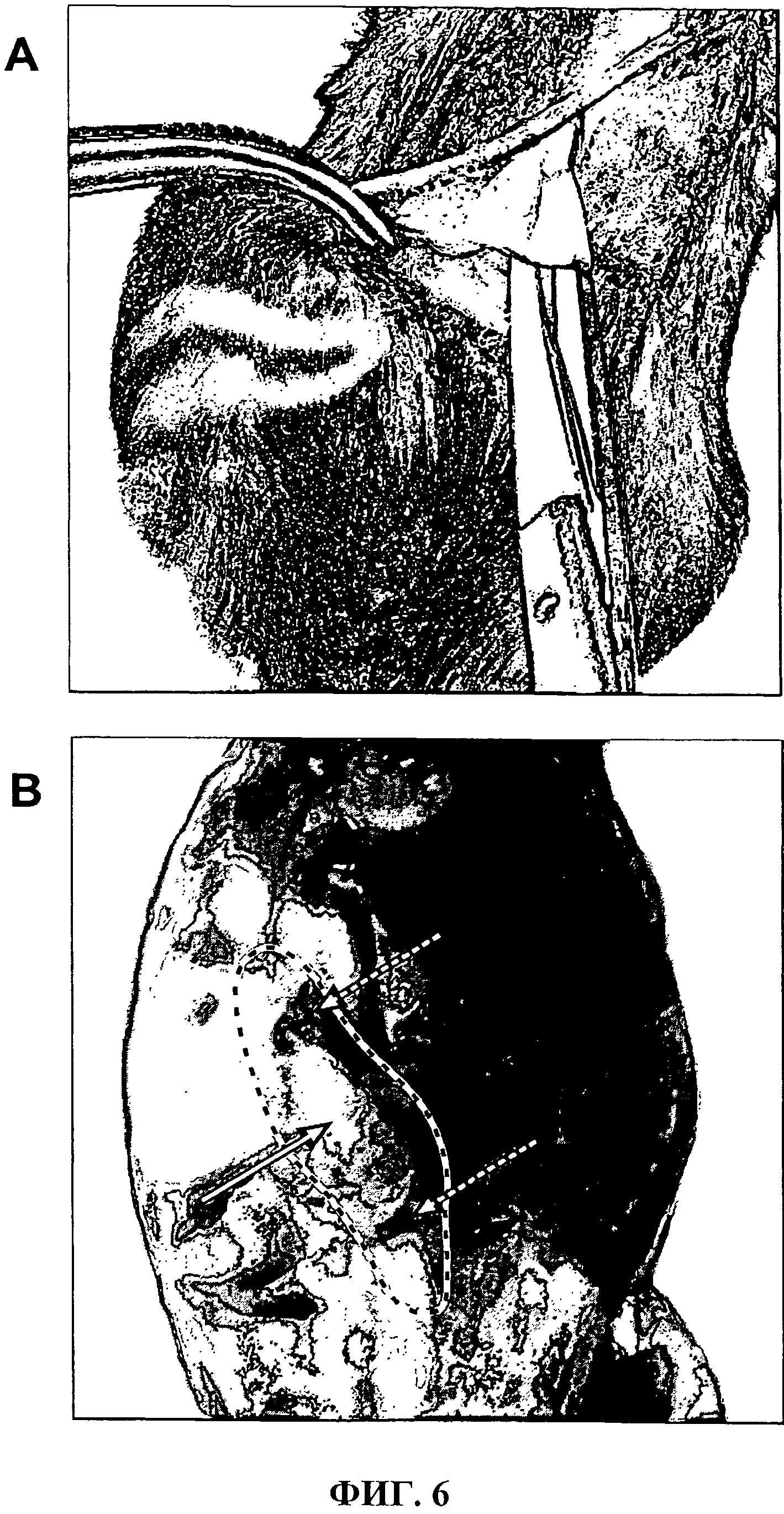
Фиг.6 показывает имплантацию трубчатой оболочки без клеток согласно изобретению в С57/ВL6-мышиную (А) и имплантированную матрицу спустя шесть недель у голых мышей (В).
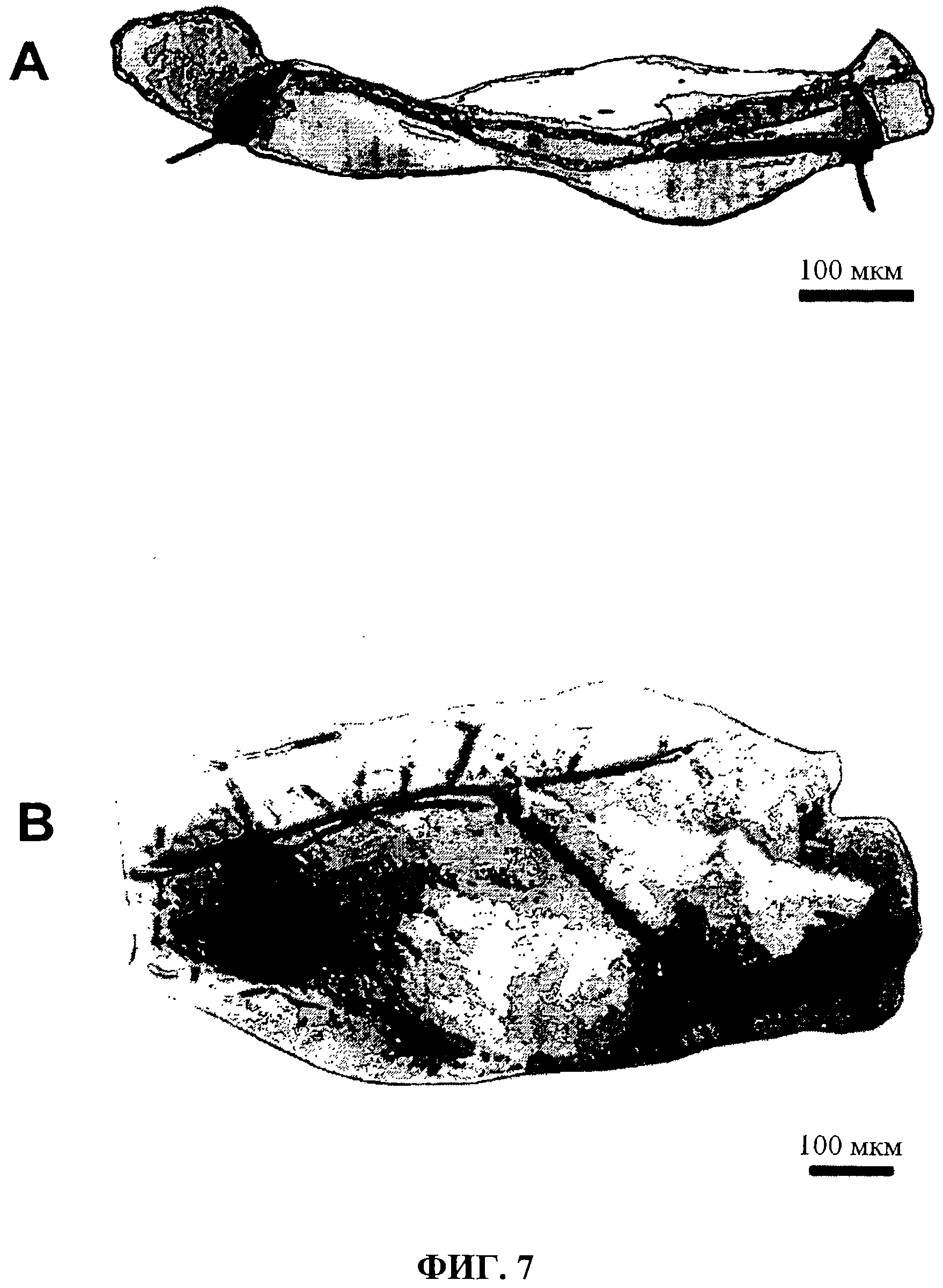
Фиг.7 показывает трубчатую пленку согласно изобретению непосредственно до имплантации, которая колонизировалась в течение одного дня с hMSCs (А), а также эксплантированный имплант, выращенный в соединительной ткани после шести недель (В).
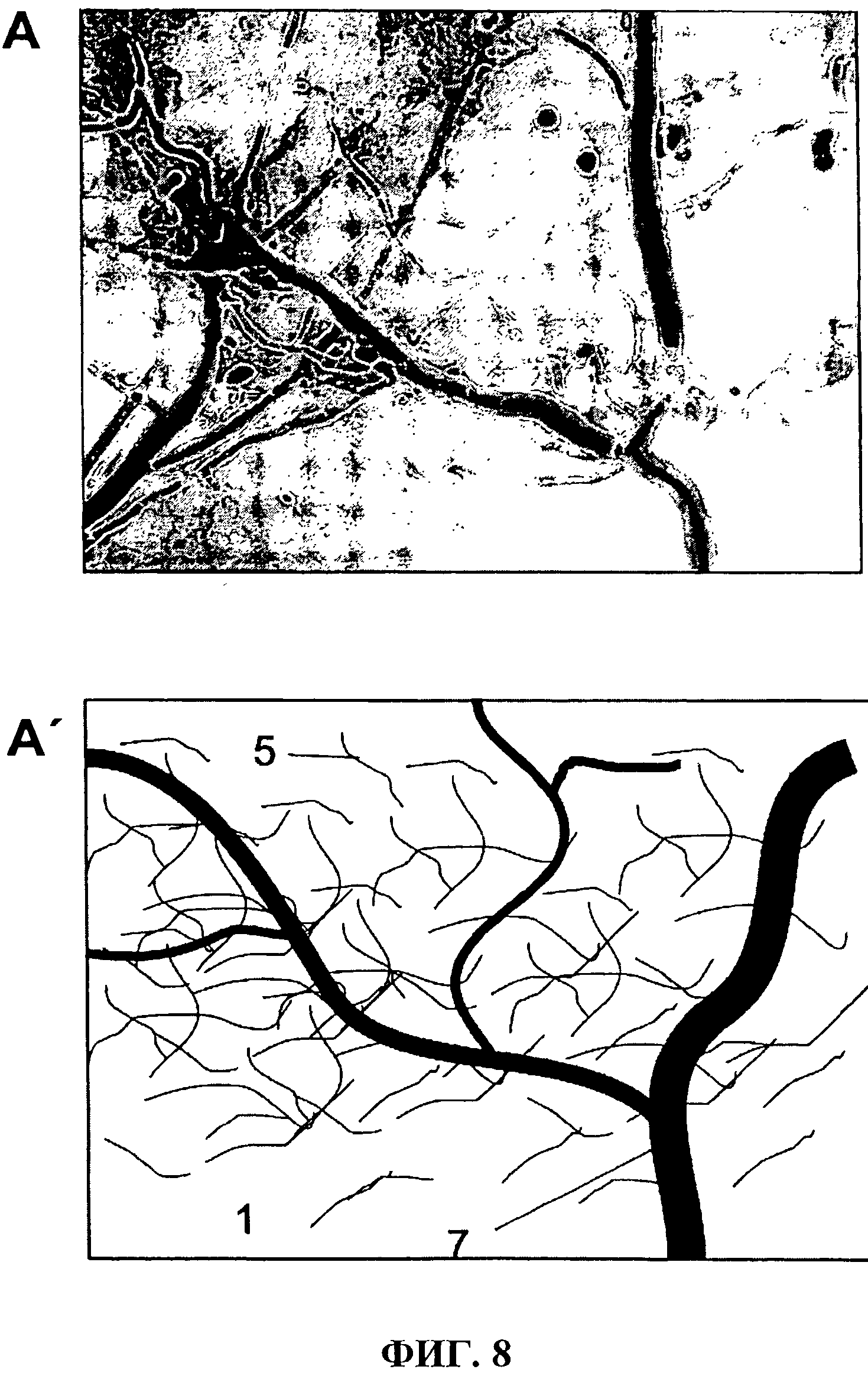
Фиг.8 показывает трубчатую пленку согласно изобретению после эксплантации спустя шесть недель в С57/ВL6-мышиных в увеличенной презентации. Кровеносные сосуды, которые проникают в коллагеновую пленку, четко опознаваемы.
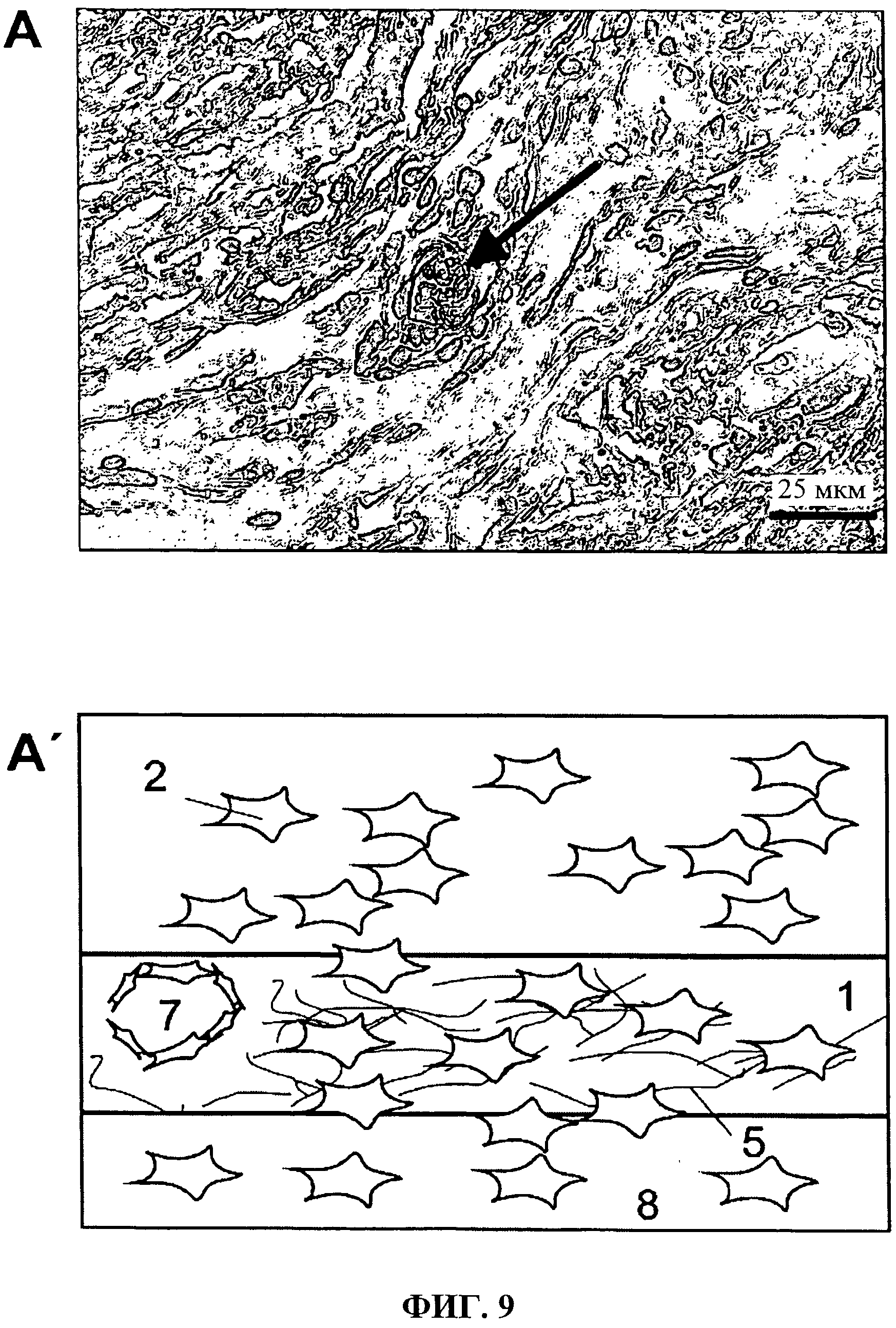
Фиг.9 показывает, что Не-окрашивание на парафиновом срезе, который был сделан из эксплантированного импланта.
Варианты осуществления
1. Коллаген-содержащая композиция
Изобретатели использовали семь пленок, коммерчески доступных от Naturin GmbH & Со.KG, и обнаружили, что они были подходящими для применения согласно изобретению. Параметры коммерчески доступных испытуемых пленок перечислены в Таблице 1.
|
1.1. Производство композиций в виде пленки согласно изобретению
Куски бычьей шкуры служат в качестве исходного материала для производства композиции согласно изобретению в виде пленки, которая, относительно своей прослеживаемости и гигиенических стандартов, отвечает требованиям, определенным в Постановлении (ЕС) №853/2004.
Эти куски бычьей шкуры грубо механически разрезают и в нескольких шагах метода сначала промывают водой, а затем разлагают с помощью щелочи. Уровень разложения может быть различен и зависит от факторов, таких как продолжительность обработки, концентрация щелочной среды (значение рН) и температура. Известковая вода, раствор гидроксида натрия или смесь этих двух компонентов обычно применяются для установления щелочной среды. Однако в равной степени подходят другие щелочные комбинации. Щелочная обработка выполняется при значении рН, например, 12.5 и может варьировать, например, от 15 часов до более 150 часов в зависимости от намеченной интенсивности разложения шкуры. Амидный азот является доказанным возможным параметром для аналитического отслеживания уровня разложения коллагеновой ткани: чем более интенсивное разложение, тем ниже амидный азот.
После достижения желаемого уровня разложения добавляется кислота и, впоследствии, вода неоднократно используется для ополаскивания. Подкисление обычно делается с помощью соляной кислоты в течение 6-10 часов при достижении значения рН<2, предпочтительно <1. Применение других кислот также возможно. Значение рН впоследствии увеличивают от 2,6 до 3,3 посредством многочисленных процедур ополаскивания с помощью воды.
Затем полученные "коллагеновые затверделости" механически обрабатывают посредством измельчения и спрессовывания измельченного материала через перфорированные диски с постепенно уменьшающимися размерами отверстия в гелеподобную, вязкоупругую материю.
1.1.1. Разработка плоской пленки (композиция №1)
Эту "сконцентрированную" коллагеновую массу переносят в мешалку, в которую добавлены глицерин, вода и кислота. В то же самое время значение рН корректируют до предпочтительно 2,6-3,2, и процент сухого коллагена приспосабливают до 1,6 мас.%-2,5 мас.%. Смесь впоследствии пропускают через гомогенизатор, аэрируют и затем льют через носик на ленточный конвейер, на котором получающаяся гелевая пленка проходит через туннельную сушилку. Перед входом в сушилку ее окуривают, предпочтительно используя аммиак, таким образом, поднимая значение рН геля. В конце сушилки высушенная пленка проходит через зону регидратации прежде, чем она будет завернута.
1.2. Разработка трубчатой оболочки (композиции №№2-7)
Вязкоупругую коллагеновую массу из 1.1 переносят в формовочную сушилку, в которую добавлен глицерин в зависимости от формулы. Значение рН и процент сухой материи корректируются одновременно с добавлением воды и кислоты.
Гомогенную массу впоследствии вытесняют через кольцевой разрезной носик, таким образом получая бесконечную трубчатую оболочку. Одновременная инъекция поддерживающего воздуха защищает трубчатую оболочку от разрушения.
Транспорт выдутой трубчатой оболочки через линию экструзии продолжается по-разному в зависимости от типа трубки, которая производиться. В принципе есть возможность пропускать через содержащий химические вещества душ и высушивающие сегменты в переменной последовательности. В конце линии экструзии высушенная трубчатая оболочка плоско укладывается между резиновыми валиками и наматывается в этом состоянии на шпульки.
Трубчатые пленки, полученные таким образом, подвергаются тепловой обработке, посредством чего они приобретают необходимую механическую стабильность для их более позднего использования. Композиции согласно изобретению в пленочной или трубчатой форме могут также быть сделаны на основе других источников коллагена, посредством чего обработка коллагенового геля может отличаться по каким-то деталям от предыдущих описаний. На основании коллагена свиной шкуры, например, подходящий путь должен быть найден для уменьшения содержания жира, который, например, описан в DE 100 60 643 и ЕР 1 423 016. Применение естественных кишечников для получения коллагеновой материи, например, описано в ES 2 017 564. Эти документы включены в раскрытие текущей заявки путем ссылки.
1.2. Коррекция значения рН
Значение рН корректируется с помощью содержащего кальций и магний фосфатного буфера [буферизированный фосфатом физиологический раствор (PBS) с Са++ и Mg++(РАА Н15-001)], который корректирует значение рН основанной на коллагене пленки в физиологической области от рН 7,2 до рН 7,5. Для этого коллагеновую пленку промывают буферной системой посредством встряхивания в течение 5 дней. Два раза в день буфер меняется.
Альтернативно, коллагеновую мембрану можно также погрузить на час в фосфатный буфер, содержащий глицерин со значением рН 7,3 (фосфатный буфер: 15,6 г KH2PO4, 71,3 г Na2HPO4×2 Н2О и 492,9 г глицерина растворяют в 7722 г дистиллированной воды). Впоследствии обработанную пленку оставляют стечь и помещают в ширильную раму, где она сохнет в течение ночи при комнатной температуре.
1.3. Дальнейшая дополнительная обработка
После короткого установления равновесия в дистиллированной воде коллагеновую мембрану обрабатывают 100%-ным ацетоном, чтобы извлечь растворимые в жирах вещества и расщепить растворимые в воде белки. После удаления ацетона высушенную мембрану промывают при отрицательном давлении 3 раза в течение одного часа, используя содержащий кальций и магний фосфатный буфера (в г/л: КСl 0,2; КН2РO4 0,2; NaCl 8,0; Na2HPO4, безводный 1,15; СаСl2·2Н2О в Н15-001 0,132; MgCl2·2H2O в Н15-001 0.1). Чтобы устранить буферную соль, процедуру промывки повторяют 3 раза в течение одного часа в дистиллированной воде.
1.4. Высушивание
Полученную мембрану или пленку высушивают. Это можно сделать в сушильном шкафу при 60°С, посредством чего может быть достигнуто значение влажности <5%, например 3%. Мембрана может также быть высушена при комнатной температуре, если ее оставить просто сушиться на воздухе так, чтобы она наконец приспособилась к относительной влажности воздуха в зависимости от балансирующей влажности мембраны или пленки, которая обычно составляет приблизительно от 8 мас.% до приблизительно 13 мас.%.
1.5. Формирование и радиационная стерилизация
Высушенные полученные коллагеновые мембраны или пленки могут быть разрезаны любым способом или продавлены, например, в DIN A5 листы. Затем эти листы стерилизуют с помощью бета- или гамма-облучения в 25 кГр или 50 кГр.
Коллагеновая пленка может, например, быть закончена как вставка для синтетических углубляющихся чашек любого типа конструкции, например микротитровальные планшеты, или произведена в виде предпочтительно трубчатых оболочек без шва с диаметром <2 мм, приблизительно 12 мм до нескольких сантиметров. Тепловая сварка или склеивание пленки также возможно.
1.6. Параметры произведенной композиции согласно изобретению в форме пленки
Параметры различных плоских коллагеновых пленок представлены в Таблице 2, которые были достигнуты в соответствии с процедурами, описанными в 1.1.1, тогда как шаги, описанные в соответствии с разделом 1.3, не выполнялись.
|
(*) Для каждого образца от 1 до 6 было 5 подтестов: без стерилизации (а), бета-облучение 25 кГр (b), бета-облучение 50 кГр (с), гамма-облучение 25 кГр (d) и гамма-облучение 50 кГр (е)
Применялись следующие методы анализа:
Коллаген через гидроксипролиновое регулирование / аналог амидного азота ЕР 1676595 (Geistlich Snhne AG) / Глицерин путем ВЭЖХ / растительное масло через экстракцию в аппарате Сокслета / Сорбит путем ВЭЖХ / Гравиметрическая зола после сжигания в муфельной печи в течение 5 часов при 600°С) / Гравиметрическое содержание воды после высушивания в сушильном шкафу при 150°С / значение рН путем отрезания пленки маленькими частями, помещения части в 5% раствор NaCl и измерения с помощью стеклянного электрода через 10 минут / масса на единицу площади путем взвешивания части 10 см × 10 см пленки с балансирующей влажностью / пределом прочности вдоль и поперек с помощью универсальной машины тестирования UTS (модель 3/205, UTS Testsysteme GmbH) после кондиционирования при 21°С/60% относительной влажности выдавленного образца и скорости пересечения 100 мм/мин.
2. Культивирование биологического материала
2.1. Конфигурация композиции
Фиг.1 показывает коллагеновую пленку согласно изобретению с толщиной 20 мкм, формируемую как вставка для полости группы клеточной культуры (А). Трубчатая оболочка показана на иллюстрации части (В), которая схематично представлена на иллюстрации части (В'). Трубчатая оболочка показана под референтным номером 1. Клетки показаны под референтным номером 2, которые могут быть помещены во внутрь оболочки. Активное вещество или факторы роста показаны под референтным номером 3, которые также могут быть помещены в оболочку, чтобы оказывать влияние на биологические клетки.
2.2. Пролиферативное поведение человеческих клеток
Пролиферативное поведение человеческих клеток, мезенхимальных стволовых клеток MS С и линии человеческих клеток SaOS2 на коллагеновой пленке согласно изобретению не показывало различия по сравнению с обычными процедурами культивирования в пластмассовом контейнере для культур; Фиг.2. Клетки культивировались на обычной пластиковой поверхности для культивирования (А) и на коллагеновой пленке согласно изобретению (В) и инкубировались с BrdU в течение одного часа. Схематическая иллюстрация (В') показывает коллагеновую пленка в 1, клетки в 2, коллагеновые волокна в 5 и BrdU-положительные клетки в 6. Статистическая оценка испытания на пролиферацию BrdU (А) и тест на витальность МТТ (В) представлены на Фиг.3.
Впоследствии никакие существенные различия не показаны между коллагеновой пленкой согласно изобретению и обычными пластиковыми контейнерами.
2.3. Биологическая совместимость
Эмбриональные мышиные предшественницы из свода черепа и hMSCs культивировались на этой матрице при условиях остеогенного дифференцирования для оценки биологической совместимости коллагеновой пленки согласно изобретению. Результат представлен на Фиг.4.
Иллюстрация части (А) показывает обзор минерализованной коллагеновой матрицы согласно изобретению, которая культивировалась вместе с hMSCs при условиях остеогенного дифференцирования. Иллюстрация части (В) показывает активность щелочного фосфата эмбриональных мышиных остеобластов из свода черепа после 2-недельного периода культивирования на коллагеновой фольге согласно изобретению. Схематические иллюстрации части (А') и (В') показывают коллагеновую мембрану на 1, клетки на 2а и клетки после обнаружения активности клеточного щелочного фосфата на 2b.
Обнаружение активности щелочного фосфата и клеточной минерализации разъясняет потенциал дифференцирования культивируемых клеток и, таким образом, биологическую совместимость матрицы согласно изобретению.
2.4. Культивирование трехмерных тканевых структур
Парафиновые поперечные срезы делаются из колонизированных коллагеновых пленок. Они были гистохимически проанализированы относительно минерализации. Результат представлен на Фиг.5. Иллюстрация части (А, А') показывает парафиновый поперечный срез при пролиферативных условиях, иллюстрация части (В, В') - при условиях остеогенного дифференцирования. 1 касается коллагеновой пленки, 2 - клеток, а 4 - отложений нитрата серебра.
С одной стороны, этот эксперимент показывает высокий потенциал минерализации и, с другой стороны, - способность к интеграции клеток в пределах трехмерной пленки/матрицы. С помощью этой матрицы согласно изобретению культивирование трехмерных тканевых структур является возможным.
2.5. Имплантации
Эксперименты по имплантации были выполнены на голых мышах и мышах C57/BL6. Для этого загруженные клетками трубчатые оболочки согласно изобретению были имплантированы в участок между подкожным жиром и брюшиной. Результат этого эксперимента показан на Фиг.6. Иллюстрация части (А) показывает имплантацию, а иллюстрация части (В) показывает имплантированную матрицу согласно изобретению после шести недель в голой мыши. Стрелка указывает на загруженную клетками трубчатую оболочку согласно изобретению. С помощью точек фиксации трубчатая оболочка со вставленными неразлагаемыми микроорганизмами нитями может также быть легко расположена на иллюстрации части (В); пунктирная стрелка. На иллюстрации части (В) препарат четко показывает все еще существующую трубчатую оболочку согласно изобретению.
Фиг.7, иллюстрация части (А) показывает трубчатую оболочку согласно изобретению непосредственно до имплантации, которая была колонизирована в течение одного дня с hMSCs. Иллюстрация части (В) показывает эксплантированный имплант, выращенный в соединительной ткани через шесть недель. Таким образом, становится очевидным, что даже спустя 6 недель после имплантации целостность трубчатого оболочки остается неповрежденной, несмотря на начинающийся процесс абсорбции.
Имплант четко врос в соединительную ткань животного и было пересечен кровеносными сосудами; см. также Фиг.8 (А, А'). Схематическая иллюстрация (А) отмечает коллагеновые мембраны (1), клетки (2), коллагеновые волокна (5) и кровеносные сосуды (7).
Иммуногистологические анализы Не-окрашенных парафиновых срезов показывает клетки, которые мигрировали в фольгу согласно изобретению; см. также Фиг.9. Кровеносный сосуд может быть четко установлен в участке имплантов (А, стрелка). Схематическая иллюстрация (А) 1 касается трубчатой оболочки, 2 - клеток, 5 -коллагеновых волокон, 7 - кровеносных сосудов и 8 - соединительной ткани.
3. Заключение
Изобретатели могли поставлять содержащую коллаген композицию, например, в виде пленки или оболочки, которая воспроизводима в крупномасштабном производстве и которая является особенно подходящей для культивирования и получения биологических материалов.