Результат интеллектуальной деятельности: КОНСОРЦИУМ ПРОБИОТИЧЕСКИХ ШТАММОВ Lactobacillus rhamnosus И Lactobacillus plantarum ДЛЯ ИЗГОТОВЛЕНИЯ БАКТЕРИАЛЬНОГО ПРЕПАРАТА И ЗАКВАСКИ ПРЯМОГО ВНЕСЕНИЯ ДЛЯ ПРОИЗВОДСТВА ФЕРМЕНТИРОВАННОГО МОЛОКА И ФЕРМЕНТИРОВАННОГО СВЕКОЛЬНОГО СОКА
Вид РИД
Изобретение
Изобретение относится к области микробиологии и биотехнологии, а именно к штаммам лактобацилл, применяемым в пищевой и медицинской биотехнологии.
Анализ состояния здоровья населения убедительно свидетельствует о неуклонном росте числа лиц, страдающих или склонных к различным заболеваниям, получившим название «болезни цивилизации». К ним относятся сердечно-сосудистые, онкологические, инфекционные, аллергические заболевания, диабет и др. Согласно эпидемиологическим данным и клиническим наблюдениям одной из главных причин развития этих заболеваний является несбалансированность современной диеты человека, что приводит к хроническому дефициту поступления в организм сотен и тысяч макро- и микронутриентов. Эта проблема может быть решена путем введения в рацион человека новых продуктов функционального питания, т.е. продуктов, которые наряду с питательными свойствами обладают также способностью восстанавливать, сохранять и улучшать здоровье человека.
В последние десятилетия концепция активного участия симбиотической микрофлоры человека в поддержании его здоровья завоевывает все большую популярность. Штаммы пробиотических микроорганизмов используются для создания фармакопейных бактериальных препаратов и для производства различных продуктов функционального питания [1]. В связи с вышеизложенным разработка и усовершенствование технологии производства продуктов функционального питания с использованием пробиотических микроорганизмов является актуальной.
Установлено, что огромная роль в системе функционального питания наряду с кисломолочными продуктами принадлежит овощам, которые легко усваиваются в виде соков. Для обогащения овощных соков биологически активными веществами и улучшения вкусовых свойств их подвергают ферментации с помощью молочнокислого брожения. Лактобактерии, ферментирующие соки, могут дополнительно оказывать пробиотические эффекты, улучшающие здоровье человека. Поэтому подбор лактобацилл с выраженными пробиотическими свойствами для ферментации овощных соков имеет принципиальное значение. Особого внимания заслуживает сок из столовой свеклы.
Известен штамм Lactobacillus cellobiosus 9K [2], используемый в технологии приготовления напитка из свеклы для диетического питания. Применение штамма Lactobacillus cellobiosus 9K для сбраживания свекольного сока вместе с мезгой перед стадией прессования позволяет повышать выход напитка и содержание в нем таких биологически ценных компонентов, как бетанидин, аминокислоты, витамины. Однако штамм Lactobacillus cellobiosus 9K не относится к видам пробиотических лактобацилл, обычно используемых в медицине и пищевой промышленности в РФ.
Известны консорциумы штаммов бифидо- и лактобактерий, используемые для производства кисломолочных и неферментированных продуктов в жидкой форме [3-6], однако отсутствуют сведения о возможности использования известных консорциумов для ферментации овощных соков, в частности свекольного.
Наиболее близким техническим решением (прототипом) является консорциум штаммов лактобактерий Lactobacillus acidophilus 57S (ВКПМ В-5863), Lactobacillus plantarum П-75 (ВКПМ В-3962), Lactobacillus casei Сб (ВКПМ В-5724), используемый для получения препарата, применяемого в качестве биологически активной добавки или закваски для производства кисломолочных продуктов в лечебно-диетических целях [7]. Однако отсутствуют сведения о возможности использования данного консорциума для ферментации овощных соков.
Задачей изобретения является расширение ассортимента консорциумов лактобактерий за счет получения консорциума, который может быть использован для изготовления бактериального препарата, а также в качестве закваски прямого внесения как для производства ферментированного молока, так и для производства ферментированного свекольного сока.
Поставленная задача решена тем, что получен консорциум пробиотических штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165, используемый для изготовления бактериального препарата и закваски прямого внесения для производства ферментированного молока и ферментированного свекольного сока в качестве продуктов функционального питания.
Штаммы Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165 выделены из кисломолочной закваски домашнего приготовления, используемой для получения простокваши на основе козьего молока.
Микроорганизмы идентифицированы методом секвенирования гена, кодирующего 16S rRNA.
Частичная олигонуклеотидная последовательность гена, кодирующего 16S rRNA Lactobacillus rhamnosus 2166:
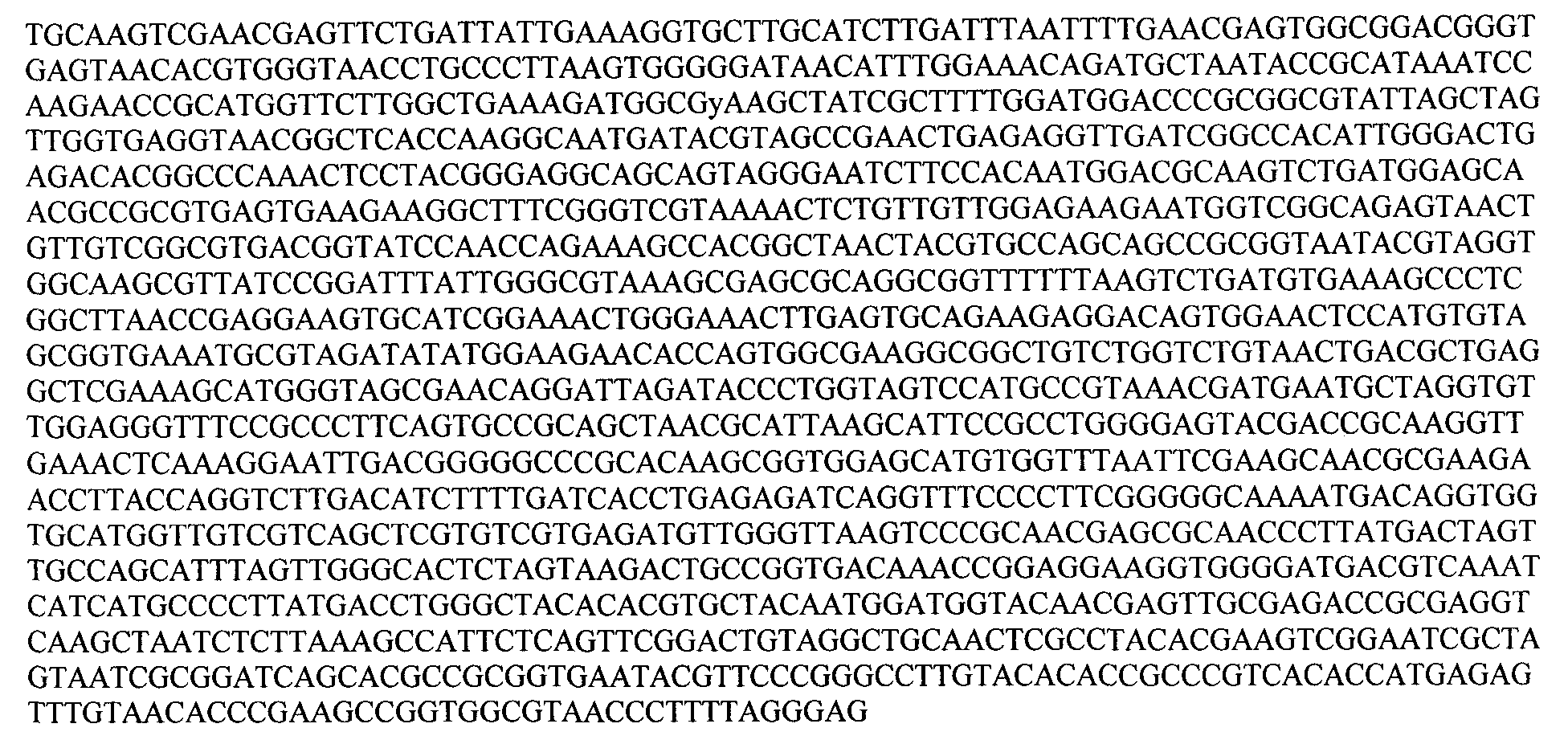
Частичная олигонуклеотидная последовательность гена, кодирующего 16S rRNA Lactobacillus plantarum 2165:

Штаммы консорциума депонированы во Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов, РАН (Московская обл., г.Пущино).
Штамм Lactobacillus plantarum 2165 имеет регистрационный номер ВКМ B-2725D.
Штамм Lactobacillus rhamnosus 2166 имеет регистрационный номер ВКМ В-2726D.
Штаммы и консорциум на их основе характеризуются следующими признаками.
Культурально-морфологические признаки
При выращивании на поверхности агаризованной среды MFC (Himedia, Индия) методом истощающего штриха в термостате при 37°С в течение 18-20 часов:
- штамм Lactobacillus plantarum 2165 - колонии средние, белые, круглые, выпуклые с ровным краем;
- штамм Lactobacillus rhamnosus 2166 - колонии мелкие, бледно-белые, круглые, выпуклые с ровным краем.
При выращивании на жидкой среде MFC (Himedia, Индия) или молоке при 37°С в течение 14-16 часов клетки штамма Lactobacillus plantarum 2165 представляют собой мелкие короткие палочки размером ~3 мкм, образуют короткие цепочки; клетки штамма Lactobacillus rhamnosus 2166 представляют собой очень мелкие короткие палочки размером ~2 мкм, образуют короткие цепочки.
При использовании консорциума штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165 для дифференциации этих штаммов с целью определения их титров при высеве из одной пробы продукта используют среду L.S. рН 6.1 (L.S. Differential Medium, Himedia) + 0,1 г трифенилтетразолия хлорида (ТТС Himedia) на 1 л среды. На этой среде колонии штамма Lactobacillus rhamnosus 2166 приобретают красную окраску с ярко-красной точкой в центре, колонии Lactobacillus plantarum 2165 не изменяют свою окраску, сохраняя белый цвет.
Физиолого-биологические признаки
Оба штамма являются факультативными анаэробами, температурный оптимум 37±2°С, растут при 42°С, слабый рост при 15°С.Оптимальное значение рН среды 5,5-6,0.
Биохимические свойства
Способность штаммов, входящих в состав консорциума, ферментировать углеводы оценивали в API-тесте в соответствии с инструкцией фирмы производителя (BioMerieux, Франция).
Оба штамма усваивают D-Рибозу, D-Галактозу, D-Глюкозу, D-Фруктозу, D-Маннозу, L-Сорбозу, D-Маннит, N-Ацетилглюкозамин, Амигдалин, Арбутин, Эскулин железа цитрат, Салицин, D-Целлобиозу, D-Мальтозу, D-Лактозу, D-Мелицитозу, D-Туранозу.
Дополнительно штамм Lactobacillus plantarum 2165 усваивает L-Арабинозу, Метил αD-маннопиранозид, D-Мелибиозу, D-Сахарозу, Гентиобиозу и имеет таксономическую характеристику ID=99,9%; Т=0,93.
Штамм Lactobacillus rhamnosus 2166 дополнительно усваивает L-Рамнозу, D-Сорбит, Метил-αD-глюкопиранозид, D-Трегалозу, D-Тагатозу и имеет таксономическую характеристику ID=99,9%; Т=0,82 (с учетом усвоения рамнозы).
Чувствительность к антибиотикам
Оба штамма резистентны к ванкомицину. Lactobacillus plantarum 2165 резистентен также к офлоксацину и к ципрофлоксацину (табл.1).
|
Способ, условия и состав сред для размножения штаммов консорциума
Штаммы Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165 выращивают при 37±2°С на жидкой среде МРС или в молоке с 1,5% жира.
Коммерчески приобретенное молоко с 1,5% жира стерилизуют 20 минут автоклавированием при давлении 0,5 атм и температуре 110-120°С.
Для выращивания индивидуальных колоний штаммов используют агаризованную среду МРС, содержащую 1,4% агара (Difco, США).
Способ, условия и состав сред для хранения штаммов консорциума
Штаммы Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165 могут храниться:
- в стерильном обезжиренном молоке при 4°C с периодическим пересевом 1 раз в 15-20 дней;
- в лиофилизированном состоянии в запаянных ампулах (защитная среда при высушивании - сахароза 10%, рН 7,0) в течение 2-х лет при температуре 4°С;
- в замороженном виде при -70°С. Длительность хранения 6 месяцев.
Консорциум штаммов может храниться:
- в лиофилизированном состоянии в запаянных ампулах (защитная среда при высушивании - сахароза 10%, рН 7,0) в течение 2-х лет при температуре 4°С;
- в замороженном виде при -70°С. Длительность хранения 6 месяцев.
Изобретение поясняется следующими примерами.
Пример 1. Культивирование штамма Lactobacillus plantarum 2165 в лабораторных условиях
Для получения посевного материала в ампулу, содержащую 10 мг лиофилизированной культуры Lactobacillus plantarum 2165, добавляют 0,5 мл стерильного раствора натрия хлорида 0,9% и выращивают культуру на поверхности агаризованной среды МРС методом истощающего штриха в термостате при 37°С в течение 18 часов. Затем изолированную колонию помещают в бактериологическую пробирку, содержащую 7 мл жидкой среды МРС, и выращивают в термостате при 37°С в течение 15 часов.
Полученный посевной материал в количестве 1% вносят во флаконы, содержащие 500 мл жидкой среды МРС, и выращивают при 37°С в течение 18 часов. Титр полученной культуры 4×109 КОЕ/мл. Путем доведения концентрации клеток до 1×109 КОЕ/мл получают стандартизованную стартовую биомассу штамма Lactobacillus plantarum 2165.
Для длительного хранения клетки освобождают от компонентов среды выращивания путем центрифугирования, переводят в среду высушивания (сахароза 10%, рН 7,0), расфасовывают по 1 мл в пенициллиновые флаконы и лиофилизируют. В лиофильно высушенном состоянии стартовая биомасса может храниться в течение двух лет при температуре 4°С.
Пример 2. Культивирование штамма Lactobacillus rhamnosus 2166 в лабораторных условиях
Культивирование штамма Lactobacillus rhamnosus 2166 осуществляют по примеру 1. Получают культуру с титром 2×109 КОЕ/мл.
Получение стандартизованной стартовой биомассы штамма Lactobacillus rhamnosus 2166 и ее лиофилизацию осуществляют по примеру 1.
Пример 3. Получение бактериального препарата консорциума штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165
Для получения бактериального препарата на основе консорциума штаммов лактобактерий производят механическое смешивание стандартизованных жидких культур штаммов Lactobacillus plantarum 2165 и Lactobacillus rhamnosus 2166, полученные по примерам 1 и 2, соответственно. Культуры смешивают в равных объемах и получают стартовую биомассу бактериального препарата - консорциума штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165.
Для получения бактериального препарата могут быть использованы и другие соотношения исходных штаммов (от 1:100 до 100:1), но соотношение 1:1 является предпочтительным.
Полученный препарат лиофилизируют по примеру 1. В лиофильно высушенном состоянии бактериальный препарат может храниться в течение двух лет при температуре 4°С. Стандартная концентрация клеток каждого штамма в полученной биомассе составляет 0,5×109 КОЕ/мл.
Полученный бактериальный препарат может быть использован, в частности, в качестве закваски прямого внесения для получения ферментированных продуктов.
Пример 4. Оценка активности кислотообразования штаммов и консорциума
Активность кислотообразования определяют титриметрическим методом [8].
В качестве закваски используют стартовые биомассы штаммов Lactobacillus plantarum 2165, Lactobacillus rhamnosus 2166 и препарата консорциума.
Измерения проводят в течение 48 часов при соотношении закваска/молоко = v/v = 1:100. Результат представляют в градусах Тернера (°Т - величина, выражающая количество 0,1 N щелочи, пошедшей на титрование 100 мл исследуемого образца).
|
Результаты, приведенные в табл.2, показывают, что штамм Lactobacillus plantarum 2165 сквашивает молоко за 48 часов, кислотность продукта составляет 71,0±1.1°Т, штамм Lactobacillus rhamnosus 2166 эффективно сквашивает молоко за 14 часов и обеспечивает кислотность продукта в 94,5±1.2°Т (что соответствует нормативам кисломолочных напитков и йогуртов 70-140°Т), образование сгустка при инокуляции консорциума (0,5% Lactobacillus plantarum 2165 и 0,5% Lactobacillus rhamnosus 2166) происходит за 10 часов сквашивания, при этом кислотность продукта достигает 115,0±1,2°Т.
Таким образом, лучший результат при сквашивании молока показал консорциум, состоящий из штаммов Lactobacillus plantarum 2165 и Lactobacillus rhamnosus 2166. При этом полученный продукт обладает хорошими вкусовыми свойствами и имеет легкий кисломолочный запах.
Проведенные исследования показали, что свойства заявляемого консорциума при использовании его в качестве закваски прямого внесения соответствуют технологическим требованиям производства кисломолочных продуктов.
Пример 5. Оценка антиоксидантной активности лактобацилл консорциума и сывороток кисломолочных продуктов, полученных с их использованием
Для оценки антиоксидантной активности используют стартовые биомассы штаммов Lactobacillus plantarum 2165, Lactobacillus rhamnosus 2166, консорциума и сыворотки кисломолочного продукта.
Антиоксидантную активность штаммов, консорциума и сыворотки кисломолочного продукта определяют по методу, предложенному в работе [9].
Измерение антиоксидантной активности осуществляют с использованием ABTS [2,2'-azinobis-(3-ethylbenzothiazoline-6sulfonicasid]. В качестве стандарта антиоксиданта используют раствор Trolox (6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylicacid). Измерения проводят на спектрофотометре "Ultrospec 3100 pro"(Amercham) при 734 нм.
Процент ингибирования вычисляют по формуле:
%=(1-Af/A0)×100,
где Af - оптическая плотность образца, A0 - оптическая плотность раствора ABTS.
Значение ТЕАС (Trolox equivalent antioxidant capacity) определяют как функцию процента ингибирования антиоксидантов к концентрации Trolox при одинаковых условиях эксперимента.
Результаты, приведенные в табл.3, показывают, что штаммы Lactobacillus plantarum 2165 и Lactobacillus rhamnosus 2166, взятые отдельно, а также совместно в составе консорциума обладают незначительной антиоксидантной активностью.
|
Наиболее выраженной антиоксидантной активностью обладает сыворотка кисломолочного продукта, полученного в процессе сквашивания коровьего молока с использованием консорциума штаммов Lactobacillus rhamnosus 2166 и Lactobacillus splantarum 2165, что может быть связано с более эффективным расщеплением белков молока и освобождением пептидов, проявляющих высокую антиоксидантную активность.
Пример 6. Исследование устойчивости штаммов к желудочному и кишечному стрессам (способность расти в средах с низким значением рН или в среде, содержащей желчь)
При исследовании используют следующие методики.
Имитация желудочного стресса in vitro
Композиция искусственного желудочного сока:
|
1 мл искусственного желудочного сока добавляют к 100 мкл культуры в стационарной фазе (1/11 разведение). Культуры инкубируют в течение 10 минут, 30 минут и 60 минут при 37°С, 10% СО2. В качестве контроля вместо искусственного желудочного сока используют 1 мл МРС. Измерения выполняют в двух повторах для каждой культуры.
После инкубации культуру (каждую повторность и контроли) разводят от 102 до 109 или 1010 в МРС, разведения высевают на чашках с МРС-агаром и инкубируют в течение 24-48 часов при 37°С, 10% СО2. Определяют титр культуры в условиях стресса и без стресса путем подсчета количества колоний для разведений.
Имитация кишечного стресса in vitro
Композиция искусственного кишечного сока:
|
1 мл искусственного кишечного сока добавляют к 100 мкл культуры в стационарной фазе (1/11 разведение). Культуры инкубируют в течение 5 часов, при 37°С, 10% CO2. В качестве контроля используют 1 мл МРС. Измерения выполняют в двух повторах для каждой культуры.
Культуры и контроли разводят от 102 до 109 или 1010 в МРС, разведения высевают на чашках с МРС-агаром и инкубируют в течение 24-48 часов при 37°С, 10% CO2. Определяют титр в условиях стресса и без стресса путем подсчета количества колоний для разведений.
Подсчет микроорганизмов в миллилитре культуры (КОЕ) осуществляют по формуле:
∑C/(n1+0,1n2)d,
где ∑C - сумма всех характерных колоний, подсчитанных на всех чашках, содержащих от 15 до 300 колоний;
n1 - количество чашек, в самом низком разведении (2 чашки на разведение);
n2 - количество чашек, в самом высоком разведении (2 чашки на разведение);
d - величина первого разведения (низкое разведение), взятого для подсчета.
Для определения устойчивости лактобацилл к желудочному и кишечному стрессам используют культуры в стационарной фазе роста, выращенные на жидкой среде МРС, рН 6,5 в течение 18 часов при 37°С, 10% CO2.
Результаты, приведенные в табл.4 и 5, показывают, что штаммы Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165 являются устойчивыми к желудочному и кишечному стрессам.


Пример 7. Исследование антагонистической активности штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165 и консорциума штаммов
Исследование антагонистической активности проводят методом двухслойного агара [10] на индикаторных культурах Escherichia coli 25922 и Staphylococcus aureus FDA 29P.
Антагонистическую активность исследуемых культур выражают минимальной ингибирующей концентрацией антагониста (МИКА) - это минимальное количество антагониста, ингибирующего размножение индикаторной культуры. Показатели для отдельных штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165 и консорциума штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165 представлены в табл.6.

Результаты исследований свидетельствуют о том, что заявляемый консорциум штаммов проявляет более выраженную антагонистическую активность, чем отдельные штаммы Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165.
Пробиотические свойства штаммов и консорциума стабильны и не изменяются при хранении, в процессе культивирования и при воздействии экстремальных факторов, что свидетельствует об их промышленной применимости.
Пример 8. Ингибирование ранней стадии процесса метастазирования раковых клеток в системе in vitro
Для исследования используют культуры Lactobacillus rhamnosus 2166, Lactobacillus plantarum 2165 и консорциума штаммов в стационарной фазе роста, а также культуральные жидкости (КЖ), полученные при культивировании штаммов и консорциума.
Во флаконы с лиофилизированными штаммами и бактериальным препаратом консорциума, полученными по примерам 1-3, соответственно, вливают по 1 мл физиологического раствора, охлажденного до комнатной температуры, взбалтывают и каждый раствор вносят в 100 мл питательной среды МРС, рН 6,5. Культуры выращивают в МРС, рН 6,5 в атмосфере 10% СО2 в течение 24 часов при 37°С.
Из бактерий, дважды промытых в физиологическом растворе, готовят взвесь в концентрации 1×108 бактерий/мл. Бактериальные концентрации каждого штамма и консорциума регулируют при OD λ=580 nm. Бактериальную КЖ, после доведения рН до 7,0-7,2, стерилизуют путем фильтрации (0,22 µm). Влияние штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165, консорциума штаммов и КЖ, полученных при культивировании штаммов и консорциума, на взаимодействие раковых клеток MCF-7 (рак молочной железы человека) с тромбоцитами оценивают по методике, описанной в работе [11]. Адгезию интактных клеток MCF-7 принимают за 100% (контроль 1). В качестве положительного контроля ингибирования взаимодействия клеток MCF-7 с тромбоцитами используют ингибитор фукоидан LS (производство Института органической химии, Москва) в концентрациях 20 мкг/мл (контроль 2) и 100 мкг/мл (контроль 3).
Полученные результаты (табл.7) показывают, что в присутствии фукоидана LS в концентрации 20 мкг/мл 72±8% опухолевых клеток связалось с иммобилизованными тромбоцитами по сравнению с интактным контролем. При увеличении концентрации фукоидана LS до 100 мкг/мл только 26±4% клеток MCF-7 связываются с тромбоцитами. Консорциум штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165 эффективно ингибирует связывание MCF-7 с тромбоцитами - 16±2%, однако, максимальная активность отмечена у КЖ, полученной после культивирования заявляемого консорциума - 3±0,5%.
В связи с этим в последующих экспериментах изучена эффективность ингибирования метастазов in vivo в опытах на мышах с помощью КЖ консорциума штаммов.
|
Пример 9. Ингибирование процесса метастазирования опухолевых клеток in vivo с помощью культуральной жидкости (КЖ) консорциума штаммов
Во флаконы с лиофилизированными штаммами Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165, полученными по примерам 1 и 2, соответственно, вливают по 1 мл физиологического раствора, охлажденного до комнатной температуры, взбалтывают и оба раствора совместно вносят в 100 мл питательной среды МРС, рН-6,5. Культуры выращивают в МРС, рН 6,5 в атмосфере 10% СО2 в течение 24 часов при 37°С.
Полученную КЖ консорциума штаммов используют для исследования ингибирования процесса метастазирования опухолевых клеток in vivo в соответствии с методикой [12].
Известно, что Т-лимфоциты - активные участники противоопухолевого иммунитета. Иммунодефицитное состояние мышей Nude позволяет использовать их в качестве объекта для роста всевозможных опухолей различных гаплотипов, включая ксеногенные. Бестимусным мышам Nude, созданным на основе линии Balb/c (гаплотип Н-2d), была привита меланома В 16 (гаплотип Н-2b). После хирургического удаления опухолевого узла такой меланомы обычно отмечается интенсивный рост метастазов в легких и плевре. Данную модель используют для изучения влияния КЖ консорциума штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165 на развитие и рост метастазов в послеоперационном периоде.
Для исследования используют 5 групп по 5 мышей в каждой. В качестве положительного контроля используют обладающий антиметастатической активностью рекомбинантный протимозин альфа человека (rHu ProTα) в концентрациях 3 мкг и 0,3 мкг. Животным в течение двух недель через день вводят внутрибрюшинно:
Группа 1 (контроль 1) - физиологический раствор 0,2 мл;
Группа 2 (контроль 2) - rHuProTα 3 мкг;
Группа 3 (контроль 3) - rHuProTα 0,3 мкг;
Группа 4 - rHuProTα 0,3 мкг + КЖ консорциума 0,2 мл;
Группа 5 - КЖ консорциума 0,2 мл.
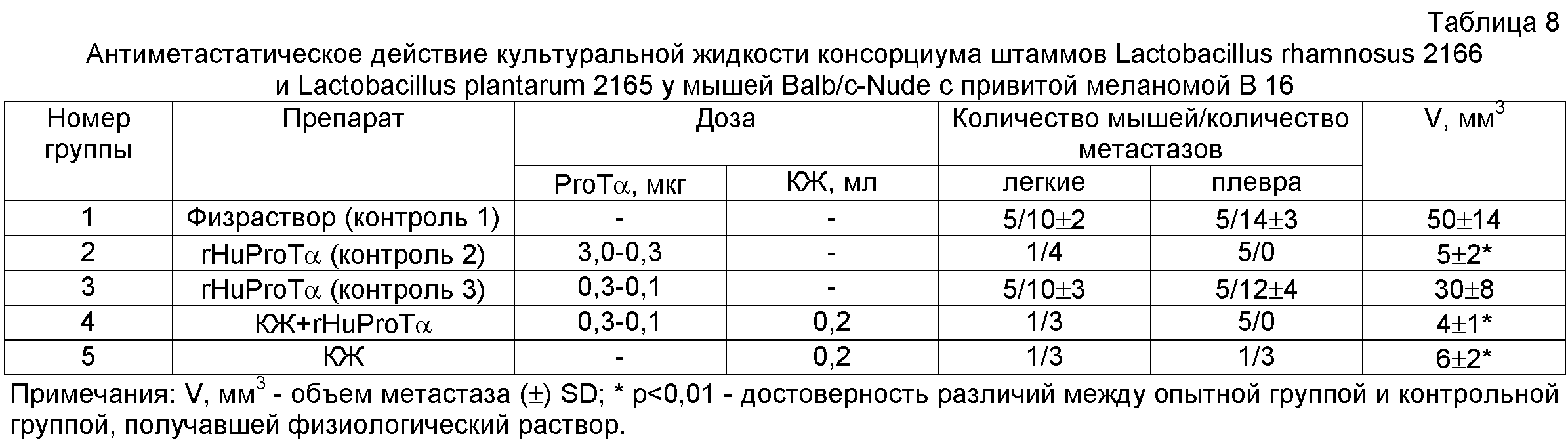
На 14 день всем мышам подкожно инъецируют клетки меланомы В 16 (1,5×103/мышь) и продолжают вводить 3 раза в неделю соответствующие препараты. Через две недели после прививки проводят хирургическую операцию по удалению образовавшейся опухоли. Животным каждой группы продолжают вводить соответствующие препараты 3 раза в неделю, при этом доза rHu ProTα снижается в 10 раз. При начале падежа в контрольной группе (на 58 день от начала опыта) животных всех групп усыпляют путем асфиксии в СО2 и производят подсчет метастазов.
Полученные результаты (табл.8) показывают, что у контрольной группы мышей в легких и плевре обнаружено от 10±2 до 14±3 метастазов, средний размер которых составляет 50±14 мм3. При этом у опытной группы мышей, получавших КЖ, только у одной мыши из пяти обнаружены 3 метастаза в легких и 3 метастаза в плевре, средний размер которых в 8,3 раза меньше по сравнению с контрольной группой, получавшей физиологический раствор, и равен 6±2 мм3. Обнаружен также синергизм антиметастатического действия КЖ консорциума лактобацилл и rHu ProTα (группа 4). В этой группе у четырех животных из пяти метастазы отсутствуют и только у одной мыши образовались 3 метастаза в легких, размер которых не превышает 4±1 мм3.
Пример 10. Использование консорциума штаммов лактобактерий в качестве закваски прямого внесения для ферментации свекольного сока с целью получения свекольного кваса (СК)
Свеклу сортируют, моют, очищают и измельчают до гомогенной массы с размером частиц 6×3×1 (длина, ширина, высота, мм). В свежеизмельченную свекольную мезгу перед ее пастеризацией вносят 0,25% аскорбиновой кислоты для увеличения глубины экстракции красящих веществ и обрабатывают при 75°С в течение 15 мин.
Мезгу охлаждают до 37°С, добавляют лиофилизированный бактериальный препарат, полученный по примеру 3, перемешивают.
Ферментацию мезги проводят в статических условиях при 37°С в течение 10 час. Отмечают снижение рН образовавшегося СК до 4,0. Мезгу отделяют от СК путем центрифугирования.
Органолептическая оценка лабораторного образца СК, ферментированного с использованием заявляемого консорциума, показала, что СК имеет насыщенный бордовый цвет, соответствующий цвету столовой свеклы, и ярко выраженный свекольный вкус, освежающий за счет кислого привкуса от содержания продуктов молочнокислого брожения.
СК, полученный с помощью консорциума штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165, в качестве пробиотической закваски прямого внесения по технологическим показателям (табл.9) и по содержанию витаминов в готовом продукте (табл.10) превосходит известный способ [2].
|
Под действием ферментов, которыми обладают штаммы консорциума Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165, происходит биотрансформация компонентов исходного овощного сырья. При этом увеличивается содержание органических кислот, отмечается частичный гидролиз структурных полисахаридов, в результате в процессе ферментации изменяется состав мезги и свекольного сока (табл.11).
Важным потребительским свойством СК является сохранение в нем высокого титра жизнеспособных клеток (по показателям КОЕ/мл), число которых в готовом напитке (10 час) составляет 6,3×108 КОЕ/мл для Lactobacillus rhamnosus 2166 и 7,8×108 КОЕ/мл для Lactobacillus plantarum 2165 и на 20 сутки хранения при 0-4°С незначительно снижается до 7,5×107 КОЕ/мл для Lactobacillus rhamnosus 2166 и 8,9×107 КОЕ/мл для Lactobacillus plantarum 2165 (табл.12).
|
|
Этот факт свидетельствует о том, что свекольный сок, ферментированный консорциумом штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165, в качестве пробиотической закваски прямого внесения не теряет в конечном продукте - свекольном квасе своих пробиотических свойств в процессе хранения в течение 20 дней при температуре 0-4°С. Данный показатель также свидетельствует о способности симбиотического консорциума штаммов Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165 хорошо выживать в сапротрофных условиях.
Таким образом, применение консорциума, содержащего пробиотические штаммы Lactobacillus rhamnosus 2166 и Lactobacillus plantarum 2165 в качестве закваски прямого внесения в свекольный сок и свекольную мезгу для производства СК позволяет повысить глубину переработки исходного сырья, качество продукции, ее биологическую ценность и вкусовые достоинства.
Пример 11. Влияние СК на процесс восстановления нормального уровня таурина в сердце крыс, обработанных β-аланином
Известно, что дефицит таурина, являющегося естественным продуктом обмена серосодержащих аминокислот, в клетках, какого бы то ни было органа, неблагоприятно сказывается на его состоянии. В частности, он важен для регенерации тканей, оказывает протективное действие при физических нагрузках, обладает антистрессорным действием. Потеря таурина клетками сердца ведет к кардиомиопатии.
Цель исследований - изучить влияние СК на процесс восстановления нормального уровня таурина в сердце крыс, обработанных β-аланином, который является ингибитором транспорта таурина.
Для исследования используют 4 группы крыс самцов линии Wistar весом 250-300 г по 15 в каждой группе.
Для снижения содержания таурина крысы в течение 24 дней получают питьевую воду, содержащую 3% β-аланина.
Животным предоставляют:
группа 1 (контроль): вода без 3% β-аланина;
группа 2 (контроль): с 4 по 28 день - вода, содержащая 3% β-аланин;
группа 3 (контроль): с 4 по 28 день - вода, содержащая 3% β-аланин, с 29 по 35 день - вода без 3% β-аланина;
группа 4 (опыт): с 4 по 28 день - вода, содержащая 3% β-аланин, с 29 по 35 день - вода без 3% β-аланина + ежедневно 2,5 мл СК интрагастрально.
Результаты (табл.13) показывают, что СК ускоряет процесс восстановления исходного уровня таурина в сердце крыс, обработанных β-аланином, и свидетельствуют о целесообразности включения СК в качестве продукта функционального питания в рацион людей, в частности спортсменов, испытывающих высокие физические и психические нагрузки.
|
Пример 12. Влияние СК на обучение и улучшение памяти крыс в тесте условного рефлекса активного избегания (УРАИ)
Влияние СК на обучение крыс линии Wistar в тесте УРАИ исследуют в челночной испытательной камере (Уго Базиле, Италия). Прибор имеет две камеры, поочередно получающие напряжение. Когда крыса переходит в "спокойный" отсек, ток отключается. Установка снабжена устройством, регистрирующим продолжительность включения электрического тока, подаваемого на электродный пол, то есть латентный период до момента перехода крысы в безопасный отсек.
Для исследования используют 2 группы крыс по 10 особей в каждой группе.
Опытной группе животных ежедневно в течение 28 дней вводят интрагастрально по 2,5 мл СК, контрольной группе - физиологический раствор в той же дозе.
Измерение величины латентного периода избегания проводят на 15, 16, 17 и 28 дни приема СК. Улучшение навыков рассчитывают в процентах в сравнении с первым сеансом обучения.
Результаты, приведенные в табл.14, показывают, что после третьего сеанса обучения животные опытной группы повысили свой показатель обучения на 29,7% против 7,4% у животных контрольной группы, что свидетельствует о стимулирующем действии СК на кратковременную память.
|
Таким образом, результаты исследований, полученные на крысах в тесте УРАИ, позволяют сделать заключение, что СК является стимулятором кратковременной памяти.
Пример 13. Возможности коррекции окислительного стресса у больных сахарным диабетом с помощью СК
Обследовано 40 больных (2 группы по 20 человек), страдающих сахарным диабетом второго типа (СД2). Длительность заболевания - 2-4 года.
Пациенты первой группы получают ежедневно в течение 2 месяцев по 100 мл СК на фоне базисной сахароснижающей терапии, пациенты второй группы (контроль) используют только базисную сахароснижающую терапию.
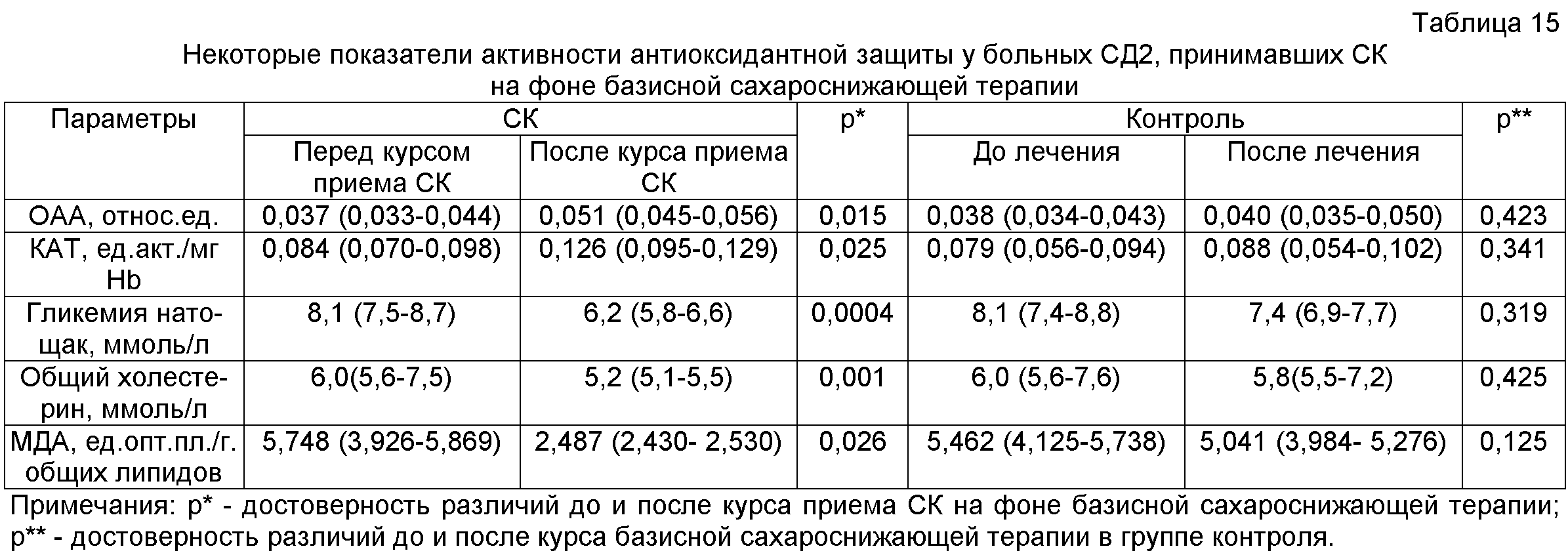
До и после курса приема СК оценивают общую антиоксидантную активность (ОАА), активность антиоксидантного фермента каталазы (КАТ), показатель углеводного обмена (гликемия натощак), показатели липидного обмена (общий холестерин и молекулярный продукт перекисного окисления липидов - малоновый диальдегид (МДА)), как описано в работе [13].
Результаты, приведенные в табл.15, показывают, что употребление в пищу СК в качестве продукта функционального питания способствует повышению общей антиоксидантной активности, реализуемой, в частности, через повышение активности антиоксидантного фермента каталазы, улучшению компенсации углеводного и липидного обменов. Снижение в плазме крови уровня МДА обусловлено ограничением перекисного окисления липидов.
Полученные результаты свидетельствуют о целесообразности применения СК в качестве продукта функционального питания в комплексной терапии сахарного диабета.
Таким образом, заявленный консорциум штаммов лактобактерий, состоящий из Lactobacillus rhamnosus 2166 и Lactobacillu splantarum 2165, имеет высокие технологические характеристики: штаммы консорциума активно развиваются в питательных средах, молоке и свекольном соке, проявляют стойкие симбиотические взаимоотношения в качестве закваски прямого внесения для производства ферментированных молочных и овощных продуктов. Это позволяет сократить длительность процесса ферментации молока и свекольного сока, увеличить глубину переработки свеклы, повысить качество СК, его вкусовые достоинства, биологическую ценность.
Показано, что продукты, полученные при использовании заявленного консорциума, могут быть рекомендованы в качестве продуктов функционального питания для профилактики и лечения широкого ряда заболеваний.
Литература
1. Шендеров Б.А. Медицинская микробная экология и функциональное питание. Т.3. Пробиотики и функциональное питание. М., 2001. Изд-во Грантъ, 287 с.
2. KZ №34 «Способ получения напитка из свеклы для диетического питания».
3. RU №2180348.
4. RU №2180914.
5. RU №2180915.
6. RU №2296797.
7. RU №2326938 (прототип).
8. ГОСТ 3624-92. Молоко и молочные продукты. Титриметрические методы определения кислотности.
9. Re, R., Pellegrini, N., Proteggente, A., Pannala, A., Yang, М. and Rice-Evans, C. (1999) Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med 26, 1231-1237.
10. Ермоленко Е.И., Исаков В.А., Ждан-Пушкина С.Х., Тец В.В. Количественная оценка антагонистической активности лактобацилл. // Журн. микробиол., эпидем., иммунобиол. - 2004. - 5. - С.94-98.
11. Cumashi A., Ushakova N. A, Preobrazhenskaya M.E., D'Incecco A., Piccoli A., Totani L., Tinari N, Morozevich G. E., Berman A. E., Bilan М. I., Usov A. I., Ustyuzhanina N. E., Grachev A. A., Sanderson C. J., Kelly М., Rabinovich G. A., Iacobelli S., Nifantiev N. E. A comparative study of the anti-inflammatory, anticoagulant, antiangiogenic, and antiadhesive activities of nine different fucoidans from brown seaweeds.// Glycobiology 2007, 17 (5): 541-552.
12. Ходякова А.В. Иммунобиологические свойства рекомбинантного протимозина альфа человека. Дисс. на соискание ученой степени канд.биол.наук. 2001, 92 с.
13. Арутюнян А.В., Дубинина Е.В., Зыбина Н.Н. Методы оценки свободнорадикального окисления и антиоксидантной системы организма. СПб., 2000, 104 с.
Консорциум пробиотических штаммов ВКМ В-2726D и ВКМ B-2725D для изготовления бактериального препарата и закваски прямого внесения для производства ферментированного молока и ферментированного свекольного сока в качестве продуктов функционального питания.
