Результат интеллектуальной деятельности: УСТРОЙСТВО И СПОСОБ ДЛЯ ОПРЕДЕЛЕНИЯ ФИЗИОЛОГИЧЕСКОГО ПАРАМЕТРА
Вид РИД
Изобретение
Настоящее изобретение относится к устройству для определения, по меньшей мере, одного физиологического параметра пациента. В частности, изобретение относится к устройству для определения, по меньшей мере, одного физиологического параметра пациента, при этом устройство содержит, по меньшей мере, одно устройство датчика, выполненное с возможностью обеспечения показаний кровяной переменной пациента, средство хранения для хранения упомянутых показаний в виде, по меньшей мере, одной кривой, представляющей упомянутую кровяную переменную по времени и средства оценки, выполненные с возможностью определения среднего значения по упомянутой кривой и определения упомянутого, по меньшей мере, одного физиологического параметра с использованием упомянутого среднего значения.
Кроме того, изобретение относится к способу определения, по меньшей мере, одного физиологического параметра пациента, путем обеспечения показаний кровяной переменной пациента, сохранения упомянутых показаний в виде, по меньшей мере, одной кривой, представляющей упомянутую кровяную переменную по времени, определения среднего значения по упомянутой кривой измерения давления и определения упомянутого, по меньшей мере, одного физиологического параметра с использованием упомянутого среднего значения.
Кроме того, изобретение относится к физическому носителю хранения, содержащему хранимую на нем компьютерную программу, которая, при исполнении в компьютерной системе, предписывает компьютерной системе выполнять способ определения, по меньшей мере, одного физиологического параметра пациента.
Устройства и способы для определения параметров сердечной функции, например, минутного сердечного выброса, фракций выброса или ударного объема сердца широко известны на современном уровне знаний. В частности, минутный сердечный выброс можно получать из непрерывного волнового сигнала артериального давления, который получают с помощью традиционного средства по артериальной линии, измеряющей артериальное давление. Минутный сердечный выброс обычно равен ударному объему сердца, умноженному на частоту сердечных сокращений.
Например, в патенте США № 6071244 предлагается способ для измерения минутного сердечного выброса пациента, который предусматривает непрерывное измерение волнового сигнала артериального давления, затем выполнение автокорреляции данных волнового сигнала и, наконец, установление минутного сердечного выброса умножением преобразованных автокорреляционных данных на калибровочный коэффициент с использованием известного способа точной калибровки для данного пациента.
В документе EP-A-0947941 описано определение in vivo функции диастолического расслабления и минутного сердечного выброса для пациента с использованием анализа формы пульса.
Однако современные надежные способы непрерывного определения минутного сердечного выброса и/или ударного объема сердца требуют калибровки по опорному значению, которое обычно определяют посредством дополнительного периодически выполняемого измерения. Кроме того, анализы формы пульса требуют надежного определения дикротической выемки для разделения систолического и диастолического составляющих пульсового давления. Кроме того, в некоторых обстоятельствах, например, во время обширного оперативного вмешательства, волновой сигнал может совсем не обнаруживать дикротической выемки. Кроме того, вышеописанные решения сопряжены с риском искажений при измерении давления из-за аритмии или отражений от ветвей артерии.
Дополнительно существует необходимость уменьшить степень инвазивности в гемодинамических методиках измерений.
Поэтому целью настоящего изобретения является создание устройства или способа, соответственно, вышеописанного типа для измерения физиологического параметра, например, минутного сердечного выброса, фракций выброса или ударного объема сердца, с решением, при этом, проблемы обязательной калибровки данных измерений по опорному значению, полученному посредством дополнительного непрерывного измерения для пациента.
Дополнительной целью настоящего изобретения является создание устройства или способа, соответственно, вышеописанного типа, которые обходятся без обязательного обнаружения дикротической выемки.
Кроме того, целью настоящего изобретения является минимизация вышеописанных искажений измерений в устройстве или способе, обусловленных аритмией или отражениями от ветвей артерии.
Дополнительной целью является, по меньшей мере, не увеличение степени инвазивности имеющей место при определении физиологического параметра(ов).
В соответствии с одним аспектом настоящего изобретения, данные цели достигаются с помощью устройства типа, описанного в начале, в котором средство оценки устройства дополнительно выполнено с возможностью
- определения, по меньшей мере, чего-то одного из спектральной плотности S(ω) кривой и дисперсии упомянутого артериальной кровяной переменной,
- определения, по меньшей мере, одного моделирующего параметра, представляющего собой эффективное значение сердечного сокращения, с использованием определенного среднего значения и, по меньшей мере, одного из упомянутой спектральной плотности S(ω) и упомянутой дисперсии, при этом, упомянутое эффективное значение выбрано из эффективной амплитуды Aeff упомянутого сердечного сокращения, эффективной продолжительности deff упомянутого сердечного сокращения и эффективной площади Feff под упомянутым сердечным сокращением, и
- определения упомянутого, по меньшей мере, одного физиологического параметра с использованием, по меньшей мере, одного упомянутого моделирующего параметра.
В предпочтительном варианте осуществления, данные цели достигаются с помощью устройства для определения, по меньшей мере, одного физиологического параметра пациента, при этом, упомянутое устройство содержит:
- устройство датчика давления, выполненное с возможностью обеспечения показаний артериального давления упомянутого пациента,
- средство памяти для хранения упомянутых показаний в виде кривой P(t) изменения давления со временем t,
- средства оценки, выполненные с возможностью определения среднего артериального давления <P> по упомянутой кривой P(t) измерения давления и определения упомянутого, по меньшей мере, одного физиологического параметра с использованием упомянутого среднего артериального давления <P>,
при этом упомянутые средства оценки дополнительно выполнены с возможностью
- определения, по меньшей мере, чего-то одного из спектральной плотности S(ω) упомянутой кривой изменения давления и дисперсии <(δP)2> упомянутого артериального давления,
- определения, по меньшей мере, одного моделирующего параметра, представляющего собой эффективное значение сердечного сокращения, с использованием упомянутого среднего артериального давления <P> и, по меньшей мере, чего-то одного из упомянутой спектральной плотности S(ω) и упомянутой дисперсии <(δP)2>, при этом, упомянутое эффективное значение выбрано из эффективной амплитуды Aeff упомянутого сердечного сокращения, эффективной продолжительности deff упомянутого сердечного сокращения и эффективной площади Feff под упомянутым сердечным сокращением, и
- определения упомянутого, по меньшей мере, одного физиологического параметра с использованием, по меньшей мере, одного упомянутого моделирующего параметра.
Хотя настоящее изобретение далее будет описано с фокусировкой на этот предпочтительный вариант осуществления, настоящее изобретение может также быть выполнено в равной степени преимущественным способом, с использованием сенсорных устройств, отличающихся от устройства датчика давления, тем не менее, следующих тому же или в значительной степени аналогичному принципу оценки. Например, настоящее изобретение может быть преимущественно выполнено с использованием сенсорного устройства пульсовой оксиметрии и/или (опто-)плетизмографии и основывая методики оценивания на показаниях пульсовой оксиметрии и/или (опто-)плетизмографии, которые обычно включают в себя множество сигналов яркости.
Методики оценивания, описанные далее на основании показаний артериального давления, таким образом, могут быть выполнены аналогичным способом, с использованием кривой, представляющей собой местный объем крови, переменную местной перфузии или т.п., вместо кривой изменения давления, и среднее значение такой переменной, вместо среднего артериального давления. Т.е. в методиках оценивания, описанных далее, члены уравнения, обусловленные артериальным давлением, могут заменяться членами уравнения, обусловленными еще одной переменной, указывающей состояние перфузии артерии.
Следует понимать, что кривая может непосредственно являться производной от исходных данных, таких как электрический сигнал, зависящий от местного светопропускания и/или отражение, обнаруженное посредством установки оптического датчика.
Так как сенсорные устройства пульсовой оксиметрии и/или (опто-)плетизмографии могут легко выполняться с использованием неинвазивных датчиков (например, датчики-зажимы пальцев, датчики-зажимы ушей или датчики, прикрепляющиеся ко лбу), настоящее изобретение, таким образом, позволяет значительно снизить или исключить инвазивность определения физиологического, в частности, гемодинамического, параметра.
Датчики пульсовой оксиметрии и/или (опто-)плетизмографии как таковые являются в значительной степени известными из предшествующего уровня техники. Плетизмография является методикой измерения вариаций объема крови, находящихся в соотношении с пульсом субъекта. Данная методика делает возможным осуществление непрерывных неинвазивных измерений артериального давления или частоты пульса, соответственно. Измерение пульсовой оксиметрии позволяет определить кислородное насыщение крови. В оптоплетизмографии, главным образом, существует два альтернативных принципа измерения: измерения передачи и измерения отражения. Измерения передачи основываются на измерении интенсивности по закону Ламберта-Бера. В оптоплетизмографии обычно используются две или более длин волн в диапазоне приблизительно от 600 нм до приблизительно 1000 нм, как правило, около 660 нм и 940 нм. Подходящими местами замера являются, например, кончики пальцев, мочки ушей, лоб (для измерений отражения), нос и пальцы ноги. Технические выполнения датчиков являются широко известными как из патентной, так и не патентной литературы, например, Vincent Chan, Steve Underwood: «A Single-Chip Pulsoximeter Design Using the MSP430» SLAA274 - November 2005 (http://focus.ti.com/lit/an/slaa274/slaa274.pdf) и Texas Instruments Medical Applications Guide 1Q2009, p. 37-44 (http://focus.ti.com/lit/an/slyb108d/slyb108d.pdf).
В предпочтительном варианте упомянутый, по меньшей мере, один физиологический параметр содержит, по меньшей мере, что-то одно из ударного объема SV сердца, минутного сердечного выброса CO и фракции EF выброса.
Кроме того, упомянутые средства оценки предпочтительно выполнены с возможностью определения упомянутого ударного объема SV сердца в форме произведения первого моделирующего параметра, представляющего собой упомянутую эффективную амплитуду Aeff, и второго моделирующего параметра, представляющего собой упомянутую эффективную продолжительность deff.
Кроме того, упомянутые средства оценки предпочтительно выполнены с возможностью определения упомянутой фракции EF выброса в форме произведения моделирующего параметра, представляющего собой упомянутую эффективную продолжительность deff, и частоты HR сердечных сокращений упомянутого пациента.
В частности, упомянутые средства оценки предпочтительно выполнены с возможностью определения упомянутого минутного сердечного выброса CO в форме произведения первого моделирующего параметра, представляющего собой упомянутую эффективную амплитуду Aeff, второго моделирующего параметра, представляющего собой упомянутую эффективную продолжительность deff, и приближенной величины частоты сердечных сокращений упомянутого пациента.
В предпочтительном варианте упомянутая приближенная величина упомянутой частоты сердечных сокращений выбрана из фактически измеренной частоты HR сердечных сокращений и приближенной функции λeff, при этом упомянутая приближенная функция λeff содержит частное от деления делимого, содержащего квадрат среднего артериального давления <P>, на делитель, содержащий спектральную плотность S(ω) при ω = 0.
Кроме того, в предпочтительном варианте упомянутые средства оценки выполнены с возможностью применения параметра α коррекции при определении упомянутого первого моделирующего параметра, при этом, упомянутый параметр α коррекции принимает значения большие или равные 1, причем, чем выше упомянутые значения, тем меньше ритм сердца пациента отклоняется от ритмического состояния.
Кроме того, в предпочтительном варианте упомянутые средства оценки выполнены с возможностью применения монотонной корректирующей функции σ, зависящей от упомянутого параметра α коррекции и принимающей значения от 0 до 1, при этом, упомянутая корректирующая функция σ принимает значение 0, если упомянутый параметр α коррекции равен 1, и упомянутая корректирующая функция σ принимает значение 1, при упомянутом параметре α коррекции, стремящемся к бесконечности.
В предпочтительном варианте упомянутая эффективная амплитуда Aeff обеспечивается как частное от деления делимого, содержащего сумму упомянутой дисперсии <(δP)2> и произведения упомянутой корректирующей функции σ и квадрата среднего артериального давления <P>, на делитель, содержащий среднее артериальное давление <P>.
Кроме того, в предпочтительном варианте упомянутая эффективная продолжительность deff обеспечивается как частное от деления делимого, содержащего спектральную плотность S(ω), при ω = 0, на делитель, содержащий сумму упомянутой дисперсии <(δP)2> и произведения упомянутой корректирующей функции σ и квадрата среднего артериального давления <P>.
Упомянутое устройство предпочтительно обеспечивает также средство Фурье-преобразования для определения упомянутой спектральной плотности S(ω) в форме Фурье-преобразования автокорреляции упомянутой кривой изменения давления.
В предпочтительном варианте спектральная плотность S(ω), при ω = 0, обеспечивается в форме упомянутой дисперсии <(δP)2>, умноженной на постоянный коэффициент.
В предпочтительном варианте осуществления упомянутый блок оценки дополнительно выполнен с возможностью определения сравнительной величины, по меньшей мере, одного из упомянутых физиологических параметров по упомянутой кривой изменения давления с использованием алгоритмов формы пульса.
В дополнительном предпочтительном варианте осуществления упомянутое устройство дополнительно содержит
- средство для введения перемещающегося отклонения характерной физической величины (например, температуры, оптической/спектральной характеристики или концентрации индикатора) в кровоток упомянутого пациента в первом местоположении кровообращения упомянутого пациента, и
- средство датчика для измерения упомянутой физической величины во втором местоположении кровообращения упомянутого пациента с течением времени,
при этом упомянутое средство памяти выполнено с возможностью записи упомянутой физической величины, измеренной с течением времени в упомянутом втором местоположении, в виде кривой разведения, и упомянутый блок оценки выполнен с возможностью определения сравнительной величины, по меньшей мере, одного из упомянутых физиологических параметров по упомянутой кривой разведения с использованием алгоритмов разведения.
В предпочтительном варианте упомянутый блок оценки выполнен с возможностью применения упомянутой сравнительной величины для калибровки.
В предпочтительном варианте упомянутая калибровка содержит определение, с применением упомянутой сравнительной величины, параметра α коррекции, применяемого при определении упомянутого моделирующего параметра, при этом, упомянутый параметр α коррекции принимает значения, большие или равные 1, причем, чем выше упомянутые значения, тем меньше ритм сердца пациента отклоняется от ритмического состояния.
В предпочтительном варианте упомянутый блок оценки выполнен с возможностью отбрасывания и повторного вычисления упомянутого физиологического параметра, если разность между найденным физиологическим параметром и соответствующей сравнительной величиной превышает пороговое значение.
В дополнение к описанным вариантам осуществления, вышеописанные цели достигаются, в соответствии с дополнительным аспектом изобретения, с использованием способа определения, по меньшей мере, одного физиологического параметра пациента, при этом, упомянутый способ содержит следующие этапы:
- импортируют показания кровяной переменной упомянутого пациента,
- сохраняют упомянутые показания в виде кривой, представляющей упомянутую кровяную переменную по времени t,
- определяют среднее значение по упомянутой кривой и определяют, по меньшей мере, один физиологический параметр с использованием упомянутого среднего значения,
причем способ дополнительно содержит следующие этапы:
- определяют, по меньшей мере, что-то одно из спектральной плотности S(ω) упомянутой кривой и дисперсии упомянутой кровяной переменной,
- определяют, по меньшей мере, один моделирующий параметр, представляющий собой эффективное значение сердечного сокращения, с использованием упомянутого среднего значения и, по меньшей мере, чего-то одного из упомянутой спектральной плотности S(ω) и упомянутой дисперсии, при этом, упомянутое эффективное значение выбрано из эффективной амплитуды Aeff упомянутого сердечного сокращения, эффективной продолжительности deff упомянутого сердечного сокращения и эффективной площади Feff под упомянутым сердечным сокращением, и
- определяют упомянутый, по меньшей мере, один физиологический параметр с использованием, по меньшей мере, одного упомянутого моделирующего параметра.
В предпочтительном варианте осуществления, вышеописанные цели достигаются с использованием способа определения, по меньшей мере, одного физиологического параметра пациента, при этом упомянутый способ содержит следующие этапы:
- импортируют показания артериального давления пациента упомянутого пациента,
- сохраняют упомянутые показания в виде кривой P(t) изменения давления со временем t,
- определяют среднее артериальное давление <P> по упомянутой кривой P(t) измерения давления и определяют, по меньшей мере, один физиологический параметр с использованием упомянутого среднего артериального давления <P>,
причем способ дополнительно содержит следующие этапы:
- определяют, по меньшей мере, что-то одно из спектральной плотности S(ω) упомянутой кривой изменения давления и дисперсии <(δP)2> упомянутого артериального давления,
- определяют, по меньшей мере, один моделирующий параметр, представляющий собой эффективное значение сердечного сокращения, с использованием упомянутого среднего артериального давления <P> и, по меньшей мере, чего-то одного из упомянутой спектральной плотности S(ω) и упомянутой дисперсии <(δP)2>, при этом, упомянутое эффективное значение выбрано из эффективной амплитуды Aeff упомянутого сердечного сокращения, эффективной продолжительности deff упомянутого сердечного сокращения и эффективной площади Feff под упомянутым сердечным сокращением, и
- определяют упомянутый, по меньшей мере, один физиологический параметр с использованием, по меньшей мере, одного упомянутого моделирующего параметра.
В предпочтительном варианте, в вышеописанном способе упомянутый, по меньшей мере, один физиологический параметр содержит, по меньшей мере, что-то одно из ударного объема SV сердца, минутного сердечного выброса CO и фракции EF выброса.
Как упоминалось, применительно к вышеописанному устройству, способ, описанный далее на основании показаний артериального давления, преимущественно может быть реализован аналогичным способом, с использованием кривой, представляющей собой переменную местного объема крови, переменную местной перфузии или т.п., вместо кривой изменения давления, и среднее значение такой переменной, вместо среднего артериального давления. Т.е. в способе, описанном ниже, члены уравнения, обусловленные артериальным давлением, могут заменяться членами уравнения, обусловленными еще одной переменной, указывающей состояние перфузии.
В частности, может являться преимуществом выполнение способа, согласно изобретению, с использованием показаний пульсовой оксиметрии и/или (опто-)плетизмографии (которые могут обычно содержать множество сигналов яркости), так как измерения пульсовой оксиметрии и/или (опто-)плетизмографии могут легко выполняться неинвазивным способом.
В дополнительном предпочтительном варианте вышеописанного способа упомянутый ударный объем SV сердца определяют в форме произведения первого моделирующего параметра, представляющего собой упомянутую эффективную амплитуду Aeff, и второго моделирующего параметра, представляющего собой упомянутую эффективную продолжительность deff.
В дополнительном предпочтительном варианте вышеописанного способа упомянутую фракцию EF выброса определяют в форме произведения моделирующего параметра, представляющего собой упомянутую эффективную продолжительность deff, и частоты HR сердечных сокращений упомянутого пациента.
В дополнительном предпочтительном варианте вышеописанного способа упомянутый минутный сердечный выброс CO определяют в форме произведения первого моделирующего параметра, представляющего собой упомянутую эффективную амплитуду Aeff, второго моделирующего параметра, представляющего собой упомянутую эффективную продолжительность deff, и приближенной величины частоты сердечных сокращений упомянутого пациента.
Кроме того, в предпочтительном варианте вышеописанного способа упомянутую приближенную величину упомянутой частоты сердечных сокращений выбирают из фактически измеренной частоты HR сердечных сокращений и приближенной функции λeff, при этом упомянутая приближенная функция λeff содержит частное от деления делимого, содержащего квадрат среднего артериального давления <P>, на делитель, содержащий спектральную плотность S(ω) при ω = 0.
Кроме того, в вышеописанном способе, при определении упомянутого моделирующего параметра, предпочтительно применяют параметр α коррекции, при этом, упомянутый параметр α коррекции принимает значения большие или равные 1, причем, чем выше упомянутые значения, тем меньше ритм сердца пациента отклоняется от ритмического состояния.
В вышеописанном способе предпочтительно применяют монотонную корректирующую функцию σ, зависящую от упомянутого параметра α коррекции и принимающую значения от 0 до 1, при этом, упомянутая корректирующая функция σ принимает значение 0, если упомянутый параметр α коррекции равен 1, и упомянутая корректирующая функция σ принимает значение 1, при упомянутом параметре α коррекции, стремящемся к бесконечности.
В предпочтительном варианте осуществления вышеописанного способа упомянутую эффективную амплитуду Aeff обеспечивают как частное, при этом, делимое упомянутого частного от деления содержит сумму упомянутой дисперсии <(δP)2> и произведения упомянутой корректирующей функции σ и квадрата среднего артериального давления <P>, и делитель упомянутого частного от деления содержит среднее артериальное давление <P>.
В предпочтительном варианте вышеописанного способа упомянутую эффективную продолжительность deff обеспечивают как частное от деления делимого, содержащего спектральную плотность S(ω), при ω=0, на делитель, содержащий сумму упомянутой дисперсии <(δP)2> и произведения упомянутой корректирующей функции σ и квадрата среднего артериального давления <P>.
В дополнительном предпочтительном варианте вышеописанного способа упомянутую спектральную плотность S(ω) определяют в форме Фурье-преобразования автокорреляции упомянутой кривой изменения давления.
В предпочтительном варианте вышеописанного способа спектральную плотность S(ω), при ω=0, обеспечивают в форме упомянутой дисперсии <(δP)2>, умноженной на постоянный коэффициент.
В предпочтительном варианте вышеописанного способа определяют сравнительную величину, по меньшей мере, одного из упомянутых физиологических параметров по упомянутой кривой изменения давления, с использованием алгоритмов формы пульса.
В предпочтительном варианте осуществления вышеупомянутый способ дополнительно содержит следующие этапы:
- вводят информацию о перемещающемся отклонении характерной физической величины (например, температуры, оптической/ спектральной характеристики или концентрации индикатора), введенной в кровоток упомянутого пациента в первом местоположении кровообращения упомянутого пациента, и
- записывают показания измерения упомянутой физической величины во втором местоположении кровообращения упомянутого пациента с течением времени,
при этом упомянутые показания измерения упомянутой физической величины в упомянутом втором местоположении кровообращения упомянутого пациента записывают в виде кривой разведения, и упомянутую сравнительную величину, по меньшей мере, одного из упомянутых физиологических параметров определяют по упомянутой кривой разведения с использованием алгоритмов разведения.
В предпочтительном варианте вышеописанного способа упомянутую сравнительную величину применяют для калибровки.
В дополнение к вышеописанному способу, упомянутая калибровка предпочтительно содержит этап определения, с применением упомянутой сравнительной величины, параметра α коррекции, применяемого при определении упомянутого моделирующего параметра, при этом, упомянутый параметр α коррекции принимает значения, большие или равные 1, причем, чем выше упомянутые значения, тем меньше ритм сердца пациента отклоняется от ритмического состояния.
В предпочтительном варианте вышеописанного способа упомянутый физиологический параметр отбрасывают и повторно вычисляют, если разность между найденным физиологическим параметром и соответствующей сравнительной величиной превышает пороговое значение.
Дополнительный вариант осуществления настоящего изобретения содержит физический носитель хранения, содержащий хранимую на нем компьютерную программу, которая, при исполнении в компьютерной системе, предписывает компьютерной системе выполнять вышеописанный способ.
Как правило, любой из вариантов осуществления или вариантов исполнения, описанных или упомянутых в настоящей заявке, может быть особенно полезен в зависимости от фактических условий применения. Кроме того, признаки одного варианта осуществления можно объединять с признаками другого варианта осуществления, а также с признаками, по существу, известными из известного уровня техники, насколько технически возможно, и если не указано иначе.
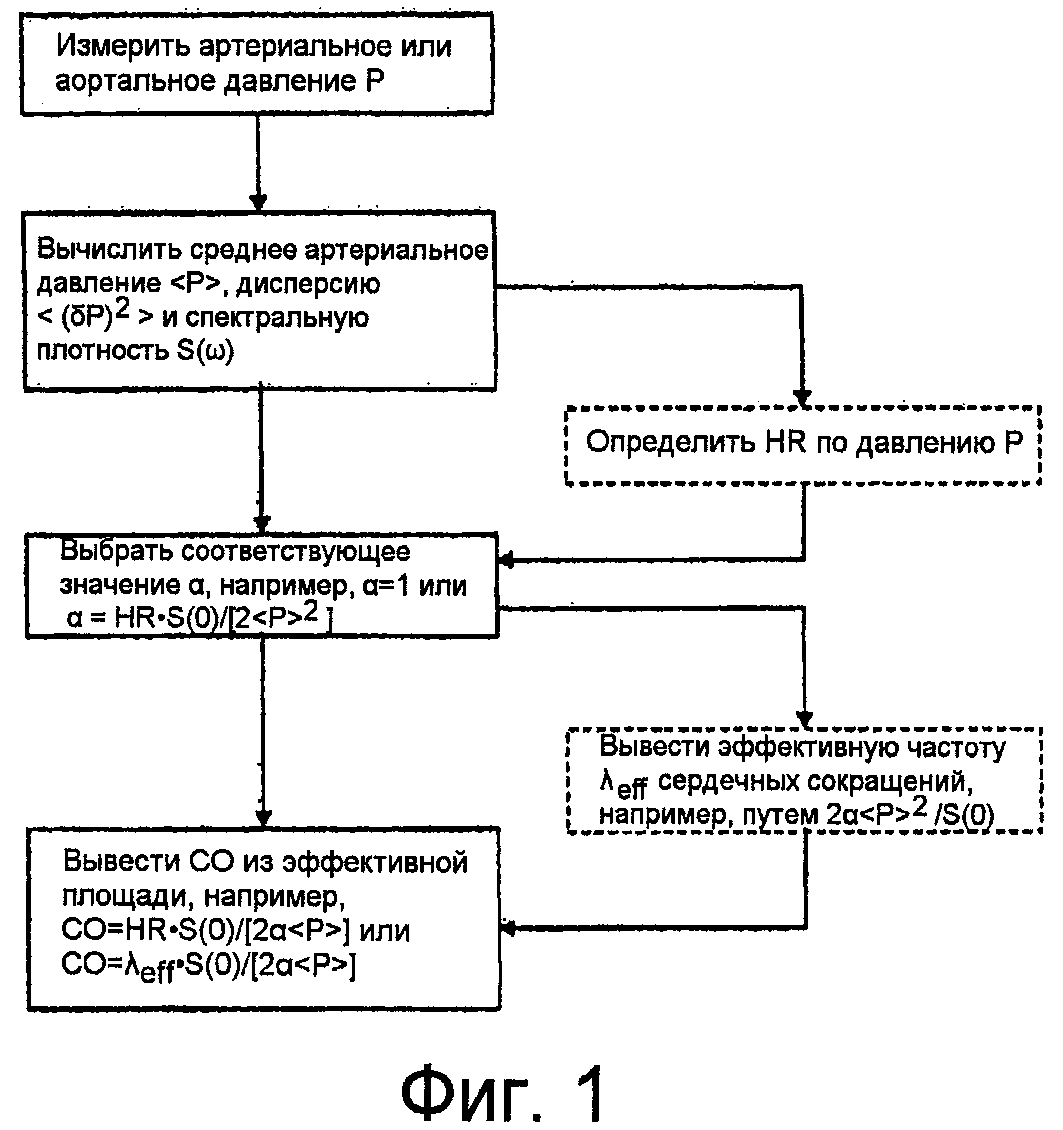
Далее приведено подробное описание изобретения. Прилагаемые чертежи, на которых представлены схематичные изображения последовательности операций и графики, служат для более глубокого понимания признаков настоящего изобретения. На данных чертежах:
Фиг.1 - блок-схема последовательности операций, поясняющая предпочтительный вариант осуществления способа согласно изобретению для определения минутного сердечного выброса CO. Дополнительные признаки представлены пунктирными линиями. Количественный параметр α может зависеть от CVP (центрального венозного давления) и/или колебаний частоты сердечных сокращений,
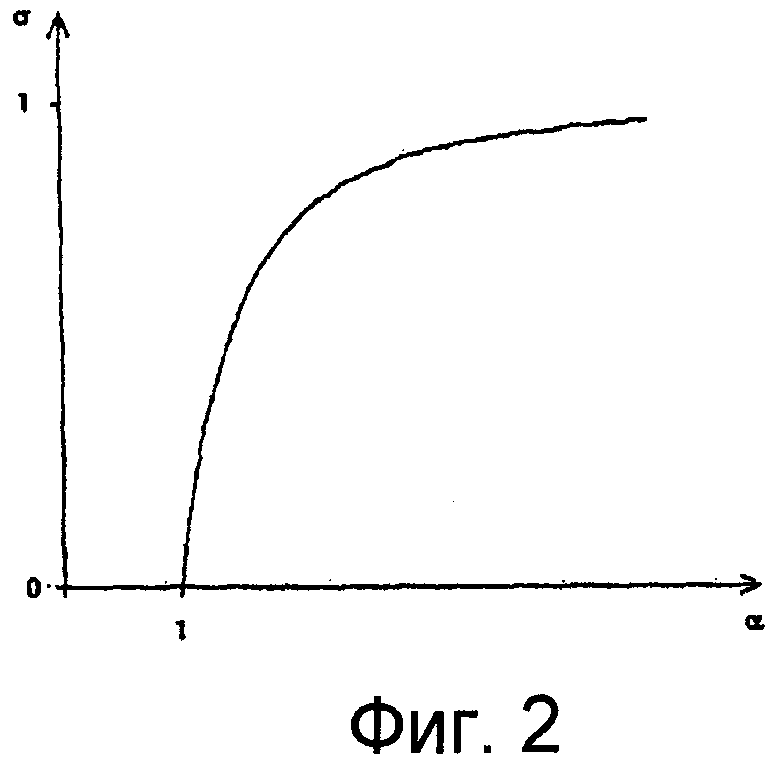
Фиг.2 - примерный график функциональной взаимозависимости σ(α), т.е. поведение σ при типичных значениях α, в соответствии с одним вариантом осуществления настоящего изобретения,
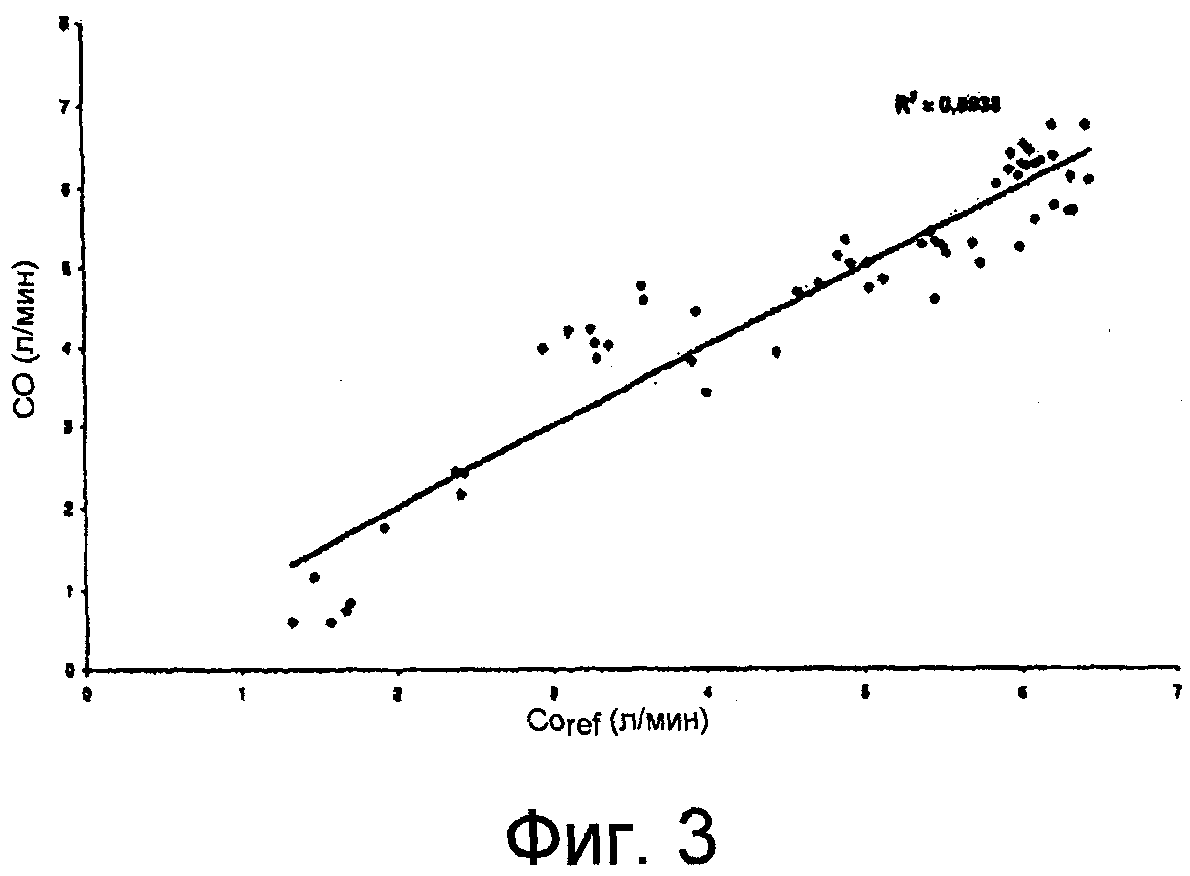
Фиг.3 - кривая корреляционной связи между значениями CO, найденными в соответствии с вариантом осуществления настоящего изобретения по уравнению (24) и опорным значениям COref, полученным посредством транспульмонарного измерения минутного сердечного выброса,
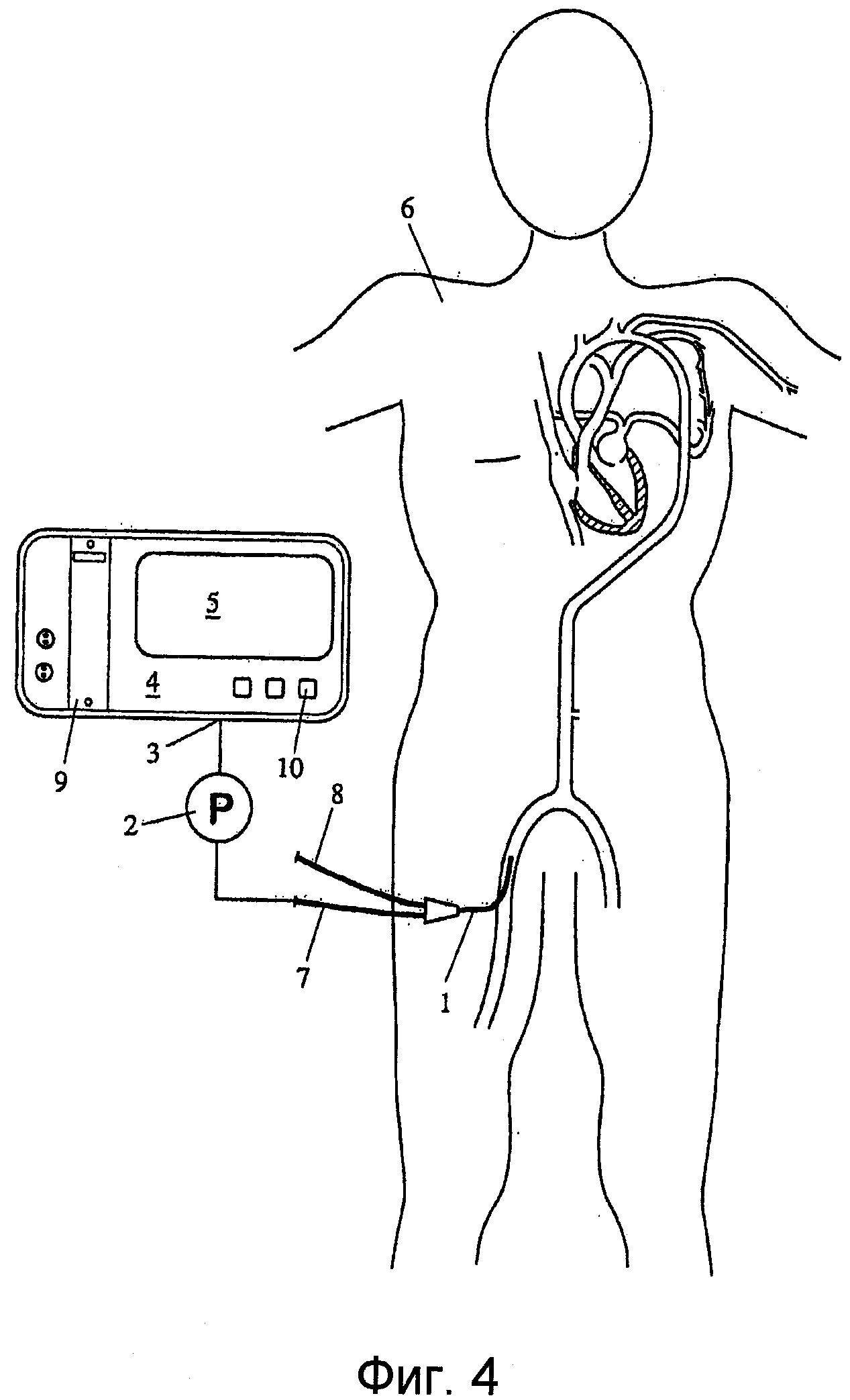
Фиг.4 - изображение общей схемы устройства в соответствии с вариантом осуществления настоящего изобретения, с использованием датчика артериального давления.
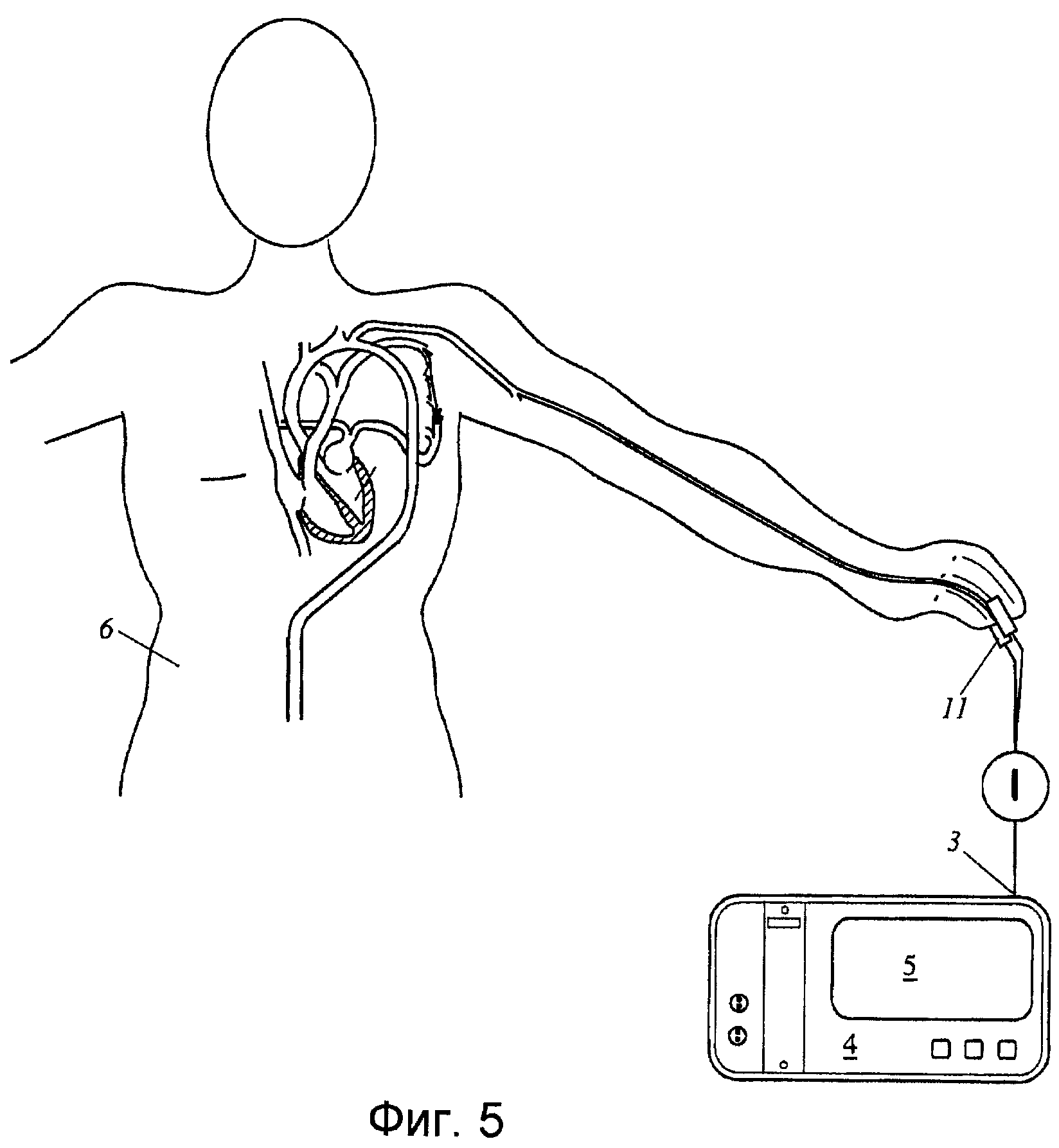
Фиг.5 - изображение общей схемы устройства согласно различным вариантам осуществления настоящего изобретения, с использованием датчика оптоплетизмографии.
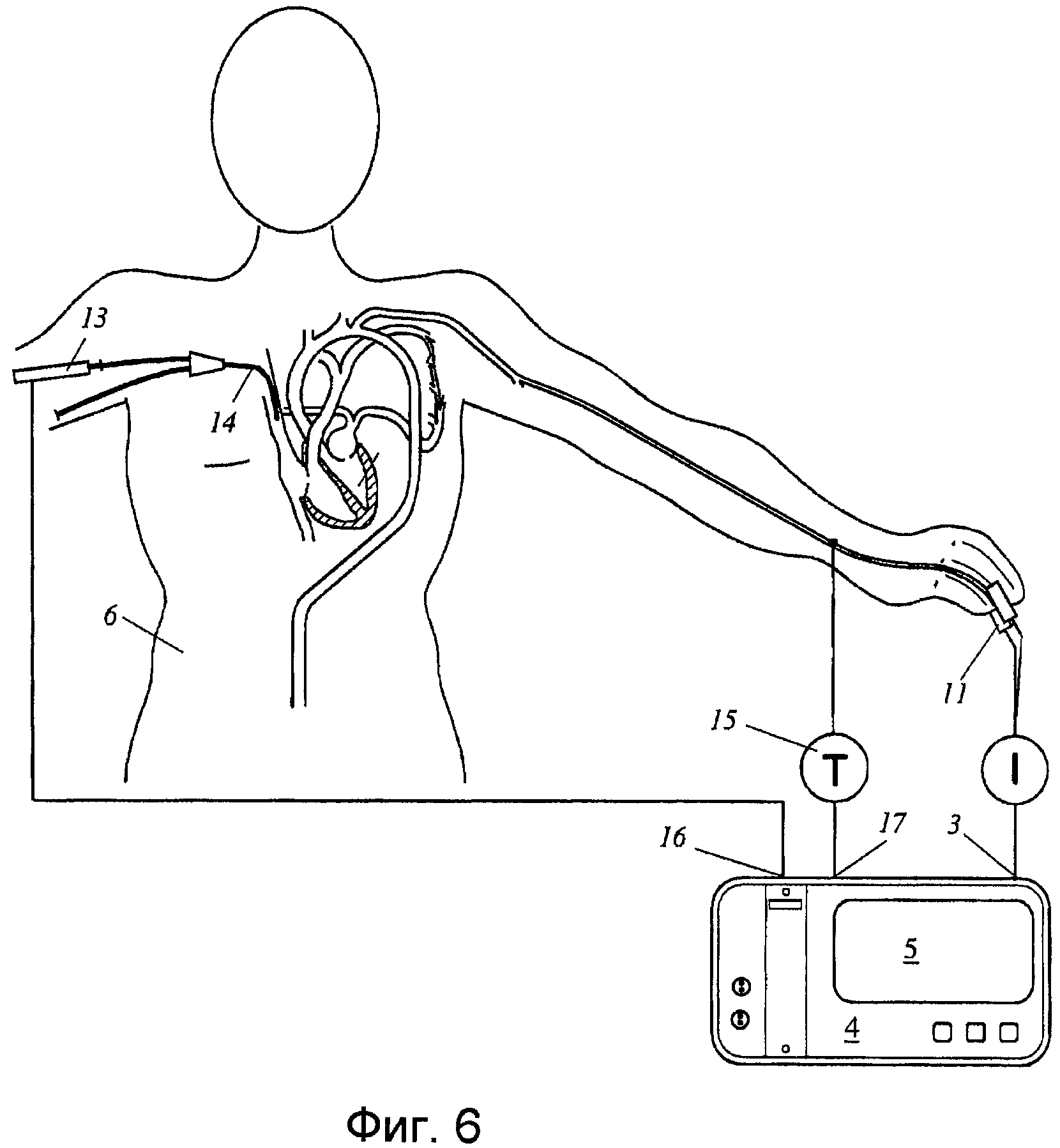
Фиг.6 показывает видоизмененную схему, сходную с Фиг.5.
На Фиг.1 представлены (указанные обычными линиями) важнейшие этапы одного предпочтительного варианта осуществления настоящего изобретения. Пунктирные линии указывают дополнительные этапы для модификации варианта осуществления и создания, тем самым, другого предпочтительного варианта осуществления. Для удобства изображения предпочтительных вариантов осуществления и облегчения их понимания, нижеследующее описание также имеет целью более подробное пояснение принципиальных основ вычислительного устройства.
Основное внимание в описанных вариантах осуществления уделяется определению минутного сердечного выброса, однако, с помощью устройства и способов в соответствии с настоящим изобретением можно также устанавливать другие физиологические параметры, в частности, параметры, характеризующие сердечную функцию, например, фракции выброса или ударный объем сердца.
Как показано на Фиг.1, в настоящем изобретении используются показания измерений, представляющие собой артериальное или аортальное давления P, при этом, показания обеспечиваются либо в виде необработанных данных (например, напряжения или электрического тока) из подходящего датчика или уже в предварительно обработанном состоянии. Выполнение фактических измерений можно осуществлять различными способами, например, с применением подходящего артериального катетерного узла с измерительным преобразователем давления или с применением неинвазивных измерений артериального давления, и широко известно в технике, и не относится к самому способу согласно изобретению. Измеренное давление зависит от времени t и получается в результате суперпозиции нескольких сердечных сокращений bk(t - tk), начиная с момента времени tk. Вследствие отражений в артериальном дереве, в получаемое давление могут вносить вклад несколько сердечных сокращений, что можно описать следующей функцией:
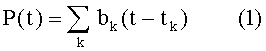
В общем, все сокращения могут различаться между собой, но, для ограниченного периода времени, существует такое среднее сокращение b(t), что функцию в уравнении (1) можно с достаточной точностью описать следующим образом
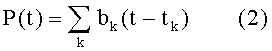
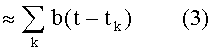
Поскольку частота HR сердечных сокращений здоровых живых существ обычно не изменяется значительно в течение ограниченного интервала времени (например, от 10 с до 200 с), то сокращения следуют одно за другим почти равномерно, и моменты, когда происходят сокращения, определяют выражением tk = k/HR.
Однако во время сильной аритмии сердечные сокращения происходят очень нерегулярно. Наихудшим сценарием является беспорядочное наступление событий независимых сокращений, что можно описать пуассоновским процессом, т.е. интервалы между последовательными сокращениями распределены случайным образом в соответствии с нижеследующим экспоненциальным распределением q:
q(tk -tk-1) = HR * exp(-HR * (tk -tk-1)).
В данном случае, суперпозиция согласно уравнению (3) является процессом Кемпбелла, описанным в работе: [N.R. Campbell, “The study of discontinuous phenomena”. Proc. Camp. Philos. Soc. Math. Phys. Sci, 15:117-136, 1909].
В соответствии с настоящим изобретением, сердечную функцию можно оценить в двух состояниях, т.е. при ритмичной и неритмичной сердечной активности, с помощью среднего, дисперсии и спектральной плотности измеренной функции P(t) давления.
Среднее артериальное давление <P> выводят интегрированием измеренного давления P(t) по соответствующему интервалу T времени, т.е.
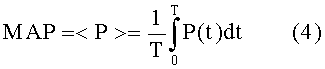
Дисперсию давления вычисляют из δP(t) = P(t) - < P>, так что:
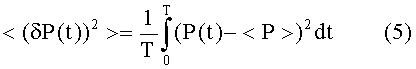
Спектральная плотность является Фурье-преобразованием автокорреляции от P(t) и, следовательно, определяется следующим образом:
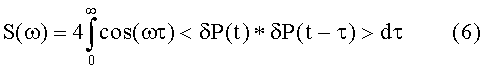
В случае аритмии, аритмические состояния можно описать приложениями уравнений (4)-(6) к процессу Кемпбелла, что дает, в результате, следующие функции:
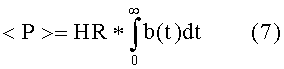
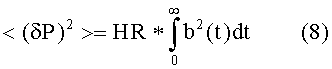
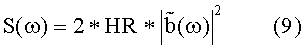
где Фурье-преобразование 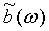 среднего сокращения b(t) получено как:
среднего сокращения b(t) получено как:
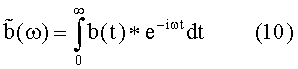
Для ритмических состояний с периодически следующими сердечными сокращениями, применение уравнений (4)-(6) дает, в результате:
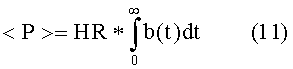

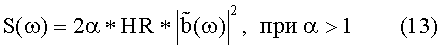
Параметр α зависит от изменчивости частоты сердечных сокращений в течении времени, намного большего, чем T. Для практических реализаций, α можно определить путем эмпирических исследований или простой оценкой с учетом принципов, изложенных в настоящей заявке.
Объединение разных условий можно сделать на основе следующих соображений. Уравнения (7)-(9) и (11)-(13) имеют одинаковую структуру. В частности, α в уравнении (13) уменьшается со снижением точности в периодичности сокращений b(t). И, наконец, для хаотично происходящих сокращений, α стремится к нижнему пределу α = 1, и уравнения (13) и (11) становятся идентичными. Уравнения (12) и (8) также могут быть объединены. Поэтому, вводят функцию σ(α), которая стремится к 0, когда α стремится к 1, и σ(α) стремится к 1 для α >> 1. Данная зависимость изображена, в качестве примера, на Фиг.2.
В результате, ритмичная, аритмичная и промежуточная работа сердца описывается следующими выражениями:
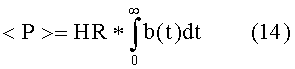
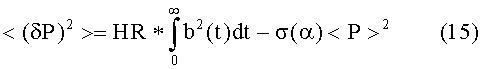
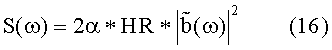
где α и σ ограничены следующим образом:
|
Кроме того, полученные данные можно интерпретировать так, чтобы иметь возможность характеризовать среднее сокращение через его амплитуду A и продолжительность d.
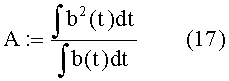
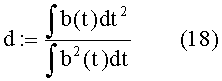
Таким образом, если принять, что волна является прямоугольным импульсом,
|
То ввод уравнений (14)-(16) дает:
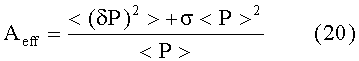
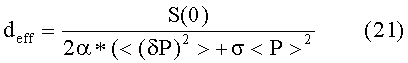
Здесь индекс «eff» введен для обозначения того, что Aeff и deff являются эффективными значениями, реконструированными из измеренного сигнала P(t) давления. Следует подчеркнуть, что упомянутая реконструкция возможна во всех состояниях, даже если сердечные сокращения не обнаружимы на кривой P(t) изменения давления. Кроме того, произведение амплитуды Aeff и продолжительности deff дает, в результате, площадь под эффективным сокращением Feff, которая составляет
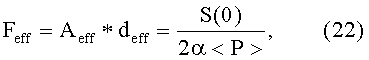
даже если сокращения не представляются в виде прямоугольного импульса.
Кроме того, отношение
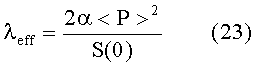
дает приближение частоты сердечных сокращений во всех обстоятельствах.
В соответствии с вариантами осуществления настоящего изобретения, полученные параметры используют для получения характеристик сердечной функции пациента. В частности, количественные величины Aeff, deff, λeff и их комбинации полезны для получения таких характеристик, как ударный объем SV сердца, минутный сердечный выброс CO, фракция EF выброса и других.
В частности, минутный сердечный выброс CO можно получить из выражения
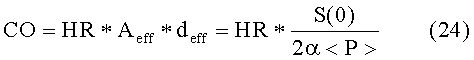
Для проверки значений, полученных по способу согласно изобретению, выполнили сравнение с известным стандартным опорным способом. С этой целью, минутный сердечный выброс измерили по настоящему изобретению, а также установленным термодилюционным способом в соответствии с ЕР-А-0 637 932.
Результаты данного сравнения представлены на Фиг.3. На данной фигуре, абсцисса представляет минутный сердечный выброс литрах в минуту, определенный опорным способом, и ордината представляет минутный сердечный выброс литрах в минуту, определенный способом согласно изобретению. Соответственно, имеет место хорошее согласование между результатами, полученными для минутного сердечного выброса при обоих измерениях.
Кроме того, из параметров, найденных в соответствии со способом согласно изобретению несложно получить также другие сердечные функции, ударный объем сердца и фракцию выброса.
Ударный объем SV сердца получают делением минутного сердечного выброса на частоту сердечных сокращений HR; то есть: SV = Aeff * deff.
Кроме того, величина deff*HR соответствует фракции EF выброса. В зависимости от местоположения измерения давления (легочная артерия или системная артерия), показания которого используют, упомянутая фракция выброса может быть фракцией выброса либо левого, либо правого желудочка.
Ниже приведено описание дополнительных вариантов осуществления изобретения.
Оптимальное упрощение способа согласно изобретению можно осуществить, если требуется спектральная плотность для частот f, близких к ω = 2πf = 0 или равных данной частоте. Тогда, в соответствии с уравнением (6), можно воспользоваться дисперсией давления P для аппроксимации
S(0) ≈ 2 * (<P2> - <P>2) (25)
= 2 * <(δP)2> (26)
Данное упрощение можно также использовать в других выражениях, в частности, в уравнении (24).
Кроме того, возможна поправка на аритмию, так как коэффициент 1/α может зависеть от изменчивости частоты сердечных сокращений.
Кроме того, на коэффициент 1/α может влиять центральное венозное давление CVP. Поэтому, чтобы установить α, можно учитывать CVP либо вводом данных измерения непосредственно в форме, обеспечиваемой источником измерения CVP, либо вводом пользователем. В общем, измерение CVP, по существу, широко известно в данной области техники и не относится к способу согласно изобретению.
Влияние изменения частоты сердечных сокращений в настоящем изобретении можно выявить определением числа сердечных сокращений в выборке данных давления и эффективной частоты λeff сердечных сокращений, определяемой из уравнения (23). В частности, отношение HR и λeff дает уравнение
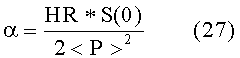
Поэтому возможна настройка системы контроля пациента, реализующей настоящее изобретение, на текущую изменчивость частоты сердечных сокращений.
Спектральную плотность S(0) для ω = 2πf = 0 можно также определить иначе, например,
a) с помощью спектральной плотности для частот, стремящихся к нулю, т.е. S(0) = limω→0S(ω) = limt→0S(2πf), или
b) подгонкой соответствующей функции (например, S(ω) = S(0)/[1 + (ωτ)2]n+1) к измеренному спектру. В данном случае, в предпочтительном варианте следует пренебречь локальным максимумом, соответствующим частоте сердечных сокращений.
На Фиг.4 показана общая схема устройства в соответствии с вариантом осуществления настоящего изобретения. Артериальный катетер 1 снабжен датчиком давления для измерения артериального давления. Датчик давления катетера 1 соединен, через измерительный преобразователь 2 давления, с входным каналом 3 устройства 4 контроля пациента. Кроме проксимального порта 7, применяемого для получения сигнала давления, катетер 1 может содержать, по меньшей мере, один другой проксимальный порт 8 для выполнения дополнительных функций, например, измерений температуры крови или чего-то подобного. Устройство 4 контроля пациента содержит соответствующее средство хранения для хранения показаний артериального давления с течением времени и выполнения функции обрабатывающего хранилища.
Устройство контроля пациента содержит также вычислительное средство 9, которое может содержать экземпляр 9 обработки цифровых сигналов, который запрограммирован на выполнение вычислений в соответствии с вышеописанными уравнениями, дисплей 5 для визуализации найденных параметров (в виде численных величин, графически или обоими способами) и элементы 10 управления для управления упомянутым устройством. Кроме того, найденные параметры могут сохраняться на носителе для записи информации. С этой целью, устройство 4 контроля пациента может содержать различные интерфейсные порты для подключения периферийного оборудования.
В частности, предпочтительный вариант осуществления нуждается только в одном датчике артериального давления. Хотя показано, что датчик является инвазивным, использующим упомянутый катетер 1, но, взамен, можно применить неинвазивный датчик давления. Вместо показанного артериального катетера 1 (или в дополнение к нему), можно также применить катетер в легочной артерии, в частности, если требуется определить фракцию выброса из правого желудочка.
Полезными, в частности, могут быть разные варианты осуществления сборной конструкции инвазивного датчика давления. Давление либо может передаваться гидравлически к проксимальному катетерному порту 7 и измеряться внешним датчиком, либо может быть измерено непосредственно в намеченном месте датчиком, установленным на конце или вблизи конца катетера. Возможно применение емкостных датчиков, пьезоэлектрических датчиков или оптических датчиков давления (например, на базе интерферометра Фабри-Перо).
Как видно из процедуры, представленной на Фиг.1, первый сигнал P давления измеряют упомянутым устройством, показанным на Фиг.4, например, в бедренной артерии, лучевой артерии, плечевой артерии или легочной артерии, или любом другом подходящем артериальном сосуде, находящемся позади по кровотоку от левого или правого желудочка, соответственно.
С использованием уравнения (6), вычислительное устройство 9 вычисляет среднее артериальное давление, дисперсию и спектральную плотность для давления, измеренного в течение соответствующего интервала времени (например, от 10 с до 200 с). Для вычисления спектральной плотности можно применить вышеозначенное средство для быстрого преобразования Фурье.
Кроме того, для ω = 0 и α = 1, вычислительное средство 9 использует уравнение (22) для вычисления эффективной площади Feff. Зависимость между эффективной площадью Feff и ударным объемом SV сердца дается отношением 1/α, где последнее можно определить эмпирически или, в качестве альтернативы, обращением к опорным результатам измерения SV (например, методом транспульмонарной термодилюции) для пациента, проходящего лечение. Чтобы выполнить данные опорные измерения SV, устройство 4 контроля пациента может быть соответственно оборудовано, например, посредством обеспечения дополнительных входных каналов для показаний измерения методом термодилюции и реализации подходящих термодилюционных алгоритмов в вычислительном средство 9, как, по существу, известно в данной области.
Знание SV позволяет определять CO согласно CO = HP * SV, где частоту HR сердечных сокращений можно также, по желанию, определять по давлению и спектральной плотности или другими способами.
Хотя варианты осуществления, подробно описанные выше, основаны на измерении артериального давления, изобретение может быть выполнено на основе плетизмографических измерений, как описано в водной части описания. Фиг.5 показывает схему с оптоплетизмографическим датчиком-зажимом 11 пальца, использующим фотометрическое средство для измерения проходящей интенсивности света и передающим соответствующий сигнал к входному каналу 3 устройства 4 контроля пациента. Устройство 4 контроля пациента содержит подходящее средство хранения для хранения показаний фотометра по времени и выполнения функций обрабатывающего хранилища.
Контролирование пациента также содержит вычислительное средство 9, которое может включать в себя экземпляр 9 обработки цифровых сигналов, который запрограммирован выполнять вычисления в соответствии с уравнениями, описанными выше, причем кривая изменения давления и производные от нее члены уравнения заменяются соответствующими членами уравнения, основанными на плетизмографическом измерении.
Как описано выше в других вариантах осуществления, также обеспечиваются дисплей 5 для визуализации определенных параметров (в виде числовых значений, графически или обоих) и элементы 10 управления для работы упомянутого устройства. Более того, определенные параметры могут быть сохранены на носитель записи и/или распечатаны.
Вариант осуществления, изображенный на Фиг.6, в целом представлен в виде варианта осуществления по Фиг.5, но дополнительно содержит канал 13 инжекции для ввода пилюли температурой ниже температуры крови через центральный венозный катетер 14 к кровотоку в верхней полой вене пациента, и датчик 15 температуры для измерения температуры артериальной крови с течением времени. Температура артериальной крови и сигнал, указывающий температуру введенной пилюли и время введения предоставляются устройству 4 контроля пациента посредством дополнительных входных каналов 16 и 17, соответственно. Средства памяти устройства 4 контроля пациента записывают температуру артериальной крови, измеренную с течением времени, для определения от нее кривой термодилюции. Устройство 4 контроля пациента выполнено с возможностью определения, с использованием, по существу, известных алгоритмов термодилюции, по меньшей мере, одного сравнительного значения физиологического параметра по кривой разведения, чтобы сделать возможным калибровку системы.