Результат интеллектуальной деятельности: КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И ДВЕ СОЛЬВАТНЫЕ ФОРМЫ СОЛЕЙ МОЛОЧНОЙ КИСЛОТЫ 4-АМИНО-5-ФТОР-3-[5-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-1 - Н-БЕНЗИМИДАЗОЛ-2-ИЛ]ХИНОЛИН-2(1Н)ОНА
Вид РИД
Изобретение
Предпосылки создания изобретения
Область изобретения
Настоящее изобретение относится к кристаллическим формам солей молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1Н-бензимидазол-2-ил]хинолин-2(1Н)-она, а также к способам их получения, фармацевтическим композициям, содержащим данные формы, и к способам лечения с использованием данных форм.
Релевантный уровень техники
Полиморфизм подразумевает существование более чем одной кристаллической структуры вещества. Способность химического вещества кристаллизоваться более чем в одну кристаллическую модификацию может оказывать сильное влияние на длительность хранения, растворимость, состав и обрабатываемость лекарственного средства. Кроме того, на действие лекарственного средства можно влиять полиморфизмом молекулы лекарственного средства. Различные полиморфы обладают различной скоростью поглощения в организме, способствующей необходимой низкой или высокой биологической активности. В крайних случаях нежелательный полиморф может быть даже токсичным. Образование неизвестной полиморфной модификации в процессе производства может иметь невероятный эффект.
Таким образом, понимание и регулирование полиморфизма дает явные преимущества при выводе новых лекарственных средств на рынок. Первое и основное - знание любых возможных полиморфов лекарственного средства может быть использовано для уменьшения возможности загрязнения другими полиморфами при производстве лекарственного средства или хранении. В некоторых случаях несоблюдение уровней загрязнения может быть опасным для жизни. Кристаллизация нецелевой полиморфной модификации при производстве может означать недели или даже месяцы простоя производства, пока ученые найдут и устранят причину возникновения новой кристаллической формы или пойдут на следующий этап тестирования для получения одобрения новой формы.
Во-вторых, понимание того, появление каких кристаллических структур возможно в некоторых случаях, позволяет исследователям максимизировать желаемые свойства продукта, такие как растворимость, состав, обрабатываемость и длительность хранения. Понимание этих факторов на ранней стадии разработки нового лекарственного средства может подразумевать более высокую активность лекарственного средства, большую его стабильность или дешевизну производства.
4-Амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-он, имеющий формулу (I):
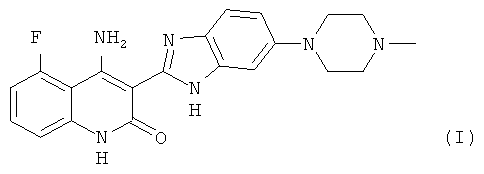
описан в US 6,774,237 и WO 2006/127926. В WO 2006/127926 содержатся сведения о полиморфных и сольватных формах 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она. Однако в WO 2006/127926 не описаны новая безводная форма II, полупентагидратная форма или метанольный сольват соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она настоящего изобретения или ее ДМФА-сольват. Знание потенциальных полиморфных форм солей молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она полезно при разработке подходящих дозированных форм, поскольку неудачное применение единственной полиморфной формы при клинических исследованиях или исследованиях стабильности может привести к строгой дозировке используемой формы или же не будет воспроизводимости результатов от партии к партии. Важно, чтобы полиморфная форма, будучи единожды выбранной, могла быть воспроизводимо получена и оставалась бы неизменной в течение длительного периода времени при разработке дозированной формы. Также желательно разработать способ получения солей молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она высокой степени чистоты, поскольку присутствие примесей может привести к нежелательным токсикологическим эффектам.
Неожиданно было обнаружено, что различные кристаллические модификации (новые полиморфные или сольватные формы) солей молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она, охарактеризованные далее, могут быть получены подбором специально выбранных условий процесса, например, выбором системы растворителей, продолжительности кристаллизации и т.д.
Краткое содержание изобретения
Настоящее изобретение относится к по существу чистым кристаллическим формам, а именно к новой безводной форме, полупентагидратной форме, метальному сольвату или ДМФА-сольвату солей молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она.
Кроме того, изобретение относится к фармацевтическим композициям, содержащим:
(а) терапевтически эффективное количество кристаллической безводной формы, полупентагидратной формы, метального сольвата или ДМФА-сольвата солей молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она настоящего изобретения и
(б) по меньшей мере, один фармацевтически приемлемый носитель, разбавитель, растворитель или эксципиент.
Также настоящее изобретение относится к способу лечения заболевания, реагирующего на ингибирование рецептора тирозинкиназы, как описано в US 6,774,237 и WO 2006/127926. Данные способы включают, но не ограничиваются только этим, ингибирование активности рецепторов VEGFR2 и FGFR3, включающее стадию введения субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества кристаллической безводной формы, полупентагидратной формы, метального сольвата или ДМФА-сольвата солей молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она настоящего изобретения. Краткое описание рисунков
На фиг.1 представлена порошковая рентгенограмма новой безводной формы соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она.
На фиг.2 представлена порошковая рентгенограмма полупентагидратной формы соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1Н-бензимидазол-2-ил]хинолин-2(1H)-она.
На фиг.3 представлена порошковая рентгенограмма метанольного сольвата соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она.
На фиг.4 представлена порошковая рентгенограмма ДМФА-сольвата соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1Н-бензимидазол-2-ил]хинолин-2(1H)-она.
На фиг.5А представлен ИК-спектр с преобразованием Фурье новой безводной формы соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она.
На фиг.5Б представлен ИК-спектр с преобразованием Фурье полупентагидратной формы соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она.
На фиг.5В представлен ИК-спектр с преобразованием Фурье метанольного сольвата соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она.
На фиг.6А представлен спектр комбинационного рассеяния новой безводной формы соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она.
На фиг.6Б представлен спектр комбинационного рассеяния полупентагидратной формы соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она.
На фиг.6В представлен спектр комбинационного рассеяния метанольного сольвата соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она.
Подробное описание изобретения
Полиморфная безводная форма соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она, полиморфная форма полупентагидрата соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она и метанольный сольват соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она могут быть получены посредством превращения полиморфов и сольватов, описанных в находящейся на рассмотрении заявке заявителя WO 2006/127926. Заявленные «кристаллические модификации» (или «полиморфные формы», «полиморфы» или «кристаллические формы») отличаются друг от друга термодинамической стабильностью, физическими параметрами, рентгеновской структурой и/или способами получения и отличаются от полиморфов и сольватов, описанных в WO 2006/127926. Кристаллические формы соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она, к которым относится настоящее изобретение, характеризуются порошковыми рентгенограммами, представленными на фиг.1-4.
Термины «выделенный» и/или «по существу чистый», используемые в настоящей заявке, означают, что более чем 50% кристаллических солей молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она содержится в одной из форм, описанных в настоящей заявке, и предпочтительно, содержится, по меньшей мере, 70%, более предпочтительно, по меньшей мере, 80%, и еще более предпочтительно, по меньшей мере, 90% одной из кристаллических форм, описанных в настоящей заявке.
Первый объект изобретения относится к по существу чистой полиморфной безводной форме соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1Н)-она, как показано на фиг.1. Безводная форма настоящего изобретения, известная в настоящей заявке как безводная форма II, может быть выделена из этанола, смеси этанол/ацетонитрил (98:2) или изопропанола при использовании полиморфной формы А, описанной в находящейся на рассмотрении заявке заявителя WO 2006/127926. Безводная форма II также может быть выделена из этанола, ацетонитрила или изопропанола при использовании формы В (моногидрата), описанной в находящейся на рассмотрении заявке заявителя WO 2006/127926.
Второй объект изобретения относится к по существу чистому полиморфному полупентагидрату соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она, как показано на фиг.2. Полупентагидрат настоящего изобретения может быть выделен посредством кристаллизации из смесей этанол/вода. Полупентагидрат также может быть выделен из смесей этанол/вода (от около 80:20 до около 60:20), из смесей этанол/вода/тетрагидрофуран или смесей ацетон/вода при использовании полиморфной формы А, описанной в находящейся на рассмотрении заявке заявителя WO 2006/127926.
Третий объект изобретения относится к по существу чистому полиморфному метанольному сольвату соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она, как показано на фиг.3.
Для получения перечисленных выше солей молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она могут быть использованы различные способы. Данные способы описаны ниже в примерах.
Еще один объект настоящего изобретения относится к фармацевтической композиции, содержащей:
(а) терапевтически эффективное количество по существу чистых кристаллических форм солей молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она, охарактеризованных одной из порошковых рентгенограмм, представленных на фиг.1-4 и
(б) по меньшей мере, один фармацевтически приемлемый носитель, разбавитель, растворитель или эксципиент.
Предпочтительно более чем 50% кристаллической формы, содержащейся в композиции, является одной из выбранных форм.
«Терапевтически эффективное количество» обозначает количество полиморфа изобретения, которое при введении субъекту, нуждающемуся в этом, достаточно для эффективного лечения болезненного состояния, облегчаемого ингибированием активности рецепторов VEGFR2 и FGFR3. Количество соединения настоящего изобретения, которое будет терапевтически эффективным, будет зависеть от различных факторов, таких как болезненное состояние и его тяжесть, индивидуальное состояние субъекта, нуждающегося в нем, и т.д., и может быть легко определено специалистом в данной области.
По меньшей мере, один фармацевтически приемлемый носитель, разбавитель, растворитель или эксципиент включает, но не ограничивается этим, микрокристаллическую целлюлозу, лактозу, двуосновный фосфат кальция, триосновный фосфат кальция, натрия крахмал гликолят (NaKT), кросповидон, кросскармеллозу (КК), лаурилсульфат натрия (ЛСН), Tween, полиэтиленгликоль (ПЭГ), повидон, гидроксипропилцеллюлозу (НРМС), стеарат Mg, стеарат Са, стеариновую кислоту, натрий стеарил фумарат и диоксид кремния, которые могут быть легко выбраны специалистом в данной области в зависимости от необходимого вида введения. Иллюстративные примеры подходящих видов введения включают оральное, назальное, парентеральное, топическое, трансдермальное и ректальное. Фармацевтические композиции настоящего изобретения могут иметь любую фармацевтическую форму, выбранную специалистом как наиболее подходящую. Подходящие фармацевтические формы включают твердые, полутвердые, жидкие или лиофилизированные составы, такие как таблетки, порошки, капсулы, суппозитории, суспензии, липосомы и аэрозоли.
Еще один объект настоящего изобретения относится к способу лечения заболевания, реагирующего на ингибирование активности рецепторов VEGFR2 и FGFR3, включающему введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества по существу чистой кристаллической формы соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она, охарактеризованной одной из порошковых рентгенограмм, представленных на фиг.1-4.
Заболевания, реагирующие на ингибирование активности рецептора VEGFR2 и FGFR3, включают, но не ограничиваются этим, рак простаты, колоректальный рак, рак груди, множественную миелому, рак поджелудочной железы, мелкоклеточную карциному, острый миелолейкоз, хронический миелолейкоз, миелопролиферативные заболевания, немелкоклеточную лейкемию, мелкоклеточную лейкемию, хроническую лимфоидную лейкемию, саркому, меланому, лимфому, рак щитовидной железы, нейроэндокринный рак, рак почек, рак желудка, желудочно-кишечные стромальные опухоли, глиому, рак мозга, рак мочевого пузыря и холангиокарциному. Другие состояния описаны в патентах заявителя и/или патентной заявке US 6,774,237, публикациях патентов США 10/644,055, 10/983,174, 10/839,793. 11/041,191 и WO 2006/127926.
Как указано выше, примеры типов введения включают оральное, назальное, парентеральное, топическое, трансдермальное и ректальное. Введение кристаллических форм может быть осуществлено посредством введения фармацевтической композиции настоящего изобретения или посредством любого другого эффективного метода.
Конкретные воплощения изобретения представлены посредством ссылки на следующие далее примеры. Следует понимать, что данные примеры представлены только для иллюстрации изобретения и никаким образом не ограничивают объем настоящего изобретения.
ОПРЕДЕЛЕНИЯ
ТГФ - тетрагидрофуран
ДМФА - диметилформамид
Тип аппаратуры и градуировка аналитической аппаратуры:
Порошковая рентгеновская дифракция (XRPD): Прибор: Bruker D8 Advance, отражение, СиКц-излучение
ИК с преобразованием Фурье в вазелиновом масле. Прибор: Bruker VERTEX 70
Монокристаллическая структура: Прибор: Bruker AXS, СиКц-излучение
Спектр комбинационного рассеяния с преобразованием Фурье: Bruker RFS100-S, мощность лазера 50 мВт (1004 нм)
Пример 1. Безводная форма II лактата 4-амино-5-фтор-3-[5-(4-
метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она
Безводную форму А превращают в безводную форму II посредством уравновешивания при перемешивании суспензии безводной формы А и предпочтительно избытка молочной кислоты в органическом растворителе, таком как этанол, смесь 98:2 (об./об.) этанол/ацетонитрил или изопропанол.
Безводную форму А также получают посредством уравновешивания могогидрата В предпочтительно в присутствии избытка молочной кислоты в этаноле, изопропаноле или ацетонитриле.
Титрование 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она перхлорной кислоты и титрование молочной кислоты показывает стехиометрическое соотношение (1:1) основания и молочной кислоты. По данным термогравиметрического анализа, содержание воды <0,5%, чистота по данным ВЭЖХ >99,5%.
При нагревании безводная формы II превращается в безводную форму А, как видно из данных рентгеновского исследования, при нагревании ячейки примерно до 160°С. При дифференциальной сканирующей калориметрии (ДСК) превращение наблюдается в виде эндотермического эффекта, который показывает, что безводная форма А и безводная форма II являются энантиотропными. Это подтверждается нагревом водного раствора при 25°С. Форма В является более эндотермичной, чем форма А: 9,2 кДж/моль против 4,6 кДж/моль.
В смесях этанол/вода суспензия безводной формы II может превращаться в моногидрат формы В (низкое содержание воды) или в полупентагидрат (высокое содержание воды).
При нагревании моногидрата формы В при 100-140°С получают безводную форму А или безводную форму II, или их смеси.
Растворимость безводной формы II по сравнению с безводной формой А
|
Пример получения
Суспензию 7 г моногидратной формы В лактата 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она в 70 мл абсолютного этанола приводят в состояние равновесия посредством перемешивания при 25°С в течение 24 ч. Высушенное отфильтрованное твердое вещество содержит безводную форму II лактата 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она.
Определяют монокристаллическую рентгеновскую структуру и подтверждают ее данными порошковой рентгеновской дифракции.
Пример 2. Полупентагидрат лактата 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она
Полупентагидрат получают посредством кристаллизации из смеси этанол/вода с большим содержанием воды.
При уравновешивании безводной формы А в смеси этанол/вода (от 80:20 до 60:40) при 25-60°С, или в смеси этанол/вода/ТГФ, или в смеси ацетон/вода (90: 10) наблюдается полное превращение в полупентагидрат. Потеря массы при сушке по данным термогравиметрии: 8,6% (по теории для полупентагидрата - 8,5%).
Титрование перхлорной кислотой: 100%, титрование молочной кислоты на безводной основе 18,9%, вода: 8,1-8,6%, чистота по ВЭЖХ >99,5%.
Полупентагидрат поглощает больше тепла в водном растворе при 25°С по сравнению с безводной формой А или В: 30 кДж/моль.
По данным рентгеновского исследования с нагретой примерно до 100°С ячейкой, при нагревании полупентагидрат превращается в новую форму, возможно в полугидрат (ТГ: 1,39%). По данным ДСК наблюдается превращение с последующим плавлением и перекристаллизацией при 130-140°С в безводную форму А. Такие же результаты наблюдаются при рентгеновских исследованиях с нагревом. При уравновешивании суспензий полупентагидрата в таких органических растворителях, как этанол, ацетон, ТГФ, полупентагидрат превращается в безводную форму А или смесь безводной формы А и моногидратной формы В.
Растворимость полупентагидрата при 25°С в воде составляет 6,2 мг/мл, в 0,1 н. НСl - 55 мг/мл, в этаноле - 2 мг/мл.
Пример получения
5 г 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она в виде свободного основания растворяют в смеси 27,6 г этанола и 2,4 г воды. Затем добавляют 0,5 г молочной кислоты и раствор перемешивают при 50°С в течение 40-48 ч. Образовавшуюся суспензию отфильтровывают и полученное твердое вещество, состоящее из полупентагидрата соли молочной кислоты 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она, сушат.
Определяют монокристаллическую рентгеновскую структуру и подтверждают ее данными порошковой рентгеновской дифракции (см. Таблицу 1).
Пример 3. Метанольный сольват лактата 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она
При приведении в состояние равновесия суспензии моногидрата, безводной формы А или безводной формы II в метаноле наблюдается полное превращение в сольват при 25°С.
Определяют монокристаллическую рентгеновскую структуру и подтверждают ее данными порошковой рентгеновской дифракции (см. Таблицу 1).
Пример 4. ДМФА-сольват лактата 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1H-бензимидазол-2-ил]хинолин-2(1H)-она
При приведении в состояние равновесия суспензии моногидрата или безводной формы А в ДМФА наблюдается полное превращение в сольват при 25°С: пример полного превращения моногидрата в сольват: ТГ: 15,5% (по теории: 13,1%).
Определяют монокристаллическую рентгеновскую структуру и подтверждают ее данными порошковой рентгеновской дифракции (см. Таблицу 1).
|
|
Полосы поглощения спектра комбинационного рассеяния, фиг.6А, 6Б и 6В представлены в Таблице 3.
|
Хотя изобретение было описано выше с отсылкой на конкретные варианты осуществления, является очевидным, что возможны многочисленные вариации, модификации и видоизменения без отклонения от основного изобретательского замысла. Соответственно подразумевается, что все такие вариации, модификации и видоизменения подпадают под объем и смысл нижеследующей формулы изобретения. Все упомянутые здесь патентные заявки, патенты и прочие публикации включены в настоящую заявку посредством ссылки в полном объеме.
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И ДВЕ СОЛЬВАТНЫЕ ФОРМЫ СОЛЕЙ МОЛОЧНОЙ КИСЛОТЫ 4-АМИНО-5-ФТОР-3-[5-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-1 - Н-БЕНЗИМИДАЗОЛ-2-ИЛ]ХИНОЛИН-2(1Н)ОНА](https://fips.edrid.ru/images/rid/5e/bf/fb/16845044a314a5d6c4b4dafc4ad5e312.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И ДВЕ СОЛЬВАТНЫЕ ФОРМЫ СОЛЕЙ МОЛОЧНОЙ КИСЛОТЫ 4-АМИНО-5-ФТОР-3-[5-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-1 - Н-БЕНЗИМИДАЗОЛ-2-ИЛ]ХИНОЛИН-2(1Н)ОНА](https://fips.edrid.ru/images/rid/5e/bf/fb/d6479a5ee6c6693a4ea44594a932f304.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И ДВЕ СОЛЬВАТНЫЕ ФОРМЫ СОЛЕЙ МОЛОЧНОЙ КИСЛОТЫ 4-АМИНО-5-ФТОР-3-[5-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-1 - Н-БЕНЗИМИДАЗОЛ-2-ИЛ]ХИНОЛИН-2(1Н)ОНА](https://fips.edrid.ru/images/rid/5e/bf/fb/6420d2a3d04355dfb70fbdc4bac160de.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И ДВЕ СОЛЬВАТНЫЕ ФОРМЫ СОЛЕЙ МОЛОЧНОЙ КИСЛОТЫ 4-АМИНО-5-ФТОР-3-[5-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-1 - Н-БЕНЗИМИДАЗОЛ-2-ИЛ]ХИНОЛИН-2(1Н)ОНА](https://fips.edrid.ru/images/rid/5e/bf/fb/dce6a6286066d5a40dc85dd97483487d.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И ДВЕ СОЛЬВАТНЫЕ ФОРМЫ СОЛЕЙ МОЛОЧНОЙ КИСЛОТЫ 4-АМИНО-5-ФТОР-3-[5-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-1 - Н-БЕНЗИМИДАЗОЛ-2-ИЛ]ХИНОЛИН-2(1Н)ОНА](https://fips.edrid.ru/images/rid/5e/bf/fb/06f12c377b29306e153c7b842b068284.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И ДВЕ СОЛЬВАТНЫЕ ФОРМЫ СОЛЕЙ МОЛОЧНОЙ КИСЛОТЫ 4-АМИНО-5-ФТОР-3-[5-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-1 - Н-БЕНЗИМИДАЗОЛ-2-ИЛ]ХИНОЛИН-2(1Н)ОНА](https://fips.edrid.ru/images/rid/5e/bf/fb/9809deb21420a145f620fafe128967a2.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И ДВЕ СОЛЬВАТНЫЕ ФОРМЫ СОЛЕЙ МОЛОЧНОЙ КИСЛОТЫ 4-АМИНО-5-ФТОР-3-[5-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-1 - Н-БЕНЗИМИДАЗОЛ-2-ИЛ]ХИНОЛИН-2(1Н)ОНА](https://fips.edrid.ru/images/rid/5e/bf/fb/1fa11cc71e3183f9e8d7f40a9260055f.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И ДВЕ СОЛЬВАТНЫЕ ФОРМЫ СОЛЕЙ МОЛОЧНОЙ КИСЛОТЫ 4-АМИНО-5-ФТОР-3-[5-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-1 - Н-БЕНЗИМИДАЗОЛ-2-ИЛ]ХИНОЛИН-2(1Н)ОНА](https://fips.edrid.ru/images/rid/5e/bf/fb/f9f604a5ad793ec00512647615fb6513.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И ДВЕ СОЛЬВАТНЫЕ ФОРМЫ СОЛЕЙ МОЛОЧНОЙ КИСЛОТЫ 4-АМИНО-5-ФТОР-3-[5-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-1 - Н-БЕНЗИМИДАЗОЛ-2-ИЛ]ХИНОЛИН-2(1Н)ОНА](https://fips.edrid.ru/images/rid/5e/bf/fb/cbab18a7fc6e2cb980499cae54dfc544.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И ДВЕ СОЛЬВАТНЫЕ ФОРМЫ СОЛЕЙ МОЛОЧНОЙ КИСЛОТЫ 4-АМИНО-5-ФТОР-3-[5-(4-МЕТИЛПИПЕРАЗИН-1-ИЛ)-1 - Н-БЕНЗИМИДАЗОЛ-2-ИЛ]ХИНОЛИН-2(1Н)ОНА](https://fips.edrid.ru/images/rid/5e/bf/fb/d46632054335ee661a3e59520b6c0ba2.png)

