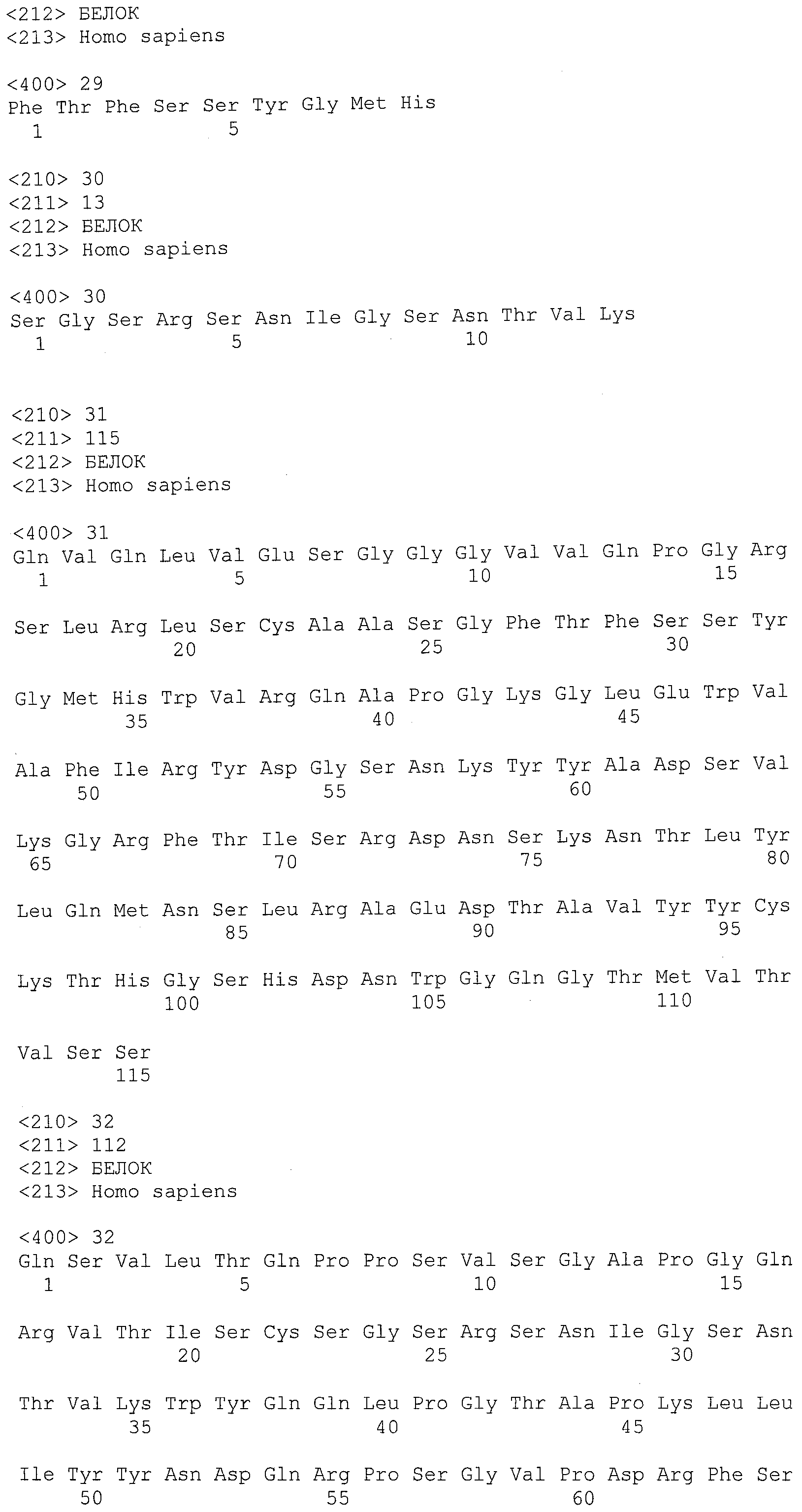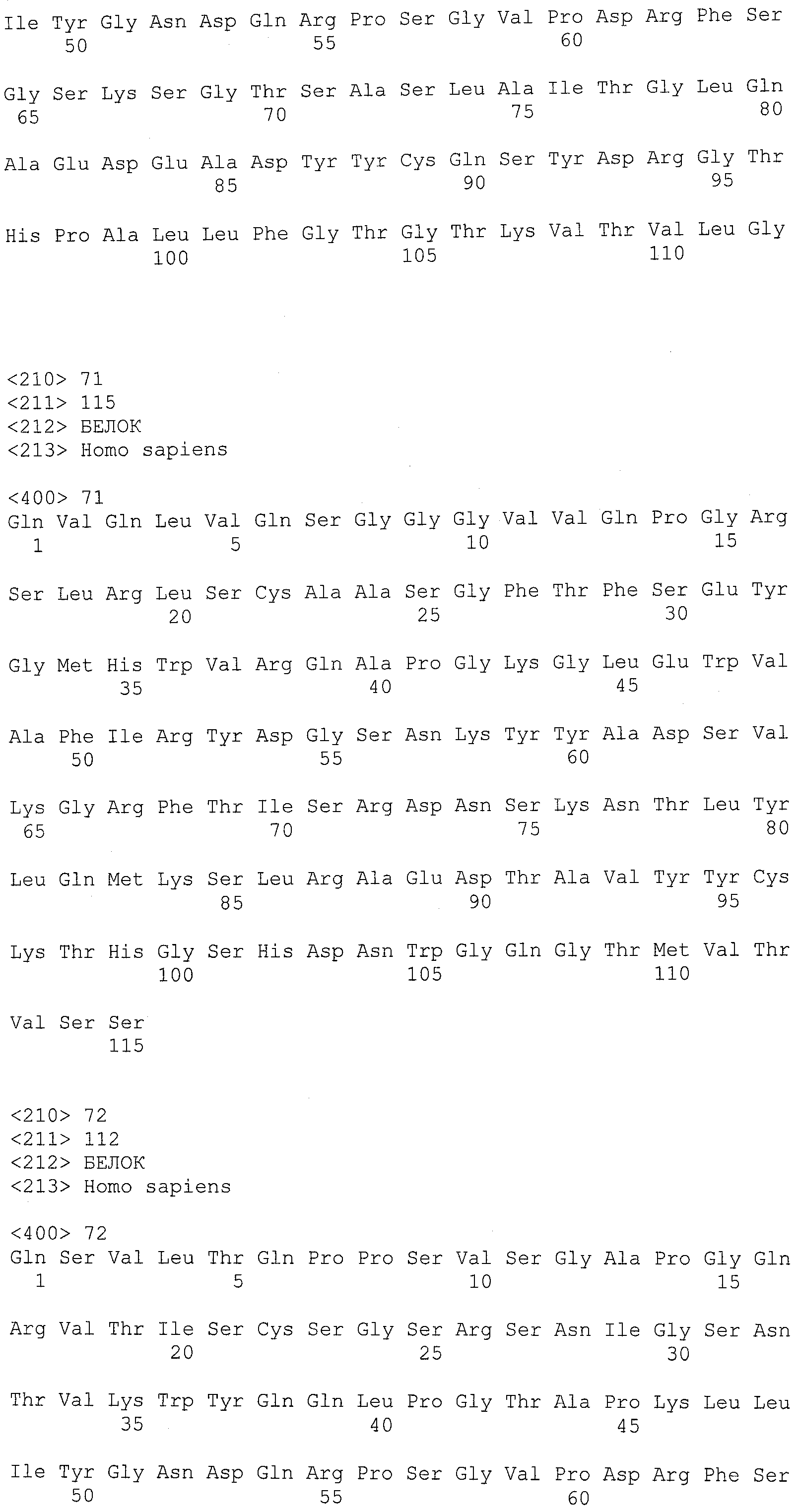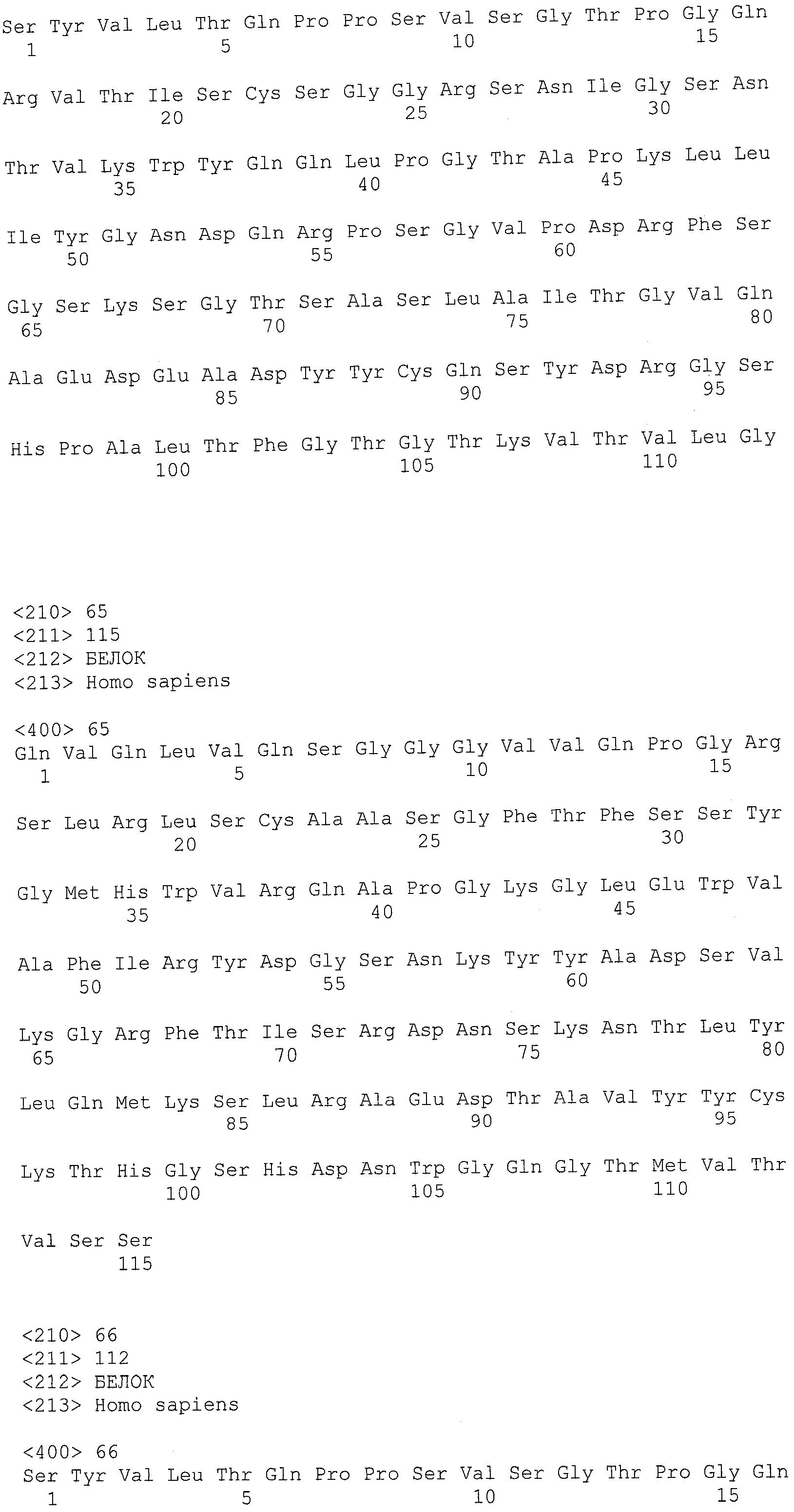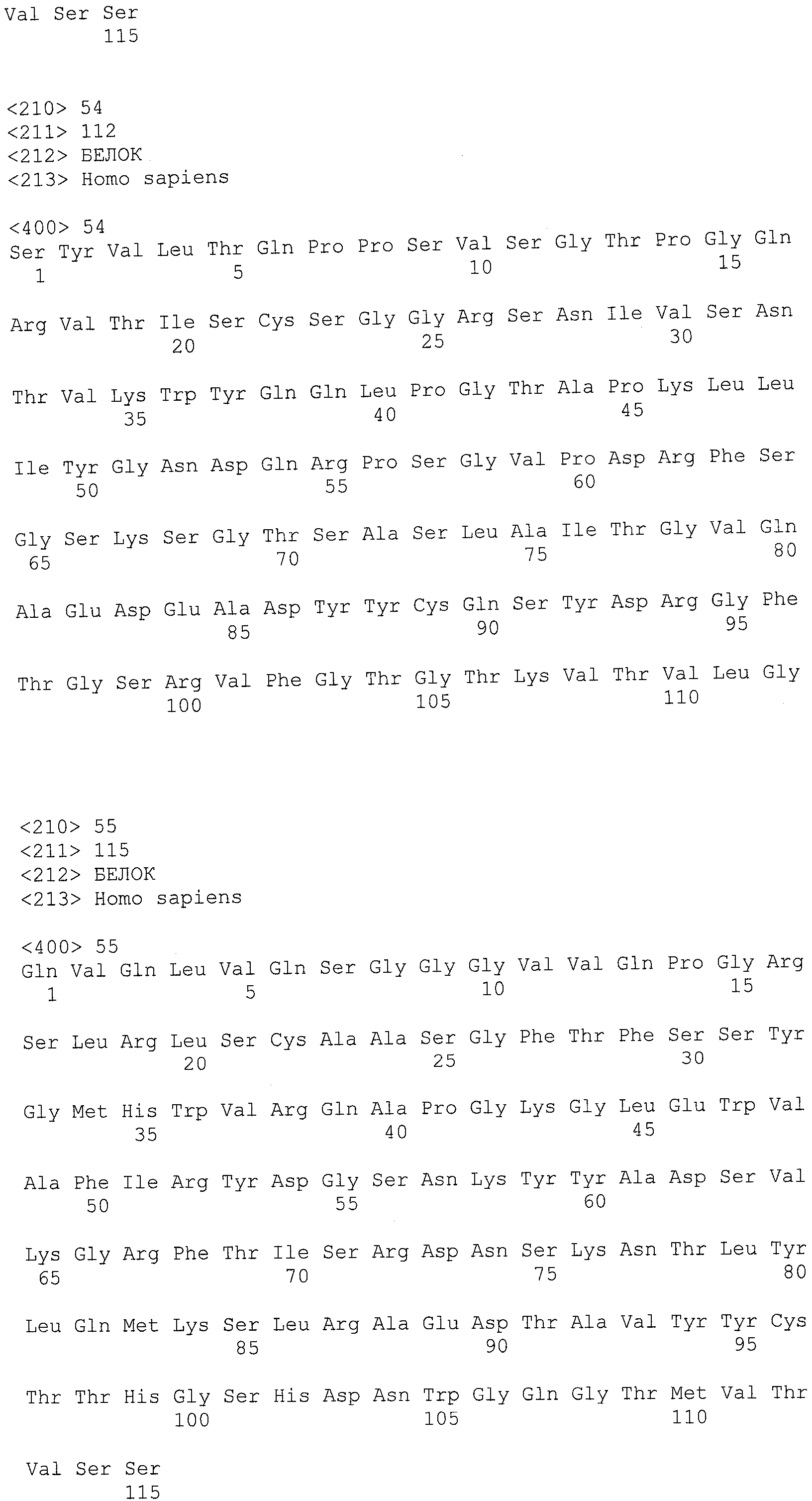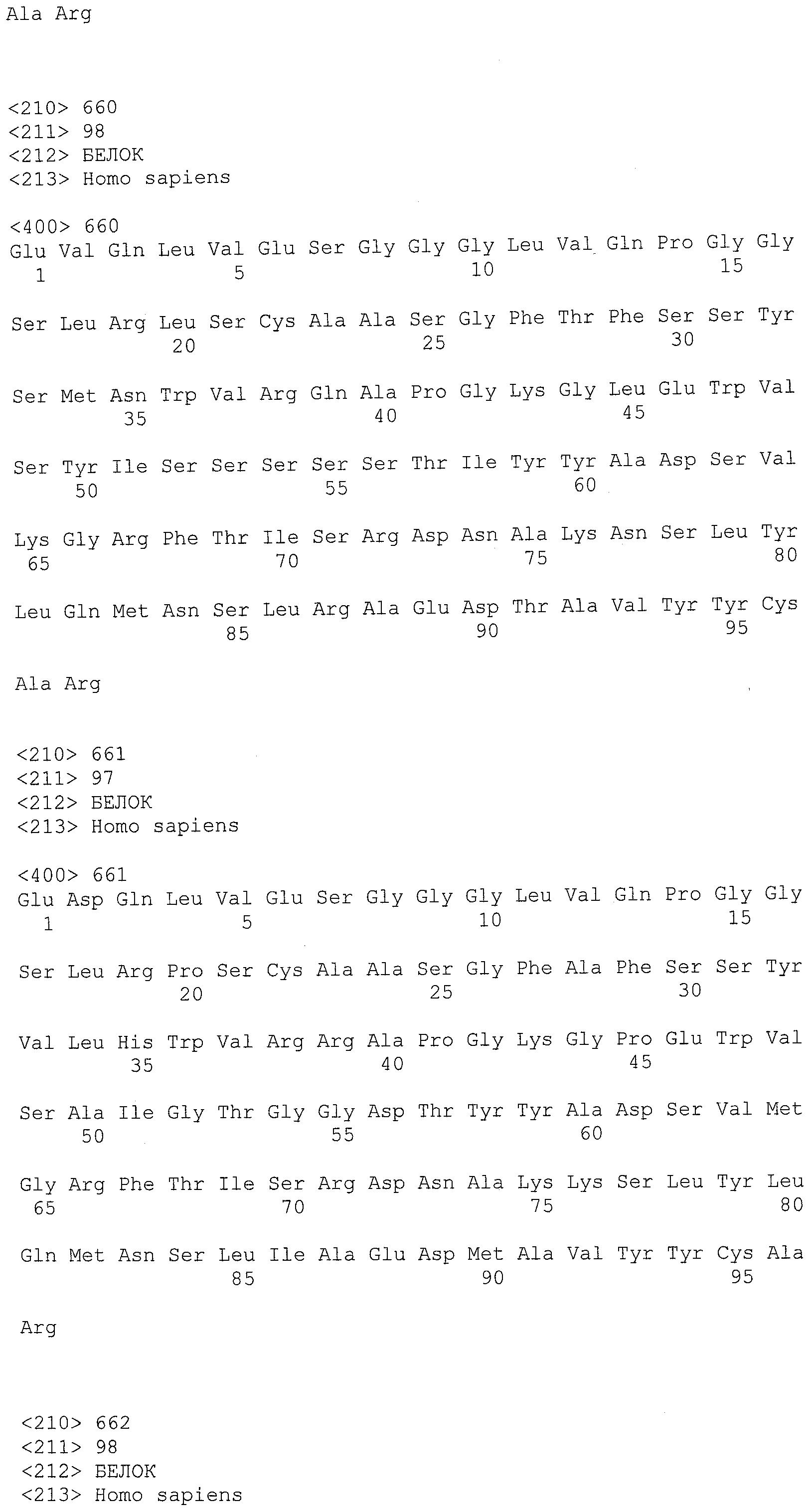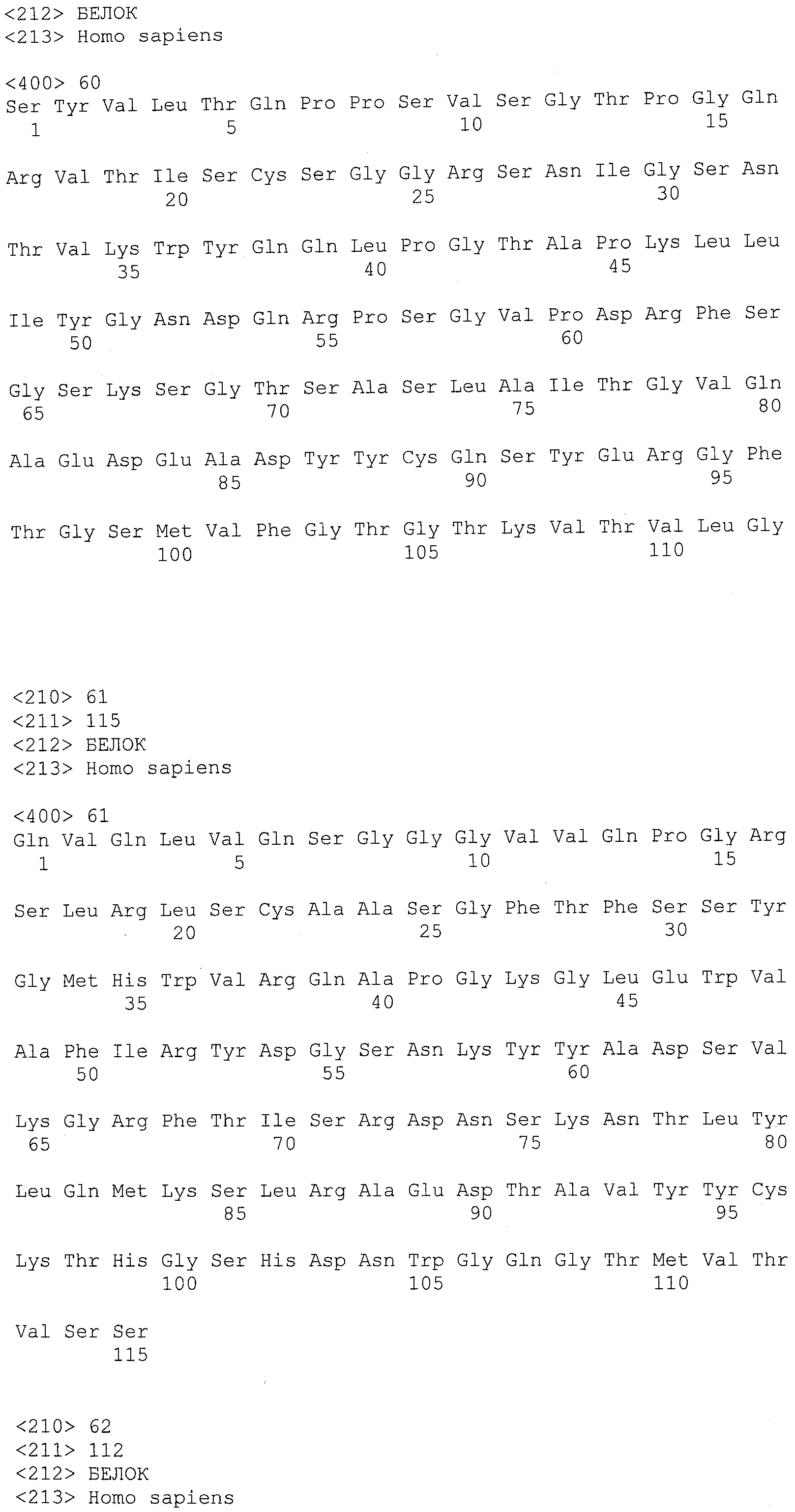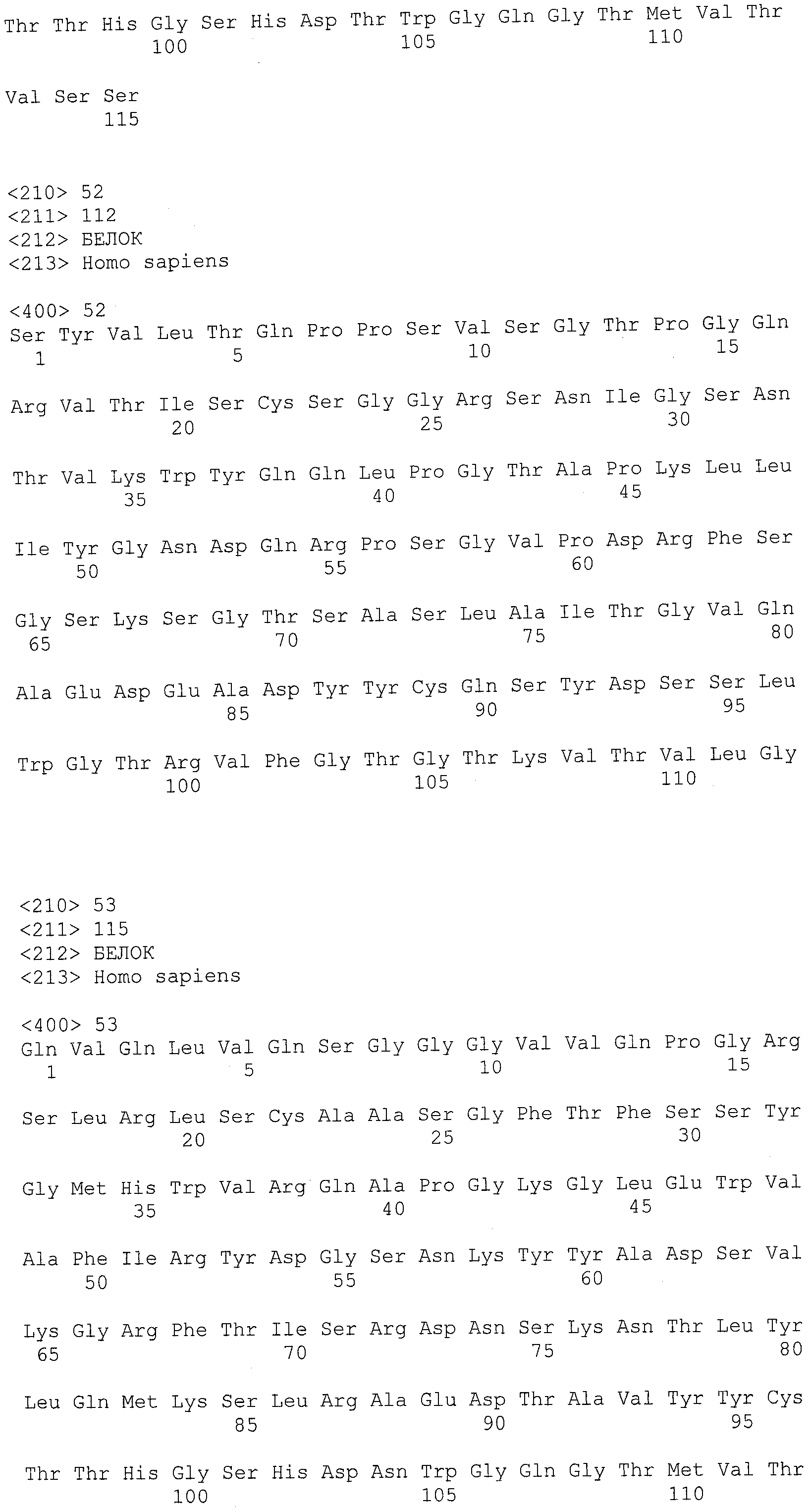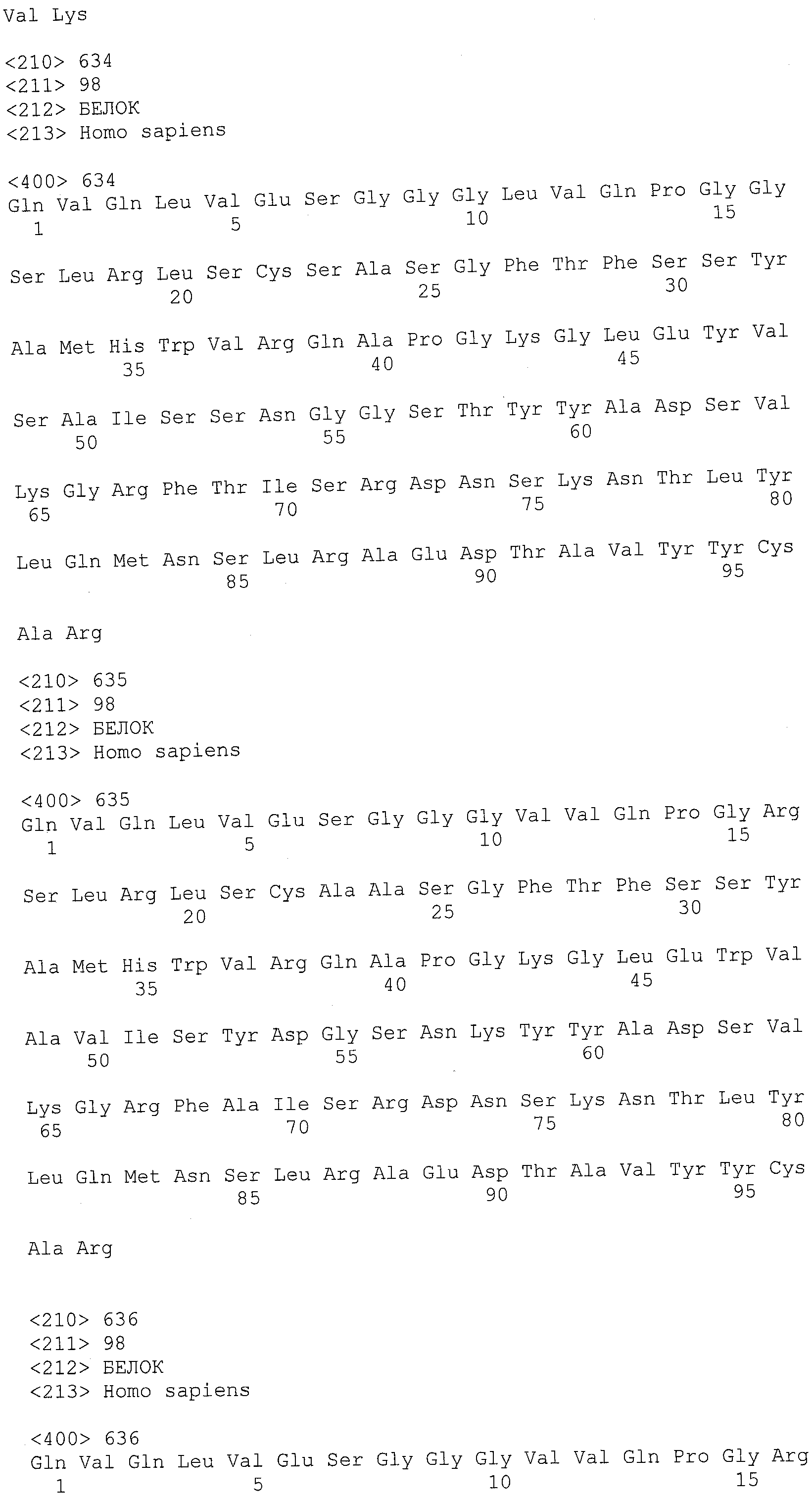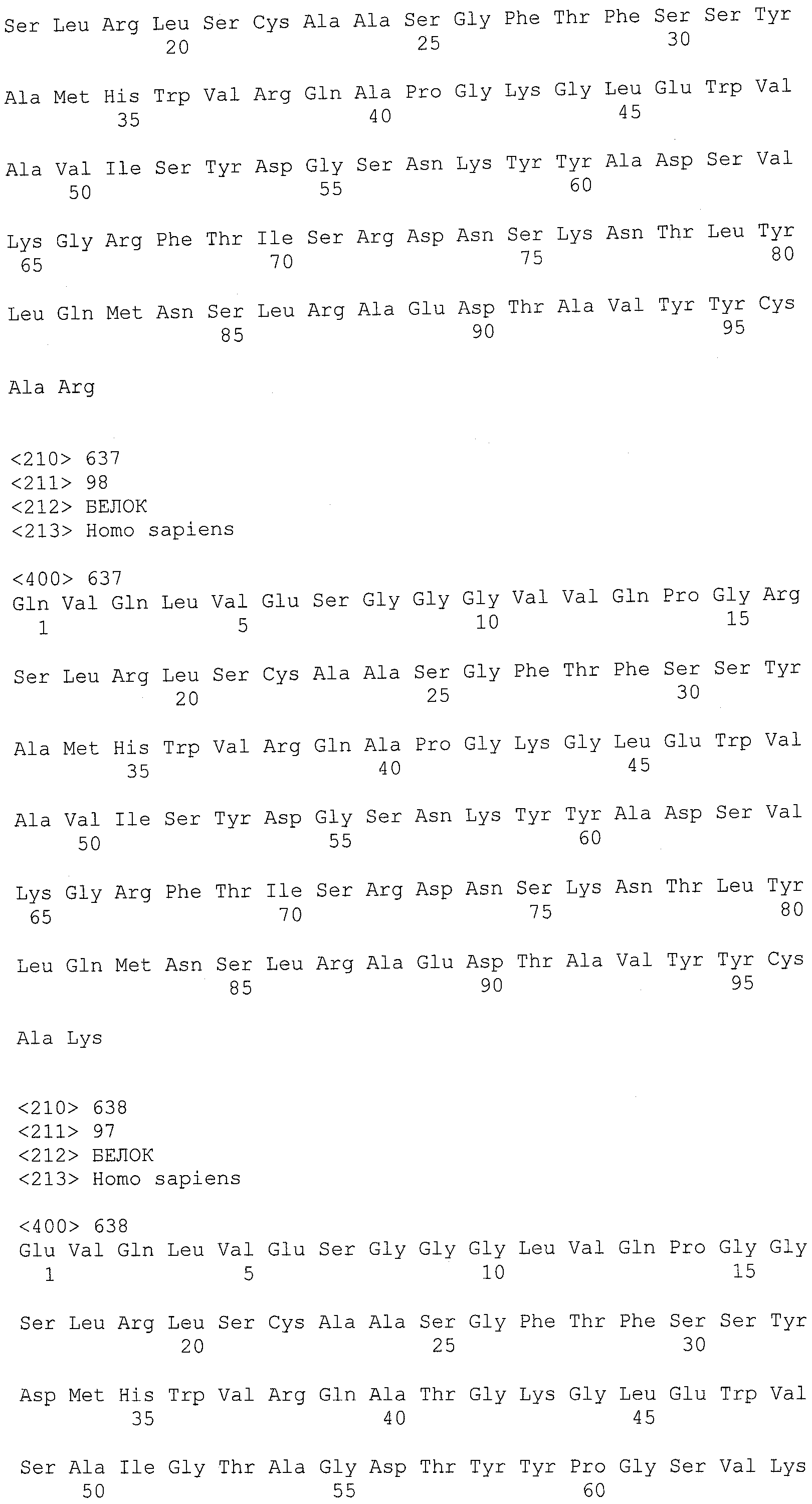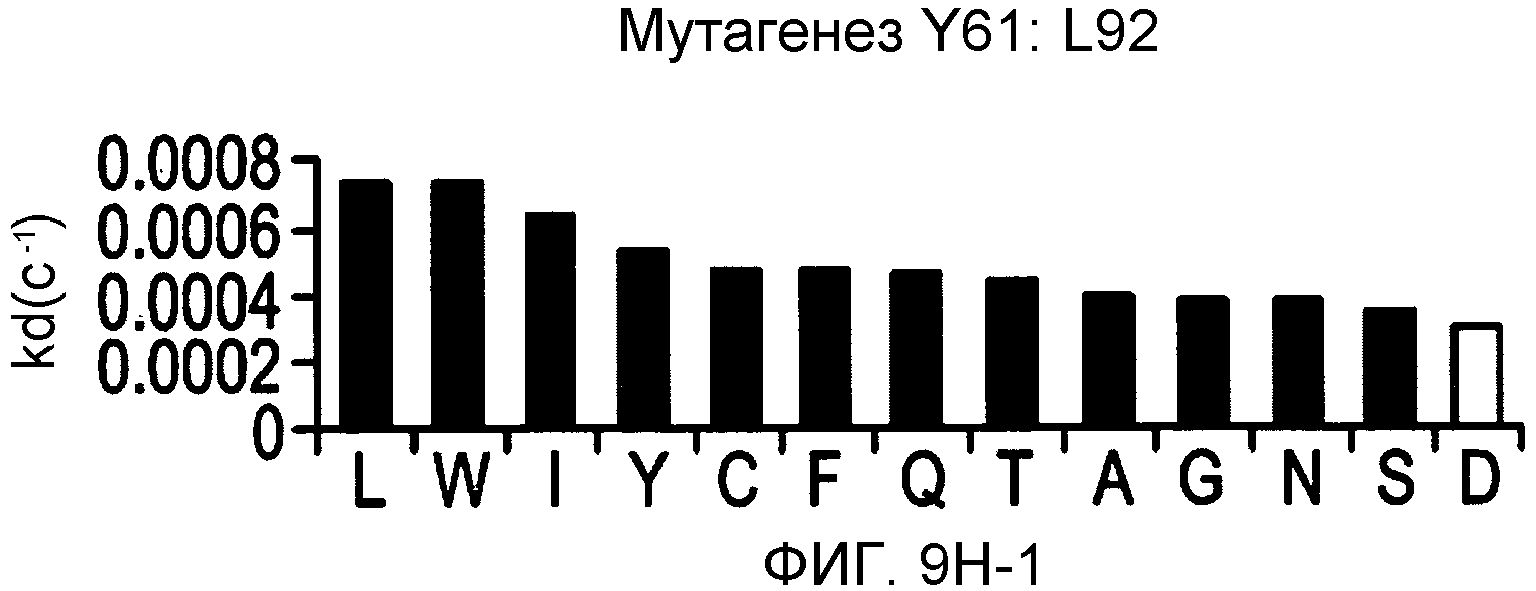Результат интеллектуальной деятельности: СПОСОБ ЛЕЧЕНИЯ ПСОРИАЗА (ВАРИАНТЫ)
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет по предварительной заявке США № 61/069840, поданной 18 марта 2008 года; предварительной заявке США № 61/095275, поданной 8 сентября 2008 года; и предварительной заявке США № 61/207904, поданной 18 февраля 2009 года, полное содержание каждой из которых включено в настоящий документ в качестве ссылки.
ПРЕДОСТАВЛЕНИЕ КОМПАКТ-ДИСКА
Данная заявка включает в качестве ссылки текстовый файл ASCII под названием SequenceListing.txt, содержащий 785 KB данных, созданный 10 марта 2009 и представленный в считываемом компьютером формате (CRF).
УРОВЕНЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Псориаз представляет собой опосредуемое T-клетками воспалительное заболевание, которое считается одним из наиболее распространенных аутоиммунных заболеваний, которым страдают приблизительно от 2% до 3% взрослых, хотя его распространенность по всему миру широко варьирует (Stern R.S., et al., J Investig Dermatol Symp Proc 2004, 9: 136-39; Davidson A and Diamond B. N Engl J Med 2001, 345: 340-50; Langley R.G.B., et al., Ann Rheum Dis 2005, 64(Suppl II): ii18-23). Псориаз оказывает значительное влияние на качество жизни (de Korte J, et al., J Investig Dermatol Symp Proc 2004, 9: 140-7; Krueger G, et al., Arch Dermatol 2001, 137: 280-4; Finlay AY and Coles EC, Br J Dermatol 1995, 132: 236-44), и он ассоциирован с рядом психологических и психосоциальных проблем (Kimball AB, et al., Am J Clin Dermatol 2005, 6: 383-92; Russo PA, et al., Australas J Dermatol 2004, 45: 155-9). Многие традиционные способы лечения псориаза имеют побочные действия; таким образом, их продолжительное применение ограничено (Lebwohl M. and Ali S., J Am Acad Dermatol 2001, 45: 487-98; Lebwohl M. и Ali S., J Am Acad Dermatol 2001, 45: 649-61). Кроме того, многих пациентов с псориазом не удовлетворяют традиционные способы лечения (Stern RS, et al., J Investig Dermatol Symp Proc 2004, 9: 136-39; Finlay AY and Ortonne JP, J Cutan Med Surg 2004, 8: 310-20); таким образом, существует очевидная потребность в способах лечения, которые являются более безопасными и более простыми в применении и которые могут быть предписаны на длительное время.
Интерлейкин-12 (IL-12) и родственный ему цитокин IL-23 являются членами суперсемейства IL-12 цитокинов, которые имеют общую субъединицу p40 (Anderson EJR, et al., Springer Semin Immunopathol 2006, 27: 425-42). Оба цитокина участвуют в развитии иммунного ответа T-хелперов 1 типа (Th1) при псориазе, однако каждый из них играет уникальную роль (Rosmarin D and Strober BE, J Drugs Dermatol 2005, 4: 318-25; Hong K, et al., J Immunol 1999, 162: 7480-91; Yawalkar N, et al., J Invest Dermatol 1998, 111: 1053-57). IL-12, главным образом, стимулирует дифференцировку Th1-клеток и последующую секрецию интерферона-гамма, в то время как IL-23 предпочтительно стимулирует дифференцировку наивных T-клеток в эффекторные T-хелперные клетки (Th17), которые стимулируют IL-17, провоспалительный медиатор (Rosmarin D and Strober BE, J Drugs Dermatol 2005, 4: 318-25; Harrington Le, et al., Nature Immunol 2005, 6: 1123-32; Park H, et al. Nature Immunol 2005, 6: 1132-41). Сверхэкспрессия матричной РНК p40 IL-12 и p40 IL-23 в псориатических очагах повреждения кожи указывает на то, что ингибирование IL-12 и IL-23 нейтрализующим антителом к субъединице p40 белка IL-12/23 может обеспечить эффективный терапевтический подход для лечения псориаза (Yawalkar N, et al., J Invest Dermatol 1998, 111: 1053-57; Lee E, et al., J Exp Med 2004, 199: 125-30; Shaker OG, et al., Clin Biochem 2006, 39: 119-25; Piskin G, et al., J Immunol 2006, 176: 1908-15). Очевидно, что в данной области необходимы такие терапевтические подходы для лечения псориаза.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам и композициям для лечения псориаза, например, хронического псориаза, с использованием антитела или его антигенсвязывающей части, которые связываются с IL-12 человека и/или IL-23 человека.
В одном аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23, где у субъекта сохраняется по меньшей мере ответ PASI 75 в течение первого длительного периода после начального введения антитела или его антигенсвязывающей части, где у субъекта обнаруживается снижение ответа после прекращения введения антитела или его антигенсвязывающей части, и где у субъекта сохраняется по меньшей мере ответ PASI 75 в течение второго длительного периода после повторного введения антитела или его антигенсвязывающей части, тем самым осуществляя лечение псориаза у субъекта.
В одном варианте осуществления первый длительный период составляет по меньшей мере приблизительно 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 недель и предпочтительно 12 недель.
В одном варианте осуществления введение антитела прекращают по меньшей мере приблизительно на 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 недель и предпочтительно на 12 недель.
В одном варианте осуществления второй длительный период составляет по меньшей мере приблизительно 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 недель и предпочтительно 12 недель.
В одном варианте осуществления антитело или его антигенсвязывающую часть вводят раз в две недели. В одном варианте осуществления антитело или его антигенсвязывающую часть вводят раз в неделю. В одном варианте осуществления антитело или его антигенсвязывающую часть вводят в однократной дозе.
В одном варианте осуществления антитело или его антигенсвязывающую часть вводят в дозе приблизительно 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 180 мг, 190 мг, 200 мг, 210 или 220 мг.
В одном варианте осуществления псориаз представляет собой хронический псориаз. В одном варианте осуществления псориаз представляет собой бляшечный псориаз, например, хронический бляшечный псориаз. В другом варианте осуществления псориаз представляет собой хронический псориаз, например, хронический бляшечный псориаз. В другом варианте осуществления псориаз представляет собой псориаз от умеренного до тяжелого, например, бляшечный псориаз от умеренного до тяжелого, хронический псориаз от умеренного до тяжелого или хронический бляшечный псориаз от умеренного до тяжелого. В одном варианте осуществления субъект имеет клинический диагноз псориаза в течение по меньшей мере 6 месяцев. В другом варианте осуществления субъект имеет стабильный бляшечный псориаз в течение по меньшей мере 2 месяцев.
В другом аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту однократной дозы антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23, где после введения антитела или его антигенсвязывающей части достигают по меньшей мере одного фармакокинетического свойства, выбранного из группы, состоящей из времени полужизни, составляющего по меньшей мере приблизительно 3 суток, Tmax, меньшего или равного 4 суткам, и биодоступности, составляющей по меньшей мере приблизительно 40%.
В различных вариантах осуществления достигают времени полужизни по меньшей мере приблизительно 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток или 10 суток.
В различных вариантах осуществления достигают Tmax, меньшего или равного приблизительно 1 суткам, 2 суткам, 3 суткам, 4 суткам, 5 суткам, 6 суткам или более.
В различных вариантах осуществления достигают биодоступности по меньшей мере приблизительно 0,1%, 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или более.
В одном варианте осуществления антитело вводят путем внутривенной инъекции.
В одном варианте осуществления антитело вводят путем подкожной инъекции.
В одном варианте осуществления однократная доза составляет от приблизительно 0,1 до приблизительно 5,0 мг/кг (например, от приблизительно 0,1 до приблизительно 1,0 мг/кг, от приблизительно 0,1 до приблизительно 2,0 мг/кг, от приблизительно 0,1 до приблизительно 3,0 мг/кг, от приблизительно 0,1 до приблизительно 4,0 мг/кг, от приблизительно 1,0 до приблизительно 2,0 мг/кг, от приблизительно 1,0 до приблизительно 3,0 мг/кг, от приблизительно 1,0 до приблизительно 4,0 мг/кг или от приблизительно 1,0 до приблизительно 5,0 мг/кг) антитела или его антигенсвязывающей части.
В другом аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23, где у субъекта сохраняется по меньшей мере ответ PASI 75 в течение первого длительного периода после начального введения антитела или его антигенсвязывающей части, где у субъекта обнаруживается снижение ответа после прекращения введения антитела или его антигенсвязывающей части, и где у субъекта сохраняется по меньшей мере ответ PASI 50 в течение второго длительного периода после повторного введения антитела или его антигенсвязывающей части, тем самым осуществляя лечение псориаза у субъекта.
В одном варианте осуществления первый длительный период составляет по меньшей мере приблизительно 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 недель и предпочтительно 12 недель.
В одном варианте осуществления введение антитела прекращают по меньшей мере приблизительно на 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 недель и предпочтительно 12 недель.
В одном варианте осуществления второй длительный период составляет по меньшей мере приблизительно 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 недель и предпочтительно 12 недель.
В одном варианте осуществления антитело или его антигенсвязывающую часть вводят раз в две недели. В одном варианте осуществления антитело или его антигенсвязывающую часть вводят раз в неделю.
В одном варианте осуществления антитело или его антигенсвязывающую часть вводят в однократной дозе. В одном варианте осуществления антитело или его антигенсвязывающую часть вводят в дозе приблизительно 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 180 мг, 190 мг или 200 мг.
В одном варианте осуществления псориаз представляет собой хронический псориаз.
В другом аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23, где у субъекта сохраняется по меньшей мере ответ PASI 75 в течение первого длительного периода после начального введения антитела или его антигенсвязывающей части, где у субъекта обнаруживается снижение ответа после прекращения введения антитела или его антигенсвязывающей части, и где у субъекта сохраняется показатель PGA "отсутствие признаков" или "минимальные признаки" в течение второго длительного периода после повторного введения антитела или его антигенсвязывающей части, тем самым осуществляя лечение псориаза у субъекта.
В одном варианте осуществления первый длительный период составляет по меньшей мере приблизительно 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 недель и предпочтительно 12 недель.
В одном варианте осуществления введение антитела прекращают по меньшей мере приблизительно на 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 недель и предпочтительно 12 недель.
В одном варианте осуществления второй длительный период составляет по меньшей мере приблизительно 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 недель и предпочтительно 12 недель.
В одном варианте осуществления антитело или его антигенсвязывающую часть вводят раз в две недели. В одном варианте осуществления антитело или его антигенсвязывающую часть вводят раз в неделю.
В одном варианте осуществления антитело или его антигенсвязывающую часть вводят в однократной дозе. В одном варианте осуществления антитело или его антигенсвязывающую часть вводят в дозе приблизительно 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 180 мг, 190 мг или 200 мг.
В одном варианте осуществления псориаз представляет собой хронический псориаз.
В другом аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту однократной дозы антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23, где после введения антитела или его антигенсвязывающей части достигают по меньшей мере одного фармакокинетического свойства, выбранного из группы, состоящей из максимальной концентрации в сыворотке (Cmax) в диапазоне от приблизительно 0,15 до приблизительно 150 мкг/мл (например, от приблизительно 0,2 до приблизительно 140 мкг/мл, от приблизительно 0,5 до приблизительно 125 мкг/мл, от приблизительно 1,0 до приблизительно 100 мкг/мл, от приблизительно 10 до приблизительно 90 мкг/мл, в диапазоне от приблизительно 25 до приблизительно 75 мкг/мл, от приблизительно 35 до приблизительно 60 мкг/мл и от приблизительно 40 до приблизительно 50 мкг/мл) и значения площади под кривой концентрация в сыворотке-время (AUC) от приблизительно 80 до приблизительно 13000 мкг × ч/мл (например, от приблизительно 100 до приблизительно 12000 мкг × ч/мл, от приблизительно 150 до приблизительно 10000 мкг × ч/мл, от приблизительно 200 до приблизительно 8000 мкг × ч/мл, от приблизительно 400 до приблизительно 6000 мкг × ч/мл, от приблизительно 800 до приблизительно 4000 мкг × ч/мл, от приблизительно 1000 до приблизительно 2000 мкг × ч/мл, от приблизительно 145 до приблизительно 13000 мкг × ч/мл и от приблизительно 80 до приблизительно 5000 мкг × ч/мл).
В одном варианте осуществления антитело вводят путем внутривенной инъекции.
В предпочтительном варианте осуществления Cmax составляет от приблизительно 1 до приблизительно 150 мкг/мл (например, от приблизительно 2 до приблизительно 125 мкг × ч/мл, от приблизительно 5 до приблизительно 100 мкг × ч/мл, от приблизительно 10 до приблизительно 80 мкг × ч/мл, от приблизительно 20 до приблизительно 60 мкг × ч/мл, от приблизительно 30 до приблизительно 50 мкг × ч/мл, от приблизительно 1 до приблизительно 20 мкг × ч/мл, от приблизительно 20 до приблизительно 300 мкг × ч/мл и от приблизительно 140 до приблизительно 150 мкг × ч/мл).
В предпочтительном варианте осуществления AUC составляет от приблизительно 145 до приблизительно 13000 мкг × ч/мл (например, от приблизительно 200 до приблизительно 11000 мкг × ч/мл, от приблизительно 500 до приблизительно 10000 мкг × ч/мл, от приблизительно 1000 до приблизительно 5000 мкг × ч/мл, от приблизительно 2000 до приблизительно 4000 мкг × ч/мл, от приблизительно 145 до приблизительно 165 мкг × ч/мл, от приблизительно 500 до приблизительно 600 мкг × ч/мл, от приблизительно 2000 до приблизительно 3000 мкг × ч/мл и от приблизительно 12000 до приблизительно 13000 мкг × ч/мл).
В одном варианте осуществления антитело вводят путем подкожной инъекции.
В предпочтительном варианте осуществления Cmax составляет от приблизительно 0,15 до приблизительно 20 мкг/мл (например, от приблизительно 0,25 до приблизительно 15 мкг/мл, от приблизительно 0,5 до приблизительно 13 мкг/мл, от приблизительно 1 до приблизительно 10 мкг/мл, от приблизительно 2 до приблизительно 8 мкг/мл, от приблизительно 0,15 до приблизительно 0,3 мкг/мл, от приблизительно 0,5 до приблизительно 2 мкг/мл, от приблизительно 2 до приблизительно 4 мкг/мл и от приблизительно 10 до приблизительно 15 мкг/мл).
В предпочтительном варианте осуществления AUC составляет от приблизительно 80 до приблизительно 5000 мкг × ч/мл (например, от приблизительно 200 до 3000 мкг × ч/мл, от приблизительно 400 до 2000 мкг × ч/мл, от приблизительно 500 до 1500 мкг × ч/мл, от приблизительно 4000 до 5000 мкг × ч/мл, от приблизительно 80 до 90 мкг × ч/мл и от приблизительно 200 до 300 мкг × ч/мл).
В одном варианте осуществления однократная доза составляет от приблизительно 0,1 до приблизительно 5,0 мг/кг (например, от приблизительно 0,1 до приблизительно 1,0 мг/кг, от приблизительно 0,1 до приблизительно 2,0 мг/кг, от приблизительно 0,1 до приблизительно 3,0 мг/кг, от приблизительно 0,1 до приблизительно 4,0 мг/кг, от приблизительно 1,0 до приблизительно 2,0 мг/кг, от приблизительно 1,0 до приблизительно 3,0 мг/кг, от приблизительно 1,0 до приблизительно 4,0 мг/кг или от приблизительно 1,0 до приблизительно 5,0 мг/кг) антитела или его антигенсвязывающей части.
В другом аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту однократной дозы антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23, где после внутривенного введения антитела или его антигенсвязывающей части достигают по меньшей мере одного фармакокинетического свойства, выбранного из группы, состоящей из клиренса (CL) в диапазоне от приблизительно 30 до приблизительно 600 мл/ч (например, от приблизительно 50 до приблизительно 500 мл/ч, от приблизительно 75 до приблизительно 400 мл/ч, от приблизительно 100 до приблизительно 300 мл/ч, от приблизительно 150 до приблизительно 250 мл/ч, от приблизительно 30 до приблизительно 40 мл/ч, от приблизительно 40 до приблизительно 60 мл/ч и от приблизительно 500 до приблизительно 600 мл/ч) и объема распределения (Vz) в диапазоне от приблизительно 8 до приблизительно 11 л (например, от приблизительно 8 до приблизительно 10 л, от приблизительно 8 до приблизительно 9 л, от приблизительно 9 до приблизительно 10 л, от приблизительно 10 до приблизительно 11 л и от приблизительно 8,5 до 9,5 л).
В родственном аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту однократной дозы антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23, где после подкожного введения антитела или его антигенсвязывающей части достигают по меньшей мере одного фармакокинетического свойства, выбранного из группы, состоящей из кажущегося клиренса (CL/F) в диапазоне от приблизительно 90 до приблизительно 250 мл/ч (например, от приблизительно 100 до приблизительно 225 мл/ч, от приблизительно 125 до приблизительно 200 мл/ч, от приблизительно 140 до приблизительно 180 мл/ч, от приблизительно 90 до приблизительно 100 мл/ч, от приблизительно 150 до приблизительно 200 мл/ч и от приблизительно 200 до приблизительно 250 мл/ч) и кажущегося объема распределения (V/F) в диапазоне от приблизительно 23 до приблизительно 67 л (например, от приблизительно 25 до приблизительно 60 л, от приблизительно 30 до приблизительно 55 л, от приблизительно 35 до приблизительно 50 л, от приблизительно 40 до приблизительно 45 л, от приблизительно 23 до приблизительно 35 л и от приблизительно 60 до приблизительно 70 л).
В одном варианте осуществления однократная доза составляет от приблизительно 0,1 до приблизительно 5,0 мг/кг (например, от приблизительно 0,1 до приблизительно 1,0 мг/кг, от приблизительно 0,1 до приблизительно 2,0 мг/кг, от приблизительно 0,1 до приблизительно 3,0 мг/кг, от приблизительно 0,1 до приблизительно 4,0 мг/кг, от приблизительно 1,0 до приблизительно 2,0 мг/кг, от приблизительно 1,0 до приблизительно 3,0 мг/кг, от приблизительно 1,0 до приблизительно 4,0 мг/кг или от приблизительно 1,0 до приблизительно 5,0 мг/кг) антитела или его антигенсвязывающей части.
В другом аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23, где у субъекта проявляется ответ PASI 75 после начального введения антитела или его антигенсвязывающей части, где у субъекта обнаруживается снижение ответа после прекращения введения антитела или его антигенсвязывающей части, и где у субъекта проявляется по меньшей мере ответ PASI 75 приблизительно через 25 суток после повторного введения антитела или его антигенсвязывающей части, тем самым осуществляя лечение псориаза у субъекта.
В одном варианте осуществления у субъекта проявляется по меньшей мере ответ PASI 75 приблизительно через 50 суток после повторного введения антитела или его антигенсвязывающей части. В одном варианте осуществления у субъекта проявляется по меньшей мере ответ PASI 75 приблизительно через 60 суток после повторного введения антитела или его антигенсвязывающей части. В одном варианте осуществления у субъекта проявляется по меньшей мере ответ PASI 75 приблизительно через 30, 35, 40, 45, 50, 60, 65, 70, 75, 80, 85, 90 или более суток после повторного введения антитела или его антигенсвязывающей части.
В одном варианте осуществления начальное введение антитела проводят в течение по меньшей мере приблизительно 12 недель.
В одном варианте осуществления введение антитела прекращают по меньшей мере приблизительно на 4, 5, 6, 7, 8, 9, 10, 11 или 12 недель.
В одном варианте осуществления антитело или его антигенсвязывающую часть вводят раз в две недели. В одном варианте осуществления антитело или его антигенсвязывающую часть вводят раз в неделю. В одном варианте осуществления антитело или его антигенсвязывающую часть вводят в однократной дозе.
В одном варианте осуществления антитело или его антигенсвязывающую часть вводят в дозе приблизительно 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 180 мг, 190 мг или 200 мг.
В одном варианте осуществления псориаз представляет собой хронический псориаз.
В другом аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23, где у субъекта проявляется ответ PASI 75 после начального введения антитела или его антигенсвязывающей части, где у субъекта обнаруживается снижение ответа приблизительно через 60 суток после прекращения введения антитела или его антигенсвязывающей части, и где у субъекта достигается ответ PASI 75 после повторного введения антитела или его антигенсвязывающей части, тем самым осуществляя лечение псориаза у субъекта.
В одном варианте осуществления у субъекта обнаруживается снижение ответа приблизительно через 120 суток после прекращения введения антитела или его антигенсвязывающей части. В одном варианте осуществления у субъекта обнаруживается снижение ответа приблизительно через 180 суток после прекращения введения антитела или его антигенсвязывающей части. В одном варианте осуществления у субъекта обнаруживается снижение ответа приблизительно через 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более суток после прекращения введения антитела или его антигенсвязывающей части.
В одном варианте осуществления начальное введение антитела проводят в течение по меньшей мере приблизительно 12 недель.
В одном варианте осуществления антитело или его антигенсвязывающую часть вводят раз в две недели. В одном варианте осуществления антитело или его антигенсвязывающую часть вводят раз в неделю. В одном варианте осуществления антитело или его антигенсвязывающую часть вводят в однократной дозе.
В одном варианте осуществления антитело или его антигенсвязывающую часть вводят в дозе приблизительно 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 180 мг, 190 мг или 200 мг.
В одном варианте осуществления псориаз представляет собой хронический псориаз.
В другом аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту раз в две недели, раз в неделю или однократной дозы антитела или его антигенсвязывающей части, направленных против IL-12 человека и/или IL-23 человека. В родственном аспекте изобретение относится к способу лечения псориаза у субъекта, включающему стадии: (i) выбора субъекта, который страдает хроническим псориазом; и (ii) введения субъекту антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23; тем самым осуществляя лечение хронического псориаза у субъекта.
В другом родственном аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23, где у субъекта сохраняется по меньшей мере ответ PASI 50, по меньшей мере ответ PASI 75 или по меньшей мере ответ PASI 90 в течение длительного периода после прекращения введения антитела или его антигенсвязывающей части, тем самым осуществляя лечение псориаза у субъекта.
В другом аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23, где у субъекта сохраняется показатель PGA "отсутствие признаков" или "минимальные признаки" в течение длительного периода после начального введения антитела или его антигенсвязывающей части, тем самым осуществляя лечение псориаза у субъекта.
В другом аспекте изобретение относится к способу лечения псориаза у субъекта, включающему введение субъекту антитела или его антигенсвязывающей части, которые способны связываться с эпитопом субъединицы p40 IL-12 и/или IL-23, где у субъекта обнаруживается улучшенный показатель PASI приблизительно через 8 недель после начального введения антитела или его антигенсвязывающей части, тем самым осуществляя лечение псориаза у субъекта. В одном варианте осуществления у субъекта обнаруживается улучшенный показатель PASI приблизительно через 7 недель, приблизительно через 6 недель, приблизительно через 5 недель, приблизительно через 4 недели, приблизительно через 3 недели, приблизительно через 2 недели или приблизительно через 1 неделю после начального введения антитела или его антигенсвязывающей части.
В одном варианте осуществления длительный период после прекращения введения антитела составляет по меньшей мере приблизительно 12 недель. В одном варианте осуществления длительный период составляет по меньшей мере приблизительно 12, 13, 14, 15, 16, 17, 18, 19, 20 недель, 21 неделю, 22, 23 или 24 недели. В одном варианте осуществления антитело вводят в течение по меньшей мере приблизительно 12 недель.
В одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, способны связываться с эпитопом субъединицы p40 IL-12.
В другом варианте осуществления антитело или его антигенсвязывающая часть способны связываться с эпитопом субъединицы p40, когда субъединица p40 связана с субъединицей p35 IL-12. В другом варианте осуществления антитело или его антигенсвязывающая часть способны связываться с эпитопом субъединицы p40, когда субъединица p40 связана с субъединицей p19. В одном варианте осуществления антитело или его антигенсвязывающая часть способны связываться с эпитопом субъединицы p40, когда субъединица p40 связана с субъединицей p35 IL-12 и когда субъединица p40 связана с субъединицей p19.
В одном варианте осуществления антитело или его антигенсвязывающая часть связываются с эпитопом субъединицы p40 IL-12, с которым связывается антитело, выбранное из группы, состоящей из Y61 и J695.
В другом варианте осуществления антитело, кроме того, способно связываться с первым гетеродимером, а также оно способно связываться со вторым гетеродимером, где первый гетеродимер содержит субъединицу p40 IL-12 и субъединицу p35 IL-12, и где второй гетеродимер содержит субъединицу p40 IL-12 и субъединицу p19.
В еще одном варианте осуществления антитело нейтрализует активность первого гетеродимера. В другом варианте осуществления антитело нейтрализует активность второго гетеродимера. В другом варианте осуществления антитело нейтрализует активность первого гетеродимера и второго гетеродимера.
В еще одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-9 M или менее, или ингибируют продукцию IFNγ человека с IC50 1×10-10 M или менее.
В одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, диссоциируют от субъединицы p40 IL-12 с Kd 1×10-10 M или менее или константой скорости koff 1×10-3 с-1 или менее, как определено поверхностным плазмонным резонансом.
В одном варианте осуществления выделенное антитело или его антигенсвязывающая часть, используемые в способах по изобретению, представляют собой химерное антитело, гуманизированное антитело или антитело человека.
В другом варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, имеют CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:25, и CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:26.
В еще одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, имеют CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:27, и CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:28.
В одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, имеют CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:29, и CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:30.
В другом варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, способны связываться с интерлейкином, содержащим субъединицу p40. В одном варианте осуществления интерлейкин содержит субъединицу p40 и субъединицу p35, например, интерлейкин представляет собой IL-12. В другом варианте осуществления интерлейкин содержит субъединицу p40 и субъединицу p19. В другом варианте осуществления антитело или его антигенсвязывающая часть нейтрализуют активность интерлейкина.
В одном варианте осуществления антитело или его антигенсвязывающая часть связываются с эпитопом субъединицы p40.
В одном варианте осуществления антитело или его антигенсвязывающую часть вводят субъекту в фармацевтической композиции, содержащей антитело или его антигенсвязывающую часть и фармацевтически приемлемый носитель. Фармацевтическая композиция также может содержать дополнительное средство, такое как лекарственное средство, например, буденозид, эпидермальный фактор роста, кортикостероиды, циклоспорин, сульфасалазин, аминосалицилаты, 6-меркаптопурин, азатиоприн, метронидазол, ингибиторы липоксигеназы, месаламин, олсалазин, балсалазид, антиоксиданты, ингибиторы тромбоксана, антагонисты рецептора IL-1, моноклональные антитела против IL-1β, моноклональные антитела против IL-6, факторы роста, ингибиторы эластазы, пиридинил-имидазольные соединения, антитела к TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF или их агонисты, антитела к CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лиганды, метотрексат, циклоспорин, FK506, рапамицин, микофенолата мофетил, лефлуномид, NSAID (НПВС), ибупрофен, кортикостероиды, преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, IRAK, NIK, IKK, p38, ингибиторы MAP-киназы, ингибиторы IL-1β-превращающего фермента, ингибиторы TNFα-превращающего фермента, ингибиторы T-клеточной передачи сигнала, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензинпревращающего фермента, растворимые рецепторы цитокинов, растворимый рецептор p55 TNF, растворимый рецептор p75 TNF, sIL-1RI, sIL-1RII, sIL-6R, противовоспалительные цитокины, IL-4, IL-10, IL-11, IL-13 и TGFβ.
В другом варианте осуществления лекарственное средство в фармацевтической композиции, вводимое субъекту, может быть выбрано из группы, состоящей из антител против TNF и фрагментов этих антител, конструкций TNFR-Ig, ингибиторов TACE, ингибиторов PDE4, кортикостероидов, буденозида, дексаметазона, сульфасалазина, 5-аминосалициловой кислоты, олсалазина, ингибиторов IL-1β-превращающего фермента, IL-1ra, ингибиторов тирозинкиназы, 6-меркаптопуринов и IL-11.
В другом варианте осуществления лекарственное средство может быть выбрано из группы, состоящей из кортикостероидов, преднизолона, метилпреднизолона, азатиоприна, циклофосфамида, циклоспорина, метотрексата, 4-аминопиридина, тизанидина, интерферона-β1a, интерферона-β1b, сополимера 1, гипербарического кислорода, внутривенного иммуноглобулина, клабрибина, антител к TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF, PDGF или их агонистов, антител к CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90 или их лигандов, метотрексата, циклоспорина, FK506, рапамицина, микофенолата мофетила, лефлуномида, NSAID (НПВС), ибупрофена, кортикостероидов, преднизолона, ингибиторов фосфодиэстеразы, агонистов аденозина, антитромботических средств, ингибиторов комплемента, адренергических средств, IRAK, NIK, IKK, p38 или ингибиторов MAP-киназы, ингибиторов IL-1β-превращающего фермента, ингибиторов TACE, ингибиторов T-клеточной передачи сигнала, ингибиторов киназы, ингибиторов металлопротеиназы, сульфасалазина, азатиоприна, 6-меркаптопуринов, ингибиторов ангиотензинпревращающего фермента, растворимых рецепторов цитокинов, растворимых рецепторов p55 TNF, растворимых рецепторов p75 TNF, sIL-1RI, sIL-1RII, sIL-6R, sIL-13R, антитела против P7s, гликопротеинового лиганда p-селектина (PSGL), противовоспалительных цитокинов, IL-4, IL-10, IL-13 и TGFβ.
В одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, связываются с IL-12 человека и/или IL-23 человека и диссоциируют от IL-12 человека и/или IL-23 человека, соответственно, с Kd 1×10-10 M или менее и константой скорости koff 1×10-3с-1 или менее, как определено поверхностным плазмонным резонансом. В одном варианте осуществления антитело или его антигенсвязывающая часть диссоциируют от IL-12 человека и/или IL-23 человека с константой скорости koff 1×10-4с-1 или менее. В другом варианте осуществления антитело или его антигенсвязывающая часть диссоциируют от IL-12 человека и/или IL-23 человека с константой скорости koff 1×10-5с-1 или менее.
В другом варианте осуществления антитело или его антигенсвязывающая часть связываются с IL-12 человека и/или IL-23 человека и диссоциируют от IL-12 человека и/или IL-23 человека, соответственно, с константой скорости koff 1×10-2с-1 или менее, как определено поверхностным плазмонным резонансом. В другом варианте осуществления антитело или его антигенсвязывающая часть диссоциируют от IL-12 человека и/или IL-23 человека с константой скорости koff 1×10-3с-1 или менее. В другом варианте осуществления антитело или его антигенсвязывающая часть диссоциируют от IL-12 человека и/или IL-23 человека с константой скорости koff 1×10-4с-1 или менее. В другом варианте осуществления антитело или его антигенсвязывающая часть диссоциируют от IL-12 человека и/или IL-23 человека с константой скорости koff 1×10-5с-1 или менее.
В другом варианте осуществления антитело или его антигенсвязывающая часть связываются с IL-12 человека и/или IL-23 человека и диссоциируют от IL-12 человека и/или IL-23 человека, соответственно, с Kd 1,34×10-10 M или менее. В другом варианте осуществления антитело или его антигенсвязывающая часть связываются с IL-12 человека и/или IL-23 человека и диссоциируют от IL-12 человека и/или IL-23 человека, соответственно, с Kd 9,74×10-11 M или менее. В одном варианте осуществления антитело или его антигенсвязывающая часть представляют собой рекомбинантное антитело или его антигенсвязывающую часть.
В одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, представляют собой нейтрализующее антитело, например, они нейтрализуют активность IL-12 человека и/или IL-23 человека. В одном варианте осуществления нейтрализующее антитело или его антигенсвязывающая часть ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-9 M или менее. В другом варианте осуществления нейтрализующее антитело или его антигенсвязывающая часть ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-10 M или менее. В другом варианте осуществления нейтрализующее антитело или его антигенсвязывающая часть ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-11 M или менее. В другом варианте осуществления нейтрализующее антитело или его антигенсвязывающая часть ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе пролиферации бластных клеток при стимуляции фитогемагглютинином in vitro (анализе PHA) с IC50 1×10-7 M или менее. В другом варианте осуществления нейтрализующее антитело или его антигенсвязывающая часть ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-8 M или менее. В одном варианте осуществления нейтрализующее антитело или его антигенсвязывающая часть ингибируют продукцию IFNγ человека с IC50 1×10-10 M или менее. В другом варианте осуществления нейтрализующее антитело или его антигенсвязывающая часть ингибируют продукцию IFNγ человека с IC50 1×10-11 M или менее. В другом варианте осуществления нейтрализующее антитело или его антигенсвязывающая часть ингибируют продукцию IFNγ человека с IC50 5×10-12 M или менее.
В одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению,
a) ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-9 M или менее;
b) имеют CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:25; и
c) имеют CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:26. В одном варианте осуществления антитело дополнительно имеет CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:27; и CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:28. В другом варианте осуществления антитело или его антигенсвязывающая часть дополнительно имеют CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:29; и CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:30. В другом варианте осуществления антитело или его антигенсвязывающая часть, кроме того, ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-10 M или менее. В другом варианте осуществления антитело или его антигенсвязывающая часть, кроме того, ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-11 M или менее.
В одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, имеют вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:31, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:32.
В одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, содержат константную область тяжелой цепи, выбранную из группы, состоящей из константных областей IgG1, IgG2, IgG3, IgG4, IgM, IgA и IgE. В одном варианте осуществления константная область тяжелой цепи антитела представляет собой IgG1. В другом варианте осуществления антитело представляет собой Fab-фрагмент, F(ab')2-фрагмент или одноцепочечный Fv-фрагмент.
В одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, диссоциируют от IL-12 человека и/или IL-23 человека с Kd 1×10-10 M или менее и связываются с эпитопом на субъединице p40 IL-12 человека и/или IL-23 человека.
В одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, представляют собой антитело человека или его антигенсвязывающую часть, которые
a) диссоциируют от IL-12 человека с константой скорости koff 1×10-3с-1 или менее, как определено поверхностным плазмонным резонансом;
b) имеют CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:25; и
c) имеют CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:26.
В другом варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, диссоциируют от IL-12 человека с константой скорости koff 1×10-4c-1 или менее. В еще одном варианте осуществления антитело человека или его антигенсвязывающая часть диссоциируют от IL-12 человека с константой скорости koff 1×10-5с-1 или менее.
В одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, представляют собой антитело человека или его антигенсвязывающую часть, которые связываются с IL-12 человека и содержат:
домен CDR3 легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:26; и
домен CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:25.
В одном варианте осуществления антитело или его антигенсвязывающая часть имеют вариабельную область легкой цепи (LCVR), имеющую домен CDR3, содержащий аминокислотную последовательность SEQ ID NO:26, и имеют вариабельную область тяжелой цепи (HCVR), имеющую домен CDR3, содержащий аминокислотную последовательность SEQ ID NO:25. В другом варианте осуществления антитело или его антигенсвязывающая часть содержат LCVR, дополнительно имеющую домен CDR2, содержащий аминокислотную последовательность SEQ ID NO:28, и HCVR, дополнительно включающую домен CDR2, содержащий аминокислотную последовательность SEQ ID NO:27. В другом варианте осуществления LCVR дополнительно имеет домен CDR1, содержащий аминокислотную последовательность SEQ ID NO:30, и HCVR имеет домен CDR1, содержащий аминокислотную последовательность SEQ ID NO:29.
В одном варианте осуществления антитело или его антигенсвязывающая часть связывают IL-12 человека и/или IL-23 человека и представляют собой антитело J695 (также называемое ABT-874) или его антигенсвязывающую часть.
В одном варианте осуществления антитело или его антигенсвязывающая часть связываются с IL-12 человека и/или IL-23 человека и диссоциируют от IL-12 человека с Kd 1,34×10-10 M или менее, и нейтрализуют IL-12 человека и/или IL-23 человека. В одном варианте осуществления антитело или его антигенсвязывающая часть диссоциируют от IL-12 человека и/или IL-23 человека с Kd 9,74×10-11 M или менее. В одном варианте осуществления антитело или его антигенсвязывающая часть ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-7 M или менее. В одном варианте осуществления антитело или его антигенсвязывающая часть ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-8 M или менее. В одном варианте осуществления антитело или его антигенсвязывающая часть ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-9 M или менее. В одном варианте осуществления антитело или его антигенсвязывающая часть ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-10 M или менее. В одном варианте осуществления антитело или его антигенсвязывающая часть ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-11 M или менее. В одном варианте осуществления антитело или его антигенсвязывающая часть ингибируют продукцию IFNγ человека с IC50 1×10-10 M или менее. В одном варианте осуществления антитело или его антигенсвязывающая часть ингибируют продукцию IFNγ с IC50 1×10-11 M или менее. В одном варианте осуществления антитело или его антигенсвязывающая часть ингибируют продукцию IFNγ человека с IC50 5×10-12 M или менее.
В одном варианте осуществления антитело или его антигенсвязывающая часть, используемые в способах по изобретению, ингибируют связывание IL-12 и/или IL-23 с их рецепторами в анализе связывания рецептора с IL-12 или IL-23 (RBA), соответственно, с IC50 1×10-9 M или менее. В одном варианте осуществления антитело или его антигенсвязывающая часть ингибируют связывание IL-12 и/или IL-23 с их рецепторами в анализе связывания рецептора с IL-12 или IL-23 (RBA), соответственно, с IC50 1×10-10 M или менее. В одном варианте осуществления антитело или его антигенсвязывающая часть ингибируют связывание IL-12 и/или IL-23 с их рецепторами в анализе связывания рецепторов IL-12 или IL-23 (RBA), соответственно, с IC50 1×10-11 M или менее.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
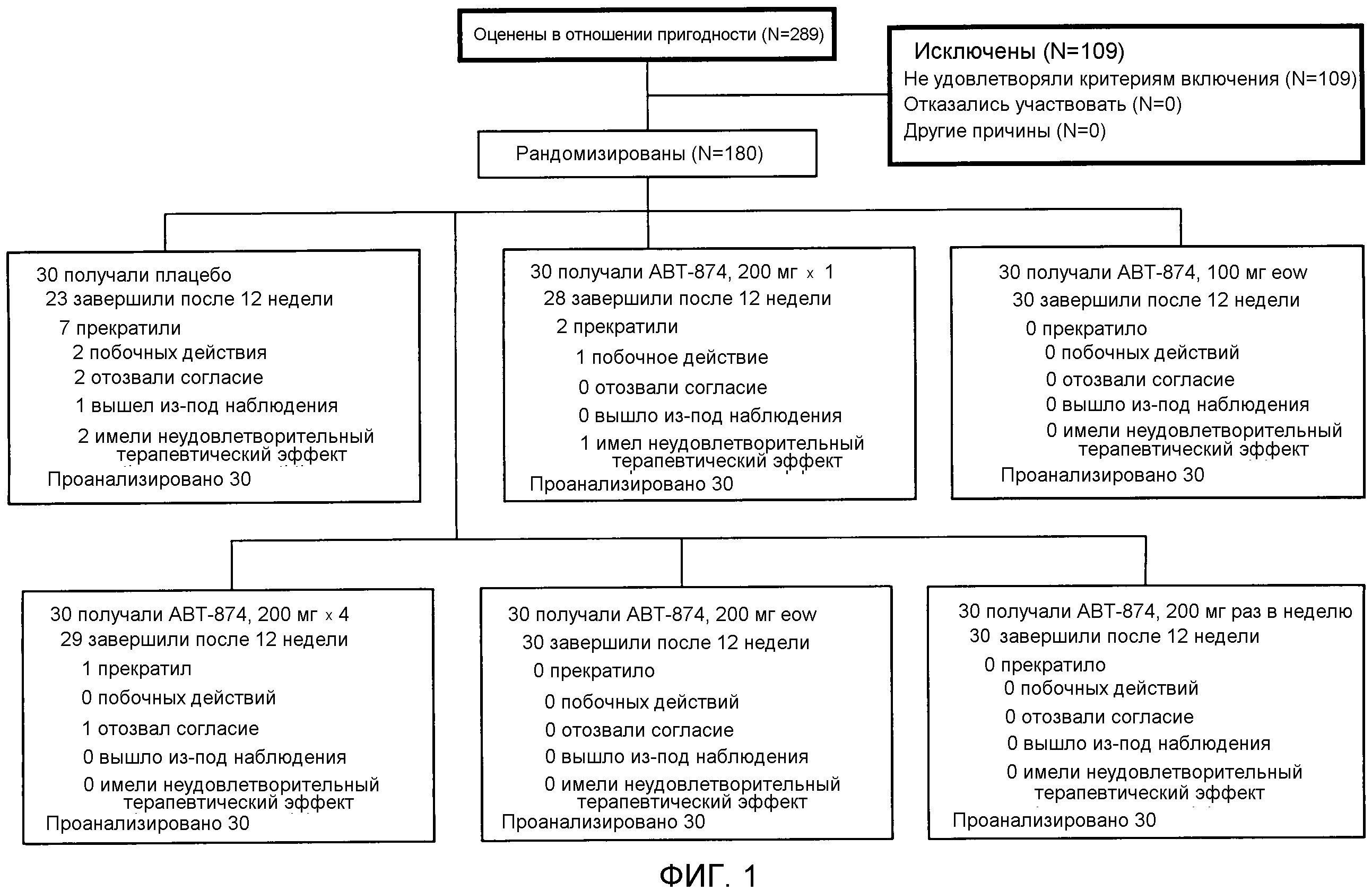
На фигуре 1 представлено распределение пациентов в испытании. (Термин "eow" относится к введению дозы раз в две недели.)
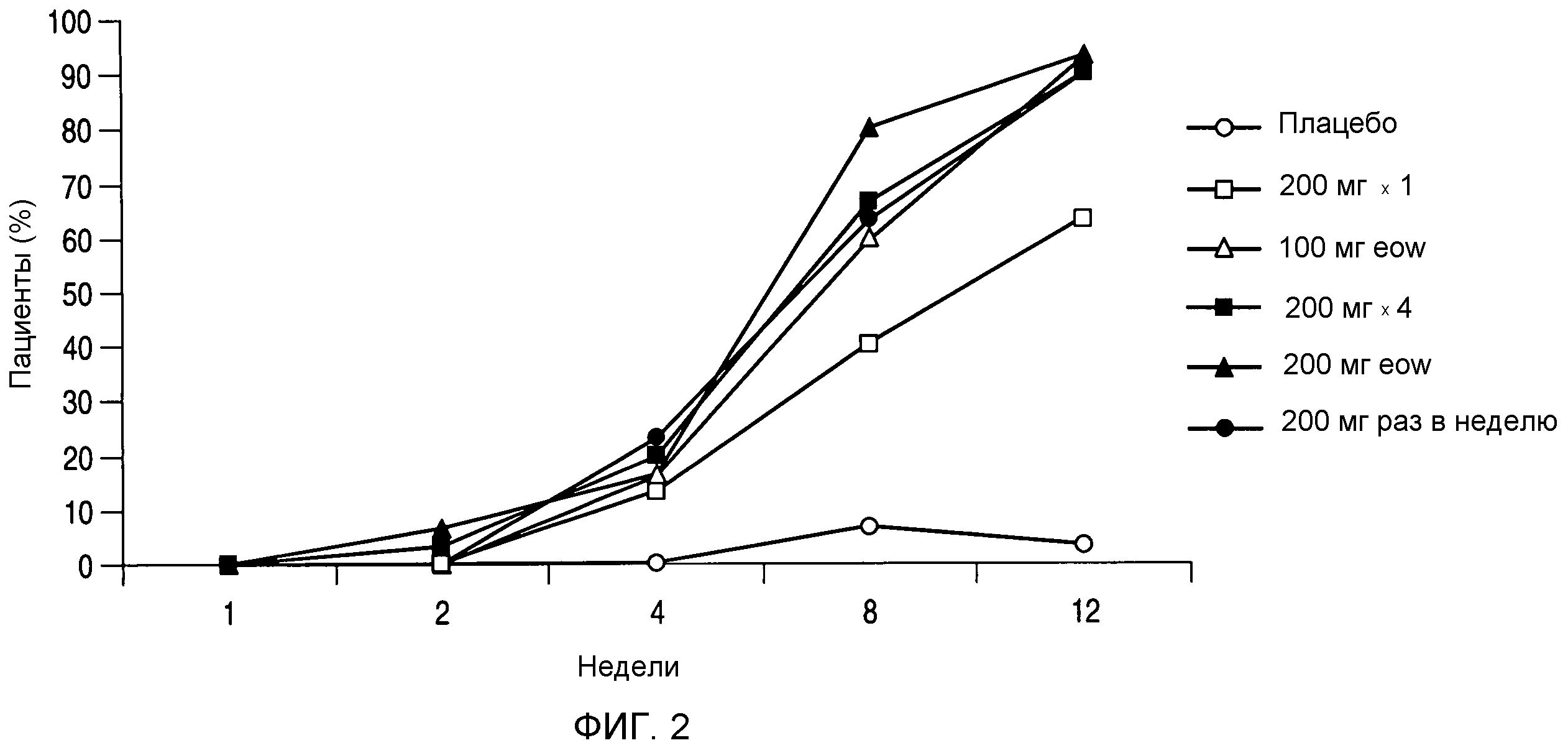
На фигуре 2 представлен процент пациентов по меньшей мере с 75% улучшением индекса площади и тяжести псориаза (PASI 75) в течение 12-недельной части испытания. К 8 неделе, за исключением группы 200 мг × 1, процент пациентов, которые имели ответ PASI 75, был статистически значимо более высоким (p<0,001) в каждой группе введения ABT-874 по сравнению с плацебо, исходя из дисперсионного анализа данных, полученных для подвергаемой лечению выборки. (Термин "eow" относится к введению дозы раз в две недели.)
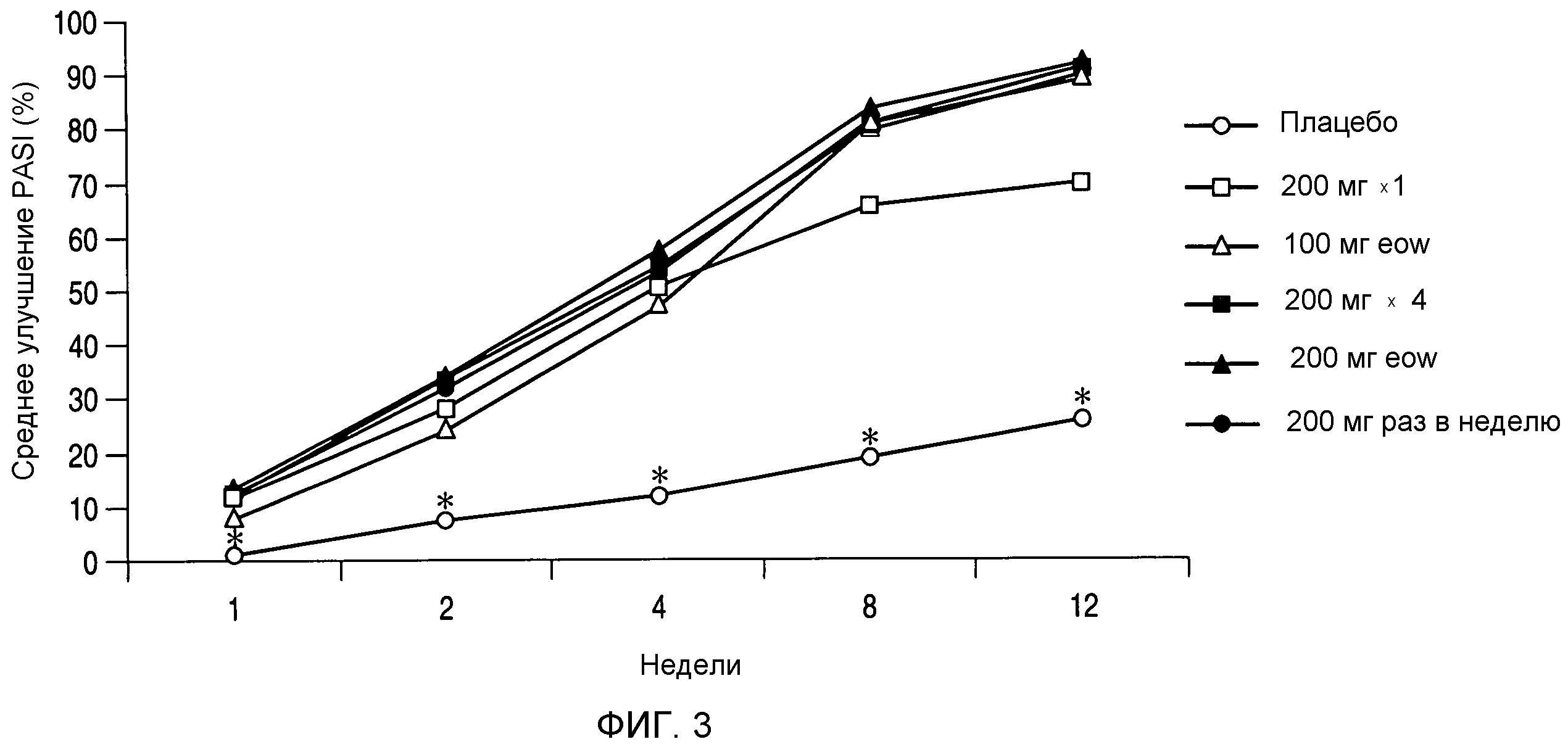
На фигуре 3 представлено среднее процентное улучшение показателей индекса площади и тяжести псориаза (PASI) по сравнению с исходным уровнем. Данные демонстрируют, что для каждой группы введения ABT-874 по сравнению с плацебо во все моменты времени *p<0,001 (за исключением 100 мг eow на 1 неделе, p=0,023), исходя из дисперсионного анализа данных, полученных для подвергаемой лечению выборки. (Термин "eow" относится к введению дозы раз в две недели.)
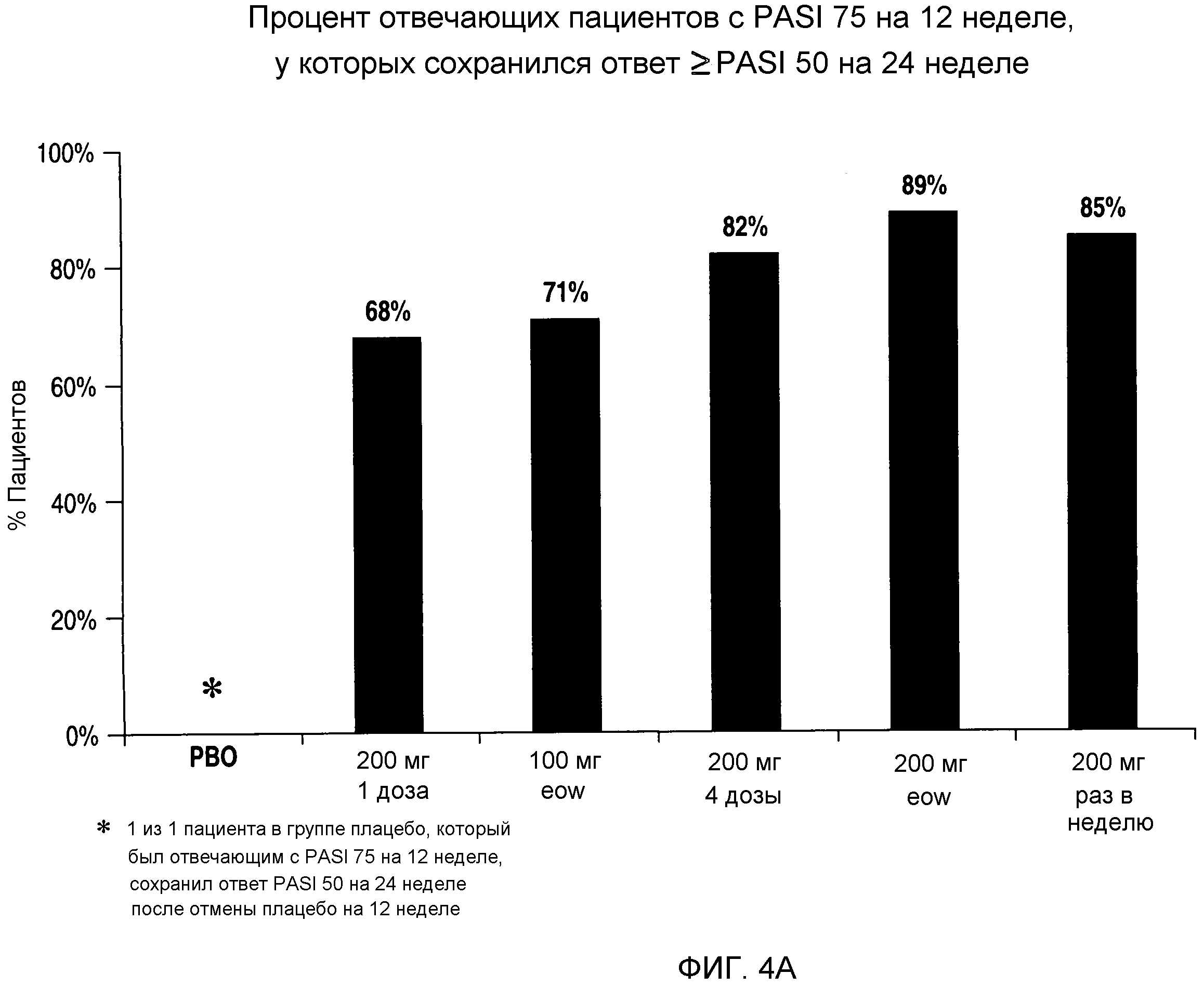
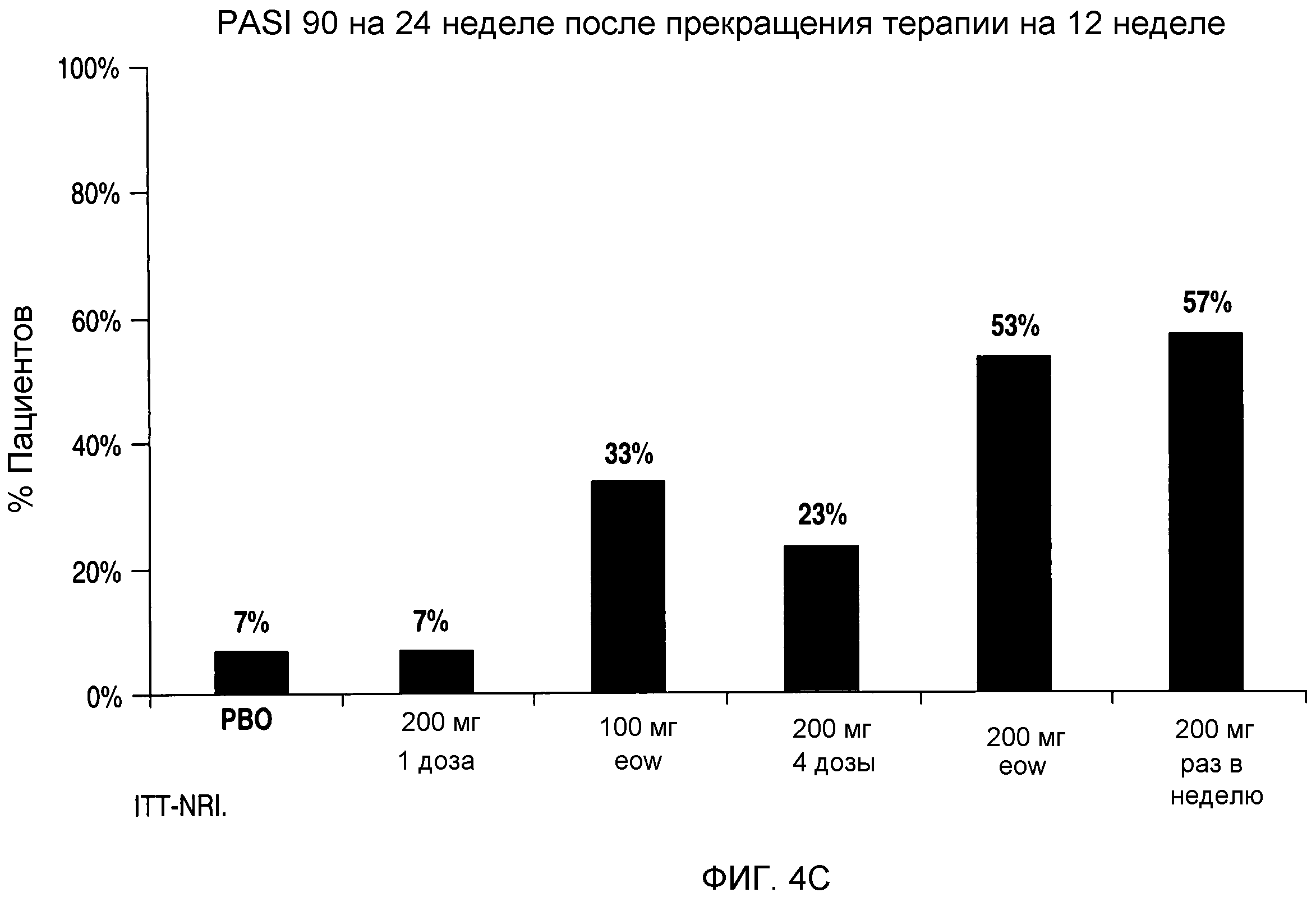
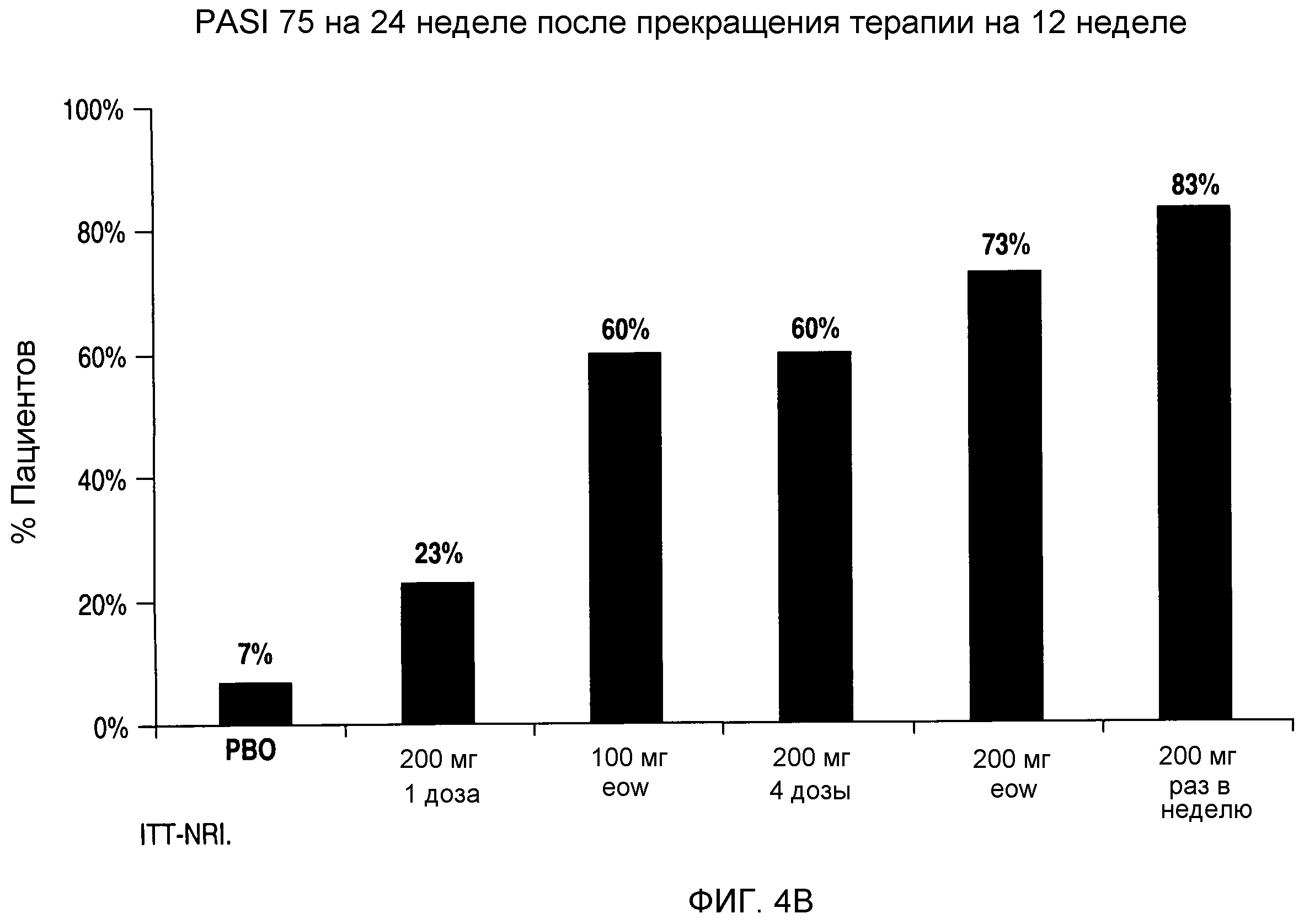
На фигурах 4A-C представлен процент пациентов, у которых сохранялся ответ PASI 50, PASI 75 и PASI 90, соответственно, на 24 неделе испытания, т.е. через 12 недель после прекращения введения антитела.
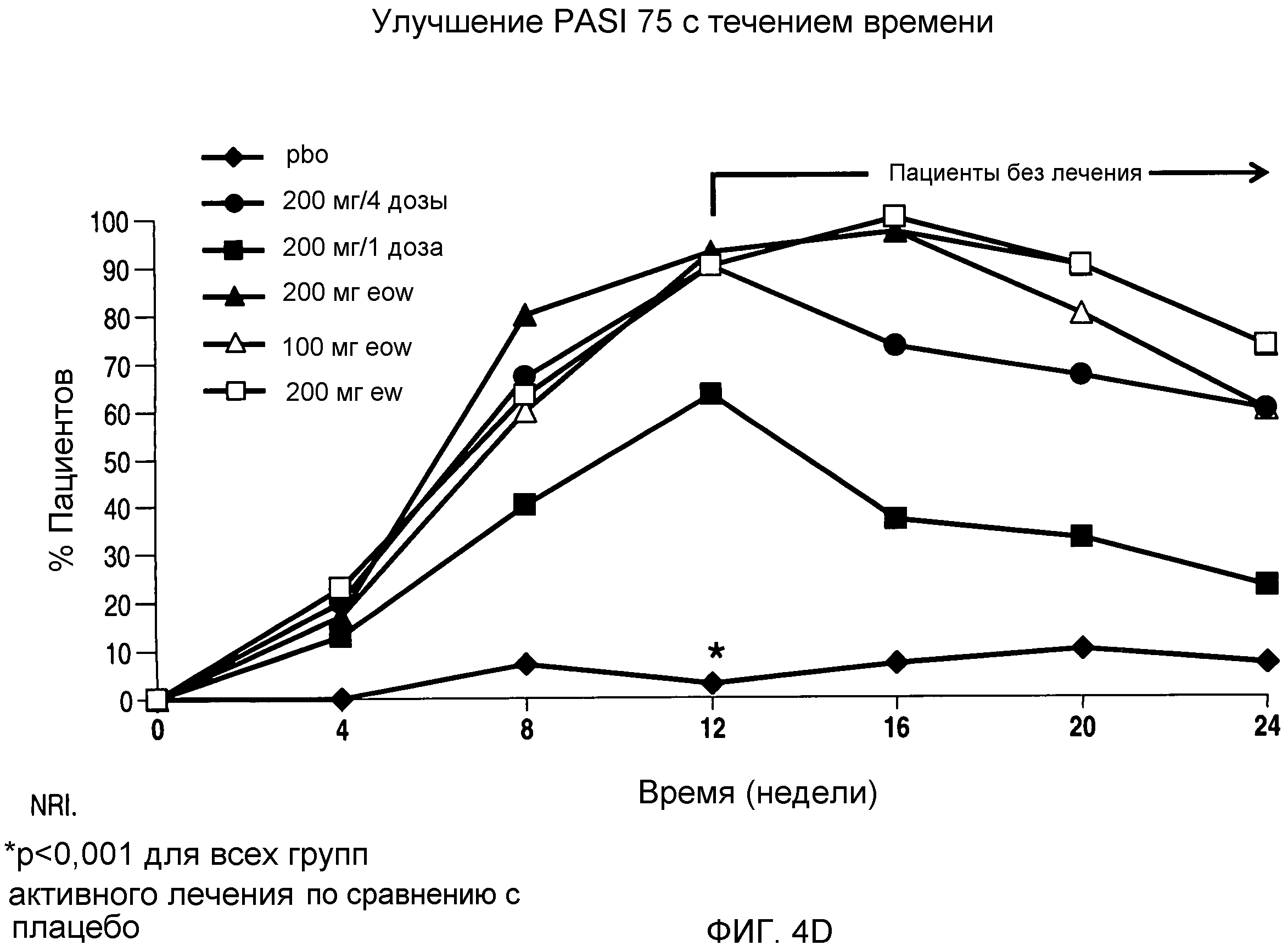
На фигуре 4D представлен процент пациентов, у которых сохранялся ответ PASI 75 с течением времени в процессе 24-недельного периода испытания.
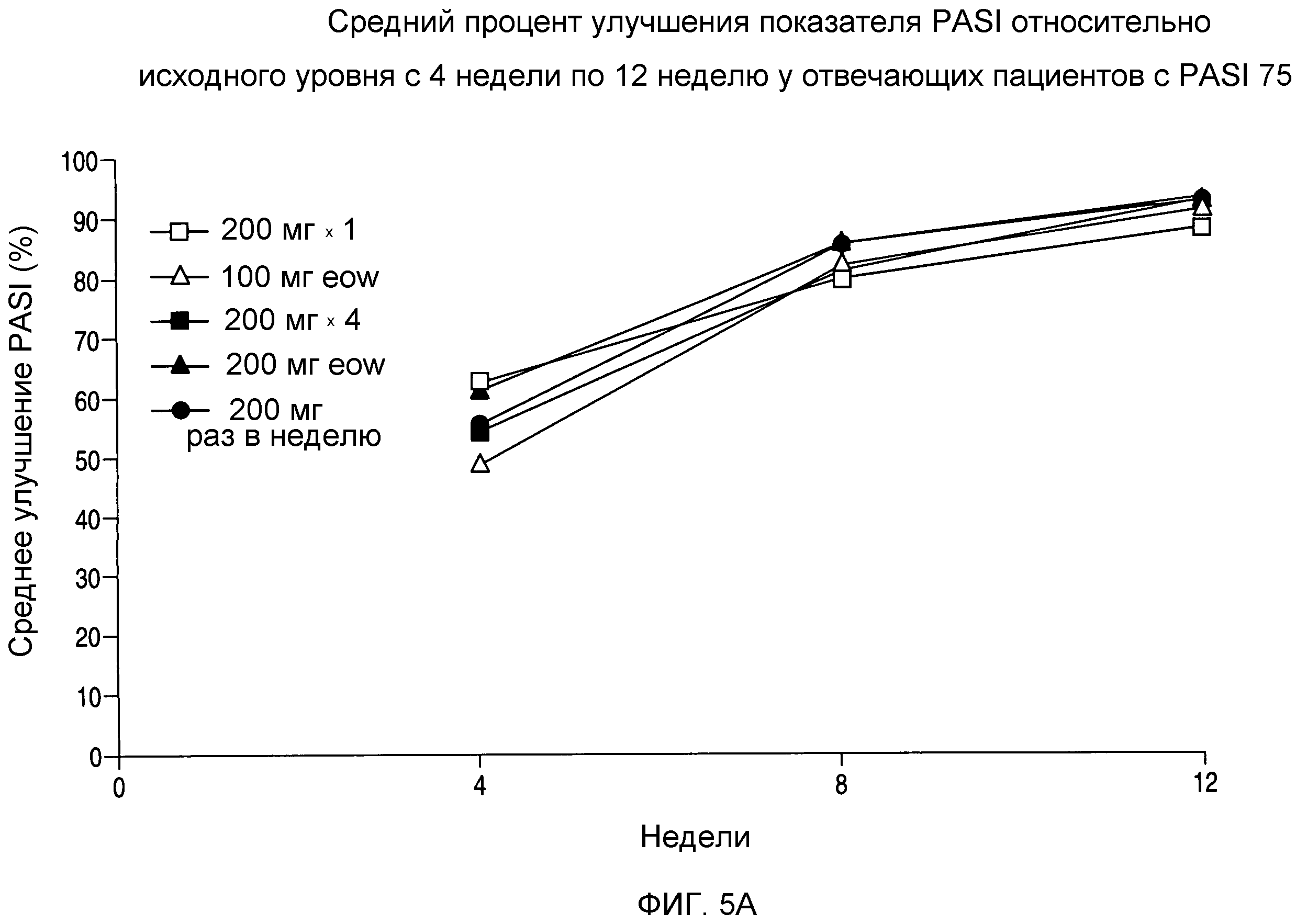
На фигуре 5A показано среднее процентное улучшение показателей PASI относительно исходного уровня с 4 недели по 12 неделю.
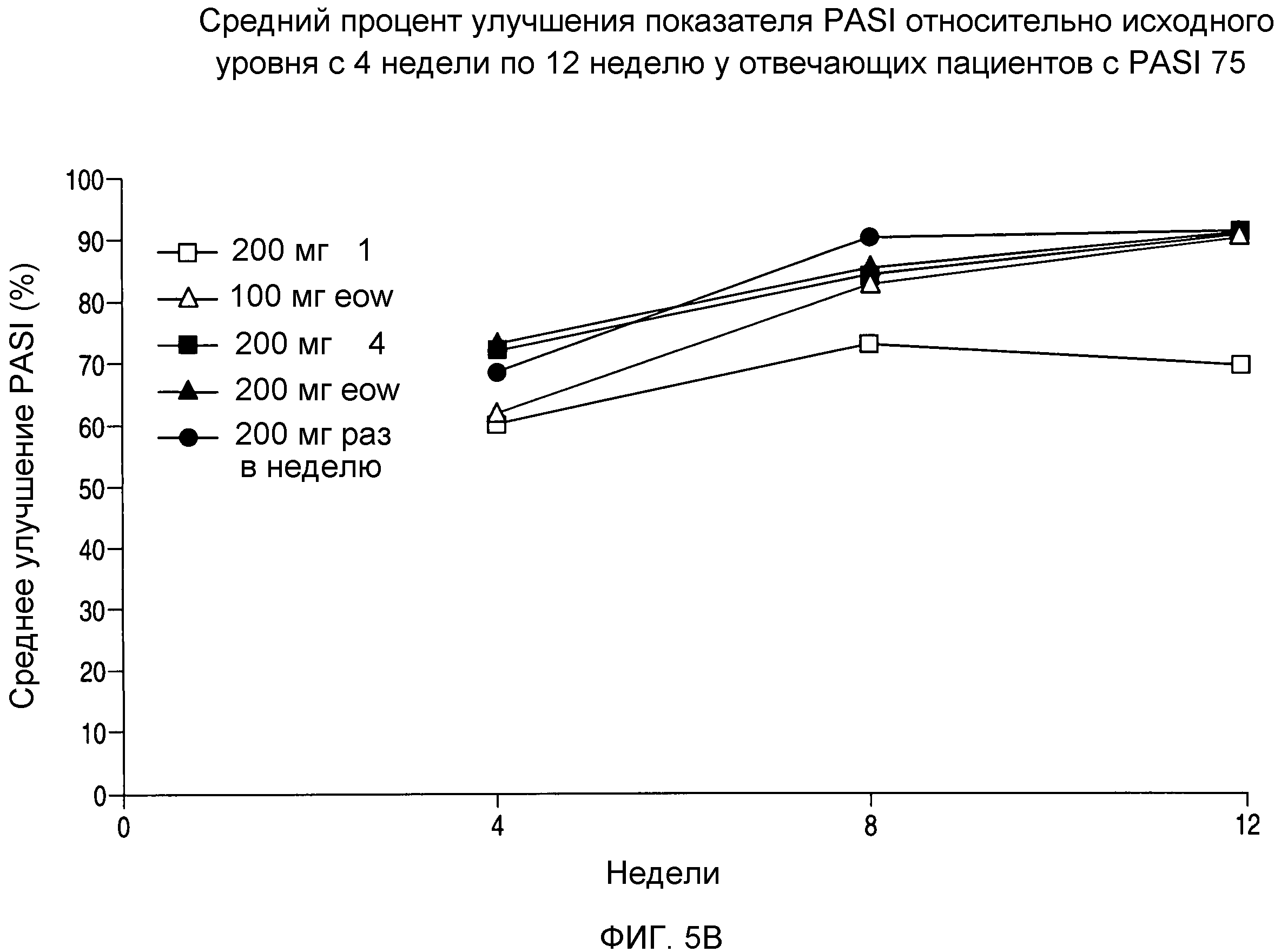
На фигуре 5B показано среднее процентное улучшение показателей PASI относительно исходного уровня с 4 недели по 12 неделю после повторного введения.
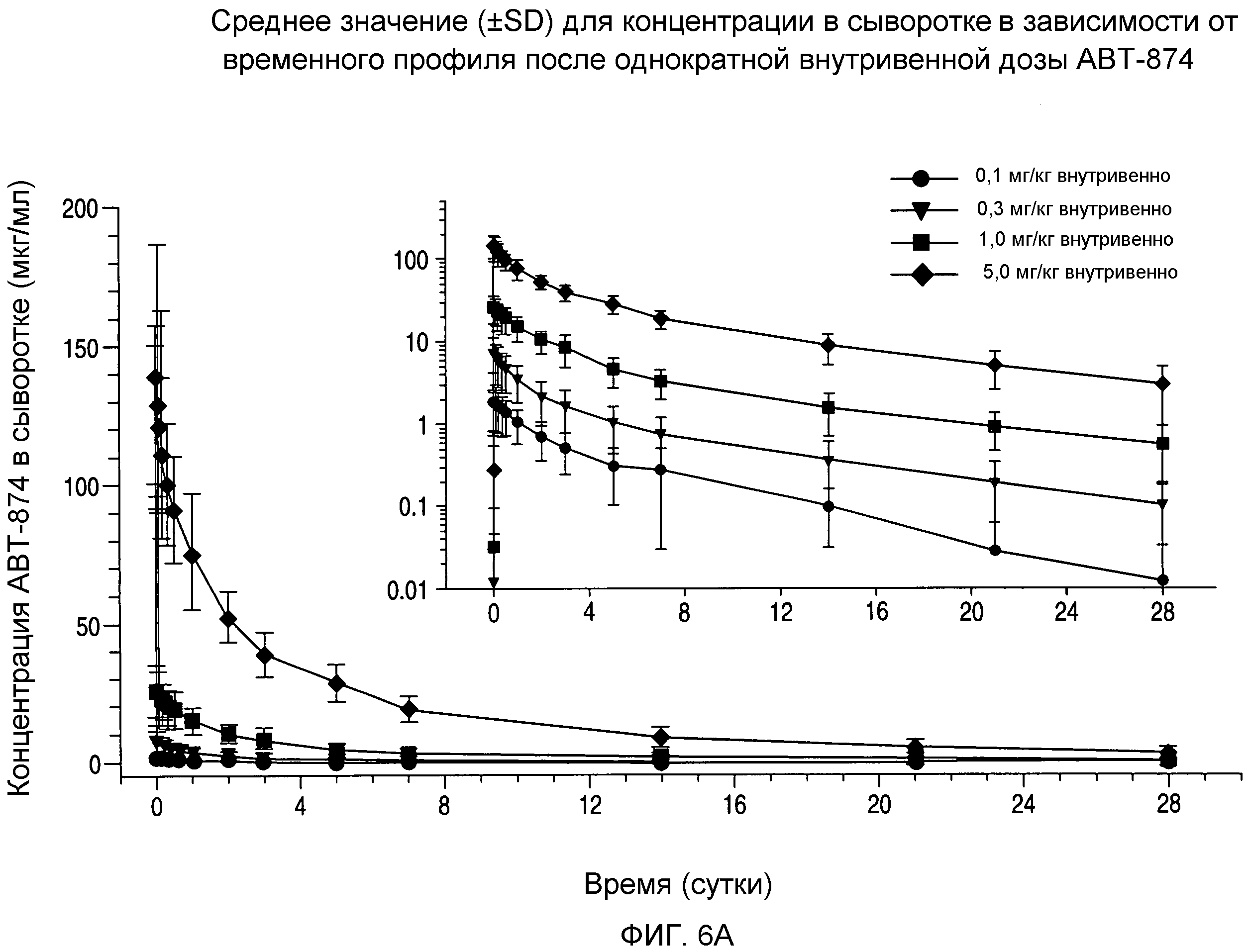
На фигуре 6A показана кривая концентрация в сыворотке-время для внутривенного введения дозы ABT-874.
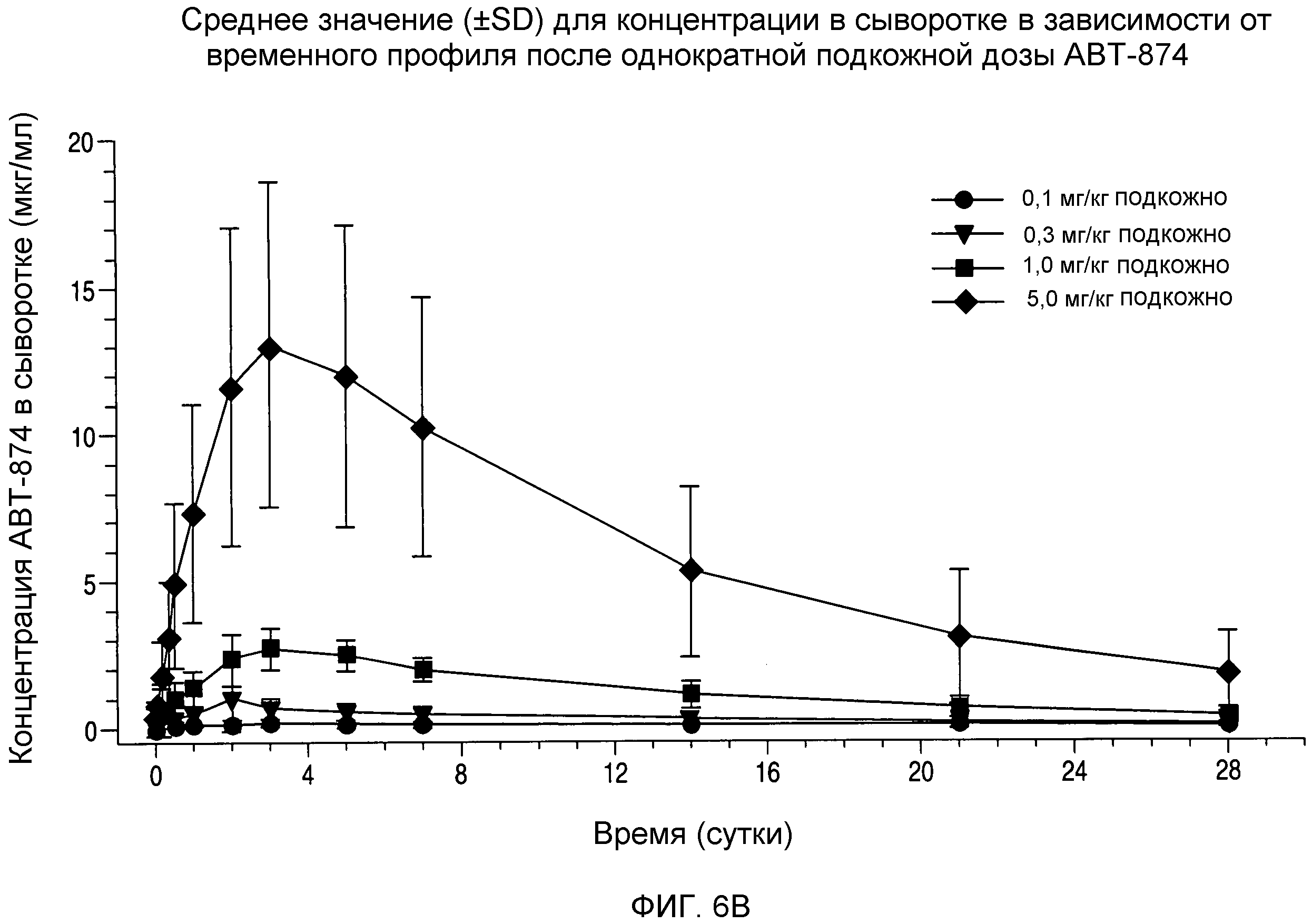
На фигуре 6B показана кривая концентрация в сыворотке-время для подкожного введения дозы ABT-874.
На фигуре 7A показан процент пациентов, повторно достигших ответа PASI 75 после повторного введения.
На фигуре 7B представлено срединное время до достижения ответа PASI 75 во всех группах дозировок ABT-874 в ходе повторного введения.
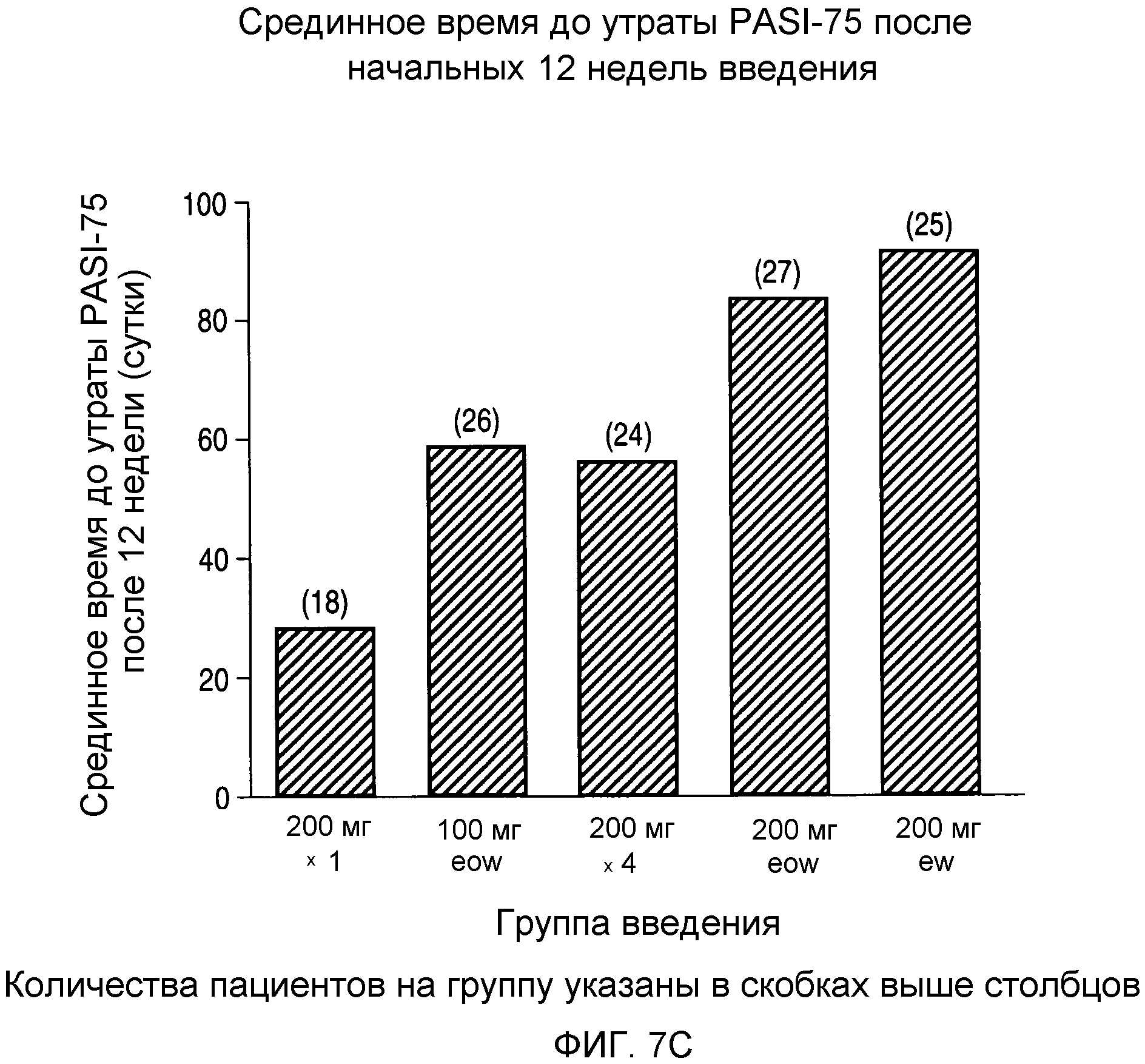
На фигуре 7C представлено срединное время до снижения ответа PASI 75 после начальных 12 недель введения.
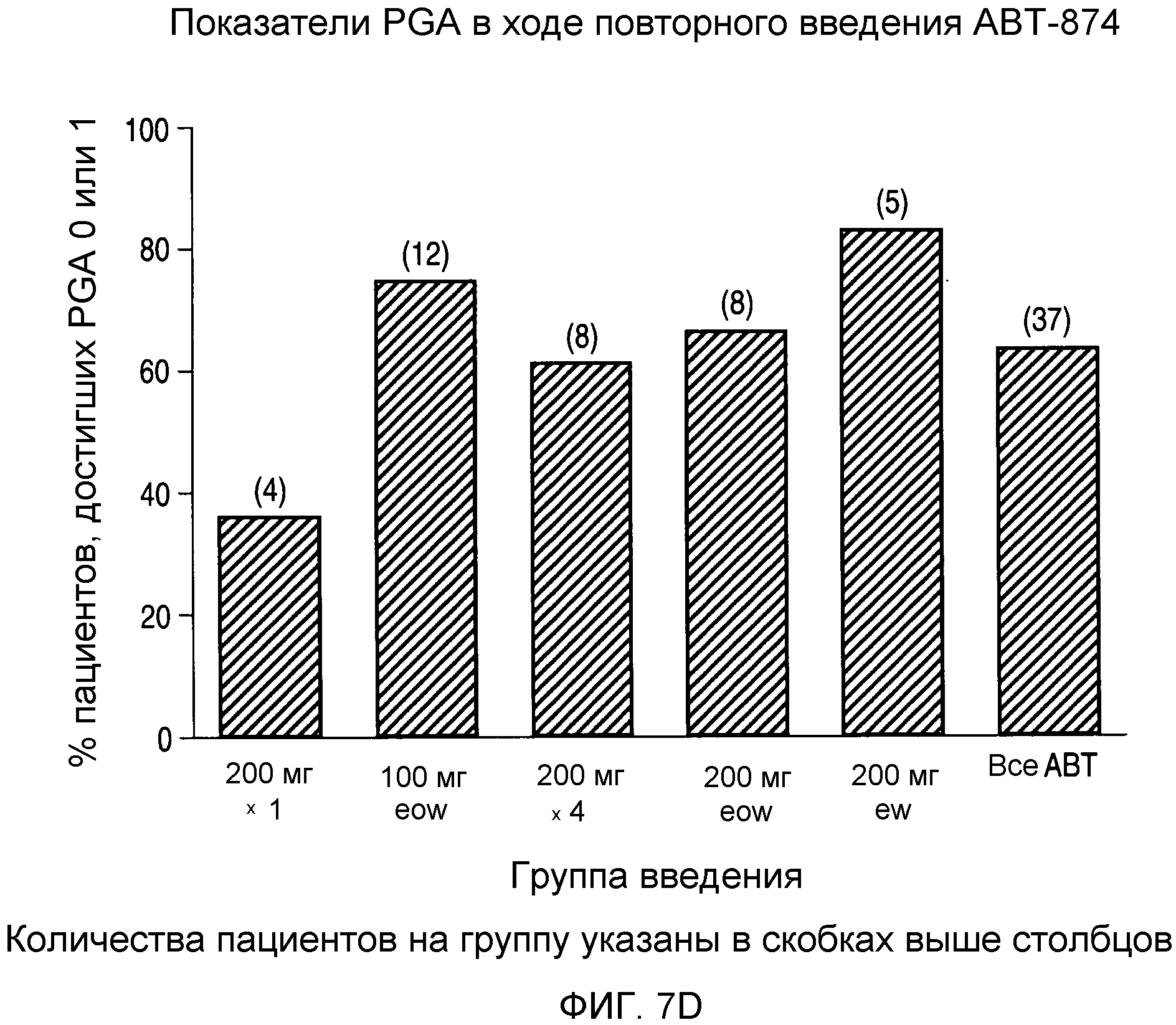
На фигуре 7D показан процент пациентов, достигших показателя PGA 0 или 1 после повторного введения.
На фигурах 8A-8B представлено выравнивание аминокислотных последовательностей вариабельных областей тяжелых цепей для серии антител человека, которые связывают IL-12 человека, по сравнению с эмбриональными последовательностями Cos-3/JH3 и Dp118 Lv1042. Для обозначения аминокислотных положений используют нумерацию по Kabat. Для Joe 9 дикого типа представлена полная последовательность. Для других антител представлены только аминокислотные положения, которые отличаются от Joe 9 дикого типа.
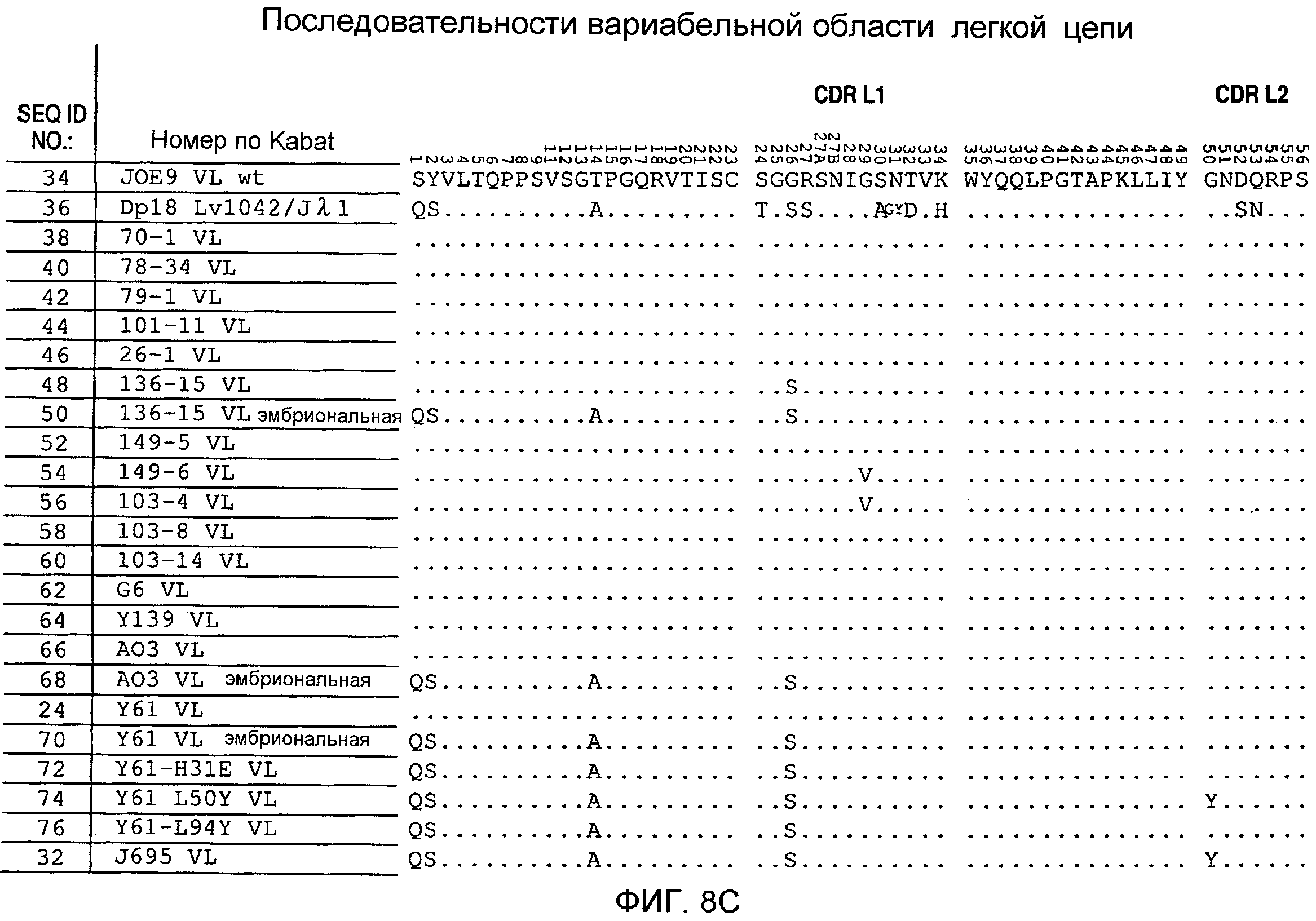
На фигурах 8С-8D представлено выравнивание аминокислотных последовательностей вариабельных областей легких цепей для серии антител человека, которые связывают IL-12 человека. Для обозначения аминокислотных положений используют нумерацию по Kabat. Для Joe 9 дикого типа представлена полная последовательность. Для других антител представлены только аминокислотные положения, которые отличаются от Joe 9 дикого типа.
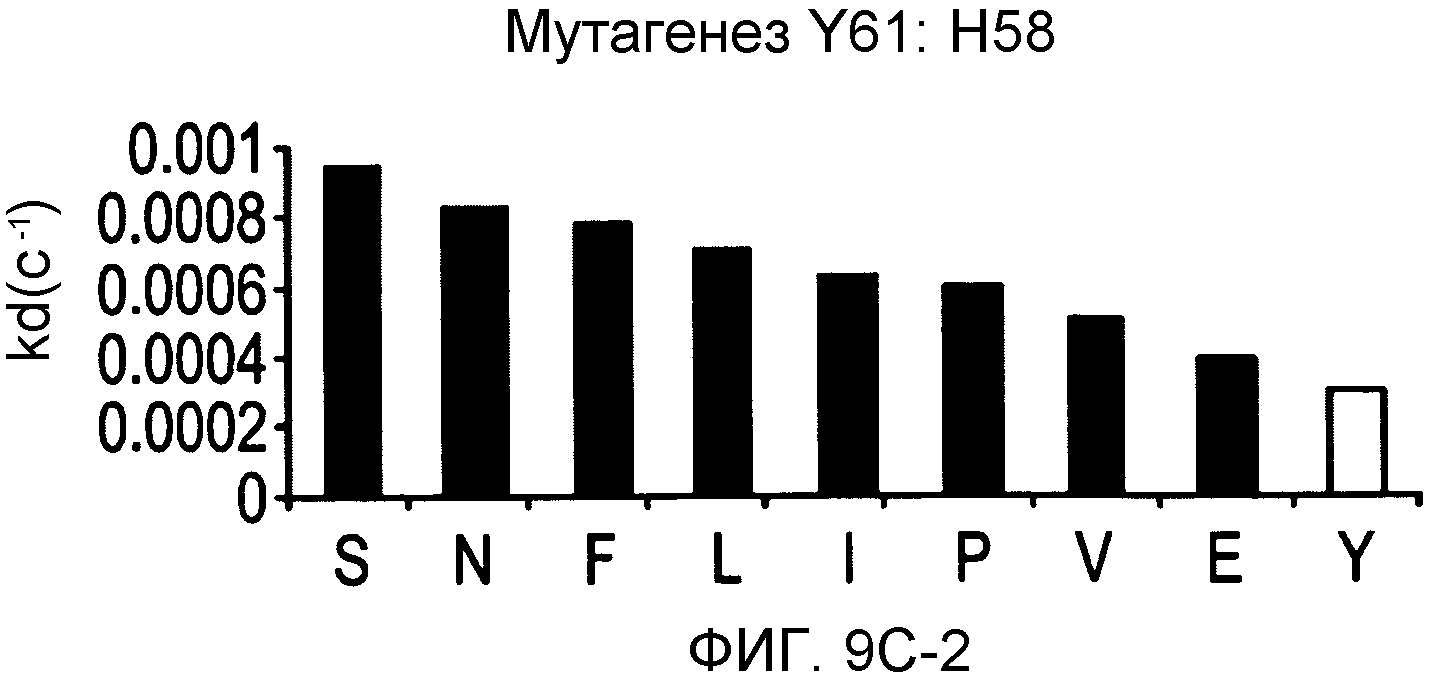
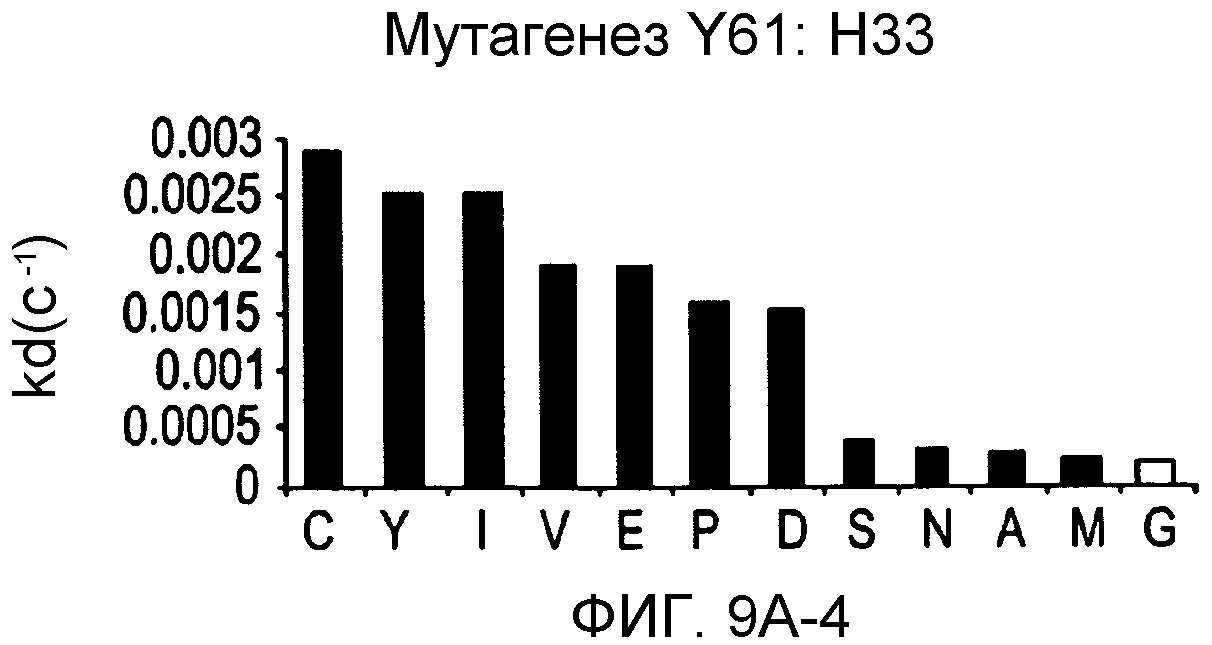
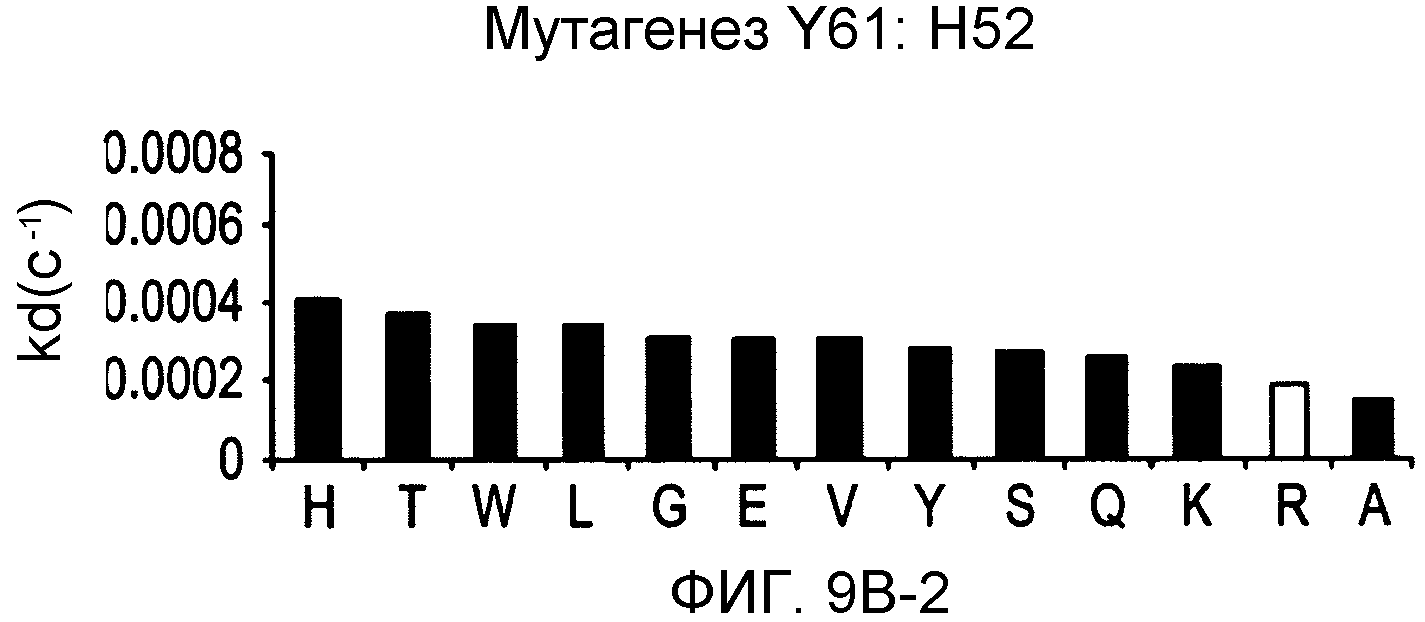
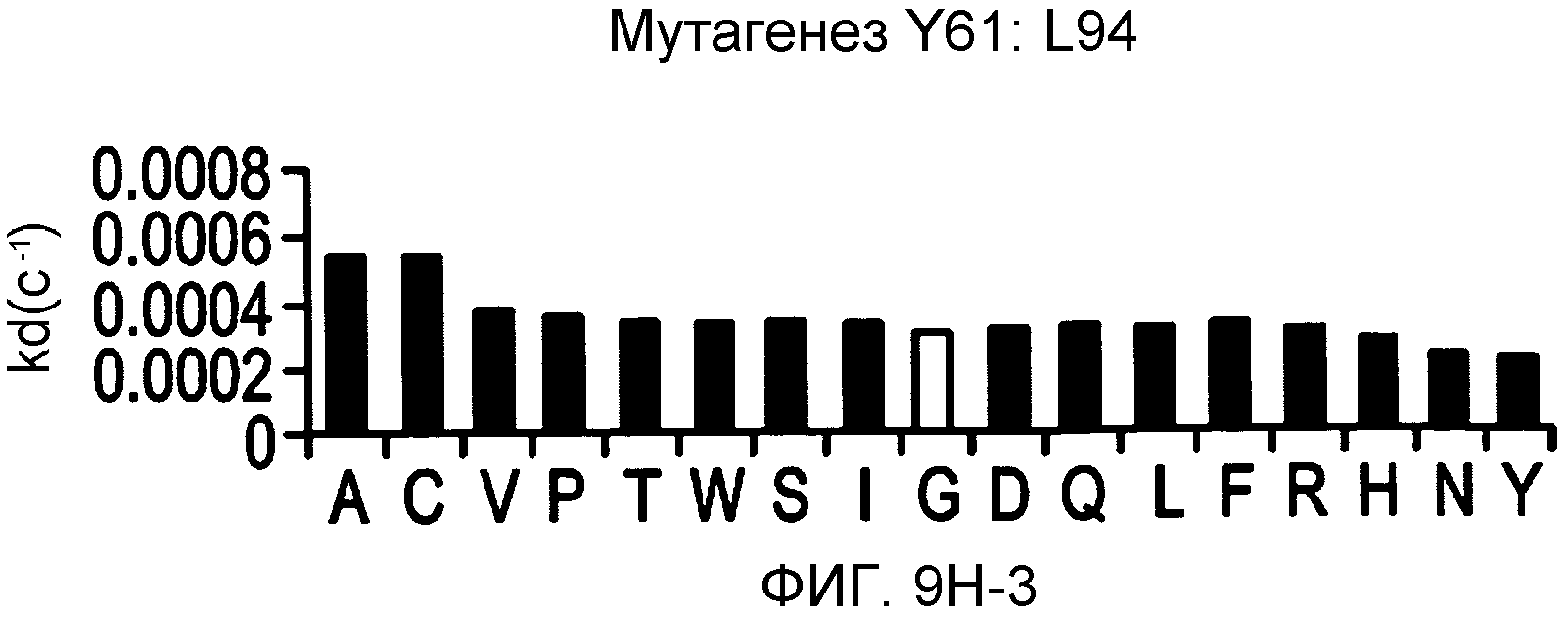
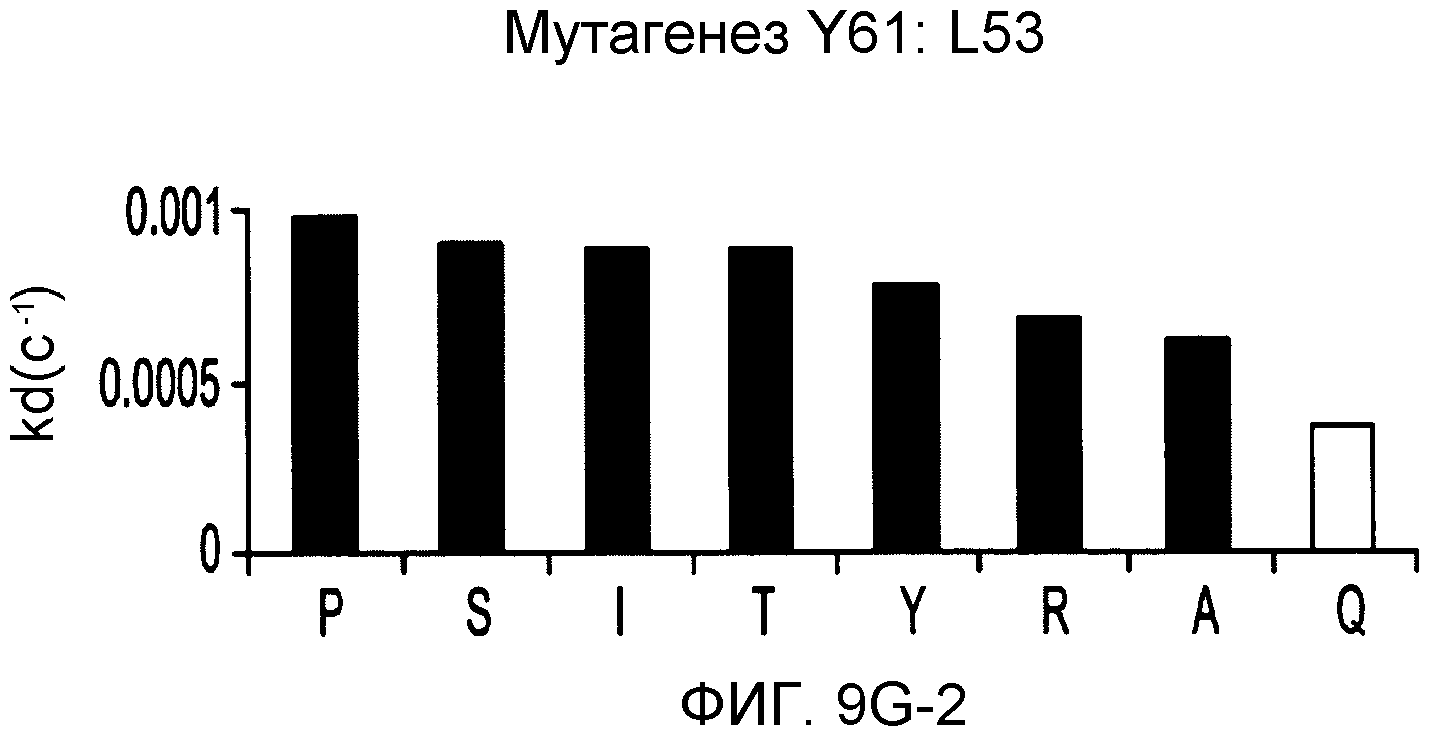
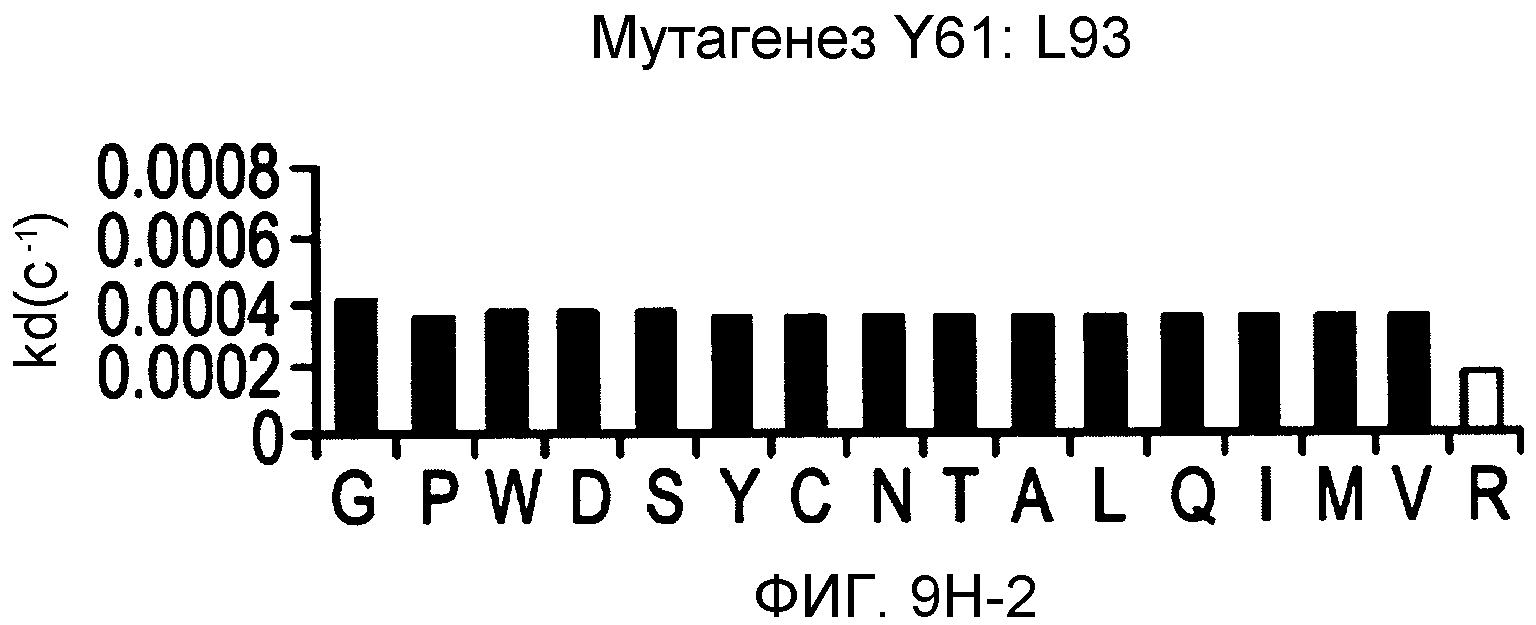
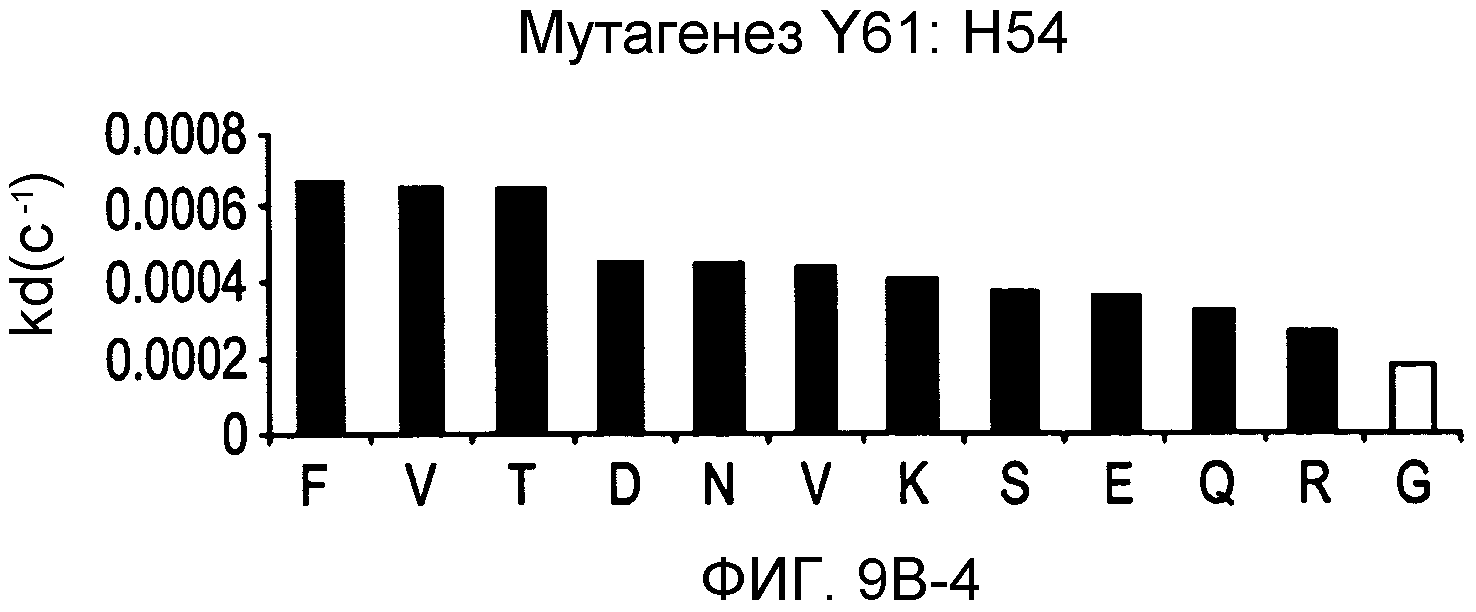
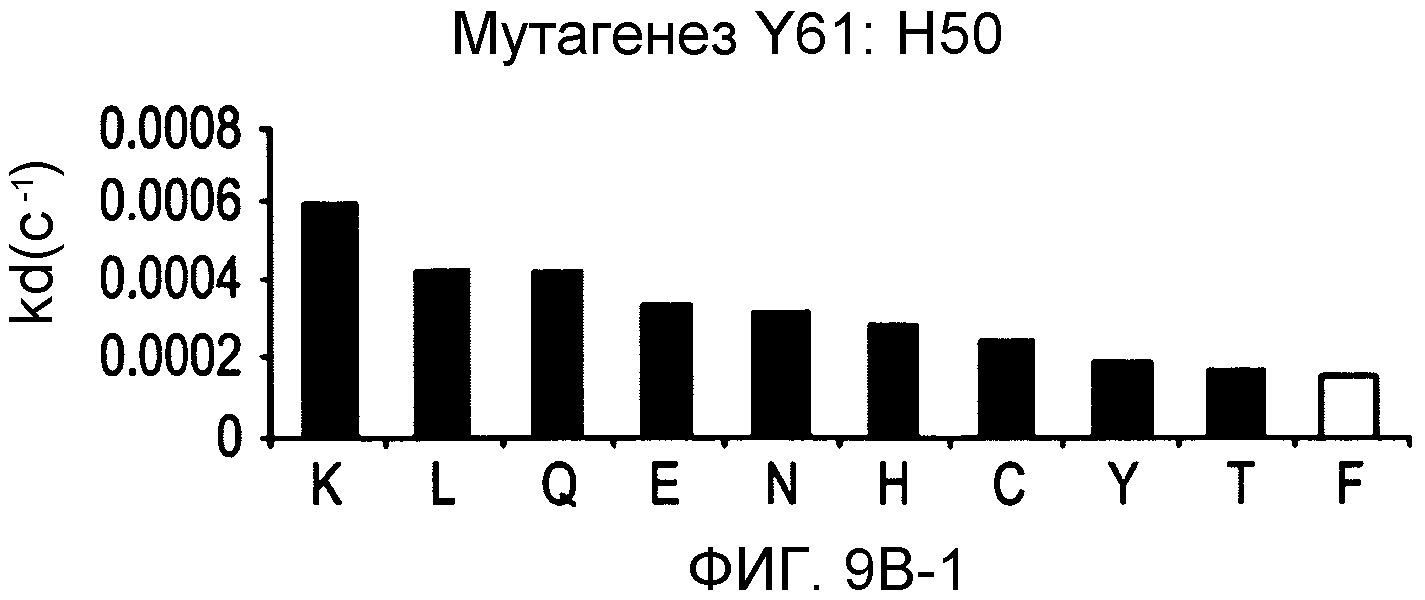
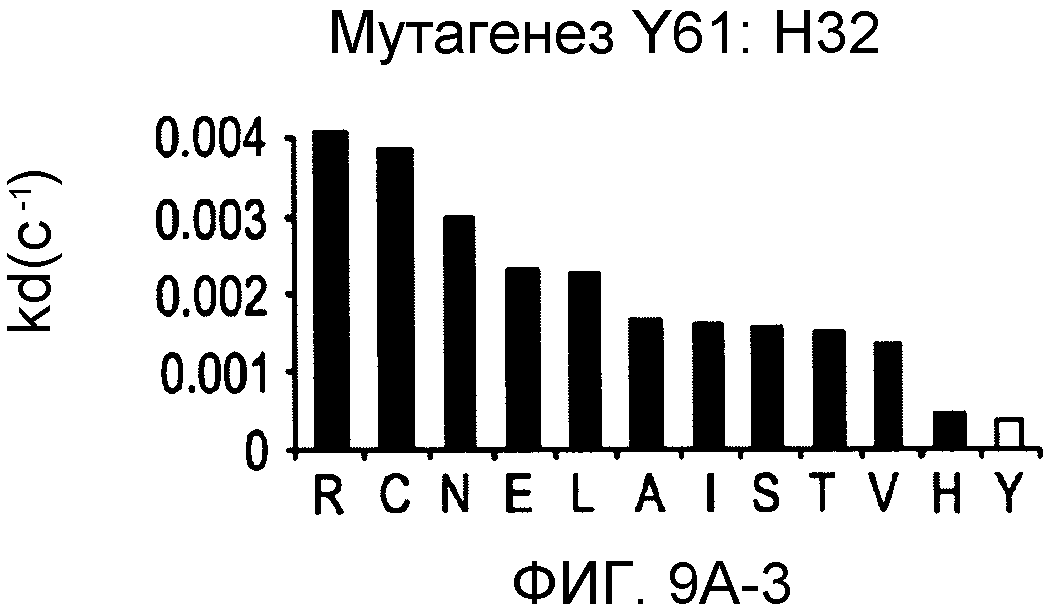
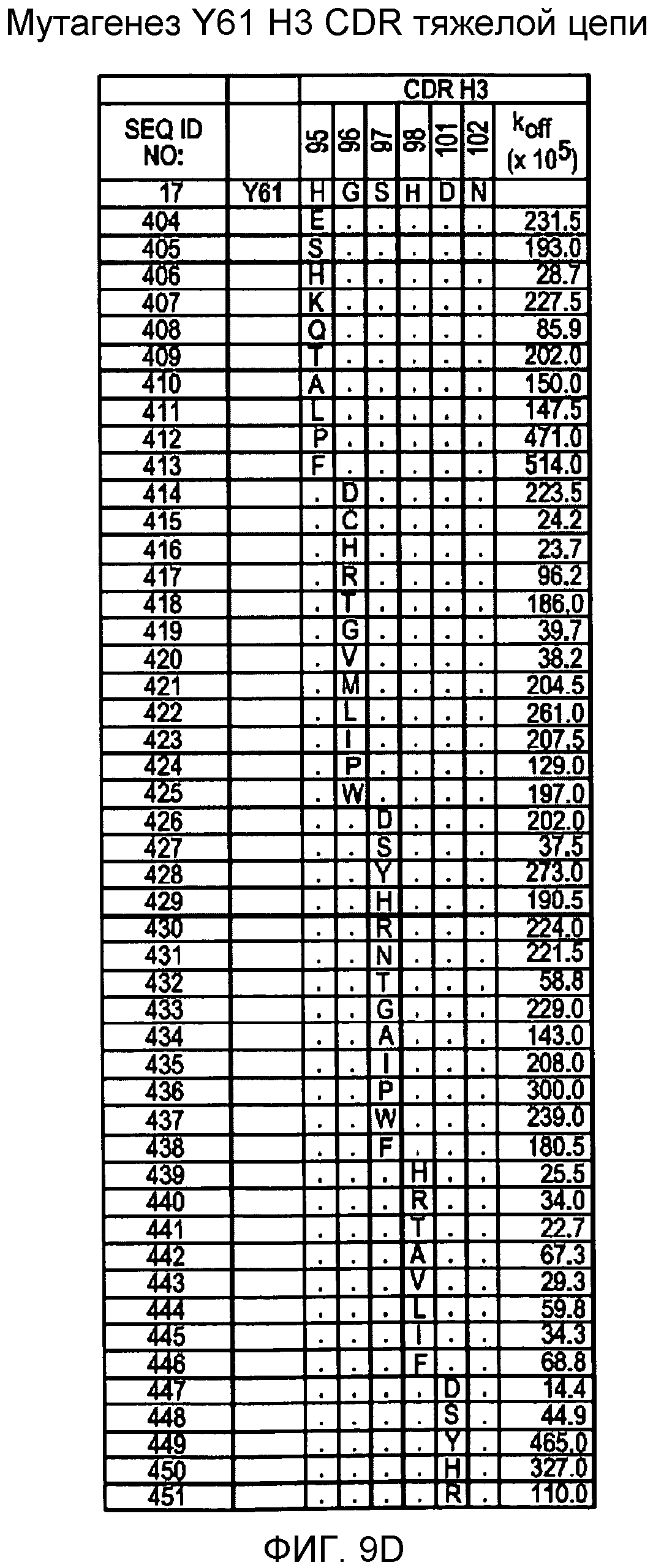
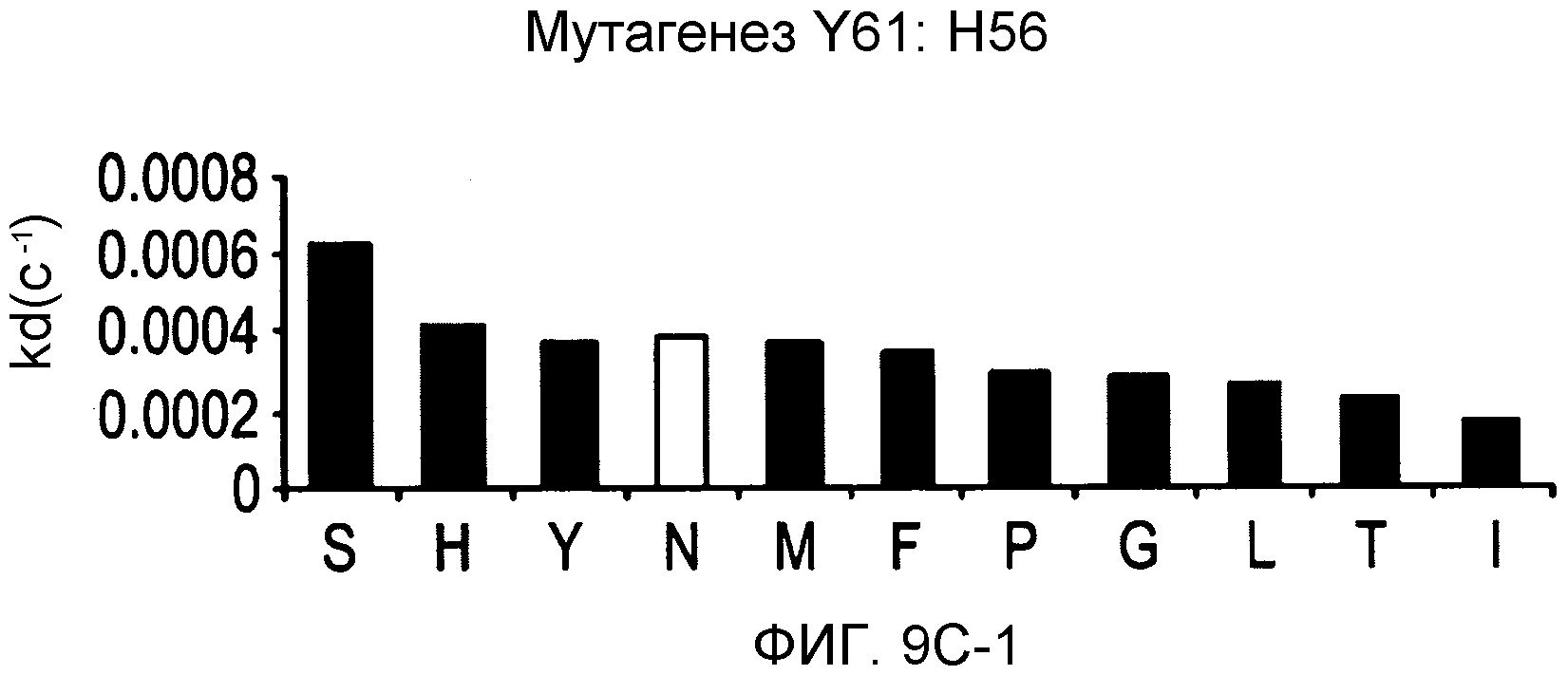
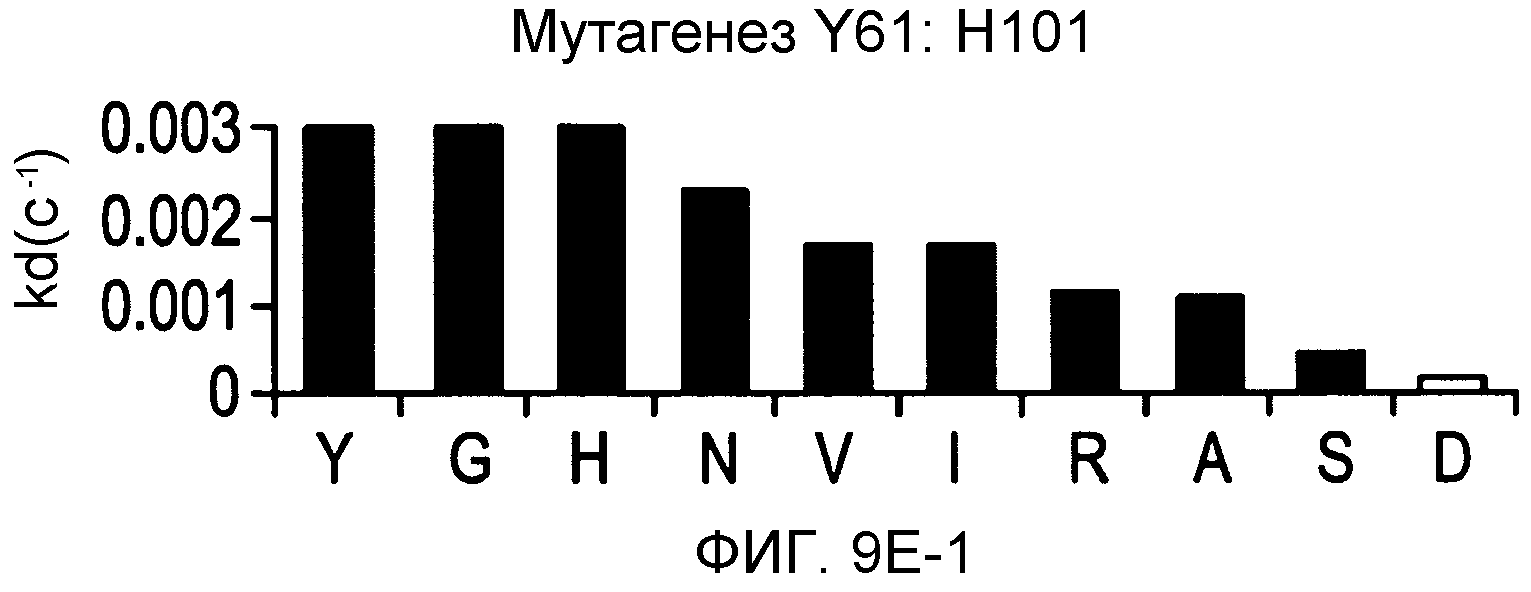
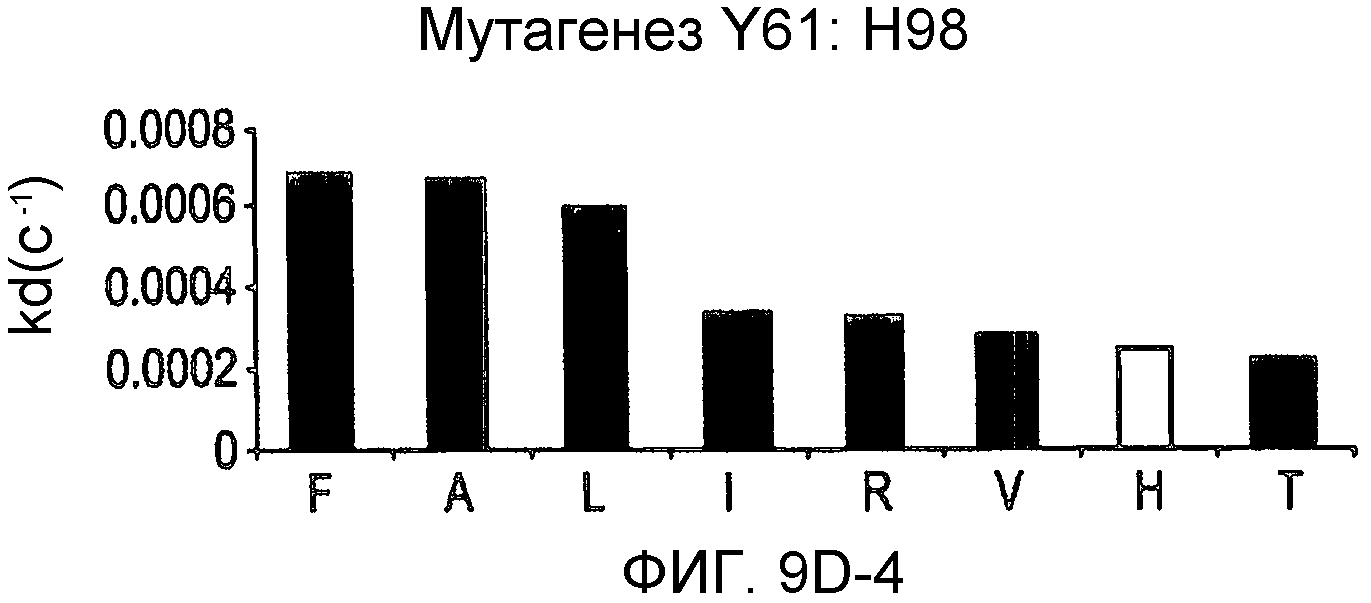
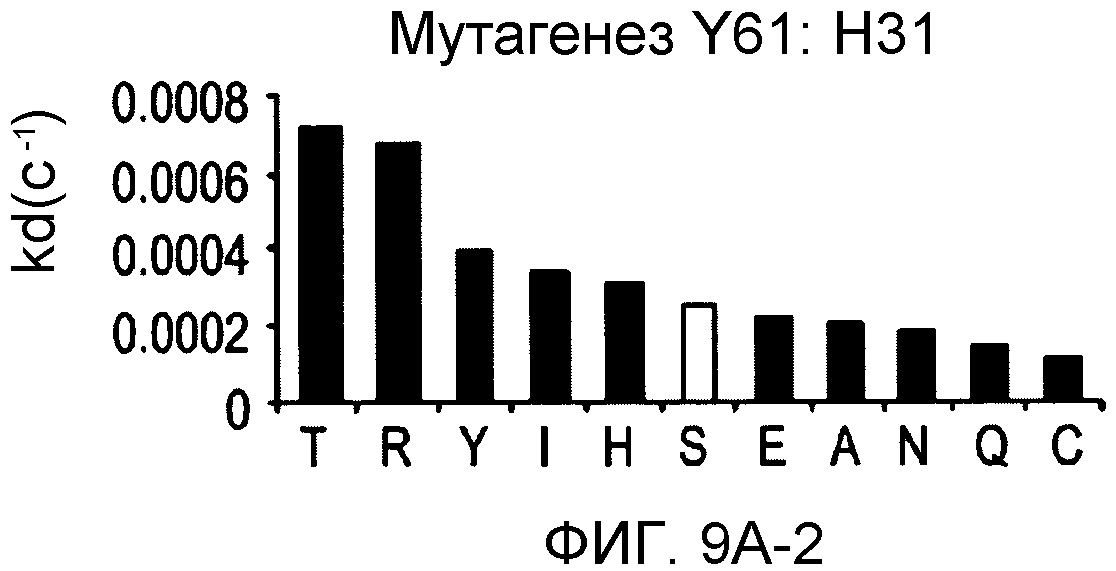
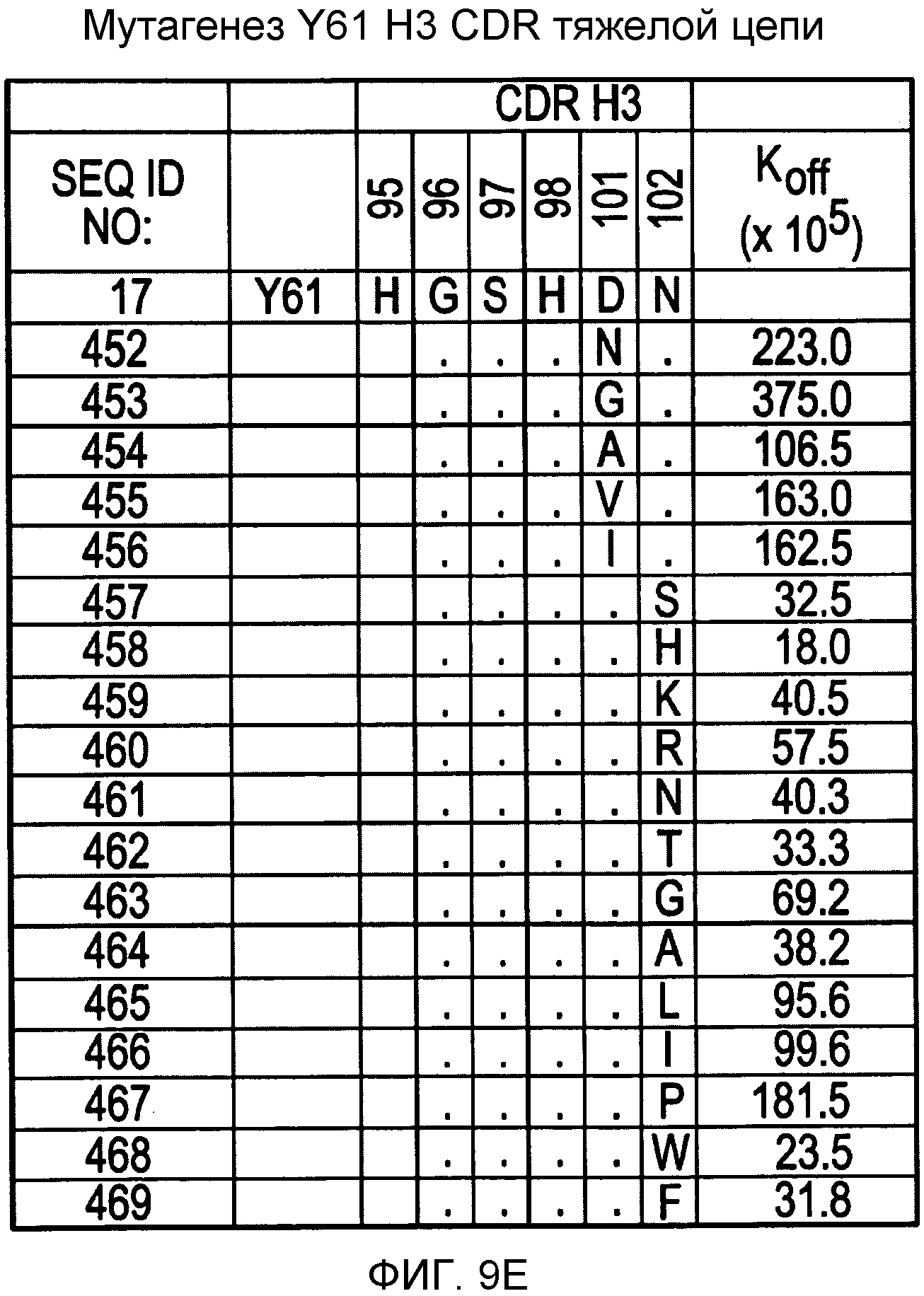
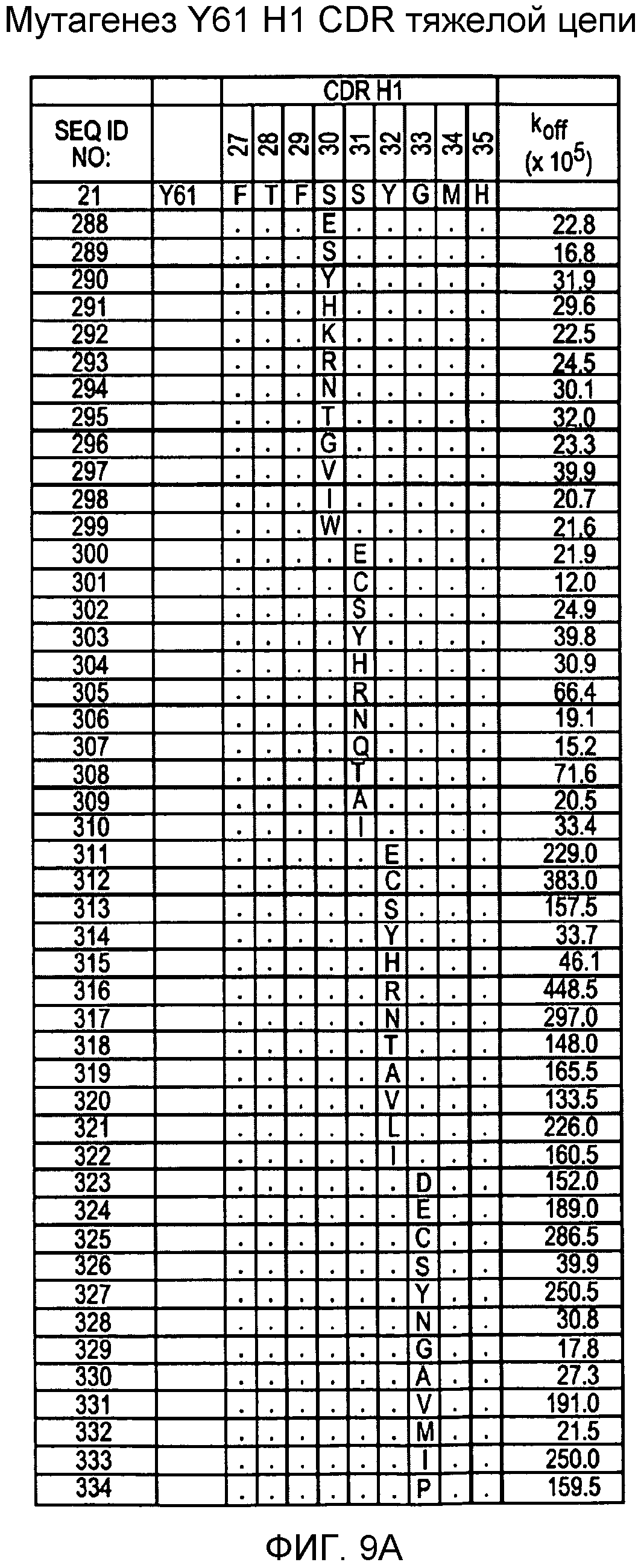
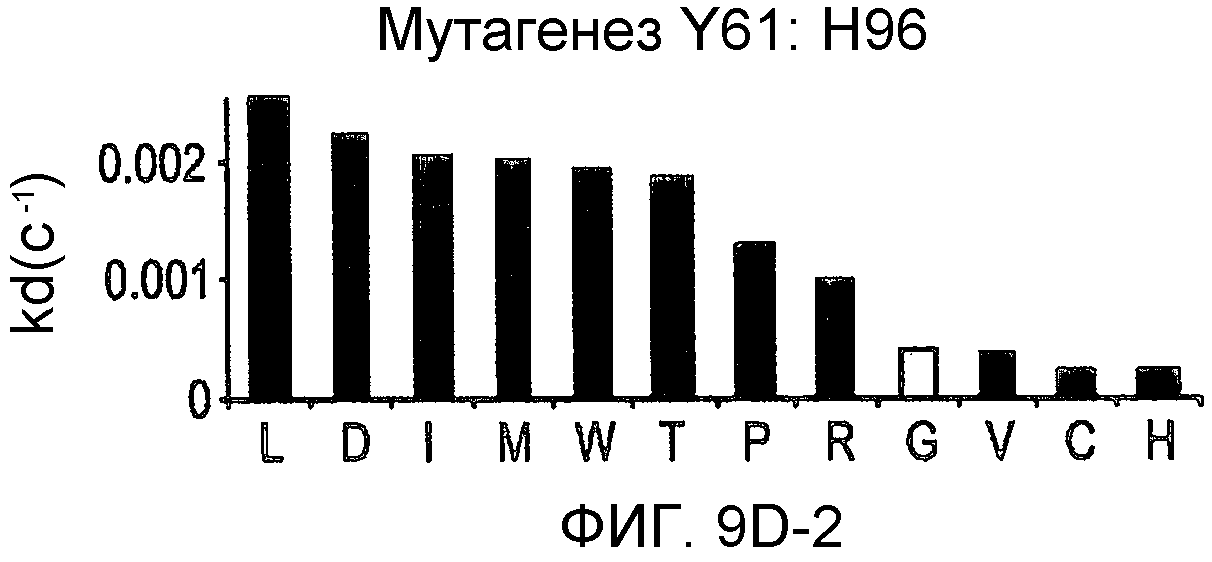
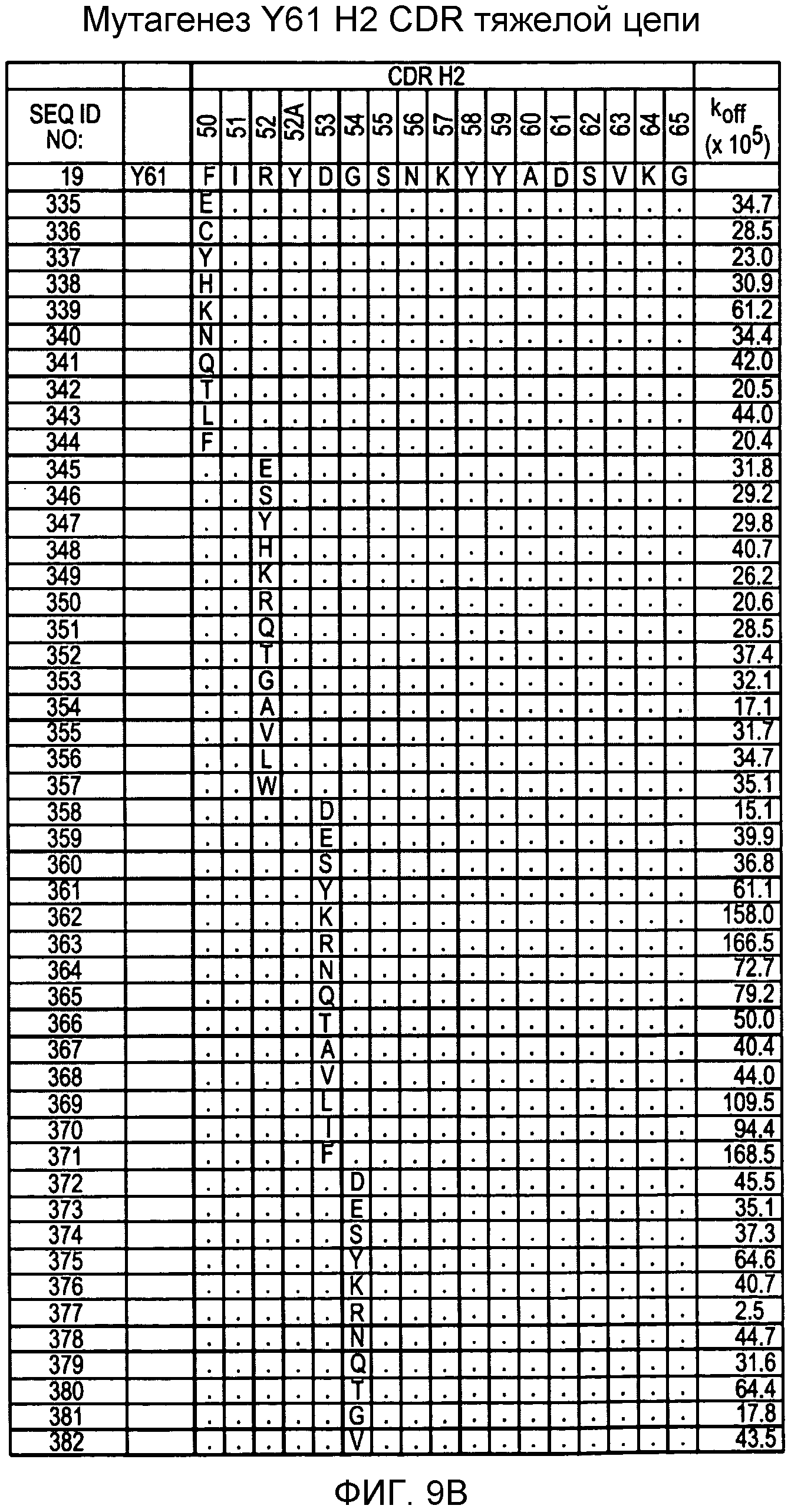
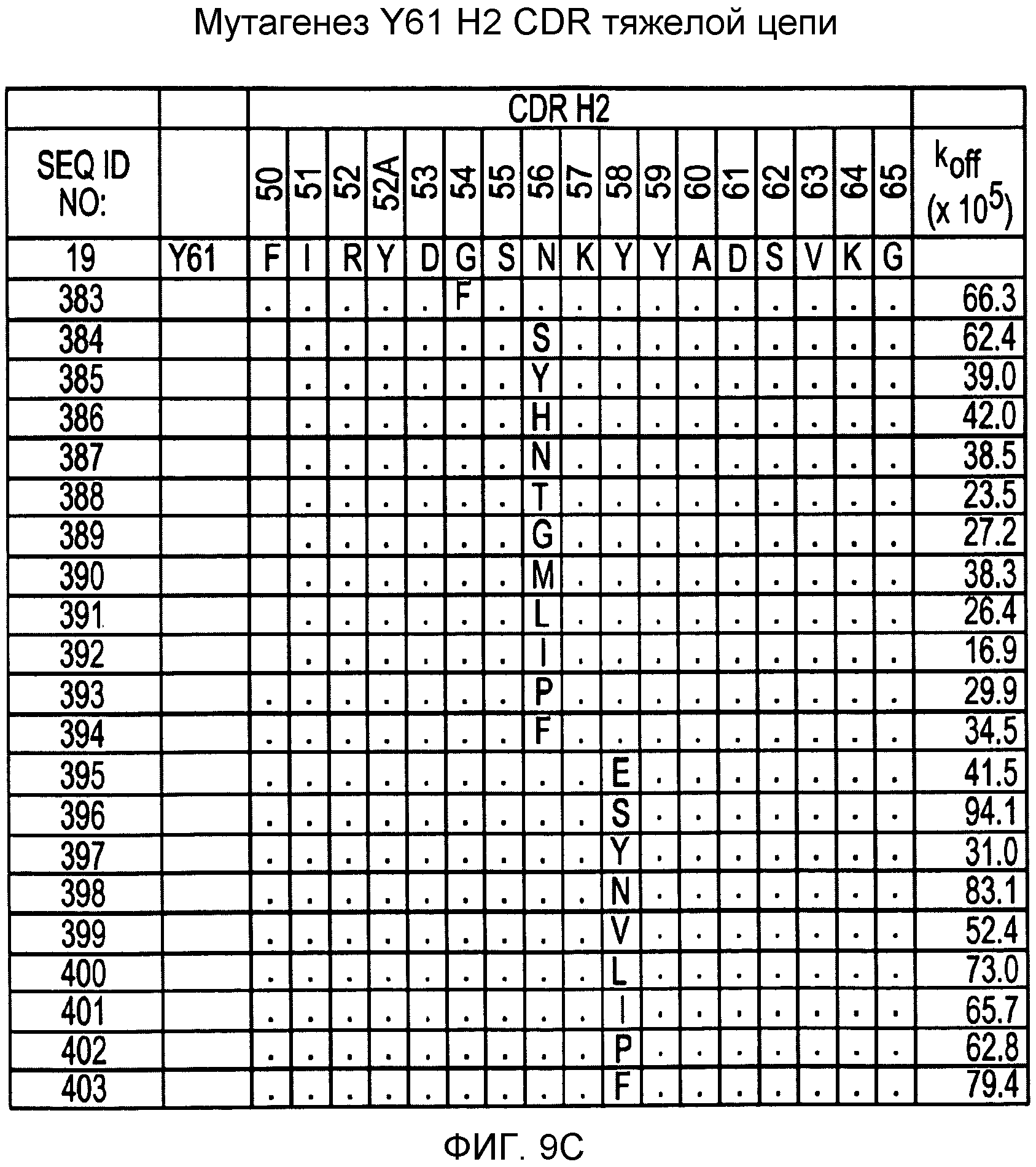
На фигурах 9A-9E показаны положения CDR в тяжелой цепи антитела Y61, которые были подвергнуты мутации сайт-направленным мутагенезом, и соответствующие аминокислотные замены в каждом положении. На графике в правой части фигур представлены скорости диссоциации для антител с заменами (черный столбец) по сравнению с немутантным Y61 (не закрашенный столбец).
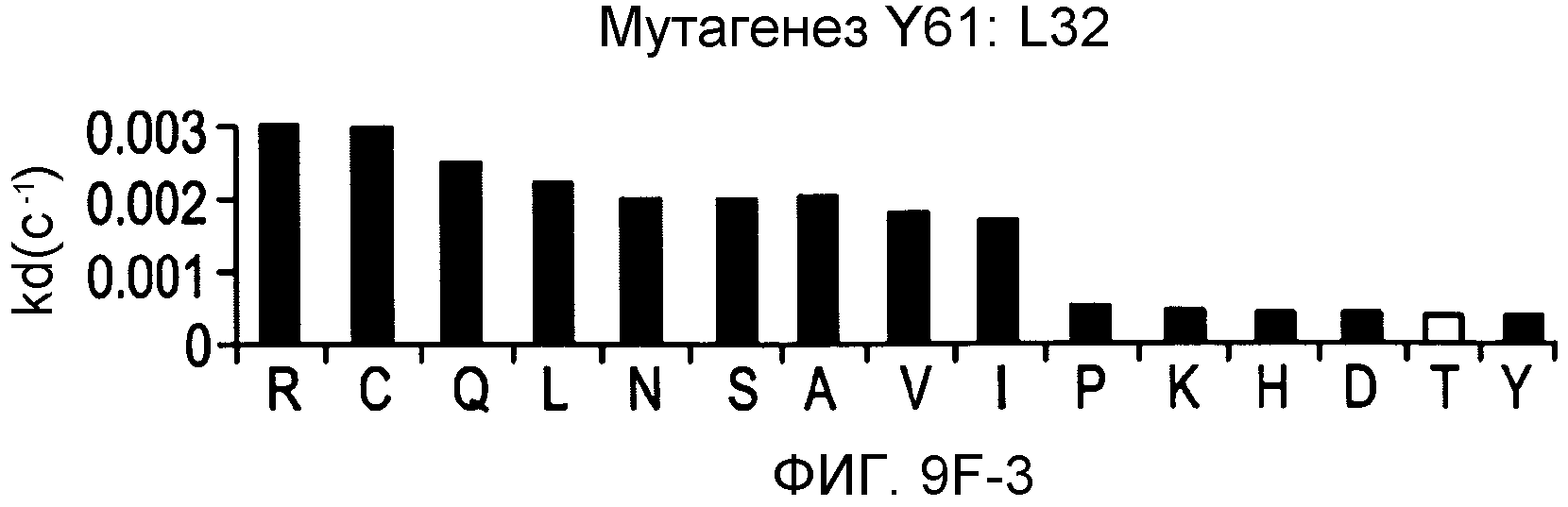
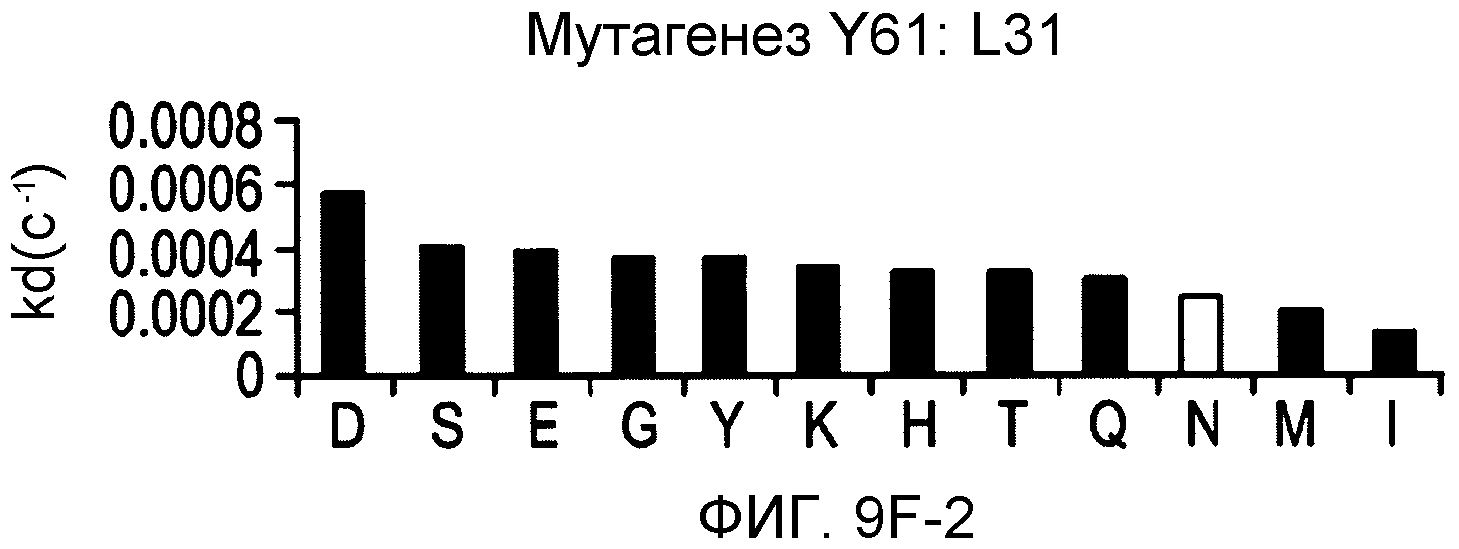
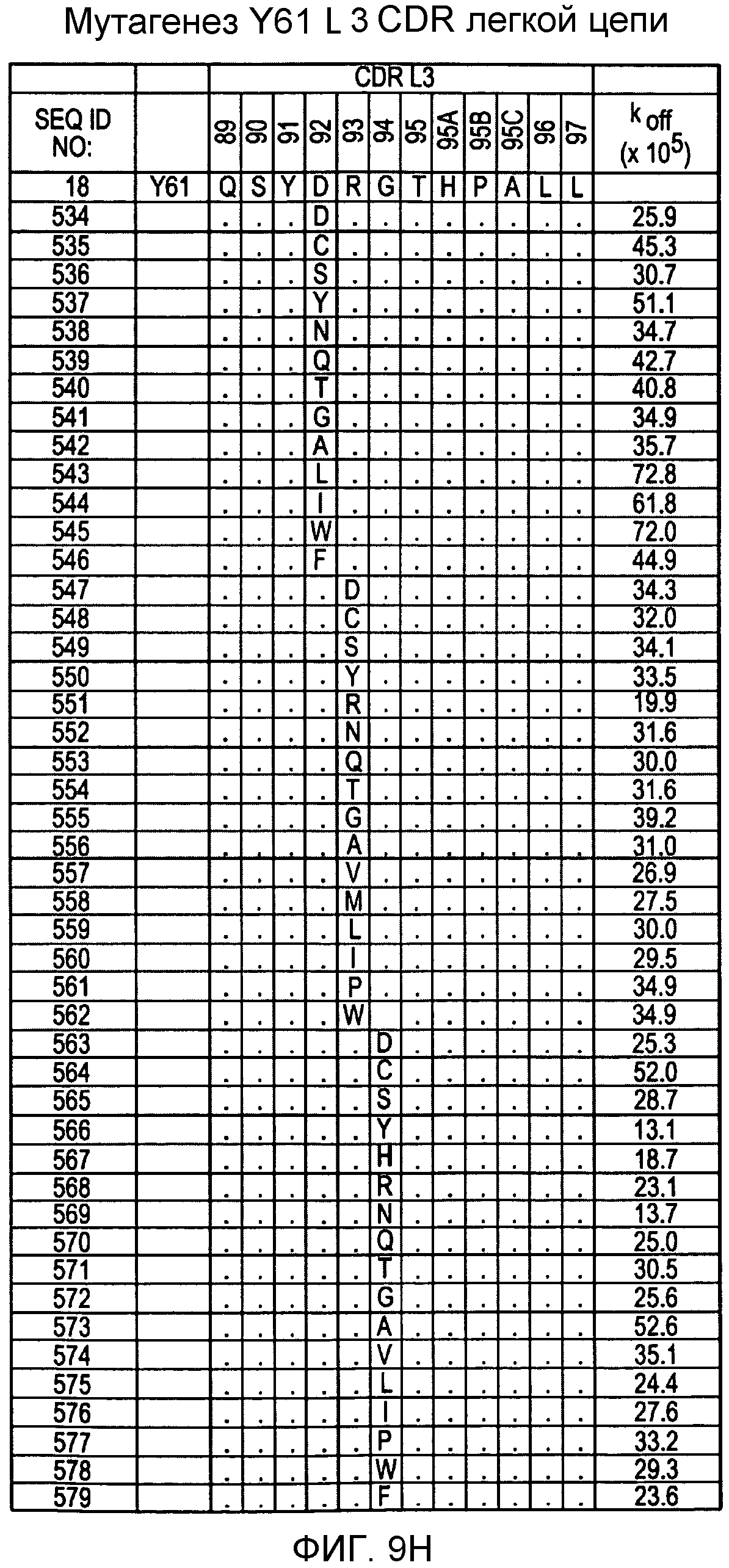
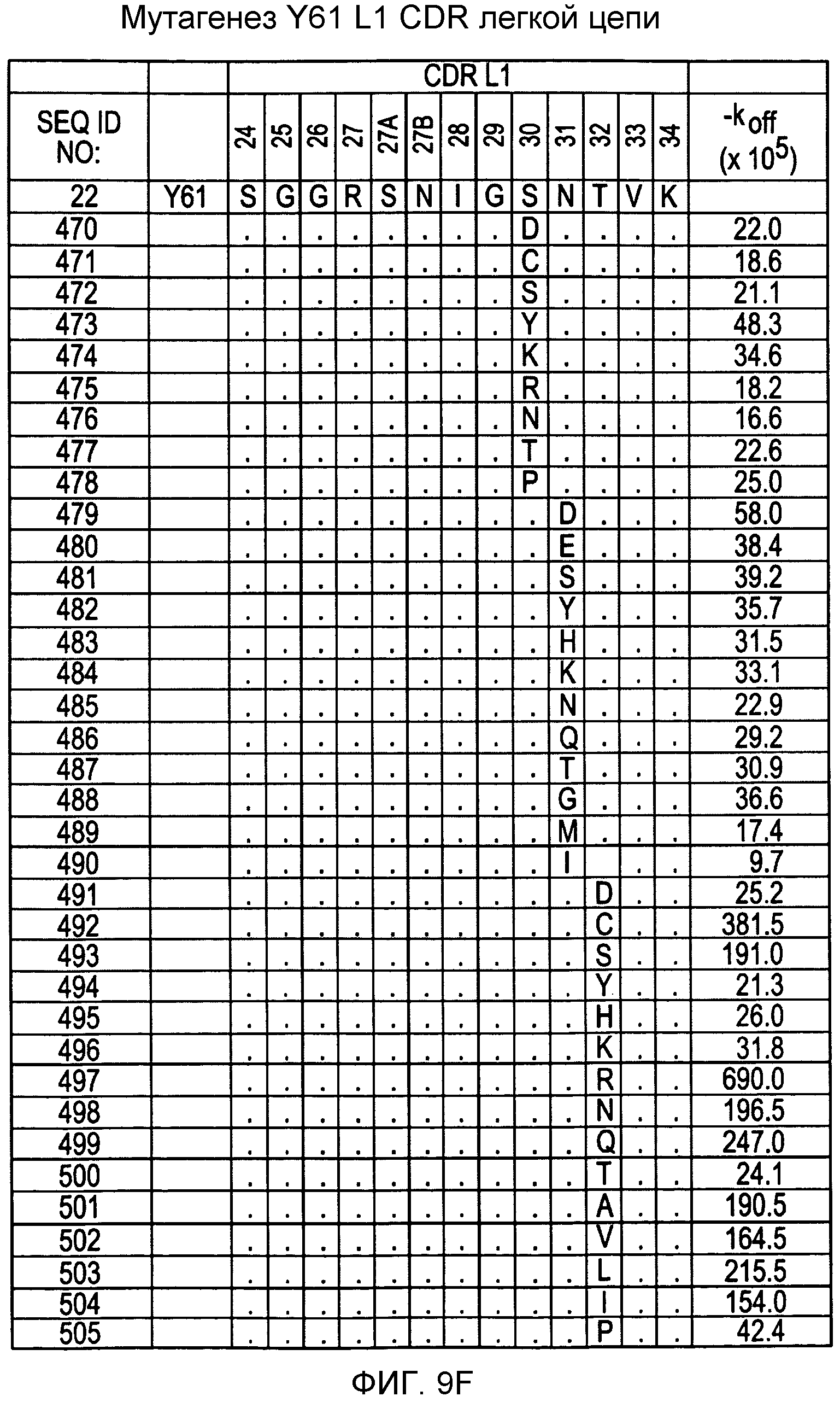
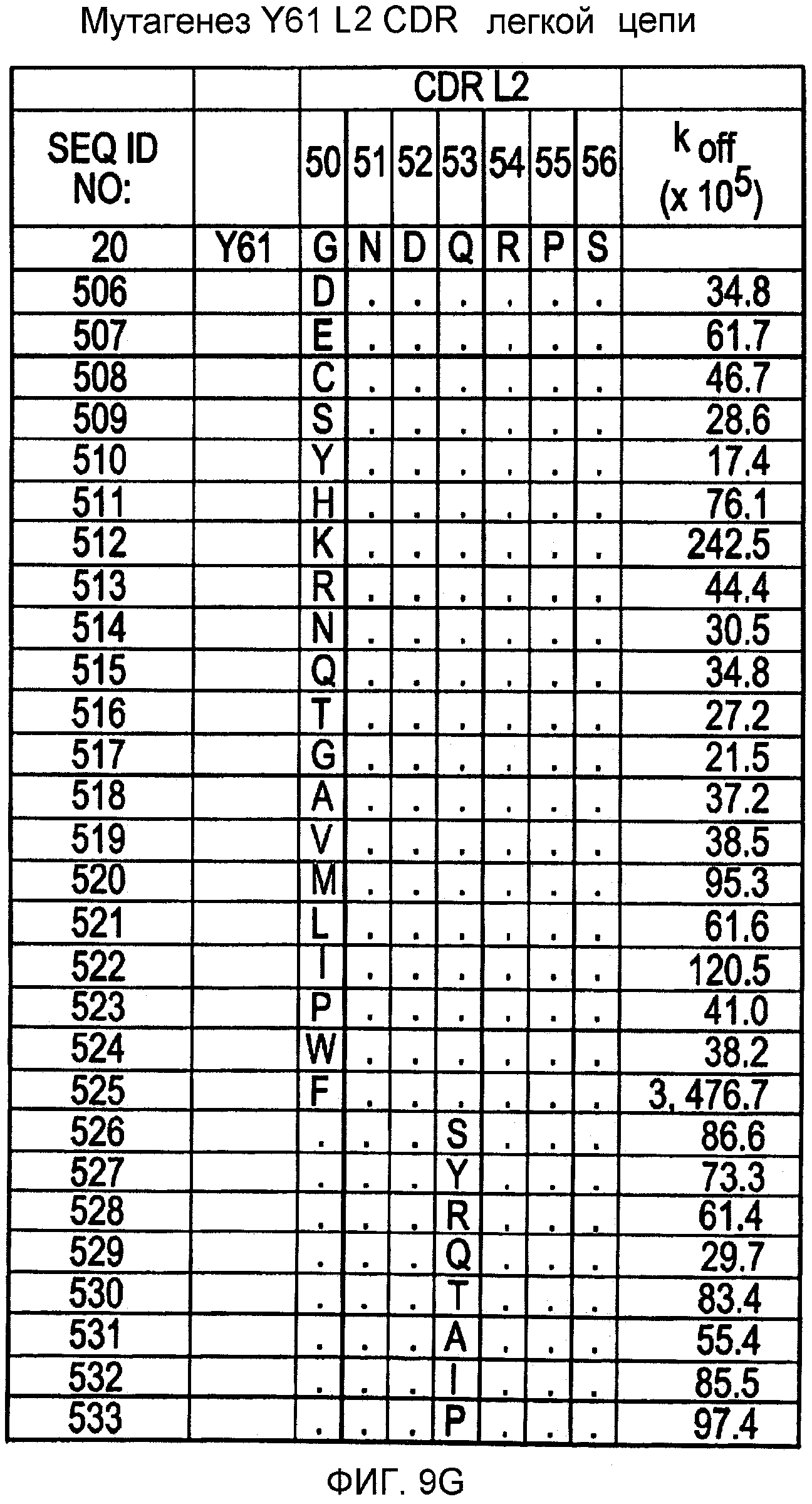
На фигурах 9F-9H показаны положения CDR в легкой цепи антитела Y61, которые были подвергнуты мутации сайт-направленным мутагенезом, и соответствующие аминокислотные замены в каждом положении. На графике в правой части фигур представлены скорости диссоциации для антител с заменами (черный столбец) по сравнению с немутантным Y61 (не закрашенный столбец).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для того чтобы настоящее изобретение было более понятным, сначала определены некоторые термины.
Термин "усиливающий активность аминокислотный остаток" включает аминокислотный остаток, который повышает активность антитела. Следует понимать, что усиливающий активность аминокислотный остаток может заменять аминокислотный остаток в положении контакта, положении гипермутации или предпочтительном положении для селективного мутагенеза, и, кроме того, в одной или нескольких CDR может присутствовать более одного усиливающего активность аминокислотного остатка. Усиливающий активность аминокислотный остаток включает аминокислотный остаток, который повышает специфичность/аффинность связывания антитела, например, связывания антитела против IL-12 человека с IL-12 человека. Усиливающий активность аминокислотный остаток также включает аминокислотный остаток, который повышает нейтрализующую эффективность антитела, например, антитела против IL-12 человека, которое ингибирует IL-12 человека.
Термин "антитело" включает молекулу иммуноглобулина, содержащую четыре полипептидных цепи: две тяжелых (H) цепи и две легких (L) цепи, соединенных между собой дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно обозначаемую в настоящем документе как HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена: CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно обозначаемую в настоящем документе как LCVR или VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен, CL. VH- и VL-области можно дополнительно подразделить на области гипервариабельности, называемые определяющими комплементарность областями (CDR), между которыми вставлены области, называемые каркасными областями (FR), которые являются более консервативными. Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. В одном варианте осуществления антитело, используемое в композициях и способах по изобретению, представляет собой антитело, описанное в патенте США № 6914128, включенном в настоящий документ в качестве ссылки. В другом варианте осуществления антитело, используемое в композициях и способах по изобретению, представляет собой антитело ABT-874 (также называемое J695; Abbott Laboratories).
Термин "антигенсвязывающая часть" антитела (или "часть антитела") включает фрагменты антитела, которые сохраняют способность специфично связываться с антигеном (например, hIL-12). Показано, что антигенсвязывающую функцию антитела могут выполнять фрагменты полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином "антигенсвязывающая часть" антитела, включают (i) Fab-фрагмент, одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), который состоит из VH-домена; и (vi) выделенную определяющую комплементарность область (CDR). Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, их можно соединять с использованием рекомбинантных способов, синтетическим линкером, который обеспечивает их продукцию в качестве единой белковой цепи, в которой VL- и VH-области составляют пару с образованием одновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также включены в термин "антигенсвязывающая часть" антитела. Также он включает другие формы одноцепочечных антител, такие как димерные антитела. Димерные антитела представляют собой двухвалентные биспецифические антитела, в которых VH- и VL-домены экспрессируются на одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы позволить образование пары между двумя доменами на одной цепи, таким образом, вынуждая домены образовывать пару с комплементарными доменами другой цепи и создавать два антигенсвязывающих участка (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak, R.J., et al. (1994) Structure 2:1121-1123). Кроме того, антитело или его антигенсвязывающая часть могут быть частью более крупных молекул иммуноадгезии, образованных ковалентным или нековалентным присоединением антитела или части антитела к одному или нескольким другим белкам или пептидам. Примеры таких молекул иммуноадгезии включают использование центральной области стрептавидина для создания тетрамерной молекулы scFv (Kipriyanov, S.M., et al. (1995) Human Antibodies and Hybridomas 6:93-101) и использование остатка цистеина, маркерного пептида и C-концевой полигистидиновой метки для получения двухвалентных и биотинилированных молекул scFv (Kipriyanov, S.M., et al. (1994) Mol. Immunol. 31:1047-1058). Части антител, такие как Fab- и F(ab')2-фрагменты, могут быть получены из целых антител с использованием общепринятых способов, таких как расщепление папаином или пепсином, соответственно, целых антител. Более того, антитела, части антител и молекулы иммуноадгезии могут быть получены с использованием стандартных способов рекомбинантных ДНК, как описано в настоящем документе. Предпочтительные антигенсвязывающие части представляют собой полные домены или пары полных доменов.
Термин "обратная мутация" относится к процессу, в котором некоторые или все из подвергнутых соматической мутации аминокислот антитела человека заменяют соответствующими эмбриональными остатками из гомологичной эмбриональной последовательности антитела. Последовательности тяжелой и легкой цепи антитела человека по изобретению выравнивают по отдельности с эмбриональными последовательностями в базе данных VBASE для идентификации последовательностей с наиболее высокой гомологией. Отличия в антителе человека по изобретению возвращают к эмбриональной последовательности путем мутации определенных нуклеотидных положений, кодирующих такие отличающиеся аминокислоты. Роль каждой аминокислоты, идентифицированной таким образом в качестве кандидата для обратной мутации, должна быть исследована в отношении прямой или косвенной роли в связывании антигена, и любая аминокислота, выявленная после мутации как влияющая на какое-либо желаемое свойство антитела человека, не должна быть включена в конечное антитело человека; в качестве примера, усиливающие активность аминокислоты, идентифицированные с использованием подхода селективного мутагенеза, не подвергают обратной мутации. Для минимизации числа аминокислот, подвергаемых обратной мутации, аминокислотные положения, отличающиеся от наиболее близкой эмбриональной последовательности, но идентичные соответствующей аминокислоте во второй эмбриональной последовательности, можно оставить, при условии, что вторая эмбриональная последовательность идентична и коллинеарна последовательности антитела человека по изобретению на протяжении по меньшей мере 10, предпочтительно 12 аминокислот, с обеих сторон от рассматриваемой аминокислоты. Обратную мутацию можно проводить на любой стадии оптимизации антитела; предпочтительно, обратную мутацию проводят непосредственно до или после подхода селективного мутагенеза. Более предпочтительно, обратную мутацию проводят непосредственно до подхода селективного мутагенеза.
Выражение "интерлейкин 12 человека" (сокращенно обозначается в настоящем документе hIL-12 или IL-12), как используют в настоящем документе, включает цитокин человека, который секретируется, главным образом, макрофагами и дендритными клетками. Этот термин включает гетеродимерный белок, содержащий субъединицу массой 35 кДа (p35) и субъединицу массой 40 кДа (p40), обе из которых связаны дисульфидным мостиком. Гетеродимерный белок обозначают как "субъединица p70". Структура IL-12 человека дополнительно описана, например, в публикациях Kobayashi, et al. (1989) J. Exp Med. 170:827-845; Seder, et al. (1993) Proc. Natl. Acad. Sci. 90:10188-10192; Ling, et al. (1995) J. Exp Med. 154:116-127; Podlaski, et al. (1992) Arch. Biochem. Biophys. 294:230-237. Термин IL-12 человека включает рекомбинантный IL-12 человека (rh IL-12), который может быть получен стандартными способами рекомбинантной экспрессии.
Термины "нумерация по Kabat", "определения по Kabat" и "обозначение по Kabat" используют в настоящем документе взаимозаменяемо. Эти термины, которые являются общепринятыми в данной области, относятся к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е. гипервариабельными), чем другие аминокислотные остатки в вариабельных областях тяжелой и легкой цепи антитела или его антигенсвязывающей части (Kabat et al. (1971) Ann. NY Acad, Sci. 190:382-391 и Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Для вариабельной области тяжелой цепи, гипервариабельная область находится в диапазоне аминокислотных положений от 31 до 35 для CDR1, аминокислотных положений от 50 до 65 для CDR2 и аминокислотных положений от 95 до 102 для CDR3. Для вариабельной области легкой цепи, гипервариабельная область находится в диапазоне аминокислотных положений от 24 до 34 для CDR1, аминокислотных положений от 50 до 56 для CDR2 и аминокислотных положений от 89 до 97 для CDR3.
Нумерацию по Kabat используют в настоящем документе для указания на положения модификаций аминокислот в антителах по изобретению. Например, в антителе против IL-12 Y61 серин (S) может быть заменен глутаминовой кислотой (E) в положении 31 CDR1 тяжелой цепи (H31S→E), или глицин (G) может быть заменен тирозином (Y) в положении 94 CDR3 легкой цепи (L94G→Y).
Термин "антитело человека" включает антитела, имеющие вариабельные и константные области, соответствующие эмбриональным последовательностям иммуноглобулинов человека, как описано Kabat et al. (См. Kabat, et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Антитела человека по изобретению могут включать аминокислотные остатки, не кодируемые эмбриональными последовательностями иммуноглобулинов человека (например, вследствие мутаций, внесенных случайным или сайт-специфическим мутагенезом in vitro, или вследствие соматической мутации in vivo), например, в CDR, и в частности, в CDR3. Мутации предпочтительно вносят с использованием "подхода селективного мутагенеза", описанного в настоящем документе. Антитело человека может иметь по меньшей мере одно положение, замененное аминокислотным остатком, например, усиливающим активность аминокислотным остатком, который не кодируется эмбриональной последовательностью иммуноглобулина человека. Антитело человека может иметь вплоть до двадцати положений, замененных аминокислотными остатками, которые не являются частью эмбриональной последовательности иммуноглобулина человека. В других вариантах осуществления заменены вплоть до десяти, вплоть до пяти, вплоть до трех или вплоть до двух положений. В предпочтительном варианте осуществления эти замены находятся в областях CDR, как подробно описано ниже. Однако термин "антитело человека", как используют в настоящем документе, не включает антитела, в которых последовательности CDR эмбрионального типа или полученные от других видов млекопитающих, таких как мышь, пересажены в последовательности каркасной области человека.
Выражение "рекомбинантное антитело человека" включает антитела человека, которые получены, экспрессированы, созданы или выделены рекомбинантными способами, такие как антитела, экспрессированные с использованием рекомбинантного экспрессирующего вектора, трансфицированного в клетку-хозяина (как дополнительно описано в разделе II, ниже), антитела, выделенные из рекомбинантной комбинаторной библиотеки антител человека (как дополнительно описано в разделе III, ниже), антитела, выделенные у животного (например, мыши), которое является трансгенным по генам иммуноглобулинов человека (см., например, Taylor, L.D., et al. (1992) Nucl. Acids Res. 20:6287-6295), или антитела, полученные, экспрессированные, созданные или выделенные любыми другими способами, которые вовлекают сплайсинг последовательностей генов иммуноглобулинов человека с другими последовательностями ДНК. Такие рекомбинантные антитела человека имеют вариабельные и константные области из эмбриональных последовательностей иммуноглобулинов человека (см. Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Однако в определенных вариантах осуществления такие рекомбинантные антитела человека подвергают мутагенезу in vitro (или, когда используют животное, трансгенное по последовательностям Ig человека, соматическому мутагенезу in vivo) и, таким образом, аминокислотные последовательности VH- и VL-областей рекомбинантных антител представляют собой последовательности, которые, хотя и происходят от эмбриональных последовательностей VH и VL человека и сходны с ними, могут не существовать в природе в наборе эмбриональных антител человека in vivo. Однако в определенных вариантах осуществления такие рекомбинантные антитела являются результатом подхода селективного мутагенеза или обратной мутации, или и того и другого.
"Выделенное антитело" включает антитело, которое по существу не содержит других антител, имеющих другую антигенную специфичность (например, выделенное антитело, которое специфично связывает hIL-12, по существу не содержит антител, которые специфично связывают антигены, отличные от hIL-12). Выделенное антитело, которое специфично связывает hIL-12, может связывать молекулы IL-12 других видов (более подробно рассмотрено ниже). Более того, выделенное антитело может по существу не содержать другого клеточного материала и/или химических веществ.
"Нейтрализующее антитело" (или "антитело, которое нейтрализует активность hIL-12") включает антитело, связывание которого с hIL-12 приводит к ингибированию биологической активности hIL-12. Это ингибирование биологической активности hIL-12 можно оценивать путем измерения одного или нескольких признаков биологической активности hIL-12, таких как ингибирование пролиферации бластных клеток человека при стимуляции фитогемагглютинином в анализе пролиферации бластных клеток при стимуляции фитогемагглютинином (PHA), или ингибирование связывания рецептора в анализе связывания рецептора с IL-12 человека (см. пример 3: Interferon-gamma Induction Assay в патенте США № 6914128). Эти признаки биологической активности hIL-12 можно оценивать одним или несколькими стандартными анализами in vitro или in vivo, известными в данной области (см. пример 3 патента США № 6914128).
Термин "активность" включает виды активности, такие как специфичность/аффинность связывания антитела с антигеном, например, антитела против hIL-12, которое связывается с антигеном IL-12, и/или нейтрализующая активность антитела, например, антитела против hIL-12, связывание которого с hIL-12 ингибирует биологическую активность hIL-12, например, ингибирование пролиферации бластных клеток при стимуляции PHA или ингибирование связывания рецептора в анализе связывания рецептора с IL-12 человека (см. пример 3 патента США № 6914128).
Выражение "поверхностный плазмонный резонанс" включает оптическое явление, которое позволяет проводить анализ биоспецифичных взаимодействий в реальном времени путем детекции изменений концентраций белка в биосенсорной матрице, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, NJ). Для более подробного описания см. пример 5 патента США № 6914128 и Jönsson, U., et al. (1993) Ann. Biol. Clin. 51:19-26; Jönsson, U., et al. (1991) Biotechniques 11:620-627; Johnsson, B., et al. (1995) J. Mol. Recognit. 8:125-131; и Johnnson, B., et al. (1991) Anal. Biochem. 198:268-277.
Термин "Koff", как используют в настоящем документе, относится к константе скорости диссоциации антитела из комплекса антитело/антиген.
Термин "Kd", как используют в настоящем документе, относится к константе диссоциации для конкретного взаимодействия антитело-антиген.
Выражение "молекула нуклеиновой кислоты" включает молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, однако предпочтительно она представляет собой двухцепочечную ДНК.
Выражение "выделенная молекула нуклеиновой кислоты", как используют в настоящем документе в отношении нуклеиновых кислот, кодирующих антитела или части антител (например, VH, VL, CDR3), которые связывают hIL-12, включая "выделенные антитела"), включает молекулу нуклеиновой кислоты, в которой нуклеотидные последовательности, кодирующие антитело или часть антитела, не содержат других нуклеотидных последовательностей, кодирующих антитела или части антител, которые связывают антигены, отличные от hIL-12, причем эти другие последовательности могут в природе фланкировать нуклеиновую кислоту в геномной ДНК человека. Таким образом, например, выделенная нуклеиновая кислота по изобретению, кодирующая VH-область антитела против IL-12, не содержит других последовательностей, кодирующих другие VH-области, которые связывают антигены, отличные от IL-12. Выражение "выделенная молекула нуклеиновой кислоты" также включает последовательности, кодирующие двухвалентные биспецифические антитела, такие как димерные антитела, в которых VH- и VL-области не содержат других последовательностей, отличных от последовательностей димерного антитела.
Термин "вектор" включает молекулу нуклеиновой кислоты, способную транспортировать другую нуклеиновую кислоту, с которой она связана. Одним из типов вектора является "плазмида", которая относится к замкнутой двухцепочечной петле ДНК, в которую могут быть лигированы дополнительные сегменты ДНК. Другим типом вектора является вирусный вектор, где в вирусный геном могут быть лигированы дополнительные сегменты ДНК. Определенные векторы способны к автономной репликации в клетке-хозяине, в которую они встроены (например, бактериальные векторы, имеющие бактериальный ориджин репликации, и эписомальные векторы млекопитающих). Другие векторы (например, неэписомальные векторы млекопитающих) могут встраиваться в геном клетки-хозяина при введении в клетку-хозяина, и, таким образом, они реплицируются вместе с геномом хозяина. Более того, определенные векторы способны контролировать экспрессию генов, с которыми они функционально связаны. Такие векторы называют в настоящем документе "рекомбинантными экспрессирующими векторами" (или просто "экспрессирующими векторами"). Как правило, экспрессирующие векторы, пригодные для использования в способах рекомбинантных ДНК, часто имеют форму плазмид. В настоящем описании "плазмида" и "вектор" могут использоваться взаимозаменяемо, поскольку плазмида является наиболее часто используемой формой вектора. Однако подразумевают, что изобретение включает и такие другие формы экспрессирующих векторов, такие как вирусные векторы (например, ретровирусы, аденовирусы и аденоассоциированные вирусы с дефектом репликации), которые выполняют эквивалентные функции.
Выражение "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин") включает клетку, в которую был введен рекомбинантный экспрессирующий вектор. Следует понимать, что такие термины относятся не только к конкретной рассматриваемой клетке, но также к потомству такой клетки. Поскольку в последующих поколениях могут происходить определенные модификации вследствие либо мутации, либо влияния окружающей среды, такое потомство, в действительности, может не быть идентичным родительской клетке, но, тем не менее, оно включено в термин "клетка-хозяин", используемый в настоящем документе.
Термин "модификация", как используют в настоящем документе, относится к изменению одной или нескольких аминокислот в антителах или их антигенсвязывающих частях. Изменение можно осуществлять добавлением, заменой или делецией аминокислоты в одном или нескольких положениях. Изменение можно проводить с использованием известных способов, таких как ПЦР-мутагенез.
Выражение "положение контакта" включает аминокислотное положение в CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи или вариабельной области легкой цепи антитела, которое занято аминокислотой, которая контактирует с антигеном в одной из двадцати шести известных структур антитело-антиген. Если аминокислота CDR в какой-либо из 26 известных решенных структур комплексов антитело-антиген контактирует с антигеном, то можно считать, что эта аминокислота занимает положение контакта. Положения контакта имеют более высокую вероятность быть занятыми аминокислотой, которая контактирует с антигеном, чем неконтактные положения. Предпочтительно положение контакта представляет собой положение CDR, содержащее аминокислоту, которая контактирует с антигеном более чем в 3 из 26 структур (>11,5%). Наиболее предпочтительно положение контакта представляет собой положение CDR, содержащее аминокислоту, которая контактирует с антигеном более чем в 8 из 25 структур (>32%).
Термин "положение гипермутации" включает аминокислотный остаток, который занимает положение в области CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи или вариабельной области легкой цепи антитела, которое считают имеющим высокую частоту или вероятность соматической гипермутации в процессе созревания аффинности антитела in vivo. "Высокая частота или вероятность соматической гипермутации" включает частоту или вероятность от 5 до приблизительно 40% случаев того, что остаток будет подвергнут соматической гипермутации в процессе созревания аффинности антитела in vivo. Следует понимать, что все диапазоны в пределах этого установленного диапазона также являются частью данного изобретения, например, от 5 до приблизительно 30%, например, от 5 до приблизительно 15%, например, от 15 до приблизительно 30%.
Термин "предпочтительное положение для селективного мутагенеза" включает аминокислотный остаток, который занимает положение в области CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи или вариабельной области легкой цепи, которое можно считать как положением контакта, так и положением гипермутации.
Выражение "подход селективного мутагенеза" включает способ повышения активности антитела путем селекции и индивидуальной мутации аминокислот CDR по меньшей мере в одном предпочтительном положении для селективного мутагенеза, положении гипермутации и/или положении контакта. "Селективно мутантное" антитело человека представляет собой антитело, которое содержит мутацию в выбранном положении, внесенную с использованием подхода селективного мутагенеза. В другом варианте осуществления подход селективного мутагенеза обеспечивает способ предпочтительной мутации выбранных индивидуальных аминокислотных остатков в CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи (далее в настоящем документе H1, H2 и H3, соответственно), или CDR1, CDR2 или CDR3 вариабельной области легкой цепи (далее в настоящем документе обозначаемых как L1, L2 и L3, соответственно) антитела. Аминокислотные остатки могут быть выбраны из предпочтительных положений для селективного мутагенеза, положений контакта или положений гипермутации. Индивидуальные аминокислоты выбирают исходя из их положения в вариабельной области легкой или тяжелой цепи. Следует понимать, что положение гипермутации также может быть положением контакта. В одном варианте осуществления подход селективного мутагенеза представляет собой "нацеленный подход". Выражение "нацеленный подход" включает способ предпочтительной мутации выбранных индивидуальных аминокислотных остатков в CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи или CDR1, CDR2 или CDR3 вариабельной области легкой цепи антитела направленным образом, например, "групповой нацеленный подход" или "нацеленный подход в соответствии с CDR". В "групповом нацеленном подходе" индивидуальные аминокислотные остатки в конкретных группах нацеливают на селективные мутации, включающие группы I (включая L3 и H3), II (включая H2 и L1) и III (включая L2 и H1), причем группы приведены в порядке предпочтительности для нацеливания. В "нацеленном подходе в соответствии с CDR" индивидуальные аминокислотные остатки в конкретных CDR нацеливают на селективные мутации со следующим порядком предпочтительности для нацеливания: H3, L3, H2, L1, H1 и L2. Выбранный аминокислотный остаток подвергают мутации, например, по меньшей мере на два других аминокислотных остатка, и определяют влияние мутации на активность антитела. Активность измеряют в виде изменения специфичности/аффинности связывания антитела и/или нейтрализующей эффективности антитела. Следует понимать, что подход селективного мутагенеза можно использовать для оптимизации любого антитела, полученного из любого источника, включая фаговый дисплей, трансгенных животных с эмбриональными генами IgG человека, антитела человека, выделенные из B-клеток человека. Предпочтительно, подход селективного мутагенеза используют для антител, которые не могут быть дополнительно оптимизированы с использованием технологии фагового дисплея. Следует понимать, что антитела из любого источника, включая фаговый дисплей, трансгенных животных с эмбриональными генами IgG человека, антитела человека, выделенные из B-клеток человека, можно подвергать обратной мутации до или после подхода селективного мутагенеза.
Термин "усиливающий активность аминокислотный остаток" включает аминокислотный остаток, который повышает активность антитела. Следует понимать, что усиливающий активность аминокислотный остаток может заменять аминокислотный остаток в предпочтительном положении для селективного мутагенеза, положении контакта или положении гипермутации, и, кроме того, в одной или нескольких CDR может присутствовать более одного усиливающего активность аминокислотного остатка. Усиливающий активность аминокислотный остаток включает аминокислотный остаток, который повышает специфичность/аффинность связывания антитела, например связывания антитела против IL-12 человека с IL-12 человека. Усиливающий активность аминокислотный остаток также включает аминокислотный остаток, который повышает нейтрализующую эффективность антитела, например, антитела против IL-12 человека, которое ингибирует IL-12 человека.
Термин "Cmax" относится к максимальной или пиковой концентрации средства в сыворотке или плазме, наблюдаемой у субъекта после его введения.
Термин "Tmax" относится к времени, за которое достигается Cmax.
Термин "биодоступность" или "F%" относится к доле или проценту дозы, которая всасывается и проникает в системный кровоток после введения данной дозированной формы. Дозу средства можно вводить любым способом, а, предпочтительно, путем внутривенной или подкожной инъекции.
Термин "введение дозы", как используют в настоящем документе, относится к введению вещества (например, антитела против IL-12 и IL-23) для достижения терапевтической цели (например, для лечения ревматоидного артрита).
Термины "режим введения дозы раз в две недели", "введение дозы раз в две недели" и "введение раз в две недели", как используют в настоящем документе, относятся к временному режиму введения вещества (например, антитела против IL-12 и IL-23) субъекту для достижения терапевтической цели, где временной режим представляет собой введение раз в две недели (eow). Режим введения дозы раз в две недели не включает режим введения дозы раз в неделю. Предпочтительно, вещество вводят каждые 9-19 суток, более предпочтительно, каждые 11-17 суток, еще более предпочтительно, каждые 13-15 суток и наиболее предпочтительно, каждые 14 суток.
Термин "комбинация", как в выражении "первое средство в комбинации со вторым средством", включает совместное введение первого средства и второго средства, которые, например, могут быть растворены в одном фармацевтически приемлемом носителе или смешаны с ним, или введение первого средства, за которым следует введение второго средства, или введение второго средства, за которым следует введение первого средства. Настоящее изобретение, таким образом, включает способы комбинированного медикаментозного лечения и комбинированные фармацевтические композиции.
Термин "одновременный", как в выражении "одновременное медикаментозное лечение", включает введение средства в присутствии второго средства. Способ одновременного медикаментозного лечения включает способы, при которых первое, второе, третье или дополнительные средства вводят совместно. Способ одновременного медикаментозного лечения также включает способы, при которых первое или дополнительные средства вводят в присутствии второго или дополнительных средств, где второе или дополнительные средства, например, могут быть введены ранее. Способ одновременного медикаментозного лечения может быть проведен поэтапно различными лицами. Например, одно лицо может вводить субъекту первое средство, а второе лицо может вводить субъекту второе средство, и стадии введения могут быть выполнены одновременно, или практически одновременно, или в отдаленное время, при условии, что первое средство (и дополнительные средства) вводят после введения второго средства (и дополнительных средств). Лицо и субъект могут быть одним и тем же лицом (например, человеком).
Термин "комбинированная терапия", как используют в настоящем документе, относится к введению двух или более лекарственных веществ, например, антитела против IL-12 и IL-23 и другого лекарственного средства. Другое лекарственное средство(а) можно вводить одновременно, до или после введения антитела против IL-12 и IL-23.
Термин "набор", как используют в настоящем документе, относится к упакованному продукту, содержащему компоненты, с которыми вводят антитело против IL-12 и IL-23 по изобретению для лечения связанного с IL-12 нарушения. Предпочтительно набор включает коробку или контейнер, в котором содержатся компоненты набора. К коробке или контейнеру прикреплен ярлык или протокол, одобренный Food and Drug Administration. В коробке или контейнере находятся компоненты по изобретению, которые предпочтительно содержатся в пластмассовой, полиэтиленовой, полипропиленовой, этиленовой или пропиленовой емкостях. Емкости могут представлять собой пробирки с крышками или флаконы. Также набор может включать инструкции по введению антитела против IL-12 и IL-23.
Различные аспекты изобретения более подробно описаны в следующих подразделах.
I. Антитела человека, которые связывают IL-12 человека
Данное изобретение относится к способам и композициям для применения антител человека или их антигенсвязывающих частей, которые связываются с IL-12 человека, для лечения псориаза. Также изобретение относится к способам и композициями для применения антитела, которое связывается как с IL-12, так и с IL-23. Предпочтительно, антитела человека, используемые в данном изобретении, представляют собой рекомбинантные нейтрализующие антитела человека против hIL-12.
В одном варианте осуществления антитело, используемое в изобретении, представляет собой антитело ABT-874 (см. патент США № 6914128). ABT-874 представляет собой полностью человеческое антитело против интерлейкина 12 (IL-12) и IL-23. Оно с большой аффинностью связывается с субъединицей p40, общей для IL-12 и IL-23, подтвержденными мишенями для лечения псориаза (Ps).
Антитела, которые связываются с IL-12 человека, могут быть выбраны, например, путем скрининга одной или нескольких библиотек кДНК VL и VH человека с помощью hIL-12, такого как способы фагового дисплея, как описано в примере 1 патента США № 6914128. Скринингом библиотек кДНК VL и VH вначале была идентифицирована серия антител против IL-12 человека, среди которых одно антитело, обозначаемое в настоящем документе как "Joe 9" (или "Joe 9 дикого типа"), было отобрано для дальнейшей разработки. Joe 9 представляет собой относительно низкоаффинное антитело против IL-12 человека (например, Koff приблизительно 0,1 с-1), но в то же время пригодное для специфичного связывания и детекции hIL-12. Аффинность антитела Joe 9 повышали проведением мутагенеза CDR тяжелой и легкой цепи, получая панель вариабельных областей легкой и тяжелой цепи, которые были "перемешаны и приведены в соответствие" и дополнительно мутированы, обеспечивая множество дополнительных антител против hIL-12 с повышенной аффинностью к hIL-12 (см. пример 1, таблица 2 патента США № 6914128 (см. таблицу 2 приложения A к нему)) и выравнивания последовательностей на фигурах 1A-D патента США № 6914128 (см. фигуры 8A-D в настоящем документе).
Среди этих антител, антитело человека против hIL-12, обозначаемое в настоящем документе как Y61, показало значительное повышение аффинности связывания (например, Koff приблизительно 2×10-4 с-1). Антитело против hIL-12 Y61 было отобрано для дальнейшего созревания аффинности путем индивидуальной мутации конкретных аминокислотных остатков в CDR тяжелой и легкой цепи. Аминокислотные остатки Y61 отбирали для сайт-специфичной мутации (подход селективного мутагенеза) исходя из его аминокислотных остатков, занимающих предпочтительное положение для селективного мутагенеза, положение контакта и/или гипермутации. Обобщение замен в выбранных положениях в CDR тяжелой и легкой цепи представлено на фигурах 2A-2H патента США № 6914128 (фигуры 9A-H в настоящем документе). Предпочтительное рекомбинантное нейтрализующее антитело по изобретению, обозначаемое в настоящем документе как J695 (также обозначаемое как ABT-874 (Abbott Laboratories), было получено путем замены Gly на Tyr в положении 50 CDR2 легкой цепи Y61 и замены Gly на Tyr в положении 94 CDR3 легкой цепи Y61.
Выравнивание аминокислотных последовательностей вариабельных областей тяжелой и легкой цепи в панели антител против IL-12, используемых в изобретении, в ряду поколений от Joe 9 дикого типа до J695, представлено на фигурах 1A-1D патента США № 6914128 (фигуры 8A-D в настоящем документе). Эти выравнивания последовательностей обеспечили возможность идентификации консенсусных последовательностей для предпочтительных вариабельных областей тяжелой и легкой цепи антител по изобретению, которые связывают hIL-12, а также консенсусных последовательностей для CDR3, CDR2 и CDR1, в ряду поколений от Joe 9 до J695. Более того, анализ мутагенеза Y61, обобщенно представленный на фигурах 2A-2H патента США № 6914128 (фигуры 9A-H в настоящем документе), позволил идентификацию консенсусных последовательностей для вариабельных областей тяжелой и легкой цепи, которые связывают hIL-12, а также консенсусных последовательностей CDR3, CDR2 и CDR1, которые связывают hIL-12, в ряду поколений от Y61 до J695, которое включает последовательности с модификациями относительно Y61, но которое все еще сохраняет хорошие характеристики связывания hIL-12. Предпочтительные последовательности CDR, VH и VL по изобретению (включая консенсусные последовательности), как обозначено идентификаторами последовательностей в прилагаемом списке последовательностей, обобщенно представлены ниже.
|
|
Антитела, полученные созреванием аффинности Joe 9 дикого типа, были функционально охарактеризованы анализом поверхностного плазмонного резонанса для определения констант Kd и Koff. Была получена серия антител, имеющих константу Koff в диапазоне от приблизительно 0,1 c-1 до приблизительно 1×10-5с-1, и более предпочтительно Koff от приблизительно 1×10-4c-1 до 1×10-5с-1 или менее. Также антитела были охарактеризованы in vitro по их способности ингибировать пролиферацию бластных клеток при стимуляции фитогемагглютинином (PHA), как описано в примере 3 патента США № 6914128. Была получена серия антител, имеющих величину IC50 в диапазоне от приблизительно 1×10-6 M до приблизительно 1×10-11 M, более предпочтительно приблизительно от 1×10-10 M до 1×10-11 M или менее.
Таким образом, в одном аспекте изобретение относится к способам и композициям для применения выделенного антитела человека или его антигенсвязывающей части, которые связываются с IL-12 человека и диссоциируют от IL-12 человека с константой скорости Koff 0,1 с-1 или менее, как определено поверхностным плазмонным резонансом, или которые ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе пролиферации бластных клеток при стимуляции фитогемагглютинином in vitro (анализе PHA) с IC50 1×10-6 M или менее. В предпочтительных вариантах осуществления выделенное антитело против IL-12 человека или его антигенсвязывающая часть диссоциируют от IL-12 человека с константой скорости Koff 1×10-2с-1 или менее, или ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-7 M или менее. В более предпочтительных вариантах осуществления выделенное антитело против IL-12 человека или его антигенсвязывающая часть диссоциируют от IL-12 человека с константой скорости Koff 1×10-3с-1 или менее, или ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-8 M или менее. В более предпочтительных вариантах осуществления выделенное антитело против IL-12 человека или его антигенсвязывающая часть диссоциируют от IL-12 человека с константой скорости Koff 1×10-4с-1 или менее, или ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-9 M или менее. В более предпочтительных вариантах осуществления выделенное антитело против IL-12 человека или его антигенсвязывающая часть диссоциируют от IL-12 человека с константой скорости Koff 1×10-5с-1 или менее, или ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-10 M или менее. В еще более предпочтительных вариантах осуществления выделенное антитело против IL-12 человека или его антигенсвязывающая часть диссоциируют от IL-12 человека с константой скорости Koff 1×10-5с-1 или менее, или ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-11 M или менее.
Константу скорости диссоциации (Koff) антитела против IL-12 можно определить поверхностным плазмонным резонансом (см. пример 5 патента США № 6914128). Как правило, в анализе поверхностного плазмонного резонанса измеряют в реальном времени связывающие взаимодействия между лигандом (рекомбинантный IL-12 человека, иммобилизованный на биосенсорной матрице) и анализируемым соединением (антитела в растворе) посредством поверхностного плазмонного резонанса (SPR), используя систему BIAcore (Pharmacia Biosensor, Piscataway, NJ). Поверхностный плазмонный анализ также можно проводить путем иммобилизации анализируемого соединения (антитела на биосенсорной матрице) и предоставления лиганда (рекомбинантный IL-12 в растворе). Нейтрализующую активность антител против IL-12 или их антигенсвязывающих частей можно оценивать, используя один или несколько подходящих анализов in vitro (см. пример 3 патента США № 6914128).
В данной области хорошо известно, что CDR тяжелой и легкой цепи антитела играют важную роль в специфичности/аффинности связывания антитела с антигеном. Таким образом, изобретение относится к антителам человека, имеющим CDR легкой и тяжелой цепи Joe 9, а также к другим антителам, имеющим CDR, которые модифицированы для повышения специфичности/аффинности связывания антитела. Как показано в примере 1 патента США № 6914128, серии модификаций в CDR легкой и тяжелой цепи приводят к созреванию аффинности антител против hIL-12 человека. Выравнивание аминокислотных последовательностей вариабельных областей тяжелой и легкой цепи серии антител человека в диапазоне от Joe 9 дикого типа до J695, которые связывают IL-12 человека, представлено на фигурах 1A-1D патента США № 6914128 (фигуры 8A-D в настоящем документе). При выравнивании последовательностей можно определять консенсусные мотивы последовательностей для CDR антител. Например, консенсусный мотив для CDR3 VH ряда поколений от Joe 9 до J695 содержит аминокислотную последовательность: (H/S)-G-S-(H/Y)-D-(N/T/Y) (SEQ ID NO:1), которая охватывает аминокислоты от положения 95 до положения 102 консенсусной HCVR, представленной в SEQ ID NO:7. Консенсусный мотив для CDR3 VL содержит аминокислотную последовательность: Q-(S/T)-Y-(D/E)-(S/R/K)-(S/G/Y)-(L/F/T/S)-(R/S/T/W/H)-(G/P)-(S/T/A/L)-(R/S/M/T/L-V/I/T/M/L) (SEQ ID NO:2), которая охватывает аминокислоты от положения 89 до положения 97 консенсусной LCVR, представленной в SEQ ID NO:8.
Таким образом, в другом аспекте изобретение относится к способам и композициям, содержащим выделенное антитело человека или его антигенсвязывающую часть, которые имеют следующие характеристики:
a) ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-6 M или менее;
b) имеют CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:1; и
c) имеют CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:2.
В предпочтительном варианте осуществления антитело дополнительно включает CDR2 VH, содержащую аминокислотную последовательность: F-I-R-Y-D-G-S-N-K-Y-Y-A-D-S-V-K-G (SEQ ID NO:3) (которая охватывает аминокислоты от положения 50 до положения 65 консенсусной HCVR, содержащей аминокислотную последовательность SEQ ID NO:7), и дополнительно включает CDR2 VL, содержащую аминокислотную последовательность: (G/Y)-N-(D/S)-(Q/N)-R-P-S (SEQ ID NO:4) (которая охватывает аминокислоты от положения 50 до положения 56 консенсусной LCVR, содержащей аминокислотную последовательность SEQ ID NO:8).
В другом предпочтительном варианте осуществления антитело дополнительно включает CDR1 VH, содержащую аминокислотную последовательность: F-T-F-S-(S/E)-Y-G-M-H (SEQ ID NO:5) (которая охватывает аминокислоты от положения 27 до положения 35 консенсусной HCVR, содержащей аминокислотную последовательность SEQ ID NO:7), и дополнительно включает CDR1 VL, содержащую аминокислотную последовательность: (S/T)-G-(G/S)-(R/S)-S-N-I-(G/V)-(S/A)-(N/G/Y)-(T/D)-V-(K/H) (SEQ ID NO:6) (которая охватывает аминокислоты от положения 24 до положения 34 консенсусной LCVR, содержащей аминокислотную последовательность SEQ ID NO:8).
В другом предпочтительном варианте осуществления антитело, используемое в изобретении, включает HCVR, содержащую аминокислотную последовательность SEQ ID NO:7, и LCVR, содержащую аминокислотную последовательность SEQ ID NO:8.
Дополнительные консенсусные мотивы можно определять исходя из анализа мутаций, проведенного для Y61, которые приводят к антителу J695 (обобщенно представленного на фигурах 2A-2H патента США № 6914128; фигуры 9A-H в настоящем документе). Как показано на графиках, представленных на фигурах 2A-2H патента США № 6914128 (фигуры 9A-H в настоящем документе), определенные остатки CDR тяжелой и легкой цепи Y61 поддавались замене без значительного нарушения свойств связывания антитела с hIL-12. Например, отдельные замены в положении 30 в CDR H1 двенадцатью различными аминокислотными остатками не приводили к значительному снижению константы Koff антитела, указывая на то, что это положение поддается замене множеством различных аминокислотных остатков. Таким образом, исходя из мутационного анализа (т.е. положений в Y61, которые поддавались замене другими аминокислотными остатками) были определены консенсусные мотивы. Консенсусные мотивы для CDR3 тяжелой и легкой цепи представлены в SEQ ID NO:9 и 10, соответственно, консенсусные мотивы для CDR2 тяжелой и легкой цепи представлены в SEQ ID NO:11 и 12, соответственно, и консенсусные мотивы для CDR1 тяжелой и легкой цепи представлены в SEQ ID NO:13 и 14, соответственно. Консенсусные мотивы для областей VH и VL представлены в SEQ ID NO:15 и 16, соответственно.
Таким образом, в одном аспекте изобретение относится к выделенному антителу человека или его антигенсвязывающей части, которые имеют следующие характеристики:
a) ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-9 M или менее;
b) имеют CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:9; и
c) имеют CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:10.
В предпочтительном варианте осуществления антитело дополнительно включает CDR2 VH, содержащую аминокислотную последовательность SEQ ID NO:11, и дополнительно включает CDR2 VL, содержащую аминокислотную последовательность SEQ ID NO:12.
В другом предпочтительном варианте осуществления антитело дополнительно включает CDR1 VH, содержащую аминокислотную последовательность SEQ ID NO:13, и дополнительно включает CDR1 VL, содержащую аминокислотную последовательность SEQ ID NO:14.
В другом предпочтительном варианте осуществления антитело, используемое в изобретении, включает HCVR, содержащую аминокислотную последовательность SEQ ID NO:15, и LCVR, содержащую аминокислотную последовательность SEQ ID NO:16.
Предпочтительное антитело, используемое в изобретении, антитело человека против hIL-12 Y61, может быть получено созреванием аффинности Joe 9 дикого типа путем ПЦР-мутагенеза CDR3 (как описано в примере 1 патента США № 6914128). Y61 обладает повышенной специфичностью/аффинностью связывания, определенной поверхностным плазмонным резонансом и анализами нейтрализации in vitro. CDR3 тяжелой и легкой цепи Y61 представлены в SEQ ID NO:17 и 18, соответственно, CDR2 тяжелой и легкой цепи Y61 представлены в SEQ ID NO:19 и 20, соответственно, и CDR1 тяжелой и легкой цепи Y61 представлены в SEQ ID NO:21 и 22, соответственно. VH Y61 имеет аминокислотную последовательность SEQ ID NO:23, и VL Y61 имеет аминокислотную последовательность SEQ ID NO:24 (эти последовательности представлены на фигурах 1A-1D патента США № 6914128 (фигуры 8A-D в настоящем документе), выровненные с Joe9).
Таким образом, в другом аспекте изобретение относится к применению выделенного антитела человека или его антигенсвязывающей части, которые
a) ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-9 M или менее;
b) имеют CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:17; и
c) имеют CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:18.
В предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть, используемые в способах и композициях по изобретению, имеют CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:19, и CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:20.
В другом предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть, используемые в способах и композициях по изобретению, имеют CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:21, и CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:22.
В другом предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть, используемые в способах и композициях по изобретению, включают вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:24.
В определенных вариантах осуществления полноразмерное антитело содержит константную область тяжелой цепи, такую как константные области IgG1, IgG2, IgG3, IgG4, IgM, IgA и IgE, и любой аллотипический их вариант, как описано у Kabat (Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Предпочтительно, константная область тяжелой цепи антитела представляет собой константную область тяжелой цепи IgG1. Альтернативно, часть антитела может представлять собой Fab-фрагмент, F(ab'2)-фрагмент или одноцепочечный Fv-фрагмент.
Модификации отдельных остатков Y61 привели к получению панели антител, представленной на фигурах 2A-2H патента США № 6914128 (фигуры 9A-H в настоящем документе). Специфичность/аффинность связывания каждого антитела определяли поверхностным плазмонным резонансом и/или анализами нейтрализации in vitro.
Таким образом, в другом аспекте изобретение относится к выделенному антителу человека или его антигенсвязывающей части, которые
a) ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-9 M или менее;
b) имеют CDR3 тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:404-SEQ ID NO:469; и
c) имеют CDR3 легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:534-SEQ ID NO:579.
В предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть, используемые в способах и композициях по изобретению, имеют CDR2 тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:335-SEQ ID NO:403; и CDR2 легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:506-SEQ ID NO:533.
В другом предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть имеют CDR1 тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:288-SEQ ID NO:334; и CDR1 легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:470-SEQ ID NO:505.
В другом предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть включают вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:23, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:24.
В определенных вариантах осуществления полноразмерное антитело содержит константную область тяжелой цепи, такую как константные области IgG1, IgG2, IgG3, IgG4, IgM, IgA и IgE, и любой их аллотипический вариант, как описано у Kabat (Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Предпочтительно, константная область тяжелой цепи антитела представляет собой константную область тяжелой цепи IgG1. Альтернативно, часть антитела может представлять собой Fab-фрагмент, F(ab'2)-фрагмент или одноцепочечный Fv-фрагмент.
Особенно предпочтительное рекомбинантное нейтрализующее антитело J695, которое может быть использовано в изобретении, было получено сайт-направленным мутагенезом аминокислотных остатков области контакта и гипермутации антитела Y61 (см. пример 2 патента США № 6914128 и раздел III, ниже). J695 отличается от Y61 заменой Gly на Tyr в Y61 в положении 50 CDR2 легкой цепи и заменой Gly на Tyr в положении 94 CDR3 легкой цепи. CDR3 тяжелой и легкой цепи J695 представлены в SEQ ID NO:25 и 26, соответственно, CDR2 тяжелой и легкой цепи J695 представлены в SEQ ID NO:27 и 28, соответственно, и CDR1 тяжелой и легкой цепи J695 представлены в SEQ ID NO:29 и 30, соответственно. VH J695 имеет аминокислотную последовательность SEQ ID NO:31, и VL J695 имеет аминокислотную последовательность SEQ ID NO:32 (эти последовательности также представлены на фигурах 1A-1D патента США № 6914128 (фигуры 8A-D в настоящем документе), выровненные с Joe9).
Таким образом, в другом аспекте изобретение относится к выделенному антителу человека или его антигенсвязывающей части, которые a) ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-9 M или менее; b) имеют CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:25; и c) имеют CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:26.
В предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть, используемые в изобретении, имеют CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:27, и CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:28.
В другом предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть, используемые в изобретении, имеют CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:29, и CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:30.
В другом предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть, используемые в изобретении, имеют вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:31, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:32.
В определенных вариантах осуществления полноразмерное антитело содержит константную область тяжелой цепи, такую как константные области IgG1, IgG2, IgG3, IgG4, IgM, IgA и IgE, и любой их аллотипический вариант, как описано у Kabat, (Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Предпочтительно, константная область тяжелой цепи антитела представляет собой константную область тяжелой цепи IgG1. Альтернативно, часть антитела может представлять собой Fab-фрагмент, F(ab'2)-фрагмент или одноцепочечный Fv-фрагмент.
Для получения дополнительных антител против IL-12 по изобретению можно вносить дополнительные мутации в предпочтительных консенсусных последовательностях для CDR3, CDR2 и CDR1 антител в ряду поколений от Joe 9 до J695, или в ряду поколений от Y61 до J695. Такие способы модификации можно проводить с использованием стандартных способов молекулярной биологии, таких как ПЦР-мутагенез, нацеленный на отдельные аминокислотные остатки области контакта или гипермутации в CDR легкой цепи и/или тяжелой цепи, с последующим анализом кинетики и функциональным анализом модифицированных антител, как описано в настоящем документе (например, анализами нейтрализации, описанными в примере 3 патента США № 6914128, и анализом BIAcore, как описано в примере 5 патента США № 6914128).
Таким образом, в другом аспекте изобретение относится к применению выделенного антитела человека или его антигенсвязывающей части, которые
a) ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-6 M или менее;
b) включают CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:1, CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:3, и CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:5, или их мутант, имеющий одну или несколько аминокислотных замен в предпочтительном положении для селективного мутагенеза или в положении гипермутации, где указанный мутант имеет константу koff, не более чем в 10 раз превышающую константу koff антитела, включающего CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:1, CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:3, и CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:5; и
c) включают CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:2, CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:4, и CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:6, или их мутант, имеющий одну или несколько аминокислотных замен в предпочтительном положении для селективного мутагенеза или в положении гипермутации, где указанный мутант имеет константу koff, не более чем в 10 раз превышающую константу koff антитела, включающего CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:2, CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:4, и CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:6.
В другом аспекте изобретение относится к применению выделенного антитела человека или его антигенсвязывающей части, которые
a) ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-9 M или менее;
b) включают CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:9, CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:11, и CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:13, или их мутант, имеющий одну или несколько аминокислотных замен в предпочтительном положении для селективного мутагенеза, в положении контакта или гипермутации, где указанный мутант имеет константу koff, не более чем в 10 раз превышающую константу koff антитела, включающего CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:9, CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:11, и CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:13; и
c) включают CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:10, CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:12, и CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:14, или их мутант, имеющий одну или несколько аминокислотных замен в предпочтительном положении для селективного мутагенеза, в положении контакта или гипермутации, где указанный мутант имеет константу koff, не более чем в 10 раз превышающую константу koff антитела, включающего CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:10, CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:12, и CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:14.
Специалисту в данной области также будет понятно, что в области CDR антитела, например, в Y61 или в J695, можно вносить дополнительные мутации для получения дополнительных антител против IL-12 по изобретению. Такие способы модификации можно проводить с использованием стандартных способов молекулярной биологии, как описано выше. Функциональный анализ и анализ кинетики модифицированных антител можно проводить, как описано в примере 3 патента США № 6914128 и примере 5 патента США № 6914128, соответственно. Модификации отдельных остатков Y61, которые привели к идентификации J695, представлены на фигурах 2A-2H патента США № 6914128 (фигуры 9A-H в настоящем документе) и описаны в примере 2 патента США № 6914128.
Таким образом, в другом аспекте изобретение относится к применению выделенного антитела человека или его антигенсвязывающей части, которые
a) ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-9 M или менее;
b) включают CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:17, CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:19, и CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:21, или их мутант, имеющий одну или несколько аминокислотных замен в предпочтительном положении для селективного мутагенеза или в положении гипермутации, где указанный мутант имеет константу koff, не более чем в 10 раз превышающую константу koff антитела, включающего CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:17, CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:19, и CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:21; и
c) включают CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:18, CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:20, и CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:22, или их мутант, имеющий одну или несколько аминокислотных замен в предпочтительном положении для селективного мутагенеза или в положении гипермутации, где указанный мутант имеет константу koff, не более чем в 10 раз превышающую константу koff антитела, включающего CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:18, CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:20, и CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:22.
В другом аспекте изобретение относится к применению выделенного антитела человека или его антигенсвязывающей части, которые
a) ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе PHA in vitro с IC50 1×10-9 M или менее;
b) включают CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:25, CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:27, и CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:29, или их мутант, имеющий одну или несколько аминокислотных замен в предпочтительном положении для селективного мутагенеза или в положении гипермутации, где указанный мутант имеет константу koff, не более чем в 10 раз превышающую константу koff антитела, включающего CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:25, CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:27, и CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:29; и
c) включают CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:26, CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:28, и CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:30, или их мутант, имеющий одну или несколько аминокислотных замен в предпочтительном положении для селективного мутагенеза или в положении гипермутации, где указанный мутант имеет константу koff, не более чем в 10 раз превышающую константу koff антитела, включающего CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:26, CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:28, и CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:30.
В другом варианте осуществления изобретение относится к применению выделенных антител человека или их антигенсвязывающих частей, которые нейтрализуют активность IL-12 человека и по меньшей мере одного дополнительного IL-12 примата, выбранного из группы, состоящей из IL-12 бабуина, IL-12 мартышки, IL-12 шимпанзе, IL-12 яванского макака и IL-12 макака резус, но которые не нейтрализуют активность IL-12 мыши.
II. Селекция рекомбинантных антител человека
Рекомбинантные антитела человека, которые могут быть использованы в изобретении, можно выделять скринингом рекомбинантной комбинаторной библиотеки антител, предпочтительно библиотеки фагового дисплея scFv, полученной с использованием кДНК VL и VH человека, полученной из мРНК, выделенной из лимфоцитов человека. Способы идентификации антител, которые могут быть использованы в способах и композициях по изобретению, описаны в патенте США № 6914128, включенном в настоящий документ в качестве ссылки. Способы получения и скрининга таких библиотек известны в данной области. В дополнение к коммерчески доступным наборам для получения библиотек фагового дисплея (например, Pharmacia Recombinant Phage Antibody System, каталожный № 27-9400-01; и набор фагового дисплея Stratagene SurfZAP™, каталожный № 240612), примеры способов и реагентов, особенно пригодных для применения в создании и скрининге библиотек дисплея антител, можно найти, например, в Kang et al., публикация PCT No. WO 92/18619; Winter et al., публикация PCT No. WO 92/20791; Breitling et al., публикация PCT No. WO 93/01288; McCafferty et al., публикация PCT No. WO 92/01047; Garrard et al., публикация PCT No. WO 92/09690; Fuchs et al. (1991) Bio/Technology 9:1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3:81-85; Huse et al. (1989) Science 246:1275-1281; McCafferty et al., Nature (1990) 348:552-554; Griffiths et al. (1993) EMBO J 12:725-734; Hawkins et al. (1992) J Mol Biol 226:889-896; Clackson et al. (1991) Nature 352:624-628; Gram et al. (1992) PNAS 89:3576-3580; Garrad et al. (1991) Bio/Technology 9:1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133-4137; и Barbas et al. (1991) PNAS 88:7978-7982.
Библиотеки антител, используемые в этом способе, предпочтительно представляют собой библиотеки scFv, полученные из кДНК VL и VH человека. Скрининг библиотек scFv-антител предпочтительно проводят с использованием рекомбинантного IL-12 человека в качестве антигена для отбора последовательностей тяжелой и легкой цепи человека, обладающих активностью связывания с IL-12. Для отбора антител, специфичных к субъединице p35 IL-12 или гетеродимеру p70, скрининговые анализы проводили в присутствии избытка свободной субъединицы p40. Предпочтение в отношении субъединиц можно определить, например, путем микротитрования Friguet, как описано в примере 1 патента США № 6914128.
После отбора исходных сегментов VL и VH человека проводят эксперименты по "перемешиванию и приведению в соответствие", в которых различные пары выбранных сегментов VL и VH подвергают скринингу в отношении связывания IL-12 для отбора предпочтительных комбинаций пар VL/VH (см. пример 1 патента США No. 6914128). Кроме того, для дополнительного повышения аффинности и/или для более низкой константы скорости диссоциации для связывания hIL-12, сегменты VL и VH предпочтительной пары(пар) VL/VH можно подвергать случайному мутагенезу, предпочтительно в области CDR3 VH и/или VL, в способе, аналогичном процессу соматической мутации in vivo, ответственному за созревание аффинности антител в ходе природного иммунного ответа. Аффинность созревания in vitro можно проводить путем амплификации областей VH и VL с использованием праймеров ПЦР, комплементарных CDR3 VH или CDR3 VL, соответственно, в которые "добавлена" произвольная смесь из четырех нуклеотидных оснований в определенных положениях, так чтобы конечные продукты ПЦР кодировали сегменты VH и VL, где в области CDR3 VH и/или VL введены случайные мутации. Эти произвольно мутированные сегменты VH и VL можно подвергать повторному отбору и повторному скринингу в отношении связывания с hIL-12, и можно отбирать последовательности, которые обладают высокой аффинностью и низкой константой скорости диссоциации для связывания IL-12. В таблице 2 приложения A патента США № 6914128 (см. таблицу 2 приложения A к нему) представлены антитела, которые проявляли измененную специфичность/аффинность связывания, полученные в результате созревания аффинности in vitro.
После отбора, выделения и скрининга антитела против hIL-12 по изобретению из библиотеки дисплея рекомбинантных иммуноглобулинов нуклеиновую кислоту, кодирующую выбранное антитело, можно выделить из фаговой частицы(частиц) (например, из генома фага) и субклонировать в другие экспрессирующие векторы стандартными способами рекомбинантных ДНК. Если желательно, можно проводить дальнейшие манипуляции с нуклеиновой кислотой для создания других форм антител по изобретению (например, связанных с нуклеиновой кислотой, кодирующей дополнительные домены иммуноглобулина, такие как дополнительные константные области). Для экспрессии рекомбинантного антитела человека, выделенного скринингом комбинаторной библиотеки, ДНК, кодирующую антитело, клонируют в рекомбинантный экспрессирующий вектор и вводят в клетки-хозяева млекопитающего, как более подробно описано в разделе IV, ниже.
Способы отбора антител, связывающих IL-12 человека, посредством технологии фагового дисплея и созревания аффинности выбранных антител случайным или сайт-направленным мутагенезом областей CDR более подробно описаны в примере 1 патента США № 6914128.
Как описано в примере 1 патента США № 6914128, скринингом библиотек кДНК VL и VH человека идентифицирована серия антител против IL-12, среди которых антитело Joe 9 было отобрано для дальнейшей разработки. Сравнение вариабельной области тяжелой цепи Joe 9 с эмбриональными последовательностями тяжелой цепи, выбранными из базы данных VBASE, показало, что Joe 9 является сходным с эмбриональной последовательностью COS-3. COS-3 относится к семейству VH3 эмбриональных последовательностей.
Семейство VH3 является частью эмбрионального набора VH человека, который подразделяют на семь семейств, VH1-VH7, исходя из гомологии нуклеотидных последовательностей (Tomlinson et al. (1992) J. Mol. Biol., 227, 776-798 и Cook et al. (1995) Immunology Today, 16, 237-242). Семейство VH3 содержит наиболее высокое число представителей и вносит наиболее крупный вклад в эмбриональный набор. Для любой данной эмбриональной последовательности антител VH3 человека идентичность аминокислотных последовательностей во всем семействе VH3 является высокой (см., например, Tomlinson et al. (1992) J. Mol. Biol., 227, 776-798 и Cook et al. (1995) Immunology Today, 16, 237-242). Диапазон идентичности аминокислотных последовательностей любых двух эмбриональных последовательностей VH в семействе VH3 находится в пределах 69-98 остатков из приблизительно остатков 100 VH, (т.е. гомология аминокислотных последовательностей между любыми двумя эмбриональными последовательностями VH составляет 69-98%). Для большинства пар эмбриональных последовательностей существует по меньшей мере 80 или более идентичных аминокислотных остатков, (т.е. гомология аминокислотных последовательностей составляет по меньшей мере 80%). Высокая степень гомологии аминокислотных последовательностей между представителями семейства VH3 приводит к тому, что в ключевых участках в CDR и каркасных областях VH-цепи присутствуют определенные аминокислотные остатки. Эти аминокислотные остатки обеспечивают структурные признаки CDR.
Исследования структур антител показали, что конформации CDR можно подразделить на семейства канонических структур CDR исходя из ключевых аминокислотных остатков, которые занимают определенные положения в CDR и каркасных областях. Следовательно, в различных антителах существуют сходные локальные конформации CDR, которые имеют канонические структуры с идентичными ключевыми аминокислотными остатками (Chothia et al. (1987) J. Mol. Biol., 196, 901-917 и Chothia et al. (1989) Nature, 342, 877-883). В семействе VH3 имеет место консервативность аминокислотных остатков в ключевых участках для канонических структур CDR1 и CDR2 (Chothia et al. (1992) J. Mol. Biol., 227, 799-817).
Эмбриональный ген VH COS-3 является представителем семейства VH3 и является вариантом 3-30 (DP-49) эмбрионального аллеля VH. Аминокислотные последовательности VH COS-3 и Joe9 отличаются только в 5 положениях. Высокая степень гомологии аминокислотных последовательностей между VH Joe9 и COS-3, и между VH Joe9 и другими представителями семейства VH3, также обеспечивает высокую степень структурной гомологии CDR (Chothia et al. (1992) J. Mol. Biol., 227, 799-817; Chothia et al. (1987) J. Mol. Biol., 196, 901-917 и Chothia et al. (1989) Nature, 342, 877-883).
Специалисту в данной области будет понятно, что, исходя из высокого сходства аминокислотных последовательностей и канонического структурного сходства с Joe 9, другие представители семейства VH3 также могут быть использованы для получения антител, которые связываются с IL-12 человека,. Это может быть осуществлено, например, путем отбора соответствующей VL с использованием технологии "перетасовки" цепей (Winter et al. (1994) Annual Rev. Immunol., 12, 433-55), или пересадкой CDR из антитела грызуна или другого антитела человека, включая CDR из антител по данному изобретению, в каркасную область семейства VH3.
Эмбриональный набор V-лямбда человека подразделяют на 10 семейств исходя из гомологии нуклеотидных последовательностей (Williams et al. (1996) J. Mol. Biol., 264, 220-232). Сравнение вариабельной области легкой цепи Joe 9 с эмбриональными последовательностями легких цепей, выбранными из базы данных VBASE, показало, что Joe 9 был сходен с эмбриональной последовательностью лямбда DPL8. VL Joe9 отличается от последовательности DPL8 только в четырех положениях каркасной области и высоко гомологичен каркасным последовательностям других представителей семейства Vλ1. Исходя из высокой гомологии аминокислотных последовательностей и сходства канонических структур с Joe 9, другие представители семейства Vλ1 также могут быть использованы для получения антител, которые связываются с IL-12 человека. Это может быть осуществлено, например, путем отбора соответствующей VH с использованием технологии "перетасовки" цепей (Winter et al., выше), или пересадкой CDR из антитела грызуна или другого антитела человека, включая CDR из антител по данному изобретению, в каркасную область семейства Vλ1.
Способы по изобретению включают рекомбинантные антитела, которые связываются с hIL-12, содержащие вариабельную область тяжелой цепи от представителя семейства VH3 эмбриональных последовательностей и вариабельную область легкой цепи от представителя семейства Vλ1 эмбриональных последовательностей. Более того, специалисту в данной области будет понятно, что любой представитель семейства VH3 последовательностей тяжелых цепей можно комбинировать с любым представителем семейства Vλ1 последовательностей легких цепей.
Специалистам в данной области также будет понятно, что в популяции (например, в человеческой популяции) могут существовать полиморфизмы последовательности ДНК, которые приводят к изменению аминокислотных последовательностей эмбрионального типа. Такой генетический полиморфизм в эмбриональных последовательностях может существовать среди индивидуумов в популяции вследствие природной аллельной вариации. Такие природные аллельные вариации, как правило, могут приводить к 1-5% вариации нуклеотидной последовательности гена. Любые и все такие нуклеотидные вариации и являющиеся их следствием полиморфизмы аминокислот в эмбриональных последовательностях, которые являются результатом природной аллельной вариации, включены в объем изобретения.
Таким образом, в одном аспекте изобретение относится к выделенному антителу человека или его антигенсвязывающей части, которые имеют следующие характеристики:
a) связываются с IL-12 человека и диссоциируют от IL-12 человека с константой скорости koff 0,1 с-1 или менее, как определено поверхностным плазмонным резонансом, или ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе пролиферации бластных клеток при стимуляции фитогемагглютинином in vitro (в анализе PHA) с IC50 1×10-6 M или менее;
b) имеют вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, выбранную из представителя эмбрионального семейства VH3, где вариабельная область тяжелой цепи имеет мутацию в положении контакта или гипермутации на усиливающий активность аминокислотный остаток;
с) имеют вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из представителя эмбрионального семейства Vλ3, где вариабельная область легкой цепи имеет мутацию в предпочтительном положении для селективного мутагенеза, в положении контакта или гипермутации на усиливающий активность аминокислотный остаток.
В предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть имеют мутацию в CDR3 тяжелой цепи. В другом предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть имеют мутацию в CDR3 легкой цепи. В другом предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть имеют мутацию в CDR2 тяжелой цепи. В другом предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть имеют мутацию в CDR2 легкой цепи. В другом предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть имеют мутацию в CDR1 тяжелой цепи. В другом предпочтительном варианте осуществления выделенное антитело человека или его антигенсвязывающая часть имеют мутацию в CDR1 легкой цепи.
Специалисту в данной области будет понятно, что, исходя из высокого сходства аминокислотной последовательности между представителями эмбрионального семейства VH3 или между представителями эмбрионального семейства Vλ1 легких цепей, эти мутации в эмбриональных последовательностях могут обеспечить дополнительные антитела, которые связываются с IL-12 человека. В таблице 1 патента США № 6914128 (см. таблицу 1 приложения A к нему) представлены эмбриональные последовательности представителей семейства VH3 и продемонстрирована значительная гомология последовательностей у представителей семейства. Также в таблице 1 патента США № 6914128 (см. таблицу 1 приложения A к нему) представлены эмбриональные последовательности представителей семейства Vλ1. Для сравнения представлены последовательности тяжелой и легкой цепи Joe 9. Мутации в эмбриональные последовательности представителей семейств VH3 или Vλ1 можно вносить, например, в тех же аминокислотных положениях, что и в антителах по изобретению (например, мутации в Joe 9). Модификации можно проводить с использованием стандартных способов молекулярной биологии, таких как ПЦР-мутагенез, нацеливание на отдельные аминокислотные остатки в эмбриональных последовательностях, с последующим анализом кинетики и функциональным анализом модифицированных антител, как описано в настоящем документе (например, анализы нейтрализации, описанные в примере 3 патента США № 6914128, и анализ BIAcore, как описано в примере 5 патента США № 6914128).
Таким образом, в одном аспекте изобретение относится к применению выделенного антитела человека или его антигенсвязывающей части, которые имеют следующие характеристики:
a) имеют вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:595-667, где вариабельная область тяжелой цепи имеет мутацию в предпочтительном положении для селективного мутагенеза, положении контакта или гипермутации на усиливающий активность аминокислотный остаток;
b) имеют вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:669-675, где вариабельная область легкой цепи имеет мутацию в предпочтительном положении для селективного мутагенеза, положении контакта или гипермутации на усиливающий активность аминокислотный остаток.
Специалисту в данной области будет понятно, что, исходя из высокого сходства аминокислотных последовательностей Joe 9 и эмбриональной последовательности тяжелой цепи COS-3, и Joe 9 и эмбриональной последовательности лямбда DPL8, другие мутации областей CDR этих эмбриональных последовательностей могут обеспечить дополнительные антитела, которые связываются с IL-12 человека. Такие способы модификации можно проводить с использованием стандартных способов молекулярной биологии, как описано выше.
Таким образом, в одном аспекте изобретение относится к применению выделенного антитела человека или его антигенсвязывающей части, которые имеют следующие характеристики:
a) связываются с IL-12 человека и диссоциируют от IL-12 человека с константой скорости koff 0,1 с-1 или менее, как определено поверхностным плазмонным резонансом, или ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе пролиферации бластных клеток при стимуляции фитогемагглютинином in vitro (в анализе PHA) с IC50 1×10-6 M или менее;
b) имеют вариабельную область тяжелой цепи, содержащую эмбриональную аминокислотную последовательность COS-3, где вариабельная область тяжелой цепи имеет мутацию в предпочтительном положении для селективного мутагенеза, положении контакта или гипермутации на усиливающий активность аминокислотный остаток;
с) имеют вариабельную область легкой цепи, содержащую эмбриональную аминокислотную последовательность DPL8, где вариабельная область легкой цепи имеет мутацию в предпочтительном положении для селективного мутагенеза, положении контакта или гипермутации на усиливающий активность аминокислотный остаток.
Вследствие того, что определенные аминокислотные остатки занимают ключевые участки в CDR и каркасных областях вариабельной области легкой и тяжелой цепи, этим областям придаются структурные признаки. В частности, области CDR2 и CDR1 являются объектами канонических структурных классификаций. Поскольку существует высокая степень гомологии аминокислотных последовательностей между представителями семейств, эти канонические признаки присутствуют у представителей семейств. Специалисту в данной области будет понятно, что модификации в аминокислотных остатках, которые обеспечивают эти канонические структуры, могут обеспечить дополнительные антитела, которые связываются с IL-12. Модификации можно проводить с использованием стандартных способов молекулярной биологии, как описано выше.
Таким образом, в другом аспекте изобретение относится к применению выделенного антитела человека или его антигенсвязывающей части, которые имеют следующие характеристики:
a) связываются с IL-12 человека и диссоциируют от IL-12 человека с константой скорости koff 0,1 с-1 или менее, как определено поверхностным плазмонным резонансом, или ингибируют пролиферацию бластных клеток при стимуляции фитогемагглютинином в анализе пролиферации бластных клеток при стимуляции фитогемагглютинином in vitro (в анализе PHA) с IC50 1×10-6 M или менее;
b) имеют вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, выбранную из представителя эмбрионального семейства VH3, где вариабельная область тяжелой цепи содержит CDR2, которая структурно сходна с CDR2 других представителей эмбрионального семейства VH3, и CDR1, которая структурно сходна с CDR1 других представителей эмбрионального семейства VH3, и где вариабельная область тяжелой цепи имеет мутацию в предпочтительном положении для селективного мутагенеза, положении контакта или гипермутации на усиливающий активность аминокислотный остаток;
c) имеют вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из представителя эмбрионального семейства Vλ1, где вариабельная область легкой цепи содержит CDR2, которая структурно сходна с CDR2 других представителей эмбрионального семейства Vλ1, и CDR1, которая структурно сходна с CDR1 других представителей эмбрионального семейства Vλ1, и где вариабельная область легкой цепи имеет мутацию в предпочтительном положении для селективного мутагенеза, положении контакта или гипермутации на усиливающий активность аминокислотный остаток.
Рекомбинантные антитела человека, используемые в изобретении, имеют вариабельные и константные области, которые гомологичны эмбриональным последовательностям иммуноглобулинов человека, выбранным из базы данных VBASE. Мутации рекомбинантных антител человека (например, случайным мутагенезом или ПЦР-мутагенезом) приводят к аминокислотам, которые не кодируются эмбриональными последовательностями иммуноглобулинов человека. Также, библиотеки рекомбинантных антител, полученных от доноров-людей, содержат последовательности антител, которые отличаются от их соответствующих эмбриональных последовательностей вследствие нормального процесса соматической мутации, который происходит в процессе развития B-клеток. Следует отметить, что если "эмбриональные" последовательности, полученные ПЦР-амплификацией, кодируют аминокислотные отличия в каркасных областях по сравнению с истинной эмбриональной конфигурацией (т.е. отличия в амплифицированной последовательности по сравнению с истинной эмбриональной последовательностью), то может быть желательным изменение этих аминокислотных отличий обратно до истинных эмбриональных последовательностей (т.е. "обратная мутация" каркасных остатков на эмбриональную конфигурацию). Таким образом, настоящее изобретение необязательно может включать стадию обратной мутации. Для этого аминокислотные последовательности тяжелой и легкой цепи, кодируемые эмбриональной последовательностью (представленной, например, в базе данных VBASE), сначала сравнивают с мутантными каркасными аминокислотными последовательностями тяжелой и легкой цепи иммуноглобулина для идентификации аминокислотных остатков в мутантной каркасной последовательности иммуноглобулина, которые отличаются от наиболее близких эмбриональных последовательностей. Затем соответствующие нуклеотиды мутантной последовательности иммуноглобулина подвергают обратной мутации до соответствующей эмбриональной последовательности, используя генетический код для определения того, какие нуклеотидные изменения следует внести. Мутагенез мутантной каркасной последовательности иммуноглобулина проводят стандартными способами, такими как опосредуемый ПЦР мутагенез (в котором мутантные нуклеотиды включают в праймеры ПЦР, так чтобы продукт ПЦР содержал мутации) или сайт-направленный мутагенез. Роль каждой аминокислоты, идентифицированной в качестве кандидата для обратной мутации, следует исследовать в отношении прямой или косвенной роли в связывании антигена, и любая аминокислота, выявленная после мутации как влияющая на какую-либо желательную характеристику антитела человека, не должна быть включена в конечное антитело человека; в качестве примера, усиливающие активность аминокислоты, идентифицированные с помощью подхода селективного мутагенеза, не подвергают обратной мутации. Анализы для определения характеристик антитела, приобретенных в результате мутагенеза, могут включать ELISA, конкурентный ELISA, анализы нейтрализации in vitro и in vivo и/или (см., например, пример 3 патента США № 6914128) иммуногистохимию срезов тканей из различных источников (включая человека, приматов и/или другие виды).
Для минимизации числа аминокислот, подвергаемых обратной мутации, аминокислотные положения, которые были выявлены как отличающиеся от наиболее близкой эмбриональной последовательности, но идентичные соответствующей аминокислоте в другой эмбриональной последовательности, можно оставить, при условии, что другая эмбриональная последовательность идентична или коллинеарна последовательности антитела человека по изобретению на протяжении по меньшей мере 10, предпочтительно 12 аминокислот, по обеим сторонам от рассматриваемой аминокислоты. Это позволит убедиться, что пептидный эпитоп, представляемый иммунной системой профессиональными антигенпредставляющими клетками у субъекта, которому ввели антитело человека по изобретению, не будет чужеродным, а будет идентичным собственному антигену, т.е. иммуноглобулину, кодируемому этой другой эмбриональной последовательностью. Обратную мутацию можно проводить на любой стадии оптимизации антитела; предпочтительно, обратную мутацию проводят непосредственно до или после подхода селективного мутагенеза. Более предпочтительно, обратную мутацию проводят непосредственно до подхода селективного мутагенеза.
III. Модификации предпочтительных положений для селективного мутагенеза, положений контакта и/или гипермутации
Как правило, отбор антител с повышенной аффинностью можно проводить с использованием способов фагового дисплея, как описано в разделе II, выше, и в патенте США № 6914128, включенном в настоящий документ в качестве ссылки. Его можно проводить случайной мутацией комбинаций остатков CDR и созданием крупных библиотек, содержащих антитела с различными последовательностями. Однако чтобы эти способы отбора работали, реакция антитело-антиген должна стремиться к равновесию, чтобы позволить, с течением времени, предпочтительное связывание более высокоаффинных антител с антигеном. Условия отбора, которые позволяют установить равновесие, нельзя было определить (предположительно из-за дополнительных неспецифических взаимодействий между антигеном и фаговой частицей), когда для повышения аффинности отобранных антител против IL-12 использовали способы фагового дисплея, при достижении определенного уровня аффинности (т.е. аффинности антитела Y61). Следовательно, антитела с еще более высокой аффинностью нельзя было отобрать способами фагового дисплея. Таким образом, по меньшей мере для определенных антител или антигенов способы фагового дисплея являются ограниченными в отношении их способности отбирать антитела с исключительно повышенной специфичностью/аффинностью связывания. Исходя из этого, для преодоления данного ограничения был разработан способ, называемый подходом селективного мутагенеза, который не требует созревания аффинности антител в фаговом дисплее, и он предусматривается изобретением. Хотя этот подход селективного мутагенеза был разработан для преодоления ограничений, связанных с использованием системы фагового дисплея, следует отметить, что этот способ также можно использовать с системой фагового дисплея. Более того, подход селективного мутагенеза можно использовать для повышения активности любого антитела.
Для повышения активности (например, аффинности или нейтрализующей активности) антитела в идеальном случае могла бы быть желательной мутация каждого положения CDR как в тяжелой, так и в легкой цепях на каждый возможный аминокислотный остаток. Однако поскольку, в среднем, в антителе существует 70 положений CDR, такой подход является очень длительным и трудоемким. Таким образом, способ по изобретению позволяет повысить активность антитела мутацией только определенных выбранных остатков в CDR тяжелой и/или легкой цепи. Более того, способ по изобретению позволяет повысить активность антитела без влияния на какие-либо желаемые свойства антитела.
Аминокислотные остатки вариабельной области антитела, которые контактируют с антигеном, нельзя точно определить исходя из их первичной последовательности или положений в вариабельной области. Тем не менее, выравнивание последовательностей антител с различной специфичностью, проведенное Kabat et al., привело к идентификации CDR в качестве локальных областей в вариабельных областях, которые значительно отличаются среди антител (Kabat et al. (1971) Ann. NY Acad, Sci. 190:382-393, Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Исследования структуры показали, что антигенсвязывающая поверхность образуется аминокислотными остатками, присутствующими в CDR. Также известно, что другие аминокислотные остатки вне CDR играют структурные роли или непосредственно вовлечены в связывание антигена. Таким образом, для каждой пары антиген-антитело аминокислотные остатки внутри и вне CDR могут быть важными.
Исследования выравнивания последовательностей, проведенные Tomlison et al, позволили идентифицировать ряд положений в CDR1 и CDR2 тяжелой и легкой цепи и в части CDR3 цепи каппа, которые являются частыми участками соматической мутации. (Tomlison et al (1996) J. Mol. Biol. 256: 813-817). В частности, положения H31, H31B, H33, H33B, H52B, H56, H58, L30, L31, L31A, L50, L53, L91, L92, L93 и L94 были идентифицированы в качестве частых участков соматической мутации. Однако этот анализ исключает важные области CDR3 тяжелой цепи и участки CDR3 легкой цепи, которые, как известно, лежат в центре участка связывания антитела и потенциально обеспечивают важные взаимодействия с антигеном. Более того, Tomlison et al. предполагают, что соматическое разнообразие отдельно не обязательно предопределяет роль конкретной аминокислоты в связывании антигена и указывает на консервативные аминокислотные остатки, которые контактируют с антигеном, и различные аминокислотные остатки, которые не контактируют с антигеном. Это заключение дополнительно подтверждено мутационными исследованиями роли соматических мутаций в аффинности антител (Sharon, (1990), PNAS, 87:4814-7). Девятнадцать соматических мутаций в высокоаффинном антителе против п-азофениларсоната (Ars) одновременно заменяли их соответствующими эмбриональными остатками, получая эмбриональный вариант антитела против Ars, который имел снижение активности в двести раз. Антитело против Ars с полной аффинностью можно было получить восстановлением только трех из девятнадцати соматических мутаций, что указывает на то, что могут быть допустимы многие соматические мутации, которые не участвуют в антигенсвязывающей активности.
Этот результат может быть частично объяснен самой природой разнообразия антител. Незрелые B-клетки могут продуцировать исходно низкоаффинные антитела, которые распознают ряд собственных или несобственных антигенов. Более того, антитела могут подвергаться в процессе созревания аффинности варьированию последовательностей, которое может приводить к аутореактивности. Гипермутация таких низкоаффинных антител может служить для устранения аутореактивности ("отрицательная селекция") и повышения аффинности к чужеродному антигену. Таким образом, анализ первичных и структурных данных большого количества антител не обеспечивает способ предсказания ни (1) роли участков соматической гипермутации в процессе созревания аффинности относительно процесса снижения аффинности к нежелательным антигенам, ни (2) того, как данная аминокислота участвует в свойствах конкретной пары антиген-антитело.
Были предприняты другие попытки определить роль конкретных аминокислотных остатков в распознавании антигена путем анализа ряда кристаллических структур комплексов антиген-антитело (MacCallum et al. (1996) J. Mol. Biol. 262: 732-745). Была показана возможная роль положений, расположенных внутри и вне CDR. Положения в CDR, вовлеченные в связывание антигена в более чем 10 из 26 анализированных структур, включали H31, H33, H50, H52, H53, H54, H56, H58, H95, H96, H97, H98 и H100 в тяжелой цепи и L30A, L32, L91, L92, L93, L94, L96 в легкой цепи. Однако авторы отметили, что предсказание контактов с антигеном с использованием этих и других структурных данных может переоценить и недооценить положения контакта, приводя к предположению, что в отношении разных антигенов может быть необходимо применять различные стратегии.
Pini et al. описывают рандомизацию множества остатков в последовательностях CDR антитела в крупной библиотеке фагового дисплея для быстрого повышения аффинности антитела (Pini et al. (1998) J. Biol Chem. 273: 21769-21776). Однако высокоаффинные антитела, рассмотренные Pini et al., имели мутации всего в восьми положениях, и редукционный анализ этих изменений, абсолютно необходимый для повышения аффинности антитела, становится непрактичным по причине большого числа возможных комбинаций, подлежащих тестированию, для наименьшего числа требуемых аминокислот.
Более того, рандомизация множества остатков не обязательно сохраняет другие желательные свойства антитела. Желательные свойства или характеристики антитела являются известными в данной области и включают, например, сохранение отсутствия перекрестной реактивности, например, с другими белками или тканями человека, и сохранение последовательностей антитела, которые близки эмбриональным последовательностям иммуноглобулинов человека, для повышения эффективности нейтрализации. Другие желательные свойства или характеристики включают способность сохранять видовую перекрестную реактивность, способность сохранять специфичность к эпитопу и способность сохранять высокие уровни экспрессии белка в клетках млекопитающих. Желательные свойства или характеристики можно выявлять или измерять с использованием известных в данной области способов, включая, но ими не ограничиваясь, ELISA, конкурентный ELISA, анализы нейтрализации in vitro и in vivo (см., например, пример 3 патента США № 6914128), иммуногистохимию со срезами тканей из различных источников, включая человека, приматов или другие источники, в зависимости от необходимости, и исследование экспрессии в клетках млекопитающих с использованием временной экспрессии или стабильной экспрессии.
Кроме того, способом Pini et al. можно вносить большее количество изменений, чем минимальное количество, в действительности требуемое для повышения аффинности, и он может привести к антителам, запускающим образование антител против антител человека (HAMA) у людей. Кроме того, как рассмотрено в других документах, фаговый дисплей, как продемонстрировано в настоящем документе, или другой сходный способ, включая рибосомный дисплей, могут не работать надлежащим образом при достижении определенной аффинности между антителом и антигеном, и условия, требуемые для достижения равновесия, могут не быть установлены в соответствующее временные рамки вследствие дополнительных взаимодействий, включающих взаимодействия с другими фаговыми или рибосомными компонентами и антигеном.
Специалист в данной области может подобрать интересующую научную информацию об источнике разнообразия антител из указаний в ссылках, приведенных выше. Однако настоящее изобретение обеспечивает способ повышения аффинности антитела в конкретной паре антиген-антитело при сохранении других необходимых признаков или желательных характеристик антитела. Это особенно важно при учете желательности придания конкретному антителу множества различных характеристик, включая связывание антигена.
Если исходное антитело обладает желаемыми свойствами или характеристиками, которые необходимо сохранить, подход селективного мутагенеза может быть лучшей стратегией для сохранения этих желательных свойств при повышении активности антитела. Например, при мутагенезе Y61 цель состояла в повышении аффинности к hIL-12 и в повышении эффективности антитела в отношении нейтрализации при сохранении желательных свойств. Желательные свойства Y61 включали (1) сохранение отсутствия перекрестной реактивности с другими белками или тканями человека, (2) сохранение высокой специфичности к эпитопу, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p70 (p40/p35), тем самым предотвращая препятствование связыванию свободным растворимым p40; и (3) получение антитела с аминокислотными последовательностями тяжелой и легкой цепи, которые максимально сходны с их соответствующими эмбриональными последовательностями иммуноглобулинов.
В одном варианте осуществления способ по изобретению предусматривает подход селективного мутагенеза в качестве стратегии сохранения желательных свойств или характеристик антитела при повышении аффинности и/или эффективности нейтрализации. Термин "подход селективного мутагенеза" определен выше и включает способ индивидуальной мутации выбранных аминокислотных остатков. Аминокислотные остатки, подлежащие мутации, сначала можно выбрать из предпочтительных положений для селективного мутагенеза, затем из положений контакта, а затем из положений гипермутации. Индивидуальное выбранное положение можно подвергать мутации по меньшей мере на два других аминокислотных остатка, и можно определять эффект мутации как на желательные свойства антитела, так и на повышение активности антитела.
Подход селективного мутагенеза включает следующие стадии:
отбор положений-кандидатов в таком порядке: 1) предпочтительные положения для селективного мутагенеза; 2) положения контакта; 3) положения гипермутации и ранжирование положений исходя из расположения положения в вариабельных областях тяжелой и легкой цепи антитела (CDR3 предпочтительнее, чем CDR2, CDR2 предпочтительнее, чем CDR1);
внесение индивидуальных мутаций в выбранные предпочтительные положения для селективного мутагенеза, положения гипермутации и/или контакта в порядке ранжирования на все возможные другие аминокислотные остатки и анализ эффекта индивидуальных мутаций на активность антитела для определения усиливающих активность аминокислотных остатков;
если необходимо, получение пошаговых комбинаций отдельных усиливающих активность аминокислотных остатков и анализ эффекта различных комбинаций на активность антител; выбор мутантных антител с усиливающими активность аминокислотными остатками и ранжирование мутантных антител на основе расположения и идентичности аминокислотных замен по отношению к их иммуногенному потенциалу. Наиболее высокий ранг присваивают мутантным антителам, которые содержат аминокислотную последовательность, которая практически идентична последовательности вариабельной области, которая описана в базе данных эмбриональных последовательностей или имеет аминокислотную последовательность, которая сравнима с другими антителами человека. Более низкий ранг присваивают мутантным антителам, содержащим аминокислотную замену, которая редко встречается как в эмбриональных последовательностях, так и в других последовательностях антител человека. Наиболее низкий ранг присваивают мутантным антителам с аминокислотной заменой, которая не встречается в эмбриональной последовательности или в последовательности другого антитела человека. Как указано выше, мутантные антитела, содержащие по меньшей мере один усиливающий активность аминокислотный остаток, расположенный в CDR3, являются предпочтительными относительно мутантных антител, содержащих по меньшей мере один усиливающий активность аминокислотный остаток, расположенный в CDR2, которые являются предпочтительными относительно мутантных антител, содержащих по меньшей мере один усиливающий активность аминокислотный остаток, расположенный в CDR1. CDR вариабельных областей тяжелой цепи являются предпочтительными по сравнению с CDR вариабельной области легкой цепи.
Также мутантные антитела можно исследовать в отношении повышения активности, например, по сравнению с их соответствующим исходным антителом. Повышение активности мутантного антитела можно определять, например, с помощью анализов нейтрализации или по специфичности/аффинности связывания в анализе поверхностного плазмонного резонанса (см. пример 3 патента США № 6914128). Предпочтительно, повышение активности может быть по меньшей мере в 2-20 раз по сравнению с исходным антителом. Повышение активности может составлять по меньшей мере от "x1" до "x2" раз по сравнению с исходным антителом, где "x1" и "x2" представляют собой целые числа между и включая 2-20, включая диапазоны в указанном интервале, например 2-15, например 5-10.
Мутантные антитела с усиливающим активность аминокислотным остатком также можно исследовать для определения того, может ли по меньшей мере одно другое желательное свойство сохраниться после мутации. Например, антитела против hIL-12 можно тестировать в отношении (1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, (2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p70 (p40/p35), тем самым предотвращая препятствование связыванию свободным растворимым p40; и (3) получения антител с аминокислотными последовательностями тяжелой и легкой цепи, которые максимально сходны с их соответствующими эмбриональными последовательностями иммуноглобулинов, и определения того, какое из них будет с наименьшей вероятностью вызывать иммунный ответ, исходя из количества отличий от эмбриональной последовательности. Те же наблюдения могут быть сделаны для антитела, имеющего более одного усиливающего активность аминокислотного остатка, например, по меньшей мере два или по меньшей мере три усиливающих активность аминокислотных остатка, чтобы определить, произошло ли сохранение желаемого свойства или характеристики.
Пример применения "подхода селективного мутагенеза" в мутагенезе Y61 описан ниже. Каждая из индивидуальных мутаций H31S→E, L50→Y или L94G→Y повышала нейтрализующую активность антитела. Однако когда тестировали комбинированные клоны, активность комбинированного клона H31S→E+L50→Y+L94G→Y была не лучше, чем у L50→Y+L94G→Y (J695). Таким образом, замена эмбрионального аминокислотного остатка Ser на Glu в положении 31 CDR1 не была необходимой для повышения активности J695 относительно Y61. С использованием подхода селективного мутагенеза, таким образом, идентифицируют минимальное число изменений, которые приводят к конечной активности, тем самым снижая иммуногенный потенциал конечного антитела и сохраняя другие желательные свойства антитела.
Выделенную ДНК, кодирующую VH и VL, полученные с использованием подхода селективного мутагенеза, можно превращать в гены цепей полноразмерного антитела, в гены Fab-фрагментов, а также в ген scFV, как описано в разделе IV. Для экспрессии VH- и VL-областей, полученных с использованием подхода селективного мутагенеза, экспрессирующие векторы, кодирующие тяжелую и легкую цепь, можно трансфицировать в различные клетки-хозяева, как подробно описано в разделе IV. Предпочтительные клетки-хозяева включают либо прокариотические клетки-хозяева, например, E coli, либо эукариотические клетки-хозяева, например, клетки дрожжей, например, S.cerevisae. Наиболее предпочтительными эукариотическими клетками-хозяевами являются клетки-хозяева млекопитающих, подробно описанные в разделе IV.
Подход селективного мутагенеза обеспечивает способ получения антител с повышенной активностью без предшествующего созревания аффинности антитела другими способами. Подход селективного мутагенеза обеспечивает способ получения антител с повышенной аффинностью, которые были подвергнуты обратным мутациям. Также подход селективного мутагенеза обеспечивает способ повышения активности антител после созревания аффинности.
Специалисту в данной области будет понятно, что подход селективного мутагенеза можно использовать в стандартных способах манипуляций с антителами, известных в данной области. Их примеры включают, но не ограничиваются ими, антитела с пересаженной CDR, химерные антитела, scFV-фрагменты, Fab-фрагменты полноразмерных антител и антител человека из других источников, например, трансгенных мышей.
Быстрый крупномасштабный мутационный анализ антител включает транскрипцию и трансляцию in vitro с использованием технологии рибосомного дисплея (см., например, Hanes et al., (1997) Proc. Natl. Acad. Sci. 94: 4937-4942; Dall Acqua et al.,(1998) Curr. Opin. Struc. Biol. 8: 443-450; He et al., (1997) Nucleic Acid Res. 25: 5132-5134), и патенты США №№ 5643768 и 5658754, выданные Kawasaki. Подход селективного мутагенеза также обеспечивает способ получения антител с повышенной активностью, которые можно отбирать с использованием технологий рибосомного дисплея.
В способах по изобретению антитела или их антигенсвязывающие части дополнительно модифицируют путем изменения отдельных положений в CDR HCVR и/или LCVR. Хотя эти модификации можно проводить в антителах, полученных способом фагового дисплея, способ является преимущественным в том, что его можно проводить с помощью антител, которые экспрессируются в других типах систем хозяев, таких как экспрессирующие системы бактерий, дрожжей или клеток млекопитающих. Выбор индивидуальных положений в CDR для модификации основан на положениях, представляющих собой положение контакта и/или гипермутации.
Предпочтительные положения контакта и положения гипермутации, как определено в настоящем документе, представлены в таблице 3 патента США № 6914128 (см. приложение A патента США № 6914128 и таблицу 3 приложения A к нему), и их модификация согласно способу по изобретению подробно описана в примере 2 патента США № 6914128. Предпочтительные положения контакта выбраны из группы, состоящей из H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96. Предпочтительные положения гипермутации выбраны из группы, состоящей из H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 и L93. Более предпочтительные аминокислотные остатки (называемые "предпочтительными положениями для селективного мутагенеза") представляют собой как положения контакта, так и положения гипермутации, и они выбраны из группы, состоящей из H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94. Особенно предпочтительные положения контакта выбраны из группы, состоящей из L50 и L94.
Предпочтительные усиливающие активность аминокислотные остатки заменяют аминокислотные остатки, расположенные в положениях, выбранных из группы, состоящей из H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96. Более предпочтительные усиливающие активность аминокислотные остатки заменяют аминокислотные остатки, расположенные в положениях H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94. Особенно предпочтительные усиливающие активность аминокислотные остатки заменяют аминокислотные остатки, расположенные в положениях, выбранных из группы, состоящей из L50 и L94.
Как правило, способ по изобретению включает выбор конкретного предпочтительного положения для селективного мутагенеза, положения контакта и/или гипермутации в CDR тяжелой или легкой цепи представляющего интерес исходного антитела или его антигенсвязывающей части, случайный мутагенез этого индивидуального положения (например, способами генетики с использованием мутагенного олигонуклеотида для создания "малой библиотеки" модифицированных антител) или мутацию положения на конкретные желаемые аминокислоты для идентификации усиливающих активность аминокислотных остатков, экспрессию и очистку модифицированных антител (например, в системе-хозяине, не являющейся фаговым дисплеем), измерение активности модифицированных антител в отношении антигена (например, путем измерения констант koff в анализе BIAcore), повторение этих стадий для других положений CDR, при необходимости, и комбинирование индивидуальных мутаций, для которых показано наличие повышенной активности, и тестирование того, дает ли комбинация(и) антитело с еще большей активностью (например, аффинностью или эффективностью нейтрализации), чем у исходного антитела или его антигенсвязывающей части.
Таким образом, в одном варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление исходного антитела или его антигенсвязывающей части;
b) селекцию по порядку 1) предпочтительного положения для селективного мутагенеза, 2) положения контакта или 3) положения гипермутации в определяющей комплементарность области (CDR) для мутации, тем самым идентифицируя выбранное предпочтительное положение для селективного мутагенеза, положение контакта или гипермутации;
c) мутацию по отдельности указанных выбранных предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части;
e) необязательно, повторение стадий a)-d) для по меньшей мере одного другого предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации;
f) комбинирование в исходном антителе или его антигенсвязывающей части индивидуальных мутаций, для которых показано наличие повышенной активности, с получением комбинированных антител или их антигенсвязывающих частей; и
g) оценку активности комбинированных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части;
пока не получат антитело или его антигенсвязывающую часть с повышенной активностью относительно исходного антитела или его антигенсвязывающей части. Предпочтительно, выбранное антитело или антитела имеют повышенную активность без потери или с сохранением по меньшей мере одной желаемой характеристики или свойства исходного антитела, как описано выше. Желаемая характеристика или свойство могут быть измерены или выявлены специалистом в данной области с использованием способов, известных в данной области.
Предпочтительные положения контакта выбраны из группы, состоящей из H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96. Предпочтительные положения гипермутации выбраны из группы, состоящей из H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 и L93. Более предпочтительные положения для селективного мутагенеза выбраны из группы, состоящей из H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93 и L94. Особенно предпочтительные положения контакта выбраны из группы, состоящей из L50 и L94.
В другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление исходного антитела или его антигенсвязывающей части;
b) выбор предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации в определяющей комплементарность области (CDR) для мутации;
c) мутацию по отдельности указанных выбранных предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) необязательно, повторение стадий a)-d) для по меньшей мере одного другого предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации;
f) комбинирование в исходном антителе или его антигенсвязывающей части двух индивидуальных усиливающих активность аминокислотных остатков, для которых показано наличие повышенной активности, с получением комбинированных антител или их антигенсвязывающих частей; и
g) оценку активности комбинированных антител или их антигенсвязывающих частей с двумя усиливающими активность аминокислотными остатками относительно исходного антитела или его антигенсвязывающей части;
пока не получат антитело или его антигенсвязывающую часть с повышенной активностью относительно исходного антитела или его антигенсвязывающей части.
Предпочтительные положения контакта выбраны из группы, состоящей из H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96. Предпочтительные положения гипермутации выбраны из группы, состоящей из H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 и L93. Более предпочтительные положения для селективного мутагенеза выбраны из группы, состоящей из H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93 и L94. Особенно предпочтительные положения контакта выбраны из группы, состоящей из L50 и L94.
В другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление исходного антитела или его антигенсвязывающей части;
b) выбор предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации в определяющей комплементарность области (CDR) для мутации;
c) мутацию по отдельности указанных выбранных предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) необязательно, повторение стадий a)-d) для по меньшей мере одного другого предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации;
f) комбинирование в исходном антителе или его антигенсвязывающей части трех индивидуальных усиливающих активность аминокислотных остатков, для которых показано наличие повышенной активности, с получением комбинированных антител или их антигенсвязывающих частей; и
g) оценку активности комбинированных антител или их антигенсвязывающих частей с двумя усиливающими активность аминокислотными остатками относительно исходного антитела или его антигенсвязывающей части;
пока не получат антитело или его антигенсвязывающую часть с повышенной активностью относительно исходного антитела или его антигенсвязывающей части.
Предпочтительно, усиливающий активность аминокислотный остаток заменяет аминокислотные остатки, расположенные в положениях, выбранных из группы, состоящей из H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96.
После мутагенеза отдельных выбранных положений мутантные клоны можно секвенировать для идентификации аминокислотных остатков, которые были внесены в выбранное положение в каждом клоне. Небольшое количество клонов (например, приблизительно 24) можно отбирать для секвенирования, которое статистически должно дать 10-15 уникальных антител, в то время как большие количества клонов (например, более 60) можно секвенировать, чтобы убедиться в том, что идентифицированы антитела с каждой возможной заменой в выбранном положении.
В одном варианте осуществления для мутагенеза сначала выбирают положения контакта и/или гипермутации в областях CDR3 тяжелой и/или легкой цепей. Однако для антител, которые уже были подвергнуты созреванию аффинности in vitro случайным мутагенезом областей CDR3, проведенным посредством селекции с помощью фагового дисплея, может быть предпочтительным первоначальный выбор положений контакта и/или гипермутации в CDR1 или CDR2 тяжелой и/или легкой цепи.
В более предпочтительном варианте осуществления для мутагенеза сначала выбирают предпочтительные положения для селективного мутагенеза в областях CDR3 тяжелой и/или легкой цепей. Однако для антител, которые уже были подвергнуты созреванию аффинности in vitro случайным мутагенезом областей CDR3, проведенным посредством селекции с помощью фагового дисплея, может быть предпочтительным первоначальный выбор предпочтительных положений для селективного мутагенеза в CDR1 или CDR2 тяжелой и/или легкой цепи.
В другом предпочтительном варианте осуществления оптимизацию выбранного антитела с помощью подхода селективного мутагенеза проводят последовательно следующим образом: каждое из предпочтительных положений для селективного мутагенеза, выбранных из группы, состоящей из H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94, сначала подвергают мутации на по меньшей мере 2 других аминокислоты (предпочтительно на 5-14 других аминокислот) и полученные антитела характеризуют в отношении повышенной аффинности, эффективности нейтрализации (и, возможно, также в отношении по меньшей мере одной другой сохраненной характеристики или свойства, рассмотренных в настоящем документе). Если мутация одного предпочтительного положения для селективного мутагенеза не повышает совсем или в достаточной степени аффинность или эффективность нейтрализации, и если даже комбинация нескольких усиливающих активность аминокислот, заменяющих аминокислоты в предпочтительных положениях для селективного мутагенеза, не приводит к комбинированному антителу, которое обладает заданной активностью (включая аффинность и/или эффективность нейтрализации), то можно выбрать дополнительные аминокислотные остатки для селективного мутагенеза из группы, состоящей из H35, H50, H53, H54, H95, H96, H97, H98, L30A и L96, подвергнуть каждый из них мутации по меньшей мере на 2 другие аминокислоты (предпочтительно на 5-14 других аминокислот) и полученные антитела характеризовать в отношении повышенной аффинности, эффективности нейтрализации (и, возможно, также в отношении по меньшей мере одной другой сохраненной характеристики или свойства, рассмотренных в настоящем документе).
Если мутация одного аминокислотного остатка, выбранного из группы, состоящей из H35, H50, H53, H54, H95, H96, H97, H98, L30A и L96, не повышает совсем или в достаточной степени активность (включая аффинность и/или эффективность нейтрализации), и если даже комбинация нескольких усиливающих активность аминокислот, заменяющих аминокислоты в предпочтительных положениях для селективного мутагенеза, не приводит к комбинированному антителу, которое обладает заданной активностью (включая аффинность и/или заданную эффективность нейтрализации), можно выбрать дополнительные аминокислотные остатки для селективного мутагенеза из группы, состоящей из H33B, H52B, L31A, подвергнуть каждый из них мутации по меньшей мере на 2 другие аминокислоты (предпочтительно на 5-14 других аминокислот) и полученные антитела характеризовать в отношении повышенной аффинности, эффективности нейтрализации (и, возможно, также в отношении по меньшей мере одной другой сохраненной характеристики или свойства, рассмотренных в настоящем документе).
Следует понимать, что последовательный подход селективного мутагенеза может завершаться на любой из стадий, приведенных выше, как только будет идентифицировано антитело с желаемой активностью (включая аффинность и эффективность нейтрализации). Если при мутагенезе предварительно выбранных положений идентифицированы усиливающие активность аминокислотные остатки, но комбинированное антитело все еще не обладает заданной активностью (включая аффинность и эффективность нейтрализации), и/или если идентифицированные усиливающие активность аминокислоты также влияют на другие желаемые характеристики и, таким образом, не приемлемы, то можно подвергнуть мутагенезу остальные остатки CDR (см. раздел IV).
Способ по изобретению можно использовать для повышения активности антитела или его антигенсвязывающей части для достижения предопределенной заданной активности (например, предопределенной аффинности и/или эффективности нейтрализации, и/или желаемого свойства или характеристики).
Таким образом, изобретение относится к способу повышения активности антитела или его антигенсвязывающей части для достижения предопределенной заданной активности, включающему:
a) предоставление исходного антитела или его антигенсвязывающей части;
b) выбор предпочтительного положения для селективного мутагенеза, выбранного из группы, состоящей из H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94;
c) мутацию по отдельности выбранного предпочтительного положения для селективного мутагенеза по меньшей мере на два других аминокислотных остатка, создавая, тем самым, первую панель мутантных антител или их антигенсвязывающих частей;
d) оценку активности первой панели мутантных антител или их антигенсвязывающих частей, чтобы определить, приводит ли мутация одного положения для селективного мутагенеза к антителу или его антигенсвязывающей части с предопределенной заданной активностью или частичной заданной активностью;
e) комбинирование пошаговым образом в исходном антителе или его антигенсвязывающей части индивидуальных мутаций, для которых показано, что они имеют повышенную активность, с получением комбинированных антител или их антигенсвязывающих частей;
f) оценку активности комбинированных антител или их антигенсвязывающих частей, чтобы определить, имеют ли комбинированные антитела или их антигенсвязывающие части предопределенную заданную активность или частичную заданную активность;
g) если стадии d) или f) не приводят к антителу или его антигенсвязывающей части, имеющим предопределенную заданную активность, или приводят к антителу только с частичной активностью, то дополнительные аминокислотные остатки, выбранные из группы, состоящей из H35, H50, H53, H54, H95, H96, H97, H98, L30A и L96, подвергают мутации по меньшей мере на два других аминокислотных остатка, создавая, тем самым, вторую панель мутантных антител или их антигенсвязывающих частей;
h) оценку активности второй панели мутантных антител или их антигенсвязывающих частей, чтобы определить, приводит ли мутация одного аминокислотного остатка, выбранного из группы, состоящей из H35, H50, H53, H54, H95, H96, H97, H98, L30A и L96, к антителу или его антигенсвязывающей части, имеющим предопределенную заданную активность или частичную активность;
i) комбинирование пошаговым образом в исходном антителе или его антигенсвязывающей части отдельных мутаций стадии g), для которых показано наличие повышенной активности, с получением комбинированных антител или их антигенсвязывающих частей;
j) оценку активности комбинированных антител или их антигенсвязывающих частей, чтобы определить, имеют ли комбинированные антитела или их антигенсвязывающие части предопределенную заданную активность или частичную заданную активность;
k) если стадии h) или j) не приводят к антителу или его антигенсвязывающей части, имеющим предопределенную заданную активность, или приводят к антителу только с частичной активностью, то дополнительные аминокислотные остатки, выбранные из группы, состоящей из H33B, H52B и L31A, подвергают мутации по меньшей мере на два других аминокислотных остатка, создавая, тем самым, третью панель мутантных антител или их антигенсвязывающих частей;
l) оценку активности третьей панели мутантных антител или их антигенсвязывающих частей, чтобы определить, приводит ли мутация одного аминокислотного остатка, выбранного из группы, состоящей из H33B, H52B и L31A, к антителу или его антигенсвязывающей части, имеющим предопределенную заданную активность или частичную активность;
m) комбинирование пошаговым образом в исходном антителе или его антигенсвязывающей части отдельных мутаций стадии k), для которых показано наличие повышенной активности, с получением комбинированных антител или их антигенсвязывающих частей;
n) оценку активности комбинированных антител или их антигенсвязывающих частей, чтобы определить, имеют ли комбинированные антитела или их антигенсвязывающие части предопределенную заданную активность, получая, тем самым, антитело или его антигенсвязывающую часть с предопределенной заданной активностью.
Можно использовать ряд способов мутагенеза, включая ПЦР со сборкой, Kunkel (dut-ung-) и тиофосфатный (набор Amersham Sculptor kit) олигонуклеотид-направленный мутагенез.
Для экспрессии мутантных антител можно использовать широкое множество экспрессирующих систем хозяев, включая экспрессирующие системы бактерий, дрожжей, бакуловирусов и млекопитающих (а также экспрессирующие системы фагового дисплея). Примером подходящего бактериального экспрессирующего вектора является pUC119(Sfi). Другие экспрессирующие системы антител известны в данной области и/или описаны ниже в разделе IV.
Модифицированные антитела или их антигенсвязывающие части, полученные способом по изобретению, можно идентифицировать, не основываясь на способах фагового дисплея для отбора. Таким образом, способ по изобретению является особенно преимущественным для повышения активности рекомбинантного исходного антитела или его антигенсвязывающей части, которые были получены путем отбора в системе фагового дисплея, но активность которых не может быть дополнительно повышена мутагенезом в системе фагового дисплея.
Таким образом, в другом варианте осуществления изобретение относится к способу повышения аффинности антитела или его антигенсвязывающей части, включающему:
a) предоставление рекомбинантного исходного антитела или его антигенсвязывающей части, которые были получены отбором в системе фагового дисплея, но активность которых нельзя дополнительно повысить мутагенезом в указанной системе фагового дисплея;
b) выбор предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации в определяющей комплементарность области (CDR) для мутации, тем самым идентифицируя выбранное положение контакта или гипермутации;
c) мутацию по отдельности указанных выбранных предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей и экспрессию указанной панели в системе не фагового дисплея;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части;
e) необязательно, повторение стадий b)-d) для по меньшей мере одного другого предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации;
f) комбинирование в исходном антителе или его антигенсвязывающей части индивидуальных мутаций, для которых показано наличие повышенной активности, с получением комбинированных антител или их антигенсвязывающих частей; и
g) оценку активности комбинированных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части;
пока не получат антитело или его антигенсвязывающую часть с повышенной активностью относительно исходного антитела или его антигенсвязывающей части.
Предпочтительные положения контакта выбраны из группы, состоящей из H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96. Предпочтительные положения гипермутации выбраны из группы, состоящей из H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 и L93. Более предпочтительные положения для селективного мутагенеза выбраны из группы, состоящей из H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93 и L94. Особенно предпочтительные положения контакта выбраны из группы, состоящей из L50 и L94.
С помощью доступных способов невозможно или крайне трудно получить антитело с повышенной аффинностью связывания и эффективностью нейтрализации при сохранении других свойств или характеристик антител, как рассмотрено выше. Однако способом по данному изобретению можно легко идентифицировать такие антитела. Антитела, подвергаемые способу по данному изобретению, могут быть получены из любого источника.
Таким образом, в другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление рекомбинантного исходного антитела или его антигенсвязывающей части;
b) выбор предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации в определяющей комплементарность области (CDR) для мутации, тем самым идентифицируя выбранное предпочтительное положение для селективного мутагенеза, положение контакта или гипермутации;
c) мутацию по отдельности указанных выбранных предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей и экспрессию указанной панели в соответствующей экспрессирующей системе;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) оценку панели мутантных антител или их антигенсвязывающих частей, относительно исходного антитела или его антигенсвязывающей части, в отношении по меньшей мере одного другого свойства или характеристики, где свойство или характеристика являются такими, которые необходимо сохранить в антителе;
пока не получат антитело или его антигенсвязывающую часть с повышенной активностью и по меньшей мере одним сохраненным свойством или характеристикой относительно исходного антитела или его антигенсвязывающей части.
В предпочтительном варианте осуществления положения контакта выбраны из группы, состоящей из H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В другом предпочтительном варианте осуществления положения гипермутации выбраны из группы, состоящей из H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 и L93, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В более предпочтительном варианте осуществления остатки для селективного мутагенеза выбраны из предпочтительных положений для селективного мутагенеза, выбранных из группы, состоящей из H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В более предпочтительном варианте осуществления положения контакта выбраны из группы, состоящей из L50 и L94, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
Если, таким образом, аффинность антитела к конкретному антигену необходимо повысить, но если способ фагового дисплея (или сходная система, включающая рибосомный дисплей) более не применим, а другие желательные свойства или характеристики должны быть сохранены, то можно использовать способ по изобретению. Исходя из этого, в другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление рекомбинантного исходного антитела или его антигенсвязывающей части, которые были получены отбором в системе фагового дисплея, но активность которых нельзя дополнительно повысить мутагенезом в указанной системе фагового дисплея;
b) выбор предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации в определяющей комплементарность области (CDR) для мутации, тем самым идентифицируя выбранное предпочтительное положение для селективного мутагенеза, положение контакта или гипермутации;
c) мутацию по отдельности указанных выбранных предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей и экспрессию указанной панели в системе не фагового дисплея;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) оценку панели мутантных антител или их антигенсвязывающих частей, относительно исходного антитела или его антигенсвязывающей части, в отношении по меньшей мере одного другого свойства или характеристики, где свойство или характеристика представляют собой свойство или характеристику, которые необходимо сохранить, пока не получат антитело или его антигенсвязывающую часть с повышенной активностью и по меньшей мере одним сохраненным свойством или характеристикой относительно исходного антитела или его антигенсвязывающей части;
f) необязательно, повторение стадий a)-e) для по меньшей мере одного другого предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации;
g) комбинирование в исходном антителе или его антигенсвязывающей части по меньшей мере двух индивидуальных усиливающих активность аминокислотных остатков, для которых показано наличие повышенной активности и по меньшей мере одного сохраненного свойства или характеристики, с получением комбинированных антител или их антигенсвязывающих частей; и
h) оценку активности комбинированных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части;
пока не получат антитело или его антигенсвязывающую часть с повышенной активностью и по меньшей мере одним сохраненным свойством или характеристикой относительно исходного антитела или его антигенсвязывающей части.
В предпочтительном варианте осуществления положения контакта выбраны из группы, состоящей из H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В другом предпочтительном варианте осуществления положения гипермутации выбраны из группы, состоящей из H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 и L93, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В более предпочтительном варианте осуществления остатки для селективного мутагенеза выбраны из предпочтительных положений для селективного мутагенеза, выбранных из группы, состоящей из H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В более предпочтительном варианте осуществления положения контакта выбраны из группы, состоящей из L50 и L94, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление рекомбинантного исходного антитела или его антигенсвязывающей части, которые были получены отбором в системе фагового дисплея, но активность которых нельзя дополнительно повысить мутагенезом в указанной системе фагового дисплея;
b) выбор предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации в определяющей комплементарность области (CDR) для мутации, тем самым идентифицируя выбранное положение контакта или гипермутации;
c) мутацию по отдельности указанных выбранных предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей и экспрессию указанной панели в системе не фагового дисплея;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) оценку панели мутантных антител или их антигенсвязывающих частей, относительно исходного антитела или его антигенсвязывающей части, в отношении по меньшей мере одного другого свойства или характеристики, где свойство или характеристика представляют собой свойство или характеристику, которые необходимо сохранить, пока не получат антитело или его антигенсвязывающую часть с повышенной активностью и по меньшей мере одним сохраненным свойством или характеристикой относительно исходного антитела или его антигенсвязывающей части.
В предпочтительном варианте осуществления положения контакта выбраны из группы, состоящей из H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В другом предпочтительном варианте осуществления положения гипермутации выбраны из группы, состоящей из H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 и L93, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В более предпочтительном варианте осуществления остатки для селективного мутагенеза выбраны из предпочтительных положений для селективного мутагенеза, выбранных из группы, состоящей из H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В более предпочтительном варианте осуществления положения контакта выбраны из группы, состоящей из L50 и L94, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление рекомбинантного исходного антитела или его антигенсвязывающей части, которые были получены отбором в системе фагового дисплея, но активность которых нельзя дополнительно повысить мутагенезом в указанной системе фагового дисплея;
b) выбор предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации в определяющей комплементарность области (CDR) для мутации, тем самым идентифицируя выбранное положение контакта или гипермутации;
c) мутацию по отдельности указанных выбранных предпочтительных положений для селективного мутагенеза, положения контакта или гипермутации по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей и экспрессию указанной панели в системе не фагового дисплея;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) оценку панели мутантных антител или их антигенсвязывающих частей, относительно исходного антитела или его антигенсвязывающей части, в отношении по меньшей мере одного другого свойства или характеристики, где свойство или характеристика представляют собой свойство или характеристику, которые необходимо сохранить, пока не получат антитело или его антигенсвязывающую часть с повышенной активностью и по меньшей мере одной сохраненной характеристикой относительно исходного антитела или его антигенсвязывающей части;
f) необязательно, повторение стадий a)-e) для по меньшей мере одного другого предпочтительного положения для селективного мутагенеза, положения контакта или гипермутации;
g) комбинирование в исходном антителе или его антигенсвязывающей части по меньшей мере двух индивидуальных усиливающих активность аминокислотных остатков, для которых показано наличие повышенной активности и по меньшей мере одной сохраненной другой характеристики, с получением комбинированных антител или их антигенсвязывающих частей; и
h) оценку активности комбинированных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части;
пока не получат антитело или его антигенсвязывающую часть с повышенной активностью и по меньшей мере одним сохраненным свойством или характеристикой относительно исходного антитела или его антигенсвязывающей части.
В предпочтительном варианте осуществления положения контакта выбраны из группы, состоящей из H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В другом предпочтительном варианте осуществления положения гипермутации выбраны из группы, состоящей из H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 и L93, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В более предпочтительном варианте осуществления остатки для селективного мутагенеза выбраны из предпочтительных положений для селективного мутагенеза, выбранных из группы, состоящей из H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
В более предпочтительном варианте осуществления положения контакта выбраны из группы, состоящей из L50 и L94, и другая характеристика выбрана из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
IV. Модификации других остатков CDR
В конечном итоге, любыми способами идентифицировали все остатки CDR в данной паре антитело-антиген, требуемые в качестве усиливающих активность аминокислотных остатков и/или требуемые прямо или косвенно для связывания с антигеном и/или для сохранения других желательных свойств или характеристик антитела. Такие остатки CDR названы "предпочтительными положениями для селективного мутагенеза". Следует отметить, что в конкретных обстоятельствах предпочтительные остатки для селективного мутагенеза можно идентифицировать также другими способами, включая совместную кристаллизацию антитела и антигена и молекулярное моделирование.
Если исчерпываются предпочтительные попытки идентифицировать усиливающие активность аминокислоты, сфокусированные на предпочтительных положениях для селективного мутагенеза, положениях контакта или гипермутации, описанных выше, или если требуются дополнительные усовершенствования, то можно модифицировать остальные остатки CDR, как описано ниже. Следует понимать, что антитело уже может быть модифицированным в любом одном или нескольких положениях контакта или гипермутации согласно вариантам осуществления, рассмотренным выше, однако оно может требовать дополнительных усовершенствований. Таким образом, в другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление исходного антитела или его антигенсвязывающей части;
b) выбор аминокислотного остатка в определяющей комплементарность области (CDR) для мутации, отличного от H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96;
c) мутацию отдельно указанного выбранного положения, например, по меньшей мере на два других аминокислотных остатка, создавая, тем самым, мутантное антитело или панель мутантных антител или их антигенсвязывающих частей;
d) оценку активности мутантного антитела или панели мутантных антител, или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) оценку мутантного антитела или панели мутантных антител, или их антигенсвязывающих частей, относительно исходного антитела или его антигенсвязывающей части, в отношении изменений по меньшей мере одного свойства или характеристики, пока не получат антитело или его антигенсвязывающую часть с повышенной активностью относительно исходного антитела или его антигенсвязывающей части.
Предпочтительно, другая характеристика или свойство выбраны из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
Если мутагенез одного остатка не является достаточным, то можно включать другие остатки; таким образом, в другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление исходного антитела или его антигенсвязывающей части;
b) выбор аминокислотного остатка в определяющей комплементарность области (CDR) для мутации, отличного от H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96;
c) мутацию отдельно указанного выбранного положения по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) повторение стадий b)-d) для по меньшей мере одного другого положения CDR, которое не является ни положением, выбранным согласно b), ни положением H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96;
f) комбинирование в исходном антителе или его антигенсвязывающей части по меньшей мере двух индивидуальных усиливающих активность аминокислотных остатков, для которых показано наличие повышенной активности, с получением комбинированных антител или их антигенсвязывающих частей; и
g) оценку активности комбинированных антител или их антигенсвязывающих частей с двумя усиливающими активность аминокислотными остатками относительно исходного антитела или его антигенсвязывающей части, пока не получат антитело или его антигенсвязывающую часть с повышенной активностью относительно исходного антитела или его антигенсвязывающей части.
Если исчерпываются предпочтительные попытки идентифицировать усиливающие активность аминокислоты, сфокусированные на положениях контакта или гипермутации, описанных выше, или если требуются дополнительные усовершенствования и рассматриваемое антитело нельзя далее оптимизировать способами мутагенеза и фагового дисплея (или сходного с ним рибосомного дисплея), то можно модифицировать остальные остатки CDR, как описано ниже. Следует понимать, что антитело уже может быть модифицированным в любом одном или нескольких предпочтительных положениях для селективного мутагенеза, положениях контакта или гипермутации согласно вариантам осуществления, рассмотренным выше, однако оно может требовать дополнительных усовершенствований.
Таким образом, в другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление рекомбинантного исходного антитела или его антигенсвязывающей части, которые были получены отбором в системе фагового дисплея, но активность которых нельзя дополнительно повысить мутагенезом в указанной системе фагового дисплея;
b) выбор аминокислотного остатка в определяющей комплементарность области (CDR) для мутации, отличного от H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и;
c) мутацию отдельно указанного выбранного положения контакта или гипермутации по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей и экспрессию указанной панели в системе не фагового дисплея;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) оценку панели мутантных антител или их антигенсвязывающих частей, относительно исходного антитела или его антигенсвязывающей части, в отношении изменений по меньшей мере одного другого свойства или характеристики, пока не получат антитело или его антигенсвязывающую часть с повышенной активностью относительно исходного антитела или его антигенсвязывающей части.
Предпочтительно, другая характеристика или свойство выбраны из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
Если мутагенез одного остатка не является достаточным для повышения аффинности антитела, то в мутагенез могут быть включены другие остатки. Таким образом, в другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление исходного антитела или его антигенсвязывающей части, которые были получены отбором в системе фагового дисплея, но активность которых нельзя дополнительно повысить мутагенезом в указанной системе фагового дисплея;
b) выбор аминокислотного остатка в определяющей комплементарность области (CDR) для мутации, отличного от H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96;
c) мутацию по отдельности указанного выбранного положения по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей и экспрессию в системе не фагового дисплея;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) повторение стадий b)-d) для по меньшей мере одного другого положения, которое не является ни положением, выбранным согласно b), ни положением H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94;
g) комбинирование в исходном антителе или его антигенсвязывающей части по меньшей мере двух индивидуальных усиливающих активность аминокислотных остатков, для которых показано наличие повышенной активности, с получением комбинированных антител или их антигенсвязывающих частей; и
h) оценку активности и другого свойства или характеристики комбинированных антител или их антигенсвязывающих частей с двумя усиливающими активность аминокислотными остатками относительно исходного антитела или его антигенсвязывающей части;
пока не получат антитело или его антигенсвязывающую часть с повышенной активностью относительно исходного антитела или его антигенсвязывающей части.
Предпочтительно, другая характеристика или свойство выбраны из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
Предпочтительные попытки идентифицировать усиливающие активность аминокислоты, сфокусированные на предпочтительных положениях для селективного мутагенеза, положениях контакта или гипермутации, могут исчерпаться или могут потребоваться дополнительные усовершенствования, и важно сохранить другие свойства или характеристики антитела.
Таким образом, в другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части без влияния на другие характеристики, включающему:
a) предоставление исходного антитела или его антигенсвязывающей части;
b) выбор аминокислотного остатка в определяющей комплементарность области (CDR) для мутации, отличного от H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96;
c) мутацию отдельно указанного выбранного положения по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) оценку панели мутантных антител или их антигенсвязывающих частей, относительно исходного антитела или его антигенсвязывающей части, в отношении изменений по меньшей мере одного другого свойства или характеристики, пока не получат антитело или его антигенсвязывающую часть с повышенной активностью и сохраненным другим свойством или характеристикой относительно исходного антитела или его антигенсвязывающей части.
Предпочтительно, другая характеристика или свойство выбраны из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
Если мутагенез одного остатка не является достаточным, то могут быть включены другие остатки; таким образом, в другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление исходного антитела или его антигенсвязывающей части;
b) выбор аминокислотного остатка в определяющей комплементарность области (CDR) для мутации, отличного от H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96;
c) мутацию по отдельности указанного выбранного положения по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) оценку панели мутантных антител или их антигенсвязывающих частей, относительно исходного антитела или его антигенсвязывающей части, в отношении изменений по меньшей мере одной другой характеристики или свойства;
e) повторение стадий b)-e) для по меньшей мере одного другого положения CDR, которое не является ни положением, выбранным согласно b), ни положением H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96;
f) комбинирование в исходном антителе или его антигенсвязывающей части по меньшей мере двух индивидуальных усиливающих активность аминокислотных остатков, для которых показано наличие повышенной активности и отсутствие влияния по меньшей мере на одно другое свойство или характеристику, с получением комбинированных антител или их антигенсвязывающих частей; и
g) оценку активности и сохранения по меньшей мере одного другого свойства или характеристики комбинированных антител или их антигенсвязывающих частей с двумя усиливающими активность аминокислотными остатками, относительно исходного антитела или его антигенсвязывающей части, пока не получат антитело или его антигенсвязывающую часть с повышенной активностью и по меньшей мере одним сохраненным другим свойством или характеристикой относительно исходного антитела или его антигенсвязывающей части.
Мутагенез остатков предпочтительного положения для селективного мутагенеза, положения контакта и положения гипермутации может не приводить к повышению аффинности антитела в достаточной степени, и мутагенез и способ фагового дисплея (или сходный способ рибосомного дисплея) могут быть более не пригодны, и должны сохраняться по меньшей мере одна характеристика или свойство антитела.
Таким образом, в другом варианте осуществления изобретение относится к способу повышения аффинности антитела или его антигенсвязывающей части, включающему:
a) предоставление исходного антитела или его антигенсвязывающей части, которые были получены отбором в системе фагового дисплея, но активность которых нельзя дополнительно повысить мутагенезом в указанной системе фагового дисплея;
b) выбор аминокислотного остатка в определяющей комплементарность области (CDR) для мутации, отличного от H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96;
c) мутацию по отдельности указанного выбранного положения по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей и экспрессию в системе не фагового дисплея;
d) оценку активности панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) оценку панели мутантных антител или их антигенсвязывающих частей, относительно исходного антитела или его антигенсвязывающей части, в отношении изменений по меньшей мере одного свойства или характеристики, пока не получат антитело или его антигенсвязывающую часть с повышенной активностью относительно исходного антитела или его антигенсвязывающей части.
Предпочтительно, другая характеристика или свойство выбраны из 1) сохранения отсутствия перекрестной реактивности с другими белками или тканями человека, 2) сохранения распознавания эпитопа, т.е. распознавания эпитопа p40 предпочтительно в контексте гетеродимера p40/p35-p70, предотвращая препятствование связыванию свободным растворимым p40, и/или 3) получения антитела с последовательностью, сходной с эмбриональной последовательностью иммуноглобулина.
Если мутагенез одного остатка не является достаточным, то могут быть включены другие остатки; таким образом, в другом варианте осуществления изобретение относится к способу повышения активности антитела или его антигенсвязывающей части, включающему:
a) предоставление исходного антитела или его антигенсвязывающей части, которые были получены отбором в системе фагового дисплея, но активность которых нельзя дополнительно повысить мутагенезом в указанной системе фагового дисплея;
b) выбор аминокислотного остатка в определяющей комплементарность области (CDR) для мутации, отличного от H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96;
c) мутацию отдельно указанного выбранного положения по меньшей мере на два других аминокислотных остатка с получением, тем самым, панели мутантных антител или их антигенсвязывающих частей и экспрессию в системе не фагового дисплея;
d) оценку активности и сохранения по меньшей мере одного другого свойства или характеристики панели мутантных антител или их антигенсвязывающих частей относительно исходного антитела или его антигенсвязывающей части, тем самым идентифицируя усиливающий активность аминокислотный остаток;
e) повторение стадий b)-d) для по меньшей мере одного другого положения CDR, которое не является ни положением, выбранным согласно b), ни положением H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 и L96;
f) комбинирование в исходном антителе или его антигенсвязывающей части по меньшей мере двух индивидуальных усиливающих активность аминокислотных остатков, для которых показано наличие повышенной активности и отсутствие влияния по меньшей мере на одно свойство или характеристику, с получением комбинированных антител или их антигенсвязывающих частей; и
g) оценку активности и сохранения по меньшей мере одного свойства или характеристики комбинированных антител или их антигенсвязывающих частей с двумя усиливающими активность аминокислотными остатками относительно исходного антитела или его антигенсвязывающей части, пока не получат антитело или его антигенсвязывающую часть с повышенной активностью и по меньшей мере одной другой сохраненной характеристикой или свойством относительно исходного антитела или его антигенсвязывающей части.
V. Экспрессия антител
Антитело или часть антитела по изобретению можно получать рекомбинантной экспрессией генов легкой и тяжелой цепи иммуноглобулина в клетке-хозяине. Для рекомбинантной экспрессии антитела клетку-хозяина трансфицируют одним или несколькими рекомбинантными экспрессирующими векторами, имеющими фрагменты ДНК, кодирующие иммуноглобулиновые легкую и тяжелую цепи антитела, так чтобы легкая и тяжелая цепи экспрессировались в клетке-хозяине и, предпочтительно, секретировались в среду, в которой клетки-хозяева культивируют, из которой можно выделять антитела. Для получения генов тяжелой и легкой цепи антитела, включения этих генов в рекомбинантные экспрессирующие векторы и введения векторов в клетки-хозяева используют стандартные технологии рекомбинантных ДНК, такие как технологии, описанные в публикациях Sambrook, Fritsch and Maniatis (eds), Molecular Cloning; A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y., (1989), Ausubel, F.M. et al. (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989) и в патенте США № 4816397, выданном Boss et al.
Для получения фрагмента ДНК, кодирующего вариабельную область тяжелой цепи Joe 9 wt или родственного Joe 9 wt антитела, антитела, специфичные к IL-12 человека, подвергали скринингу из библиотек человека и внесению мутаций, как описано в разделе II. После получения фрагментов ДНК, кодирующих сегменты VH и VL Joe 9 wt или родственные Joe 9 wt сегменты VH и VL, проводят мутагенез этих последовательностей стандартными способами, такими как сайт-направленный мутагенез с помощью ПЦР (ПЦР-опосредуемый мутагенез, в котором в праймеры для ПЦР включены мутантные нуклеотиды, так что продукт ПЦР содержит мутации) или другие способы сайт-направленного мутагенеза. Антитела против IL-12 человека, которые обладали желательными уровнем активности и специфичностью/аффинностью связывания, например J695, подвергали дальнейшему манипулированию стандартными способами рекомбинантных ДНК, например, для превращения генов вариабельной области в гены цепей полноразмерного антитела, в гены Fab-фрагмента или в ген scFv. При этих манипуляциях фрагмент ДНК, кодирующий VL или VH, функционально связывают с другим фрагментом ДНК, кодирующим другой белок, такой как константная область антитела или гибкий линкер. Термин "функционально связанный", как используют в данном контексте, означает, что два фрагмента ДНК соединены, так что аминокислотные последовательности, кодируемые этими двумя фрагментами ДНК, остаются в рамке считывания.
Выделенную ДНК, кодирующую область VH, можно превращать в ген полноразмерной тяжелой цепи функциональным связыванием ДНК, кодирующей VH, с другой молекулой ДНК, кодирующей константные области тяжелой цепи (CH1, CH2 и CH3). Последовательности генов константных областей тяжелой цепи человека известны в данной области (см., например, Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК, охватывающие эти области, можно получить стандартной ПЦР-амплификацией. Константная область тяжелой цепи может представлять собой константную область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD и любого аллотипического их варианта, как описано Kabat (Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), но наиболее предпочтительно она представляет собой константную область IgG1 или IgG4. Для гена Fab-фрагмента тяжелой цепи ДНК, кодирующая VH, может быть функционально связана с другой молекулой ДНК, кодирующей только константную область CH1 тяжелой цепи.
Выделенную ДНК, кодирующую область VL, можно превращать в ген полноразмерной легкой цепи (а также в ген Fab легкой цепи) функциональным связыванием ДНК, кодирующей VL, с другой молекулой ДНК, кодирующей константную область легкой цепи CL. Последовательности генов константной области легкой цепи человека известны в данной области (см., например, Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК, охватывающие эти области, можно получать стандартной ПЦР-амплификацией. Константная область легкой цепи может представлять собой константную область каппа или лямбда, но наиболее предпочтительно она представляет собой константную область лямбда.
Для создания гена scFv фрагменты ДНК, кодирующие VH и VL, функционально связывают с другим фрагментом, кодирующим гибкий линкер, например, кодирующим аминокислотную последовательность (Gly4-Ser)3, так чтобы последовательности VH и VL могли быть экспрессированы в качестве непрерывного одноцепочечного белка, в котором области VL и VH связаны гибким линкером (см., например, Bird et al. (1988) Science 242:423-426; Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al., Nature (1990) 348:552-554).
Для экспрессии антител или частей антител по изобретению ДНК, кодирующие неполные или полноразмерные легкие и тяжелые цепи, полученные, как описано выше, встраивают в экспрессирующие векторы, так чтобы гены были функционально связаны с последовательностями контроля транскрипции и трансляции. В этом контексте термин "функционально связанный" означает, что ген антитела лигирован в вектор, так чтобы последовательности контроля транскрипции и трансляции в векторе выполняли их предполагаемую функцию регуляции транскрипции и трансляции гена антитела. Экспрессирующий вектор и последовательности контроля экспрессии выбирают так, чтобы они были совместимы с используемой для экспрессии клеткой-хозяином. Ген легкой цепи антитела и ген тяжелой цепи антитела могут быть встроены в отдельные векторы или, более часто, оба гена встроены в один экспрессирующий вектор. Гены антитела встраивают в экспрессирующий вектор стандартными способами (например, лигированием комплементарных участков рестрикции на фрагменте гена антитела и векторе или лигированием "тупых" концов, если участки рестрикции отсутствуют). Перед встраиванием последовательностей легкой или тяжелой цепи J695, или родственных J695 последовательностей легкой или тяжелой цепи, экспрессирующий вектор может уже иметь последовательности константной области антитела. Например, один из подходов преобразования последовательностей VH и VL J695 или родственных J695 последовательностей VH и VL в гены полноразмерных антител представляет собой встраивание их в экспрессирующие векторы, уже кодирующие константные области тяжелой цепи и константные области легкой цепи, соответственно, так чтобы VH-сегмент был функционально связан с CH-сегментом(ами) в векторе и VL-сегмент был функционально связан с CL-сегментом в векторе. Дополнительно или альтернативно, рекомбинантный экспрессирующий вектор может кодировать сигнальный пептид, который облегчает секрецию цепи антитела из клетки-хозяина. Ген цепи антитела можно клонировать в вектор, так чтобы сигнальный пептид был связан в рамке считывания с амино-концом гена цепи антитела. Сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (т.е. сигнальный пептид из не являющегося иммуноглобулином белка).
В дополнение к генам цепей антител, рекомбинантные экспрессирующие векторы по изобретению имеют регуляторные последовательности, которые контролируют экспрессию генов цепей антител в клетке-хозяине. Термин "регуляторная последовательность" включает промоторы, энхансеры и другие элементы контроля экспрессии (например, сигналы полиаденилирования), которые контролируют транскрипцию или трансляцию генов цепей антител. Такие регуляторные последовательности описаны, например, в публикации Goeddel; Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990). Специалистам в данной области будет понятно, что конструирование экспрессирующего вектора, включая выбор регуляторных последовательностей, может зависеть от таких факторов, как выбор клетки-хозяина, подлежащей трансформации, уровень экспрессии желаемого белка и т.д. Предпочтительные регуляторные последовательности для экспрессии в клетках-хозяевах млекопитающих включают вирусные элементы, которые обеспечивают высокие уровни экспрессии белков в клетках млекопитающих, такие как промоторы и/или энхансеры, происходящие от цитомегаловируса (CMV) (такие как промотор/энхансер CMV), вируса обезьяны 40 (SV40) (такие как промотор/энхансер SV40), аденовируса, (например, основной поздний промотор аденовируса (AdMLP)) и вируса полиомы. Для более подробного описания вирусных регуляторных элементов и их последовательностей см., например, патент США № 5168062, выданный Stinski, патент США № 4510245, выданный Bell et al., и патент США № 4968615, выданный Schaffner et al., патент США № 5464758, выданный Bujard et al., и патент США № 5654168, выданный Bujard et al.
В дополнение к генам цепей антител и регуляторным последовательностям, рекомбинантные экспрессирующие векторы по изобретению могут иметь дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например, ориджины репликации) и гены селективных маркеров. Ген селективного маркера упрощает селекцию клеток-хозяев, в которые был введен вектор (см., например, патенты США №№ 4399216, 4634665 и 5179017, все выданы Axel et al.). Например, обычно ген селективного маркера обеспечивает устойчивость клетки-хозяина, в которую был введен вектор, к лекарственным средствам, таким как G418, гигромицин или метотрексат. Предпочтительные гены селективных маркеров включают ген дигидрофолатредуктазы (DHFR) (для применения в клетках-хозяевах dhfr- с селекцией/амплификацией в присутствии метотрексата) и ген neo (для селекции в присутствии G418).
Для экспрессии легких и тяжелых цепей экспрессирующий вектор(ы), кодирующий тяжелую и легкую цепи, трансфицируют в клетку-хозяина стандартными способами. Различные формы термина "трансфекция" охватывают широкое множество способов, обычно используемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, электропорацию, осаждение с фосфатом кальция, трансфекцию с DEAE-декстраном и т.п. Хотя является теоретически возможной экспрессия антител по изобретению как в прокариотических, так и в эукариотических клетках-хозяевах, экспрессия антител в эукариотических клетках и, наиболее предпочтительно, в клетках-хозяевах млекопитающих является наиболее предпочтительной, поскольку такие эукариотические клетки и, в частности, клетки млекопитающих более вероятно, чем прокариотические клетки, соберут и секретируют надлежащим образом свернутое и иммунологически активное антитело. Предпочтительные клетки-хозяева млекопитающих для экспрессии рекомбинантных антител по изобретению включают клетки яичника китайского хомяка (клетки CHO) (включая клетки CHO dhfr-, описанные в публикации Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA 77:4216-4220, используемые с селективным маркером DHFR, например, как описано в публикации R.J. Kaufman and P.A. Sharp (1982) Mol. Biol. 159:601-621), клетки миеломы NS0, клетки COS и клетки SP2. Когда рекомбинантные экспрессирующие векторы, кодирующие гены антител, вводят в клетки-хозяева млекопитающих, антитела получают культивированием клеток-хозяев в течение периода времени, достаточного для обеспечения экспрессии антитела в клетках-хозяевах или, более предпочтительно, секреции антитела в культуральную среду, в которой клетки-хозяева выращивают. Антитела можно выделять из культуральной среды с использованием стандартных способов очистки белков.
Клетки-хозяева также можно использовать для получения частей интактных антител, таких как Fab-фрагменты или молекулы scFv. Будет понятно, что варианты указанного выше способа входят в объем настоящего изобретения. Например, может быть желательной трансфекция клетки-хозяина с ДНК, кодирующей либо легкую цепь, либо тяжелую цепь (но не обе вместе) антитела по данному изобретению. Технологию рекомбинантных ДНК можно использовать для удаления части или всей ДНК, кодирующей любую или обе из легкой и тяжелой цепей, которые не являются необходимыми для связывания с hIL-12. Молекулы, экспрессированные с таких укороченных молекул ДНК, также относятся к антителам по изобретению. Кроме того, могут быть получены бифункциональные антитела, в которых одна тяжелая и одна легкая цепь представляют собой антитело по изобретению, а другие тяжелая и легкая цепь являются специфичными к антигену, отличному от hIL-12, посредством поперечного сшивания антитела по изобретению со вторым антителом стандартными способами химического поперечного сшивания.
В предпочтительной системе для рекомбинантной экспрессии антитела или его антигенсвязывающей части по изобретению рекомбинантный экспрессирующий вектор, кодирующий как тяжелую цепь антитела, так и легкую цепь антитела, вводят в клетки dhfr- CHO трансфекцией, опосредуемой фосфатом кальция. В рекомбинантном экспрессирующем векторе каждый из генов тяжелой и легкой цепи антитела функционально связан с энхансерными/промоторными регуляторными элементами (например, происходящими от SV40, CMV, аденовируса и т.п., такими как регуляторный элемент энхансер CMV/промотор AdMLP или регуляторный элемент энхансер SV40/промотор AdMLP) для обеспечения высоких уровней транскрипции генов. Рекомбинантный экспрессирующий вектор также имеет ген DHFR, который позволяет селекцию клеток CHO, которые трансфицированы вектором с использованием селекции/амплификации в присутствии метотрексата. Отобранные трансформированные клетки-хозяева культивируют для обеспечения экспрессии тяжелых и легких цепей антитела и из культуральной среды выделяют интактное антитело. Для получения рекомбинантного экспрессирующего вектора, трансфекции клеток-хозяев, селекции трансформантов, культивирования клеток-хозяев и выделения антитела из культуральной среды используют стандартные способы молекулярной биологии. Антитела или их антигенсвязывающие части по изобретению можно экспрессировать у животного (например, мыши), которое является трансгенным по генам иммуноглобулинов человека (см., например, Taylor, L.D. et al. (1992) Nucl. Acids Res. 20: 6287-6295). Клетки растений также можно модифицировать для получения трансгенных растений, которые экспрессируют антитело или его антигенсвязывающую часть по изобретению.
Ввиду указанного выше, другой аспект изобретения относится к композициям нуклеиновых кислот, векторов и клеток-хозяев, которые можно использовать для рекомбинантной экспрессии антител и частей антител по изобретению. Предпочтительно, изобретение относится к выделенным нуклеиновым кислотам, которые кодируют CDR J695 или полную вариабельную область тяжелой и/или легкой цепи J695. Таким образом, в одном варианте осуществления изобретение относится к выделенной нуклеиновой кислоте, кодирующей вариабельную область тяжелой цепи антитела, которая кодирует CDR3 тяжелой цепи J695, содержащую аминокислотную последовательность SEQ ID NO:25. Предпочтительно, нуклеиновая кислота, кодирующая вариабельную область тяжелой цепи антитела, дополнительно кодирует CDR2 тяжелой цепи J695, которая содержит аминокислотную последовательность SEQ ID NO:27. Более предпочтительно, нуклеиновая кислота, кодирующая вариабельную область тяжелой цепи антитела, кроме того, кодирует CDR1 тяжелой цепи J695, которая содержит аминокислотную последовательность SEQ ID NO:29. Еще более предпочтительно, выделенная нуклеиновая кислота кодирует вариабельную область тяжелой цепи антитела, содержащую аминокислотную последовательность SEQ ID NO:31 (полная VH-область J695).
В других вариантах осуществления изобретение относится к выделенной нуклеиновой кислоте, кодирующей вариабельную область легкой цепи антитела, которая кодирует CDR3 легкой цепи J695, содержащую аминокислотную последовательность SEQ ID NO:26. Предпочтительно, нуклеиновая кислота, кодирующая вариабельную область легкой цепи антитела, кроме того, кодирует CDR2 легкой цепи J695, которая содержит аминокислотную последовательность SEQ ID NO:28. Более предпочтительно, нуклеиновая кислота, кодирующая вариабельную область легкой цепи антитела, кроме того, кодирует CDR1 легкой цепи J695, которая содержит аминокислотную последовательность SEQ ID NO:30. Еще более предпочтительно, выделенная нуклеиновая кислота кодирует вариабельную область легкой цепи антитела, содержащую аминокислотную последовательность SEQ ID NO:32 (полная VL-область J695).
Изобретение также относится к рекомбинантным экспрессирующим векторам, кодирующим как тяжелую цепь антитела, так и легкую цепь антитела. Например, в одном варианте осуществления изобретение относится к рекомбинантному экспрессирующему вектору, кодирующему:
a) тяжелую цепь антитела, имеющую вариабельную область, содержащую аминокислотную последовательность SEQ ID NO:31; и
b) легкую цепь антитела, имеющую вариабельную область, содержащую аминокислотную последовательность SEQ ID NO:32.
Изобретение также относится к клеткам-хозяевам, в которые введен один или несколько рекомбинантных экспрессирующих векторов по изобретению. Предпочтительно, клетка-хозяин представляет собой клетку-хозяина млекопитающих, более предпочтительно, клетка-хозяин представляет собой клетку CHO, клетку NS0 или клетку COS. Кроме того, изобретение относится к способу синтеза рекомбинантного антитела человека по изобретению путем культивирования клетки-хозяина по изобретению в подходящей культуральной среде до тех пор, пока не синтезируется рекомбинантное антитело человека по изобретению. Способ может дополнительно включать выделение рекомбинантного антитела человека из культуральной среды.
VI. Фармацевтические композиции и введение фармацевтической композиции
Антитела и части антител по изобретению могут быть включены в состав фармацевтических композиций, подходящих для введения субъекту. Как правило, фармацевтическая композиция содержит антитело или часть антитела по изобретению и фармацевтически приемлемый носитель. Как используют в настоящем документе, "фармацевтически приемлемый носитель" включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, обеспечивающие изотоничность и замедляющие всасывание средства и т.п., которые являются физиологически совместимыми. Примеры фармацевтически приемлемых носителей включают один или несколько носителей, выбранных из воды, физиологического раствора, фосфатно-солевого буфера, декстрозы, глицерина, этанола и т.п., а также их комбинаций. Во многих случаях может быть предпочтительным включение в композицию средств, обеспечивающих изотоничность, например, сахаров, полиспиртов, таких как маннит, сорбит, или хлорида натрия. Фармацевтически приемлемые носители могут дополнительно содержать небольшие количества вспомогательных веществ, таких как смачивающие средства или эмульгаторы, консерванты или буферы, которые увеличивают срок хранения или эффективность антитела или части антитела.
Антитела и части антител по изобретению могут быть включены в фармацевтическую композицию, подходящую для парентерального введения. Предпочтительно, антитело или части антитела можно получать в виде инъецируемого раствора, содержащего 0,1-250 мг/мл антитела. Инъецируемый раствор может состоять из жидкой или лиофилизированной дозированной формы в бесцветном или желтом флаконе, ампуле или предварительно заполненном шприце. Буфер может представлять собой L-гистидин (1-50 мМ), оптимально 5-10 мМ, при pH от 5,0 до 7,0 (оптимально pH 6,0). Другие подходящие буферы включают, но не ограничиваются ими, сукцинат натрия, цитрат натрия, фосфат натрия или фосфат калия. Хлорид натрия можно использовать для модификации токсичности раствора в концентрации 0-300 мМ (оптимально 150 мМ для жидкой дозированной формы). Для лиофилизированной дозированной формы можно включать криопротектор, главным образом, 0-10% сахарозу (оптимально 0,5-1,0%). Другой подходящий криопротектор включает трегалозу и лактозу. Для лиофилизированной дозированной формы можно включать наполнители, главным образом, 1-10% маннит (оптимально 2-4%). Стабилизаторы могут быть использованы как для жидкой, так и для лиофилизированной дозированной формы, главным образом, 1-50 мМ L-метионин (оптимально 5-10 мМ). Другие подходящие наполнители включают глицин, аргинин, которые могут быть включены в виде 0-0,05% полисорбата-80 (оптимально 0,005-0,01%). Дополнительные поверхностно-активные вещества включают, но не ограничиваются ими, полисорбат 20 и поверхностно-активные вещества BRIJ.
В предпочтительном варианте осуществления фармацевтическая композиция включает антитело в дозировке приблизительно 100 мг-200 мг на дозу.
Композиции по данному изобретению могут быть в различных формах. Они включают, например, жидкие, полутвердые и твердые дозированные формы, такие как жидкие растворы (например, инъецируемые и инфузируемые растворы), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения. Типичные предпочтительные композиции находятся в форме инъецируемых или инфузируемых растворов, таких как композиции, сходные с композициями, используемыми для пассивной иммунизации людей другими антителами. Предпочтительным способом введения является парентеральный способ (например, внутривенный, подкожный, внутрибрюшинный, внутримышечный). В предпочтительном варианте осуществления антитело вводят путем подкожной инъекции.
Терапевтические композиции, как правило, должны быть стерильными и стабильными в условиях изготовления и хранения. Композицию можно изготавливать в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Стерильные инъецируемые растворы могут быть получены включением активного соединения (т.е. антитела или части антитела) в требуемом количестве в соответствующий растворитель с одним ингредиентом или с комбинацией ингредиентов, перечисленных выше, при необходимости, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают включением активного соединения в стерильный носитель, который содержит основную дисперсионную среду и в случае которого требуются другие ингредиенты из тех, что перечислены выше. В случае стерильных лиофилизированных порошков для получения стерильных инъецируемых растворов, предпочтительными способами получения являются вакуумная сушка и распылительная сушка, которые дают порошок активного ингредиента вместе с любым дополнительным желательным ингредиентом из их предварительно стерилизованного фильтрованием раствора. Надлежащую текучесть раствора можно поддерживать, например, с использованием покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и с использованием поверхностно-активных веществ. Длительного всасывания инъецированных композиций можно достигать включением в композицию средства, которое замедляет всасывание, например, моностеаратных солей и желатина.
Антитела и части антител по настоящему изобретению можно вводить различными способами, известными в данной области, хотя для множества терапевтических применений предпочтительным путем/способом введения является подкожная инъекция, внутривенная инъекция или инфузия. Как будет понятно специалисту в данной области, путь и/или способ введения будет варьировать в зависимости от желаемых результатов. В определенных вариантах осуществления активное соединение может быть получено с носителем, который защитит соединение от быстрого высвобождения, например, лекарственная форма с контролируемым высвобождением, включая импланты, трансдермальные пластыри и микроинкапсулированные системы для доставки. Можно использовать биологически деградируемые биологически совместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Многие способы получения таких лекарственных форм запатентованы или являются общеизвестными специалистам в данной области. См., например, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
В определенных вариантах осуществления антитело или часть антитела по изобретению можно вводить перорально, например, с помощью инертного разбавителя или ассимилируемого пищевого носителя. Соединение (и другие ингредиенты, если желательно) можно заключать в желатиновую капсулу с твердой или мягкой оболочкой, прессовать в таблетки или включать непосредственно в рацион субъекта. Для перорального терапевтического введения соединения можно включать с эксципиентами и использовать в форме проглатываемых таблеток, буккальных таблеток, лепешек, капсул, эликсиров, суспензий, сиропов, пластинок и т.п. Для введения соединения по изобретению способом, отличным от парентерального введения, может быть необходимым покрытие соединения материалом, препятствующим его инактивации, или совместное введение с ним.
Также в композиции можно включать вспомогательные активные соединения. В определенных вариантах осуществления антитело или часть антитела по изобретению изготавливают совместно и/или вводят совместно с одним или несколькими дополнительными лекарственными средствами, которые пригодны для лечения нарушений, при которых активность IL-12 является вредной. Например, антитело против hIL-12 или часть антитела по изобретению можно изготавливать совместно и/или вводить совместно с одним или несколькими дополнительными антителами, которые связывают другие мишени (например, антителами, которые связывают другие цитокины или которые связывают молекулы клеточной поверхности). Кроме того, одно или несколько антител по изобретению можно использовать в комбинации с двумя или более из указанных выше лекарственных средств. В такой комбинированной терапии можно преимущественно использовать более низкие дозировки вводимых лекарственных средств, таким образом, избегая возможной токсичности или осложнений, ассоциированных с различными способами монотерапии. Специалисту в данной области будет понятно, что когда антитела по изобретению используют в виде части комбинированной терапии, может быть желательной более низкая дозировка антитела, чем когда субъекту вводят антитело отдельно (например, с использованием комбинированной терапии можно достигнуть синергичного терапевтического эффекта, который, в свою очередь, позволяет применение более низкой дозы антитела для достижения желаемого терапевтического эффекта).
Интерлейкин 12 играет важную роль в патологии, ассоциированной с различными заболеваниями, вовлекающими иммунные и воспалительные элементы. Эти заболевания включают, но не ограничиваются ими, ревматоидный артрит, остеоартрит, ювенильный хронический артрит, артрит Лайма, псориатический артрит, реактивный артрит, спондилоартропатию, системную красную волчанку, болезнь Крона, язвенный колит, воспалительное заболевание кишечника, инсулинозависимый сахарный диабет, тиреоидит, астму, аллергические заболевания, псориаз, склеротический дерматит, атопический дерматит, реакцию "трансплантат против хозяина", отторжение трансплантата органа, острое или хроническое иммунное заболевание, ассоциированное с трансплантацией органа, саркоидоз, атеросклероз, диссеминированное внутрисосудистое свертывание, болезнь Кавасаки, болезнь Грэйвса, нефротический синдром, синдром хронической усталости, гранулематоз Вегенера, болезнь Шенлейн-Геноха, микроскопический васкулит почек, хронический активный гепатит, увеит, септический шок, синдром токсического шока, септический синдром, кахексию, инфекционные заболевания, паразитарные заболевания, синдром приобретенного иммунодефицита, острый поперечный миелит, хорею Гентингтона, болезнь Паркинсона, болезнь Альцгеймера, инсульт, первичный билиарный цирроз, гемолитическую анемию, злокачественные опухоли, сердечную недостаточность, инфаркт миокарда, болезнь Аддисона, спорадическую полигландулярную недостаточность типа I и полигландулярную недостаточность типа II, синдром Шмидта, (острый) респираторный дистресс-синдром взрослых, алопецию, гнездную алопецию, серонегативную артропатию, артропатию, болезнь Рейтера, псориатическую артропатию, артропатию при язвенном колите, энтеропатический синовит, ассоциированную с хламидиями, иерсиниями и сальмонеллами артропатию, спондилоартропатию, атероматозное заболевание/артериосклероз, атопическую аллергию, аутоиммунное буллезное заболевание, обычный пемфигус, листовидный пемфигус, пемфигоид, заболевание линейного IgA, аутоиммунную гемолитическую анемию, Кумбс-положительную гемолитическую анемию, приобретенную пернициозную анемию, ювенильную пернициозную анемию, миалгический энцефалит/синдром хронической усталости, хронический кожно-слизистый кандидоз, гигантоклеточный артрит, первичный склерозирующий гепатит, криптогенный аутоиммунный гепатит, синдром приобретенного иммунодефицита, связанные с приобретенным иммунодефицитом заболевания, гепатит C, вариабельный неклассифицируемый иммунодефицит (вариабельную неклассифицируемую гипогаммаглобулинемию), кардиомиопатию с дилатацией, женское бесплодие, угасание функции яичников, преждевременное угасание функции яичников, фиброзную болезнь легких, криптогенный фиброзный альвеолит, поствоспалительное интерстициальное заболевание легких, интерстициальный пневмонит, связанное с болезнью соединительной ткани интерстициальное заболевание легких, ассоциированное со смешанной болезнью соединительной ткани заболевание легких, ассоциированное с системной склеродермией интерстициальное заболевание легких, ассоциированное с ревматоидным артритом интерстициальное заболевание легких, ассоциированное с системной красной волчанкой заболевание легких, ассоциированное с дерматомиозитом/полимиозитом заболевание легких, ассоциированное с болезнью Шегрена заболевание легких, ассоциированное с анкилозирующим спондилитом заболевание легких, васкулитное диффузное заболевание легких, ассоциированное с гемосидерозом заболевание легких, индуцированное лекарственным средством интерстициальное заболевание легких, связанный с радиацией фиброз, облитерирующий бронхиолит, хроническую эозинофильную пневмонию, заболевание легких с инфильтрацией лимфоцитов, постинфекционное интерстициальное заболевание легких, подагрический артрит, аутоиммунный гепатит, аутоиммунный гепатит 1 типа (классический аутоиммунный или люпоидный гепатит), аутоиммунный гепатит 2 типа (гепатит, связанный с антителом против LKM), опосредуемую аутоиммунным заболеванием гипогликемию, устойчивость к инсулину типа B с акантокератодермией, гипопаратиреоз, острое иммунное заболевание, ассоциированное с трансплантацией органа, хроническое иммунное заболевание, ассоциированное с трансплантацией органа, остеоартроз, первичный склерозирующий холангит, идиопатическую лейкопению, аутоиммунную нейтропению, NOS-болезнь почек, гломерулонефрит, микроскопический васкулит почек, болезнь Лайма, дискоидную красную волчанку, идиопатическое или NOS-мужское бесплодие, аутоиммунитет к сперматозоидам, рассеянный склероз (все подтипы), инсулинозависимый сахарный диабет, симпатическую офтальмию, легочную гипертензию, вторичную для болезни соединительной ткани, синдром Гудпасчера, легочное проявление узелкового полиартериита, острую ревматическую атаку, ревматоидный спондилит, болезнь Стилла, системную склеродермию, болезнь Такаясу/артериит, аутоиммунную тромбоцитопению, идиопатическую тромбоцитопению, аутоиммунное заболевание щитовидной железы, гипертиреоидизм, зобный аутоиммунный гипотиреоз (болезнь Хашимото), атрофический аутоиммунный гипотиреоз, первичную микседему, факогенный увеит, первичный васкулит и витилиго. Антитела человека и части антител по изобретению можно использовать для лечения аутоиммунных заболеваний, в частности заболеваний, ассоциированных с воспалением, включая ревматоидный спондилит, аллергию, аутоиммунный диабет, аутоиммунный увеит.
Предпочтительно, антитела по изобретению или их антигенсвязывающие части применяют для лечения ревматоидного артрита, болезни Крона, рассеянного склероза, инсулинозависимого сахарного диабета и псориаза, как более подробно описано в разделе VII.
Антитело человека или часть антитела по изобретению также можно вводить с одним или несколькими дополнительными лекарственными средствами, пригодными для лечения аутоиммунных и воспалительных заболеваний.
Для лечения таких заболеваний антитела по изобретению или их антигенсвязывающие части можно применять отдельно или в комбинации. Следует понимать, что антитела против IL-12 по изобретению или их антигенсвязывающие части можно применять отдельно или в комбинации с дополнительным средством, например, лекарственным средством, причем указанное дополнительное средство выбирает квалифицированный специалист для предполагаемой цели. Например, дополнительным средством может быть лекарственное средство, признанное в данной области пригодным для лечения заболевания или состояния, подвергаемого лечению антителом по настоящему изобретению. Дополнительным средством также может быть средство, которое придает полезный признак терапевтической композиции, например, средство, которое влияет на вязкость композиции.
Кроме того, следует понимать, что комбинации, которые включены в данное изобретение, представляют собой комбинации, пригодные для предполагаемой цели. Средства, указанные ниже, являются иллюстративными для различных целей и не предназначены для ограничения. Комбинации, которые являются частью данного изобретения, могут представлять собой антитела по настоящему изобретению и по меньшей мере одно дополнительное средство, выбранное из списков, приведенных ниже. Также комбинация может включать более одного дополнительного средства, например, два или три дополнительных средства, если комбинация является такой, что полученная композиция может выполнять ее предполагаемую функцию. Более того, дополнительные средства, описанные в настоящем документе, используемые в комбинации с антителом против IL-12, не ограничиваются нарушением, для лечения которого они предназначены.
Предпочтительным комбинируемым средством является нестероидное противовоспалительное средство(а), также обозначаемое как NSAID, которое включает лекарственные средства, такие как ибупрофен. Другими предпочтительными комбинируемыми средствами являются кортикостероиды, включая преднизолон; хорошо известные побочные эффекты применения стероидов могут быть снижены или даже устранены снижением требуемой дозы стероидов при лечении ими пациентов в комбинации с антителами против IL-12 по данному изобретению. Неограничивающие примеры лекарственных средств от ревматоидного артрита, с которыми можно комбинировать антитело или часть антитела по изобретению, включают следующие средства: цитокин-супрессивное противовоспалительное лекарственное средство(а) (CSAID); антитела или антагонисты к другим цитокинам или факторам роста человека, например, к TNF (включая адалимумаб/HUMIRA), LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела по изобретению или их антигенсвязывающие части можно комбинировать с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (B7.2), CD90, или их лигандам, включая CD154 (gp39 или CD40L).
Предпочтительные комбинации лекарственных средств могут препятствовать на различных этапах аутоиммунному и последующему воспалительному каскаду; их предпочтительные примеры включают антагонисты TNF, такие как химерные, гуманизированные или человеческие антитела против TNF, D2E7, (заявка США с серийным номером 08/599226, поданная 9 февраля 1996 года), cA2 (Remicade™), CDP 571, фрагменты антител против TNF (например, CDP870), и растворимые рецепторы p55 или p75 TNF, их производные (p75TNFR1gG (Enbrel™) или p55TNFR1gG (Lenercept), растворимый рецептор IL-13 (sIL-13), а также ингибиторы TNFα-превращающего фермента (TACE); аналогично могут быть эффективны ингибиторы IL-1 (например, ингибиторы интерлейкин-1-превращающего фермента, такие как Vx740 или IL-1RA и т.д.) по той же причине. Другие предпочтительные комбинируемые средства включают интерлейкин-11, антитело против P7s и гликопротеиновый лиганд p-селектина (PSGL). Другими предпочтительными комбинируемыми средствами являются другие ключевые участники аутоиммунного ответа, которые могут действовать параллельно, в зависимости или согласованно с функцией IL-12; особенно предпочтительными являются антагонисты IL-18, включая антитела против IL-18 или растворимые рецепторы IL-18, или связывающие IL-18 белки. Было показано, что IL-12 и IL-18 имеют перекрывающиеся, но различные функции, и комбинация антагонистов обоих из них может быть наиболее эффективной. Другими предпочтительными комбинируемыми средствами являются неистощающие ингибиторы CD4. Другие предпочтительные комбинируемые средства включают антагонисты костимуляторного пути CD80 (B7.1) или CD86 (B7.2), включая антитела, растворимые рецепторы или антагонистические лиганды.
Антитела против IL12 или их антигенсвязывающие части также можно комбинировать с такими средствами, как метотрексат, 6-MP, азатиоприн сульфасалазин, месалазин, олсалазин хлорхинин/гидроксихлороквин, пеницилламин, ауротиомалат (внутримышечный и пероральный), азатиоприн, кохицин, кортикостероиды (пероральные, ингалируемые и локальная инъекция), агонисты бета-2-адренорецепторов (салбутамол, тербуталин, салметерал), ксантины (теофиллин, аминофиллин), кромогликат, недокромил, кетотифен, ипратропиум и окситропиум, циклоспорин, FK506, рапамицин, микофенолата мофетил, лефлуномид, NSAID, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, средства, которые препятствуют передаче сигнала провоспалительными цитокинами, такими как TNFα или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP-киназы), ингибиторы IL-1β-превращающего фермента (например, Vx740), антитело против P7s, гликопротеиновый лиганд p-селектина (PSGL), ингибиторы TNFα-превращающего фермента (TACE), ингибиторы T-клеточной передачи сигнала, такие как ингибиторы киназ, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензинпревращающего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые рецепторы p55 или p75 TNF и производные p75TNFRIgG (Enbrel™) и p55TNFRIgG (Lenercept), sIL-1RI, sIL-1RII, sIL-6R, растворимый рецептор IL-13 (sIL-13)) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ). Предпочтительные комбинируемые средства включают метотрексат или лефлуномид и, в случаях умеренного или тяжелого ревматоидного артрита, циклоспорин.
Неограничивающие примеры лекарственных средств против воспалительного заболевания кишечника, с которыми можно комбинировать антитело против IL-12 или часть антитела, включают следующие лекарственные средства: буденозид; эпидермальный фактор роста; кортикостероиды; циклоспорин, сульфасалазин; аминосалицилаты; 6-меркаптопурин; азатиоприн; метронидазол; ингибиторы липоксигеназы; месаламин; олсалазин; балсалазид; антиоксиданты; ингибиторы тромбоксана; антагонисты рецептора IL-1; моноклональные антитела против IL-1β; моноклональные антитела против IL-6; факторы роста; ингибиторы эластазы; пиридинил-имидазольные соединения; антитела к другим цитокинам человека или факторам роста, или антагонисты последних, например, TNF (включая адалимумаб/HUMIRA), LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела по изобретению или их антигенсвязывающие части можно комбинировать с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90, или их лигандам. Антитела по изобретению или их антигенсвязывающие части также можно комбинировать с такими средствами, как метотрексат, циклоспорин, FK506, рапамицин, микофенолат мофетил, лефлуномид, NSAID, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, средства, которые препятствуют передаче сигнала провоспалительными цитокинами, такими как TNFα или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP-киназы), ингибиторы IL-1β-превращающего фермента (например, Vx740), антитело против P7s, гликопротеиновый лиганд p-селектина (PSGL), ингибиторы TNFα-превращающего фермента, ингибиторы T-клеточной передачи сигнала, такие как ингибиторы киназы, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензинпревращающего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые рецепторы p55 или p75 TNF, sIL-1RI, sIL-1RII, sIL-6R, растворимый рецептор IL-13 (sIL-13)) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ).
Предпочтительные примеры лекарственных средств против болезни Крона, с которыми можно комбинировать антитело или его антигенсвязывающую часть, включают следующие средства: антагонисты TNF, например, антитела против TNF, D2E7 (адалимумаб/HUMIRA), cA2 (Remicade™), CDP 571, фрагменты антитела против TNF (например, CDP870), конструкции TNFR-Ig (p75TNFRIgG (Enbrel™) и p55TNFRIgG (Lenercept)), антитело против P7s, гликопротеиновый лиганд p-селектина (PSGL), растворимый рецептор IL-13 (sIL-13) и ингибиторы PDE4. Антитела по изобретению или их антигенсвязывающие части можно комбинировать с кортикостероидами, например, буденозидом и дексаметазоном. Также антитела можно комбинировать с такими средствами, как сульфасалазин, 5-аминосалициловая кислота и олсалазин, и средствами, которые препятствуют синтезу или действию провоспалительных цитокинов, таких как IL-1, например, ингибиторами IL-1β-превращающего фермента (например, Vx740) и IL-1ra. Антитела или их антигенсвязывающие части также можно использовать с ингибиторами T-клеточной передачи сигнала, например, ингибиторами тирозинкиназы 6-меркаптопуринами. Антитела или их антигенсвязывающие части можно комбинировать с IL-11.
Неограничивающие примеры лекарственных средств против рассеянного склероза, с которыми можно комбинировать антитело или часть антитела, включают следующие лекарственные средства: кортикостероиды; преднизолон; метилпреднизолон; азатиоприн; циклофосфамид; циклоспорин; метотрексат; 4-аминопиридин; тизанидин; интерферон-β1a (Avonex; Biogen); интерферон-β1b (Betaseron; Chiron/Berlex); сополимер 1 (Cop-1; копаксон; Teva Pharmaceutical Industries, Inc.); гипербарический кислород; внутривенный иммуноглобулин; кладрибин; антитела к другим цитокинам человека или факторам роста, или антагонисты последних, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела по изобретению или их антигенсвязывающие части можно комбинировать с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90, или их лигандам. Антитела по изобретению или их антигенсвязывающие части также можно комбинировать с такими средствами, как метотрексат, циклоспорин, FK506, рапамицин, микофенолата мофетил, лефлуномид, NSAID, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, средства, которые препятствуют передаче сигнала провоспалительными цитокинами, такими как TNFα или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP-киназы), ингибиторы IL-1β-превращающего фермента (например, Vx740), антитело против P7s, гликопротеиновый лиганд p-селектина (PSGL), ингибиторы TACE, ингибиторы T-клеточной передачи сигнала, такие как ингибиторы киназы, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензинпревращающего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые рецепторы p55 или p75 TNF, sIL-1RI, sIL-1RII, sIL-6R, растворимый рецептор IL-13 (sIL-13)) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ).
Предпочтительные примеры лекарственных средств против рассеянного склероза, с которыми можно комбинировать антитело или его антигенсвязывающую часть, включают интерферон-β, например, IFNβ1a и IFNβ1b; копаксон, кортикостероиды, ингибиторы IL-1, ингибиторы TNF и антитела к лиганду CD40 и CD80.
Антитело или часть антитела можно использовать в комбинации с другими средствами для лечения состояний кожи. Например, антитело, часть антитела или другой ингибитор IL-12 по изобретению комбинируют с терапией PUVA. PUVA представляет собой комбинацию псоралена (P) и длинноволнового ультрафиолетового излучения (УФ-A), которую используют для лечения множества различных состояний кожи. Антитела, части антител или другие ингибиторы IL-12 по изобретению также можно комбинировать с пимекролимусом. В другом варианте осуществления антитела по изобретению используют для лечения псориаза, при котором антитела вводят в комбинации с такролимусом. В следующем варианте осуществления такролимус и ингибиторы IL-12 вводят в комбинации с метотрексатом и/или циклоспорином. В другом варианте осуществления ингибитор IL-12 по изобретению вводят совместно с обработкой эксцимерным лазером для лечения псориаза.
Фармацевтические композиции по изобретению могут включать "терапевтически эффективное количество" или "профилактически эффективное количество" антитела или части антитела по изобретению. "Терапевтически эффективное количество" относится к количеству, эффективному в дозировках и в течение периодов времени, необходимых для достижения желаемого терапевтического результата. Терапевтически эффективное количество антитела или части антитела может варьировать в зависимости от таких факторов, как болезненное состояние, возраст, пол и масса тела индивида, а также способность антитела или части антитела вызывать желаемый ответ у индивидуума. Терапевтически эффективное количество также представляет собой количество, при котором терапевтически полезные эффекты преобладают над токсическими или вредными эффектами антитела или части антитела. "Профилактически эффективное количество" относится к количеству, эффективному в дозировках в течение периодов времени, необходимых для достижения профилактического результата. Как правило, поскольку профилактическую дозу используют у субъектов до заболевания или на ранних его стадиях, профилактически эффективное количество будет меньше, чем терапевтически эффективное количество.
Режимы дозирования можно корректировать для обеспечения оптимального желаемого ответа (например, терапевтического или профилактического ответа). Например, можно вводить однократный болюс, можно вводить несколько разделенных доз с течением времени или дозу можно пропорционально снижать или повышать в зависимости от потребности для данной терапевтической ситуации. Особенно преимущественным является изготовление парентеральных композиций в единичной дозированной форме для простоты введения и единообразия дозировки. Единичная дозированная форма, как используют в настоящем документе, относится к физически дискретным единицам, подходящим в качестве единиц дозирования для субъектов-млекопитающих, подвергаемых лечению; причем каждая единица содержит предопределенное количество активного соединения, вычисленного для достижения терапевтического эффекта, вместе с требуемым фармацевтическим носителем. Конкретные параметры единичных дозированных форм по изобретению определяются и непосредственно зависят от (a) уникальных характеристик активного соединения и конкретного терапевтического или профилактического эффекта, подлежащего достижению, и (b) ограничений, характерных для области приготовления такого активного соединения для лечения чувствительности у индивидов.
В одном варианте осуществления антитело против IL-12 или его антигенсвязывающую часть вводят в режиме введения доз раз в две недели, включая, например, двухнедельную дозировку в диапазоне приблизительно от 50 до 300 мг, дозировку в диапазоне от приблизительно 100 мг до приблизительно 200 мг и дозировку от приблизительно 125 до приблизительно 175 мг. Альтернативно, антитело против IL-12 можно вводить в виде однократной дозы, включая, например, дозу приблизительно 200 мг, дозу приблизительно 100 мг. В другом варианте осуществления антитело против IL-12 вводят в режиме введения доз раз в неделю, включая, например, дозу в диапазоне приблизительно от 50 до 300 мг, дозировку в диапазоне от приблизительно 100 мг до приблизительно 200 мг и дозировку от приблизительно 125 до приблизительно 175 мг. Следует отметить, что дозы в пределах указанных диапазонов также включены сюда, например, 85 мг, 97 мг и т.д.
В другом варианте осуществления антитело против IL-12 человека или его антигенсвязывающую часть вводят в виде однократной дозы субъекту, имеющему нарушение, при котором активность IL-12 является вредной, например, псориаз, что приводит к лечению. Ответ на антитело против IL-12 или его антигенсвязывающую часть может сохраняться у субъекта в течение длительного периода. Мониторинг сохранения ответа можно проводить в соответствии с нарушением, подвергаемым лечению. Например, сохранение ответа с помощью антитела против IL-12 или его антигенсвязывающей части на лечение псориаза можно определять по ответу PASI 75 субъекта с течением времени. Сохранение ответа на лечение псориаза можно также определять по ответу PASI 50 или ответу PASI 90 субъекта с течением времени. Сохранение ответа на лечение псориаза альтернативно можно определять по достижению субъектом показателя PGA "отсутствие признаков" или "минимальные признаки", например, показателя PGA, равного 0 или 1, с течением времени.
Следует отметить, что объемы дозировок могут варьировать в зависимости от типа и тяжести состояния, подлежащего облегчению. Кроме того, понятно, что для любого конкретного субъекта конкретные режимы дозирования можно корректировать с течением времени в зависимости от потребности индивидуума и профессионального мнения лица, вводящего или наблюдающего за введением композиций, и что диапазоны дозировок, указанные в настоящем документе, являются только иллюстративными и не предназначены для ограничения объема или практики заявленной композиции.
VII. Применение изобретения
Изобретение относится к способу ингибирования активности IL-12 у субъекта, страдающего нарушением, при котором активность IL-12 является вредной. В одном варианте осуществления изобретение относится к способу лечения псориаза, включающему введение однократной дозы антитела против IL-12 или его антигенсвязывающей части.
IL-12 вовлечен в патофизиологию широкого множества нарушений (Windhagen et al., (1995) J. Exp. Med. 182: 1985-1996; Morita et al. (1998) Arthritis and Rheumatism. 41: 306-314; Bucht et al., (1996) Clin. Exp. Immunol. 103: 347-367; Fais et al. (1994) J. Interferon Res. 14:235-238; Parronchi et al., (1997) Am. J. Path. 150:823-832; Monteleone et al., (1997) Gastroenterology. 112:1169-1178, and Berrebi et al., (1998) Am. J. Path 152:667-672; Parronchi et al (1997) Am. J. Path. 150:823-832). Изобретение относится к способам ингибирования активности IL-12 у субъекта, страдающего таким нарушением, причем способ включает введение субъекту антитела или части антитела по изобретению, так чтобы у субъекта ингибировалась активность IL-12. Предпочтительно, IL-12 представляет собой IL-12 человека и субъектом является человек. Альтернативно, субъектом может быть млекопитающее, у которого экспрессируется IL-12, с которым антитело по изобретению перекрестно реагирует. Более того, субъектом может быть млекопитающее, которому был введен hIL-12 (например, путем введения hIL-12 или экспрессии трансгена hIL-12). Антитело по изобретению можно вводить человеку в терапевтических целях (дополнительно рассмотренных ниже). Кроме того, антитело по изобретению можно вводить не являющемуся человеком млекопитающему, экспрессирующему IL-12, с которым антитело перекрестно реагирует, для ветеринарных целей или в качестве модели на животных заболевания человека. В отношении последнего, такие модели на животных могут быть пригодны для оценки терапевтической эффективности антител по изобретению (например, тестирования дозировок и интервалов между введениями).
Как используют в настоящем документе, выражение "нарушение, при котором активность IL-12 является вредной" включает заболевания и другие нарушения, при которых показано присутствие IL-12 у субъекта, страдающего нарушением, или предполагается, что IL-12 ответственен за патофизиологию нарушения или является фактором, который приводит к ухудшению нарушения. Таким образом, нарушение, при котором активность IL-12 является вредной, представляет собой нарушение, при котором ожидается, что ингибирование активности IL-12 смягчит симптомы и/или замедлит прогрессирование нарушения. На такие нарушения может указывать, например, повышение концентрации IL-12 в биологической жидкости субъекта, страдающего нарушением (например, повышение концентрации IL-12 в сыворотке, плазме, синовиальной жидкости и т.д. субъекта), которое может быть выявлено, например, с использованием антитела против IL-12, как описано выше. Существует множество примеров нарушений, при которых активность IL-12 является вредной. В одном варианте осуществления антитела или их антигенсвязывающие части можно использовать в терапии для лечения заболеваний или нарушений, описанных в настоящем документе. В другом варианте осуществления антитела или их антигенсвязывающие части можно использовать для изготовления лекарственного средства для лечения заболеваний или нарушений, описанных в настоящем документе. Применение антител и частей антител по изобретению для лечения некоторых из конкретных неограничивающих нарушений дополнительно рассмотрено ниже.
A. Ревматоидный артрит
Интерлейкин-12 вовлечен в воспалительные заболевания, такие как ревматоидный артрит. Индуцибельный транскрипт IL-12p40 выявлен в синовиальной жидкости пациентов с ревматоидным артритом, и было показано, что IL-12 присутствует в синовиальных жидкостях пациентов с ревматоидным артритом (см., например, Morita et al., (1998) Arthritis and Rheumatism 41: 306-314). Было выявлено, что при ревматоидном артрите в подстилающем слое синовиальной оболочки присутствуют положительные по IL-12 клетки. Антитела человека и части антител по изобретению можно использовать для лечения, например, ревматоидного артрита, ювенильного ревматоидного артрита, артрита Лайма, ревматоидного спондилита, остеоартрита и подагрического артрита. Как правило, антитело или часть антитела вводят системно, хотя для некоторых нарушений может быть полезным локальное введение антитела или части антитела. Антитело или часть антитела по изобретению также можно вводить с одним или несколькими дополнительными лекарственными средствами, пригодными для лечения аутоиммунных заболеваний.
При индуцированном коллагеном артрите (CIA) на мышиной модели ревматоидного артрита введение мышам mAb против IL-12 (моноклональное антитело крысы против IL-12 мыши, C17.15) до артрита в корне подавляло возникновение и снижало заболеваемость и тяжесть заболевания. Введение mAb против IL-12 на ранней стадии после возникновения артрита снижало тяжесть, однако более позднее введение мышам mAb против IL-12 после возникновения заболевания оказывало минимальное воздействие на тяжесть заболевания.
B. Болезнь Крона
Интерлейкин-12 также участвует в воспалительном заболевании кишечника, болезни Крона. У пациентов с болезнью Крона в слизистой кишечника повышена экспрессия IFN-γ и IL-12 (см., например, Fais et al., (1994) J. Interferon Res. 14: 235-238; Parronchi et al., (1997) Amer. J. Pathol. 150: 823-832; Monteleone et al., (1997) Gastroenterology 112: 1169-1178; Berrebi et al., (1998) Amer. J. Pathol. 152: 667-672). Было показано, что антитела против IL-12 подавляют заболевание в моделях колита на мышах, например, TNBS индуцировал колит у мышей с нокаутом по IL-2 и, недавно, у мышей с нокаутом по IL-10. Таким образом, антитела и части антител по изобретению можно использовать для лечения воспалительных заболеваний кишечника.
C. Рассеянный склероз
Интерлейкин-12 вовлечен в рассеянный склероз в качестве ключевого медиатора. Экспрессия индуцируемого транскрипта p40 IL-12 или самого IL-12 может быть показана в очагах повреждения пациентов с рассеянным склерозом (Windhagen et al., (1995) J. Exp. Med. 182: 1985-1996, Drulovic et al., (1997) J. Neurol. Sci. 147: 145-150). Пациенты с хроническим прогрессирующим рассеянным склерозом имеют повышенные уровни IL-12 в кровотоке. Исследования с T-клетками и антигенпредставляющими клетками (APC) от пациентов с рассеянным склерозом показали бесконечные серии иммунных взаимодействий в качестве основы прогрессирующего рассеянного склероза, ведущие к иммунному ответу Th1-типа. Повышенная секреция IFN-γ из T-клеток приводила к повышенной продукции IL-12 из APC, которая замыкала цикл, ведущий к хроническому состоянию иммунной активации Th1-типа и заболеванию (Balashov et al., (1997) Proc. Natl. Acad. Sci. 94: 599-603). Роль IL-12 в рассеянном склерозе исследовали с использованием экспериментального аллергического энцефаломиелита (EAE) у мышей и крыс, являющегося моделью рассеянного склероза. В EAE-модели возвратно-ремиттирующего рассеянного склероза у мышей предварительное введение mAb против IL-12 замедляло паралич и снижало клинические показатели. Введение mAb против IL-12 на пике паралича или в ходе последующего периода ремиссии снижало клинические показатели. Таким образом, антитела или их антигенсвязывающие части по изобретению могут служить для смягчения симптомов, ассоциированных с рассеянным склерозом у человека.
D. Инсулинозависимый сахарный диабет
Интерлейкин-12 в качестве важного медиатора вовлечен в инсулинозависимый сахарный диабет (IDDM). IDDM индуцировали у мышей NOD введением IL-12, и антитела против IL-12 были защитными в модели адоптивного переноса для IDDM. Пациенты с IDDM на начальных этапах часто испытывают так называемый "период медового месяца", в течение которого сохраняется некоторая функция остаточных островковых клеток. Эти остаточные островковые клетки продуцируют инсулин и регулируют уровни глюкозы в крови лучше, чем введенный инсулин. Лечение этих пациентов на начальных этапах антителом против IL-12 может препятствовать дальнейшему разрушению островковых клеток, тем самым сохраняя эндогенный источник инсулина.
E. Псориаз
Интерлейкин-12 (IL-12) и родственный ему цитокин IL-23 вовлечены в качестве ключевых медиаторов в псориаз. Псориаз включает острые и хронические повреждения кожи, которые ассоциированы с профилем экспрессии цитокинов TH1-типа (Hamid et al. (1996) J. Allergy Clin. Immunol. 1:225-231; Turka et al. (1995) Mol. Med. 1:690-699). Как IL-12, так и IL-23 участвуют в развитии иммунного ответа T-хелперных клеток 1 типа (Th1) при псориазе. Кроме того, в псориатических очагах повреждения кожи сверхэкспрессируется матричная РНК p40 IL-12 и p40 IL-23. Таким образом, антитела или их антигенсвязывающие части по изобретению могут служить для смягчения хронических нарушений кожи, таких как псориаз.
В одном варианте осуществления изобретение относится к способу лечения псориаза. Лечение псориаза часто включает местные кортикостероиды, аналоги витамина D и местные или пероральные ретиноиды, или их комбинации. В одном варианте осуществления антитело против IL-12 и/или IL-23 вводят в комбинации с одним из этих основных способов лечения или в его присутствии. Дополнительные лекарственные средства, которые можно комбинировать с антителом против IL-12 и/или IL-23 для лечения псориаза, более подробно описаны ниже.
Диагностика псориаза обычно основывается на внешнем виде кожи. Кроме того, для исключения других кожных нарушений могут потребоваться биопсия кожи или соскоб и культивирование лоскутов кожи. Если присутствует и не прекращается боль в суставах, то для проверки на псориатический артрит можно использовать рентген.
Мониторинг улучшения при псориазе у субъекта можно проводить с помощью индекса площади и тяжести псориаза (PASI) у субъекта. Способ определения PASI описан в публикациях Fredriksson and Pettersson (1978) Dermatologica 157:238 и Marks et al. (1989) Arch Dermatol 125:235. В кратком изложении, показатель основан на оценке четырех анатомических областей, включая голову, верхние конечности, туловище и нижние конечности, в отношении эритемы, уплотнения и десквамации с использованием шкалы из 5 баллов (0 = нет симптомов; 1 = небольшие симптомы; 2 = умеренные симптомы; 3 = выраженные симптомы; 4 = очень выраженные симптомы). Исходя из распространенности повреждений в данной анатомической области, пораженной площади присваивается числовое значение (0=0; 1=<10%; 2=10-29%; 3=30-49%; 4=50-69%; 5=70=89%; 6=90-100%). Затем вычисляют показатель PASI, где возможный диапазон показателя PASI составляет от 0,0 до 72,0, причем наиболее высокий показатель соответствует полной эритродерме наиболее тяжелой степени.
В одном варианте осуществления изобретения антитело против IL-12 и/или IL-23 используют для лечения псориаза, включая хронический бляшечный псориаз, каплевидный псориаз, инверсный псориаз, пустулезный псориаз, пемфигус обыкновений, эритродермический псориаз, псориаз, ассоциированный с воспалительным заболеванием кишечника (IBD), и псориаз, ассоциированный с ревматоидным артритом (RA). В другом варианте осуществления антитело против IL-12 и/или IL-23, такое как J695/ABT-874, используют для лечения субъектов, которые имеют псориаз в комбинации с PsA. Конкретные типы псориаза, включенные в способы лечения по изобретению, подробно описаны ниже:
a. Хронический бляшечный псориаз
Хронический бляшечный псориаз (также называемый псориазом обыкновенным) представляет собой наиболее распространенную форму псориаза. Хронический бляшечный псориаз характеризуется возвышенными покрасневшими участками кожи, размером в диапазоне от размера монеты до значительно большего размера. При хроническом бляшечном псориазе бляшки могут быть единичными или множественными, они могут варьировать по размеру от нескольких миллиметров до нескольких сантиметров. Бляшки обычно являются красными, с чешуевидной поверхностью и отражают свет, если их осторожно расцарапать, создавая "серебристый" эффект. Очаги повреждения (которые часто являются симметричными) при хроническом бляшечном псориазе возникают по всему телу, но с предрасположенностью к разгибательным поверхностям, включая колени, локти, люмбосакральные области, область черепа и ногти. Иногда хронический бляшечный псориаз может возникать на половом члене, женских наружных половых органах и изгибах, но шелушение обычно отсутствует. Диагноз пациентов с хроническим бляшечным псориазом обычно основан на клинических признаках, описанных выше. В частности, распределение, цвет и типичное серебристое шелушение очага повреждения при хроническом бляшечном псориазе являются характерными для хронического бляшечного псориаза.
b. Каплевидный псориаз
Каплевидный псориаз относится к форме псориаза с характерными чешуйчатыми бляшками в форме капель воды. Обострение каплевидного псориаза обычно происходит после инфекции, особенно стрептококковой инфекции горла. Диагноз каплевидного псориаза обычно основан на внешнем виде кожи и на том факте, что часто в анамнезе встречается недавняя ангина.
c. Инверсный псориаз
Инверсный псориаз представляет собой форму псориаза, при которой пациент имеет гладкие, обычно влажные области кожи, которые являются красными и воспаленными и которые не похожи на чешуйчатость, ассоциированную с бляшечным псориазом. Инверсный псориаз также называют опрелым псориазом или псориазом изгибов. Инверсный псориаз возникает, главным образом, в подмышках, паху, под молочными железами и в других складках кожи вокруг половых органов и ягодиц, и, в результате таких областей расположения, трение и потение могут раздражать поврежденные области.
d. Пустулезный псориаз
Пустулезный псориаз, также называемый ладонно-подошвенным псориазом, представляет собой форму псориаза, которая приводит к заполненным гноем волдырям, которые варьируют по размеру и расположению, но часто они возникают на руках и стопах. Волдыри могут быть локализованными или распространенными на протяжении больших площадей тела. Пустулезный псориаз может быть как мягким, так и болезненным, может вызывать лихорадку.
e. Другие псориатические нарушения
Другие примеры псориатических нарушений, которые можно лечить антителом против IL-12 и/или IL-23, включают эритродермический псориаз, обыкновенный псориаз, псориаз, ассоциированный с IBD, и псориаз, ассоциированный с артритом, включая ревматоидный артрит.
Настоящее изобретение дополнительно проиллюстрировано представленными ниже примерами, которые не следует никоим образом истолковывать как ограничивающие. Содержание всех цитированных ссылок, включая литературные ссылки, выданные патенты и опубликованные патентные заявки, цитированные на протяжении данной заявки, включено в настоящий документ в качестве ссылки в полном объеме. Кроме того, следует понимать, что содержание всех таблиц, прилагаемых к ним (см. приложение A настоящего документа и приложение A патента США № 6914128), а также полное содержание патента США № 6914128 включено в настоящий документ в качестве ссылки.



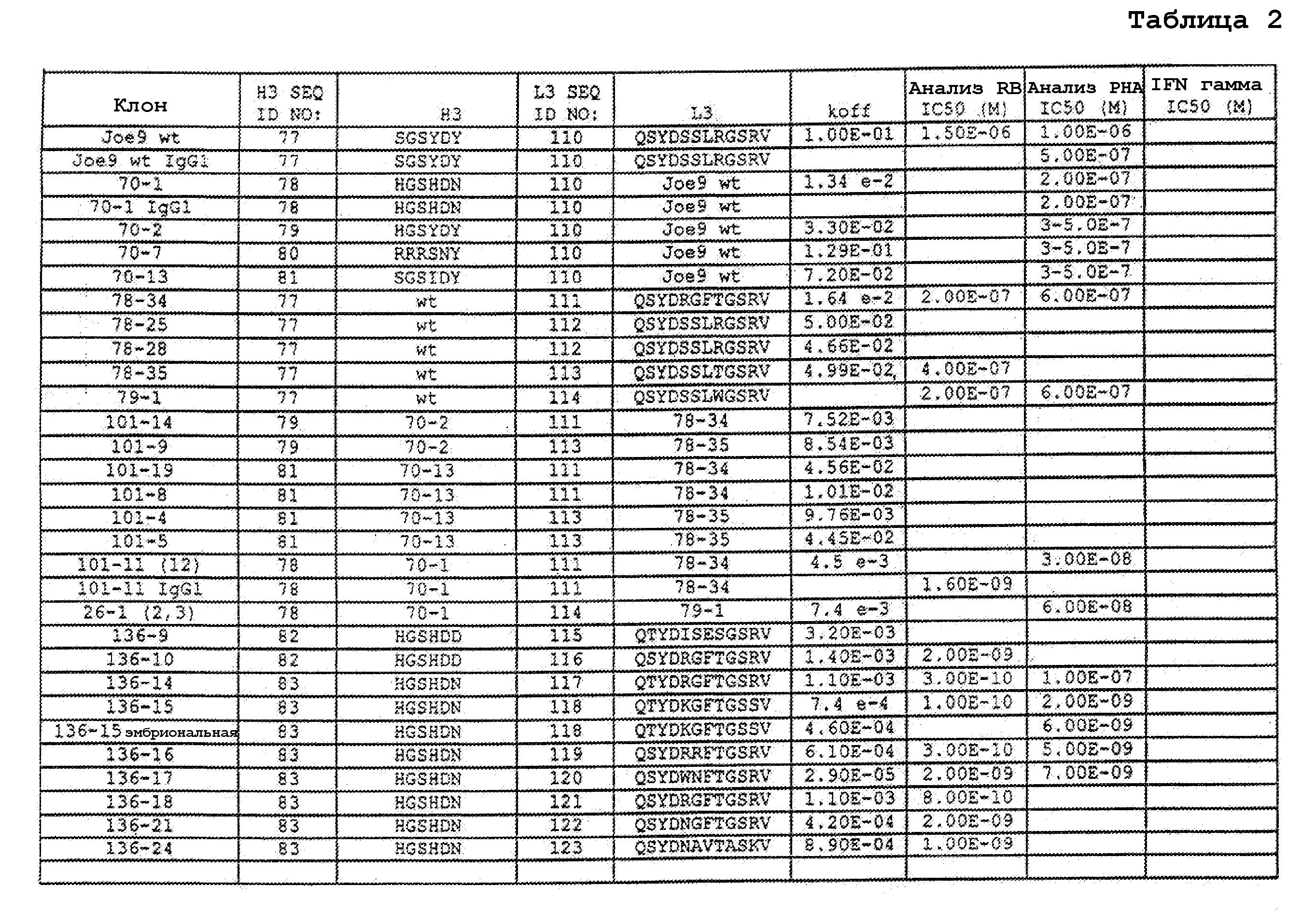
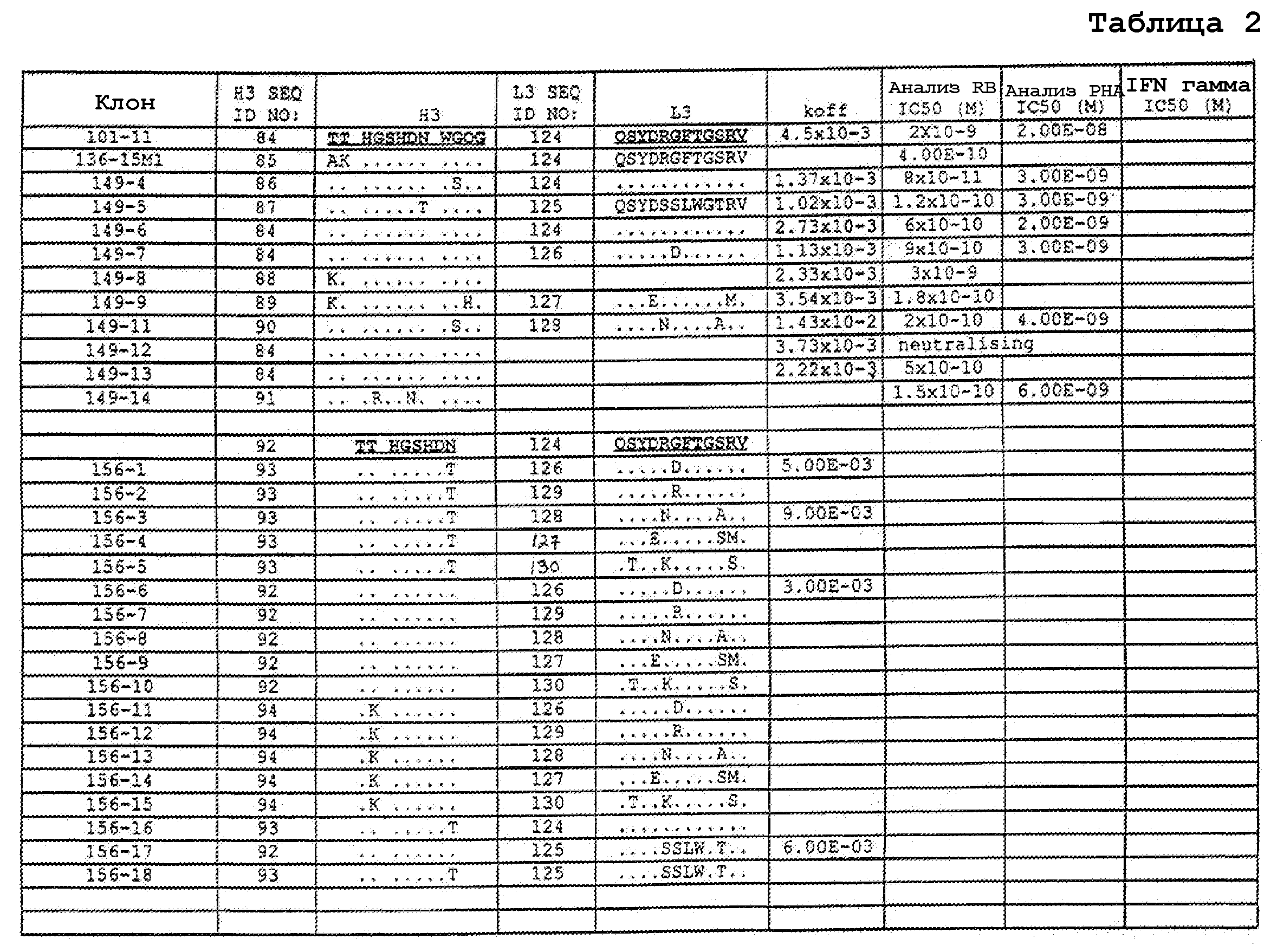
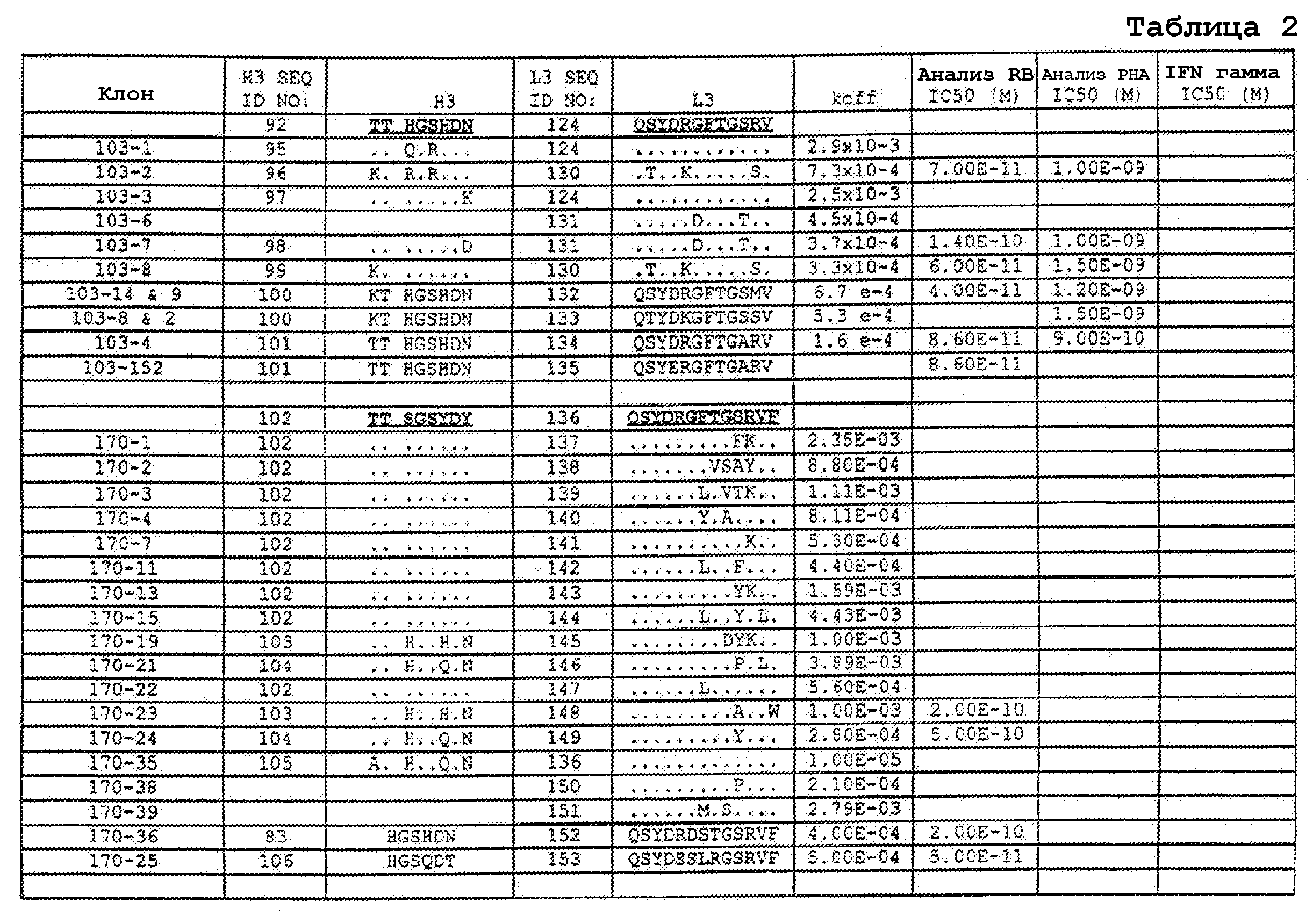
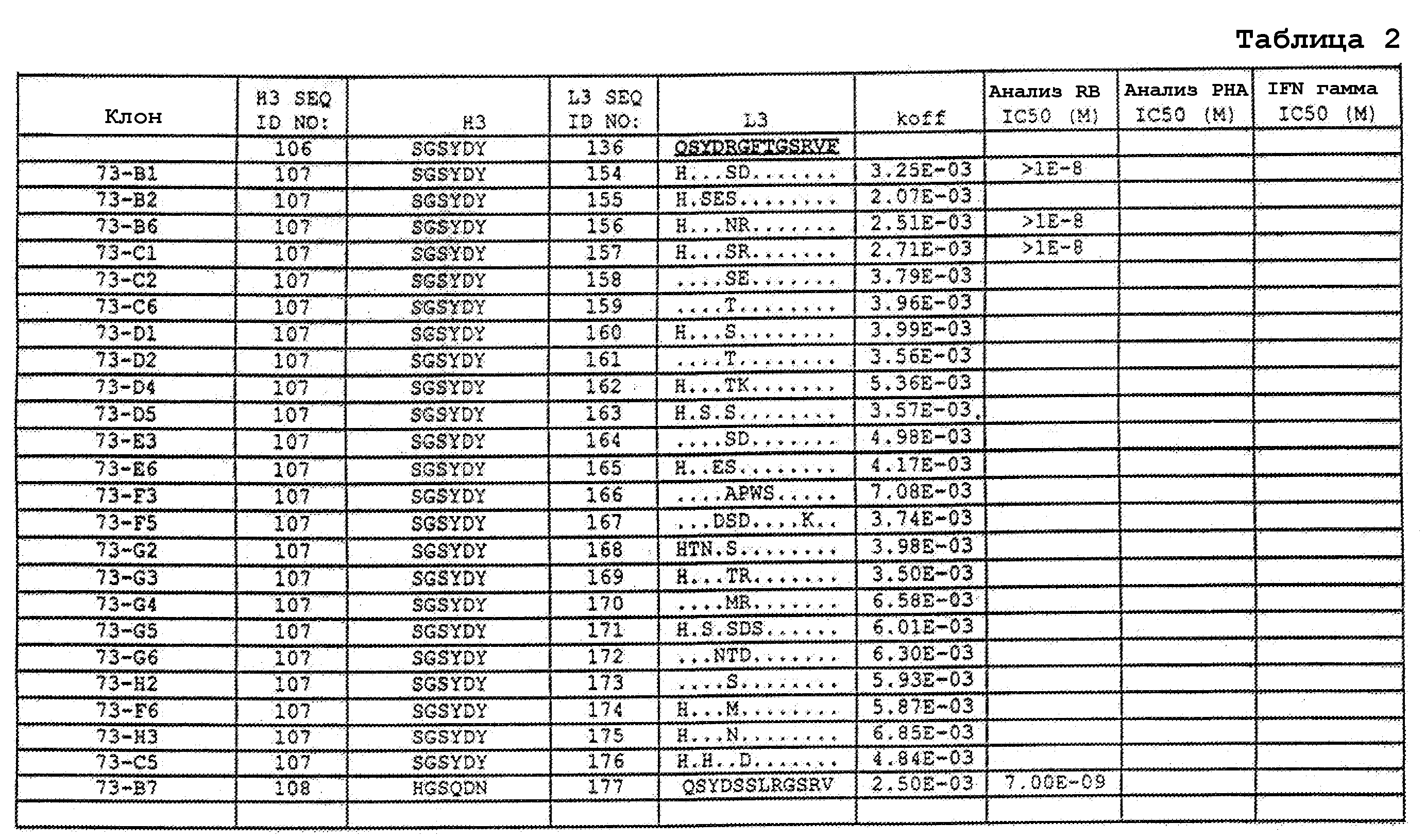
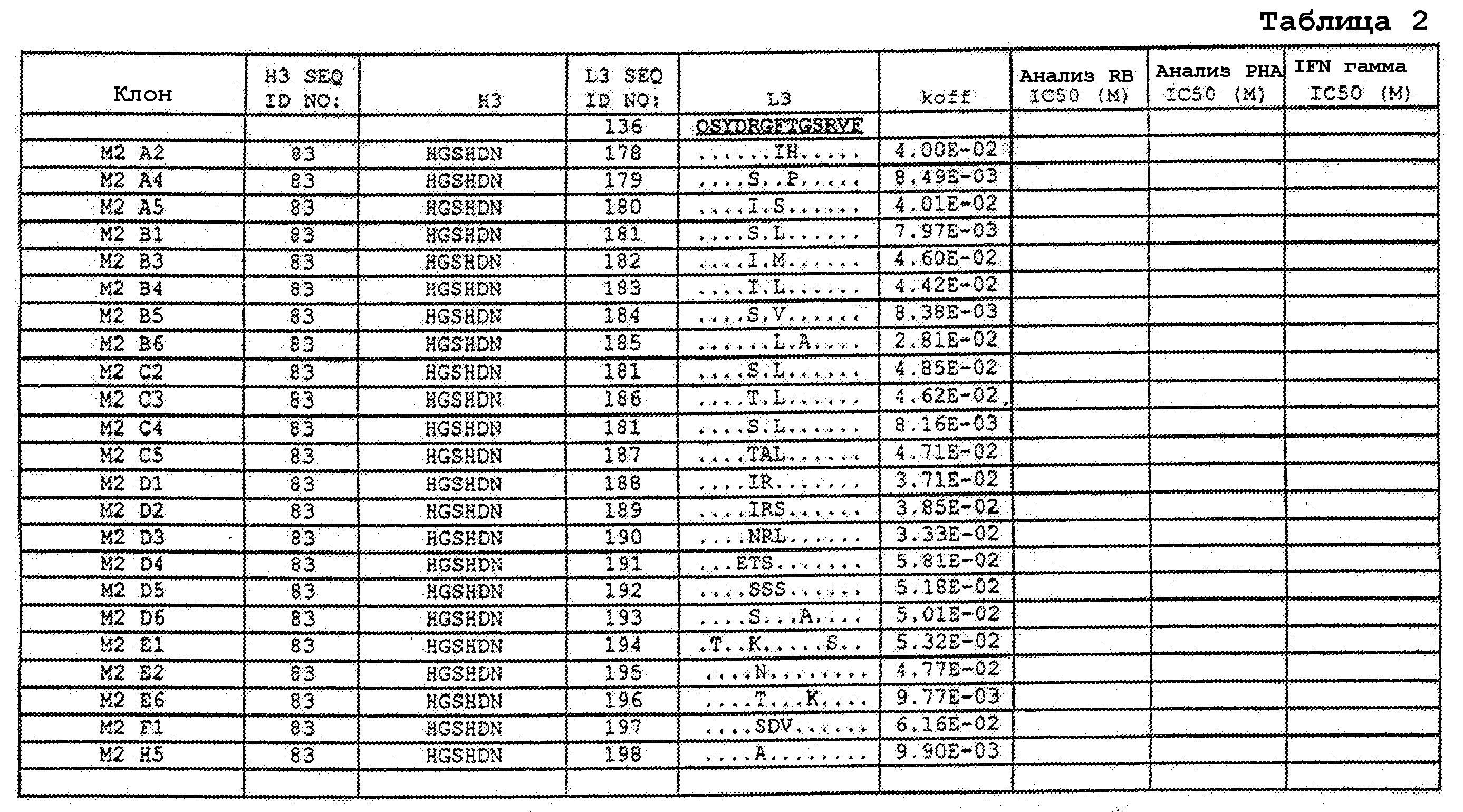
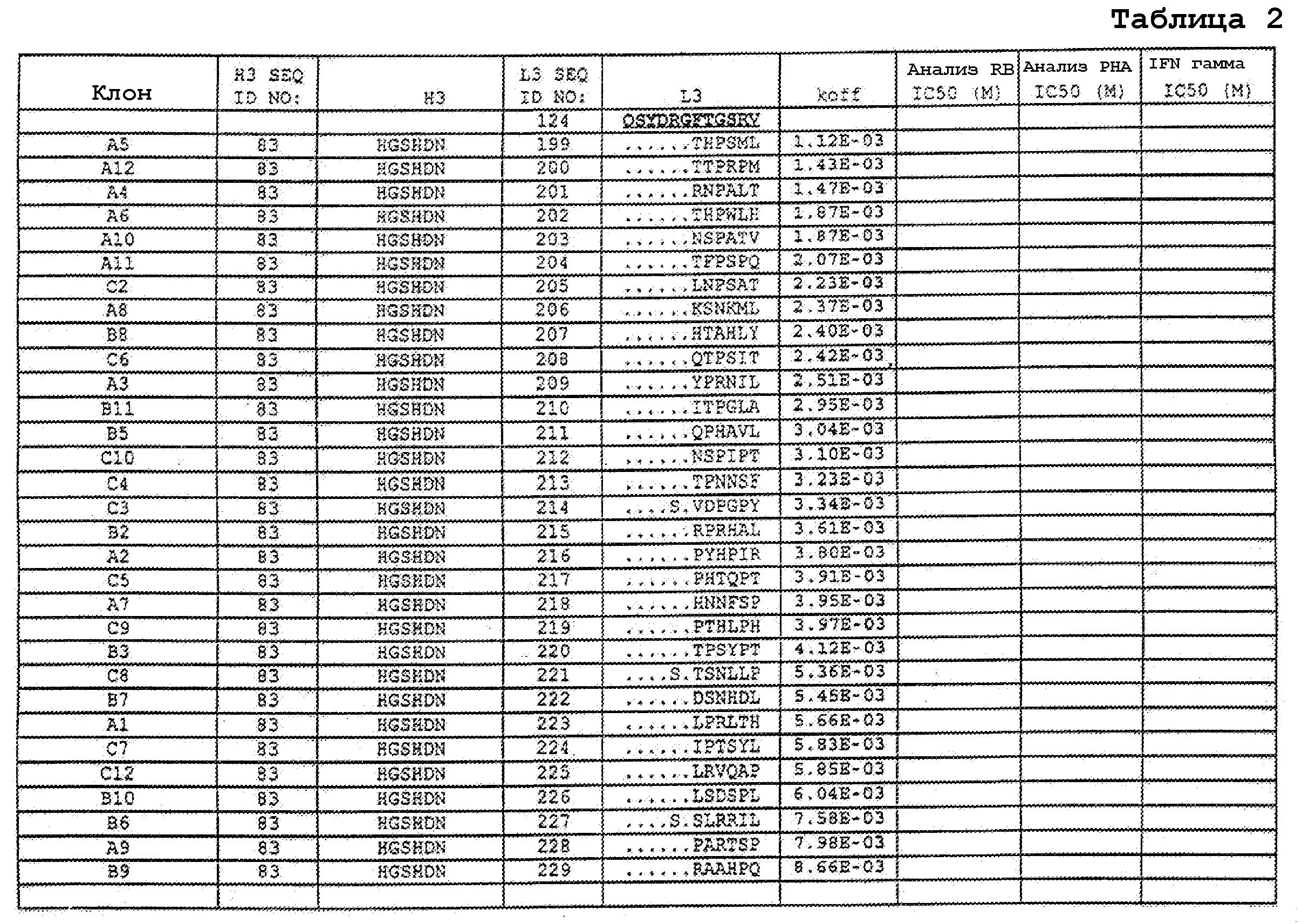

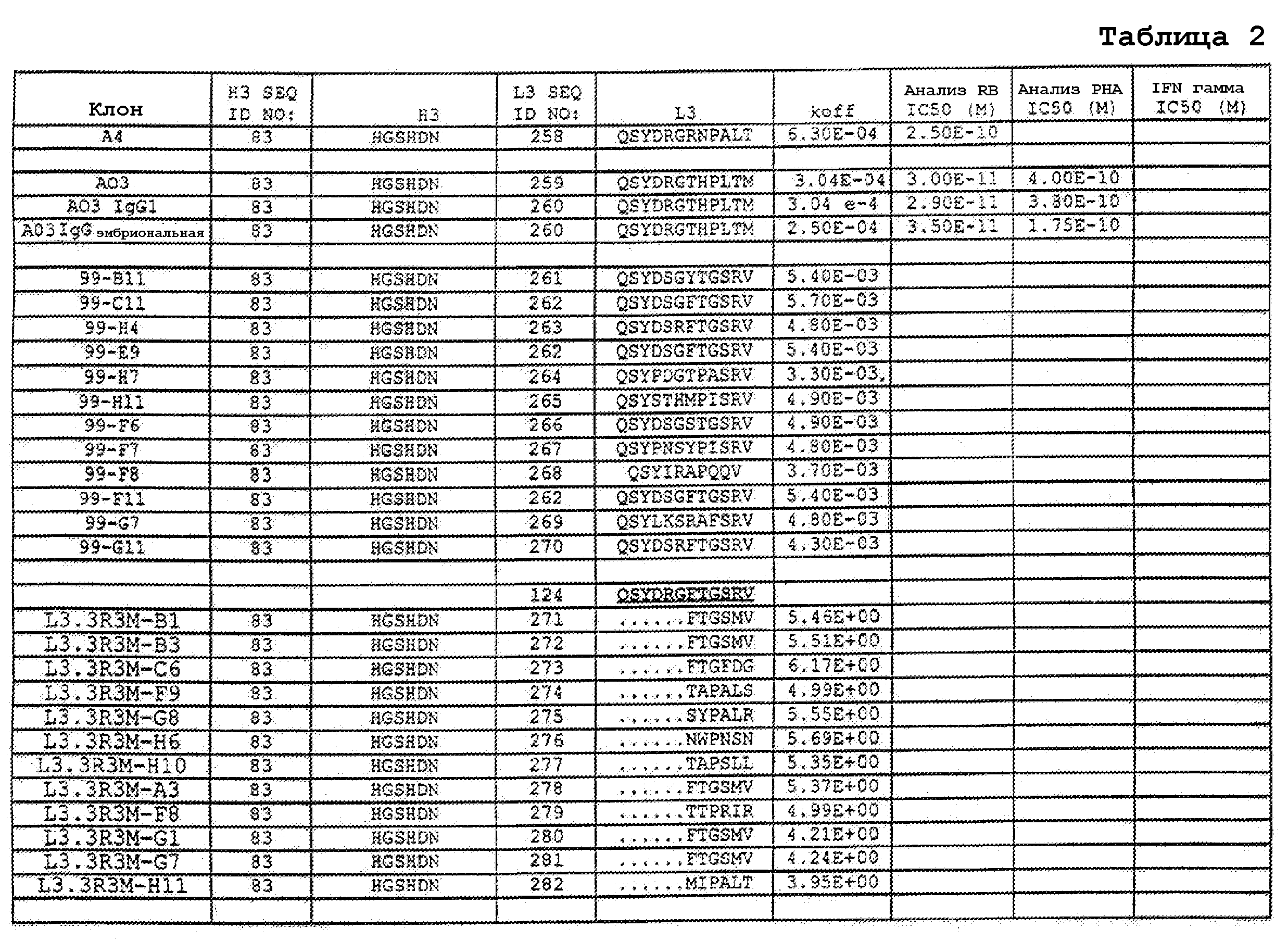
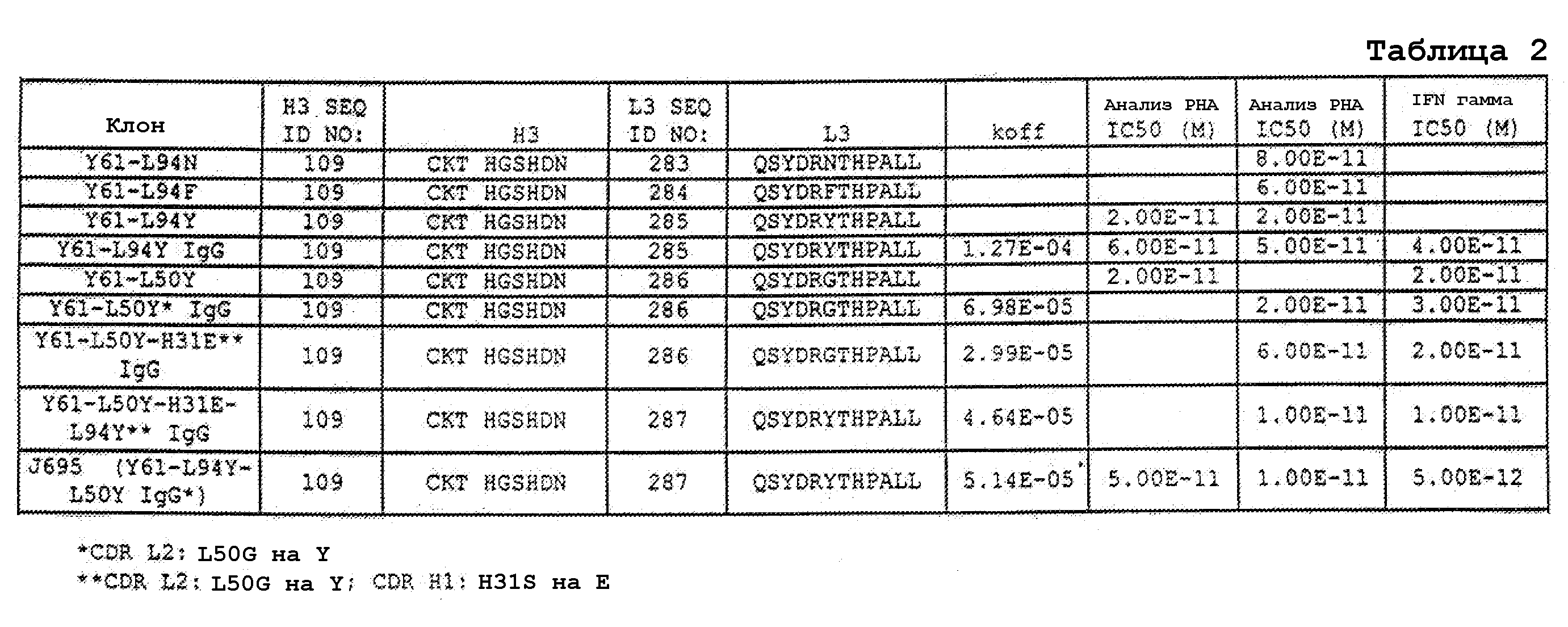

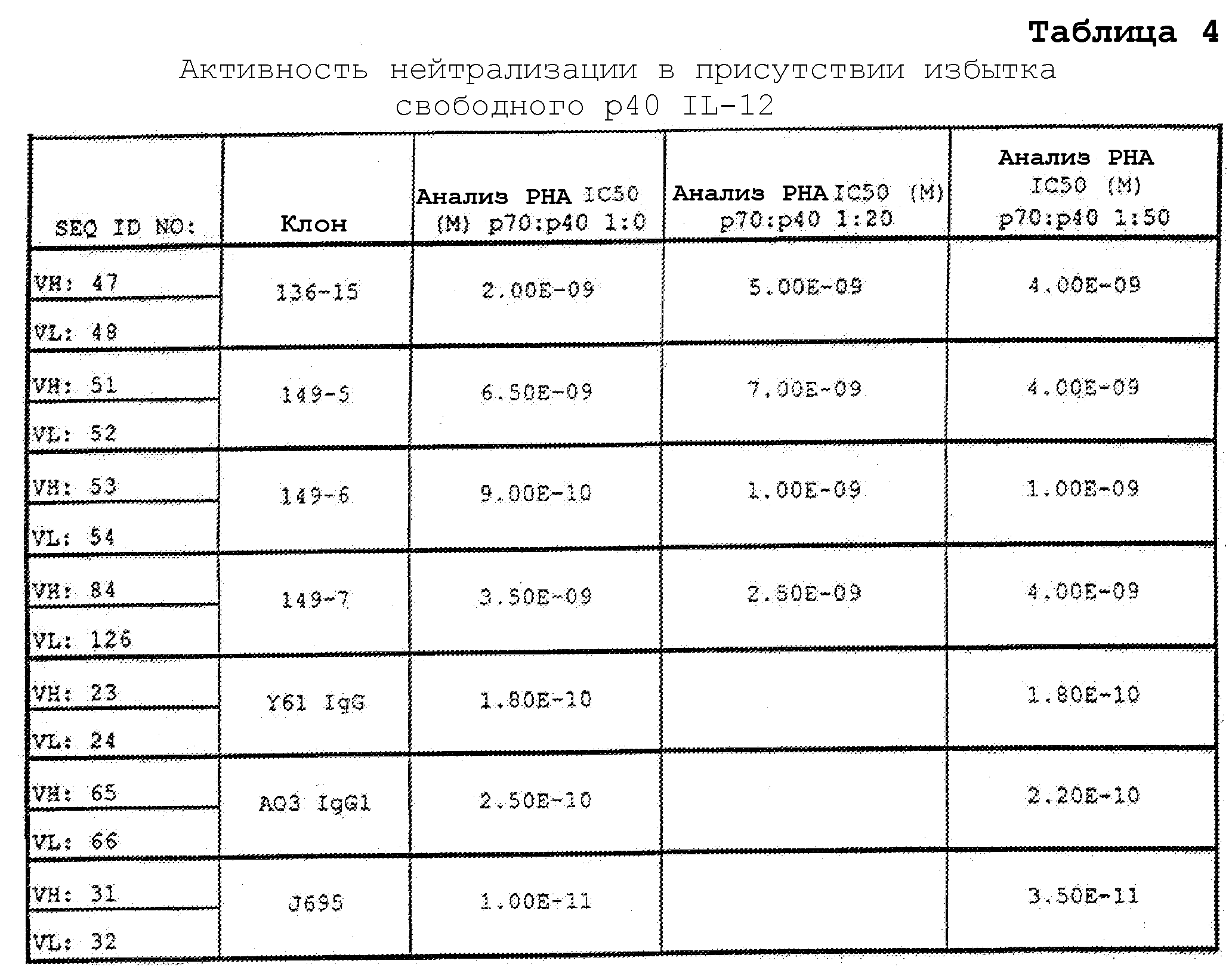
ПРИМЕРЫ
ПРИМЕР 1: Эффективность полностью человеческого моноклонального антитела против IL-12/IL-23, ABT-874, при лечении бляшечного псориаза от умеренного до тяжелого
ABT-874 представляет собой полностью человеческое антитело против интерлейкина-12 (IL-12) и IL-23. Оно с высокой аффинностью связывается с субъединицей p40, общей для IL-12 и IL-23, оба из которых являются подтвержденными мишенями при лечении псориаза (Ps).
Задачей описанного далее исследования была оценка эффективности подкожных инъекций ABT-874 при лечении пациентов с бляшечным Ps от умеренного до тяжелого.
Для этого 12-недельного, двойного слепого, плацебо-контролируемого исследования были пригодны взрослые пациенты с Ps, поражающим ≥10% площади поверхности тела (BSA), и показателем индекса площади и тяжести псориаза (PASI) ≥12 на исходном уровне. Пациентов случайным образом определяли в 1 из 6 групп: 1) 100-мг ABT-874 раз в две недели (eow) в течение 12 недель; 2) одна 200-мг доза ABT-874 на 0 неделе; 3) 200-мг ABT-874 раз в неделю в течение 4 недель; 4) 200-мг ABT-874 eow в течение 12 недель; 5) 200-мг ABT-874 раз в неделю в течение 12 недель; или 6) плацебо. Первичным результатом был ответ ≥PASI75 на 12 неделе. Другие оценки эффективности включали PASI50 и общую оценку врача (PGA). Пациентов, которые удовлетворяли первичному результату, включали в 36-недельную слепую фазу/фазу повторного введения и их подвергали мониторингу в течение времени до утраты ответа.
В исследование было включено всего 180 пациентов, по 30 в каждой группе. Исходные характеристики были сходными между группами, и они указывали на Ps от умеренного до тяжелого (все средние значения, за исключением % мужчин): возраст: 46 лет, 74% мужчин; длительность Ps: 21 год; PASI 19; и 25% пораженной BSA. На 12 неделе процент пациентов, достигших ≥PASI75, был статистически значимо более высоким для пациентов в каждой из 5 групп ABT-874 относительно плацебо (93%, 63%, 90%, 93%, 90% против 3%, соответственно, p<0,001, ITT). Кроме того, процент пациентов, достигших ≥PASI50, был статистически значимо более высоким для пациентов в каждой из 5 групп ABT-874 относительно плацебо (100%, 77%, 97%, 97% и 100% против 17%, p<0,001). Среднее процентное снижение (улучшение) PASI на 12 неделе составило 90%, 70%, 92%, 92% и 90%, соответственно, в группах ABT-874, и 26% для плацебо. Аналогично, проценты пациентов с PGA "отсутствие признаков"/"минимальные признаки" составили 83%, 50%, 73%, 87% и 87%, соответственно, в группах ABT-874, и 3% для плацебо.
В заключение, ABT-874 было в значительной степени более эффективным, чем плацебо, при лечении бляшечного псориаза от умеренного до тяжелого.
ПРИМЕР 2: Безопасность и эффективность полностью человеческого моноклонального антитела против IL-12/-23, ABT-874, при лечении бляшечного псориаза от умеренного до тяжелого
ABT-874 представляет собой полностью человеческое антитело против интерлейкина 12 (IL-12) и IL-23. Оно связывается с высокой аффинностью с субъединицей p40, общей для IL-12 и IL-23, подтвержденных мишеней при лечении псориаза (Ps). Задачей этой фазы II испытания было исследование эффективности и безопасности подкожных инъекций ABT-874 при лечении бляшечного Ps от умеренного до тяжелого.
Для этого 12-недельного, двойного слепого, плацебо-контролируемого исследования были пригодны взрослые пациенты с Ps, поражающим ≥10% площади поверхности тела (BSA), и показателем PASI ≥12. Пациентов случайным образом определяли в 1 из 6 групп: 1) 100-мг ABT-874 раз в две недели (eow) в течение 12 недель; 2) одна 200-мг доза ABT-874 на 0 неделе; 3) 200-мг ABT-874 раз в неделю в течение 4 недель; 4) 200-мг ABT-874 eow в течение 12 недель; 5) 200-мг ABT-874 раз в неделю в течение 12 недель; или 6) плацебо. Первичным результатом был ответ ≥PASI75 на 12 неделе. Пациентов, которые удовлетворяли первичному результату, включали в 36-недельную слепую фазу/фазу повторного введения и их подвергали мониторингу в течение времени до утраты ответа. Безопасность оценивали у всех пациентов до 54 недели.
В исследование было включено всего 180 пациентов, по 30 в каждой группе. Исходные характеристики были сходными между группами (представлены средние значения, за исключением % мужчин): возраст: 46 лет, 74% мужчин; длительность Ps: 21 год; PASI=19; и 25% пораженной BSA. На 12 неделе % пациентов с ≥PASI75 был статистически значимо более высоким для пациентов в каждой из 5 групп ABT-874 относительно плацебо (93%, 63%, 90%, 93%, 90% против 3%, соответственно, p<0,001, ITT). В ходе 12-недельной, двойной слепой фазы инфекционные AE для групп ABT-874 находились в диапазоне 23-43% и для группы плацебо они составили 23%, причем наиболее распространенным был назофарингит (7-17% для ABT-874; 3% для плацебо). Между группами не было статистически значимых отличий. Не было описано тяжелых инфекционных AE и не было смертей.
В заключение, ABT-874 было в значительной степени более эффективным, чем плацебо, при лечении Ps от умеренного до тяжелого, и, как оказалось, оно имело благоприятный профиль безопасности.
ПРИМЕР 3: Сохранение ответа с помощью полностью человеческого моноклонального антитела против IL-12/-23, ABT-874, при лечении бляшечного псориаза от умеренного до тяжелого
Эффективность и безопасность ABT-874 оценивали в 12-недельном, рандомизированном контролируемом испытании фазы II и 36-недельной фазе наблюдения. Задачей представленного ниже примера был анализ сохранения ответа после прекращения терапии в течение вторых 12 недель этого испытания фазы II подкожных инъекций ABT-874 при лечении бляшечного Ps от умеренного до тяжелого.
Для этого 12-недельного, двойного слепого, плацебо-контролируемого исследования были пригодны взрослые пациенты с Ps, поражающим ≥10% площади поверхности тела (BSA), и показателем PASI ≥12. Пациентов случайным образом определяли в 1 из 6 групп:
1) 100-мг ABT-874 раз в две недели (eow) в течение 12 недель;
2) одна 200-мг доза ABT-874 на 0 неделе;
3) 200-мг ABT-874 раз в неделю в течение 4 недель;
4) 200-мг ABT-874 eow в течение 12 недель;
5) 200-мг ABT-874 раз в неделю в течение 12 недель; или
6) плацебо.
Первичным результатом был ответ ≥PASI75 на 12 неделе. Пациентов, которые удовлетворяли первичному результату, включали в 36-недельную слепую фазу/фазу повторного введения. Введение исследуемого лекарственного средства прекращали и пациентов подвергали мониторингу в течение времени до утраты ответа (снижение показателя PASI, в любой момент времени в течение 36-недельного периода наблюдения, до <PASI 50). Сохранение ответа PASI оценивали до 24 недели.
В исследование было включено всего 180 пациентов, по 30 в каждой группе. Исходные характеристики были сходными между группами (представлены средние значения, за исключением % мужчин): возраст: 46 лет, 74% мужчин; длительность Ps: 21 год; PASI=19; и 25% пораженной BSA.
На 12 неделе % пациентов с ≥PASI75 был статистически значимо более высоким для пациентов в каждой из 5 групп ABT-874 относительно плацебо (таблица 1). На 24 неделе у значительного процента отвечающих пациентов с PASI 75 в группах активного лечения сохранялся по меньшей мере ответ PASI 50.
|
В заключение, ABT-874 было в значительной степени более эффективным, чем плацебо, при лечении бляшечного Ps от умеренного до тяжелого. У значительного процента отвечающих пациентов с PASI 75 сохранялись эти ответы на 24 неделе после прекращения активной терапии.
ПРИМЕР 4: Безопасность и эффективность ABT-874, полностью человеческого моноклонального антитела против IL-12/-23, при лечении хронического бляшечного псориаза от умеренного до тяжелого
Задачей следующего примера была демонстрация эффективности и безопасности диапазона доз моноклонального антитела человека против IL-12/23 (ABT-874) по сравнению с плацебо при лечении пациентов с клинически стабильным хроническим бляшечным псориазом от умеренного до тяжелого.
I. Материалы и способы
A. Схема эксперимента: Описанное ниже исследование представляло собой 12-недельное, многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое испытание фазы II, которое проводили в 24 центрах в США (16 центров) и Канаде (8 центров). ABT-874 (Abbott Laboratories, Abbott Park, IL) представляет собой моноклональные антитело человека с измененными способами генетической инженерии областями, определяющими комплементарность, которые обладают высокой аффинностью к белку субъединицы p40 IL-12/23. Пациентов случайным образом разделяли в соотношении 1:1:1:1:1:1 на группы для прохождения 1 из 6 курсов лечения: 200 мг ABT-874, 1 доза на 0 неделе (200 мг × 1); 100 мг ABT-874 раз в две недели (eow) в течение 12 недель (100 мг eow); 200 мг ABT-874 раз в неделю в течение первых 4 недель (200 мг × 4); 200 мг ABT-874 eow в течение 12 недель (200 мг eow); 200 мг ABT-874 раз в неделю в течение 12 недель (200 мг раз в неделю); или плацебо. После 12 недели все пациенты, которые достигли ответа в виде по меньшей мере 75% снижения индекса площади и тяжести псориаза (PASI 75), продолжили исследование в 36-недельной фазе слепого наблюдения/повторного введения.
B. Пациенты: Возраст пациентов составлял ≥18 лет, и они имели клинический диагноз псориаза в течение по меньшей мере 6 месяцев (определенный по беседе с пациентом и по подтверждению диагноза при физикальном обследовании исследователем), стабильный бляшечный псориаз в течение по меньшей мере 2 месяцев до скрининга и при исходных посещениях, исходя из беседы с субъектом, бляшечный псориаз от умеренного до тяжелого, определенный по вовлечению ≥10% площади поверхности тела (BSA) при исходном посещении, показателю PASI ≥12 при исходном посещении и, по общей оценке врача (PGA), по меньшей мере умеренное заболевание при исходном посещении.
Пациентов не включали в исследование, если они ранее подвергались воздействию системной или биологической терапии против IL-12; имели небляшечный псориаз; не могли прекратить следующее лечение перед исходным визитом: местная терапия псориаза по меньшей мере за 2 недели, фототерапия ультрафиолетовым излучением B по меньшей мере за 2 недели, псорален-фототерапия ультрафиолетовым излучением по меньшей мере за 4 недели, системная терапия по меньшей мере за 4 недели и биологическая терапия по меньшей мере за 12 недель; испытывали необходимость в приеме пероральных или инъецируемых кортикостероидов в ходе исследования (ингалируемые кортикостероиды для стабильных медицинских состояний были допустимы); имели обострение астмы, требующее госпитализации, в течение 10 лет перед скринингом; имели инфекцию или факторы риска для тяжелой инфекции; имели злокачественные опухоли в анамнезе, отличные от успешно вылеченной базально-клеточной карциномы (пациентов с плоскоклеточной карциномой в анамнезе исключали) или карциномы шейки матки in situ; или имели тяжелую иммунологическую реакцию в анамнезе (например, сывороточную болезнь или анафилактическую реакцию) на средство, содержащее иммуноглобулин G (например, внутривенный гамма-глобулин, слитый белок или моноклональное антитело).
Пациентам позволяли продолжать лечение лечебными шампунями, которые не содержат кортикостероидов, мягкими (без бета- или альфа-гидроксикислот) смягчителями или низкоэффективными местными кортикостероидами класса VI или VII на ладонях, подошвах стоп, лице, воспаленных областях и паховой области в ходе исследования. Эти местные лекарственные средства против псориаза не применяли в пределах 24 часов до посещения для исследования. Вакцинация живыми вирусными агентами не допускалась в пределах 1 месяца до введения доз ABT-874, в ходе исследования или в течение 1 месяца после введения последней дозы исследуемого лекарственного средства.
Появление какого-либо из следующих клинически значимых аномальных лабораторных результатов приводило к немедленному прекращению исследования пациента: аспартаттрансаминаза или аланинтрансаминаза в >5 раз выше верхней границы нормы; общий сывороточный билирубин в >3 раз выше верхней границы нормы; сывороточный креатинин в >3 раз выше верхней границы нормы; креатинфосфокиназа в >5 раз выше верхней границы нормы; гемоглобин <8 г/дл; уровень лейкоцитов в крови <2×109/л; или уровень тромбоцитов в крови <75×109/л.
C. Оценка эффективности: Главным оцениваемым показателем эффективности был процент пациентов, достигших ответа PASI 75 на 12 неделе, определенный как по меньшей мере 75% снижение показателя PASI относительно исходного показателя. PASI является показателем тяжести псориатических очагов повреждения (с точки зрения эритемы, уплотнения и десквамации) и степени вовлечения BSA. Показатель PASI находится в диапазоне от 0 (нет псориаза) до 72 (тяжелое заболевание) (Fredriksson T, Pettersson U. Dermatologica 1978; 157: 238-44). Другие показатели эффективности включали процент пациентов, достигших по меньшей мере PASI 75 на 1, 2, 4 и 8 неделе; процент пациентов, достигших по меньшей мере PASI 50 или PASI 90 на 1, 2, 4, 8 и 12 неделе; и процент пациентов, достигших PGA "отсутствие признаков" или "минимальные признаки" на 12 неделе и на 1, 2, 4 и 8 неделе. PGA является показателем тяжести заболевания по шкале из 6 баллов в диапазоне от 0 (нет заболевания или "отсутствие признаков") до 5 (крайне тяжелое) (Ko H-S. Clinical trial design in psoriasis. Presented at: 49th Meeting of the Dermatologic and Ophthalmologic Advisory Committee; March 20, 1998; Bethesda, MD).
D. Оценка безопасности: На протяжении исследования оценивали неблагоприятные действия, лабораторные данные и показатели жизнедеятельности. Пациентов подвергали тщательному мониторингу в отношении признаков инфекции, злокачественности и иммунологической реакции. Возникшие вследствие лечения AE определяли как явления, которые возникали между 0 неделей и ранее чем через 45 суток после последнего не пропущенного исследования дозы лекарственного средства или до 1 суток перед первой дозой повторного введения (для пациентов, продолжающих 36-недельное испытание).
E. Статистический анализ: Размер выборки вычисляли с использованием nQuery Advisor® 4.0 (Statistical Solutions, Saugus, MA). Допуская, что 15% пациентов в группе плацебо могут достигнуть ответа PASI 75 на 12 неделе, разработчики исследования определили, что размер выборки, составляющий 26 в каждой группе дозирования, может быть достаточным для детекции по меньшей мере 45% отличия от группы лечения с использованием точного критерия Фишера с мощностью 90% при 2-стороннем уровне значимости, составляющем 0,05. Исследование было запланировано так, чтобы оно включало приблизительно 180 пациентов, с 30 пациентами в каждой группе.
Подвергаемая лечению группа включала всех пациентов, которых случайным образом распределили на 0 неделе, и она получала по меньшей мере 1 инъекцию исследуемого лекарственного средства; эту группу использовали для анализов эффективности. Все тесты проводили при α=0,05. Для всех анализов эффективности использовали определение не отвечающего пациента; любого пациента с отсутствующим показателем PASI или PGA при любом посещении считали не отвечающим при этом посещении. Для оценки влияния отсутствующих данных проводили анализы чувствительности для данных 12 недели с использованием способа переноса данных последнего наблюдения. Первичный анализ ответа PASI 75 на 12 неделе проводили с использованием следующего последовательного порядка для коррекции по многозначности: 200 мг раз в неделю против плацебо, 200 мг eow против плацебо, 100 мг eow против плацебо, 200 мг × 4 против плацебо и 200 мг × 1 против плацебо. Разницу лечения между каждой группой введения ABT-874 и группой плацебо по среднему процентному изменению показателя PASI оценивали, используя дисперсионный анализ, с исходным показателем PASI и группой введения в качестве факторов. Анализ безопасности проводили с использованием выборки безопасности, которая включала всех пациентов, которым проводили по меньшей мере 1 инъекцию исследуемого лекарственного средства.
II. Результаты
A. Пациенты: Всего 180 пациентов были включены и случайным образом распределены в 1 из 6 групп введения (фигура 1). Большинство пациентов (76,7% пациентов, которым вводили плацебо, и 98% всех пациентов из групп введения ABT-874) завершили 12-недельную часть исследования.
В группах лечения пациенты были сопоставимыми в отношении демографических характеристик и активности заболевания (таблица 1). Пациентами, главным образом, были мужчины (74,4%) и белые (92,2%). Среднее вовлечение BSA составляло 25%, и средний показатель PASI составлял 18,8.
B. Эффективность: Процент пациентов, достигших первичного результата в виде ответа PASI 75 на 12 неделе, был статистически значимо более высоким (p<0,001) во всех группах введения ABT-874 (200 мг × 1: 63,3%, 19 из 30; 100 мг eow: 93,3%, 28 из 30; 200 мг × 4: 90,0%, 27 из 30; 200 мг eow: 93,3%, 28 из 30; 200 мг раз в неделю: 90,0%, 27 из 30) по сравнению с плацебо (3,3%, 1 из 30). В течение относительно короткого периода этого испытания отвечающие пациенты с PASI 75 во всех группах введения ABT-874 были сходны, за исключением группы введения 200 мг × 1 (фигура 2).
Анализ подгрупп по демографическим показателям (пол, возраст, раса и масса тела), исходным характеристикам заболевания (анамнез псориатического артрита, BSA и показатель PASI) и исходной терапии псориаза в пределах 12 месяцев от получения исследуемого лечения (системная биологическая и небиологическая, местная и фототерапия) показал, что пациенты, которым вводили ABT-874 в различных подгруппах, устойчиво достигали высоких уровней ответа PASI 75 на 12 неделе.
Практически 100% в группах с более высокой дозировкой ABT-874 достигали по меньшей мере PASI 50 на 12 неделе (200 мг × 1: 76,7%, 23 из 30; 100 мг eow: 100,0%, 30 из 30; 200 мг × 4: 96,7%, 29 из 30; 200 мг eow: 96,7%, 29 из 30; 200 мг раз в неделю: 100,0%, 30 из 30; плацебо: 16,7%, 5 из 30; p<0,001 для каждого сравнения с плацебо). Процент пациентов, достигших по меньшей мере ответа PASI 90 на 12 неделе, был на статистически значимом уровне более высоким (p<0,001) во всех группах введения ABT-874, кроме одной (200 мг × 1), по сравнению с плацебо, следующим образом: 200 мг × 1: 16,7%, 5 из 30; 100 мг eow: 53,3%, 16 из 30; 200 мг × 4: 63,3%, 19 из 30; 200 мг eow: 76,6%, 23 из 30; 200 мг раз в неделю: 53,3%, 16 из 30; и плацебо: 0%, 0 из 30. Кроме того, на 12 неделе значительно большее число пациентов (p<0,001) во всех группах введения ABT-874 достигло оценки PGA "отсутствие признаков" или "минимальные признаки", по сравнению с пациентами группы плацебо, следующим образом: 200 мг × 1: 50,0%, 15 из 30; 100 мг eow: 83,3%, 25 из 30; 200 мг × 4: 73,3%, 22 из 30; 200 мг eow: 86,7%, 26 из 30; 200 мг раз в неделю: 86,7%, 26 из 30; против плацебо: 3,3%, 1 из 30.
Процент пациентов, достигших первичного результата в виде ответа PASI 100 на 12 неделе, был статистически значимо более высоким (p<0,001) в следующих группах введения ABT-874 (200 мг eow: 46,7%, 14 из 30; 200 мг раз в неделю: 36,7%, 11 из 30) по сравнению с плацебо (0%, 0 из 30).
Ответ на ABT-874 был быстрым. Средний процент улучшения показателей PASI по сравнению с исходным уровнем повышался с течением временем для всех групп введения ABT-874 (фигура 3) и был статистически значимо более высоким для каждой группы введения ABT-874 по сравнению с плацебо в каждый момент времени (p<0,001, за исключением группы 100 мг eow на 1 неделе, p=0,023).
C. Безопасность: терапия ABT-874, в целом, была хорошо переносимой (таблица 2). Один (0,7%) пациент, которому вводили ABT-874, прекратил исследование из-за локального обесцвечивания кожи; 2 (6,7%) пациента, которым вводили плацебо, прекратили исследование, 1 вследствие псориатической артропатии и 1 вследствие рака яичников. Два (1,1%) пациента испытывали тяжелые побочные действия (AE); у 1 пациентки, которой вводили плацебо, был диагностирован рак яичников на 37 сутки, и у 1 пациента, которому вводили ABT-874 (200 мг × 1), диагностировали реберный хондрит на 10 сутки. Ни один пациент не перенес инфарктов миокарда или головного мозга, и не было смертей.
Пациенты, которые получали любую дозу ABT-874, статистически значимо (p=0,033) с большей вероятностью, чем пациенты, которые получали плацебо, испытывали AE, по меньшей мере возможно связанное с исследуемым лекарственным средством (ABT-874: 36,0%, 54 из 150; плацебо: 10,0%, 3 из 30; таблица 2); большинство из этих AE были связаны с областью инъекции (реакция области инъекции, эритема, зуд или раздражение).
Большинство AE были мягкими (мягкие AE встречались у 46,0% [69 из 150] пациентов, которым вводили ABT-874, и 30,0% [9 из 30] пациентов, которым вводили плацебо). Наиболее распространенным AE была реакция области инъекции, встречавшаяся у 16,7% (25 из 150) пациентов, которым вводили какую-либо дозу ABT-874 (нет описанных реакций области инъекции для пациентов, которым вводили плацебо; p=0,028; таблица 3). Не было статистически значимых отличий между встречаемостью других AE у пациентов, которым вводили ABT-874, по сравнению с пациентами, которым вводили плацебо. Следующим из наиболее часто описываемых AE были назофарингит и инфекция верхних дыхательных путей.
Инфекционные AE были описаны как 32,8% (59 из 180) из всех пациентов (плацебо: 23,3%, 7 из 30; все пациенты, которым вводили ABT-874: 34,7%, 52 из 150). Наиболее распространенными инфекционными AE, описанными для любой группы введения ABT-874, были назофарингит (12,0%, 18 из 150), инфекция верхних дыхательных путей (10,7%, 16 из 150) и бронхит и вирусная инфекция ( и то и другое 2,7%, 4 из 150). Не было сообщений о тяжелых инфекционных AE.
Для двух пациентов в ходе исследования сообщалось о злокачественных опухолях. У одной пациентки, которой вводили плацебо, был диагностирован рак яичников, который по данным развивался со 129 суток. У одного пациента, которому вводили ABT-874 (200 мг × 4), был диагностирован немеланомный рак кожи (плоскоклеточная карцинома), которую удалили на 133 сутки. Медицинский анамнез для этого пациента включал удаление доброкачественной опухоли кожи в марте 2005 года.
Не было клинически значимых изменений гематологии, химии (включая концентрации глюкозы в крови) или показателей жизнедеятельности по сравнению с плацебо.
|
|
|
|
III. Заключение
Многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое испытание фазы II, описанное в данном примере, продемонстрировало статистически и клинически значимую эффективность ABT-874 при лечении хронического бляшечного псориаза от умеренного до тяжелого. За исключением группы введения ABT-874 200 мг × 1, 90% или более пациентов во всех группах введения ABT-874 достигали PASI 75 или более к 12 неделе, по сравнению с 3,3% пациентов, которым вводили плацебо. Даже в группе, которой вводили только 1 дозу исследуемого лекарственного средства (200 мг × 1), большинство (63,3%) пациентов достигли по меньшей мере PASI 75 к 12 неделе. Кроме того, практически 100% пациентов, которым вводили ABT-874, достигли PASI 50 или более, что считали клинически значимым улучшением (Carlin CS, Feldman SR, Krueger JG, Menter A, Krueger GG. J Am Acad Dermatol 2004; 50: 859-66), к 12 неделе. Итоги для других вторичных ожидаемых результатов, таких как PASI 90 и PGA "отсутствие признаков" или "минимальные признаки", согласовывались с первичным анализом эффективности и подтверждали его.
Ответ на ABT-874 был быстрым. Статистически значимое разделение между пациентами, которым вводили плацебо и ABT-874, происходило уже на 1 неделе с точки зрения среднего процентного улучшения показателей PASI. Улучшение сохранялось в течение 12 недель испытания, даже у пациентов в группах с дозами ABT-874 200 мг × 1 и 200 мг × 4.
ABT-874 был хорошо переносимым, и большинство AE были мягкими. Хотя пациенты, которым вводили ABT-874, со значительно большей вероятностью испытывали AE, по меньшей мере возможно связанные с исследуемым лекарственным средством, большинство из них представляли собой AE, связанные с областью инъекции (реакция области инъекции, эритема, зуд или раздражение). Не было очевидной связи между повышенной дозой ABT-874 и увеличенным числом случаев AE. Следует отметить, что не было инфарктов миокарда или головного мозга.
Связанные с иммунной системой побочные действия представляют особый интерес в случае пациентов, которым вводили антитела против IL-12/23. Наиболее часто описанными инфекционными AE были назофарингит, инфекция верхних дыхательных путей, бронхит и вирусная инфекция. Не было серьезных инфекционных AE, описанных на протяжении этого испытания. Среди 2 диагностированных в ходе исследования злокачественных опухолей рак яичников был диагностирован у пациентки, которой вводили плацебо, и немеланомный рак кожи был диагностирован у пациента, которому вводили ABT-874 и который в анамнезе имел доброкачественную опухоль кожи.
В общем, ABT-874 продемонстрировало статистически и клинически значимую пользу в отношении лечения пациентов с хроническим бляшечным псориазом от умеренного до тяжелого и было хорошо переносимым.
ПРИМЕР 5: Сохранение ответа на полностью человеческое моноклональное антитело против IL-12/-23, ABT-874, при лечении бляшечного псориаза от умеренного до тяжелого
Эффективность и безопасность ABT-874 оценивали в 12-недельном, рандомизированном контролируемом испытании фазы II и 36-недельной фазе наблюдения. Задачей представленного ниже примера был анализ сохранения ответа после прекращения терапии в течение вторых 12 недель данного испытания фазы II подкожных инъекций ABT-874 при лечении бляшечного Ps от умеренного до тяжелого.
Для этого 12-недельного, двойного слепого, плацебо-контролируемого исследования были пригодны взрослые пациенты с Ps, поражающим ≥10% площади поверхности тела (BSA) и показателем PASI ≥12. Пациентов случайным образом определяли в 1 из 6 групп:
1) 100-мг ABT-874 раз в две недели (eow) в течение 12 недель;
2) одна 200-мг доза ABT-874 на 0 неделе;
3) 200-мг ABT-874 раз в неделю в течение 4 недель;
4) 200-мг ABT-874 eow в течение 12 недель;
5) 200-мг ABT-874 раз в неделю в течение 12 недель; или
6) плацебо.
Первичным результатом был ответ ≥PASI 75 на 12 неделе. Пациентов, которые удовлетворяли первичному результату, включали в 36-недельную слепую фазу/фазу повторного введения. Введение исследуемого лекарственного средства прекращали и пациентов подвергали мониторингу в отношении показателя PASI в различные моменты времени в ходе 36-недельного периода наблюдения, включая ответы PASI 50, PASI 75 и PASI 90. Сохранение ответа PASI оценивали до 24 недели.
В исследование было включено всего 180 пациентов, по 30 в каждой группе. Исходные характеристики были сходными между группами (представлены средние значения, за исключением % мужчин): возраст: 46 лет, 74% мужчин; длительность Ps: 21 год; PASI=19; и 25% пораженной BSA.
На 12 неделе % пациентов с ≥PASI 75 был статистически значимо более высоким для пациентов в каждой из 5 групп ABT-874 относительно плацебо (таблица 4). На 24 неделе у значительного процента отвечающих пациентов с PASI 75 в группах активного лечения сохранялся по меньшей мере показатель PASI, составляющий ≥PASI 50. Кроме того, у значительного процента отвечающих пациентов с PASI 75 в группах активного лечения также сохранялся по меньшей мере показатель PASI, составляющий >PASI 75, а также показатель PASI, составляющий >PASI 90 (таблица 4 и фигуры 4A-C). Процент пациентов, сохранивших ответ PASI 75 с течением времени на протяжении 24-недельного периода, представлен на фигуре 4D.
|
В заключение, ABT-874 было в значительной степени более эффективным, чем плацебо, при лечении бляшечного Ps от умеренного до тяжелого. Значительный процент отвечающих пациентов с PASI 75 сохраняли ответ >PASI 50, >PASI 75 и >PASI 90 на 24 неделе после прекращения активной терапии.
ПРИМЕР 6: Сохранение ответа при повторном лечении полностью человеческим моноклональным антителом против IL-12/-23, ABT-874, при лечении бляшечного псориаза от умеренного до тяжелого
Эффективность и безопасность ABT-874 оценивали в 48-недельном, рандомизированном контролируемом испытании фазы II, которое включало 12-недельную начальную фазу введения и 36-недельную фазу повторного введения пациентам, отвечающим на начальное введение. Начальные 12-недельные результаты эффективности и результаты сохранения ответа описаны в представленных выше примерах. Задачей представленного ниже примера было исследование ответа при повторном введении в течение 36-недельной фазы повторного введения/наблюдения у пациентов, которые утратили их начальные ответы в этом исследовании фазы II подкожных инъекций ABT-874 при лечении бляшечного Ps от умеренного до тяжелого. Следующей задачей представленного ниже примера была оценка безопасности подкожных инъекций ABT-874 при лечении бляшечного Ps от умеренного до тяжелого вплоть до 48 недели.
На исходном уровне деморафические показатели и клинические характеристики были сходными среди групп введения (обобщены в таблице 5, ниже).
|
Взрослых людей с псориазом, поражающим ≥10% площади поверхности тела, и показателем индекса площади и тяжести псориаза (PASI) ≥12 случайным образом распределяли в 1 из 6 групп: 1) одна 200-мг доза ABT-874 на 0 неделе; 2) 100 мг ABT-874 раз в две недели (eow) в течение 12 недель; 3) 200 мг ABT-874 раз в неделю в течение 4 недель; 4) 200 мг ABT-874 eow в течение 12 недель; 5) 200 мг ABT-874 раз в неделю в течение 12 недель; или 6) плацебо. Первичным результатом был ответ ≥PASI 75 на 12 неделе. Пациентов, которые удовлетворяли первичному результату, включали в 36-недельную фазу повторного введения. Введение исследуемого лекарственного средства прекращали и пациентам, которые утрачивали ответ (≤PASI 50) в течение 12-36 недель, проводили повторное введение с той же схемой дозирования, что и в ходе начального 12-недельного периода. Повторное введение длилось в течение 12 недель. Независимо от распределения по группам, всех пациентов подвергали мониторингу в ходе всего исследования или до прекращения введения.
Среди 180 исходно включенных пациентов, 130 (1 плацебо) были включены в фазу повторного введения и 58 (все ABT-874) подвергали повторному введению. Процент пациентов, которые достигли ≥PASI 75 через 12 недель и затем снова через 12 недель после повторного введения, был следующим для каждой группы: одна 200-мг доза, 63% против 55%; 100 мг eow, 93% против 94%; 200 мг раз в неделю в течение 4 недель, 90% против 69%; 200 мг eow, 93% против 75%; и 200 мг раз в неделю, 90% против 83%, соответственно. Всего из 58 пациентов, которым проводили повторное введение, 76% достигли ≥PASI 75 через 12 недель после повторного введения.
Улучшение показателей PASI с течением времени для пациентов после повторного введения представлено на фигурах 5A-B. Конкретно, на фигуре 5A представлено среднее процентное улучшение относительно исходного уровня в показателях PASI с 4 недели по 12 неделю у отвечающих пациентов с PASI, и на фигуре 5B представлено среднее процентное улучшение относительно исходного уровня в показателях PASI с 4 недели по 12 неделю после повторного введения у отвечающих пациентов с PASI 75.
Процент пациентов, которые достигли ≥PASI 50 через 12 недель после повторного введения, были следующими для каждой группы: одна 200-мг доза, 82%; 100 мг eow, 100%; 200 мг раз в неделю в течение 4 недель, 77%; 200 мг eow, 83%; и 200 мг раз в неделю, 100%. Всего из 58 пациентов, которым проводили повторное введение, 88% достигли ≥PASI 50 через 12 недель после повторного введения.
Процент пациентов, которые достигли PGA "отсутствие признаков" или "минимальные признаки" через 12 недель после повторного введения, были следующими для каждой группы: одна 200-мг доза, 36%; 100 мг eow, 75%; 200 мг раз в неделю в течение 4 недель, 62%; 200 мг eow, 67%; и 200 мг раз в неделю, 83%. Всего из 58 пациентов, которым проводили повторное введение, 64% достигли PGA "отсутствие признаков" или "минимальные признаки" через 12 недель после повторного введения.
Побочные действия (AE), встречающиеся с частотой ≥5% по меньшей мере в 1 группе введения вплоть до 48 недели, в порядке убывания представляли собой: назофарингит, реакцию области инъекции, инфекцию верхних дыхательных путей, головную боль, гипертензию и артралгию. Обзор вызванных лечением побочных действий вплоть до 48 недели представлен в таблице 6, ниже. Обзор вызванных лечением побочных действий с частотой ≥5% в любой группе введения представлен в таблице 7, ниже.
|
|
Представленные выше данные демонстрируют, что ABT-874 было высоко эффективным при лечении псориаза от умеренного до тяжелого. При утрате ответа и повторном введении большинство пациентов были способны повторно достигнуть ответа PASI 75. Более того, оказалось, что ABT-874 имеет благоприятный профиль безопасности в течение длительного времени.
ПРИМЕР 7: Фармакокинетика полностью человеческого моноклонального антитела против IL-12/-23, ABT-874, у нормальных здоровых добровольцев
Переносимость, безопасность и фармакокинетику (PK) ряда доз ABT-874 оценивали в рандомизированном, двойном слепом, плацебо-контролируемом исследовании с варьированием доз. Задачей следующего примера было исследование фармакокинетики внутривенных (IV) и подкожных (SC) инъекций ABT-874 у здоровых добровольцев.
Основными критериями включения были: (i) здоровые добровольцы-мужчины в возрасте от 18 до 45 лет; (ii) отсутствие клинически значимых нарушений при любом из исследований скринингового обследования (физикальное обследование, показатели жизнедеятельности, электрокардиограмма, биохимия, гематология, анализ мочи, серология); и (iii) нормальный рентген грудной клетки в пределах 12 месяцев до включения в исследование. Основными критериями исключения были: (i) курение более 10 сигарет в сутки; (ii) употребление более 30 г спирта в сутки; (iii) положительный скрининг на лекарственные средства в моче; (iv) хронические инфекции, особенно внутриклеточными бактериальными патогенами, такими как Mycobacterium tuberculosis; и (v) тяжелые инфекции, требующие госпитализации или внутривенных антибиотиков, в пределах предшествующих 2 лет.
Молодым (в возрасте 18-45 лет) здоровым мужчинам-добровольцам вводили 2 равные дозы (1 внутривенно и 1 подкожно, вводимые с интервалом 8 недель) 0,1, 0,3, 1,0 или 5,0 мг/кг ABT-874 в перекрестной схеме из 2-периодов (латинский квадрат 2 × 2). Образцы крови для определения концентраций ABT-874 собирали до первой дозы (0) и через 0,5, 1, 1,5, 2, 4, 8, 12, 24, 48, 72, 120, 168, 336, 504 и 672 часов после введения доз. Сывороточные концентрации ABT-874 определяли твердофазным иммуноферментным анализом.
Сывороточные концентрации ABT-874 индивидуально сводили в таблицы, описывали с помощью статистических показателей (включая геометрическое среднее значение и геометрическое стандартное отклонение) и индивидуально отображали, так же как и среднее значение, срединное значение и кривые геометрической средней концентрации в зависимости от времени для внутривенного и подкожного введения и каждой группы введения. Следующие параметры PK оценивали с использованием некомпартментальных способов:
- Cmax максимальная сывороточная концентрация (мкг/мл)
- Tmax время до достижения Cmax (ч)
- AUC площадь под кривой концентрация в сыворотке-время (мкг×ч/мл)
- t½ время полужизни (ч)
- CL клиренс (мл/ч) (для внутривенного введения)
- Vz объем распределения (мл) (для внутривенного введения)
- CL/F кажущийся CL (мл/ч) (для подкожного введения)
- V/F кажущийся Vz (мл) (для подкожного введения)
Всего 64 пациентов случайным образом распределяли на группы; 12 вводили ABT-874 и 4 вводили плацебо для группы каждой дозы. Оказалось, что ABT-874 демонстрирует биэкспоненциальную кинетику после внутривенного введения, с вхождением в конечную фазу приблизительно через 7 суток после введения. Среднее значение ±SD конечного времени полужизни для внутривенных доз 0,1, 0,3, 1,0 и 3,0 мг составляло 81,2±55,6, 147±73,2, 208±79,2 и 196±55,4 часов, соответственно. Среднее значение ±SD конечного времени полужизни для подкожных доз 0,1, 0,3, 1,0 и 3,0 мг составляло 221±103, 161±92,6, 210±90,9 и 208±79,2 часов, соответственно. Среднее значение конечного времени полужизни для внутривенного введения находилось в диапазоне от 81,2±55,6 часов до 208±79,2 часов. Среднее значение конечного времени полужизни для подкожного введения находилось в диапазоне от 161±92,6 часов до 221±103 часов. Общее среднее значение конечного времени полужизни составило 8-9 суток.
Фармакокинетика ABT-874 (максимальная концентрация лекарственного средства [Cmax] или площадь под кривой [AUC]) возрастали пропорционально дозе как после внутривенного, так и после подкожного введения. Кривая концентрация в сыворотке-время для внутривенного и подкожного дозирования представлена на фигурах 6A и 6B, соответственно. Объем распределения находился в диапазоне от приблизительно 8-10 л после внутривенного введения до 24-67 л после подкожного введения. После подкожного введения время до достижения Cmax составляло приблизительно 3-4 суток. Биодоступность для оцениваемых доз после подкожного введения находилась в диапазоне от 42% до 62%. Фармакокинетические параметры после внутривенного или подкожного введения в каждой дозе, включая Cmax (максимальную концентрацию в сыворотке в мкг/мл), AUC (площадь под кривой концентрация в сыворотке-время в мкг×ч/мл), tmax (время до достижения Cmax в часах), t1/2 (время полужизни в часах), CL (клиренс в мл/ч) и Vz (объем распределения (мл)), представлены в таблице 8, ниже.
|
Представленные выше данные демонстрируют, что ABT-874, введенный внутривенно и подкожно в однократных дозах, составляющих от 0,1 и 5,0 мг/кг, был хорошо переносим молодыми здоровыми мужчинами. Фармакокинетические свойства ABT-874, с его временем полужизни 8-9 суток, являются такими, как можно ожидать для антитела IgG1.
ПРИМЕР 8: Сохранение ответа после повторного введения полностью человеческого моноклонального антитела против IL-12/-23, ABT-874, при лечении бляшечного псориаза от умеренного до тяжелого
Эффективность и безопасность ABT-874 оценивали в 48-недельном, рандомизированном контролируемом испытании фазы II, которое включало 12-недельную начальную фазу введения и 36-недельную фазу повторного введения пациентам, отвечающим на начальное введение. Начальные 12-недельные результаты эффективности и результаты сохранения ответа описаны в примерах 1-5, выше. Задачей представленного ниже примера было исследование ответа при повторном введении в течение 36-недельной фазы повторного введения/наблюдения у пациентов, которые утратили их начальные ответы в этом исследовании фазы II подкожных инъекций ABT-874 при лечении бляшечного Ps от умеренного до тяжелого. Следующей задачей представленного ниже примера была оценка безопасности подкожных инъекций ABT-874 при лечении бляшечного Ps от умеренного до тяжелого вплоть до 48 недели.
Основными критериями включения были: (i) взрослые с клиническим диагнозом псориаза в течение по меньшей мере 6 месяцев и стабильного бляшечного псориаза в течение по меньшей мере 2 месяцев до скрининга; и (ii) бляшечный псориаз от умеренного до тяжелого (вовлечение ≥10% площади поверхности тела, показатель индекса площади и тяжести псориаза [PASI] ≥12 и общая оценка врача [PGA] - по меньшей мере умеренное заболевание) при исходном посещении.
Первым критерием исключения из испытания было предшествующее воздействие системной или биологической терапии против IL-12. Вторым критерием исключения была невозможность прекратить следующие виды лечения перед исходным посещением: местная терапия псориаза ≥2 недель до испытания; фототерапия ультрафиолетовым (УФ) излучением B ≥2 недель до испытания; псорален-фототерапия УФ-излучением ≥4 недель до испытания; системная терапия ≥4 недель до испытания; и биологическая терапия ≥12 недель до испытания.
На исходном уровне демографические показатели и клинические характеристики были схожими между группами введения (обобщено в таблице 5 примера 6, выше).
Взрослых людей с псориазом, поражающим ≥10% площади поверхности тела, и показателем индекса площади и тяжести псориаза (PASI) ≥12 случайным образом распределяли в 1 из 6 групп: 1) одна 200-мг доза ABT-874 на 0 неделе; 2) 100 мг ABT-874 раз в две недели (eow) в течение 12 недель; 3) 200 мг ABT-874 раз в неделю в течение 4 недель; 4) 200 мг ABT-874 eow в течение 12 недель; 5) 200 мг ABT-874 раз в неделю в течение 12 недель; или 6) плацебо. Первичным результатом был ответ ≥PASI 75 на 12 неделе. Пациентов, которые удовлетворяли первичному результату, включали в 36-недельную фазу повторного введения. Введение исследуемого лекарственного средства прекращали и пациентам, которые утрачивали ответ (≤PASI 50) в течение 12-36 недель, проводили повторное введение с той же схемой дозирования, что и в ходе начального 12-недельного периода. Повторное введение длилось в течение 12 недель. Независимо от нахождения в группах, всех пациентов подвергали мониторингу в ходе всего исследования или до прекращения введения.
Показатели исхода включали следующее: (i) процент пациентов, достигших PASI 75; (ii) срединное время до достижения ответа PASI 75 после повторного введения; (iii) срединное время до утраты ответа PASI 75; (iv) процент пациентов с показателем PGA "отсутствие признаков" или "минимальные признаки" после повторного введения.
Статистический анализ проводили следующим образом. Анализ “intention-to-treat” (ITT) (анализ результатов в зависимости от назначенного лечения) проводили с помощью рандомизированной группы введения. Для оценки PASI, полученного после повторного введения ABT-874, посещениям для исследования оценку присваивали в соответствии с количеством суток после первой дозы повторного введения. Доля пациентов, достигших ответа PASI (да/нет), представлена согласно установленному посещению для исследования. Все статистические тесты были 2-сторонними с величиной значимости 0,05.
Из 180 исходно включенных пациентов (30 пациентов на группу введения) 130 (1 плацебо) были включены в фазу повторного введения и 58 (все ABT-874) подвергали повторному введению. Процент пациентов, которые достигли ≥PASI 75 через 12 недель и затем снова через 12 недель после повторного введения, были следующими для каждой группы: одна 200-мг доза, 63% против 55%; 100 мг eow, 93% против 94%; 200 мг раз в неделю в течение 4 недель, 90% против 69%; 200 мг eow, 93% против 75%; и 200 мг раз в неделю, 90% против 83%, соответственно. Всего из 58 пациентов, которым проводили повторное введение, 76% достигли ≥PASI 75 через 12 недель после повторного введения. Большинство пациентов были способны к повторному достижению ответа PASI 75 (фигура 7A).
Срединное время (в сутках) до достижения PASI 75 в ходе фазы повторного введения во всех группах дозировок ABT-874 представлено на фигуре 7B. Срединное время до достижения ≥PASI 75 в ходе повторного введения было следующим для каждой группы: одна 200-мг доза, между 60 и 65 сутками; 100 мг eow, между 55 и 60 сутками; 200 мг раз в неделю в течение 4 недель, между 55 и 60 сутками; 200 мг eow, между 25 и 35 сутками; и 200 мг раз в неделю, между 55 и 60 сутками, соответственно.
Срединное время (в сутках) до утраты PASI 75 после начальных 12 недель лечения представлено на фигуре 7C. Срединное время до утраты PASI 75 после начальных 12 недель введения было следующим для каждой группы: одна 200-мг доза, от 55 до 60 суток; 100 мг eow, от 110 до 120 суток; 200 мг раз в неделю в течение 4 недель, от 110 до 120 суток; 200 мг eow, от 160 до 180 суток; и 200 мг раз в неделю, от 180 до 190 суток, соответственно.
Процент пациентов, которые достигли PGA "отсутствие признаков" или "минимальные признаки" (например, PGA 0 или 1) через 12 недель после повторного введения, представлены на фигуре 7D. Процент пациентов, которые достигли PGA 0 или 1 в ходе повторного введения, были следующими для каждой группы: одна 200-мг доза, от 35% до 40%; 100 мг eow, от 70% до 80%; 200 мг раз в неделю в течение 4 недель, от 60% до 65%; 200 мг eow, от 60% до 70%; и 200 мг раз в неделю, от 80% до 90%, соответственно. Среди всех пациентов, которым проводили повторное введение, от 60 до 65% достигали PGA 0 или 1 после повторного введения.
Побочные действия (AE), встречающиеся с частотой ≥5% по меньшей мере в 1 группе введения вплоть до 48 недели, в убывающем порядке представляли собой: назофарингит, реакцию области инъекции, инфекцию верхних дыхательных путей, головную боль, гипертензию и артралгию. Обзор вызванных лечением побочных действий вплоть до 48 недели представлен в таблице 6 примера 6, выше. Обзор вызванных лечением побочных действий с частотой ≥5% в какой-либо группе введения представлен в таблице 7 примера 6, выше.
Представленные выше данные демонстрируют, что ABT-874 было высоко эффективным при лечении псориаза от умеренного до тяжелого. При утрате ответа и повторном введении большинство пациентов были способны повторно достигать ответа PASI 75. Более того, оказалось, что ABT-874 имеет благоприятный профиль безопасности в течение длительного периода времени.
ЭКВИВАЛЕНТЫ
Специалистам в данной области будет понятно, или они будут способны установить, используя не более чем обычное экспериментирование, множество эквивалентов конкретным вариантам осуществления изобретения, описанным в настоящем документе. Такие эквиваленты охватываются представленной ниже формулой изобретения.