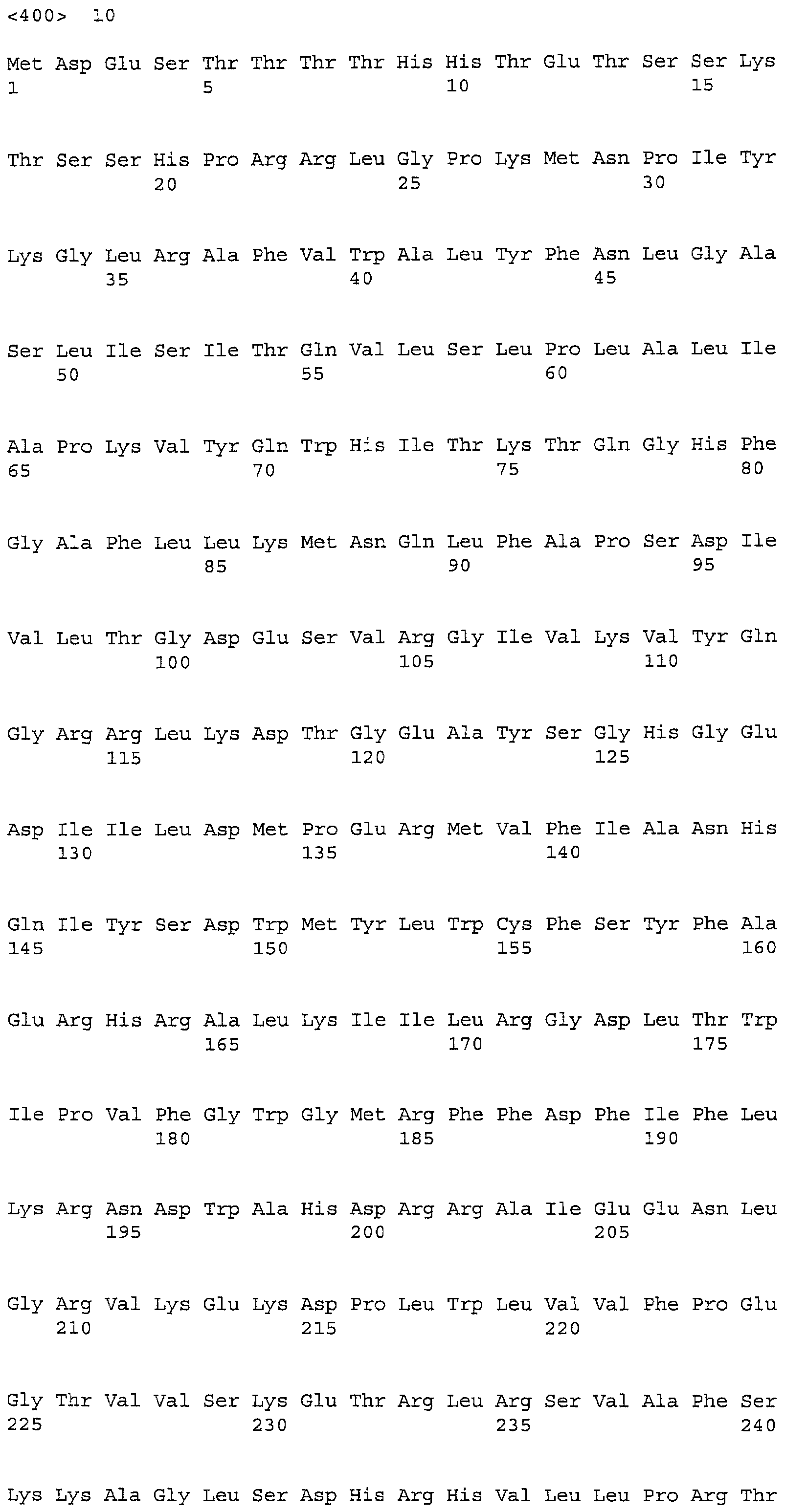Результат интеллектуальной деятельности: КОМПОЗИЦИИ ЖИРНЫХ КИСЛОТ, ИМЕЮЩИЕ НОВУЮ ПРОПОРЦИЮ ЖИРНЫХ КИСЛОТ
Вид РИД
Изобретение
Область техники
По настоящей заявке испрашивается приоритет заявки на патент Японии № 2007-190680 (поданной 23 июля 2007 г).
Настоящее изобретение относится к композиции жирных кислот, полученной культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность SEQ ID NO:1, или нуклеотидную последовательность, кодирующую белок, имеющий аминокислотную последовательность, показанную в SEQ ID NO:2, или мутант, функционально эквивалентный нуклеиновой кислоте, где по меньшей мере один или более параметров подпунктов i)-v), показанных далее:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение содержания олеиновой кислоты к содержанию стеариновой кислоты;
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к общему содержанию пальмитиновой кислоты и пальмитолеиновой кислоты; и
v) содержание n-6 жирной кислоты
выше в пропорции жирных кислот композиции жирных кислот, чем в культивированном продукте, полученном культивированием хозяина, который не трансформирован рекомбинантным вектором.
Предшествующий уровень техники
Жирные кислоты представляют важные компоненты липидов, таких как фосфолипиды и триацилглицерины. Сообщалось, что полиненасыщенные жирные кислоты (PUFA), содержащие две или более ненасыщенные связи, включая арахидоновую кислоту, дигомо-γ-линоленовую кислоту, эйкозапентаеноевую кислоту и декозагексаеноевую кислоту, обладают различными видами физиологической активности (не патентный документ 1). Ожидается, что эти полиненасыщенные жирные кислоты найдут применение в различных областях. Для эффективного получения этих жирных кислот, были разработаны микробные методики, которые включают культивирование различных микроорганизмов для получения полиненасыщенных жирных кислот. Предпринимались также другие попытки получения полиненасыщенных жирных кислот в растениях. Известно, что в этих случаях полиненасыщенные жирные кислоты накапливаются, например, в виде компонентов липидов накопления, таких как триацилглицерины внутри клеток микроорганизмов или семян растений.
Этот триацилглицерин получает in vivo, начиная с глицерин-3-фосфата через лизофосфатидиновую кислоту, фосфатидиновую кислоту и диацилглицерин.
Как описано выше, известно, что реакция, при которой лизофосфатидиновая кислота (далее также называемая «LPA» или «1-ацилглицерин-3-фосфат») ацилируется для генерирования фосфатидиновой кислоты (далее также называемой «РА» или «1,2-диацил-sn-глицерин-3-фосфат»), опосредуется ацилтрансферазой лизофосфатидиновой кислоты (далее также называемой «LPAAT»).
Эта LPAAT также известна как ацилтрансфераза 1-ацилглицерин-3-фосфата (E.C. 2.3.1.51). К настоящему времени сообщалось, что гены LPAAT содержатся в нескольких организмах. В качестве гена LPAAT из Escherichia coli, был клонирован ген plsC (не патентный документ 2). В грибах был клонирован ген SLC1 из Saccharomyces cerevisiae (не патентный документ 3). Аналогичным образом, гены LPAAT также были клонированы из животных и растений (патентный документ 1).
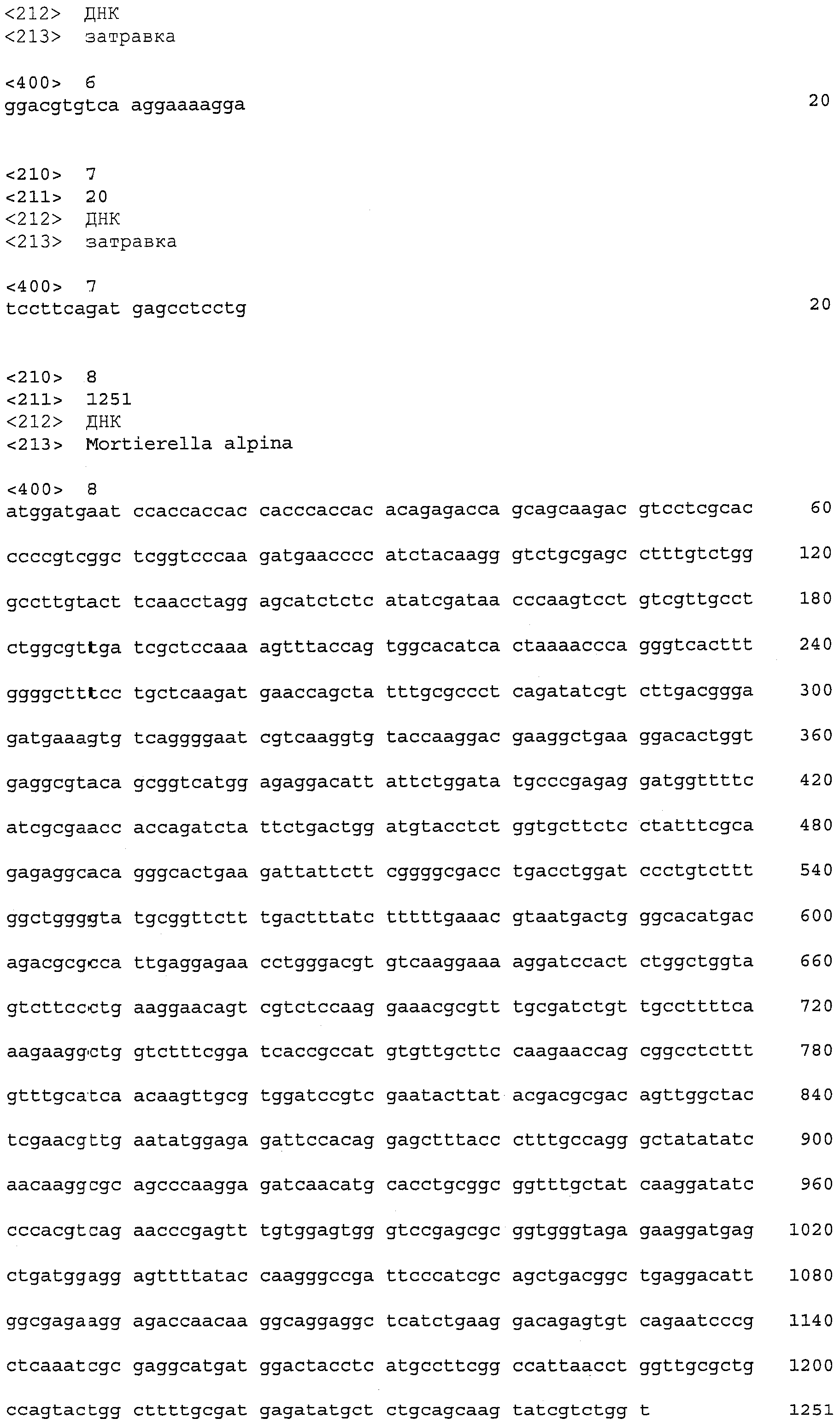
Для гена LPAAT из продуцирующего липиды гриба, Mortierella alpina (далее также называемого «M. Alpine»), сообщалось о двух гомологах (патентные документы 2 и 3).
В патентном документе 2 описано клонирование полученного из M. alpine гомолога LPAAT (LPAAT1), который представляет собой ген, являющийся геном, имеющим CDS 1254 нуклеотидов, и состоящий из нуклеотидной последовательности, показанной в SEQ ID NO:16. В этом документе также сообщается, что когда этот LPAAT1 был совместно экспрессирован в дрожжевых клетках с десатуразой Δ6 и элонгазой Δ6 и культивировался в среде с добавлением определенных жирных кислот, такие дрожжевые клетки продуцировали большие количества жирных кислот, длина цепи которых длиннее, и/или чья степень ненасыщения выше, чем степень насыщения добавленных жирных кислот, по сравнению со штаммами, не экспрессирующими LPAAT1 (Патентный документ 2).
Патентный документ 1: Международная патентная публикация №WO2004/076617
Патентный документ 2: Патентная публикация США №2006/174376
Патентный документ 3: Патентная публикация США №2006/0094090
Не патентный документ 1: Lipids, 39, 1147 (2004)
Не патентный документ 2: Mol. Gen. Genet., 232, 295-303, 1992
Не патентный документ 3: J.B.C., 268, 22156-22163, 1993
Не патентный документ 4: Biochemical Society Transactions, 28, 707-709, 2000
Не патентный документ 5: J. Bacteriology, 180, 1425-1430, 1998
Не патентный документ: J. Bacteriology, 173, 2026-2034 1991.
Описание изобретения
Задачи, решаемые изобретением
Однако даже если гены LPAAT, о которых ранее сообщалось, вводятся в клетки-хозяева и экспрессируются в них, композиции жирных кислот, получаемые хозяевами, ограничены вследствие специфичности субстрата экспрессированных ферментов. По этой причине, имеется потребность в идентичности гена, который обеспечивает возможность получения композиции жирных кислот, пропорция жирных кислот которой отличается от ранее отмеченной пропорции.
Средства для решения задач
Целью настоящего изобретения является получение композиции жирных кислот, имеющей пропорцию жирных кислот, полезную для получения жиров и масел или пищевых продуктов и т.д.
Для достижения указанной выше цели авторы настоящего изобретения предприняли большие и интенсивные усилия. Во-первых, был выделен ген LPAAT1-длинный, который получен из продуцирующего липиды гриба Mortierella alpine, и введен в высоко пролиферативные клетки-хозяева (например, дрожжевые клетки) для получения посредством этого композиции жирных кислот. В результате, авторы успешно получили композицию жирных кислот, отличную от композиций, полученных с известными LPAAT. Это привело к осуществлению настоящего изобретения. А именно, настоящее изобретение заключается в следующем.
(1) Композиция жирных кислот, полученная культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в любом из представленных ниже подпунктов (а)-(е):
(а) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:2, и имеющей активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO:1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
(с) нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, имеющей идентичность 90% или более с нуклеотидной последовательностью, состоящей из SEQ ID NO:1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
(d) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
или
(е) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты,
где по меньшей мере один или более из параметров подпунктов i)-v), показанных далее, выше по пропорции жирных кислот композиции жирных кислот в культивированном продукте, полученном культивированием хозяина, который не трансформирован рекомбинантным вектором:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение содержания олеиновой кислоты к содержанию стеариновой кислоты;
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к общему количеству пальмитиновой кислоты и пальмитолеиновой кислоты; и
v) содержание n-6 жирной кислоты.
Альтернативно, композиция жирных кислот по настоящему изобретению может также представлять собой композицию жирных кислот, полученную культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную ниже в любом из подпунктов (а)-(е):
(а) нуклеотидную последовательность, которая кодирует аминокислотную последовательность с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:2;
(b) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO:1;
с) нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, имеющей идентичность 90% или более с нуклеотидной последовательности, состоящей из SEQ ID NO:1;
d) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO:2; или
(е) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:2.
(2) Композиция жирных кислот по указанному выше пункту (1), где нуклеиновая кислота содержит нуклеотидную последовательность, показанную ниже в любом из подпунктов (а)-(с):
(а) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:2, и имеющую активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизироваться в условиях 1 × SSC при 60ºС с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO:1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты; или
(с) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 95% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты.
(3) Композиция жирных кислот по указанному выше пункту (1), где нуклеиновая кислота содержит нуклеотидную последовательность, показанную ниже в подпункте (а) или (b):
(а) нуклеотидную последовательность, показанную в SEQ ID NO: 1; или
(b) нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2.
(4) Композиция жирных кислот по указанному выше пункту (1), где n-6 жирная кислота представляет собой по меньшей мере одну жирную кислоту, выбранную из группы, состоящей из линолевой кислоты, γ-линоленовой кислоты, дигомо-γ-линоленовой кислоты, (DGLA) и арахидоновой кислоты.
(5) Способ получения композиции жирных кислот, который включает составление композиции жирных кислот из культивированного продукта, полученного культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в любом из представленных ниже подпунктов (а)-(е):
(а) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, и имеющей активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
(с) нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, имеющей идентичность 90% или более с нуклеотидной последовательностью, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
(d) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
или
(е) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты,
где композиция жирных кислот имеет более высокую величину по меньшей мере одой или нескольких из i)-v), показанных ниже, по сравнению с культивированным продуктом, полученным культивированием хозяина, который не трансформирован рекомбинантным вектором:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение содержания олеиновой кислоты к содержанию стеариновой кислоты;
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к общему количеству пальмитиновой кислоты и пальмитолеиновой кислоты; и
v) содержание n-6 жирной кислоты.
(6) Способ по представленному выше пункту (5), где n-6 жирная кислота представляет собой по меньшей мере одну жирную кислоту, выбранную из группы, состоящей из линолевой кислоты, γ-линоленовой кислоты, дигомо-γ-линоленовой кислоты, (DGLA) и арахидоновой кислоты.
(7) Способ по представленному выше пункту (5) или пункту (6), где нуклеиновая кислота содержит нуклеотидную последовательность, показанную ниже в любом из подпунктов (а)-(с):
(а) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, и имеющую активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизироваться в условиях 1 × SSC при 60ºС с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты; или
(с) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 95% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты.
(8) Применение нуклеиновой кислоты, содержащей нуклеотидную последовательность, показанную в любом из представленных ниже подпунктов (а)-(е), для получения композиции жирных кислот по любому из представленных выше пп.(1)-(4):
(а) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, и имеющей активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
(с) нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, имеющей идентичность 90% или более с нуклеотидной последовательностью, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
(d) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
или
(е) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты.
(9) Применение по представленному выше п.(8), где нуклеиновая кислота содержит нуклеотидную последовательность, показанную ниже в любом из подпунктов (а)-(с):
(а) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, и имеющую активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизироваться в условиях 1 × SSC при 60ºС с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты; или
(с) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 95% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты.
(10) Пищевой продукт, содержащий композицию жирных кислот по любому из представленных выше пп.(1)-(4).
Преимущества изобретения
LPAAT1-длинный по настоящему изобретению имеет субстратную специфичность, отличную от субстратной специфичности известного LPAAT1, и обеспечивает хозяину возможность получения композиции жирных кислот, пропорция жирных кислот которой отличается от пропорции жирных кислот композиции, полученной хозяином, экспрессирующим известный LPAAT1. В результате, LPAAT1-длинный по настоящему изобретению обеспечивает возможность предоставления липидов, имеющих желательные свойства и эффекты, и может использоваться как применимая в пищевых продуктах, косметических изделиях, фармацевтических продуктах, мылах и т.д.
Содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих LPAAT1-длинный по настоящему изобретению, выше, чем содержание арахидоновой кислоты в клетках-хозяевах, не экспрессирующих LPAAT1-длинный по настоящему изобретению. Ожидается, что композиция жирных кислот, полученная из культивированного продукта этих клеток, экспрессирующих LPAAT1-длинный, обеспечит более высокий питательный эффект и, следовательно, является предпочтительной.
Кроме того, LPAAT по настоящему изобретению обеспечивает возможность улучшения способности получения жирных кислот и липидов накопления и, следовательно, предпочтителен в качестве средства для повышения продуктивности полиненасыщенных жирных кислот у микроорганизмов и растений.
Краткое описание чертежей
На фиг.1 показано сравнение LPAAT1-длинного и LPAAT1-короткого в настоящем изобретении с LPAAT1 по их нуклеотидным последовательностям CDS.
На фиг.2 показано сравнение LPAAT1-длинного и LPAAT1-короткого в настоящем изобретении с LPAAT1 по их аминокислотным последовательностям CDS.
Лучший способ осуществления изобретения
Настоящее изобретение относится к новой композиции жирных кислот, способу получения композиции жирных слот и пищевому продукту, содержащему композицию жирных кислот.
Ниже настоящее изобретение будет объяснено более детально.
В настоящем изобретении используется ген ацилтрансферазы лизофосфатидиновой кислоты (LPAAT) из рода Mortierella, который характеризуется обеспечением возможности получения указанной выше новой композиции жирных кислот. Конкретнее, в настоящем изобретении используется нуклеиновая кислота, именуемая LPAAT1-длинной, или ее мутант, который был выделен авторами настоящего изобретения, и показана в SEQ ID NO: 1. Следует отметить, что ацилтрансфераза лизофосфатидиновой кислоты представляет собой фермент, который катализирует реакцию, при которой лизофосфатидиновая кислота ацилируется для генерирования фосфатидиновой кислоты. Термин «LPAAT1-длинный» и LPAAT1-короткий» используется в настоящей заявке для описания штамма, гена, белка или альтернативно, клетки, полученной культивированием трансформанта, который создан вставкой указанного выше гена LPAAT1-длинного или LPAAT1-короткого в вектор экспрессии и трансформацией вектора в соответствующий хозяин.
Гомологи ацилтрансферазы лизофосфатидиновой кислоты (LPAAT)1
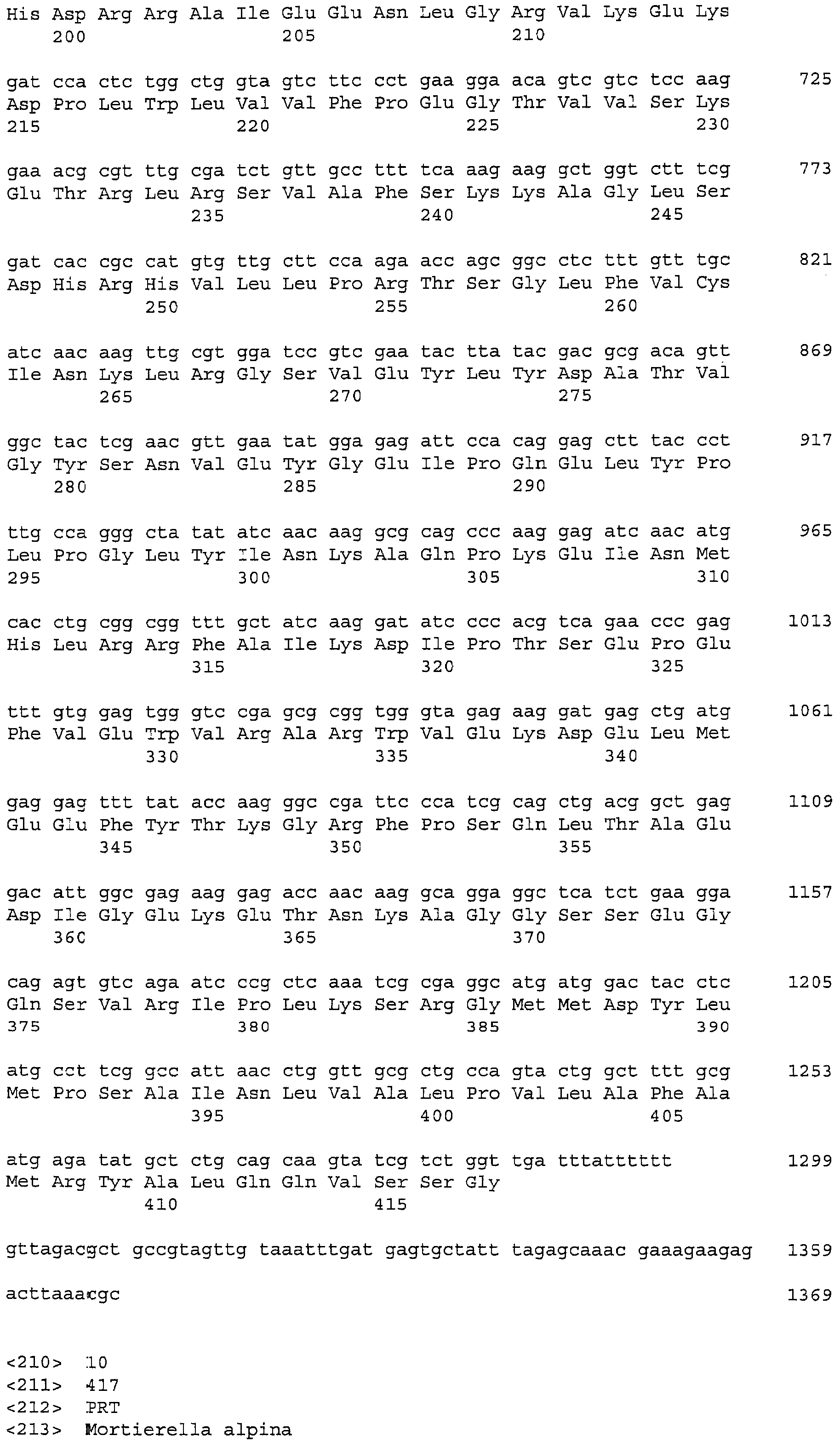
Последовательности, относящиеся к LPAAT1-длинному по настоящему изобретению, включают SEQ ID NO: 1 (последовательность, представляющая область ORF LPAAT1-длинного, SEQ ID NO: 2 (аминокислотная последовательность LPAAT1-длинного, SEQ ID NO: 3 (нуклеотидная последовательность кДНК для LPAAT1-длинного и SEQ ID NO: 4 (последовательность, представляющая область CDS LPAAT1-длинного). Среди них, SEQ ID NO: 1 соответствует нуклеотидам 115-1557 SEQ ID NO: 3.
В дополнение к LPAAT1-длинному, авторы настоящего изобретения выделили другой ген LPAAT1 (далее именуемый «LPAAT1-короткий»), который соответствует 86,6% всей нуклеотидной последовательности LPAAT1-длинного и 86,7% всей аминокислотной последовательности LPAAT1-длинного. Последовательности, связанные с LPAAT1-коротким, включают SEQ ID NO: 8 (последовательность, представляющая область ORF LPAAT1-короткого), SEQ ID NO: 10 (аминокислотную последовательность LPAAT1-короткого) и SEQ ID NO: 9 (нуклеотидную последовательность кДНК для LPAAT1-короткого). Нуклеотиды 36-1286 SEQ ID NO: 9 соответствуют ORF, показанной в SEQ ID NO: 8. Связь между LPAAT1-длинным и LPAAT1-коротким показан ниже в таблице 1.
|
А именно, нуклеотидная последовательность с 5'-концевой делецией в нуклеотидной последовательности ORF LPAAT1-длинного по настоящему изобретению соответствует LPAAT1-короткому. В деталях, среди 1443 нуклеотидов в нуклеотидной последовательности ORF (SEQ UID NO: 1) LPAAT1-длинного по настоящему изобретению, нуклеотиды в области между положениями 193 и 1443, которые составляют 86,8% общего количества нуклеотидов, соответствуют нуклеотидной последовательности ORF (SEQ UID NO: 8) LPAAT1-короткого. А именно, LPAAT1-длинный представляет собой последовательность, более длинную, чем LPAAT1-короткий, на 192 нуклеотида в области 5'. Аналогичным образом, среди 481 остатка в аминокислотной последовательности (SEQ UID NO: 2) LPAAT1 -длинного по настоящему изобретению, остатки в области между положениями 65 и 481, которые составляют 86,7% общего количества остатков, соответствуют аминокислотной последовательности (SEQ UID NO: 8) LPAAT1-короткого. А именно, LPAAT1-длинный представляет собой последовательность, которая длиннее, чем LPAAT1-короткий, на 64 аминокислотных остатков (аминокислотные остатки 1-64 в SEQ UID NO: 2) N-конца.
Следует отметить, что известный LPAAT, полученный из M. Alpina (далее именуемой «LPAAT1»), раскрыт в патентном документе 2, перечисленном выше. Количество нуклеотидов в ORF LPAAT1, составляет 1251, что идентично таковому LPAAT1-короткого. Идентичность нуклеотидной последовательности между этими ORF достигает 89%, свидетельствуя о том, что LPAAT1-короткий мог бы представлять собой изоаллель LPAAT1. На фиг.1 и 2 показаны совмещения соответственно нуклеотидной и аминокислотной последовательности для LPAAT1-длинного, LPAAT1-короткого и LPAAT1 (фиг.1 и 2).
Таким образом, авторы настоящего изобретения использовали LPAAT1-короткий в качестве модели известного LPAAT1 в целях сравнения при исследовании активности LPAAT1-длинного по настоящему изобретению. Конкретнее, LPAAT1-длинный и LPAAT1-короткий были экспрессированы в дрожжевых клетках, и полученные композиции жирных кислот сравнивали по их пропорции жирных кислот. В результате, как детально объясняется ниже, пропорция жирных кислот композиции жирных кислот, полученных хозяином, экспрессирующим LPAAT1-длинный ген по настоящему изобретению, полностью отличалась от пропорции композиции жирных кислот, полученной хозяином, экспрессирующим LPAAT1-короткий. А именно, было обнаружено, что LPAAT1-длинный по настоящему изобретению имеет способность продуцировать композицию жирных кислот, пропорция жирных кислот которой полностью отличается от пропорции композиции жирных кислот, полученных известным LPAAT1.
Конкретнее, одним из отличительных признаков в композиции жирных кислот по настоящему изобретению является высокое содержание арахидоновой кислоты. Арахидоновая кислота, вещество, представленное химической формулой C20H32O2, и имеющее молекулярную массу 304,47, представляет собой карбоновую кислоту, содержащую 20 атомов углерода и 4 двойных связи ([20:4(n-6)]), и классифицируется в качестве члена серии (n-6). Арахидоновая кислота присутствует в качестве важного фосфолипида (в частности, фосфатидилэтаноламина, фосфатидилхолина, фосфатидилинозитола) в мембранах клеток животных, и в большом количестве содержится в мозге. Кроме того, арахидоновая кислота служит в качестве исходного материала для ряда эйкозаноидов (например, простагландина, тромбоксана, лейкотриена), генерируемых каскадом арахидоновой кислоты, и также важна в качестве второго посредника при внутриклеточной передаче сигналов. С другой стороны, арахидоновая кислота синтезируется из линолиновой кислоты в организме животных. Однако, в зависимости от их вида или возраста, некоторые животные не осуществляют эту функцию, достаточную для получения требуемого количества арахидоновой кислоты или для наличия функции получения арахидоновой кислоты. Таким образом, арахидоновую кислоту следует получать из пищевых источников, и ее можно рассматривать в качестве незаменимой жирной кислоты.
Содержание арахидоновой кислоты в композиции жирных кислот по настоящему изобретению может быть измерено следующим образом, в качестве примера. А именно, плазмида для LPAAT1-длинного по настоящему изобретению вставляется в вектор, такой как pDura5MCS, как описано в примерах 8 и 9, и трансформируется в штамм M. alpina. Полученному трансформанту предоставляется возможность экспрессироваться и культивироваться в соответствии с процедурами, описанными в примере 10. Полученные таким образом культивированные клетки используются для измерения пропорции жирных кислот и/или содержания арахидоновой кислоты в клетках и т.д. Для анализа содержания арахидоновой кислоты и т.д., например, жирные кислоты в полученных культивированных клетках дериватизируются в соответствующие сложные метиловые эфиры жирных кислот способом с использованием хлористоводородной кислоты/метанола и затем экстрагируются гексаном. После отгонки гексана, жирные кислоты анализируются газовой хроматографией. В соответствии с этим анализом, было обнаружено, что M. alpina, трансформированная LPAAT1-длинным по настоящему изобретению, проявляет высокое содержание арахидонововй кислоты среди жирных кислот в клетках. Таким образом, предпочтительна композиция жирных кислот по настоящему изобретению, имеющая высокое содержание арахидонововй кислоты, потому что она обеспечивает возможность эффективного поглощения арахидоновой кислоты.
Как показано выше, LPAAT1-длинный по настоящему изобретению имеет активность, которая совершенно отличается от активности известного LPAAT1. Одним из оснований для такой новой активности может быть различие структуры гена/белка между LPAAT1-длинным по настоящему изобретению и известным LPAAT1.
Таким образом, мутанты, имеющие нуклеотидную последовательность/аминокислотную последовательность, крайне близкую к нуклеотидной последовательности LPAAT1-длинного по настоящему изобретению, и являющиеся функционально эквивалентными LPAAT1-длинному, также входят в объем настоящего изобретения. Примеры включают следующие:
i) мутанты, нуклеотидная последовательность/аминокислотная последовательность которых является примерно на 90% идентичной таковой специфического LPAAT1-длинного по настоящему изобретению (примерно 144 нуклеотидов или примерно 48 аминокислотных остатков являются идентичными; также включая мутантов с делецией, заменой или добавлением этих нуклеотидов/остатков); и
ii) мутанты, нуклеотидная последовательность/аминокислотная последовательность которых гидролизуется в очень жестких условиях с последовательностью LPAAT1-длинного по настоящему изобретению.
Детали изложены в описанном ниже разделе «Нуклеиновые кислоты по настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидиновой кислоты».
Нуклеиновые кислоты по настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидиновой кислоты (LPAAT)
Настоящее изобретение относится к композиции жирных кислот, имеющих новую пропорцию жирных кислот, полученную культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность SEQ ID NO: 1 (LPAAT1-длинный), или ей подобную, а также к способу ее получения. Во-первых, будет дано объяснение нуклеиновых кислот, используемых для получения указанной выше композиции жирных кислот.
Как описано выше, ацилтрансфераза лизофосфатидиновой кислоты (LPAAT) в настоящем изобретении охватывает LPAAT1-длинный. Последовательности, связанные с LPAAT1-длинным по настоящему изобретению, включают SEQ ID NO: 1 (последовательность, представляющую область ORF LPAAT1-длинного), SEQ ID NO: 2 (аминокислотную последовательность LPAAT1-длинного), SEQ ID NO: 3 (нуклеотидную последовательность для LPAAT1-длинного) и SEQ ID NO: 4 (последовательность, представляющую область CDS LPAAT1-длинного), как объясняется в разделе «Гомологи ацилтрансферазы лизофосфатидиновой кислоты (LPAAT) 1».
Нуклеиновые кислоты по настоящему изобретению охватывают однонитевые и двухнитевые ДНК, а также их комплементарные РНК, которые могут быть или естественно встречающимися или полученными искусственно. ДНК включают без ограничения геномные ДНК, кДНК, соответствующие геномным ДНК, химически синтезированные ДНК, ДНК, амплифицированным PCR, а также их комбинации и гибриды ДНК/РНК.
Предпочтительные варианты осуществления нуклеиновых кислот по настоящему изобретению включают (а) нуклеотидную последовательность, показанную в SEQ ID NO: 1, и (b) нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2.
Для получения этих нуклеотидных последовательностей, данные о нуклеотидной последовательности по анализу EST или геномных ДНК из организмов, имеющих активность LPAAT, могут использоваться для поиска нуклеотидной последовательности, кодирующей белок, имеющий высокую идентичность с известными белками, имеющими активность LPAAT. Предпочтительными организмами, имеющими активность LPAAT, являются продуцирующие липиды грибы, включая без ограничения M. alpine.
Для анализа EST, сначала получают библиотеку кДНК. Что касается методик получения библиотеки кДНК, то можно сослаться на руководство “Molecular Cloning, A Laboratory Manual 3rd ed.” (Cold Spring Harbor Press (2001)). Альтернативно, может использоваться выпускаемый промышленностью набор для получения библиотеки кДНК. В качестве примера, методики для получения библиотеки кДНК, подходящие для настоящего изобретении, следующие. А именно, соответствующий штамм M. alpina, продуцирующий липид гриб, инокулируется в соответствующую среду и предварительно культивируется в течение соответствующего периода. Условия культуры, подходящие для этой предварительной культуры, включают, например, композицию среду из 1,8% глюкозы, 1% дрожжевого экстракта и pH 6,0, периода культуры 3 дня и температуры культуры 28°C. Затем предварительно культивированный продукт подвергается основному культивированию в соответствующих условиях. Композиция среды, подходящая для основной культуры, может составлять, например, 1,8% глюкозы, 1% порошка соевых бобов, 0,1% оливкового масла, 0,01% адеканола, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2·2H2O, 0,05% MgCl2·6H2O и pH 6,0. Условия культивирования, подходящие для основной культуры, могут представлять, например, аэробную центрифужную культуру при 300 об/мин, 1 об.об.м, 26°C в течение 8 дней. Во время культивирования может добавляться соответствующее количество глюкозы. Пробы культивированного продукта берутся в соответствующие точки времени во время основного культивирования, из которых затем собирают клетки для получения общей РНК. Для получения общей РНК, можно использовать любую известную методику, такую как способ гидрохлорида гуанидина/CsCl2. Полученная общая РНК может обрабатываться выпускаемого промышленностью набора для очистки поли(А)+РНК. Далее, библиотека кДНК может быть получена выпускаемым промышленностью набором. Затем определяется нуклеотидная последовательность любого клона из библиотеки кДНК использованием затравок, которые сконструированы на векторе для обеспечения возможности определения нуклеотидной последовательности вставки. В результате, могут быть получены EST. Например, когда для получения библиотеки кДНК используется набор ZAP-cDNA GigapackIII Gold Cloning Kit (STRATAGENE), может выполняться направленное клонирование.
Настоящее изобретение также охватывает нуклеиновые кислоты, функционально эквивалентные нуклеиновой кислоте, содержащей указанную выше нуклеотидную последовательность, показанную в SEQ ID NO: 1 (далее также именуемую как «нуклеотидная последовательность по настоящему изобретению») или нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 (далее также именуемую как «аминокислотная последовательность по настоящему изобретению»). Предполагается, что фраза «функциональный эквивалент» значит, что белок, кодируемый нуклеотидной последовательностью по настоящему изобретению, или белок, состоящий из аминокислотной последовательности по настоящему изобретению, имеет активность LPAAT. В дополнение к этой активности LPAAT, белок, кодируемый нуклеотидной последовательностью по настоящему изобретению, или белок, состоящий из аминокислотной последовательности по настоящему изобретению, могут иметь способность дать пропорцию жирных кислот, обеспечивающую более высокую ценность по меньшей мере для одной или более из следующих величин:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение содержания олеиновой кислоты к содержанию стеариновой кислоты;
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к общему содержанию пальмитиновой кислоты и пальмитолеиновой кислоты; и
v) содержание n-6 жирной кислоты
в пропорции жирных кислот хозяина, экспрессирующего белок, чем в пропорции жирных кислот хозяина, не экспрессирующего белок (такой белок далее также именуется «белком, имеющим способность дать пропорцию жирных кислот LPAAT в настоящем изобретении»).
Определенный пример представляет нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую белок, имеющий способность дать пропорцию жирных кислот, обеспечивая следующее:
i) содержание олеиновой кислоты составляет 47% или более;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты составляет 6,7 или более;
iii) отношение содержания олеиновой кислоты к содержанию стеариновой кислоты составляет 10 или более; и/или
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к общему содержанию пальмитиновой кислоты и пальмитолеиновой кислоты составляет 1,1 или более,
когда указанная выше нуклеотидная последовательность по настоящему изобретению вставляется в вектор экспрессии pYE22m (Biosci. Biotech. Biochem., 59, 1221-1228, 1995) и трансформируется в дрожжевого хозяина, штамм Saccharomyces cerevisiae EH13-15 (Appl. Microbiol. Biotechnol., 30, 515-520, 1989), и полученный трансформант культивируется для сбора клеток, которые затем анализируются на содержание жирных кислот процедурами, описанными ниже в примере 6. Более предпочтительной является нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, имеющий активность LPAAT, и дающий пропорцию жирных кислот LPAAT в настоящем изобретении.
В результате анализа жирных кислот LPAAT1-длинного по настоящему изобретению и LPAAT1-короткого, как описано в примере 6, LPAAT1-длинный по настоящему изобретению достиг содержания олеиновой кислоты примерно 54%, которое было выше, чем содержание олеиновой кислоты в LPAAT1-коротком (примерно 42%), как показано ниже в таблице 3. Кроме того, содержание пальмитиновой кислоты по настоящему изобретению составляло примерно 7,6%, что было равно содержанию пальмитиновой кислоты в контроле и ниже, чем содержание пальмитиновой кислоты в LPAAT1-коротком (примерно 13,5%). Кроме того, LPAAT1-длинный по настоящему изобретению привел к отношению содержания олеиновой кислоты к содержанию пальмитиновой кислоты, в 1,8-2,5 раз выше, чем в LPAAT1-коротком. Аналогичным образом, LPAAT1-длинный по настоящему изобретению привел к отношению содержания олеиновой кислоты к содержанию стеариновой кислоты, в 1,5-1,8 раз превышающему это отношение в LPAAT1-коротком.
Кроме того, белок, кодируемый нуклеотидной последовательностью по настоящему изобретению, или белок, состоящий из аминокислотной последовательности по настоящему изобретению, может также иметь способность давать пропорцию жирных кислот, обеспечивающую более высокое содержание n-6 жирных кислот в пропорции жирных кислот хозяина, экспрессирующего белок, чем в пропорции жирных кислот хозяина, не экспрессирующего белок (такой белок поэтому также именуется как «белок, имеющий способность дать пропорцию жирных кислот LPAAT в настоящем изобретении» как в описанном выше случае). N-6 жирные кислоты включают без ограничения линолевую кислоту, γ-линоленовую кислоту, дигомо-γ-линоленовую кислоту, арахидоновую кислоту, 7,10,13,16-докозатетраеноевую кислоту и 4, 7, 10, 13, 16-докозапентаеноевую кислоту. Например, n-6 жирные кислоты, предпочтительные для M. alpina, включают линолевую кислоту, γ-линоленовую кислоту, дигомо-γ-линоленовую кислоту и арахидоновую кислоту.
Конкретным примером является нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, обеспечивающий более высокое содержание n-6 жирных кислот, как показано ниже в таблице 5 для LPAAT1-длинного по настоящему изобретению, когда указанная выше нуклеотидная последовательность по настоящему изобретению вставляется в вектор экспрессии pYE22m и трансформируется в продуцирующие арахидоновую кислоту дрожжи или гифомицет-хозяев (например, штаммы Saccharomyces cerevisiae или Mortierella, разведенных для обеспечения возможности получения арахидоновой кислоты), и полученный трансформант культивируется для сбора клеток, которые затем анализируются на содержание жирных кислот процедурами, описанными ниже в примерах 7-10.
В случае, когда LPAAT1-длинный по настоящему изобретению или LPAAT1-короткий был экспрессирован в штамме дрожжей, разведенном для обеспечения возможности получения арахидоновой кислоты, результаты анализа жирных кислот, выполненного процедурами, описанными в примере 7, показаны ниже в таблице 4. А именно, LPAAT1-длинный по настоящему изобретению приводит к более высокому содержанию линолевой кислоты, чем в контроле и LPAAT1-коротком. Аналогичным образом, LPAAT1-длинный по настоящему изобретению приводит к более высокому содержанию γ-линоленовой кислоты, чем в контроле и LPAAT1-коротком. Кроме того, LPAAT1-длинный по настоящему изобретению приводит к содержанию DGLA, которое выше, чем в контроле, и равно содержанию DGLA в LPAAT1-коротком. Кроме того, LPAAT1-длинный по настоящему изобретению приводит к более высокому содержанию арахидоновой кислоты, чем в контроле и LPAAT1-коротком.
В случае, когда LPAAT1-длинный по настоящему изобретению или LPAAT1-короткий был экспрессирован у M. alpina, результаты анализа жирных кислот, выполненного процедурами, описанными в примерах 8-10, показаны ниже в таблице 5. А именно, LPAAT1-длинный по настоящему изобретению приводит к более высокому содержанию арахидоновой кислоты и DGLA, чем в контроле и LPAAT1-коротком.
Таким образом, как будет объяснено позже, LPAAT1-длинный по настоящему изобретению имеет полностью новую функцию, которую нельзя ожидать от предшествующего уровня техники, потому что он обеспечивает возможность получения хозяином композиции жирных кислот, пропорция жирных кислот которой полностью отличается от пропорции жирных кислот композиций жирных кислот, полученных хозяевами, экспрессирующими другие LPAAT.
Такие нуклеиновые кислоты, которые являются функционально эквивалентными нуклеиновым кислотам по настоящему изобретению, включают нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную ниже в любом из подпунктов (а)-(е) (далее также именуемую «(функционально эквивалентным) мутантом по настоящему изобретению»). Следует отметить, что при использовании для описания перечисленных ниже нуклеотидных последовательностей, предполагается, что фраза «указанная выше активность по настоящему изобретению» означает определенную выше «активность LPAAT и/или способность дать соотношение жирных кислот LPAT в настоящем изобретении».
(а) Нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, и имеющей указанную выше активность по настоящему изобретению.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах по настоящему изобретению, включают нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, и имеющей указанную выше активность по настоящему изобретению. Конкретнее, как объясняется в разделе «Гомологи ацилтрансферазы лизофосфатидиновой кислоты (LPAAT) 1», она представляет собой нуклеотидную последовательность, которая кодирует белок, состоящий из:
(i) аминокислотной последовательности с делецией одной или более (предпочтительно, одной или нескольких (например, 1-48, 1-32, 1-24, 1-20, 1-16, 1-12, 1-10, 1-8, предпочтительнее, 1-4)) аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2;
(ii) аминокислотной последовательности с заменой других аминокислот на одну или более (предпочтительно, одну или несколько (например, 1-48, 1-32, 1-24, 1-20, 1-16, 1-12, 1-10, 1-8, предпочтительнее, 1-4)) аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2;
(iii) аминокислотной последовательности с добавлением других одной или более (предпочтительно, одной или нескольких (например, 1-48, 1-32, 1-24, 1-20, 1-16, 1-12, 1-10, 1-8, предпочтительнее, 1-4)) аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2; или
(iv) аминокислотной последовательности с любой комбинацией представленных выше подпунктов от (i) до (iii),
и имеющую указанную выше активность по настоящему изобретению.
Среди указанных выше модификаций, замена является предпочтительно консервативной, что означает замену определенного аминокислотного остатка другим остатком, имеющим аналогичные физические и химические характеристики. Она может представлять собой любую замену, пока она по существу не изменяет структурные характеристики первоначальной последовательности. Например, возможна любая замена, пока замененная аминокислота не разрушает спираль, присутствующую в первоначальной последовательности, или не разрушает любой другой тип вторичной структуры, характеризующей первоначальную последовательность.
Консервативное замена в целом вводится синтезом в биологических системах или химическим пептидным синтезом, предпочтительно, химическим пептидным синтезом. В этом случае, замены могут включать ненатуральные аминокислотные остатки, а также пептидомиметики, и реверсивные или инвертированные формы аминокислотных последовательностей, в которых незамененные области являются реверсивными или инвертированными.
Аминокислотные остатки классифицируются и перечислены ниже в группах взаимно заменяемых членов, но не ограничиваются следующим:
Группа А: лейцин, изолейцин, норлейцин, валин, норвалин, аланин, 2-аминобутаноевая кислота, метионин, О-метилсерин, трет-бутилглицин, трет-бутилаланин и цикогексилаланин;
Группа В: аспарагиновая кислота, глутаминовая кислота, изоаспарагиновая кислота, изоглутаминовая кислота, 2-аминоадипиновая кислота и 2-аминосуберовая кислота;
Группа С: аспарагин и глутамин;
Группа D: лизин, аргинин, орнитин, 2,4-диаминобутаноевая кислота и 2,3-диаминопропионовуая кислота;
Группа Е: пролин, 3-гидроксипролин и 4-гидроксипролин;
Группа F: серин, треонин и гомосерин; и
Группа G: фенилаланин и тирозин.
Не консервативная замена может включать обмен члена одного из указанных выше классов на член из другого класса. В этом случае, с целью поддержания биологических функций белков по настоящему изобретению, предпочтительно учитывать гидропатический показатель аминокислот (гидропатический аминокислотный индекс) (Kyte et al., J. Mol. Biol., 157:105-131 (1982)).
В случае не консервативной замены, аминокислотные замены могут также осуществляться на основе гидрофильности.
В описании и чертежах настоящей заявки, нуклеотиды, аминокислоты и их аббревиатуры представлены в соответствии с номенклатурой IUPAC-IUB Commission on Biochemical Nomenclature или в соответствии с обычными нормами, принятыми в данной области, например, как оописано в публикации Immunology - A Synthesis (second edition, edited by E.S. Golub and D.R. Gren, Sinauer Associates, Sunderland, Massachusetts (1991)). Кроме того, пока нет других определений, аминокислоты, которые могут иметь оптические изомеры, предназначены для представления их L-изомера.
Стереоизомеры (например, D-аминокислоты) указанных выше аминокислот, ненатуральных аминокислот, таких как α,α-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие необычные аминокислоты, могут также представлять членов, составляющих белки по настоящему изобретению.
Следует отметить, что в используемом в настоящем описании обозначении белка, направление влево представляет собой амино концевое направление, и направление вправо представляет собой карбокси концевое направление, в соответствии со стандартным использованием и конвенцией.
Аналогичным образом, пока нет других определений, левый конец однонитевых полинуклеотидных последовательностей представляет собой 5'-конец, а направление влево двухнитевых полинуклеотидных последовательностей именуется направлением 5'.
Специалисты в данной области могли бы сконструировать и получить соответствующие мутанты белков, описанных в настоящем описании, использованием методик, известных в данной области. Например, при нацеливании на область, которая, как представляется, менее важна для биологической активности белка по настоящему изобретению, можно идентифицировать подходящую область в молекуле белка, структуру которой можно изменить без придания биологической активности белка по настоящему изобретению. Можно также идентифицировать остатки или области в молекуле, которые сохраняются у одинаковых белков. Кроме того, можно также ввести консервативные аминокислотные замены в область, которая, как представляется, важна для биологической активности или структуры белка по настоящему изобретению без неблагоприятного воздействия на полипептидную структуру белка. В частности, в настоящем изобретении, аминокислотная последовательность LPAAT по настоящему изобретению содержит консенсусный мотив, «HXXXXD (HX4D)», в остатках 208-213. Этот мотив существен для ацилтрансферазы глицеролипида (J. Bacteriology, 180, 1425-1430, 1998) и также важен для LPAAT по настоящему изобретению. Таким образом, мутанты в соответствии с настоящим изобретением ни коим образом не ограничиваются, пока консенсусный мотив сохранен и не нарушена указанная выше активность по настоящему изобретению. В указанном выше консенсусном мотиве, Х представляет любой аминокислотный остаток.
Специалисты в данной области должны быть способны провести так называемое исследование структуры-функции, которое идентифицирует остатки, в белке по настоящему изобретению и в его аналогичном пептиде, которые важны для биологической активности или структуры, и включает аминокислотные остатки между этими двумя пептидами, посредством этого, прогнозируя, какие остатки в белке, аналогичном белку по настоящему изобретению, представляют собой аминокислотные остатки, соответствующие тем, которые важны для биологической активности или структуры. Кроме того, химически похожие аминокислотные замещения могут быть выбраны для аминокислотных остатков, таким образом, прогнозируя для выбора, посредством этого, мутанта, который сохраняет биологическую активность белка по настоящему изобретению. Аналогичным образом, специалисты в данной области могли бы также проанализировать трехмерную структуру и аминокислотную последовательность этого белкового мутанта. Полученные таким образом результаты анализа могут быть, кроме того, использованы для прогноза совмещения аминокислотных остатков в отношении трехмерной структуры белка. Поскольку аминокислотные остатки, прогнозируемые как находящиеся на белковой поверхности, могут быть вовлечены в важные взаимодействия с другими молекулами, специалисты в данной области могли бы получить мутант, который не вызывает изменение в этих аминокислотных остатках, прогнозированных как находящиеся на белковой поверхности, на основании результатов анализа, как указано выше. Кроме того, специалисты в данной области могли бы также получить мутант, имеющий замену одной аминокислоты на любые аминокислотные остатки, составляющие белок по настоящему изобретению. Скрининг этих мутантов может проводиться любым известным анализом для сбора информации об отдельных мутантах, что в свою очередь обеспечивает возможность оценки возможности использования отдельных аминокислотных остатков, составляющих белок по настоящему изобретению при сравнении со следующим случаем, где мутант, имеющий замену определенного аминокислотного остатка проявляет более низкую биологическую активность, чем биологическая активность белка по настоящему изобретения, где такой мутант не проявляет биологической активности, или где такой мутант проявляет неподходящую активность для ингибирования биологической активности белка по настоящему изобретению. Кроме того, на основании информации, собранной по таким обычным экспериментам, специалисты данной области могут легко проанализировать аминокислотные замещения, нежелательные для мутантов белка по настоящему изобретению или отдельно, или в комбинации с другими мутациями.
Как описано выше, белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, может быть получен в соответствии с методиками, такими как направленный на сайт мутагенеза, как описано в публикациях “Molecular Cloning, A Laboratory Manual 3rd ed.” (Cold Spring Harbor Press (2001)), “Current Protocols in Molecular Biology” (John Wiley & Sons (1987-1997), Kunkel (1985) Proc. Natl. Acad. Sci. USA 82: 488-92, и Kunkel (1988) Method. Enzymol. 85: 2763-6. Получение мутанта с такой мутацией, включающей аминокислотную делецию, замену или добавление, может осуществляться, например, известными процедурами, такими как способ Kunkel или способ дуплекса с гэпом, с использованием вводящего мутацию набором на основании направленного на сайт мутагенеза, такого как наборы QuikChangeTM Site-Directed Mutagenesis Kit (Stratagene), a GeneTailorTM Site-Directed Mutagenesis System (Invitrogen) или TaKaRa Site-Directed Mutagenesis System (например, Mutan-K, Mutan-Super Express Km; Takara Bio Inc., Japan).
Методики для обеспечения возможности делеции, замены или добавления одной или более аминокислот в аминокислотных последовательностях белков при сохранении их активности, включают указанный выше направленный на сайт мутагенез, а также другие методики, такие как методики для обработки гена мутагеном, и методики, при которых ген селективно расщепляется для удаления, замены или добавления выбранного нуклеотида или нуклеотидов, и затем лигируется.
Настоящее изобретение более предпочтительно направлено на белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в SEQ ID NO: 2, и имеющий указанную выше активность по настоящему изобретению.
Нет ограничения количества или сайтов аминокислотных мутаций или модификаций в белке по настоящему изобретению, пока полученный мутант сохраняет активность LPAAT или способность давать пропорцию жирных кислот LPAAT в настоящем изобретении.
Активность LPAAT в настоящем изобретении или способность давать пропорцию жирных кислот LPAAT в настоящем изобретении могут быть измерены известным образом. Например, можно сделать ссылку на следующий документ: J.B.C., 265, 17215-17221, 1990.
«Активность LPAAT» в настоящем изобретении, в качестве примера, может быть измерена следующим образом. Микросомальную фракцию получают из дрожжевых клеток, трансформированных для экспрессии LPAAT по настоящему изобретению, как описано, например, в публикации J. Bacteriology, 173, 2026-2034 (1991). К реакционному раствору, содержащему 0,44 мМ LPA, 0,36 мМ ацил-CoA, 0,5 мМ DTT, 1 мг/мл BSA и 2 мМ MgCl2 в 50 мМ Tris-HCl (pH 7,5), затем добавляют указанную выше микросомальную фракцию, и реакцию проводят при 28°C в течение соответствующего периода. Добавляют хлороформ:метанол для прекращения реакции с последующей экстракцией липидов. Полученные липиды фракционируются тонкослойной хроматографией или другими методиками, посредством чего может быть определено количество генерированного PA.
Аналогичным образом, «способность давать пропорцию жирных кислот LPAAT» в настоящем изобретении можно измерить, в качестве примера, следующим образом. К лиофилизированным клеткам, полученным способом получения композиции жирных кислот по настоящему изобретению, добавляется смесь хлороформа:метанола, доведенная до соответствующего соотношения, и перемешивается с последующей тепловой обработкой в течение соответствующего периода. Далее выполняется центрифугирование, выполняемое для отделения клеток и сбора растворителя. Эта процедура повторяется несколько раз. Затем липиды высушиваются соответствующим образом, и добавляется растворитель, такой как хлороформ, для растворения липидов. Соответствующий аликвот этого образца обрабатывается способом хлористоводородной кислоты/метанола для превращения жирных кислот в клетках в соответствующие сложные метиловые эфиры с последующей экстракцией гексаном. После отгонки гексана, жирные кислоты анализируются газовой хроматографией.
(b) Нуклеотидная последовательность, которая является гибридизируемой в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO; 1, и которая кодирует белок, имеющий указанную выше активность настоящему изобретению.
Нуклеотидная последовательность, содержащаяся в нуклериновых кислотах по настоящему изобретению, включают нуклеотидную последовательность, которая является гибридизируемой в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO; 1, и которая кодирует белок, имеющий указанную выше активность настоящему изобретению, как объясняется в разделе «Гомологи ацилтрансферазы лизофосфатидиновой кислоты (LPAAT) 1.» SEQ ID NO; 1 и указанная выше активность по настоящему изобретению представляют собой, как описано выше.
Для получения указанной выше нуклеотидной последовательности, зонд может быть получен из соответствующего фрагмента известным специалистам в данной области образом, и этот зонд может использоваться в известных методиках гибридизации, таких как гибридизация колонии, гибридизация бляшки или саузерн блоттинг, для получения нуклеотидной последовательности из библиотеки кДНК, геномной библиотеки или тому подобных.
Что касается детальных процедур методик гибридизации, можно сделать ссылку на публикации “Molecular Cloning, A Laboratory Manual 3rd ed.” (Cold Spring Harbor Press (2001); в частности, разделы 6-7), “Current Protocols in Molecular Biology” (John Wiley & Sons (1987-1997); в частности, разделы 6.3-6.4), “DNA Cloning 1: Core Techniques, A Practical Approach 2nd ed.” (Oxford University (1995); в частности, раздел 2.10, где описаны условия гибридизации).
Сила гибридизации определяется в первую очередь условиями гибридизации, предпочтительнее, условиями гибридизации и условиями промывания. Условия высокой строгости (высоко жесткие условия) включают, например, условия гибридизации от 0,1 (SSC до 2 (SSC при 55°C-65°C, предпочтительнее, от 0,1 (SSC до 1 (SSC при 60°C-65°C, а наиболее предпочтительно, 0,2 (SSC при 63°C. В определенных случаях, таких, где раствор гибридизации содержит примерно 50% формамида, используется температура, которая на 5°C-15°C ниже, чем указанная выше температура. Условия промывания могут быть от 0,2 (SSC до 2 (SSC при 50°C-68°C, а предпочтительнее, 0,2 (SSC при 60°C-65°C. Во время гибридизации и промывания, может добавляться от 0,05% до 0,2% SDS, предпочтительно, примерно 0,1% SDS.
Предпочтительная нуклеотидная последовательность, охватываемая настоящим изобретением, представляет собой нуклеотидную последовательность, которая может гибридизироваться в условиях 1 (SSC при 60°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность LPAAT.
Можно также использовать выпускаемый промышленностью набор для гибридизации, в котором не используется радиоактивное вещество в качестве зонда. Определенные примеры включают гибридизацию набором для выявления нуклеиновых кислот DIG (Roche Diagnostics) или устройством для прямого мечения и выявления ECL direct labeling & detection system (Amersham).
(с) Нуклеотидная последовательность, которая состоит из нуклеотидной последовательности, имеющей идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий указанную выше активность по настоящему изобретению.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах по настоящему изобретению, включают нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, представляющей собой по меньшей мере на 90% или более последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, и которая кодирует белок, имеющий указанную выше активность по настоящему изобретению, как объясняется в разделе «Гомологи ацилтрансферазы лизофосфатидиновой кислоты (LPAAT) 1».
Настоящее изобретение включает нуклеиновые кислоты, содержащие нуклеотидную последовательность, имеющую идентичность по меньшей мере 90% или более, предпочтительно, 93% или более, предпочтительнее, 95% или более (например, 95%, еще предпочтительнее, 96%, конкретнее, 97%, 98% или 99%) с последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 1, и которая кодирует белок, имеющий указанную выше активность по настоящему изобретению.
Процент идентичности между двумя последовательностями нуклеиновых кислот может быть определен визуальным осмотром и математическим расчетом или предпочтительнее, использованием компьютерной программы для сравнения информации о последовательности между двумя нуклеиновыми кислотами. Компьютерные программы для сравнения последовательностей включают, например, программу BLASTN (Altschul et al. (1990) J. Mol. Biol. 215: 403-10) в версии 2.2.7, доступную для использования через сайт в интернете Национальной Медицинской Библиотеки: http://www.ncbi.nlm.nih.gov/blast/b12seq/bls.html, или алгоритм WU-BLAST 2.0. Стандартные установки параметров по умолчанию для алгоритма WU-BLAST 2.0 описаны в следующем сайте интернета: .
(d) Нуклеотидная последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий указанную выше активность по настоящему изобретению.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах по настоящему изобретению, включают нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий указанную выше активность по настоящему изобретению, как объясняется в разделе «Гомологи ацилтрансферазы лизофосфатидиновой кислоты (LPAAT) 1».
Конкретнее, настоящее изобретение включает нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность по меньшей мере 90% или более, предпочтительно, 93% или более, предпочтительнее, 95% или более (например, 95%, еще предпочтительнее, 96%, конкретнее, 97%, 98% или 99%) с аминокислотной последовательностью, показанной в SEQ ID NO: 2, и которая кодирует белок, имеющий указанную выше активность по настоящему изобретению.
Предпочтительная нуклеотидная последовательность, содержащаяся в нуклеиновых кислотах по настоящему изобретению, представляет собой нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий указанную выше активность по настоящему изобретению. Более предпочтительной является нуклеотидная последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 95% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий указанную выше активность по настоящему изобретению.
Процент идентичности между двумя аминокислотными последовательностями может быть определен визуальным осмотром и математическим расчетом. Альтернативно, процент идентичности может быть определен с использованием компьютерной программы. Примеры такой компьютерной программы включают BLAST, FASTA (Altschul et al., J. Mol. Biol., 215: 403-410 (1990)) и ClustalW. В частности, различные условия (параметры) для поиска идентичности программой BLAST, описаны Altschul et al. (Nucl. Acids. Res., 25, p.3389-3402, 1997) и общедоступны через сайт интернета Национального Центра Биотехнологической Информации (NCBI) или Банка данных ДНК Японии (DDBJ) (BLAST Manual, Altschul et al., NCB/NLM/NIH Bethesda, MD 20894; Altschul et al.). Можно также использовать программу, такую как программное обеспечение для обработки генетической информации GENETYX Ver.7 (Genetyx Corporation, Japan), DINASIS Pro (Hitachisoft, Japan) или Vector NTI (Infomax), для определения процент идентичности.
Определенные схемы совмещения для совмещения аминокислотных последовательностей может также привести к подбору определенной короткой области последовательностей, и можно также вывить область с очень высокой идентичностью последовательности в таком маленькой совмещенной области, даже когда нет значимой связи между используемыми последовательностями полной длины. Кроме того, в алгоритме BLAST используется матрица балльной оценки аминокислот BLOSUM62, и необязательные параметры, которые могут использоваться следующим образом: (А) включение фильтра для маскировки сегментов вызывающей сомнение последовательности, которые имеют низкую композиционную сложность (по данным определения программой SEG Wootton и Federhen (Computers and Chemistry, 1993); см. также Wootton and Federhen, 1996, “Analysis of compositionally biased regions in sequence databases,” Methods Enzymol., 266: 544-71), или сегментов, состоящих из внутренних повторений с короткой периодичностью (по данным определения программой XNU Claverie и States (Computers and Chemistry, 1993)), и (B) порог статистической значимости для сообщения о парах, соответствующих последовательностям базы данных, или балльная оценка по шкале Е (при ожидаемой вероятности совпадающих пар обнаруживаемой просто случайно, в соответствии со стохастической моделью Karlin и Altschul, 1990; если статистическая значимость, приписанная совпадающей паре, больше чем этот порог балльной оценки по шкале Е, то совпадающая пара не будет отмечена).
(е) Нуклеотидная последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящей из аминокислотной последовательности, показанной в SEQ ID NO: 2, и которая кодирует белок, имеющий указанную выше активность по настоящему изобретению.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах по настоящему изобретению, включают нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2, и которая кодирует белок, имеющий указанную выше активность по настоящему изобретению, как объясняется в разделе «Гомологи ацилтрансферазы лизофосфатидиновой кислоты (LPAAT) 1».
Такой белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2, и условия гибридизации представляют собой, как описано выше. Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах по настоящему изобретению, включают нуклеотидную последовательность, которая может гибридизироваться в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2, и которая кодирует белок, обладающей активностью по настоящему изобретению.
Нуклеиновые кислоты по настоящему изобретению также включают нуклеиновую кислоту, которая содержит нуклеотидную последовательность с делецией, заменой или добавлением одной или более нуклеотидных последовательностей в нуклеотидной последовательности, состоящей из SEQ ID NO: 1, и кодирующей белок, имеющий указанную выше активность по настоящему изобретению. Конкретнее, можно также использовать нуклеиновую кислоту, которая содержит нуклеотидную последовательность, выбранную из:
(i) нуклеотидной последовательности с делецией одного или более (предпочтительно, одного или нескольких (например, 1-144, 1-96, 1-72, 1-48, 1-30, 1-24, 1-20, 1-15, 1-10, предпочтительнее, 1-5)) нуклеотидов в нуклеотидной последовательности, показанной в SEQ ID NO: 1;
(ii) нуклеотидной последовательности с заменой других нуклеотидов на один или более (предпочтительно, один или несколько (например, 1-144, 1-96, 1-72, 1-48, 1-30, 1-24, 1-20, 1-15, 1-10, предпочтительнее, 1-5)) нуклеотидов в нуклеотидной последовательности, показанной в SEQ ID NO: 1;
(iii) нуклеотидной последовательности с добавлением других одного или более (предпочтительно, одного или нескольких (например, 1-144, 1-96, 1-72, 1-48, 1-30, 1-24, 1-20, 1-15, 1-10, предпочтительнее, 1-5)) нуклеотидов в нуклеотидной последовательности, показанной в SEQ ID NO: 1; или
(iv) нуклеотидной последовательности с любой комбинацией представленных выше подпунктов от (i) до (iii),
и кодирующую белок, имеющий указанную выше активность по настоящему изобретению.
Настоящее изобретение конкретнее направлено на белок, состоящий из нуклеотидной последовательности с делецией, заменой или добавлением от одного до нескольких десятков нуклеотидов, предпочтительнее, 1-10 нуклеотидов в SEQ ID NO: 1, и имеющий указанную выше активность по настоящему изобретению.
Белки ацилтрансферазы лизофосфатидиновой кислоты по настоящему изобретению
LPAAT1-длинный по настоящему изобретении, который может быть или естественно встречающимся, или искусственно полученным, включает белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2, и белки, функционально эквивалентные этому белку. Такой белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2, представляет собой, как описано выше. Фраза «белки, функционально эквивалентные» предназначена для обозначения белков, имеющих «указанную выше активность по настоящему изобретению», как описано выше в разделе «Нуклеиновые кислоты по настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидиновой кислоты».
В настоящем изобретении, белки, функционально эквивалентные белку, состоящему из аминокислотной последовательности, показанной в SEQ ID NO: 2, включают белки, показанные ниже в подпунктах (а)-(е), каждый из которых имеет указанную выше активность по настоящему изобретению:
(а) белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, и имеющей активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) белок, кодируемый нуклеотидной последовательностью, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющей активность ацилтрансферазы лизофосфатидиновой кислоты;
(с) белок, кодируемый нуклеотидной последовательностью, которая состоит из нуклеотидной последовательности, имеющей идентичность 90% или более с нуклеотидной последовательностью, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющей активность ацилтрансферазы лизофосфатидиновой кислоты;
(d) белок, состоящий из аминокислотной последовательности, имеющей идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и имеющей активность ацилтрансферазы лизофосфатидиновой кислоты; и
(е) белок, кодируемый нуклеотидной последовательностью, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты.
Среди указанных выше, аминокислотная последовательность с делецией, заменой или добавлением одной или более аминокислот в SEQ ID NO: 2 или аминокислотная последовательность, имеющая идентичность 90% или более с аминокислотной последовательностью SEQ ID NO: 2, представляет собой, как объясняется в описанном выше разделе «Нуклеиновые кислоты по настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидиновой кислоты». Фраза «белок, который имеет указанную выше активность по настоящему изобретению» предназначена также для включения мутантов белка, кодируемого нуклеиновой кислотой, содержащей нуклеотидную последовательность SEQ ID NO: 1, или мутированные белки с различными модификациями, такими как замена, делеция или добавление одной или более аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, а также их модифицированные белки, чьи аминокислотные боковые цепи или им подобные модифицированы, и их конденсированные беки с другими белками, пока эти белки имеют активность LPAAT и/или способность давать пропорцию жирных кислот LPAAT в настоящем изобретении. Следует отметить, что такой белок, функционально эквивалентный белку, состоящему из аминокислотной последовательности, показанной в SEQ ID NO: 2, предпочтительнее представляет собой белок, который состоит из аминокислотной последовательности, имеющей идентичность 95% или более с аминокислотной последовательностью SEQ ID NO: 2, и который имеет указанную выше активность по настоящему изобретению.
LPAAT1-длинный по настоящему изобретению может также быть искусственно получен методиками химического синтеза, такими как способ Fmoc (фторенилметилоксикарбонильный способ) и способ tBoc (трет-бутоксикарбонильный способ). Кроме того, для химического синтеза могут также использоваться пептидные синтезаторы, выпускаемые компаниями Advanced ChemTech, Perkin Elmer, Pharmacia, Protein Technology Instrument, Synthecell-Vega, PerSeptive, Shimadzu Corporation (Japan) или другими изготовителями.
Клонирование нуклеиновых кислот LPAAT
Нуклеиновые кислоты, имеющие специфическую последовательность LPAAT1-длинного по настоящему изобретению и их мутанты могут клонироваться, например, скринингом из библиотеки кДНК с использованием соответствующего зонда. Они могут также клонироваться амплификацией PCR (полимеразной реакцией синтеза цепи) с соответствующими затравками и последующим лигированием в соответствующий вектор. Полученные таким образом клоны могут далее субклонироваться в другой вектор. Ниже будет дано объяснение для случая использования нуклеиновой кислоты LPAAT1-длинного.
Например, можно использовать выпускаемые промышленностью плазмидные векторы, включая pBlue-ScriptTM SK(+) (Stratagene), pGEM-T (Promega), pAmp (TM: Gibco-BRL), p-Direct (Clontech) и pCR2.1-TOPO (Invitrogen). В случае использования амплификации PCR, затравками могут быть любые области нуклеотидной последовательности, показанной в SEQ ID NO: 1. В качестве примера, можно использовать следующие затравки из SEQ ID NO: 1:
Затравку 955-1: GGACGTGTCAAGGAAAAGGA (SEQ ID NO: 6) в качестве затравки выше по ходу танскрипции; и
Затравку 955-2: TCCTTCAGATGAGCCTCCTG (SEQ ID NO: 7) в качестве затравки ниже по ходу транскрипции. Затем PCR выполняется на кДНК, полученной из клеток M. alpine, с указанными выше затравками и термофильной ДНК полимеразой или тому подобной. Хотя эта процедура может легко осуществляться специалистами в данной области, например, в соответствии с положениями руководства “Molecular Cloning, A Laboratory Manual 3rd ed.” (Cold Spring Harbor Press (2001)), условия PCR в настоящем изобретении могут быть установлены следующим образом, в качестве примера:
Температура денатурации: 90-95°C
Температура отжига: 40-60°C
Температура удлинения: 60-75°C
Число циклов: 10 или более циклов.
Полученные продукты PCR могут быть очищены известным образом, например, использованием набора (например, GENECLEAN (Funakoshi Co., Ltd., Japan), наборов для очистки QIAquick PCR purification Kits (QIAGEN), ExoSAP-IT (GE Healthcare Bio-Sciences)), фильтра DEAE-целлюлозы или диализной трубки. В случае использования агарозного геля, продукты PCR подвергаются электрофорезу на агарозном геле, и фрагменты нуклеотидной последовательности вырезаются из агарозного геля с последующей очисткой набором GENECLEAN (Funakoshi Co., Ltd., Japan) или экстракционным набором QIAquick Gel extraction Kits (QIAGEN) или способом замораживания-выдавливания и т.д.
Нуклеотидные последовательности клонированных нуклеиновых кислот могут быть определены нуклеотидным секвенсером.
Конструкция вектора для экспрессии LPAAT и получения трансформанта
Рекомбинантный вектор, несущий нукелиновую кислоту, кодирующую LPAAT1-длинный по настоящему изобретению, или его мутант и трансформант, трансформированный этим рекомбинантным вектором, может быть получен следующим образом. Ниже объяснение будет дано для случая использования нуклеиновой кислоты LPAAT1-длинного. А именно, плазмида, несущая нуклеиновую кислоту, кодирующую LPAAT1-длинный по настоящему изобретению, переваривается рестрикционными ферментами. Примеры имеющихся рестрикционных ферментов для использования включают без ограничения EcoRI, KpnI, BamHI и SalI. За этим перевариванием может следовать «затупление конца» T4 полимеразой. Фрагмент переваренной нуклеотидной последовательности очищается электрофорезом на агарозном геле. Этот Фрагмент нуклеотидной последовательности может быть интегрирован в вектор экспрессии известным образом для получения вектора для экспрессии LPAAT1-длинного. Этот вектор экспрессии вводится в хозяина для получения трансформанта, который затем предоставляется для экспрессии желательного белка.
В этом случае, типы вектора экспрессии и хозяина ни коим образом не ограничиваются, пока они обеспечивают возможность экспрессии желательного белка. Примеры хозяина включают грибы, бактерии, растения, животных или их клетки. Грибы включают гифомицеты, такие как продуцирующие липиды M. alpina, и дрожжевые штаммы, такие как Saccharomyces cerevisiae. Бактерии включают Escherichia coli (E.coli) и Bacillus subtilis. Аналогичным образом, растения включают масляничные растения, такие как семена капусты, соевые бобы, хлопок, сафлор и лен.
В качестве продуцирующих липиды штаммов могут использоваться такие как те, которые можно найти в документе MYCOTAXON, Vol.XLIV, NO. 2, pp.257-265 (1992). Определенные примеры включают микроорганизмы, относящиеся к роду Mortierella, примерами которых являются микроорганизмы, относящиеся к подроду Mortierella, такие как Mortierella elongata IFO8570, Mortierella exigua IFO8571, Mortierella hygrophila IFO5941, Mortierella alpina IFO8568, ATCC16266, ATCC32221, ATCC42430, CBS 219.35, CBS224.37, CBS250.53, CBS343.66, CBS527.72, CBS528.72, CBS529.72, CBS608.70, CBS754.68, а также микроорганизмы, относящиеся к подроду Micromucor, такие как Mortierella isabellina CBS194.28, IFO6336, IFO7824, IFO7873, IFO7874, IFO8286, IFO8308, IFO7884, Mortierella nana IFO8190, Mortierella ramanniana IFO5426, IFO8186, CBS112.08, CBS212.72, IFO7825, IFO8184, IFO8185, IFO8287, Mortierella vinacea CBS236.82. Особенно предпочтительной является Mortierella alpina.
Когда гриб используется в качестве хозяина, желательно, чтобы нуклеотидная кислота по настоящему изобретению была самореплицируемой у хозяина, или имела структуру, вставляемую в грибковую хромосому. В то же самое время, предпочтительно, кроме того, содержать промотер и терминатор. Когда M. alpina используется в качестве хозяина, примеры вектора экспрессии включают pD4, pDuraSC и pDura5. Может использоваться любой промотер, пока он обеспечивает возможность экспрессии в хозяине, и примеры включают промотеры, полученные из M. alpina, такие как промотер гена histonH 4.1, промотер гена GAPDH (глицеральдегид-3-фосфат-дегидрогеназы) и промотер гена TEF (фактор трансляции удлинения).
Методики введения рекомбинантного вектора в гифомицеты (например, M. alpine) включают способы электропорообразования, сферопласт и доставку частиц, а также прямую микроинъекцию ДНК в ядра. В случае использования ауксотрофического штамма хозяина, могут быть выбраны штаммы, растущие на селективной среде, лишенной питательных веществ, требуемых для штамма хозяина для получения посредством этого трансформированных штаммов. Альтернативно, в случае, когда используется маркерный ген устойчивости к лекарственному средству, культивирование может проводиться в селективной среде, содержащей лекарственное средство, для получения посредством этого колоний клеток, устойчивых к лекарственному средству.
Когда дрожжи используются в качестве хозяина, примеры вектора экспрессии включают pYE22m. Альтернативно, могут также использоваться выпускаемые промышленностью дрожжевые векторы экспрессии, такие как pYES (Invitrogen) и pESC (STRATAGENE). Дрожжевые хозяева, подходящие для настоящего изобретения, включают без ограничения штамм EH13-15 Saccharomyces cerevisiae (trp1, MATα). Примеры промотера, доступного для использования, включают промотеры, полученные из дрожжей или тому подобные, такие как промотер GAPDH, промотер gal1 и промотер gal10.
Методики введения рекомбинантного вектора в дрожжевые клетки включают способы с использованием ацетата лития, электропорообразования и сферопласта, а также опосредованную декстраном трансфекцию, осаждение фосфатом кальция, опосредованную полибреном трансфекцию, слияние протопласта, инкапсуляцию полинуклеотида (полинуклеотидов) в липосомах и прямую микроинъекцию ДНК в ядра.
Когда бактерия, такая как E.coli, используется в качестве хозяина, примеры вектора экспрессии включают pGEX и pUC18, выпускаемые компанией Pharmacia. Примеры промотера, выпускаемого для использования, включают те, которые получены из E.coli, фага или тому подобных, таких как промотер trp, промотер lac, промотер PL и промотер PR. Методики для введения рекомбинантного вектора в бактерии включают способы с использованием электропорообразования и хлорида кальция.
Композиции жирных кислот по настоящему изобретению
Настоящее изобретение относится к композиции жирных кислот, полученной культивированием хозяина, который трансформирован указанным выше рекомбинантным вектором, несущим LPAAT1-длинный или ему подобный. Конкретнее, композиция жирных кислот по настоящему изобретению представляет собой композицию жирных кислот, полученную культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту по настоящему изобретению, кодирующую ацилтрансферазу лизофосфатидиновой кислоты (т.е., нуклеиновую кислоту, содержащую нуклеотидную последовательность SEQ ID NO: 1 или нуклеотидную последовательность, кодирующую белок, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 2, или мутант, функционально эквивалентный нуклеиновой кислоте), где по меньшей мере один из указанных ниже параметров i)-v):
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение содержания олеиновой кислоты к содержанию стеариновой кислоты;
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к общему содержанию пальмитиновой кислоты и пальмитолеиновой кислоты; и
v) содержание n-6 жирной кислоты
выше в пропорции жирных кислот композиции жирных кислот, чем в культивированном продукте, полученном культивированием хозяина, который не трансформирован рекомбинантным вектором по настоящему изобретению. Используемая в настоящем описании фраза «хозяин, который не трансформирован рекомбинантным вектором по настоящему изобретению» предназначена для обозначения, например, хозяина, трансформированного пустым вектором, не несущим нуклеиновых кислот, описанных в разделе «Нуклеиновые кислоты по настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидиновой кислоты».
Жирные кислоты, охватываемые настоящим изобретением, могут представлять собой свободные жирные кислоты или могут представлять собой триглицериды, фосфолипиды или им подобные.
Жирные кислоты, содержащиеся в композиции жирных кислот по настоящему изобретению, относятся к линейным или разветвленным монокарбоновым ксилотам длинноцепочечных углеводородов, включая без ограничения миристиновую кислоту (тетрадеканоевую кислоту) (14:0), миристолеиновую кислоту (тетрадеценоевую кислоту) (14:1), пальмитиновую кислоту (гексадеканоевую кислоту) (16:0), пальмитолеиновую кислоту (9-гексадеканоевую кислоту) (16:1), стеариновую кислоту (октадеканоевую кислоту) (18:0), олеиновую кислоту (цис-9-октадеканоевую кислоту) (18:1(9)), вакценовую кислоту (11-октадеканоевую кислоту) (18:1(11)), линолевую кислоту (цис, цис-9,12-октадеканоевую кислоту) (18:2(9,12)), α-линоленовую кислоту (9,12,15-октадекатриеноевую кислоту) (18:3(9,12,15)), γ-линоленовую кислоту (6,9,12-октадекатриеноевую кислоту) (18:3(6,9,12)), стеаридоновую кислоту (6,9,12,15-октадекатетраеноевую кислоту) (18:4(6,9,12,15)), арахидоновую кислоту (икозаноевую кислоту) (20:0), (8,11-икозадиеновую кислоту) (20:2(8,11)), мидовую кислоту (5,8,11-икозатриеноевую кислоту) (20:3(5,8,11)), дигомо-γ-линоленовую кислоту (8,11,14-икозатриеноевую кислоту) (20:3(8,11,14)), арахидоновую кислоту (5,8,11,14-икозатетраеноевую кислоту) (20:4(5,8,11,14)), эйкозатетраеноевую кислоту (5,11,14,17-икозатетраеноевую кислоту) (20:4(5,11,14,17), эйкозапентаеноевую кислоту (5,8,11,14,17-икозапентаеноевую кислоту) (20:5(5,8,11,14,17)), бегеновую кислоту (докозаноевую кислоту) (22:0), (7,10,13,16-докозатетраеноевую кислоту) (22:4(7,10,13,16)), (4,7,13,16,19-докозапентаеноевую кислоту) (22:5(4,7,13,16,19)), (4,7,10,13,16-докозапентаеноевую кислоту) (22:5(4,7,10,13,16)), (4,7,10,13,16,19-докозагексаеноевую кислоту) (22:6(4,7,10,13,16,19)), лигноцеровую кислоту (тетрадокозаноевую кислоту) (24:0), нервоновую кислоту (цис-15-тетадокозаноевую кислоту) (24:1) и церотовую кислоту (гексадокозаноевую кислоту) (26:0). Следует отметить, что названия указанных выше веществ представляют собой общие названия, определенные номенклатурой IUPAC Biochemical Nomenclature, а их систематические названия даны в скобках наряду с цифровыми обозначениями, указывающими число атомов углерода и положения двойных связей.
То, получена ли композиция жирных кислот по настоящему изобретению, т.е. экспрессирован ли LPAAT1-длинный по настоящему изобретению, может быть подтверждено общеизвестным методом, например, в виде изменения пропорции жирных кислот, когда LPAAT1-длинный экспрессирован в дрожжевых клетках. А именно, к лиофилизированным клеткам, полученным указанным выше способом получения композиции жирных кислот по настоящему изобретению, добавляется смесь хлороформа:метанола, доведенная до их соответствующего соотношения, и перемешивается с последующей термической обработкой в течение соответствующего периода. Далее выполняется центрифугирование для отделения клеток и сбора растворителя. Эта процедура повторяется несколько раз. Затем, липиды высушиваются соответствующим образом, и добавляется растворитель, такой как хлороформ, для растворения липидов. Соответствующий аликвот данного образца обрабатывается способом с использованием хлористоводородной кислоты/метанола для превращения жирных кислот в клетках в соответствующие сложные метиловые эфиры, с последующей экстракцией гексаном. После отгонки гексана, жирные кислоты анализируются газовой хроматографией.
В результате, если получена композиция жирных кислот, имеющая указанную выше пропорцию жирных кислот, может быть определено, что была получена композиция жирных кислот по настоящему изобретению. Следует отметить, что LPAAT1-длинный по настоящему изобретению дает пропорцию жирных кислот, отличное от пропорции известных композиций жирных кислот LPAAT1, как описано выше. А именно, после анализа жирных кислот в LPAAT1-длинном по настоящему изобретению и в LPAAT1-коротком, использованном в качестве модели известного LPAAT1, LPAAT1-длинный по настоящему изобретению приводит к содержанию олеиновой кислоты примерно 54%, которое выше, чем содержание олеиновой кислоты в LPAAT1-коротком (около 42%), и он также приводит к отношению содержания олеиновой кислоты к содержанию пальмитиновой кислоты, которое выше в 1,8-2,5 раза, и к отношению общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты, которое выше в 1,8-2,3 раза, по сравнению с LPAAT1-коротким. Аналогичным образом, содержание n-6 жирных кислот в LPAAT1-длинном выше, чем в LPAAT1-коротком, конкретнее, содержание линолевой кислоты, γ-линоленовой кислоты и арахидоновой кислоты в LPAAT1-длинном выше, чем в LPAAT1-коротком.
Это указывает на то, что LPAAT1-длинный по настоящему изобретению имеет субстратную специфичность, отличную от субстратной специфичности известных LPAAT.
Следует отметить, что настоящее изобретение также относится к композиции жирных кислот, полученной культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность SEQ ID NO: 1 или нуклеотидную последовательность, кодирующую белок, имеющий аминокислотную последовательность SEQ ID NO: 2, или мутант, функционально эквивалентный нуклеиновой кислоте, как описано выше в разделе «Нуклеиновые кислоты по настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидиновой кислоты», где соотношение длинноцепочечных жирных кислот и/или содержание n-6 жирных кислот выше в композиции жирных кислот, чем в культивированном продукте, полученном культивированием хозяина, который не трансформирован рекомбинантным вектором. Термин «длинноцепочечные» означает, что углеродная цепь, составляющая жирную кислоту, имеет большую длину. Например, стеариновая кислота или олеиновая кислота, содержащая 18 атомов углерода, имеет более длинную цепь, чем пальмитиновая кислота или пальмитолеиновая кислота, содержащая 16 атомов углерода. N-6 жирные кислоты представляют собой, как объяснено в описанном выше разделе «Нуклеиновые кислоты по настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидиновой кислоты». Композицию жирных кислот по настоящему изобретению можно рассматривать как композицию жирных кислот, имеющую более высокое содержание олеиновой кислоты и более высокое отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты, а также имеющую более высокое соотношение длинноцепочечных жирных кислот или более высокое содержание n-6 жирных кислот, по сравнению с культивированным продуктом, полученным культивированием хозяина, который не трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, кодирующую LPAAT1-длинный. Кроме того, в зависимости от типа хозяина, выбранного в способе получения композиции жирных кислот по настоящему изобретению, возможно получение композиции жирных кислот, имеющей более высокое соотношение жирных кислот с более длинной цепью или высокое содержание n-6 жирных кислот. Примеры такого хозяина включают грибы, растения, животных или их клетки. Грибы включают гифомицеты, такие как продуцирующие липиды M. alpina, и дрожжевые штаммы, такие как Saccharomyces cerevisiae. Аналогичным образом, растения включают масляничные растения, такие как семена капусты, соевые бобы, хлопок, сафлор и лен. В этом случае, длинноцепочечные жирные кислоты, содержание которых выше, чем содержание жирных кислот в культивированном продукте, полученном культивированием хозяина, который не трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту по настоящему изобретению, включают без ограничения олеиновую кислоту, линолевую кислоту, γ-линоленовую кислоту, DGLA, α-линоленовую кислоту, стеаридоновую кислоту, арахидоновую кислоту, эйкозапентаеноевую кислоту, докозапентаеноевую кислоту и докозагексаноевую кислоту. N-6 жирные кислоты включают без ограничения линолевую кислоту, γ-линоленовую кислоту, DGLA и арахидоновую кислоту. Композиции жирных кислот, имеющие высокое соотношение таких жирных кислот более длинной цепью предпочтительны, потому что они могут иметь преимущество для применения в питательных добавочных пищевых продуктах, оздоровительных пищевых продуктах, функциональных пищевых продуктах, детском питании, модифицированном молоке для грудных детей, модифицированном молоке для недоношенных грудных детей, пищевых продуктах для лиц пожилого возраста и т.д.
Способы по настоящему изобретению для получения композиции жирных кислот
Настоящее изобретение также относится к способу получения этих композиций жирных кислот. Способ по настоящему изобретению характеризуется использованием описанного выше LPAAT1-длинного. Конкретнее, настоящее изобретение относится к способу получения композиции жирных кислот, который включает сбор композиции жирных кислот из культивированного продукта, полученного культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность SEQ ID NO: 1 или нуклеотидную последовательность, кодирующую белок, имеющий аминокислотную последовательность в SEQ ID NO: 2 или мутант, функционально эквивалентный нуклеиновой кислоте, где композиция жирных кислот имеет более высокую величину по меньшей мере для одного из указанных ниже параметров i)-v):
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение содержания олеиновой кислоты к содержанию стеариновой кислоты;
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к общему содержанию пальмитиновой кислоты и пальмитолеиновой кислоты; и
v) содержание n-6 жирной кислоты,
по сравнению с культивированным продуктом, полученным культивированием хозяина, который не трансформирован рекомбинантным вектором.
Для культивирования организмов, трансформированных для экспрессии LPAAT1-длинного, может использоваться любая среда, пока она представляет собой культуральный раствор (среду), имеющий соответствующий рН и осмотическое давление, а также содержащий питательные вещества, требуемые для роста каждого хозяина, микроэлементов и биоматериалы, такие как сыворотка или антибиотики. Например, в случае дрожжевых клеток, трансформированных для экспрессии LPAAT1-длинного, может использоваться среда SC-Trp, среда YPD, среда YPD5 или тому подобные, без ограничения ими. Композиция среды детально иллюстрируется для среды SC-Trp: 6,7 г дрожжевого азотного основания без аминокислот (DIFCO), 20 г глюкозы и 1,3 г аминокислотного порошка (смесь 1,25 г аденинсульфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г.Валина, 6 г треонина и 0,6 г урацила) на литр среды.
Могут использоваться любые условия культивирования, пока они подходят для роста хозяина и адекватны для поддержания генерированного фермента в устойчивом состоянии. Конкретнее, отдельные условия могут подбираться, включая анаэробную степень, период культивирования, температуру, влажность, статическое культивирование или культивирование при встряхивании. Культивирование может осуществляться в одинаковых условиях (одноэтапная культура) или так называемым двухэтапным или трехэтапным культивированием с использованием двух или более различных условий культивирования. Для крупномасштабного культивирования, предпочтительна двухэтапная или многоэтапная культура, ввиду высокой эффективности этой культуры.
Для детального объяснения процедур способа по настоящему изобретению получения композиции жирных кислот, ниже в качестве примера будет проиллюстрирована двухэтапная культура дрожжевого хозяина. А именно, на стадии перед культивированием, полученные выше колонии инокулируются в любую среду, описанную выше (например, среду SC-Trp) и культивируются при встряхивании при 30°C в течение 2 дней. Затем, на основной стадии культивирования, раствор для предварительного культивирования (500 мкл) добавляется к 10 мл среды YPD5 (2% дрожжевой экстракт, 1% полипептон, 5% глюкоза) и культивируется в условиях встряхивания при 30°C в течение 2 дней.
Применение нуклеиновых кислот по настоящему изобретению
Настоящее изобретение, кроме того, относится к применению описанного выше LPAAT1-длинного для получения композиции жирных кислот по настоящему изобретению.
Конкретнее, настоящее изобретение относится к применению LPAAT, кодирующего нуклеиновую кислоту по настоящему изобретению, для получения композиции жирных кислот по настоящему изобретению.
Применение указанной выше нуклеиновой кислоты предпочтительно, потому что она обеспечивает не только получение композиции жирных кислот по настоящему изобретению, но также получение пищевых или других продуктов, содержащих композицию жирных кислот, которые достигают предполагаемые цели, как объясняется в описанном ниже разделе «Пищевые или другие продукты, содержащие композиции жирных кислот по настоящему изобретению».
Пищевые или другие продукты, содержащие композиции жирных кислот по настоящему изобретению
Настоящее изобретение, кроме того, относится к пищевому продукту, содержащему указанную выше композицию жирных кислот. Композиция жирных кислот по настоящему изобретению может применяться обычным образом с такими целями как получение пищевых продуктов, содержащих жиры и масла, а также получение промышленных исходных материалов (материалом для косметических продуктов, фармацевтических продуктов (например, наружных препаратов для нанесения на кожу), мыл и т.д.). Косметические средства (косметические композиции) или фармацевтические средства (фармацевтические композиции) могут составляться в любую лекарственную форму, включая без ограничения растворы, пасты, гели, твердые вещества или порошки. Аналогичным образом, возможные формы пищевых продуктов включают фармацевтические препаративные формы, такие как капсулы, а также, переработанные пищевые продукты, такие как обычные жидкие рационы, полупереваренные питательные рационы, элементные рационы, питьевые препараты или препараты для энтерального питания, которые содержат композицию жирных кислот по настоящему изобретению, в смеси с белками, сахарами, жирами, микроэлементами, витаминами, эмульгаторами, ароматизаторами и т.д.
Кроме того, примеры пищевых продуктов по настоящему изобретению включают без ограничения питательные пищевые добавки, оздоровительные пищевые продукты, функциональные пищевые продукты, детское питание, модифицированное молоко для грудных детей, модифицированное молоко для недоношенных грудных детей и пищевые продукты для лиц пожилого возраста. Термин «пища» или «пищевой продукт» используется в настоящем описании в качестве генерического названия для пищевых материалов в форме твердых веществ, текучих веществ, жидкостей или их смесей.
Термин «питательные пищевые добавки» относится к пищевым продуктам, обогащенным определенными питательными ингредиентами. Термин «оздоровительные пищевые продукты» относится к пищевым продуктам, которые являются оздоровительными или полезными для здоровья, и охватывает питательные пищевые добавки, натуральные пищевые продукты и диетические пищевые продукты. Термины «функциональные пищевые продукты» относится к пищевым продуктам для восполнения питательных ингредиентов, которые содействуют функциям регуляции организма. Функциональные пищевые продукты синонимичны пищевым продуктам для определенного гигиенического применения. Термин «детское питание» относится к пищевым продуктам, даваемым детям в возрасте примерно до 6 лет. Термин «пищевые продукты для лиц пожилого возраста» относится к пищевым продуктам, обработанным для облегчения переваривания и всасывания, по сравнению с необработанными пищевыми продуктами. Термин «модифицированное молоко для грудных детей» относится к модифицированному молоку, даваемому детям в возрасте примерно до одного года. Термин «модифицированное молоко для недоношенных грудных детей» относится к модифицированному молоку, даваемому недоношенным младенцам примерно до 6 месяцев после рождения.
Эти пищевые продукты включают натуральные пищевые продукты (обработанные жирами и маслами), таких как мясо, рыба и орехи; пищевые продукты с добавками жиров и масел во время приготовления (например, китайские пищевые продукты, китайская лапша, супы); пищевые продукты, приготовленные с использованием жиров и масел в качестве сред для подогрева (например, температура (рыба и овощи глубокой заморозки), пищевые продукты глубокой заморозки, жареные продукты из свернувшегося соевого молока, китайский жареный рис, пончики, японские жареное тестовое печенье (каринто)); пищевые продукты на основе жира и масла или переработанные пищевые продукты с добавками жиров и масел во время переработки (например, сливочное масло, маргарин, майонез, приправы, шоколад, лапша немедленного приготовления, карамель, бисквиты, печенье, торты, мороженое) и пищевые продукты, на которые нанесены аэрозольным распылением или в виде покрытия жиры и масла после приготовления (например, рисовые крекеры, твердые бисквиты, сладкий хлеб из соевой пасты). Однако пищевой продукт по настоящему изобретению не ограничивается пищевыми продуктами, содержащими жиры и масла, и другие примеры включают сельскохозяйственные пищевые продукты, такие как хлебопекарные продукты, макаронные изделия, приготовленный рис, сладости (например, леденцы, жевательные резинки, мягкие жевательные конфеты на основе желатина, таблетки, японские сладости), продукты из свернувшегося соевого молока и его переработки; подвергнутые брожению пищевые продукты, такие как японское рисовое вино (сакэ), лекарственный раствор, сладкий кулинарный аперитив (мирин), уксус, соевый сок и мисо (соевая паста); продукты для кормления скота, такие как рыбный брикет (камабоко), брикет из рыбы глубокой заморозки (агетен) и рыхлый рыбный брикет (ханпен); а также фруктовые напитки, безалкогольные напитки, спортивные напитки, алкогольные напитки и чай.
Способ оценки или отбора штамма с использованием нуклеиновых кислот или белков, связанных с настоящим изобретением
Настоящее изобретение также относится к способу оценки или отбора продуцирующего липиды штамма с использованием нуклеиновых кислот или белков, связанных с настоящим изобретением. Детали представлены ниже.
(1) Способ оценки
Один вариант осуществления настоящего изобретения представляет собой способ оценки продуцирующего липид штамма с использованием LPAAT1-длинного, кодирующего нуклеиновую кислоту, или белок LPAAT1-длинный по настоящему изобретению. В качестве первого примера указанного выше способа оценки по настоящему изобретению, продуцирующие липиды тестируемые штаммы оцениваются для выявления указанной выше активности по настоящему изобретению путем использования затравок или зондов, сконструированных на основе нуклеотидной последовательности по настоящему изобретению. Общие процедуры такой оценки известны, и их можно найти, например, в международной патентной публикации № WO 01/040514 или JP 8-205900 A. Краткое объяснение данной оценки будет дано ниже.
Во-первых, получают геном тестируемого штамма. Для получения генома, можно использовать любую известную методику, такую как способ Hereford или способ с использованием ацетата калия (см., например, документ Methods in Yeast Genetics, Cold Spring Harbor Laboratory Press, p130 (1990)).
Затравки или зонды конструируются на основе нуклеотидной последовательности по настоящему изобретению, предпочтительно, SEQ ID NO: 1. Эти затравки или зонды могут представлять собой любые области нуклеотидной последовательности по настоящему изобретению, и для их конструирования могут использоваться известные процедуры. Число нуклеотидов в полинуклеотиде, используемом в качестве затравки, составляет в целом 10 нуклеотидов или более, предпочтительно, 15-25 нуклеотидов. Аналогичным образом, число нуклеотидов, целесообразное для области, которая подлежит фланкированию затравками, составляет в целом от 300 до 2000 нуклеотидов.
Затравки или зонды, полученные выше, используются для исследования того, содержит ли геном указанного выше тестируемого штамма последовательность, специфичную для нуклеотидной последовательности по настоящему изобретению. Последовательность, специфичная для нуклеотидной последовательности по настоящему изобретению, может быть выявлена с использованием известных процедур. Например, полинуклеотид, содержащий часть или всю последовательность, специфичную для нуклеотидной последовательности по настоящему изобретению, или полинуклеотид, содержащий нуклеотидную последовательность, комплементарную указанной выше нуклеотидной последовательности, используется в качестве одной затравки, и полинуклеотид, содержащий часть или всю последовательность, расположенную выше или ниже по ходу транскрипции этой последовательности или полнуклеотида, содержащего нуклеотидную последовательность, комплементарную указанной выше нуклеотидной последовательности, используется в качестве другой затравки, для амплификации с использованием PCR или других методик нуклеиновых кислот из тестируемого штамма, с последующим определением присутствия или отсутствия продуктов амплификации, молекулярной массы продуктов амплификации и т.д.
Условия PCR, подходящие для способа по настоящему изобретению, ни коим образом не ограничиваются, и могут в качестве примера быть установлены следующим образом:
Температура денатурации: 90-95°C
Температура отжига: 40-60°C
Температура удлинения: 60-75°C
Число циклов: 10 или более циклов.
Полученные продукты реакции могут быть разделены электрофорезом на агарозном геле или тому подобном для определения молекулярной массы продуктов амплификации. Затем подтверждается, имеет ли каждый продукт амплификации величину молекулярной массы, достаточную для охвата молекулы нуклеиновой кислоты, соответствующую области, специфичной для нуклеотидной последовательности по настоящему изобретению, посредством чего тестируемый штамм может прогнозироваться или оцениваться в отношении указанной выше активности по настоящему изобретению. Кроме того, если указанные выше продукты анализируются для определения их нуклеотидных последовательностей, как описано выше, указанную выше активность по настоящему изобретению можно прогнозировать или оценивать с большей точностью. Следует отметить, что процедуры для оценки указанной выше активности по настоящему изобретению описаны выше.
В качестве другого примера описанного выше способа оценки по настоящему изобретению, тестируемый штамм культивируется и производится измерение уровня экспрессии LPAAT1-длинного, кодируемого нуклеотидной последовательностью по настоящему изобретению (например, SEQ ID NO: 1), посредством чего можно провести оценку тестируемого штамма для выявления указанной выше активности по настоящему изобретению. Следует отметить, что уровень экспрессии LPAAT1-длинного может быть измерен культивированием тестируемого штамма в соответствующих условиях и количественным определением мРНК или белка для LPAAT1-длинного. Количественное определение мРНК или белка может осуществляться путем использования известных процедур, например, норзерн гибридизации или количественной RT-PCR для количественного определения мРНК и вестерн блоттинга для количественного определения белка (Current Protocols in Molecular Biology, John Wiley & Sons 1994-2003). Для оценки указанной выше активности, можно также измерить пропорцию жирных кислот композиции жирных кислот, полученных LPAAT1-длинным по настоящему изобретению. Процедуры для измерения пропорции жирных кислот композиции жирных кислот, как описано выше.
(2) Способ отбора
Другой вариант осуществления настоящего изобретения представляет собой способ отбора продуцирующего липиды штамма с использованием кодирующей LPAAT1-длинный нуклеиновой кислоты или белка LPAAT1-длинного по настоящему изобретению. В качестве примера указного выше способа отбора по настоящему изобретению, тестируемые штаммы культивируются, и производится измерение уровня экспрессии LPAAT1-длинного, кодируемого нуклеотидной последовательностью по настоящему изобретению (например, SEQ ID NO: 1), для отбора штамма с желательным уровнем экспрессии, посредством чего может быть выбран штамм, имеющий желательную активность. Альтернативно, тип штамма является заданным, и каждый из штамма этого типа и тестируемых штаммов культивируется и производится измерение для выявления указанного выше уровня экспрессии с последующим сравнением уровня экспрессии между типовым штаммом и каждым тестируемым штаммом, посредством чего может быть выбран желательный штамм. Конкретнее, например, типовой штамм и тестируемые штаммы культивируются в соответствующих условиях, и уровень их экспрессии измеряется для выбора тестируемого штамма, проявляющего экспрессию, выше или ниже типового штамма, посредством чего может быть выбран штамм, имеющий желательную активность. Примеры желательной активности включают уровень экспрессии LPAAT1-длинного и пропорцию жирных кислот композиции жирных кислот, полученной LPAAT1-длинным, который может быть измерен, как описано выше.
В качестве другого примера описанного выше способа отбора по настоящему изобретению, тестируемый штаммы культивируются для отбора штамма, у которого указанная выше активность по настоящему изобретению является высокой или низкой, посредством чего может быть отобран штамм, имеющий желательную активность. Примеры желательной активности включают уровень экспрессии LPAAT1-длинного и пропорцию жирных кислот композиции жирных кислот, полученной LPAAT1-длинным, который может быть измерен, как описано выше.
Примеры тестируемого штамма или типового штамма, доступного для использования, включают без ограничения штамм, трансформированный указанным выше вектором по настоящему изобретению, штамм, модифицированный для подавления экспрессии указанной выше нуклеиновой кислоты по настоящему изобретению, штамм, модифицированный мутагенезом, и штамм, имеющий естественную мутацию (мутации). Следует отметить, что в настоящем изобретении активность LPAAT1-длинного в настоящем изобретении и способность давать пропорцию жирных кислот LPAAT1-длинного могут быть измерены, например, процедурами, описанными в разделах «Нуклеиновые кислоты по настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидиновой кислоты» и «Композиции жирных кислот по настоящему изобретению». Мутагенез может быть осуществлен без ограничения физическими методиками, включая ультрафиолетовое или радиоактивное облучение, или химические методики, включая обработку таким агентом как EMS (этилметансульфонат) или N-метил-N-нитрозогуанидин (см., например, Yasuji Oshima ed., Biochemistry Experiments vol.39, Experimental Protocols for Yeast Molecular Genetics, pp.67-75, Japan Scientific Societies Press).
Штаммы, используемые в настоящем изобретении в качестве типового и тестируемого штамма, включают без ограничения указанные выше продуцирующие липиды штаммы или дрожжевые штаммы. Конкретнее, типовой штамм и тестируемый штамм могут представлять собой комбинацию любых штаммов, относящихся к различным родам или видам, и один или более тестируемых штаммов могут использоваться одновременно.
Теперь настоящее изобретение будет более детально описано в виде следующих примеров, которые не предназначены для ограничения объема изобретения.
Пример 1
Анализ EST
Штамм 1S-4 M. alpina инокулировали в 100 мл среды (1,8% глюкозы, 1% дрожжевого экстракта, pH 6,0) и предварительно культивировали в течение 3 дней при 28°C. В сосуд для культивирования емкостью 10 л (Able Co., Tokyo) загружали 5 л среды (1,8% глюкозы, 1% порошка соевых бобов, 0,1% оливкового масла, 0,01% адеканола, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2·2H2O, 0,05% MgCl2·6H2O, pH 6,0), и в него вносили весь предварительно культивированный продукт с последующим аэробным центрифужным культивированием при 300 об/мин, 1 об.об.м и 26°C в течение 8 дней. На 1, 2 и 3 день культивирования, добавляли глюкозу в количестве, соответствующем 2%, 2% и 1,5%, соответственно. Клетки собирали на каждой стадии культивирования (1-ый, 2-ой, 3-ий, 6-ой или 8-ой день) для получения общей РНК способом гидрохлорида гуанидина/CsCl. С использованием набора для очистки мРНК Oligotex-dT30<Super>mRNA Purification Kit (Takara Bio Inc., Japan), поли(A)+РНК очищали из общей РНК. Библиотеку кДНК получали для каждой стадии набором ZAP-cDNA GigapackIII Gold Cloning Kit (STRATAGENE), с последующим анализом последовательности одним прохождением по концу 5' кДНК (8000 клонов × 5 стадий). Полученные последовательности группировали в кластеры. В результате, было получено примерно 5000 последовательностей.
(2) Поиск гомологов гена LPAAT
Поиск нуклеотидных последовательностей, полученных по анализу EST, проводили относительно аминокислотных последовательностей, зарегистрированных в GENEBANK, с использованием программы поиска гомологии, BLASTX, для экстракции гомологов гена LPAAT. В результате, была обнаружена последовательность гомолога LPAAT (SEQ ID NO: 5). Было обнаружено, что SEQ ID NO: 5 имеет самую высокую идентичность с полученного из Neurospora crassa предполагаемого белка, подобного ацилтрансферазе 1-ацил-sn-глицерин-3-фосфата (№доступа в генном банке EAA28956).
Последовательность гомолога LPAAT M. alpine (LPAAT1), показанная в описании патентного документа 2, сравнивали с последовательностью, полученной выше, указывая на то, что SEQ ID NO: 5 представляла собой частичную последовательность изоаллели LPAAT1.
В отношении указанной выше последовательности, библиотеки ее источника и EST показаны в таблице 2. Следует отметить, что в таблице 2, клоны классифицируются по дню культивирования, в который были получены библиотеки кДНК их источника.
|
Пример 2
(1) Клонирование гомологов LPAAT
SEQ ID NO: 5 не содержит CDS, которые, как представляется, кодируют гомолог LPAAT. Таким образом, для клонирования кДНК, кодирующей полную длину этого гена, затравки были получены на основании этой последовательности следующим образом.
Затравки, сконструированные на основе SEQ ID NO: 5:
Затравка 955-1: GGACGTGTCAAGGAAAAGGA (SEQ ID NO: 6)
Затравка 955-2: TCCTTCAGATGAGCCTCCTG (SEQ ID NO: 7)
Используя эти затравки, PCR выполняли ExTaq (Takara Bio Inc., Japan) использованием библиотеки кДНК, содержащей EST, составляющие SEQ ID NO: 5 в качестве матрицы. Полученные фрагменты ДНК TA-клонировали набором для клонирования TOPO-TA cloning Kit (INVITROGEN CORPORATION) для определения нуклеотидной последовательности вставки.
Результаты подтвердили, что был клонирован фрагмент ДНК, охватывающий нуклеотиды 20-518 SEQ ID NO: 5. Эта плазмида была обозначена как pCR-955-P. Затем эту плазмиду использовали в качестве матрицы для выполнения PCR с указанными выше затравками. При PCR использовали ExTaq (Takara Bio Inc., Japan), но приложенную смесь dNTP замещали метящей смесью PCR (Roche Diagnostics) для мечения дигоксигенином (DIG) подлежащей амплификации ДНК, получая посредством этого зонд для использования при скрининге библиотеки кДНК. Этот зонд использовали для скрининга библиотеки кДНК, из которой EST, составляющие указанную выше последовательность, были получены анализом EST.
Условия гибридизации были установлены следующим образом.
Буфер: 5 (SSC, 1% SDS, 50 мМ Tris-HCl (pH 7,5), 50% формамид
Температура: 42°C (в течение ночи)
Условия промывания: в 0,2 (SSC, 0,1% SDS при 65°C в течение 20 минут (повторяемого три раза).
Выявление осуществляли использованием набора для выявления нуклеиновых кислот DIG (Roche Diagnostics). Из клонов фагов, полученных скринингом, плазмиду вырезали эксцизией in vivo для получения ДНК плазмиды.
Нуклеотидная последовательность вставки из клона с самой длинной вставкой, полученная скринингом кДНК, содержащей SEQ ID NO: 5, показана в SEQ ID NO: 3. SEQ ID NO: 3 содержит кодирующую область из 1442 пар оснований между положениями 116 и 1557, таким образом, свидетельствуя о том, что была получена последовательность, кодирующая полную длину LPAAT. Выведенная аминокислотная последовательность белка, кодируемого этим геном, показана в SEQ ID NO: 2.
Во время скрининга кДНК, содержащей SEQ ID NO: 5, был также получен другой клон, который представлял собой вставку, более короткую чем SEQ ID NO: 3. Нуклеотидная последовательность вставки из полученного клона показана в SEQ ID NO: 9. SEQ ID NO: 9 содержит ORF из 1251 пар оснований между положениями 36 и 1286, таким образом, указывая на то, что эта последовательность была идентична 5'-концевым нуклеотидам 193-1443 нуклеотидной последовательности, показанной в SEQ ID NO: 1. А именно, нуклеотидная последовательность, показанная в SEQ ID NO: 9, была короче, чем нуклеотидная последовательность, показанная в SEQ ID NO: 1, 192 нуклеотидами в области 5'. Выведенная аминокислотная последовательность белка, кодируемого этим геном, показана SEQ ID NO: 10.
Плазмида, содержащая SEQ ID NO: 3, была обозначена как pB-LPAAT1-длинный, тогда как плазмида, содержащая SEQ ID NO: 9, была обозначена как pB-LPAAT1-короткий. Аналогичным образом, ген SEQ ID NO: 3 был назван геном LPAAT1-длинным, тогда как ген SEQ ID NO: 9 был назван геном LPAAT1-коротким.
(2) Анализ последовательности
Полученные таким образом последовательности кДНК гомологов LPAAT, полученных из M. alpine, были подвергнуты анализу гомологии BLASTX относительно аминокислотных последовательностей, зарегистрированных в GENEBANK. В результате, аминокислотные последовательности, имеющие самые низкие величины Е, т.е., имеющие самую высокую идентичность с каждой последовательностью, показаны ниже. Последовательности, имеющие самую высокую идентичность, анализировали clustalW, для определения их идентичности с ORF каждой последовательности на уровнях нуклеотидной и аминокислотной последовательности, которые также показаны ниже.
Было обнаружено, что SEQ ID NO: 3 имеет идентичность 51% на уровне нуклеотидной последовательности и 32,1% на уровне аминокислотной последовательности, по сравнению с соответствующей областью предполагаемого полученного из Aspergillus nidulans белка, подобного ацилтрансферазе 1-ацил-sn-глицерин-3-фосфата (№доступа в генном банке EAA60126).
Было обнаружено, что SEQ ID NO: 9 имеет идентичность 51% на уровне нуклеотидной последовательности и 32,1% на уровне аминокислотной последовательности, по сравнению с соответствующей областью предполагаемого полученного из Aspergillus nidulans белка, подобного ацилтрансферазе 1-ацил-sn-глицерин-3-фосфата (№доступа в генном банке EAA60126).
Каждую из SEQ ID NOs: 3 и 9 также сравнивали с известным гомологом LPAAT, полученным из M. alpine, т.е., гена LPAAT1 (патентный документ 2) и с выведенной аминокислотной последовательностью, код ируемой этим геном. Последовательность, описанная в указанном выше документе, и последовательности, полученные из штамма 1S-4 M. alpine, сравнивали друг с другом в их соответствующих областях, подтверждая то, что и LPAAT1-длинный, и LPAAT1-короткий имели идентичность 89% на уровне нуклеотидных последовательностей и 91% на уровне аминокислотных последовательностей.
Пример 3
Конструкция дрожжевого вектора экспрессии
Для экспрессии LPAAT1-длинного и LPAAT1-короткого в дрожжевых клетках, дрожжевые векторы экспрессии конструировали следующим образом.
Плазмиду pB-LPAAT1-длинного переваривали рестрикционными ферментами EcoRI и KpnI для получения фрагмента ДНК приблизительно из 1,7 т.н., который заем вставляли в сайт EcoRI-KpnI дрожжевого вектора экспрессии pYE22m (Biosci. Biotech. Biochem., 59, 1221-1228, 1995) для конструирования плазмиды pYE-MALPAA1-длинного.
Для экспрессии LPAAT1-короткого в дрожжевых клетках, дрожжевой вектор экспрессии конструировали следующим образом. А именно, плазмиду pB-LPAAT1-короткого использовали в качестве матрицы для выполнения PCR со следующими затравками LPAAT1-6F (SEQ ID NO: 11) и LPAAT1-R1 (SEQ ID NO: 12) с использованием ExTaq (Takara Bio Inc., Japan).
LPAAT1-6F: TCTGAGATGGATGAATCCACCACCACCAC (SEQ ID NO: 11)
LPAAT1-R1: GTCGACTCAACCAGACGATACTTGCTGCAGAG (SEQ ID NO: 12)
Полученные фрагмента ДНК были ТА-клонированы набором TOPO-TA cloning Kit (INVITROGEN) для подтверждения нуклеотидной последовательности каждой вставки. Плазмида, несущая правильную нуклеотидную последовательность, была обозначена как pCR-LPAAT1-короткий. Эту плазмиду переваривали рестрикционными ферментами EcoRI и SalI для получения фрагмента ДНК приблизительно 1,3 т.н., который затем вставляли в сайт EcoRI-SalI дрожжевого вектора экспрессии pYE22m для конструкции плазмиды pYE-MALPAAT1-короткого.
Пример 4
Дрожжевая трансформация
Плазмиду pYE22m, pYE-MALPAA1-длинный или pYE-MALPAAT1-короткий использовали для трансформации штамма Saccharomyces cerevisiae EH13-15 (trp1, MATα) (Appl. Microbiol. Biotechnol., 30, 515-520, 1989) способом с использованием ацетата лития. Проводили скрининг трансформированных штаммов по способности роста на агаровой среде SC-Trp (2% агар), содержащей на литр 6,7 г азотного основания дрожжей без аминокислот (DIFCO), 20 г глюкозы и 1,3 г аминокислотного порошка (смесь 1,25 г аденинсульфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 0,6 г урацилла).
Пример 5
Дрожжевая культура
Среди трансформированных штаммов, полученных каждым вектором (штамма c-1 и c-2, штаммов LPAAT1-длинный-1 и LPAAT1-длинный-2, или штаммы LPAAT1-короткий-1 и LPAAT1-короткий-2), выбирали любые 2 штамма и культивировали в следующих условиях.
А именно, на стадии предварительной культуры, полную петлю каждой дрожжевой культуры инокулировали из чашки в среду SC-Trp (10 мл) и культивировали со встряхиванием при 30°C в течение 2 дней. На основной стадии культуры, раствор предварительного культивирования (500 мл) добавляли к 10 мл среды YPD5 (2% дрожжевого экстракта, 1% полипептона, 5% глюкозы) и культивировали со встряхиванием при 30°C в течение 2 дней.
Пример 6
Анализ жирных кислот дрожжевых штаммов
Каждый из растворов для культивирования дрожжей центрифугировали до сбора клеток. После промывания 10 мл стерилизованной воды, клетки снова собирали центрифугированием и лиофилизировали. К лиофилизированным клеткам добавляли хлороформ:метанол (2:1, 4 мл) и энергично перемешивали с последующей инкубацией при 70°C в течение 1 часа. Клетки разделяли центрифугированием для сбора растворителя. К остающимся клеткам снова добавляли хлороформ:метанол (2:1, 4 мл), такую же процедуру повторяли для сбора растворителя. После высушивания липидов с использованием вакуумной сушилки SpeedVac, добавляли 2 мл хлороформа для растворения липидов. Аликвот 200 мкл этого образца обрабатывали способом с использованием хлористоводородной кислоты/метанола для превращения жирных кислот в клетках в соответствующие сложные метиловые эфиры, с последующей экстракцией гексаном. После отгонки гексана, жирные кислоты анализировали газовой хроматографией.
Полученные результаты показаны в таблице 3.
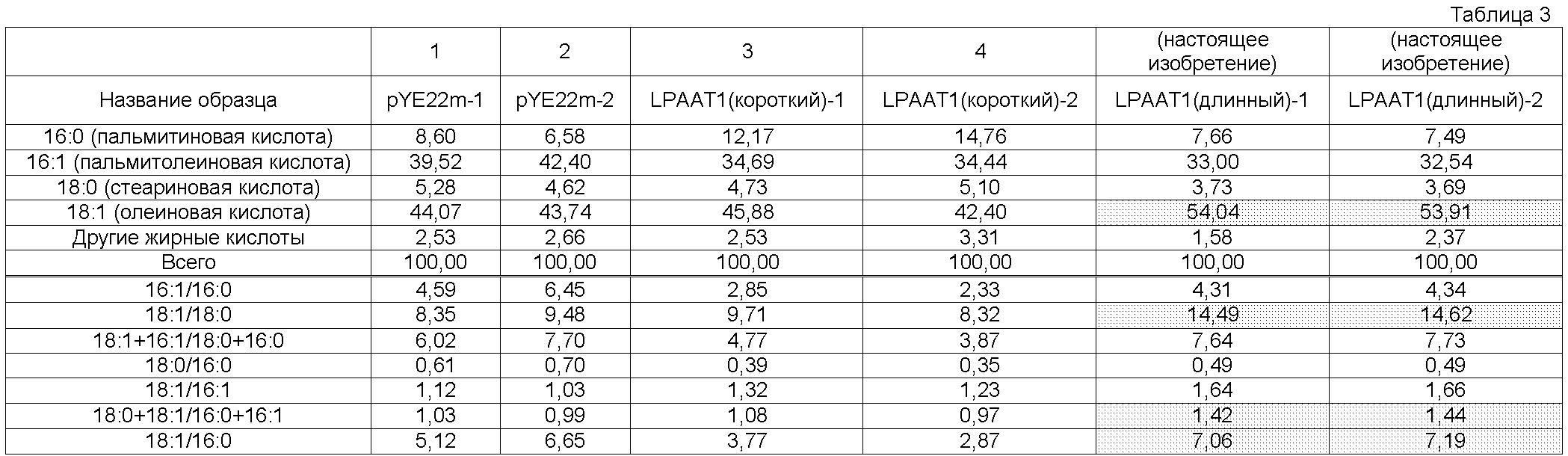
Дрожжевые штаммы, трансформированные гомологами LPAAT, полученными из M. alpina, и контрольные дрожжевые штаммы сравнивали по их пропорции жирных кислот. В пропорции жирных кислот дрожжей, трансформированных LPAAT1-коротким, процентная доля пальмитиновой кислоты увеличивалась, но содержание пальмитолеиновой кислоты уменьшалась, по сравнению с контрольными штаммами. Таким образом, отношение содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты было ниже, чем у контрольных штаммов. Содержание стеариновой кислоты и олеиновой кислоты было таким же как у контрольных штаммов.
Напротив, в дрожжах, трансформированных LPAAT1-длинным, процентная доля олеиновой кислоты увеличивалась на 10% или более, по сравнению с контрольными штаммами, тогда как процентные доли и пальмитолеиновой кислоты, и стеариновой кислоты уменьшались. Таким образом, отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты и отношение содержания олеиновой кислоты к содержанию стеариновой кислоты были выше, чем эти отношения у контрольных штаммов. Отношение общего содержания стеариновой и олеиновой кислоты к общему содержанию пальмитиновой кислоты и пальмитолеиновой кислоты было также выше, чем такое отношение контрольных штаммов.
Эти результаты указали на то, что гомологи LPAAT, полученные из M. alpine, имели другую специфичность ацильной группы их субстрата и, следовательно, дрожжевые штаммы, трансформированные этими генами, давали пропорции жирных кислот, совершенно отличные от гомолога к гомологу. Эти результаты также указали на то, что было возможно вывести организмы с желательной пропорцией жирных кислот, когда указанные выше гомологи были выбраны для соответствия предполагаемому назначению.
Пример 7
(1) Разведение дрожжевых штаммов, продуцирующих арахидоновую кислоту
Для разведения продуцирующих арахидоновую кислоту дрожжевых штаммов (Saccharomyces cerevisiae), были сконструированы следующие плазмиды.
Во-первых, кДНК, полученную из штамма 1S-4 M. alpine, использовали в качестве матрицы для выполнения PCR с ExTaq, используя набор затравок из Δ12-f и Δ12-r, Δ6-f и Δ6-r, GLELO-f и GLELO-r, или Δ5-f и Δ5-r для амплификации, посредством этого, гена Δ12 десатуразы жирных кислот, гена Δ6 десатуразы жирных кислот, гена GLELO элонгазы жирных кислот или гена Δ5 десатуразы жирных кислот в штамме 1S-4 M. alpina.
Δ12-f: TCTAGAATGGCACCTCCCAACACTATTG (SEQ ID NO: 13)
Δ12-r: AAGCTTTTACTTCTTGAAAAAGACCACGTC (SEQ ID NO: 14)
Δ6-f: TCTAGAATGGCTGCTGCTCCCAGTGTGAG (SEQ ID NO: 15)
Δ6-r: AAGCTTTTACTGTGCCTTGCCCATCTTGG (SEQ ID NO: 16)
GLELO-f: TCTAGAATGGAGTCGATTGCGCAATTCC (SEQ ID NO: 17)
GLELO-r: GAGCTCTTACTGCAACTTCCTTGCCTTCTC (SEQ ID NO: 18)
Δ5-f: TCTAGAATGGGTGCGGACACAGGAAAAACC (SEQ ID NO: 19)
Δ5-r: AAGCTTTTACTCTTCCTTGGGACGAAGACC (SEQ ID NO: 20).
Эти гены клонировали с использованием набора для клонирования TOPO-TA-cloning Kit. Подтверждали нуклеотидную последовательность клонов, и те, которые содержали нуклеотидные последовательности SEQ ID NOs: 21-24 обозначали соответственно как плазмиды pCR-MAΔ12DS (содержащие нуклеотидную последовательность SEQ ID NO: 21), pCR-MAΔ6DS (содержащие нуклеотидную последовательность SEQ ID NO: 22), pCR-MAGLELO (содержащие нуклеотидную последовательность SEQ ID NO: 23) и pCR-MAΔ5DS (содержащие нуклеотидную последовательность SEQ ID NO: 24).
Затем, плазмиду pCR-MAΔ12DS переваривали рестрикционным ферментом HindIII и, после «затупления конца», далее переваривали рестрикционным ферментом XbaI для получения фрагмента ДНК приблизительно из 1,2 т.н.., тогда как вектор pESC-URA (STRATAGENE) переваривали рестрикционным ферментом SacI и, после «затупления конца», далее переваривали рестрикционным ферментом SpeI для получения фрагмента ДНК приблизительно из 6,6 т.н. Эти фрагменты ДНК лигировали для получения плазмиды pESC-U-Δ12. Плазмиду pCR-MAΔ6DS переваривали рестрикционным ферментом XbaI, и, после «затупления конца», далее переваривали рестрикционным ферментом HindIII для получения фрагмента ДНК приблизительно из 1,6 т.н., тогда как плазмиду pESC-U-Δ12 переваривали рестрикционным ферментом SalI и, после «затупления конца», далее переваривали рестрикционным ферментом HindIII для получения фрагмента ДНК приблизительно из 8 т.н. Эти фрагменты ДНК лигировали для получения плазмиды pESC-U-Δ12:Δ6. Эту плазмиду частично переваривали рестрикционным ферментом PvuII, и полученный фрагмент приблизительно из 4,2 т.н. вставляли в сайт SmaI pUC-URA3 для получения плазмиды pUC-URA-Δ12:Δ6.
Аналогичным образом, плазмиду pCR-MAGLELO переваривали рестрикционными ферментами XbaI и SacI для получения фрагмента ДНК приблизительно из 0,95 т.п.о., тогда как вектор pESC-LEU (STRATAGENE) переваривали рестрикционными ферментами XbaI и SacI для получения фрагмента ДНК приблизительно из 7,7 т.п.о. Эти фрагменты ДНК лигировали для получения плазмиды pESC-L-GLELO. Плазмиду pCR-MAΔ5DS переваривали рестрикционными ферментами XbaI и, после «затупления конца», далее переваривали рестрикционным ферментом HindIII для получения фрагмента ДНК приблизительно из 1,3 т.п.о., тогда как плазмиду pESC-L-GLELO переваривали рестрикционным ферментом ApaI и, после «затупления конца», далее переваривали рестрикционным ферментом HindIII для получения фрагмента ДНК приблизительно из 8,7 т.п.о. Эти фрагменты ДНК лигировали для получения плазмиды pESC-L-GLELO:Δ5. Эту плазмиду переваривали рестрикционным ферментом PvuII, и полученный фрагмент приблизительно из 3,2 т.н. вставляли в сайт SmaI pUC-LEU2 для получения плазмиды pUC-LEU-GLELO:Δ5.
Штамм YPH499 (STRATAGENE) S. cerevisiae совместно трансформировали плазмидой pUC-URA-Δ12:Δ6 и плазмидой pUC-LEU-GLELO:Δ5. Проводили скрининг трансформированных штаммов по способности расти на агаровой среде SC-Leu,Ura (2% агара), содержащей на литр 6,7 г дрожжевого азотного основания без аминокислот (DIFCO), 20 г глюкозы и 1,3 г аминокислотного порошка (смесь 1,25 г аденинсульфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 1,2 г триптофана). Среди полученных таким образом штаммов, любой штамм был обозначен как штамм ARA3-1.
(2) Получение и анализ трансформированных штаммов дрожжей, продуцирующих арахидоновую кислоту
Штамм ARA3-1 соответственно трансформировали плазмидами pYE22m, pYE-MALPAAT1-длинный и pYE-MALPAAT1-короткий. Проводили скрининг трансформированных штаммов по способности расти на агаровой среде SC-Leu,Ura (2% агара), содержащей на литр 6,7 г дрожжевого азотного основания без аминокислот (DIFCO), 20 г глюкозы и 1,3 г аминокислотного порошка (смесь 1,25 г аденинсульфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина и 6 г треонина). Среди трансформированных таким образом штаммов, для каждой плазмиды были выбраны 4 штамма.
Каждый из этих штаммов культивировали при 30ºС в течение 1 дня в указанной выше жидкой среде SC-Trp, Leu, Ura (10 мл), 1 мл которой затем культивировали при 15ºС в течение 7 дней в жидкой среде SC-Trp, Leu, Ura (10 мл), содержащей на литр 6,7 г дрожжевого азотного основания без аминокислот (DIFCO), 20 г галактозы и 1,3 г аминокислотного порошка (смесь 1,25 г аденинсульфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина и 6 г треонина), с последующим анализом жирных кислот в клетках. В таблице 4 показана пропорция жирных кислот в клетках.
|
Как показано выше, высокая экспрессия LPAAT1-длинного в дрожжевом штамме, разведенном для обеспечения возможности продукции арахидоновой кислоты, привела к более высокому отношению n-6 PUFA к общему содержанию жирных кислот, по сравнению с контрольными штаммами, трансформированными одним вектором. Кроме того, высокая экспрессия LPAAT1-длинного привела к более высоким пропорциям линолевой кислоты, γ-линоленовой кислоты и арахидоновой кислоты, по сравнению с высокой экспрессией LPAAT1-короткого.
Пример 8
Конструкция вектора для экспрессии M. alpina
Вектор, использованный для экспрессии M. alpine, представлял собой pDuraSC, который обеспечивает возможность экспрессии желательного гена из промотера GAPDH.
Для экспрессии LPAAT1-длинного и LPAAT1-короткого в клетках M. alpina, векторы конструировали следующим образом. А именно, плазмиду pB-LPAAT1-длинный переваривали рестрикционными ферментами EcoRI и SalI. Среди полученных фрагментов ДНК, вырезали фрагмент приблизительно из 1,5 т.н. и вставляли в сайты EcoRI-XhoI в сайт множественного клонирования вектора pDuraSC для конструирования плазмиды pDuraSC-LPAAT1-длинный. Аналогичным образом, плазмиду pCR-LPAAT1-короткий переваривали EcoRI и SalI. Среди полученных фрагментов ДНК, вырезали фрагмент приблизительно из 1,3 т.н. и вставляли в сайты EcoRI-XhoI в сайт множественного клонирования вектора pDuraSC для конструирования pDura5SC-LPAAT1-короткий.
Пример 9
Получение трансформированных штаммов M. alpina
Ауксотрофный к урацилу штамм Δura-3, полученный из M. alpine, как описано в патентном документе (WO2005/019437, озаглавленном «Способ разведения продуцирующего липиды гриба»), использовали в качестве хозяина и трансформировали с этими плазмидами способом доставки частиц. Для скрининга трансформированных штаммов, использовали агаровую среду SC (0,5% дрожжевого азотного основания без аминокислот и сульфата аммония (Difco), 0,17% сульфата аммония, 2% глюкозы, 0,002% аденина, 0,003% тирозина, 0,0001% метионина, 0,0002% аргинина, 0,0002% гистидина, 0,0004% лизина, 0,0004% триптофана, 0,0005% треонина, 0,0006% изолейцина, 0,0006% лейцина, 0,0006% фенилаланина и 2% агара).
Пример 10
Оценка трансформантов N. alpine
Каждый из полученных трансформированных штаммов инокулировали в 4 мл среды Gγ (2% глюкозы, 1% дрожжевого экстракта) и культивировали со встряхиванием при 28°C в течение 3 или 4 дней. Клетки собирали фильтрацией и РНК экстрагировали с использованием набора RNeasy plant kit (QIAGEN). Устройство SuperScript First-Strand для RT-PCR (Invitrogen) использовали для синтеза кДНК. Для подтверждения экспрессии из трансформированного конструкта и общей экспрессии для каждого гена, RT-PCR выполняли со следующими наборами затравок.
Затравки, использованные для подтверждения экспрессии от введенного конструкта, представляли собой:
MaGAPDHpfw: CACACCACACATTCAACATC (SEQ ID NO: 25)
LPAAT1-r: GCCTTCGTCCTTGGTACACCTTGAC (SEQ ID NO: 26)
Затравки, использованные для подтверждения экспрессии LPAAT1, представляли собой:
LPAAT1-2F: TCGGCTCGGTCCCAAGATGAAC (SEQ ID NO: 27)
Затравку LPAAT1-2R: GCGTCTGTCATGTGCCCAGTCA (SEQ ID NO: 28)
На основании результатов представленной выше RT-PCR, были выбраны трансформанты, проявляющие высокий уровень экспрессии каждого гена и экспрессии от введенного конструкта, и общей экспрессии: соответственно штаммы Gp-LPAAT1-длинный-5 и Gp-LPAAT1-короткий-6 из тех, которые были трансформированы плазмидами pDuraSC-LPAAT1-длинный и pDuraSC-LPAAT1-короткий.
Каждый из этих штаммов инокулировали в среду GY (4 мл) и культивировали со встряхиванием при 28°C при 125 об/мин. На 6-ой день культивирования, все клетки собирали фильтрацией и лиофилизировали. Часть (примерно 10-20 мг) высушенных клеток обрабатывали способом с использованием хлористоводородной кислоты/метанолом для превращения жирных кислот в клетках в соответствующие метиловые эфиры, с последующей экстракцией гексаном. После отгонки гексана, жирные кислоты анализировали газовой хроматографией. В таблице 5 показана пропорция жирных кислот в клетках.
|
Как показано выше, было обнаружено, что штамм A. Alpine, трансформированный для высокой экспрессии LPAAT1-длинного или LPAAT1-короткого, проявляет более высокие пропорции DGLA и арахидоновой кислоты, чем штамм IS-4 дикого типа. Кроме того, проведено сравнение между штаммом, трансформированным для высокой экспрессии LPAAT1-длинного, и штаммом, трансформированным для высокой экспрессии LPAAT1-короткого, указывающее на то, что эта тенденция была сильнее у первого.
ТЕКСТ БЕЗ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 6: затравка
SEQ ID NO: 7: затравка
SEQ ID NO: 11: затравка
SEQ ID NO: 12: затравка
SEQ ID NO: 13: затравка
SEQ ID NO: 14: затравка
SEQ ID NO: 15: затравка
SEQ ID NO: 16: затравка
SEQ ID NO: 17: затравка
SEQ ID NO: 18: затравка
SEQ ID NO: 19: затравка
SEQ ID NO: 20: затравка
SEQ ID NO: 25: затравка
SEQ ID NO: 26: затравка
SEQ ID NO: 27: затравка
SEQ ID NO: 28: затравка