Результат интеллектуальной деятельности: НАНОКОМПОЗИТ С АКТИВНЫМ ЛИГАНДОМ, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ АДРЕСНОЙ ИНАКТИВАЦИИ ВИРУСА ГРИППА ВНУТРИ КЛЕТКИ
Вид РИД
Изобретение
Изобретение относится к области молекулярной биологии, биоорганической химии и медицины. Нанокомпозиты состоят из наночастиц диоксида титана, иммобилизованных полилизиновых производных олигонуклеотидов (PL-oligo) и фотоактивируемых групп и предназначены для направленного воздействия на внутриклеточный генетический материал и подавления его дальнейшего функционирования.
Одним из наиболее значимых направлений развития современной молекулярной биологии и фундаментальной медицины является разработка способов селективного воздействия на внутриклеточные нуклеиновые кислоты - носители генетической информации. Впервые данное направление было сформулировано еще в 1967 г. в работе /Belikova A.M., Zarytova V.F., Grineva N.I. Tetrahedron Lett., 1967, p.3557-3562/, в которой авторы предложили использовать так называемые адресованные реагенты-олигонуклеотиды, несущие реакционноспособные группы - для воздействия на комплементарные нуклеиновые кислоты. Впоследствии такая стратегия была названа антисенс подходом, а олигонуклеотиды - антисенс олигонуклеотидами. В настоящее время с этой целью используются олигонуклеотиды и их различные аналоги, а также малые интерферирующие РНК (siRNA) и РНК- и ДНК-зимы /например, Crooke S.T., Ann. Rev. Med., 2004, v.55, p.61-95; Giuseppina M. et al., Nucleic Acids Res. 2004, v.32, p.4358-4367/.
Олигонуклеотиды, несущие химически активные группы, сохраняют способность к комплементарным взаимодействиям с НК, что обеспечивает направленную модификацию НК-мишеней. Олигонуклеотид при этом играет роль «адреса», который обеспечивает комплементарное связывание с фрагментом нуклеиновой кислоты-мишени, после чего реакционноспособная группировка модифицирует ген-мишень и выводит его из строя /Knorre D.G., et al., Design and Target Reactions of Oligonucleotide Derivatives. CRC Press: Boca Raton-Ann Arbor-Tokyo, 1994, p.366; Ros D.T., et al., Current Medicinal Chemistry, 2005, v.l2, p.71-88/.
Для воздействия на НК широко используются производные олигонуклеотидов, несущие фотоактивируемые, группировки. Такие группы стабильны в физиологических условиях, они инертны в темноте и вступают в реакцию только при облучении светом; так что возможно инициировать реакцию в любой определенный момент времени и легко контролировать процесс модификации. Эти группы обладают большей реакционной способностью по сравнению с другими модифицирующими группами. В качестве фотореагентов используются различные фотоактивируемые группы: эллиптицин /Favire G., С.R. Seances Soc. Biol. Fil. 1992, v.186(1-2), p.73-87/, порфирины /Szentmary N. et al., Ophthalmologe. 2012, v.109(2), p.165-170/, фталоцианины /Kuznetsova A.A., et al., Bioorg. Khim. 2008, v.34(5), p.683-695; Kuznetsova A.A., et al., J.Biomol. Struct. Dyn. 2008, v.26(3), p.307-320/, производные псоралена /Pacifico A, Leone G., Photodermatol. Photoimmunol. Photomed. 2011, v.5, p.261-277; Corash L., Expert Rev. Hematol. 2011, v.5, p.509-525; Stafforst T, Hilvert D,. Angew. Chem. Int. Ed. Engl. 2011, v.50, p.9483-9486/, различные ароматические азиды /Shanmugavelan P., et al., Bioorg. Med. Chem. Lett. 2011, v.21, p.7273-72761; Kolpashchikov D.M., et al., Bioorg. Khim. 1999, v.25, p.129-136/, производные диазирина /Chiara D.C., et al., Biochemistry 2012, v.51, p.836-847/, акридина /Asanuma K., et al., Anticancer Res. 2011, v.31, p.4163-4168/ и др. Фотореагенты, основанные на ароматических азидах и их фторированных аналогах, представляют большой интерес. Известно, что тетрафторарилазиды, присоединенные к олигонуклеотиду, способны эффективно и сайт-специфически модифицировать РНК и ДНК /Levina A.S., et al., Antisense Nucleic Acid Drug Dev., 1996, v.6, p.119-126; 127-132; Levina A.S., et al., 1993, Biochimie v.75, p.25-27/. Основная идея этого подхода состоит в том, что на первом этапе реагент, не вступая в химическую реакцию, "находит" свою мишень и лишь затем под воздействием света действует на нее.
Исследования на самых различных модельных системах подтвердили эффективность использования антисенс-олигонуклеотидов, несущих различные, в том числе фотоактивируемые, группы для модификации нуклеиновых кислот, однако применение этой стратегии на организме пока не нашло окончательного решения. Основным препятствием является трудность доставки олигонуклеотидов и их производных к гену-мишени внутри клетки. Одним из путей решения данной проблемы может оказаться использование наночастиц в качестве средств доставки лекарственных средств /Mario Ferrari, Nature Reviews Cancer, 2005, v.5, p.161-171/, a также олигонуклеотидов и их производных к гену-мишени /Paunesku Т., et al.. Nature materials, 2003, v.2, p.343-346; Endres P.J., et al., J. Am. Chem. Soc. 2007, v.129, p.15760-15761/.
Сущность данного изобретения заключается в создании полифункциональных нанокомпозитов, содержащих наночастицы диоксида титана, олигонуклеотидный конъюгат с полилизином и фотоактивный лиганд. Каждый компонент нанокомпозита выполняет определенную функцию (доставка в клетки, доставка к целевой нуклеиновой кислоте и модификация этой НК).
Наиболее близким к данному изобретению является патент РФ №244571, 12N15/11, B82B 3/00, A61K 48/00, 10.03.2012, в котором описан способ получения нанокомпозитов, состоящих из наночастиц диоксида титана, на которые иммобилизуются полиаминовые производные олигонуклеотидов (PA-oligo), в частности полилизин-содержащие олигонуклеотиды (PL-oligo). Показана способность полученных нанокомпозитов TiO2-PL-oligo проникать в клетки и ингибировать размножение вируса гриппа A Недостатком является отсутствие необратимой инактивации вирусного генома, поскольку используемые нанокомпозиты способны только блокировать мишенную РНК, но не расщеплять ее. Недостатком является также невысокая противовирусная активность, которая проявляется спонтанно и неспецифично.
Изобретение решает задачу адресной (специфичной) инактивации вирусного генома внутри клетки за счет использования в составе нанокомпозита олигонуклеотидного фрагмента, комплементарного участкам вирусных НК, и повышения функциональных возможностей нанокомпозитов за счет введения в них дополнительных фотоактивируемых групп, способных необратимо воздействовать на генетический материал клеток. Поскольку фотоактивируемые группы вступают в реакцию только при облучении светом, то возможно инициировать реакцию в любой определенный момент времени и легко контролировать процесс воздействия на вирусный геном.
Наличие реакционноспособной фотоактивной группы в нанокомпозите обеспечивает ему дополнительную, уникальную способность необратимо модифицировать те НК, которые будут содержать участки, комплементарные иммобилизованному на TiO2 олигонуклеотиду. Создание нанокомпозитов, обладающих тремя функциями (доставка в клетки, доставка к целевой нуклеиновой кислоте и модификация этой НК) и исследование их свойств позволит приблизиться к разработке нового класса полифункциональных нанокомпозитов, которые могут рассматриваться как перспективные лекарственные препараты для лечения вирусных, наследственных и других заболеваний.
Задача достигается за счет использования нанокомпозитов, состоящих из наночастиц диоксида титана в аморфной или кристаллической (анатаз, брукит) форме, иммобилизованных полилизиновых производных олигонуклеотидов (PL-oligo) и фотоактивируемых перфторарилазидных групп, введенных по аминогруппам полилизина. Все компоненты нанокомпозита выполняют определенную функцию: TiO2-наночастицы способствуют трансфекции клеток; полилизин способствует иммобилизации олигонуклеотида на поверхность наночастиц и вносит дополнительные функциональные группы (NH2), позволяющие вводить дополнительные реакционноспособные группы; олигонуклеотиды определенной последовательности направляют композит к целевым участкам вирусной РНК; фотоактивируемая перфторарилазидная группа после облучения светом способна разрушать нуклеиновые кислоты.
Задача решается способом приготовления нанокомпозиитов вида TiO2-PL(ArN3)-oligo, который включает синтез наночастиц диоксида титана (аморфные, анатаз, брукит), синтез конъюгатов олигонуклеотида с соответствующим линкером, с емкостью по олигонуклеотиду 10-40 нмол/мг, иммобилизацию конъюгатов на наночастицы диоксида титана, и введение фотоактивируемой n-азидо-тетрафторбензоильной (ArN3) группы по аминогруппам полилизина в составе нанокомпозита TiO2-PL-oligo (1-5 мг/мл) путем его обработки с помощью 100-кратного избытка сукцинимидного эфира n-азидотетрафторбензойной кислоты в смеси диметилформамид-вода или диметилсульфоксид-вода в присутствии основного буфера, преимущественно, 0.1 М Na2CO3 или 0.1 М HEPES, pH 9.0, в течение ~3 ч с последующей отмывкой нанокомпозита с помощью 0.1 М NaCl.
Доставку нанокомпозитов TiO2-PL(ArN3)-oligo в клетки осуществляют путем обычного эндоцитоза.
Задача решается способом адресной инактивации вируса гриппа внутри клетки, включающим обработку клеток MDCK нанокомпозитами диоксида титана TiO2-PL(ArN3)-oligo с последующим их заражением вирусом гриппа A (H3N2) и УФ-облучением с расстояния 1.5 см в течение 16 мин (расчетная удельная мощность светового потока 4 мВт/см2), при этом адресная противовирусная активность проявляется благодаря тому, что олигонуклеотиды определенной последовательности  направляют нанокомпозит к целевым участкам вирусной РНК, а фотоактивируемая перфторарилазидная группа после облучения светом разрушает нуклеиновые кислоты.
направляют нанокомпозит к целевым участкам вирусной РНК, а фотоактивируемая перфторарилазидная группа после облучения светом разрушает нуклеиновые кислоты.
Сущность изобретения иллюстрируется примерами 1-11 и рисунками Фиг.1-3.
Пример 1 иллюстрирует способ приготовления нанокомпозита TiO2-PL-oligo по прототипу.
Примеры 2-10 иллюстрируют способ приготовления нанокомпозитов TiO2-PL(ArN3)-oligo.
Пример 11 иллюстрирует способ приготовления нанокомпозита TiO2-PL(ArN3)-oligo(Flu).
Пример 12 иллюстрирует проникновение нанокомпозитов в клетки.
Примеры 13, 14 иллюстрируют противовирусную активность предлагаемых нанокомпозитов.
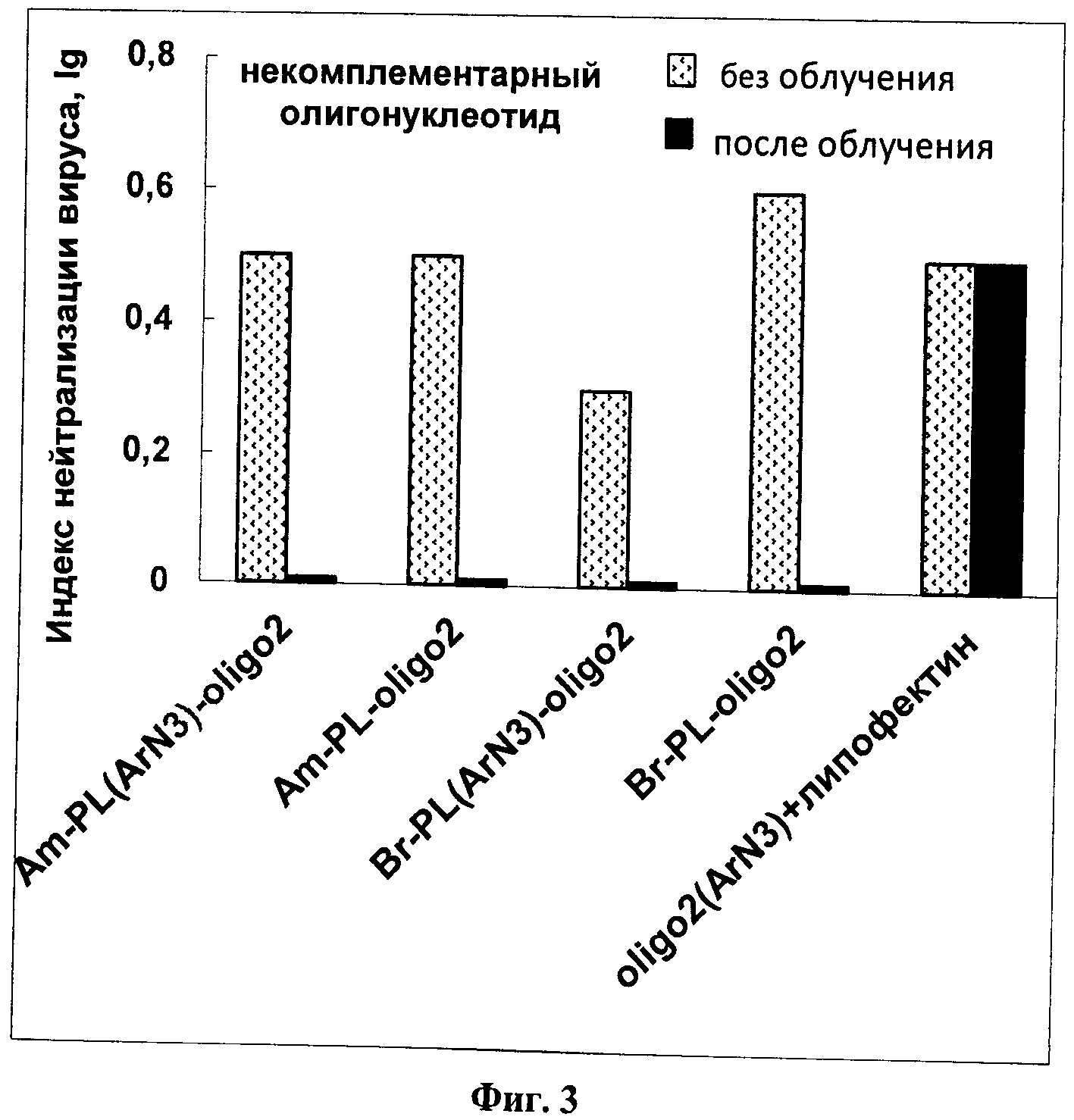
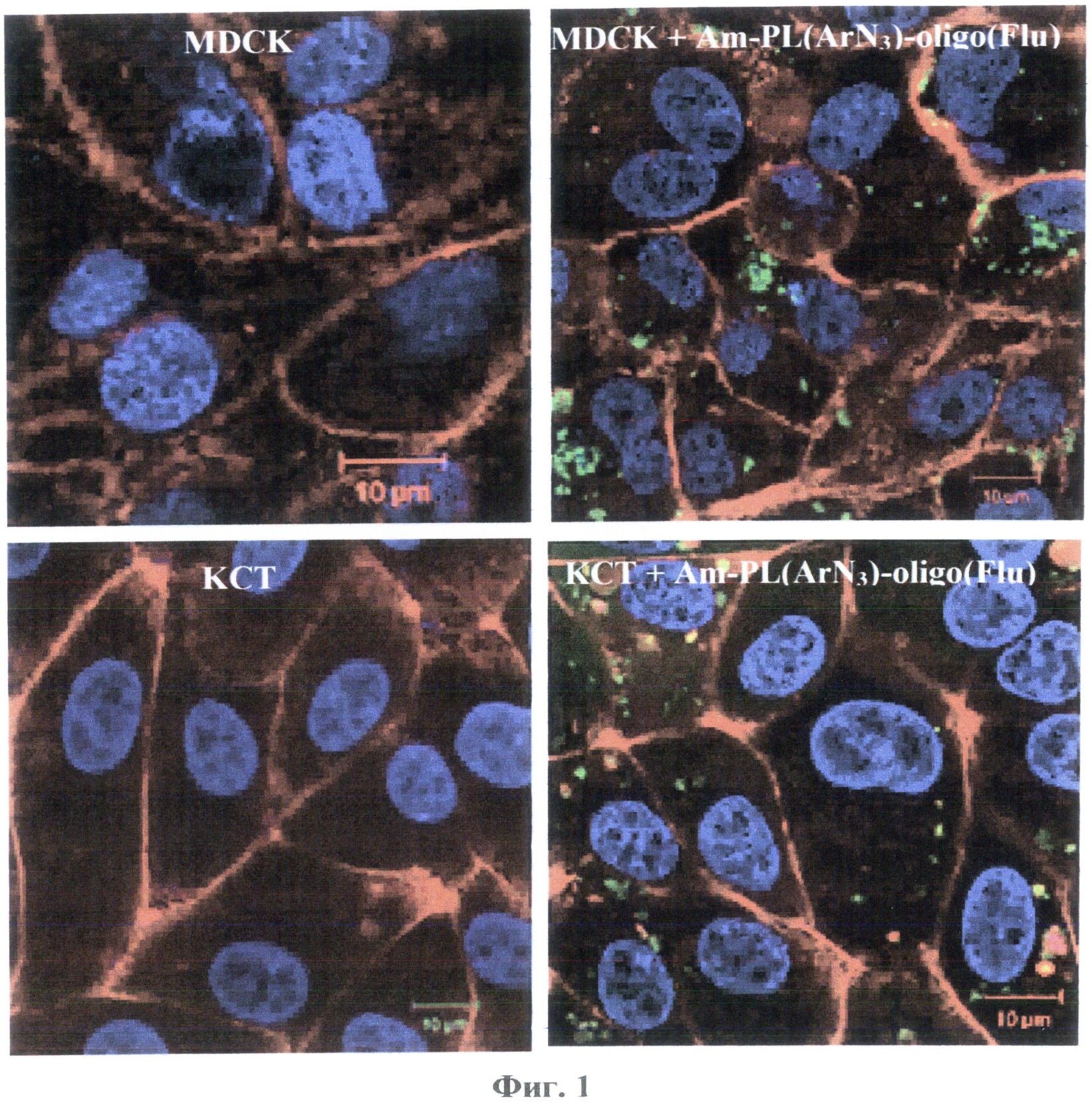
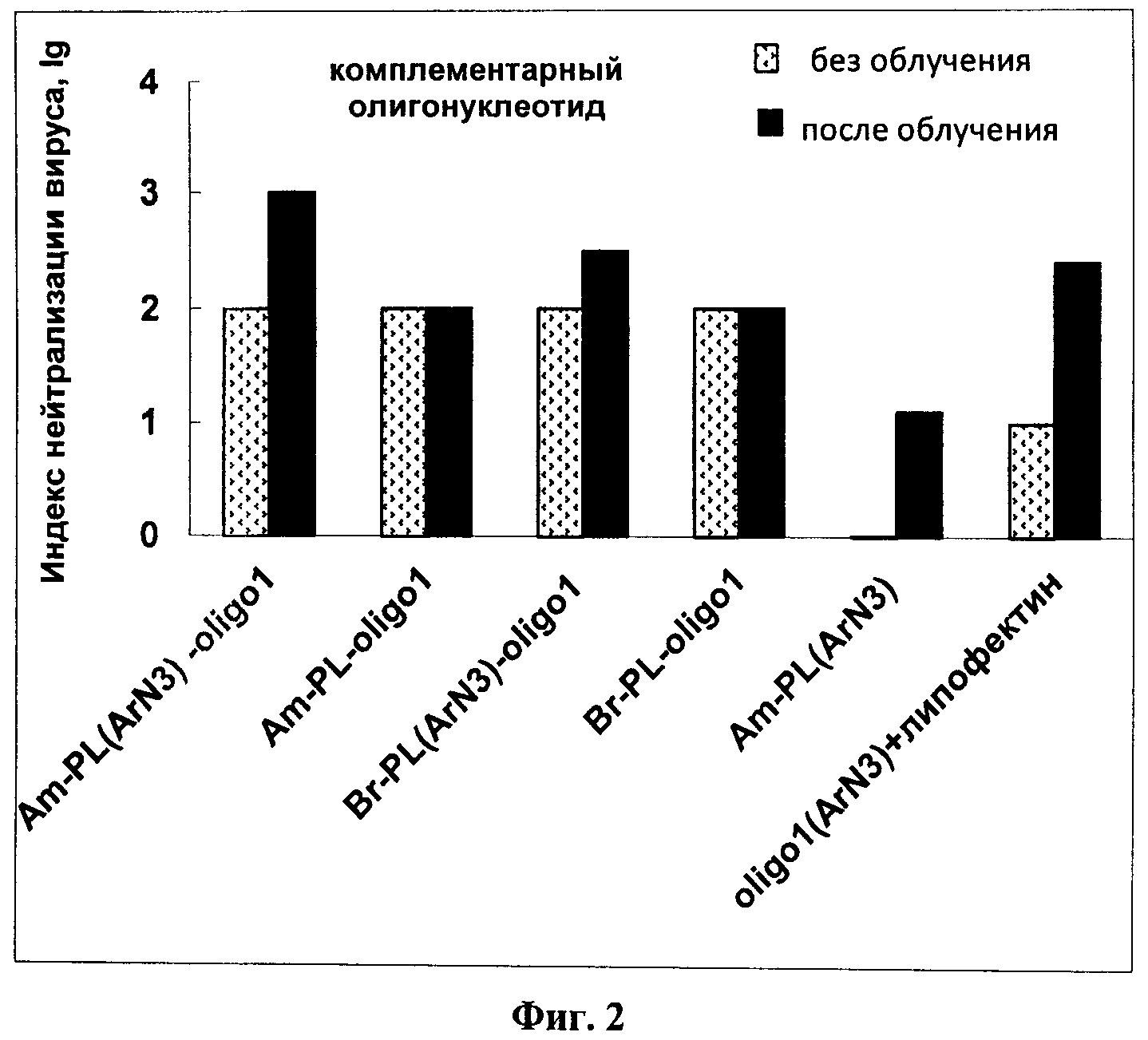
На Фиг.1 представлены фотографии образцов клеток линий MDCK и КСТ до и после инкубации с нанокомпозитом TiO2-PL(ArN3)-oligo(Flu), демонстрирующие проникновение нанокомпозитов в клетки. На Фиг.2 приведена противовирусная активность нанокомпозитов TiO2-PL(ArN3)-oligo1, содержащих комплементарный олигонуклеотидный фрагмент и фотоактивируемую группу, в сравнении с аналогичными нанокомпозитами без фотоактивируемой группы и с композитом без олигонуклеотида, до (светлые столбики) и после (темные столбики) УФ-облучения. На Фиг.3 приведена противовирусная активность нанокомпозитов TiO2-PL(ArN3)-oligo2, содержащих некомплементарный олигонуклеотидный фрагмент, в сравнении с аналогичными нанокомпозитами без фотоактивируемой группы, до (светлые столбики) и после (темные столбики) УФ-облучения.
Пример 1 (по прототипу).
Получение нанокомпозита TiO2-PL-oligo, состоящего из наночастиц диоксида титана в кристаллической форме (анатаз, An; брукит, Br; или аморфный, Am) проводят, добавляя 10 мкл 10-5 М раствора полилизин-содержащего олигонуклеотида (1 нмол) к 0.5 мл суспензии наночастиц (2 мг/мл). Смесь выдерживают при встряхивании в течение 1 ч при комнатной температуре, после чего центрифугируют и отделяют супернатант. К осадку нанокомпозита добавляют 0.5 мл 0.1 М KH2PO4 (pH 7), выдерживают 5-10 мин при встряхивании и снова центрифугируют. Процедуру повторяют, используя в качестве раствора 0.1 М NaCl. Осадок суспендируют в 0.5 мл 0.1 М NaCl. Количество конъюгата PA-oligo, присоединившегося к наночастицам диоксида титана, определяют по разности оптического поглощения раствора конъюгата перед добавлением к частицам и промывных растворов после иммобилизации. Концентрация частиц в суспензии нанокомпозита - 2 мг/мл, соотношение PL-oligo/TiO2=~0.9 нмол/мг.
Пример 2.
В качестве исходного нанокомпозита используют TiO2-PL-oligo с емкостью по олигонуклеотиду 10 нмол/мг, полученный известным способом (прототип). В качестве основы для нанокомпозитов используют наночастицы в аморфной форме. В качестве олигонуклеотидного фрагмента нанокомпозита используют последовательность 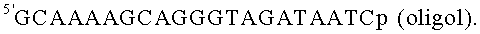
Синтез нанокомпозита Am-PL(ArN3)-oligo1, содержащего фотоактивируемую арилазидную группу, осуществляют следующим образом. Суспензию нанокомпозита Am-PL-oligo1 в 0.5 мл 0.1 М NaCl (1 мг/мл) с емкостью по олигонуклеотиду 10 нмол/мг центрифугируют, отделяют супернатант, к частицам добавляют 100 мкл 0.1 М Na2CO3, 100 мкл диметилформамида (DMF) и 3 раза с интервалом 30 мин - по 100 мкл раствора 0.3 М N-оксисукцинимидного эфира n-азидотетрафторбензойной кислоты в DMF. Через 2 ч после последнего добавления реагента нанокомпозит, содержащий присоединившиеся арилазидные (ArN3) группы, отмывают от непрореагировавших компонентов с помощью DMF (3×500 мкл), затем 0.1 М NaCl (3×500 мкл) и суспендируют в 0.5 мл 0.1 М NaCl. Концентрация частиц в суспензии нанокомпозита - 1 мг/мл.
Полноту реакции проверяют по реакции с хлоридом N-(2-оксиэтил)феназиния (Phn) следующим образом. Полученный нанокомпозит Am-PL(ArN3)-oligo (0.1 мг в 200 мкл 0.1 М NaCl) центрифугируют, отделяют супернатант, к частицам добавляют раствор Phn (0.5 мг в 20 мкл 0.2 М Na2CO3) и смесь выдерживают при встряхивании в течение 10 мин при комнатной температуре и затем отмывают тем же раствором соды (3×100 мкл). Исходный нанокомпозит Am-PL-oligo (контроль) обрабатывают аналогичным образом. Сравнивают окрашивание контрольного и опытного образцов. Отсутствие окрашивания (или очень слабое окрашивание) опытного образца по сравнению с контрольным образцом) свидетельствует о полноте реакции аминогрупп полилизина в составе нанокомпозита с эфиром арилазида.
Пример 3
Способ аналогичен примеру 2, отличается тем, что в качестве исходного используют нанокомпозит Am-PL-oligo в концентрации 5 мг/мл.
Пример 4
Способ аналогичен примеру 2, отличается тем, что в качестве исходного используют нанокомпозит с емкостью по олигонуклеотиду 40 нмол/мг.
Пример 5
Способ аналогичен примеру 2, отличается тем, что в качестве растворителя вместо диметилформамида используют диметилсульфоксид (DMSO).
Пример 6
Способ аналогичен примеру 2, отличается тем, что в качестве основы для исходного нанокомпозита An-PL-oligo1 используют TiO2-наночастицы в форме анатаз.
Пример 7
Способ аналогичен примеру 2, отличается тем, что в качестве основы для исходного нанокомпозита Br-PL-oligo1 используют TiO2-наночастицы в форме брукит.
Пример 8
Способ аналогичен примеру 2, отличается тем, что в качестве олигонуклеотидной части нанокомпозита используют последовательность 
Пример 9
Способ аналогичен примеру 8, отличается тем, что в качестве основы для исходного нанокомпозита используют наночастицы в форме брукит.
Пример 10
Способ аналогичен примеру 2, отличается тем, что вместо раствора Na2CO3 используют буфер 0.1 М HEPES, pH 9.0.
Пример 11
Способ аналогичен примеру 2, отличается тем, что в качестве исходного используют полученный известным способом (прототип) нанокомпозит Am-PL-oligo1(Flu), несущий на 5'-конце олигонуклеотида флуоресцентную метку (остаток флуоресцеина).
Пример 12
Для проведения экспериментов по проникновению в клетки нанокомпозитов, приготовленных по примеру 11, используют клетки линий КСТ и MDCK. Клетки получают из коллекции культур клеток ФБУН ГНЦ ВБ «Вектор» (п. Кольцово, Новосибирская обл.).
Для приготовления образцов для конфокальной микроскопии клетки КСТ, HeLa и MDCK культивируют в полной среде DMEM в присутствии 5% фетальной сыворотки крупного рогатого скота (КРС) с добавлением пенициллина (100 МЕ/мл) и стрептомицина (100 мкг/мл) в 8-ми луночных камерах до достижения 70% монослоя. После этого полную среду заменяют на среду без сыворотки, стрептомицина и пенициллина (160 мкл). Затем добавляют исследуемые образцы нанокомпозитов, содержащих флуоресцентно-меченный олигонуклеотид (40 мкл) до конечной концентрации 0.1 мг/мл по TiO2 и 2 нмол/мл по DNA-фрагменту. После 24 ч инкубации клетки отмывают 1×PBS, фиксируют смесью 0.4% формалина и 0.1% Triton Х-100 (10 мин), обрабатывают 0.5% Triton X-100 (10 мин) и дофиксируют 2% формалином (10 мин). Все растворы готовят в буфере PBS, pH 7.2. Затем клетки обрабатывают красителями (DAPI для ядер, голубой цвет и Cell Mask Plasma Membrane Stain для клеточных мембран, красный цвет) в течение 10 мин. Препараты анализируют с помощью конфокального лазерного сканирующего микроскопа LSM 510 UV Meta Microscope (Carl Zeiss, Inc., Германия). Используют три лазерные линии с длиной волны 405 нм (для обнаружения ядер клеток), 543 нм (для клеточных мембран) и 488 (для нанокомпозитов, меченных флуоресцеином). Флуоресцеин-меченные нанокомпозиты (зеленый цвет) в черно-белом варианте проявляются как белые точки (рис.8).
На Фиг.1 приведена фотография образцов клеток линий MDCK и КСТ до и после инкубации с нанокомпозитом Am-PL(ArN3)-oligo1(Flu), полученном по примеру 10. Рисунок демонстрирует проникновение нанокомпозитов в клетки.
Пример 13
В экспериментах используют вирус гриппа A/Aichi/2/68 (H3N2) с исходным титром 108,5 ТЦД50/мл. В качестве нанокомпозитов используют Am-PL(ArN3)-oligo1 и Br-PL(ArN3)-oligo1 с фотоактивируемой арилазидной группой, полученные по примерам 2 и 7, Am-PL-oligo1 и Br-PL-oligo1 без фотоактивируемой группы, полученные известным способом (прототип), в которых адресующей частью выступает олигонуклеотид oligo1, комплементарный 3'-концу 5 сегмента вирусной (-)РНК и имеющий выраженные противовирусные свойства по отношению к вирусу гриппа A H3N2. В качестве TiO2-частиц используют наночастицы в аморфной и кристаллической (брукит) форме. В качестве контрольных образцов используют Am-PL(ArN3) (композит, не содержащий олигонуклеотид) и oligo1(ArN3)+липофектин (композит, в котором липофектин выполняет роль трансфектанта вместо TiO2-наночастиц).
Противовирусные свойства нанокомпозитов исследуют на культуре клеток MDCK. Клетки культивируют, как описано в примере 11. Препараты нанокомпозитов, разводят средой RPMI-1640, содержащей 2 мкг/мл трипсина, и вносят в трех повторах на монослой отмытых от сыворотки клеток MDCK в объеме 50 мкл на лунку 96-луночного планшета из расчета 100 мкг/мл по отношению к наночастицам или 1 мкМ по отношению к олигонуклеотиду в конечной реакционной смеси. Второй планшет готовят аналогичным образом с теми же препаратами. Реакционные смеси инкубируют при 37°C и 100% влажности в CO2-инкубаторе в течение 1 ч. Затем вносят вирус A/Aichi/2/68 (H3N2) в разведениях на среде RPMI-1640, содержащей 2 мкг/мл трипсина, от -1 до -8 с десятикратным шагом в объеме 50 мкл/лунку. Через 2,5 ч инкубации реакционные смеси одного из планшетов подвергают УФ-облучению с расстояния 1.5 см в течение 16 мин (расчетная удельная мощность светового потока 4 мВт/см2). Все реакционные смеси затем инкубируют в течение 2 суток в CO2-термостате при 37°C и 100% влажности. Наличие вируса определяют визуально под микроскопом с использованием гемагглютинации по ЦПД и в РГА с 1% эритроцитами петуха.
В качестве дополнительных контролей используют: контроль клеток MDCK (вносят по 100 мкл/лунку питательной среды RPMI-1640, содержащей 2 мкг/мл трипсина) и контроль вируса A/Aichi/2/68 (H3N2) (вносят 50 мкл/лунку среды и через 1 ч инкубации вносят вирус по 50 мкл/лунку в разведениях на среде RPMI-1640, содержащей 2 мкг/мл трипсина, от -1 до -8 с десятикратным шагом). Дальнейшая обработка - как в основном опыте.
Противовирусную активность выражают с помощью индекса нейтрализации, определенного как разность логарифмов титра вируса в клетках в отсутствие нанокомпозитов (контроль) и титра вируса в клетках, обработанных нанокомпозитами (lg ТЦД50/млконтроль - lg ТЦД50/млобразец).
Результаты приведены на Фиг.2, из которой следует, что нанокомпозиты Am-PL-oligo1 и Br-PL-oligo1, не содержащие фотоактивируемой группы, проявляют практически одинаковую противовирусную активность до и после облучения. Такую же активность проявляют нанокомпозиты Am-PL(ArN3)-oligo1 и Br-PL(ArN3)-oligo1 с фотоактивируемой арилазидной группой без облучения. Однако если эти же нанокомпозиты используют в опытах с облучением, их активность значительно увеличивается (в 5-10 раз в зависимости от использованной формы наночастиц диоксида титана). Воздействие контрольных образцов Am-PL(ArN3) и oligo1(ArN3)+липофектин также в 10 раз увеличивается при облучении, благодаря наличию в их составе фотоактивируемой группы.
Пример 14
Способ аналогичен примеру 13, отличается тем, что в качестве нанокомпозитов используют нанокомпозиты, приготовленные по примеру 6, т.е. на основе наночастиц в форме анатаз, а также тем, что концентрация нанокомпозитов в конечной реакционной смеси в опытах по подавлению репродукции вируса составляет 5 мкг/мл по отношению к наночастицам или 0.05 мкМ по отношению к олигонуклеотиду. Как и в предыдущем примере, противовирусная активность нанокомпозита An-PL-oligo1, не содержащего фотоактивируемую группу, не зависит от облучения. В тот же время, нанокомпозит An-PL(ArN3)-oligo1 с фотоактивируемой арилазидной группой проявляет в ~10 раз большую активность после облучения.
Пример 15
Способ аналогичен примеру 13, отличается тем, что в качестве нанокомпозитов используют нанокомпозиты Am-PL(ArN3)-oligo2 и Br-PL(ArN3)-oligo2, полученные по примерам 8 и 9, и Am-PL-oligo2 и Br-PL-oligo2, полученные известным способом (прототип), в которых адресующей частью выступает олигонуклеотид oligo2, имеющий случайную последовательность той же длины, что и oligo1. В качестве контрольного образца использовали oligo2(ArN3)+липофектин (композит, в котором липофектин выполняет роль трансфектанта вместо TiO2-наночастиц).
Результаты приведены на Фиг.3, из которой следует, что нанокомпозиты, содержащие олигонуклеотид, некомплементарный вирусной РНК, без облучения проявляет слабую противовирусную активность (на ~1.5 порядка меньшую по сравнению с нанокомпозитами, содержащими комплементарный олигонуклеотид). Противовирусная активность таких нанокомпозитов после облучения практически отсутствует вовсе. Вероятно, это связано с тем, что некомплементарный олигонуклеотид, не находя своей мишени, подвергается воздействию облучения в составе нанокомпозита, т.е. саморазрушается. Таким образом, разница в действии нанокомпозитов, несущих комплементарный и некомплементарный олигонуклеотид достигает 3 порядков, т.е. увеличивается специфичность противовирусного действия нанокомпозитов. Контрольный образец oligo2(ArN3)+липофектин также проявляет низкую противовирусную активность, одинаковую до и после облучения Вероятно, липофектин защищает олигонуклеотид от саморазрушения при воздействии облучения.
Таким образом, предлагаемый способ позволяет увеличить функциональные возможности нанокомпозитов. получаемых известным способом (прототип), за счет введения в них дополнительной фотоактивируемой группировки. Нанокомпозиты проявляют сайт-специфическое действие, которое обусловлено последовательностью олигонуклеотида в его составе: контрольный нанокомпозит, содержащий специфичный к вирусу гриппа A олигонуклеотид (oligo1) ингибирует размножение вируса с эффективностью, на ~1.5 порядка превосходящей действие нанокомпозита, содержащего олигонуклеотид со случайной последовательностью (oligo2). Получаемые заявляемым способом нанокомпозиты обладают более высокой противовирусной активностью по отношению к вирусу гриппа A при УФ-облучении.