ПЕПТИДЫ
Вид РИД
Изобретение
Настоящее изобретение относится к циклическому олигопептиду с конформационными ограничениями, к фармацевтической композиции, содержащей такой олигопептид, применению такого олигопептида и фармацевтической композиции в медицине и способу получения такого олигопептида.
Область техники
Известно, что белковые рецепторы обычно связывают свои лиганды при помощи эпитопов, т.е. комбинаций аминокислотных остатков, составляющих небольшую часть белковой молекулы.
При активации белковых рецепторов на поверхности клетки они продуцируют внутриклеточный сигнал вследствие связывания с другими белками, называемыми белковыми лигандами. Часть лиганда, взаимодействующая с рецептором, называется эпитопом и обычно состоит из комбинации небольшого числа аминокислотных остатков, находящихся в непосредственной близости друг от друга и удерживаемых в этом положении остовом белковой цепи. Примерами эпитопов могут служить структуры на поверхности белков, взаимодействующие с антителами или Т-клеточными рецепторами, но фактически любая структура на поверхности белка, специфически узнаваемая другим белком, подпадает под определение эпитопа. Поскольку связывание белкового рецептора с эпитопом может служить важным этапом в этиологии болезни или, напротив, в лечении патологического состояния, идентификация функциональных групп, образующих эпитопы, представляет собой потенциально эффективный способ разработки новых лекарственных средств, где лекарственное средство представляет собой агент, содержащий эпитоп, который связывается с рецептором.
Существуют две проблемы, затрудняющие этот подход к разработке новых лекарственных средств. Одна из них заключается в идентификации эпитопов, которые могут использоваться в качестве лекарственных молекул, связывающихся с подходящими рецепторами для лечения заболевания. Вторая проблема заключается в дизайне молекул, способных удерживать и презентировать комбинации аминокислотных остатков, образующих эпитоп, таким образом, что может достигаться сильное связывающее взаимодействие с клеточным рецептором.
Известны методы идентификации комбинации аминокислотных остатков, способной образовывать эпитопы. В традиционной комбинаторной химии идентификация наиболее подходящих последовательностей для связывания с конкретным рецептором должна происходить путем синтеза сотен возможных комбинаций различных групп, таких как аминокислоты, в различном порядке, и проверки эффективности каждой комбинации. Это трудоемкий и дорогостоящий процесс, ограниченный к тому же природой химических реакций, проводящихся для связывания вместе различных компонентов.
В заявке на международный патент WO 01/01140 описан усовершенствованный способ идентификации эпитопов. Описана композиция для взаимодействия с лигандом. Композиция содержит нековалентную ассоциацию множества различных конъюгатов, где каждый конъюгат содержит головную группу и хвостовую группу. Хвостовые группы конъюгатов образуют гидрофобный агрегат, и конъюгаты обладают свободой движения относительно друг друга в составе агрегата, так что в присутствии лиганда по крайней мере две головные группы располагаются надлежащим образом для формирования эпитопа, способного связываться с лигандом сильнее, чем каждая из групп по отдельности. Большое количество конъюгатов, обладающих желаемой биологической активностью, может быть идентифицировано путем подбора группы конъюгатов, содержащих совокупность головных групп, которые образуют нековалентные ассоциации, в которых хвостовые группы объединяются путем гидрофобных взаимодействий и в которых конъюгаты проявляют свободу движения относительно друг друга, а также анализа с целью выявления достаточного взаимодействия между нековалентной ассоциацией и лигандом. Этот процесс может быть повторен с использованием модифицированной совокупности головных групп для обнаружения достаточного взаимодействия между нековалентной ассоциацией и лигандом. Этот процесс позволяет идентифицировать наиболее подходящую последовательность для связывания с конкретным рецептором, полагаясь на близость головных групп для получения эпитопов-производных ассоциации без необходимости синтеза сотен возможных комбинаций различных групп, используя подход традиционной комбинаторной химии. Метод основывается на близости головных групп для получения эпитопов-производных ассоциации. После синтеза группы конъюгатов, дальнейшего химического синтеза не требуется, только смешивание конъюгатов для получения различных проб путем нековалентной ассоциации.
В то время как эта новая композиция и метод позволяют успешно идентифицировать функциональные группы, образующие эпитоп и связывающиеся со своим лигандом, по-прежнему необходима разработка усовершенствованных композиций, способных к формированию желаемого эпитопа и более стабильному и специфичному взаимодействию со своим лигандом для генерации биологического ответа.
Попытки конструирования пептида, аналогичного эпитопу, только из аминокислот, входящих в состав сайта связывания, часто терпят неудачу, поскольку такие пептиды не обладают биологической активностью, аналогичной активности белкового рецептора.
При конструировании сайта связывания белка из олигопептидов, принадлежащих различным, дискретным участкам белковой цепи, попытки реконструкции сайта связывания путем смешивания отдельных олигопептидов в растворе не приводили к получению активного сайта связывания.
В соответствии с вышесказанным, настоящее изобретение направлено на получение усовершенствованных олигопептидов, способных к образованию желаемого эпитопа, способного к более стабильному и специфичному взаимодействию со своим лигандом для генерации биологического ответа.
Сущность изобретения
В настоящем изобретении представлен циклический олигопептид, содержащий цикл не менее чем из шести аминокислотных остатков для специфического связывания со своим лигандом, где кольцо включает несколько аминокислотных доменов, каждый из которых содержит не менее двух аминокислотных остатков, образующих эпитоп, и две или более ассоциирующих функциональных группы, расположенных таким образом, что они формируют одну или более ассоциации внутри цикла; где циклический олигопептид ограничен до единственной конформации таким образом, что аминокислотные остатки, образующие эпитоп, образуют эпитоп в каждом домене, при этом каждый эпитоп способен специфически связываться с лигандом.
Из уровня техники известно, что циклические пептиды имеют более ограниченную конформацию, чем линейные олигопептиды. Свобода движений концов пептида в циклическом пептиде ограничена, поскольку они химически связаны друг с другом. Тем не менее, циклические пептиды все же обладают значительной степенью гибкости, что делает их непригодными для участия в стабильном связывающем взаимодействии с лигандом.
Путем конструирования циклических олигопептидов, содержащих две или более ассоциирующих функциональных группы, расположенные таким образом, что они образуют одну или более ассоциаций внутри цикла, циклический олигопептид оказывается ограниченным до единственной конформации. Это позволяет аминокислотным остаткам, образующим эпитоп в каждом домене, специфически связываться с лигандом более стабильно и специфично, чем было доступно до настоящего времени. Аминокислотные остатки, образующие эпитоп, могут образовывать стабильный эпитоп для взаимодействия с лигандом, приводящего к биологическому ответу. Поскольку формируется стабильный эпитоп, взаимодействие с лигандом улучшается.
В заявке на патент США US 2005/0107289 раскрываются антимикробные агенты и композиции, включающие циклические пептиды, содержащие последовательность чередующихся D- и L- α-аминокислотных остатков или β-аминокислотных остатков. В этом документе далее раскрывается, что, по-видимому, циклические пептиды самостоятельно сворачиваются в надмолекулярные структуры внутри микробных мембран или будучи ассоциированными с ними. Такие надмолекулярные структуры могут, например, представлять собой нанотрубки. В центре каждой нанотрубки имеется пора, окруженная остовами полипептидных цепей расположенных друг над другом циклических пептидов. Через поры нанотрубок могут проходить ионы и мелкие молекулы.
В заявке на патент США US 2005/0107289 не раскрывается, что циклические пептиды содержат аминокислотные остатки, образующие эпитоп, которые образуют эпитоп, способный специфически связываться с лигандом. В заявке на патент США US 2005/0107289 также не раскрывается, что циклические пептиды ограничены ассоциациями внутри цикла, что обеспечивает формирование таких эпитопов.
В работе G. Abbenante et al. "Conformational Control by Thiazole and Oxazoline Rings in Cyclic Octapeptides of Marine Origin. Novel Macrocyclic Chair and Boat Conformations; J. Am. Chem. Soc. 1996, 118, 10384-10388 раскрывается использование строительных блоков аминокислот (Thr, Cys) в качестве ограничителей конформации цикла (оксазолин, тиазол) для регуляции трехмерной структуры и реактивности морских макроциклов. Циклический октапептид 1, c[Ile-Thr-D-Val-Cys-Ile-Thr-D-Val-Cyc-], обладает высокой гибкостью и может образовывать многие структуры, обладающие низкой энергией. Этот циклический октапептид не имеет ассоциаций внутри цикла и не ограничен до единственной конформации для образования различных эпитопов.
В работе G. Abbenante et al. "Conformational Control by Thiazole and Oxazoline Rings in Cyclic Octapeptides of Marine Origin. Novel Macrocyclic Chair and Boat Conformations; J. Am. Chem. Soc. 1996, 118, 10384-10388 также раскрывается циклический пептид 2, c[Ile-Thr-D-(Val)Thz-Ile-Thr-D-(Val)ThZ-], у которого в растворе обнаруживалась единственная конформация псевдокресла. Также был синтезирован циклический пептид 7, c[(Ile)Oxn-D-(Val)-Thz-(Ile)Oxn-D-(Val)Tnz-], дающий высокоограниченный макроцикл с конформацией псевдокресла или седла. Циклический октапептид 8, полученный путем кислого гидролиза 7, принимал конформацию лодки, обладающую большей гибкостью. Эти циклические октапептиды являются до некоторой степени ограниченными благодаря присутствию оксазолинов и/или тиазолов, но они не формируют различных эпитопов.
В работе R. M. Cusack et al, Conformations of cyclic octapeptides and the influence of heterocyclic ring constraints upon calcium binding; J. Chem. Soc, Perkin Trans. 2, 2000, 323-331 раскрываются четыре циклических октапептида, различающихся по количеству гетероциклических тиазольных и оксазолиновых колец-ограничителей. Пептиды 1, 2 и 3 в растворе принимали различные конформации. Эти циклические октапептиды являются до некоторой степени ограниченными благодаря присутствию оксазолинов и/или тиазолов, но они не формируют различных эпитопов.
В работе R. M. Cusack et al, Conformations of cyclic octapeptides and the influence of heterocyclic ring constraints upon calcium binding; J. Chem. Soc, Perkin Trans. 2, 2000, 323-331 раскрывается также пептид 4, не содержащий оксазолиновых и тиазольных колец, и молекулярное моделирование показало, что такие циклические пептиды, не содержащие никаких ограничений помимо водородных связей, оказываются очень гибкими и потенциально могут принимать большое число конформаций в растворе. Пептид 4 не содержит ассоциаций внутри цикла и не ограничен до единственной конформации для формирования различных эпитопов.
Ниже циклический олигопептид согласно настоящему изобретению будет описан более детально.
Циклический олигопептид состоит из цикла, содержащего, по меньшей мере, шесть аминокислотных остатков, где цикл содержит несколько аминокислотных доменов, где каждый домен содержит, по крайней мере, два аминокислотных остатка, образующих эпитоп, и две или более ассоциирующих функциональных группы.
В одном воплощении, циклический олигопептид состоит из цикла из шести аминокислотных остатков, где цикл состоит из двух аминокислотных доменов, и каждый домен состоит из двух аминокислотных остатков, образующих эпитоп, и двух ассоциирующих функциональных групп. В предпочтительном воплощении циклический олигопептид состоит из цикла из восьми аминокислотных остатков, где цикл состоит из двух аминокислотных доменов, каждый домен состоит из трех аминокислотных остатков, образующих эпитоп, и двух ассоциирующих функциональных групп.
В альтернативном воплощении циклический олигопептид состоит из цикла из более чем восьми аминокислотных остатков. В этом воплощении, предпочтительно цикл содержит три ассоциирующих функциональных группы, образующие ассоциации внутри цикла, приводящие к образованию трех аминокислотных доменов, каждый из которых содержит три аминокислотных остатка, образующих эпитоп.
Аминокислотные остатки, входящие в состав циклического олигопептида, могут представлять собой любые натуральные аминокислоты, их производные, содержащие замены, аналоги и их D-формы.
В предпочтительном воплощении настоящего изобретения используются три аминокислотных остатка, образующих эпитоп, с чередующимися стереохимическими конфигурациями, т.е. L-D-L или D-L-D. Это чередование является особенно благоприятным, поскольку позволяет боковым цепям аминокислотных остатков, образующих эпитоп, ориентироваться в плоской конфигурации и разворачиваться в одну и ту же сторону. Это дает возможность аминокислотным остаткам, образующим эпитоп, оказаться в непосредственной близости друг от друга для образования эпитопа.
В альтернативном воплощении циклический олигопептид состоит из цикла из десяти аминокислотных остатков, где цикл состоит из двух аминокислотных доменов, а каждый домен состоит из четырех аминокислотных остатков, образующих эпитоп, и двух ассоциирующих функциональных групп. Аминокислотные остатки, образующие эпитоп, могут иметь одну и ту же или чередующиеся стереохимические конфигурации, т.е. L-L-L-L, D-D-D-D, L-D-L-L, L-L-D-L, L-L-L-D, D-L-L-L, L-L-D-D, D-D-L-L, L-D-L-D, D-L-D-L, L-D-D-L, D-L-L-D, D-L-D-D, D-D-L-D, D-D-D-L или L-D-D-D.
Ассоциирующие функциональные группы расположены в циклическом олигопептиде таким образом, что они образуют одну или несколько ассоциаций внутри цикла, посредством которых циклический олигопептид оказывается ограниченным до единственной конформации таким образом, что аминокислотные остатки, образующие эпитоп, образуют эпитоп в каждом домене. Образование единственной конформации циклическим олигопептидом может быть измерено с помощью различных методов, известных из уровня техники. Для определения конформации циклического олигопептида могут использоваться стандартные спектроскопические методы такие как 1Н ЯМР-спектроскопия, круговой дихроизм, вращательная дисперсия или рентгеновская кристаллография.
Аминокислотные остатки, образующие эпитоп, образуют эпитоп в каждом домене, поскольку циклический олигопептид ограничен до единственной конформации одной или более ассоциациями внутри цикла. Образованные эпитопы способны специфически связываться с лигандом. Специфические структуры эпитопа и лиганда не ограничены в настоящем изобретении. Целью настоящего изобретения является получение олигопептидного каркаса, презентирующего различные эпитопы, состоящие из любой подходящей комбинации двух или более аминокислотных остатков, образующих эпитоп, их аналогов или производных, таким образом, что эти аминокислотные остатки, образующие эпитоп, удерживаются в стабильной конфигурации, обладающей жесткостью, достаточной для прочного связывания эпитопа со специфическим лигандом, таким, как рецептор. Специалисту в уровне техники известна последовательность аминокислотных остатков, образующих эпитоп, или способ получения эпитопа, взаимодействующего с лигандом, такой как способ, раскрытый в заявке на международный патент WO 01/01140. Специалист в уровне техники не нуждается в подробных химических структурах всех возможных эпитопов, поскольку подбор подходящих аминокислотных остатков для формирования эпитопов не представляет для него трудности. Любая последовательность аминокислотных остатков, образующих эпитоп, может оказаться подходящей в той или иной ситуации, и это зависит от конкретного лиганда. Далее, порядок аминокислотных остатков в каждом домене может определять активность образованного эпитопа и также зависит от конкретного лиганда. Необязательно знать точную химическую структуру лиганда при условии, что известна биологическая активность лиганда. Аминокислотные остатки, образующие эпитоп, могут быть включены в циклический олигопептид согласно настоящему изобретению без необходимости знания точной химической структуры лиганда, поскольку возможно измерить биологическую функцию, ассоциированную с лигандом, чтобы определить, имело ли место взаимодействие эпитопа с лигандом. Для специалиста в уровне техники не представляет трудности на основании экспериментальных данных, полученных на подходящей экспериментальной модели, выбор аминокислот для включения в циклический олигопептид в качестве аминокислотных остатков, образующих эпитоп, и определение порядка аминокислотных остатков в каждом домене, обеспечивающего наилучшую биологическую активность, путем анализа желаемой активности.
Примеры тестов на обнаружение взаимодействия между циклическим олигопептидом и лигандом могут включать методы связывания, например, использующие принцип иммуноферментного анализа для обнаружения взаимодействия между антителом и антигеном. Другие подходящие методы in vitro включают изменение флуоресценции чувствительных к окружению мембраносвязанных флуоресцентных проб, реакции преципитации, стимуляцию или ингибирование энзиматической активности и т.д. Также применимы методы, основывающиеся на способности материалов изменять поведение клеток, культивируемых in vitro, такие как анализ гибели клеток, пролиферации клеток, апоптоза, ингибирования или стимуляции межклеточных контактов, секреции цитокинов и других растворимых белков, синтеза специфических мРНК, внутриклеточного везикулярного транспорта, изменения процессов передачи сигналов в клетке и т.д. Также могут использоваться методы in vivo на интактных животных или людях, например, включение радиоактивной метки в циклический олигопептид и последующее изучение его распределения после введения в организм различными путями.
Эпитоп образуется в каждом домене. Таким образом, в циклическом олигопептиде образуется не менее двух эпитопов, предпочтительно два или три. Эпитопы в циклическом олигопептиде могут быть одинаковыми или различными. В случае различных эпитопов в циклическом олигопептиде каждый домен может содержать другие аминокислотные остатки или те же аминокислотные остатки в другом порядке. Примером такого эпитопа может служить эпитоп, образуемый комбинацией аминокислотных остатков серина (S), фенилаланина (F) и аргинина (R), связывающийся с рецептором на поверхности макрофагов. Связывание эпитопа с рецептором на поверхности клетки подавляет секрецию TNF.
Ассоциации внутри цикла
Одна или более ассоциаций внутри цикла служат для ограничения циклического олигопептида до единственной конформации с различными аминокислотными доменами. Аминокислотные остатки, образующие эпитоп, сильно ограничены и обладают очень небольшой свободой движения. Это обеспечивает формирование в каждом домене стабильного эпитопа, способного более стабильно и специфично взаимодействовать с лигандом для генерации биологического ответа.
Количество ассоциирующих функциональных групп в каждом циклическом олигопептиде и тип выбранных ассоциирующих функциональных групп зависит от аминокислотных остатков, образующих эпитоп, и лиганда. Количество и тип ассоциирующих функциональных групп могут влиять на биологическую активность олигопептида. Для специалиста в уровне техники не представляет трудности выбор для использования наиболее эффективного типа ассоциирующих функциональных групп с помощью анализа желаемой активности.
Одну или более ассоциаций внутри цикла образуют две или более ассоциирующих функциональных групп, расположенных соответствующим образом. Как минимум одна ассоциирующая функциональная группа предпочтительно расположена между аминокислотными доменами.
Одна или более ассоциаций внутри цикла могут быть ковалентными или нековалентными. Ассоциирующие функциональные группы в циклическом олигопептиде могут быть одинаковыми или различными.
Ассоциирующие функциональные группы могут присоединяться к ассоциирующим аминокислотным остаткам. В одном воплощении ассоциирующие функциональные группы представляют собой боковые цепи ассоциирующих аминокислотных остатков или модифицированные боковые цепи ассоциирующих аминокислотных остатков или группы, присоединенные к боковым цепям ассоциирующих аминокислотных остатков. Структура I, приведенная ниже, иллюстрирует пример этого воплощения.
В качестве альтернативы, ассоциирующие функциональные группы могут присоединяться к атомам азота в пептидных связях в кольце циклического олигопептида путем замещения водорода, связанного с азотом. Структура II, приведенная ниже, иллюстрирует пример этого воплощения.
Еще в одном альтернативном воплощении, ассоциирующие функциональные группы могут присоединяться к другим подходящим для этого группам, расположенным внутри олигопептидного цикла, отличным от аминокислотных остатков. Примером такой группы может служить альфагидроксикарбоксикислота, где гидроксильная группа участвует в образовании сложноэфирной связи вместо пептидной связи.
Термин «две или более ассоциирующие функциональные группы» включает следующие воплощения:
- при нековалентной ассоциации внутри цикла:
ассоциирующие функциональные группы представляют собой две группы в боковом обрамлении олигопептидного цикла, присоединенные к ассоциирующим аминокислотным остаткам в составе цикла, ассоциирующие с образованием нековалентной ассоциации;
ассоциирующие функциональные группы представляют собой две группы в боковом обрамлении олигопептидного цикла, присоединенные к атомам азота в пептидных связях в составе цикла, ассоциирующие с образованием нековалентной ассоциации;
ассоциирующие функциональные группы представляют собой две группы в боковом обрамлении олигопептидного цикла, присоединенные к другим подходящим группам, расположенным внутри цикла, ассоциирующие с образованием нековалентной ассоциации; или
- при ковалентной ассоциации внутри цикла:
ассоциирующие функциональные группы представляют собой две группы, присоединенные к ассоциирующим аминокислотным остаткам в составе цикла, связанные между собой с образованием ковалентной ассоциации напрямую либо посредством линкера, такого как бифункциональная группа;
ассоциирующие функциональные группы представляют собой две группы, присоединенные к атомам азота в пептидных связях в составе цикла, связанные между собой с образованием ковалентной ассоциации напрямую либо посредством линкера, такого как бифункциональная группа;
ассоциирующие функциональные группы представляют собой две группы, присоединенные к другим подходящим группам, расположенным внутри цикла, связанные между собой с образованием ковалентной ассоциации напрямую либо посредством линкера, такого как бифункциональная группа.
Термин «присоединена» означает, что ассоциирующие группы связаны напрямую или посредством линкера с ассоциирующими аминокислотными остатками, атомами азота или другими подходящими группами.
В предпочтительном воплощении одна или более ассоциаций внутри цикла между ассоциирующими функциональными группами являются нековалентными. Нековалентные ассоциации внутри цикла особенно предпочтительны в настоящем изобретении, так как они придают циклическому олигопептиду оптимальный баланс между жесткостью и гибкостью. Циклический олигопептид обладает достаточной жесткостью для поддержания единственной конформации пептидного остова и обеспечения достаточной близости и правильного расположения аминокислотных остатков, образующих эпитоп, для правильного формирования эпитопа, способного специфически связываться с лигандом. Также циклический олигопептид обладает достаточной гибкостью, обеспечивающей достаточную подвижность боковых цепей аминокислотных остатков, образующих эпитоп, что позволяет им адаптироваться к точной структуре лиганда, с которым они могут связываться. Таким образом, циклические олигопептиды согласно настоящему изобретению, содержащие нековалентные ассоциации внутри цикла, могут взаимодействовать со своим лигандом более стабильно и специфично для генерации биологического ответа.
Ассоциации внутри цикла предпочтительно являются гидрофобными. В особенно предпочтительном воплощении присутствуют два аминокислотных домена и две липофильные ассоциирующие функциональные группы.
Использование нековалентных ассоциаций внутри цикла, в особенности путем гидрофобных взаимодействий, обладает преимуществом, поскольку при этом ассоциации внутри цикла могут образовываться посредством взаимодействий между тремя или более ассоциирующими функциональными группами. Это дает возможность формирования трех или более аминокислотных доменов, что является затруднительным при использовании ковалентных ассоциаций внутри цикла. Соответственно, в других предпочтительных воплощениях настоящего изобретения циклический олигопептид может содержать три или более ассоциирующих функциональных группы, формирующие ассоциации внутри цикла, для образования трех или более аминокислотных доменов. Использование липофильных ассоциирующих функциональных групп для образования нековалентных ассоциаций внутри цикла путем гидрофобных взаимодействий обладает особым преимуществом при больших размерах циклического олигопептида.
Ассоциирующие функциональные группы, расположенные подходящим образом для образования одной или более нековалентных ассоциаций внутри цикла, могут представлять собой любую молекулу, присоединенную к подходящей группе, обладающей соответствующей стереохимией, которая образует часть цикла циклического олигопептида. Ассоциирующие функциональные группы предпочтительно присоединены к ассоциирующим аминокислотным остаткам или их аналогам, примеры которых приведены ниже, однако могут использоваться и другие группы, пригодные к введению в циклический олигопептид. В общем случае предпочтительно, чтобы группы, к которым присоединяются ассоциирующие функциональные группы, были связаны в кольце пептидными связями. В альтернативном воплощении, одна или более пептидных связей могут заменяться другими типами связей. Примеры таких связей включают сложноэфирные связи, эфирные связи, сложные тиоэфирные связи и простые тиоэфирные связи. В некоторых случаях это может быть желательно для предотвращения расщепления протеазами в биологических жидкостях.
Ассоциирующие аминокислотные остатки могут включать остатки натуральных аминокислот с присоединенными ассоциированными функциональными группами.
Предпочтительные ассоциирующие аминокислотные остатки представляют собой липидные аналоги аминокислот. Например, ассоциирующие аминокислотные остатки могут быть получены на основе остатков цистеина, глицина, лизина, аспартата или глутамата. В случае цистеина, ассоциирующая функциональная группа может представлять собой алифатическую группу, присоединенную к боковой цепи цистеина через сульфгидрильную группу. Таким же образом можно использовать лизин, аспартат и глутамат, добавляя ассоциирующую функциональную группу к боковой цепи. В качестве альтернативы, ассоциирующий аминокислотный остаток может представлять собой аминокислотный остаток, в котором остаток боковой цепи представляет собой единственную алифатическую группу, составляющую ассоциирующую функциональную группу. Например, в случае если ассоциирующий аминокислотный остаток основывается на глицине, водородный атом в альфа-положении глицина может заменяться на алифатическую группу, которая и составляет ассоциирующую функциональную группу.
Алифатическая группа, упомянутая выше, которая может образовывать ассоциирующую функциональную группу, предпочтительно представляет собой алифатическую углеводородную цепь, которая предпочтительно содержит от 8 до 20 углеродных атомов, более предпочтительно содержит от 10 до 16 углеродных атомов, наиболее предпочительно 10 или 12 углеродных атомов и может быть насыщенной или ненасыщенной, линейной или разветвленной, и незамещенной или замещенной полностью или частично, например, атомами галогенов. В качестве альтернативы, алифатическая цепь может быть построена из силановых компонентов.
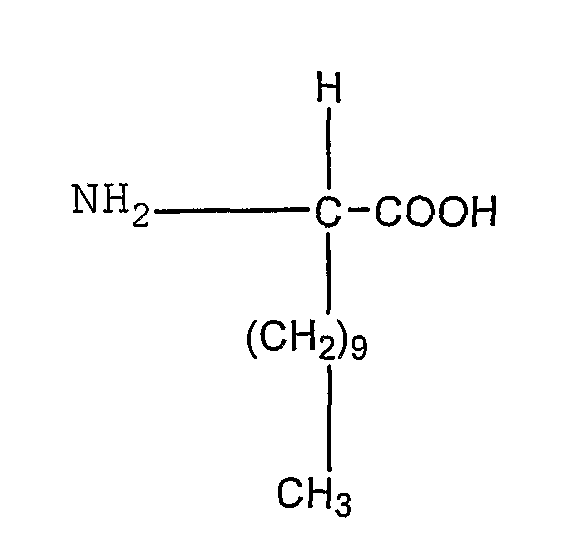
В типичной структуре I, приведенной ниже, ассоциирующая аминокислота представляет собой глицин, в котором водородный атом в альфа-положении заменен на углеводородную цепь С10.
В одном воплощении, где ассоциирующие функциональные группы присоединены к атомам азота в пептидных связях в кольце, нековалентные ассоциации внутри цикла, такие как гидрофобные ассоциации, могут осуществляться путем замены атомов водорода на азоте в пептидных связях на ассоциирующие функциональные группы, такие как, например, алифатическую группу, определенную выше.
Замена атома водорода на атоме азота в пептидной связи в циклическом олигопептиде согласно настоящему изобретению на ассоциирующую функциональную группу может быть осуществлена путем замены атома водорода на метиленовую группу, несущую подходящую функциональную группу, такую как, например, -SH, -OH или -NH2, с последующей дериватизацией ассоциирующей функциональной группой, такой как алифатической группой, определенной выше.
В одном аспекте настоящего изобретения, где атом азота принадлежит пептидной связи, связывающей аминокислотные остатки, образующие эпитоп, из различных аминокислотных доменов, циклический олигопептид согласно настоящему изобретению может иметь следующую структуру II:
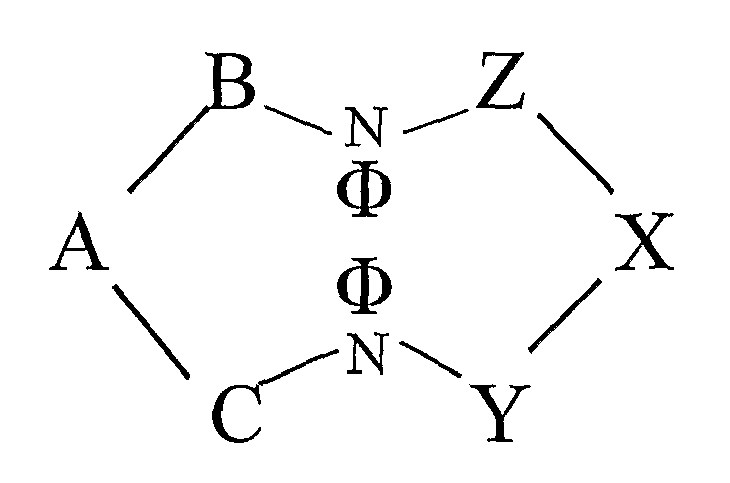
где A, B, C, X, Y и Z обозначают аминокислотные остатки, образующие эпитоп, N обозначает азот, принадлежащий пептидным связям между B и Z и между C и Y, и Ф обозначает ассоциирующие функциональные группы, определенные выше, присоединенные к атомам азота.
Еще одно преимущество использования нековалентных, в особенности гидрофобных, ассоциирующих функциональных групп, состоит в том, что это дает возможность образовываться димерам или олигомерам, содержащим множественные повторяющиеся эпитопы, ориентированные в разных направлениях, с помощью межмолекулярных взаимодействий, где гидрофобные ассоциирующие группы разных циклических олигопептидов ассоциируют друг с другом. Насколько такие взаимодействия окажутся возможными, зависит от структуры последовательности циклического олигопептида, определяющей относительную гидрофильность аминокислотных доменов. Это можно далее регулировать путем тщательного подбора ассоциирующих функциональных групп, у которых можно варьировать хиральность и размер боковой цепи с целью точного регулирования площади открытой гидрофобной поверхности олигопептида. Это может обладать определенными преимуществами при регулировании межмолекулярных взаимодействий с другими циклическими олигопептидами с конформационными ограничениями, или взаимодействий с другими молекулами, такими как белки или циклодекстрины. Это может обладать определенными преимуществами при получении небольших мультимерных структур, состоящих из двух или более циклических олигопептидов согласно настоящему изобретению, способных одновременно связываться с двумя или более рецепторами на клеточной поверхности, так что рецепторы образуют поперечную связь, в результате чего клетка получает сильный сигнал активации и запускает сигнальный каскад.
Взаимодействия циклических олигопептидов согласно настоящему изобретению с другими неидентичными циклическими олигопептидами согласно настоящему изобретению могут обладать преимуществами при получении мультимерных структур, обладающих множественной функциональностью благодаря различным эпитопам, привнесенным в структуру различными олигопептидами. Таким образом, например, один олигопептид может содержать один или два эпитопа, связывающиеся с рецепторами, что приводит к интернализации мультимерной структуры, в то время как второй олигопептид в составе мультимерной структуры может содержать один или более эпитопов, способных взаимодействовать с компонентами сигнального каскада внутри клетки после интернализации.
Связывание циклодекстринов с циклическими олигопептидами согласно настоящему изобретению может помочь снизить уровень взаимодействий между гидрофобными частями различных олигопептидов и таким образом предотвратить образование крупных агрегатов, вероятно, обладающих пониженной активностью по сравнению с мономерами или олигомерами из-за стерических ограничений, накладываемых на эпитопы в таких крупных агрегатах.
В растворах белков, таких как альбумин или желатин, один или более циклических олигопептидов согласно настоящему изобретению могут связываться с поверхностью белка в результате ассоциаций липофильных компонентов гидрофобных ассоциирующих функциональных групп в пептиде с областями белка, обладающими сродством к алкильным или ацильным углеводородным цепям. Такое связывание одного или более циклических олигопептидов согласно настоящему изобретению с поверхностью крупного белка является одним из способов презентации множественных эпитопов на циклических олигопептидах таким образом, что максимально усиливается активация сигнальных взаимодействий в клетке.
В дальнейшем воплощении, одна или более ассоциаций внутри цикла между ассоциирующими функциональными группами являются ковалентными. В этом воплощении, ассоциирующие функциональные группы также могут присоединяться к ассоциирующим аминокислотам. Например, ассоциирующие функциональные группы могут представлять собой боковые цепи цистеинов (ассоциирующих аминокислотных остатков), и ассоциация образуется с помощью внутрикольцевой дисульфидной связи между этими боковыми цепями. В качестве альтернативы, ассоциирующие аминокислотные остатки могут представлять собой лизин и глутамат, способные ассоциировать ковалентно путем образования пептидной связи посредством терминальных групп своих боковых цепей (ассоциирующие функциональные группы), или глутамат и серин, способные реагировать с образованием сложноэфирной связи. Также могут использоваться аналоги этих аминокислот, несущие те же функциональные группы.
В одном воплощении ковалентная ассоциация внутри цикла достигается за счет замещения водородов, связанных с атомами азота в пептидных связях цикла на ассоциирующие функциональные группы, образующие ковалентные ассоциации. Ассоциирующие функциональные группы могут представлять собой тиолы или другие цепи, несущие на своих концах функциональные группы, которые могут образовывать ковалентную ассоциацию. Замена атома водорода на азоте пептидной связи в циклическом олигопептиде согласно настоящему изобретению ассоциирующей функциональной группой может производиться путем замены атома водорода метиленовой группой, несущей подходящую функциональную группу, такую как, например, -SH, -OH или -NH2, с последующим связыванием функциональной группы с бифункциональным реагентом. Ковалентная ассоциация образуется путем замены второго атома водорода (на азоте пептидной связи, расположенной подходящим образом на циклическом олигопептиде) со второй метиленовой группой, несущей подходящую функциональную группу, и вышеупомянутый бифункциональный реагент дополнительно связывается с функциональной группой этой второй метиленовой группы с образованием ковалентной связи между двумя атомами азота пептидных связей в циклическом олигопептиде. В зависимости от природы ассоциирующих функциональных групп, включенных в циклические олигопептиды, для этого подходят бифункциональные реагенты, содержащие короткую цепь, в которой в каждом терминальном положении находится функциональная группа, выбранная, но не ограниченная следующим списком: карбоксильные, амино-, гидроксильные, сульфгидрильные, бромо-, йодо-, циано-, азо-, и боронокислые группы.
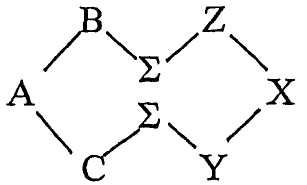
В определенном аспекте настоящего изобретения, где циклический олигопептид содержит два аминокислотных домена и две ассоциирующих функциональных группы, каждая из которых присоединена к ассоциирующему аминокислотному остатку, и эпитоп образуется из трех аминокислотных остатков, образующих эпитоп, в каждом домене, циклический олигопептид может иметь следующую структуру:
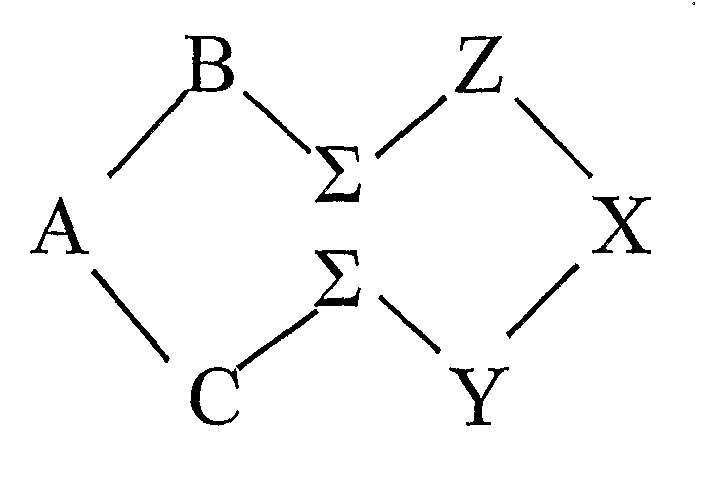
где A, B, C, X, Y и Z обозначают аминокислотные остатки, формирующие эпитоп; A и X обозначают D-аминокислотные остатки, а B, C, Y и Z обозначают L-аминокислотные остатки, или A и X обозначают L-аминокислотные остатки, а B, C, Y и Z обозначают D-аминокислотные остатки; один эпитоп образуется в домене C-A-B, а другой эпитоп образуется в домене Z-X-Y; и каждая Σ обозначает ассоциирующий аминокислотный остаток, несущий ассоциирующую функциональную группу.
В одном примере циклического олигопептида согласно настоящему изобретению домен Z-X-Y и/или домен С-А-В могут выбираться из последовательностей аминокислот RFS, RSF, FSR, FRS, SRF, SFR, QLS, QSL, SQL, SLQ, LQS или LSQ, и каждая Σ представляет собой липидную аминокислоту с линейной углеводородной цепью С10 в качестве ассоциирующей функциональной группы. Предпочтительно домен Z-X-Y представляет собой RFS, в котором фенилаланин предпочтительно имеет D-конфигурацию, серин L-конфигурацию, аргинин L-конфигурацию, и каждая липидная аминокислота L-конфигурацию. В предпочтительном воплощении домен Z-X-Y и/или домен C-A-B, выбранные из вышеприведенных последовательностей, образуют эпитоп, способный подавлять секрецию TNF. Соответственно, эти последовательности могут оказаться применимыми в лечении заболевания, где TNF является осложняющим фактором, например, заболевание, выбранное из рака, ожирения, сердечных заболеваний, аутоиммунных заболеваний и воспалительных заболеваний. Эти последовательности могут использоваться для лечения аутоиммунного заболевания, выбранного из ревматоидного артрита, рассеянного склероза и болезни Крона.
В вышеприведенной структуре домен С-А-В может быть идентичным домену Z-X-Y или отличаться от него.
В другом аспекте настоящего изобретения циклический олигопептид содержит три аминокислотных домена, и эпитоп образуется из трех аминокислотных остатков, образующих эпитоп, в каждом домене, и олигопептид предпочтительно содержит три ассоциирующие функциональные группы.
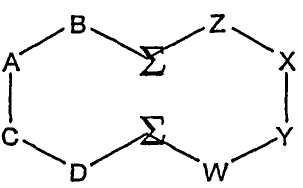
В другом аспекте настоящего изобретения циклический олигопептид содержит два домена, и эпитоп образуется из четырех аминокислотных остатков, образующих эпитоп, в каждом домене. В одном воплощении этого аспекта изобретения циклический олигопептид имеет следующую структуру:
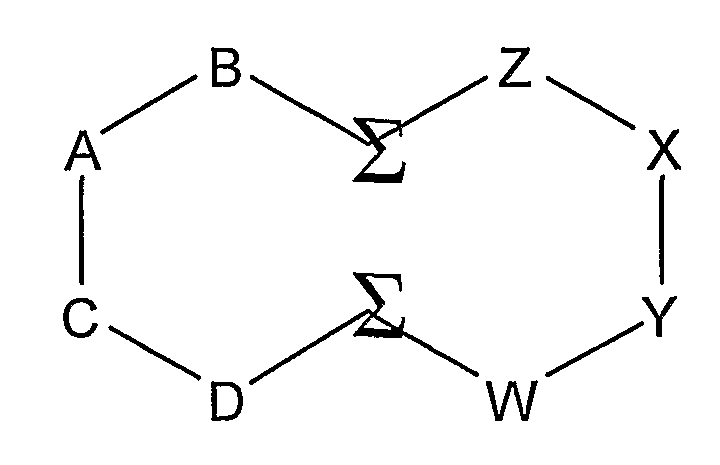
где A, B, C, D, W, X, Y и Z обозначают аминокислоты, образующие эпитоп; один эпитоп образуется из домена D-C-A-B и один эпитоп образуется из домена Z-X-Y-W; каждая Σ обозначает ассоциирующий аминокислотный остаток.
В альтернативном воплощении этого аспекта изобретения циклический олигопептид имеет следующую структуру:
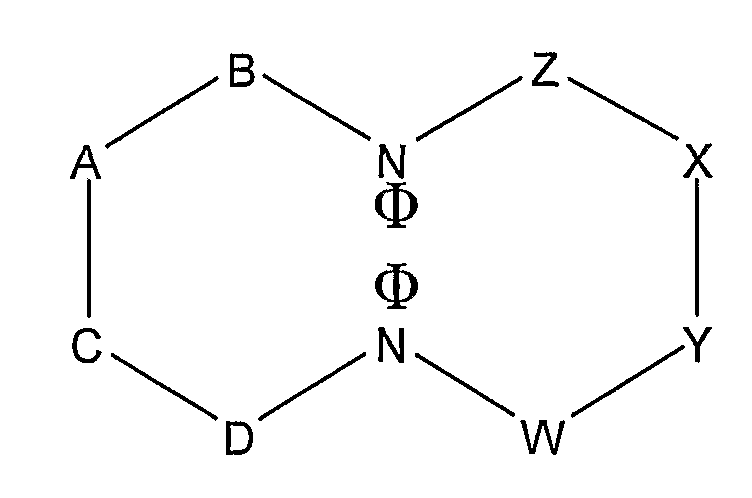
где A, B, C, D, W, X, Y и Z обозначают аминокислоты, образующие эпитоп; один эпитоп образуется из домена D-C-A-B, и один эпитоп образуется из домена Z-X-Y-W; каждая N обозначает азот в пептидных связях между B и Z и между С и Y, и каждая Ф обозначает ассоциирующую функциональную группу, присоединенную к азоту.
В одном примере циклического олигопептида согласно этому аспекту настоящего изобретения домен Z-X-Y-W и/или домен D-C-A-B могут выбираться из аминокислотных последовательностей YEKA, YEAK, YAKE, YAEK, YKAE, YKEA, EYKA, EYAK, EKAY, EKYA, EAKY, EAYK, KAYE, KAEY, KYAE, KYEA, KEYA, AKEY, AKYE, AYEK, AYKE, AEYK или AEKY, и каждая Σ обозначает липидную аминокислоту с линейной углеводородной боковой цепью - ассоциирующей функциональной группой, содержащей углеводородную цепь длиной от 8 до 20 атомов углерода. Предпочтительно домен Z-X-Y-W представляет собой YEKA, и домен D-C-A-B представляет собой EYAK. В предпочтительном воплощении домен Z-X-Y-W и/или домен D-C-A-B, выбранные из вышеприведенных последовательностей, каждый образует эпитоп, способный ингибировать протеолитическую активность. Соответственно, эти последовательности могут использоваться для лечения заболевания, где протеазная активность является осложняющим фактором, такого как сердечно-сосудистое заболевание, болезни кровообращения и СПИД.
В одном воплощении этого аспекта изобретения, домен D-C-A-B идентичен домену Z-X-Y-W.
Композиции
В другом аспекте, в настоящем изобретении представлена фармацевтическая композиция, содержащая циклический олигопептид, определенный выше, и фармацевтически приемлемое формообразующее вещество и/или вспомогательное вещество. Формообразующее вещество предпочтительно выбирается из транскутола, блоксополимеров полоксамера, циклодекстринов, неионных поверхностно-активных веществ или солей желчных кислот. Если формообразующее вещество представляет собой неионное поверхностно-активное вещество, оно предпочтительно выбирается из ациловых эфиров полиэтиленгликоля или алифатических эфиров полиэтиленгликоля.
Как обсуждалось выше, в одном воплощении изобретения ассоциации внутри цикла могут образовываться между различными циклическими олигопептидами, где гидрофобные ассоциирующие функциональные группы различных циклических олигопептидов ассоциируют друг с другом, в результате чего получаются димеры или олигомеры, содержащие множественные повторяющиеся эпитопы, ориентированные в различных направлениях. Сила взаимодействий внутри цикла может модифицироваться путем смешивания с формообразующими веществами, облегчающими растворение гидрофобных соединений в водной среде.
Применение
В другом аспекте, в настоящем изобретении представлен циклический олигопептид, как определено выше, или композиция, как определено выше, для использования в качестве лекарственного, профилактического или диагностического средства.
В настоящем изобретении также представлено использование циклического олигопептида как определено выше, или композиции как определено выше для производства лекарственного препарата для лечения заболевания, в котором TNF является осложняющим фактором. Предпочтительно заболевание выбирается из ожирения, сердечных заболеваний, аутоиммунного заболевания и воспалительных заболеваний. Более предпочтительно заболевание представляет собой ревматоидный артрит или болезнь Крона. Циклический олигопептид, как определено выше, может использоваться для лечения рака, где TNF является осложняющим фактором. Рак может быть доброкачественным или злокачественным. Рак предпочтительно представляет собой солидную опухоль. Такие раковые заболевания включают, но не ограничиваются раком яичника, раком груди, раками кожи и раками эпителия.
В настоящем изобретении также представлено использование циклического олигопептида как определено выше, для производства лекарственного препарата для лечения заболевания, в котором протеазная активность является осложняющим фактором, включая сердечно-сосудистое заболевание, болезни кровообращения и СПИД. В одном специфическом воплощении изобретения, каждый домен в циклическом олигопептиде содержит аминокислотные остатки, образующие эпитоп, SRER, SERE, EYKA, YEAK, SFR или RFS, для которых в примере 7 было показано ингибирование протеолитической активности тромбина.
В одном специфическом воплощении этого изобретения, описанном выше, циклический олигопептид содержит аминокислотные остатки серина, фенилаланина и аргинина в качестве аминокислотных остатков, образующих эпитоп, по крайней мере, в одном домене. Было показано, что такие олигопептиды активны в отношении ингибирования секреции TNF макрофагами. В предпочтительном аспекте этого воплощения, ассоциирующие функциональные группы представляют собой липидные аминокислоты с углеводородными боковыми цепями C12, и аминокислотные остатки, образующие эпитоп, выбираются из RFS, FSR или SRF, где центральная аминокислота находится в D-форме, а две краевые аминокислоты находятся в L-форме. Эпитопы в циклическом олигопептиде могут быть идентичными или различаться.
Благодаря своей способности ослаблять секрецию TNF, эти олигопептиды могут оказаться эффективными в лечении таких заболеваний, как ревматоидный артрит, болезнь Крона, рассеянный склероз, ожирение, сердечные заболевания, аутоиммунные заболевания и другие заболевания, связанные с воспалительными процессами. Благодаря своей способности ослаблять секрецию TNF, эти олигопептиды могут также оказаться эффективными в лечении рака, где TNF является осложняющим фактором. Рак может быть доброкачественным или злокачественным. Рак предпочтительно представляет собой солидную опухоль. Такие раки включают, но не ограничиваются раком яичника, раком груди, раками кожи и раками эпителия.
В одном специфическом воплощении этого изобретения, описанном выше, циклический олигопептид содержит аминокислотные остатки A, K, E и Y в качестве аминокислотных остатков, образующих эпитоп, по крайней мере, в одном из доменов. Было показано, что эти олигопептиды активны в отношении ингибирования секреции TNF макрофагами. В предпочтительном аспекте этого воплощения, ассоциирующие функциональные группы представляют собой липидные аминокислоты с углеводородной боковой цепью C10, и аминокислотные остатки, образующие эпитоп, выбираются из YEKA и EYAK. Эпитопы в циклическом олигопептиде могут быть идентичными или различаться. Считается, что эффективность копаксона (глатирамер ацетат), случайного сополимера, содержащего аминокислотные остатки A, K, E и Y, в лечении рассеянного склероза отражает способность этого вещества ослаблять секрецию TNF in vitro (см. Weber MS, Starck M, Wagenpfeil S, Meinl E, Hohlfeld R & Farina C. Multiple sclerosis: glatiramer acetate inhibits monocyte reactivity in vitro and in vivo. Brain 127 pp 1370-8 (2004)). В этой связи, циклический олигопептид цикло(-A-K-Σ-Y-E-K-A-Σ-E-Y), проанализированный в примере 6, также может применяться для лечения рассеянного склероза, поскольку содержит те же аминокислотные остатки в неслучайной конфигурации и проявляет тот же эффект в отношении секреции TNF макрофагами. Также для лечения рассеянного склероза в циклических олигопептидах согласно настоящему изобретению могут использоваться другие комбинации A, K, E и Y.
Преимуществом настоящего изобретения является то, что циклические олигопептиды согласно настоящему изобретению позволяют достигать сильного специфического связывания по сравнению с обычными биологическими рецепторами. Циклический олигопептид может иметь сравнительно небольшой размер, предпочтительно не более 6-8 аминокислотных остатков. Соответственно, возможно получить циклический олигопептид согласно настоящему изобретению, который будет намного менее иммуногенным, чем его белковые аналоги.
В соответствии с этим аспектом настоящего изобретения, возможно не только разработать формулу циклического олигопептида для взаимодействия с лигандом in vitro, но и применять композицию in vivo.
Циклический олигопептид или композиция согласно настоящему изобретению могут вводиться в организм любым путем, соответствующим данному заболеванию, включая, но не ограничиваясь, оральным, назальным, ректальным, трансбуккальным, сублингвальным, пульмональным, вагинальным, наружным, глазным, ушным, подкожным, интрадермальным, интраартикулярным, интратекальным, внутримышечным, интрацеребральным, интракраниальным и внутривенным путями введения.
Циклические олигопептиды могут вводиться в виде водных растворов или в сочетании с фармацевтическими формообразующими веществами в композиции согласно настоящему изобретению. Циклический олигопептид или композиция также может смешиваться с другими активными молекулярными элементами с целью синергии или другого усиления их активности в качестве лекарственных средств. При введении определенными путями, например, оральным или ректальным, олигопептиды или композиции могут быть изготовлены в твердой, полужидкой или жидкой форме и помещены в капсулы, или в твердой форме, спрессованы в таблетки или сформованы в пилюли. В случае орального введения, капсулы, таблетки или пилюли могут иметь энтеросолюбильное покрытие. Для наружного применения, наилучшим образом подходит состав в виде геля, пасты или масла, а для пульмонального или назального введения олигопептид может быть в форме аэрозоля.
Способ
В другом аспекте, в настоящем изобретении представлен способ получения циклического олигопептида как определено выше, включающий:
i) выбор аминокислотных остатков, образующих эпитоп;
ii) получение циклического олигопептида, включающего аминокислотные остатки, образующие эпитоп.
Известны методы идентификации эпитопов. В традиционной комбинаторной химии идентификация наиболее подходящих последовательностей для связывания с конкретным рецептором должна происходить путем синтеза сотен возможных комбинаций различных групп, таких как аминокислоты, в различном порядке, и проверки эффективности каждой комбинации. Это трудоемкий и дорогостоящий процесс, ограниченный к тому же природой химических реакций, проводящихся для связывания вместе различных компонентов.
Как обсуждалось выше, аминокислотные остатки, образующие эпитоп, могут выбираться с помощью различных способов, известных специалисту в уровне техники.
В заявке на международный патент WO01/01140 представлен способ обнаружения молекул, образующих эпитоп, способный связываться с желаемым лигандом, использующий нековалентную ассоциацию множества различных конъюгатов. Как описано на стр. 2-5 документа WO01/01140, каждый конъюгат содержит головную группу и хвостовую группу, где хвостовые группы конъюгатов образуют гидрофобный агрегат, в котором конъюгаты обладают свободой движения относительно друг друга, так что в присутствии лиганда по крайней мере две головные группы (идентичные или различные) располагаются надлежащим образом для формирования эпитопа, способного связываться с лигандом сильнее, чем каждая из групп по отдельности. Головные группы, как правило, гидрофильные, а хвостовые группы, как правило, гидрофобные, т.е. липофильные, состоящие из углеводородных цепей, галофильные, состоящие из фторуглеродных цепей, или состоящие из силановых компонентов. Путем построения конъюгатов, имеющих головную и хвостовую группы, хвостовые группы могут ассоциировать, образуя гидрофобный агрегат, обычно представляющий собой надмолекулярную ассоциацию, такую как мицелла, ламеллярная структура, липосома или другая липидная структура, в которой конъюгаты ориентированы таким образом, что при нахождении в водной фазе головные группы располагаются в непосредственной близости друг от друга. Поскольку конъюгаты в агрегате подвижны, головные группы могут занимать различные положения в агрегате. Головные группы, которые обычно различаются, таким образом, обладают свободой движения внутри агрегата и могут вступать в кооперативные взаимодействия, приводящие к биологическим ответам, которые головные группы не способны вызывать поодиночке.
В предпочтительном воплощении настоящего изобретения, способ, раскрытый в документе WO01/01140, используется для выбора аминокислотных остатков, образующих эпитоп, включающий:
(a) выбор группы конъюгатов, где каждый конъюгат содержит головную и хвостовую группы, с совокупностью головных групп, где каждая головная группа содержит аминокислотный остаток;
(b) образование нековалентной ассоциации конъюгатов, где хвостовые группы объединяются путем гидрофобных взаимодействий и где конъюгаты подвижны;
(c) анализ для выявления достаточного взаимодействия между нековалентной ассоциацией и лигандом;
(d) необязательный повтор стадий (a)-(c) с использованием группы конъюгатов с модифицированной совокупностью головных групп; и
(e) при обнаружении достаточного взаимодействия на стадии (c) выбор аминокислотных остатков головных групп группы конъюгатов в качестве аминокислотных остатков, образующих эпитоп, на стадии (a).
Примеры тестов на «достаточное взаимодействие» могут включать методы связывания, например, использующие принцип иммуноферментного анализа для обнаружения взаимодействия между антителом и антигеном. Другие подходящие методы in vitro включают изменение флуоресценции чувствительных к окружению мембраносвязанных флуоресцентных проб, реакции преципитации, стимуляцию или ингибирование энзиматической активности и т.д. Также применимы методы, основывающиеся на способности материалов изменять поведение клеток, культивируемых in vitro, такие как анализ гибели клеток, пролиферации клеток, апоптоза, ингибирования или стимуляции межклеточных контактов, секреции цитокинов и других растворимых белков, синтеза специфических мРНК, внутриклеточного везикулярного транспорта, изменения процессов передачи сигналов в клетке и т.д. Также могут использоваться методы in vivo на интактных животных или людях, например, включение радиоактивной метки в надмолекулярные ассоциации и последующее изучение ее распределения после введения в организм различными путями.
Согласно этому способу, используется комбинаторный подход, в ходе которого готовится ряд различных надмолекулярных ассоциаций («проб»), каждая из которых содержит различную комбинацию конъюгатов, выбранных из пресинтезированного банка. Выбор подходящих конъюгатов может основываться на известных свойствах лиганда или может включать использование очень широкого диапазона головных групп, чтобы повысить вероятность образования двумя или более головными группами эпитопа, взаимодействующего с лигандом. Таким образом, после выявления достаточного взаимодействия между пробой и лигандом как описано выше, комбинация конъюгатов, оказавшаяся наиболее эффективной, может быть модифицирована путем добавления головных групп, удаления некоторых головных групп, или и того и другого, и повторного анализа полученных проб для выявления достаточного взаимодействия. В итоге, оказывается возможным обнаружение наиболее подходящей комбинации головных групп и выбор ее в качестве аминокислотных остатков, образующих эпитоп.
ПРИМЕРЫ
Пример 1 - анализ зависимости «доза-эффект» для циклического олигопептида при подавлении секреции TNF клетками линии макрофагов, стимулированных липополисахаридом (LPS).
1. Циклический олигопептид со структурой:
цикло(-DF-S-Σ-R-DF-S-Σ-R-)
синтезировали с использованием стандартных способов, основанных на методе Меррифилда с использованием смолы с последующей циклизацией в жидкой фазе. Очищенный пептид готовили в виде раствора в дистиллированной воде с концентрацией 1 мг/мл.
R, F, и S обозначают аминокислотные остатки, образующие эпитоп, а Σ обозначает ассоциирующую функциональную группу, присоединенную к ассоциирующему аминокислотному остатку, где ассоциирующий аминокислотный остаток представляет собой L-альфа аминокарбоксикислоту, а ассоциирующая функциональная группа представляет собой остаток боковой цепи, состоящий из линейной алифатической цепи, содержащей десять атомов углерода.
Все аминокислоты имеют L-конформацию если не указано иначе.
Все аминокислоты связаны пептидными связями.
2. Клетки линии J774A.1 (макрофагальная клеточная линия) рассевали во все лунки 24-луночного планшета с частотой рассева 5×105 клеток/мл на лунку (1 мл культуральной среды RPMI 1640 на лунку) и инкубировали в течение ночи при 37°С и 5% CO2 в атмосфере.
3. На следующий день раствор согласно стадии 1 добавляли в 15 лунок, содержащих клетки согласно стадии 2, так чтобы конечная концентрация составляла 50, 25, 12,5, 6,25, или 3,125 мкг/мл, по три лунки на каждую концентрацию. Оставшиеся лунки оставляли для контроля. После добавления планшет инкубировали в течение 4 часов при 37°С.
4. Липополисахарид из штамма 0111 B4 E. coli добавляли в лунки, содержащие раствор октапептида, и в три лунки, не содержащие пептида. Конечная концентрация липополисахарида составляла 0,625 мкг/мл.
5. Планшет инкубировали в течение ночи, и на следующий день супернатанты тестировали на присутствие TNF с использованием коммерческого набора реагентов для иммуноферментного анализа.
Из полученных результатов, приведенных в таблице ниже, видно, что активность циклического олигопептида в отношении подавления секреции TNF, индуцированной LPS, зависит от дозы.
|
Пример 2 - эффект циклических олигопептидов с различными ассоциирующими функциональными группами в отношении подавления секреции TNF, индуцированной фрагментном холерного токсина B (CTB) клетками линии макрофагов.
1. Получали циклические олигопептиды со следующими структурами:
цикло (-DF-R-Σ10-S-DF-R-Σ10-S-)
цикло (-DF-S-Σ10-R-DF-S-Σ10-R-)
цикло (-DF-R-Σ4-S-DF-R-Σ4-S-)
цикло (-DF-S-Σ4-R-DF-S-Σ4-R-)
где S, F и R обозначают аминокислотные остатки, образующие эпитоп, Σ обозначает ассоциирующую функциональную группу, присоединенную к ассоциирующему аминокислотному остатку, где Σ10 обозначает рацемический ассоциирующий аминокислотный остаток, представляющий собой аминокарбоксикислоту, а ассоциирующая функциональная группа представляет собой остаток боковой цепи, состоящий из линейной цепи -C10H21, и Σ4 обозначает норлейцин, где ассоциирующая функциональная группа представляет собой боковую цепь, содержащую четыре атома углерода.
Эти циклические олигопептиды готовили в виде растворов в транскутоле с концентрацией 5 мг/мл, которые далее разводили дистиллированной водой до концентрации 1 мг/мл.
2. Клетки линии J774A.1 (макрофагальная клеточная линия) рассевали во все лунки 24-луночного планшета с частотой рассева 3×105 клеток/мл на лунку (1 мл культуральной среды RPMI 1640 на лунку) и инкубировали в течение ночи при 37°С и 5% CO2 в атмосфере.
3. На следующий день растворы согласно стадии 1 добавляли в 12 лунок, содержащих клетки согласно стадии 2, так чтобы конечная концентрация составляла 12,5 мкг/мл, по три лунки на каждый раствор. Оставшиеся лунки оставляли для контроля. После добавления планшет инкубировали в течение 4 часов при 37°С.
4. Фрагмент холерного токсина B (CTB) добавляли в лунки, содержащие растворы октапептидов а также в три лунки, не содержащие пептидов. Конечная концентрация фрагмента холерного токсина В составляла 10 мкг/мл.
5. Планшет инкубировали в течение ночи, и на следующий день супернатанты тестировали на присутствие TNF с использованием коммерческого набора реагентов для иммуноферментного анализа.
Из полученных результатов, приведенных в таблице ниже, видно, что присутствие длинноцепочечных углеводородных боковых цепей, содержащих линейную цепь -C10H21 в качестве ассоциирующей функциональной группы придает активность циклическим олигопептидам в отношении подавления секреции TNF, индуцированной фрагментом холерного токсина B. Циклические олигопептиды, в которых боковая цепь ассоциирующей функциональной группы содержит только четыре атома углерода, не обладали ингибиторной активностью.
|
Пример 3 - эффект циклических олигопептидов с различными аминокислотными остатками, образующими эпитоп, и стереохимическими конфигурациями ассоциирующих аминокислотных остатков в отношении подавления секреции TNF, индуцированной липополисахаридом (LPS), клетками линии макрофагов.
1. Получали циклические октапептиды со следующими структурами:
цикло (-DF-S-ΣL-R-DF-S-ΣL-R-)
цикло (-DF-S-ΣL-R-DF-S-ΣD-R-)
цикло (-DF-S-ΣD-R-DF-S-ΣD-R-)
цикло (-DF-R-ΣL-S-DF-R-ΣL-S-)
цикло (-DF-R-ΣL-S-DF-R-ΣD-S-)
цикло (-DF-R-ΣD-S-DF-R-ΣD-S-)
где F, S и R обозначают аминокислотные остатки, образующие эпитоп, ΣL обозначает ассоциирующий аминокислотный остаток, представляющий собой L-альфааминокарбоксикислоту, где ассоциирующая функциональная группа представляет собой остаток боковой цепи, состоящий из линейной цепи -C10H21; ΣD обозначает ассоциирующий аминокислотный остаток, представляющий собой D-альфааминокарбоксикислоту, где ассоциирующая функциональная группа представляет собой остаток боковой цепи, состоящий из линейной цепи -C10H21. Эти циклические олигопептиды получали в виде растворов в дистиллированной воде с концентрацией 1 мг/мл.
2. Клетки линии J774-1 (макрофагальная клеточная линия) рассевали во все лунки 24-луночного планшета с частотой рассева 3×105 клеток/мл на лунку (1 мл культуральной среды RPMI 1640 на лунку) и инкубировали в течение ночи при 37°С и 5% CO2 в атмосфере.
3. На следующий день растворы согласно стадии 1 добавляли в 18 лунок, содержащих клетки согласно стадии 2, так чтобы конечная концентрация составляла 50 мкг/мл, по три лунки на каждый раствор. Оставшиеся лунки оставляли для контроля. После добавления планшет инкубировали в течение 4 часов при 37°С.
4. Липополисахарид из штамма 0111 B4 E. coli добавляли в лунки, содержащие растворы октапептидов, а также в три лунки, не содержащие пептидов. Конечная концентрация липополисахарида составляла 1,25 мкг/мл.
5. Планшет инкубировали в течение ночи, и на следующий день супернатанты тестировали на присутствие TNF с использованием коммерческого набора реагентов для иммуноферментного анализа.
Из результатов, приведенных в таблице ниже, видно, что циклические олигопептиды, содержащие аминокислотные остатки в порядке R-DF-S, активно подавляют секрецию TNF, индуцированную LPS, и что необходимо присутствие как минимум одного ассоциирующего аминокислотного остатка, представляющего собой L-альфааминокарбоксикислоту, с ассоциирующей функциональной группой, представляющей собой остаток боковой цепи, состоящий из неразветвленной цепи -C10H21, при этом другой ассоциирующий аминокислотный остаток представляет собой идентичную аминокарбоксикислоту в L- или D-форме.
|
Связывание циклодекстринов с циклическими олигопептидами согласно настоящему изобретению помогает понизить уровень взаимодействия между гидрофобными частями различных олигопептидов, и таким образом предотвращает образование крупных агрегатов, вероятно, обладающих пониженной активностью по сравнению с мономерами или олигомерами из-за стерических ограничений для эпитопов в таких крупных агрегатах.
Пример 4 - дозозависимый эффект циклического олигопептида с конформационными ограничениями, смешанного с гидроксипропил-бета-циклодекстрином и содержащего эпитопы, образованные из аминокислотных остатков, образующих эпитоп, R-DF-S, в отношении подавления секреции TNF, индуцированной липополисахаридом (LPS), клетками линии макрофагов, в широком диапазоне концентраций циклодекстрина
1. Получали циклический олигопептид со структурой цикло (-DF-S-Σ-R-DF-S-Σ-R-) в виде раствора в транскутоле с концентрацией 5 мг/мл, где Σ обозначает ассоциирующий аминокислотный остаток, представляющий собой L-альфааминокарбоксикислоту, и ассоциирующую функциональную группу, присоединенную к ассоциирующему аминокислотному остатку, и представляющую собой остаток боковой цепи, состоящий из линейной алифатической цепи, содержащей десять атомов углерода.
2. Шесть независимых аликвот раствора согласно стадии 1 объемом 200 мкл переносили в чистые ампулы объемом 8 мл и смешивали путем несильного встряхивания с помощью прибора Vortex с 800 мкл раствора гидроксипропил-бета-циклодекстрина в концентрации 50, 25, 12,5, 6,25, 3,125 или 1,5625 мг/мл в дистиллированной воде.
2. Клетки линии J774A.1 (макрофагальная клеточная линия) рассевали во все лунки 24-луночного планшета с частотой рассева 5×105 клеток/мл на лунку (1 мл культуральной среды RPMI 1640 на лунку) и инкубировали в течение ночи при 37°С и 5% CO2 в атмосфере.
3. На следующий день каждый из растворов согласно стадии 1 добавляли в соответствующем объеме в лунки, содержащие клетки согласно стадии 2, так чтобы конечная концентрация составляла 8, 4 или 2 мкг/мл, по три лунки на каждый раствор. Оставшиеся лунки оставляли для контроля. После добавления планшет инкубировали в течение 4 часов при 37°С.
4. Липополисахарид из штамма 0111 B4 E. coli добавляли в лунки, содержащие растворы октапептида и в лунки, не содержащие пептида. Конечная концентрация липополисахарида составляла 0,625 мкг/мл.
5. Планшет инкубировали в течение ночи, и на следующий день супернатанты тестировали на присутствие TNF с использованием коммерческого набора реагентов для иммуноферментного анализа.
Из полученных результатов, приведенных в таблице ниже, видно, что активность октапептида в отношении подавления секреции TNF, индуцированной LPS, зависит от дозы.
|
Из результатов видно, что смешивание октапептида с циклодекстрином приводит к значительному подавлению секреции TNF до концентрации 2 мкг/мл в лунке культурального планшета, и что такое ингибирование достигается в широком диапазоне концентраций циклодекстрина при соотношении масс 40:1 и ниже.
Пример 5 - эффект циклического олигопептида с конформационными ограничениями, смешанного с гидроксипропил-бета-циклодекстрином и содержащего эпитопы, образованные из аминокислотных остатков, образующих эпитоп, R-DF-S, в подавлении секреции TNF, индуцированной липополисахаридом (LPS) у крыс.
1. Получали циклический октапептид со структурой цикло (-DF-S-Σ-R-DF-S-Σ-R-), где Σ обозначает ассоциирующий аминокислотный остаток, представляющий собой L-альфааминокарбоксикислоту, и ассоциирующую функциональную группу, присоединенную к ассоциирующему аминокислотному остатку, и представляющей собой остаток боковой цепи, состоящий из линейной алифатической цепи, содержащей десять атомов углерода, в виде раствора в транскутоле, и гидрокси-бета-циклодекстрин, как описано в примере 4, где концентрация пептида составляла 1 мг/мл и конечная концентрация циклодекстрина составляла 40 мг/мл.
2. 1 мл раствора пептида вводили внутрибрюшинно крысам массой 250 г (1 мг пептида на крысу). Второй группе крыс вводили 1 мл среды транскутол/циклодекстрин, не содержащей пептида. Через 1 час, крысам вводили 1 мг липополисахарида (из Salmonella abortus equi).
3. Через 150 минут у животных брали кровь и измеряли уровень TNF у животных обеих групп с помощью иммуноферментного анализа. Из результатов, приведенных в таблице ниже, видно, что пептид способен ингибировать продукцию TNF клетками в ответ на стимул, показывая уменьшение более чем на 75%.
|
Пример 6 - подавление секреции TNF циклическим аналогом копаксона (глатирамер ацетат).
1. Получали два циклических олигопептида со следующими структурами:
цикло (-A-K-Σ-Y-E-K-A-Σ-E-Y-)
цикло (-A-K-Σ-E-Y-K-A-Σ-Y-E-)
все аминокислотные остатки находились в L-форме, если не указано иначе.
Все аминокислотные остатки связаны пептидными связями.
A, K, Y и E обозначают аминокислотные остатки, образующие эпитоп, а Σ обозначает ассоциирующую функциональную группу, присоединенную к ассоциирующему аминокислотному, представляющему собой L-альфааминокарбоксикислоту, и представляющую собой остаток боковой цепи, состоящий из линейной алифатической цепи, содержащей десять атомов углерода.
Циклические олигопептиды получали в виде раствора в гексафтороизопропаноле (HFIP) с концентрацией 10 мг/мл, затем смешивали с равными объемами раствора HFIP, содержащего бета-гидроксипропил-циклодекстрин в концентрации 50 мг/мл. Органические растворители затем высушивали в атмосфере азота, и комплекс пептида с циклодекстрином растворяли в дистиллированной воде до конечной концентрации циклического олигопептида 1 мг/мл.
2. Клетки линии J774A.1 (макрофагальная клеточная линия) рассевали во все лунки 24-луночного планшета с частотой рассева 3×105 клеток/мл на лунку (1 мл культуральной среды RPMI 1640 на лунку) и инкубировали в течение ночи при 37°С и 5% CO2 в атмосфере.
3. На следующий день растворы согласно стадии 1 добавляли в лунки, содержащие клетки согласно стадии 2, так чтобы конечная концентрация составляла 12 мкг/мл, по три лунки на каждый раствор. Также в другие лунки добавляли раствор циклодекстрина с концентрацией 62,5 мкг/мл. Оставшиеся лунки оставляли для контроля. После добавления планшет инкубировали в течение 4 часов при 37°С.
4. Липополисахарид из штамма 0111 B4 E. coli добавляли в лунки, содержащие растворы циклического олигопептида и в три лунки, не содержащие пептида. Конечная концентрация липополисахарида составляла 0,1 мкг/мл.
5. Планшет инкубировали в течение ночи, и на следующий день супернатанты тестировали на присутствие TNF с использованием коммерческого набора реагентов для иммуноферментного анализа.
|
Из результатов, приведенных в таблице, видно, что только один из двух протестированных циклических олигопептидов обладает способностью подавлять секрецию TNF, индуцированную LPS. Соответственно, последовательность аминокислотных остатков в каждом домене влияет на биологическую активность олигопептида. Цикло (-A-K-Σ-Y-E-K-A-Σ-E-Y-) может оказаться применимым для лечения рассеянного склероза, поскольку содержит те же аминокислоты (однако в неслучайной конфигурации), что и Копаксон, и проявляет тот же эффект в отношении секреции TNF макрофагами.
Пример 7 - подавление энзиматической активности тромбина
1. Циклические олигопептиды со следующими структурами синтезировали, как описано выше, и готовили в форме комплекса с циклодекстрином в концентрации 1 мг/мл в растворе солей Хэнкса (Hanks Balanced Salts Solution), используя процедуру, описанную в общих чертах в примере 6.
(i) цикло(-R-E-Σ-S-R-E-R-Σ-S-E-)
(ii) цикло(-A-K-Σ-E-Y-K-A-Σ-Y-E-)
(iii) цикло(-dF-R-C-S-dF-R-C-S-)
(iv) цикло(-dF-S-C-R-dF-S-C-R-)
Все аминокислотные остатки находились в L-форме, если не указано иначе.
Все аминокислотные остатки связаны пептидными связями.
Где R, E, S, Y, K и A обозначают аминокислотные остатки, образующие эпитоп, Σ обозначает ассоциирующую функциональную группу, присоединенную к ассоциирующему аминокислотному остатку, где ассоциирующая аминокислота представляет собой L-альфааминокарбоксикислоту и ассоциирующая функциональная группа представляет собой остаток боковой цепи, состоящий из линейной алифатической цепи, содержащей десять атомов углерода, и С обозначает цистеин, где цистеины обоих колец находятся в окисленной форме в составе внутреннего мостика.
2. По 20 мкл раствора тромбина (0,01 мг/мл) добавляли в лунки 394-луночного микропланшета и смешивали с 60 мкл раствора циклического олигопептида.
3. В каждую лунку добавляли по 20 мкл субстрата бок-бета-бензил-Asp-Pro-Arg-7-амидометилкумарин гидрохлорида (0,01 мг/мл) и измеряли время образования субстрата.
4. Из результатов, приведенных в таблице ниже, видно, что изученные циклические олигопептиды проявляли различные эффекты по отношению к ингибированию протеолитической активности тромбина, и что различия в их активности обусловлены природой и комбинацией аминокислотных остатков в составе кольца. Очевидно, что при правильном подборе аминокислотных остатков, основываясь на шаблоне циклического олигопептида с конформационными ограничениями, можно получить достаточно жесткие структуры, могущие влиять на активность ферментов.
Соответственно, циклические олигопептиды согласно настоящему изобретению, способные ингибировать протеолитическую активность тромбина могут использоваться для лечения заболеваний, где протеазная активность является осложняющим фактором, включая сердечно-сосудистое заболевание, болезни кровообращения и СПИД.
|
Из таблицы видно, что некоторые циклические олигопептиды обладали большей активностью, чем другие, в зависимости от порядка аминокислотных остатков в каждом домене.
Пример 8 - подавление активности TNF циклическими олигопептидами, содержащими два различных эпитопа.
1. Получали два циклических олигопептида, имеющих следующие структуры:
(i) цикло(-dF-S-Σ-Q-dL-S-Σ-R-)
и
(ii) цикло(-dF-S-Σ-L-dQ-S-Σ-R-)
все аминокислотные остатки находились в L-форме, если не указано иначе.
Все аминокислотные остатки связаны пептидными связями.
где Q, L, S, R и F обозначают аминокислотные остатки, образующие эпитоп, Σ обозначает ассоциирующую функциональную группу, присоединенную к ассоциирующему аминокислотному остатку, где ассоциирующая аминокислота представляет собой L-альфааминокарбоксикислоту и ассоциирующая функциональная группа представляет собой остаток боковой цепи, состоящий из линейной алифатической цепи, содержащей десять атомов углерода.
Эти циклические олигопептиды в виде раствора в транскутоле с добавлением циклодекстрина, как описано в примере 4, с конечной концентрацией пептида 1 мг/мл и циклодекстрина 20 мг/мл.
2. Клетки линии J774A.1 (макрофагальная клеточная линия) рассевали во все лунки 24-луночного планшета с частотой рассева 3×105 клеток/мл на лунку (1 мл культуральной среды RPMI 1640 на лунку) и инкубировали в течение ночи при 37°С и 5% CO2 в атмосфере.
3. На следующий день растворы согласно стадии 1 добавляли в лунки, содержащие клетки согласно стадии 2, так чтобы конечная концентрация составляла 50, 25, 12,5, 6,25, или 3,125 мкг/мл циклического олигопептида, по три лунки на каждую концентрацию. Также в другие лунки добавляли циклодекстрин в концентрации 1, 0,5, 0,25, 0,125 и 0,0625 мкг/мл. Оставшиеся лунки оставляли для контроля. После добавления планшет инкубировали в течение 4 часов при 37°С.
4. Липополисахарид из штамма 0111 B4 E. coli добавляли в лунки, содержащие раствор циклического олигопептида и в три лунки, не содержащие пептида. Конечная концентрация липополисахарида составляла 0,1 мкг/мл.
5. планшет инкубировали в течение ночи, и на следующий день супернатанты тестировали на присутствие TNF с использованием коммерческого набора реагентов для иммуноферментного анализа.
Из полученных результатов, приведенных в таблице ниже, видно, что циклические олигопептиды, содержащие два различных эпитопа, один из которых состоит из аминокислотных остатков F, R и S, способны ослаблять секрецию TNF клетками J774 в зависимости от дозы.
|