Результат интеллектуальной деятельности: КОМПОЗИЦИЯ (АРАБИНО)КСИЛАН-ОЛИГОСАХАРИДОВ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к композициям, содержащим (арабино)ксилан-олигосахариды, которые, в частности, могут применяться в качестве ингредиентов пищевых продуктов или напитков или в качестве пищевых добавок, а также к способам получения таких композиций. Изобретение, кроме того, относится к применению указанных композиций для укрепления здоровья желудочно-кишечного тракта людей посредством добавления указанных композиций к их рациону.
Предшествующий уровень техники
Арабиноксилан (AX), также именуемый пентозаном, представляет собой основной компонент клеточной стенки многих видов растений. Например, в зернах злаков AX содержится в количестве 5-10% от сухой массы зерен. В целом, AX из злаковых состоит из основной цепи бета-(1-4)-связанных остатков D-ксилопиранозила (ксилозы), некоторые из которых моно- или ди-замещены остатками альфа-L-арабинофуранозила (арабинозы) (Izydorczyk and Biliaderis, 1995). Отношение арабинозы к ксилозе (средняя степень замещения арабинозы) в злаковом AX находится в диапазоне от 0,10 до более чем 1,0, в зависимости от ткани и вида растения. Кроме того, к остаткам ксилозы могут быть присоединены в небольшом количестве такие заместители, как боковые цепи ацетила, альфа-глюкуронила, альфа-4-О-метилглюкуронила, галактуронила, ксилозила, рамнозила, галактозила или глюкозила, или боковые цепи коротких олигосахаридов (Izydorczyk and Biliaderis, 1995; Andersson and Aman, 2001). Гидроксикоричные кислоты, главным образом, феруловая кислота и, в меньшей степени, дегидродиферуловая кислота, п-кумаровая кислота или синаповая кислота, также присутствуют в качестве заместителей, и они в целом связаны с положением С-(О)-5 концевых единиц арабинозы (Izydorczyk and Biliaderis, 1995; Andersson and Aman, 2001). С диетической точки зрения, арабиноксилан вызывает повышенный интерес, так как было показано, что некоторые типы олигосахаридов, полученных ферментным или химическим расщеплением арабиноксилана, проявляют пребиотические свойства (WO2006/002495; Courtin et al., 2008).
Пребиотики представляют собой соединения, обычно олигосахариды, которые не могут расщепляться ферментами верхних отделов желудочно-кишечного тракта, но избирательно сбраживаются некоторыми типами кишечных бактерий в толстой кишке (Gibson and Roberfroid, 1995; Roberfroid, 1988; Van Loo, 2004). Прием внутрь пребиотиков вызывает сдвиг состава кишечной бактериальной популяции, обычно характеризуемый относительным увеличением содержания видов Lactobacillus и Bifidobacterium. Этот сдвиг кишечной микрофлоры связан с улучшенным общим состоянием здоровья, снижением частоты кишечных инфекций, улучшением всасывания минералов и подавлением инициации развития рака толстой кишки (Van Loo, 2004; Macfarlane et al., 2006).
Переваривание пребиотиков толстокишечными бактериями вызывает продукцию короткоцепочечных жирных кислот (SCFA), таких как ацетат, пропионат, бутират и лактат, которые действуют в качестве электронных стоков дыхания в анаэробной среде кишечника. Присутствие SCFA в кишечнике способствует более низкому рН, лучшей биодоступности кальция и магния и ингибированию потенциально вредных бактерий (Teitelbaum and Walker, 2002; Wong et al., 2006). Представляется, что среди SCFA самый большой интерес в качестве предпочтительного источника энергии для колоноцитов представляет бутират (Roediger, 1982), он стимулирует эпителиальные клетки толстой кишки, посредством этого увеличивая абсорбционную способность эпителия (Topping and Clifton, 2001), и ингибирует рост клеток карциномы толстой кишки и in vitro, и in vivo (Cheppach et al., 1995). Представляется, что подавляющие рак свойства пищевых волокон коррелируются с их способностью генерировать бутират после толстокишечного переваривания (Perrin et al., 2001).
Селективная стимуляция пребиотиками определенных толстокишечных бактерий, таких как молочнокислые бактерии, и бифидобактерии, которые обычно используют сахаролитические пути для обеспечения их энергетических нужд, в некоторых случаях параллельно сопровождается подавлением переваривания белка в толстой кишке (van Nuenen et al., 2003; De Preter et al., 2004; Geboes et al., 2005). Сниженное переваривание белка в толстой кишке представляет собой желательный исход, поскольку пути разрушения аминокислот в бактериях приводят к продукции потенциально токсичных катаболитов, таких как аммиак, амины, фенолы, индолы и тиолы, некоторые из которых были причастны к развитию рака кишечника (Bone et al., 1976; Johnson, 1977; Visek 1978) и к обострению таких заболеваний, как язвенный колит (Ramakrishna et al., 1991).
Было показано, что композиции ксило-олигосахаридов (XOS, олигосахаридов, состоящих из β-1,4-связанных единиц D-ксилопиранозила) с преобладанием олигосахаридов со степенью полимеризации (DP) 2-3 (ксилобиоза и ксилотроза), вызывают значительное увеличение уровня бифидобактерий и SCFA в фекалиях и слепой кишке крыс (EP 0265970B1; Campbell et al., 1997; Hsu et al., 2004) и ободочной кишке людей (Okazaki et al., 1990). Такие богатые ксилобиозой композиции XOS также подавляют ранние симптомы вызванного химическими веществами канцерогенеза толстой кишки у крыс (Hsu et al., 2004) и усиливают всасывание кальция в толстой кишке (Toyoda et al., 1993). Было также показано, что композиция, преимущественно состоящая из арабиноксило-олигосахаридов (AXOS) с DP (степенью полимеризации) 3-5 (арабинозилксилобиоза, арабинозилксилотриоза, арабинозилксилотетраоза и диарабинозилксилотетраоза), увеличивает уровни бифидобактерий в кишечниках крыс и мышей (Yamada et al., 1993). Эксперименты, описанные в документе WO2006/002495, доказали, что AXOS с промежуточной средней DP (avDP) в диапазоне от 5 до 50, обладают лучшими пребиотическими свойствами, чем AXOS с более высокой avDP и менее сладкие, чем композиции AXOS с более низкой avDP. Добавление таких композиций AXOS к рациону вызывает значительное увеличение количества бифидобактерий, присутствующих в слепой кишке кур, слепой кишке крыс и фекалиях людей (WO2006/002495).
Для оптимальных эффектов укрепления здоровья, кроме того, желательно, чтобы гидроксикоричные кислоты, такие как феруловые кислоты, были связаны с боковыми цепями арабинозы соединений AXOS. Ферулоилированные AXOS обладают антиоксидантными свойствами благодаря присутствию остатков феруловой кислоты, связанных сложноэфирной связью (Ohta et al., 1997; Katapodis et al., 2003; Yuan et al., 2005), а хорошо известно, что антиоксиданты оказывают на состояние здоровья благоприятные эффекты (Ratnam et al., 2006). Сложноэфирные связи, которые связывают гидроксикоричные кислоты с боковыми цепями арабинозы арабиноксиланов, расщепляются в щелочной среде (Rosazza et al., 1995; Lozovaya et al., 1999). В этом отношении содержащая (арабино)ксилан-олигосахарид композиция, описанная Yamada et al., (1993), недостаточно оптимальна, поскольку щелочная обработка, используемая для экстракции арабиноксиланов, ведет к удалению большой фракции боковых цепей феруловой кислоты.
Еще один важный аспект содержащих AXOS композиций, предназначенных для применения в качестве пищевых продуктов, ингредиента пищевых продуктов или пищевых добавок, состоит в том, что он имеет приятный, а более предпочтительно нейтральный вкус, поскольку иначе он может оказывать неблагоприятный эффект на удовлетворение и сенсорное восприятие потребляемого продукта, содержащего эту композицию. Кроме того, в композициях, содержащих (арабино)ксилан-олигосахарид, следует избегать присутствия окрашенных примесей с тем, чтобы композиция не оказывала или оказывала только минимальное влияние на цвет пищевого продукта или продукта в виде пищевой добавки, в состав которого она включена, и после нагревания продукта в виде пищевой добавки, в состав которого она включена, не должны происходить существенные изменения цвета и вкуса.
Целью настоящего изобретения является предоставление композиций (арабино)ксилан-олигосахаридов, содержащих смесь ксило-олигосахаридов и арабиноксило-олигосахаридов, где по меньшей мере часть указанных арабиноксило-олигосахаридов замещены гидроксикоричными кислотами. Причем средняя степень полимеризации и общая средняя степень замещения арабинозы указанных ксило- и арабиноксило-олигосахаридов выбрана для получения оптимальных воздействий на состояние здоровья желудочно-кишечного тракта после приема внутрь соответствующих количеств указанных олигосахаридов. В то же время указанный ингредиент пищевых продуктов имеет нейтральный вкус и белый или слегка не совсем белый цвет, которые устойчивы во время термической обработки ингредиента. Эта термическая устойчивость органолептических и цветовых свойств ингредиента особенно полезна при получении подвергнутых термической обработке пищевых продуктов, обогащенных такой смесью ксило-олигосахаридов и арабиноксило-олигосахаридами.
Сущность изобретения
Настоящее изобретение предоставляет композиции (арабино)ксилан-олигосахаридов, экстрагированные из растительного материала, содержащего арабиноксилан. Эти композиции (арабино)ксилан-олигосахаридов особенно полезны в качестве ингредиентов пищевых продуктов или напитков или в качестве пищевых добавок и оптимизированы для обеспечения оптимальных благоприятных воздействий на здоровье и в то же самое время вполне подходят для переработки в разнообразные пищевые продукты, в частности термически обработанные пищевые продукты. Изобретение, кроме того, предоставляет способы получения композиций (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением, в частности композиций, содержащих низкое количество азота и имеющих низкое содержание клейковины.
Подробное описание
Список чертежей
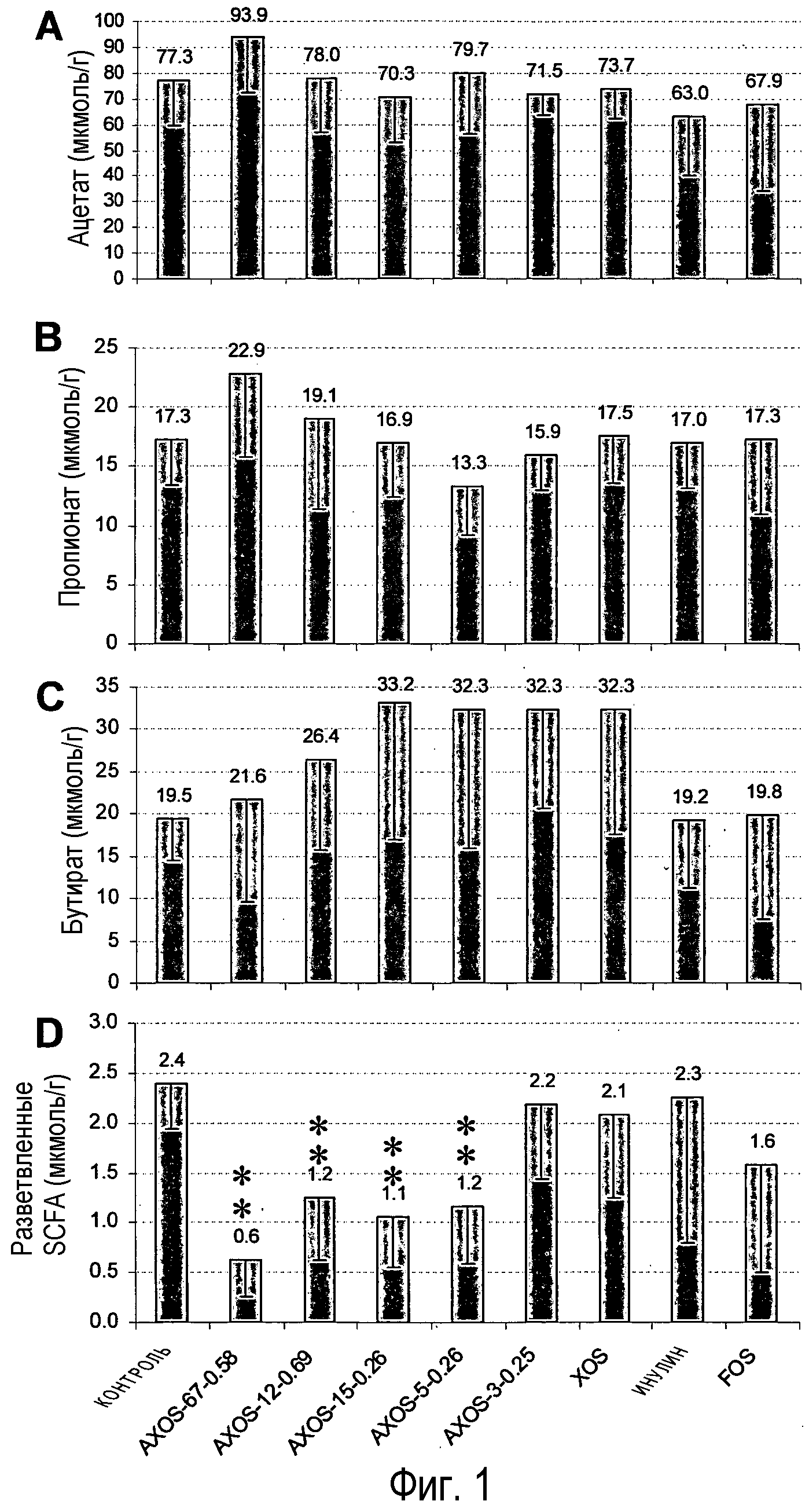
Фиг.1: Воздействие различных олигосахаридов на уровень ацетата (А), пропионата (В) и бутирата (С) суммарное количество изовалериата и изобутирата (D) в слепой кишке крыс после 14 дней кормления. Столбцы, отмеченные одной или двумя звездочками, значимо отличаются от контрольной группы соответственно при p<0,05 или p<0,01. Номера над столбцами представляют средние величины измерений, и столбцы указывают стандартное отклонение.
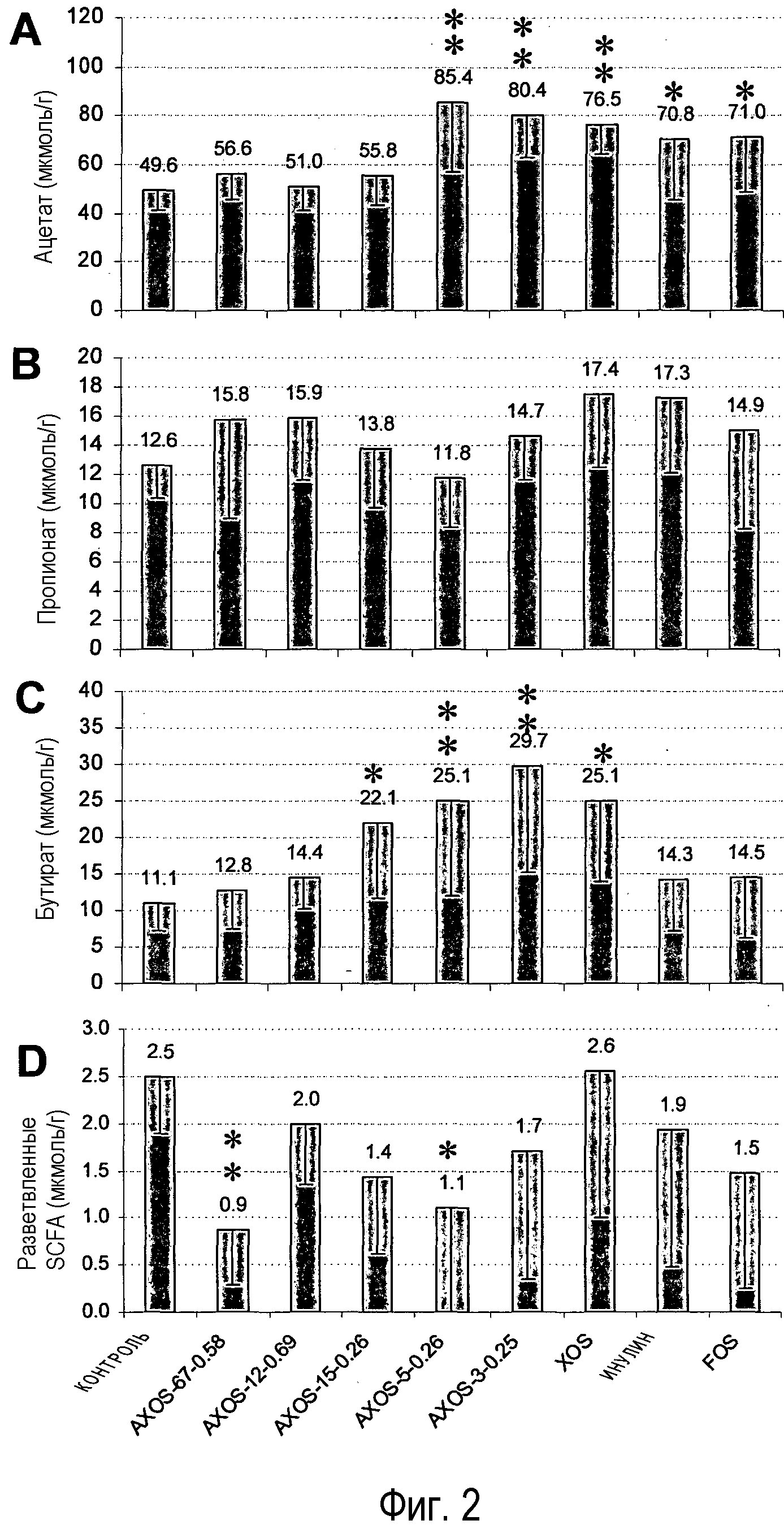
Фиг.2: Воздействие различных олигосахаридов на уровень ацетата (А), пропионата (В) и бутирата (С) суммарное количество изовалериата и изобутирата (D) в ободочной кишке крыс после 14 дней кормления. Столбцы, отмеченные одной или двумя звездочками, значимо отличаются от контрольной группы соответственно при p<0,05 или p<0,01. Номера над столбцами представляют средние величины измерений, и столбцы указывают стандартное отклонение.
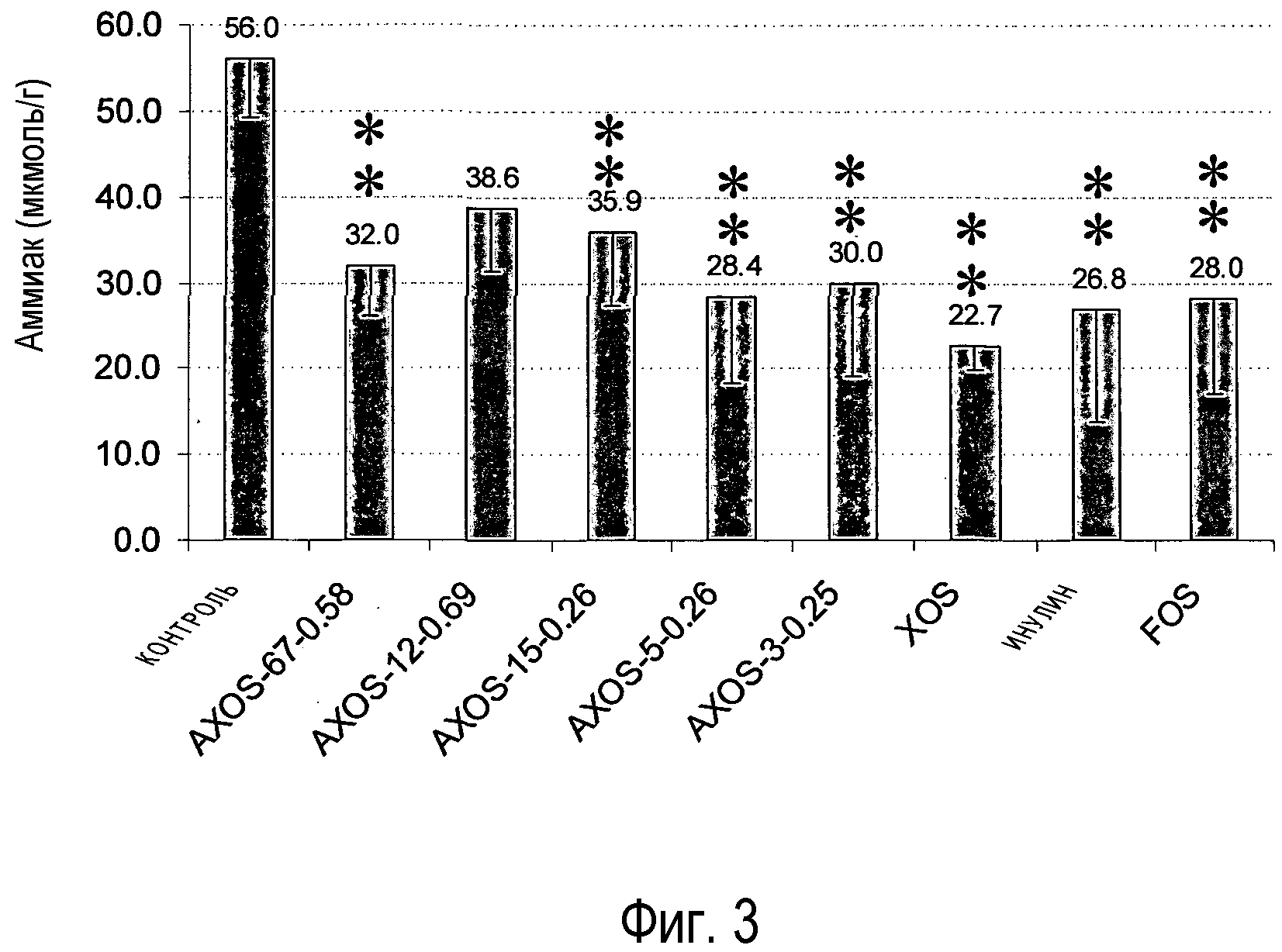
Фиг.3: Воздействие различных олигосахаридов на уровень аммония в слепой кишке крыс после 14 дней кормления. Столбцы, отмеченные одной или двумя звездочками, значимо отличаются от контрольной группы соответственно при p<0,05 или p<0,01. Номера над столбцами представляют средние величины измерений, и столбцы указывают стандартное отклонение.
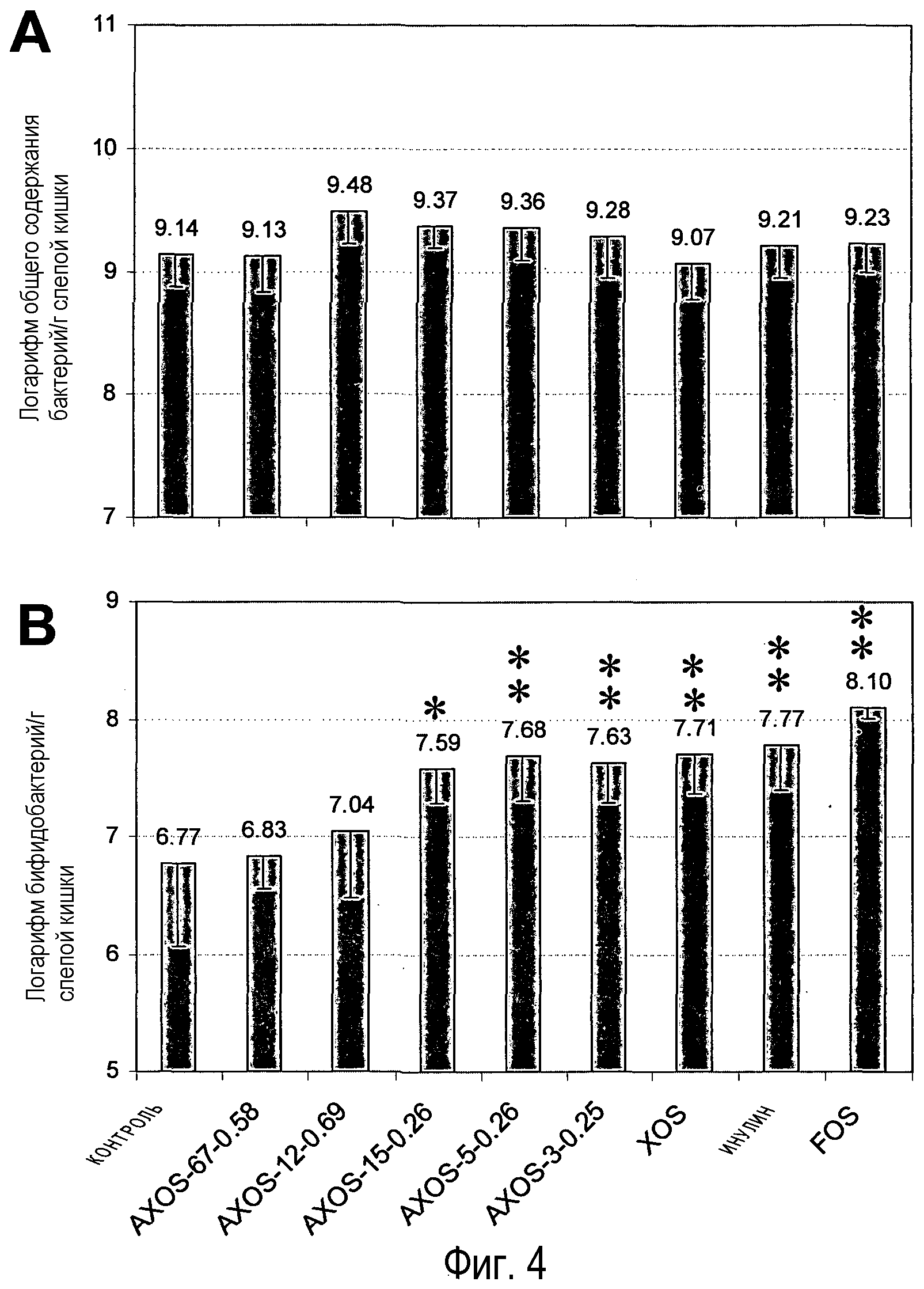
Фиг.4: Воздействие различных олигосахаридов на уровень всех бактерий (А) и бифидобактерий в слепой кишке крыс после 14 дней кормления. Столбцы, отмеченные одной или двумя звездочками, значимо отличаются от контрольной группы соответственно при p<0,05 или p<0,01. Номера над столбцами представляют средние величины измерений, и столбцы указывают стандартное отклонение.
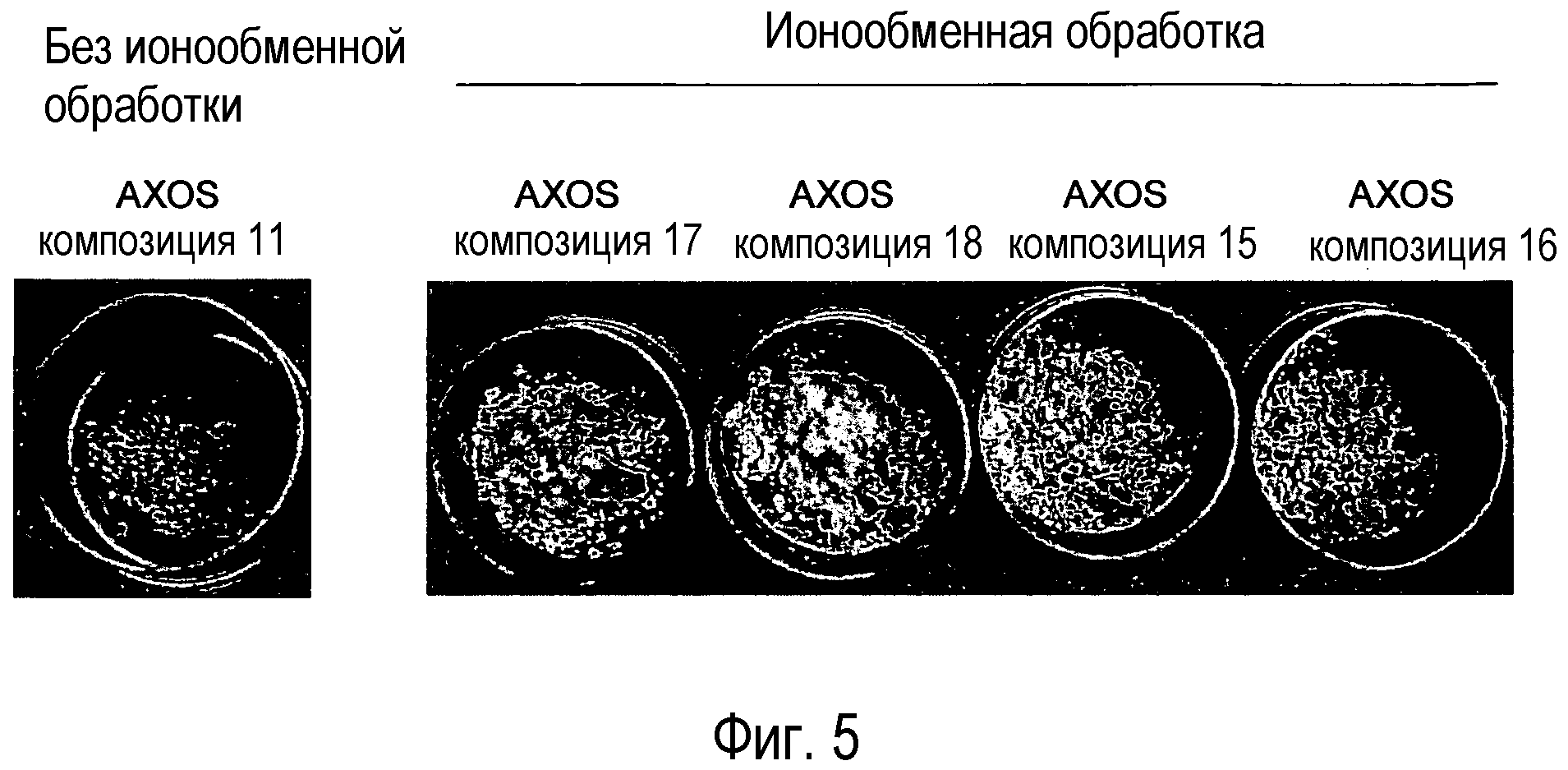
Фиг.5: Фотография 0,5-граммовых количеств композиций (A)XOS 11 (без ионообменной обработки) и композиций (A)XOS 15, 16, 17, 18, которые были подвергнуты соответственно ионообменной обработке № 1, 2, 3 и 4, после воздействия в течение 3 ч при 130°С.
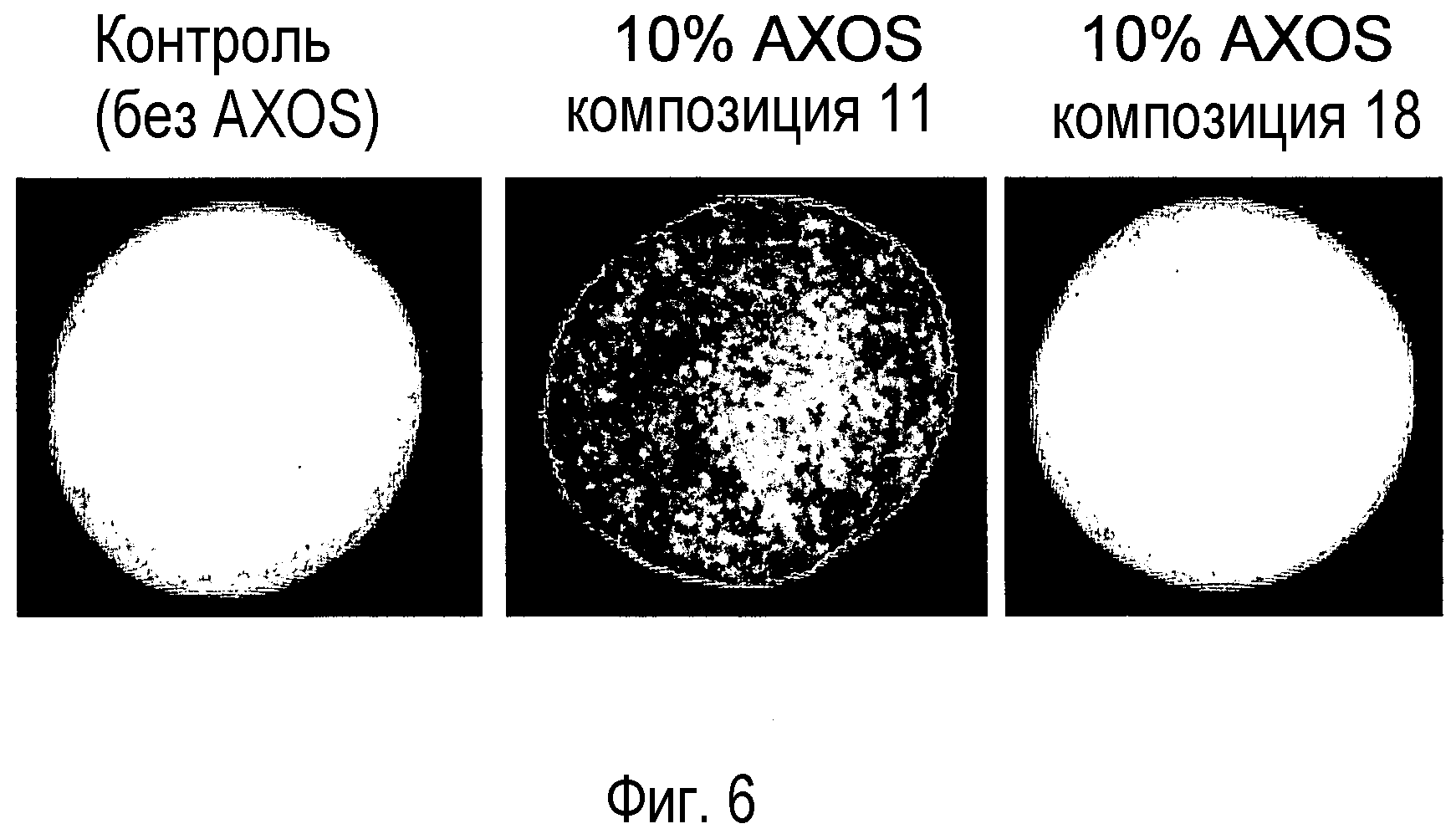
Фиг.6: Фотография печений, приготовленных без (A)XOS, с 10% композиций (A)XOS 11 (без ионообменной обработки) и с композицией (A)XOS 18 (ионообменная обработка № 4).
Описание
Настоящее изобретение предоставляет композиции (арабино)ксилан-олигосахаридов, экстрагированные из растительного материала, содержащего арабиноксилан. Эти композиции (арабино)ксилан-олигосахаридов особенно полезны в качестве ингредиентов пищевых продуктов или напитков или в качестве пищевых добавок и оптимизированы для обеспечения оптимальных благоприятных воздействий на здоровье и в то же самое время вполне подходят для переработки в разнообразные пищевые продукты, в частности термически обработанные пищевые продукты.
Благоприятные воздействия на здоровье композиций (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением связаны с химическими свойствами смеси содержащихся в них ксило- и арабиноксило-олигосахаридов. Исследования на крысах, вскармливавшихся гуманизированными рационами, показали, что оптимальный пребиотический эффект был получен, когда в рационы были включены смеси (арабино)ксилан-олигосахаридов с общей средней степенью полимеризации (avDP) от 4 до 10 и общей средней степенью замещения арабинозы (avDAS) от 0,15 до 0,35. Конкретнее, наблюдалось, что добавление в гуманизированный рацион крыс таких смесей (арабино)ксилан-олигосахаридов привело к более сильному подавляющему воздействию на переваривание белка и более сильному реиммунизирующему эффекту ацетата и бутирата, чем эффект, полученный со смесями (арабино)ксилан-олигосахаридов, имеющими соответственно более низкую и более высокую avDP. Кроме того, добавление в рационы (арабино)ксилан-олигосахаридов с avDAS, превышающей 0,35, не оказывало или оказывало лишь слабые пребиотические эффекты.
Другой аспект благоприятных воздействий композиций (арабино)ксилан-олигосахаридов по настоящему изобретению относится к содержанию в них гидроксикоричной кислоты, а конкретнее к содержанию феруловой кислоты, которая вносит значительный вклад в антиоксидантные свойства композиций по настоящему изобретению. Гидроксикоричные кислоты, главным образом, эстерифицируют боковые цепи арабинозы арабиноксило-олигосахаридов. Эта ковалентная связь с неперевариваемыми олигосахаридами предотвращает высвобождение и абсорбцию гидроксикоричных кислот в верхней части желудочно-кишечного тракта и, таким образом, транспорт антиоксидантной активности по направлению к области ободочной кишки, где гидроксикоричные кислоты могут высвобождаться после переваривания олигосахаридов. Сложноэфирная связь между гидроксикоричными кислотами и боковыми цепями арабинозы является неустойчивой в щелочных условиях (pH>10). Поэтому таких щелочных условий следует избегать в течение всей процедуры и предпочтительно также дальнейшей переработки указанных композиций арабиноксилан-олигосахаридов, если желательно присутствие замещенных гидроксикоричной кислотой арабиноксило-олигосахаридов.
Далее, было обнаружено, что концентрация элементарного азота, по данным определения, например, способами на основе сжигания или способом Кьельдаля, служила хорошим маркером для выявления присутствия нежелательных привкусов и позволяла прогнозировать образование неприятных вкусов и/или сильное окрашивание после нагревания композиций (арабино)ксилан-олигосахаридов. Указанный азот присутствует в композициях (арабино)ксилан-олигосахаридов в составе органических молекул, таких как белки, пептиды и аминокислоты. Предпочтительно содержание азота в композициях (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением составляет 0,16% (масс./масс.) или менее. Ниже этого порога после нагревания композиций не возникало заметных неприятных привкусов, а лишь небольшое окрашивание. Высушенные и порошкообразные композиции (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением имеют величину ΔE* (Good, 2002) ниже чем 15, более предпочтительно ниже чем 12, например ниже чем 10, причем указанная величина ΔE* представляет различие цвета указанного порошка до и после тепловой обработки в печи при 130°С в течение 3 ч.
Таким образом, в качестве первого объекта настоящее изобретение предоставляет композиции (арабино)ксилан-олигосахаридов для применения в качестве ингредиентов пищевых продуктов или напитков или в качестве пищевых добавок. Композиции (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением отличаются тем, что молекулы арабиноксилана, содержащиеся в указанных композициях, имеют avDP от 4 до 10 и avDAS от 0,15 до 0,35. Предпочтительно avDP и avDAS определяются с использованием газовой хроматографии, как описано в примере 1 настоящего изобретения.
Кроме того, предпочтительно, чтобы содержание азота в композициях (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением составляло 0,16% (масс./масс.) или менее. Указанный азот присутствует в композициях в составе органических молекул, таких как белки, пептиды и аминокислоты. Способы измерения содержания элементарного азота хорошо известны в данной области; примерами таких способов являются способы на основе сжигания (Protein (Crude) in Animal Feed: Combustion Method. (990.03) Official Methods of Analysis. 1990. Association of Official Analytical Chemists. 15th Edition), and the Kjeldahl method (Dr. D. Julian McClements. "Analysis of Proteins". University of Massachusetts, http://www- unix.oit.umass.edu/~mcclemen/581Proteins.html).
В предпочтительном варианте осуществления композиции (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением дополнительно содержат некоторое количество феруловой кислоты, соответствующее от 1 до 10% (масс./масс.), например от 1 до 5% (масс./масс.) или от 2 до 45% (масс./масс.) от общего содержания (арабино)ксилан-олигосахаридов (T-AX) указанных композиций. Предпочтительно указанные феруловые кислоты ковалентно связаны с боковыми цепями арабинозы арабиноксило-олигосахаридов в указанной композиции. Предпочтительно общее содержание (арабино)ксилан-олигосахаридов (T-AX) определяется с использованием газохроматографического способа, как описано в примере 2.
В другом предпочтительном варианте осуществления композиции (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением имеют низкое содержание клейковины. Такое низкое содержание клейковины обеспечивает возможность включения этих композиций в пищевые продукта или напитки, которые обычно не содержат клейковину, не вызывая существенного неудобства для людей, которые чувствительны к клейковине. Композиции в соответствии с настоящим изобретением предпочтительно содержат менее чем 1000 м.д., более предпочтительно менее чем 800 м.д., например менее чем 500 м.д. клейковины.
Кроме того, предпочтительно, чтобы содержание золы в композициях (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением было ниже чем 1% (масс./масс.), более предпочтительно ниже чем 0,5% (масс./масс.), например ниже чем 0,3% (масс./масс.) от общей сухой массы композиций.
Предпочтительно композиции (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением предоставляются в виде порошков с содержанием сухого вещества от 90% до 99,9% (масс./масс.) или сиропов с содержанием сухого вещества от 25% до 75% (масс./масс.). Предпочтительно композиции содержат более чем 40% (масс./масс.), наиболее предпочтительно более чем 50% (масс./масс.), например более чем 60% (масс./масс.), наиболее предпочтительно более чем 70% (масс./масс.), например более чем 80% (масс./масс.) (арабино)ксилан-олигосахаридов в расчете на общую сухую массу указанных композиций. Предпочтительно композиции арабиноксилана в соответствии с настоящим изобретением содержат до 90% (масс./масс.). более предпочтительно до 95% (масс./масс.), например до 98% (масс./масс.) (арабино)ксилан-олигосахаридов в расчете на общую сухую массу указанных композиций.
Предпочтительно композиции (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением содержат хорошо сбалансированную смесь ксило-олигосахаридов и арабиноксило-олигосахаридов, обеспечивающих оптимальные пребиотические эффекты. Предпочтительно содержание ксило-олигосахаридов в указанных композициях, выраженное в процентных долях общего содержания (арабино)ксилан-олигосахарида (T=AX), составляет по меньшей мере 30% (масс./масс.), более предпочтительно по меньшей мере 35% (масс./масс.), наиболее предпочтительно по меньшей мере 40% (масс./масс.), например по меньшей мере 45% (масс./масс.), причем указанное общее содержание (арабино)ксилан-олигосахарида (T=AX) предпочтительно определяется с использованием способа газовой хроматографии, как описано в примере 1. Предпочтительно содержание ксило-олигосахарида в указанных композициях, выраженное в виде процентной доли от общего содержания (арабино)ксилан-олигосахарида, составляет ниже 60% (масс./масс.), более предпочтительно ниже 55% (масс./масс.), например ниже 50% (масс./масс.). Предпочтительно степень полимеризации основной цепи ксилана указанных ксило-олигосахаридов варьируется от 2 до 9. Предпочтительно содержание арабиноксило-олигосахаридов в указанных композициях, выраженное в виде процентной доли от общего содержания (арабино)ксилан-олигосахарида, составляет по меньшей мере 40% (масс./масс.), более предпочтительно по меньшей мере 45% (масс./масс.), наиболее предпочтительно по меньшей мере 50% (масс./масс.), например по меньшей мере 55% (масс./масс.). Предпочтительно содержание арабиноксило-олигосахаридов в указанных композициях, выраженное в виде процентной доли от общего содержания (арабино)ксилан-олигосахарида, составляет ниже 70% (масс./масс.), более предпочтительно ниже 65% (масс./масс.), например ниже 60% (масс./масс.). Предпочтительно степень полимеризации основной цепи ксилана указанных арабиноксило-олигосахаридов варьируется от 1 до 9. Кроме того, предпочтительно, чтобы по меньшей мере часть арабиноксило-олигосахаридов, содержащихся в указанных композициях (арабино)ксилан-олигосахаридов, содержала одну или более феруловых кислот, связанных с боковой цепью арабинозы. В предпочтительном варианте осуществления отношение содержания ксило-олигосахаридов со степенью полимеризации основной цепи ксилана от 2 до 9 (XOSDPX2-9) к содержанию арабиноксило-олигосахаридов со степенью полимеризации основной цепи ксилана от 1 до 9 (AXOSDPX1-9) составляет ниже чем 1,5, например ниже чем 1,4, 1,3 или 1,2. Предпочтительно отношение содержания ксило-олигосахаридов со степенью полимеризации основной цепи ксилана от 2 до 9 (XOSDPX2-9) к содержанию арабиноксило-олигосахаридов со степенью полимеризации основной цепи ксилана от 1 до 9 (AXOSDPX1-9) составляет выше чем 0,6, например выше чем 0,65, 0,7, 0,8 или 0,9. Кроме того, предпочтительно, чтобы более чем 90% (масс./масс.), например более чем 95% (масс./масс.) (арабино)ксилан-олигосахаридов, содержащихся в композициях в соответствии с настоящим изобретением, представляли собой или ксило-олигосахариды с основной цепью ксилана со степенью полимеризации от 2 до 9, или арабиноксило-олигосахариды со степенью полимперизации от 1 до 9.
Композиции (арабино)ксилан-олигосахаридов по настоящему изобретению экстрагируют из растительного материала, содержащего арабиноксилан, а более предпочтительно из злакового материала. Однако незлаковые источники, такие как семена видов Plantago или Gossypium, также могут представлять собой богатые источники арабиноксилана. Указанные композиции (арабино)ксилан-олигосахаридов могут содержать изолированные природные (арабино)ксилан-олигосахариды или могут быть получены деполимеризацией или фрагментацией природных арабиноксиланов, или они могут представлять собой структурные аналоги, полученные химическими, ферментными и/или физическими способами. Предпочтительно растительный материал, содержащий арабиноксилан, представляет собой отруби, побочные продукты соцветий, побочные продукты стеблей или отработанные злаки. Более предпочтительно растительный материал, содержащий арабиноксилан, представляет собой отруби, наиболее предпочтительно отруби, полученные их злаков, таких как пшеница, рожь, овес, ячмень, маис, сорго или рис. Наиболее предпочтительно растительный материал, содержащий арабиноксилан, представляет собой пшеничные отруби, например отруби твердой пшеницы.
Второй объект настоящего изобретения относится к способу получения композиций (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением с использованием растительного материала, содержащего арабиноксилан, в качестве исходного материала. Указанный способ включает разминание указанного растительного материала, содержащего арабиноксилан, в воде и обработку его эндоксиланазой в соответствующей концентрации для ферментативной деполимеризации фракции арабиноксиланов, содержащихся в указанном растительном материале. Способ дополнительно включает разделение указанного подвергнутого разминанию растительного материала на нерастворимую в воде фракцию и солюбилизированную водой фракцию, которая содержит солюбилизированные продукты деполимеризации арабиноксилана, включающие ксило-олигосахариды и арабиноксило-олигосахариды. Затем указанную солюбилизированную водой фракцию дополнительно очищают с использованием ионообменной хроматографии, возможно, с предшествующим устранением по меньшей мере части суспендированных твердых веществ из указанной солюбилизированной водой фракции, например, фильтрацией или центрифугированием. Предпочтительно указанная ионообменная очистка включает пропускание указанной солюбилизированной водой фракции через сильнокислотную катионообменную смолу и в последующем через слабощелочную анионообменную смолу. В предпочтительном варианте осуществления способа по настоящему изобретению указанную солюбилизированную водой фракцию сначала пропускают через одну или несколько колонок сильнокислотной катионообменной смолы с последующим пропусканием через одну или несколько колонок слабощелочной анионообменной смолы. После этих двух первых колонок или нескольких колонок могут проводиться повторные пропускания через сильнокислотные катионообменные смолы и слабощелочные анионообменные смолы. Последняя колонка может необязательно представлять собой колонку со смешанным сорбентом, содержащую анионообменную смолу и катионообменную смолу. Предпочтительно, чтобы сильнокислотная катионообменная обработка выполнялась при температуре выше чем 30°С, предпочтительно выше чем 40°С, например выше чем 45°С. К удивлению, ионообменная обработка оказалась более эффективной для удаления белков клейковины из указанных композиций (арабино)ксилан-олигосахарида, когда сильнокислотная катионообменная обработка выполнялась при температурах выше 30°С, например выше 50°С. Предпочтительно сильнокислотная катионообменная обработка выполняется при температуре ниже чем 90°С, предпочтительно ниже чем 80°С, например ниже чем 70°С, или ниже чем 65°С. Предпочтительно слабощелочная анионообменная обработка выполняется при температуре 20°С или выше, например выше чем 25°С. Предпочтительно слабощелочная анионообменная обработка выполняется при температуре ниже чем 70°С, предпочтительно ниже чем 60°С, например ниже чем 50°С. Кроме того, наблюдалось, что удалению содержащего азот материала из указанной солюбилизированной водой фракции способствовало поддержание рН сильнокислотной катионообменной смолы ниже 3,5, более предпочтительно ниже 3, например на уровне рН примерно 2,8. Во избежание деполимеризации (арабино)ксилан-олигосахаридов во время пропускания через сильнокислотную катионообменную смолу предпочтительно, чтобы рН поддерживался на уровне выше 2,0.
После ионообменной очистки указанная солюбилизированная фракция может концентрироваться любым из способов выпаривания или обратного осмоса или обоими этими способами с получением содержащего (арабино)ксилан-олигосахарид сиропа, который может быть необязательно высушен с использованием, например, распылительной сушки для получения порошка.
В предпочтительном варианте осуществления содержащий арабиноксилан растительный материал, используемый в качестве исходного материала в способе экстракции в соответствии с настоящим изобретением, представляет собой растительный материал с удаленным крахмалом. Более предпочтительно указанный растительный материал с удаленным крахмалом получен разминанием содержащего арабиноксилан растительного материала в воде в присутствии соответствующей концентрации α-амилазы и в последующем отделением лишенного крахмала растительного материала от жидкой фракции, содержащей солюбилизированный материал, полученный из крахмала.
Подходящие выпускаемые промышленностью ферментные композиции с преобладающей активностью эндоксиланазы, пригодные для применения в способе в соответствии с настоящим изобретением, включают без ограничения Shearzyme TM 500L (Novozymes), Pentopan TM Mono BG (Novozymes), Pulpzyme TM (Novozymes), Ecopulp TM TX-200A (AB Enzymes), Veron TM 191 (AB Enzymes), Veron TM Special (AB Enzymes), Multifect TM CX 12 L (Genencor/Danisco), Grindamyl TM H640 (Danisco) и GrindamylTM Powerbake TM (Danisco). Стадия гидролиза арабиноксилана включает инкубацию в течение соответствующего периода времени, такого как, без ограничения, от 1 ч до 24 ч, кашицеобразной суспензии при величинах температуры и рН, рекомендуемых разработчиком промышленно производимой ферментной смеси, используемой для гидролиза арабиноксилана. Предпочтительно эндоксиланаза представляет собой эндоксиланазу с высокой селективностью по отношению к WU-AX, с фактором субстратной селективности (SSFCHROM), как определено в публикации Moers et al., (2005), которая составляет по меньшей мере 2 или выше, предпочтительно по меньшей мере 3 или выше, например 4 или выше. Эндоксиланаза представляет собой предпочтительно эндоксиланазу семейства 11 гликозил-гидролазы (Henrissat 1991). Ферментные компоненты ферментной композиции могут включать, без ограничения, арабинофуранозидазы, бета-глюканазы, экзоксиланазы, бета-ксилозидазы и/или ксилобиазы.
Третий объект настоящего изобретения относится к способу определения содержания ксило-олигосахаридов со степенью полимеризации основной цепи ксилана от 2 до 9 (XOSDPX2-9) и содержания арабиноксило-олигосахаридов со степенью полимеризации основной цепи ксилана от 1 до 9 (AXOSDPX1-9). Способ включает измерение содержания всей и свободной феруловой кислоты высокоэффективной жидкостной хроматографией (ВЭЖХ) и детекцию поглощением света при 310 нм (Hartmann, G., Piber, M, Koehler, P. Isolation and chemical characterization of water-extractable arabinoxylans from wheat and rye during bread making. Eur Food Res Technol (2005) 221:487-492) и измерение содержания ксило-олигосахаридов высокоэффективной анионообменной хроматографией с импульсной амперометрической детекцией (HPAEC-PAD) в образце после 24-часовой инкубации указанного образца при 90°C в забуференном растворе соответственно при pH 7,0 и pH 2,8. Содержание в % (масс./масс.) сухого вещества XOS со степенью полимеризации основной цепи ксилана от 2 до 9 [% XOSDPX2-9] в образце определяется в соответствии с формулой (a). Содержание в % (масс./масс.) сухого вещества (ферулоилированных) арабиноксило-сахаридов со степенью полимеризации основной цепи ксилана от 1 до 9 [% AXOS DPX1-9] в образце рассчитывали в соответствии с формулой (b).
(a) [% XOSDPX2-9] = [%X2H2О + %X3H2О +... + %X9H2O];
(b) [% (F)AXOSDPX1-9] = [(AHCl-AH2O + 150/194×bFA) × 0,88 + (%XHCl + %X2HCl + %X3HCl +... + %X9HCl) - (%XH2O + %X2H2О + %X3H2O +... + %X9H2O) + (0,907×bFA)].
В указанных выше формулах аббревиатуры соединений с подстрочными обозначениями H2O и HCl относятся к величинам концентрации в виде % (масс./масс.) сухого вещества образца соответствующего соединения соответственно в обработанных водой и обработанных HCl образцах. Фактор 0,88 производит коррекцию на включения воды во время гидролитического высвобождения арабинозы. bFA представляет собой содержание связанной феруловой кислоты (определяемой в виде общего количества феруловой кислоты минус свободная феруловая кислота и выраженной в виде % масс./масс. образца сухого вещества), а bFA×150/194 относится к содержанию ферулоилированной арабинозы (арабинозы, которая эквимолярно соединена со связанной феруловой кислотой). Фактор 0,907 осуществляет коррекцию на включение воды во время щелочного гидролитического высвобождения феруловой кислоты. При расчете XOSDPX2-9 и AXOSDPX1-9 в соответствии с формулами (a) и (b) используются допущения, что (i) разность концентрации X, X2, X3.... X9 между обработанным HCl образцом и обработанным водой образцом возникает в результате опосредованного кислотой высвобождения арабинозы из (F)AXOSDPX1-9; (ii) в образцах, обработанных HCl, не происходит гидролиза связей бета-(1-4)-D-ксилопиранозила; (iii) все гидроксикоричные кислоты в образце присутствуют в форме феруловой кислоты; (iv) вся связанная феруловая кислота соединена с боковыми цепями арабинозы арабиноксило-олигосахаридов.
Четвертый объект настоящего изобретения относится к пищевому продукту или напитку, содержащему композицию (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением, а также к способам получения такого пищевого продукта или напитка, причем указанные способы включают добавление такой композиции (арабино)ксилан-олигосахаридов к указанному пищевому продукту или напитку во время их получения. В предпочтительном варианте осуществления пищевой продукт или напиток содержит от 0,25 до 10 г композиции (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением на порцию. В более предпочтительном варианте осуществления пищевой продукт или напиток содержит от 0,5 до 5 г композиции (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением на порцию. В еще более предпочтительном варианте осуществления пищевой продукт или напиток содержит от 1 до 5 г на порцию композиции (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением. В другом предпочтительном варианте осуществления пищевой продукт или напиток содержит от 0,25 до 10 г на порцию (арабино)ксилан-олигосахаридов в соответствии с настоящим изобретением, имеющих avDP от 4 до 10 и avDAS от 0,15 до 0,35. В более предпочтительном варианте осуществления пищевой продукт или напиток содержит от 0,25 до 5 г на порцию (арабино)ксилан-олигосахаридов, имеющих avDP от 4 до 10 и avDAS от 0,15 до 0,35. В еще более предпочтительном варианте осуществления пищевой продукт или напиток содержит от 1 до 5 г на порцию (арабино)ксилан-олигосахаридов, имеющих avDP от 4 до 10 и avDAS от 0,15 до 0,35. Как указано выше, композиции в соответствии с настоящим изобретение особенно подходят в качестве благоприятной добавки к низкокалорийным пищевым продуктам.
Пищевые продукты или напитки, в которые могут с пользой добавляться композиции (арабино)ксилан-олигосахарида по настоящему изобретению, представляют собой, например, без ограничения, молочные продукты, такие как молоко, йогурт или свежий сыр, безалкогольные напитки, фруктовые соки, фруктовые пасты, пищевые продукты или напитки на основе сои, шоколад, печенье, батончики, конфеты, десерты, такие как десертные пудинги, мясные фарши и корм для домашних животных.
В целом, пищевые продукты, содержащие злаки или материал, полученный из злаков, в качестве ингредиента, изначально содержат арабиноксиланы. Однако арабиноксиланы, содержащиеся в этих пищевых продуктах, представляют собой или длинноцепочечные натуральные арабиноксиланы с DP более 6000, или частично деполяризованные арабиноксиланы, имеющие DP по меньшей мере от 200 до 300. Поэтому обогащение указанных пищевых продуктов арабиноксиланами в соответствии с настоящим изобретением также улучшает их питательную ценность. Предпочтительно такое обогащение получается добавлением данного количества композиции (арабино)ксилан-олигосахаридов по настоящему изобретению в качестве ингредиента во время получения содержащих злаки пищевых продуктов. Ясно, что такое обогащение приводит к получению содержащих злаки пищевых продуктов, включающих арабиноксиланы, имеющие DP 200 и выше, вслед за популяцией (арабино)ксилан-олигосахаридов, имеющих DP ниже 200, причем указанная популяция характеризуется avDP в диапазоне от 4 до 10 и avDAS в диапазоне от 0,15 до 0,35. Содержащие злаки продукты, в которые могут с пользой добавляться композиции (арабино)ксилан-олигосахаридов по настоящему изобретению, представляют собой, например, без ограничения, выпекаемые продукты, такие как хлеб, кондитерские изделия, такие как торт, готовые к употреблению в пищу злаки, злаковые батончики или макаронные изделия.
Пятый объект настоящего изобретения относится к продукту в виде пищевой добавки, содержащему композицию (арабино)ксилан-олигосахаридов по настоящему изобретению. В предпочтительном варианте осуществления продукт в виде пищевой добавки представляет собой капсулу, таблетку, порошок, сироп или тому подобный продукт. В более предпочтительном варианте осуществления продукт в виде пищевой добавки составляется так, что он обеспечивает возможность ежедневного введения от 0,25 до 10 г (арабино)ксилан-олигосахаридов, имеющих avDP в диапазоне от 4 до 10 и avDAS в диапазоне от 0,15 до 0,35, более предпочтительно от 0,5 до 5 г, например от 1 до 5 г.
Термин «ксило-олигосахариды» в контексте настоящего изобретения относится к поли- или олигосахаридам, состоящим из незамещенных бета-(1-4)-связанных остатков D-ксилопиранозила (ксилозы) со степенью полимеризации от 2 до 100, предпочтительно от 2 до 20.
Термин «арабиноксило-олигосахариды», обозначаемый аббревиатурой AXOS, в контексте настоящего изобретения относится к поли- или олигосахаридам, содержащим основную цепь бета-(1-4)-связанных D-ксилопиранозильных остатков (ксилозы) со степенью полимеризации основной цепи от 1 до 100, предпочтительно от 1 до 20, по меньшей мере с одним остатком альфа-L-арабинофуранозила (арабинозы), соединенным с одним из остатков ксилозы основной цепи, на молекулу. Другие заместители, такие как ацетил, альфа-глюкуронил, альфа-4-O-метилглюкуронил, галактуронил, ксилозил, рамнозил, галактозил или боковые цепи глюкозила, или боковые цепи коротких олигосахаридов могут быть присоединены к одному или более остаткам ксилозы, и гидроксикоричные кислоты, такие как феруловая кислота, дегидроферуловая кислота, п-кумаровая кислота, кофеиновая кислота или синаповая кислота, могут быть присоединены к одной или более единицам арабинозы.
Термин «(арабино)ксилан-олигосахариды», обозначаемый аббревиатурой (A)XOS, в контексте настоящего изобретения относится к ксило-олигосахаридам, или арабиноксило-олигосахаридам, или смесям ксило-олигосахаридов и арабиноксило-олигосахаридов.
Термин «злаковые» в контексте настоящего изобретения относится к растениям ботанического семейства Poaceae, включающего без ограничения такие виды, как пшеница, ячмень, овес, рожь, сорго, маис и рис.
Термин «отруби» в контексте настоящего изобретения означает полученную из зерен злаковых молотую фракцию, обогащенную одной или всеми тканями, выбранными из алейрона, перикарпа, семенной оболочки, чашелистиков и лепестков, по сравнению с соответствующим интактным зерном злака.
Термин «порция» или «размер порции» относится к количеству пищи, обычно потребляемому за один прием средним здоровым индивидуумом. Производители пищевых продуктов обычно указывают размер порции на этикетке, характеризующей питательную ценность пищевого продукта, а в рамках национальных законов о маркировке пищевых продуктов определенные законы обязывают предоставлять конкретные инструкции по определению размера порции для данного пищевого продукта. См., например, код США федеральной инструкции под заголовком 21 - Пищевые продукты и лекарственные средства, §101.12.
Изобретение далее иллюстрируется описанными ниже примерами вариантов осуществления.
Иллюстративный вариант осуществления
ПРИМЕРЫ
Пример 1: Воздействие композиций (A)XOS на кишечные параметры
Материалы и методы
Получение (A)XOS с avDP 67 и avDAS 0,58 (AXOS-67-0,58). Исходный материал для получения AXOS-67-0,58 представлял собой выпускаемый промышленностью концентрат пшеничного пентозана - Wheat Pentosan Concentrate (WPC, Pfeifer & Langen, Dormagen, Germany), химический состав которого был подробно описан Courtin and Delcour (1998). WPC солюбилизировали в деионизированной воде (1:10 масс./об.) и добавляли диоксид кремния в виде водной суспензии (20% масс./об.) до достижения отношения диоксид кремния/белок 7:1. pH смеси доводили до 4,8, используя 0,1 M HCl для получения максимальной адсорбции белков к диоксиду кремния. После 30 мин перемешивания суспензию подвергали вакуумной фильтрации через воронку Бюнхера. Остаток, содержащий диоксид кремния/белок, удаляли. К фильтрату добавляли этанол (95% об./об.) при непрерывном перемешивании до конечной концентрации 65% (об./об.) и после перемешивания в течение дополнительных 30 мин осаждения (24 ч, 4°C) и центрифугирования (10000×g в течение 30 мин при 4°C) полученный остаток растворяли в деионизированной воде и лиофилизировали. Полученный материал гомогенизировали и просеивали через сито с размером отверстий 250 мкм.
Получение (A)XOS с avDP 12 и avDAS 0,69 (AXOS-12-0,69). AXOS-12-0,69 получали, используя в качестве исходного материала выпускаемый промышленностью концентрат пшеничного пентозана Wheat Pentosan Concentrate (WPC, Pfeifer & Langen, Dormagen, Germany). WPC обрабатывали диоксидом кремния для удаления белков, как описано для получения AXOS-67-0,58. Извлеченный фильтрат далее инкубировали при 30°C в течение 24 ч с эндоксилазой семейства гликозид-гидролазы (GHF) 10 из Aspergillus aculeatus (Shearzyme 500L, Novozymes, Bagsvaerd, Denmark) в количестве 29 единиц на 1 г концентрата пшеничного пентозана. После инактивации фермента кипячением (30 мин) полученный раствор охлаждали и подвергали осаждению этанолом. Этанол (95% об./об.) добавляли при постоянном перемешивании до конечной концентрации 65% (об./об.) и после перемешивания в течение еще 30 мин, осаждения (24 ч, 4°C) и центрифугирования (10000×g в течение 30 мин при 4°C) осажденный материал удаляли. К супернатанту добавляли этанол (95% об./об.) при непрерывном перешивании до конечной концентрации 80% (об./об.) и после перемешивания в течение еще 30 мин, осаждения (24 ч, 4°C) и центрифугирования (10000×g в течение 30 мин при 4°C) полученный остаток растворяли в деионизированной воде и лиофилизировали. Полученный материал гомогенизировали и просеивали через сито с размером отверстий 250 мкм.
Получение (A)XOS с avDP 15 и avDAS 0,26 (AXOS-15-0,26). Выпускаемые промышленностью пшеничные отруби (Dossche Mills & Bakery, Deinze, Belgium) использовали в качестве исходного материала для получения AXOS-15-0,26. Суспензию пшеничных отрубей в воде (1:7 масс./об.) сначала обрабатывали термоустойчивой α-амилазой (Termamyl 120LS, Novozymes, Bagsvaerd, Denmark; 1 мкл/г пшеничных отрубей) в течение 90 мин при 90°C для гидролиза крахмала. После охлаждения до 50°C pH суспензии доводили до 6,0, используя концентрированную HCl, и суспензию инкубировали с протеазой (Neutrase 0,8 л, Novozymes, Bagsvaerd, Denmark; 40 мкл/г пшеничных отрубей) в течение 4 ч при 50°C для гидролиза остаточных белков (необязательная стадия при получении). Затем суспензию кипятили в течение 20 мин, фильтровали и фильтрат удаляли. Остаток промывали водой и ресуспендировали в деионизированной воде (1:14 масс./об.). Суспензию инкубировали при постоянном перемешивании в течение 10 ч при 50°C с эндоксиланазой GHF11 из Bacillus subtilis (Grindamyl H640, Danisco, Denmark) при ее содержании в количестве 1,4 единиц на 1 г лишенных крахмала депротеинизированных пшеничных отрубей и в течение еще 10 ч при 50°C после добавления второй дозы эндоксиланазы GHF11 Bacillus subtilis при ее содержании в количестве 1,1 единиц на 1 г лишенных крахмала депротеинизированных пшеничных отрубей. После инактивации фермента кипячением (30 мин) раствор концентрировали до 20% сухого вещества в выпарном аппарате с падающей пленкой жидкости и, наконец, сушили в распылительной сушке.
Получение (A)XOS с avDP 5 и avDAS 0,26 (AXOS-5-0,26). AXOS-6-0,26 получали инкубацией раствора (1:10 масс./об.) AXOS-15-0,26 при 30°C в течение 1 ч с XAA, эндоксиланазой GHF10 из Aspergillus aculeatus (Shearzyme 500L, Novozymes, Bagsvaerd, Denmark) при ее содержании в количестве 75 единиц на 1 г AXOS-15-0,26. После инактивации фермента кипячением (30 мин) раствор лиофилизировали и полученный материал гомогенизировали и просеивали через сито с размером отверстий 250 мкм.
Получение (A)XOS с avDP 3 и avDAS 0,25 (AXOS-3-0,25). Выпускаемые промышленностью пшеничные отруби (Dossche Mills & Bakery, Deinze, Belgium) освобождали от крахмала и белков, как описано для получения AXOS-15-0,26. Лишенные крахмала и белков пшеничные отруби инкубировали при постоянном перемешивании в течение 10 ч при 50°C с эндоксиланазой GHF11 из Bacillus subtilis (Grindamyl H640, Danisco, Denmark) при ее содержании в количестве 1,2 единиц на 1 г лишенных крахмала депротеинизированных пшеничных отрубей и еще в течение 10 ч при 50°C после добавления эндоксиланазы из Aspergillus aculeatus (Shearzyme 500L, Novozymes, Bagsvaerd, Denmark) при ее содержании в количестве 21 единица на 1 г лишенных крахмала и белков пшеничных отрубей. После инактивации ферментов кипячением (30 мин) раствор концентрировали до содержания сухого вещества 20% в выпарном аппарате с падающей пленкой жидкости и, наконец, сушили в распылительной сушке.
Композиция XOS. XOS представлял собой выпускаемую промышленностью композицию олигосахарида Xylooligo-95P (Suntory Ltd., Tokyo, Japan). Этот продукт состоит преимущественно из ксилобиозы, ксилотриозы и ксилотетралозы (Moura et al., 2006).
Композиции FOS и инулина. Композиция фрукто-олигорсахарида (FOS) представляла собой выпускаемый промышленностью продукт Raftilose (Orafti, Tienen, Belgium). Композиция инулина представляла собой выпускаемый промышленностью продукт Raftilin (Orafti, Tienen, Belgium).
Характеристика изолированных композиций
Для характеристики олигосахаридных композиций использовали различные методики.
Общее содержание и содержание восстанавливающего концевого сахара определяли газожидкостным хроматографическим анализом, как описано Courtin et al., (2000). Для определения общего содержания сахара образцы по 20 мг гидролизовали суспендированием в 5 мл 2,0 M трифторуксусной кислоты (2,0 M) и инкубацией при 110°C в течение 60 мин. После гидролиза смесь фильтровали и 3,0 мл фильтрата дополнительно обрабатывали добавлением 1,0 мл раствора внутреннего стандарта (100 мг бета-D-аллозы в 100 мл 50% насыщенного раствора бензойной кислоты), 1,0 мл раствора аммиака (25% об./об.) и 3 капель 2-октанола. Моносахариды восстанавливали в альдиты добавлением 200 мкл раствора боргидрида натрия (200 мг боргидрида натрия в 1,0 мл 2 М аммиака) и образец инкубировали в течение 30 мин при 40°C. Реакцию останавливали добавлением 400 мкл ледяной уксусной кислоты. Для реакции ацетилирования 500 мкл образца, содержащего альдиты, добавляли к 5,0 мл уксусного ангидрида и 500 мкл 1-метилимидазола. Через 10 мин избыток уксусного ангидрида удаляли добавлением к образцу 900 мкл этанола. Альдитцетаты затем концентрировали в органической фазе добавлением воды (10 мл) и раствора гидроксида калия (2 раза 5,0 мл 7,5М раствора с промежуточным отдыхом в течение нескольких минут). Раствор бромфенола синего (500 мкл, 0,04% масс./об.) добавляли в качестве индикатора для водной фазы. Аликвоты по 1 мкл органической фазы, содержащей образованные альдитацетаты, отделяли газовой хроматографией на полярной колонке Supelco SP-2380 (30 м × внутренний диаметр 0,32 мм; толщина пленки 0,2 мкм) (Supelco, Bellefonte, PA, USA) в хроматографе Agilent (Agilent 6890 series, Wilmington, DE, USA), оборудованном автосэмплером, каналом инжекции разделителя (отношение разделения 1:20) и детектором пламенной ионизации. Очищенные моносахариды D-глюкозу, D-маннозу, D-галактозу, D-ксилозу и L-арабинозу обрабатывали параллельно с каждым набором образцов в целях калибровки.
Для определения содержания концевого восстанавливающего сахара образцы по 40 мг суспендировали в 2,5 мл воды с добавлением 500 мкл внутреннего стандарта (100 мг бета-D-аллозы в 100 мл 50% насыщенного раствора бензойной кислоты), 50 мкл раствора аммиака (25% об./об.) и 9 капель 2-октанола. Сахариды восстанавливали до альдитов добавлением 200 мкл раствора боргидрида натрия (200 мг боргидрида натрия в 1,0 мл 2 M аммиака) и образец инкубировали в течение 30 мин при 40°C. Реакцию останавливали добавлением 400 мкл ледяной уксусной кислоты. Аликвоту 2,5 мл образца, содержащего восстановленные сахариды, гидролизовали добавлением 500 мкл трифторуксусной кислоты (99%) и образец инкубировали при 110°C в течение 60 мин. После гидролиза ацетилирование и хроматографический анализ выполняли, как описано выше. Очищенные моносахариды D-глюкозу, D-ксилозу и L-арабинозу обрабатывали параллельно с каждым набором образцов в целях калибровки.
Среднюю степень полимеризации (A)XOS (avDP) рассчитывали, используя формулу (1).
Среднюю степень замещения арабинозы (avDAS или отношение A/X) (A)XOS рассчитывали, используя формулу (2). Общее количество арабиноксилана (T-AX, также упоминаемое ниже в виде содержания (A)XOS) в образцах рассчитывали, используя формулу (3).
(1) avDP = (% арабинозы + % ксилозы)/% восстанавливающей концевой ксилозы;
(2) avDAS = (% арабинозы - 0,7 × % галактозы)/% ксилозы);
(3) T-AX = (% арабинозы - 0,7 × % галактозы)*132/150 + ((132×(avDP-1)+150))/(150 × avDP) × % ксилозы.
Вычитание % галактозы в формулах (2) и (3) подразумевается как коррекция на содержание растворимого арабиногалактана в злаках.
Содержание влаги и золы анализировали в соответствии со способами, утвержденными Американской Ассоциацией Химии Злаков AACC 44-19 и 08-01 (Approved Methods of the American Association of Cereal Chemist, 10th edition. 2000. The Association, St. Paul, MN, USA).
Содержание азота и выведенные величины содержания белков определяли в соответствии со способом сжигания Dumas с использованием автоматизированной системы белкового анализа Dumas (EΞAS varioMax N/CN, EIt, Gouda, The Netherlands), который выполняет адаптацию принятого в медицине и фармации способа определения содержания белков Ассоциации Официальных Химиков-Аналитиков AOAC (Association of Official Analytical Chemists. Official Methods of Analysis, 16th edition. 1995. Method 990.03. AOAC Washington DC, USA). Содержание белка выводили умножением содержания азота на фактор 5,7.
Определение активности ксиланолитических ферментов. Активность эндоксиланазы определяли, используя нерастворимый арабиноксилан, поперечно сшитый азурином (таблетки Xylazyme AX, Megazyme, Bray, Ireland), как описано в листке технических данных Megazyme Data Sheet 9/95. Ферменты Grindamyl H640 (Danisco, Copenhagen, Denmark) и Shearzyme 500L (Novozymes, Bagsvaerd, Denmark) анализировали в соответствующих разведениях в 25 мМ буфере ацетата натрия, pH 4,7, при 40°C в течение 10 мин. Спектральную поглощательную способность при 590 нм измеряли спектрофотометром УФ/видимого светового излучения Ultraspec III (Pharmacia Biotech, Uppsala, Sweden). Одна Единица (U) ферментной активности представляла собой количество фермента, требуемое для получения спектральной поглощательной способности 1,0 после 10 мин при 590 нм в условиях количественного анализа.
Анализ короткоцепочечных жирных кислот. Во флаконы, содержащие кишечные образцы (2 г), добавляли следующие вещества: 0,5 мл 9,2 M серной кислоты, 0,4 мл 0,75% (об./об.) 2-метилгексаноевой кислоты (внутренний стандарт), 0,4 г NaCl и 2 мл простого диэтилового эфира. После встряхивания флаконов в течение 2 мин флаконы центрифугировали (3 мин при 3000×g) и фазу простого диэтилового эфира переносили в стеклянные флаконы. Фазу простого диэтилового эфира, содержащую органические кислоты, анализировали на газожидкостном хроматографе (Di200, Shimadzu), оборудованном колонкой EC-1000 Econo-Cap (Alltech, Laarne, Belgium; размеры: 25 м × 0,53 мм, толщина пленки 1,2 мкм; модифицированный кислотой полиэтиленгликоль в качестве жидкой фазы) и пламенным ионизационным детектором. Азот использовали в качестве газа-носителя при скорости потока 20 мл/мин и температуру колонки и температуру инжектора устанавливали соответственно на уровни 130 и 195°C. Величины концентрации SCFA рассчитывали на основании стандартов с известными концентрациями различных кислот. 2-Метилгексаноевую кислоту использовали в качестве внутреннего стандарта.
Анализ аммония. Аммоний в кишечных образцах освобождали в виде аммиака добавлением MgO (0,4 г на 1 г образца) и проводили перегонку высвободившегося аммиака в раствор борной кислоты (20 г/л), используя автоматической аппарат для перегонки 1062 Kjeltec Auto Distillation apparatus (FOSS Benelux, Amersfoort, The Netherlands). Затем содержание аммиака определяли титрованием с использованием 665 Dosimat (Metrohm, Berchem, Belgium) и 686 Titroprocessor (Metrohm).
Микробиологический анализ путем количественной PCR. Экстракцию метагеномной ДНК из образцов слепой кишки выполняли с использованием набора для анализа ДНК QIAamp DNA Stool Mini kit (Qiagen, Venlo, The Netherlands) в соответствии с инструкциями изготовителя и начиная с 0,2 г образца. Величины концентрации ДНК измеряли спектрофотометрически, используя спектрофотометр NanoDrop ND-1000 (Isogen, IJselstein, The Netherlands). Амплификацию ДНК выполняли в реакционных смесях по 25 мкл, используя буферы, поставляемые с набором qPCR Core Kit для SYBR® Green I, как описано поставщиком (Eurogentec, Liege, Belgium) в 96-луночных реакционных планшетах MicroAmp Optical с оптическими колпачками (PE Applied Biosystems, Nieuwerkerk a/d Ijssel, The Netherlands), используя прибор ABI Prism SDS7000 (PE Applied Biosystems). Прямые праймеры 338f (Lane et al., 1991) и 518r (Muyzer et al., 1993) использовали в концентрации 0,3 мкМ для выявления копий генов 16S рибосомной РНК из всех бактерий с использованием следующей температурной программы PCR: 50°C в течение 2 мин, 95°C в течение 10 мин с последующими 40 циклами при 94°C в течение 1 мин, 53°C в течение 1 мин и 60°C в течение 2 мин. Прямой и обратный праймеры, соответственно 243f и 243r (Rinttila et al., 2004), использовали в концентрации 0,3 мкМ для выявления копий генов 16S рибосомной РНК из бактерий рода Bifidobacterium, используя следующую температурную программу PCR: 50°C в течение 2 мин, 95°C в течение 10 мин, с последующими 40 циклами при 94°C в течение 20 сек, 58°C в течение 30 сек и 60°C в течение 1 мин. Матричную ДНК амплифицировали в трех повторах реакционных смесей. Стандартные кривые для количественного определения Bifidobacteria конструировали на основании амплификации PCR в реальном масштабе времени при реакции в трех повторах на 6 различных разведениях ДНК, экстрагированной из культуры Bifidobacterium breve (штамм LMG11042) и из культуры Lactobacillus brevis (штамм LMG 12023) для количественного определения общего содержания бактерий. Данные PCR в реальном масштабе времени по экспериментальным образцам наносили на график для сравнения со стандартной кривой и корригировали на эффективность экстракции ДНК, используя фактор, состоящий из средней концентрации ДНК во всех образцах, деленный на концентрацию ДНК отдельного экспериментального образца.
Статистические анализы. Воздействие рационов на различные параметры анализировали непараметрическим критерием Kruskal-Wallis при доверительном уровне 95% с использованием программного обеспечения Analyse-it в версии 2.07. В случае если наблюдался статистически значимый эффект для определенного рациона, то различия между каждым из испытуемых рационов и контрольного рациона анализировали с защитой от ошибок Бонферрони при доверительном уровне 95%.
Различные типы (A)XOS, отличающиеся средней степенью полимеризации (avDP) и/или степенью замещения арабинозы (avDAS), получали для определения структурных требований для оптимальных благоприятных воздействий на параметры здорового состояния кишечника. Свойства различных композиций с точки зрения общего содержания арабиноксилана (T-AX), avDAS и avDP показаны в таблице 1. Все композиции имели чистоту по меньшей мере 70% с точки зрения содержания (арабино)ксилана, и их avDP находился в диапазоне от 3 до 67, и их величины avDAS - от 0,25 до 0,69. Эти различные композиции (A)XOS были включены в «гуманизированные» рационы крыс (таблица 2), которые имитировали состав среднего рациона человека, живущего в западных странах, и ими кормили популяции крыс. В целях сравнения выпускаемые промышленностью ксилоолигосахариды (XOS) со средней DP 3 и avDAS 0,09 (таблица 1), и фруктоолигосахариды типа фруктана (FOS) и инулин также включали при испытаниях. Таким образом, крыс использовали в качестве модели in vivo для исследования эффекта включения в рацион различных типов олигосахаридов у млекопитающих.
Девяносто (90) 6-недельных самцов крыс (Wistar) закупали в Elevage Janvier (Le Genest-St-IsIe, France) и содержали в клетках из нержавеющей стали с проволочным дном (по 2 крысы на клетку) в помещении с регулируемой средой (22°C) при цикле света-темноты 14-10 ч. Крысам обеспечивали свободный доступ к воде и «основному гуманизированному рациону» (в виде гранул сухого корма размером 10 мм) в течение 6 дней. Состав «основного гуманизированного рациона» представлен в таблице 2. После 6 дней адаптации к основному гуманизированному рациону крыс методом случайной выборки включали в одну из 9 различных групп обработки (по 10 крыс в группе), и каждой группе обеспечивали свободный доступ к сухому гранулированному корму (с размером гранул 10 мм) одного из следующих рационов в течение 14 дней:
- Основной гуманизированный рацион
- Основной гуманизированный рацион + 5,48% композиции AXOS-67-0,58 ((арабино)ксилан с чистотой 3,9%)
- Основной гуманизированный рацион + 4,49% композиции AXOS-12-0,69 ((арабино)ксилан с чистотой 4,0%)
- Основной гуманизированный рацион + 5,26% композиции AXOS-15-0,26 ((арабино)ксилан с чистотой 3,8%)
- Основной гуманизированный рацион + 5,15% композиции AXOS-5-0,26 ((арабино)ксилан с чистотой 3,8%)
- Основной гуманизированный рацион + 4,44% композиции AXOS-3-0,25 ((арабино)ксилан с чистотой 3,6%)
- Основной гуманизированный рацион + 4,61% композиции XOS ((арабино)ксилан с чистотой 3,9%)
- Основной гуманизированный рацион + 4,21% композиции инулина (инулин с чистотой 4,0%)
- Основной гуманизированный рацион + 4,21% композиции FOS (FOS с чистотой 4,0%)
Величины концентрации, указанные в скобках, корригировали на их чистоту по данным расчета содержания в них полимерного AX или содержания фрукто-олигосахарида. Для рационов, содержащих олигосахариды, крахмал в основном гуманизированном рационе был заменен соответствующим количеством олигосахаридной композиции.
Животных взвешивали и потребление корма измеряли 3 раза в неделю. После 14 дней обработки всех животных взвешивали и подвергали эвтаназии передозировкой 5-этил-5-(1-метилбутил)-2,4,6(1H,3H,5H)-пиримидинтриона (Nembutal™). Затем животных вскрывали для сбора содержимого слепой кишки и содержимого ободочной кишки.
Потребление корма в течение первой недели и второй недели периода обработки составляло в среднем соответственно 21 и 21,2 г/крысу/д. Величины массы тела крыс в начале обработки составляли в среднем 252 г и достигли в среднем 311 г и 360 г соответственно после 1 недели и 2 недель обработки (таблица 3). Существенных различий массы тела или суточного потребления корма между различными видами обработки не наблюдали.
Поскольку увеличение содержания SCFA в кишечнике представляет собой признаки сдвигов в микрофлоре кишечника, вызванных потреблением пребиотических соединений (Macfarlane et al., 2006), то концентрацию основных SCFA, ацетата, пропионата и бутирата, измеряли в слепой кишке и ободочной кишке для различных групп обработки. Как показано на фиг.1, уровни ацетата, пропионата и бутирата в слепой кишке значимо не различались между любой из групп обработки олигосахаридами и контрольной группой. Однако имелась тенденция к увеличенному содержанию бутирата в группах, получавших с кормом AXOS-15-0,26, AXOS-5-0,26, AXOS-3-0,25 и XOS, у которых уровни бутирата были на 65%-70% выше, чем у контрольной группы. В ободочной кишке значимое увеличение уровней ацетата наблюдалось у крыс, получавших корм, который содержал или AXOS-5-0,26, AXOS-3-0,25, XOS, инулин или FOS (фиг.2A), в то время как значимые различия в содержании пропионата не наблюдались (фиг.2B). Уровни бутирата в ободочной кишке были значимо увеличены в группах AXOS-15-0,26, AXOS-5-0,26, AXOS-3-0,25 и XOS более чем вдвое по сравнению с контрольной группой (фиг.2C).
Изобутират и изовалерат разветвленных SCFA образуются во время катаболизма разветвленных аминокислот валина, лейцина, изолейцина (Mortensen et al., 1992; Macfarlane and Macfarlane, 1995) и являются индикаторами переваривания белка в кишечнике. Поэтому содержимое слепой и ободочной кишки крыс оценивали на содержание изобутирата и изовалерата разветвленных SCFA. Как показано на фиг.1D, значимое снижение уровней разветвленных SCFA наблюдались в группах AXOS-67-0,58, AXOS-12-0,69, AXOS-15-0,26 и AXOS-5-0,26, но не в других группах (фиг.2D).
Уровни аммония в слепой кишке были значительно снижены во всех группах, получавших с кормом олигосахаридные композиции, за исключением группы AXOS-12-0,69 (фиг.3). Сниженные уровни аммония можно объяснить сниженным перевариванием белка, но также увеличенной ассимиляцией бактериями, вызывающими переваривание углеводородов (Mortensen et al., 1992).
Общее количество бактерий и количество бифидобактерий в слепой кишке измеряли количественной PCR. Ни при одном из видов обработки не наблюдались значимые различия количества всех бактерий (фиг.4A). Однако содержание бифидобактерий в слепой кишке было значительно увеличено у крыс, получавших с кормом любые олигосахаридные композиции, в сравнении с контрольной обработкой за исключением групп AXOS-67-0,58 и AXOS-12-0,69 (фиг.4B). Самое большое увеличение уровня бифидобактерий в слепой кишке наблюдалось в группе FOS, а уровни бифидобактерий в группах AXOS-5-0,26, AXOS-3-0,25, XOS и инулина были одинаковыми и примерно на 1 логарифмическую единицу выше, чем уровни бифидобактерий в контрольной группе. Бифидобактерии оказывали положительное воздействие на состояние здоровья животных и людей и являются компонентами многих пробиотических соединений. Имелся возрастающий интерес к селективному обогащению этих бактериальных популяций внутри желудочно-кишечного тракта в дополнение к непосредственному включению в пищу микробных композиций для содействия или поддержания хорошего состояния здоровья у животных и людей, включая подавляющее воздействие на развитие рака ободочной и прямой кишки (Gibson and Roberfroid 1995).
Полученные результаты указывают на то, что среди тестированных композиций (A)XOS AXOS-5-0,26 проявляет наилучшую комбинацию желательных эффектов на параметры состояния здоровья желудочно-кишечного тракта, то есть, иными словами, повышенные уровни ацетата и бутирата в ободочной кишке, сниженное содержание маркеров переваривания белков в кишечнике (сниженное содержание разветвленных SCFA в ободочной и слепой кишке и сниженные уровни аммиака в слепой кишке) и повышенные уровни бифидобактерий в слепой кишке. Воздействия AXOS-15-0,26 были относительно похожи на воздействия AXOS-5-0,26 за исключением того, что они в целом были менее выражены и что AXOS-15-0,26 не вызывал ни значимого увеличения уровней ацетата в ободочной кишке, ни значимого снижения концентраций разветвленной SCFA в ободочной кишке. Композиции (A)XOS и XOS с более низкой avDP (AXOS-3-0,25 и XOS) вызывали увеличенную продукцию ацетата и бутирата и повышенные уровни бифидобактерий, но не смогли значимо снизить уровни разветвленных SCFA. С другой стороны, композиция (A)XOS с самой высокой avDP, AXOS-67-0,58, была эффективна в подавлении разветвленных SCFA и, следовательно, отклонении баланса от переваривания белка, но она не увеличивала уровни бутирата в ободочной кишке и не стимулировала бифидобактерии. Степень замещения арабинозы (A)XOS оказывает сильное влияние на активность пребиотика, что может быть выведено из сравнения воздействий AXOS-15-0,26 и AXOS-12-0,69, которые имеют одинаковую avDP, но отчетливо различную avDAS. Композиция с самой высокой avDAS, AXOS-12-0,69 не оказывает значимого воздействия на любой из измеряемых параметров за исключением снижения содержания разветвленных SCFA в слепой кишке, в то время как AXOS-15-0,26 стимулирует продукцию ацетата и бутирата в ободочной кишке, повышает содержание бифидобактерий в слепой кишке и снижает уровень аммиака и разветвленных SCFA в слепой кишке. При сравнении с AXOS-5-0,26 олигосахариды на основе фруктана FOS и инулин оказывают одинаковые бифидогенные воздействия, при этом они вызывают только увеличение продукции ацетата SCFA, но не бутирата и неэффективны в снижении уровня разветвленных SCFA.
Композициями (A)XOS с оптимальной комбинацией желательных воздействий на параметры состояния здоровья кишечника являются параметры, имеющие avDP от 4 до 10, и avDAS от 0,15 до 0,35.
Пример 2: Композиции (A)XOS со средней DP от 4 до 10: характеристика содержания феруловой кислоты
Материалы и методы
Получение лишенных крахмала злаковых отрубей. Пшеничные отруби (полученные из сухой вальцовой мельницы) суспендировали в воде (1:8 масс./об.) в резервуаре с перемешиваемым содержимым и комбикорм нагревали до 90°C. Добавляли композицию α-амилазы (Termamyl 120LS, Novozymes, Bagsvaerd, Denmark; 1 мл/кг отрубей) и давали возможность взаимодействовать при непрерывном перемешивании в течение 90 мин при 90°C для гидролиза крахмала. Кашицеобразную суспензию фильтровали и твердый остаток от фильтрования промывали деминерализованной водой при 80°C при отношении объема воды к объему твердого остатка от фильтрования 3:1. Промытый остаток был назван лишенными крахмала злаковыми отрубями. Лишенные крахмала злаковые отруби имели общее содержание арабиноксилана (T-AX) 37% (масс./масс. сухого вещества).
Ржаные отруби (полученные из сухой вальцовой мельницы) суспендировали в воде (1:8 масс./об.) в резервуар с перемешиваемым содержимым и комбикорм нагревали при 90°C. Добавляли композицию α-амилазы (Termamyl 120LS, Novozymes, Bagsvaerd, Denmark; 1 мл/кг пшеничных отрубей) и давали возможность взаимодействовать при непрерывном перемешивании в течение 90 мин при 90°C для гидролиза крахмала. Кашицеобразную суспензию фильтровали и твердый остаток от фильтрования промывали деминерализованной водой при 80°C при отношении объема деминерализованной воды к объему твердого остатка от фильтрования 3:1. Промытый остаток был назван лишенными крахмала ржаными отрубями. Лишенные крахмала ржаные отруби имели общее содержание арабиноксилана (T-AX) 40% (масс./масс. сухого вещества).
Химическая характеристика выделенных композиций. Определение характеристик композиций (A)XOS выполняли, как описано в примере 1. Общее содержание феруловой кислоты в образцах (A)XOS определяли в образцах 30-50 мг, суспендированных в гидроксиде натрия (2 мл; 2 M, лишенном кислорода). Свободное пространство над продуктом в емкости продували азотом и гидролиз связанной феруловой кислоты проводили в течение 18 ч при комнатной температуре. o-Кумариновую кислоту (100 мкл, 100 мг/л) добавляли в качестве внутреннего стандарта и раствор подкисляли хлористоводородной кислотой (1 мл; 25% масс./масс.). Затем раствор экстрагировали 3 раза этилацетатом (3 мл соответственно) и органические фазы объединяли и сушили азотом. Остаток растворяли в метаноле (1 мл) и фильтровали (фильтр с размером пор 0,45 мкм) перед анализом ВЭЖХ. Использовали систему ВЭЖХ Kontron Kroma System 2000 HPLC system (Biotek) с насосным модулем 522, УФ детектором 535 и октадецилсилановой колонкой Hyperclone 5 мкм (C18) (250×4,6 мм; Phenomenex). Система растворителей была следующая: растворитель A, 0,1% (об./об.) трифторуксусная кислота (TFA) в воде, и растворитель B, 0,1% (об./об.) TFA в метаноле. Объем инжекции составлял 100 мкл, скорость потока составляла 0,8 мл/мин, и выявление проводили измерением спектральной поглощательной способности при 310 нм. Элюирование начинали изократически при 35% растворителя B, затем через 45 мин наносили линейный градиент от 35 до 95% растворителя B. Количественное определение было основано на площадях пиков при 310 нм, и калибровочные кривые получали инжекцией стандартных растворов с различными молярными соотношениями феруловой кислоты и внутреннего стандарта (1:5, 1:1, 5:1). Содержание свободной феруловой кислоты в образцах (A)XOS определяли таким же образом, как общее содержание феруловой кислоты, за исключением того, что первоначальную стадию гидролиза в гидроксиде натрия исключали. Содержание связанной (главным образом, связанной со сложным эфиром) феруловой кислоты в образцах (A)XOS рассчитывали вычитанием содержания свободной феруловой кислоты из общего содержания феруловой кислоты.
Определение активности ксиланолитических ферментов. Активность эндоксиланазы определяли с использованием нерастворимого поперечно сшитого азурином арабиноксилана (таблетки Xylazyme AX, Megazyme, Bray, Ireland), как описано в справочном листке технических данных Megazyme Data Sheet 9/95. Ферменты Grindamyl H640 (Danisco, Copenhagen, Denmark), Shearzyme 500L (Novozymes, Bagsvaerd, Denmark), Multifect CX 12 L (Danisco, Copenhagen, Denmark), Ecopulp TX200 A (AB Enzymes, Darmstadt, Germany), Brewlyve AXC 1500 L (Lyven, Colombelles, France) анализировали в соответствующих разведениях в ацетатном буфере 25 мМ ацетата натрия, pH 5,6, при 35°C в течение 10 мин. Спектральную поглощательную способность при 590 нм измеряли спектрофотометром УФ/видимого спектра Uitraspec III (Pharmacia Biotech, Uppsala, Sweden). Одна Единица (U) активности фермента представляла собой количество фермента, требуемое для получения спектральной поглощательной способности 1,0 через 10 мин при 590 нм в условиях анализа.
Определение спектральной поглощательной способности окислительных радикалов (ORAC). Величину ORAC измеряли мониторингом угасания со временем флюоресценции флюоресцеина в присутствии генерирующего пероксильный радикал соединения 2,2'-Аробис (2-метилпропионамидин)дигидрохлорид (AAPH), как описано Ou et al., (2001) и как адаптировано к считывающему устройству микропланшет Huang et al., (2002). Величину ORAC определяли с использованием серии разведений растворимого в воде аналога витамина E, 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновой кислоты (Trolox), в качестве стандарта и выраженную в микромолях эквивалента Trolox (TE) на грамм.
Лишенные крахмала пшеничные отруби и ржаные отруби получали, как описано в разделе «Материалы и методы». Лишенные крахмала композиции отрубей суспендировали в воде в резервуаре с перемешиваемым содержимым в соотношении 1 кг сухого вещества на 10 кг воды и давали возможность взаимодействовать при постоянном перемешивании с композициями ксиланазы. После инкубации с соответствующими ферментами в течение соответствующих периодов и при соответствующих величинах температуры комбикорма фильтровали. Фильтраты нагревали в течение 10 мин при 90°C для инактивации ферментов, центрифугировали при 10000×g и супернатанты концентрировали выпариванием и подвергали распылительной сушке.
Условия инкубации, определенные в таблице 4, оптимизировали для предоставления композиций (A)XOS с avDP от 4 до 10, и avDAS от 0,15 до 0,35. Содержание азота в композициях варьировалось от 1,7% (масс./масс.) для образцов, полученных инкубацией лишенных крахмала пшеничных отрубей с ферментом Brewlyve AXC 1500 L до 0,6% (масс./масс.) для образцов, полученных инкубацией лишенных крахмала пшеничных отрубей с ферментом Multifect CX 12 L. Содержание свободной феруловой кислоты в различных образцах было всегда очень низким, ниже 0,4 мг/г. Отношение содержания связанной (главным образом, сложноэфирной связью) феруловой кислоты к содержанию (A)XOS составило выше чем 1% в образцах, до 3,4% в образцах, полученных инкубацией лишенных крахмала пшеничных отрубей с Brewlyve AXC 1500 L.
Композицию (A)XOS номер 3 (таблица 4) характеризовали в отношении ее антиоксидантной способности с использованием анализа ORAC. Композиция имела величину ORAC 410 мкмоль эквивалента Trolox на грамм.
Определяли содержание свободной и связанной (сложноэфирной связью) феруловой кислоты композиций (A)XOS AXOS-5-0,26, описанной в примере 1. Эта композиция имела содержание свободной феруловой кислоты 0,25 мг/г и отношение содержания связанной феруловой кислоты к содержанию (A)XOS 2,5%.
Пример 3: Удаление мешающих загрязнителей из композиций (A)XOS
Материалы и методы
Характеристика изолированных композиций. Характеристику композиций (A)XOS выполняли, как описано в примерах 1 и 2.
Очистка ионообменной смолой. Ионообменные смолы пищевых сортов Amberlite FPC22 (сильнокислотная катионообменная смола), Amberlite FPA51 (слабоосновная анионообменная смола) и FPA90 (сильноосновная анионообменная смола) закупали у компании Rohm & Haas. Перед использованием катионообменные смолы были доставлены в форме H+, а анионообменные смолы были доставлены в форме OH-. Пропускание растворов (A)XOS через ионообменные смолы осуществляли при 4 объемах слоев в час.
Характеристика цвета изолированных композиций. Для всех определений цвета использовали колориметр (модель Colorquest 45/0 LAV, CQ/UNI-1600, HunterLab, Reston, VA, USA). Прибор калибровали черной и белой калибровочной мозаикой. Колориметр был установлен на условие освещения D65 (среднее дневное освещение) и стандартный обзор 10°. Каждый образец помещали в прозрачную чашку Петри и покрывали белой пластиной. Цвет измеряли в виде цветовых интервалов L*a*b*, разработанных Commission International de I'Eclairage (CIE) в 1976 г. L* представляет собой меру яркости от черного (0) до белого (100); a* описывает красно-зеленый цвет при положительных величинах a*, указывающих на преобладание красного цвета, и отрицательных величинах a*, указывающих на преобладание зеленого цвета; b* описывает желто-синий цвет при положительных величинах b*, указывающих на преобладание желтого цвета, и отрицательных величинах b*, указывающих на преобладание синего цвета. Различия цвета (ΔL*, Δa*, Δb*) оценивали по разности L*, a* и b* между образцом и нагревали в течение 3 ч при 130°C в термостате. Общую разницу цвета (ΔE*) рассчитывали следующим образом (Good, 2002):
ΔE*=[(ΔL*)2+(Δa*)2+(Δb*)2]1/2.
Приготовление печенья. Печенье без (A)XOS готовили из теста, содержащего 100 г мелкомолотой пшеничной муки, 72 г сахара, 45 г маргарина для выпечки, 12 г воды и 2 г гидрокарбоната натрия. Печенье с (A)XOS готовили из теста, содержащего 89 г мелкомолотой пшеничной муки, 64 г сахара, 40 г маргарина для выпечки, 12 г воды, 2 г гидрокарбоната натрия и 23 г (A)XOS. Тесто раскатывали в лист толщиной 4 мм и печенье круглой формы вырезали из теста. Выпечку проводили при 190°C в течение 15 мин.
Композиции (A)XOS со средней DP от 4 до 10, как описано в примере 1 и 2, имеют два недостатка для использования в приготовлении пищи. Во-первых, они имеют неприятный вкус и, во-вторых, после нагревания они дают продукты с проявленным цветом. После нагревания вкус продуктов еще больше портится.
Композицию (A)XOS номер 11 (см. пример 2, таблицу 4) обрабатывали следующими 4 способами:
1) Ионообменная обработка № 1: Пропускание через колонку FPA90 при температуре 20°C и в последующем через последовательно соединенную колонку FPC22 при температуре 20°C (композиция 15).
2) Ионообменная обработка № 2: Пропускание через колонку FPC22 при температуре 50°C и в последующем через последовательно соединенную колонку FPA90 при температуре 35°C (композиция 16).
3) Ионообменная обработка № 3: Пропускание через колонку FPC22 при температуре 20°C, в последующем через последовательно соединенную колонку FPA51 и в последующем через последовательно соединенную колонку FPA90 при температуре 20°C (композиция 17).
4) Ионообменная обработка № 4: Пропускание через колонку FPC22 при температуре 50°C, в последующем через последовательно соединенную колонку FPA51 при температуре 35°C, и в последующем через последовательно соединенную колонку FPA90 при температуре 25°C (композиция 18).
рН композиций, полученных после ионообменной обработки № 1-4, доводили до pH 6,5, композиции концентрировали выпариванием и подвергали распылительной сушке. В последующем композиции анализировали, и результаты показаны в таблице 5. Различные способы ионообменной обработки не оказывали значимого воздействия на avDP и avDAS (A)XOS в композициях, но при этом они увеличивали содержание (A)XOS и снижали содержание минералов и азота в композициях. Ионообменная обработка № 3 и № 4 давала такое же содержание минералов (0,4-0,5% масс./масс. сухого вещества). Самое низкое содержание азота было получено для ионообменной обработки № 4, а именно 0,09% масс./масс. сухого вещества (таблица 5).
Порошки перед или после ионообменной обработки № 1-4 растворяли в воде в количестве 5% (масс./масс.) и представляли в виде зашифрованных слепым методом образцов членам комиссии дегустаторов, состоящей из 12 человек. 12 членов комиссии единодушно (12 из 12) обнаружили, что композиция (A)XOS перед ионообменной обработкой имела самый неприятный вкус. 10 из 12 членов комиссии обнаружили, что композиция после ионообменной обработки № 4 имел самый приятный вкус, тогда как 2 из 12 членов комиссии обнаружили, что самый приятный вкус композиция имела после ионообменной обработки № 3.
Сухие порошки композиций (A)XOS до и после ионообменной обработки № 1-4 нагревали в течение 3 ч при 130°C. Порошок перед ионообменной обработкой проявлял отчетливое коричневое окрашивание после тепловой обработки. Порошок после ионообменной обработки № 4 проявлял наименьшее окрашивание с последующей ионообменной обработкой № 3, тогда как порошки, полученные после ионообменной обработки № 1 и 2, проявляли отчетливое окрашивание в виде коричневых пятен (фиг.5). Цвет композиций количественно определяли в соответствии с цветовым интервалом CIE до и после тепловой обработки в течение 3 ч при 130°C (таблица 6). Количественное определение подтверждает, что композиция № 18 белее, чем композиции 16 и 11 и что ионообменная обработка № 4 снижает окрашивание после тепловой обработки.
Печенье готовили с 10% (масс./масс.) композиции (A)XOS до и после ионообменной обработки № 4. Печенье, приготовленное с композицией (A)XOS перед ионообменной обработкой, проявило отчетливое коричневое окрашивание (потемнение), тогда как печенье, приготовленное с 10% композиции (A)XOS после ионообменной обработки № 4, имело такой же цвет, как печенье без добавления (A)XOS (фиг.6).
Композиция (A)XOS перед ионообменной обработкой имела величину ORAC 370 мкмоль эквивалента Trolox на грамм, тогда как композиция (A)XOS после ионообменной обработки № 4 имела величину ORAC 280 мкмоль эквивалента Trolox на грамм. Это указывает на то, что антиоксидантная способность (A)XOS в значительной степени сохраняется после процедуры очистки. Это также отражено уровнем связанной феруловой кислоты перед и после ионообменной обработки (таблица 5).
Композицию (A)XOS получали обработкой лишенных крахмала пшеничных отрубей, полученных, как описано в примере 2, ксиланазой в условиях, описанных для примера получения номер 4 в таблице 4 (композиция 19). Эту композицию обрабатывали ионообменными смолами следующим образом:
1) Ионообменная обработка № 5: Пропускание через колонку FPC22 при температуре 50°C, затем через последовательно соединенную колонку FPA51 при температуре 20°C (композиция 20)
2) Ионообменная обработка № 6: Пропускание через колонку FPC22 при температуре 20°C, затем через последовательно соединенную колонку FPA51 при температуре 20°C (композиция 21)
рН композиций, полученных после ионообменной обработки № 5-6, доводили до pH 6,5, композиции концентрировали выпариванием и подвергали распылительной сушке. Композиции в последующем анализировали, и результаты показаны в таблице 5. Самое низкое содержание азота получено при ионообменной обработке № 5 (композиция 20), а именно, 0,07% масс./масс. сухой массы (таблица 5). Композиция 20 также проявляла самое низкое окрашивание после тепловой обработки при 130°C (таблица 6). Ионообменная обработки № 5 также приводила к самой низкой концентрации клейковины в конечной композиции (арабино)ксилан-олигосахарида. Концентрация клейковины в экстрактах (арабино)ксилан-олигосахарида перед ионообменной обработкой составляла 24000 м.д. и более, тогда как после обработки № 5 уровень клейковины в композиции составил примерно 900 м.д. сухой массы. Уровни клейковины определяли с использованием иммуноферментного анализа ELISA Eurofins Food BV (Heerenyeen, The Netherlands).
Пример 4: Композиции (A)XOS со средней DP от 4 до 10: характеристика содержания ксило-олигосахарида и арабиноксило-олигосахарида
Материалы и методы
Химические соединения
Моносахариды L-рамнозу, D-ксилозу (X), L-арабинозу (A) и ксилан березовой древесины приобретали у компании Sigma-Aldrich (Bornem, Belgium). Ксилобиозу (X2), ксилотриозу (X3), ксилотетраозу (X4), ксилопентаозу (X5) и ксилогексаозу (X6) получали у компании Megazyme (Bray, Ireland). Ксилогептаозу (X7), ксилооктаозу (X8) и кесилононаозу (X9) и ксилодекаозу (X10), где X7, X8 и X9 получали ксиланолитическим гидролизом ксилана березовой древесины от компании Megazyme (Bray, Ireland) ксиланазой Bacillus subtilis (Grindamyl H640, Danisco, Copenhagen, Denmark) с последующей гель-фильтрацией через две последовательно соединенные колонки, заполненные соответственно матрицей Bio-Gel P4 и Bio-Gel P2 (Bio-Rad, Hercules, CA, USA).
Определение содержания связанной феруловой кислоты в композициях (арабино)ксрилан-олигосахаридов. Общее содержание феруловой кислоты определяли в образцах по 10-50 мг, суспендированных в гидроксиде натрия (5 мл; 2 M, лишенных кислорода). Пространство в резервуаре над раствором продували азотом и гидролиз связанной феруловой кислоты проводили в течение 18 ч при комнатной температуре. o-Кумариновую кислоту (100 мкл, 50 мг/100 мл) добавляли в качестве внутреннего стандарта, и раствор подкисляли хлористоводородной кислотой (4 мл; 4 M). Затем раствор экстрагировали 3 раза этилацетатом (соответственно 3 мл) и органические фазы объединяли и сушили азотом. Остаток растворяли в метаноле (5 мл) и фильтровали (фильтром с размером пор 0,45 мкм) перед анализом ВЭЖХ.
Содержание свободной феруловой кислоты определяли в образце 200 мг, суспендированном в хлористоводородной кислоте (2 мл; 0,1 M). о-Кумариновую кислоту (50 мкл, 50 мг/100 мл) добавляли в качестве внутреннего стандарта. Затем раствор экстрагировали 3 раза этилацетатом (3 мл соответственно) и органические фазы объединяли и сушили азотом. Остаток растворяли в метаноле (2,5 мл) и фильтровали (фильтром с размером пор 0,45 мкм) перед анализом ВЭЖХ.
Систему ВЭЖХ Kontron Kroma System 2000 (Biotek) с насосным модулем 522, детектором УФ 535 и колонкой Superspher 60 RP8 (125×4,0 мм; Merck) с предколонкой ODS2 (25×4,0 мм; Waters) использовали для анализа с помощью ВЭЖХ и общего содержания феруловой кислоты и содержания свободной феруловой кислоты. Объем инжекции составлял 100 мкл, скорость потока была 0,8 мл/мин, и детекцию проводили измерением спектральной поглощающей способности при 310 нм. Растворитель (вода:ацетонитрил:уксусная кислота; 75:25:0,04 об./об./об.) наносили изократически. Количественное определение было основано на площадях пиков при 310 нм и калибровочные кривые получали инжекцией стандартных растворов с различными молярными соотношениями феруловой кислоты и внутреннего стандарта (1:5, 1:1, 5:1). Содержание связанной (главным образом, сложноэфирной связью) феруловой кислоты рассчитывали вычитанием содержания свободной феруловой кислоты из общего содержания феруловой кислоты.
Определение содержания ксило-олигосахарида и содержания (ферулоилированного) арабиноксило-олигосахарида в композициях (арабино)ксилан-олигосахаридов путем HPAEC-PAD
Сухие образцы композиций (арабино)ксилан олигосахарида обрабатывали параллельно следующим образом:
- Раствор необработанного образца: 25 мкл образца растворяли в 90 мл дистиллированной воды в мерной колбе емкостью 100 мл, pH доводили до 7,0 добавлением или 0,1 M NaOH, или 0,1 M HCl и объем доводили до 100 мл добавлением дистиллированной воды.
- Раствор обработанного HCl образца: 30 мл брали из необработанного образца и переносили в пробирку с плоским дном и завинчивающимся колпачком, pH доводили до 2,8 добавлением отмеренного количества 1 M HCl при постоянном перемешивании. Подкисленный раствор нагревали до 90°C на водяной бане и оставляли при 90°С в течение 24 ч в термостате (при закрытых винновых колпачках) и после охлаждения до комнатной температуры pH доводили до 7,0 добавлением отмеренного количества 0,1 M NaOH при постоянном перемешивании.
Легкая кислотная обработка HCl привела к почти количественно определяемому высвобождению боковых цепей арабинозы (A)XOS, в то же время лишь минимально гидролизуя основную цепь ксилана (Swennen et al., 2005). Однако она не вызывала гидролиза сложноэфирных связей между феруловой кислотой и боковыми цепями арабинозы.
Затем из каждого из необработанных и обработанных HCl образцов брали 900 мкл и добавляли к 100 мкл 0,2 мг/мл L-рамнозы (внутренний стандарт). Образцы центрифугировали (10000×g в течение 10 мин) перед высокоэффективной анионообменной хроматографией с импульсной амперометрической детекцией (HPAEC-PAD). С каждым набором максимум из 20 образцов анализировали два калибровочных образца. Первый калибровочный образец содержал известные количества L-рамнозы, D-ксилозы (X), L-арабинозы (A), ксилобиозы (X2), ксилотриозы (X3), ксилотетраозы (X4), ксилопентаозы (X5) и ксилогексозы (X6). Второй калибровочный образец содержал известные количества L-рамнозы, D-ксилозы, ксилогептаозы (X7), ксилооктаозы (X8) и ксилононаозы (X9). HPAEC-PAD выполняли хроматографической системой Dionex ICS-3000 (Sunnyvale, CA1USA). Аликвотные количества образцов (25 мкл) инжектировали на колонку CarboPac PA-100 с предохранительным устройством (25×4 мм), прикрепленную к анионообменной колонке CarboPac PA-100 (250×4 мм). Элюирование (1,0 мл/мин) проводили 100 мМ гидроксида натрия в течение 5 мин с последующим линейным градиентом 0-125 мМ ацетата натрия в 100 мМ гидроксида натрия в течение 30 мин. За градиентом следовало 5-минутное элюирование 400 мМ ацетата натрия в 100 мМ гидроксида натрия для промывания колонки. Элюирование контролировали с использованием электрохимического детектора в импульсном режиме амперометрического выявления для анализа углеводородов.
Для различных типов сахаридов (SA), факторы чувствительности (RF) определяли на основании анализа калибровочного раствора, содержащего известное количество L-рамнозы, L-арабинозы (A), D-ксилозы (X), X2, X3, X4, X5, X6, X7, X8 и X9. L-рамнозу использовали в качестве внутреннего стандарта (IS) для нормализации всех площадей пиков хроматограммы. RF рассчитывается следующим образом:
RF = [(м.д. SA/м.д. IS)×(площадь пика IS/площадь пика SA)].
М.д. SA и м.д. IS в приведенной выше формуле относятся к концентрации в м.д. (мкг/мл) соответственно SA и IS в калибровочном растворе.
Концентрации сахаридов в обработанном водой образце [%SAH2O], выраженные в виде % (масс./масс.) SA в расчете на сухое вещество первоначального образца, рассчитывали по их нормализованным площадям пиков и соответствующим RF следующим образом:
[%SAH2O] = (площадь пика SAH2O/площадь пика ISH2O)×RF×(м.д. IS/м.д. образца)×0,1/(0,9×% образца DM)×100.
«М.д. образца» в приведенной выше формуле относится к концентрации в м.д. (мкг/мл) образца в растворе необработанного образца. М.д. IS в приведенной выше формуле относится к концентрации в м.д. (мкг/мл) L-рамнозы в растворе IS. Факторы 0,1 и 0,9 учитывают разведение раствора IS и основного раствора образца, соответственно, в конечном образце, полученном для HPAEC-PAD. % DM образца представляет собой % сухого вещества (масс./масс.) от первоначального сухого образца.
Концентрации сахаридов в обработанном HCl образце [%SAHCl], выраженные в виде % (масс./масс.) SA в расчете на сухое вещество первоначального образца, рассчитывали по их нормализованным площадям пиков и соответствующим RF следующим образом:
[%SAHCl] = (площадь пика SAHCl/площадь пика ISHCl)×RF×(м.д. IS/м.д. образца)×0,1/(0,9×DFpH×% DM образца)×100.
«М.д. образца» в приведенной выше формуле относится к концентрации в м.д. (мкг/мл) образца в растворе необработанного образца. М.д. IS в приведенной выше формуле относится к концентрации в м.д. (мкг/мл) L-рамнозы в растворе IS. Факторы 0,1 и 0,9 учитывают разведение раствора IS и основного раствора образца, соответственно, в конечном образце, полученном для HPAEC-PAD. DFpH представляют собой фактор разведения, вызванный добавлением HCl и NaOH, выраженный в виде отношения объема добавлением HCl и NaOH к объему после добавления HCl и NaOH. % DM образца представляет собой % сухого вещества (масс./масс.) от первоначального сухого образца.
% (масс./масс.) сухого вещества XOS со степенью полимеризации основной цепи ксилана от 2 до 9 [% XOSDPX2-9] в образце определяется в соответствии с формулой (a). % (масс./масс.) сухого вещества (феруолилированных) арабиноксило-олигосахаридов со степенью полимеризации основной цепи ксилана от 1 до 9 [% (F)AXOSDPX1-9] в образце рассчитывали в соответствии с формулой (b).
(a) [% XOSDPX2-9] = [%X2H2O + %X3H2O +... + %X9H2O]
(b) [% (F)AXOSDPX1-9] = [(AHCl-AH2О+150/194×bFA) × 0,88 + (%XHCl + %X2HCl + %X3HCl +... + %X9HCl) - (%XH2О + %X2H2О + %X3H2О +... + %X9H2О) + (0,907×bFA)]
В указанных выше формулах аббревиатуры соединений с подстрочным указанием H2O и HCl относятся к концентрациям в % (масс./масс.) образца сухого вещества соответствующего соединения в образцах, обработанных водой и HCl, соответственно, определяемым, как изложено в п.4.B и 4.C. Фактор 0,88 корригирует на включение воды во время гидролитического высвобождения арабинозы. bFA представляет собой содержание связанной феруловой кислоты (определяемое как общее содержание феруловой кислоты минус свободная феруловая кислота и выражаемое в виде % масс./масс. сухого вещества), а bFA×150/194 относится к содержанию ферулоилированной арабинозы (арабинозы, которая эквимолярно соединена со связанной феруловой кислотой). Фактор 0,907 корригирует на включение воды во время щелочного гидролитического высвобождения феруловой кислоты. Для этих формул делаются допущения, что (i) разность концентрации X, X2, X3.... X9 между образцом, обработанным HCl, и обработанным водой образцом возникает в результате опосредованного арабинозой высвобождения из (F)AXOSDPX1-9; (ii) в образцах, обработанных HCl, не происходит гидролиза бета-(1-4)-D-ксилопиранозильных связей; (iii) все гидроксикоричные кислоты в образце присутствуют в форме феруловой кислоты; (iv) вся связанная феруловая кислота соединена с боковыми цепями арабинозы арабиноксило-олигосахаридов.
Ряд композиций (арабино)ксилан-олигосахаридов характеризуется в отношении содержания в них XOSDPX2-9 и (F)AXOSDPX1-9 с использованием методики на основе HPAEC-PAD, описанной в данном примере (таблица 7). Композиция AXOS-5-0,26 примера 1, которая, как было обнаружено, проявляет оптимальную комбинацию желательных эффектов на параметры состояния здоровья кишечника, в экспериментах, описанных в примере 1, имеет содержание XOSDPX2-9 33% (масс./масс. в расчете на сухое вещество) и содержание (F)AXOSDPX1-9 38% (масс./масс. в расчете на сухое вещество) при отношении XOSDPX2-9/(F)AXOSDPX1-9 0,87. Отношение XOSDPX2-9/(F)AXOSDPX1-9 AXOS-5-0,26 значительно выше, чем для композиции AXOS-12-0,26 (0,12). Отношения XOSDPX2-9/(F)AXOSDPX1-9 композиций 18 и 20 (соответственно 0,92 и 1,09) находятся в том же диапазоне, как отношение AXOS-5-0,26, и содержание в них XOSDPX2-9 и (F)AXOSDPX1-9 составляет 77% (масс./масс. в расчете на сухое вещество) и 78% (таблица 7) соответственно.
ССЫЛКИ
Andersson, R. and Aman, P. (2001) Cereal arabinoxylan: occurrence, structure and properties. In Advanced dietary fibre technology, pp. 301-314 [BV McCleary and L Prosky, editors]. Oxford: Blackwell Science Ltd.
Campbell J.M., Fahey, G.C., Wolf, B.W. (1997) Selected indigestible oligosaccharides affect large bowel mass, cecal and fecal short-chain fatty acids, pH and micorflora in rats. J. Nutr. 127:130-136.
Courtin, СМ., Van den Broeck, H. and Delcour, J.A. (2000). Determination of reducing end sugar residues in oligo- and polysaccharides by gas liquid chromatography. Journal of Chromatography A, 866, 97-104.
Courtin, СМ., К. Swennen, W.F. Broekaert, O. Lescroart, O. Onagbesan, J. Buyse, E. Decuypere, T. Van de Wiele, M. Marzoratti, W. Verstraete, G. Huyghebaert, and J.A. Delcour. (2008) Dietary inclusion of wheat bran arabinoxylooligosaccharides has beneficial nutritional effects on chickens. Cereal Chemistry.85: 607-613.
De Preter V, Geboes K, Verbrugghe K, De Vuyst L, Vanhoutte T, Huys G, Swings J, Pot B, Verbeke К. (2004) The in vivo use of the stable isotope-labelled biomarkers lactose-[15N]ureide and [2H4]tyrosine to assess the effects of pro- and prebiotics on the intestinal flora of healthy human volunteers. Brit J Nutrition 92: 439-446.
Englyst, H.N., Cumming, J.H. (1984) Simplified method for the measurement of total non-starch polysaccharides by GLC of constituent sugars as alditol acetates. Analyst 109, 937-942.
Geboes K.P., De Peter V, Luypaerts A., Bammens В., Evenepoel P., Ghoos Y., Rutgeerts P., Verbeke K. (2005) Validation of lactose[15N,15N]ureide as a tool tо study colonic nitrogen metabolism. Am J Physiol 288: G994-G999.
Gibson, G.R. and Roberfroid M.B. (1995) Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J. Nutr. 125:1401-1412.
Good, H. (2002) Measurement of color in cereal products. Cereal Foods World 47: 5-6.
Grasten S, Liukkonen K-H, Chrevatidis A, El-Nezami H, Poutanen K, Mykkanen H. (2003) Effects of wheat pentosan and inulin on the metabolic activity of fecal microbiota and on bowel function in healthy humans. Nutrition Research 23:1503-1514.
Hsu C-K, Liao, J-W, Chung, Y-C, Hsieh, C-P, Chan, Y-C. (2004) Xylooligosaccharides and fructooligosaccharides affect the intestinal microbiota and precancerous colonic lesions development in rats. J. Nutr. 134:1523-1528.
Huang D, Ou B, Hampsch-Woodill M, Flanagan JA, Prior RL. (2002) High-throughput assay of oxygen radical absorbance capacity (ORAC) using a multichannel liquid handling system coupled with a microplate fluorescence reader in 96-well format. J Agric Food Chem. 50:4437-4444.
Johnson K. A. (1977) The production of secondary amines by human gut bacteria and its possible relevance to carcinogenesis. Med. Lab. Sci. 34:131-143.
Kabel, M.A., Kortenoeven, L, Schols, H.A. & Voragen, A.G.J. (2002). In vitro fermentability of differently substituted xylo-oligosaccharides. Journal of Agricultural and Food Chemistry, 50: 6205-6210.
Katapodis P, Vardakou M, Kalogeris E, Kekos D, Macris BJ & Christakopoulos P. (2003) Enzymic production of a feruloylated oligosaccharide with antioxidant activity from wheat flour arabinoxylan. European Journal of Nutrition 42: 55-60.
Lozovaya, V.V, Gorshkova, T.A., Yablokova, E.V., Rumyantseva, N.I., Valieva, A., Ulanov, A., Widholm, J. (1999) Cold alkali can extract phenolic acids that are ether linked to cell wall components in dicotyledonous plants (buckwheat, soybean, and flax). Phytochemistry. 50: 395-400.
Macfarlane S and Macfarlane GT (1995) Proteolysis and amino acid fermentation. In: Human Colonic Bacteria: Role in Nutrition, Physiology and Pathology. Gibson GR Macfarlane GT (eds.) CRC Press, Boca Raton, FL. pp. 75-100.
Macfarlane S, Macfarlane GT, Cummings JH. (2006) Prebiotics in the gastrointestinal tract. Aliment. Pharmacol. Ther. 24:701-14.
Mortensen PB, Clausen MR, Bonnen H, Hove H, Holtug K. (1992) Colonic fermentation of ispaghula, wheat bran, glucose, and albumin to short-chain fatty acids and ammonia evaluated in vitro in 50 subjects. J Parenter Enteral Nutr. 16:433-439.
Moura P, Barata R, Carvalheiro F, Girio F, Loureiro-Dias MC & Esteves MP. (2007) In vitro fermentation of xylooligosaccharides from corn cobs autohydrolysis by Bifidobacterium and Lactobacillus strains. Lwt-Food Science and Technology 40: 963-972.
Ohta T, Semboku N, Kuchii A, Egashira Y & Sanada H. (1997) Antioxidant activity of corn bran cell-wall fragments in the LDL oxidation system. Journal of Agricultural and Food Chemistry 45: 1644-1648.
Okazaki M., Fujikawa, S., Matsumoto, N. (1990) Effect of xylooligosaccharides on the growth of bifidobacteria. Bifidobacteria Microflora 9:77-86.
Ou, В., Hampsch-Woodill, M., Prior, R.L. (2001) Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe. J Agric Food Chem. 49:4619-4626.
Perrin P, Pierre F, Patry Y, Champ M, Berreur M, Pradal G, Bornet F, Meflah K, Menanteau J (2003) Only fibres promoting a stable butyrate producing colonic ecosystem decrease the rate of aberrant crypt foci in rats. Gut 48:53-61.
Ratnam, D.V., Ankola, D.D., Bhardwaj, V., Sahana, D.K., Ravi Kumar, M.N.V. (2006) Review. Role of antioxidants in prophylaxis and therapy: a pharmaceutical perspective. J. Controlled Release. 113:189-207.
Ramakrishna B. S., Roberts-Thomas I. C, Pannall P. R., Roediger W.E.W. (1991) Impaired sulphation of phenol by the colonic mucosa in quiescent and active colitis. Gut 32:46-49.
Rinttila T, Kassinen A, Malinen E, Krogius L, Palva A. (2004) Development of an extensive set of 16S rDNA-targeted primers for quantification of pathogenic and indigenous bacteria in faecal samples by real-time PCR. J. Appl. Microbiol. 97:1166-1177.
Roberfroid, M.B. (1998) Prebiotics and synbiotics: concepts and nutritional properties. Brit. J. Nutr. 80:S197-S202.
Roediger WE. (1982) Utilization of nutrients by isolated epithelial cells of the rat colon. Gastroenterology 83: 424-429.
Rosazza JP, Huang Z, Dostal L, Volm T, Rousseau В. (1995) Review: biocatalytic transformations of ferulic acid: an abundant aromatic natural product. Journal of Industrial Microbiology and Biotechnology 1995.15:457-471.
Satokari, R.M., Vaughan, E.E., Akkermans, A.D.L., Saarela, M. and De Vos, W.M. (2001) Bifidobacterial diversity in human feces detected by genus-specific PCR and denaturing gradient gel electrophoresis. Appl. Env. Micorbiol. 67:504-513.
Saulnier.L, Vigouroux, J., Thibault, J.-F. (1995) Isolation and partial characterization of feruloylated oligosaccharides from maize bran. Carbohydrate Research.272: 241-253.
Scheppach W, Barthram HP, Richter F. (1995) Role of short-chain fatty acids in the prevention of colorectal cancer. Eur J Cancer 31A:1077-1080.
Swennen, K., Courtin, СМ., Van der Bruggen, В., Vandecasteele, C, Delcour, J.A. (2005) Ultrafiltration and ethanol precipitation for isolationof arabinoxylooligosaccharides with different structures. Carbohydrate Polymers 62: 283-292.
Suntory. Xylo-oligosaccharide, brochure and product sheet, 2001.
Teitelbaum, J.E., Walker, W.A. (2002) Nutritional impact of pre- and probiotics as protective gastrointestinal organisms. Annual Review of Nutrition 22:107-38.
Topping DL and Clifton PM. (2001) Short-chain fatty acids and human colonic function: roles of resistant starch and nonstarch polysaccharides. Physiol Rev 81:1031-1064.
Toyoda, Y., Hatakana, Y., Suwa, Y., (1993) Effect of xylooligosaccharides on calcium absorption. In Proc. of 47th Annual Meeting of Jpn Soc Nutr Food Sci, Tokyo, p109.
Van Loo, J.A.E. (2004) Prebiotics promote good health. The basis, the potential, and the emerging evidence. J Clin Gastroenterol 38: S70-S75.
van Nuenen M.H.M.C, Meyer P.D., Venema К. (2003) The effect of various inulins and Clostridium difficile on the metabolic activity of the human colonic microbiota in vitro. Microbial Ecol. Health Dis. 15:137 - 14.
Visek WJ. (1978) Diet and cell growth modulation by ammonia. Am J Clin Nutr 31, Supp 10: S216-S220.
Yuan XP, Wang J & Yao HY. (2005) Antioxidant activity of feruloylated oligosaccharides from wheat bran. Food Chemistry 90: 759-764.
Wong, J.M., de Souza, R., Kendall, C.W., Emam, A., Jenkins, D.J. (2006) Colonic health: fermentation and short chain fatty acids. J. Clin. Gastroenterol. 40: 235-243.
Yamada H., Itoh, K., Morishita, Y., Taniguchi, H. (1993) Structure and properties of oligosaccharides from wheat bran. Cereal Foods World 38:490-492.
Muyzer, G., Dewaal, E.C., Uitteriinden, A.G. (1993) Profiling of complex microbial populations by denaturing gradient gel electrophoresis-analysis of polymerase chain reaction-amplified genes coding for 16S rRNA. Appl. Environ. Microbiol. 59, 695-700.
Lane, D.J. (1991) 16S/23S rRNA sequencing. In: Stackebrandt, E., Goodfellow, M. (Eds.), Nucleic Acid Techniques in Bacterial Systematics. John Wiley & Sons Ltd., West Sussex, United Kingdom, pp. 115-175.
ТАБЛИЦЫ
|
|
|
|
|
|
|