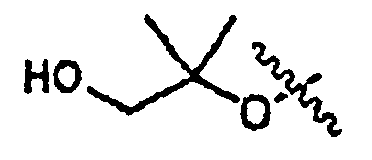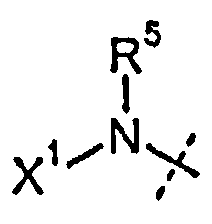Результат интеллектуальной деятельности: ИЗОИНДОЛОНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Данная заявка представляет собой международную патентную заявку, которая заявляет приоритет предварительной патентной заявки США № 61/077432, поданной 1 июля 2008 года, содержание которой включено в данный документ путем ссылки.
Изобретение относится к изоиндолонам с противоопухолевой активностью и более конкретно, к изоиндолонам с ингибиторной активностью в отношении MEK-киназы. В изобретении предлагаются композиции и способы, применимые для ингибирования аномального роста клеток, лечения гиперпролиферативных расстройств или лечения воспалительных заболеваний у млекопитающего. Изобретение также относится к способам применения соединений для in vitro, in situ и in vivo диагностики или для обработки клеток млекопитающих или лечения ассоциированных патологических состояний.
При выяснении того, как Ras передает внеклеточные сигналы роста, оказалось, что каскад MAP(митоген-активированной протеин)киназы (MAPK) выступает как основной путь между мембраносвязанным Ras и ядром. Каскад MAPK включает каскад явлений фосфорилирования с участием трех ключевых киназ, а именно Raf, MEK (киназа MAP-киназы) и ERK (MAP-киназа). Активный ГТФ-связанный Ras приводит к активации и непрямому фосфорилированию Raf-киназы. Затем Raf фосфорилирует MEK1 и 2 по двум сериновым остаткам (S218 и S222 в случае MEK1 и S222 и S226 в случае MEK2) (Ahn et al., Methods in Enzymology 2001, 332, 417-431). Затем активированная MEK фосфорилирует свои единственно известные субстраты, MAP-киназы, ERK1 и 2. Фосфорилирование ERK посредством MEK происходит по Y204 и T202 в случае ERK1 и по Y185 и T183 в случае ERK2 (Ahn et al., Methods in Enzymology 2001, 332, 417-431). Фосфорилированная ERK димеризуется и затем переносится в ядро, где она аккумулируется (Khokhlatchev et al., Cell 1998, 93, 605-615). В ядре ERK участвует в нескольких важных клеточных функциях, включая, но, не ограничиваясь перечисленным, внутриядерный транспорт, трансдукцию сигналов, репарацию ДНК, сборку и транслокацию нуклеосом, а также процессинг и трансляцию мРНК (Ahn et al., Molecular Cell 2000, 6, 1343-1354). В целом обработка клеток факторами роста ведет к активации ERK1 и 2, которая приводит к пролиферации и в некоторых случаях к дифференцировке клеток (Lewis et al., Adv. Cancer Res. 1998, 74, 49-139).
Существует убедительное доказательство того, что при пролиферативных заболеваниях генетические мутации и/или сверхэкспрессия протеинкиназ, участвующих в MAP-киназном каскаде, приводит к неконтролируемой клеточной пролиферации и, в конечном счете, к образованию опухоли. Например, некоторые злокачественные опухоли содержат мутации, которые приводят к постоянной активации такого каскада вследствие непрерывной продукции факторов роста. Другие мутации могут приводить к дефектам при дезактивации активированного ГТФ-связанного комплекса Ras, вновь приводя к активации каскада MAP-киназы. Мутированные, онкогенные формы Ras обнаруживаются в 50% злокачественных опухолей толстой кишки и >90% злокачественных опухолей поджелудочной железы, а также при многих других типах злокачественных опухолей (Kohl et al., Science 1993, 260, 1834-1837). В настоящее время мутации bRaf идентифицированы в более чем 60% случаев злокачественной меланомы (Davies H. et al., Nature 2002, 417, 949-954). Такие мутации bRaf приводят к конститутивно активному каскаду MAP-киназы. При исследовании образцов первичных опухолей и клеточных линий также была выявлена конститутивная или сверхактивация MAP-киназного каскада при злокачественных опухолях поджелудочной железы, толстой кишки, легкого, яичника и почки (Hoshino R. et al., Oncogene 1999, 18, 813-822).
Выяснилось, что MEK является привлекательной терапевтической мишенью в каскаде MAP-киназы. MEK ниже Ras и Raf является высокоспецифичной в отношении фосфорилирования MAP-киназы; фактически, единственно известными субстратами для фосфорилирования MEK являются MAP-киназы, ERK1 и 2. В нескольких исследованиях было показано, что ингибирование MEK имеет потенциальное терапевтическое преимущество. Например, на ксенотрансплантатах у "голых" мышей было показано, что низкомолекулярные ингибиторы MEK ингибируют рост человеческой опухоли (Sebolt-Leopold et al., Nature-Medicine 1999, 5 (7), 810-816); Trachet et al., AACR Apr. 6-10, 2002, Poster #5426; Tecle, H. IBC 2.sup.nd International Conference of Protein Kinases, Sep. 9-10, 2002), блокируют статическую аллодинию у животных (WO 01/05390, опубликовано 25 января 2001 г.) и ингибируют рост клеток при остром миелолейкозе (Milella et al., J. Clin. Invest. 2001, 108 (6), 851-859).
Несколько низкомолекулярных ингибиторов MEK также обсуждаются, например, в WO02/06213, WO 03/077855 и WO03/077914. До настоящего времени существует потребность в новых ингибиторах MEK как эффективных и надежных терапевтических средствах для лечения ряда болезненных пролиферативных состояний, таких как состояния, связанные с гиперактивностью MEK, а также заболеваний, модулируемых посредством MEK-каскада.
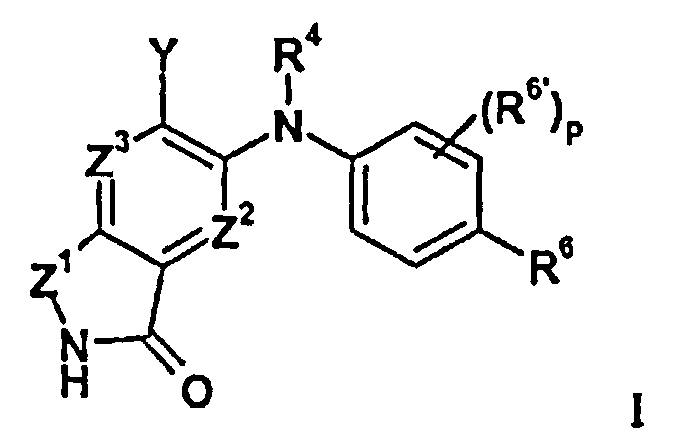
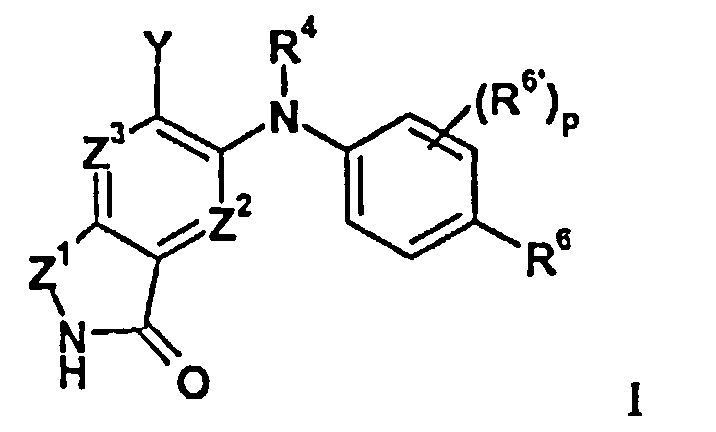
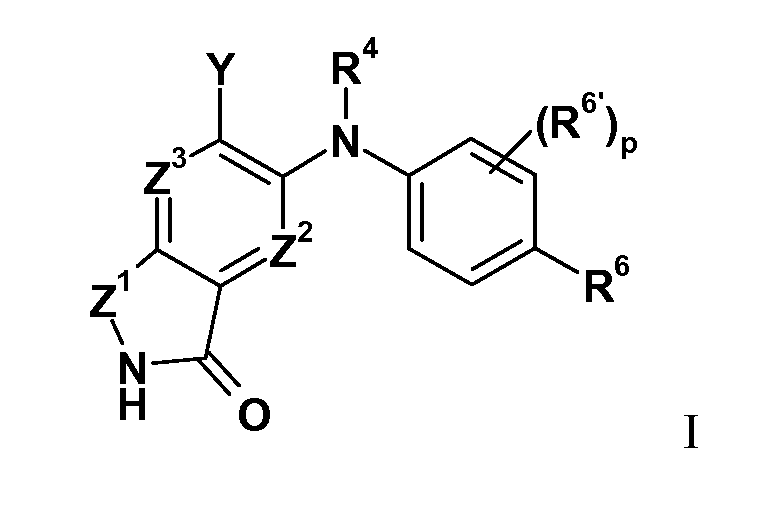
В целом изобретение относится к изоиндолонам формулы I (и/или их сольватам, гидратам и/или их солям) с противоопухолевой и/или противовоспалительной активностью и более конкретно, с ингибиторной активностью в отношении MEK-киназы. Определенные гиперпролиферативные и воспалительные расстройства характеризуются модуляцией функции MEK-киназы, например, в результате мутации или сверхэкспрессии белков. Соответственно, соединения согласно изобретению и композиции на их основе применимы при лечении гиперпролиферативных расстройств, таких как злокачественная опухоль и/или воспалительных заболеваний, таких как ревматоидный артрит.
в которой
Z1 представляет собой CR1R1a или NRA;
R1 и R1a независимо выбраны из H, C1-C3-алкила, CF3, CHF2, CN или ORA; или R1 и R1a вместе с атомом углерода, к которому они присоединены, образуют 3-5-членное карбоциклическое кольцо;
или R1 и R1a, взятые вместе, представляют собой (=О) или (=CRARA);
Z2 представляет собой CR2 или N;
R2 представляет собой H, C1-C3-алкил, атом галогена, CF3, CHF2, CN, ORA или NRARA;
каждый RA независимо представляет собой H или C1-C3-алкил;
Z3 представляет собой CR3 или N;
R3 выбран из H, атома галогена, CN, CF3, -OCF3, -NO2, -(CR14R15)nC(=Y')R11, -(CR14R15)nC(=Y')OR11, -(CR14R15)nC(=Y')NR11R12, -(CR14R15)nNR11R12, -(CR14R15)nOR11, -(CR14R15)nSR11, -(CR14R15)nNR12C(=Y')R11,-(CR14R15)nNR12C(=Y')OR11, -(CR14R15)nNR13C(=Y')NR11R12, -(CR14R15)nNR12SO2R11, -(CR14R15)nOC(=Y')R11, -(CR14R15)nOC(=Y')OR11, -(CR14R15)nOC(=Y')NR11R12, -(CR14R15)nOS(O)2(OR11), -(CR14R15)nOP(=Y')(OR11)(OR12), -(CR14R15)nOP(OR11)(OR12), -(CR14R15)nS(O)R11, -(CR14R15)nS(O)2R11, -(CR14R15)nS(O)2NR11R12, -(CR14R15)nS(O)(OR11), -(CR14R15)nS(O)2(OR11), -(CR14R15)nSC(=Y')R11, -(CR14R15)nSC(=Y')OR11, -(CR14R15)nSC(=Y')NR11R12, C1-C12-алкила, C2-C8-алкенила, C2-C8-алкинила, карбоциклила, гетероциклила, арила и гетероарила;
R4 представляет собой H, C1-C6-алкил или C3-C4-карбоциклил;
Y представляет собой W-C(O)- или W;
W представляет собой 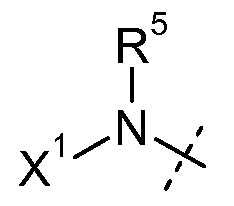 или
или 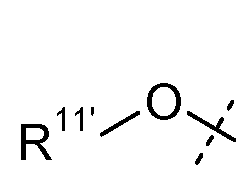 ;
;
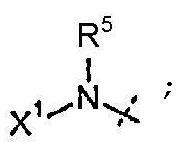
R5 представляет собой H или C1-C12-алкил;
X1 выбран из R11' и -OR11'; когда X1 представляет собой R11', X1 необязательно вместе с R5 и атомом азота, с которым они связаны, образуют 4-7-членное насыщенное или ненасыщенное кольцо, содержащее 0-2 дополнительных гетероатома, выбранных из O, S и N, где упомянутое кольцо необязательно замещено одной или несколькими группами, выбранными из атома галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)n-SR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21;
каждый R11' независимо представляет собой H, C1-C12-алкил, C2-C8-алкенил, C2-C8-алкинил, карбоциклил, гетероциклил, арил или гетероарил;
R11, R12 и R13 независимо представляют собой H, C1-C12-алкил, C2-C8-алкенил, C2-C8-алкинил, карбоциклил, гетероциклил, арил или гетероарил,
или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют 3-8-членное насыщенное, ненасыщенное или ароматическое кольцо, содержащее 0-2 гетероатома, выбранных из O, S и N, где упомянутое кольцо необязательно замещено одной или несколькими группами, выбранными из атома галогена, CN, CF3, -OCF3, -NO2, C1-C6-алкила, -OH, -SH, -О(C1-C6-алкила), -S(C1-C6-алкила), -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -SO2(C1-C6-алкила), -CO2H, -CO2(C1-C6-алкила), -C(O)NH2, -C(O)NH(C1-C6-алкила), -C(O)N(C1-C6-алкила)2, -N(C1-C6-алкила)C(O)(C1-C6-алкила), -NHC(O)(C1-C6-алкила), -NHSO2(C1-C6-алкила), -N(C1-C6-алкил)SO2(C1-C6-алкила), -SO2NH2, -SO2NH(C1-C6-алкила), -SO2N(C1-C6-алкила)2, -OC(O)NH2, -OC(O)NH(C1-C6-алкила), -OC(O)N(C1-C6-алкил)2, -OC(O)O(C1-C6-алкила), -NHC(O)NH(C1-C6-алкила), -NHC(O)N(C1-C6-алкила)2, -N(C1-C6-алкил)C(O)NH(C1-C6-алкила), -N(C1-C6-алкил)C(O)N(C1-C6-алкила)2, -NHC(O)NH(C1-C6-алкила), -NHC(O)N(C1-C6-алкила)2, -NHC(O)O(C1-C6-алкила) и -N(C1-C6-алкил)C(O)O(С1-C6-алкила);
R14 и R15 независимо выбраны из H, C1-C12-алкила, арила, карбоциклила, гетероциклила и гетероарила;
W' представляет собой
в которых  представляет собой:
представляет собой:
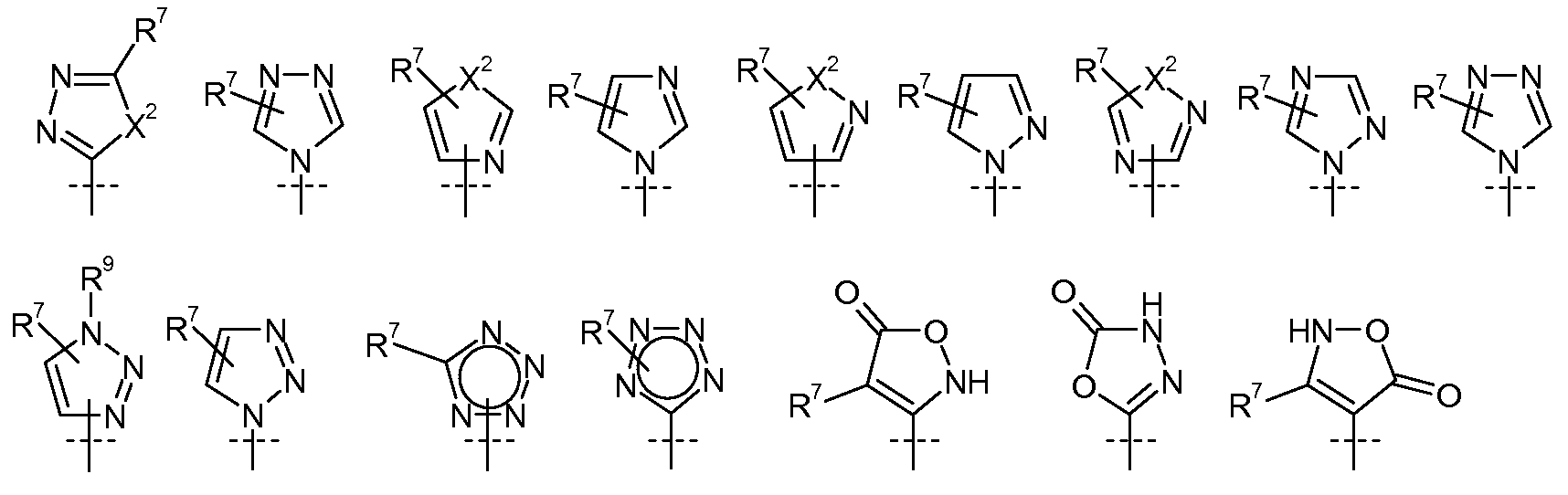
X2 представляет собой О, S, или NR9;
R7 выбран из H, атома галогена, CN, CF3, -OCF3, -NO2, -(CR14R15)nC(=Y')R11, -(CR14R15)nC(=Y')OR11, -(CR14R15)nC(=Y')NR11R12, -(CR14R15)nNR11R12, -(CR14R15)nOR11, -(CR14R15)nSR11, -(CR14R15)nNR12C(=Y')R11, -(CR14R15)nNR12C(=Y')OR11, -(CR14R15)nNR13C(=Y')NR11R12, -(CR14R15)nNR12SO2R11, -(CR14R15)nOC(=Y')R11, -(CR14R15)nOC(=Y')OR11, -(CR14R15)nOC(=Y')NR11R12, -(CR14R15)nOS(O)2(OR11), -(CR14R15)nOP(=Y')(OR11)(OR12), -(CR14R15)nOP(OR11)(OR12), -(CR14R15)nS(O)R11, -(CR14R15)nS(O)2R11, -(CR14R15)nS(O)2NR11R12, -(CR14R15)nS(O)(OR11), -(CR14R15)nS(O)2(OR11), -(CR14R15)nSC(=Y')R11, -(CR14R15)nSC(=Y')OR11, -(CR14R15)nSC(=Y')NR11R12, C1-C12-алкила, C2-C8-алкенила, C2-C8-алкинила, карбоциклила, гетероциклила, арила и гетероарила;
R8 выбран из C1-C12-алкила, арила, карбоциклила, гетероциклила и гетероарила;
R9 выбран из H, -(CR14R15)nC(=Y')R11, -(CR14R15)nC(=Y')OR11, -(CR14R15)nC(=Y')NR11R12, -(CR14R15)qNR11R12, -(CR14R15)qOR11, -(CR14R15)qSR11, -(CR14R15)qNR12C(=Y')R11, -(CR14R15)qNR12C(=Y')OR11, -(CR14R15)qNR13C(=Y')NR11R12, -(CR14R15)qNR12SO2R11, -(CR14R15)qOC(=Y')R11, -(CR14R15)qOC(=Y')OR11, -(CR14R15)qOC(=Y')NR11R12, -(CR14R15)qOS(O)2(OR11), -(CR14R15)qOP(=Y')(OR11)(OR12), -(CR14R15)qOP(OR11)(OR12), -(CR14R15)nS(O)R11, -(CR14R15)nS(O)2R11, -(CR14R15)nS(O)2NR11R12, C1-C12-алкила, C2-C8-алкенила, C2-C8-алкинила, карбоциклила, гетероциклила, арила и гетероарила;
R10 представляет собой H, C1-C6-алкил или C3-C4-карбоциклил;
R6 представляет собой H, атом галогена, C1-C6-алкил, C2-C8-алкенил, C2-C8-алкинил, карбоциклил, гетероарил, гетероциклил, -OCF3, -NO2, -Si(C1-C6-алкил), -(CR19R20)nNR16R17, -(CR19R20)nOR16 или -(CR19R20)n-SR16;
R6' представляет собой H, атом галогена, C1-C6-алкил, C2-C8- алкенил, C2-C8-алкинил, карбоциклил, гетероциклил, арил, гетероарил, CF3, -OCF3, -NO2, -Si(C1-C6-алкил), -(CR19R20)nNR16R17, -(CR19R20)nOR16 или -(CR19R20)n-SR16; при условии, что оба R6 и R6' не представляют собой H в одно и то же время;
p равно 0, 1, 2 или 3;
n равно 0, 1, 2 или 3;
q равно 2 или 3;
где каждый упомянутый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил R3, R4, R5, R6, R6', R7, R8, R9, R10, R11, R11', R12, R13, R14 и R15 необязательно независимо замещен одной или несколькими группами, независимо выбранными из атома галогена, CN, CF3, -OCF3, -NO2, оксо, -Si(C1-C6-алкила), -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17,
-(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21;
каждый R16, R17 и R18 независимо представляет собой H, C1-C12-алкил, C2-C8-алкенил, C2-C8-алкинил, карбоциклил, гетероциклил, арил или гетероарил, где упомянутый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил или гетероарил необязательно замещен одной или несколькими группами, выбранными из атома галогена, CN, -OCF3, CF3, -NO2, C1-C6-алкила, -OH, -SH, -О(C1-C6-алкила), -S(C1-C6-алкила), -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -SO2(C1-C6-алкила), -CO2H, -CO2(C1-C6-алкила), -C(O)NH2, -C(O)NH(C1-C6-алкила), -C(O)N(C1-C6-алкила)2, -N(C1-C6-алкил)C(O)(C1-C6-алкила), -NHC(O)(C1-C6-алкила), -NHSO2(C1-C6-алкила), -N(C1-C6-алкил)SO2(C1-C6-алкила), -SO2NH2, -SO2NH(C1-C6-алкила), -SO2N(C1-C6-алкила)2, -OC(O)NH2, -OC(O)NH(C1-C6-алкила), -OC(O)N(C1-C6-алкила)2, -OC(O)O(C1-C6-алкила), -NHC(O)NH(C1-C6-алкила), -NHC(O)N(C1-C6-алкила)2, -N(C1-C6-алкил)C(О)NH(C1-C6-алкила), -N(C1-C6-алкил)C(О)N(C1-C6-алкила)2, -NHC(O)NH(C1-C6-алкила), -NHC(O)N(C1-C6-алкила)2, -NHC(O)O(C1-C6-алкила) и -N(C1-C6-алкил)C(О)О(C1-C6-алкила);
или R16 и R17 вместе с атомом азота, к которому они присоединены, образуют 3-8-членное насыщенное, ненасыщенное или ароматическое кольцо, содержащее 0-2 гетероатома, выбранных из O, S и N, где упомянутое кольцо необязательно замещено одной или несколькими группами, выбранными из атома галогена, CN, -OCF3, CF3, -NO2, C1-C6-алкила, -OH, -SH, -О(C1-C6-алкила), -S(C1-C6-алкила), -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -SO2(C1-C6-алкила), -CO2H, -CO2(C1-C6-алкила), -C(O)NH2, -C(O)NH(C1-C6-алкила), -C(O)N(C1-C6-алкила)2, -N(C1-C6-алкил)C(O)(C1-C6-алкила), -NHC(O)(C1-C6-алкила), -NHSO2(C1-C6-алкила), -N(C1-C6-алкил)SO2(C1-C6-алкила), -SO2NH2, -SO2NH(C1-C6-алкила), -SO2N(C1-C6-алкила)2, -OC(O)NH2, -OC(O)NH(C1-C6-алкила), -OC(O)N(C1-C6-алкила)2, -OC(O)O(C1-C6-алкила), -NHC(O)NH(C1-C6-алкила), -NHC(O)N(C1-C6-алкила)2, -N(C1-C6-алкил)C(O)NH(C1-C6-алкила), -N(C1-C6-алкил)C(O)N(C1-C6-алкила)2, -NHC(O)NH(C1-C6-алкила), -NHC(O)N(C1-C6-алкила)2, -NHC(O)O(C1-C6-алкила) и -N(C1-C6-алкил)C(O)O(C1-C6-алкила);
R19 и R20 независимо выбраны из H, C1-C12-алкила, -(CH2)n-арила, -(CH2)n-карбоциклила, -(CH2)n-гетероциклила и -(CH2)n-гетероарила;
R21 представляет собой C1-C12-алкил, C2-C8-алкенил, C2-C8-алкинил, карбоциклил, гетероциклил, арил или гетероарил, где каждый член в R21 необязательно замещен одной или несколькими группами, выбранными из атома галогена, оксо, CN, -OCF3, CF3, -NO2, C1-C6-алкила, -OH, -SH, -О(C1-C6-алкила), -S(C1-C6-алкила), -NH2, -NH(C1-C6-алкила), -N(C1-C6-алкила)2, -SO2(C1-C6-алкила), -CO2H, -CO2(C1-C6-алкила), -C(O)NH2, -C(O)NH(C1-C6-алкила), -C(O)N(C1-C6-алкила)2, -N(C1-C6-алкил)C(O)(C1-C6-алкила), -NHC(O)(C1-C6-алкила), -NHSO2(C1-C6-алкила), -N(C1-C6-алкил)SO2(C1-C6-алкила), -SO2NH2, -SO2NH(C1-C6-алкила), -SO2N(C1-C6-алкила)2, -OC(O)NH2, -OC(O)NH(C1-C6-алкила), -OC(O)N(C1-C6-алкила)2, -OC(O)O(C1-C6-алкила), -NHC(O)NH(C1-C6-алкила), -NHC(O)N(C1-C6-алкила)2, -N(C1-C6-алкил)C(O)NH(C1-C6-алкила), -N(C1-C6-алкил)C(O)N(C1-C6-алкила)2, -NHC(O)NH(C1-C6-алкила), -NHC(O)N(C1-C6-алкила)2, -NHC(O)O(C1-C6-алкила) и -N(C1-C6-алкил)C(O)O(C1-C6-алкила);
каждый Y' независимо представляет собой O, NR22 или S; и
R22 представляет собой H или C1-C12-алкил.
Настоящее изобретение включает композицию (например, фармацевтическую композицию), содержащую соединение формулы I (и/или его сольваты, гидраты и/или соли) и носитель (фармацевтически приемлемый носитель). Настоящее изобретение также включает композицию (например, фармацевтическую композицию), содержащую соединение формулы I (и/или его сольваты, гидраты и/или соли) и носитель (фармацевтически приемлемый носитель), дополнительно содержащую второе химиотерапевтическое и/или второе противовоспалительное средство. Настоящие композиции применимы для ингибирования аномального роста клеток или лечения гиперпролиферативного расстройства у млекопитающего (например, человека). Настоящие композиции также применимы для лечения воспалительных заболеваний у млекопитающего (например, человека).
Настоящее изобретение включает способ ингибирования аномального роста клеток или способ лечения гиперпролиферативного расстройства у млекопитающего (например, человека), включающий введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции в чистом виде или в комбинации со вторым химиотерапевтическим средством.
Настоящее изобретение включает способ лечения воспалительного заболевания у млекопитающего (например, человека), включающий введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции в чистом виде или в комбинации со вторым противовоспалительным средством.
Настоящее изобретение включает способ применения настоящих соединений для in vitro, in situ и in vivo диагностики или для обработки клеток, организмов или лечения ассоциированных патологических состояний млекопитающих.
Теперь будет сделана подробная ссылка на определенные варианты осуществления изобретения, примеры которых проиллюстрированы сопроводительными структурами и формулами. Несмотря на то, что изобретение будет описано в связи с приведенными вариантами осуществления изобретения, будет понятно, что не подразумевается, что изобретение ограничивается описанными вариантами осуществления. Наоборот, подразумевается, что изобретение охватывает все альтернативные варианты, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения согласно формуле изобретения. Специалист в данной области оценит большинство способов и материалов, подобных или эквивалентных описанным в описании способам и материалам, которые можно было бы применять при осуществлении настоящего изобретения на практике. Настоящее изобретение ни в коей мере не ограничивается описанными в описании способами и материалами. В том случае, если одна или несколько включенных в настоящий документ литературных публикаций, патентов и подобных материалов отличаются от данной заявки или вступают в противоречие с данной заявкой, включая, но не ограничиваясь определяющими терминами, употреблением терминов, описанными методиками или т.п., данная заявка имеет преимущественную силу.
Применяемый в описании термин "алкил" относится к насыщенному одновалентному углеводородному радикалу с линейной или разветвленной цепью, содержащему от одного до двенадцати атомов углерода. Примеры алкильных групп включают, но не ограничиваются перечисленным, метил (Me, -CH3), этил (Et, -CH2CH3), 1-пропил (н-Pr, н-пропил, -CH2CH2CH3), 2-пропил (изо-Pr, изопропил, -CH(CH3)2), 1-бутил (н-Bu, н-бутил, -CH2CH2CH2CH3), 2-метил-1-пропил (изо-Bu, изобутил, -CH2CH(CH3)2), 2-бутил (втор-Bu, втор-бутил, -CH(CH3)CH2CH3), 2-метил-2-пропил (трет-Bu, трет-бутил, -C(CH3)3), 1-пентил (н-пентил, -CH2CH2CH2CH2CH3), 2-пентил (-CH(CH3)CH2CH2CH3), 3-пентил (-CH(CH2CH3)2), 2-метил-2-бутил (-C(CH3)2CH2CH3), 3-метил-2-бутил (-CH(CH3)CH(CH3)2), 3-метил-1-бутил (-CH2CH2CH(CH3)2), 2-метил-1-бутил (-CH2CH(CH3)CH2CH3), 1-гексил (-CH2CH2CH2CH2CH2CH3), 2-гексил (-CH(CH3)CH2CH2CH2CH3), 3-гексил (-CH(CH2CH3)(CH2CH2CH3)), 2-метил-2-пентил (-C(CH3)2CH2CH2CH3), 3-метил-2-пентил (-CH(CH3)CH(CH3)CH2CH3), 4-метил-2-пентил (-CH(CH3)CH2CH(CH3)2), 3-метил-3-пентил (-C(CH3)(CH2CH3)2), 2-метил-3-пентил (-CH(CH2CH3)CH(CH3)2), 2,3-диметил-2-бутил (- C(CH3)2CH(CH3)2), 3,3-диметил-2-бутил (-CH(CH3)C(CH3)3, 1-гептил, 1-октил и т.п.
Термин "алкенил" относится к одновалентному углеводородному радикалу с линейной или разветвленной цепью, содержащему от двух до двенадцати атомов углерода и по меньшей мере один участок с ненасыщенной связью, т.е. углерод-углеродной sp2-двойной связью, где алкенильный радикал включает радикалы с "цис"- и "транс"-конфигурациями, или альтернативно "E"- и "Z"-конфигурациями. Примеры включают, но не ограничиваются перечисленным, этиленил или винил (-CH=CH2), аллил (-CH2CH=CH2) и т.п.
Термин "алкинил" относится к одновалентному углеводородному радикалу с линейной или разветвленной цепью, содержащему от двух до двенадцати атомов углерода и по меньшей мере один участок с ненасыщенной связью, т.е. углерод-углеродной sp-тройной связью. Примеры включают, но не ограничиваются перечисленным, этинил (-C≡CH), пропинил (пропаргил, -CH2C≡CH) и т.п.
Термины "карбоцикл", "карбоциклил", "карбоциклическое кольцо" и "циклоалкил" относятся к одновалентному неароматическому, насыщенному или частично ненасыщенному кольцу, содержащему от 3 до 12 атомов углерода в случае моноциклического кольца или от 7 до 12 атомов углерода атомы в случае бициклического кольца. Бициклические карбоциклы, содержащие от 7 до 12 атомов, можно осуществлять, например, в виде бицикло[4,5]-, [5,5]-, [5,6]- или [6,6]-системы, и бициклические карбоциклы, содержащие 9 или 10 кольцевых атомов, можно осуществлять в виде бицикло[5,6]- или [6,6]-системы или в виде мостиковых систем, таких как бицикло[2.2.1]гептан, бицикло[2.2.2]октан и бицикло[3.2.2]нонан. Примеры моноциклических карбоциклов включают, но не ограничиваются перечисленным, циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогексадиенил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил, циклододецил и т.п.
"Арил" означает одновалентный ароматический углеводородный радикал, состоящий из 6-18 атомов углерода, получаемый путем удаления одного атома водорода от одного атома углерода исходной ароматической кольцевой системы. Некоторые арильные группы представлены в типичных структурах в виде "Ar". Арил включает бициклические радикалы, содержащие ароматическое кольцо, конденсированное с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим или гетероциклическим кольцом. Типичные арильные группы включают, но не ограничиваются перечисленным, радикалы, получаемые из бензола (фенила), замещенных бензолов, нафталина, антрацена, инденила, инданила, 1,2-дигидронафталина, 1,2,3,4-тетрагидронафтила и т.п.
Термины "гетероцикл," "гетероциклил" и "гетероциклическое кольцо" применяются в описании взаимозаменяемо и относятся к насыщенному или частично ненасыщенному (т.е. содержащему одну или несколько двойных и/или тройных связей внутри кольца) карбоциклическому радикалу, содержащему от 3 до 18 кольцевых атомов, в котором по меньшей мере один кольцевой атом представляет собой гетероатом, выбранный из азота, кислорода и серы; остальные кольцевые атомы представляют собой C, и где один или несколько кольцевых атомов необязательно независимо замещены одним или несколькими заместителями, описанными ниже. Гетероцикл может представлять собой моноцикл, содержащий от 3 до 7 кольцевых членов (от 2 до 6 атомов углерода и от 1 до 4 гетероатомов, выбранных из N, O и S), или бицикл, содержащий от 7 до 10 кольцевых членов (от 4 до 9 атомов углерода и от 1 до 6 гетероатомов, выбранных из N, O и S), например, бицикло[4,5]-, [5,5]-, [5,6]- или [6,6]-систему. Гетероциклы описаны в Paquette Leo A. "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), в частности, в главах 1, 3, 4, 6, 7 и 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, от 1950 по настоящее время), в частности, в томах 13, 14, 16, 19 и 28; и J. Am. Chem. Soc. (1960) 82:5566. Термин "гетероциклил" также включает радикалы, где гетероциклические радикалы конденсированы с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим или гетероциклическим кольцом. Примеры гетероциклических колец включают, но не ограничиваются перечисленным, пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидинил, морфолинил, тиоморфолинил, тиоксанил, пиперазинил, гомопиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 2-пирролинил, 3-пирролинил, индолинил, 2H-пиранил, 4H-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинилимидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил и азабицикло[2.2.2]гексанил. Спиро-фрагменты также включены в объем данного определения. Примеры гетероциклической группы, в которой кольцевые атомы замещены оксо (=О)-фрагментами, представляют собой пиримидинонил и 1,1-диоксотиоморфолинил.
Термин "гетероарил" относится к одновалентному ароматическому радикалу, содержащему 5- или 6-членные кольца, и включает конденсированные циклические системы (по меньшей мере, одна из которых является ароматической) из 5-18 атомов, содержащие один или несколько гетероатомов, независимо выбранных из атомов азота, кислорода и серы. Примеры гетероарильных групп представляют собой пиридинил (включая, например, 2-гидроксипиридинил), имидазолил, имидазопиридинил, пиримидинил (включая, например, 4-гидроксипиримидинил), пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил.
Гетероциклические или гетероарильные группы могут быть соединены через атом углерода (углерод-связанные) или через атом азота (азот-связанные), где такое возможно. В качестве примера и без ограничения, углерод-связанные гетероциклы или гетероарилы связываются в положениях 2, 3, 4, 5 или 6 пиридина, в положении 3, 4, 5 или 6 пиридазина, в положении 2, 4, 5 или 6 пиримидина, в положении 2, 3, 5 или 6 пиразина, положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофена, пиррола или тетрагидропиррола, в положении 2, 4 или 5 оксазола, имидазола или тиазола, в положении 3, 4 или 5 изоксазола, пиразола или изотиазола, в положении 2 или 3 азиридина, в положении 2, 3 или 4 азетидина, в положении 2, 3, 4, 5, 6, 7 или 8 хинолина или в положении 1, 3, 4, 5, 6, 7 или 8 изохинолина.
В качестве примера и без ограничения, азот-связанные гетероциклы или гетероарилы связываются в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1H-индазола, в положении 2 изоиндола или изоиндолина, в положении 4 морфолина и в положении 9 карбазола или β-карболина.
Термин "галоген" относится к F, Cl, Br или I. Гетероатомы, присутствующие в гетероариле или гетероциклиле, включают окисленные формы, такие как N+→O-, S(O) и S(O)2.
Термины "лечить" и "лечение" относятся как к терапевтическому лечению, так и к профилактическим или предупредительным мерам, цель которых состоит в предотвращении или замедлении (уменьшении) нежелательного физиологического изменения или расстройства, такого как рост или метастазирование злокачественной опухоли. Для целей данного изобретения существенные или желательные клинические результаты включают, но не ограничиваются перечисленным, ослабление симптомов, уменьшение степени заболевания, стабильное (т.е. без ухудшения) состояние болезни, задержку или замедление развития болезни, улучшение или временное облегчение болезненного состояния и ремиссию (как частичную, так и общую), как выявляемую, так и невыявляемую. "Лечение" также может означать повышение выживаемости по сравнению с выживаемостью, предполагаемой в отсутствие лечения. Те, кто нуждается в лечении, включают тех, у кого состояние или расстройство уже присутствует, а также тех, кто склонен к тому, чтобы иметь такое состояние или расстройство, или тех, у кого состояние или расстройство должно быть предотвращено.
Фраза "терапевтически эффективное количество" означает количество соединения по настоящему изобретению, которое (i) лечит или предотвращает конкретное заболевание, состояние или расстройство, (ii) ослабляет, улучшает или устраняет один или несколько симптомов конкретного заболевания, состояния или расстройства, или (iii) предотвращает или задерживает начало одного или нескольких симптомов описанного в описании конкретного заболевания, состояния или расстройства. В случае злокачественной опухоли терапевтически эффективное количество лекарственного средства может уменьшать число клеток злокачественной опухоли; уменьшать размер опухоли; ингибировать (т.е. до некоторой степени замедлять и, предпочтительно, останавливать) инфильтрацию клетками злокачественной опухоли периферических органов; ингибировать (т.е. до некоторой степени замедлять и, предпочтительно, останавливать) метастазирование опухоли; до некоторой степени ингибировать рост опухоли; и/или до некоторой степени облегчать один или несколько симптомов, ассоциированных со злокачественной опухолью. Лекарственное средство до некоторой степени может предотвращать рост и/или убивать существующие клетки злокачественной опухоли, оно может являться цитостатическим и/или цитотоксическим. При лечении злокачественной опухоли эффективность можно определять, например, путем оценки времени развития болезни (TTP) и/или путем определения частоты ответов (RR).
Термины "аномальный рост клеток" и "гиперпролиферативное расстройство" в данной заявке применяются взаимозаменяемо. Применяемый в описании термин "аномальный рост клеток", если не указано иначе, относится к росту клеток, который не зависит от нормальных регуляторных механизмов (например, потери контактного ингибирования). Он включает, например, аномальный рост (1) опухолевых клеток (опухолей), которые пролиферируют из-за экспрессии мутированной тирозинкиназы или сверхэкспрессии рецепторной тирозинкиназы; (2) доброкачественных и озлокачествленных клеток при других пролиферативных заболеваниях, в которых происходит аберрантная активация тирозинкиназы; (3) любых опухолей, которые пролиферируют благодаря рецепторным тирозинкиназам; (4) любых опухолей, которые пролиферируют из-за аберрантной активации серин/треонинкиназы; и (5) доброкачественных и озлокачествленных клеток при других пролиферативных заболеваниях, в которых происходит аберрантная активация серин/треонинкиназы.
Термины "злокачественная опухоль" и "злокачественное" относятся к физиологическому состоянию млекопитающих или описывают физиологическое состояние млекопитающих, которое обычно характеризуется неконтролируемым ростом клеток. "Опухоль" содержит одну или более злокачественных опухолевых клеток. Примеры злокачественной опухоли включают, но не ограничиваются перечисленным, карциному, лимфому, бластому, саркому и лейкоз или лимфонеоплазию. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого (NSCLC), аденокарциному легкого и плоскоклеточную карциному легкого; злокачественную опухоль брюшины, гепатоцеллюлярный рак, злокачественную опухоль желудка или желудочно-кишечного тракта, включая гастроинтестинальную злокачественную опухоль, злокачественную опухоль поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, карциному матки или эндометрия, карциному слюнных желез, злокачественную опухоль почки или ренальный рак, злокачественную опухоль простаты, злокачественную опухоль влагалища, злокачественную опухоль щитовидной железы, карциному печени, карциному анального канала, карциному полового члена, острый лейкоз, а также злокачественную опухоль головы/головного мозга и шеи.
"Химиотерапевтическое средство" представляет собой соединение, применимое для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают эрлотиниб (TARCEVA®, Genentech/OSI Pharm.), бортезомиб (VELCADE®, Millennium Pharm.), фулвестрант (FASLODEX®, AstraZeneca), сутент (SU 11248, Pfizer), летрозол (FEMARA®, Novartis), иматиниб мезилат (GLEEVEC®, Novartis), PTK787/ZK 222584 (Novartis), оксалиплатин (Eloxatin®, Sanofi), 5-FU (5-фторурацил), лейковорин, рапамицин (Sirolimus, RAPAMUNE®, Wyeth), лапатиниб (TYKERB®, GSK572016, Glaxo Smith Kline), лонафарниб (SCH 66336), сорафениб (BAY43-9006, Bayer Labs) и гефитиниб (IRESSA®, AstraZeneca), AG1478, AG1571 (SU 5271; Sugen), алкилирующие средства, такие как тиотепа и CYTOXAN® (циклосфосфамид); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты (хлорметины), такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитромочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности, калихеамицин гамма 1I и калихеамицин омега I1 (Angew Chem. Intl. Ed. Engl. (1994) 33: 183-186); динемицин, включая динемицин A; бисфосфонаты, такие как клодронат; эсперамицин; а также неокарциностатиновый хромофор и родственные хромофоры хромопротеиновых энедииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, ADRIAMYCIN® (доксорубицин, морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и деоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин; митомицины, такие как митомицин С, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-ФУ); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадреналины, такие как аминоглютетимид, митотан, трилостан; восполнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамидгликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиния ацетат; эпотилон; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтансиноиды, такие как майтансин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; PSK® полисахаридный комплекс (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); циклофосфамид; тиотепа; таксоиды, например паклитаксел TAXOL® (паклитаксел, Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANETM (не содержащий кремофор), препараты из наночастиц паклитаксела, сконструированных на основе альбумина (American Pharmaceutical Partners, Schaumberg, Illinois) и TAXOTERE® (доксетаксел; Rhône-Poulenc Rorer, Antony, France); хлоранбуцил; GEMZAR® (гемцитабин); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; NAVELBINE® (винорелбин); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; капецитабин (XELODA®); ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; и фармацевтически приемлемые соли, кислоты и производные любого из приведенных выше лекарственных средств.
В данное определение "химиотерапевтическое средство" включены также (i) антигормональные средства, которые действуют регулирующим или ингибирующим образом на действие гормонов на опухоли, такие как антиэстрогены и селективные модуляторы рецепторов эстрогенов (SERM), включая, например, тамоксифен (включая NOLVADEX®; тамоксифена цитрат), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и FARESTON® (торемифина цитрат); (ii) ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует продуцирование эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, MEGASE® (мегестрола ацетат), AROMASIN® (экземестан; Pfizer), форместан, фадрозол, RIVISOR® (ворозол), FEMARA® (летрозол; Novartis) и ARMIDEX® (анастрозол; AstraZeneca); (iii) антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и госерелин; а также троксацитабин (1,3-диоксолановый аналог нуклеозида цитозина); (iv) ингибиторы протеинкиназы; (v) ингибиторы липидкиназы; (vi) антисмысловые олигонуклеотиды, в частности олигонуклеотиды, которые ингибируют экспрессию генов в путях передачи сигналов, участвующих в аберрантной пролиферации клеток, таких как, например PKC-альфа, Ralf и H-Ras; (vii) рибозимы, такие как ингибиторы экспрессии VEGF (например, ANGIOZYME®) и ингибиторы экспрессии HER2; (viii) вакцины, такие как вакцины генотерапии, например вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; rIL-2 PROLEUKIN®; ингибитор топоизомеразы 1, такой как LURTOTECAN®; rmRH ABARELIX®; (ix) антиангиогенные средства, такие как бевацизумаб (AVASTIN®, Genentech); и (x) фармацевтически приемлемые соли, кислоты и производные любого из приведенных выше лекарственных средств. Другие антиангиогенные средства включают ингибиторы ММП-2 (матриксной металлопротеиназы 2), ингибиторы ММП-9 (матриксной металлопротеиназы 9), ингибиторы COX-II (циклооксигеназы II) и ингибиторы рецепторных тирозинкиназ VEGF. Примеры таких применимых ингибиторов матриксных металлопротеиназ, которые можно применять в комбинации с соединениями/композициями по настоящему изобретению, описаны в WO 96/33172, WO 96/27583, EP 818442, EP 1004578, WO 98/07697, WO 98/03516, WO 98/34918, WO 98/34915, WO 98/33768, WO 98/30566, EP 606046, EP 931788, WO 90/05719, WO 99/52910, WO 99/52889, WO 99/29667, WO 99/07675, EP 945864, патент США № 5863949, патент США № 5861510 и EP 780386, все из которых в полном объеме включены в настоящее описание путем ссылки. Примеры ингибиторов рецепторных тирозинкиназ VEGF включают 4-(4-бром-2-фторанилино)-6-метокси-7-(1-метилпиперидин-4-илметокси)хиназолин (ZD6474; пример 2 в WO 01/32651), 4-(4-фтор-2-метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпропокси)хиназолин (AZD2171; пример 240 в WO 00/47212), ваталаниб (PTK787; WO 98/35985) и SU11248 (сунитиниб; WO 01/60814) и соединения, такие как соединения, описанные в публикациях PCT № WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354.
Другие примеры химиотерапевтических средств, которые можно применять в комбинации с соединениями по настоящему изобретению, включают ингибиторы PI3K (фосфоинозитид-3-киназы), такие как ингибиторы, о которых сообщалось в Yaguchi et al. (2006) Jour. of the Nat. Cancer Inst. 98(8):545-556; US 7173029; US 7037915; US 6608056; US 6608053; US 6838457; US 6770641; US 6653320; US 6403588; WO 2006/046031; WO 2006/046035; WO 2006/046040; WO 2007/042806; WO 2007/042810; WO 2004/017950; US 2004/092561; WO 2004/007491; WO 2004/006916; WO 2003/037886; US 2003/149074; WO 2003/035618; WO 2003/034997; US 2003/158212; EP 1417976; US 2004/053946; JP 2001247477; JP 08175990; JP 08176070; US 6703414 и WO 97/15658, все из которых в полном объеме включены в настоящее описание путем ссылки. Конкретные примеры таких ингибиторов PI3K включают SF-1126 (ингибитор PI3K, Semafore Farmaceuticals), BEZ-235 (ингибитор PI3K, Novartis), XL-147 (ингибитор PI3K, Exelixis, Inc.) и GDC-0941 (ингибитор PI3K, PIramed и Genenetch).
Применяемый в настоящей заявке термин "воспалительные заболевания" включает, но не ограничивается перечисленным, ревматоидный артрит, атеросклероз, конгестивное нарушение слуха, воспалительное заболевание кишечника (включая, но не ограничиваясь перечисленным, болезнь Крона и неспецифический язвенный колит), хроническое обструктивное заболевание легких, фиброзирующее заболевание печени и почек, болезнь Крона, волчанку, заболевания кожи, такие как псориаз, экзема и склеродермия, остеоартрит, рассеянный склероз, астму, заболевания и расстройства, связанные с диабетическими осложнениями, фиброзирующее нарушение в органах, таких как легкое, печень, почки, и воспалительные осложнения сердечно-сосудистой системы, такие как острый коронарный синдром.
"Противовоспалительное средство" представляет собой соединение, применяемое для лечения воспаления. Примеры противовоспалительных средств включают инъекционные белоксодержащие терапевтические средства, такие как Enbrel®, Remicade®, Humira® и Kineret®. Другие примеры противовоспалительных средств включают нестероидные противовоспалительные средства (НПВС), такие как ибупрофен или аспирин (которые уменьшают припухлость и облегчают боль); модифицирующие заболевание противоревматические лекарственные средства (DMARD), такие как метотрексат; 5-аминосалицилаты (сульфасалазин и средства, не содержащие сульфамидов); кортикостероиды; иммуномодуляторы, такие как 6-меркаптопутин ("6-MP"), азатиоприн ("AZA"), циклоспорины и модификаторы биологического ответа, такие как Remicade® (инфликсимаб) и Enbrel® (этанерцепт); факторы роста фибробластов; тромбоцитарные факторы роста; блокаторы ферментов, такие как Arava® (лефлуномид); и/или хрящезащитное средство, такое как гиалуроновая кислота, глюкозамин и хондроитин.
Применяемый в настоящей заявке термин "пролекарство" относится к предшественнику соединения по изобретению или к производной форме соединения по изобретению, которая способна ферментативно или гидролитически активироваться или превращаться в более активную исходную форму. См., например, Wilman, "Prodrugs in Cancer Chemotherapy", Biochemical Society Transactions, 14, рр. 375-382, 615th Meeting Belfast (1986) и Stella et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery", Directed Drug Delivery, Borchardt et al., (под ред.), р. 247-267, Humana Press (1985). Пролекарства согласно данному изобретению включают, но не ограничиваются перечисленным, пролекарства, содержащие сложные эфиры, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, модифицированные D-аминокислотные пролекарства, гликозилированные пролекарства, β-лактамсодержащие пролекарства, необязательно замещенные феноксиацетамидсодержащие пролекарства, необязательно замещенные фенилацетамидсодержащие пролекарства, 5-фторцитозин и другие 5-фторуридиновые пролекарства, которые могут превращаться в более активное, цитотоксическое, свободное лекарственное средство. Примеры цитотоксических лекарственных средств, которые можно превращать в пролекарственную форму для применения в данном изобретении, включают, но не ограничиваются, соединения по данному изобретению и химиотерапевтические средства, такие как описанные выше химиотерапевтические средства.
"Метаболит" представляет собой продукт, образующийся в организме за счет метаболизма определенного соединения или его соли. Метаболиты соединения можно идентифицировать с помощью общепринятых методик, известных в данной области, и определять их активности с помощью испытаний, таких как описанные в описании испытания. Такие продукты, например, могут быть результатом окисления, гидроксилирования, восстановления, гидролиза, амидирования, деамидирования, этерификации, деэтерификации, ферментативного расщепления и т.п. вводимого соединения. Соответственно изобретение включает метаболиты соединений по данному изобретению, включая соединения, образующиеся в результате процесса контактирования соединения по данному изобретению с млекопитающим в течение периода времени, достаточного для образования его метаболического продукта.
"Липосома" представляет собой небольшую везикулу, состоящую из различных типов липидов, фосфолипидов и/или поверхностно-активного вещества, которая используется для доставки лекарственного средства (такого, как описанные в описании MEK-ингибиторы и необязательно химиотерапевтического средства) млекопитающему. Компоненты липосомы обычно расположены в бислойной структуре, подобно расположению липидов в биологических мембранах.
Применяемый в описании термин "упаковочный вкладыш" относится к инструкциям, обычно включаемым в промышленные упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозе, введении, противопоказаниях и/или предупреждениях, касающихся применения таких терапевтических продуктов.
Термин "хиральный" относится к молекулам, которые обладают свойством несовпадения при наложении зеркально отображенного партнера, в то время как термин "ахиральный" относится к молекулам, которые совпадают при наложении своего зеркально отображенного партнера.
Термин "стереоизомер" относится к соединениям, которые обладают одинаковым химическим составом и связями, но различными конфигурациями своих атомов в пространстве, которые не могут взаимно превращаться друг в друга путем вращения вокруг одинарных связей.
Термин "диастереомер" относится к стереоизомеру с двумя или более центрами хиральности, молекулы которого не являются зеркальными изображениями друг друга. Диастереомеры обладают различными физическими свойствами, например, температурами плавления, температурами кипения, спектральными свойствами и реакционными способностями. Смеси диастереомеров можно разделять с помощью аналитических процедур с высоким разделением энантиомеров, таких как кристаллизация, электрофорез и хроматография.
Термин "энантиомеры" относится к двум стереоизомерам одного соединения, которые не совпадают друг с другом при наложении их зеркальных изображений.
Применяемые в описании стереохимические определения и условные обозначения обычно соответствуют следующему: S.P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel E. and Wilen S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994. Соединения по данному изобретению могут содержать асимметрические или хиральные центры и, следовательно, существовать в различных стереоизомерных формах. Подразумевается, что все стереоизомерные формы соединений по данному изобретению, включенные в настоящий документ, но не ограничивающиеся диастереомерами, энантиомерами и атропоизомерами, а также их смесями, такими как рацемические смеси, образуют часть настоящего изобретения. Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью вращать плоскость поляризации плоскополяризованного света. При описании оптически активного соединения для обозначения абсолютной конфигурации молекулы вокруг ее хирального центра(ов) применяются префиксы D и L или R и S. Префиксы d и l или (+) и (-) используются для обозначения направления вращения плоскополяризованного света соединением, при этом (-) или l означает, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Такие стереоизомеры с конкретной химической структурой являются идентичными за исключением того, что они представляют собой зеркальные изображения друг друга. Конкретный стереоизомер также может называться энантиомером, а смесь таких изомеров часто называется энантиомерной смесью. Смесь энантиомеров 50:50 принято называть рацемической смесью или рацематом, которая может встречаться в тех случаях, когда во время химической реакции или процесса нет стереоселективности или стереоспецифичности. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных соединений, лишенных оптической активности.
Термин "таутомер" или "таутомерная форма" относится к структурным изомерам с различными энергиями, которые способны к взаимопревращению друг в друга благодаря низкому энергетическому барьеру. Например, благодаря миграции протона протонные таутомеры (также известные как прототропные таутомеры) подвержены взаимным превращениям, таким как кето-енольная и имин-енаминная изомеризации. Валентные таутомеры подвержены взаимным превращениям путем перераспределения некоторых связывающих электронов (валентных связей).
Применяемая в описании фраза "фармацевтически приемлемая соль" относится к фармацевтически приемлемым органическим или неорганическим солям соединения по данному изобретению. Типичные соли включают, но не ограничиваются перечисленным, сульфатные, цитратные, ацетатные, оксалатные, хлоридные, бромидные, иодидные, нитратные, бисульфатные, фосфатные, кислые фосфатные, изоникотинатные, лактатные, салицилатные, кислые цитратные, тартратные, олеатные, таннатные, пантотенатные, битартратные, аскорбатные, сукцинатные, малеатные, гентизинатные, фумаратные, глюконатные, глюкуронатные, сахараты, формиатные, бензоатные, глутаматные, метансульфонатные ("мезилатные"), этансульфонатные, бензолсульфонатные, п-толуолсульфонатные, памоатные (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)) соли; соли щелочных металлов (например, натрия и калия), соли щелочноземельных металлов (например, магния) и соли аммония. Фармацевтически приемлемая соль может содержать еще одну присоединенную (инклюдированную) молекулу, такую как ацетатный ион, сукцинатный ион или другой противоион. Противоион может представлять собой любой органический или неорганический фрагмент, который стабилизирует заряд на исходном соединении. Кроме того, фармацевтически приемлемая соль может содержать в своей структуре более одного заряженного атома. В тех случаях, когда многозарядные атомы являются частью фармацевтически приемлемой соли, может присутствовать несколько противоионов. Следовательно, фармацевтически приемлемая соль может содержать один или несколько заряженных атомов и/или один или несколько противоионов.
Если соединение по данному изобретению представляет собой основание, желаемую фармацевтически приемлемую соль можно получать любым подходящим способом, доступным в данной области, например обработкой свободного основания неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, метансульфоновая кислота, фосфорная кислота и т.п.; или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидильная кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как п-толуолсульфоновая кислота или этансульфоновая кислота или т.п.
Если соединение по данному изобретению представляет собой кислоту, желаемую фармацевтически приемлемую соль можно получать любым подходящим способом, например, обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла или гидроксид щелочноземельного металла или т.п. Иллюстративные примеры подходящих солей включают, но не ограничиваются перечисленным, органические соли, получаемые из аминокислот, таких как глицин и аргинин, аммиак, первичные, вторичные и третичные амины и циклические амины, такие как пиперидин, морфолин и пиперазин, и неорганические соли, получаемые из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития.
Фраза "фармацевтически приемлемая" указывает на то, что вещество или композиция должны быть химически и/или токсилогически совместимы с другими ингредиентами, содержащимися в препарате, и/или с млекопитающим, которое подвергается лечению таким препаратом.
Термин "сольват" относится к объединению или комплексу одной или нескольких молекул растворителя и соединения по изобретению. Примеры растворителей, которые образуют сольваты, включают, но не ограничиваются перечисленным, воду, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусную кислоту и этаноламин. Термин "гидрат" относится к комплексу, в котором молекула растворителя представляет собой воду.
Термин "защитная группа" относится к заместителю, который обычно используется для блокирования или защиты конкретных функциональных групп во время взаимодействия других функциональных групп соединения. Например, "аминозащитная группа" представляет собой заместитель, присоединенный к аминогруппе, который блокирует или защищает функциональные аминогруппы в соединении. Подходящие аминозащитные группы включают ацетил, трифторацетил, трет-бутоксикарбонил (BOC), бензилоксикарбонил (CBZ) и 9-флуоренилметиленоксикарбонил (Fmoc). Аналогично "гидроксизащитная группа" относится к заместителю на гидроксигруппе, который блокирует или защищает функциональные гидроксигруппы. Подходящие защитные группы включают ацетил и триалкилсилил. Термин "карбоксизащитная группа" относится к заместителю на карбоксигруппе, который блокирует или защищает функциональные карбоксигруппы. Обычно карбоксизащитные группы включают фенилсульфонилэтил, цианоэтил, 2-(триметилсилил)этил, 2-(триметилсилил)этоксиметил, 2-(п-толуолсульфонил)этил, 2-(п- нитрофенилсульфенил)этил, 2-(дифенилфосфино)этил, нитроэтил и т.п. Общую информацию по описанию защитных группы и их применению см. в T.W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991.
Термины "соединение по данному изобретению", "соединения по настоящему изобретению", "соединения формулы I", "изоиндолоны" и "изоиндолоны формулы I", если не указано иначе, включают соединения/изоиндолоны формулы I и их стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, соли (например, фармацевтически приемлемые соли) и пролекарства. Если не указано иначе, изображенные в описании структуры также означают, что включены соединения, которые отличаются только наличием одного или нескольких изотопически обогащенных атомов. Например, соединения формулы I, в которых один или несколько атомов водорода заменены дейтерием или тритием, или один или несколько атомов углерода заменены 13C- или 14C-обогащенными атомами углерода, включены в объем данного изобретения.
В одном из вариантов осуществления настоящего изобретения соединения представляют собой соединения формулы I-a (т.е. Z1 представляет собой CR1R1a) или I-b (т.е. Z1 представляет собой CR1R1a), а все другие переменные имеют значения, указанные для формулы I, или указанные в описанном выше варианте осуществления изобретения.
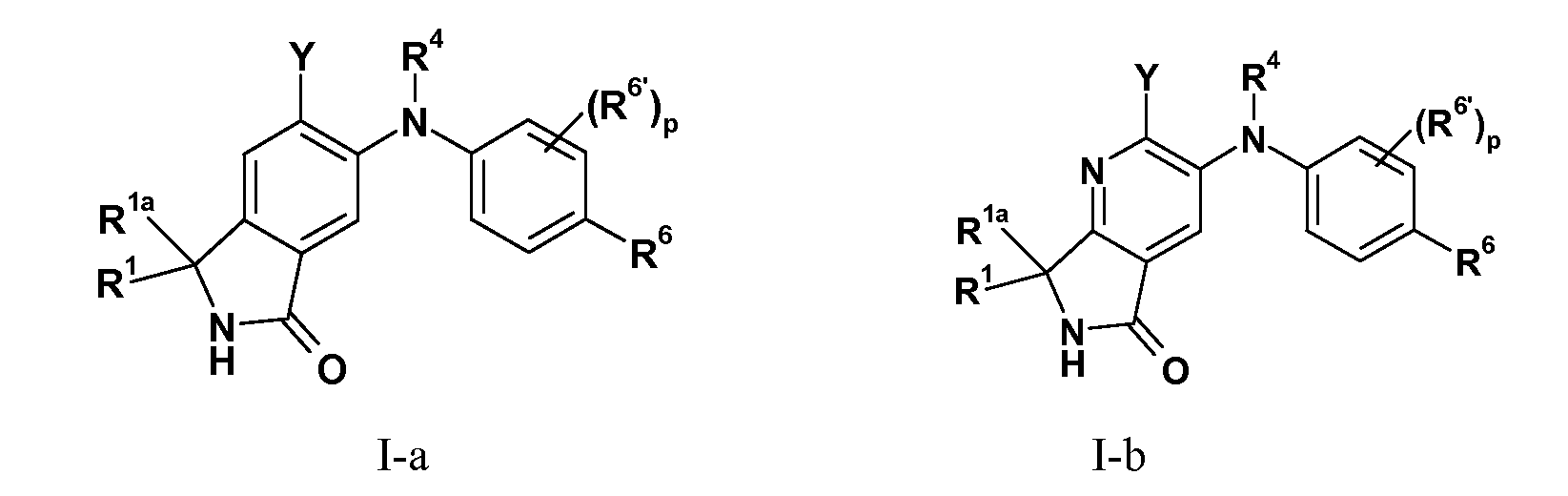
В одном из вариантов осуществления настоящего изобретения Z1 представляет собой CR1R1a и R1 представляет собой H или C1-C3-алкил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из описанных выше вариантов осуществления изобретения. В еще одном варианте осуществления R1 представляет собой H, и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения. В еще одном варианте осуществления изобретения R1 представляет собой метил, и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения Z1 представляет собой CR1R1a, и R1a представляет собой Н или C1-C3-алкил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из описанных выше вариантов осуществления изобретения. В еще одном варианте осуществления изобретения R1a представляют собой H, и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения. В еще одном варианте осуществления изобретения R1a представляет собой метил, и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или определенные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения Z1 представляет собой CR1R1a, и R1 и R1a представляют собой H или C1-C3-алкил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из описанных выше вариантов осуществления изобретения. В еще одном варианте осуществления изобретения R1 и R1a представляют собой H, и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения. В еще одном варианте осуществления R1 и R1a представляют собой метил, и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения Z1 представляет собой CR1R1a, и R1 и R1a вместе с атомом углерода, к которому они присоединены, образуют 3-5-членное карбоциклическое кольцо, или R1 и R1a могут представлять собой =О; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из описанных выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения Z1 представляет собой CR1R1a, и R1 и R1a вместе с атомом углерода, к которому они присоединены, могут образовывать 3-членное карбоциклическое кольцо; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из описанных выше вариантов осуществления изобретения.
В одном из вариантов осуществления настоящего изобретения Z1 представляет собой NRA и все другие переменные имеют значения, указанные для формулы I или I-a или I-b, или указанные в любом из описанных выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения Z1 представляет собой NRA, и RA представляет собой H или C1-C3-алкил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из описанных выше вариантов осуществления изобретения. В еще одном варианте осуществления настоящего изобретения RA представляет собой H, и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения. В еще одном варианте осуществления изобретения RA представляет собой метил, и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из описанных выше вариантов осуществления изобретения.
В одном из вариантов осуществления настоящего изобретения Z2 представляет собой R2, и R2 представляет собой H, галоген, CF3 или C1-C3-алкил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из описанных выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения Z2 представляет собой R2, и R2 представляет собой H, метил, F или Cl; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из описанных выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения Z2 представляет собой R2, и R2 представляет собой H, F или Cl; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из описанных выше вариантов осуществления изобретения.
В одном из вариантов осуществления настоящего изобретения Z3 представляет собой R3, и R3 представляет собой H, галоген, CF3, -OCF3, -(CR14R15)nOR11 или C1-C3-алкил; и все другие переменные имеют значения, указанные для формулы I или I-a, или указанные в любом из описанных выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения Z3 представляет собой R3, и R3 представляет собой H, -OCF3, метил, -OMe, -OCHF2, F или Cl; и все другие переменные имеют значения, указанные для формулы I или I-a, или указанные в любом из описанных выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения Z3 представляет собой R3, и R3 представляет собой H, метил, F или Cl; и все другие переменные имеют значения, указанные для формулы I или I-a, или указанные в любом из описанных выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения Z3 представляет собой R3, и R3 представляет собой H; и все другие переменные имеют значения, указанные для формулы I или I-a, или указанные в любом из описанных выше вариантов осуществления изобретения.
В одном из вариантов осуществления настоящего изобретения Z3 представляет собой N, и все другие переменные имеют значения, указанные для формулы I или I-a, или указанные в любом из описанных выше вариантов осуществления изобретения.
В одном из вариантов осуществления настоящего изобретения R4 представляет собой H или C1-C6-алкил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения R4 представляет собой H или метил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения. В еще одном варианте осуществления настоящего изобретения R4 представляет собой H; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В одном из вариантов осуществления настоящего изобретения R5 представляет собой H или C1-C6-алкил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения R5 представляет собой H или метил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения R5 представляет собой H; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В одном из вариантов осуществления настоящего изобретения Х1 представляет собой OR11′, в котором R11′ представляет собой H или С1-С12-алкил (например, С1-С6-алкил), замещенный одной или несколькими группами, выбранными из атома галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17, и R21; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения X1 представляет собой OR11′, в котором R11′ представляет собой гетероциклил (например, 4-6-членный гетероциклил), необязательно замещенный одной или несколькими группами, независимо выбранными из атома галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)nC(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17, и R21; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения X1 представляет собой OR11′, в котором R11′ представляет собой 4-6-членный гетероциклил, содержащий 1 кольцевой атом азота, где упомянутый гетероциклил необязательно замещен одной или несколькими группами, независимо выбранными из атома галогена, CN, CF3, -OCF3, -NO2, оксо, -(CR19R20)nC(=Y')R16, -(CR19R20)n C(=Y')OR16, -(CR19R20)nC(=Y')NR16R17, -(CR19R20)nNR16R17, -(CR19R20)nOR16, -(CR19R20)nSR16, -(CR19R20)nNR16C(=Y')R17, -(CR19R20)nNR16C(=Y')OR17, -(CR19R20)nNR18C(=Y')NR16R17, -(CR19R20)nNR17SO2R16, -(CR19R20)nOC(=Y')R16, -(CR19R20)nOC(=Y')OR16, -(CR19R20)nOC(=Y')NR16R17, -(CR19R20)nOS(O)2(OR16), -(CR19R20)nOP(=Y')(OR16)(OR17), -(CR19R20)nOP(OR16)(OR17), -(CR19R20)nS(O)R16, -(CR19R20)nS(O)2R16, -(CR19R20)nS(O)2NR16R17, -(CR19R20)nS(O)(OR16), -(CR19R20)nS(O)2(OR16), -(CR19R20)nSC(=Y')R16, -(CR19R20)nSC(=Y')OR16, -(CR19R20)nSC(=Y')NR16R17 и R21; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
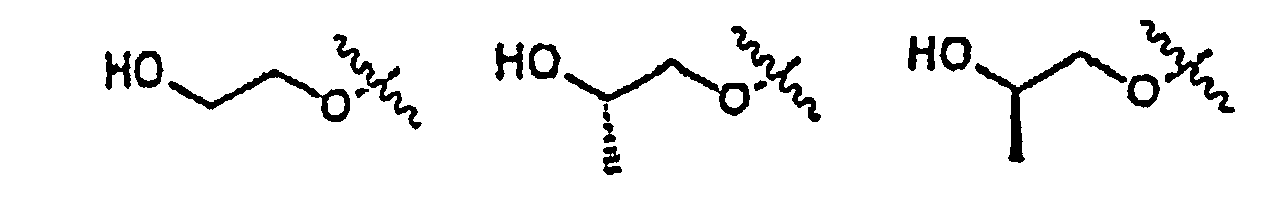
В еще одном варианте осуществления настоящего изобретения, X1 представляет собой:
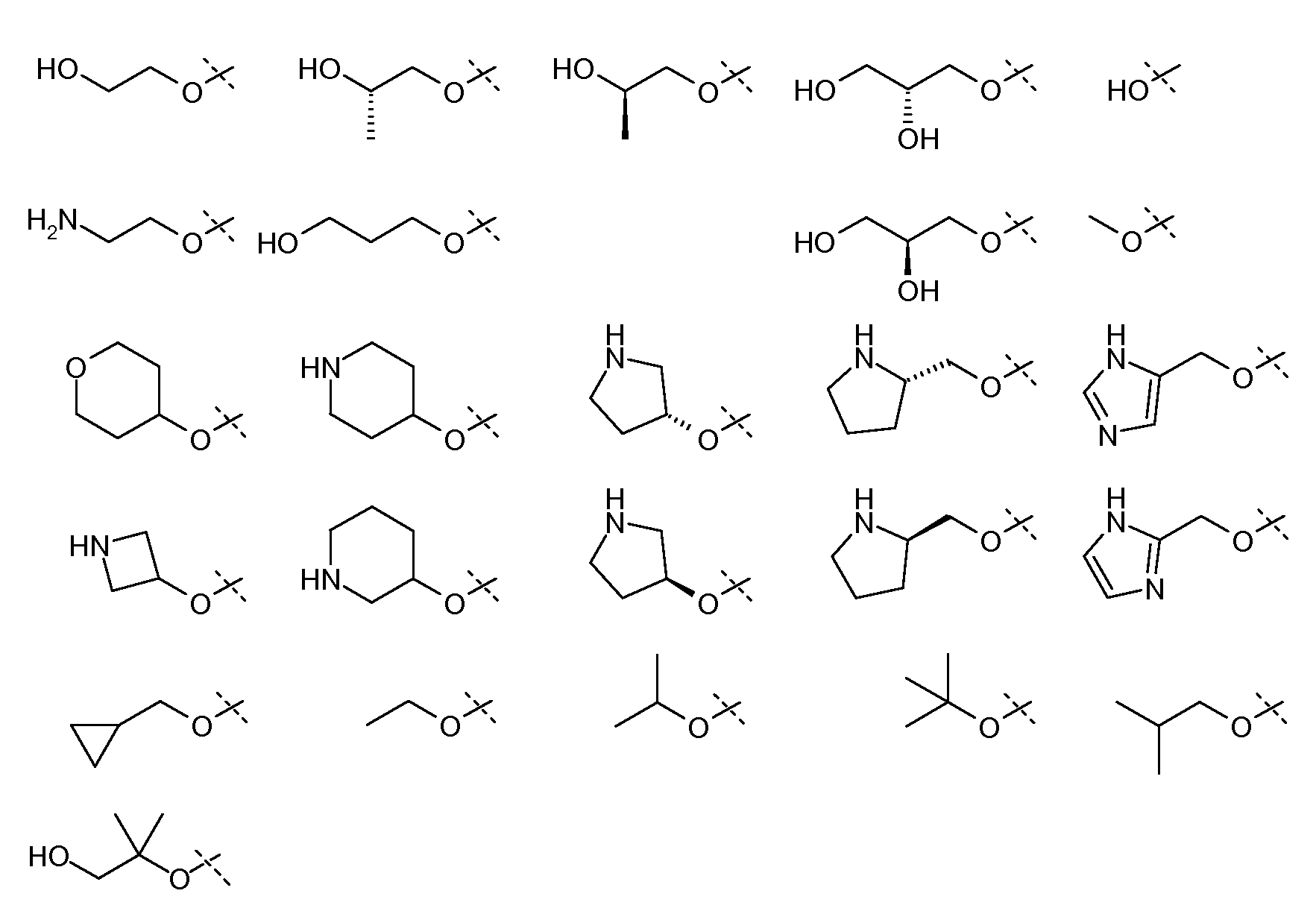
и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения, X1 представляет собой
 ;
;
и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В одном из вариантов осуществления настоящего изобретения W представляет собой -OR11′, в котором R11′ представляет собой H или C1-C12-алкил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения W представляет собой -OR11′, в котором R11′ представляет собой H; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения W представляет собой -OR11′, в котором R11′ представляет собой C1-C6-алкил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В одном из вариантов осуществления настоящего изобретения W′ представляет собой -NHSO2R8; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В одном из вариантов осуществления настоящего изобретения R6 представляет собой атом галогена, C2-C8-алкинил, карбоциклил или -SR16; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения R6 представляет собой атом галогена, C2-C3-алкинил, C3-карбоциклил, или -SR16; и все другие переменные имеют значения, указанные в формуле I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения R6 представляет собой Br, I, SMe, C3-карбоциклил или C2-алкинил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В одном из вариантов осуществления настоящего изобретения R6′ представляет собой H, атом галогена или C1-C3-алкил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В одном из вариантов осуществления настоящего изобретения R6′ представляет собой H, F, Cl или метил; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В еще одном варианте осуществления настоящего изобретения R6′ представляет собой F или Cl; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
В варианте осуществления настоящего изобретения p равно 1 или 2; и все другие переменные имеют значения, указанные для формулы I, I-a или I-b, или указанные в любом из упомянутых выше вариантов осуществления изобретения.
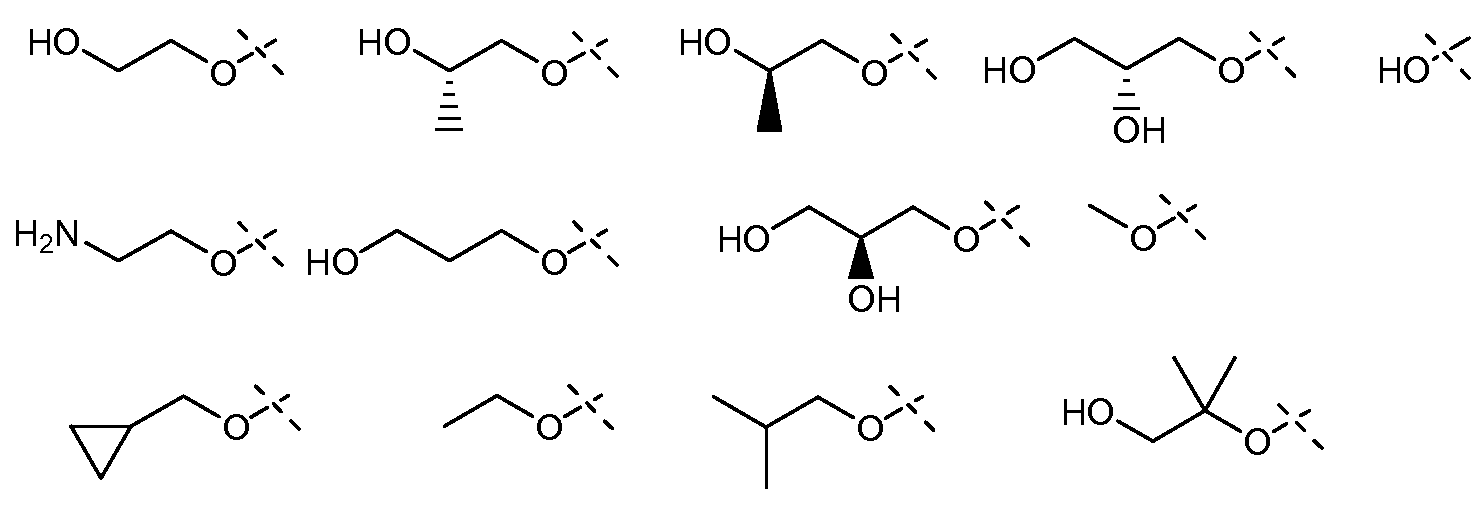
Еще в одном варианте осуществления настоящее изобретение включает соединения, описанные в примере 5, и приведенные ниже соединения:
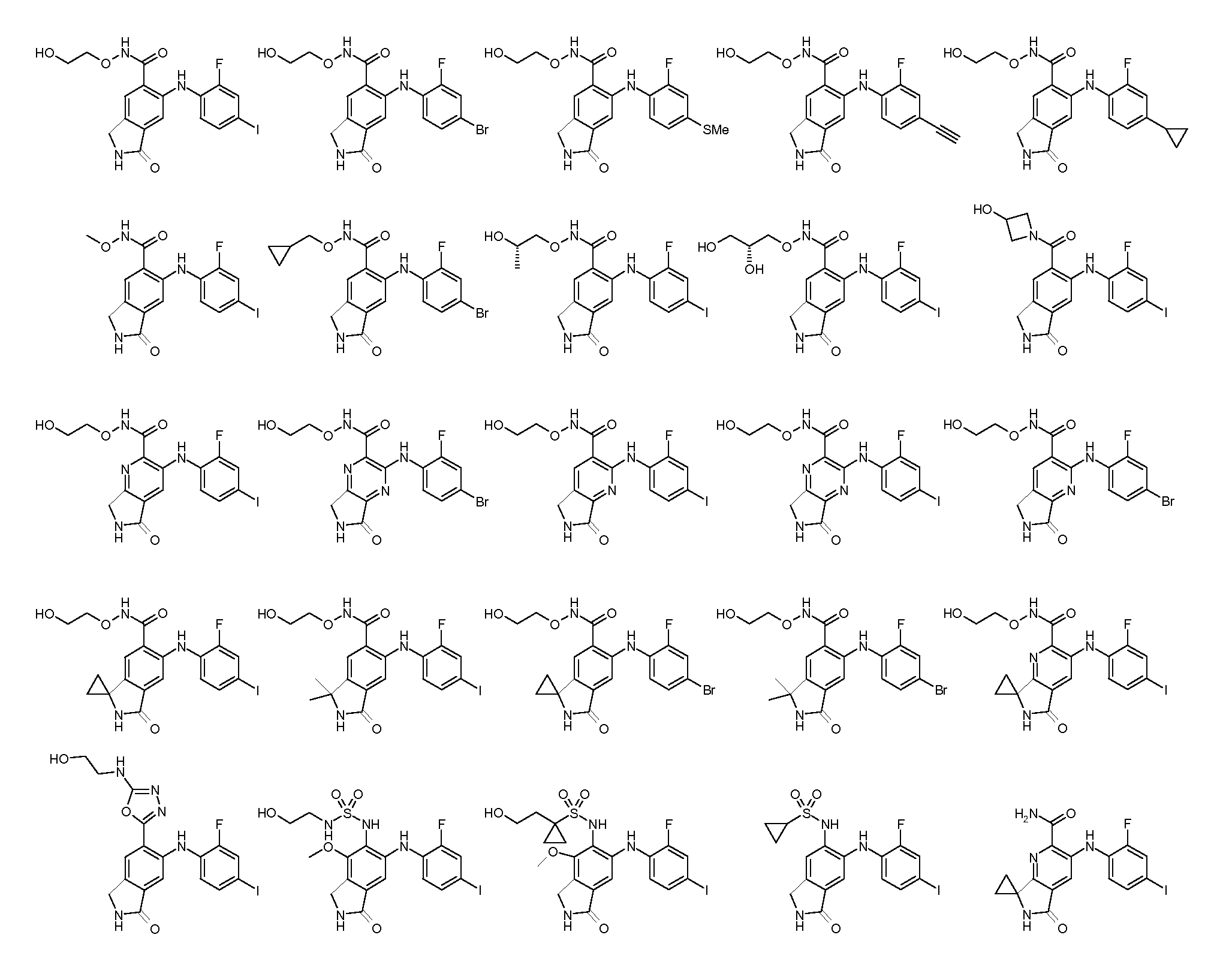
Получение соединений формулы I
Соединения формулы I можно получать согласно схеме 1.
Схема 1
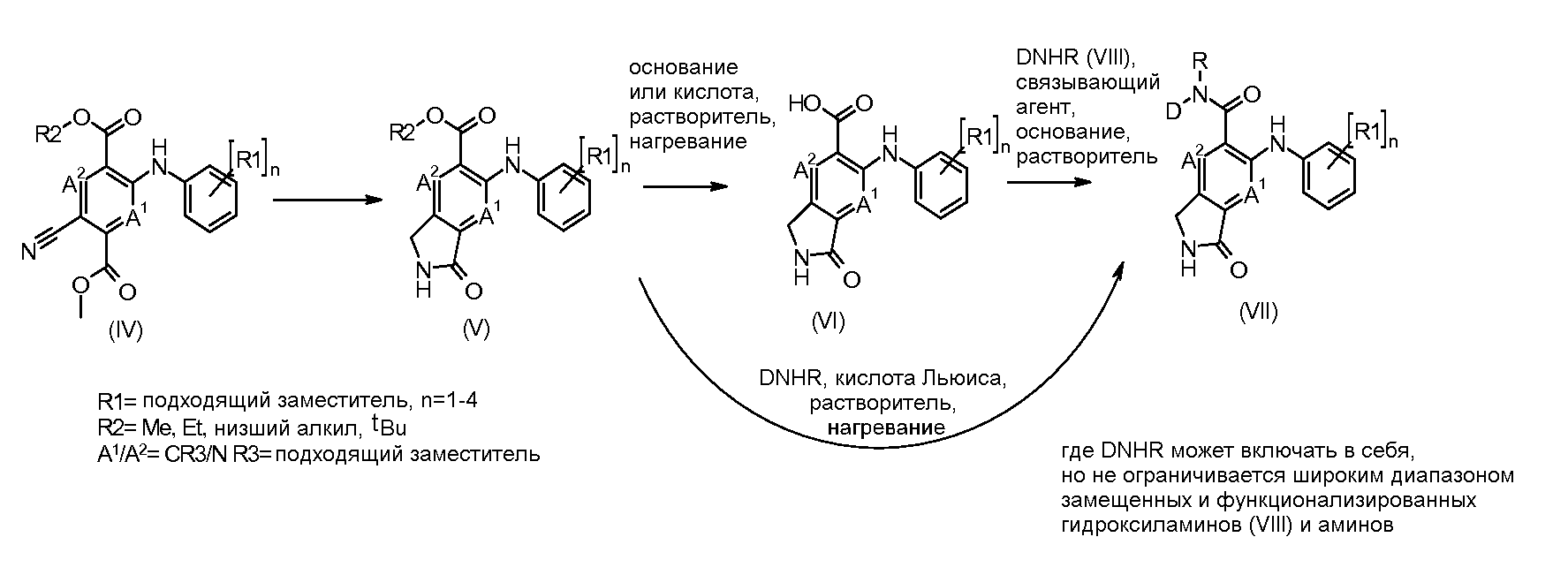
Соединения формулы (V) можно получать из соединений формулы (IV) путем восстановительной циклизации с применением восстановителя, такого как гидрид кобальта (образуемый на месте путем взаимодействия боргидрида натрия с хлоридом кобальта(II)) в растворителе, таком как метанол, при температуре от -20°C до 5°C. Альтернативно соединения формулы (V) можно получать из соединений формулы (IV) путем восстановления под давлением водорода (1-5 бар) в растворителе, таком как метанол или этанол, в присутствии катализатора, такого как никель Ренея.
Соединения формулы (VI) можно получать из соединений формулы (V), где R2=Me, этил, другой алкил, путем взаимодействия с основанием, таким как гидроксид натрия, в растворителе, таком как этанол или метанол, при температуре от комнатной температуры до температуры кипения. Когда R2=tBu, соединения формулы (VI) можно получать из соединений формулы (V) путем обработки чистой кислотой, такой как ТФУК, или в присутствии растворителя, такого как DCM, при температуре от 0°C до температуры кипения. Альтернативно, когда R2=Me, омыление можно проводить в нещелочных (неосновных) условиях путем обработки кислотой Льюиса, такой как бис(три-н-бутилолово)оксид, в растворителе, таком как толуол, при температуре от комнатной температуры до температуры кипения.
Соединения формулы (VI) можно подвергать взаимодействию с функционализированным гидроксиламином формулы (VIII) (имеющимся в продаже или полученным согласно схеме 3) или амином и подходящим связывающим агентом, таким как гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N′,N′-тетраметилурония, гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида или N,N'-дициклогексилкарбодиимид, в присутствии N-гидрокси-1,2,3-бензотриазола и подходящего основания, такого как диизопропилэтиламин или триэтиламин, в инертном растворителе, таком как тетрагидрофуран, N,N--диметилформамид или дихлорметан, при температуре около комнатной температуры, получая при этом соединения формулы (VII). Альтернативно, соединения формулы (VII) можно получать непосредственно из соединений формулы (V) путем взаимодействия с амином или гидроксиламином DNHR (VIII) в присутствии кислоты Льюиса, такой как триметилалюминий, в растворителе, таком как DCM, при температуре от комнатной температуры до температуры кипения.
Соединения формулы (IV) можно получать согласно схеме 2.
Схема 2
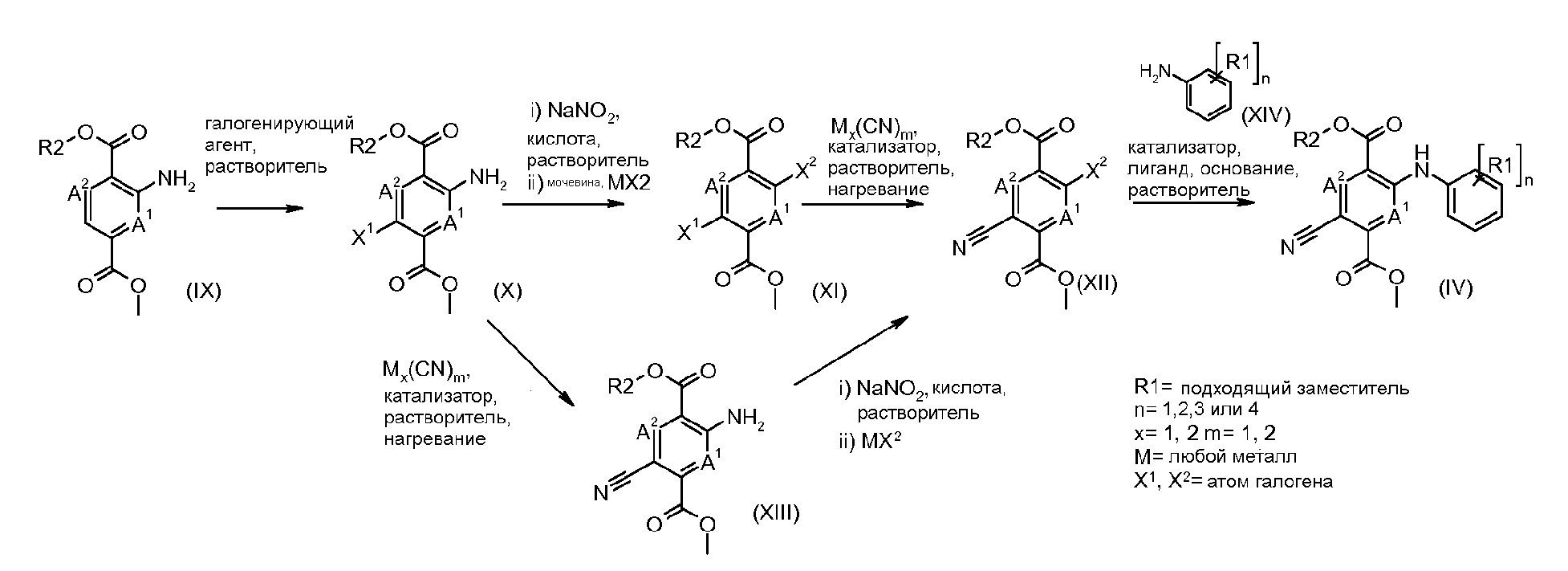
Соединения формулы (IV) можно получать из соединений формулы (XII) путем взаимодействия с анилином формулы (XIV) (вводя в состав подходящие заместители R1) в присутствии катализатора, такого как трис(дибензилиденацетон)дипалладий(0) или ацетат палладия(II), основания, такого как фосфат калия или карбонат цезия, лиганда, такого как фосфиновый лиганд Xantphos или 2-дициклогексилфосфино-2',6'-(диизопропокси)бифенил, подходящего растворителя, такого как толуол или DME, при температуре от комнатной температуры до температуры кипения растворителя или под воздействием микроволнового облучения при температуре от 70°C до 150°C. Соединения формулы (XII) можно получать из соединений формулы (XI) путем взаимодействия с неорганическим цианидом, таким как цианид цинка(II), в присутствии катализатора, такого как тетракис(трифенилфосфин)палладий(0), в растворителе, таком как DMF, при температуре от 50°C до температуры кипения или под воздействием микроволнового облучения при температуре от 100°C до 190°C. Соединения формулы (XI) можно получать из соединений формулы (X) путем взаимодействия с диазотирующим реагентом, таким как нитрит натрия, в растворителе, таком как ацетон, в присутствии кислоты, такой как серная кислота, при температуре от -25°C до комнатной температуры с последующей обработкой промежуточного диазосоединения мочевиной и затем галогенидной солью, такой как иодид калия. Соединения формулы (X) можно получать из соединения формулы (IX) с применением галогенирующего реагента, такого как бром, в растворителе, таком как дихлорметан, в присутствии основания, такого как пиридин, при температуре от 0°C до около комнатной температуры. Соединения формулы (IX) можно получать на коммерческой основе или получать с применением способов, описанных в литературе. Альтернативно соединения формулы (XII) можно получать из соединений формулы (XIII) с применением описанных способов образования соединений (XI) из соединений формулы (X). Соединения формулы (XIII) можно получать из соединений формулы (X) с применением описанных способов образования соединений формулы (XII) из соединений формулы (XI).
Гидроксиламины формулы (VIII) можно получать с применением способов, описанных в литературе, или с применением пути синтеза, представленного на схеме 3. Схема 3
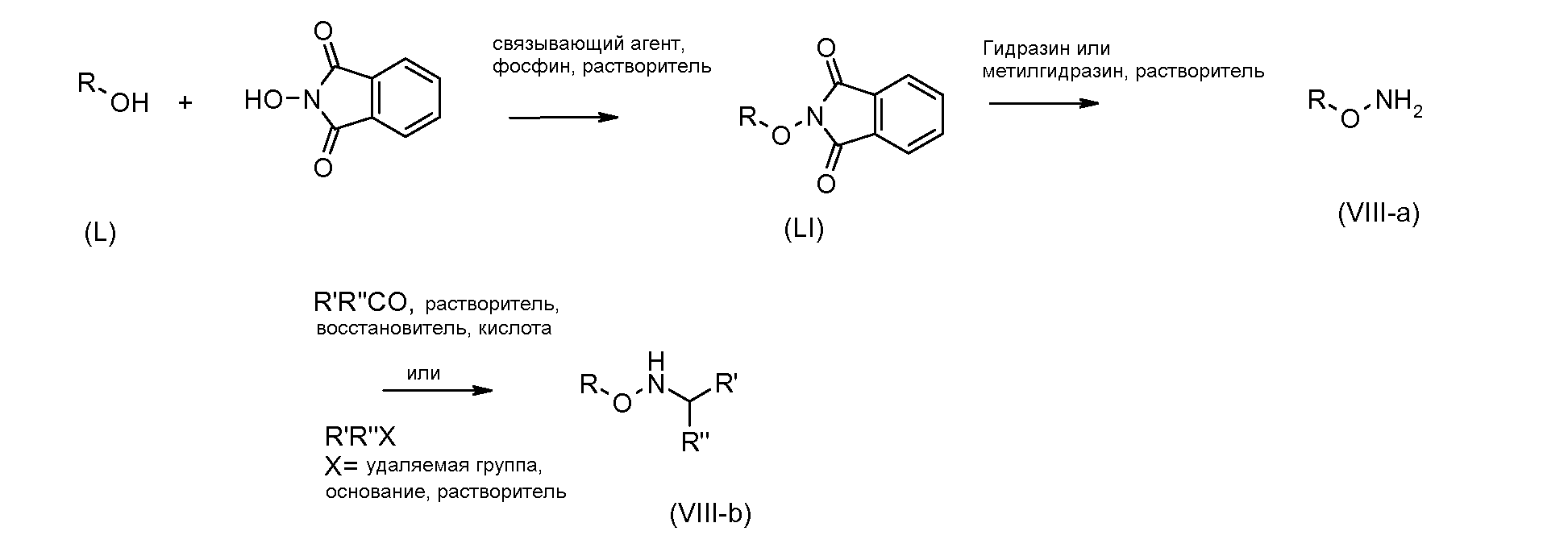
Первичные или вторичные спирты общей формулы (L) можно получать с применением способов, описанных в литературе. Их можно подвергать взаимодействию с N-гидроксифталимидом с применением фосфина и связывающего реагента, такого как диэтилазодикарбоксилат, получая при этом соединения общей формулы (LI).
С соединений общей формулы (LI) можно снимать защиту с применением гидразина или метилгидразина, получая при этом гидроксиламины общей формулы (VIII-a). Соединения формулы (VIII-a) можно дополнительно модифицировать путем восстановительного аминирования с помощью альдегидов или кетонов с применением восстановителя, такого как триацетоксиборгидрид натрия, цианоборгидрид натрия или боранпиридин, в растворителе, таком как дихлорэтан, при температуре от температуры окружающей среды до температуры кипения. Кроме того, соединения формулы (VIII-a) можно дополнительно модифицировать путем алкилирования с помощью алкилгалогенида в присутствии основания, такого как триэтиламин, в растворителе, таком как дихлорметан, получая при этом гидроксиламины общей формулы (VIII-b).
Анилины общей формулы (XIV), применяемые в описанных выше реакциях кросс-сочетания, можно получать с применением описанных в литературе способов или согласно схема 4.
Схема 4
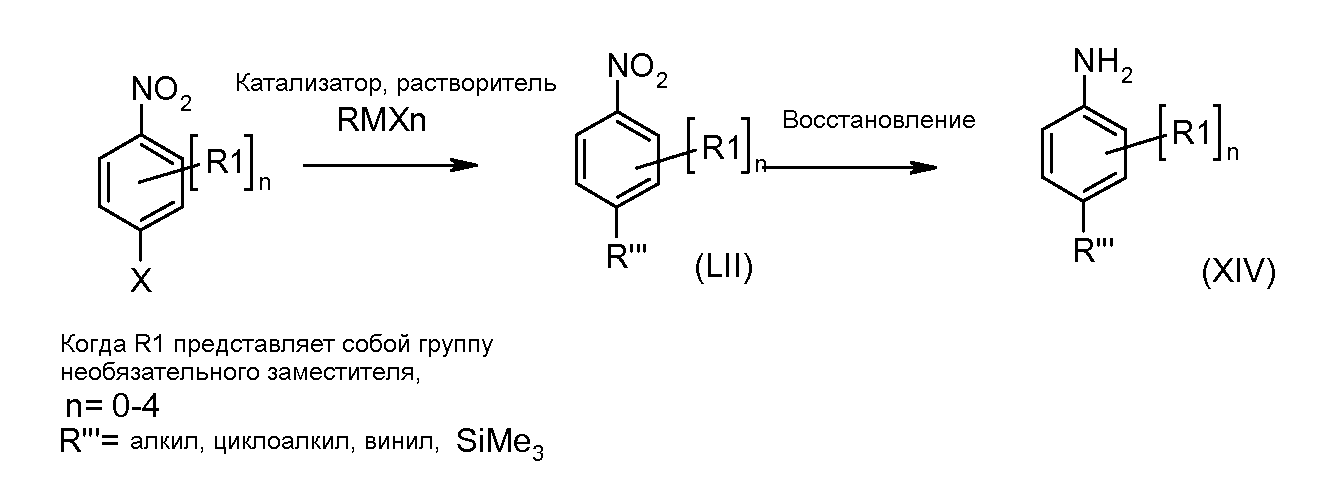
Замещенные 1-хлор-4-нитробензолы можно подвергать взаимодействию с металлсодержащим RMXn, таким как циклопропилбороновая кислота или гексаметилдисилазан, в растворителе, таком как ксилол, с применением катализатора, такого как тетракис(трифенилфосфин)палладий, при температуре от комнатной температуры до температуры кипения, получая при этом соединения формулы (LII). Нитрогруппу можно восстанавливать с применением описанных в литературе способов, таких как реакция в атмосфере водорода под давлением от 1 до 5 атмосфер, в присутствии катализатора, такого как палладий-на-углероде, и в растворителе, таком как этанол или этилацетат, при комнатной температуре, получая при этом соединения формулы (LIII).
Анилины формулы (XIV) можно получать согласно схеме 5.
Схема 5
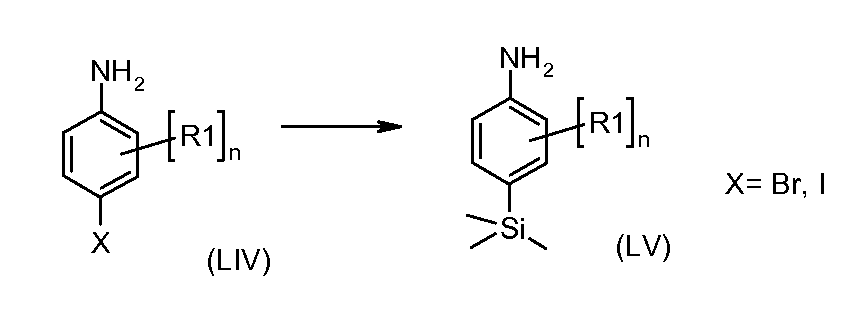
4-бром- или йоданилины формулы (LIV) можно подвергать взаимодействию с 2 эквивалентами сильного металлоорганического основания, такого как н-бутиллитий, в растворителе, таком как ТГФ, при температуре от -100°C до -20°C с последующим гашением промежуточного продукта ариллития электрофилом, таким как триметилсилилхлорид, получая при этом соединения формулы (LV).
Будет понятно, что, когда присутствуют подходящие функциональные группы, соединения формулы (I) или любые промежуточные продукты, применяемые для их получения, можно дополнительно дериватизировать с помощью одного или нескольких стандартных способов синтеза, используя реакции замещения, окисления, восстановления или расщепления. Конкретные реакции замещения включают общепринятые процедуры алкилирования, арилирования, гетероарилирования, ацилирования, сульфонилирования, галогенирования, нитрования, формилирования и связывания.
Например, арилбромидные или арилхлоридные группы можно превращать в арилиодиды с применением реакции Финкельштайна, используя такой источник иодида, как иодид натрия, катализатор, такой как иодид меди, и лиганд, такой как транс-N,N'-диметил-1,2-циклогександиамин, в растворителе, таком как 1,4-диоксан, и нагревая реакционную смесь при температуре кипения (с обратным холодильником). Арилтриалкилсиланы можно превращать в арилиодиды путем обработки силана с помощью такого источника иодида, как монохлорид йода, в растворителе, таком как дихлорметан, в присутствии кислоты Льюиса или без кислоты Льюиса, такой как тетрафторборат серебра, при температуре от -40°C до температуры кипения.
В дополнительном примере первичные аминогруппы (-NH2) можно алкилировать с применением способа восстановительного алкилирования, используя альдегид или кетон и боргидрид, например триацетоксиборгидрид натрия или цианоборгидрид натрия, в растворителе, таком как галогенированный углеводород, например 1,2-дихлорэтан, или спирт, такой как этанол; если необходимо, в присутствии кислоты, такой как уксусная кислота, при температуре, близкой к температуре окружающей среды. Аналогично можно алкилировать вторичные аминогруппы (-NH-), используя альдегид.
В дополнительном примере первичные аминогруппы или вторичные аминогруппы путем ацилирования можно превращать в амидные группы (-NHCOR' или -NRCOR'). Ацилирования можно достичь путем взаимодействия с подходящим хлорангидридом в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан, или путем взаимодействия с подходящей карбоновой кислотой в присутствии подходящего связывающего агента, такого как HATU гексафторфосфат (O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония), в подходящем растворителе, таком как дихлорметан. Аналогично, аминогруппы можно превращать в сульфонамидные группы (-NHSO2R' или -NR"SO2R') путем взаимодействия с подходящим сульфонилхлоридом в присутствии подходящего основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан. Первичные или вторичные аминогруппы можно превращать в мочевинные группы (-NHCONR'R" или -NRCONR'R") путем взаимодействия с подходящим изоцианатом в присутствии подходящего основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан.
Амин (-NH2) можно получать путем восстановления нитрогруппы (-NO2), например, путем каталитического гидрирования с применением, например, водорода в присутствии металлического катализатора, например, палладия на подложке, такой как углерод, в растворителе, таком как этилацетат или спирт, например, метанол. Альтернативно процесс превращения можно осуществлять путем химического восстановления с применением, например, металла, например олова или железа, в присутствии кислоты, такой как хлористоводородная кислота.
В дополнительном примере аминогруппы (-CH2NH2) можно получать путем восстановления нитрилов (-CN), например, путем каталитического гидрирования с применением, например, водорода в присутствии металлического катализатора, например, палладия на подложке, такой как углерод, или никеля Ренея, в растворителе, например, таком как простой эфир, циклический простой эфир, такой как тетрагидрофуран, при температуре от -78°C до температуры кипения растворителя.
В дополнительном примере аминогруппы (-NH2) можно получать из групп карбоновой кислоты (-CO2H) путем превращения до соответствующего ацилазида (-CON3), перегруппировки Курциуса и гидролиза полученного изоцианата (-N=C=O).
Альдегидные группы (-CHO) можно превращать в аминогруппы (-CH2NR5R")) путем восстановительного аминирования, используя амин и боргидрид, например, триацетоксиборгидрид натрия или цианоборгидрид натрия, в растворителе, таком как галогенированный углеводород, например дихлорметан, или спирт, такой как этанол; если необходимо, в присутствии кислоты, такой как уксусная кислота, при температуре, близкой к температуре окружающей среды.
В дополнительном примере альдегидные группы можно превращать в алкенильные группы (-CH=CHR') с помощью реакции Виттига или реакции Уодсворта-Эммонса с применением подходящего фосфорана или фосфоната в стандартных условиях, известных специалисту в данной области.
Альдегидные группы можно получать путем восстановления сложноэфирных групп (таких как -CO2Et) или нитрилов (-CN) с применением гидрида диизобутилалюминия в подходящем растворителе, таком как толуол. Альтернативно альдегидные группы можно получать путем окисления спиртовых групп с применением любого подходящего окислителя, известного специалисту в данной области.
Сложноэфирные группы (-CO2R') можно превращать в соответствующую кислотную группу (-CO2H) путем кислотно-катализируемого или основно-катализируемого гидролиза в зависимости от природы R. Если R представляет собой трет-бутил, кислотно-катализируемого гидролиза можно достичь, например, путем обработки органической кислотой, такой как трифторуксусная кислота, в водном растворителе или путем обработки неорганической кислотой, такой как хлористоводородная кислота, в водном растворителе.
Группы карбоновых кислот (-CO2H) можно превращать в амиды (CONHR' или -CONR'R") путем взаимодействия с подходящим амином в присутствии подходящего связывающего агента, такого как HATU, в подходящем растворителе, таком как дихлорметан.
В дополнительном примере карбоновые кислоты можно превращать в ближайший более высокий гомолог (гомологизировать) с помощью одного атома углерода (например, от -CO2H до -CH2CO2H) путем превращения в соответствующий хлорангидрид (-COC1) с последующим синтезом Арндта-Эйстерта.
В дополнительном примере OH-группы можно образовывать из соответствующего сложного эфира (например, -CO2R') или альдегида (-CHO) путем восстановления, например, с применением комплексного металлогидрида, такого как алюмогидрид лития, в простом диэтиловом эфире или тетрагидрофуране, или боргидрида натрия в растворителе, таком как метанол. Альтернативно спирт можно получать путем восстановления соответствующей кислоты (-CO2H) с применением, например, алюмогидрида лития в растворителе, таком как тетрагидрофуран, или с применением борана в растворителе, таком как тетрагидрофуран.
Спиртовые группы можно превращать в удаляемые группы, такие как атомы галогена или сульфонилоксигруппы, такие как алкилсульфонилокси, например трифторметилсульфонилокси или арилсульфонилокси, например, п-толуолсульфонилоксигруппу, применяя условия, известные специалисту в данной области. Например, спирт можно подвергать взаимодействию с тионилхлоридом в галогенированном углеводороде (например, дихлорметане), получая при этом соответствующий хлорид. В реакции также можно применять основание (например, триэтиламин).
В еще одном примере спиртовые, фенольные или амидные группы можно алкилировать путем конденсации фенола или амида со спиртом в растворителе, таком как тетрагидрофуран, в присутствии фосфина, например трифенилфосфина, и активатора, такого как диэтил-, диизопропил- или диметилазодикарбоксилат. Альтернативно алкилирования можно достичь путем депротонирования с применением подходящего основания, например гидрида натрия, с последующим дополнительным добавлением алкилирующего средства, такого как алкилгалогенид.
Галогенные заместители на ароматическом кольце в соединениях можно подвергать замене галогена на металл путем обработки основанием, например литиевым основанием, таким как н-бутиллитий или трет-бутиллитий, необязательно при низкой температуре, например, около -78°C, в растворителе, таком как тетрагидрофуран, и затем гасить с помощью электрофила для введения желательного заместителя. Таким образом, например, формильную группу можно вводить путем применения в качестве электрофила N,N-диметилформамида. Альтернативно галогенные заместители на ароматическом кольце можно подвергать реакциям, катализируемым металлами (например, палладием или медью), для введения заместителей в виде, например, кислотных, сложноэфирных, циано, амидных, арильных, гетероарильных, алкенильных, алкинильных, тио- или аминогрупп. Подходящие процедуры, которые можно использовать, включают процедуры, описанные в публикациях Heck, Suzuki, Stille, Buchwald или Hartwig.
Галогенные заместители на ароматическом кольце также могут подвергаться нуклеофильному замещению в результате реакции с подходящим нуклеофильным реагентом, таким как амин или спирт. Предпочтительно такую реакцию можно осуществлять при повышенной температуре в присутствии микроволнового облучения.
Соединения по настоящему изобретению испытывали на их способность ингибировать активность и активацию MEK (основные испытания) и в отношении их биологических воздействий на растущие клетки (дополнительные испытания), как описано ниже. Соединения по настоящему изобретению с IC50 менее 5 мкМ (более предпочтительно менее 0,1 мкМ, наиболее предпочтительно менее 0,01 мкМ) в испытании активности MEK по примеру 1, с IC50 менее 5 мкМ (более предпочтительно менее 1 мкМ, еще более предпочтительно менее 0,1 мкМ, наиболее предпочтительно менее 0,01 мкМ) в испытании активации MEK по примеру 2, с EC50 менее 10 мкМ (более предпочтительно менее 1 мкМ, еще более предпочтительно менее 0,5 мкМ, наиболее предпочтительно менее 0,1 мкМ) в испытании пролиферации клеток по примеру 3, и/или EC50 менее 10 мкМ (более предпочтительно менее 1 мкМ, еще более предпочтительно менее 0,5 мкМ, наиболее предпочтительно менее 0,1 мкМ) в испытании фосфорилирования ERK по примеру 4, применимы в качестве ингибиторов MEK.
Настоящее изобретение включает композицию (например, фармацевтическую композицию), содержащую соединение формулы I (и/или его сольваты и/или соли) и носитель (фармацевтически приемлемый носитель). Настоящее изобретение также включает композицию (например, фармацевтическую композицию), содержащую соединение формулы I (и/или его сольваты и/или соли) и носитель (фармацевтически приемлемый носитель), и дополнительно содержащую второе химиотерапевтическое и/или второе противовоспалительное средство, такое как описанные в описании средства. Настоящие композиции применимы для ингибирования аномального роста клеток или лечения гиперпролиферативного расстройства у млекопитающего (например, человека). Настоящие композиции также применимы для лечения воспалительных заболеваний у млекопитающего (например, человека).
Настоящие соединения и композиции также применимы для лечения аутоиммунного заболевания, деструктивного поражения костей, пролиферативных расстройств, инфекционного заболевания, вирусного заболевания, фиброзирующего заболевания или нейродегенеративного заболевания у млекопитающего (например, человека). Примеры таких заболеваний/расстройств включают, но не ограничиваются перечисленным, диабет и диабетические осложнения, диабетическую ретинопатию, ретинопатию недоношенных, возрастную дегенерацию желтого пятна, гемангиому, идиопатический фиброз легких, ринит и атопический дерматит, болезнь почек и почечную недостаточность, поликистозную болезнь почек, застойную сердечную недостаточность, нейрофиброматоз, отторжение трансплантатов при пересадке органов, кахексию, удар, септический шок, сердечную недостаточность, отторжение трансплантатов при пересадке органов, болезнь Альцгеймера, хроническую или невропатическую боль и вирусные инфекции, такие как ВИЧ, вирус гепатита B (HBV), папилломавирус человека (HPV), цитомегаловирус (CMV) и вирус Эпштейна-Барра (EBV). Хроническая боль для целей настоящего изобретения включает, но не ограничивается перечисленным, идиопатическую боль и боль, ассоциированную с хроническим алкоголизмом, витаминной недостаточностью, уремией, гипотиреозом, воспалением, артритом, и послеоперационную боль. Невропатическая боль ассоциирована с многочисленными состояниями, которые включают, но не ограничиваются перечисленным, воспаление, послеоперационную боль, фантомную боль в ампутированных конечностях, ожоговую боль, боль при подагре, тригеминальной невралгии, острую герпетическую и постгерпетическую боль, боль при каузалгии, диабетической невропатии, разрыве сплетения, невроме, васкулите, вирусной инфекции, повреждении с размозжением тканей, компрессии, повреждении тканей, ампутации конечностей, артрите и повреждении нервов между периферической нервной системой и центральной нервной системой.
Настоящие соединения и композиции также применимы для лечения панкреатита или болезни почек (включая пролиферативный гломерулонефрит и болезнь почек, вызванную диабетом) у млекопитающего (например, человека).
Настоящие соединения и композиции также применимы для предотвращения имплантации бластоцитов у млекопитающего (например, человека).
Настоящее изобретение включает способ ингибирования аномального роста клеток или лечения гиперпролиферативного расстройства у млекопитающего (например, человека), включающий введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и/или солей) или его композиции. Также в настоящее изобретение включен способ лечения воспалительного заболевания млекопитающего (например, человека), включающий введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и/или солей) или его композиции.
Настоящее изобретение включает способ ингибирования аномального роста клеток или лечения гиперпролиферативного расстройства млекопитающего (например, человека), включающий введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и/или солей) или его композиции в комбинации со вторым химиотерапевтическим средством, таким как описанные в описании химиотерапевтические средства. Настоящее изобретение также включает способ лечения воспалительного заболевания млекопитающего (например, человека), включающий введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и/или солей) или его композиции в комбинации со вторым противовоспалительным средством, таким как описанные в описании противовоспалительные средства.
Настоящее изобретение включает способ лечения аутоиммунного заболевания, деструктивного поражения костей, пролиферативных расстройств, инфекционного заболевания, вирусного заболевания, фиброзного заболевания или нейродегенеративного заболевания млекопитающего (например, человека), включающий введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции, необязательно дополнительно содержащей второе терапевтическое средство. Примеры таких заболеваний/расстройств включают, но не ограничиваются перечисленным, диабет и дабетические осложнения, диабетическую ретинопатию, ретинопатию недоношенных, возрастную дегенерацию желтого пятна, гемангиому, идиопатический фиброз легких, ринит и атопический дерматит, болезнь почек и почечную недостаточность, поликистозную болезнь почек, застойную сердечную недостаточность, нейрофиброматоз, отторжение трансплантатов при пересадке органов, кахексию, удар, септический шок, сердечную недостаточность, отторжение трансплантатов при пересадке органов, болезнь Альцгеймера, хроническую или невропатическую боль и вирусные инфекции, такие как ВИЧ, вирус гепатита B (HBV), папилломавирус человека (HPV), цитомегаловирус (CMV) и вирус Эпштейна-Барра (EBV).
Настоящее изобретение включает способ лечения панкреатита или болезни почек (включая пролиферативный гломерулонефрит и болезнь почек, вызванную диабетом) млекопитающего (например, человека), включающий введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции, необязательно дополнительно содержащей второе терапевтическое средство.
Настоящее изобретение включает способ предотвращения имплантации бластоцитов у млекопитающего (например, человека), включающий введение упомянутому млекопитающему терапевтически эффективного количества соединения формулы I (и/или его сольватов и солей) или его композиции, необязательно дополнительно содержащей второе терапевтическое средство.
Настоящее изобретение включает способ применения настоящих соединений для in vitro, in situ и in vivo диагностики или обработки клеток млекопитающих, организмов или для лечения ассоциированных патологических состояний.
Также считается, что соединения по настоящему изобретению могут приводить аномальные клетки в состояние, более восприимчивое к лучевой обработке с целью подавления и/или ингибирования роста таких клеток. Соответственно, данное изобретение дополнительно относится к способу сенсибилизации аномальных клеток млекопитающего (например, человека) в случае лучевой обработки, который включает введение упомянутому млекопитающему некоторого количества соединения формулы I (и/или его сольватов и солей) или его композиции, которое эффективно для сенсибилизации аномальных клеток в случае лучевой обработки.
Введение соединений по настоящему изобретению (в дальнейшем активного соединения (соединений)) можно осуществлять любым способом, который позволяет доставлять соединения к месту приложения действия. Такие способы включают пероральные пути, интрадуоденальные пути, парентеральную инъекцию (включая внутривенную, подкожную, внутримышечную, интраваскулярную или инфузию), местное введение, ингаляцию и ректальное введение.
Количество вводимого активного соединения будет зависеть от субъекта, подвергаемого лечению, серьезности расстройства или состояния, дозировки, фармакокинетики соединения и выбора лечащего врача. Однако эффективная доза находится в диапазоне от приблизительно 0,001 до приблизительно 100 мг на кг веса тела в день, предпочтительно от приблизительно 1 до приблизительно 35 мг/кг/день, в виде одной или повторяемых через определенные интервалы времени доз. Для человека весом 70 кг такая дозировка могла бы составлять от приблизительно 0,05 до 7 г/день, предпочтительно от приблизительно 0,05 до приблизительно 2,5 г/день. В некоторых случаях уровни дозировки ниже нижнего предела вышеупомянутого диапазона могут быть более чем достаточны, в то время как в других случаях можно использовать еще более большие дозы без причинения какого-либо вредного побочного эффекта, при условии, что такие более большие дозы сначала делятся на несколько небольших доз для введения в течение дня.
Активное соединение можно применять в виде единственной терапии или в комбинации с одним или несколькими химиотерапевтическими или противовоспалительными средствами, например, описанными в описании химиотерапевтическими или противовоспалительными средствами. Такое совместное лечение можно обеспечить путем одновременного, последовательного или отдельного введения доз индивидуальных компонентов лечения.
Фармацевтическая композиция, например, может находиться в форме, подходящей для перорального введения, в виде таблетки, капсулы, драже, порошка, препаратов замедленного высвобождения, раствора, суспензии; для парентеральной инъекции в виде стерильного раствора, суспензии или эмульсии; для местного введения в виде мази или крема или для ректального введения в виде суппозитория. Фармацевтическая композиция может находиться в стандартных лекарственных формах, подходящих для разового введения определенных доз. Фармацевтическая композиция будет включать общепринятый фармацевтический носитель или инертный наполнитель и соединение согласно изобретению в качестве активного ингредиента. Кроме того, она может включать другие лекарственные или фармацевтические средства, носители, вспомогательные вещества и т.д.
Типичные формы для парентерального введения включают растворы или суспензии активных соединений в стерильных водных растворах, например в водных растворах пропиленгликоля или декстрозы. Если это желательно, такие лекарственные формы могут быть соответствующим образом забуферены.
Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители. Фармацевтические композиции, если желательно, могут содержать дополнительные ингредиенты, такие как корригенты, связующие, инертные наполнители и т.п. Таким образом, для перорального введения таблетки, содержащие различные инертные наполнители, такие как лимонная кислота, можно использовать вместе с различными разрыхлителями, такими как крахмал, альгиновая кислота, определенными комплексными силикатами и со связующими средствами, такими как сахароза, желатин и аравийская камедь. Дополнительно для целей таблетирования часто применяются смазывающие средства, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа также можно использовать в мягких и твердых заполненных желатиновых капсулах. Предпочтительные материалы, следовательно, включают лактозу или молочный сахар и полиэтиленгликоли с высокой молекулярной массой. Когда для перорального введения желательно применять водные суспензии или эликсиры, активное соединение в них можно объединять с различными подсластителями или ароматизаторами, окрашивающими веществами или красителями и, если желательно, эмульгаторами или суспендирующими средствами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их комбинации.
Способы получения различных фармацевтических композиций с определенным количеством активного соединения известны или будут очевидны специалисту в данной области. Например, см. Remington's Pharmaceutical Sciences, Mack Publishing Company, Ester, Pa., 15.sup.th Edition (1975).
ПРИМЕРЫ
Сокращения
Н-BuLi - н-бутиллитий
CDCl3 - дейтерированный хлороформ
CD3OD - дейтерированный метанол
CH2Cl2 - дихлорметан
DCM - дихлорметан
DIPEA - диизопропилэтиламин
DMF - диметилформамид
ДМСО(DMSO) - диметилсульфоксид
Dppf - 1,1'-бис(дифенилфосфино)ферроцен
EDCI - гидрохлорид 1-этил-3-(3'-диметиламинопропил)карбодиимида
Et3N - триэтиламин
Et2O - простой диэтиловый эфир
HATU - гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония
HCl - хлористоводородная кислота
HMN - диатомовая земля
HOBt - 1-гидроксибензотриазол
H2SO4 - серная кислота
ICl - монохлорид йода
IMS - промышленно денатурированные спирты (денатураты)
LHMDS - бис(триметилсилил)амид лития
MeOH - метанол
MgSO4 - сульфат магния
Na2SO4 - сульфат натрия
NBS - N-бромсукцинимид
Pd(PPh3)4 - тетракис(трифенилфосфин)палладий(0)
Pd2dba3 - трис(дибензилиденацетон)дипалладий(0)
Si-PPC - картридж с расфасованным диоксидом кремния для флэш-хроматографии: Isolute®SPE, Biotage SNAP® или ISCO Redisep®
SCX-2 - сорбент на основе диоксида кремния Isolute®, химически связанный с функциональной группой пропилсульфоновой кислоты.
ТГФ - тетрагидрофуран
Общие экспериментальные условия
1H ЯМР спектры записывали при температуре окружающей среды с применением спектрометра Varian Unity Inova (400 МГц) с 5 мм датчиком тройного резонанса. Химические сдвиги выражали в м.д. относительно тетраметилсилана. Применяли следующие сокращения: br = уширенный сигнал, s = синглет, d = дублет, dd = двойной дублет, t = триплет, q = квартет, m = мультиплет.
Эксперименты по жидкостной хроматографии высокого разрешения/масс-спектрометрии (ЖХ/МС) для определения времен удерживания (RT) и присоединенных масс ионов проводили с применением одного из следующих способов.
Способ A: Эксперименты проводили на квадрупольном масс-спектрометре Waters Micromass ZQ, связанном с системой Hewlett Packard HPl 100 LC с диодно-матричным детектором. В такой системе применяется колонка Higgins Clipeus 5 микрон C18 100×3,0 мм и скорость потока 1 мл/минута. Применяемая на начальном этапе система растворителей состояла из 95% воды, содержащей 0,1% муравьиной кислоты (растворитель A) и 5% ацетонитрила, содержащего 0,1% муравьиной кислоты (растворитель B) в течение первой минуты с последующим созданием градиента до 5% растворителя A и 95% растворителя B в течение следующих 14 минут. Применяемая на заключительном этапе система растворителей оставалась постоянной в течение дополнительных 5 минут.
Способ B: Эксперименты проводили на квадрупольном масс-спектрометре Waters Platform LC, связанном с системой Hewlett Packard HPl 100 LC с диодно-матричным детектором и автосамплером со 100 позициями, с применением колонки Phenomenex Luna C18(2) 30×4,6 мм и скорости потока 2 мл/минута. Система растворителей состояла из 95% воды, содержащей 0,1% муравьиной кислоты (растворитель A), и 5% ацетонитрила, содержащего 0,1% муравьиной кислоты (растворитель B), в течение первых 0,50 минуты с последующим созданием градиента до 5% растворителя A и 95% растворителя B в течение следующих 4 минут. Применяемая на заключительном этапе система растворителей оставалась постоянной в течение дополнительных 0,50 минуты.
Способ C: Эксперименты проводили на квадрупольном масс-спектрометре PE Sciex API 150 EX, связанном с системой Shimadzu LC-10AD LC с диодно-матричным детектором и автосамплером с 225 позициями, с применением колонки Kromasil C18 50×4,6 мм и скорости потока 3 мл/минута. Система растворителей соответствовала градиенту, начинающемуся со 100% воды с 0,05% ТФУК (растворитель A) и 0% ацетонитрила с 0,0375% ТФУК (растворитель B) и в течение 4 минут возрастающему до 10% растворителя A и 90% растворителя B. Применяемая на заключительном этапе система растворителей оставалась постоянной в течение дополнительных 0,50 минуты.
Способ D: Эксперименты проводили на масс-спектрометре/жидкостном хроматографе Agilent Technologies, связанном с системой Agilent Technologies Series 1200 LC с диодно-матричным детектором, с применением колонки Zorbax 1,8 микрон SB-C18 30×2,1 мм со скоростью потока 1,5 мл/минута. Применяемая на начальном этапе система растворителей состояла из 95% воды, содержащей 0,05% трифторуксусной кислоты (растворитель A), и 5% ацетонитрила, содержащего 0,05% трифторуксусной кислоты (растворитель B), с последующим созданием градиента до 5% растворителя A и 95% растворителя B в течение 1,5 минуты. Применяемая на заключительном этапе система растворителей оставалась постоянной в течение дополнительной 1 минуты.
Способ E: Эксперименты проводили на масс-спектрометре/жидкостном хроматографе Agilent Technologies, связанном с системой Agilent Technologies Series 1200 LC с диодно-матричным детектором, с применением колонки Zorbax 1,8 микрон SB-C18 30×2,1 мм и скорости потока 0,6 мл/минута. Применяемая на начальном этапе система растворителей состояла из 95% воды, содержащей 0,05% трифторуксусной кислоты (растворитель A), и 5% ацетонитрила, содержащего 0,05% трифторуксусной кислоты (растворитель B), с последующим созданием градиента до 5% растворителя A и 95% растворителя B в течение 9,0 минуты. Применяемая на начальном этапе система растворителей оставалась постоянной в течение дополнительной 1 минуты.
Эксперименты по микроволновому облучению осуществляли с применением оборудования Personal Chemistry Emrys InitiatorTM или OptimizerTM, в котором применяется одномодовый резонатор и настройка динамического поля, оба из которых показывали воспроизводимость и управляемость. Можно было обеспечивать температуру от 40 до 250°C и повышать давления до 20 бар.
ПРИМЕР 1 Анализ MEK (анализ активности MEK)
В качестве источника ферментативной активности применяли конститутивно активированную человеческую мутантную MEK1, экспрессируемую в клетках насекомых, при конечной концентрации при анализе киназы 15 нМ.
Анализ проводили в течение 30 минут в присутствии 50 мкМ АТФ с применением рекомбинантной GST-ERK1, продуцируемой в E. coli, в качестве субстрата. Детектировали и количественно определяли фосфорилирование субстрата с помощью реагентов HTRF, поставляемых компанией Cisbio. Они состоят из антитела против GST, конъюгированного с аллофикоцианином (XL665), и антитела против фосфо(Thr202/Tyr204) ERK, конъюгированного с европиевой меткой (криптатом европия). Их применяли при конечной концентрации 4 мкг/мл и 0,84 мкг/мл соответственно. Антитело против фосфо(Thr202/Tyr204) ERK признает ERKl, дважды фосфорилированную по Thr202 и Tyr204. Когда оба антитела связаны с ERK1 (т.е. когда субстрат фосфорилирован), происходит передача энергии от криптата к аллофикоцианину, сопровождающаяся излучением при 340 нм, приводящим к испусканию флуоресценции, которая пропорциональна количеству образующегося фосфорилированного субстрата. Флуоресценцию детектировали с помощью многолуночного флуориметра.
Перед добавлением к буферу для анализа соединения разбавляли в ДМСО, и конечная концентрация ДМСО при анализе составляла 1%.
IC50 определяется как концентрация, при которой данное соединение обеспечивает 50%-ное ингибирование контрольного образца. Значения IC50 рассчитывали с помощью пакета программного обеспечения XLfit (версия 2.0.5).
При анализе, описанном в примере 1, указанное в заголовке соединение по примеру 5 показывало IC50 менее 0,1 мкМ.
ПРИМЕР 2 Анализ bRaf (анализ активации MEK)
В качестве источника ферментативной активности применяли конститутивно активированную мутантную bRaf, экспрессируемую в клетках насекомых.
Анализ проводили в течение 30 минут в присутствии 200 мкМ АТФ с применением рекомбинантной GST-ERK1, продуцируемой в E. coli, в качестве субстрата. Детектировали и количественно определяли фосфорилирование субстрата с помощью HTRF и реагентов, поставляемых компанией Cisbio. Они состоят из антитела против GST, конъюгированного с аллофикоцианином (XL665), и антитела против фосфо(Ser217/Ser221) МЕК, конъюгированного с криптатом европия. Антитело против фосфо(Ser217/Ser221)МЕК признает МЕК, дважды фосфорилированную по Ser217 и Ser221, или единожды фосфорилированную по Ser217. Когда оба антитела связаны с MEK (т.е. когда субстрат фосфорилирован), происходит передача энергии от криптата к аллофикоцианину, сопровождающаяся излучением при 340 нм, приводящим к испускаемой флуоресценции, которая пропорциональна количеству образующегося фосфорилированного субстрата. Флуоресценцию детектировали с применением многолуночного флуориметра.
Перед добавлением к буферу для анализа соединения разбавляли в ДМСО, и конечная концентрация ДМСО при анализе составляла 1%.
IC50 определяется как концентрация, при которой данное соединение обеспечивает 50%-ное ингибирование контрольного образца. Значения IC50 рассчитывали с помощью пакета программного обеспечения XLfit (версия 2.0.5).
ПРИМЕР 3 Исследование пролиферации клеток
Соединения испытывали с помощью исследования пролиферации клеток с применением следующих клеточных линий:
HCT116 колоректальная карцинома человека (ATCC)
A375 злокачественная меланома человека (ATCC)
Обе клеточных линии содержались в среде DMEM/F12 (1:1) (Gibco), дополненной 10% FCS при 37°С во влажной камере с атмосферой, содержащей 5% СО2.
Клетки высевали в 96-луночные планшеты в количестве 2000 клеток/лунка и спустя 24 часа подвергали их воздействию растворов соединений в 0,83% ДМСО при различных концентрациях. Клетки выращивали в течение дополнительных 72 часов и в каждую лунку добавляли равный объем реагента CellTiter-Glo (Promega). Это приводило к лизису клеток и генерации люминесцентного сигнала, пропорционального количеству высвобождаемого АТФ (и, следовательно, пропорционального числу клеток в лунке), который можно детектировать с помощью многолуночного люминометра.
EC50 определяется как концентрация, при которой данное соединение обеспечивает 50%-ное ингибирование контрольного образца. Значения EC50 рассчитывали с помощью пакета программного обеспечения XLfit (версия 2.0.5).
При данном исследовании указанное в заголовке соединение по примеру 5 показывало EC50 менее чем 0,5 мкМ для обеих клеточных линий.
ПРИМЕР 4 Клеточный анализ фосфо-ERK
Соединения испытывали в клеточном анализе фосфо-ERK ELISA с применением следующих клеточных линий:
HCT116 колоректальная карцинома человека (ATCC)
A375 злокачественная меланома человека (ATCC)
Обе клеточных линии содержались в среде DMEM/F12 (1:1) (Gibco), дополненной 10% FCS при 37°С во влажной камере с атмосферой, содержащей 5% СО2.
Клетки высевали в 96-луночные планшеты в количестве 2000 клеток/лунка и спустя 24 часа подвергали их воздействию растворов соединений в 0,83% ДМСО при различных концентрациях. Клетки выращивали в течение дополнительных 2-х или 24-х часов, фиксировали формальдегидом (конечная концентрация 2%) и пермеабилилировали метанолом. После блокирования с применением TBST-3% BSA фиксированные клетки инкубировали с первичным антителом (кроличье антитело против фосфо-ERK) в течение ночи при 4°C. Клетки инкубировали с иодидом пропидия (флуоресцентным красителем для окрашивания ДНК) и проводили детектирование клеточной p-ERK с применением вторичного антикроличьего антитела, конъюгированного с флуоресцентным красителем Alexa Fluor 488 (молекулярный зонд). Анализировали данные флуоресценции с применением оборудования Acumen Explorer (TTP Labtech), лазерного сканирующего цитометра для работы с микропланшетами, и проводили нормализацию сигнала от флуоресцентного красителя Alexa Fluor 488 до PI-сигнала (пропорционального числу клеток).
EC50 определяется как концентрация, при которой данное соединение обеспечивает половину сигнала между минимальным и максимальным ответом. Значения EC50 рассчитывали с помощью пакета программного обеспечения XLfit (версия 2.0.5).
В данном анализе указанное в заголовке соединение по примеру 5 показывало EC50 менее чем 0,5 мкМ для клеточной линии HCTl16.
СИНТЕЗ ИЗОИНДОЛОНОВ
2-фтор-4-триметилсиланилфениламин
Способ A, стадия 1: (3-фтор-4-нитрофенил)триметилсилан
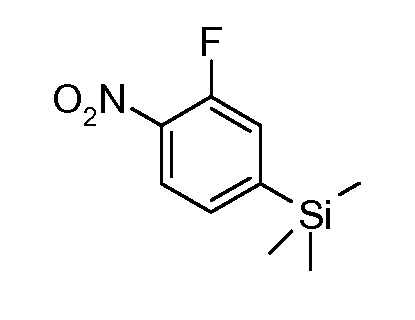
4-хлор-2-фтор-1-нитробензол (97,2 г, 0,55 моль) растворяли в смеси ксилолов (208 мл) и добавляли гексаметилдисилан (306 г, 2,78 моль). В течение 20 минут через смесь барботировали аргон, затем добавляли Pd(PPh3)4 (16,2 г, 14 ммоль) и нагревали смесь в непрерывном потоке аргона при 150°C в течение 1 часа. Затем подключали баллон, заполненный аргоном, и нагревали смесь при 150°C в течение дополнительных 60 часов. После охлаждения смесь разбавляли Et2O и фильтровали через 4 см рыхлый слой диоксида кремния. Остаток на фильтре дополнительно промывали Et2O и объединенные органические остатки концентрировали в вакууме. При очистке полученного остатка флэш-хроматографией (SiO2, элюент: пентан:CH2Cl2:Et20 в отношении 98:1:1) получали 76,7 г указанного в заголовке соединения в виде оранжевого масла, а также смешанных фракций. Смешанные фракции объединяли и концентрировали, затем перегоняли (110°C, 6 мбар), получая при этом дополнительно 7,2 г указанного в заголовке соединения (в целом 83,9 г, 71%). 1Н ЯМР (ДМСО-d6) 0,30 (9Н, с), 7,56 (1Н, д, J=8,02 Гц), 7,67 (1Н, дд, J=11,49, 1,14 Гц), 8,10 (1Н, т, J=7,66 Гц).
Способ A, стадия 2: 2-фтор-4-триметилсиланилфениламин
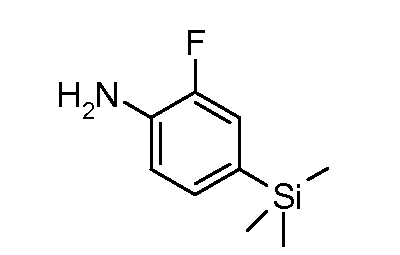
К раствору (3-фтор-4-нитрофенил)триметилсилана (62,0 г, 0,29 моль) в IMS (250 мл) добавляли взвесь 10% масс. палладия-на-углероде (4,0 г) в IMS (25 мл) и реакционную смесь продували пять раз азотом и затем три раза водородом. Затем реакционную смесь перемешивали при комнатной температуре в течение 4 часов под давлением водорода 3 бар. Затем реакционную смесь снова продували азотом перед фильтрованием через рыхлый слой целита (Celite®) с промывками этилацетатом. Фильтрат концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение в виде светло-коричневого масла (53,0 г, количественный выход). 1Н ЯМР (CDCl3, 400 МГц) 7,16-7,09 (1Н, м), 7,10 (1Н, д, J=7,75 Гц), 6,81 (1Н, т, J=8,16 Гц), 3,78 (2Н, с), 0,26 (9Н, с).
Способ B, 2-Фтор-4-триметилсиланилфениламин
К раствору 4-бром-2-фторфениламина (114 г, 0,6 моль) в безводном ТГФ (750 мл) в инертной атмосфере при -78°C по каплям добавляли 1,6 M раствор н-BuLi в смеси гексанов (1500 мл, 2,4 моль), сохраняя внутреннюю температуру ниже -60°C. Реакционную смесь по каплям обрабатывали TMSCl (256 мл, 2,0 моль), сохраняя внутреннюю температуру ниже -60°C. Реакционной смеси давали возможность нагреться до 0°C в течение 1 часа и выливали в 2M раствор HCl (приблизительно 1 л), охлаждаемый льдом. Смесь энергично перемешивали в течение 10 мин, затем органический слой отделяли, промывали водой, затем насыщенным раствором карбоната калия, сушили (Na2SO4), фильтровали и концентрировали, получая при этом указанное в заголовке соединение в виде светло-коричневого масла (89 г, 81%).
Сложный диметиловый эфир 2-амино-5-цианотерефталевой кислоты
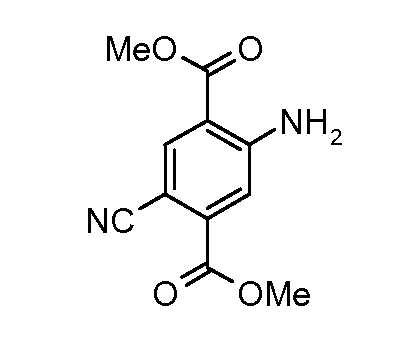
Сложный диметиловый эфир 2-амино-5-бромтерефталевой кислоты (15,0 г, 52,1 ммоль), цианид цинка (II) (6,11 г, 52,1 ммоль) и тетракис(трифенилфосфин)палладий (0) (3,0 г, 2,6 ммоль) суспендировали в ДМФА (50 мл) и полученную дегазированную реакционную смесь продували аргоном. Реакционную смесь нагревали при 120°C в течение 30 минут, затем концентрировали в вакууме. Полученный остаток растирали в горячей воде (100 мл) и собирали продукт фильтрованием, получая при этом указанное в заголовке соединение в виде темно-серого твердого вещества (12,0 г, 98%). 1Н ЯМР (d6-ДМСО, 400 МГц) 8,11 (1Н, с), 7,62 (2Н, ушир.с), 7,52 (1Н, с), 3,89 (3Н, с), 3,85 (3Н, с).
Сложный диметиловый эфир 2-бром-5-цианотерефталевой кислоты
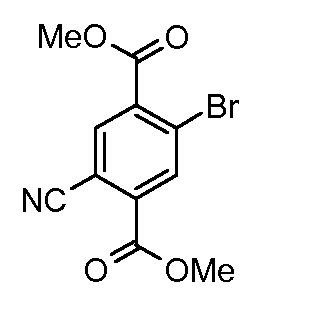
К суспензии сложного диметилового эфира 2-амино-5-цианотерефталевой кислоты (11,6 г, 49,5 ммоль) в бромистоводородной кислоте (20 мл, 48%) при 0°C добавляли водный раствор нитрита натрия (55 ммоль, 11 мл, 5 M). Реакционную смесь перемешивали при 0°C в течение 30 минут. Добавляли бромид меди (I) (7,1 г, 49,5 ммоль) в виде раствора в бромистоводородной кислоте (10 мл, 48%) и перемешивали реакционную смесь при 0°C в течение 10 мин перед тем, как нагревать при 65°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой (50 мл) и экстрагировали полученную смесь этилацетатом (3×20 мл). Водную фракцию фильтровали, чтобы извлечь непрореагировавший сложный диметиловый эфир 2-амино-5-цианотерефталевой кислоты (7,1 г). Объединенные органические фракции промывали насыщенным раствором соли (20 мл), сушили (MgSO4) и концентрировали в вакууме. Полученный остаток подвергали флэш-хроматографии (SiO2, градиент 0-50% этилацетат в циклогексане), получая при этом указанное в заголовке соединение в виде коричневого твердого вещества (1,0 г, 7%). 1Н ЯМР (CDCl3, 400 МГц) 8,43 (1Н, с), 8,19 (1Н, с), 4,04 (3Н, с), 4,00 (3Н, с).
Сложный диметиловый эфир 2-циано-5-(2-фтор-4-триметилсиланилфениламино)терефталевой кислоты
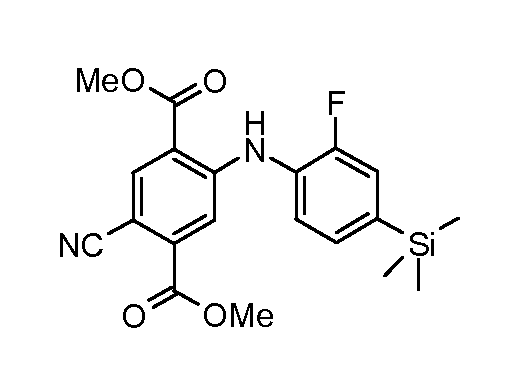
Сложный диметиловый эфир 2-бром-5-цианотерефталевой кислоты (620 мг, 2,1 ммоль), 2-фтор-4-триметилсиланилфениламин (419 мг, 2,3 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (62 мг, 0,10 ммоль), фосфат калия (486 мг, 2,30 ммоль) и трис(дибензилиденацетон)дипалладий (0) (29 мг, 0,05 ммоль) суспендировали в диоксане (20 мл) и полученную смесь продували аргоном. Реакционную смесь нагревали с обратным холодильником в течение 16 часов. Реакционную смесь гасили добавлением насыщенного водного раствора хлорида аммония (20 мл) и экстрагировали полученную смесь этилацетатом (3×20 мл). Объединенные органические фракции промывали насыщенным раствором соли (20 мл), сушили (MgSO4) и концентрировали в вакууме. Полученный остаток подвергали флэш-хроматографии (SiO2, градиент 0-40% этилацетат в циклогексане), получая при этом указанное в заголовке соединение в виде коричневого твердого вещества (0,5 г, 60%). ЖХ/МС (способ B): RT=4,74 мин, M+H+=401.
Сложный метиловый эфир 6-(2-фтор-4-триметилсиланилфениламино)-1-оксо-2,3-дигидро-1H-изоиндол-5-карбоновой кислоты
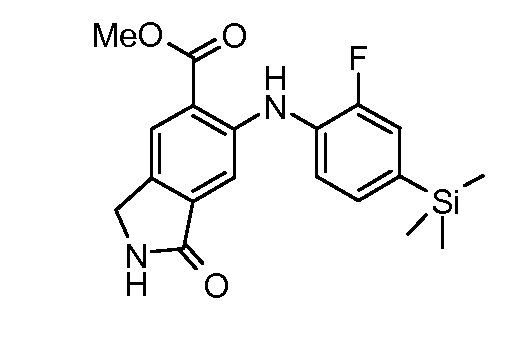
К раствору сложного диметилового эфира 2-циано-5-(2-фтор-4-триметилсиланилфениламино)терефталевой кислоты (300 мг, 0,75 ммоль) в метаноле (15 мл) и DCM (2 мл) при 0°C добавляли диоксид кремния (1 г) и гексагидрат хлорида кобальта (II) (357 мг, 1,50 ммоль) с последующим добавлением боргидрида натрия (285 мг, 7,50 ммоль). Во время добавления боргидрида натрия наблюдалось выделение больших количеств пузырьков газа, и реакционная смесь становилась черного цвета. Реакционную смесь перемешивали при 0°C в течение 1 часа. Реакционную смесь фильтровали, и фильтрат концентрировали в вакууме, получая при этом остаток, который подвергали флэш-хроматографии (SiO2, градиент 0-20% метанола в DCM), получая при этом указанное в заголовке соединение в виде коричневого твердого вещества (138 мг, 49%). ЖХ/МС (способ B): RT=4,18 мин, 2M+H+=745 (100%), M+H+=373 (25%).
Сложный метиловый эфир 6-(2-фтор-4-йодфениламино)-1-оксо-2,3-дигидро-1H-изоиндол-5-карбоновой кислоты
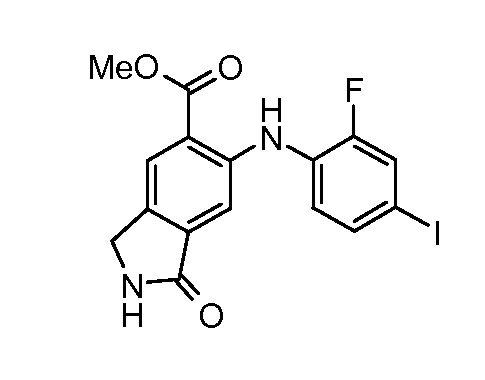
К раствору сложного метилового эфира 6-(2-фтор-4-триметилсиланилфениламино)-1-оксо-2,3-дигидро-1H-изоиндол-5-карбоновой кислоты (284 мг, 0,76 ммоль) в DCM (5 мл) при 0°C добавляли раствор монохлорида йода (246 мг, 1,52 ммоль) в DCM (1,5 мл). Реакционную смесь перемешивали при 0°C в течение 4 часов. Реакционную смесь гасили путем добавления воды (10 мл), затем разбавляли насыщенным водным раствором тиосульфата натрия (10 мл). Полученную смесь экстрагировали этилацетатом (3×20 мл). Объединенные органические фракции промывали насыщенным раствором соли (20 мл), сушили (MgSO4) и концентрировали в вакууме. Полученный остаток подвергали флэш-хроматографии (SiO2, градиент 0-7% метанола в DCM), получая при этом указанное в заголовке соединение в виде коричневого твердого вещества (220 мг, 68%). ЖХ/МС (способ B): RT=3,65 мин, 2M+H+=853.
6-(2-фтор-4-йодфениламино)-1-оксо-2,3-дигидро-1H-изоиндол-5-карбоновая кислота
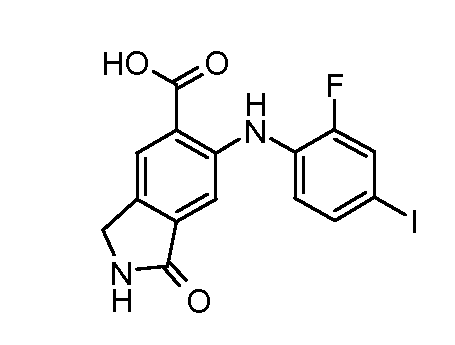
К суспензии сложного метилового эфира 6-(2-фтор-4-йодфениламино)-1-оксо-2,3-дигидро-1H-изоиндол-5-карбоновой кислоты (220 мг, 0,52 ммоль) в IMS (7 мл) добавляли водный раствор гидроксида натрия (1,3 мл, 1M, 1,30 ммоль). Реакционную смесь нагревали при 60°C в течение 3 часов, во время которых твердые вещества растворялись. Реакционную смесь концентрировали в вакууме, удаляя при этом IMS, и полученный раствор подкисляли до pH ~5 путем добавления водного раствора хлористоводородной кислоты (1M), вызывающей образование осадка. Продукт собирали фильтрованием и сушили в вакууме при 45°C, получая при этом указанное в заголовке соединение в виде коричневого твердого вещества (250 мг, >100%). ЖХ/МС (способ B): RT=3,07 мин, M+MeCN+H+=454.
(2-винилоксиэтокси)амид 6-(2-фтор-4-йодфениламино)-1-оксо-2,3-дигидро-1H-изоиндол-5-карбоновой кислоты
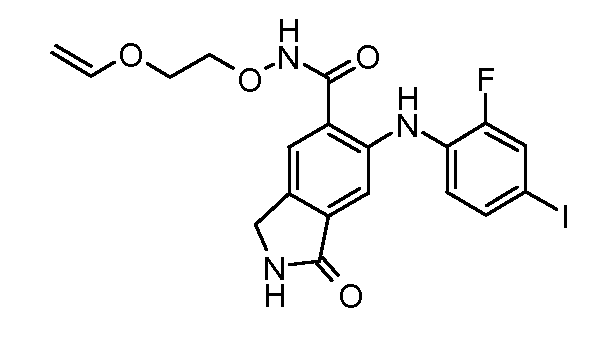
6-(2-фтор-4-йодфениламино)-1-оксо-2,3-дигидро-1H-изоиндол-5-карбоновую кислоту (209 мг, 0,52 ммоль), O-(2-винилоксиэтил)гидроксиламин (58 мг, 0,56 ммоль), HOBt (77 мг, 0,56 ммоль), гидрохлорид EDCI (109 мг, 0,56 ммоль) и DIPEA (96 мкл, 0,56 ммоль) растворяли в ДМФА (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, затем концентрировали в вакууме. Полученный остаток растворяли в этилацетате (10 мл), промывали водным насыщенным раствором бикарбоната натрия (10 мл) и дважды экстрагировали водную фракцию этилацетатом (2×10 мл). Объединенные органические фракции промывали насыщенным раствором соли (20 мл), сушили (MgSO4) и концентрировали в вакууме. Полученный остаток подвергали флэш-хроматографии (SiO2, градиент 0-10% метанола в DCM), получая при этом указанное в заголовке соединение в виде коричневого твердого вещества (100 мг, 40%). ЖХ/МС (способ B): RT=3,32 мин, 2M+H+=995.
ПРИМЕР 5: (2-гидроксиэтокси)амид 6-(2-фтор-4-йодфениламино)-1-оксо-2,3-дигидро-1H-изоиндол-5-карбоновой кислоты
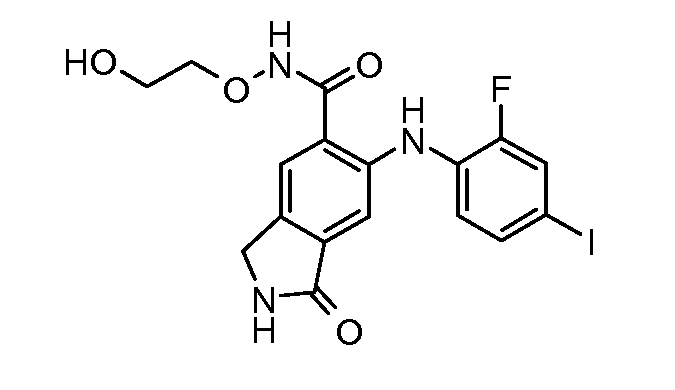
К раствору (2-винилоксиэтокси)амида 6-(2-фтор-4-йодфениламино)-1-оксо-2,3-дигидро-1H-изоиндол-5-карбоновой кислоты (100 мг, 0,20 ммоль) в метаноле (7 мл) добавляли хлористоводородную кислоту (1 мл, 1M, 1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали в вакууме, и полученный остаток растирали в горячем этилацетате. Продукт собирали фильтрованием, получая при этом указанное в заголовке соединение в виде бледно-бежевого твердого вещества (58 мг, 61%). ЖХ/МС (способ A): RT=7,64, M+H+=472. 1Н ЯМР (ДМСО-d6) 11,89 (1Н, с), 9,00 (1Н, с), 8,68 (1Н, с), 7,68-7,62 (2Н, м), 7,49-7,45 (1Н, м), 7,24 (1Н, с), 7,17 (1Н, т, J=8,63 Гц), 4,69 (1Н, с), 4,28 (2Н, с), 3,89 (2Н, т, J=4,82 Гц), 3,58 (2Н, т, J=4,73 Гц).