Результат интеллектуальной деятельности: РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pGEM-Puro-DS-Apo, СОДЕРЖАЩАЯ СИНТЕТИЧЕСКИЙ ГЕН АПОПТИНА, ФЛАНКИРОВАННЫЙ ПОСЛЕДОВАТЕЛЬНОСТЯМИ ГЕНОМА ВИРУСА ОСПОВАКЦИНЫ ИЗ РАЙОНА C10L-C12L, И РЕКОМБИНАНТНЫЙ ШТАММ VVdGF-ApoS24/2 ВИРУСА ОСПОВАКЦИНЫ, ПРОДУЦИРУЮЩИЙ АПОПТИН
Вид РИД
Изобретение
Изобретение относится к рекомбинантным плазмидным ДНК, содержащим синтетический ген апоптина, и рекомбинантным штаммам вируса осповакцины, продуцирующим апоптин вируса анемии цыплят, и может быть использовано в биотехнологии, в частности в генетической инженерии, для разработки лекарственных средств нового поколения для борьбы с онкологическими заболеваниями.
Вирус осповакцины (ВОВ) согласно известным данным обладает природной селективностью в отношении опухолевых клеток (Thorne, 2007 [1]), но в онкотерапии используются аттенуированные штаммы ВОВ. Показано, что подавление генов тимидинкиназы и ростового фактора (VGF, virus growth factor) ВОВ приводит к практически полному отсутствию репликации вируса в неделящихся клетках (McCart, 2007 [2]), при этом эффективность разрушения раковых клеток такими двойными мутантами (VVdd) не отличалась от исходного штамма (Thorne, 2007 [1]).
Известно, что для увеличения онкоспецифичности и онколитической активности ВОВ используется способность этого вируса нести большое количество введенных инородных генов (трансгенов). В качестве трансгенов исследованы гены цитокинов и других иммуномодуляторов и иммуностимуляторов (Ziauddin,2010 [3]; Thorne, 2007 [1]; Kirn, 2010 [4]); ингибиторов ангиогенеза (Guse, 2010 [5]; Tysome, 2009[6]); ферментов, превращающих внутри опухоли нетоксичные предшественники (prodrugs, продраги) в их цитотоксические производные (Chalikonda, 2008 [7]; McCart, 2007[2]). Полученные рекомбинантные ВОВ показали хороший противоопухолевый эффект в доклинических испытаниях.
В настоящее время три рекомбинантных штамма ВОВ проходят клинические испытания в качестве противоопухолевых препаратов. Первый такой штамм - JX-594 - был сконструирован путем введения гена ГМ-КСФ человека в район ТК-гена ВОВ (Kirn, 2010 [4]), второй, JX-963, содержал дополнительную делециюVGF гена (Thorne, 2007 [1]), третий штамм JX929 имеет делеции ТК и VGF генов и вместо последнего встроен ген цитозиндезаминазы (Chalikonda, 2008 [7]). Этот фермент катализирует превращение пролекарства 5-фторцитозина в 5-фторурацил, который является токсичным для активно реплицирующихся клеток и широко используется при лечении многочисленных форм рака. Пролекарство 5-фторцитозин не оказывает нежелательных побочных токсических проявлений в нормальных тканях человека. На двух моделях - рака яичника (карциномы мыши MOSEC и карциномы человека A2780) - была показана эффективность этого подхода с использованием указанного варианта вируса осповакцины. В настоящее время онколитический вирус JX929 проходит I фазу клинических испытаний для лечения рака яичников на стадии метастазов (Lee, 2010 [8]). Штамм JX-594 успешно прошел I и II стадии клинических испытаний против первичного рака печени и меланомы (Kirn, 2010 [4]).
Известно использование в качестве трансгена гена апоптина (Los, 2009 [9]). Апоптин является одним из неструктурных белков вируса анемии цыплят (VP3), который отвечает за гибель клеток при вирусной инфекции (Maddika, 2006 [10]; Noteborn, 2005 [11]). Это белок длиной 121 аминокислот (14 килодальтон, кДа), который способен индуцировать апоптоз широкого спектра раковых и трансформированных клеток, но не нормальных клеток. Апоптоз, вызываемый апоптином, не зависит от р53 и не подавляется экспрессией антиапоптозного белка Bcl-2 (Los, 2009 [9]).
Несмотря на высокий онколитический потенциал апоптина в настоящее время нет противоопухолевых препаратов, основанных на использовании как самостоятельно белка апоптина, так и его вирус-индуцированных форм, хотя исследования в этом направлении ведутся очень интенсивно.
Известны ретровирусные конструкции, несущие ген апоптина, и показана избирательная индукция апоптоза раковых клеток с использованием таких векторов (Noteborn, 2007 [11]). Однако ретровирусные конструкции нельзя использовать для лечения человека, поскольку они могут встраиваться в хромосомы и приводить к неконтролируемой модификации генома человека.
Сконструированы рекомбинантные аденовирусы, экспрессирующие апоптин, и на модели опухолей печени человека в безтимусных мышах (nude) показана их противоопухолевая активность (Noteborn, 2007 [11]; Zhang, 2012 [12]). Однако проведенные к настоящему времени клинические испытания показали, что литический потенциал аденовируса недостаточен для остановки роста опухолей у человека (Rojas, 2012 [13]). Кроме того, у большинства людей имеется достаточно высокий уровень антител к аденовирусам вследствие их широкой циркуляции в человеческой популяции, что также снижает эффективность использования таких препаратов в качестве онколитических агентов.
Введение гена апоптина в геном вируса болезни Ньюкастла (Wu, 1012 [14]) или вируса оспы кур (Li, 2006 [15]) повышало способность этих вирусов размножаться в опухолевых клетках человека как in vitro, так и in vivo в мышиной модели. Однако эти вирусы видоспецифичны, вызывают заболевания птиц, практически не патогенны для человека, что ограничивает клеточный тропизм этих вирусов и возможности их использования в онкотерапии.
Наиболее близким аналогом изобретения (прототипом) является вектор доставки генов, способный индуцировать апоптоз в клетке, включающий фрагмент ДНК, кодирующий белок, обладающий апоптиноподобной активностью, при этом апоптоз индуцируется в раковых клетках и в меньшей степени или вообще не происходит в нормальных диплоидных нетрансформированных/незлокачественных клетках, причем вектор доставки генов является независимо инфицирующим вектором и представляет собой аденовирус (патент РФ №2252255, МПК C12N15/37, опубл. 20.05.2005 г. [16]). Вектор доставки генов дополнительно содержит модифицированный сайт инициации трансляции непосредственно перед инициаторным кодоном ATG молекулы нуклеиновой кислоты, причем сайт инициации трансляции содержит нуклеотидную последовательность GCCAAC. Вектор доставки генов представляет собой дефектный по репликации аденовирус и предназначен для лечения рака. Данное изобретение относится к вектору доставки генов на основе аденовируса, который обеспечивает возможность использования особенностей противоопухолевого средства апоптина или других белков с апоптиноподобной активностью для лечения рака с помощью применения генной терапии или для лечения злокачественных перерождений, характеризующихся гиперплазией, метаплазией или дисплазией.
Однако, как указывалось выше, проведенные к настоящему времени клинические испытания показали, что литический потенциал аденовируса недостаточен для остановки роста опухолей у человека (Rojas, 2012 [13]). Кроме того, у большинства людей имеется достаточно высокий уровень антител к аденовирусам вследствие их широкой циркуляции в человеческой популяции, что также сужает сферу и снижает эффективность использования таких препаратов в качестве онколитических агентов.
Техническим результатом заявляемого изобретения является создание рекомбинантной плазмидной ДНК, содержащей синтетический ген апоптина, и - на ее основе - рекомбинантного штамма вируса, который обладает более высокой и адресной онколитической активностью и на который практически отсутствуют антитела в организме человека.
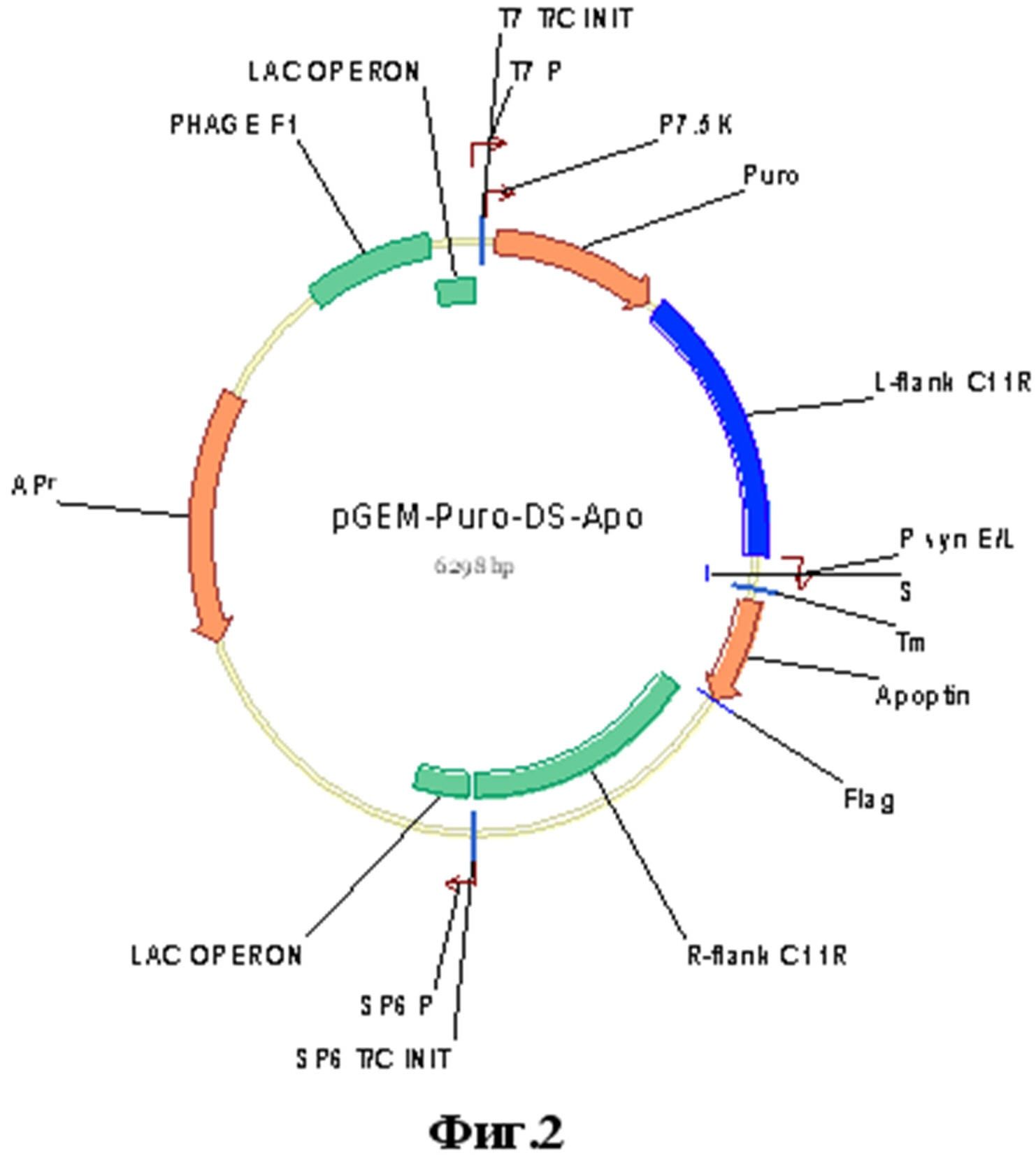
Указанный технический результат достигается созданием рекомбинантной плазмидной ДНК pGEM-Puro-DS-Apo, несущей синтетический ген апоптина размером 363 п.н. с нуклеотидной последовательностью, представленной на фиг. 1, фланкированный фрагментами генома вируса осповакцины, имеющей размер 6298 п.н., молекулярную массу 4.19 мДа и содержащей в соответствии с физической и генетической картой, представленной на фиг. 2:
Оперон размером 540 п.н., состоящий из ранне-позднего промотора ВОВ (Merchlinsky, 1997 [17]), лидерного фрагмента гена C11R ВОВ, последовательности пенетрирующего пептида белка TAT ВИЧ, гена апоптина и последовательности эпитопа Flag (Einhauer and Jungbaeur, 2001 [18]);
ПЦР-фрагмент генома ВОВ L-flank C11R длиной 944 п.н., содержащий ОРТ C10L и фланкированный сайтами узнавания эндонуклеаз рестрикции BamHI и KasI;
ПЦР-фрагмент генома ВОВ R-flank C11R длиной 985 п.н., содержащий ОРТ C12L и фланкированный сайтами узнавания эндонуклеаз рестрикции ApaI и HindIII;
BamHI - HindIII фрагмент векторной плазмиды pGEM-Puro (Falkner and Moss, 1990 [19]) размером 3825 п.н., включающий промотор P7.5K ВОВ; прокариотический промотор SP6; последовательность фага f1; прокариотический промотор фага T7;
генетические маркеры:
ген β-лактамазы, определяющий устойчивость к ампициллину;
ген пуромицин-трансферазы, определяющий устойчивость к пуромицину;
уникальные сайты рестрикции: EcoRI (6); BamHI (683); ApaI (2174).
Указанный технический результат достигается также созданием штамма рекомбинантного вируса осповакциныVVdGF-ApoS24/2, полученного с использованием рекомбинантной плазмидной ДНКpGEM-Puro-DS-Apo по п.1 формулы изобретения, обладающего повышенной онколитической активностью и депонированного в Государственной коллекции Роспотребнадзора возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» под номером V-585.
Заявителем показано, что рекомбинантный ВОВ VVdGF-ApoS24/2, полученный в результате встройки апоптинового оперона из инсерционной плазмиды pGEM-Puro-DS-Apo в район гена C11L ДНК ВОВ, после заражения им клеток почки африканской зеленой мартышки CV-1 продуцирует апоптин.
Фрагменты генома ВОВ были получены с помощью полимеразной цепной реакции (ПЦР). Матрицей для амплификации служил вирус осповакцины штамм Л-ИВП. Праймеры для амплификации фрагментов генома ВОВ, содержащих ОРТ C10L (1-2) и ОРТ C12L (3-4), имели следующую структуру:
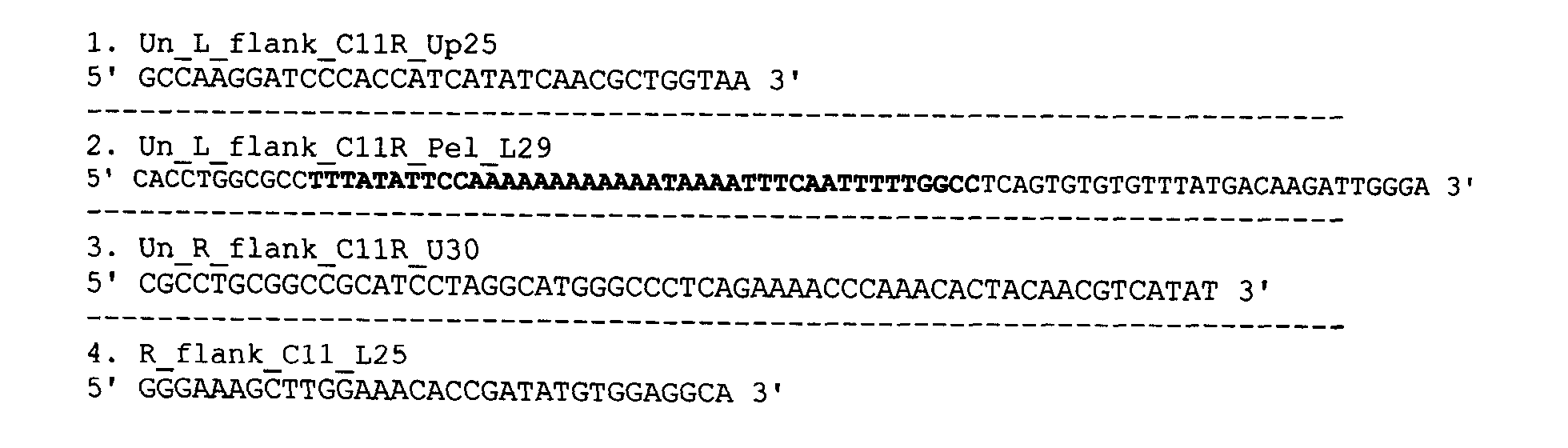
В структуры праймеров были введены сайты узнавания эндонуклеаз рестрикции (выделены серым цветом): Un_L_flank_C11R_Up25 - BamHI, Un_L_flank_C11R_Pel_L29 - KasI, Un_R_flank_C11R_U30 - NotI, R_flank_C11_L25 - HindIII. В качестве плазмидного вектора, обеспечивающего доминантную селекцию рекомбинантных штаммов вируса, использовали плазмиду pGEM-Puro, содержащую гены устойчивости к ампициллину и пуромицину, полилинкер для клонирования целевых генов и origin репликации. В данную плазмиду были введены последовательности оперона, содержащего синтетический ген апоптина, и фланкирующие последовательности ВОВ, содержащие ОРТ C10L и ОРТ C12L. Сконструированная плазмида обеспечивала высокую эффективность получения рекомбинантных ВОВ. Использование гена устойчивости к пуромицину в качестве доминантного селективного маркера позволило выделить целевые рекомбинантные вирусы уже в 3-м селективном пассаже, в котором 50% вирусных клонов содержали искомую встройку. При использовании нами для селекции описанной в литературе системы, основанной на бактериальном ферменте ксантин-гуанин-фосфорибозилтрансферазе (gpt) (Falkner and Moss, 1990 [19]), который в клетках млекопитающих способен восстанавливать метаболизм пуриновых нуклеотидов, блокируемый микофеноловой кислотой, целевые рекомбинанты ВОВ удавалось количественно выявить только в 6 пассаже (10% клонов содержали искомую встройку).
Штамм характеризуется следующими признаками:
Морфологические признаки. Штамм обладает свойствами типичного представителя ВОВ, но в отличие от векторного вируса имеет фенотип VGF-Apo+.
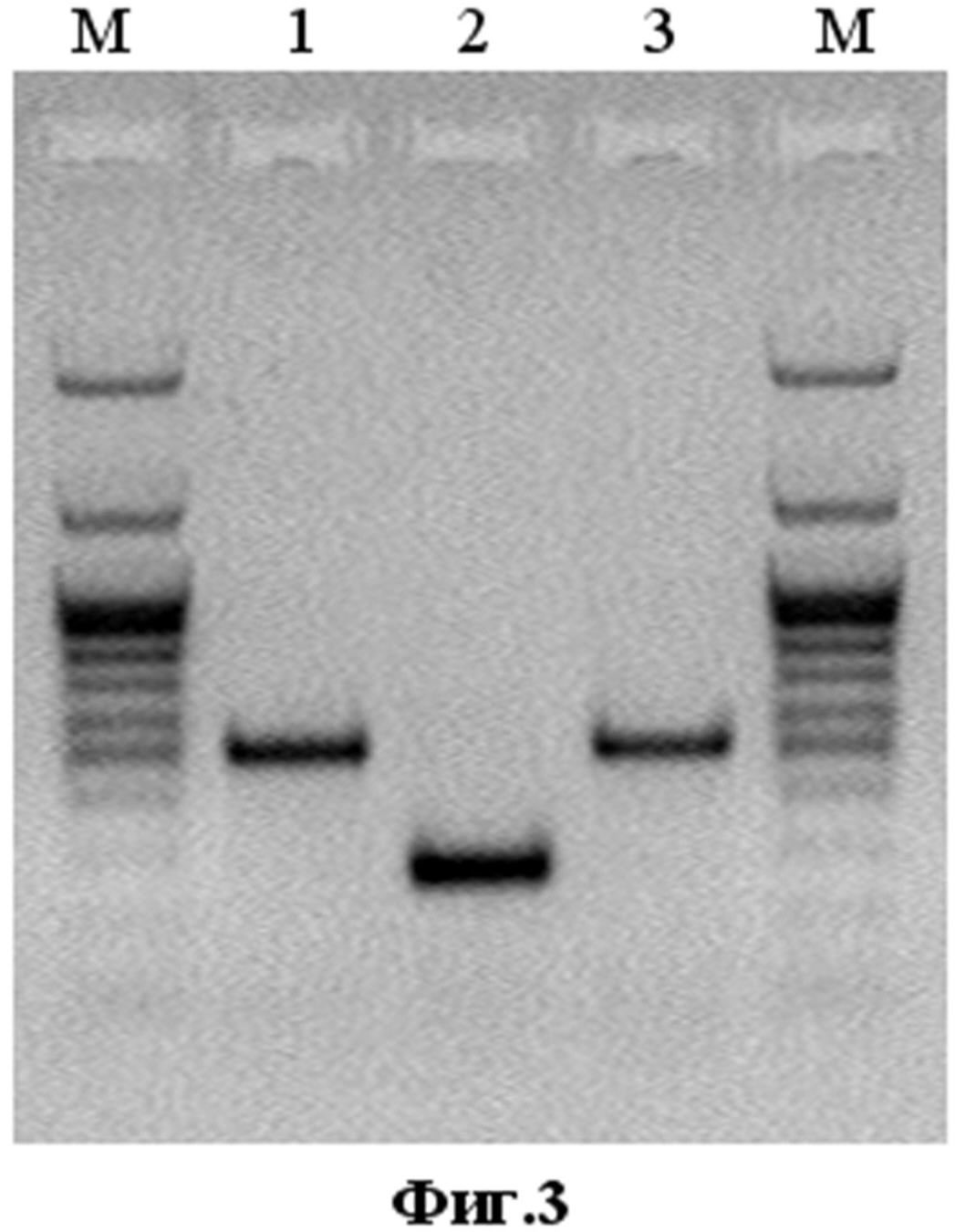
Физиолого-биохимические характеристики и культуральные свойства штамма. ДНК рекомбинантного ВОВ имеет длину около 200000 п.н. Наличие в его геноме целевой вставки длиной 363 п.о. подтверждено с помощью метода ПЦР (фиг. 3), экспрессия гена апоптина подтверждена Western blot анализом лизатов клеток CV-1, инфицированных рекомбинантным штаммом VVdGF-ApoS24/2 (фиг. 4). Рекомбинантный штамм вируса осповакцины со встройкой гена апоптина имеет достоверно (на уровне значимости 95%) большую цитотоксическую активность для ряда раковых клеток по сравнению с исходным родительским штаммом, что подтверждается данными, приведенными в таблице.
Таблица. Сравнительная онколитическая активность исходного (Л-ИВП) и рекомбинантного (VVdGF-ApoS24/2) штаммов вируса осповакцины для опухолевых и нормальных клеток.
|
Условные обозначения:
(*) В таблице приведены средние значения и стандартное отклонение, рассчитанное на 95% уровне значимости.
А431 - культура клеток эпидермоидной карциномы человека
MCF-7 - клетки аденокарциномы молочной железы человека
А549 - культура клеток карциномы легкого человека
DU-145 - клетки рака простаты
MCF 10A - нормальные клетки эпителия молочной железы
LECH-240 - диплоидная культура клеток легкого человека.
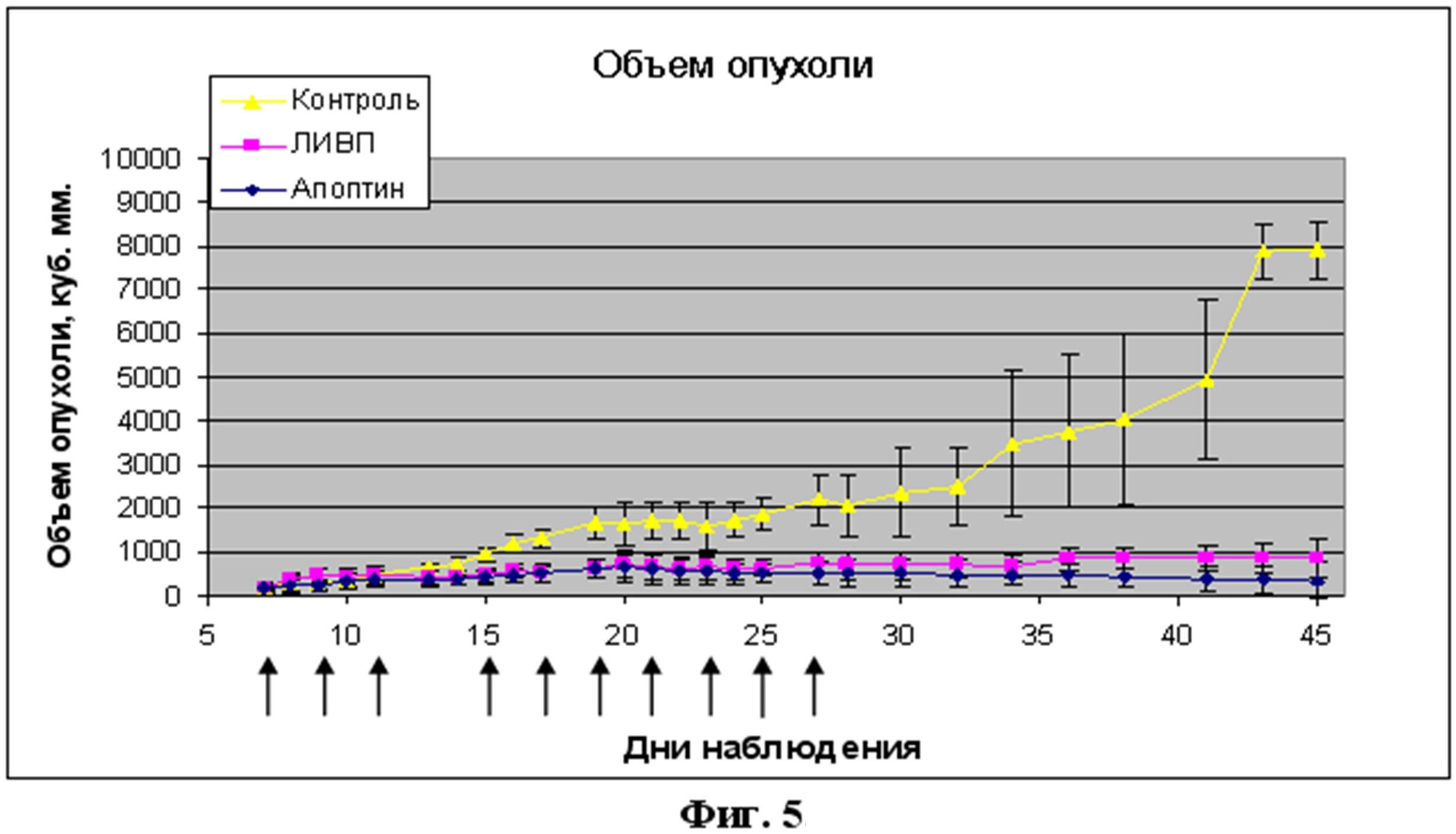
Противоопухолевая активность рекомбинантного штамма на модели nude мышей с ксенографтами эпидермоидной карциномы А431 оказалась также достоверно выше родительского штамма (фиг. 5).
Полученный штамм рекомбинантного вируса осповакцины VVdGF-ApoS24/2 депонирован в Государственной коллекции Роспотребнадзора возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» за номером V-585 (справка № 02.15/2626 от 27.07.2012 г.).
Заявляемый штамм вируса осповакцины, как онколитический агент, обладает целым рядом преимуществ. Он реплицируется в цитоплазме инфицированных клеток в автономных образованиях - вирусных фабриках, не контактирует с клеточным генетическим материалом, не встраивается в хромосомы, не имеет онкогенного потенциала. Вирус осповакцины обладает широким клеточным тропизмом и высоким литическим потенциалом для раковых клеток, хорошо передается от клетки к клетке через непосредственные мембранные контакты, что особенно важно для плотно агрегированных солидных опухолей (Moss and Damon, 2007 [20]). Вирус осповакцины способен системно распространяться по организму, что обеспечивает его эффективную доставку к отдаленным опухолям и метастазам (Breitbach, 2011 [21]).
Заявляемый штамм вируса осповакцины VVdGF-ApoS24/2 получен на основе вакцинного штамма Л-ИВП, который широко применялся в медицинской практике для борьбы против оспы в России, но с 1980 года такая вакцинация прекращена вследствие искоренения натуральной оспы на земном шаре (Как это было, 2011 [22]). Таким образом, большинство людей не имеют антител к вирусам группы оспы, что существенно увеличивает эффективность использования вируса осповакцины в качестве онколитического агента.
Все вышесказанное свидетельствует о высокой перспективности противоопухолевых препаратов на основе рекомбинантных штаммов вируса осповакцины. Встройка гена апоптина вместо делеции гена вирусного ростового фактора усиливает адресную литическую активность вируса в отношении опухолевых клеток.
Изобретение иллюстрируется следующими фигурами графических изображений:
- Фиг.1.Нуклеотидная последовательность синтетического гена апоптина;
- Фиг.2. Физическая и генетическая карта плазмиды pGEM-Puro-DS-Apo. За первый нуклеотид плазмиды принимается нуклеотид G, являющийся сайтом инициации транскрипции фага T7 (T7_T/C_INIT); промотор P7.5K ВОВ; Puro - ген устойчивости к пуромицину; L-flank C11R - фрагмент генома ВОВ, содержащий ОРТ C10L; P syn E/L - синтетический ранне-поздний промотор ВОВ; S - N-концевой лидерный фрагмент гена C11R ВОВ; Tm - последовательность пенетрирующего пептида белка TAT ВИЧ; Apoptin - ген апоптина; Flag - последовательность эпитопа DYKDDDDK; R-flank C11R - фрагмент генома ВОВ, содержащий ОРТ C12L; SP6_T/C_INIT - прокариотический сайт инициации транскрипции; SP6_P - прокариотический промотор; LAC_OPERON - последовательность lac-оперона; APr- ген устойчивости к ампициллину; PHAGE_F1 - последовательность фага f1; T7_P - прокариотический промотор фага T7;
- Фиг.3. Электрофоретический анализ в 1% агарозе ПЦР-фрагментов, содержащих ген апоптина, амплифицированных с помощью специфических праймеров с ДНК рекомбинантного штамма VVdGF-ApoS24/2 (дорожка 1), исходного ВОВ дикого типа (дорожка 2) и с плазмиды pGEM-Puro-DS-Apo (дорожка 3). Дорожки М - маркер молекулярных весов М28 (НПО «СибЭнзим», Россия);
- Фиг.4. Анализ экспрессии гена апоптина вируса анемии цыплят в составе рекомбинантного ВОВ VVdGF-ApoS24/2. Размер транскрипта, включающего leader C11R+apoptin+Flag, составляет 467 п.н. Расчетная молекулярная масса полипептида составляет 16 кДа. М- контроль М.в. - сверху 250,150, 100, 75; 50, 37, 25, 20, 15 (BioRad, Kaleidoscope Prestained Standards, Cat 161-0324); 1 - лизат клеток CV-1, инфицированных Л-ИВП, 48 час; 2-3 - лизат клеток CV-1, инфицированных VVdGF-ApoS24/2, 24 и 48 час, соответственно. В качестве антител использовали Monoclonal ANTI-FLAGBioM2 antibody (Sigma, F9291). В качестве вторичных антител - Anti-mouseIgG (Whole molecule) alcalinephosphatase conjugate (Sigma). В качестве субстрата использовали BCIP (5-bromo-4-chloro- 3-indolylphosphate) и NBT (NitroBluetetrazolium);
- Фиг.5. Анализ противоопухолевой активности рекомбинантного штамма VVdGF-ApoS24/2 in vivo. В работе использовали самок nude мышей, возраст 8-10 недель, вес 20-26 г. Опухоль - мышам прививали 5х106 клеток эпидермоидной карциномы человека А431 подкожно в левую заднюю часть тела. Виротерапию начали через 7 дней после формирования хорошо видимых опухолей объемом 175-211 мм3, введение препаратов осуществляли интратуморально на 7,9,11,15,17,19,21,23,25 и 27 сутки от начала эксперимента - введения клеток А431. Контроль - мышам вводили физ. раствор в объеме 100 мкл. Л-ИВП и VVdGF-ApoS24/2 - вводили 2х106БОЕ/мышь в физ. растворе, объем инокулята - 100 мкл. Стрелками указаны дни интратуморального введения вирусных препаратов и физ. раствора (контроль). Объем опухоли рассчитывали по формуле LxW2x0,5 (Yu, 2009 [23]). Измерения проводили каждые 2 дня. Общий период наблюдения - 45 дней.
Для лучшего понимания сущности изобретения ниже следуют примеры его осуществления.
Пример 1. Способ синтеза гена апоптина.
Для сборки гена апоптина в соответствии с известной структурой были синтезированы перекрывающиеся праймеры, а также два праймера для амплификации полноразмерного сегмента ДНК, кодирующего апоптин. Структура праймеров приведена ниже:
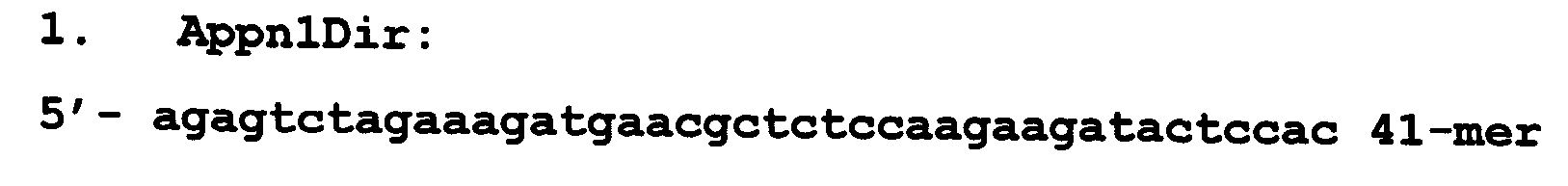

Четырнадцать перекрывающихся олигонуклеотидов были подвергнуты отжигу с образованием промежуточного комплекса следующей структуры:

Далее бреши достраивались ДНК-полимеразой фага Т4, фрагменты соединялись лигазой, и затем проводилась амплификация вставки с использованием двух праймеров (номера 15 и 16), содержащих клонирующие сайты для рестриктаз XbaI и BamHI. После выделения из агарозного геля и рестрикции вставку лигировали в вектор pLCMV-STm-puro. Правильность сборки апоптина определяли секвенированием вставок. Для оценки экспрессии гена апоптина методом иммуноблоттинга в С-конец белка был введен эпитоп FLAG с получением вектора pLCMV-STm-Apoptin-Flag.
Пример 2. Конструирование рекомбинантной плазмидной ДНК pGEM-Puro-DS-Apo.
5-10 мкг плазмиды pGEM-Puro гидролизуют эндонуклеазами рестрикции BamHI и HindIII, 1-5 мкг ПЦР-продукта, содержащего фрагмент ВОВ L-flank C11R гидролизуют эндонуклеазами рестрикции BamHI и KasI, 1-5 мкг ПЦР-продукта, содержащего ген апоптина, гидролизуют эндонуклеазами рестрикции KasI и ApaI, 1-5 мкг ПЦР-продукта, содержащего фрагмент ВОВ R-flank C11R, гидролизуют эндонуклеазами рестрикции ApaI и HindIII в стандартных условиях. Полученные фрагменты выделяют электрофорезом в 1% агарозном геле с последующей элюцией. 0.2 мкг вектора и по 0.6 мкг фрагментов лигируют в стандартных условиях и полученной лигазной смесью трансформируют компетентные клетки E.coli штамма XL-blue. Клеточные Apr-клоны выращивают при 37оС в LB-бульоне, содержащем 50 мкг/мл ампициллина, до стационарной фазы. Рекомбинантную плазмидную ДНК выделяют по стандартной методике и анализируют с помощью эндонуклеаз рестрикции BamHI и HindIII. Из клонов, содержащих встроенный фрагмент, выделяют плазмидную ДНК, структуру которой подтверждают определением нуклеотидной последовательности методом терминации синтезируемой цепи на автоматическом секвенаторе ABIPRISM 310 Genetic Analyze (Applied Biosystems, США). Полученную таким образом целевую плазмиду обозначают pGEM-Puro-DS-Apo.
Пример 3. Трансфекция клеток CV-1 рекомбинантной плазмидой pGEM-Puro-DS-Apo и получение рекомбинантного штамма ВОВ VVdGF-ApoS24/2.
Для проведения трансфекции ДНК плазмиды pGEM-Puro-DS-Apo была наработана в препаративных количествах из 1000 мл среды Лурия-Бертани и выделена с использованием набора лабораторных реагентов для выделения плазмидной ДНК, очищенной от эндотоксинов «EndoFree Plasmid Maxi Kit (QIAGEN, Cat.12362).
Для получения рекомбинантного штамма вируса использовали реагент для трансфекции Lipofectamine™ LTX, 1мл и реагент Plus (Invitrogen, Cat. 15338100, USA). Трансфекцию проводили на 90%-ном монослое клеток CV-1, выращенном в шести-луночных планшетах (Greiner, Корея). Клетки инфицировали вирусом осповакцины с множественностью 0,05 БОЕ/клетка, и через 1 час инкубации при 37ºС добавляли смесь плазмидной ДНК (5 мгк)+липофектамин (20 мкл)+Реагент Plus в соответствии с рекомендацией производителя в 1 мл среды Opti-MEM (Invitrogen, Cat. 31985-047, USA). Через 1 час инкубации при 37ºС в лунки добавляли еще 2 мл среды Opti-MEM и инкубировали при 37ºС в атмосфере 5% СО2 еще 24-36 часов до развития цитопатического действия (ЦПД). Материал трижды замораживали-оттаивали и обрабатывали ультразвуком для получения гомогенной вирусной суспензии. Далее проводили селекцию рекомбинантов путем трех-кратного пассирования на монослое клеток CV-1 с добавлением пуромицина (Sigma, P8833-10mg) в концентрации 10мкг/мл среды DMEM (Invitrogen, Cat. 52100021). Вирус клонировали методом бляшек под твердым агаровым покрытием и анализировали на наличие встройки гена апоптина методом ПЦР с использованием праймеров Not-U26 5' aattatctgatgttgttgttcgctgc 3' и Apa-L22 5' cgagcacaataccgggagatgg 3'. Вирусную ДНК для проведения ПЦР выделяли с использованием наборов «РИБО-сорб» (K2-1-Et-100, Комплект реагентов для выделения РНК/ДНК из клинического материала, ЗАО «Интерлабсервис»). Размер амплифицированного фрагмента ДНК исходного ВОВ составлял 316 п.н. (фиг. 3), а рекомбинантного вируса со встройкой гена апоптина - 826 п.н. Отобранный рекомбинантный вариант VVdGF-ApoS24/2 дважды реклонировали, нарабатывали на монослое клеток CV-1 и очищали центрифугированием в градиенте плотности сахарозы (25-40%). Титр вируса определяли методом бляшек на монослое клеток CV-1, окрашенном фиксирующим раствором кристаллического фиолетового (2г/л кристаллический фиолетовый, 50 мл/л формальдегид, 100 мл/л этанол, вода). Очищенный рекомбинантный штамм ВОВ VVdGF-ApoS24/2 с титром 109БОЕ/мл хранится в расфасованном виде при -80°С.
Пример 4. Оценка экспрессии гена апоптина рекомбинантным штаммом ВОВ VVdGF-ApoS24/2.
Монослой клеток CV-1 (90% поверхности), выращенный в культуральном матрасе объемом 650 мл (Greiner, Cat. 661160), инфицировали рекомбинантный штамм ВОВ VVdGF-ApoS24/2 с множественностью 1 БОЕ/кл. Инкубировали 24 часа при 37°С в атмосфере 5% СО2, поддерживающую среду (DMEM+2% фетальной бычьей сыворотки, HyClone) удаляли, клетки разрушали лизирующим буфером (50mM TRIS-HClpH 7.5, 150mM NaCl, 1% Triton X-100, 5mM MgCl2, proteases inhibitor cocktail) в объеме 7 мл, проводили 3 раунда замораживания-оттаивания, затем трехкратную обработку ультразвуком (20 сек при 200-300 W с 10-ти сек охлаждением после каждой обработки), центрифугирование 14000rpm 30 мин, 4°C, супернатант анализировали в Western blot анализе с использованием в качестве первичных антител Monoclonal ANTI-FLAG BioM2 antibody (Sigma, F9291). В качестве вторичных антител использовали Anti-mouse IgG (Whole molecule) alcalinephosphatase conjugate (Sigma). Электрофоретическое разделение белков проводили в камере «BioRad» в 5% концентрирующем и 14% разделяющем акриламидном геле при V=100. Перенос белков с геля осуществляли в камере MiniTrans-Blot cell «BioRad» на мембрану Immun-Blot TMPVDF Membrane for Protein Blotting 0,2µm при V=100 1 час 20 минут. Затем мембрану промывали буфером для переноса и помещали в блокирующий раствор - TBS рН 7,4 с 5% молоком (Skim Milk Powder, Biochemika, Fluka) на 1 час при комнатной температуре (КТ) на качалке. Отмывали мембрану 3 раза по 5 минут TBS рН 7,4 на качалке и инкубировали 16 часов, при +4ºС с первичными антителами в рабочей концентрации 0,2 мкг/мл, в TBS рН 7,4 с 0,1% Tween-20 и 5% молока. После связывания с первичными антителами мембраны отмывали 3 раза по 5 минут TBS рН 7,4 с 0,1% Tween-20 на качалке, затем проводили связывание с вторичными антителами в рабочем разведении 1:5000 в TBS рН 7,4 с 0,1% Tween-20 и 5% молока в течение 1 часа при КТ на качалке. После связывания с коньюгатом отмывали 3 раза по 5 минут TBS рН 7,4 с 0,1% Tween-20 на качалке и 1 раз буфером для субстрата (АР - буфер: 100 mMTris, 100mM NaCl, pH 9,5 с добавлением 50 mM MgCl2). В качестве субстрата использовали BCIP (5-bromo-4-chloro- 3-indolyl phosphate) и NBT (NitroBluetetrazolium). Останавливали реакцию промыванием мембраны в дистиллированной воде.
Пример 5. Оценка онколитической активности рекомбинантного штамма ВОВ VVdGF-ApoS24/2 в раковых культурах клеток различного происхождения.
Исследование цитолитической активности ВОВ и его рекомбинантного варианта на культурах первичных, диплоидных и раковых клеток проводили микрометодом на 96-луночных культуральных планшетах (Costar) с использованием реагента XTT (Monks, 1991 [24]; Scudiere, 1988 [25]). Инфекционный титр вирусов для соответствующих типов клеток выражали как ЕС50 - эффективная концентрация вируса, необходимая для гибели 50% клеток. Для определения ЕС50 в лунки планшета с 50%-ным монослоем клеток вносили десятикратные разведения вирусной суспензии с множественностью инфекции от 10 до 0,001 БОЕ на клетку (multiplicity of infection, MOI) в 100 мкл среди 199 с добавлением 2% фетальной сыворотки коров. Планшеты помещали в термостат при температуре 37˚С, 5% СО2, влажности 85% и инкубировали 72 часа. После инкубации в каждую тестируемую лунку добавляли по 50 мкл реагента ХТТ и PMS, который получали добавлением к рабочему раствору с содержанием XTT 1 мг/мл раствора PMS 1,25 мМ из расчета: на каждый мл ХТТ - 20 мкл PMS. Планшет инкубировали еще 4 часа и определяли оптическую плотность ОП490/620на планшетном спектрофотометре SpectraCount (Packard, США). Каждую точку делали в пяти повторностях, определяли среднее значение и дисперсию для различных концентраций вируса, строили график зависимости ОП от MOI. По графику определяли EC50 - концентрацию вируса, при которой величина ОП490/620, измеренная в зараженных лунках, составляет 50% от величины ОП490/620, измеренной в лунках с незараженной культурой. Сравнивали EC50 для разных культур клеток. Чем больше EC50, тем меньшей ингибирующей способностью обладает исследуемый вирусный препарат для данной культуры клеток.
Пример 6. Оценка онколитической активности рекомбинантного штамма ВОВ VVdGF-ApoS24/2 in vivo на модели nude мышей с ксенографтами эпидермоидной карциномы человека А431.
В работе использовали 12 самок nude мышей, возраст 8-10 недель, вес 20-26 г. Для получения ксенографтов эпидермоидной карциномы человека всем мышам прививали 5х106 клеток А431 подкожно в левую заднюю часть тела. Виротерапию начали через 7 дней после формирования хорошо видимых опухолей объемом 175-211 мм3, введение препаратов осуществляли интратуморально на 7,9,11,15,17,19,21,23,25 и 27 сутки от начала эксперимента - введения клеток А431. Все мыши были разделены на 3 группы по 4 штуки каждая. Мышам контрольной группы вводили физ. раствор в объеме 100 мкл. Две других группы мышей лечили исходным вирусом дикого типа Л-ИВП и рекомбинантным штаммом VVdGF-ApoS24/2 соответственно. С этой целью животным в вышеуказанные сроки вводили 2х106БОЕ/мышь в физ. растворе, объем инокулята составлял 100 мкл. Объем опухоли рассчитывали по формуле LxW2x0,5 (Yu, 2009 [23]). Измерения проводили каждые 2 дня. Общий период наблюдения - 45 дней (Фиг. 5).
Таким образом, вышеизложенные результаты (примеры 4-6) подтверждают достижение заявляемого технического результата, а именно: созданы рекомбинантная плазмидная ДНК pGEM-Puro-DS-Apo, несущая синтетический ген апоптина вируса анемии цыплят, и на ее основе штамм рекомбинантного вируса осповакцины VVdGF-ApoS24/2 с усиленной адресной литической активностью в отношении опухолей человека.