НОВЫЕ ЛИГАНДЫ ЭСТРОГЕНОВЫХ РЕЦЕПТОРОВ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к соединениям, которые являются лигандами эстрогеновых рецепторов и предпочтительно избирательны в отношении β-изоформы эстрогеновых рецепторов, к способам получения таких соединений и к способам применения таких соединений при лечении связанных с эстрогеновыми рецепторами заболеваний, таких как депрессивные расстройства, тревожные расстройства, болезнь Альцгеймера, нарушения познавательной способности, остеопороз, повышенное содержание триглицеридов в крови, атеросклероз, эндометриоз, недержание мочи, аутоиммунное заболевание и рак легких, толстой кишки, молочной железы, матки и предстательной железы.
Предпосылки создания изобретения
Эстрогеновый рецептор (ER) представляет собой активируемый лигандом фактор транскрипции млекопитающих, вовлеченный в активацию и подавление экспрессии генов. Естественным гормоном для эстрогенового рецептора является 17β-эстрадиол (E2) и близкородственные метаболиты. Связывание эстрадиола с эстрогеновым рецептором вызывает димеризацию рецептора, и димер, в свою очередь, связывается с эстрогеновыми ответными элементами (ERE) на ДНК. Комплекс ER/ДНК рекрутирует другие факторы транскрипции, отвечающие за транскрипцию ДНК, расположенной дальше ERE по ходу транскрипции, в мРНК, которая, в конечном счете, транслируется в белок. В качестве альтернативы, взаимодействие ER с ДНК может быть непрямым и опосредоваться другими факторами транскрипции, в особенности fos и jun. В связи с тем, что экспрессия большого числа генов регулируется эстрогеновым рецептором, а эстрогеновый рецептор экспрессируется многими типами клеток, модуляция эстрогенового рецептора посредством связывания им естественных гормонов или синтетических лигандов ER может обладать сильным эффектом на физиологию и патофизиологию организма.
Исторически считалось, что существует только один эстрогеновый рецептор. Однако был обнаружен второй подтип рецептора (ER-β). Хотя и «классический» ERα позднее открытый ER-β широко распространены в различных тканях, тем не менее, их распределение в типах клеток и тканях весьма различно. Поэтому, синтетические лиганды, селективные в отношении ER-α или ER-β, могут оказывать положительное действие эстрогена, уменьшая в то же время риск возникновения нежелательных побочных эффектов.
Эстрогены имеют решающее значение для полового развития женщин. Кроме того, эстрогены играют важную роль в поддержании плотности костей, регуляции содержания липидов в крови, и, по-видимому, обладают нейропротекторными эффектами. Следовательно, сниженная продукция эстрогена у женщин в постклимактерическом периоде ассоциирована с целым рядом заболеваний, таких как остеопороз, атеросклероз, депрессия и нарушения познавательной способности. И, наоборот, некоторые типы пролиферативных заболеваний, такие как рак молочной железы, рак матки и эндометриоз, стимулируются эстрогенами, а потому антиэстрогены (т.е. антагонисты эстрогенов) применимы при профилактике и лечении указанных типов нарушений.
Также была продемонстрирована эффективность природного эстрогена, 17β-эстрадиола, для лечения различных форм депрессивного заболевания, и было высказано предположение, что антидепрессантная активность эстрогена может опосредоваться регуляцией активности триптофангидроксилазы и последующего синтеза серотонина (см., например, Lu N.Z., Shlaes T.A., Cundlah C., Dziennis S.E., Lyle R.E., Bethea C.L., "Ovarian steroid action on tryptophan hydroxylase protein and serotonin compared to localization of ovarian steroid receptors in midbrain of guinea pigs." Endocrine 11:257-267, 1999). Плейотропная природа природного эстрогена исключает его широкое, более длительное применение вследствие увеличения риска пролиферативного действия на ткани молочной железы, матки и яичников. Идентификация эстрогенового рецептора, ERβ, обеспечила возможность идентификации более селективных эстрогеновых агентов, которые обладают желаемой антидепрессантной активностью при отсутствии пролиферативного действия, опосредуемого ERα. Таким образом, было показано, что терапевтические средства, обладающие избирательностью в отношении Erβ, потенциально эффективны при лечении депрессии.
В данной области техники существует потребность в соединениях, которые способны индуцировать те же положительные эффекты, что и заместительная терапия эстрогенами, без отрицательных побочных эффектов. Также существует потребность в эстрогеноподобных соединениях, которые обладают эффектами, селективными в отношении различных тканей организма.
В WO 2006/019831 раскрыты некоторые индольные производные, применимые при профилактике или лечении инфекции вирусом гепатита C. В WO 2005/018636 раскрыто определенное индольное производное, обладающее модулирующей активностью в отношении эстрогенового рецептора, причем все упомянутые индолы являются оксимами.
Соединения по настоящему изобретению являются лигандами эстрогеновых рецепторов, а потому могут быть применимы для лечения или профилактики целого ряда состояний, связанных с действием эстрогенов, включая потерю костной массы, переломы костей, остеопороз, дегенерацию хряща, эндометриоз, миому матки, приливы, повышенное содержание холестерина липопротеидов низкой плотности, сердечно-сосудистое заболевание, ухудшение когнитивного функционирования, возрастные умеренные когнитивные нарушения, дегенеративные нарушения в головном мозге, рестеноз, гинекомастию, пролиферацию гладкомышечных клеток сосудов, ожирение, недержание мочи, тревоги, депрессию, депрессию в период перименопаузы, послеродовую депрессию, предменструальный синдром, маниакальную депрессию, деменцию, обсессивно-компульсивное поведение, синдром дефицита внимания, синдром гиперактивности с дефицитом внимания, нарушения сна, раздражительность, импульсивность, управление гневом, нарушения слуха, рассеянный склероз, болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, боковой амиотрофический склероз, травму спинного мозга, удар, аутоиммунное заболевание, воспаление, воспалительное заболевание кишечника, синдром раздраженного кишечника, сексуальную дисфункцию, гипертензии, дегенерацию сетчатки, рак легких, рак толстой кишки, рак молочной железы, рак матки, рак предстательной железы и холангиокарциному.
Краткое описание сущности изобретения
Настоящее изобретение относится к соединению формулы (I) или к его фармацевтически приемлемому сложному эфиру, амиду, карбамату, сольвату или соли, включая соль такого сложного эфира, амида или карбамата и сольват такого сложного эфира, амида, карбамата или соли
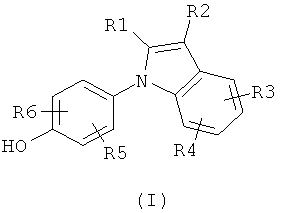
где R1 выбирают из группы, состоящей из атома галогена, циано, нитро, ORΛ, N(RB)2, -C(O)C1-4алкила, -SO2C1-4алкила, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-6алкила, дигалогенC1-6алкила, тригалогенC1-6алкила, галогенC2-6алкенила, дигалогенC2-6алкенила, тригалогенC2-6алкенила, цианоC1-6алкила, C1-4алкоксиC1-6алкила, C3-8циклоалкила, C3-8циклоалкилC1-6алкила, фенила, бензила и 5-10-членного гетероциклила, где упомянутые фенильная, бензильная или гетероциклильная группы могут быть либо незамещенными, либо замещенными 1-3 заместителями, причем каждый заместитель выбирают из группы, состоящей из ORΛ, атома галогена, циано, нитро, -C(O)C1-4алкила, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-6алкила, дигалогенC1-6алкила и тригалогенC1-6алкила;
R2 выбирают из группы, состоящей из атома галогена, циано, нитро, ORA, N(RB)2, N(OH)2, -C(O)C1-4алкила, необязательно замещенного 1-3 атомами галогена, -SO2C1-4алкила, -C(O)NH-OH, -C(NH2)=N-OH, -C(CO2H)=N-OH, -C(NH2)=NH, -C(NHC1-4алкил)=NH, -C(O-C1-4алкил)=NH, -C(NH2)=N-NH2, -NH-C(NH2)=NH, -NH-C(O)NH2, -N=C(-NH-CH2CH2-NH-), -S-CN, -S-C(NH2)=NH, -S-C(NH2)=N-OH, -CO2H, -CH2-CO2H, -CH(OH)CO2H, -C(O)CO2H, SO3H, CH2SO3H, C1-6алкила, галогенC1-6алкила, дигалогенC1-6алкила, тригалогенC1-6алкила, цианоC1-6алкила, C1-4алкоксиC1-6алкила, C2-6алкенила, C2-6алкинила, C3-8циклоалкила, C3-8циклоалкилC1-6алкила, фенила, бензила и 5-10-членного гетероциклила, где упомянутые фенильная, бензильная или гетероциклильная группы могут быть либо незамещенными, либо замещенными 1-3 заместителями, причем каждый заместитель выбирают из группы, состоящей из ORΛ, атома галогена, циано, нитро, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-6алкила, дигалогенC1-6алкила и тригалогенC1-6алкила; при условии, что если одна из R1 и R2 представляет собой атом галогена, то другая должна представлять собой группу, отличную от атома галогена;
каждую из R3, R4, R5 и R6 независимо выбирают из группы, состоящей из атома водорода, ORA, атома галогена, циано, нитро, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-6алкила, дигалогенC1-6алкила и тригалогенC1-6алкила;
каждую RA независимо выбирают из группы, состоящей из атома водорода, C1-6алкила, C2-6алкенила, C2-6алкинила, C3-8циклоалкила, C3-8циклоалкилC1-6алкила, C6-10арила и C6-10арилC1-6алкила, каждый из которых необязательно замещен 1-3 атомами галогена; и
каждую RB независимо выбирают из группы, состоящей из атома водорода, C1-6алкила, C2-6алкенила, C2-6алкинила, C3-8циклоалкила, C3-8циклоалкилC1-6алкила, C6-10арила и C6-10арилC1-6алкила, каждый из которых необязательно замещен 1-3 атомами галогена;
при условии, что соединение формулы (I) не представляет собой
4-[3-(4,5-Дигидро-1H-имидазол-2-ил)-2-(3,5-диметилизоксазол-4-ил)индол-1-ил]фенол;
1-(4-Гидроксифенил)-2-(4-метилимидазол-1-ил)-1H-индол-3-карбонитрил;
1-(4-Гидроксифенил)-2-(1H-пиразол-3-ил)-1H-индол-3-карбонитрил;
1-(3-Хлор-4-гидроксифенил)-2-(1-метил-1H-пиразол-4-ил)-1H-индол-3-карбонитрил;
Амид 1-(4-Гидроксифенил)-2-проп-1-инил-1H-индол-3-карбоновой кислоты; или
1-(4-Гидроксифенил)-2-тиазол-2-ил-1H-индол-3-карбоновую кислоту.
К удивлению было обнаружено, что соединения по настоящему изобретению являются лигандами эстрогенового рецептора. Соответственно, соединения находят применение при лечении и профилактике состояний, ассоциированных с активностью эстрогеновых рецепторов.
Подробное описание изобретения
Соединения по настоящему изобретению могут содержать хиральные (асиметрические) центры, или молекула в целом может быть хиральной. Отдельные стереоизомеры (энантиомеры и диастереоизомеры) и их смеси подпадают под объем настоящего изобретения.
Настоящее изобретение относится к соединениям, которые являются лигандами эстрогеновых рецепторов. Используемый в этом документе термин «лиганд эстрогеновых рецепторов» предназначен охватывать любой фрагмент, который связывается с эстрогеновым рецептором. Лиганд может действовать как агонист, частичный агонист, антагонист или частичный антагонист.Лиганд может быть селективным в отношении ERβ или показывать смешанную активность в отношении ERα и ERβ. Например, лиганд может действовать и как агонист или как частичный агонист ERβ и как антагонист или как частичный антагонист ERα.
Если R1 представляет собой гетероциклильную группу, то эта группа может быть насыщенной или ненасыщенной и может содержать один или несколько атомов O, N и/или S. Она предпочтительно является 5- или 6-членной. Подходящие гетероциклильные группы включают фурил, тиенил, пирролил, пирролинил, пирролидинил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, пиридил, морфолинил и пиперидил, причем изоксазолил является особенно предпочтительной гетероциклильной группой. Предпочтительные заместители для гетероциклильной группы включают 1-3, например, 1 или 2, заместителя, причем каждый заместитель выбирают из группы, состоящей из ORA, атома галогена, циано, -C(O)C1-4алкила, C1-4алкила, C2-4алкенила, C2-4алкинила, галогенC1-4алкила, дигалогенC1-4алкила и тригалогенC1-4алкила. Особенно предпочтительные заместители выбирают из атома галогена, циано, C1-4алкила (в особенности, метила), -C(O)C1-4алкила и ORA, где RA предпочтительно представляет собой атом водорода или C1-4алкильную группу. Более предпочтительные заместители выбирают из атома галогена, циано и C1-4алкила (в особенности, метила или этила).
Предпочтительные заместители для фенильной или бензильной группы R1 включают заместители, упомянутые выше для гетероциклильной группы R1.
Если R2 представляет собой гетероциклильную группу, то эта группа может представлять собой, например, одну из предпочтительных групп, упомянутых выше для R1.
Предпочтительные заместители для фенильной или бензильной группы R2 включают заместители, упомянутые выше для гетероциклильной группы R1.
Если иное не указано особо, то каждую RA предпочтительно независимо выбирают из группы, состоящей из атома водорода, C1-4алкила, C2-4алкенила, C2-4алкинила, C3-6циклоалкила, фенила и бензила. Предпочтительно, каждая RA независимо представляет собой атом водорода или C1-4алкил, в особенности метил.
Если иное не указано особо, то каждую RB предпочтительно независимо выбирают из группы, состоящей из атома водорода и C1-4алкила.
Предпочтительно, R1 выбирают из группы, состоящей из ORA, N(RB)2, -C(O)C1-4алкила, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-4алкила, дигалогенC1-4алкила, тригалогенC1-4алкила, галогенC2-4алкенила, дигалогенC2-4алкенила, тригалогенC2-4алкенила, фенила и 5-6-членного гетероциклила, где упомянутые фенильная или гетероциклильная группы могут быть либо незамещенными, либо замещенными, как описано выше. Более предпочтительно, R1 выбирают из группы, состоящей из ORA, N(RB)2, -C(O)C1-4алкила, C1-4алкила, C2-4алкенила, C2-4алкинила, фенила и 5-6-членного гетероциклила, где упомянутые фенильная или гетероциклильная группы могут быть либо незамещенными, либо замещенными, как описано выше.
R2 может быть выбрана, например, из одной из предпочтительных групп, упомянутых выше для R1. В одном варианте осуществления настоящего изобретения R2 выбирают из группы, состоящей из атома галогена, циано, нитро, ORA, N(RB)2, N(OH)2, -C(O)C1-4алкила, необязательно замещенного 1-3 атомами галогена, -SO2C1-4алкила, -C(O)NH-OH, -C(NH2)=N-OH, -C(CO2H)=N-OH, -C(O-C1-4алкил)=NH, -C(NH2)=N-NH2, -NH-C(NH2)=NH, -NH-C(O)NH2, -N=C(-NH-CH2CH2-NH-), -S-CN, -S-C(NH2)=NH, -S-C(NH2)=N-OH, -CO2H, -CH2-CO2H, -CH(OH)CO2H, -C(O)CO2H, SO3H, CH2SO3H, C1-6алкила, галогенC1-6алкила, дигалогенC1-6алкила, тригалогенC1-6алкила, цианоC1-6алкила, C1-4алкоксиC1-6алкила, C2-6алкенила, C2-6алкинила, C3-8циклоалкила, C3-8циклоалкилC1-6алкила, фенила, бензила и 5-10-членного гетероциклила, где упомянутые фенильная, бензильная или гетероциклильная группы могут быть либо незамещенными, либо замещенными 1-3 заместителями, причем каждый заместитель выбирают из группы, состоящей из ORΛ, атома галогена, циано, нитро, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-6алкила, дигалогенC1-6алкила и тригалогенC1-6алкила.
В альтернативном варианте осуществления настоящего изобретения R2 выбирают из группы, состоящей из атома галогена, нитро, ORA, N(RB)2, -C(O)C1-4алкила, необязательно замещенного 1-3 атомами галогена, -SO2C1-4алкила, -C(O)NH-OH, -C(NH2)=N-OH, -C(NH2)=NH, -NH-C(NH2)=NH, -NH-C(O)NH2, -N=C(-NH-CH2CH2-NH-), -S-C(NH2)=NH, -CO2H, -CH2-CO2H, SO3H, CH2SO3H, C1-6алкила, галогенC1-6алкила, дигалогенC1-6алкила, тригалогенC1-6алкила, цианоC1-6алкила, C1-4алкоксиC1-6алкила, C2-6алкенила, C2-6алкинила, C3-8циклоалкила, C3-8циклоалкилC1-6алкила, фенила, бензила и 5-10-членного гетероциклила, где упомянутые фенильная, бензильная или гетероциклильная группы могут быть либо незамещенными, либо замещенными 1-3 заместителями, причем каждый заместитель выбирают из группы, состоящей из ORA, атома галогена, циано, нитро, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-6алкила, дигалогенC1-6алкила и тригалогенC1-6алкила.
В предпочтительном варианте осуществления настоящего изобретения R2 выбирают из группы, состоящей из атома галогена, нитро, ORA, N(RB)2, -C(O)C1-4алкила, необязательно замещенного 1-3 атомами галогена, -SO2C1-4алкила, -C(O)NH-OH, -C(NH2)=N-OH, -NH-C(NH2)=NH, -NH-C(O)NH2, -N=C(-NH-CH2CH2-NH-), -S-C(NH2)=NH, -CO2H, -CH2-CO2H, C1-6алкила, галогенC1-6алкила, дигалогенC1-6алкила, тригалогенC1-6алкила, цианоC1-6алкила, C1-4алкоксиC1-6алкила, C2-6алкенила, C2-6алкинила, C3-8циклоалкила, C3-8циклоалкилC1-6алкила, фенила, бензила и 5-10-членного гетероциклила, где упомянутые фенильная, бензильная или гетероциклильная группы могут быть либо незамещенными, либо замещенными 1-3 заместителями, причем каждый заместитель выбирают из группы, состоящей из ORA, атома галогена, циано, нитро, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-6алкила, дигалогенC1-6алкила и тригалогенC1-6алкила. Более предпочтительно, R2 выбирают из группы, состоящей из -C(O)C1-4алкила (особенно -C(O)CH3), -C(NH2)=N-OH, -CO2H, -CH2-CO2H, C1-4алкила, C2-4алкенила, C2-4алкинила и 5-6-членного гетероциклила, где упомянутая гетероциклильная группа может быть либо незамещенной, либо замещенной, как описано выше. Наиболее предпочтительно, R2 выбирают из группы, состоящей из -C(O)CH3), -C(NH2)=N-OH, -CO2H и -CH2-CO2H, причем -C(NH2)=N-OH является особенно предпочтительной R2 группой.
Предпочтительно, каждую из R3, R4, R5 и R6 выбирают из группы, состоящей из атома водорода, ORΛ, атома галогена, циано, C1-4алкила, например, метила, галогенC1-4алкила, например, хлорметила или фторметила, дигалогенC1-4алкила, например, дихлорметила или дифторметила, и тригалогенC1-4алкила, например, трихлорметила или трифторметила. Предпочтительно, каждую из R3, R4, R5 и R6 выбирают из группы, состоящей из атома водорода, OH, атома галогена, циано, метила или трифторметила. Наиболее предпочтительно, по меньшей мере, одна из R3 и R4 представляет собой атом водорода. Наиболее предпочтительно, каждая R5 и R6 независимо представляет собой атом водорода и/или галогена, в особенности атом фтора.
Соответственно, в одной предпочтительной группе соединений по настоящему изобретению R1 выбирают из группы, состоящей из ORA, N(RB)2, -C(O)C1-4алкила, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-4алкила, дигалогенC1-4алкила, галогенC2-4алкенила, дигалогенC2-4алкенила, тригалогенC2-4алкенила, фенила и 5-6-членного гетероциклила, где упомянутые фенильная или гетероциклильная группы могут быть либо незамещенными, либо замещенными, как описано выше; более предпочтительно, R1 выбирают из группы, состоящей из ORA, N(RB)2, -C(O)C1-4алкила, C1-4алкила, C2-4алкенила, C2-4алкинила, фенила и 5-6-членного гетероциклила, где упомянутые фенильная или гетероциклильная группы могут быть либо незамещенными, либо замещенными, как описано выше;
R2 выбирают из группы, состоящей из -C(O)C1-4алкила (в особенности -C(O)CH3), -C(NH2)=N-OH, -CO2H, -CH2-CO2H, C1-4алкила, C2-4алкенила, C2-4алкинила и 5-6-членного гетероциклила, где упомянутая гетероциклильная группа может быть либо незамещенной, либо замещенной, как описано выше;
каждую из R3, R4, R5 и R6 выбирают из группы, состоящей из атома водорода, ORA, атома галогена, циано, C1-4алкила, галогенC1-4алкила, дигалогенC1-4алкила и тригалогенC1-4алкила, в особенности из атома водорода, OH, атома галогена, циано, метила или трифторметила; в особенности, каждый из R5 и R6 представляет собой атом водорода и/или галогена, в особенности атом фтора;
каждую RA предпочтительно независимо выбирают из группы, состоящей из атома водорода, C2-4алкенила, C2-4алкинила, C3-6циклоалкила, фенила и бензила, в особенности из атома водорода и C1-4алкила, в особенности метила; и
каждую RB независимо выбирают из группы, состоящей из атома водорода и C1-4алкила.
В дополнительном варианте осуществления настоящее изобретение относится к соединению формулы (I) или к его фармацевтически приемлемому сложному эфиру, амиду, сольвату или соли, включая соль такого сложного эфира, амида и сольват такого сложного эфира, амида или соли

где R1 выбирают из группы, состоящей из атома галогена, циано, нитро, ORA, N(RB)2, -C(O)C1-4алкила, -SO2C1-4алкила, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-6алкила, дигалогенC1-6алкила, тригалогенC1-6алкила, галогенC2-6алкенила, дигалогенC2-6алкенила, тригалогенC2-6алкенила, цианоC1-6алкила, C1-4алкоксиC1-6алкила, C3-8циклоалкила, C3-8циклоалкилC1-6алкила, фенила, бензила и 5-10-членного гетероциклила, где упомянутые фенильная, бензильная или гетероциклильная группы могут быть либо незамещенными, либо замещенными 1-3 заместителями, причем каждый заместитель выбирают из группы, состоящей из ORA, атома галогена, циано, нитро, -C(O)C1-4алкила, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-6алкила, дигалогенC1-6алкила и тригалогенC1-6алкила;
R2 выбирают из группы, состоящей из атома галогена, циано, нитро, ORA, N(RB)2, -C(O)C1-4алкила, необязательно замещенного 1-3 атомами галогена, -SO2C1-4алкила, -C(O)NH-OH, -C(NH2)=N-OH, -C(NH2)=NH, -NH-C(NH2)=NH, -NH-C(O)NH2, -N=C(-NH-CH2CH2-NH-), -S-C(NH2)=NH, -CO2H, -CH2-CO2H, SO3H, CH2SO3H, C1-6алкила, галогенC1-6алкила, дигалогенC1-6алкила, тригалогенC1-6алкила, цианоC1-6алкила, C1-4алкоксиC1-6алкила, C2-6алкенила, C2-6алкинила, C3-8циклоалкила, C3-8циклоалкилC1-6алкила, фенила, бензила и 5-10-членного гетероциклила, где упомянутые фенильная, бензильная или гетероциклильная группы могут быть либо незамещенными, либо замещенными 1-3 заместителями, причем каждый заместитель выбирают из группы, состоящей из ORA, атома галогена, циано, нитро, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-6алкила, дигалогенC1-6алкила и тригалогенC1-6алкила; при условии, что если одна из R1 и R2 представляет собой атом галогена, то другая должна представлять собой группу, отличную от атома галогена;
каждую из R3, R4, R5 и R6 независимо выбирают из группы, состоящей из атома водорода, ORA, атома галогена, циано, нитро, C1-6алкила, C2-6алкенила, C2-6алкинила, галогенC1-6алкила, дигалогенC1-6алкила и тригалогенC1-6алкила;
каждую RΛ независимо выбирают из группы, состоящей из атома водорода, C1-6алкила, C2-6алкенила, C2-6алкинила, C3-8циклоалкила, C3-8циклоалкилC1-6алкила, C6-10арила и C6-10арилC1-6алкила, каждый из которых необязательно замещен 1-3 атомами галогена; и
каждую RB независимо выбирают из группы, состоящей из атома водорода, C1-6алкила, C2-6алкенила, C2-6алкинила, C3-8циклоалкила, C3-8циклоалкилC1-6алкила, C6-10арила и C6-10арилC1-6алкила, каждый из которых необязательно замещен 1-3 атомами галогена;
при условии, что соединение формулы (I) не представляет собой 4-[3-(4,5-дигидро-1H-имидазол-2-ил)-2-(3,5-диметилизоксазол-4-ил)индол-1-ил]фенол.
Соединения формулы (I) включают без ограничения соединения, конкретно поименованные в представленных в этом документе примерах. В примерах названия соединений были образованы в соответствии с IUPAC при помощи программного обеспечения ACD Labs 8.0/name program, версия 8.05 и/или при помощи ISIS DRAW Autonom 2000 и/или ChemBioDraw Ultra, версия 11.0.
В зависимости от заместителей, присутствующих в соединениях формулы (I), соединения могут образовывать сложные эфиры, амиды, карбаматы и/или соли. Солями и сольватами соединений формулы (I), подходящими для применения в медицине, являются те из них, в которых противоион или ассоциированный растворитель является фармацевтически приемлемым. Тем не менее, соли и сольваты, содержащие фармацевтически неприемлемые противоионы или ассоциированные растворители, подпадают под объем настоящего изобретения, например, для применения в качестве промежуточных продуктов при получении соединений формулы (I) и их фармацевтически приемлемых солей, сольватов и физиологически активных производных. Под термином «физиологически активное производное» понимают химическое производное соединения формулы (I), обладающее той же физиологической активностью, что и свободное соединение формулы (I), например, преобразуясь в него в организме. Сложные эфиры, амиды и карбаматы являются примерами физиологически активных производных.
Подходящие соли по настоящему изобретению включают соли, образованные с органическими или неорганическими кислотами или основаниями. В частности, подходящие соли, образованные с кислотами по настоящему изобретению, включают соли, образованные с неорганическими кислотами, сильными органическими карбоновыми кислотами, такими как алканкарбоновые кислоты, содержащие 1-4 атома углерода, которые являются незамещенными или замещенными, например, атомом галогена, такими как ненасыщенные или насыщенные дикарбоновые кислоты, такими как гидроксикарбоновые кислоты, такими как аминокислоты, или с органическими сульфоновыми кислотами, такими как (C1-C4)-алкилсульфоновыми или арилсульфоновыми кислотами, которые являются незамещенными или замещенными, например, атомом галогена. Фармацевтически приемлемые кислотно-аддитивные соли включают соли, образованные с хлористоводородной, бромистоводородной, серной, азотной, лимонной, винной, фосфорной, пировиноградной, трифторуксусной, янтарной, перхлорной, фумаровой, малеиновой, гликолевой, салициловой, щавелевоуксусной, метансульфоновой, этансульфоновой, пара-толуолсульфоновой, муравьиной, бензойной, малоновой, нафталин-2-сульфоновой, бензолсульфоновой, изэтионовой, аскорбиновой, яблочной, фталевой, аспарагиновой и глутаминовой кислотами, лизином и аргинином. Другие кислоты, такие как щавелевая, хотя и не являются сами по себе фармацевтически приемлемыми, могут использоваться в качестве промежуточных продуктов при получении соединений по настоящему изобретению и их фармацевтически приемлемых кислотно-аддитивных солей.
Фармацевтически приемлемые основно-аддитивные соли включают соли аммония, соли щелочных металлов, например, соли калия и натрия, соли щелочноземельных металлов, например, соли кальция и магния, и соли, образованные с органическими основаниями, например, с дициклогексиламином, N-метил-D-глюкомином, морфолином, тиоморфолином, пиперидином, пирролидином, с моно-, ди- или три-(низший алкил)амином, например, с этил-, трет-бутил-, диэтил-, диизопропил-, триэтил-, трибутил- или диметилпропиламином, или с моно-, ди- или тригидрокси(низший алкил)амином, например, с моно-, ди- или триэтаноламином. Дополнительно могут образовываться внутренние соли.
Соединения формулы (I) могут содержать подходящую группу, преобразованную в сложный эфир, амид или карбамат. Так, типичные сложноэфирные и амидные группы, образованные из кислотной группы в соединении формулы (I), включают -COORB, -CONRB 2, -SO2ORB или -SO2NRB 2, тогда как типичные сложноэфирные, амидные и карбаматные группы, образованные из -OH или -NHRB группы в соединении формулы (I), включают -OCORB, -NRBCORB, -NRBCO2R8 -OSO2RB и -NRBSO2RB, где значение RB является одним из представленных выше.
Специалисты в области органической химии должны понимать, что многие органические соединения могут образовывать комплексы с растворителями, в которых они вступают во взаимодействие или в которых они выпадают в осадок или кристаллизуются. Такие комплексы известны как «сольваты». Например, комплекс с водой известен как «гидрат».
Соединение, которое при введении реципиенту способно преобразовываться в описанное выше соединение формулы (I), или в его активный метаболит или остаток, известно как «пролекарство». Пролекарство может быть преобразовано внутри организма, например, путем гидролиза в крови, в свою активную форму, которая обладает лечебными эффектами. Фармацевтически приемлемые пролекарства описаны в T. Higuchi and V. Stella, Prodrugs as Novel Delivery Systems, Vol.14 of the A.C.S. Symposium Series (1976); "Design of Prodrugs" ed. H. Bundgaard, Elsevier, 1985; и в Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987, которые включены в этот документ посредством ссылки.
Следующие определения применяются к терминам, используемым на всем протяжении этого описания изобретения, если иное не оговорено особо в специальных случаях.
Используемый в этом документе термин «алкил» означает насыщенные углеводородные группы и с неразветвленной и с разветвленной цепью.
Примеры алкильных групп включают метильную, этильную, н-пропильную, изопропильную, н-бутильную, трет-бутильную, изобутильную, втор-бутильную, пентильную и гексильную группы. Среди неразветвленных алкильных групп предпочтительными являются метильная, этильная, н-пропильная, изопропильная и н-бутильная группы. Среди разветвленных алкильных групп могут быть упомянуты трет-бутильная, изобутильная, 1-этилпропильная и 1-этилбутильная группы.
Используемый в этом документе термин «алкокси» означает группу O-алкил, где значение термина «алкил» описано выше.
Примеры алкоксигрупп включают метоксигруппу и этоксигруппу. Другие примеры включают пропокси и бутокси.
Используемый в этом документе термин «алкенил» означает ненасыщенные углеводородные группы и с неразветвленной и с разветвленной цепью, содержащие, по меньшей мере, одну двойную углерод-углеродную связь. Примеры алкенильных групп включают этенил, пропенил, бутенил, пентенил и гексенил. Предпочтительные алкенильные группы включают этенил, 1-пропенил и 2-пропенил.
Используемый в этом документе термин «алкинил» означает ненасыщенные углеводородные группы и с неразветвленной и с разветвленной цепью, содержащие, по меньшей мере, одну тройную углерод-углеродную связь. Примеры алкинильных групп включают этинил, пропинил, бутинил, пентинил и гексинил. Предпочтительные алкенильные группы включают этинил, 1-пропинил и 2-пропинил.
Используемый в этом документе термин «циклоалкил» означает насыщенную группу в кольцевой системе. Циклоалкильная группа может быть моноциклической и бициклической. Бициклическая группа может быть, например, конденсированной или связанной мостиковой связью. Примеры моноциклических циклоалкильных групп включают циклопропил, циклобутил и циклопентил. Другими примерами моноциклических циклоалкильных групп являются циклогексил, циклогептил и циклооктил. Примеры бициклических циклоалкильных групп включают бицикло[2.2.1]гепт-2-ил. Предпочтительно, циклоалкильная группа является моноциклической.
Используемый в этом документе термин «арил» означает моноциклическую или бициклическую ароматическую карбоциклическую группу. Примеры арильных групп включают фенил и нафтил. Нафтильная группа может быть присоединена через 1- или 2-положение. В бициклической ароматической группе одно из колец может быть, например, частично насыщенным. Примеры таких групп включают инданил и тетрагидронафтил. Конкретно, используемый в этом документе термин «C5-10арил» означает группу, содержащую от 5 до 10 атомов углерода в моноциклической или бициклической ароматической группе. Особенно предпочтительной C5-10арильной группой является фенил.
Используемый в этом документе термин «атом галогена» означает атом фтора, хлора, брома или йода. Особенно предпочтительными являются атом фтора, хлора и брома.
Используемый в этом документе термин «галогеналкил» означает алкильную группу, содержащую галогеновый заместитель, причем значения терминов «алкил» и «атом галогена» определены выше. По аналогии, термин «дигалогеналкил» означает алкильную группу, содержащую два галогеновых заместителя, а термин «тригалогеналкил» означает алкильную группу, содержащую три галогеновых заместителя. Примеры галогеналкильных групп включают фторметильную, хлорметильную, бромметильную, фторпропильную и фторбутильную группы; примеры дигалогенальных групп включают дифторметильную и дифторэтильную группы; примеры тригалогенальных групп включают трифторметильную и трифторэтильную группы.
Используемый в этом документе термин «гетероциклил» означает состоящую из атомов углерода ароматическую или неароматическую циклическую группу, в которой от 1 до 3 атомов углерода замещены одним или несколькими гетероатомами, независимо выбранными из атомов азота, кислорода или серы. Гетероциклильная группа может быть, например, моноциклической или бициклической. В бициклической гетероциклильной группе один или несколько гетероатомов может содержаться в каждом кольце или только в одном из колец. Гетероатом предпочтительно представляет собой O или N. Гетероциклильные группы, содержащие подходящий атом азота, включают соответствующие N-оксиды.
Примеры моноциклических неароматических гетероциклильных групп (также называемых моноциклическими гетероциклоалкильными кольцами) включают азиридинил, азетидинил, пирролидинил, имидазолидинил, пиразолидинил, пиперидинил, пиперазинил, тетрагидрофуранил, тетрагидропиранил, морфолинил, тиоморфолинил и азепанил.
Примеры моноциклических гетероциклильных групп, в которых одно из колец является неароматическим, включают дигидробензофуранил, инданил, индолинил, изоиндолинил, тетрагидроизохинолинил, тетрагидрохинолил и бензоазепанил.
Примеры моноциклических ароматических гетероциклильных групп (также называемых моноциклическими гетероарильными группами) включают фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, оксадиазолил, тиадиазолил, пиридил, триазолил, триазинил, пиридазил, изотиазолил, изоксазолил, пиразинил, пиразолил и пиримидил.
Примеры бициклических ароматических гетероциклильных групп (также называемых бициклическими гетероарильными группами) включают хиноксалинил, хиназолинил, пиридопиразинил, бензоксазолил, бензотиофенил, бензимидазолил, нафтиридинил, хинолинил, бензофуранил, индолил, бензотиазолил, оксазолил[4,5-b]пиридинил, пиридопиримидил, изохинолинил и бензодроксазол.
Примеры предпочтительных гетероциклильных групп включают пиперидинил, тетрагидрофуранил, тетрагидропиранил, пиридил, пиримидил и индолил. Предпочтительные гетероциклильные группы также включают тиенил, тиазолил, фуранил, пиразолил, пирролил, изоксазолил и имидазолил.
Используемый в этом документе термин «циклоалкилалкил» означает группу циклоалкил-алкил-, присоединенную через алкильную группу, при этом понимают, что значения терминов «циклоалкил» и «алкил» определены выше.
Как упомянуто выше, соединения по настоящему изобретению обладают активностью в качестве лигандов эстрогеновых рецепторов. Соединения по настоящему изобретению обладают активностью в качестве модуляторов эстрогеновых рецепторов и могут являться агонистами, частичными агонистами, антагонистами или частичными антагонистами эстрогенового рецептора. В частности, предпочтительные соединения по настоящему изобретению обладают активностью в качестве агониста или частичного агониста ERβ. Предпочтительные соединения этого типа являются селективными агонистами эстрогенового рецептора β (ERβ).
Таким образом, соединения по настоящему изобретению могут быть применимы при лечении заболеваний или нарушений, ассоциированных с активностью эстрогеновых рецепторов. В частности, соединения по настоящему изобретению, которые являются агонистами или частичными агонистами эстрогенового рецептора, могут быть применимы при лечении заболеваний или нарушений, для которых показано применение селективных агонистов или частичных агонистов эстрогенового рецептора. Соединения по настоящему изобретению, которые являются антагонистами или частичными антагонистами эстрогенового рецептора, могут быть применимы при лечении заболеваний или нарушений, для которых показано применение селективных антагонистов или частичных антагонистов эстрогенового рецептора.
Клиническими состояниями, для которых показано применение агониста или частичного агониста, включают без ограничения потерю костной массы, переломы костей, остеопороз, дегенерацию хряща, эндометриоз, миому матки, приливы, повышенное содержание холестерина липопротеидов низкой плотности, сердечно-сосудистое заболевание, ухудшение когнитивного функционирования, дегенеративные нарушения в головном мозге, рестеноз, гинекомастию, пролиферацию гладкомышечных клеток сосудов, ожирение, недержание мочи, тревоги, депрессию, аутоиммунное заболевание, воспаление, воспалительное заболевание кишечника, синдром раздраженного кишечника, сексуальную дисфункцию, гипертензию, дегенерацию сетчатки и рак легких, рак толстой кишки, рак молочной железы, рак матки и рак предстательной железы, и/или нарушения, связанные с действием эстрогенов.
Соединения по настоящему изобретению обнаруживают особое применение для лечения или профилактики следующего: потери костной массы, переломов костей, остеопороза, дегенерации хряща, эндометриоза, миомы матки, приливов, повышенного содержания холестерина липопротеидов низкой плотности, сердечно-сосудистого заболевания, ухудшения когнитивного функционирования, возрастных умеренных когнитивных нарушений, дегенеративных нарушений в головном мозге, рестеноза, гинекомастии, пролиферации гладкомышечных клеток сосудов, ожирения, недержания мочи, тревоги, депрессии, депрессии в период перименопаузы, послеродовой депрессии, предменструального синдрома, маниакальной депрессии, деменции, обсессивно-компульсивного поведения, синдрома дефицита внимания, синдрома гиперактивности с дефицитом внимания, нарушений сна, раздражительности, импульсивности, управления гневом, нарушений слуха, рассеянного склероза, болезни Паркинсона, болезни Альцгеймера, болезни Гентингтона, бокового амиотрофического склероза, травмы спинного мозга, удара, аутоиммунного заболевания, воспаления, воспалительного заболевания кишечника, синдрома раздраженного кишечника, сексуальной дисфункции, гипертензии, дегенерации сетчатки, рака легких, рака толстой кишки, рака молочной железы, рака матки, рака предстательной железы и рака желчного протока, называемого холангиокарциномой.
В одном варианте осуществления настоящего изобретения соединения по настоящему изобретению обнаруживают особое применение для лечения или профилактики депрессии, депрессии в период перименопаузы, послеродовой депрессии, предменструального синдрома и маниакальной депрессии.
Лечение или профилактика приливов (или приливов крови) у мужчин предпочтительна для пациентов, проходящих андроген-депривационную терапию для лечения рака предстательной железы.
Выражение «депрессия» включает без ограничения большое депрессивное расстройство, дистимическое расстройство, биполярное расстройство, циклотимическое расстройство, расстройство настроения вследствие общего состояния здоровья, индуцированное веществами расстройство настроения, сезонное аффективное расстройство (SAD), послеродовую депрессию и предменструальное дисфорическое расстройство.
Настоящее изобретение также относится к способу лечения или профилактики опосредованного эстрогеновыми рецепторами состояния у млекопитающего, который включает введение млекопитающему терапевтически эффективного количества соединения по настоящему изобретению. Опосредованные эстрогеновыми рецепторами клинические состояния, которые могут подвергаться лечению способом по настоящему изобретению, предпочтительно представляют собой состояния, описанные выше.
Настоящее изобретение также относится к применению соединения по настоящему изобретению для производства лекарственного средства для лечения или профилактики опосредованного эстрогеновыми рецепторами состояния. Опосредованные эстрогеновыми рецепторами клинические состояния, которые могут подвергаться лечению способом по настоящему изобретению, предпочтительно представляют собой состояния, описанные выше.
Количество активного ингредиента, которое требуется для достижения терапевтического эффекта, без сомнения, будет варьировать от конкретно используемого соединения, пути введения, подвергаемого лечению субъекта, включая тип, виды, возраст, массу тела, пол и состояние здоровья пациента, функции почек и печени у пациента, и конкретного подвергаемого лечению нарушения или заболевания, а также от его тяжести. Врач, ветеринар или клинический врач может легко определить и прописать эффективное количество лекарства, требуемое для предупреждения, противодействия или подавления прогрессирования заболевания.
Пероральные дозировки по настоящему изобретению, в случае применения для достижения указанных эффектов, будут варьировать приблизительно от 0,01 мг на кг массы тела в сутки (мг/кг/сутки) для взрослого человека приблизительно до 100 мг/кг/сутки, предпочтительно от 0,01 мг на кг массы тела в сутки (мг/кг/сутки) до 10 мг/кг/сутки, и наиболее предпочтительно от 0,1 до 5,0 мг/кг/сутки. Для перорального введения композиции предпочтительно представлены в виде таблеток или других форм, представленных в виде дискретных элементов, содержащих 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100 и 500 мг активного ингредиента для симптоматической корректировки дозировки для подлежащего лечению пациента. Лекарственное средство обычно содержит приблизительно от 0,01 мг приблизительно до 500 мг активного ингредиента, предпочтительно приблизительно от 1 мг приблизительно до 100 мг активного ингредиента. Для внутривенного введения наиболее предпочтительные дозы будут варьировать приблизительно от 0,1 приблизительно до 10 мг/кг/мин с постоянной скоростью вливания. Предпочтительно, соединения по настоящему изобретению могут вводиться в виде однократной суточной дозы, или общая суточная доза может вводиться дробными дозами 2, 3 или 4 раза в сутки. Кроме того, предпочтительные соединения по настоящему изобретению могут вводиться в интраназальной форме в подходящих для местного применения интраназальных носителях, или чрезкожно с использованием форм чрезкожных пластырей, хорошо известных специалистам в данной области техники. Для введения в форме чрезкожной системы доставки введение дозы, без сомнения, будет скорее постоянным, чем прерывистым, на протяжении всей схемы приема лекарственного средства.
Хотя и возможно введение только активного ингредиента, является предпочтительным, чтобы он был включен в фармацевтический препарат или композицию. Соответственно, настоящее изобретение относится к фармацевтической композиции, содержащей соединение по настоящему изобретению и фармацевтически приемлемый разбавитель, эксципиент или носитель (собирательно называемые в этом документе «носителями»). Фармацевтические композиции по настоящему изобретению могут принимать форму фармацевтического препарата, описанного ниже.
Фармацевтические препараты по настоящему изобретению включают препараты, подходящие для перорального, парентерального (включая подкожное, внутрикожное, внутримышечное, внутривенное [болюс или инфузия] и внутрисуставное), ингаляционного (включая мелкодисперсные порошки или аэрозоли, которые могут генерироваться посредством применения различных типов дозирующих ингаляторов по давлением), введения с применением небулайзеров или инсуффляторов, ректального, интраперитонеального и местного (включая дермальное, буккальное, подъязычное и внутриглазное) введения, хотя наиболее подходящий путь может зависеть, например, от состояния пациента и имеющегося у него нарушения.
Препараты могут быть подходящим образом представлены в виде единичной дозированной формы и могут быть приготовлены любыми из способов, хорошо известных в области фармации. Все способы включают стадию смешивания активного ингредиента с носителем, который содержит один или несколько дополнительных ингредиентов. В целом препараты получают путем однородного и тщательного смешивания активного ингредиента с жидкими носителями или мелкодисперсными твердыми носителями, или с обоими, а затем, при необходимости, формования продукта в виде желаемого препарата.
Препараты по настоящему изобретению, подходящие для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, облатки, пилюли или таблетки, каждая из которых содержит заранее определенное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной жидкости или в неводной жидкости, например, в виде эликсиров, настоек, суспензий или сиропов; или в виде жидкой эмульсии типа «масло в воде» или жидкой эмульсии типа «вода в масле». Активный ингредиент может быть также представлен в виде болюса, электуария или пасты.
Таблетка может быть изготовлена путем прессования или формования, необязательно с одним или несколькими дополнительными ингредиентами. Спрессованные таблетки могут быть получены путем прессования в подходящем механизме активного ингредиента в свободнотекучем состоянии, таком как порошок или гранулы, необязательно смешанного со связующим веществом, лубрикантом, инертным разбавителем, поверхностно-активным или диспергирующим веществом. Формованные таблетки могут быть получены путем формования в подходящем механизме смеси измельченного соединения, увлажненного инертным жидким разбавителем. На таблетки необязательно могут быть нанесены покрытие и риски, и таблетки могут быть приготовлены таким образом, чтобы обеспечить медленное или контролируемое высвобождение содержащегося в них активного ингредиента. Соединения по настоящему изобретению, например, могут вводиться в форме, подходящей для немедленного высвобождения или длительного высвобождения. Немедленное высвобождение или длительное высвобождение могут достигаться путем применения подходящих фармацевтических композиций, содержащих соединения по настоящему изобретению, или, особенно в случае длительного высвобождения, путем использования устройств, таких как подкожные имплантаты или осмотические наносы. Соединения по настоящему изобретению могут также вводиться внутри липосом.
Типичные композиции для перорального введения включают суспензии, которые могут содержать, например, микрокристаллическую целлюлозу для придания сыпучести, альгиновую кислоту или альгинат натрия в качестве суспендирующего агента, метилцеллюлозу в качестве усилителя вязкости, и подсластители и ароматизаторы, такие как известные в данной области техники; и таблетки с немедленным высвобождением, которые могут содержать, например, микрокристаллическую целлюлозу, дикальцийфосфат, крахмал, стеарат магния, сульфат кальция, сорбит, глюкозу и/или лактозу и/или другие эксципиенты, связующие вещества, средства увеличения объема, дезинтегранты, разбавители и лубриканты, такие как известные в данной области техники. Подходящие связующие вещества включают крахмал, желатин, натуральные сахара, такие как глюкоза или β-лактоза, подсластители из кукурузы, натуральные или синтетические камеди, такие как акация, трагакант или альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль, воски, и тому подобное. Дезинтегранты включают без ограничения крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь, и тому подобное. Соединения формулы (I) могут быть также доставлены в ротовую полость путем подъязычного и/или буккального введения. Типичными формами, которые могут быть использованы, являются формованные таблетки, спрессованные таблетки или лиофилизированные таблетки. Типичные композиции включают препараты, содержащие соединение(я) по настоящему изобретению, и быстрорастворимые разбавители, такие как манит, лактоза, сахароза и/или циклодекстрины. В такие препараты также могут быть включены высокомолекулярные эксципиенты, такие как целлюлозы (авицел) или полиэтиленгликоли (PEG). Такие препараты могут также содержать эксципиент для улучшения адгезии к слизистым оболочкам, такой как гидроксипропилцеллюлозу (HPC), гидроксипропилметилцеллюлозу (HPMC), натрия карбоксиметилцеллюлозу (SCMC), сополимер малеинового ангидрида (например, Gantrez) и регуляторы высвобождения, такие как полиакриловый сополимер (например, Carbopol 934). Для простоты производства и использования также могут быть добавлены лубриканты, глиданты, ароматизаторы, красители и стабилизаторы. Лубриканты, используемые в таких дозированных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия, и тому подобное. Для перорального введения в жидкой форме компоненты перорального лекарства могут быть объединены с любым пероральным, нетоксичным, фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода, и тому подобное.
Соединения по настоящему изобретению также могут вводиться в форме липосомальных систем доставки, таких как небольшие моноламеллярные везикулы, большие моноламеллярные везикулы и мультиламеллярные везикулы. Липосомы могут быть сформированы целым рядом фосфолипидов, 1,2-дипальмитоилфосфатидилхолином, фосфатидилэтаноламином (цефалином) или фосфатидилхолином (лецитином).
Препараты для парентерального введения включают водные и неводные стерильные инъецируемые растворы, которые могут содержать антиоксиданты, буферные вещества, бактериостаты и растворимые вещества, наделяющие препарат свойством изотоничности с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители. Препараты могут быть представлены в виде контейнеров с единичными или многократными дозами, например, герметичные ампулы или сосуды, и могут храниться в высушенном сублимацией (лиофилизированном) состоянии, требующем лишь добавления стерильного жидкого носителя, например, солевого раствора или воды для инъекций, непосредственно перед использованием. Спонтанно приготовленные для немедленного введения инъецируемые растворы и суспензии могут быть приготовлены из стерильных порошков, гранул или таблеток ранее описанных видов. Типичные композиции для парентерального введения включают инъецируемые растворы или суспензии, которые могут содержать, например, подходящие нетоксичные приемлемые для парентерального введение разбавители или растворители, такие как маннит, 1,3-бутандиол, вода, раствор Рингера, изотоничный раствор хлорида натрия, или другие подходящие диспергирующие, увлажняющие или суспендирующие агенты, включая синтетические моно- или диглицериды, и жирные кислоты, включая олеиновую кислоту, или Cremaphor.
Типичные композиции для назального, аэрозольного или ингаляционного введения включают растворы в солевом растворе, которые могут содержать, например, бензиловый спирт или другие подходящие консерванты, усилители всасывания для улучшения биодоступности и/или другие солюбилизирующие или диспергирующие средства, такие как известные в данной области техники.
Препараты для ректального введения могут быть представлены в виде суппозитория с обычными носителями, такими как какао-масло, синтетические сложные эфиры триглицеридов или полиэтиленгликоль. Такие носители обычно твердые при обыкновенных температурах, но становятся жидкими и/или растворяются в полости прямой кишки с высвобождением лекарства.
Препараты для местного введения в ротовую полость, например, буккального или подъязычного, включают таблетки для рассасывания, содержащие активный ингредиент в ароматизированной основе, такой как сахароза, акация или трагакант, и пастилки, содержащие активный ингредиент в основе, такой как желатин и глицерин, или сахарозу и акацию. Типичные композиции для местного введения включают местный носитель, такой как Plastibase (минеральное масло, желированное с полиэтиленом).
Предпочтительными единичными дозированными препаратами являются такие препараты, в которых содержится определенная ранее в этом документе эффективная доза активного ингредиента или ее соответствующая часть.
Следует понимать, что в дополнение к ингредиентам, конкретно упомянутым выше, препараты по настоящему изобретению могут содержать другие традиционные в данной области техники агенты, принимая во внимание тип обсуждаемого препарата, например, препараты для перорального введения могут содержать ароматизаторы.
Хотя соединение по настоящему изобретению может использоваться в качестве единственного активного ингредиента в лекарственном средстве, также возможно применение соединения в комбинации с одним или несколькими другими дополнительными активными агентами. Такими дополнительными активными агентами могут являться дополнительные соединения по настоящему изобретению, или они могут представлять собой другие терапевтические средства, например, антидепрессант, анксиолитик, антипсихотическое средство, средство, применимое для профилактики или лечения остеопороза, средство, применимое для профилактики или лечения рака, или другое фармацевтически активное вещество. Например, соединения по настоящему изобретению могут эффективно вводиться в комбинации с эффективными количествами других агентов, таких как антидепрессант, анксиолитик, антипсихотическое средство, органический бифосфонат или ингибитор катепсина K. В одном предпочтительном варианте осуществления соединения по настоящему изобретению могут эффективно вводиться в комбинации с эффективным количеством антидепрессанта. Неограничивающие примеры антидепрессантов включают ингибиторы обратного захвата норадреналина (NRI), селективные ингибиторы обратного захвата серотонина, ингибиторы моноаминоксидазы, трициклические антидепрессанты (TCA), ингибиторы обратного захвата дофамина (DRI), опиоиды, селективные усилители обратного захвата серотонина, тетрациклические антидепрессанты, обратимые ингибиторы моноаминоксидазы, агонисты мелатонина, ингибиторы обратного захвата серотонина и норадреналина (SNRI), антагонисты кортикотропин-релизинг фактора, антагонисты α-адренорецептора, агонисты и антагонисты 5HT1(рецептора, литий и атипичные антипсихотические средства. Примеры антидепрессантов SSRI класса включают флуоксетин и сертралин; примеры антидепрессантов SNRI класса включают венлафаксин, циталопрам, пароксетин, эсциталопрам, флувоксамин; примеры антидепрессантов SNRI класса включают дулоксетин; примеры антидепрессантов DRI и NRI классов включают бупропион; примеры антидепрессантов TCA класса включают амитриптилин и дотиепин (досулепин). Примеры атипичных антипсихотических средств включают: клозапин, оланзапин, рисперидон, кветиапин, зипрасидон и частичные агонисты дофамина. Неограничивающие примеры анксиолитиков включают бензодиазепины и небензодиазепины. Примеры бензодиазепинов включают лоразепам, алпразолам и диазепам. Примеры небензодиазепинов включают бусприрон (Buspar®), барбитураты и мепробамат.Один или несколько из указанных дополнительных антидепрессантов может использоваться в комбинации.
Примеры противораковых средств включают тамоксифен или ингибитор ароматазы, используемые при лечении рака молочной железы.
В том случае, когда приливы вызываются конкретным лечением, соединение по настоящему изобретению может быть применимо в комбинированной терапии вместе с агентом для лечения такого заболевания. Неограничивающие примеры таких видов комбинированной терапии включают: соединение по настоящему изобретению в комбинации с тамоксифеном при лечении рака молочной железы, соединение по настоящему изобретению в комбинации с ингибитором ароматазы при лечении рака молочной железы или соединение по настоящему изобретению в комбинации с ралоксифеном при лечении остеопороза.
Неограничивающие примеры упомянутых выше органических бифосфонатов включают адендронат, клодронат, этидронат, ибандронат, инкадронат, минодронат, неридронат, ризедронат, пиридронат, памидорнат, тилудронат, золедронат, их фармацевтически приемлемые соли и сложные эфиры, и их смеси. Предпочтительные органические бифосфонаты включают алендронат и его фармацевтически приемлемые соли и смеси. Наиболее предпочтительным является алендроната натрия тригидрат.
Точная дозировка бифосфоната будет варьировать вместе с режимом дозирования, эффективностью при пероральном приеме конкретно выбранного бифосфоната, возраста, размера, пола и состояния млекопитающего или человека, природы и тяжести подлежащего лечению нарушения, и других значимых медицинских и физических факторов. Таким образом, точное фармацевтически эффективное количество не может быть указано заранее и может быть легко определено лицом, осуществляющим уход за больным, или клиническим врачом. Подходящее количество может быть определено путем проведения рутинных экспериментов на животных моделях и в клинических испытаниях на людях. Как правило, выбирают количество бифосфоната, подходящее для достижения ингибирующего эффекта на резорбцию кости, т.е. вводят количество бифосфоната, ингибирующее резорбцию кости. Для человека эффективная пероральная доза бифосфоната обычно составляет приблизительно от 1,5 приблизительно до 6000 мкг/кг массы тела и предпочтительно составляет приблизительно от 10 приблизительно до 2000 мкг/кг массы тела.
В предназначенных для человека пероральных композициях, содержащих алендронат, его фармацевтически приемлемые соли или его фармацевтически приемлемые производные, единичная дозированная форма обычно содержит приблизительно от 8,75 мг приблизительно до 140 мг алендронатного соединения, в пересчете на активный вес алендроновой кислоты, т.е. в пересчете на соответствующую кислоту.
Соединения по настоящему изобретению могут применяться в комбинации с другими агентами, применимыми для лечения опосредованных эстрогенами состояний. Отдельные компоненты таких комбинаций могут вводиться раздельно в различное время на протяжении курса лечения или параллельно в раздельных или единых комбинированных формах. Поэтому настоящее изобретение понимают как охватывающее все такие схемы одновременного или чередующегося лечения, и термин «введение» следует интерпретировать соответственно. Следует понимать, что объем комбинаций соединений по настоящему изобретению с другими агентами, применимыми для лечения опосредованных эстрогенами состояний, включает в принципе любую комбинацию с другой фармацевтической композицией, применимой для лечения нарушений, связанных с действием эстрогенов.
При использовании в комбинации с соединениями по настоящему изобретению указанные выше другие терапевтические средства могут использоваться, например, в количествах, указанных в Physicians' Desk Reference (PDR) или иначе определенных специалистом в данной области техники.
Если соединения по настоящему изобретению применяются в комбинации с одним или несколькими другими терапевтическими средствами, параллельно или последовательно, то предпочтительными являются следующие соотношения и диапазоны доз:
в комбинации с антидепрессантом, анксиолитиками, антипсихотическими средствами, органическим бифосфонатом или ингибитором катепсина K соединения формулы (I) могут использоваться в массовом соотношении с дополнительным средством в диапазоне приблизительно от 10:1 приблизительно до 1:10.
Описанные выше соединения по настоящему изобретению также находят применение, необязательно в меченой форме, в качестве диагностического средства для диагностики состояний, ассоциированных с дисфункцией эстрогенового рецептора. Например, такое соединение может быть меченым радиоактивным изотопом.
Описанные выше соединения по настоящему изобретению, необязательно в меченой форме, также находят применение в качестве эталонного соединения в способах разработки других агонистов, частичных агонистов, антагонистов или частичных антагонистов эстрогенового рецептора. Таким образом, настоящее изобретение относится к способу разработки лиганда эстрогенового рецептора, который включает применение соединения по настоящему изобретению или соединения по настоящему изобретению в меченой форме, в качестве эталонного соединения. Например, такой способ может включать проведение теста на конкурентное связывание, в котором связывание соединения по настоящему изобретению с эстрогеновым рецептором снижено ввиду присутствия другого соединения, обладающего способностью связываться с эстрогеновым рецептором, например, более сильными параметрами связывания с эстрогеновым рецептором по сравнению с рассматриваемым соединением по настоящему изобретению.
Любым специалистом в данной области техники могут быть предложены многочисленные пути синтеза соединений по настоящему изобретению, и описанные ниже возможные пути синтеза не ограничивают настоящее изобретение. Множество способов синтеза индолов представлено в литературе, например: Indoles Part One, W.J. Houlihan (ed.), 1972; Indoles, Sundberg, R.J., 1996; Heterocyclic Chemistry, Joule, J.A.; Mills, K. 2000; Chem. Rev., 2005, 105, 2873-2920; Org. Lett. 2006, 8, 5919-5922; и Bioorg. Med. Chem. Lett., 2007, 77, 902-906. Целый ряд возможных путей синтеза представлен схематически ниже. При необходимости, любое изначально полученное соединение по настоящему изобретению может быть преобразовано в другое соединение по настоящему изобретению известными способами.
Общий способ 1
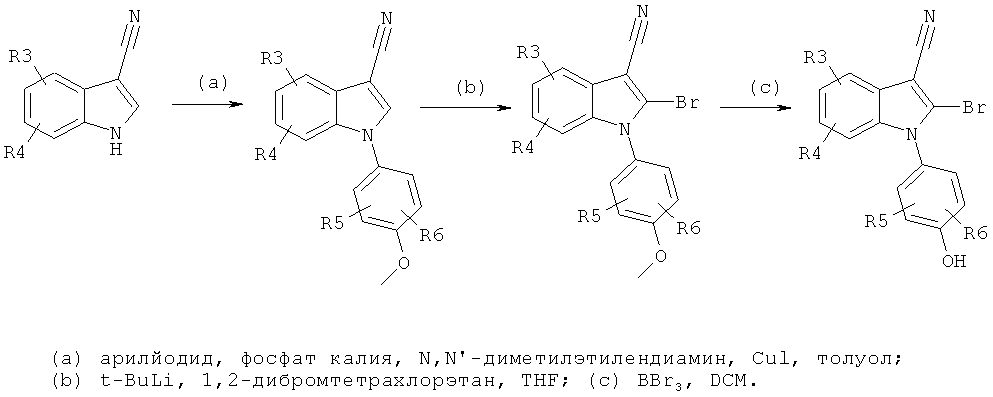
Общий способ 1, представленный выше на реакционной схеме, использовали для синтеза соединений следующих примеров:
- примеры 46-159 и 211 - все подробности экспериментов для каждой из отдельных стадий общего способа, применимого для синтеза конечных соединений примеров 46-159 и 211, описаны в примерах 1-5, 16 и 38-40;
- примеры 160-162 и 196-210 - все подробности экспериментов для каждой из отдельных стадий общего способа, применимого для синтеза конечных соединений примеров 160-162 и 196-210, описаны в примерах 1-4, 8, 16 и 38-40;
- примеры 169 и 173-195 - все подробности экспериментов для каждой из отдельных стадий общего способа, применимого для синтеза конечных соединений примеров 169 и 173-195, описаны в примерах 1-4, 8, 10-13, 14-16, 20, 25, 38-40 и 45;
- примеры 233-270 - все подробности экспериментов для каждой из отдельных стадий общего способа, применимого для синтеза конечных соединений примеров 233-270, описаны в примерах 1-4, 10-11, 14-16, 38-40 и 45.
Общий способ 2
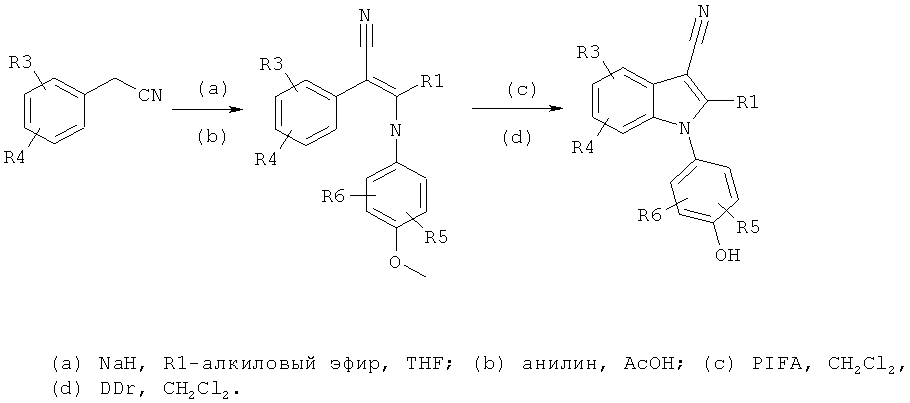
Общий способ 2, представленный выше на реакционной схеме, использовали для синтеза соединения примера 6.
Общий способ 3
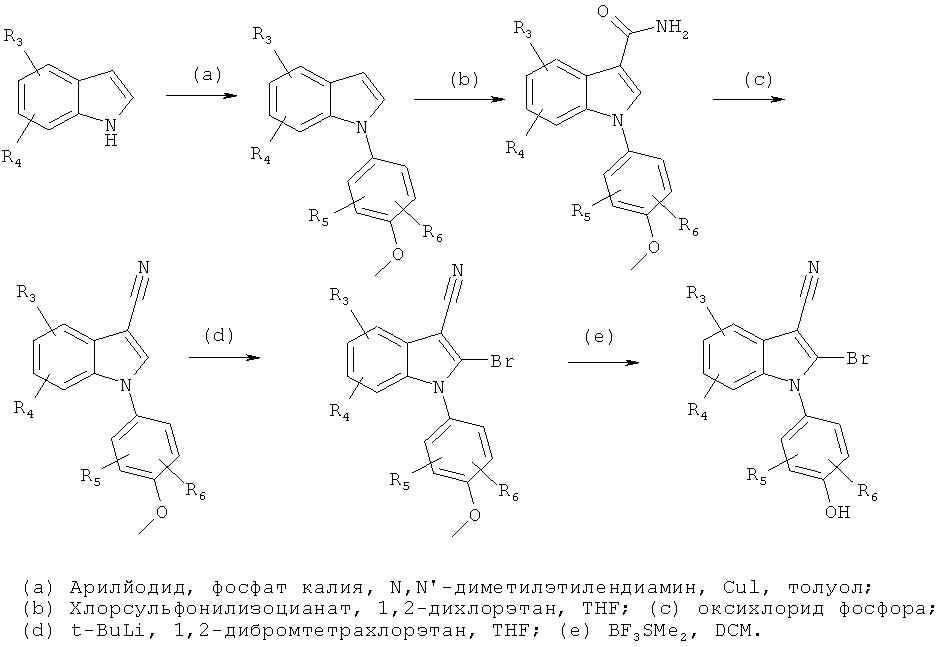
Общий способ 3, представленный выше на реакционной схеме, использовали для синтеза соединений примеров 212-232 и 271. Все подробности экспериментов для каждой из отдельных стадий общего способа, применимого для синтеза конечных соединений примеров 212-232 и 271, описаны в примерах 2-4, 8, 16, 24 и 38-40.
Общий способ 4
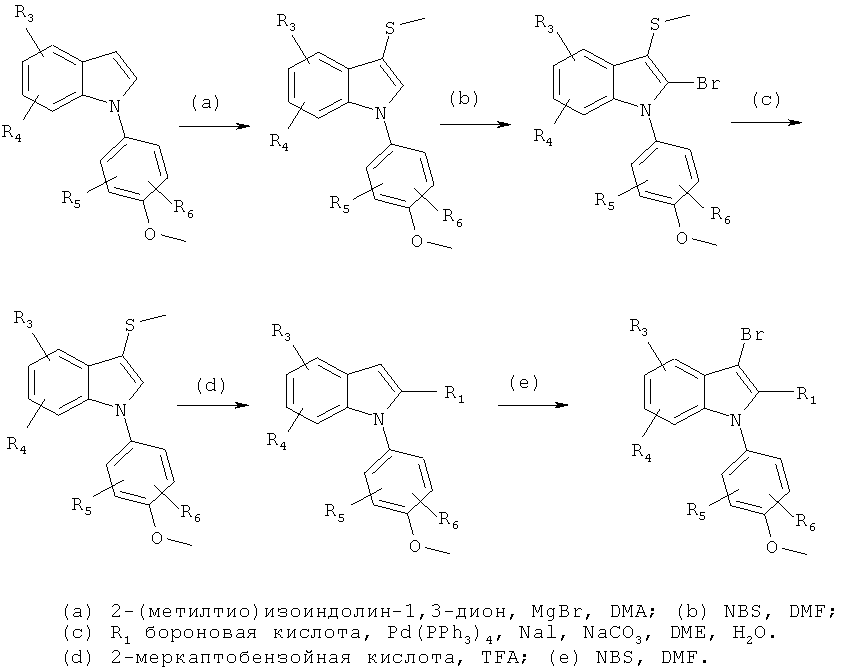
Общий способ 4, представленный выше на реакционной схеме, использовали для синтеза соединений примеров 163-168 и 170-172. Все подробности экспериментов для каждой из отдельных стадий общего способа, применимого для синтеза конечных соединений примеров 163-168 и 170-172, описаны в примерах 2-4, 9, 20-21.
Общий способ 5
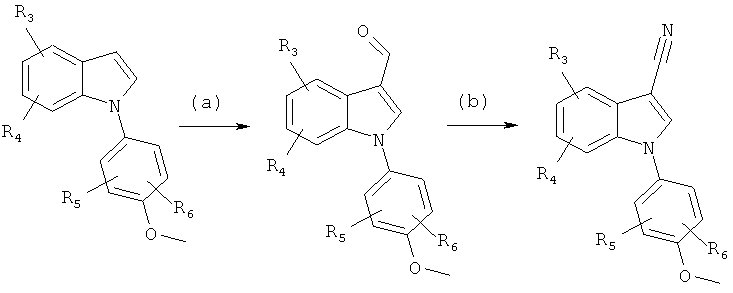
Общий способ 5, представленный выше на реакционной схеме, также потенциально применим для синтеза соединений по настоящему изобретению. Подходящий 3-циано-N-арилиндол может быть получен из N-арилиндола путем формилирования, как представлено на стадии (a), например, в реакции Вильсмайера-Хаака, с последующим осуществлением взаимодействия альдегида с гидроксиламина гидрохлоридом и последующим элиминированием с использованием уксусного ангидрида, как представлено на стадии (b).
Последующие примеры иллюстрируют настоящее изобретение.
Пример 1
2-Бром-1-(4-гидроксифенил)-1H-индол-3-карбонитрил (E1)
Схема 1
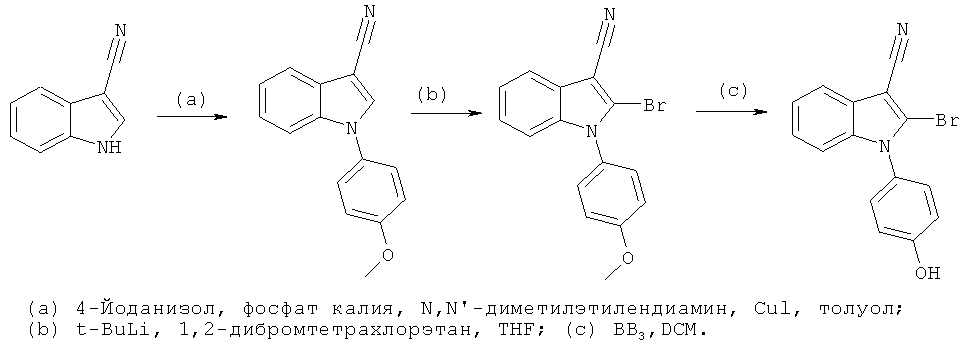
Стадия (a): 1 экв. 3-цианоиндола, 2 экв. 4-йоданизола, 2,1 экв. фосфата калия, 4,5 экв. N,N'-диметилэтилендиамина и 0,2 экв. Йодида меди(I) смешивали в высушенном в печи сосуде и добавляли толуол. Смесь перемешивали в атмосфере азота при 110°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, фильтровали и упаривали в условиях вакуума. Неочищенный продукт очищали на силикагеле с использованием н-гептана/EtOAc (4:1) в качестве подвижной фазы.
Стадия (b): 1-(4-Метоксифенил)-1H-индол-3-карбонитрил растворяли в безводном THF и охлаждали до -78°C, по каплям добавляли 1,1 экв. t-buLi, и перемешивали смесь в течение 1 часа. Добавляли раствор 1,3 экв. 1,2-дибромтетрахлорэтана в безводном THF, и перемешивали смесь в течение 4 часов, медленно нагревая ее до комнатной температуры, а затем гасили добавлением H2O. Реакционную смесь разбавляли DCM, фазы разделяли, и упаривали органическую фазу в условиях вакуума. Неочищенный продукт очищали на силикагеле с использованием н-гептана/DCM (1:1) в качестве подвижной фазы.
Стадия (c): 2-Бром-1-(4-метоксифенил)-1H-индол-3-карбонитрил растворяли в безводном DCM и охлаждали до 0°C. Добавляли 5 экв. BBr3 (1,0 M раствор в гексане) и перемешивали смесь в течение ночи. Оставаясь при 0°C, реакционную смесь гасили добавлением MeOH. Смесь разбавляли H2O, и разделяли фазы. Органическую фазу концентрировали, и очищали неочищенный продукт на силикагеле с использованием н-гептана:EtOAc (4:1) в качестве подвижной фазы. ES/MS m/z: 313, 315 (M+H), 311, 313 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,69 (м, 1H), 7,38-7,30 (м, 4H) и 7,16-7,10 (м, 3H).
Пример 2
1-(4-Гидроксифенил)-2-тиофен-3-ил-1H-индол-3-карбонитрил (E2)
Схема 2

К 2-бром-1-(4-гидроксифенил)-1H-индол-3-карбонитрилу (пример 1) добавляли 2 экв. 3-тиофенбороновой кислоты, 2,1 экв. карбоната калия и 10 мол.% тетракис(трифенилфосфин)палладий. Добавляли THF:EtOH:H2O (4:1:0,5), сосуд продували азотом, герметично закрывали и перемешивали при 100°C в течение 48 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли H2O, экстрагировали EtOAc и фильтровали через силикагель. Органическую фазу упаривали досуха, и подвергали неочищенный продукт препаративной ВЭЖХ с обращенной фазой. Соответствующие фракции объединяли, упаривали и идентифицировали по методу 1H-ЯМР и ЖХ/МС. Чистоту определяли по методу аналитической ВЭЖХ. ES/MS m/z: 317,9 (M+H), 314,8 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,73 (м, 1H), 7,62 (дд, 1H, J=1,3, 2,9 Гц), 7,54 (дд, 1H, J=2,9, 5,0 Гц), 7,37-7,30 (м, 2H), 7,26 (м, 2H), 7,18 (м, 1H), 7,15 (дд, 1H, J=1,3, 5,0 Гц) и 7,03 (м, 2H).
Пример 3
2-(3-Цианофуран-2-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил (E3)
Схема 3

2-Бром-1-(4-гидроксифенил)-1H-индол-3-карбонитрил (пример 1, 40 мг, 0,13 ммоль, 1 экв.), 2-трибутилстаннилфуран-3-карбонитрил (63,5 мг, 0,17 ммоль, 1,3 экв.) и дихлорбис(трифенилфосфин)палладий(II) (9 мг, 0,01 ммоль, 0,1 экв.) навешивали в сосуд для микроволновой обработки. Добавляли диоксан (1 мл), сосуд продували азотом и закрывали крышкой. Реакционную смесь обрабатывали микроволнами при 130°C в течение 30 мин, а затем фильтровали раствор. Добавляли насыщенный водный раствор хлорида аммония (5 мл), и смесь экстрагировали несколько раз DCM. Объединенные DCM фазы пропускали через мембрану для разделения фаз и упаривали. Неочищенный продукт очищали по методу флэш-хроматографии на силикагеле с использованием градиента н-гептана:этилацетат (7:3) для удаления остатков оловосодержащего реагента. Соответствующие фракции собирали и упаривали, растворяли в ацетонитриле (1 мл) и очищали по методу препаративной ВЭЖХ с получением 33 мг (выход 79%) продукта с чистотой 99%, определенной по методу аналитической ВЭЖХ. (Колонка: Reprosil Pur 120 ODS-3 (C18), 30×100 мм, 5 мкм. Подвижная фаза A: муравьиная кислота 0,05%, Подвижная фаза B: ACN. Градиент 20% A-100% B. ES/MS m/z: 326,1 (M+H), 324,1 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,89 (д, 1H, J=2,2 Гц), 7,85 (м, 1H), 7,48-7,43 (м, 2H), 7,34 (м, 1H), 7,32 (м, 2H) и 7,04-7,01 (м, 3H).
Пример 4
1-(4-Гидроксифенил)-2-пиррол-1-ил-1H-индол-3-карбонитрил (E4)
Схема 4

2-Бром-1-(4-гидроксифенил)-1H-индол-3-карбонитрил (пример 1), 1,4 экв. пиррола, 2 экв. карбоната цезия и 20 мол.% йодида меди(I) смешивали в высушенном в печи сосуде, добавляли DMF, и продували смесь азотом. Сосуд герметично закрывали и перемешивали при 120°C в течение 48 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc и фильтровали через силикагель. Неочищенную смесь упаривали досуха и подвергали препаративной ВЭЖХ с обращенной фазой. Соответствующие фракции объединяли, упаривали и идентифицировали по методам 1H-ЯМР и ЖХ/МС. Чистоту определяли по методу аналитической ВЭЖХ. ES/MS m/z: 300,2 (M+H), 298,3 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,74 (м, 1H), 7,41-7,35 (м, 2H), 7,27 (м, 2H), 7,23 (м, 1H), 6,98 (м, 2H), 6,95 (т, 2H, J=2,2 Гц) и 6,23 (т, 2H, J=2,2 Гц).
Пример 5
2-Диметиламино-1-(4-гидроксифенил)-1H-индол-3-карбонитрил (E5)
Схема 5
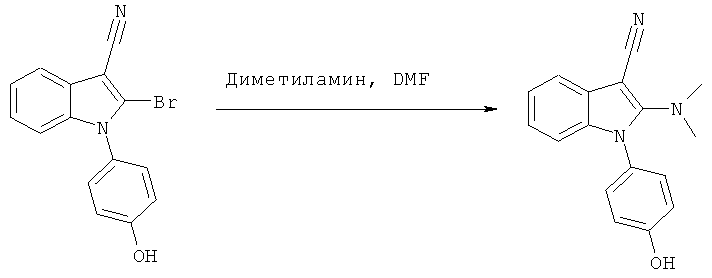
2-Бром-1-(4-гидроксифенил)-1H-индол-3-карбонитрил (пример 1) смешивали с избытком диметиламина в DMF (1:3), и перемешивали смесь в герметично закрытом сосуде при 80°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, разбавляли H2O и DCM, а затем разделяли фазы. Органическую фазу упаривали досуха и подвергали препаративной ВЭЖХ с обращенной фазой. Соответствующие фракции объединяли, упаривали и идентифицировали по методам 1H-ЯМР и ЖХ/МС. Чистоту определяли по методу аналитической ВЭЖХ. ES/MS m/z: 278,1 (M+H), 276,1 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,42 (м, 1H), 7,33 (м, 2H), 7,17 (м, 1H), 7,09-7,05 (м, 3H), 6,95 (м, 1H) и 2,93 (с, 6H).
Пример 6
1-(4-Гидроксифенил)-2-изопропил-1H-индол-3-карбонитрил (E6)
Схема 6
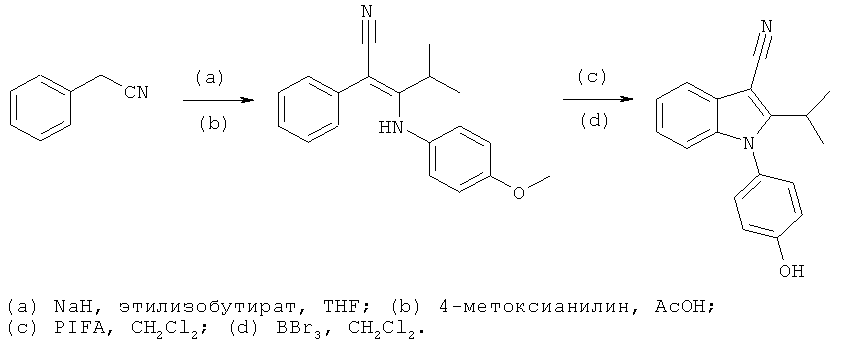
Стадия (a): Бензилцианид (1500 мг, 12,8 ммоль) растворяли в 150 мл безводного THF и охлаждали до 0°C. Раствор перемешивали при этой температуре, в процессе чего медленно добавляли NaH (60% в минеральном масле, 663 мг). После завершения добавления смесь перемешивали при 0°C в течение 30 мин, а затем баню со льдом удаляли и продолжали перемешивание при комнатной температуре в течение 120 минут. Одной порцией добавляли этилизобутират (1785 мг, 15,4 ммоль), и реакционную смесь нагревали при 60°C в течение 2 ч. THF удаляли в условиях вакуума, и вливали остаток в воду со льдом. Добавляли 6M HCl при перемешивании до достижения pH нейтральных значений. Смесь экстрагировали EtOAc, сушили над MgSO4 и концентрировали в условиях вакуума. Соединение очищали по методу флэш-хроматографии [силикагель; н-гептан:EtOAc (9:1)] с получением 4-метил-3-оксо-2-фенилпентаннитрила (460 мг, 19%).
Стадия (b): 4-Метил-3-оксо-2-фенилпентаннитрил (100 мг, 0,53 ммоль) и 4-метоксианилин растворяли в 100% AcOH (1 мл). Смесь нагревали при 160°C в течение 30 мин в микроволновом реакторе. Растворитель совместно выпаривали с толуолом в условиях вакуума. Остаток растворяли в CH2Cl2 и фильтровали через слой силикагеля. Растворитель удаляли, и использовали полученную смесь непосредственно на следующей стадии без дополнительной очистки.
Стадия (c): Смесь, полученную на стадии (b) (65 мг), и PDPA (26 мг) растворяли в CH2Cl2 (безводный, 1,5 мл) и перемешивали при комнатной температуре в течение ночи. Смесь экстрагировали добавлением в NaHCO3/CH2Cl2 с использованием разделителя фаз. Смесь очищали по методу препаративной ВЭЖХ с получением желаемого 2-изопропил-1-(4-метоксифенил)-1H-индол-3-карбонитрила (3 мг).
Стадия (d): 2-Изопропил-1-(4-метоксифенил)-1H-индол-3-карбонитрил (3 мг, 0,01 ммоль) растворяли в безводном CH2Cl2 (0,5 мл) и перемешивали при 0°C. Добавляли BBr3 (1M в CH2Cl2, 50 мкл) и оставляли смесь в холодильнике при перемешивании в течение ночи. Добавляли несколько капель MeOH и перемешивали. Растворитель удаляли в условиях вакуума, и распределяли смесь путем добавления в H2O/DCM. Органическую фазу разделяли с использованием разделителя фаз. Растворитель удаляли в условиях вакуума и смесь подвергали хроматографии с использованием заранее заполненной силикагелем колонки (растворитель: EtOAc/н-гептан 3:7) с получением желаемого 1-(4-гидроксифенил)-2-изопропил-1H-индол-3-карбонитрила (1,1 мг, 39%). 1H-ЯМР (ацетон-d6, 500 МГц): 7,64 (м, 1H), 7,32 (м, 2H), 7,28 (м, 1H), 7,22 (м, 1H), 7,11 (м, 2H), 6,98 (м, 1H), 3,07 (м, 1H) и 1,43 (д, 6H, J=7,0 Гц).
Пример 7
2-Ацетил-1-(4-гидроксифенил)-1H-индол-3-карбонитрил (E7)
Указанное в заголовке соединение синтезировали путем гидролиза 2-(1-этоксивинил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрила. ES/MS m/z: 277,1 (M+H), 275,1 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,84 (д, 1H, J=7,5 Гц), 7,49-7,42 (м, 2H), 7,32 (м, 2H), 7,18 (м, 1H, J=8,0 Гц), 7,06 (м, 1H) и 2,46 (с, 3H).
Пример 8
2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбоновая кислота (E8)
Схема 7
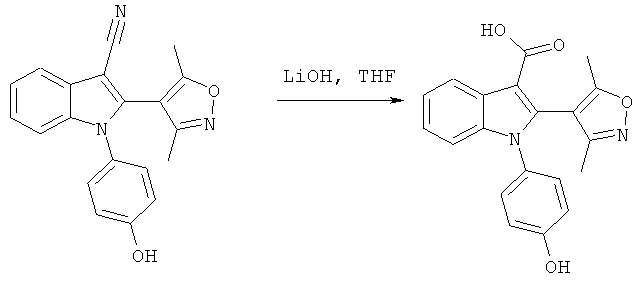
2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил (пример 51) растворяли в 1:2 смеси THF и LiOH (водн., 2M) и обрабатывали в микроволновом реакторе при 160°C в течение 1 часа. Смесь разбавляли H2O и DCM, подкисляли до pH-1 добавлением HCl (1M) и разделяли фазы. Органическую фазу концентрировали в условиях вакуума и очищали на Chromatotrone с использованием 5% MeOH в DCM в качестве подвижной фазы. ES/MS m/z: 349,4 (M+H), 347,2 (M-H); 1H-ЯМР (ацетон-d6; 500 МГц): 8,31 (м, 1H), 7,32-7,23 (м, 3H), 7,20 (м, 1H), 7,12 (ушир.с, 1H), 6,97 (м, 2H), 2,16 (с, 3H) и 2,05 (с, 3H).
Пример 9
1-[1-(4-Гидроксифенил)-2-фенил-1H-индол-3-ил]этанон (E9)
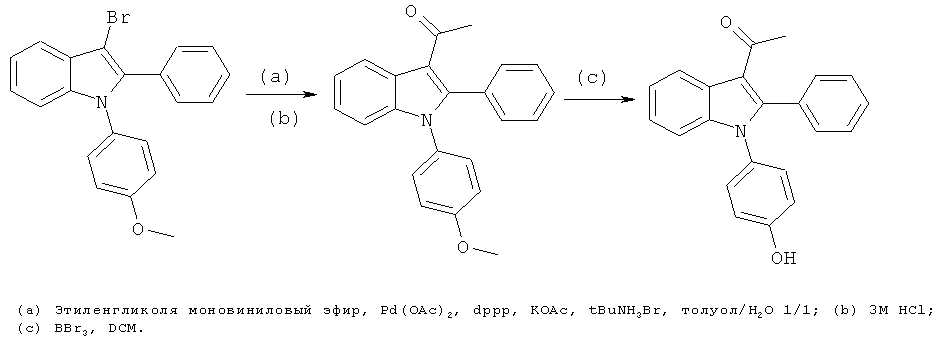
Стадии (a) и (b): 1 экв. 3-бром-1-(4-метоксифенил)-2-фенил-1H-индола (синтезированного из 1-(4-метоксифенил)-1H-индола способом, аналогичным используемому на стадиях (a), (b) и (c) примера 21, с последующими стадиями (a) и (b) примера 22), 5 экв. моновинилового эфира этиленгликоля, 5 мол.% Pd(OAc)2, 10 мол.% dppp, 1,3 экв. ацетата калия, 5 мол.% тетрабутиламмония бромида смешивали с толуолом/водой в сосуде для микроволновой обработки в атмосфере азота. Реакцию проводили в микроволновом реакторе при 150°C в течение 20 мин. Добавляли 2 мл 3M HCl, и перемешивали смесь при комнатной температуре в течение 30 мин. Добавляли воду и DCM, и разделяли фазы. После выпаривания растворителей остаток очищали по методу флэш-хроматографии с гептаном/EtOAc 9:1.
Стадия (c): Исходное вещество растворяли в безводном DCM в атмосфере азота и охлаждали до 0°C. Добавляли BBr3, и позволяли температуре достичь комнатной температуры в течение 2 ч. Реакционную смесь гасили добавлением воды, разделяли фазы. После выпаривания растворителей остаток очищали по методу препаративной ВЭЖХ. ES/MS m/z: 328,16 (M+H), 326,2 (M-H); 1H-ЯМР (DMSO-d6, 500 МГц): 8,35 (м, 1H), 7,43 (м, 2H), 7,40-7,37 (м, 3H), 7,28 (м, 1H), 7,24 (м, 1H), 7,10 (м, 2H), 7,00 (м, 1H), 6,73 (м, 2H) и 1,88 (с, 3H).
Пример 10
Амид 1-(4-гидроксифенил)-2-фенил-1H-индол-3-карбоновой кислоты (E10)
Схема 9
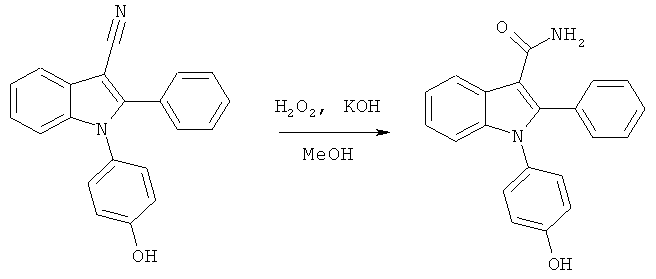
1-(4-Гидроксифенил)-2-фенил-1H-индол-3-карбонитрил (пример 46, 10 мг, 0,03 ммоль) растворяли в 1 мл MeOH. Добавляли H2O2 (1 мл, 35% по массе в H2O) и 2M KOH (0,5 мл), и нагревали реакционную смесь с обратным холодильником в течение ночи. Смесь подкисляли добавлением 1M HCl и добавляли EtOAc. Фазы разделяли и органические растворители выпаривали. Неочищенный продукт очищали по методу препаративной ВЭЖХ с обращенной фазой с получением указанного в заголовке амида. ES/MS m/z: 329,1 (M+H), 327,13 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,34 (м, 1H), 7,46 (м, 2H), 7,40-7,37 (м, 3H), 7,24-7,18 (м, 2H), 7,12 (м, 2H), 7,07 (м, 1H) и 6,85 (м, 2H).
Пример 11
(Z)-2-(3,5-Диметилизоксазол-4-ил)-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид (E11)
Схема 10

В атмосфере азота раствор 2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрила (пример 51), 12 экв. гидроксиламина гидрохлорида и 12 экв. триэтиламина в EtOH нагревали при 100°C в течение 24 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли метанолом, отфильтровывали осадок и подвергали препаративной ВЭЖХ с обращенной фазой. Соответствующие фракции объединяли, упаривали и идентифицировали по методу 1H-ЯМР и ЖХ/МС. Чистоту определяли по методу аналитической ВЭЖХ. ES/MS m/z: 363,5 (M+H), 361,6 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,14-8,13 (с, OH), 8,08-8,04 (м, 1H), 7,23-7,14 (м, 3H), 7,15-7,06 (м, 2H), 6,96-6,91 (м, 2H), 5,18-5,07 (м, 2H), 2,16 (с, 3H), 2,00 (с, 3H).
Примеры 12 и 13
[2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил]карбаминовой кислоты сложный трет-бутиловый эфир (E12)
4-(3-Амино-2-(3,5-диметилизоксазол-4-ил)-1H-индол-1-ил)фенол (E13)
Схема 11
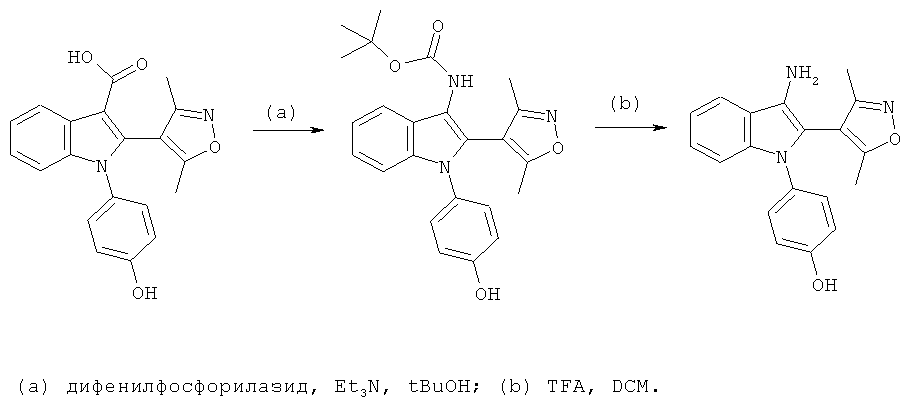
Стадия (a): Смесь 2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбоновой кислоты (пример 8), дифенилфосфорилазида (1,1 экв.) и триэтиламина (1,1 экв.) в трет-BuOH нагревали в микроволновом реакторе при 90°C в течение 1 часа. После охлаждения смесь подвергали препаративной ВЭЖХ с обращенной фазой. Соответствующие фракции объединяли и упаривали с получением [2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил]карбаминовой кислоты сложного трет-бутилового эфира (E12). ES/MS m/z: 420,21 (M+H), 418,22 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,61 (м, 1H), 7,26-7,13 (м, 5H), 6,93 (м, 2H), 2,22 (с, 3H), 1,89 (с, 3H) и 1,44 (с, 9H).
Стадия (b): Трет-бутил-2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-илкарбамат растворяли в DCM и обрабатывали каталитическим количеством TFA до завершения реакции. Смесь концентрировали в условиях вакуума и совместно упаривали с MeOH. 4-(3-Амино-2-(3,5-диметилизоксазол-4-ил)-1H-индол-1-ил)фенол (E13) идентифицировали по методу ЖХ/МС и определяли чистоту по методу аналитической ВЭЖХ. ES/MS m/z: 320,2 (M+H) и 318,2 (M-H).
Пример 14
(Z)-2-(3,5-Диметилизоксазол-4-ил)-7-фтор-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид (E14)
Схема 12
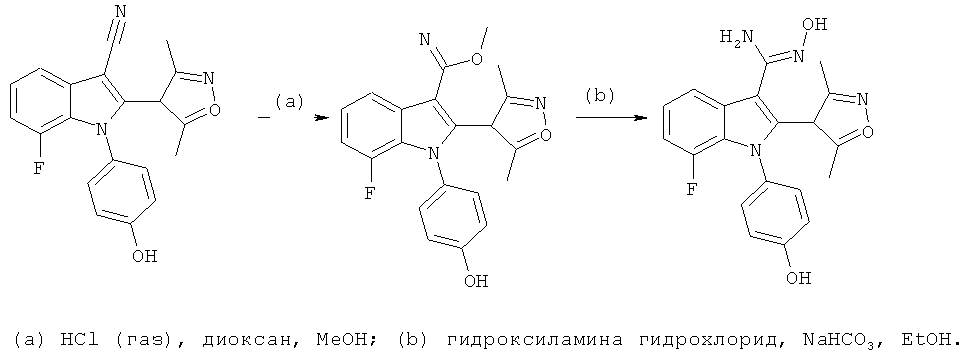
Стадия (a): Охлажденный (0°C) раствор 2-(3,5-диметилизоксазол-4-ил)-7-фтор-1-(4-гидроксифенил)-1H-индол-3-карбонитрила (пример 230, 19 мг, 0,05 ммоль) в диоксане (1,5 мл) и MeOH (0,5 мл) барботировали газообразным HCl в течение 10 мин. Пробирку герметично закрывали, оставляли температуру повышаться до комнатной температуры, и перемешивали смесь в течение ночи. Растворители выпаривали в условиях вакуума.
Стадия (b): К раствору гидроксиламина гидрохлорида (19 мг, 0,27 ммоль) в воде при перемешивании при комнатной температуре добавляли твердый NaHCO3 (23 мг, 0,27 ммоль). Добавляли полученный выше амидат, растворенный в EtOH (1,5 мл), и перемешивали раствор при 90°C в герметично закрытом сосуде в течение 1 ч. Смесь очищали по методу препаративной ВЭЖХ с получением указанного в заголовке соединения, (Z)-2-(3,5-диметилизоксазол-4-ил)-7-фтор-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамида, с выходом 10%. ES/MS m/z: 381,1 (M+H), 279,2 (M-H); 1H-ЯМР (метанол-d4, 500 МГц): 7,68 (дд, 1H, J=8,1, 0,7 Гц), 7,13 (м, 1H), 7,08 (м, 2H), 6,93 (м, 1H), 6,77 (м, 2H), 2,16 (с, 3H) и 2,00 (с, 3H).
Пример 15
(Z)-2-(5-Хлортиофен-2-ил)-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид (E15)
Схема 13
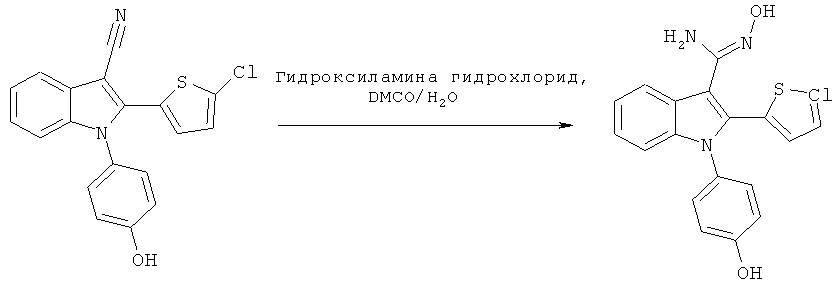
2-(5-Хлортиофен-2-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил (пример 86) растворяли в DMSO (0,25 мл) и добавляли гидроксиламин (0,25 мл, 100 экв.) из 2M маточного раствора гидроксиламина гидрохлорида, нейтрализованного гидроксидом натрия (pH 7,01, как измерено pH-метром). Смесь перемешивали при 60°C в течение 18 часов. Охлажденную смесь разбавляли солевым раствором, экстрагировали EtOAc и подвергали препаративной ВЭЖХ с обращенной фазой. Соответствующие фракции объединяли, упаривали и идентифицировали по методам 1H-ЯМР и ЖХ/МС. Чистоту определяли по методу аналитической ВЭЖХ. ES/MS m/z: 386,3 (M+H), 384,2 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,89 (м, 1H), 7,21-7,13 (м, 4H), 7,04 (м, 1H), 7,00-6,97 (м, 3H) и 6,91 (д, 1H, J=4,0 Гц).
Пример 16
1-(2,3-Дифтор-4-гидроксифенил)-2-(3,5-диметилизоксазол-4-ил)-1H-индол-3-карбонитрил (E16)
Схема 14
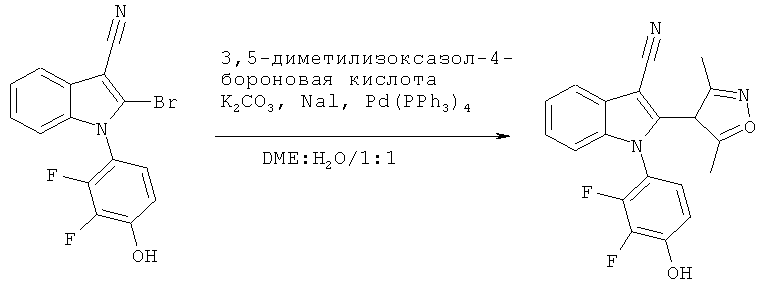
К 2-бром-1-(2,3-дифтор-4-гидроксифенил)-1H-индол-3-карбонитрилу (пример 103) добавляли 1,5 экв. 3,5-диметилизоксазол-4-бороновой кислоты, 4 экв. карбоната калия, 2 экв. йодида натрия и 10 мол.% тетракис(трифенилфосфин)палладий. Добавляли DME/H2O (1:1), сосуд продували азотом, герметично закрывали и перемешивали при 150°C в течение 10 мин. Реакционную смесь охлаждали до комнатной температуры, разбавляли H2O и экстрагировали DCM. Органическую фазу упаривали досуха и очищали на колонке с силикагелем с использованием 1:1 н-гептан/EtOAc в качестве подвижной фазы. ES/MS m/z: 366,20 (M+H), 364,20 (M-H); 1H-ЯМР (CDCl3, 500 МГц): 7,84 (д, 1H), 7,39 (м, 2H), 7,19 (д, 1H), 6,93 (ушир.м, 2H), 2,42 (с, 1,5H), 2,24 (с, 1,5 H), 2,19 (с, 1,5H), 2,01 (с, 1,5H).
Пример 17
2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбогидразонамид (E17)
Схема 15
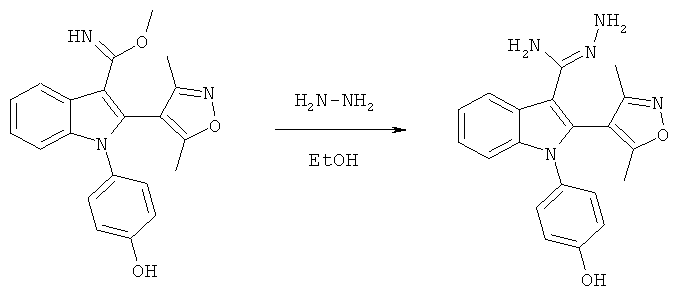
2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбимидат (пример 184) растворяли в EtOH и добавляли 10 экв. гидразина. Полученную смесь перемешивали при 90°C в течение 10 часов. Реакционную смесь разбавляли EtOAc и промывали солевым раствором. Органическую фазу упаривали досуха в условиях вакуума, а затем очищали по методу препаративной ВЭЖХ с обращенной фазой. Фракции объединяли, концентрировали и идентифицировали конечный продукт по методам 1H-ЯМР и ЖХ/МС. Чистоту определяли по методу аналитической ВЭЖХ. ES/MS m/z: 362,21 (M+H), 360,28 (M-H); 1H-ЯМР (метанол-d3, 500 МГц): 7,81 (м, 1H), 7,36-7,32 (м, 3H), 7,08 (м, 2H), 6,90 (м, 2H), 2,16 (с, 3H) и 1,96 (с, 3H).
Пример 18
4-(2-(3,5-Диметилизоксазол-4-ил)-3-(1,2,4-оксадиазол-3-ил)-1H-индол-1-ил)фенол (E18)
Схема 16
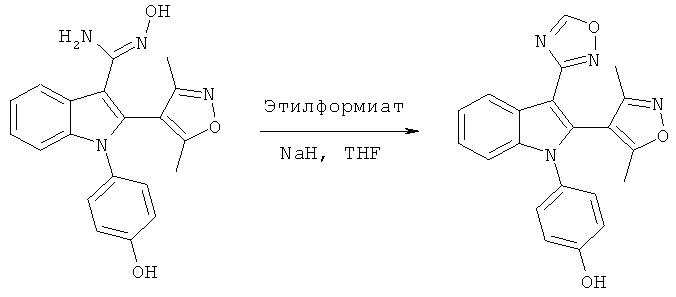
(Z)-2-(3,5-Диметилизоксазол-4-ил)-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид (пример 11) растворяли в THF, содержащем 4Å измельченные молекулярные сита. Смесь перемешивали в течение 30 мин в атмосфере N2. Добавляли NaH (60% дисперсия в минеральном масле, 7,0 мг, 2,1 экв.) и перемешивали смесь при 60°C в течение 20 мин. После охлаждения до комнатной температуры по каплям добавляли этилформиат (25,6 мг, 2,5 экв.) в THF. Полученную смесь нагревали с обратным холодильником в течение 1 ч, а затем охлаждали до комнатной температуры. Смесь фильтровали и концентрировали. Остаток фильтровали через силикагель, а затем очищали по методу ВЭЖХ с обращенной фазой с получением 4-(2-(3,5-диметилизоксазол-4-ил)-3-(1,2,4-оксадиазол-3-ил)-1H-индол-1-ил)фенола в виде белого порошка: ES/MS m/z: 395,17 (M+H), 393,19 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 9,21 (с, 1H), 8,40 (м, 1H), 7,37-7,31 (м, 2H), 7,26-7,22 (м, 3H), 6,98 (м, 2H), 2,17 (с, 3H) и 1,98 (с, 3H).
Пример 19
Метил-2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбоксилат (E19)
Схема 17
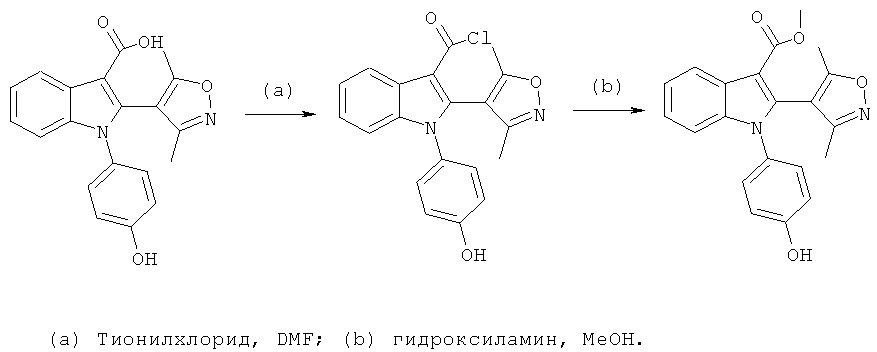
Стадия (a): 2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбоновую кислоту (пример 8, 6,0 мг, 0,02 ммоль) растворяли в 0,5 мл тионилхлорида и добавляли 2 капли DMF. Смесь нагревали при 70°C в течение 1 ч, а затем осторожно упаривали в условиях вакуума.
Стадия (b): 2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонилхлорид растворяли в 0,5 мл безводного MeOH и охлаждали смесь на бане со льдом. Приготавливали свежий гидроксиламин вливания раствора (0,3 мл) гидроксиламина гидрохлорида (12 мг, 0,17 ммоль) в MeOH в раствор (0,3 мл) KOH (19 мг, 0,33 ммоль) в MeOH. Смесь фильтровали через шприцевой фильтр в охлажденный раствор хлорангидрида. Спустя 5 мин охлаждающую баню удаляли, оставляли реакционную смесь нагреваться до комнатной температуры и перемешивали в течение 10 мин. Добавляли воду, 1M HCl и EtOAc и разделяли фазы. После выпаривания растворителей остаток очищали по методу препаративной ВЭЖХ с получением метил-2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбоксилата с выходом 16%. ES/MS m/z: 363,11 (M+H), 361,13 (M-H); 1H-ЯМР (метанол-d4, 500 МГц): 8,21 (м, 1H), 7,32-7,26 (м, 2H), 7,20 (м, 1H), 7,13 (ушир.с, 1H), 7,01 (ушир.с, 1H), 6,88 (м, 2H), 3,83 (с, 3H), 2,12 (с, 3H) и 2,03 (с, 3H).
Пример 20
2-(3,5-Диметилизоксазол-4-ил)-N-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксамид (E20)
Схема 18
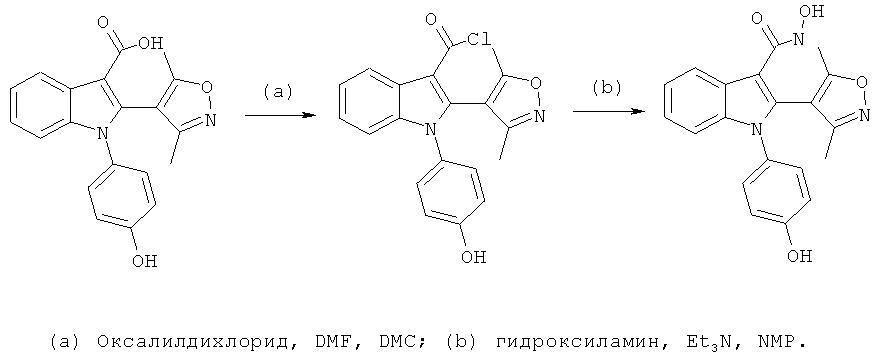
Стадия (a): Оксалилдихлорид (75 мкл, 0,86 ммоль) и каплю DMF добавляли к охлажденному (0°C) раствору 2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбоновой кислоты (пример 8, 30 мг, 0,09 ммоль) в безводном DCM. Температуру оставляли повышаться до комнатной температуры и перемешивали в течение 2 ч. Растворители выпаривали.
Стадия (b): К неочищенному продукту, полученному на стадии (a), добавляли смесь гидроксиламина гидрохлорида (30 мг, 0,43 ммоль) и триэтиламина (60 мкл, 0,43 ммоль) в 3 мл NMP. Смесь перемешивали при комнатной температуры в течение 15 мин. Добавляли воду и EtOAc, и разделяли фазы. После выпаривания растворителей остаток очищали по методу препаративной ВЭЖХ с получением указанного в заголовке соединения, 2-(3,5-диметилизоксазол-4-ил)-N-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксамида, с выходом 32%. ES/MS m/z: 364,15 (M+H), 362,19 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,40 (м, 1H), 6,80-6,70 (м, 3H), 6,62 (м, 2H), 6,39 (м, 2H), 1,65 (с, 3H) и 1,49 (с, 3H).
Пример 21
4-[2-(3,5-Диметилизоксазол-4-ил)-3-метансульфонилиндол-1-ил]фенол (E21)
Схема 19
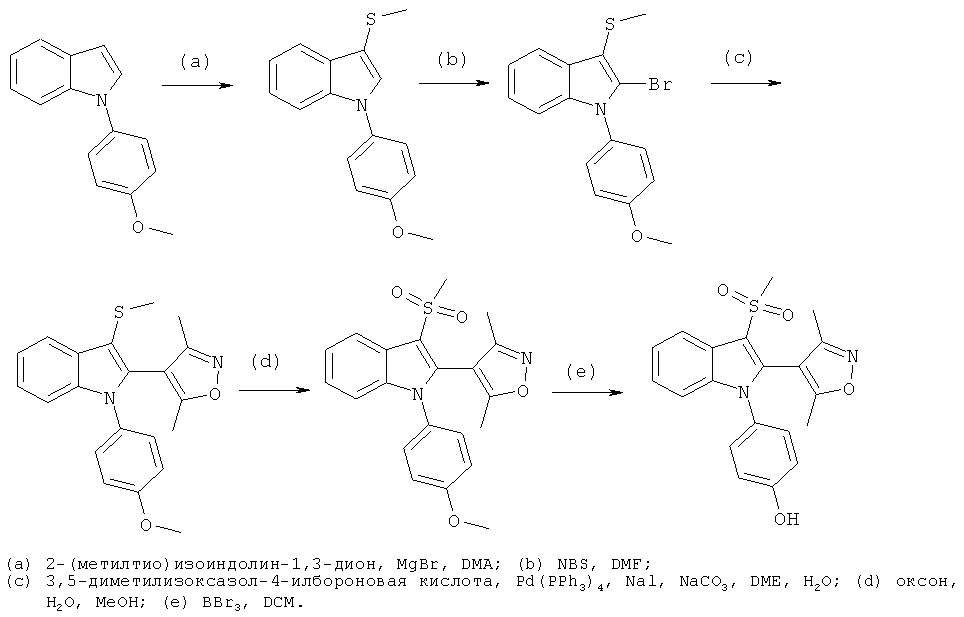
Стадия (a): 1-(4-Метоксифенил)-1H-индол (синтезированный из индола путем арилирования, аналогичного описанному на стадии (a) примера 1 [процесс арилирования также описан в J. Org. Chem. 2008, 73(14), 5529-5535], 1,0 г, 4,48 ммоль), 2-(метилтио)изоиндолин-1,3-дион (0,95 г, 4,93 ммоль) и бромид магния (8 мг, 0,045 ммоль) смешивали в дегазированном DMA и перемешивали в атмосфере азота при 90°C в течение 90 мин. Добавляли 1M NaOH и EtOAc. Фазы разделяли, и выпаривали органические растворители. Остаток очищали по методу флэш-хроматографии с гептаном/EtOAc 20:1 с получением 1-(4-метоксифенил)-3-(метилтио)-1H-индола с выходом 80%. ES/MS m/z: 270,11 (M+H).
Стадия (b): К охлажденному (0°C) раствору 1-(4-метоксифенил)-3-(метилтио)-1H-индола (800 мг, 2,97 ммоль) в 10 мл DMF добавляли NBS (529 мг, 2,97 ммоль). Температуру оставляли повышаться до комнатной температуры, и перемешивали смесь при комнатной температуре в течение 30 мин. Добавляли воду и DCM, и разделяли фазы. После выпаривания растворителей остаток очищали по методу флэш-хроматографии с гептаном/EtAc 20:1 с получением 2-бром-1-(4-метоксифенил)-3-(метилтио)-1H-индола с выходом 66%. ES/MS m/z: 348,04, 350,01 (M+H).
Стадия (c): 4-(1-(4-Метоксифенил)-3-(метилтио)-1H-индол-2-ил)-3,5-диметилизоксазол синтезировали из продукта, полученного на стадии (b), с использованием методики, аналогичной описанной в примере 16.
Стадия (d): Оксон (152 мг, 0,25 ммоль) смешивали с водой (1 мл) и добавляли к охлажденной (0°C) смеси 4-(1-(4-метоксифенил)-3-(метилтио)-1H-индол-2-ил)-3,5-диметилизоксазола (30 мг, 0,08 ммоль) в 2 мл MeOH. Температуру оставляли повышаться до комнатной температуры, и перемешивали взвесь при комнатной температуре в течение ночи. Добавляли 1M HCl и EtOAc и разделяли фазы. Органическую фазу концентрировали.
Стадия (e): 4-(1-(4-Метоксифенил)-3-(метилсульфонил)-1H-индол-2-ил)-3,5-диметилизоксазол растворяли в 2 мл безводного DCM и охлаждали до -78°C в атмосфере азота. Добавляли BBr3 (31 мкл, 0,33 ммоль) и оставляли температуру повышаться до комнатной температуры в течение 2 ч. Добавляли воду и EtOAc, и разделяли фазы. После выпаривания растворителей остаток очищали по методу препаративной ВЭЖХ с получением 4-[2-(3,5-диметилизоксазол-4-ил)-3-метансульфонилиндол-1-ил]фенола с выходом 27%. ES/MS m/z: 383,11 (M+H), 381,13 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,12 (м, 1H), 7,39-7,34 (м, 2H), 7,25-7,19 (м, 3H), 6,98 (м, 2H), 3,06 (с, 3H), 2,30 (с, 3H) и 2,09 (с, 3H).
Пример 22
1-(2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)-2,2,2-трифторэтанон (E22)
Схема 20
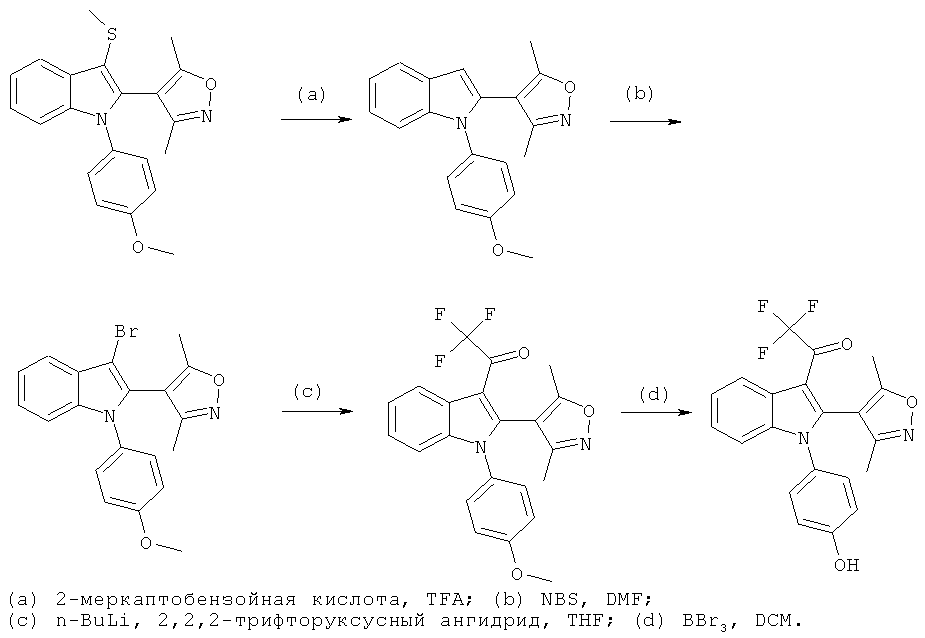
Стадия (a): К 5 мл трифторуксусной кислоты при комнатной температуре добавляли 4-(1-(4-метоксифенил)-3-(метилтио)-1H-индол-2-ил)-3,5-диметилизоксазол (промежуточный продукт стадии (c) примера 21, 140 мг, 0,38 ммоль) и 2-меркаптобензойную кислоту (118 мг, 0,77 ммоль). Смесь перемешивали в виде взвеси при комнатной температуре в атмосфере азота в течение ночи. Добавляли 2M NaOH и EtAc, и разделяли фазы. Растворители выпаривали, и очищали остаток по методу флэш-хроматографии с гептаном/EtAc 4:1 в качестве элюента с получением 4-(1-(4-метоксифенил)-1H-индол-2-ил)-3,5-диметилизоксазола с выходом 86%. ES/MS m/z: 319,1 (M+H).
Стадия (b): К охлажденному (0°C) раствору 4-(1-(4-метоксифенил)-1H-индол-2-ил)-3,5-диметилизоксазола (105 мг, 0,33 ммоль) в 5 мл DMF добавляли NBS (59 мг, 0,33 ммоль). Температуру оставляли повышаться до комнатной температуры и перемешивали смесь при комнатной температуре в течение 30 мин. DMF выпаривали. Добавляли DCM и воду, и разделяли фазы. После выпаривания растворителей остаток очищали по методу флэш-хроматографии с гептаном/EtOAc 9:1 с получением 4-(3-бром-1-(4-метоксифенил)-1H-индол-2-ил)-3,5-диметилизоксазола с выходом 98%. ES/MS m/z: 365,14 (M+H), 363,30 (M-H).
Стадия (c): К охлажденному (-78°C) раствору 4-(3-бром-1-(4-метоксифенил)-1H-индол-2-ил)-3,5-диметилизоксазола (10 мг, 0,03 ммоль) в атмосфере азота добавляли n-BuLi (10 мкл, 0,03 ммоль). Спустя 5 мин добавляли 2,2,2-трифторуксусный ангидрид (7 мкл, 0,05 ммоль). Температуру оставляли повышаться до комнатной температуры и перемешивали смесь в течение ночи. Добавляли 1M NaHCO3 и DCM, фазы разделяли и выпаривали растворители.
Стадия (d): 1-(2-(3,5-Диметилизоксазол-4-ил)-1-(4-метоксифенил)-1H-индол-3-ил)-2,2,2-трифторэтанон растворяли в безводном DCM и охлаждали смесь на бане со льдом в атмосфере азота. Добавляли BBr3 (17 мкл, 0,1 ммоль), оставляли температуру повышаться до комнатной температуры и перемешивали смесь в течение ночи. Добавляли воду, DCM и немного диоксана, фазы разделяли и выпаривали растворители. Остаток пропускали через тонкий слой силикагеля с EtOAc в качестве элюента. Остаток очищали по методу препаративной ВЭЖХ с получением указанного в заголовке соединения, 1-(2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)-2,2,2-трифторэтанона, с выходом 46%. ES/MS m/z: 401,1 (M+H), 399,1 (M-H); 1H-ЯМР (метанол-d4, 500 МГц): 8,26 (м, 1H), 7,41-7,34 (м, 2H), 7,18 (м, 1H), 7,11 (м, 2H), 6,89 (м, 2H), 2,19 (с, 3H) и 2,01 (с, 3H).
Пример 23
4-[3-Бром-2-(3,5-диметилизоксазол-4-ил)-1H-индол-1-ил]фенол (E23)
Схема 21
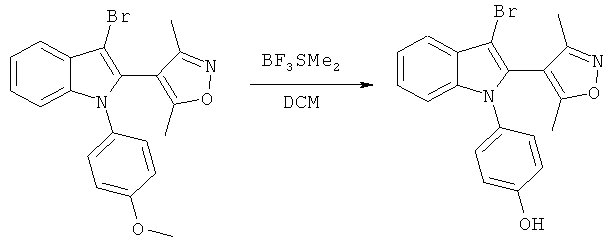
При 0°C к 4-[3-бром-1-(4-метоксифенил)-1H-индол-2-ил]-3,5-диметилизоксазолу (промежуточный продукт стадии (b) примера 22), растворенному в DCM, добавляли 10 экв. трифтордиметилсульфида бора и перемешивали при температуре окружающей среды в течение ночи. Смесь разбавляли EtOAc и промывали солевым раствором, органическую фазу концентрировали и подвергали препаративной ВЭЖХ с обращенной фазой. Соответствующие фракции объединяли, упаривали и идентифицировали по методу ES/MS m/z: 385,1 (M+H), 383,09 (M-H) и 1H-ЯМР (ацетон-d6, 500 МГц): 7,60 (м, 1H), 7,31-7,23 (м, 3H), 7,17 (м, 2H), 6,95 (м, 2H), 2,28 (с, 3H) и 1,99 (с, 3H).
Пример 24
2-Бром-4-фтор-1-(4-гидроксифенил)-1H-индол-3-карбонитрил (E24)
Схема 22
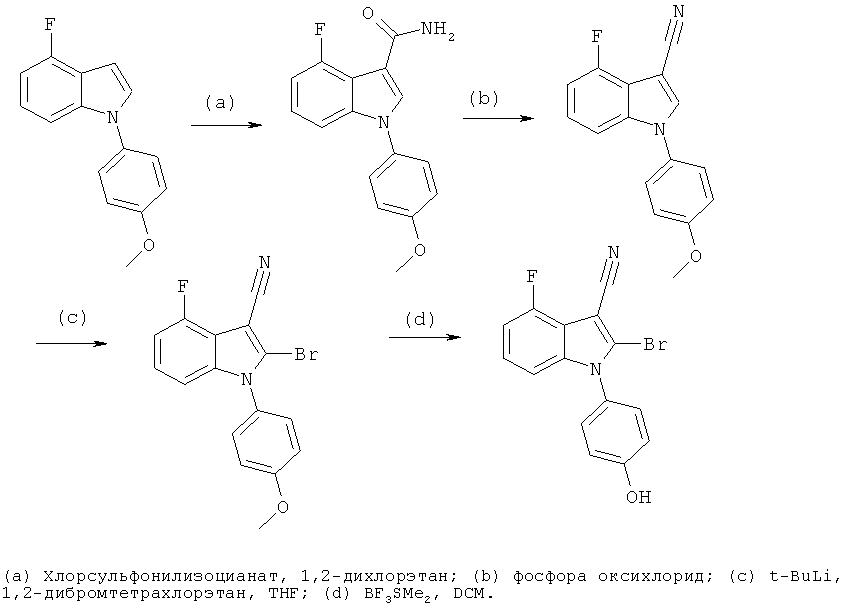
Стадия (a): 4-Фтор-1-(4-метоксифенил)-1H-индол (синтезированный из 4-фториндола путем арилирования, аналогичного описанному на стадии (a) примера 1 [процесс арилирования также описан в J. Org. Chem. 2008, 73(14), 5529-5535]) растворяли в 1,2-дихлорэтане, добавляли 1,2 экв. хлорсульфонилизоцианата, и перемешивали смесь при комнатной температуре в течение 2 часов. К смеси добавляли воду, корректировали pH до нейтральных значений добавлением NaOH (водн., 1M), а затем экстрагировали смесь EtOAc. Органическую фазу промывали солевым раствором и сушили над Na2SO4. Неочищенный продукт очищали на колонке с силикагелем с использованием 50% EtOAc в н-гептане в качестве подвижной фазы.
Стадия (b): К 4-фтор-1-(4-метоксифенил)-1H-индол-3-карбоксамиду добавляли 50 экв. фосфора оксихлорида и проводили реакцию при 60°C в течение 2 часов. Смесь охлаждали до комнатной температуры и совместно упаривали с толуолом. Остаток разбавляли EtOAc, сначала промывали насыщен. NaHCO3, затем солевым раствором и сушили органическую фазу над Na2SO4. Неочищенный продукт очищали на колонке с силикагелем с использованием 10% EtOAc в н-гептане в качестве подвижной фазы.
Стадия (c): Промежуточный продукт синтезировали из продукта, полученного на стадии (b), с использованием методики, аналогичной описанной на стадии (b) примера 1.
Стадия (d): Указанное в заголовке соединение, 2-бром-4-фтор-1-(4-гидроксифенил)-1H-индол-3-карбонитрил, синтезировали из продукта, полученного на стадии (c) с использованием методики, аналогичной описанной в примере 23. ES/MS m/z: 333,04 (M+H), 331,04 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,44 (дд, 1H, J=8,9, 2,6 Гц), 7,39 (м, 2H), 7,18 (дд, 1H, J=8,5, 4,2 Гц) и 7,15-7,09 (м, 3H).
Пример 25
(Z)-2-(4-Фторфенокси)-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид (E25)
Схема 23
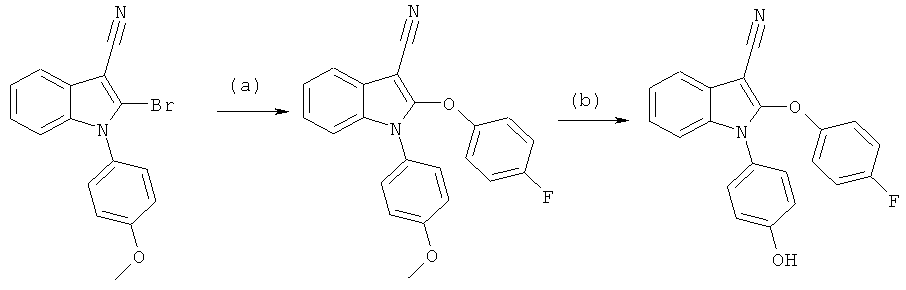
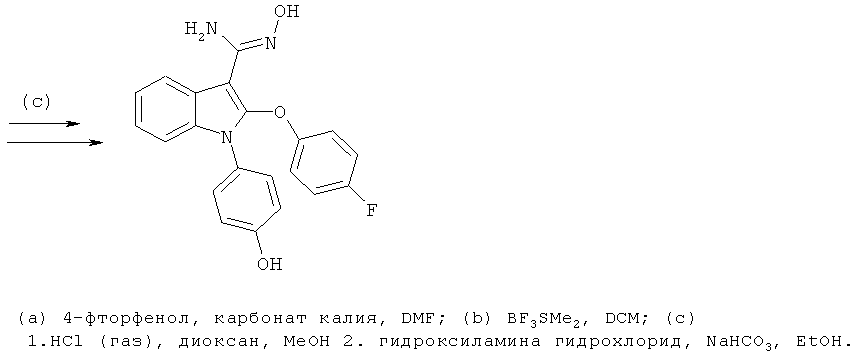
Стадия (a): Смесь 2-бром-1-(4-метоксифенил)-1H-индол-3-карбонитрила (промежуточный продукт стадии (b) примера 1), 5 экв. 4-фторфенола и 5 экв. карбоната калия нагревали при 200°C в течение 20 минут в микроволновом реакторе в инертной атмосфере. Охлажденную смесь разбавляли водой и экстрагировали EtOAc, объединенные органические фазы сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали на колонке с силикагелем с использованием 20% EtOAc в н-гептане в качестве подвижной фазы.
Стадия (b): 2-Бром-4-фтор-1-(4-гидроксифенил)-1H-индол-3-карбонитрил синтезировали из продукта, полученного на стадии (a) с использованием методики, аналогичной описанной в примере 23.
Стадия (c): Указанное в заголовке соединение, (Z)-N'-гидрокси-1-(4-гидроксифенил)-2-фенокси-1H-индол-3-карбоксимидамид, синтезировали из продукта, полученного на стадии (b) с использованием методик, аналогичных описанным в примере 14. ES/MS m/z: 360,18 (M+H), 358,22 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,24 (м, 1H), 7,25-7,14 (м, 6H), 7,09 (м, 1H), 7,00 (м, 1H) и 6,90-6,85 (м, 4H).
Пример 26
4-(2-(3,5-Диметилизоксазол-4-ил)-3-нитро-1H-индол-1-ил)фенол (E26)
Схема 24
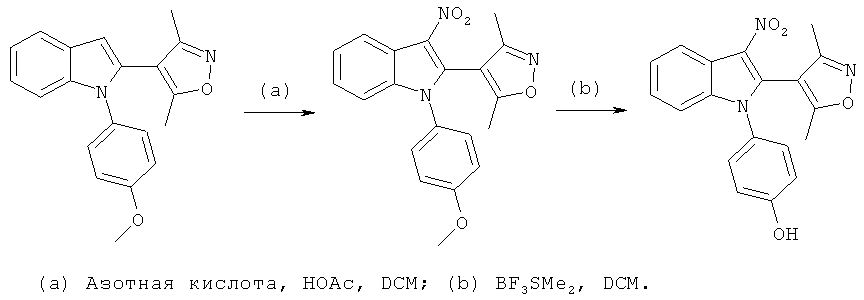
Стадия (a): К раствору 4-(1-(4-метоксифенил)-1H-индол-2-ил)-3,5-диметилизоксазола (промежуточного продукта стадии (a) примера 22) в DCM медленно добавляли смесь 2 экв. азотной кислоты и 20 экв. уксусной кислоты. После 1 часа перемешивания при комнатной температуры смесь разбавляли водой и разделяли фазы. Органическую фазу концентрировали и очищали на колонке с силикагелем с использованием 30% EtOAc в н-гептане в качестве подвижной фазы.
Стадия (b): Указанное в заголовке соединение, 4-(2-(3,5-диметилизоксазол-4-ил)-3-нитро-1H-индол-1-ил)фенол, синтезировали из продукта, полученного на стадии (a), с использованием методики, аналогичной описанной в примере 23. ES/MS m/z: 350,18 (M+H), 348,22 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,34 (м, 1H), 7,50 (м, 1H), 7,44-7,40 (м, 2H), 7,29 (м, 1H), 7,20 (м, 1H), 7,01 (м, 2H), 2,22 (с, 3H) и 2,11 (с, 3H).
Пример 27
4-(3-(Дигидроксиамино)-2-(3,5-диметилизоксазол-4-ил)-1H-индол-1-ил)фенол (E27)
Схема 25
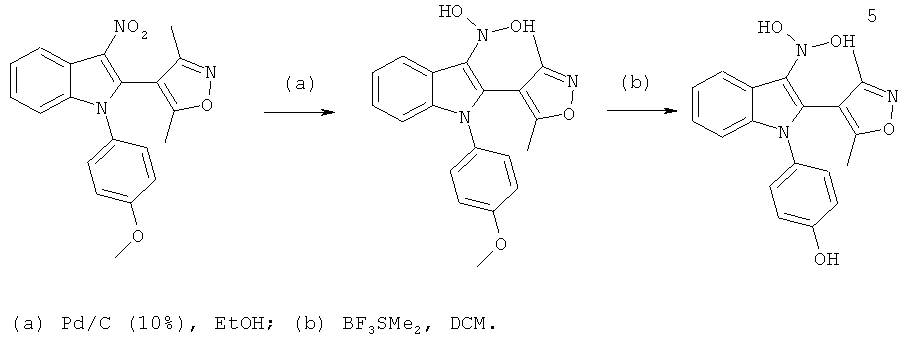
Стадия (a): 4-(1-(4-Метоксифенил)-3-нитро-1H-индол-2-ил)-3,5-диметилизоксазол (промежуточный продукт стадии (a) примера 26) растворяли в EtOH (99%), добавляли каталитическое количество Pd/C (10%) и перемешивали смесь под давлением 4 фунтов/дюйм2 H2 в течение ночи. Смесь фильтровали через слой целита, концентрировали и очищали на колонке с силикагелем с использованием 45% EtOAc в н-гептане в качестве подвижной фазы.
Стадия (b): Указанное в заголовке соединение, 4-(3-(дигидроксиамино)-2-(3,5-диметилизоксазол-4-ил)-1H-индол-1-ил)фенол, синтезировали из продукта, полученного на стадии (a), с использованием методики, аналогичной описанной в примере 23. ES/MS m/z: 351,13 (M+H), 350,18 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,31 (д, 1H, J=8,2 Гц), 7,44 (т, 1H, J=7,4 Гц), 7,36 (м, 1H), 7,30 (м, 2H), 7,22 (д, 1H, J=8,2 Гц), 7,05 (м, 2H), 1,81 (с, 3H) и 1,80 (с, 3H).
Пример 28
N-(2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)ацетамид (E28)
Схема 26
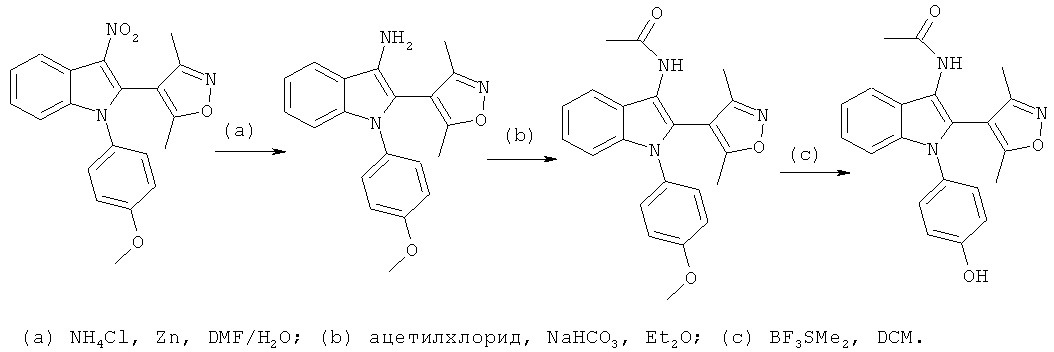
Стадия (a): К раствору 4-[1-(4-метоксифенил)-3-нитро-1H-индол-2-ил]-3,5-диметилизоксазола (промежуточный продукт стадии (a) примера 26) в DMF/воде (10/1) при 0°C добавляли хлорид аммония (5 экв.) и цинк (5 экв.). Смесь перемешивали в течение 2 часов при этой температуре, затем разбавляли EtOAc, образовавшийся осадок отфильтровывали, органическую фазу промывали солевым раствором и сушили над Na2SO4. Смесь концентрировали и использовали на следующей стадии без дополнительной очистки.
Стадия (b): 2-(3,5-Диметилизоксазол-4-ил)-1-(4-метоксифенил)-1Η-индол-3-амин растворяли в диэтиловом эфире и охлаждали до 0°C, затем добавляли NaHCO3 (2 экв.) и хлорангидрид (2 экв.) в виде растворе в диэтиловом эфире, смесь поддерживали при 0°C и перемешивали в течение 1 часа. Растворитель удаляли, остаток растворяли в EtOAc и промывали водой, затем солевым раствором, затем сушили над Na2SO4. Смесь концентрировали и использовали на следующей стадии без дополнительной очистки.
Стадия (c): Указанное в заголовке соединение, N-(2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)ацетамид, синтезировали из продукта, полученного на стадии (b), с использованием методики, аналогичной описанной в примере 23. ES/MS m/z: 361,21 (M+H), 360,17 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,58 (м, 1H), 7,21-7,11 (м, 5H), 6,93 (м, 2H), 2,20 (с, 3H), 2,07 (с, 3H) и 1,88 (с, 3H).
Пример 29
N-(2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)метансульфонамид (E29)
Схема 27
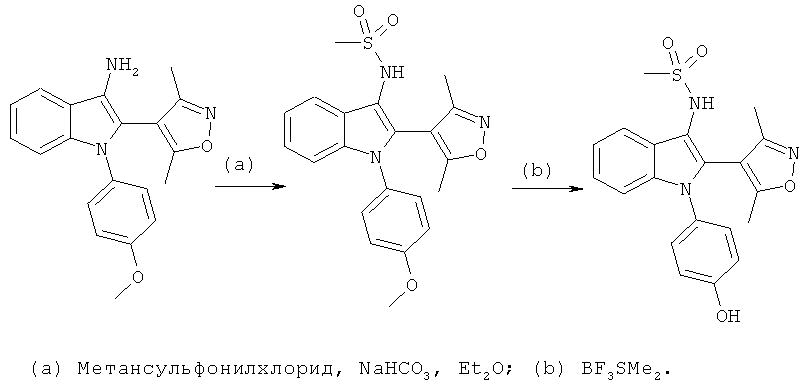
Стадия (a): 2-(3,5-Диметилизоксазол-4-ил)-1-(4-метоксифенил)-1H-индол-3-амин (промежуточный продукт стадии (a) примера 28) растворяли в диэтиловом эфире и охлаждали до 0°C, затем добавляли NaHCO3 (2 экв.) и метансульфонилхлорид (2 экв.) в виде раствора в диэтиловом эфире, смесь поддерживали при 0°C и перемешивали в течение 1 часа, а затем при комнатной температуре в течение выходных дней. Растворитель удаляли, остаток растворяли в EtOAc и промывали водой, затем солевым раствором, затем сушили над Na2SO4. Смесь концентрировали и использовали на следующей стадии без дополнительной очистки.
Стадия (b): Указанное в заголовке соединение, N-(2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)метансульфонамид, синтезировали из продукта, полученного на стадии (a), с использованием методики, аналогичной описанной в примере 23. ES/MS m/z: 398,17 (M+H), 396,15 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,82 (м, 1H), 7,24-7,20 (м, 3H), 7,17 (м, 2H), 6,95 (м, 2H), 2,89 (с, 3H), 2,26 (с, 3H) и 1,96 (с, 3H).
Пример 30
1-(2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)мочевина (E30)
Схема 28
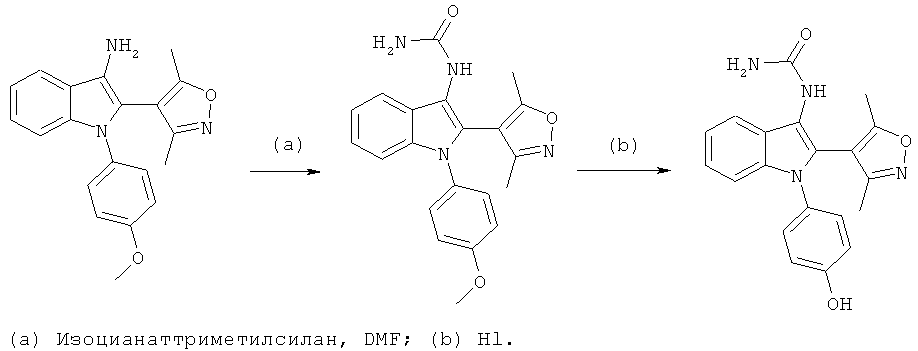
Стадия (a): Дегазированную (N2) смесь 2-(3,5-диметилизоксазол-4-ил)-1-(4-метоксифенил)-1H-индол-3-амина (промежуточный продукт стадии (a) примера 28) и изоцианатотриметилсилан (6 экв.) в DMF нагревали в микроволновом реакторе при 200°C в течение 2×20 мин. Смесь охлаждали, концентрировали и использовали на следующей стадии без дополнительной очистки.
Стадия (b): 1-(2-(3,5-Диметилизоксазол-4-ил)-1-(4-метоксифенил)-1H-индол-3-ил)мочевину нагревали в йодистоводородной кислоте (водн., 57%) при 100°C в течение 3 часов. Реакционную смесь охлаждали, концентрировали и совместно упаривали с DCM и EtOAc. Остаток подвергали препаративной ВЭЖХ с обращенной фазой. Соответствующие фракции объединяли, упаривали и идентифицировали по методу 1H-ЯМР. ES/MS m/z: 363,19 (M+H), 362,18 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,65 (м, 1H), 7,22-7,09 (м, 5H), 6,93 (м, 2H), 2,25 (с, 3H) и 1,94 (с, 3H).
Примеры 31 и 32
4-(2-(3,5-Диметилизоксазол-4-ил)-3-тиоцианато-1H-индол-1-ил)фенол (E31)
2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил-N'-гидроксикарбамимидотиоат (E32)
Схема 29
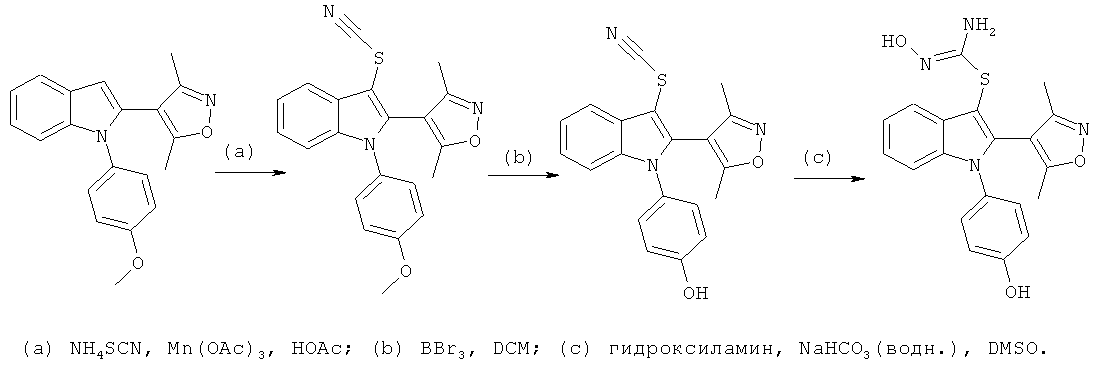
Стадия (a): 4-(1-(4-Метоксифенил)-1H-индол-2-ил)-3,5-диметилизоксазол (промежуточный продукт стадии (a) примера 22) растворяли в AcOH, и добавляли 1,2 экв. аммония тиоцианата. Затем добавляли 3 экв. ацетата магния(III) и перемешивали реакционную смесь при комнатной температуре в течение 45 минут, после чего мониторинг по методу ТСХ показал полное расходование исходного вещества. Реакционную смесь разбавляли EtOAc и промывали солевым раствором. Фазы разделяли, и промывали органическую фазу NaHCO3 (водн.). Затем органическую фазу упаривали досуха в условиях вакуума, и использовали неочищенный продукт без дополнительной очистки. ES/MS m/z: 376,14 (M+H).
Стадия (b): Продукт, полученный на стадии (a), подвергали деметилированию с использованием BBr3 в соответствии со способом, описанным на стадии (c) примера 9, с получением 4-(2-(3,5-диметилизоксазол-4-ил)-3-тиоцианато-1H-индол-1-ил)фенола (E31). ES/MS m/z: 362,14 (M+H), 360,18 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,86 (м, 1H), 7,43-7,37 (м, 2H), 7,31 (м, 1H), 7,26 (м, 2H), 6,98 (м, 2H), 2,34 (с, 3H) и 2,03 (с, 3H).
Стадия (c): 4-(2-(3,5-Диметилизоксазол-4-ил)-3-тиоцианато-1H-индол-1-ил)фенол растворяли в DMSO и добавляли 10 экв. 2M маточного раствора гидроксиламина/NaHCO3 (водн.). Реакционную смесь перемешивали при 65°C в течение ночи, а затем разбавляли H2O. После перемешивания в течение 5 мин образовывался осадок. Смесь разбавляли EtOAc и диэтиловым эфиром, промывали NH4Cl (водн.) и разделяли фазы. Органическую фазу упаривали досуха в условиях вакуума и подвергали очистке по методу препаративной ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения, 2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил-N'-гидроксикарбамимидотиоата (E32). ES/MS m/z: 395,17 (M+H), 393,19 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,88 (ушир.с, 1H), 8,73 (ушир.с, 1H), 7,80-7,78 (м, 1H), 7,29-7,24 (м, 3H), 7,18 (д, 2H), 6,95 (д, 2H), 5,11 (ушир.с, 2H), 2,28 (с, 3H), 2,00 (с, 3H).
Пример 33
4-(3-Бензил-2-фенил-1H-индол-1-ил)фенол (E33)
Схема 30
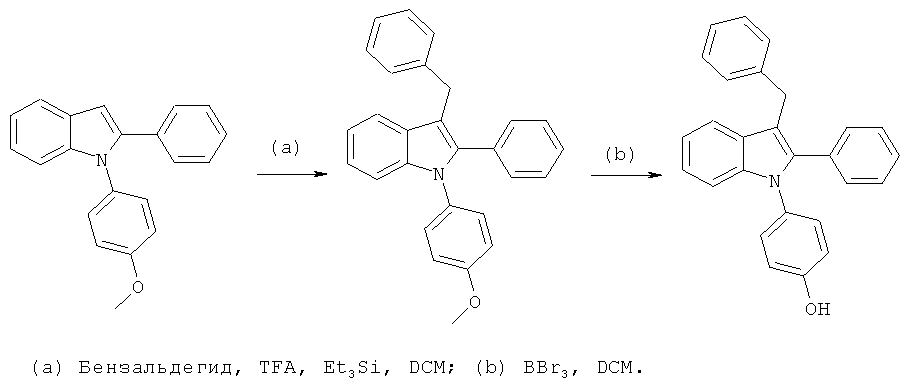
Стадия (a): К смеси 47 мг 1-(4-метоксифенил)-2-фенил-1H-индола (синтезированного из 2-фенилиндола путем арилирования, описанного в J. Org. Chem. 2001, 66(23), 7729-7737) и 19 мкл бензальдегида в 1 мл безводного DCM при 0°C в атмосфере азота по каплям в течение 5 мин добавляли смесь 19 мкл TFA и 80 мкл Et3SiH в 0,5 мл безводного DCM. Смесь оставляли нагреваться до комнатной температуры в течение ночи, после чего смесь охлаждали до 0°C и добавляли 160 мкл Et3SiH и 38 мкл TFA, растворенные в 1 мл CH2Cl2. Смесь перемешивали в течение 40 мин, затем подщелачивали добавлением NaOH 2M (~pH 13), затем добавляли солевой раствор, экстрагировали дихлорметаном (×3) и упаривали. К неочищенному продукту в 3 мл дихлорметана добавляли 0,2 г TsNHNH2 на твердой подложке. Смесь осторожно перемешивали в течение 1 ч 20 мин. Полимер отфильтровывали, и фильтровали неочищенный продукт через слой силикагеля. Продукт получали чистым, не требующим дополнительной очистки.
Стадия (b): Продукт, полученный на стадии (a), подвергали деметилированию с использованием BBr3 в соответствии со способом, описанным на стадии (c) примера 9, с получением 4-(3-бензил-2-фенил-1H-индол-1-ил)фенола. ES/MS m/z: 376,4 (M+H), 374,2 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,86 (м, 1H), 7,43-7,37 (м, 2H), 7,31 (м, 1H), 7,26 (м, 2H), 6,98 (м, 2H), 2,34 (с, 3H) и 2,03 (с, 3H).
Примеры 34 и 35
2-(2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)-2-оксоацетамид (E34)
2-(2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)-2-(гидроксиимино)ацетамид (E35)
Схема 31
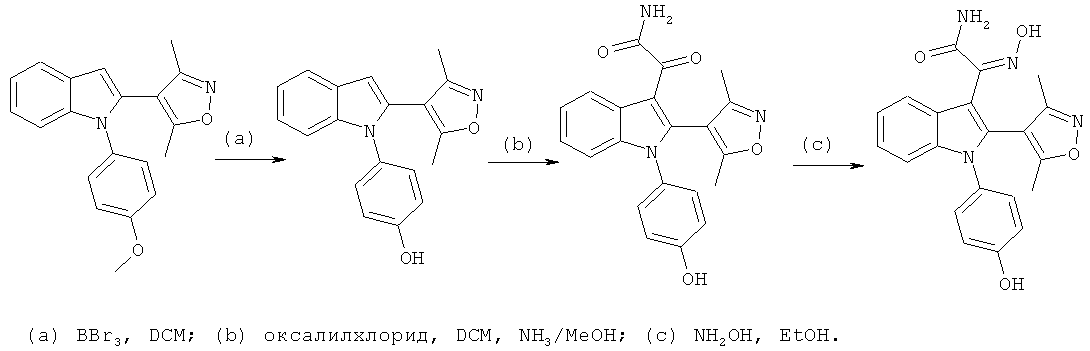
Стадия (a): 4-(2-(3,5-Диметилизоксазол-4-ил)-1H-индол-1-ил)фенол синтезировали из 4-(1-(4-метоксифенил)-1H-индол-2-ил)-3,5-диметилизоксазола (промежуточного продукта стадии (a) примера 22) способом, аналогичным описанному на стадии (c) примера 1.
Стадия (b): 4-(2-(3,5-Диметилизоксазол-4-ил)-1H-индол-1-ил)фенол растворяли в 1 мл безводного дихлорметана в атмосфере азота и охлаждали до 0°C. Добавляли 4 мл оксалилхлорида и перемешивали смесь при 0°C в течение 2 ч 15 мин, а затем при комнатной температуре в течение 1 ч 15 мин. Смесь концентрировали в условиях вакуума без нагревания, и добавляли 1 мл NH3/MeOH (нас.). Смесь перемешивали в течение 1 ч, а затем концентрировали. Неочищенный продукт очищали по методу флэш-хроматографии (EtOAc/гептан; от 4:6 до 8:2) с получением 2-(2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)-2-оксоацетамида (E34). ES/MS m/z: 376,18 (M+H), 374,17 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,33 (м, 1H), 7,37-7,15 (м, 5H), 6,98 (ушир.с, 2H), 2,27 (с, 3H) и 2,00 (с, 3H).
Стадия (c): К 8,8 мг 2-(2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)-2-оксоацетамида и 32,6 мг гидроксиламина гидрохлорида в 1,5 мл EtOH в сосуде для микроволновой обработки добавляли 50 мкл пиридина. Сосуд герметично закрывали и продували азотом. Смесь нагревали до 150°C в течение 7,5 мин, а затем до 150°C в течение 5 мин в микроволновой печи Biotage Initiator. Смесь концентрировали в условиях вакуума и очищали по методу препаративной ВЭЖХ (муравьиная кислота/буфер/ацетонитрил). 2-(2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)-2(гидроксиимино)ацетамид (E35) получали в виде смеси syn и anti оксимных изомеров. ES/MS m/z: 391,4 (M+H), 389,5 (M-H); 1H-ЯМР (DMSO-d6, 500 МГц): 7,37 (м, 1H), 7,20-7,03 (м, 5H), 6,84 (м, 2H), 2,15 (с, 3H) и 1,77 (с, 3H).
Примеры 36 и 37
2-(2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)-2-гидроксиацетамид (E36)
2-(2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)ацетамид (E37)
Схема 32
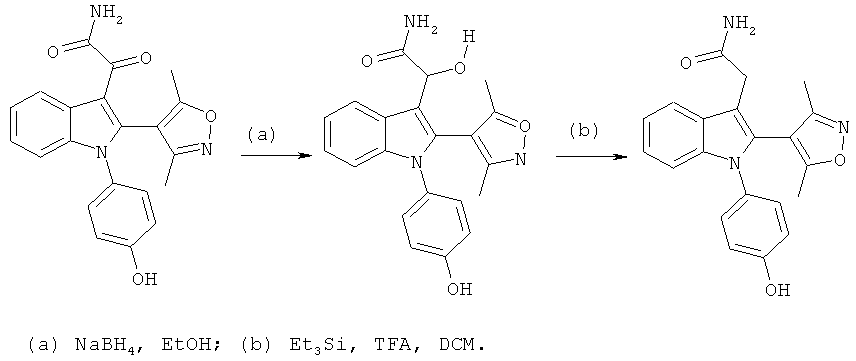
Стадия (a): 9 мг 2-(2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)-2-оксоацетамида (пример 34) смешивали с 1 мл EtOH, добавляли 1,8 мг NaBH4 и перемешивали смесь в течение 1,5 ч. Смесь упаривали, добавляли воду, а затем экстрагировали EtOAc. Неочищенный продукт очищали по методу флэш-хроматографии с обращенной фазой (ацетонитрил/вода) с получением 2-(2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)-2-гидроксиацетамида (E36). ES/MS m/z: 376,3 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,78 (м, 1H), 7,13-6,93 (м, 5H), 6,79 (м, 2H), 2,23, 2,21 (2 с, 3H) и 1,93, 1,90 (2 с, 3H).
Стадия (b): К 2-(2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)-2-гидроксиацетамиду при 0°C добавляли 1 мл TFA и 19 мкл Et3SiH и перемешивали смесь в течение 60 мин. Растворитель упаривали без нагревания, проводили короткую очистку на силикагеле (EtOAc/гептан; от 1:9 до 8:2) с получением 2-(2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)ацетамида (E37). ES/MS m/z: 362,3 (M+H); 1H-ЯМР (метанол-d3, 500 МГц): 8,98 (м, 1H), 8,46-8,35 (м, 5H), 8,16 (м, 2H), 4,78 (д, 2H, J=1,9 Гц), 3,54 (с, 3H) и 3,19 (с, 3H).
Пример 38
2-((Z)-Бут-1-енил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил (E38)
Схема 33
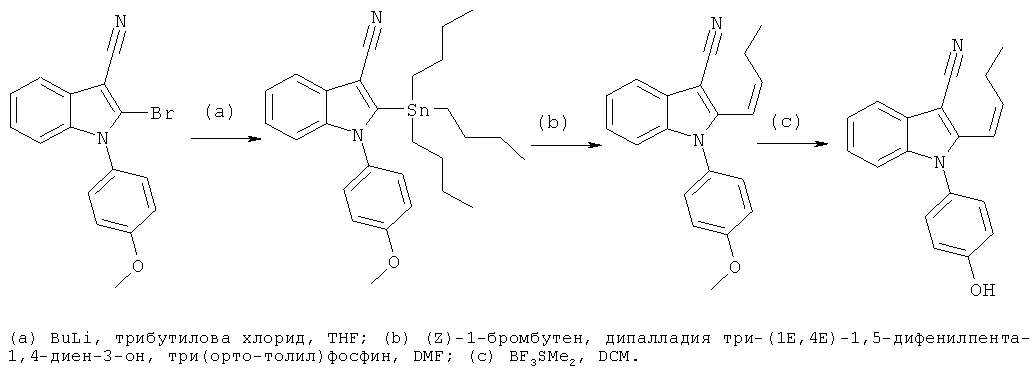
Стадия (a): К охлажденному раствору 2-бром-1-(4-метоксифенил)-1H-индол-3-карбонитрила (промежуточный продукт стадии (b) примера 1) в безводном THF при -78°C медленно добавляли n-BuLi (1,6 M в гексане, 1,2 экв.), и перемешивали смесь в течение 30 минут. Добавляли трибутилолова хлорид (1,5 экв.), поддерживали смесь при -78°C в течение 1 часа, а затем перемешивали при комнатной температуре в течение ночи. Смесь гасили добавлением нас. NH4Cl, а затем концентрировали. Остаток поглощали EtOAc, промывали солевым раствором, сушили над Na2SO4 и очищали на колонке с силикагелем с использованием 20% EtOAc в н-гептане в качестве подвижной фазы.
Стадия (b): Смесь 1-(4-метоксифенил)-2-(трибутилстаннил)-1H-индол-3-карбонитрила, (Z)-1-бромбут-1-ена (1,2 экв.), Pd2(dba)3 (3%) и три(орто-толил)фосфина (17%) в DMF дегазировали с N2 и нагревали при 80°C в течение ночи. Смесь разбавляли нас. NH4Cl и EtOAc и разделяли фазы. Органическую фазу промывали солевым раствором, сушили над Na2SO4 и подвергали препаративной ВЭЖХ с обращенной фазой. Соответствующие фракции объединяли, упаривали и идентифицировали по методу 1H-ЯМР.
Стадия (c): Указанное в заголовке соединение, 2-((Z)-бут-1-енил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил, синтезировали из продукта, полученного на стадии (b), с использованием методики, аналогичной описанной в примере 23. ES/MS m/z: 289,11 (M+H), 287,15 (M-H).
Пример 39
2-(Изобут-1-енил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил (E61)
Схема 34
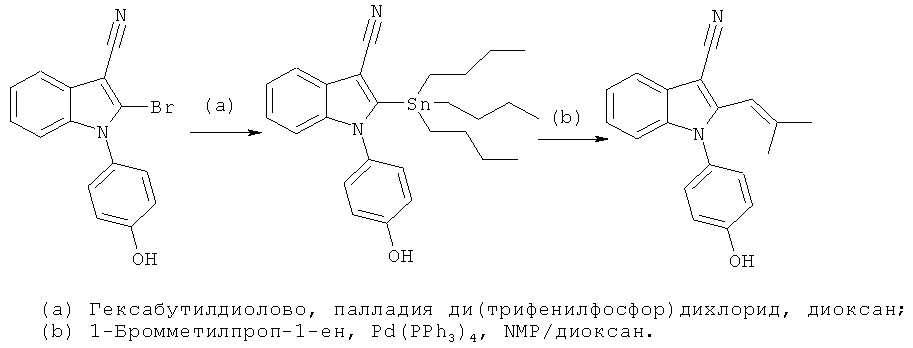
Стадия (a): 1 экв. 2-бром-1-(4-гидроксифенил)-1H-индол-3-карбонитрила (пример 1) растворяли в 1,4-диоксане и перемешивали при комнатной температуре. Добавляли 1,9 экв. гексабутилдиолова и 0,04 экв. палладия ди(трифенилфосфор)дихлорида, дегазировали азотом и нагревали смесь до 80°C в течение 4 часов. Смесь фильтровали для удаления катализатора, упаривали для удаления большей части растворителя, а остаток очищали на колонке с силикагелем с использованием 75:25 н-гептан:этилацетата в качестве подвижной фазы (выход 65%).
Стадия (b): 1 экв. Станнила, полученного на стадии (a), растворяли в смешанном растворителе (1-метил-2-пирролодинон и 1,4-диоксан, 2:1), перемешивали при комнатной температуре, добавляли 2 экв. 1-бромметилпроп-1-ена и 0,2 масс.% тетракис(трифенилфосфин)палладия, дегазировали азотом, нагревали смесь до 80°C в течение ночи. Смесь фильтровали для удаления катализатора, упаривали для удаления большей части растворителя, и очищали остаток по методу препаративной ВЭЖХ. ES/MS m/z: 289,11 (M+H), 287,15 (M-H); 1H-ЯМР (хлороформ-d, 500 МГц): 7,76 (м, 1H), 7,28 (м, 1H), 7,23 (м, 1H), 7,17 (м, 2H), 7,13 (м, 1H), 6,98 (м, 2H), 5,86 (м, 1H), 1,98 (д, 3H, J=1,3 Гц) и 1,89 (д, 3H, J=1,2 Гц).
Пример 40
1-(2,3-Дифтор-4-гидроксифенил)-2-(2-метилаллил)-1H-индол-3-карбонитрил (E40)
Схема 35

Смесь 2-бром-1-(2,3-дифтор-4-гидроксифенил)-1H-индол-3-карбонитрила (пример 103), металлилтри-н-бутилолова (2 экв.), Pd2(dba)3 (0,05%) и три(орто-толил)фосфина (20%) растворяли в DMF, дегазировали N2 и нагревали при 80°C в течение ночи. Реакционную смесь гасили добавлением нас. NH4Cl, разбавляли EtOAc, промывали солевым раствором а затем сушили над Na2SO4. Остаток подвергали препаративной ВЭЖХ с обращенной фазой. Соответствующие фракции объединяли, упаривали и идентифицировали по методу 1H-ЯМР. ES/MS m/z: 289,11 (M+H), 287,15 (M-H); 1H-ЯМР (хлороформ-d, 500 МГц): 7,76 (м, 1H), 7,28 (м, 1H), 7,23 (м, 1H), 7,17 (м, 2H), 7,13 (м, 1H), 6,98 (м, 2H), 5,86 (м, 1H), 1,98 (д, 3H, J=1,3 Гц) и 1,89 (д, 3H, J=1,2 Гц).
Пример 41
(Z)-2-(5-Этил-3-метилизоксазол-4-ил)-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид (E41)
Схема 36
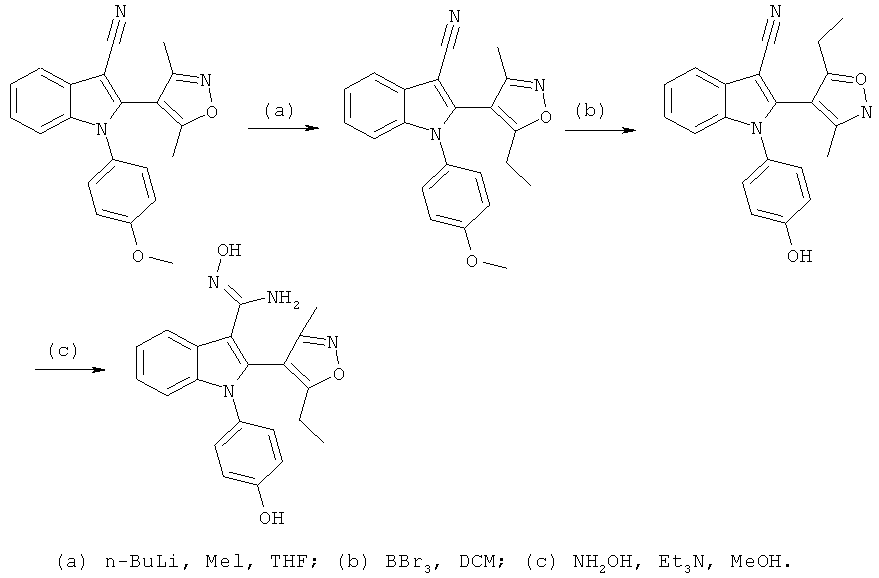
Стадия (a): К 2-(3,5-диметилизоксазол-4-ил)-1-(4-метоксифенил)-1H-индол-3-карбонитрилу (синтезированному в реакции сочетания промежуточного продукта, полученного на стадии (b) примера 1, с 3,5-диметилизоксазол-4-бороновой кислотой с использованием способа, описанного в примере 16) в 1 мл безводного THF в атмосфере аргона при -78°C по каплям добавляли 38 мкл н-бутиллития (1,6M в гексанах). Смесь перемешивали при -78°C в течение 45 мин. Добавляли 34 мкл метилйодида, и оставляли смесь нагреваться до комнатной температуры. Спустя 4 ч смесь концентрировали в условиях вакуума и очищали на силикагеле (EtOAc/гептан; 1:1).
Стадия (b): Промежуточный продукт получали из 4-(1-(4-метоксифенил)-3-фенил-1H-индол-2-ил)-3,5-диметилизоксазола способом, аналогичным описанному на стадии (c) примера 1.
Стадия (c): Указанное в заголовке соединение получали из 2-(5-этил-3-метилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрила способом, аналогичным описанному в примере 11. ES/MS m/z: 377,3 (M+H), 375,4 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,06 (м, 1H), 7,22-7,10 (м, 5H), 6,94 (м, 2H), 2,56 (м, 2H), 2,02 (с, 3H) и 1,03 (т, 3H, J=7,3 Гц).
Пример 42
4-(2-(3,5-Диметилизоксазол-4-ил)-3-фенил-1H-индол-1-ил)фенол (E42)
Схема 37
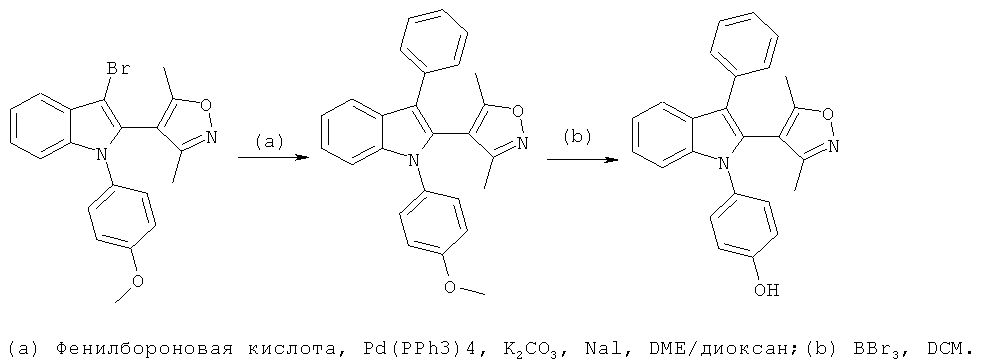
Стадия (a): Смесь DME/диоксана (1:1) трижды дегазировали путем замораживания-оттаивания, а затем помещали в атмосферу аргона. 4-(3-Бром-1-(4-метоксифенил)-1H-индол-2-ил)-3,5-диметилизоксазол (10 мг, промежуточный продукт стадии (b) примера 22), 6,1 мг фенилбороновой кислоты, 2,9 мг Pd(PPh3)4, 21 мг карбоната калия и 7,6 мг Nal помещали в сосуд для микроволновой обработки, который герметично закрывали и продували аргоном. В сосуд для микроволновой обработки через канюлю добавляли 0,7 мл раствора DME/вода.
Смесь дважды дегазировали путем замораживания-оттаивания, а затем продували аргоном. Смесь нагревали до 150°C/15 мин в микроволновой печи Biotage Initiator. Неочищенный продукт фильтровали, затем упаривали и фильтровали через тонкий слой силикагеля (EtOAc). Путем очистки по методу флэш-хроматографии (EtOAc/гептан; от 1:9 до 2:8) получали 22,2 мг смеси дебромированного исходного вещества и продукта с небольшим количеством исходного вещества (в соответствии с ЖХ/МС). Соединения хорошо разделялись по методу ВЭЖХ, но образовывали только одно пятно по методу ТСХ. Неочищенное вещество использовали непосредственно на следующей стадии деметилирования.
Стадия (b): Указанное в заголовке соединение получали из 4-(1-(4-метоксифенил)-3-фенил-1H-индол-2-ил)-3,5-диметилизоксазола способом, аналогичным описанному на стадии (c) примера 1. ES/MS m/z: 381,2 (M+H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,78 (м, 1H), 7,43-7,37 (м, 4H), 7,30-7,19 (м, 4H), 7,17 (м, 2H), 6,96 (м, 2H), 1,99 (с, 3H) и 1,77 (с, 3H).
Пример 43
4-(3-Хлор-2-(3,5-диметилизоксазол-4-ил)-1H-индол-1-ил)фенол (E43)
Схема 38
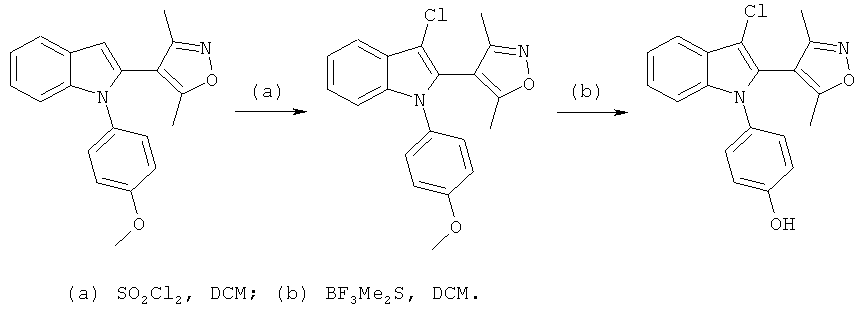
Стадия (a): К раствору 4-(1-(4-метоксифенил)-1H-индол-2-ил)-3,5-диметилизоксазола (промежуточный продукт стадии (a) примера 22, 7,5 мг, 0,024 ммоль) в DCM добавляли 1,5 экв. SO2Cl2, и перемешивали смесь при комнатной температуре в течение 1,5 ч. Раствор концентрировали с получением неочищенного продукта, который использовали непосредственно на следующей стадии.
Стадия (b): Указанное в заголовке соединение получали из 4-(1-(4-метоксифенил)-3-фенил-1H-индол-2-ил)-3,5-диметилизоксазола способом, аналогичным описанному в примере 23. ES/MS m/z: 339,1/341,1 (M+H), 337,2/339,2 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,78 (м, 1H), 7,43-7,37 (м, 4H), 7,30-7,19 (м, 4H), 7,17 (м, 2H), 6,96 (м, 2H), 1,99 (с, 3H) и 1,77 (с, 3H).
Пример 44
2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-сульфонамид (E44)
Схема 39
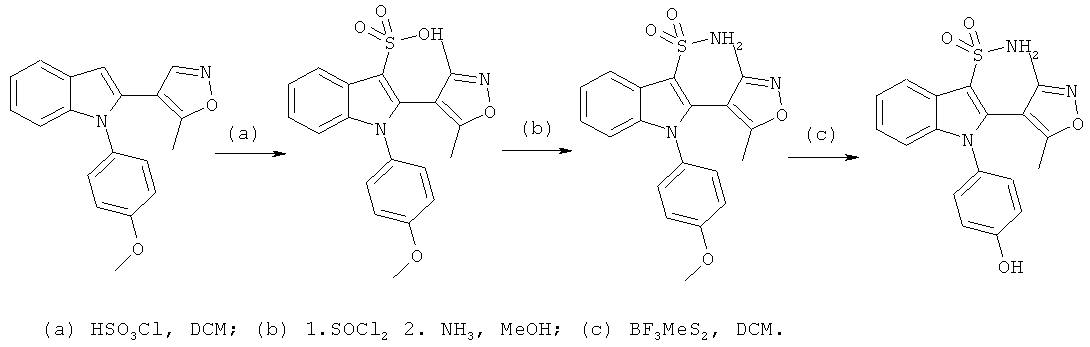
Стадия (a): К раствору 4-(1-(4-метоксифенил)-1H-индол-2-ил)-3,5-диметилизоксазола (промежуточный продукт стадии (a) примера 22, 7,5 мг, 0,024 ммоль) в DCM при 0°C добавляли 1,0 экв. HSO3Cl, и перемешивали смесь при комнатной температуре в течение 1 ч. Раствор концентрировали с получением неочищенного продукта, который использовали на следующей стадии.
Стадия (b): К раствору неочищенного продукта, полученного на стадии (a), в DCM добавляли 0,5 мл SOCl2, и перемешивали смесь при 70°C в течение 15 мин. Раствор концентрировали, добавляли 2 мл насыщенного NH3 в MeOH, и перемешивали смесь в течение ночи. Раствор концентрировали с получением неочищенного продукта, который использовали непосредственно на следующей стадии.
Стадия (c): Указанное в заголовке соединение получали из неочищенного продукта, полученного на стадии (b), с использованием способа, описанного в примере 23. ES/MS m/z: 384,2 (M+H), 382,2 (M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,13 (м, 1H), 7,32-7,28 (м, 2H), 7,19-7,15 (м, 3H), 6,93 (м, 2H), 2,24 (с, 3H) и 2,05 (с, 3H).
Пример 45
2-(3,5-Диметилизоксазол-4-ил)-1-(2-фтор-4-гидроксифенил)-1H-индол-3-карбоксимидамид (E45)
Схема 40
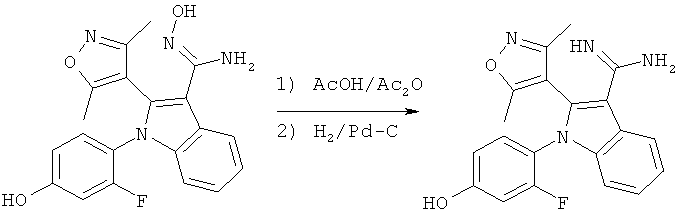
0,5 ммоль (Z)-2-(3,5-диметилизоксазол-4-ил)-1-(2-фтор-4-гидроксифенил)-N'-гидрокси-1H-индол-3-карбоксимидамида (Пример 235) растворяли в 5 мл уксусной кислоты. Медленно добавляли уксусный ангидрид (4 экв.), и перемешивали смесь в течение ночи. Добавляли Pd-C катализатор (10% на угле), и помещали смесь на ночь в аппарат для гидрирования под давление 50 фунтов/дюйм2 H2. Смесь фильтровали через целит и концентрировали. Неочищенный продукт очищали по методу ВЭЖХ: (колонка: Sunfire, 20 мин кислотного градиента: 5-50% MeCN. ES/MS m/z: 365,15 (M+H), 363,18 (M-H); 1H-ЯМР (MeOD, 500 МГц): 7,86 (м, 1H), 7,41-7,31 (м, 2,5H), 7,25-7,13 (м, 1,5H), 6,76 (м, 1H), 6,67 (м, 1H), 2,21, 2,15 (2 с, 3H) и 2,08, 2,06 (2 с, 3H).
Пример 46-95
Следующие соединения получали в соответствии с описанным выше общим способом 1. Все подробности экспериментов для каждой из отдельных стадий указанного общего способа описаны выше в примерах 1-5, 16 и 38-40.
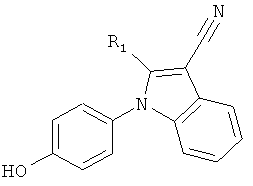
E46 1-(4-Гидроксифенил)-2-фенил-1H-индол-3-карбонитрил
R1=фенил
ES/MS m/z: 311,1 (положит.M+H), 309,11 (отрицат.M-H); 1H-ЯМР (CDCl3, 500 МГц): 7,74 (м, 1H), 7,31-7,15 (м, 8H), 7,00 (м, 2H) и 6,80 (м, 2H).
E47 1-(4-Гидроксифенил)-2-метил-1H-индол-3-карбонитрил
R1=метил
ES/MS m/z: 249,1 (положит.M+H), 247,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,63 (м, 1H), 7,33 (м, 2H), 7,27 (м, 1H), 7,23 (м, 1H), 7,10 (м, 2H), 7,08 (м, 1H) и 2,43 (с, 3H).
E48 2-(3-Цианотиофен-2-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=3-цианотиофен-2-ил
ES/MS m/z: 342,1 (положит.M+H), 340,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,95 (д, 1H, J=5,4 Гц), 7,84 (м, 1H), 7,52 (д, 1H, J=5,4 Гц), 7,46-7,42 (м, 2H), 7,32-7,28 (м, 3H) и 7,00 (м, 2H).
E49 1-(4-Гидроксифенил)-2-((E)-пропенил)-1H-индол-3-карбонитрил
R1=(E)-пропенил
ES/MS m/z: 275,3 (положит.M+H), 273,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,65 (м, 1H), 7,32-7,23 (м, 4H), 7,10 (м, 2H), 7,06 (м, 1H), 6,85 (м, 1H), 6,26 (м, 1H) и 1,91 (дд, 3H, J=1,8, 6,9 Гц).
E50 1-(4-Гидроксифенил)-2-тиофен-2-ил-1H-индол-3-карбонитрил
R1=тиофен-2-ил
ES/MS m/z: 317,0 (положит.M+H), 315,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,73 (м, 1H), 7,65 (дд, 1H, J=1,1, 5,0 Гц), 7,54 (дд, 1H, J=1,1, 3,8 Гц), 7,37-7,29 (м, 4H), 7,15 (дд, 1H, J=3,8, 5,0 Гц), 7,11 (м, 1H) и 7,06 (м, 2H).
E51 2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=3,5-диметилизоксазол-4-ил
ES/MS m/z: 330,2 (положит.M+H), 328,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,78 (м, 1H), 7,42-7,32 (м, 3H), 7,28 (м, 2H), 7,00 (м, 2H), 2,36 (с, 3H) и 2,02 (с, 3H).
E52 1-(4-Гидроксифенил)-2-пиридин-4-ил-1H-индол-3-карбонитрил
R1=пиридин-4-ил
ES/MS m/z: 312,2 (положит.M+H), 310,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,35 (м, 2H), 7,38 (м, 1H), 7,20 (м, 2H), 6,98 (м, 2H), 6,82 (м, 1H), 6,79 (м, 2H) и 6,44 (м, 2H).
E53 1-(4-Гидроксифенил)-2-(1-метил-1H-пиррол-2-ил)-1H-индол-3-карбонитрил
R1=1-метил-1H-пиррол-2-ил
ES/MS m/z: 314,3 (положит.M+H), 312,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,75 (м, 1H), 7,38-7,32 (м, 2H), 7,29 (м, 1H), 7,20 (м, 2H), 6,95 (м, 2H), 6,83 (дд, 1H, J=1,9, 2,5 Гц), 6,24 (дд, 1H, J=1,9, 3,8 Гц), 6,09 (дд, 1H, J=2,5, 3,8 Гц) и 3,51 (с, 3H).
E54 1-(4-Гидроксифенил)-2-(3-метилтиофен-2-ил)-1H-индол-3-карбонитрил
R1=3-метилтиофен-2-ил
ES/MS m/z: 331,4 (положит.M+H), 329,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,77 (м, 1H), 7,56 (д, 1H, J=5,1 Гц), 7,40-7,34 (м, 2H), 7,27 (м, 1H), 7,21 (м, 2H), 6,97 (д, 1H, J=5,1 Гц), 6,95 (м, 2H) и 2,21 (с, 3H).
E55 1-(4-Гидроксифенил)-2-изопропиламино-1H-индол-3-карбонитрил
R1=изопропиламино
ES/MS m/z: 292,1 (положит.M+H), 290,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,34 (м, 1H), 7,25 (м, 2H), 7,09 (м, 1H), 7,06 (м, 2H), 6,95 (м, 1H), 6,70 (м, 1H), 4,33 (м, 1H) и 1,28 (д, 6H, J=6,5 Гц).
E56 2-Этиламино-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=этиламино
ES/MS m/z: 278,3 (положит.M+H), 276,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,33 (м, 1H), 7,26 (м, 2H), 7,09 (м, 1H), 7,06 (м, 2H), 6,95 (м, 1H), 6,70 (м, 1H), 3,65 (кв, 2H, J=7,4 Гц) и 1,27 (т, 3H, J=7,4 Гц).
E57 2-Бутиламино-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=бутиламино
ES/MS m/z: 306,2 (положит.M+H), 304,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,33 (м, 1H), 7,26 (м, 2H), 7,10-7,05 (м, 3H), 6,94 (м, 1H), 6,69 (м, 1H), 3,61 (м, 2H), 1,68 (м, 2H), 1,41 (м, 2H) и 0,92 (т, 3H, J=7,4 Гц).
E58 1-(4-Гидроксифенил)-2-пиперидин-1-ил-1H-индол-3-карбонитрил
R1=пиперидин-1-ил
ES/MS m/z: 317,9 (положит.M+H), 316,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,45 (м, 1H), 7,36 (м, 2H), 7,18 (м, 1H), 7,12-7,07 (м, 3H), 7,01 (м, 1H), 3,27 (м, 4H), 1,54 (м, 2H) и 1,49 (м, 4H).
E59 1-(4-Гидроксифенил)-2-пирролидин-1-ил-1H-индол-3-карбонитрил
R1=пирролидин-1-ил
ES/MS m/z: 304,4 (положит.M+H), 302,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,33-7,29 (м, 3H), 7,11 (м, 1H), 7,04 (м, 2H), 6,96 (м, 1H), 6,73 (м, 1H), 3,40 (м, 4H) и 1,87 (м, 4H).
E60 1-(4-Гидроксифенил)-2-морфолин-4-ил-1H-индол-3-карбонитрил
R1=морфолин-4-ил
ES/MS m/z: 320,3 (положит.M+H), 317,8 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,49 (м, 1H), 7,40 (м, 2H), 7,21 (м, 1H), 7,14 (м, 1H), 7,10 (м, 2H), 7,05 (м, 1H), 3,59 (м, 4H) и 3,28 (м, 4H).
E61 2-Диэтиламино-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=диэтиламино
ES/MS m/z: 306,2 (положит.M+H), 304,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,47 (м, 1H), 7,31 (м, 2H), 7,19 (м, 1H), 7,10 (м, 1H), 7,08 (м, 2H), 6,96 (м, 1H), 3,28 (кв, 4H, J=6,9 Гц) и 1,05 (т, 6H, J=6,9 Гц).
E62 2-Этинил-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=этинил
ES/MS m/z: 259,1 (положит.M+H), 257,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,74 (м, 1H), 7,44-7,37 (м, 4H), 7,26 (м, 1H), 7,10 (м, 2H) и 4,45 (с, 1H).
E63 1-(4-Гидроксифенил)-2-винил-1H-индол-3-карбонитрил
R1=винил
ES/MS m/z: 261,1 (положит.M+H), 259,0 (отрицат.M-H); 1Η-ЯМР (ацетон-d6, 500 МГц): 7,70 (м, 1H), 7,34-7,27 (м, 4H), 7,13-7,09 (м, 3H), 6,56 (дд, 1H, J=17,6, 11,6 Гц), 6,24 (дд, 1H, J=17,6, 0,6 Гц) и 5,69 (дд, 1H, J=11,6, 0,6 Гц).
E64 1-(4-Гидроксифенил)-1H-индол-2,3-дикарбонитрил
R1=циано
ES/MS m/z: 258,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,88 (м, 1H), 7,59 (м, 1H), 7,56 (м, 2H), 7,52 (м, 1H), 7,42 (м, 1H) и 7,15 (м, 2H).
Е65 1-(4-Гидроксифенил)-2-проп-1-инил-1H-индол-3-карбонитрил
R1=проп-1-инил
ES/MS m/z: 273,1 (положит.M+H), 271,1 (отрицат.M-H) 1H-ЯМР (ацетон-d6, 500 МГц): 7,68 (м, 1H), 7,38 (м, 2H), 7,36-7,33 (м, 2Н), 7,22 (м, 1H), 7,08 (м, 2Н) и 2,09 (с, 3Н).
E66 1-(4-Гидроксифенил)-2-пиридин-2-ил-1H-индол-3-карбонитрил
R1=пиридин-2-ил
ES/MS m/z: 312,1 (положит.M+H), 310,2 (отрицат.M-H) 1H-ЯМР (ацетон-d6, 500 МГц): 8,63 (м, 1H), 7,84-7,78 (м, 2H), 7,49 (м, 1H), 7,41-7,36 (м, 3H), 7,26 (м, 1H), 7,22 (м, 2H) и 6,96 (м, 2H).
E67 1-(4-Гидроксифенил)-2-(2-метилаллил)-1H-индол-3-карбонитрил
R1=2-метилаллил
ES/MS m/z: 289,1 (положит.M+H), 287,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,67 (м, 1H), 7,31-7,24 (м, 4H), 7,10-7,05 (м, 3H), 4,76 (с, 1H), 4,41 (с, 1H), 3,55 (с, 2H) и 1,66 (с, 3H).
E68 1-(4-Гидроксифенил)-2-((Z)-пропенил)-1H-индол-3-карбонитрил
R1=(Z)-пропенил
ES/MS m/z: 275,1 (положит.M+H), 273,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,71 (м, 1H), 7,33-7,27 (м, 4H), 7,17 (м, 1H), 7,06 (м, 2H), 6,20-6,12 (м, 2H) и 1,94 (д, 3H, J=5,3 Гц)
E69 2-(Бутилметиламино)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=бутилметиламино
ES/MS m/z: 320,3 (положит.M+H), 318,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,43 (м, 1H), 7,31 (м, 2H), 7,17 (м, 1H), 7,09-7,06 (м, 3H), 6,93 (м, 1H), 3,15 (м, 2H), 3,00 (с, 3H), 1,45 (м, 2H), 1,20 (м, 2H) и 0,83 (т, 3H, J=7,4 Гц).
E70 1-(4-Гидроксифенил)-2-((Z)-1-метилпропенил)-1H-индол-3-карбонитрил
R1=(Z)-1-метилпропенил
ES/MS m/z: 289,2 (положит.M+H), 287,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,70 (м, 1H), 7,33-7,27 (м, 4H), 7,22 (м, 1H), 7,05 (м, 2H), 5,90 (м, 1H), 1,78 (м, 3H) и 1,66 (м, 3H).
E71 1-(4-Гидроксифенил)-2-имидазол-1-ил-1H-индол-3-карбонитрил
R1=имидазол-1-ил
ES/MS m/z: 301,1 (положит.M+H), 299,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,85 (т, 1H, J=0,9 Гц), 7,79 (м, 1H), 7,47-7,40 (м, 2H), 7,34-7,31 (м, 3H), 7,26 (м, 1H), 7,06 (дд, 1H, J=0,9, 1,6 Гц) и 6,99 (м, 2H).
E72 1-(4-Гидроксифенил)-2-[1,2,4]триазол-1-ил-1H-индол-3-карбонитрил
R1=[1,2,4]триазол-1-ил
ES/MS m/z: 302,3 (положит.M+H), 300,4 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,73 (с, 1H), 8,15 (с, 1H), 7,84 (м, 1H), 7,49-7,46 (м, 2H), 7,33-7,28 (м, 3H) и 6,99 (м, 2H).
E73 2-(3,5-Диметилпиразол-1-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=3,5-диметилпиразол-1-ил
ES/MS m/z: 329,3 (положит.M+H), 327,4 (отрицат.M-H); 1Η-ЯМР (ацетон-d6, 500 МГц): 7,81 (м, 1H), 7,46-7,42 (м, 2H), 7,35 (м, 1H), 7,21 (м, 2H), 6,93 (м, 2H), 5,98 (с, 1H), 2,15 (с, 3H) и 2,12 (с, 3H).
E74 1-(4-Гидроксифенил)-2-пиразол-1-ил-1H-индол-3-карбонитрил
R1=пиразол-1-ил
ES/MS m/z: 301,4 (положит.M+H), 299,5 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,89 (д, 1H, J=2,6 Гц), 7,79 (м, 1H), 7,72 (д, 1H, J=1,8 Гц), 7,45-7,39 (м, 2H), 7,29-7,23 (м, 3H), 6,97 (м, 2H) и 6,47 (дд, 1H, J=1,8, 2,6 Гц).
E75 1-(4-Гидроксифенил)-2-(5-метилимидазол-1-ил)-1H-индол-3-карбонитрил
R1=5-метилимидазол-1-ил
ES/MS m/z: 315,2 (положит.M+H), 313,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,82 (м, 1H), 7,76 (д, 1H, J=0,9 Гц), 7,47-7,43 (м, 2H), 7,33-7,27 (м, 3H), 6,97 (м, 2H), 6,76 (м, 1H) и 2,13 (д, 3H, J=1,1 Гц).
E76 1-(4-Гидроксифенил)-2-(5-метилпиразол-1-ил)-1H-индол-3-карбонитрил
R1=5-метилпиразол-1-ил
ES/MS m/z: 315,2 (положит.M+H), 313,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,83 (м, 1H), 7,55 (д, 1H, J=1,3 Гц), 7,47-7,44 (м, 2H), 7,37 (м, 1H), 7,20 (м, 2H), 6,93 (м, 2H), 6,19 (м, 1H) и 2,22 (с, 3H).
E77 1-(4-Гидроксифенил)-2-(3-метилпиразол-1-ил)-1H-индол-3-карбонитрил
R1=3-метилпиразол-1-ил
ES/MS m/z: 315,2 (положит.M+H), 313,3 (положит.M+H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,76 (м, 1H), 7,69 (д, 1H, J=2,5 Гц), 7,42-7,36 (м, 2H), 7,27-7,23 (м, 3H), 6,98 (м, 2H), 6,25 (д, 1H, J=2,5 Гц) и 2,21 (с, 3H).
E78 1-(4-Гидроксифенил)-2-тиазол-2-ил-1H-индол-3-карбонитрил
R1=тиазол-2-ил
ES/MS m/z: 318,1 (положит.M+H), 316,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,99 (д, 1H, J=3,2 Гц), 7,81 (м, 1H), 7,76 (д, 1H, J=3,2 Гц), 7,42-7,37 (м, 4H) и 7,15-7,11 (м, 3H).
E79 1-(4-Гидроксифенил)-2-(2-метокситиазол-4-ил)-1H-индол-3-карбонитрил
R1=2-метокситиазол-4-ил
ES/MS m/z: 348,1 (положит.M+H), 346,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,75 (м, 1H), 7,37-7,31 (м, 4H), 7,11 (м, 1H), 7,07 (м, 2H), 6,68 (с, 1H) и 4,04 (с, 3H).
E80 1-(4-Гидроксифенил)-2-тиазол-4-ил-1H-индол-3-карбонитрил
R1=тиазол-4-ил
ES/MS m/z: 318,1 (положит.M+H), 316,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 9,08 (д, 1H, J=1,9 Гц), 7,78 (м, 1H), 7,41 (д, 1H, J=1,9 Гц), 7,39-7,33 (м, 2H), 7,29 (м, 2H), 7,17 (м, 1H) и 7,04 (м, 2H).
E81 1-(4-Гидроксифенил)-2-(3-метилбут-2-енил)-1H-индол-3-карбонитрил
R1=3-метилбут-2-енил
ES/MS m/z: 303,1 (положит.M+H), 301,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,64 (м, 1H), 7,30 (м, 2H), 7,29-7,21 (м, 2H), 7,09 (м, 2H), 7,03 (м, 1H), 5,11 (м, 1H), 3,54 (м, 2H), 1,62 (м, 3H) и 1,48 (с, 3H).
E82 2-((Е)-Бут-1-енил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=(Е)-Бут-1-енил
ES/MS m/z: 289,1 (положит.M+H), 287,2 (отрицат.M-H); 1H-ЯМР (CDCl3, 500 МГц): 7,73 (м, 1H), 7,28 (м, 1H), 7,22-7,19 (м, 3H), 7,04 (м, 2H), 7,02 (м, 2H), 6,92 (м, 1H), 6,11 (м, 1H), 2,23 (м, 2H) и 1,04 (т, 3H, J=7,1 Гц).
E83 1-(4-Гидроксифенил)-2-(5-метилтиофен-2-ил)-1H-индол-3-карбонитрил
R1=5-метилтиофен-2-ил
ES/MS m/z: 331,1 (положит.M+H), 329,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,70 (м, 1H), 7,35-7,28 (м, 5H), 7,09-7,05 (м, 3H), 6,82 (м, 1H) и 2,45 (с, 3H).
E84 2-(5-Ацетилтиофен-2-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=5-ацетилтиофен-2-ил
ES/MS m/z: 359,3 (положит.M+H), 357,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,85 (д, 1H, J=4,1 Гц), 7,77 (м, 1H), 7,57 (д, 1H, J=4,1 Гц), 7,41-7,34 (м, 4H), 7,15 (м, 1H), 7,08 (м, 2H) и 2,54 (с, 3H).
E85 1-(4-Гидроксифенил)-2-(1-метил-1H-пиразол-4-ил)-1H-индол-3-карбонитрил
R1=1-метил-1H-пиразол-4-ил
ES/MS m/z: 315,2 (положит.M+H), 313,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,73 (с, 1H), 7,67 (м, 1H), 7,35 (с, 1H), 7,32-7,28 (м, 3H), 7,26 (м, 1H), 7,09 (м, 2H), 7,07 (м, 1H) и 3,90 (с, 3H).
E86 2-(5-Хлортиофен-2-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=5-хлортиофен-2-ил
ES/MS m/z: 351,2 (положит.M+H), 349,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,74 (м, 1H), 7,45 (д, 1H, J=4,1 Гц), 7,39-7,32 (м, 4H) и 7,13-7,08 (м, 4H).
E87 1-(4-Гидроксифенил)-2-(4-метилтиофен-3-ил)-1H-индол-3-карбонитрил
R1=4-метилтиофен-3-ил
ES/MS m/z: 331,4 (положит.M+H), 329,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,76 (м, 1H), 7,59 (д, 1H, J=3,2 Гц), 7,39-7,33 (м, 2H), 7,29 (м, 1H), 7,21 (м, 2H), 7,18 (м, 1H), 6,93 (м, 2H) и 2,08 (д, 3H, J=0,9 Гц).
E88 1-(4-Гидроксифенил)-2-(4-метилтиофен-2-ил)-1H-индол-3-карбонитрил
R1=4-метилтиофен-2-ил
ES/MS m/z: 331,4 (положит.M+H), 329,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,71 (м, 1H), 7,39 (д, 1H, J=1,3 Гц), 7,36-7,29 (м, 2H), 7,27 (м, 2H), 7,22 (м, 1H), 7,08 (м, 1H), 7,04 (м, 2H) и 2,23 (д, 3H, J=0,9 Гц).
E89 2-(4-Цианотиофен-3-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=4-цианотиофен-3-ил
ES/MS m/z: 342,2 (положит.M+H), 340,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,49 (д, 1H, J=3,1 Гц), 7,98 (д, 1H, J=3,1 Гц), 7,81 (м, 1H), 7,44-7,39 (м, 2H), 7,31 (м, 1H), 7,26 (м, 2H) и 6,97 (м, 2H).
E90 1-(4-Гидроксифенил)-2-(2-метил-2H-пиразол-3-ил)-1H-индол-3-карбонитрил
R1=2-метил-2H-пиразол-3-ил
ES/MS m/z: 315,2 (положит.M+H), 313,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,80 (м, 1H), 7,45 (д, 1H, J=2,0 Гц), 7,43-7,39 (м, 2H), 7,32 (м, 1H), 7,27 (м, 2H), 6,97 (м, 2H), 6,42 (д, 1H, J=2,0 Гц) и 3,77 (с, 3H).
E91 1-(4-Гидроксифенил)-2-(1,3,5-триметил-1H-пиразол-4-ил)-1H-индол-3-карбонитрил
R1=1,3,5-триметил-1H-пиразол-4-ил
ES/MS m/z: 343,1 (положит.M+H), 341,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,73 (м, 1H), 7,36-7,30 (м, 3H), 7,17 (м, 2H), 6,94 (м, 2H), 3,69 (с, 3H), 2,11 (с, 3H) и 1,96 (с, 3H).
E92 2-(2-Ацетилпиррол-1-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=2-ацетилпиррол-1-ил
ES/MS m/z: 342,2 (положит.M+H), 340,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,76 (м, 1H), 7,44 (дд, 1H, J=1,6, 2,8 Гц), 7,42-7,37 (м, 2H), 7,23 (м, 1H), 7,13 (дд, 1H, J=1,6, 3,9 Гц), 7,09 (м, 2H), 6,88 (м, 2H), 6,41 (дд, 1H, J=2,8, 3,9 Гц) и 2,23 (с, 3H).
E93 2-(2-Этилпиррол-1-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=2-этилпиррол-1-ил
ES/MS m/z: 328,4 (положит.M+H), 326,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,78 (м, 1H), 7,44-7,39 (м, 2H), 7,30 (м, 1H), 7,22 (м, 2H), 6,93 (м, 2H), 6,88 (дд, 1H, J=2,9, 1,6 Гц), 6,11 (т, 1H, J=3,2 Гц), 5,95 (м, 1H), 2,49 (м, 1H), 2,37 (м, 1H) и 1,09 (т, 3H, J=7,5 Гц).
E94 2-(2-Цианопиррол-1-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=2-цианопиррол-1-ил
ES/MS m/z: 325,4 (положит.M+H), 323,5 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,85 (м, 1H), 7,49-7,46 (м, 3H), 7,32 (м, 1H), 7,28 (м, 2H), 7,11 (дд, 1H, J=4,1, 1,6 Гц), 6,99 (м, 2H) и 6,45 (дд, 1H, J=4,1, 2,9 Гц).
E95 1-(4-Гидроксифенил)-2-(2-метилпиррол-1-ил)-1H-индол-3-карбонитрил
R1=2-метилпиррол-1-ил
ES/MS m/z: 314,3 (положит.M+H), 312,4 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,78 (м, 1H), 7,44,7,39 (м, 2H), 7,31 (м, 1H), 7,22 (м, 2H), 6,94 (м, 2H), 6,85 (дд, 1H, J=3,0, 1,6 Гц), 6,07 (т, 1H, J=3,3 Гц), 5,92 (м, 1H) и 2,12 (д, 3H, J=0,7 Гц).
Примеры 96-159
Следующие соединения получали в соответствии с описанным выше общим способом 1. Все подробности экспериментов для каждой из отдельных стадий указанного общего способа описаны выше в примерах 1-5, 16 и 38-40.
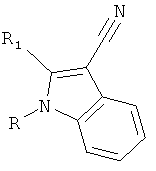
E96 1-(3-Хлор-5-фтор-4-гидроксифенил)-2-фенил-1H-индол-3-карбонитрил
R1=фенил; R=3-хлор-5-фтор-4-гидроксифенил
ES/MS m/z: 363,1 (положит.M+H), 361,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,77 (м, 1H), 7,56-7,53 (м, 2H), 7,50-7,45 (м, 3H), 7,41-7,34 (м, 4H) и 7,32 (дд, 1H, J=10,8, 2,5 Гц).
E97 1-(3-Хлор-5-фтор-4-гидроксифенил)-2-(3-цианотиофен-2-ил)-1H-индол-3-карбонитрил
R1=3-цианотиофен-2-ил; R=3-хлор-5-фтор-4-гидроксифенил
ES/MS m/z: 392,0, 394,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,00 (д, 1H, J=5,4 Гц), 7,84 (м, 1H), 7,56 (д, 1H, J=5,4 Гц) и 7,49-7,41 (м, 5H).
E98 1-(3-Хлор-5-фтор-4-гидроксифенил)-2-(3-цианофуран-2-ил)-1H-индол-3-карбонитрил
R1=3-цианофуран-2-ил; R=3-хлор-5-фтор-4-гидроксифенил
ES/MS m/z: 376,0, 378,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,97 (д, 1H, J=2,0 Гц), 7,86 (м, 1H), 7,52-7,44 (м, 5H) и 7,07 (д, 1H, J=2,0 Гц).
E99 2-Бром-1-(3-хлор-5-фтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=бром; R=3-хлор-5-фтор-4-гидроксифенил
ES/MS m/z: 362,0, 364,0, 366,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,70 (м, 1H), 7,54 (т, 1H, J=2,5 Гц), 7,50 (дд, 1H, J=2,5, 10,7 Гц), 7,39-7,34 (м, 2H) и 7,27 (м, 1H).
E100 2-Бром-1-(2-фтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=бром; R=2-фтор-4-гидроксифенил
ES/MS m/z: 331,1, 333,2 (положит.M+H), 328,9, 331,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,71 (м, 1H), 7,48 (м, 1H), 7,38-7,33 (м, 2H), 7,14 (м, 1H) и 6,98-6,93 (м, 2H).
E101 1-(2-Фтор-4-гидроксифенил)-2-фенил-1H-индол-3-карбонитрил
R1=фенил; R=2-фтор-4-гидроксифенил
ES/MS m/z: 329,3 (положит.M+H), 327,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,78 (м, 1H), 7,52-7,49 (м, 2H), 7,47-7,44 (м, 3H), 7,42-7,36 (м, 3H), 7,19 (м, 1H), 6,84 (м, 1H) и 6,77 (дд, 1H, J=2,7, 11,7 Гц).
E102 2-Бром-1-(3-фтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=бром; R=3-фтор-4-гидроксифенил
ES/MS m/z: 331,1, 333,2 (положит.M+H), 329,2, 331,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,70 (м, 1H), 7,46 (дд, 1H, J=2,5, 11,4 Гц), 7,38-7,32 (м, 2H), 7,31-7,25 (м, 2H) и 7,21 (м, 1H).
E103 2-Бром-1-(2,3-дифтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=бром; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 349,1, 351,2 (положит.M+H), 346,9, 349,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,72 (м, 1H), 7,40-7,34 (м, 3H), 7,22 (м, 1H) и 7,14 (м, 1H).
E104 2-Бром-1-(2,5-дифтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=бром; R=2,5-дифтор-4-гидроксифенил
ES/MS m/z: 349,1, 351,2 (положит.M+H), 346,9, 349,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,73 (м, 1H), 7,61 (дд, 1H, J=7,2, 10,6 Гц), 7,41-7,35 (м, 2H), 7,23 (м, 1H) и 7,16 (дд, 1H, J=7,6, 10,7 Гц).
E105 2-Бром-1-(3-хлор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=бром; R=3-хлор-4-гидроксифенил
ES/MS m/z: 347,0, 349,1, (положит.M+H), 344,8, 347,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,70 (м, 1H), 7,65 (д, 1H, J=2,5 Гц), 7,39 (дд, 1H, J=2,5, 8,5 Гц), 7,38-7,32 (м, 2H), 7,30 (д, 1H, J=8,5 Гц) и 7,20 (м, 1H).
E106 2-Бром-1-(3,5-дифтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=бром; R=3,5-дифтор-4-гидроксифенил
ES/MS m/z: 349,1, 351,2 (положит.M+H), 347,2, 349,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,70 (м, 1H), 7,40-7,34 (м, 4H) и 7,27 (м, 1H).
E107 1-(3-Фтор-4-гидроксифенил)-2-фенил-1H-индол-3-карбонитрил
R1=фенил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 329,3 (положит.M+H), 327,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,77 (м, 1H), 7,51 (м, 2H), 7,46-7,43 (м, 3H), 7,40-7,35 (м, 2H), 7,31-7,26 (м, 2H) и 7,14-7,07 (м, 2H).
E108 1-(3,5-Дифтор-4-гидроксифенил)-2-фенил-1H-индол-3-карбонитрил
R1=фенил; R=3,5-дифтор-4-гидроксифенил
ES/MS m/z: 347,2 (положит.M+H), 344,8 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,77 (м, 1H), 7,53 (м, 2H), 7,49-7,46 (м, 3H), 7,42-7,35 (м, 3H) и 7,19 (м, 2H).
E109 1-(3-Хлор-4-гидроксифенил)-2-фенил-1H-индол-3-карбонитрил
R1=фенил; R=3-хлор-4-гидроксифенил
ES/MS m/z: 344,9, 347,3 (положит.M+H), 343,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,77 (м, 1H), 7,52 (м, 2H), 7,48 (д, 1H, J=2,5 Гц), 7,47-7,44 (м, 3H), 7,41-7,35 (м, 2H), 7,29 (м, 1H), 7,22 (дд, 1H, J=2,5, 8,8 Гц) и 7,13 (д, 1H, J=8,8 Гц).
E110 1-(2,3-Дифтор-4-гидроксифенил)-2-фенил-1H-индол-3-карбонитрил
R1=фенил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 347,2 (положит.M+H), 344,8 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,80 (м, 1H), 7,52 (м, 2H), 7,49-7,46 (м, 3H), 7,43-7,38 (м, 2H), 7,29-7,25 (м, 2H) и 7,00 (м, 1H).
E111 1-(2,5-Дифтор-4-гидроксифенил)-2-фенил-1H-индол-3-карбонитрил
R1=фенил; R=2,5-дифтор-4-гидроксифенил
ES/MS m/z: 347,3 (положит.M+H), 344,8 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,79 (м, 1H), 7,54-7,51 (м, 3H), 7,50-7,46 (м, 3H), 7,43-7,37 (м, 2H), 7,27 (м, 1H) и 6,96 (дд, 1H, J=1,6, 10,7 Гц).
E112 1-(3,5-Дифтор-4-гидроксифенил)-2-тиофен-3-ил-1H-индол-3-карбонитрил
R1=тиофен-3-ил; R=3,5-дифтор-4-гидроксифенил
ES/MS m/z: 353,0 (положит.M+H), 351,4 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,74 (м, 1H), 7,71 (дд, 1H, J=1,3, 2,9 Гц), 7,59 (дд, 1H, J=2,9, 5,1 Гц), 7,40-7,34 (м, 2H), 7,30 (м, 1H) и 7,24-7,20 (м, 3H).
E113 1-(3,5-Дифтор-4-гидроксифенил)-2-тиофен-2-ил-1H-индол-3-карбонитрил
R1=тиофен-2-ил; R=3,5-дифтор-4-гидроксифенил
ES/MS m/z: 353,0 (положит.M+H), 351,4 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,74 (м, 1H), 7,71 (дд, 1H, J=1,2, 5,0 Гц), 7,54 (дд, 1H, J=1,2, 3,8 Гц), 7,40-7,34 (м, 2H), 7,30 (м, 2H), 7,25 (м, 1H) и 7,19 (дд, 1H, J=3,8, 5,0 Гц).
E114 1-(3,5-Дифтор-4-гидроксифенил)-2-(3,5-диметилизоксазол-4-ил)-1H-индол-3-карбонитрил
R1=3,5-диметилизоксазол-4-ил; R=3,5-дифтор-4-гидроксифенил
ES/MS m/z: 366,2 (положит.M+H), 364,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,78 (м, 1H), 7,45 (м, 1H), 7,44-7,40 (м, 2H), 7,22 (м, 2H), 2,41 (с, 3H) и 2,09 (с, 3H).
E115 1-(3,5-Дифтор-4-гидроксифенил)-2-(1-метил-1H-пиррол-2-ил)-1H-индол-3-карбонитрил
R1=1-метил-1H-пиррол-2-ил; R=3,5-дифтор-4-гидроксифенил
ES/MS m/z: 350,3 (положит.M+H), 348,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,76 (м, 1H), 7,41-7,36 (м, 3H), 7,15 (м, 2H), 6,90 (дд, 1H, J=1,8, 2,6 Гц), 6,27 (дд, 1H, J=1,8, 3,8 Гц), 6,12 (дд, 1H, J=2,6, 3,8 Гц) и 3,61 (с, 3H).
E116 1-(3,5-Дифтор-4-гидроксифенил)-2-(3-метилтиофен-2-ил)-1H-индол-3-карбонитрил
R1=3-метилтиофен-2-ил; R=3,5-дифтор-4-гидроксифенил
ES/MS m/z: 367,1 (положит.M+H), 365,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,77 (м, 1H), 7,61 (д, 1H, J=5,1 Гц), 7,42-7,36 (м, 3H), 7,16 (м, 2H), 7,02 (д, 1H, J=5,1 Гц) и 2,26 (с, 3H).
E117 1-(3,5-Дифтор-4-гидроксифенил)-2-(1-метил-1H-пиразол-4-ил)-1H-индол-3-карбонитрил
R1=1-метил-1H-пиразол-4-ил; R=3,5-дифтор-4-гидроксифенил
ES/MS m/z: 351,5 (положит.M+H), 349,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,79 (с, 1H), 7,68 (м, 1H), 7,50 (с, 1H), 7,35-7,28 (м, 2H), 7,25 (м, 2H), 7,18 (м, 1H) и 3,91 (с, 3H).
E118 1-(3,5-Дифтор-4-гидроксифенил)-2-пиридин-4-ил-1H-индол-3-карбонитрил
R1=пиридин-4-ил; R=3,5-дифтор-4-гидроксифенил
ES/MS m/z: 348,2 (положит.M+H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,70 (м, 2H), 7,81 (м, 1H), 7,49 (м, 2H), 7,45-7,39 (м, 3H) и 7,24 (м, 2H).
E119 1-(3-Хлор-4-гидроксифенил)-2-тиофен-3-ил-1H-индол-3-карбонитрил
R1=тиофен-3-ил; R=3-хлор-4-гидроксифенил
ES/MS m/z: 351,2 (положит.M+H), 349,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,74 (м, 1H), 7,67 (дд, 1H, J=1,3, 2,8 Гц), 7,57 (дд, 1H, J=2,8, 5,1 Гц), 7,52 (д, 1H, J=2,5 Гц), 7,39-7,32 (м, 2H), 7,27 (дд, 1H, J=2,5, 8,6 Гц), 7,23 (м, 1H), 7,20 (д, 1H, J=8,6 Гц) и 7,18 (дд, 1H, J=1,3, 5,1 Гц).
E120 1-(3-Хлор-4-гидроксифенил)-2-тиофен-2-ил-1H-индол-3-карбонитрил
R1=тиофен-2-ил; R=3-хлор-4-гидроксифенил
ES/MS m/z: 351,2 (положит.M+H), 349,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,74 (м, 1H), 7,68 (дд, 1H, J=1,3, 5,0 Гц), 7,58 (д, 1H, J=2,5 Гц), 7,56 (дд, 1H, J=1,3, 3,8 Гц), 7,39-7,31 (м, 3H), 7,24 (д, 1H, J=8,5 Гц) и 7,18-7,15 (м, 2H).
E121 1-(3-Хлор-4-гидроксифенил)-2-(3,5-диметилизоксазол-4-ил)-1H-индол-3-карбонитрил
R1=3,5-диметилизоксазол-4-ил; R=3-хлор-4-гидроксифенил
ES/MS m/z: 364,4 (положит.M+H), 362,5 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,78 (м, 1H), 7,53 (ушир.с, 1H), 7,43-7,36 (м, 3H), 7,27 (ушир.д, 1H, J=7,7 Гц), 7,19 (д, 1H, J=8,9 Гц), 2,39 (с, 3H) и 2,06 (с, 3H).
E122 1-(3-Хлор-4-гидроксифенил)-2-(1-метил-1H-пиррол-2-ил)-1H-индол-3-карбонитрил
R1=1-метил-1H-пиррол-2-ил; R=3-хлор-4-гидроксифенил
ES/MS m/z: 348,2 (положит.M+H), 346,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,75 (м, 1H), 7,43 (д, 1H, J=2,5 Гц), 7,40-7,35 (м, 2H), 7,32 (м, 1H), 7,22 (дд, 1H, J=2,5, 8,7 Гц), 7,14 (д, 1H, J=8,7 Гц), 6,87 (дд, 1H, J=1,9, 2,8 Гц), 6,25 (дд, 1H, J=1,9, 3,8 Гц), 6,10 (дд, 1H, J=2,8, 3,8 Гц) и 3,58 (с, 3H).
E123 1-(3-Хлор-4-гидроксифенил)-2-(3-метилтиофен-2-ил)-1H-индол-3-карбонитрил
R1=3-метилтиофен-2-ил; R=3-хлор-4-гидроксифенил
ES/MS m/z: 365,0 (положит.M+H), 363,4 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,77 (м, 1H), 7,59 (д, 1H, J=5,1 Гц), 7,46 (д, 1H, J=2,6 Гц), 7,41-7,36 (м, 2H), 7,30 (м, 1H), 7,22 (дд, 1H, J=2,6, 8,5 Гц), 7,14 (д, 1H, J=8,5 Гц), 7,00 (д, 1H, J=5,1 Гц) и 2,24 (с, 3H).
E124 1-(3-Хлор-4-гидроксифенил)-2-пиридин-4-ил-1H-индол-3-карбонитрил
R1=пиридин-4-ил; R=3-хлор-4-гидроксифенил
ES/MS m/z: 346,1 (положит.M+H), 343,9 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,68 (м, 2H), 7,81 (м, 1H), 7,55 (д, 1H, J=2,5 Гц), 7,47 (м, 2H), 7,44-7,41 (м, 2H), 7,34 (м, 1H), 7,27 (дд, 1H, J=2,5, 8,6 Гц) и 7,16 (д, 1H, J=8,6 Гц).
E125 1-(3-Фтор-4-гидроксифенил)-2-тиофен-3-ил-1H-индол-3-карбонитрил
R1=тиофен-3-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 335,6 (положит.M+H), 333,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,74 (м, 1H), 7,67 (дд, 1H, J=1,3, 2,8 Гц), 7,56 (дд, 1H, J=2,8, 5,0 Гц), 7,38-7,30 (м, 3H), 7,24 (м, 1H), 7,21-7,17 (м, 2H) и 7,13 (м, 1H).
E126 1-(3-Фтор-4-гидроксифенил)-2-тиофен-2-ил-1H-индол-3-карбонитрил
R1=тиофен-2-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 335,6 (положит.M+H), 333,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,73 (м, 1H), 7,68 (дд, 1H, J=1,3, 5,0 Гц), 7,54 (дд, 1H, J=1,3, 3,8 Гц), 7,39-7,32 (м, 3H) и 7,25-7,16 (м, 4H).
E127 2-(3,5-Диметилизоксазол-4-ил)-1-(3-фтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=3,5-диметилизоксазол-4-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 348,2 (положит.M+H), 346,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,79 (м, 1H), 7,43-7,39 (м, 3H), 7,32 (м, 1H), 7,20-7,13 (м, 2H), 2,39 (с, 3H) и 2,05 (с, 3H).
E128 1-(3-Фтор-4-гидроксифенил)-2-(1-метил-1H-пиррол-2-ил)-1H-индол-3-карбонитрил
R1=1-метил-1H-пиррол-2-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 332,3 (положит.M+H), 330,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,75 (м, 1H), 7,40-7,32 (м, 3H), 7,21 (дд, 1H, J=2,1, 11,3 Гц), 7,15-7,08 (м, 2H), 6,87 (дд, 1H, J=1,8, 2,5 Гц), 6,25 (дд, 1H, J=1,8, 3,8 Гц), 6,10 (дд, 1H, J=2,5, 3,8 Гц) и 3,56 (с, 3H).
E129 1-(3-Фтор-4-гидроксифенил)-2-(3-метилтиофен-2-ил)-1H-индол-3-карбонитрил
R1=3-метилтиофен-2-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 349,4 (положит.M+H), 347,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,77 (м, 1H), 7,59 (д, 1H, J=5,1 Гц), 7,41-7,36 (м, 2H), 7,32 (м, 1H), 7,25 (дд, 1H, J=2,4, 11,4 Гц), 7,15-7,08 (м, 2H), 7,00 (д, 1H, J=5,1 Гц) и 2,24 (с, 3H).
E130 1-(3-Фтор-4-гидроксифенил)-2-(1-метил-1H-пиразол-4-ил)-1H-индол-3-карбонитрил
R1=1-метил-1H-пиразол-4-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 333,2 (положит.M+H), 331,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,76 (ушир.с, 1H), 7,68 (м, 1H), 7,41 (д, 1H, J=0,6 Гц), 7,36-7,23 (м, 4H), 7,16 (м, 1H), 7,12 (м, 1H) и 3,91 (с, 3H).
E131 1-(3-Фтор-4-гидроксифенил)-2-пиридин-4-ил-1H-индол-3-карбонитрил
R1=пиридин-4-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 330,2 (положит.M+H), 328,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,68 (м, 2H), 7,81 (м, 1H), 7,47 (м, 2H), 7,44-7,40 (м, 2H), 7,37-7,33 (м, 2H) и 7,17-7,12 (м, 2H).
E132 2-Диметиламино-1-(2-фтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=диметиламино; R=2-фтор-4-гидроксифенил
ES/MS m/z: 296,3 (положит.M+H), 294,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,45-7,41 (м, 2H), 7,19 (м, 1H), 7,10 (м, 1H), 6,69-6,85 (м, 3H) и 2,96 (с, 6H).
E133 2-(3,5-Диметилизоксазол-4-ил)-1-(2-фтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=3,5-диметилизоксазол-4-ил; R=2-фтор-4-гидроксифенил
ES/MS m/z: 348,2 (положит.M+H), 346,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,80 (м, 1H), 7,47 (м, 1H), 7,42 (м, 1H), 7,27 (м, 1H), 6,88 (м, 1H), 6,83 (м, 1H), 2,34, 2,33 (2 с, 3H) и 2,10, 2,09 (2 с, 3H).
E134 1-(3-Фтор-4-гидроксифенил)-2-((E)-пропенил)-1H-индол-3-карбонитрил
R1=(E)-пропенил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 293,1 (положит.M+H), 291,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,66 (м, 1H), 7,35-7,25 (м, 4H), 7,16 (м, 1H), 7,11 (м, 1H), 6,86 (м, 1H), 6,29 (м, 1H) и 1,92 (дд, 3H, J=1,9, 6,9 Гц).
E135 1-(3-Фтор-4-гидроксифенил)-2-((Z)-пропенил)-1H-индол-3-карбонитрил
R1=(Z)-пропенил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 293,1(положит.M+H), 291,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,71 (м, 1H), 7,35-7,29 (м, 3H), 7,25-7,21 (м, 2H), 7,16 (м, 1H), 6,23-6,16 (м, 2H) и 1,94 (м, 3H).
E136 1-(2,3-Дифтор-4-гидроксифенил)-2-((Z)-пропенил)-1H-индол-3-карбонитрил
R1=(Z)-пропенил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 311,0 (положит.M+H), 309,1 (отрицат.M-H); 1H-ЯМР (CDCl3, 500 МГц): 7,79 (м, 1H), 7,35-7,28 (м, 2H), 7,08 (м, 1H), 7,05-6,96 (м, 2H), 6,17 (м, 1H), 6,10 (м, 1H) и 1,98 (дд, 3H, J=1,5, 6,9 Гц).
E137 1-(2,3-Дифтор-4-гидроксифенил)-2-винил-1H-индол-3-карбонитрил
R1=винил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 297,0 (положит.M+H), 295,1 (отрицат.M-H); 1H-ЯМР (CDCl3, 500 МГц): 7,78 (м, 1H), 7,34-7,27 (м, 2H), 7,08-6,99 (м, 3H), 6,46 (дд, 1H, J=11,7, 17,8 Гц), 6,31 (д, 1H, J=17,8 Гц) и 5,67 (д, 1H, J=11,7 Гц).
E138 1-(2,3-Дифтор-4-гидроксифенил)-2-тиофен-3-ил-1H-индол-3-карбонитрил
R1=тиофен-3-ил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 353,3 (положит.M+H), 351,4 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,77 (м, 1H), 7,70 (дд, 1H, J=1,3, 2,8 Гц), 7,61 (дд, 1H, J=2,8, 5,0 Гц), 7,41-7,35 (м, 2H), 7,31 (м, 1H), 7,25 (дд, 1H, J=1,3, 5,0 Гц), 7,23 (м, 1H) и 7,06 (м, 1H).
E139 1-(2,3-Дифтор-4-гидроксифенил)-2-тиофен-2-ил-1H-индол-3-карбонитрил
R1=тиофен-2-ил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 353,3 (положит.M+H), 351,4 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,76 (м, 1H), 7,71 (м, 1H), 7,60 (м, 1H), 7,42-7,32 (м, 3H), 7,21-7,19 (м, 2H) и 7,10 (м, 1H).
E140 1-(2,3-Дифтор-4-гидроксифенил)-2-(3-метилтиофен-2-ил)-1H-индол-3-карбонитрил
R1=3-метилтиофен-2-ил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 367,1 (положит.M+H), 365,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,80 (м, 1H), 7,60 (д, 1H, J=5,1 Гц), 7,44-7,39 (м, 2H9, 7,27 (м, 1H), 7,22 (м, 1H), 7,02 (д, 1H, J=5,1 Гц), 6,99 (м, 1H) и 2,28 (с, 3H).
E141 1-(2,3-Дифтор-4-гидроксифенил)-2-(1-метил-1H-пиррол-2-ил)-1H-индол-3-карбонитрил
R1=1-метил-1H-пиррол-2-ил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 350,3 (положит.M+H), 348,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,78 (м, 1H), 7,42-7,37 (м, 2H), 7,26-7,22 (м, 2H), 6,99 (м, 1H), 6,93 (дд, 1H, J=1,5, 2,9 Гц), 6,14 (дд, 1H, J=1,5, 3,8 Гц), 6,08 (дд, 1H, J=2,9, 3,8 Гц) и 3,70 (с, 3H).
E142 2-(2-Ацетилпиррол-1-ил)-1-(3-фтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=2-ацетилпиррол-1-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 360,2 (положит.M+H), 358,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,31 (м, 1H), 7,41 (д, 1H, J=5,2 Гц), 7,32-7,26 (м, 2H), 7,18 (м, 1H), 7,16-6,96 (м, 3H), 6,85 (д, 1H, J=5,2 Гц) и 2,09 (с, 3H).
E143 1-(3-Фтор-4-гидроксифенил)-2-пиррол-1-ил-1H-индол-3-карбонитрил
R1=пиррол-1-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 317,9 (положит.M+H), 316,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,74 (м, 1H), 7,43-7,37 (м, 2H), 7,31-7,29 (м, 2H), 7,16-7,14 (м, 2H), 6,97 (т, 2H, J=2,2 Гц) и 6,26 (т, 2H, J=2,2 Гц).
E144 1-(2,3-Дифтор-4-гидроксифенил)-2-пиррол-1-ил-1H-индол-3-карбонитрил
R1=пиррол-1-ил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 336,5 (положит.M+H), 334,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,77 (м, 1H), 7,46-7,40 (м, 2H), 7,31 (м, 1H), 7,27 (м, 1H), 7,02 (м, 1H), 6,99 (т, 2H, J=2,2 Гц) и 6,28 (т, 2H, J=2,2 Гц).
E145 1-(2,3-Дифтор-4-гидроксифенил)-2-проп-1-инил-1H-индол-3-карбонитрил
R1=проп-1-инил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 309,1 (положит.M+H), 307,2 (отрицат.M-H); 1H-ЯМР (CDCl3, 500 МГц): 7,74 (м, 1H), 7,34-7,30 (м, 2H), 7,12 (м, 1H), 7,05 (м, 1H), 6,98 (м, 1H) и 2,08 (с, 3H).
E146 1-(3-Фтор-4-гидроксифенил)-2-(2-метилпроп-1-енил)-1H-индол-3-карбонитрил
R1=2-метилпроп-1-енил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 307,1 (положит.M+H), 305,2 (отрицат.M-H); 1H-ЯМР (CDCl3, 500 МГц): 7,76 (м, 1H), 7,40-7,36 (м, 2H), 7,18-7,13 (м, 2H), 7,07 (м, 1H), 7,02 (м, 1H), 5,86 (м, 1H), 1,98 (д, 3H, J=1,3 Гц) и 1,91 (д, 3H, J=1,4 Гц).
E147 1-(2,3-Дифтор-4-гидроксифенил)-2-(2-метилпроп-1-енил)-1H-индол-3-карбонитрил
R1=2-метилпроп-1-енил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 325,1 (положит.M+H), 323,2 (отрицат.M-H); 1H-ЯМР (CDCl3, 500 МГц): 7,77 (м, 1H), 7,33-7,25 (м, 2H), 7,05-7,01 (м, 2H), 6,96 (м, 1H), 5,85 (м, 1H), 1,96 (д, 3H, J=1,2 Гц) и 1,91 (д, 3H, J=1,3 Гц).
E148 2-(2-Ацетилпиррол-1-ил)-1-(2,3-дифтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=2-ацетилпиррол-1-ил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 378,2 (положит.M+H), 376,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): две конформации в соотношении 2:1, 7,82-7,77 (м, 3H), 7,52 (дд, 1H, J=2,9, 1,6 Гц), 7,47-7,42 (м, 6H), 7,35-7,34 (м, 2H), 7,31 (м, 1H), 7,27-7,25 (м, 2H), 7,20 (дд, 2H, J=4,1, 1,6 Гц), 7,16 (дд, 1H, J=4,0, 1,6 Гц), 7,03-6,99 (м, 2H), 6,96-6,88 (м, 3H), 6,81 (м, 1H), 6,47 (дд, 1H, J=4,0, 2,8 Гц), 6,44 (дд, 2H, J=3,8, 2,8 Гц), 2,29 (с, 6H) и 2,21 (с, 3H).
E149 1-(3-Фтор-4-гидроксифенил)-2-пиразол-1-ил-1H-индол-3-карбонитрил
R1=пиразол-1-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 319,1 (положит.M+H), 317,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,98 (дд, 1H, 3=2,6, 0,6 Гц), 7,79 (м, 1H), 7,73 (д, 1H, J=1,8 Гц), 7,46-7,41 (м, 2H), 7,33 (м, 1H), 7,28 (м, 1H), 7,15-7,09 (м, 2H) и 6,51 (дд, 1H, J=2,5, 1,7 Гц).
E150 1-(2,3-Дифтор-4-гидроксифенил)-2-пиразол-1-ил-1H-индол-3-карбонитрил
R1=пиразол-1-ил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 337,4 (положит.M+H), 335,5 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,14 (д, 1H, J=2,6 Гц), 7,82 (м, 1H), 7,72 (д, 1H, J=1,6 Гц), 7,48-7,43 (м, 2H), 7,31 (м, 1H), 7,20 (м, 1H), 6,96 (м, 1H) и 6,56 (дд, 1H, J=2,6, 1,6 Гц).
E151 2-(2,5-Диметилпиррол-1-ил)-1-(3-фтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=2,5-диметилпиррол-1-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 346,1 (положит.M+H), 344,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,82 (м, 1H), 7,46-7,43 (м, 3H), 7,15-7,10 (м, 2H), 7,04 (м, 1H), 5,83 (с, 2H) и 2,06 (с, 6H).
E152 2-(2-Этилпиррол-1-ил)-1-(3-фтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=2-этилпиррол-1-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 346,1 (положит.M+H), 344,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,79 (м, 1H), 7,45-7,41 (м, 2H), 7,37 (м, 1H), 7,22 (м, 1H), 7,13-7,09 (м, 2H), 6,92 (дд, 1H, J=2,9, 1,6 Гц), 6,14 (т, 1H, J=3,3 Гц), 5,98 (м, 1H), 2,50 (м, 1H), 2,40 (м, 1H) и 1,10 (т, 3H, J=7,6 Гц).
E153 2-(2-Цианопиррол-1-ил)-1-(3-фтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=2-цианопиррол-1-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 343,1 (положит.M+H), 341,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,86 (м, 1H), 7,52-7,48 (м, 3H), 7,39 (м, 1H), 7,32 (м, 1H), 7,19-7,12 (м, 3H) и 6,48 (дд, 1H, J=3,9, 2,8 Гц).
E154 1-(3-Фтор-4-гидроксифенил)-2-(2-метилпиррол-1-ил)-1H-индол-3-карбонитрил
R1=2-метилпиррол-1-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 332,3 (положит.M+H), 330,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,79 (м, 1H), 7,45-7,41 (м, 2H), 7,37 (м, 1H), 7,23 (м, 1H), 7,14-7,09 (м, 2H), 6,88 (дд, 1H, J=3,1, 1,7 Гц), 6,09 (т, 1H, J=3,1 Гц), 5,95 (м, 1H) и 2,14 (д, 1H, J=0,9 Гц).
E155 1-(2,3-Дифтор-4-гидроксифенил)-2-(2-этилпиррол-1-ил)-1H-индол-3-карбонитрил
R1=2-этилпиррол-1-ил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 364,4 (положит.M+H), 362,5 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): две конформации в соотношении 1,5:1, 7,83-7,80 (м, 2,5H), 7,48-7,43 (м, 5H), 7,33-7,28 (м, 4H), 7,10 (м, 1H), 6,99-6,90 (м, 4H), 6,73 (м, 1H), 6,14-6,11 (м, 2,5H), 6,00-5,99 (м, 2,5H), 2,59-2,46 (м, 3,5H), 2,36 (м, 1,5H) и 1,17-1,13 (м, 7,5H).
E156 2-(2-Цианопиррол-1-ил)-1-(2,3-дифтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=2-цианопиррол-1-ил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 361,4 (положит.M+H), 359,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,88 (м, 1H), 7,55-7,50 (м, 2H), 7,46-7,33(м, 3H), 7,17 (дд, 1H, J=4,0, 1,5 Гц), 7,01 (м, 1H) и 6,49 (дд, 1H, J=3,8, 2,9 Гц).
E157 1-(2,3-Дифтор-4-гидроксифенил)-2-(2-метилпиррол-1-ил)-1H-индол-3-карбонитрил
R1=2-метилпиррол-1-ил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 350,3 (положит.M+H), 348,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,82 (м, 1H), 7,48-7,44 (м, 2H), 7,37 (м, 1H), 7,30 (м, 1H), 7,09-6,85 (м, 2H), 6,08 (м, 1H), 5,97 (м, 1H) и 1,20 (с, 3H).
E158 1-(2-Фтор-4-гидроксифенил)-2-пиррол-1-ил-1H-индол-3-карбонитрил
R1=пиррол-1-ил; R=2-фтор-4-гидроксифенил
ES/MS m/z: 317,9 (положит.M+H), 316,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,76 (м, 1H), 7,47 (т, 1H, J=8,8 Гц), 7,44-7,38 (м, 2H), 7,19 (м, 1H), 6,96 (м, 2H), 6,86 (м, 1H), 6,81 (дд, 1H, J=11,5, 2,5 Гц) и 6,27 (м, 2H).
E159 1-(2,3-дифтор-4-гидроксифенил)-2-(3-метилбут-2-енил)-1H-индол-3-карбонитрил
R1=3-метилбут-2-енил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 317,9 (положит.M+H), 316,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,76 (м, 1H), 7,47 (т, 1H, J=8,8 Гц), 7,44-7,38 (м, 2H), 7,19 (м, 1H), 6,96 (м, 2H), 6,86 (м, 1H), 6,81 (дд, 1H, J=11,5, 2,5 Гц) и 6,27 (м, 2H).
Примеры 160-195
Представленные ниже соединения примеров 160-162 получали в соответствии с описанным выше общим способом 1. Все подробности экспериментов для каждой из отдельных стадий указанного общего способа, применимые для синтеза соединений примеров 160-162, описаны выше в примерах 1-4, 8, 16 и 38-40.
Представленные ниже соединения примеров 163-168 и 170-172 получали в соответствии с описанным выше общим способом 4. Все подробности экспериментов для каждой из отдельных стадий указанного общего способа описаны выше в примерах 2-4, 9 и 20-21.
Представленные ниже соединения примеров 173-195 получали в соответствии с описанным выше общим способом 1. Все подробности экспериментов для каждой из отдельных стадий указанного общего способа, применимые для синтеза соединений примеров 173-195, описаны выше в примерах 1-4, 10-11, 14-16, 38-40 и 45.
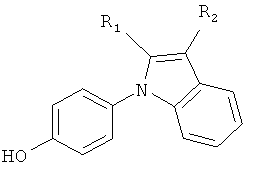
E160 [1-(4-Гидроксифенил)-2-фенил-1H-индол-3-ил]ацетонитрил
R1=фенил; R2=цианометил
ES/MS m/z: 325,1 (положит.M+H), 323,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,81 (м, 1H), 7,41-7,32 (м, 5H), 7,25-7,22 (м, 2H), 7,19 (м, 1H), 7,11 (м, 2H), 6,88 (м, 2H) и 3,97 (с, 2H).
E161 [1-(4-Гидроксифенил)-2-фенил-1H-индол-3-ил]уксусная кислота
R1=фенил; R2=карбоксиметил
ES/MS m/z: 344,1 (положит.M+H), 342,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,71 (м, 1H), 7,39-7,27 (м, 5H), 7,17,7,12 (м, 3H), 7,07 (м, 2H), 6,86 (м, 2H) и 3,74 (с, 2H).
E162 2-[1-(4-Гидроксифенил)-2-фенил-1H-индол-3-ил]ацетамид
R1=фенил; R=карбамоил
ES/MS m/z: 313,1 (положит.M+H), 311,2 (отрицат.M-H); 1H-ЯМР (CDCl3, 500 МГц): 7,68 (м, 1H), 7,32-7-23 (м, 6H), 7,20-7,18 (м, 2H), 7,06 (м, 2H), 6,81 (м, 2H) и 3,77 (с, 2H).
E163 4-(3-Изопропенил-2-фенилиндол-1-ил)фенол
R1=фенил; R=изопропенил
ES/MS m/z: 326,2 (положит.M+H), 324,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,72 (м, 1H), 7,31-7,25 (м, 5H), 7,16-7,11 (м, 3H), 7,07 (м, 2H), 6,86 (м, 2H), 5,27 (м, 1H), 5,15 (м, 1H) и 1,83 (м, 3H).
E164 4-[3-(2-Метил-2H-пиразол-3-ил)-2-фенилиндол-1-ил]фенол
R1=фенил; R2=2-метил-2H-пиразол-3-ил
ES/MS m/z: 366,2 (положит.M+H), 364,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,47-7,45 (м, 2H), 7,24-7,13 (м, 10H), 6,92 (м, 2H), 6,32 (д, 1H, J=1,9 Гц) и 3,33 (с, 3H).
E165 4-(2-Фенил-3-тиазол-4-илиндол-1-ил)фенол
R1=фенил; R2=тиазол-4-ил
ES/MS m/z: 369,1 (положит.M+H), 367,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 9,06 (д, 1H, J=2,0 Гц), 8,30 (м, 1H), 7,35-7,31 (м, 5H), 7,22-7,18 (м, 2H), 7,16-7,12 (м, 3H), 6,87 (м, 2H) и 6,81 (д, 1H, J=2,2 Гц).
E166 4-(2-Фенил-3-проп-1-инилиндол-1-ил)фенол
R1=фенил; R2=проп-1-инил
ES/MS m/z: 324,2 (положит.M+H), 322,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,70 (м, 1H), 7,48-7,46 (м, 2H), 7,34-7,26 (м, 3H), 7,21-7,18 (м, 2H), 7,16 (м, 1H), 7,11 (м, 2H), 6,91 (м, 2H) и 2,07 (с, 3H).
E167 1-(4-Гидроксифенил)-2-((E)-пропенил)-1H-индол-3-карбоновой кислоты амид
R1=(E)-пропенил; R2=карбамоил
ES/MS m/z: 293,1 (положит.M+H), 291,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,99 (м, 1H), 7,19 (м, 2H), 7,16-7,10 (м, 2H), 7,05 (м, 2H), 6,94 (м, 1H), 6,73 (м, 1H), 5,91 (м, 1H) и 1,73 (дд, 3H, J=1,3, 6,6 Гц).
E168 1-(4-Гидроксифенил)-2-(2-метилпроп-1-енил)-1H-индол-3-карбоновой кислоты амид
R1=2-метилпроп-1-енил; R2=карбамоил
ES/MS m/z: 307,2 (положит.M+H), 305,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,36 (м, 1H), 7,20 (м, 2H), 7,17-7,12 (м, 2H), 7,05 (м, 1H), 7,01 (м, 2H), 6,17 (м, 1H), 1,83 (д, 3H, J=1,4 Гц) и 1,65 (д, 3H, J=1,2 Гц).
E169 1-(4-Гидроксифенил)-2-((Z)-1-метилпропенил)-1H-индол-3-карбоновой кислоты амид
R1=(Z)-1-метилпропенил; R2=карбамоил
ES/MS m/z: 307,1 (положит.M+H), 305,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,41 (м, 1H), 7,23 (ушир.с, 2H), 7,19-7,13 (м, 2H), 7,03-7,00 (м, 3H), 5,91 (м, 1H), 1,89 (м, 3H) и 1,59 (м, 3H).
E170 4-(2-Фенил-3-пиразол-1-илиндол-1-ил)фенол
R1=фенил; R2=пиразол-1-ил
ES/MS m/z: 352,1 (положит.M+H), 350,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,68 (д, 1H, J=1,3 Гц), 7,57 (м, 1H), 7,51 (дд, 1H, J=0,6, 2,5 Гц), 7,27-7,17 (м, 10H), 6,92 (м, 2H) и 6,34 (т, 1H, J=2,1 Гц).
E171 4-(3-Имидазол-1-ил-2-фенилиндол-1-ил)фенол
R1=фенил; R2=имидазол-1-ил
ES/MS m/z: 352,2 (положит.M+H), 350,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,75 (ушир.с, 1H), 7,53 (м, 1H), 7,38-7,29 (м, 7H), 7,25-7,19 (м, 5H) и 6,91 (м, 2H).
E172 4-[3-(5-Метилпиразол-1-ил)-2-фенилиндол-1-ил]фенол
R1=фенил; R2=5-метилпиразол-1-ил
ES/MS m/z: 366,1 (положит.M+H), 364,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,61 (м, 1H), 7,34 (д, 1H, J=2,1 Гц), 7,25-7,15 (м, 10H), 6,91 (м, 2H), 6,11 (д, 1H, J=2,1 Гц) и 2,29 (с, 3H).
E173 2-Бром-1-(4-гидроксифенил)-1H-индол-3-карбоновой кислоты амид
R1=бром; R2=карбамоил
ES/MS m/z: 331,0, 333,0 (положит.M+H), 329,0, 331,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,22 (м, 1H), 7,28 (м, 2H), 7,22-7,17 (м, 2H), 7,08 (м, 2H) и 7,00 (м, 1H).
E174 1-(4-Гидроксифенил)-2-((Z)-3,3,3-трифторпропенил)-1H-индол-3-карбонитрил
R1=(Z)-3,3,3-трифторпропенил; R2=CN
ES/MS m/z: 329,1 (положит.M+H), 327,13 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,75 (м, 1H), 7,39-7,34 (м, 2H), 7,31 (м, 2H), 7,23 (м, 1H), 7,08 (м, 2H), 7,03 (д, 1H, J=12,2 Гц) и 6,43 (м, 1H).
E175 (Z)-2-бром-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид
R1=бром; R2=N-гидроксикарбамимидоил
ES/MS m/z: 346,1, 347,9 (положит.M+H), 343,9, 346,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,91-8,84 (с, OH), 7,98-7,95 (м, 1H), 7,27-7,23 (м, 2H), 7,17-7,10 (м, 2H), 7,09-7,05 (м, 2H), 7,00-6,97 (м, 1H), 5,49-5,38 (м, 2H).
E176 (Z)-N'-гидрокси-1-(4-гидроксифенил)-2-(1H-пиррол-1-ил)-1H-индол-3-карбоксимидамид
R1=пиррол-1-ил; R2=N-гидроксикарбамимидоил
ES/MS m/z: 333,2 (положит.M+H), 331,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,25-8,22 (м, 1H), 8,14-8,12 (с, OH), 7,25-7,16 (м, 4H), 7,10-7,06 (м, 1H), 6,92-6,90 (т, 2H), 6,90-6,86 (м, 2H), 6,16-6,14 (т, 2H), 4,71-4,53 (м, 2H).
E177 2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбоновой кислоты амид
R1=3,5-диметилизоксазол-4-ил; R2=карбамоил
ES/MS m/z: 348,2 (положит.M+H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,26 (м, 1H), 7,27-7,23 (м, 2H), 7,21-7,08 (м, 3H), 6,95 (м, 2H), 2,20 (с, 3H) и 2,06 (с, 3H).
E178 (Z)-N'-гидрокси-1-(4-гидроксифенил)-2-(2-метилпроп-1-енил)-1H-индол-3-карбоксимидамид
R1=2-метилпроп-1-енил; R2=N-гидроксикарбамимидоил
ES/MS m/z: 322,4 (положит.M+H), 320,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,14 (с, 1H), 7,99 (м, 1H), 7,29 (м, 2H), 7,13-7,05 (м, 5H) и 1,35 (с, 6H).
E179 1-(4-Гидроксифенил)-2-фенил-1H-индол-3-карбоновой кислоты гидроксиамид
R1=фенил; R2=гидроксикарбамоил
ES/MS m/z: 345,13 (положит.M+H), 343,13 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,04 (м, 1H), 7,38 (м, 2H), 7,34-7,31 (м, 3H), 7,23-7,20 (м, 2H), 7,13-7,08 (м, 3H) и 6,87 (м, 2H).
E180 (Z)-N'-гидрокси-1-(4-гидроксифенил)-2-фенил-1H-индол-3-карбоксимидамид
R1=фенил; R2=N-гидроксикарбамимидоил
ES/MS m/z: 344 (положит.M+H), 342,4 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,03 (м, 1H), 7,39 (м, 2H), 7,31-7,28 (м, 3H), 7,18-7,13 (м, 2H), 7,09-7,06 (м, 3H) и 6,85 (м, 2H).
E181 1-(4-Гидроксифенил)-2-пиррол-1-ил-1H-индол-3-карбоновой кислоты амид
R1=пиррол-1-ил; R2=карбамоил
ES/MS m/z: 318,15 (положит.M+H), 316,19 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,44 (м, 1H), 7,29-7,23 (м, 4H), 7,10 (м, 1H), 7,00 (т, 2H, J=2,1 Гц), 6,90 (м, 2H) и 6,24 (т, 2H, J=2,1 Гц).
E182 [1-(4-Гидроксифенил)-2-пиррол-1-ил-1H-индол-3-ил]карбаминовой кислоты сложный трет-бутиловый эфир
R1=пиррол-1-ил; R2=трет-бутоксикарбониламино
ES/MS m/z: 390,16 (положит.M+H), 388,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,59 (м, 1H), 7,22-7,15 (м, 3H), 7,11 (м, 2H), 6,89 (м, 2H), 6,77 (м, 2H), 6,09 (м, 2H) и 1,45 (с, 9H).
E183 2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-N-метил-1H-индол-3-карбоксамидин
R1=3,5-диметилизоксазол-4-ил; R2=N-метилкарбамимидоил
ES/MS m/z: 361,2 (положит.M+H), 359,2 (отрицат.M-H); 1H-ЯМР (метанол-d4, 500 МГц): 7,81 (м, 1H), 7,38-7,34 (м, 3H), 7,07 (ушир.с, 2H), 6,91 (м, 2H), 3,11 (с, 3H), 2,14 (с, 3H) и 1,96 (с, 3H).
E184 Метил-2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбимидат
R1=3,5-диметилизоксазол-4-ил; R2=имино(метокси)метил
ES/MS m/z: 362,3 (положит.M+H), 360,4 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц):8,26 (м, 1H), 7,27-7,04 (м, 5H), 6,96 (м, 2H), 3,04 (с, 3H), 2,21 (с, 3H) и 2,07 (с, 3H).
E185 N-((2-(3,5-Диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-ил)(имино)метил)ацетамид
R1=3,5-диметилизоксазол-4-ил; R2=(имино)метилацетамид
ES/MS m/z: 1H-ЯМР (ацетон-d6, 500 МГц): 8,38 (м, 1H), 7,34-7,29 (м, 2H), 7,25-7,20 (м, 3H), 6,97 (м, 2H), 2,59 (с, 3H), 2,17 (с, 3H) и 1,97 (с, 3H).
E186 2-(5-Этил-3-метилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбоксамид
R1=5-этил-3-метилизоксазол-4-ил; R2=карбамоил
ES/MS m/z: 362,3 (положит.M+H), 360,4 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,27 (м, 1H), 7,27-7,07 (м, 5H), 6,96 (м, 2H), 2,58 (м, 2H), 2,09 (с, 3H) и 1,04 (т, 3H, J=7,6 Гц).
E187 (Z)-2-(2-Этил-1H-пиррол-1-ил)-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид
R1=2-этил-1H-пиррол-1-ил; R2=N-гидроксикарбамимидоил
ES/MS m/z: 361,23 (положит.M+H), 359,35 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,34 (д, 1H, J=7,9 Гц), 7,24 (м, 1H), 7,20-7,17 (м, 3H), 7,11 (м, 1H), 6,91-6,87 (м, 3H), 6,13 (т, 1H, J=3,2 Гц), 5,91 (м, 1H), 2,35 (м, 1H), 2,25 (м, 1H) и 1,06 (т, 3H, J=7,6 Гц).
E188 (Z)-N'-Гидрокси-1-(4-гидроксифенил)-2-(2-метил-1H-пиррол-1-ил)-1H-индол-3-карбоксимидамид
R1=2-метил-1H-пиррол-1-ил; R2=N-гидроксикарбамимидоил
ES/MS m/z: 347,18 (положит.M+H), 345,25 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,33 (д, 1H, J=7,8 Гц), 7,24 (м, 1H), 7,20-7,17 (м, 3H), 7,12 (м, 1H), 6,91-6,87 (м, 3H), 6,08 (т, 1H, J=3,0 Гц), 5,88 (м, 1H) и 1,99 (с, 3H).
E189 1-(4-Гидроксифенил)-2-(2-метил-1H-пиррол-1-ил)-1H-индол-3-карбоксамид
R1=2-метил-1H-пиррол-1-ил; R2=карбамоил
ES/MS m/z: 332,16 (положит.M+H), 330,21 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,50 (м, 1H), 7,31-7,27 (м, 2H), 7,25 (м, 2H), 7,14 (м, 1H), 6,98 (м, 1H), 6,93 (м, 2H), 6,16 (т, 1H, J=3,4 Гц), 5,96 (м, 1H) и 2,00 (с, 3H).
E190 4-(3-Хлор-2-(3,5-диметилизоксазол-4-ил)-1H-индол-1-ил)фенол
R1=3,5-диметилизоксазол-4-ил; R2=Cl
ES/MS m/z: 339,1/341,1 (положит.M+H), 337,2/339,2 (отрицат.M-H); 1H-ЯМР (CDCl3, 500 МГц): 7,72 (м, 1H), 7,32-7,27 (м, 3H), 7,02 (м, 2H9, 6,86 (м, 2H), 2,24 (с, 3H) и 1,99 (с, 3H).
E191 (Z)-2-((Z)-Бут-2-ен-2-ил)-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид
R1=(Z)-бут-2-ен-2-ил; R2=N-гидроксикарбамимидоил
ES/MS m/z: 322,19 (положит.M+H), 320,27 (отрицат.M-H); 1H-ЯМР (метанол-d3, 500 МГц): 7,69 (м, 1H), 7,30-7,24 (м, 2H), 7,19-7,10 (м, 3H), 6,94 (м, 2H), 5,85 (м, 1H), 1,79 (т, 3H, J=1,3 Гц) и 1,57 (м, 3H).
E192 (Z)-N'-Гидрокси-1-(4-гидроксифенил)-2-(5-метил-1H-пиразол-1-ил)-1H-индол-3-карбоксимидамид
R1=5-метил-1H-пиразол-1-ил; R2=N-гидроксикарбамимидоил
ES/MS m/z: 348,22 (положит.M+H), 346,23 (отрицат.M-H); 1H-ЯМР (метанол-d3, 500 МГц): 8,10 (д, 1H, J=8,1 Гц), 7,59 (д, 1H, J=1,9 Гц), 7,32-7,21 (м, 3H), 7,08 (м, 2H), 6,78 (м, 2H), 6,14 (м, 1H) и 2,02 (с, 3H).
E193 (Z)-N'-Гидрокси-1-(4-гидроксифенил)-2-(4-метилтиофен-3-ил)-1H-индол-3-карбоксимидамид
R1=4-метилтиофен-3-ил; R2=N-гидроксикарбамимидоил
ES/MS m/z: 364,17 (положит.M+H), 362,2 (отрицат.M-H); 1H-ЯМР (метанол-d3, 500 МГц): 7,88 (м, 1H), 7,33 (д, 1H, J=3,2 Гц), 7,23-7,20 (м, 2H), 7,17 (м, 1H), 7,02-6,99 (м, 3H), 6,78 (м, 2H) и 1,99 (с, 3H).
E194 (Z)-2-(2,5-Диметил-1H-пиррол-1-ил)-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид
R1=2,5-диметил-1H-пиррол-1-ил; R2=N-гидроксикарбамимидоил
ES/MS m/z: 361,4 (положит.M+H), 359,5 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,38 (м, 1H), 7,25 (м, 1H), 7,21-7,18 (м, 2H), 7,12 (м, 2H), 6,91 (м, 2H), 5,80 (с, 2H) и 2,00 (с, 6H).
E195 (Z)-N'-Гидрокси-1-(4-гидроксифенил)-2-фенокси-1H-индол-3-карбоксимидамид
R1=фенокси; R2=N-гидроксикарбамимидоил
ES/MS m/z: 360,18 (положит.M+H), 358,22 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,24 (м, 1H), 7,25-7,14 (м, 6H), 7,09 (м, 1H), 7,00 (м, 1H) и 6,90-6,85 (м, 4H).
Примеры 196-210
Представленные ниже соединения примеров 196-210 получали в соответствии с описанным выше общим способом 1. Все подробности экспериментов для каждой из отдельных стадий указанного общего способа, применимые для синтеза соединений примеров 196-210, описаны выше в примерах 1-4, 8, 16 и 38-40.
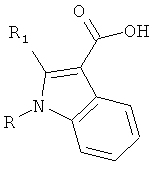
E196 1-(4-Гидроксифенил)-2-фенил-1H-индол-3-карбоновая кислота
R1=фенил; R=карбокси
ES/MS m/z: 330,1 (положит.M+H), 328,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,31 (м, 1H), 7,38-7,36 (м, 2H), 7,29-7,24 (м, 4H), 7,22 (м, 1H), 7,11-7,08 (м, 3H) и 6,88 (м, 2H).
E197 2-(3,5-Диметилизоксазол-4-ил)-1-(3-фтор-4-гидроксифенил)-1H-индол-3-карбоновая кислота
R1=3,5-диметилизоксазол-4-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 367,1 (положит.M+H), 365,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,31 (м, 1H), 7,33-7,28 (м, 2H), 7,23 (м, 1H), 7,21-6,95 (м, 3H), 2,19 (с, 3H) и 2,07 (с, 3H).
E198 2-(3,5-Диметилизоксазол-4-ил)-1-(2-фтор-4-гидроксифенил)-1H-индол-3-карбоновая кислота
R1=3,5-диметилизоксазол-4-ил; R=2-фтор-4-гидроксифенил
ES/MS m/z: 367,1 (положит.M+H), 365,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,32 (д, 1H, J=7,3 Гц), 7,46 (т, 1H, J=8,8 Гц), 7,34-7,25 (м, 2H), 7,13 (м, 1H), 6,89-6,77 (м, 2H), 2,16, 2,15 (2 с, 3H) и 2,07, 2,06 (2 с, 3H).
E199 1-(2,3-Дифтор-4-гидроксифенил)-2-(3,5-диметилизоксазол-4-ил)-1H-индол-3-карбоновая кислота
R1=3,5-диметилизоксазол-4-ил; R=2,3-дифтор-4-гидроксифенил
ES/MS m/z: 385,1 (положит.M+H), 383,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,32 (д, 1H, J=7,6 Гц), 7,36-7,28 (м, 3H), 7,17 (м, 1H), 7,03 (м, 1H), 2,20, 2,17 (2 с, 3H) и 2,08, 2,05 (2 с, 3H).
E200 1-(4-Гидроксифенил)-2-((Z)-пропенил)-1H-индол-3-карбоновая кислота
R1=(Z)-пропенил; R=4-гидроксифенил
ES/MS m/z: 294,1 (положит.M+H), 292,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,24 (м, 1H), 7,25 (м, 2H), 7,23 (м, 1H), 7,19 (м, 1H), 7,14 (м, 1H), 7,03 (м, 2H), 6,42 (м, 1H), 5,86 (м, 1H) и 1,46 (дд, 3H, J=1,9, 7,1 Гц).
E201 1-(4-Гидроксифенил)-2-((E)-пропенил)-1H-индол-3-карбоновая кислота
R1=(E)-пропенил; R=4-гидроксифенил
ES/MS m/z: 294,1 (положит.M+H), 292,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,20 (м, 1H), 7,24 (м, 2H), 7,22-7,18 (м, 2H), 7,15 (м, 1H), 7,08 (м, 2H), 6,94 (м, 1H), 5,72 (м, 1H) и 1,72 (дд, 3H, J=1,8, 6,7 Гц).
E202 1-(4-Гидроксифенил)-2-(2-метилпроп-1-енил)-1H-индол-3-карбоновая кислота
R1=2-метилпроп-1-енил; R=4-гидроксифенил
ES/MS m/z: 308,1 (положит.M+H), 306,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,23 (м, 1H), 7,24-7,20 (м, 3H), 7,17 (м, 1H), 7,12 (м, 1H), 7,02 (м, 2H), 6,17 (м, 1H), 1,75 (д, 3H, J=1,3 Гц) и 1,48 (д, 3H, J=1,2 Гц).
E203 1-(4-Гидроксифенил)-2-(2-метилаллил)-1H-индол-3-карбоновая кислота
R1=2-метилаллил; R=4-гидроксифенил
ES/MS m/z: 308,1 (положит.M+H), 306,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,21 (м, 1H), 7,24 (м, 2H), 7,21 (м, 1H), 7,15 (м, 1H), 7,05 (м, 2H), 6,97 (м, 1H), 4,65 (м, 1H), 4,24 (м, 1H), 3,83 (с, 2H) и 1,62 (с, 3H).
E204 1-(4-Гидроксифенил)-2-((Z)-1-метилпропенил)-1H-индол-3-карбоновая кислота
R1=(Z)-1-метилпропенил; R=4-гидроксифенил
ES/MS m/z: 308,1 (положит.M+H), 306,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,24 (м, 1H), 7,26-7,21 (м, 3H), 7,17 (м, 1H), 7,05 (м, 1H), 7,02 (м, 2H), 5,59 (м, 1H), 1,92 (м, 3H) и 1,39 (м, 3H).
E205 1-(3-Фтор-4-гидроксифенил)-2-тиофен-3-ил-1H-индол-3-карбоновая кислота
R1=тиофен-3-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 354,2 (положит.M+H), 352,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,29 (м, 1H), 7,48 (дд, 1H, J=1,3, 2,9 Гц), 7,36 (дд, 1H, J=3,2, 5,1 Гц), 7,28 (м, 1H), 7,24 (м, 1H), 7,17-7,12 (м, 3H), 7,08 (дд, 1H, J=8,4, 9,3 Гц) и 7,00 (м, 1H).
E206 1-(3-Фтор-4-гидроксифенил)-2-тиофен-2-ил-1H-индол-3-карбоновая кислота
R1=тиофен-2-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 354,2 (положит.M+H), 352,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,29 (м, 1H), 7,54 (дд, 1H, J=1,3, 5,0 Гц), 7,31-7,25 (м, 2H), 7,22-7,19 (м, 2H), 7,13 (м, 1H), 7,09 (м, 1H), 7,04 (м, 1H) и 7,00 (дд, 1H, J=3,5, 5,0 Гц).
E207 1-(3-Фтор-4-гидроксифенил)-2-(1-метил-1H-пиррол-2-ил)-1H-индол-3-карбоновая кислота
R1=1-метил-1H-пиррол-2-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 351,5 (положит.M+H), 349,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,30 (м, 1H), 7,31-7,25 (м, 2H), 7,17 (м, 1H), 7,16-6,93 (м, 3H), 6,75 (м, 1H) и 5,96-5,93 (м, 2H).
E208 1-(3-Фтор-4-гидроксифенил)-2-(3-метилтиофен-2-ил)-1H-индол-3-карбоновая кислота
R1=3-метилтиофен-2-ил; R=3-фтор-4-гидроксифенил
ES/MS m/z: 368,0 (положит.M+H), 366,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,31 (м, 1H), 7,41 (д, 1H, J=5,1 Гц), 7,32-7,26 (м, 2H), 7,18 (м, 1H), 7,16-6,97 (м, 3H), 6,85 (д, 1H, J=5,1 Гц) и 2,09 (с, 3H).
E209 2-Бром-1-(4-гидроксифенил)-1H-индол-3-карбоновая кислота
R1=бром; R=4-гидроксифенил
ES/MS m/z: 332,0, 334,0 (положит.M+H), 330,0, 332,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,22 (м, 1H), 7,32-7,20 (м, 4H) и 7,12-7,01 (м, 3H).
E210 1-(4-Гидроксифенил)-2-пиррол-1-ил-1H-индол-3-карбоновая кислота
R1=пиррол-1-ил; R2=карбокси
ES/MS m/z: 319,15 (положит.M+H), 317,16 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,03 (м, 1H), 7,39 (м, 2H), 7,31-7,28 (м, 3H), 7,18-7,13 (м, 2H), 7,09-7,06 (м, 3H) и 6,85 (м, 2H).
Пример 211
Представленное ниже соединение примера 211 получали в соответствии с описанным выше общим способом 1. Все подробности экспериментов для каждой из отдельных стадий указанного общего способа, применимые для синтеза соединения примера 211, описаны выше в примерах 1-5, 16 и 38-40.
E211 2,7-Дибром-1-(2,5-дифтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R1=бром; R2=циано; R=2,5-дифтор-4-гидроксифенил; R4=бром
ES/MS m/z: 426,8 428,9 431,3 (положит.M+H), 425,0 427,1 429,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,77 (м, 1H), 7,44-7,37 (м, 2H) и 7,25-7,21 (м, 2H).
Примеры 212-228
Представленные ниже соединения примеров 212-228 получали в соответствии с описанным выше общим способом 2. Все подробности экспериментов для каждой из отдельных стадий указанного общего способа, применимые для синтеза соединений примеров 212-228, описаны выше в примерах 2-4, 8, 16, 24 и 38-40.
E212 2-Бром-4-фтор-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=Br; R2=CN; R3=F; R4=H
ES/MS m/z: 332,97 (положит.M+H), 331,01 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,40 (м, 2H), 7,30 (м, 1H), 7,12 (м, 2H), 7,07 (дд, 1H, J=10,4, 8,2 Гц) и 6,98 (д, 1H, J=8,2 Гц).
E213 4-Фтор-1-(4-гидроксифенил)-2-пиррол-1-ил-1H-индол-3-карбонитрил
R1=пиррол-1-ил; R2=CN; R3=F; R4=H
ES/MS m/z: 318,1 (положит.M+H), 316,14 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,34 (м, 1H), 7,29 (м, 2H), 7,11 (дд, 1H, J=10,4, 8,0 Гц), 7,06 (д, 1H, J=8,3 Гц), 6,99 (м, 2H), 6,96 (т, 2H, J=2,2 Гц) и 6,24 (т, 2H, J=2,2 Гц).
E214 4-Фтор-1-(4-гидроксифенил)-2-фенил-1H-индол-3-карбонитрил
R1=фенил; R2=CN; R3=F; R4=H
ES/MS m/z: 329,11 (положит.M+H), 327,15 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,51 (м, 2H), 7,45-7,42 (м, 3H), 7,31 (м, 1H), 7,25 (м, 2H), 7,09-7,06 (м, 2H) и 6,95 (м, 2H).
E215 2-(3,5-Диметилизоксазол-4-ил)-4-фтор-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=3,5-Диметилизоксазол-4-ил; R2=CN; R3=F; R4=H
ES/MS m/z: 348,11 (положит.M+H), 346,15 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,36 (м, 1H), 7,30 (ушир.с, 2H), 7,17 (д, 1H, J=8,3 Гц), 7,11 (дд, 1H, J=10,4, 7,8 Гц), 7,01 (м, 2H), 2,38 (с, 3H) и 2,05 (с, 3H).
E216 4-Фтор-1-(4-гидроксифенил)-2-(2-метилпроп-1-енил)-1H-индол-3-карбонитрил
R1=2-метилпроп-1-енил; R2=CN; R3=F; R4=H
ES/MS m/z: 307,14 (положит.M+H), 305,15 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,28 (м, 2H), 7,24 (м, 1H), 7,06 (м, 2H), 7,00 (дд, 1H, J=10,5, 8,2), 6,97 (д, 1H, J=8,2 Гц), 5,96 (м, 1H), 1,94 (д, 3H, J=1,2 Гц) и 1,90 (д, 3H, J=1,4 Гц).
E217 5-Фтор-1-(4-гидроксифенил)-2-фенил-1H-индол-3-карбонитрил
R1=фенил; R2=CN; R3=H; R4=F
ES/MS m/z: 329,3 (положит.M+H), 327,4 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,50-7,42 (м, 6H), 7,27-7,22 (м, 3H), 7,14 (м, 1H) и 6,95 (м, 2H).
E218 2-(3,5-Диметилизоксазол-4-ил)-5-фтор-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=3,5-Диметилизоксазол-4-ил; R2=CN; R3=H; R4=F
ES/MS m/z: 348,2 (положит.M+H), 346,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,50 (дд, 1H, J=8,8, 2,2 Гц), 7,37 (дд, 1H, J=9,1, 4,4 Гц), 7,29 (м, 2H), 7,19 (м, 1H), 7,00 (м, 2H), 2,36 (с, 3H) и 2,02 (с, 3H).
E219 5-Фтор-1-(4-гидроксифенил)-2-пиррол-1-ил-1H-индол-3-карбонитрил
R1=2-пиррол-1-ил; R2=CN; R3=H; R4=F
ES/MS m/z: 317,9 (положит.M+H), 316,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,46 (дд, 1H, J=8,8, 2,5 Гц), 7,29-7,24 (м, 3H), 7,16 (м, 1H), 6,99 (м, 2H), 6,94 (т, 2H, J=2,2 Гц) и 6,24 (т, 2H, J=2,2 Гц).
E220 5-Фтор-1-(4-гидроксифенил)-2-(2-метилпроп-1-енил)-1H-индол-3-карбонитрил
R1=2-метилпроп-1-енил; R2=CN; R3=H; R4=F
ES/MS m/z: 307,4 (положит.M+H), 305,5 (отрицат.M-Н); 1H-ЯМР (ацетон-d6, 500 МГц): 7,38 (дд, 1H, J=9,0, 2,5 Гц), 7,27 (м, 2H), 7,15 (дд, 1H, J=9,0, 4,3 Гц), 7,09-7,04 (м, 3H), 5,97 (м, 1H), 1,93 (д, 3H, J=1,2 Гц) и 1,90 (д, 3H, J=1,6 Гц).
E221 (Z)-2-(3,5-Диметилизоксазол-4-ил)-5-фтор-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид
R1=3,5-диметилизоксазол-4-ил; R2=N-гидроксикарбамимидоил; R3=H; R4=F
ES/MS m/z: 381,2 (положит.M+H), 379,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,79 (дд, 1H; J=10,0, 2,5 Гц), 7,17-7,10 (м, 3H), 7,01 (м, 1H), 6,94 (м, 2H), 2,17 (с, 3H) и 2,01 (с, 3H).
E222 (Z)-2-(3,5-Диметилизоксазол-4-ил)-4-фтор-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид
R=3,5-диметилизоксазол-4-ил; R2=N-гидроксикарбамимидоил; R3=F; R4=H
ES/MS m/z: 381,5 (положит.M+H), 379,3 (отрицат.M-H).
E223 (Z)-5-Фтор-N'-гидрокси-1-(4-гидроксифенил)-2-(2-метилпроп-1-енил)-1H-индол-3-карбоксимидамид
R1=2-метилпроп-1-енил; R2=N-гидроксикарбамимидоил; R3=H; R4=F
ES/MS m/z: 340,4 (положит.M+H), 338,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,84 (дд, 1H, J=10,4, 2,7 Гц), 7,17 (м, 2H), 7,02-6,99 (м, 3H), 6,89 (м, 1H), 6,08 (м, 1H), 1,80 (д, 3H, J=1,4 Гц) и 1,65 (д, 3H, J=1,1 Гц).
E224 4-Хлор-2-(3,5-диметилизоксазол-4-ил)-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=3,5-диметилизоксазол-4-ил; R2=CN; R3=Cl; R4=H
ES/MS m/z: 362,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,35-7,26 (м, 3H), 7,15 (ушир.с, 2H), 6,90 (м, 2H), 2,32 (с, 3H) и 2,00 (с, 3H).
E225 2-(3,5-Диметилизоксазол-4-ил)-4,5-дифтор-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=3,5-диметилизоксазол-4-ил; R2=CN; R3=F; R4=F
ES/MS m/z: 366,2 (положит.M+H), 364,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,41-7,28 (м, 3H), 7,17 (м, 1H), 7,01 (м, 2H), 2,38 (с, 3H) и 2,04 (с, 3H).
E226 2-(4-Циано-1-метил-1H-пиразол-5-ил)-4-фтор-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=4-циано-1-метил-1H-пиразол-5-ил; R2=CN; R3=F; R4=H
ES/MS m/z: 366,2 (положит.M+H), 364,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,41-7,28 (м, 3H), 7,17 (м, 1H), 7,01 (м, 2H), 2,38 (с, 3H) и 2,04 (с, 3H).
E227 2-(3,5-Диметилизоксазол-4-ил)-5-фтор-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид
R1=3,5-диметилизоксазол-4-ил; R2=карбамимидоил; R3=H; R4=F
ES/MS m/z: 365,15 (положит.M+H), 363,19 (отрицат.M-H); 1H-ЯМР (метанол-d3, 500 МГц): 7,54 (дд, 1H, J=9,1, 2,2 Гц), 7,34 (дд, 1H, J=93, 4,5 Гц), 7,15 (м, 1H), 7,05 (ушир.с, 2H), 6,91 (м, 2H), 2,15 (с, 3H) и 2,00 (с, 3H).
E228 2-(3,5-Диметилизоксазол-4-ил)-5-фтор-1-(4-гидроксифенил)-1H-индол-3-карбоксамид
R1=3,5-диметилизоксазол-4-ил; R2=карбамоил; R3=H; R4=F
ES/MS m/z: 366,2 (положит.M+H), 364,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,99 (дд, 1H, J=10,1, 2,6 Гц), 7,26-7,03 (м, 4H), 6,96 (м, 2H9, 2,21 (с, 3H) и 2,07 (с, 3H).
Примеры 229-232
Представленные ниже соединения примеров 229-232 получали в соответствии с описанным выше общим способом 2. Все подробности экспериментов для каждой из отдельных стадий указанного общего способа, применимые для синтеза соединений примеров 229-232, описаны выше в примерах 2-4, 8, 16, 24 и 38-40.
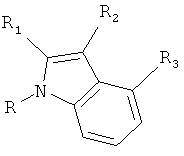
E229 2-Бром-7-фтор-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=Br; R2=CN; R3=H; R4=F
ES/MS m/z: 331,0; 333,0 (положит.M+H), 331,0; 329,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,45 (м, 1H), 7,28-7,22 (м, 3H), 7,00 (м, 1H) и 6,92 (м, 2H).
E230 2-(3,5-Диметилизоксазол-4-ил)-7-фтор-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=3,5-Диметилизоксазол-4-ил: R2=CN; R3=H; R4=F
ES/MS m/z: 348,1 (положит.M+H), 346,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,55 (дд, 1H, J=8,2, 0,9 Гц), 7,31 (м, 1H), 7,19 (м, 1H), 7,11 (м, 1H), 7,08 (м, 1H), 6,84-6,79 (м, 2H), 2,29 (с, 3H) и 2,00 (с, 3H).
E231 2-(3,5-Диметилизоксазол-4-ил)-4,7-дифтор-1-(4-гидроксифенил)-1H-индол-3-карбонитрил
R1=3,5-Диметилизоксазол-4-ил; R2=CN; R3=F; R4=F
ES/MS m/z: 366,2 (положит.M+H), 364,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,39-7,32 (м, 2H), 7,13-7,04 (м, 2H) 6,96-6,90 (м, 2H), 2,37 (с, 3H) и 2,07 (с, 3H).
E232 (Z)-2-(3,5-Диметилизоксазол-4-ил)-4,7-дифтор-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид
R1=3,5-диметилизоксазол-4-ил; R2=N-гидроксикарбамимидоил; R3=F; R4=F
ES/MS m/z: 399,2 (положит.M+H), 397,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,06 (м, 2H), 6,87 (м, 1H), 6,83-6,75 (м, 3H), 2,21 (с, 3H) и 2,01 (с, 3H).
Примеры 233-270
Представленные ниже соединения примеров 233-270 получали в соответствии с описанным выше общим способом 1. Все подробности экспериментов для каждой из отдельных стадий указанного общего способа, применимые для синтеза соединений примеров 233-270, описаны выше в примерах 1-4, 10-11, 14-16, 38-40 и 45.

E233 1-(2,5-Дифтор-4-гидроксифенил)-2-(3,5-диметилизоксазол-4-ил)-1H-индол-3-карбонитрил
R=2,5-дифтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=CN; R3=H
ES/MS m/z: 366,2 (положит.M+H), 364,6 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,80 (м, 1H), 7,55 (м, 1H), 7,45-7,41 (м, 2H), 7,34 (м, 1H), 7,03 (м, 1H), 2,38, 2,34 (2 с, 3H) и 2,14, 2,10 (2 с, 3H).
E234 1-(3-Бром-4-гидроксифенил)-2-(2-метилпроп-1-енил)-1H-индол-3-карбоксамид
R=3-бром-4-гидроксифенил; R1=2-метилпроп-1-енил; R2=карбамоил; R3=H
ES/MS m/z: 385,06/ 387,02 (положит.M+H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,35 (м, 1H), 7,55 (д, 1H, J=2,4 Гц), 7,25 (м, 1H), 7,21-7,14 (м, 3H), 7,08 (м, 1H), 6,20 (м, 1H), 1,85 (д, 3H, J=1,4 Гц) и 1,66 (д, 3H, J=1,0 Гц).
E235 (Z)-2-(3,5-Диметилизоксазол-4-ил)-1-(2-фтор-4-гидроксифенил)-N'-гидрокси-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил; R1=3,5-Диметилизоксазол-4-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 380,3 (положит.M+H), 378,4 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,06 (м, 1H), 7,34 (т, 0,5H, J=8,7 Гц), 7,25-7,18 (м, 2,5H), 7,07 (м, 1H), 6,84-6,74 (м, 2H), 2,17, 2,15 (2 с, 3H) и 2,05, 2,02 (2 с, 3H).
E236 (Z)-1-(2,5-Дифтор-4-гидроксифенил)-2-(3,5-диметилизоксазол-4-ил)-N'-гидрокси-1H-индол-3-карбоксимидамид
R=2,5-дифтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 399,2 (положит.M+H), 397 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,07 (м, 1H), 7,40 (дд, 0,5H, J=10,0, 6,6 Гц), 7,28-7,19 (м, 2,5H), 7,12 (м, 1H), 6,96 (м, 1H), 2,23, 2,17 (2 с, 3H) и 2,09, 2,02 (2 с, 3H).
E237 (Z)-1-(3,5-Дифтор-4-гидроксифенил)-2-(3,5-диметилизоксазол-4-ил)-N'-гидрокси-1H-индол-3-карбоксимидамид
R=3,5-дифтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 399,2 (положит.M+H), 397 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,06 (м, 1H), 7,28-7,19 (м, 3H), 7,06-7,00 (м, 2H), 2,23 (с, 3H) и 2,05 (с, 3H).
E238 (Z)-2-(3,5-Диметилизоксазол-4-ил)-1-(3-фтор-4-гидроксифенил)-N'-гидрокси-1H-индол-3-карбоксимидамид
R=3-фтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 381,5 (положит.M+H), 379,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,06 (м, 1H), 7,25-7,17 (м, 3H9, 7,14-7,09 (м, 2H), 6,98 (м, 1H), 2,20 (с, 3H) и 2,02 (с, 3H).
E239 (Z)-1-(3-Хлор-4-гидроксифенил)-2-(3,5-диметилизоксазол-4-ил)-N'-гидрокси-1H-индол-3-карбоксимидамид
R=3-хлор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 397,4/399,2 (положит.M+H), 394,9/397,0 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,25 (м, 1H), 7,50-7,14 (м, 6H), 2,19 (с, 3H) и 2,05 (с, 3H).
E240 2-(3,5-Диметилизоксазол-4-ил)-1-(2-фтор-4-гидроксифенил)-1H-индол-3-карбоксамид
R=2-фтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=карбамоил; R3=H
ES/MS m/z: 366,2 (положит.M+H), 364,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,25 (м, 1H), 7,38 (т, 0,6H, J=9,0 Гц), 7,29-7,25 (м, 2H), 7,21 (т, 0,4H, J=9,0 Гц), 7,10 (м, 1H), 6,84-6,72 (м, 2H), 2,21, 2,19 (2 с, 3H) и 2,09, 2,06 (2 с, 3H).
E241 (Z)-1-(2,3-Дифтор-4-гидроксифенил)-2-(3,5-диметилизоксазол-4-ил)-N'-гидрокси-1H-индол-3-карбоксимидамид
R=2,3-дифтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 399,2 (положит.M+H), 397,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,07 (м, 1H), 7,27-7,19 (м, 3H), 7,13 (м, 1H), 6,99 (м, 1H), 2,19, 2,18 (2 с, 3H) и 2,05, 2,04 (2 с, 3H).
E242 1-(2,3-Дифтор-4-гидроксифенил)-2-(3,5-диметилизоксазол-4-ил)-1H-индол-3-карбоксамид
R=2,3-дифтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=карбамоил; R3=H
ES/MS m/z: 384,2 (положит.M+H), 382,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,25 (м, 1H), 7,31-7,26 (м, 2,5H), 7,16 (м, 1H), 7,11 (м, 0,5H), 7,01 (м, 1H), 2,23, 2,22 (2 с, 3H) и 2,09, 2,08 (2 с, 3H).
E243 1-(2-Фтор-4-гидроксифенил)-2-(3-метилтиофен-2-ил)-1H-индол-3-карбонитрил
R=2-фтор-4-гидроксифенил; R1=3-метилтиофен-2-ил; R2=CN; R3=H
ES/MS m/z: 349,1 (положит.M+H), 347,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,83 (м, 1H), 7,38-7,31 (м, 3H), 7,13-7,11 (м, 2H), 6,89 (д, 1H, J=5,8 Гц), 6,71-6,67 (м, 2H) и 2,18 (с, 3H).
E244 2-(3,5-Диметил-1H-пиразол-4-ил)-1-(2-фтор-4-гидроксифенил)-1H-индол-3-карбонитрил
R=2-фтор-4-гидроксифенил; R1=3,5-диметил-1H-пиразол-4-ил; R2=CN; R3=H
ES/MS m/z: 347 (положит.M+H), 345,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,75 (м, 1H), 7,39-7,31 (м, 3H), 7,21 (м, 1H), 6,83-6,76 (м, 2H), 2,13 (с, 3H) и 2,08 (с, 3H).
E245 1-(2-Фтор-4-гидроксифенил)-2-(1-метил-1H-пиразол-5-ил)-1H-индол-3-карбонитрил
R=2-фтор-4-гидроксифенил; R1=1-метил-1H-пиразол-5-ил; R2=CN; R3=H
ES/MS m/z: 333,2 (положит.M+H), 331,3 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,87 (м, 1H), 7,48 (д, 1H, J=2,2 Гц), 7,42-7,37 (м, 2H), 7,20 (м, 1H), 7,15 (т, 1H, J=8,6 Гц), 6,69 (м, 1H), 6,60 (дд, 1H, J=2,5, 11,0 Гц), 6,22 (д, 1H, J=2,2 Гц) и 3,87 (с, 3H).
E246 1-(2-Фтор-4-гидроксифенил)-2-(1,3,5-триметил-1H-пиразол-4-ил)-1H-индол-3-карбонитрил
R=2-фтор-4-гидроксифенил; R1=1,3,5-триметил-1H-пиразол-4-ил; R2=CN; R3=H
ES/MS m/z: 361,4 (положит.M+H), 359,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,81 (м, 1H), 7,38-7,31 (м, 2H), 7,22 (м, 1H), 7,12 (т, 0,5H, J=8,7 Гц), 7,02 (т, 0,5H, J=8,7 Гц), 6,59 (м, 1H), 6,45 (м, 1H), 3,73, 3,70 (2 с, 3H), 2,17, 2,09 (2 с, 3H) и 2,05, 1,96 (2 с, 3H). Две конформации.
E247 1-(2-Фтор-4-гидроксифенил)-2-(3-(трифторметил)-1H-пиразол-4-ил)-1H-индол-3-карбонитрил
R=2-фтор-4-гидроксифенил; R1=3-(трифторметил)-1H-пиразол-4-ил; R2=CN; R3=H
ES/MS m/z: 385,3 (положит.M+H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,73 (м, 1H), 7,35-7,22 (м, 4H), 7,05 (м, 1H) и 6,87-6,83 (м, 2H).
E248 (Z)-1-(2-Фтор-4-гидроксифенил)-N'-гидрокси-2-(3-метилтиофен-2-ил)-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил R1=3-метилтиофен-2-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 382,2 (положит.M+H), 380,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,25 (м, 1H), 7,41 (д, 1H, J=5,0 Гц), 7,33-7,27 (м, 3H), 7,06 (м, 1H), 6,87 (д, 1H, J=5,0 Гц), 6,74 (ушир.с, 2H) и 2,09 (ушир.с, 3H).
E249 (Z)-1-(2-Фтор-4-гидроксифенил)-N'-гидрокси-2-(1-метил-1H-пиразол-5-ил)-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил; R1=1-метил-1H-пиразол-5-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 366,2 (положит.M+H), 364,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,27 (м, 1H), 7,50 (ушир.с, 1H), 7,37-7,31 (м, 3H), 7,12 (ушир.с, 1H), 6,84 (ушир.с, 1H), 6,70 (ушир.с, 1H), 6,14 (с, 1H) и 3,71 (с, 3H).
E250 (Z)-1-(2-Фтор-4-гидроксифенил)-N'-гидрокси-2-(1,3,5-триметил-1H-пиразол-4-ил)-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил; R1=1,3,5-триметил-1H-пиразол-4-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 394,3 (положит.M+H), 392,1 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,23 (д, 1H, J=7,9 Гц), 7,30-7,20 (м, 3H), 7,07 (м, 1H), 6,80-6,70 (м, 2H), 3,64, 3,63 (2 с, 3H), 2,05, 1,92 (2 с, 3H) и 1,99, 1,88 (2 с, 3H). Две конформации.
E251 (Z)-4-Фтор-1-(2-фтор-4-гидроксифенил)-N'-гидрокси-2-(1-метил-1H-пиразол-5-ил)-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил; R1=1-метил-1H-пиразол-5-ил; R2=N-гидроксикарбамимидоил; R3=F
ES/MS m/z: 384,16 (положит.M+H), 382,16 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,30-7,21 (м, 3H), 6,95-6,89 (м, 2H), 6,78-6,71 (м, 2H), 6,12 (д, 1H, J=1,9 Гц) и 3,72 (с, 3H).
E252 (Z)-4-Фтор-1-(2-фтор-4-гидроксифенил)-N'-гидрокси-2-(1,3,5-триметил-1H-пиразол-4-ил)-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил; R1=1,3,5-триметил-1H-пиразол-4-ил; R2=N-гидроксикарбамимидоил; R3=F
ES/MS m/z: 412,18 (положит.M+H), 410,21 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,17-7,11 (м, 2H), 6,88-6,83 (м, 2H), 6,75-6,67 (м, 2H), 3,59, 3,58 (2 с, 3H), 2,08, 2,02 (2 с, 3H) и 1,96, 1,91 (2 с, 3H). Две конформации.
E253 (Z)-2-(3,5-Диметил-1H-пиразол-4-ил)-4-фтор-1-(2-фтор-4-гидроксифенил)-N'-гидрокси-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил; R1=3,5-диметил-1H-пиразол-4-ил; R2=N-гидроксикарбамимидоил; R3=F
ES/MS m/z: 399,16 (положит.M+H), 397,18 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,30 (кв, 1H, J=9,1 Гц), 7,21 (м, 1H), 6,94-6,90 (м, 2H), 6,82-6,75 (м, 2H), 2,20, 2,19 (2 с, 3H) и 2,03, 2,01 (2 с, 3H). Две конформации.
E254 (Z)-4-Фтор-1-(2-фтор-4-гидроксифенил)-N'-гидрокси-2-(3-метилтиофен-2-ил)-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил; R1=3-метилтиофен-2-ил; R2=N-гидроксикарбамимидоил; R3=F
ES/MS m/z: 400,14 (положит.M+H), 398,12 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,30 (кв, 1H, J=9,1 Гц), 7,21 (м, 1H), 6,94-6,90 (м, 2H), 6,82-6,75 (м, 2H), 2,20, 2,19 (2 с, 3H) и 2,03, 2,01 (2 с, 3H). Две конформации.
E255 (Z)-2-(3,5-Диметилизоксазол-4-ил)-4-фтор-1-(2-фтор-4-гидроксифенил)-N'-гидрокси-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=N-гидроксикарбамимидоил; R3=F
ES/MS m/z: 399,16 (положит.M+H), 397,18 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,30 (кв, 1H, J=9,1 Гц), 7,21 (м, 1H), 6,94-6,90 (м, 2H), 6,82-6,75 (м, 2H), 2,20, 2,19 (2 с, 3H) и 2,03, 2,01 (2 с, 3H). Две конформации.
E256 (Z)-1-(2-Фтор-4-гидроксифенил)-N'-гидрокси-2-(3-метилтиофен-2-ил)-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил; R1=3-метилтиофен-2-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 382,16 (положит.M+H), 380,07 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,27 (м, 1H), 7,50 (ушир.с, 0,5H), 7,37-7,31 (м, 3H), 7,15-7,09 (м, 1,5H), 6,84 (ушир.с, 1H), 6,69 (ушир.с, 1H), 6,14 (с, 1H) и 1,41 (с,3H).
E257 (Z)-1-(2-Фтор-4-гидроксифенил)-N'-гидрокси-2-(1-метил-1H-пиразол-5-ил)-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил; R1=1-метил-1H-пиразол-5-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 366,2 (положит.M+H), 364,17 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,25 (м, 1H), 7,41 (д, 1H, J=5,0 Гц), 7,33-7,27 (м, 2,5H), 7,13 (ушир.с, 0,5H), 7,06 (д, 1H, J=7,8 Гц), 6,87 (д, 1H, J=5,0 Гц), 6,75 (ушир.с, 2H) и 3,75 (с, 3H).
E258 (Z)-1-(2-Фтор-4-гидроксифенил)-N'-гидрокси-2-(1,3,5-триметил-1H-пиразол-4-ил)-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил; R1=1,3,5-триметил-1H-пиразол-4-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 394,26 (положит.M+H), 392,17 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,23 (м, 1H), 7,30-7,20 (м, 3H), 7,07 (м, 1H), 6,80-6,70 (м, 2H), 3,64, 3,63 (2 с, 3H), 2,05, 1,99 (2 с, 3H) и 1,92, 1,88 (2 с,3H).
E259 (Z)-2-(3,5-Диметил-1H-пиразол-4-ил)-1-(2-фтор-4-гидроксифенил)-N'-гидрокси-1H-индол-3-карбоксимидамид
R=2-фтор-4-гидроксифенил; R1=3,5-диметил-1H-пиразол-4-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 380,16 (положит.M+H), 378,18 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,25 (м, 1H), 7,18-7,12 (м, 3H), 6,99 (м, 1H), 6,77-6,71 (м, 2H), 2,08 (с, 3H) и 2,01 (с, 3H).
E260 Метил-2-(3,5-диметилизоксазол-4-ил)-1-(2-фтор-4-гидроксифенил)-1H-индол-3-карбимидат
R=2-фтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=имино(метокси)метил; R3=H
ES/MS m/z: 380,3 (положит.M+H), 378,7 (отрицат.M-H)
E261 2-(3,5-Диметилизоксазол-4-ил)-1-(3-фтор-4-гидроксифенил)-1H-индол-3-карбоксамид
R=3-фтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=карбамоил; R3=H
ES/MS m/z: 366,2 (положит.M+H), 364,3 (отрицат.M-H).
E262 1-(2,5-Дифтор-4-гидроксифенил)-2-(3,5-диметилизоксазол-4-ил)-1H-индол-3-карбоксимидамид
R=2,5-дифтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=карбамимидоил; R3=H
ES/MS m/z: 383,3 (положит.M+H); 1H-ЯМР (ацетон-d6, 500 МГц): 7,95 (м, 1H), 7,56 (м, 1H), 7,42-7,30 (м, 3H), 7,01 (м, 1H), 2,27, 2,23 (2 с, 3H) и 2,13, 2,08 (2 с, 3H).
E263 2-(3,5-Диметилизоксазол-4-ил)-1-(3-фтор-4-гидроксифенил)-1H-индол-3-карбоксимидамид
R=3-фтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=карбамимидоил; R3=H
ES/MS m/z: 365,17 (положит.M+H), 363,21 (отрицат.M-H); 1H-ЯМР (MeOD, 500 МГц): 7,86 (м, 1H), 7,40-7,37 (м, 3H), 7,08-7,01 (м, 3H), 6,90 (ушир.с, 1H), 2,18 (с, 3H) и 2,02 (с, 3H).
E264 (Z)-1-(3-Фтор-4-гидроксифенил)-N'-гидрокси-2-(1H-пиррол-1-ил)-1H-индол-3-карбоксимидамид
R=3-фтор-4-гидроксифенил; R1=1H-пиррол-1-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 351,16 (положит.M+H), 349,14 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,24 (д, 1H, J=7,9 Гц), 7,27-7,12 (м, 4H), 7,08-7,04 (м, 2H), 6,94 (т, 2H, J=2,2 Гц) и 6,18 (т, 2H, J=2,2 Гц).
E265 1-(3-Фтор-4-гидроксифенил)-2-(1H-пиррол-1-ил)-1H-индол-3-карбоксамид
R=3-фтор-4-гидроксифенил; R1=1H-пиррол-1-ил; R2=карбамоил; R3=H
ES/MS m/z: 336,13 (положит.M+H), 334,22 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,44 (м, 1H), 7,32-7,23 (м, 3H), 7,15 (м, 1H), 7,12-7,06 (м, 2H), 7,04 (т, 2H, J=2,2 Гц) и 6,26 (т, 2H, J=2,2 Гц).
E266 (Z)-1-(2,3-Дифтор-4-гидроксифенил)-N'-гидрокси-2-(1H-пиррол-1-ил)-1H-индол-3-карбоксимидамид
R=2,3-дифтор-4-гидроксифенил; R1=1H-пиррол-1-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 369,14 (положит.M+H), 367,19 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,24 (д, 1H, J=7,9 Гц), 7,27 (м, 1H), 7,22 (м, 1H), 7,14 (м, 1H), 7,06 (д, 1H, J=7,8 Гц), 6,92-6,88 (м, 3H) и 6,17 (т, 2H,J=2,1 Гц).
E267 1-(2,3-Дифтор-4-гидроксифенил)-2-(1H-пиррол-1-ил)-1H-индол-3-карбоксамид
R=2,3-дифтор-4-гидроксифенил; R1=1H-пиррол-1-ил; R2=карбамоил; R3=H
ES/MS m/z: 354,12 (положит.M+H), 352,19 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,44 (м, 1H), 7,34-7,29 (м, 2H), 7,20 (ушир.с, 1H), 7,11 (м, 1H), 6,99 (т, 2H, J=2,1 Гц), 6,91 (м, 1H) и 6,26 (т, 2H, J=2,1 Гц).
E268 (Z)-2-(2,5-Диметил-1H-пиррол-1-ил)-1-(3-фтор-4-гидроксифенил)-N'-гидрокси-1H-индол-3-карбоксимидамид
R=3-фтор-4-гидроксифенил; R1=2,5-диметил-1H-пиррол-1-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 379,21 (положит.M+H), 377,29 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,37 (д, 1H, J=8,1 Гц), 7,34-7,20 (м, 4H), 7,11-6,98 (м, 4H), 2,52 (с, 3H) и 2,01 (с, 3H).
E269 (Z)-1-(3-Фтор-4-гидроксифенил)-N'-гидрокси-2-(2-метил-1H-пиррол-1-ил)-1H-индол-3-карбоксимидамид
R=3-фтор-4-гидроксифенил; R1=2-метил-1H-пиррол-1-ил; R2=N-гидроксикарбамимидоил; R3=H
ES/MS m/z: 365,18 (положит.M+H), 363,2 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,33 (д, 1H, J=8,1 Гц), 7,29-7,14 (м, 4H), 7,09-7,04 (м, 2H), 6,92 (дд, 1H, J=2,8, 1,8 Гц), 6,10 (т, 1H, J=3,2 Гц), 5,90 (м, 1H) и 2,01 (с, 3H).
E270 1-(3,5-Дифтор-4-гидроксифенил)-2-(3,5-диметилизоксазол-4-ил)-1H-индол-3-карбоксамид
R=3,5-дифтор-4-гидроксифенил; R1=3,5-диметилизоксазол-4-ил; R2=карбамоил; R3=H
ES/MS m/z: 384,2 (положит.M+H), 382,3 (отрицат.M-H) 1H-ЯМР (ацетон-d6, 500 МГц): 8,25 (м, 1H), 7,30-7,25 (м, 3H), 7,10 (ушир.с, 2H), 2,27 (с, 3H) и 2,11 (с, 3H).
Пример 271
Представленное ниже соединение примера 271 получали в соответствии с описанным выше общим способом 3. Все подробности экспериментов для каждой из отдельных стадий указанного общего способа описаны выше в примерах 2-4, 8, 16, 24 и 38-40.
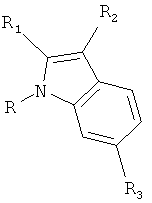
E271 (Z)-2-(3,5-Диметилизоксазол-4-ил)-6-фтор-N'-гидрокси-1-(4-гидроксифенил)-1H-индол-3-карбоксимидамид
R=4-гидроксифенил; R1=3,5-метилиозоксазол-4-ил; R2=N-гидроксикарбамимидоил; R3=F
ES/MS m/z: 381,18 (положит.M+H), 379,22 (отрицат.M-H); 1H-ЯМР (ацетон-d6, 500 МГц): 8,08 (дд, 1H, J=8,9, 5,7 Гц), 7,13 (ушир.с, 2H), 6,99 (м, 1H), 6,95 (м, 2H), 6,87 (дд, 1H, J=9,8, 2,3 Гц), 2,17 (с, 3H) и 2,00 (с, 3H).
Тест на связывание 1:
Тест на связывание с эстрогеновыми рецепторами
Тест на связывание лигандов с эстрогеновыми рецепторами проводили в виде сцинтилляционного анализа сближения (SPA) с использованием меченого тритием эстрадиола (3H-E2) и рекомбинатно экспрессируемых биотинилированных связывающих доменов эстрогеновых рецепторов. связывающие домены белков ERα человека (ERα-LBD, pET-N-AT #1, аминокислоты 301-595) и ERβ человека (ERβ-LBD, pET-N-AT #1, аминокислоты 255-530) продуцировали в E.coli ((BL21, (DE3), pBirA)) при 22°C в 2×LB среде с добавлением 50 мкМ биотина. Спустя 3 ч после индукции изопропил-β-D-1-тиогалактопиранозидом (IPTG, 0,55 мМ) клетки собирали путем центрифугирования при 7300×g в течение 15 мин и хранили дебрис замороженным при -20°C. Экстракцию ERα и ERβ проводили с использованием 5 г клеток, суспендированных в 50 мл экстрагирующего буфера (50 мМ Tris, pH 8,0, 100 мМ KCl, 4 мМ EDTA, 4 мМ DDT и 0,1 мМ PMSF). Клеточную суспензию дважды прогоняли через Microfluidizer M-110L (Microfluidics) и центрифугировали при 15000×g в течение 60 мин. Супернатант делили на аликвоты и хранили при -70°C.
Экстракты ERα-LBD или ERβ-LBD разбавляли в аналитическом буфере (18 мМ K2HPO4, 2 мМ KH2PO4, 20 мМ Na2MoO4, 1 мМ EDTA, 1 мМ TCEP) в соотношениях 1:676 и 1:517 для ERα-LBD и ERβ-LBD, соответственно. Концентрации рецепторов должны составлять 900 фмоль/л. Экстракты предварительно инкубировали с покрытыми стрептавидином бусами для SPA из поливинилтолуола (RPNQ0007, GE Healthcare) в концентрации 0,43 мг/мл в течение 1 часа при комнатной температуре.
Тестируемые соединения оценивали в диапазоне концентраций от 157 мкМ до 37,5 пМ. Для проведения теста приготавливали 5-кратные (относительно желаемых конечных концентраций) маточные растворы тестируемых соединений в 100% DMSO. Количество DMSO в лунках 384-луночного микропланшета должно составлять 20%. В аналитические микропланшеты добавляли 18 мкл аликвот тестируемых соединений, затем 35 мкл предварительно инкубированной смеси рецептор/бусы для SPA, и в завершение добавляли 35 мкл 3 нМ 3H-E2. Микропланшеты покрывали герметизирующей пластиковой крышкой, центрифугировали в течение 1 мин при 1000 об/мин и уравновешивали в течение ночи на шейкере при комнатной температуре. На следующее утро микропланшеты центрифугировали в течение 5 мин при 2000 об/мин и проводили измерения на планшетном сцинтилляционном счетчике, например, на PerkinElmer Microbeta 1450 Trilux.
Для соединений, способных вытеснять с рецептора 3H-E2, при помощи нелинейной четырехпараметрической логистической модели определяли значение IC50 (концентрацию, требуемую для ингибирования 50% связывания 3H-E2)
b=((bmax-bmin)/(1+(I/IC50)S))+bmin
где I представляет собой добавленную концентрацию ингибитора связывания, IC50 представляет собой концентрацию ингибитора при полумаксимальном связывании, и S представляет собой угловой коэффициент. Аппарат Microbeta генерирует средние значения имп/мин (импульсов в минуту) за минуту и корректирует единичные отклонения между детекторами, выдавая тем самым исправленные значения имп/мин.
Тест на связывание 2:
Тест на связывание на фильтрах с эстрогеновыми рецепторами
Лиганд-связывающий домен эстрогенового рецептора β человека (hERβ-LBD) использовали в тесте на конкурентное связывание с разделением на фильтре связанного и свободного лиганда. В указанном тесте использовали меченный тритием эстрадиол (3H-E2) в качестве испускающего β-частицы изотопного маркера и рекомбинатно экспрессируемый связывающий домен эстрогенового рецептора β человека. Связывающий домен ERβ (hERβ-LBD, pET-N-AT #1, аминокислоты 255-530) продуцировали в Escherichia coli ((BL21, (DE3), pBirA)) при 22°C в 2×LB среде с добавлением 50 мкМ биотина. Спустя 3 ч после индукции изопропил-β-D-1-тиогалактопиранозидом (0,55 мМ) клетки собирали путем центрифугирования при 7300×g в течение 15 мин и хранили дебрис замороженным при -20°C. Экстракцию hERβ-LBD проводили с использованием 5 г клеток, суспендированных в 50 мл экстрагирующего буфера (50 мМ Tris, pH 8,0, 100 мМ KCl, 4 мМ этилендиаминтетрауксусной кислоты (EDTA), 4 мМ дитиотреитола и 0,1 мМ фенилметансульфонилхлорида (TCEP)). Клеточную суспензию дважды прогоняли через Microfluidizer M-110L (Microfluidics) и центрифугировали при 15000×g в течение 60 мин. Супернатант делили на аликвоты и хранили при -70°C. Экстракт эстрогенового рецептора разбавляли 1:400 аналитическим буфером (18 мМ K2HPO4, 2 мМ KH2PO4, 20 мМ Na2MoO4, 1 мМ EDTA, 1 мМ TCEP, pH 8,0). Тестируемые соединения оценивали в диапазоне концентраций от 2 мкМ до 10 пМ. Для проведения анализа приготавливали 51-кратные (относительно желаемых конечных концентраций) маточные растворы тестируемых соединений в 100% диметилсульфоксиде (DMSO). Конечное содержание DMSO в лунках 96-луночного микропланшета должно составлять 2%. В аналитические микропланшеты добавляли 100 мкл 3H-E2, затем 4 мкл аликвот тестируемых соединений и 100 мкл разбавленного экстракта рецептора. Аналитические микропланшеты инкубировали в течение ночи при +4°C. Связанный с рецептором и свободный изотопный маркер разделяли на фильтре из стекловолокна (FILTERMAT B, PerkinElmer) в коллекторе клеток (TOMTECMACH3, Tomtec) с отмывочным буфером (18 мМ K2HPO4, 2 мМ KH2PO4, 0,5 мМ EDTA). Фильтры сушили при 60°C в течение 1 часа, а затем спекали с расплавленным сцинтиллянтом (MELTILEX, PerkinElmer) перед измерением на планшетном β-счетчике (Wallac Microbeta Trilux 1450-028, PerkinElmer). Аппарат Trilux генерирует средние значения импульсов в минуту (имп/мин) за минуту и корректирует единичные отклонения между детекторами, выдавая тем самым исправленные значения имп/мин (ccpm). Значения IC50, определенные как срединная точка между значениями максимального связывания и минимального связывания на сигмодной кривой связывания, рассчитывали с использованием программного обеспечения XLfit (версия 2.0 или более поздняя) (IDBS) при помощи четырехпараметрической логистической модели
b=((bmax-bmin)/(1+(I/IC50)S))+bmin
где I представляет собой добавленную концентрацию ингибитора связывания, IC50 представляет собой концентрацию ингибитора при полумаксимальном связывании, и S представляет собой угловой коэффициент.
Тест на трансактивацию 1:
Тест на трансактивацию в эмбриональных клетках почек человека (HEK 293), стабильно трансфицированных pERE-ALP и эстрогеновым рецептором α человека
Экспрессирующий вектор pMThERα содержит вставку эстрогенового рецептора α человека дикого типа с удаленной лидерной последовательностью. Репортерная конструкция pERE-ALP содержит ген секретируемой формы плацентарной щелочной фосфатазы (ALP) и вителлогениновый эстрогеновый ответный элемент (ERE). Эмбриональные клетки почек человека (HEK 293) трансфицировали в два этапа. На первом этапе разрабатывали смесь стабильных клонов, трансфицированных репортерной конструкцией pERE-ALP и плазмидой pSV2-Neo для селекции. На втором этапе смесь стабильных клонов трансфицировали pMThERα и детерминантой резистентности pKSV-Hyg для селекции. Все процедуры транфекции проводили с использованием Lipofectamine (Invitrogen) в соответствии с рекомендациями поставщика. В тесте на трансактивацию использовали отобранный клон, содержащий и pERE-ALP, и pMThERα.
Клетки высевали в 384-луночные микропланшеты в количестве 12500 клеток на лунку в модифицированной по Куну среде F12 Хэма (без фенолового красного) с добавлением 10% эмбриональной бычьей сыворотки (FBS), обработанной нагруженной декстраном угольной пылью (DCC), 2 мМ L-глутамина и 50 мкг/мл гентамицина. После инкубации в течение 24 ч (37°C, 5% CO2) используемую для посева среду удаляли и заменяли 20 мкл модифицированной по Куну среды F12 Хэма (без фенолового красного) с добавлением 1,5% DCC-FCS, 2 мМ L-глутамина, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина. Выбранные соединения добавляли в лунки в 12 концентрациях в диапазоне от 3,3 пМ до 33 мкМ. Соединения растворяли в 100% диметилсульфоксиде (DMSO), и конечная концентрация DMSO в анализе составляла 0,1%. После инкубации в течение 72 ч (37°C, 5% CO2) проводили анализ среды на активность ALP по методу хемилюминесценции: 10 мкл аликвоты культуральной клеточной среды смешивали с 100 мкл аналитического буфера (0,1 M диэтаноламин, 1 мМ MgCl2) и 0,5 мМ динатрия 3-(4-метоксиспиро-1,2-диоксетан-3,2'-(5'-хлор)-трицикло[3.3.1.13,7]декан-4-ил)фенилфосфата (CSPD) (Tropix, Applied Biosystems) и инкубировали в течение 20 мин при 37°C и 15 мин при комнатной температуре перед измерением светового сигнала хемилюминесценции (1 с на лунку) в Wallac Microbeta Trilux 1450-028 (PerkinElmer). Полумаксимальные эффективные концентрации (EC50) рассчитывали из кривых концентрационных зависимостей при помощи четырехпараметрической логистической модели с использованием программного обеспечения XLfit (версия 2.0 или более поздняя) (IDBS).
Тест на трансактивацию 2:
Тест на трансактивацию в эмбриональных клетках почек человека (HEK 293), стабильно трансфицированных pERE2-ALP и эстрогеновым рецептором β человека
Генерация стабильных клеточных линий HEK293 (CRL-1573; Американская коллекция типовых культур), экспрессирующих репортерный вектор pERE2-ALP и эстрогеновый рецептор β человека (hERβ 530), были описаны ранее (Mol. Pharmacol. 1998, 54, 105-112; Endocrinology 2002, 143, 1558-1561).
Клетки высевали в 384-луночные микропланшеты в количестве 12500 клеток на лунку в модифицированной по Куну среде F12 Хэма (без фенолового красного) с добавлением 10% эмбриональной бычьей сыворотки (FBS), обработанной нагруженной декстраном угольной пылью (DCC), 2 мМ L-глутамина и 50 мкг/мл гентамицина. После инкубации в течение 24 ч (37°C, 5% CO2) используемую для посева среду удаляли и заменяли 20 мкл модифицированной по Куну среды F12 Хэма (без фенолового красного) с добавлением 1,5% DCC-FCS, 2 мМ L-глутамина, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина. Выбранные соединения добавляли в лунки в 12 концентрациях в диапазоне от 3,3 пМ до 33 мкМ. Соединения растворяли в 100% диметилсульфоксиде (DMSO), и конечная концентрация DMSO в анализе составляла 0,1%. После инкубации в течение 72 ч (37°C, 5% CO2) проводили анализ среды на активность ALP по методу хемилюминесценции: 10 мкл аликвоты культуральной клеточной среды смешивали с 100 мкл аналитического буфера (0,1 M диэтаноламин, 1 мМ MgCl2) и 0,5 мМ динатрия 3-(4-метоксиспиро-1,2-диоксетан-3,2'-(5'-хлор)-трицикло[3.3.1.13,7]декан-4-ил)фенилфосфата (CSPD) (Tropix, Applied Biosystems) и инкубировали в течение 20 мин при 37°C и 15 мин при комнатной температуре перед измерением светового сигнала хемилюминесценции (1 с на лунку) на Wallac Microbeta Trilux 1450-028 (PerkinElmer). Активность ALP, выраженная в световых импульсах в секунду (lcps), прямо пропорциональная содержанию ALP, экспрессируемой клетками. Полумаксимальные эффективные концентрации (EC50) рассчитывали из кривых концентрационных зависимостей при помощи четырехпараметрической логистической модели с использованием программного обеспечения XLfit (версия 2.0 или более поздняя) (IDBS).
Соединения примеров 1-271 проявляют одно или несколько из следующих качеств:
(i) аффинность связывания с эстрогеновым рецептором α-подтипа в диапазоне значений IC50 от 1 до 10000 нМ в тесте на связывание 1;
(ii) аффинность связывания с эстрогеновым рецептором β-подтипа в диапазоне значений IC50 от 1 до 10000 нМ в тесте на связывание 1;
(iii) аффинность связывания с эстрогеновым рецептором α-подтипа в диапазоне значений IC50 от 1 до 10000 нМ в тесте на связывание 2;
(iv) аффинность связывания с эстрогеновым рецептором β-подтипа в диапазоне значений IC50 от 1 до 10000 нМ в тесте на связывание 2;
(v) эффективность в отношении эстрогенового рецептора α-подтипа в диапазоне значений EC50 от 1 до 10000 нМ в тесте на трансактивацию 1;
(vi) эффективность в отношении эстрогенового рецептора β-подтипа в диапазоне значений EC50 от 1 до 10000 нМ в тесте на трансактивацию 2.
Предпочтительными соединениями примеров по настоящему изобретению являются те соединения, которые обладают аффинностью связывания с эстрогеновым рецептором β-подтипа в меньших концентрациях внутри представленного выше диапазона значений IC50. Например, в тесте на связывание 1 соединения примеров 1, 2, 4-6, 11, 23, 39, 42, 43, 46, 49-51, 53, 54, 63, 64, 68, 70, 83, 86, 87, 95, 100, 101, 107, 110, 125, 126, 128, 129, 132-141, 143, 144, 146, 147, 158, 163, 188, 191, 194, 212-217, 219-221, 223, 224, 235, 243 обладают аффинностью связывания с эстрогеновым рецептором β-подтипа в диапазоне значений IC50 от 1 до 200 нМ.
Предпочтительными соединениями примеров по настоящему изобретению являются те соединения, которые в тесте на связывание 1 обладают избирательностью в отношении эстрогенового рецептора β-подтипа по сравнению с эстрогеновым рецептором α-подтипа. Например, в тесте на связывание соединения примеров 2, 4, 5, 11, 23, 43, 51, 53, 68, 70, 39, 95, 133, 134, 143, 146, 188, 191, 213, 215, 221, 224, 235 обладают избирательностью в отношении эстрогенового рецептора β-подтипа, равной 50 или большей.
Предпочтительными соединениями примеров по настоящему изобретению являются те соединения, которые обладают эффективностью в отношении эстрогенового рецептора β-подтипа в меньших концентрациях внутри представленного выше диапазона значений EC50. Например, в тесте на трансактивацию 2 соединения примеров 11, 14, 39, 41, 42, 47, 68, 163, 176, 187, 188, 191, 194, 220, 221, 223, 235-238, 255, 266, 268, 269, 271 обладают эффективностью в отношении эстрогенового рецептора β-подтипа в диапазоне значений EC50 от 1 до 50 нМ.
Предпочтительными соединениями примеров по настоящему изобретению являются те соединения, которые в тестах на трансактивацию 1 и 2 обладают избирательностью в отношении эстрогенового рецептора β-подтипа по сравнению с эстрогеновым рецептором α-подтипа. Например, в тестах на трансактивацию соединения примеров 11, 14, 41, 42, 44, 221, 235-238, 241, 255, 260, 268, 271 обладают избирательностью в отношении эстрогенового рецептора β-подтипа, равной 50 или большей.
Особенно предпочтительными соединениями примеров по настоящему изобретению являются те соединения, которые обладают и аффинностью связывания с эстрогеновым рецептором β-подтипа в меньших концентрациях внутри представленного выше диапазона значений IC50, и эффективностью в отношении эстрогенового рецептора β-подтипа в меньших концентрациях внутри представленного выше диапазона значений EC50. Например, соединения 11, 39, 42, 68, 163, 188, 191, 194, 220, 221, 223, 235 обладают аффинностью связывания с эстрогеновым рецептором β-подтипа со значениями IC50 в диапазоне от 1 до 200 нМ в тесте на связывание 1, и эффективностью в диапазоне значений EC50 от 1 до 50 нМ в отношении эстрогенового рецептора β-подтипа в тесте на трансактивацию 2.

