Результат интеллектуальной деятельности: СЕЛЕКТИВНОЕ ВВЕДЕНИЕ РАДИОАКТИВНОЙ МЕТКИ В БИОМОЛЕКУЛЫ
Вид РИД
Изобретение
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Способы введения атомов фтора, в частности радиоактивных атомов фтора, в биомолекулы, содержащие аминокислотные остатки, представляют значительный интерес. Однако, так как радиоактивные атомы фтора, такие как 18F, имеют относительно короткое время жизни, равное примерно 110 минутам, для введения радиоактивного фтора в биомолекулы требуются эффективные в отношении времени способы.
Существует постоянная потребность в эффективных и сайт-специфичных способах введения в биомолекулы атома(ов) фтора, в том числе радиоактивного(ых) атома(ов) фтора.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте изобретения раскрыты способы введения атома фтора в биомолекулу, такую как полипептид. Способы могут включать: (1) предоставление линкера, содержащего тиол-реакционно-способный конец и азидо/алкин-реакционно-способный конец; (2) взаимодействие тиол-реакционно-способного конца линкера с биомолекулой, содержащей по меньшей мере одну тиоловую группу или ее реакционно-способное производное; и (3) последующее взаимодействие азидо/алкин-реакционно-способного конца линкера с фторзамещенным азидом или алкином, соответственно.
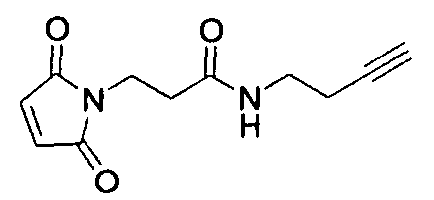
В другом аспекте предложены способы введения одного или более атомов фтора в биомолекулу. Способы включают: (1) взаимодействие тиол-реакционно-способной группы Mal-алкинового бифункционального линкера, такого как N-(бут-3-инил)-3-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)пропанамидный линкер (1), с биомолекулой, содержащей по меньшей мере одну тиоловую группу; и (2) последующее взаимодействие алкиновой группы линкера с фторзамещенным азидом.
В еще одном аспекте предложены биоконъюгаты, содержащие структурные единицы, полученные из (1) биомолекулы, содержащей по меньшей мере одну тиоловую группу; и (2) линкера. Линкер может быть получен способом, включающим взаимодействие аминного соединения, содержащего азидо- или алкин-реакционно-способную функциональную группу, с карбоновой кислотой или активированным сложным эфиром, содержащими тиол-реакционно-способную функциональную группу. В другом аспекте линкер может быть получен путем взаимодействия аминного соединения, содержащего тиол-реакционно-способную функциональную группу, с карбоновой кислотой или активированным сложноэфирным соединением, содержащими азидо- или алкин-реакционно-способную функциональную группу.
В еще одном аспекте предложены биоконъюгаты, полученные с использованием указанных способов, линкеров и биомолекул.
В другом аспекте предложены структуры линкеров.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Эти аспекты и преимущества настоящего изобретения станут более понятными из следующего ниже подробного описания со ссылкой на прилагающиеся графические материалы, в которых одинаковые символы означают одинаковые части на всех фигурах, где:
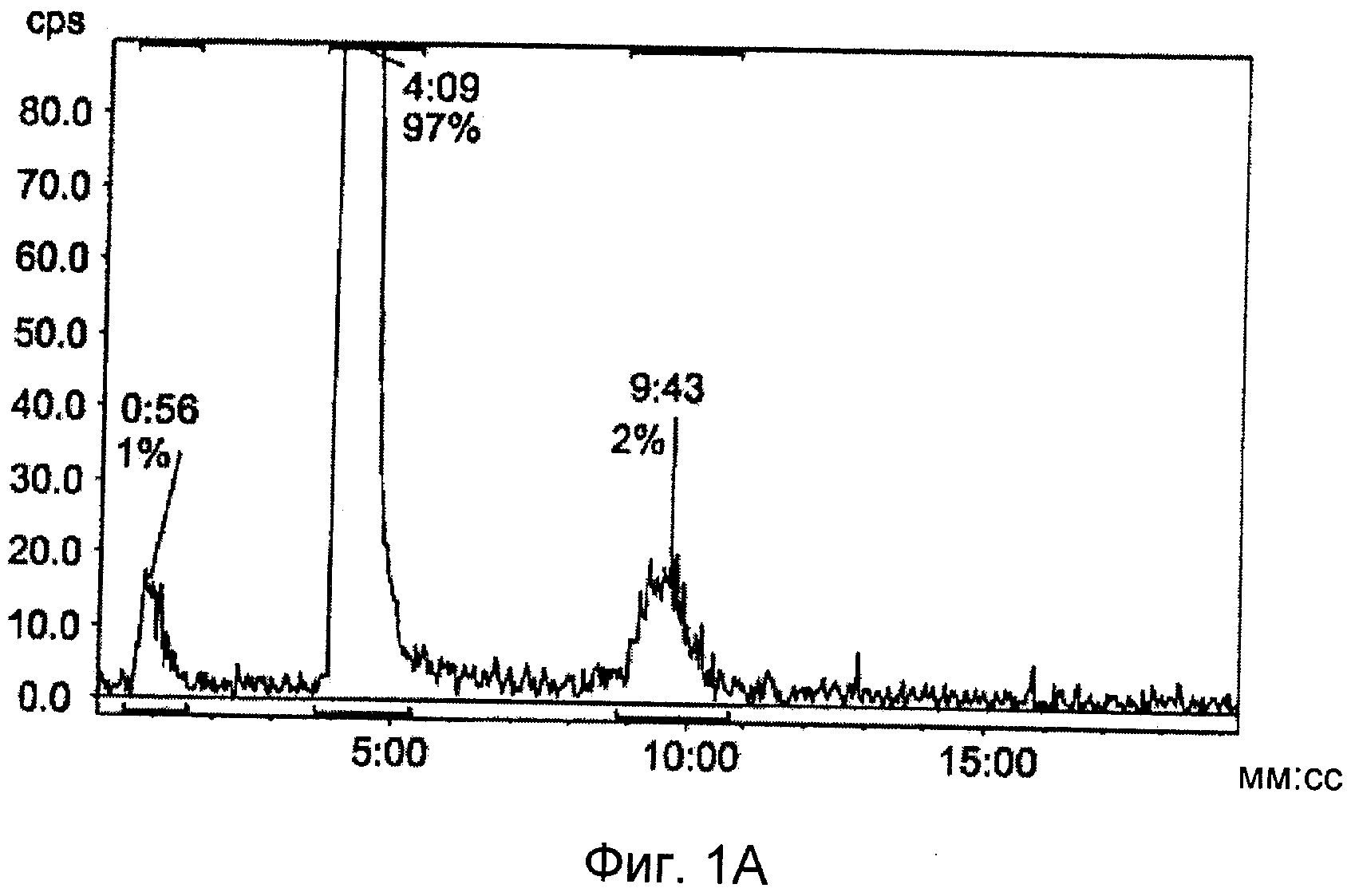
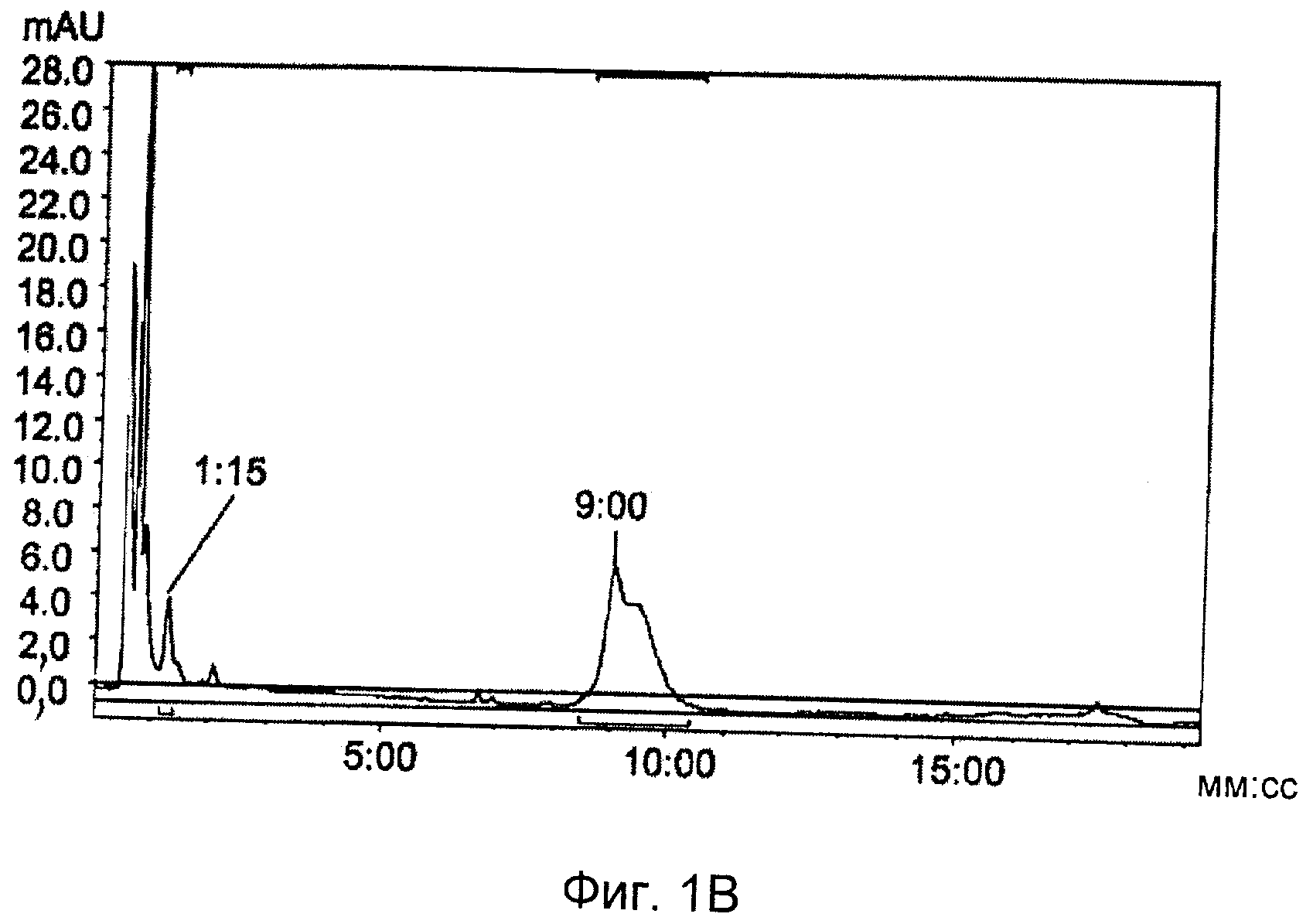
на Фиг.1 представлены результаты HPLC (жидкостная хроматография высокого давления) анализа реакционной смеси неоптимизированной системы, демонстрирующие 18F «click»-меченное анти-Her2 аффитело (27) (а, канал радиоактивности; b, УФ канал при 280 нм).
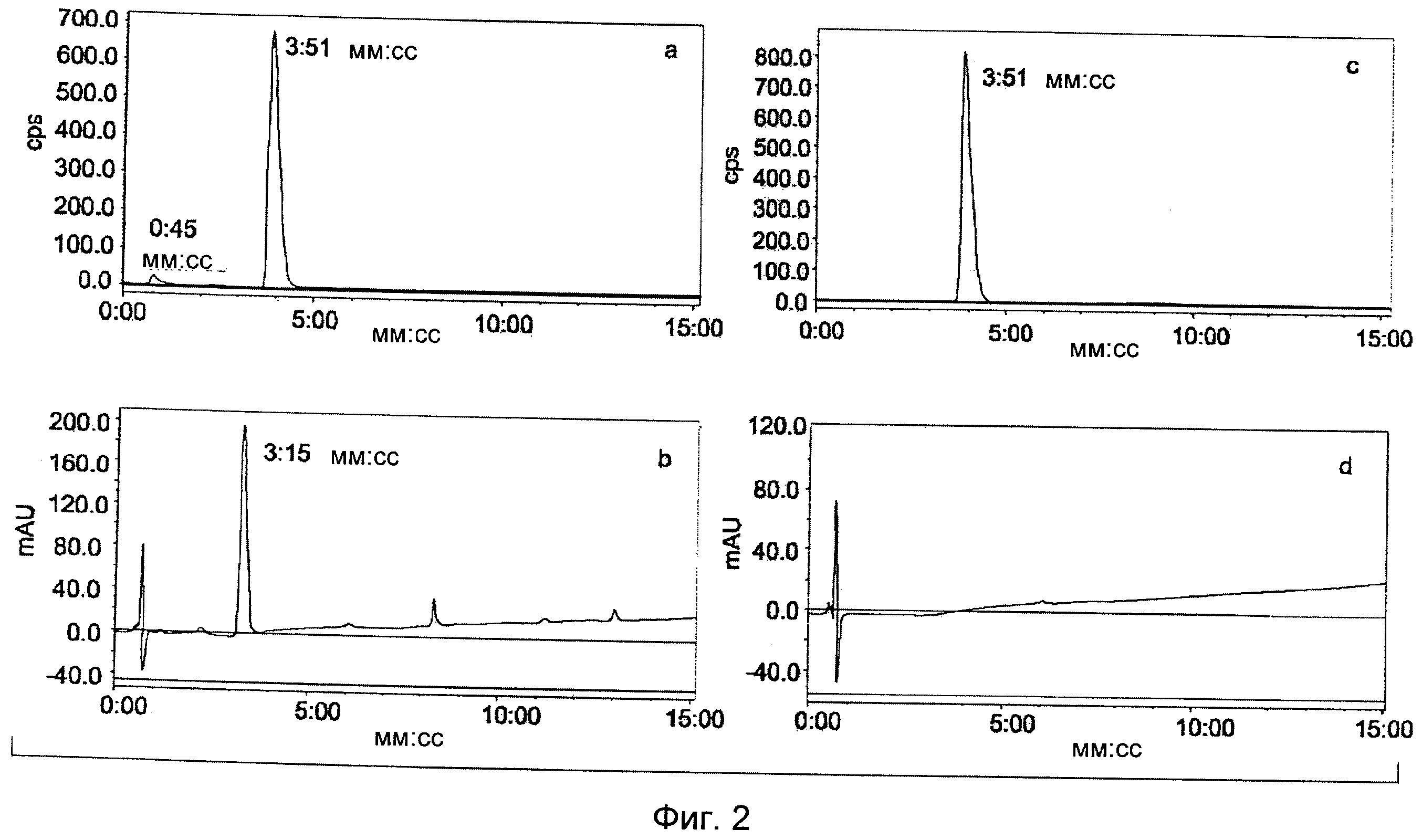
На Фиг.2 представлены результаты HPLC анализа реакционной смеси, содержащей 2-[18F]фторэтилазид (11), с использованием градиента I, УФ 216 нм (а, канал радиоактивности, 2-[18F]фторэтилазид (11) при 3:51 мин; b, УФ канал). Перегнанный продукт указывает на присутствие только 2-[18F]фторэтилазида (11) (с, канал радиоактивности; d, УФ канал).
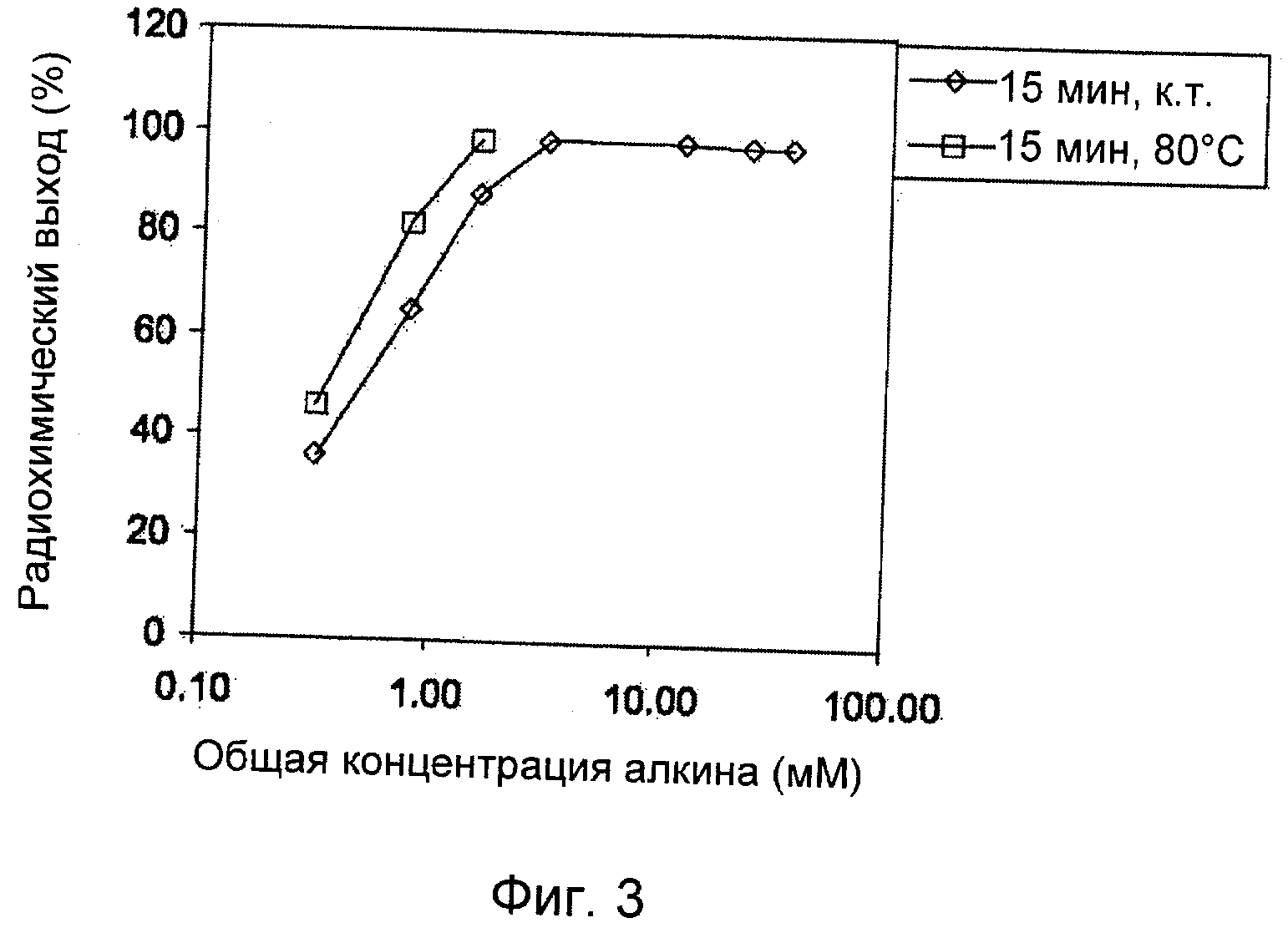
На Фиг.3 представлен HPLC график радиохимического выхода триазольного продукта (17), полученного при различных концентрациях алкина (16) и температурах с использованием модельного соединения (16) и 2-[18F]фторэтилазида (11).
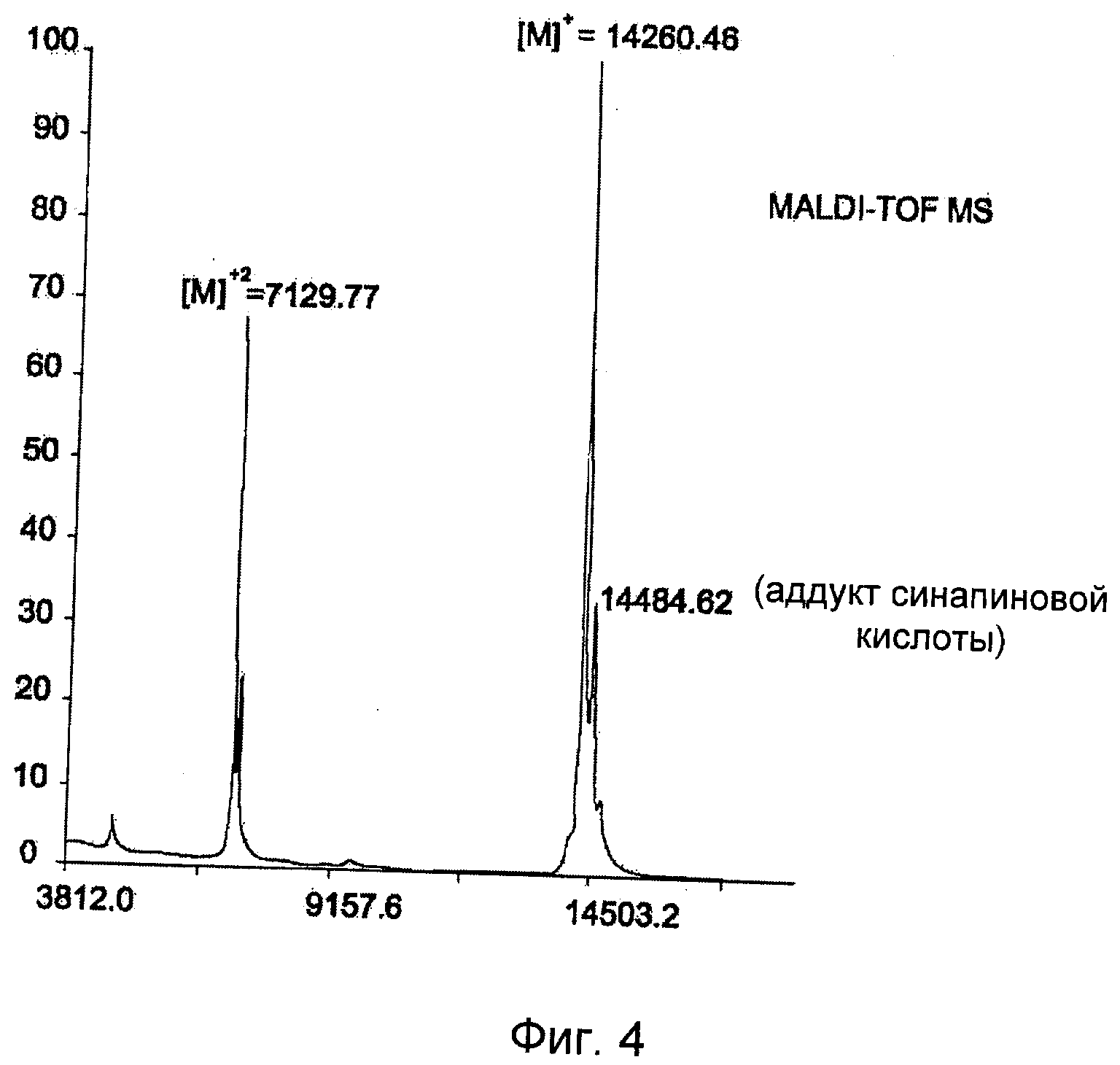
На Фиг.4 представлены данные MALDI-TOF MS (времяпролетная масс-спектрометрия с ионизацией методом лазерной десорбции из матрицы) для алкинилированного аффитела (22).
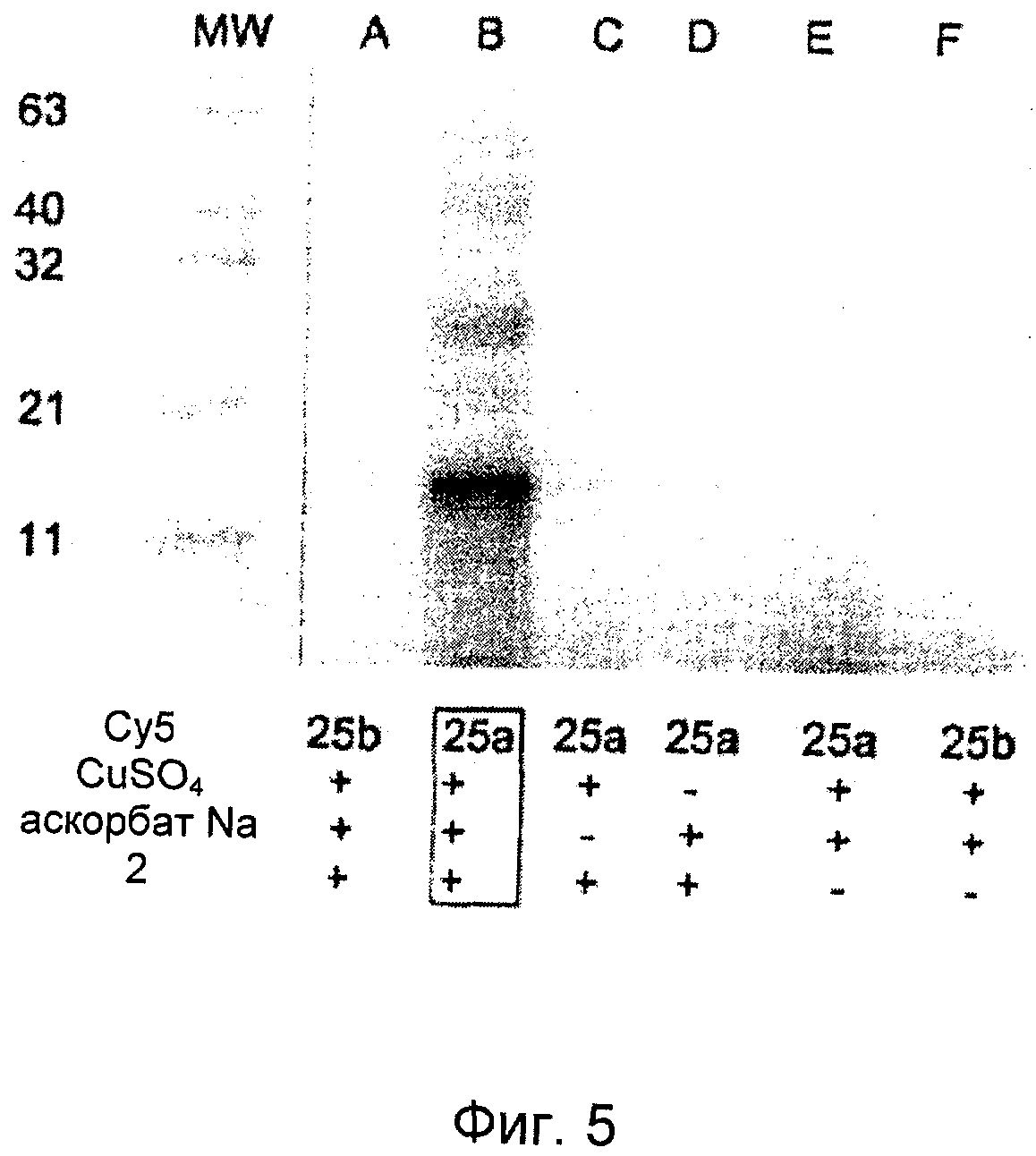
На Фиг.5 представлен SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия) белкового геля для "click" конъюгата между алкинилированным аффителом (22) и Су5-меченным азидо-PEG (25а). Испускание флуоресценции красителя Су5 наблюдается при молекулярной массе ожидаемого продукта-конъюгата (26) в присутствии источника Cu| и восстановителя. В контрольных экспериментах в отсутствие любого из них никакого присутствия конъюгированного продукта не наблюдается.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следующее ниже подробное описание является иллюстративным и не предназначено для ограничения изобретения согласно данной заявке и применений согласно данному изобретению. Более того, изобретение не ограничено никакой теорией, представленной в предшествующем описании уровня техники или в следующем ниже подробном описании изобретения.
Для того чтобы более ясно и кратко описать предмет настоящего изобретения и обратить внимание на него, следующие ниже определения предложены в отношении конкретных терминов, используемых в следующем ниже описании и прилагаемой к нему формуле изобретения. Формы единственного числа включают множественные формы для объектов ссылки, если иное явно не продиктовано контекстом.
Используемый в данном документе термин "активирующая группа" относится к любой группе, которая делает карбонильную группу более реакционно-способной по отношению к нуклеофилам, например N-гидроксисукцинимидной, сульфо-N-гидроксисукцинимидной, хлорангидридной и мочевинной промежуточным структурам.
Используемый в данном документе термин "азидо-реакционно-способный конец" и/или "азидо-реакционно-способная функциональная группа" относится к любой функциональной группе, которая может реагировать с азидной функциональной группой. Некоторые примеры азидо-реакционно-способных функциональных групп включают алкины, аллены и фосфины, но не ограничиваются ими.
Используемый в данном документе термин "алкин-реакционно-способный конец" и/или "алкин-реакционно-способная функциональная группа" относится к любой функциональной группе, которая может реагировать с алкиновой функциональной группой. Примеры алкин-реакционно-способной функциональной группы включают, без ограничения, азиды, которые могут реагировать в присутствии источника Cu|, в том числе, без ограничения, Cu0, Cu|, Cu||, и восстановителя, такого как аскорбат натрия.
Используемый в данном документе термин "алифатический радикал" или "алифатическая группа" обычно относится к упорядоченной последовательности атомов углерода, которая не является циклической и имеет точку присоединения, представляющую собой sp3 атом углерода. Упорядоченная последовательность атомов углерода может дополнительно содержать любую комбинацию sp3-, sp2- или sp-гибридизованных атомов углерода. Кроме того, упорядоченная последовательность атомов углерода может быть одновалентной, двухвалентной или трехвалентной. Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изооктил, бензил, циклогексилметил, фенетил и 1',1'-диметилбензил.
Используемые в данном документе термины "ароматический радикал" или/и "ароматическая группа" относятся к циклической упорядоченной последовательности sp2-гибридизованных атомов углерода и конъюгированных двойных связей углерод-углерод, которая имеет точку присоединения у ароматического sp2-гибридизованного атома углерода, составляющего часть этой циклической упорядоченной последовательности атомов углерода. Ароматическая группа или радикал может иметь от одного до максимально допустимого числа заместителей. Примеры арильных групп включают фенил, замещенный фенил, толил, замещенный толил, ксилил, мезитил, хлорфенил, нафтил, фурил, тиенил и пирролил.
Используемый в данном документе термин "циклоалкильный радикал" или "циклоалкильная группа" относится к циклической упорядоченной последовательности sp3-гибридизованных атомов углерода, которая имеет точку присоединения у sp3-гибридизованного углеродного атома, составляющего часть этой циклической упорядоченной последовательности атомов углерода. Упорядоченная последовательность атомов углерода может дополнительно содержать любую комбинацию sp3-, sp2- или sp-гибридизованных атомов углерода. Кроме того, циклическая упорядоченная последовательность атомов углерода может быть замещена от одного до максимально допустимого числа заместителей. Более того, упорядоченная последовательность циклических атомов углерода может содержать гетероатомы, такие как О, N или S. Примеры циклоалкильных групп включают циклогексил, метилциклогексил, триметилциклогексил, фенилциклогексил, тетрагидропиранил, 4-тиациклогексил и циклооктил.
Термин "дисульфидная группа, способная к тиол-обменной реакции с тиоловой группой" относится к группам, которые могут реагировать с тиоловой группой биомолекулы. Таким образом, дисульфид можно рассматривать в качестве тиол-реакционно-способной группы. Пиридилдисульфид является примером такого дисульфида.
Используемый в данном документе термин "фторзамещенный азид" обозначает азид-содержащее соединение, имеющее по меньшей мере один фтор-заместитель. Кроме того, фтор-заместитель может представлять любое множество изотопов, такое как, например, 18F и 19F. В одном из воплощений фтор-заместитель представляет собой 18F. Азид может быть алифатическим азидом, циклоалифатическим азидом или ароматическим азидом. Более того, циклоалифатические азиды и ароматические азиды могут иметь моноциклические, бициклические или полициклические структуры.
Используемый в данном документе термин "фторзамещенный алкин" обозначает алкин-содержащее соединение, имеющее по меньшей мере один фтор-заместитель. Кроме того, фтор-заместитель может представлять любое множество изотопов, такое как, например, 18F и 19F. В одном из воплощений фтор-заместитель представляет собой 18F. Алкин может быть алифатическим алкином, циклоалифатическим алкином или ароматическим алкином. Более того, циклоалифатические алкины и ароматические алкины могут иметь моноциклические, бициклические или полициклические структуры.
Термины "белок", "пептид" и "полипептид" используют в данном документе для описания любой цепи аминокислот, независимо от длины или посттрансляционной модификации, например, гликозилирования или фосфорилирования. Таким образом, для ссылки на полимер из аминокислотных остатков эти термины могут быть использованы в данном документе взаимозаменяемым образом. Эти термины также применяют к аминокислотным полимерам, в которых один или более чем один аминокислотный остаток является искусственным химическим миметиком соответствующей природной аминокислоты. Таким образом, термин "полипептид" включает как полноразмерные природные белки, так и рекомбинантно или синтетически полученные полипептиды, которые соответствуют полноразмерному природному белку или конкретным доменам или частям природного белка.
Термины "радикал" и "группа" в отношении терминов "алкильный", "алифатический", "циклоалифатический" и "ароматический" используют в данном документе взаимозаменяемым образом.
Используемый в данном документе термин "тиол-реакционно-способный конец" и/или "тиол-реакционно-способная функциональная группа" относится к функциональной группе, которая может реагировать с тиоловой группой или меркаптановой группой (то есть группой -SH). Примеры тиол-реакционно-способных функциональных групп включают группу малеимидо, галогеналифатическую группу, галогенароматическую группу, галогенциклоалифатическую группу, (галогенацетил)алкильную группу, (галогенацетил)циклоалкильную группу, (галогенацетил)арильную группу, α,β-ненасыщенную сульфоновую группу, винилсульфоновую группу, α,β-ненасыщенную карбонильную группу, группу эпокси, азиридиновую группу и дисульфидную группу, способную к тиол-обменной реакции с тиоловой группой, но не ограничены ими.
Подходящие группы малеимидо включают как родительскую (незамещенную) группу, так и производные, содержащие алифатические, циклоалифатические или ароматические группы в качестве заместителей. Подходящие α,β-ненасыщенные карбонильные группы включают группы, содержащие акрилоильную группу. Подходящие α,β-ненасыщенные карбонильные группы включают α,β-ненасыщенные сложные эфиры и α,β-ненасыщенные сульфоны. Винилсульфоновая группа является конкретным примером α,β-ненасыщенной сульфоновой группы.
Следует понимать, что если не указано иное, то все числа, выражающие количества ингредиентов, свойства, например молекулярную массу, условия реакции и тому подобное, используемые в описании и формуле изобретения, во всех случаях являются корректируемыми посредством термина "примерно". Соответственно, если не указано иное, численные параметры, изложенные в следующем ниже описании и прилагаемой формуле изобретения, являются приближенными значениями, которые могут варьироваться в зависимости от тех свойств, которые хотели определить в настоящем изобретении. По меньшей мере, но не в качестве попытки ограничить объем формулы изобретения путем использования теории эквивалентов, каждый численный параметр следует толковать в свете количества представленных значащих цифр и обычных правил округления.
Аспекты изобретения относятся к способу введения атома фтора в биомолекулу. Способ включает стадии:
(1) предоставления линкера, содержащего тиол-реакционно-способный конец и азидо- или алкин-реакционно-способный конец;
(2) взаимодействия тиол-реакционно-способного конца линкера с биомолекулой, содержащей по меньшей мере одну тиоловую группу или ее реакционно-способное производное; и
(3) последующего взаимодействия азидо- или алкин-реакционно-способного конца линкера с фторзамещенной азидной или алкиновой группой, соответственно.
Другой аспект изобретения заключается в предоставлении биоконъюгатной композиции, содержащей структурные единицы, полученные из биомолекулы, содержащей по меньшей мере одну тиоловую группу, и линкера. Линкер может быть получен способом, включающим взаимодействие аминного соединения, содержащего азидо- или алкин-реакционно-способную функциональную группу, с карбоновой кислотой или активированным сложным эфиром, содержащими тиол-реакционно-способную функциональную группу. В другом аспекте линкер может быть получен путем взаимодействия аминного соединения, содержащего тиол-реакционно-способную функциональную группу, с карбоновой кислотой или активированным сложноэфирным соединением, содержащими азидо- или алкин-реакционно-способную функциональную группу.
Биомолекулы
Используемый в данном документе термин "биомолекулы" относится к природным или искусственно полученным молекулам, которые содержат по меньшей мере одну тиоловую группу (также иногда называемую группой "меркапто") или ее реакционно-способное производное, для взаимодействия с линкером. Тиоловая группа может или естественным образом входить в биомолекулу или может быть введена или получена химическим путем с использованием стандартных биологических методов либо подходящих методов, известных из уровня техники. В некоторых воплощениях из биомолекул специально исключены биомолекулы, имеющие менее 50 аминокислотных остатков.
Такие биомолекулы могут иметь одну или более групп SH либо в своем естественном состоянии, либо они могут быть искусственно полученными, например, с использованием стандартных методик в молекулярной биологии. Примеры биомолекул, имеющих группу SH естественным образом, включают молекулы, связанные с одной или более цистеиновыми аминокислотами. Под термином "ее реакционно-способное производное" понимают производное группы SH, которое активировано таким образом, чтобы образовать свободную тиоловую группу для взаимодействия с линкерным соединением.
Примеры биомолекул, которые содержат одну или более тиоловых групп либо естественным образом, либо тиоловых групп, полученных химическим путем, включают пептиды, полипептиды, вектор, липиды, полисахариды, гликозаминогликаны и их модифицированные версии, гликолипиды, гликопротеины, синтетические полимеры, клеточные модуляторы (например, факторы роста, хемотаксические факторы или цитокины), ферменты, рецепторы, нейротрансмиттеры, гормоны, цитокин, вакцины, гаптены, токсины, интерфероны и рибозимы. Раскрытые способы также можно применять в отношении молекул, которые не содержат тиоловую группу, но конъюгированы с молекулой, содержащей тиоловую группу. Дополнительные примеры биомолекул включают белки, фрагменты белков, вариации белков, каркасные (scaffold-based) белки, искусственные белки, нуклеотиды и родственные молекулы, нуклеиновые кислоты, пептидные конъюгаты олиго-ДНК или олиго-РНК, антитела, такие как поликлональные и моноклональные антитела и фрагменты на основе антител. Таким образом, раскрытые способы можно применять для фторирования нуклеиновых кислот, включая дезоксирибонуклеиновые кислоты (например, олигодезоксинуклеотиды, зонды нуклеиновых кислот, плазмиды), рибонуклеиновые кислоты (например, миРНК), ассоциированные с тиол-содержащей молекулой, такой как полипептид, которая имеет тиоловую группу.
Биомолекулы могут быть любыми природными или искусственно полученными биомолекулами, имеющими по меньшей мере одну тиоловую группу. Во всех воплощениях биомолекула может содержать остатки природных и/или искусственных аминокислот. В другом воплощении биомолекула, содержащая по меньшей мере одну тиоловую группу, содержит цистеиновый остаток или искусственную группу. Под термином "цистеиновый остаток" понимают отличный от тиоловой группы структурный фрагмент в виде части цепи биомолекулы, который является результатом включения цистеина. В еще одном воплощении биомолекула для взаимодействия с линкером представляет собой биомолекулу, которая имеет искусственно полученный цистеиновый остаток; это означает, что подходящая биомолекула-предшественник может быть химически модифицирована для образования желаемой биомолекулы, содержащей тиоловую группу и цистеиновый остаток.
В некоторых случаях биомолекула для образования реакционно-способной тиоловой группы может быть обработана восстановителем. Например, биомолекула, имеющая дисульфидную связь, может быть восстановлена подходящим восстановителем с получением двух эквивалентов биомолекулы, имеющей тиоловую группу. Примеры подходящих восстановителей включают 2-меркаптоэтанол, 2-меркаптоэтаноламин, дитиотреитол (DTT) и трис-(2-карбоксиэтил)фосфин (ТСЕР).
Линкеры
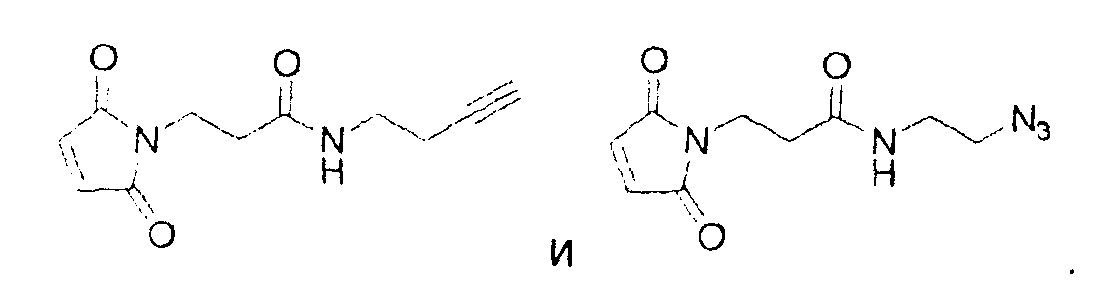
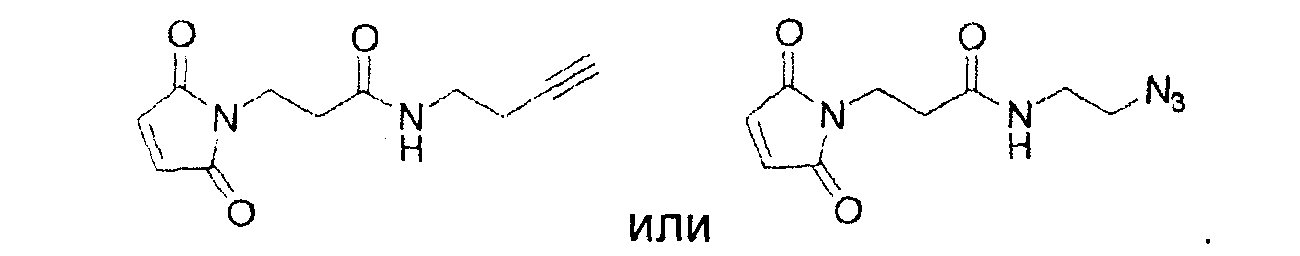
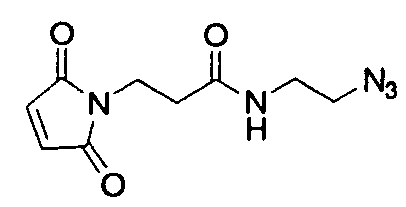
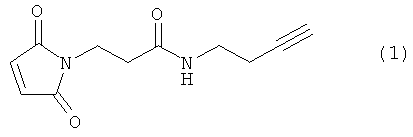
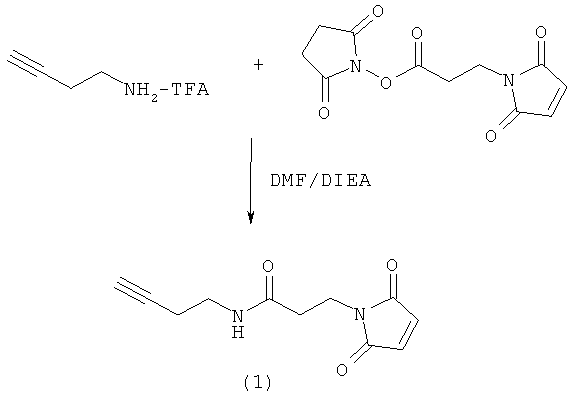
Используемый в данном документе термин "линкер" относится к бифункциональному соединению, содержащему тиол-реакционно-способный конец или его защищенное производное и азидо- или алкин-реакционно-способный конец или его защищенное производное. Линкеры могут быть использованы для присоединения тиол-содержащего соединения к одному концу посредством тиол-реакционно-способного конца и для присоединения азида или алкина, особенно фторзамещенного азида или алкина, к другому концу посредством азидо- или алкин-реакционно-способного конца, соответственно. Используемый в данном документе термин "Mal-алкиновый бифункциональный линкер" относится к линкеру, имеющему группу малеимидо на одном конце и алкиновую группу на другом конце, такому как N-(бут-3-инил)-3-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)пропанамидный линкер (1), а термин "Mal-азидный бифункциональный линкер" относится к линкеру, имеющему группу малеимидо на одном конце и азидную группу на другом конце, такому как соединение (2). Некоторые неограничивающие примеры линкеров показаны с помощью структур (1)-(6)
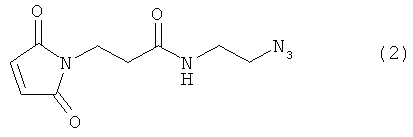

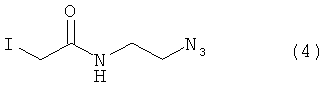
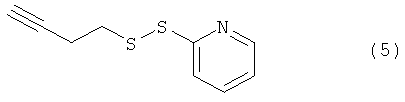
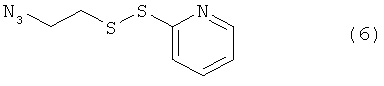
В некоторых воплощениях тиол-реакционно-способный конец, азидо- или алкин-реакционно-способный конец, или как тиол-реакционно-способный конец, так и азидо- или алкин-реакционно-способный конец могут быть заменены предшественником-производным. Линкеры могут быть использованы для присоединения тиол-содержащего соединения к одному концу посредством тиол-реакционно-способного конца и/или для присоединения азида или алкина (например, фторзамещенного азида или алкина) к другому концу посредством азидо- или алкин-реакционно-способного конца, соответственно.
Получение линкера
Линкер может быть получен любым способом, который делает как тиол-реакционно-способную функциональную группу, так и азидо- или алкин-реакционно-способную функциональную группу доступной к взаимодействию с (1) биомолекулой, имеющей, по меньшей мере одну тиоловую группу, и (2) фторзамещенным азидом или алкином, соответственно. В одном воплощении линкер получают путем взаимодействия аминного соединения, содержащего азидо- или алкин-реакционно-способную функциональную группу, с карбоновой кислотой или активированным сложным эфиром, содержащими тиол-реакционно-способную группу. Может быть использовано любое аминное соединение, имеющее азидо- или алкин-реакционно-способную функциональную группу. В одном воплощении аминное соединение включает структуру (7)
 ,
,
где G представляет собой азидо- или алкин-реакционно-способную функциональную группу, J представляет собой связующее звено, и R1 представляет собой Н, алифатический радикал, ароматический радикал или циклоалифатический радикал. Для минимизации стерического препятствия, которое могло бы неблагоприятно влиять на реакционную способность тиол-реакционно-способной и азидо- или алкин-реакционно-способной функциональных групп, можно разработать двухвалентное связующее звено J конкретной природы. Одно из преимуществ настоящего подхода заключается в том, что связующее звено может быть специально подобрано для изменения конечных свойств биоконъюгата. Таким образом, линкеры могут различаться по размеру, полярности, заряду и химическому составу с целью модификации свойств конечных конъюгатов, таких как растворимость и фармакокинетические/фармакодинамические (PK/PD) свойства. Более того, линкеры могут включать дополнительные концы для присоединения групп, которые могут улучшить нацеливание и/или растворимость.
В других воплощениях линкер может быть получен путем взаимодействия аминного соединения, содержащего тиол-реакционно-способную функциональную группу с карбоновой кислотой или активированным сложноэфирным соединением, содержащими азидо- или алкин-реакционно-способную функциональную группу.
Карбоновая кислота или активированный сложный эфир включают структуру (8)

где L включает тиол-реакционно-способную функциональную группу или ее защищенное производное, М представляет собой двухвалентное связующее звено, и R2 представляет собой ОН или активирующую группу. Активирующая группа R2 облегчает взаимодействие аминного соединения, имеющего азидо-или алкин-реакционно-способную функциональную группу, с карбонильным атомом углерода из структуры (8).
В другом воплощении линкерная структура включает формулу
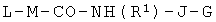 ,
,
где L представляет собой тиол-реакционно-способную функциональную группу;
М и J представляют собой бифункциональные звенья/связующие звенья;
R1 представляет собой Н, алифатический радикал, ароматический радикал или циклоалифатический радикал; и
G представляет собой азидо- или алкин-реакционно-способную функциональную группу.
Типичные синтетические подходы с целью получения линкера, имеющего структуру (1) и (2), изображены на реакционных схемах 1 и 2.
Реакционная схема 1
Реакционная схема 2
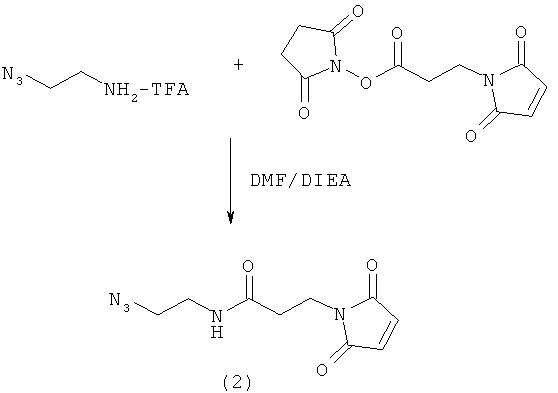
На реакционных схемах 1 и 2 DMF означает диметилформамид, a DIEA означает диизопропилэтиламин. Некоторые примеры линкеров, которые могут быть получены с использованием этих методов, показаны выше с помощью структур (1)-(6).
Биоконъюгаты
Продукты, получающиеся в результате взаимодействия линкера с биомолекулой, имеющей по меньшей мере одну тиоловую группу, обозначают термином "биоконъюгат". Таким образом, в одном воплощении биоконъюгат содержит структурные единицы, полученные из: (1) биомолекулы, содержащей по меньшей мере одну тиоловую группу; и (2) линкера, где линкер получают способом, включающим взаимодействие аминного соединения, содержащего азидо- или алкин-реакционно-способную функциональную группу, с карбоновой кислотой или активированным сложным эфиром, содержащими тиол-реакционно-способную функциональную группу. В другом воплощении биоконъюгат содержит структурные единицы, полученные из: (1) биомолекулы, содержащей по меньшей мере одну тиоловую группу; и (2) линкера, где линкер получают способом, включающим взаимодействие аминного соединения, содержащего тиол-реакционно-способную функциональную группу, с карбоновой кислотой или активированным сложным эфиром, содержащими азидо- или алкин-реакционно-способную функциональную группу. В другом аспекте линкер может быть получен путем взаимодействия аминного соединения, содержащего тиол-реакционно-способную функциональную группу, с карбоновой кислотой или активированным сложноэфирным соединением, содержащими азидо- или алкин-реакционно-способную функциональную группу.
Способы фторирования биоконъюгатов
Описанные здесь способы позволяют получать биоконъюгаты, меченные фтором, более конкретно биоконъюгаты, меченные радиоактивным фтором (например, 18F). Одно из преимуществ этих способов заключается в том, что линкер может быть селективно присоединен к биомолекуле, например к биомолекуле в нерадиоактивных условиях, при которых тиоловая группа биомолекулы может селективно взаимодействовать с тиол-реакционно-способной функциональной группой линкера, и получающийся биоконъюгат может быть очищен до взаимодействия с 18F- или обычным фтор-замещенным азидом или алкином. Другое преимущество заключается в том, что метка радиоактивного фтора может быть селективно присоединена на конечной стадии, тем самым устраняя необходимость в требующих много времени дополнительных стадиях очистки перед получением конечного биоконъюгата, особенно в качестве изотопных индикаторов.
Описанные здесь способы введения фтора в биоконъюгат могут быть использованы для создания фторированного биоконъюгата любой длины. Таким образом, в некоторых воплощениях биомолекула биоконъюгата содержит по меньшей мере 50 аминокислотных остатков или по меньшей мере 100 аминокислотных остатков.
В одном аспекте изобретения раскрыты способы введения одного или более атомов фтора в биомолекулу. Способы могут включать: (1) предоставление линкера, содержащего тиол-реакционно-способный конец и азидо- или алкин-реакционно-способный конец; (2) взаимодействие тиол-реакционно-способного конца линкера с биомолекулой, содержащей по меньшей мере одну тиоловую группу или ее реакционно-способное производное; и (3) последующее взаимодействие азидо- или алкин-реакционно-способного конца линкера с фторзамещенным азидом или алкином, соответственно.
В некоторых воплощениях способов введения атома фтора в биомолекулу, такую как полипептид, тиол-реакционно-способный конец линкера выбран из группы малеимидо, галогеналифатической группы, галогенароматической группы, галогенциклоалифатической группы, (галогенацетил)алкильной группы, (галогенацетил)циклоалкильной группы, (галогенацетил)арильной группы, винилсульфоновой группы, акрилоильной группы, группы эпокси, азиридиновой группы и дисульфидной группы, способной к тиол-обменной реакции с тиоловой группой.
Более конкретно, описанные здесь способы могут быть использованы для введения одного или более атомов фтора в биомолекулу с помощью Mal-алкинового бифункционального линкера, например N-(бут-3-инил)-3-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)пропанамида (1) в качестве линкера. Такие способы включают: (1) взаимодействие тиол-реакционно-способной группы N-(бут-3-инил)-3-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)пропанамида (1) с биомолекулой, содержащей по меньшей мере одну тиоловую группу; и (2) последующее взаимодействие алкиновой группы промежуточного продукта, получающегося на стадии (1), с фторзамещенным азидом. В другом воплощении способы могут быть использованы для введения одного или более атомов фтора в биомолекулу с помощью Mal-азидного бифункционального линкера, например соединения (2) в качестве линкера. Такие способы включают: (1) взаимодействие тиол-реакционно-способной функциональной группы соединения (2) с биомолекулой, содержащей по меньшей мере одну тиоловую группу; и (2) последующее взаимодействие азидной группы промежуточного продукта, получающегося на стадии (1) с фторзамещенным алкином.
Реакцию азидо- или алкин-реакционно-способного конца линкера с фторзамещенным азидом или алкином можно проводить в любых условиях, которые могут изменяться от слабокислых до умеренно щелочных условий. В одном воплощении реакцию можно проводить в среде, имеющей рН в диапазоне от примерно 6 до примерно 9; а в другом воплощении при рН в диапазоне от примерно 7 до примерно 8. Температуру реакции можно варьировать от температуры окружающей среды до примерно 70°С. Время реакции можно менять, но обычно оно может составлять от примерно 10 до примерно 60 минут. В некоторых воплощениях время реакции изменяется от примерно 10 минут до примерно 30 минут. Однако также могут быть использованы более длительные времена реакции. Реакцию можно проводить в присутствии Cu| или его предшественника, включая соли Cu0, Cu| или Cu||, но не ограничиваясь ими, в присутствии восстановителя, такого как аскорбат натрия, но не ограничиваясь им. На реакционных схемах 3 и 4 изображены возможные способы получения биоконъюгатов (9) и (10), меченных фтором.
|
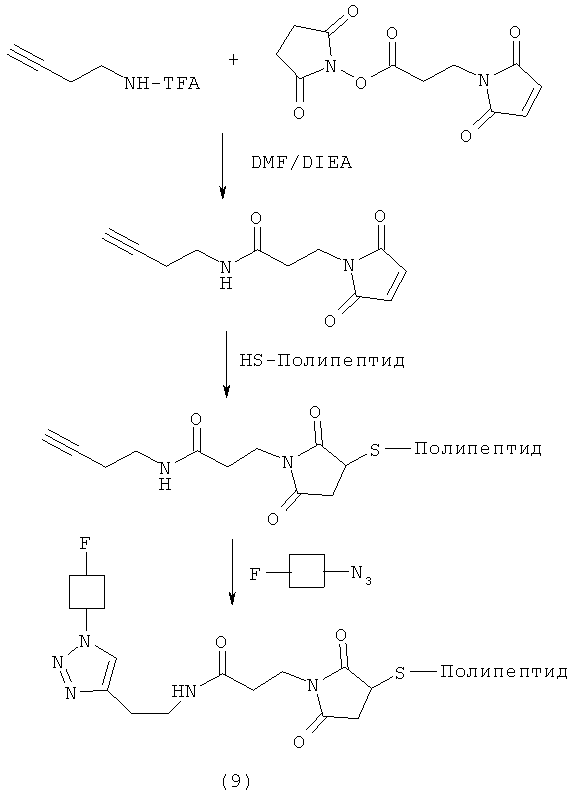
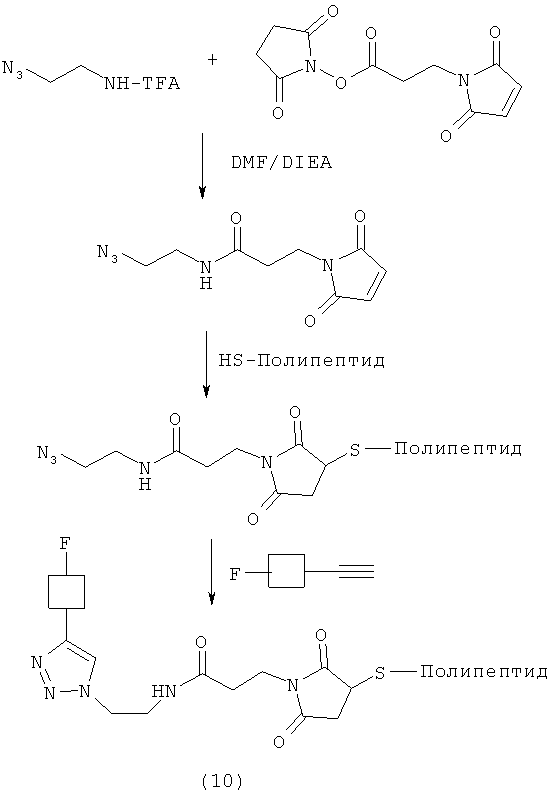
В одном способе предшественник алкин- или азид-содержащего линкера сначала может быть подвергнут взаимодействию с полипептидом, содержащим тиоловую группу, а получающееся промежуточное соединение преобразовано в желаемый биоконъюгат. Альтернативно, предшественник алкин- или азид-содержащего линкера сначала может быть преобразован в линкер, который затем может быть подвергнут взаимодействию с полипептидом, содержащим тиоловую группу, с получением продукта.
Используя описанные выше методики, можно ввести атом(ы) фтора или радиоактивного фтора, такого как 18F, в биомолекулу. В результате реакции фторзамещенного азида или алкина с биоконъюгатом получают фторзамещенный биоконъюгат. В результате реакции азида или алкина, замещенного радиоактивным фтором, с биоконъюгатом получают биоконъюгат, меченный радиоактивным фтором. Неограничивающие примеры подходящих фторзамещенных азидов/алкинов показаны с помощью структур (11)-(14).
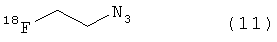

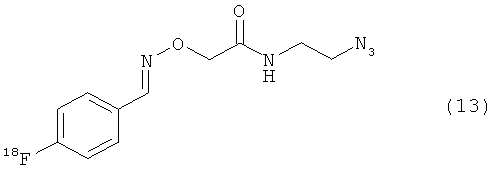
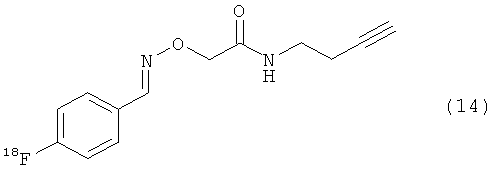
Любые биомолекулы, такие как полипептиды, описанные ранее, имеющие по меньшей мере одну тиоловую группу могут быть использованы для получения биоконъюгатов. Биомолекулы, такие как полипептиды, векторы, каркасные белки и искусственные связывающие белки, имеющие по меньшей мере одну тиоловую группу, являются особенно ценными, так как такие материалы обладают потенциальной диагностической и терапевтической ценностью. Таким образом, в одном воплощении биоконъюгаты могут быть получены путем взаимодействия каркасных белков, таких как аффитела, с Mal-алкиновым бифункциональным линкером, таким как N-(бут-3-инил)-3-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)пропанамидный линкер (1). В другом воплощении биоконъюгаты могут быть получены путем взаимодействия каркасных белков, таких как аффитела, с Mal-азидным бифункциональным линкером, таким как соединение (2). Кроме того, ценные меченные фтором биоконъюгаты могут быть получены путем взаимодействия биоконъюгата с фторзамещенным азидом или алкином.
Биоконъюгаты, меченные фтором, являются ценными веществами для диагностических приложений. Биоконъюгаты, меченные 18F, могут быть подвергнуты визуализации с использованием методик визуализации, известных из уровня техники, таких как, например, ПЭТ- (позитронная эмиссионная томография) методик.
Несмотря на то, что в данном документе были проиллюстрированы и описаны только лишь некоторые особенности этого изобретения, множество других модификаций и изменений будут понятны специалистам в данной области техники. Поэтому следует понимать, что прилагаемая формула изобретения предназначена для того, чтобы охватить все такие модификации и изменения, которые находятся в рамках действительной сущности настоящего изобретения.
ПРИМЕРЫ
Практическое применение изобретения станет еще более понятным из следующих ниже примеров, которые представлены здесь только для иллюстрации, и их не следует толковать в качестве ограничивающих настоящее изобретение каким-либо образом.
Сокращения, используемые в разделе Примеры, расшифровываются следующим образом: "мг": миллиграммы; "мл": миллилитры; "мг/мл": миллиграмм на миллилитр; "ммоль": миллимоль; "мкл": микролитр; "кДа": килодальтон; "MALDI-MS": масс-спектрометрия с ионизацией методом лазерной десорбции из матрицы; "HPLC": жидкостная хроматография высокого давления; "LC-MS": жидкостная хроматография - масс-спектрометрия; "ESI-MS": масс-спектрометрия с электрораспылительной ионизацией; "MALDI-TOF MS": времяпролетная масс-спектрометрия с ионизацией методом лазерной десорбции из матрицы; "TFA": трифторуксусная кислота; "DMSO": диметилсульфоксид; "DTT": дитиотреитол; "MeCN": ацетонитрил; "PBS": фосфатно-солевой буферный раствор; "Mal": малеимидо; "млн-1": частей на миллион, "MWCO": отсечение по молекулярной массе; "холодные условия"; без радиоактивного изотопа; и "радиохимический выход": доля первоначального уровня активности. Если не указано иное, все чистые для анализа (reagent-grade) химические реактивы использовали в том виде, в котором они были получены; для приготовления всех водных растворов использовали воду Millipore.
Пример 1. Получение 2-[18F]Фторэтилазида (11)

[18F]-фторид получали с помощью циклотрона, используя ядерную реакцию 18O(р,n)18F с облучением обогащенной [18О]H2O мишени протонами с энергией 19 МэВ. После облучения к 18F-воде (1 мл) добавляли смесь Kryptofix® (5 мг, 13,3 мкмоль), карбоната калия (1 мг, 7,2 мкмоль) и MeCN (1 мл). Растворитель удаляли нагреванием при 80°С в потоке азота (100 мл/мин). После этого добавляли MeCN (0,5 мл) и выпаривали при нагревании и потоке азота. Эту процедуру повторяли дважды. После охлаждения до комнатной температуры добавляли раствор 2-азидоэтилового эфира толуолсульфоновой кислоты (15) в безводном MeCN (0,2 мл). Реакционную смесь перемешивали в течение 15 минут при 80°С. После добавления MeCN (0,3 мл), 2-[18F]фторэтилазид (11) перегоняли при 130°С в потоке азота (15 мл/мин) и собирали в сборник-уловитель, содержащий MeCN (0,1 мл). Соединение (11) получали с радиохимическим выходом, скорректированным на распад, 54% (относительно 18F-фторида) и эффективностью перегонки 63%.
На Фиг.2 представлены результаты HPLC анализа реакционной смеси, содержащей 2-[18F]фторэтилазид (11), с использованием градиента I, УФ 216 нм (а, канал радиоактивности, 2-[18F]фторэтилазид (11) при 3:51 мин; b, УФ канал), и перегнанного продукта, 2-[18F]фторэтилазида (11) (с, канал радиоактивности; а, УФ канал).
Пример 2. Исследования влияния концентрации, демонстрирующие образование триазола при разных концентрациях небольшого субстрата
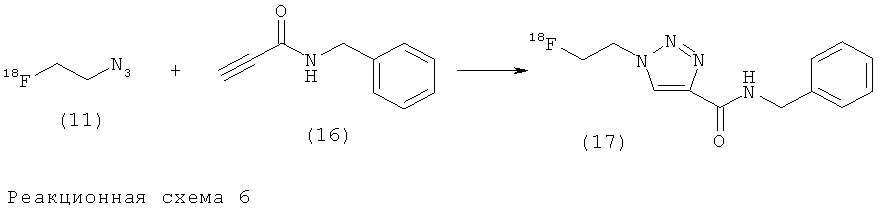
В этом исследовании влияния концентрации, модельный алкин (16) (1,2-0,01 мг, 7,5-0,25 мкмоль) растворяли в DMF (50 мкл) и смешивали в атмосфере азота с водным раствором сульфата меди (II) (25 мкл, 2,8 мг, 11,25 мкмоль) и аскорбата натрия (25 мкл, 7,5 мг, 37,5 мкмоль). После добавления [18F]2-фторэтилазида (11) в MeCN (100 мкл) и выдержки в течение 15 мин при комнатной температуре смесь анализировали с помощью HPLC. Затем пробирки нагревали (15 мин, 80°С) и снова анализировали.
Образующийся в результате триазольный продукт (17) получали с количественным выходом при комнатной температуре при минимальной концентрации модельного алкина (16), составляющей 3,14 мМ (100 мкг). При нагревании реакционной смеси при 80°С минимальная концентрация модельного алкина (16) для количественного выхода образующегося в результате триазола (17) составила 1,57 мМ (50 мкг).
На Фиг.3 представлен HPLC график радиохимического выхода триазольного продукта (17), полученного при различных концентрациях алкина (16) и температурах с использованием модельного соединения (16) и 2-[18F]фторэтилазида (11).
Пример 3. Образование триазола на пептиде
Получение [18F](S)-амино-2-(2-{(S)-2-[2-((S)-6-амино-2-{[4-(2-фтор-этил)-[1,2,3]триазол-1-карбонил]-амино}-гексаноиламино)-ацетиламино]-3-фенил-пропиониламино}-ацетиламино)-гексановой кислоты (19)
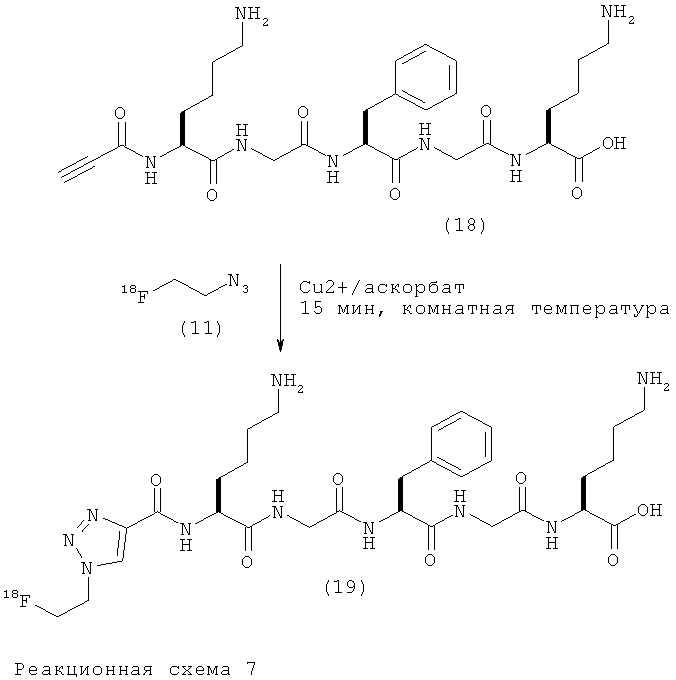
К раствору пентагидрата сульфата меди (II) (4,3 мг, 17 мкмоль) в воде (50 мкл) добавляли раствор аскорбата натрия (3,4 мг, 17 мкмоль) в воде (50 мкл) в атмосфере азота. Через примерно 1 минуту при комнатной температуре добавляли раствор алкинового пептидного предшественника (18) (2 мг, 3,4 мкмоль, в натрий-фосфатном буфере, рН 6,0, 0,5 М, 50 мкл), а затем раствор 2-[18F]фторэтилазида (11) (24-32 МБк) в MeCN (50 мкл). Смесь выдерживали при комнатной температуре в течение 15 минут и разбавляли подвижной фазой А для HPLC (вода, 0,1% TFA) (0,3 мл). Меченый пептид (19) выделяли с помощью полупрепаративной HPLC (УФ 216 нм, Rt=6:24).
Пример 4. Синтез Mal-алкинового бифункционального линкера (1)
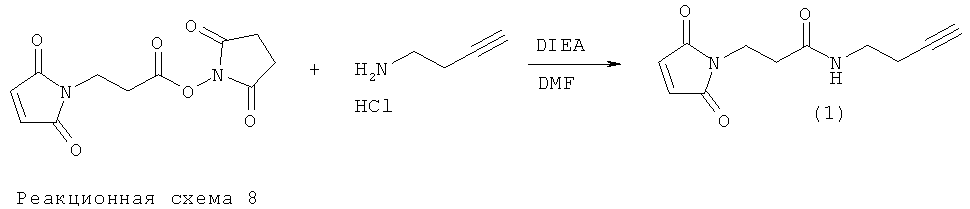
N-[β-малеимидопропилокси]сукцинимидный сложный эфир (50 мг, 1,25 экв.) растворяли в 1,0 мл сухого DMF. Гидрохлорид 3-бутин-1-амина (16 мг, 1,0 экв.) растворяли в 0,5 мл сухого диметилформамида (DMF) и 26 мкл диизопропилэтиламина (DIEA). Этот аминный раствор по каплям добавляли к сукцинимидному сложному эфиру, причем эфирный раствор держали в ледяной бане. Смесь перемешивали при 0°С в течение 10 мин. Раствор нагревали до комнатной температуры и перемешивали в течение 18 ч. Растворители выпаривали под вакуумом, и остаток растворяли в 5 мл CH2Cl2. Органический раствор экстрагировали рассолом (3×5 мл) и сушили над MgSO4. Растворитель удаляли при пониженном давлении, и неочищенный материал очищали флэш-хроматографией (диоксид кремния, MeOH/CH2Cl2). Продукт (1) очищали от жира путем растворения образца в минимальном количестве CH2Cl2 (около 2 мл) с последующими тремя промывками смесью гексанов. Продукт (1) выпадал в осадок в виде пушистого белого вещества. Характеристики продукта определяли с помощью 1H-ЯМР. Выход: 8,2 мг (25%). 1H-ЯМР (500 МГц, CDCl3): δ 2.02 (s, 1), 2.41 (t, J=5 Гц, 2), 2.57 (t, J=5 Гц, 2), 3.42 (td, J=5 Гц, 2), 3.88 (t, J=5 Гц), 5.90 (bs, 1), 6.73 (s, 2).
Пример 5. Получение 2-фторэтилтриазол-малеимида (контрольное соединение)(21)
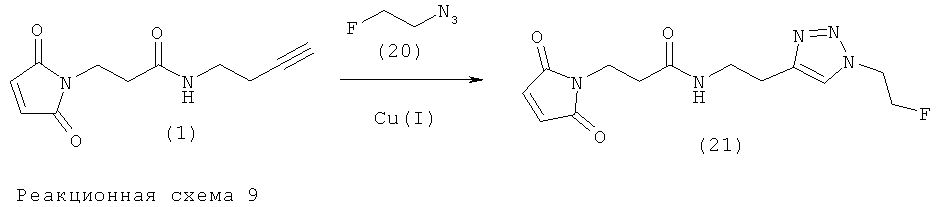
Через смесь натрий-фосфатного буфера (20 мкл, 250 мМ, рН 6,0), DMF (50 мкл) и порошка меди (100 мг, - 40 меш, Aldrich Cat. No.26,608-6) продували газообразный азот (10 мл/мин) в течение 5 минут. После добавления 2-фторэтилазида (20) (10 мкмоль) в DMF (9,2 мкл, приготовлен, как описано Glaser и Arstad, 2007) и 3-(N-малеимидил)-N-(3-пропаргил)пропионамида (1) (2,1 мг, 9,5 мкмоль) в DMF (20 мкл), содержимое сосуда перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли при пониженном давлении (1 мбар (100 Па), 80°С). После очистки препаративной HPLC получили фторэтилтриазольное соединение (21) (1,2 мг, 41%). HR (высокого разрешения) ESI-MS для C13H16N5O3F: рассчитано: m/z=310,1310, найдено: m/z=310,1314.
Очистка препаративной HPLC (градиент: 5-80% растворителя В в течение 15 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой MeCN/0,1% TFA, скорость потока: 15 мл/мин; колонка: Luna 5 мкм С18(2) (Phenomenex), 75×30 мм, детектирование: УФ 216 нм).
Пример 6. Аликинилирование аффитела и взаимодействие с Mal-алкиновым бифункциональным линкером
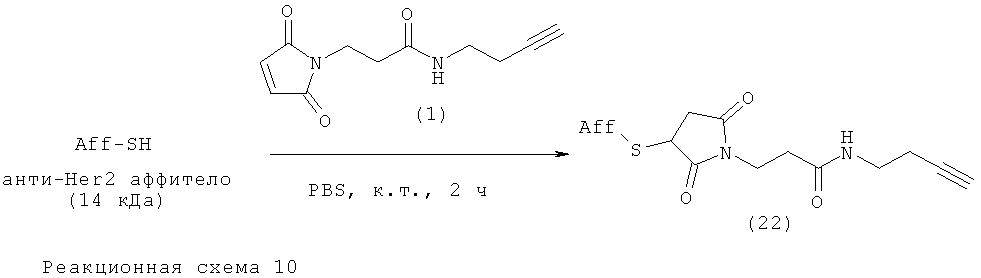
Анти-Her2 аффитело (14 кДа, 1 мг в виде лиофилизированного порошка) растворяли в 460 мкл фосфатно-солевого буферного раствора (PBS). рН раствора поддерживали на уровне 7,4. К этому раствору добавляли 40 мкл 0,5М раствора дитиотреитола (DTT) в PBS; рН поддерживали на уровне 7,4. Получающуюся смесь перемешивали при комнатной температуре в течение 2 ч. Восстановленное аффитело очищали гель-фильтрацией. К чистой фракции восстановленного аффитела добавляли 12 мкл аликвоту раствора Mal-алкинового бифункционального линкера (1) (0,15 мМ в DMSO). Эту реакционную смесь инкубировали при комнатной температуре в течение 2 ч с умеренным перемешиванием. Для получения очищенного алкинилированного аффитела (22) реакционную смесь очищали с использованием гель-фильтрации с последующей центробежной ультрафильтрацией (Amicon), MWCO 5 кДа (Millipore).
Характеристики получившегося очищенного алкинилированного аффитела определяли с использованием MALDI-TOF-MS и HPLC с последующей LC(ESI)-MS. Выход (%): 78; MS: MH+: рассчитано: 14260, найдено: 14260. На Фиг.4 представлены данные MALDI-TOF MS для алкинилированного аффитела (22).
Стандартные условия HPLC анализа алкинилированного аффитела (22): для HPLC анализа использовали колонку Grace Vydac Protein C4. Растворитель А: 100% H2O, 0,1% TFA; растворитель В: 100% MeCN, 0,1% TFA; детектирование: УФ 216 и 280 нм; скорость потока: 1 мл/мин. Изменение концентрации растворителя во времени приведено ниже в Таблице 1.
|
Типичное время элюирования алкинилированного аффитела (22) составило примерно 11 минут.
Пример 7. Образование триазола на биоконъюгате в холодных условиях
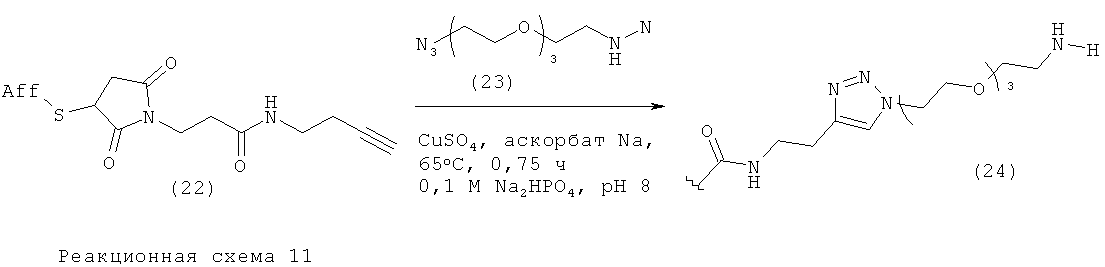
Введение метки в алкинилированное аффитело (22) с использованием азидо-PEG (23). К 36 мкл водного раствора фосфата натрия (100 мМ, рН 8) добавляли 3 мкл аликвоту исходного раствора алкинилированного аффитела (22) (0,6 мМ, примерно 8 мг/мл в фосфатно-солевом буферном растворе, при рН 7,4). К этому раствору добавляли 1 мкл аликвоту свежеприготовленного 18 мМ раствора 11-азидо-3,6,9-триоксаундекан-1-амина (азидо-PEG) (23) (разведенного в 100 мМ фосфате натрия, при рН 8). Затем к этому раствору добавляли 5 мкл аликвоту свежеприготовленного 10 мМ (2 мг/мл) раствора аскорбата натрия (в 100 мМ фосфате натрия, рН 8). В заключение к реакционной смеси добавляли 5 мкл аликвоту свежеприготовленной 10 мМ (1,6 мг/мл) суспензии сульфата меди (II) (в 100 мМ фосфате натрия, рН 8). Таким образом, после этих добавлений получали следующие конечные концентрации реагентов и субстрата - алкинилированное аффитело (22) (36 мкМ), азидо-PEG (23) (360 мкМ), аскорбат натрия (1 мМ) и CuSO4 (1 мМ).
Получившийся раствор перемешивали при 65°С с умеренным перемешиванием в течение 0,75 ч. Затем реакционную смесь сразу разбавляли до 4 мл в чистой воде (MilliQ) и концентрировали до менее 100 мкл с использованием установки для центробежной ультрафильтрации Amicon Centrifugal Ultrafiltration, MWCO 5 кДа (Millipore). Эту последовательность водное разбавление - концентрирование повторяли еще два раза для удаления избытка реагентов. Характеристики полученного очищенного конъюгата (24) определяли с использованием MALDI-TOF-MS и высокоэффективной жидкостной хроматографии с последующей LC(ESI)-MS. Выход (%): 42. MS: МН+: рассчитано: 14478, найдено: 14492.
Пример 8. Введение метки в алкинилированное аффитело (22) с использованием Су5-меченного азидо-PEG (25а)
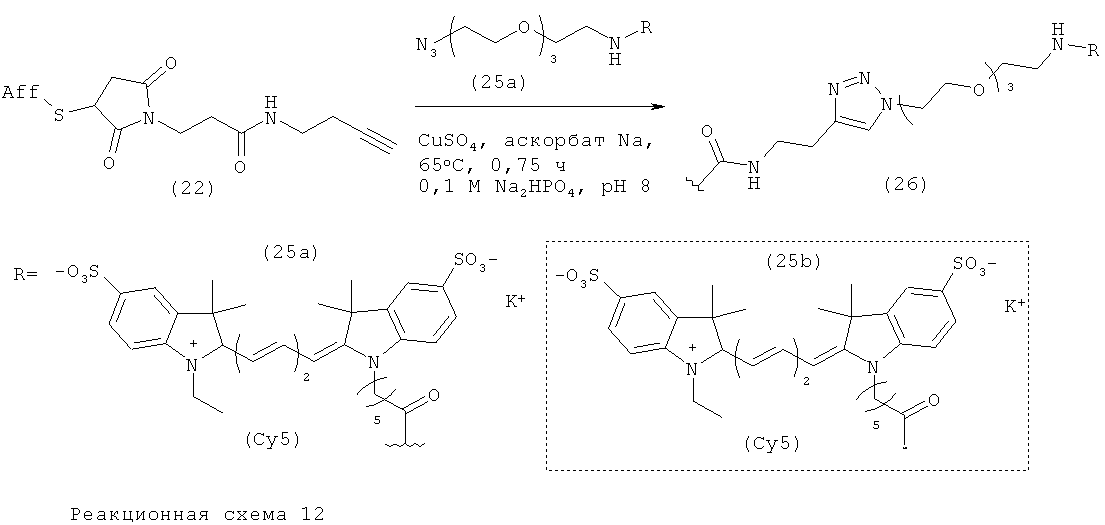
К 36 мкл водного раствора фосфата натрия (100 мМ, рН 8) добавляли 3 мкл аликвоту исходного раствора алкинилированного аффитела (22) (0,6 мМ, примерно 8 мг/мл в фосфатно-солевом буферном растворе, рН 7,4). Затем добавляли 1 мкл аликвоту свежеприготовленного 18 мМ раствора Су5-меченного азидо-PEG (25а) (разведенного в 100 мМ фосфате натрия, рН 8). После этого к этому раствору добавляли 5 мкл аликвоту свежеприготовленного 10 мМ (2 мг/мл) раствора аскорбата натрия (в 100 мМ фосфате натрия, рН 8). В заключение к реакционной смеси добавляли 5 мкл аликвоту свежеприготовленной 10 мМ (1,6 мг/мл) суспензии сульфата меди (II) (в 100 мМ фосфате натрия, рН 8). Таким образом, после этих добавлений получали следующие конечные концентрации реагентов и субстрата: алкинилированное аффитело (22) (36 мкМ), Су5-меченый азидо-PEG (25а) (360 мкМ), аскорбат натрия (1 мМ) и CuSO4 (1 мМ).
Получившийся раствор перемешивали при 65°С с умеренным перемешиванием в течение 0,75 ч. Затем реакционную смесь сразу разбавляли до 4 мл в чистой воде (MilliQ) и концентрировали до менее 100 мкл с использованием установки для центробежной ультрафильтрации Amicon Centrifugal Ultrafiltration, MWCO 5 кДа (Millipore). Эту последовательность водное разбавление - концентрирование повторяли еще два раза для удаления избытка реагентов. Характеристики полученного очищенного конъюгата (26) определяли HPLC и SDS-PAGE белкового геля, контролируя испускание флуоресценции красителя (Фиг.5).
Пример 9. Образование триазола на алкинилированном аффителе (22) в горячих условиях
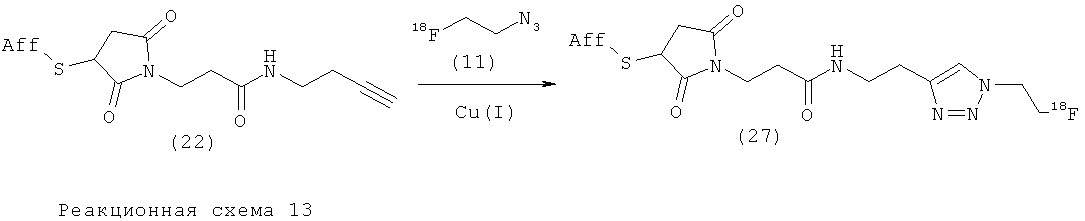
Введение 18F-метки в анти-Her2 аффитело (22). Водный раствор сульфата меди (II) (5 мкл, 0,0249 мг, 0,1 мкмоль) смешивали с аскорбатом натрия (0,198 мг, 1 мкмоль) в натрий-фосфатном буфере (5 мкл, 100 мМ, рН 8,0) и алкинилированным аффителом (22) (50 мкг, 3,57 нмоль) в PBS (5 мкл). После добавления 2-[18F]фторэтилазида (11) (264 мкКи 9,8 МБк, приготовлен, как описано Glaser, M. и Arstad, E. (2007) "Click labeling' with 2-[18F]fluoroethylazide for Positron Emission Tomography. Bioconj. Chem. 18, 989-993 (этот документ включен в данное описание путем ссылки) в MeCN (20 мкл) смесь нагревали при 60°С в течение 30 мин. HPLC анализ реакционной смеси в отношении мечения 2-[18F]фторэтилазидом (11) показал, что пик с радиоактивностью совместно элюировался с УФ сигналом аффитела (27).
Очистка препаративной HPLC (градиент: 5-80% растворителя В в течение через 15 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой MeCN/0,1% TFA, скорость потока: 1 мл/мин; колонка: Luna 3 мкм С18(2) (Phenomenex), 50×4,6 мм, детектирование: УФ 280 нм). На Фиг.1 представлены результаты HPLC анализа реакционной смеси неоптимизированной системы, демонстрирующие 18F «click»-меченное анти-Her2 аффитело (27) (а, канал радиоактивности; b, УФ канал при 280 нм).
Изобретение может быть воплощено в других конкретных формах без отступления от его сущности или существенных признаков. Поэтому вышеупомянутые воплощения должны рассматриваться во всех отношениях скорее в качестве иллюстративных, а не ограничивающих описанное здесь изобретение. Таким образом, объем изобретения определяется прилагаемой формулой изобретения, а не вышеизложенным описанием; следовательно, все изменения, которые находятся в пределах понимания и области эквивалентности формулы изобретения, подразумеваются включенными в него.