ПОЛИМОРФНАЯ ФОРМА СОЕДИНЕНИЯ 2-АМИНОТИАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРА КИНАЗЫ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Настоящее изобретение относится к промышленному способу синтеза фармацевтических соединений, имеющих формулу I:
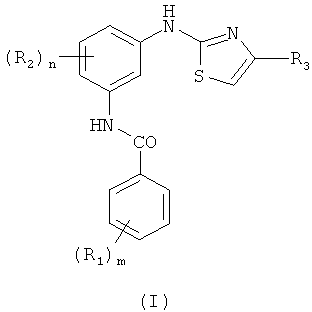
которые полезны в качестве определенных ингибиторов тирозинкиназ и, более конкретно, в качестве ингибиторов c-kit и bcr-abl. Группы R1 и R2, одинаковые или разные, представляют собой каждая атом водорода, галогена, алкил, алкокси, трифторметил, амино, алкиламино, диалкиламино, солюбилизирующую группу; m означает 0-5, и n означает 0-4; группа R3 представляет собой арильную или гетероарильную группу, как описано в формуле изобретения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Тирозинкиназы представляют собой белки рецепторного типа или нерецепторного типа, которые переносят концевой фосфат из АТР на тирозиновые остатки белков, таким образом активируя или инактивируя пути передачи сигналов. Эти белки, как известно, вовлечены во многие клеточные механизмы, которые в случае нарушения, приводят к расстройствам, таким как аномальная клеточная пролиферация и миграция, а также воспаление.
На сегодняшний день существует примерно 58 известных рецепторных тирозинкиназ. В их число входят хорошо известные рецепторы VEGF (Kim et al., Nature 362, pp.841-844, 1993), рецепторы PDGF, c-kit, Flt-3 и FLK семейство. Эти рецепторы могут передавать сигналы к другим тирозинкиназам, включающим Src, Raf, Frk, Btk, Csk, Abl, Fes/Fps, Fak, Jak, Ack и т.д.
Среди тирозинкиназных рецепторов особый интерес вызывает c-kit. Действительно, c-kit является ключевым рецептором, активирующим тучные клетки, которые, как доказано, непосредственно или опосредованно вовлечены в многочисленные патологии, в отношении которых заявитель подал WO 03/004007, WO 03/004006, WO 03/003006, WO 03/003004, WO 03/002114, WO 03/002109, WO 03/002108, WO 03/002107, WO 03/002106, WO 03/002105, WO 03/039550, WO 03/035050, WO 03/035049, WO 03/0720090, WO 03/072106, WO 04/076693 и WO 2005/016323.
Авторы изобретения обнаружили, что тучные клетки, присутствующие в тканях пациентов, вовлечены или вносят вклад в генез таких заболеваний, как аутоиммунные заболевания (ревматоидный артрит, воспалительные заболевания кишечника (IBD)) аллергические заболевания, потеря костной массы, такие виды рака, как твердые опухоли, лейкоз и GIST (гастроинтестинальные стромальные опухоли), опухолевый ангиогенез, воспалительные заболевания, интерстициальный цистит, мастоцитоз, заболевания "трансплантат против хозяина", инфекционные заболевания, метаболические расстройства, фиброз, диабет и заболевания ЦНС. В этих заболеваниях было показано, что тучные клетки участвуют в разрушении тканей путем высвобождения коктейля из различных протеаз и медиаторов, таких как гистамин, нейтральные протеазы, липидные медиаторы (простагландины, тромбоксаны и лейкотриены) и различные цитокины (IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, TNF-α, GM-CSF, MIP-1a, MIP-1b, MIP-2 и IFN-γ).
Рецептор c-kit также может быть конститутивно активирован мутациями, приводящими к аномальной клеточной пролиферации и развитию таких заболеваний, как мастоцитоз (мутация D816V) и различные виды рака, такие как GIST (c-kitA27, околомембранная делеция).
Кроме того, 60%-70% пациентов с AML (острым миелобластным лейкозом) имеют бластные клетки, которые экспрессируют c-kit - рецептор для фактора стволовых клеток (SCF) (Broudy, 1997). SCF стимулирует рост гемопоэтических предшественников и действует в качестве фактора выживания для AML-бластов. В некоторых случаях (1-2%) AML была описана мутация в консервативном остатке киназного домена (Kit816), приводящая к конститутивной активации c-kit (Beghini et al., 2000; Longley et al., 2001). Это усиление функциональной мутации (замена Asp на Val/Tyr) идентифицировали в тучноклеточных лейкозных клеточных линиях и в образцах, полученных от пациентов с мастоцитозом (Longley et al., 1996).
Кроме того, авторы изобретения исследовали примерно 300 пациентов, страдающих системным мастоцитозом, и показали, что мутация Kit816 экспрессируется примерно в 60% случаев. В этой связи авторы изобретения подали WO 04/076693, которая относится к специализированному лечению различных форм мастоцитоза в зависимости от присутствия или отсутствия мутации Kit816.
Таким образом, авторы изобретения в последнее время предложили воздействовать на c-kit для истощения тучных клеток, ответственных за эти расстройства. Авторы изобретения обнаружили в этой связи новые мощные и селективные ингибиторы c-kit, которые представляют собой 2-(3-аминоарил)амино-4-арилтиазолы, описанные в их PCT публикации WO 2004/014903.
Синтез замещенного 2-аминотиазола известен из литературы. В следующих публикациях относительно общего синтеза эти соединения обычно получают с использованием двухстадийной схемы, включая бромирование исходных кетонов (A) (G. Crank and R. Kahn, Austr. J. Chem, 38 (3), 447-458 (1985)) с последующей циклоконденсацией промежуточных α-бромкетонов (С) с тиомочевиной (В) путем нагревания с обратным холодильником в этаноле или метаноле (M. Maziere et al, Bull. Soc. Chim. France, 1000-1003 (1963); J.D. Spivack, патент США 3299087).
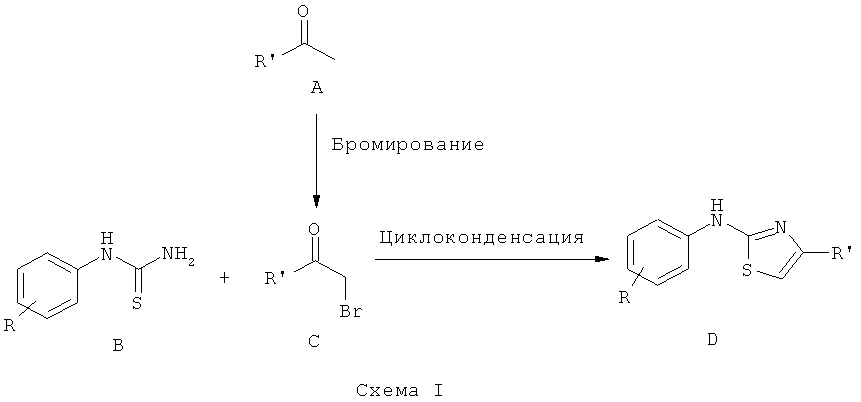
Однако, когда R представляет собой такие электроноакцепторные группы, как функциональная группа нитро, выход циклоприсоединения не превышает 65% (S.P. Singh et al, Indian j. Chem. Sect. B, 29 (6), 533-538, (1990)). Этот недостаток, возможно, является следствием нестабильности нитроарилтиомочевины, что приводит к образованию как примеси, так и высокореакционноспособного побочного продукта при взаимодействии в присутствии основания.
Из вышеуказанного очевидно, что эта методология, применяемая к нитроарилтиомочевине, имеет недостатки синтеза, относящиеся к одной или более из этих характеристик: выход, масштабируемость до многограммового синтеза и очистки. Цель изобретения состояла в том, чтобы усовершенствовать применяемый в промышленности способ, в котором хорошие выходы получают с помощью простых промышленных операций.
Авторы изобретения обнаружили, что взаимодействие ацетилированной нитроарилтиомочевины с α-бромкетоарилом при комнатной температуре, в метаноле и в присутствии основания, такого как карбонат калия, дает желаемый тиазол через 3-6 ч с отличным выходом (90-97%).
Кроме того, чистые тиазолы получали простой фильтрацией после добавления воды в реакционную смесь.
Поэтому в настоящем изобретении предложен новый и промышленный способ синтеза 2-амино(нитроарил)тиазола с хорошим выходом путем взаимодействия стабильной ацетилированной нитроарилтиомочевины с α-бромкетоарилом в мягких условиях.
Раскрытие изобретения
Изобретение относится к способу получения соединения формулы (I):
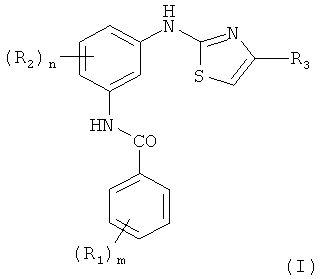
или его соли или сольвата, где
R1 и R2 выбраны независимо из водорода, галогена, линейной или разветвленной алкильной, циклоалкильной группы, содержащей от 1 до 10 атомов углерода, трифторметила, алкокси, циано, диалкиламино и солюбилизирующей группы,
m означает 0-5, и n означает 0-4,
R3 представляет собой одно из следующего:
(1) арильную группу, такую как фенил или его замещенный вариант, несущий любую комбинацию, по любому положению в кольце, одного или более заместителей, таких как галоген, алкильные группы, содержащие от 1 до 10 атомов углерода, трифторметил, циано и алкокси;
(2) гетероарильную группу, такую как 2-, 3- или 4-пиридильная группа, которая может дополнительно нести любую комбинацию одного или более заместителей, таких как галоген, алкильные группы, содержащие от 1 до 10 атомов углерода, трифторметил и алкокси;
(3) пятичленную кольцевую ароматическую гетероциклическую группу, такую как, например, 2-тиенил, 3-тиенил, 2-тиазолил, 4-тиазолил, 5-тиазолил, которая может дополнительно нести любую комбинацию одного или более заместителей, таких как галоген, алкильная группа, содержащая от 1 до 10 атомов углерода, трифторметил и алкокси;
включающему стадии, состоящие из:
а) циклизации при комнатной температуре соединения (IV):
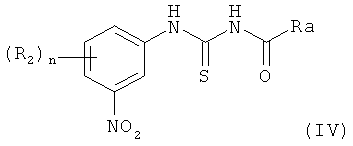
с промежуточным соединением Int4 формулы:
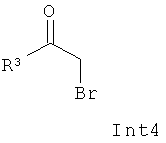
где Ra может представлять собой метил, трифторметил, изопропил или фенил, возможно замещенный, и R2, R3 и n являются такими, как описано выше, с получением соединения (III):

где R2, R3 и n являются такими, как описано выше;
б) восстановления нитрогруппы указанного соединения (III) с получением соединения формулы II:
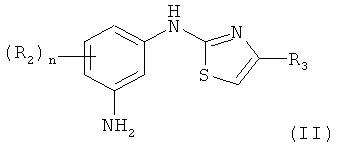
где R2, R3 и n являются такими, как описано выше;
в) присоединения в апротонном растворителе соединения (II):
к соединению формулы Int5:
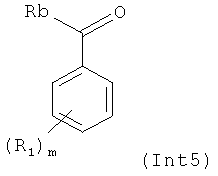
где Rb представляет собой гидроксильную, или алкокси, или галогеновую группу, и R1 и m являются такими, как описано выше, с получением соединения (I).
В одном предпочтительном воплощении на стадии в) соединение (II) обрабатывают 3,0 эквивалентами кислоты Льюиса и добавляют к раствору 1,0 эквивалента сложного эфира (Int5). В дополнение, кислота Льюиса представляет собой триметилалюминий.
В еще одном предпочтительном воплощении на стадии в) раствор 1,0 эквивалента хлорангидрида (Int5) добавляют к раствору 0,8 эквивалента соединения формулы II. Здесь реакцию осуществляют в основных условиях, и основание может представлять собой, например, триэтиламин.
В еще одном предпочтительном воплощении на стадии в) 1,0 эквивалент соединения формулы II подвергают сочетанию с 1,1 эквивалента бензойной кислоты (Int5). Эту реакцию осуществляют с использованием активирующего агента, такого как реагент Мукайяма (2-хлор-1-метилпиридиния йодид).
На стадии а) реакционную смесь разбавляют водой и осажденный продукт выделяют фильтрацией.
На стадии б) способа, описанного выше, соединение (II) получают путем восстановления соответствующего нитросоединения, осуществляемого путем гидрирования. Гидрирование может быть осуществлено с катализатором, таким как никель Ренея, и реакцию осуществляют в полярном протонном растворителе, таком как метанол или этанол.
На стадии б) реакционную смесь разбавляют водой и осажденный продукт выделяют фильтрацией.
В еще одном предпочтительном воплощении на стадии а) циклизацию осуществляют в основных условиях при температуре от 20 до 30°C. Основание может представлять собой карбонат калия, и реакцию осуществляют в полярном протонном растворителе, таком как метанол или этанол.
Описанный выше способ может дополнительно включать стадию получения соединения (IV), включающую взаимодействие промежуточного соединения Int1 формулы:
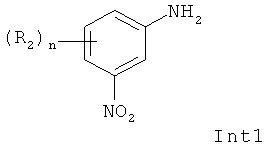
с Int2 формулы:
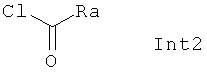
и Int3 формулы NH4SCN,
где Ra, R2 и n являются такими, как определено выше.
Предпочтительно, это реакцию осуществляют в апротонном растворителе, таком как ацетон. Также реакционную смесь предпочтительно разбавляют водой и осажденный продукт выделяют фильтрацией.
Если не указано иное, используемые здесь термины определяют следующим образом:
Используемый здесь термин "арильная группа" означает моноциклический или полициклический ароматический радикал, содержащий атомы углерода и водорода. Примеры подходящих арильных групп включают в себя, но не ограничиваются этим, фенил, толил, антраценил, флуоренил, инденил, азуленил и нафтил, а также бензоконденсированные карбоциклические группировки, такие как 5,6,7,8-тетрагидронафтил. Арильная группа может быть не замещена или замещена одним или более заместителями. В одном из воплощений арильная группа представляет собой моноциклическое кольцо, где указанное кольцо содержит 6 атомов углерода, обозначенное здесь как "(С6)арил."
Используемый здесь термин "алкильная группа" означает насыщенный прямоцепочечный или разветвленный нециклический углеводород, имеющий от 1 до 10 атомов углерода. Типичные насыщенные алкилы с прямой цепью включают в себя метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, н-гептил, н-октил, н-нонил и н-децил; тогда как насыщенные разветвленные алкилы включают в себя изопропил, фтор-бутил, изобутил, трет-бутил, изопентил, 2-метилбутил, 3-метилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилбутил, 2,3-диметилпентил, 2,4-диметилпентил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилпентил, 2,2-диметилгексил, 3,3-диметилпентил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилпентил, 3-этилпентил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил, 2-метил-4-этилпентил 2-метил-2-этилгексил, 2-метил-3-этилгексил, 2-метил-4-этилгексил, 2,2-диэтилпентил, 3,3-диэтилгексил, 2,2-диэтилгексил, 3,3-диэтилгексил и тому подобное. Алкильные группы, включенные в соединения по данному изобретению, могут быть возможно замещены одним или более заместителями.
Используемый здесь термин "алкокси" относится к алкильной группе, которая присоединена к другой группировке по атому кислорода. Примеры алкоксигрупп включают в себя метокси, изопропокси, этокси, трет-бутокси и тому подобное. Алкоксигруппы могут быть возможно замещены одним или более заместителями.
Используемый здесь термин "гетероарил" или похожие термины означают моноциклическое или полициклическое гетероароматическое кольцо, содержащее атомы углерода в кольце и один или более гетероатомов в кольце (таких как, например, кислород, сера или азот). Типично, гетероарильная группа имеет от 1 до примерно 5 гетероатомов в кольце и от 1 до примерно 14 атомов углерода в кольце. Типичные гетероарильные группы включают в себя пиридил, 1-оксопиридил, фуранил, бензо[1,3]диоксолил, бензо[1,4]диоксинил, тиенил, пирролил, оксазолил, имидазолил, тиазолил, изоксазолил, хинолинил, пиразолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, триазолил, тиадиазолил, изохинолинил, индазолил, бензоксазолил, бензофурил, индолизинил, имидазопиридил, тетразолил, бензимидазолил, бензотиазолил, бензотиадиазолил, бензоксадиазолил, индолил, тетрагидроиндолил, азаиндолил, имидазопиридил, хиназолинил, пуринил, пирроло[2,3]пиримидинил, пиразоло[3,4]пиримидинил, имидазо[1,2-а]пиридил и бензо(b)тиенил. Гетероатом может быть замещен защитной группой, известной специалистам в данной области, например, водород на азоте может быть замещен трет-бутоксикарбонильной группой. Гетероарильные группы могут быть возможно замещены одним или более заместителями. Кроме того, кольцевые гетероатомы азот или сера могут быть окислены. В одном из воплощений гетероароматическое кольцо выбрано из 5-8-членных моноциклических гетероарильных колец. Точка присоединения гетероароматического или гетероарильного кольца к другой группе может находиться либо на атоме углерода, либо на гетероатоме гетероароматических или гетероарильных колец.
Используемый здесь термин "гетероцикл" относится в совокупности к гетероциклоалкильным группам и гетероарильным группам.
Используемый здесь термин "гетероциклоалкил" означает моноциклическую или полициклическую группу, имеющую по меньшей мере один гетероатом, выбранный из О, N или S, и имеющий 2-11 атомов углерода, которая может быть насыщенной или ненасыщенной, но не является ароматической. Примеры гетероциклоалкильных групп включают в себя (но не ограничиваются этим): пиперидинил, пиперазинил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 4-пиперидонил, пирролидинил, гидантоинил, валеролактамил, оксиранил, оксетанил, тетрагидропиранил, тетрагидротиопиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиопиранилсульфон, тетрагидротиопиранилсульфоксид, морфолинил, тиоморфолинил, тиоморфолинилсульфоксид, тиоморфолинилсульфон, 1,3-диоксолан, тетрагидрофуранил, дигидрофуранил-2-он, тетрагидротиенил и тетрагидро-1,1-диоксотиенил. Типично, моноциклические гетероциклоалкильные группы имеют от 3 до 7 членов. Предпочтительные 3-7-членные моноциклические гетероциклоалкильные группы представляют собой группы, имеющие 5 или 6 кольцевых атомов. Гетероатом может быть замещен защитной группой, известной специалистам в данной области, например, водород на азоте может быть замещен трет-бутоксикарбонильной группой. Кроме того, гетероциклоалкильные группы могут быть возможно замещены одним или более заместителями. Кроме того, точка присоединения гетероциклического кольца к другой группе может находиться либо на атоме углерода, либо на гетероатоме гетероциклического кольца. Только стабильные изомеры таких замещенных гетероциклических групп рассматриваются в этом определении.
Используемый здесь термин "заместитель" или "замещенный" означает, что водородный радикал на соединении или группе замещен любой желаемой группой, которая является по существу стабильной в реакционных условиях в незащищенной форме или когда защищена с использованием защитной группы. Примерами предпочтительных заместителей являются заместители, встречающиеся в примерных соединениях и воплощениях, раскрытых здесь, а также галоген (хлоро, йодо, бромо или фторо); алкил; алкенил; алкинил; гидрокси; алкокси; нитро; тиол; тиоэфир; имин; циано; амидо; фосфонато; фосфин; карбоксил; тиокарбонил; сульфонил; сульфонамид; кетон; альдегид; сложный эфир; кислород (-O); галогеноалкил (например, трифторметил); циклоалкил, который может быть моноциклическим или конденсированным или неконденсированным пол и циклическим (например, циклопропил, циклобутил, циклопентил или циклогексил), или гетероциклоалкил, которыйя может быть моноциклическим или конденсированным или неконденсированным полициклическим (например, пирролидинил, пиперидинил, пиперазинил, морфолинил или тиазинил), моноциклический или конденсированный или неконденсированный пол и циклически и арил или гетероарил (например, фенил, нафтил, пирролил, индолил, фуранил, тиофенил, имидазолил, оксазолил, изоксазолил, тиазолил, триазолил, тетразолил, пиразолил, пиридил, хинолинил, изохинолинил, акридинил, пиразинил, пиридазинил, пиримидинил, бензимидазолил, бензотиофенил или бензофуранил); амино (первичный, вторичный или третичный); CO2CH3; CONH2; OCH2CONH2; NH2; SO2NH2; OCHF2; CF3; OCF3; и такие группировки также могут быть возможно замещены конденсированной кольцевой структурой или мостиком, например -OCH2O-. Эти заместители возможно могут быть дополнительно замещены заместителем, выбранным из таких групп. В некоторых воплощениях термин "заместитель" или прилагательное "замещенный" относится к заместителю, выбранному из группы, состоящей из алкила, алкенила, алкинила, циклоалкила, циклоалкенила, гетероциклоалкила, арила, гетероарила, аралкила, гетероаралкила, галогеноалкила, -C(O)NR11R12, -NR13C(O)R14, галогено, -OR13, циано, нитро, галогеноалкокси, -C(O)R13, -NR11R12, -SR13, -C(O)OR13, -OC(O)R13, -NR13C(O)NR11R12, -OC(O)NR11R12, -NR13C(O)OR14, -S(O)rR13, -NR13S(O)rR14, -OS(O)rR14, S(O)rNR11R12, -O, -S, и -N-R13, где r равно 1 или 2; R11 и R12 при каждом своем появлении представляют собой независимо H, возможно замещенный алкил, возможно замещенный алкенил, возможно замещенный алкинил, возможно замещенный циклоалкил, возможно замещенный циклоалкенил, возможно замещенный гетероциклоалкил, возможно замещенный арил, возможно замещенный гетероарил, возможно замещенный аралкил или возможно замещенный гетероаралкил; или R1 и R12, взятые вместе с атомом азота, к которому они присоединены, представляет собой возможно замещенный гетероциклоалкил или возможно замещенный гетероарил; и R13 и R14 при каждом своем появлении представляют собой независимо H, возможно замещенный алкил, возможно замещенный алкенил, возможно замещенный алкинил, возможно замещенный циклоалкил, возможно замещенный циклоалкенил, возможно замещенный гетероциклоалкил, возможно замещенный арил, возможно замещенный гетероарил, возможно замещенный аралкил или возможно замещенный гетероаралкил. В некоторых воплощениях термин "заместитель" или прилагательное "замещенный" относятся к солюбилизирующей группе.
Термин "солюбилизирующая группа" означает любую группу, которая может быть по существу ионизирована и которая позволяет соединению растворяться в желаемом растворителе, таком как, например, вода или содержащий воду растворитель. Кроме того, солюбилизирующая группа может представлять собой группу, которая увеличивает липофильность соединения или комплекса. Типично, солюбилизирующая группа выбрана из алкильной группы, замещенной одним или более гетероатомами, такими как N, О, S, каждый из которых возможно замещен алкильной группой, замещенной независимо алкокси, амино, алкиламино, диалкиламино, карбоксилом, циано, или замещенной циклогетероалкилом или гетероарилом, или фосфатом, или сульфатом, или карбоновой кислотой.
Например, под "солюбилизирующей группой" здесь подразумевают одно из следующего:
алкильную, циклоалкильную, арильную, гетероарильную группу, содержащую либо по меньшей мере один гетероатом азот или кислород, либо замещенную по меньшей мере одной аминогруппой или оксогруппой.
- аминогруппу, которая может представлять собой насыщенную циклическую аминогруппу, которая может быть замещена группой, состоящей из алкила, алкоксикарбонила, галогена, галогеноалкила, гидроксиалкила, амино, моноалкиламино, диалкиламино, карбамоила, моноалкилкарбамоила и диалкилкарбамоила.
- одну из структур с а) по и), показанных ниже, где волнистая линия и стрелка соответствуют месту присоединения к сердцевинной структуре формулы I.
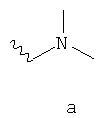
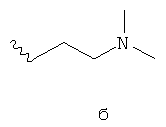
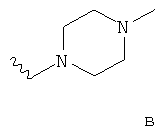
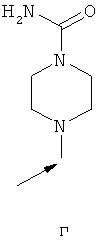
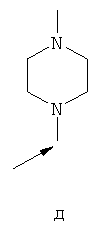
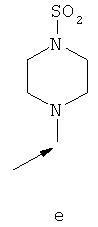
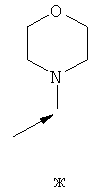
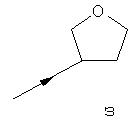
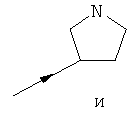
Термин "циклоалкил" означает насыщенный циклический алкильный радикал, имеющий от 3 до 10 атомов углерода. Типичные циклоалкилы включают в себя циклопропил, 1-метилциклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил и циклодецил. Циклоалкильные группы могут быть возможно замещены одним или более заместителями.
Термин "галоген" означает -F, -Cl, -Br или -I.
В одном из конкретных воплощений в изобретении предложен способ синтеза возможно замещенных 2-(3-аминоарил)амино-4-арилтиазолов, имеющих формулу I.

где:
R1 и R2 выбраны независимо из водорода, галогена, линейной или разветвленной алкильной, циклоалкильной группы, содержащей от 1 до 10 атомов углерода, трифторметила, алкокси, амино, алкиламино, диалкиламино, солюбилизирующей группы.
m означает 0-5, и n означает 0-4.
R3 представляет собой одно из следующего:
(1) арильную группу, такую как фенил или его замещенный вариант, несущий любую комбинацию, по любому положению в кольце, одного или более заместителей, таких как галоген, алкильные группы, содержащие от 1 до 10 атомов углерода, трифторметил, циано и алкокси;
(2) гетероарильную группу, такую как 2-, 3- или 4-пиридильная группа, которая может дополнительно нести любую комбинацию одного или более заместителей, таких как галоген, алкильные группы, содержащие от 1 до 10 атомов углерода, трифторметил и алкокси;
(3) пятичленную кольцевую ароматическую гетероциклическую группу, такую как, например, 2-тиенил, 3-тиенил, 2-тиазолил, 4-тиазолил, 5-тиазолил, которая может дополнительно нести любую комбинацию одного или более заместителей, таких как галоген, алкильная группа, содержащая от 1 до 10 атомов углерода, трифторметил и алкокси.
Один аспект изобретения относится к способу получения 2-(3-аминоарил)амино-4-арилтиазолов (I) или фармацевтически приемлемой соли, показанному на Схеме II, включающему:
а) Взаимодействие нитроанилина (Int1), ацилхлорида (Int2) и тиоцианата аммония (Int3) в подходящем растворителе с получением (IV),
где:
Ra может представлять собой метил, трифторметил, изопропил или фенил, возможно замещенный.
R2 выбран независимо из водорода, галогена, линейной или разветвленной алкильной, циклоалкильной группы, содержащей от 1 до 10 атомов углерода, трифторметила, алкокси, амино, алкиламино, диалкиламино, солюбилизирующей группы.
n означает 0-4.
б) Взаимодействие бромкетона (Int4) с защищенной тиомочевиной (IV) в подходящем растворителе и с использованием подходящих оснований.
Заместитель R3 в (Int4) и в соединениях (III), (II), и (I), показанных на Схеме II ниже, представляет собой одно из следующего:
(1) арильную группу, такую как фенил или его замещенный вариант, несущий любую комбинацию, по любому положению в кольце, одного или более заместителей, таких как галоген, алкильные группы, содержащие от 1 до 10 атомов углерода, трифторметил, циано и алкокси;
(2) гетероарильную группу, такую как 2-, 3- или 4-пиридильная группа, которая может дополнительно нести любую комбинацию одного или более заместителей, таких как галоген, алкильные группы, содержащие от 1 до 10 атомов углерода, трифторметил и алкокси;
(3) пятичленную кольцевую ароматическую гетероциклическую группу, такую как, например, 2-тиенил, 3-тиенил, 2-тиазолил, 4-тиазолил, 5-тиазолил, которая может дополнительно нести любую комбинацию одного или более заместителей, таких как галоген, алкильная группа, содержащая от 1 до 10 атомов углерода, трифторметил и алкокси.
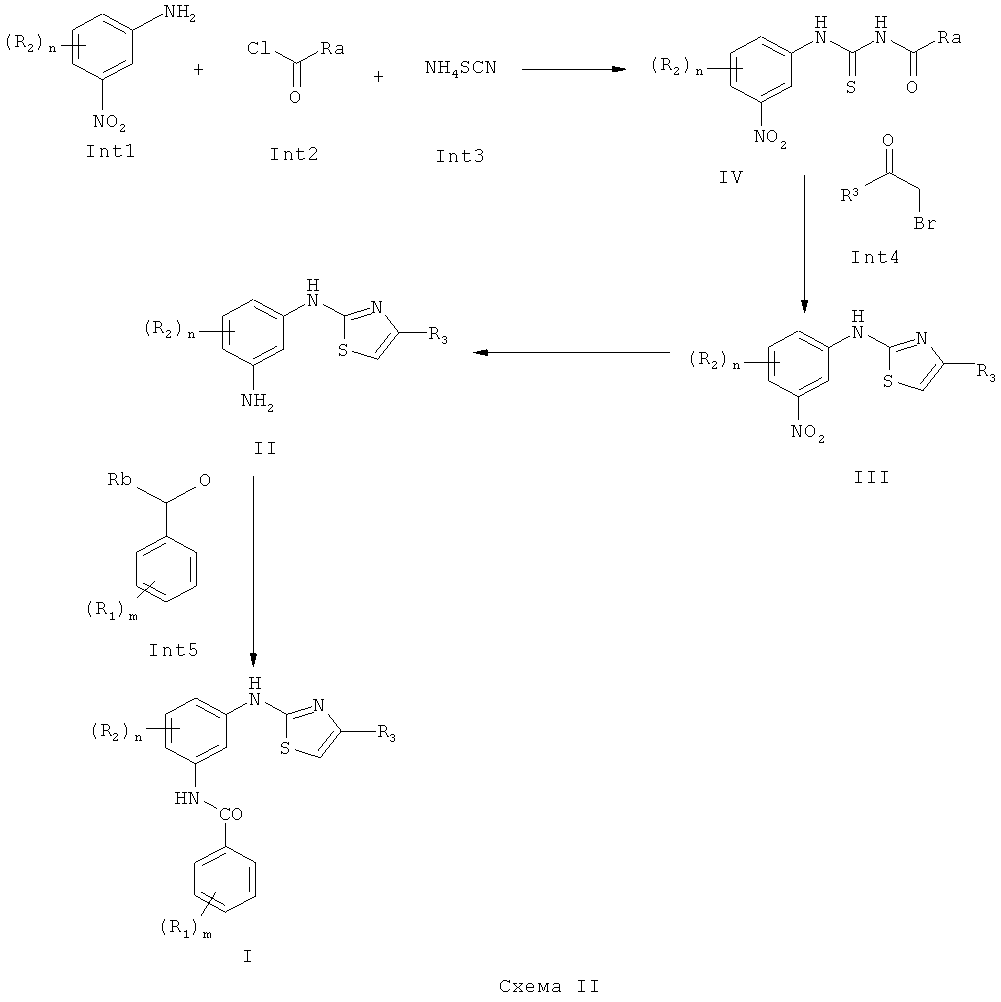
в) Восстановление нитрогруппы соединения (III) до соответствующего амина (II) в подходящем растворителе.
г) Взаимодействие анилина (II) с (Int5) с использованием подходящей методики присоединения в подходящем растворителе.
Rb может представлять собой гидроксильную, или алкокси, или галогеновую группу.
R1 выбран независимо из водорода, галогена, линейной или разветвленной алкильной, циклоалкильной группы, содержащей от 1 до 10 атомов углерода, трифторметила, алкокси, амино, алкиламино, диалкиламино, солюбилизирующей группы.
m означает 0-5.
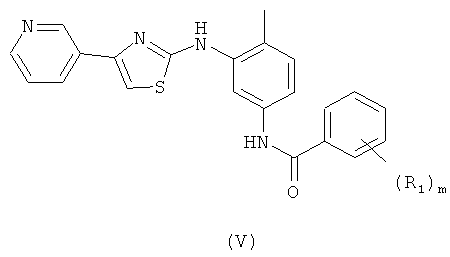
В еще одном конкретном воплощении способ, показанный на Схеме II, используют для синтеза соединения формулы V или его фармацевтически приемлемой соли,
где:
R1 выбран независимо из водорода, галогена, линейной или разветвленной алкильной, циклоалкильной группы, содержащей от 1 до 10 атомов углерода, трифторметила, алкокси, амино, алкиламино, диалкиламино, солюбилизирующей группы.
m означает 0-5.
Соединение (VIII) может быть получено путем добавления нитроанилина (Int1a) к раствору тиоцианата аммония и ацетилхлорида в апротонном растворителе, предпочтительно ацетоне.
Соединение (VII) получают циклизацией соединения (VIII) с бромкетоном (Int4a) в основных условиях, предпочтительно с карбонатом калия, в полярном протонном растворителе, таком как метанол.
Соединение (VII) восстанавливают с получением соединения (VI). Предпочтительно, реакцию восстановления осуществляют с катализатором, таким как реактивированный никель Ренея. Восстановление может быть осуществлено в спиртовом или полярном апротонном растворителе, таком как ТГФ (THF). Согласно одному воплощению реакцию осуществляют в присутствии водорода. Реакция может быть также осуществлена в условиях гидрирования с фазовым переносом.
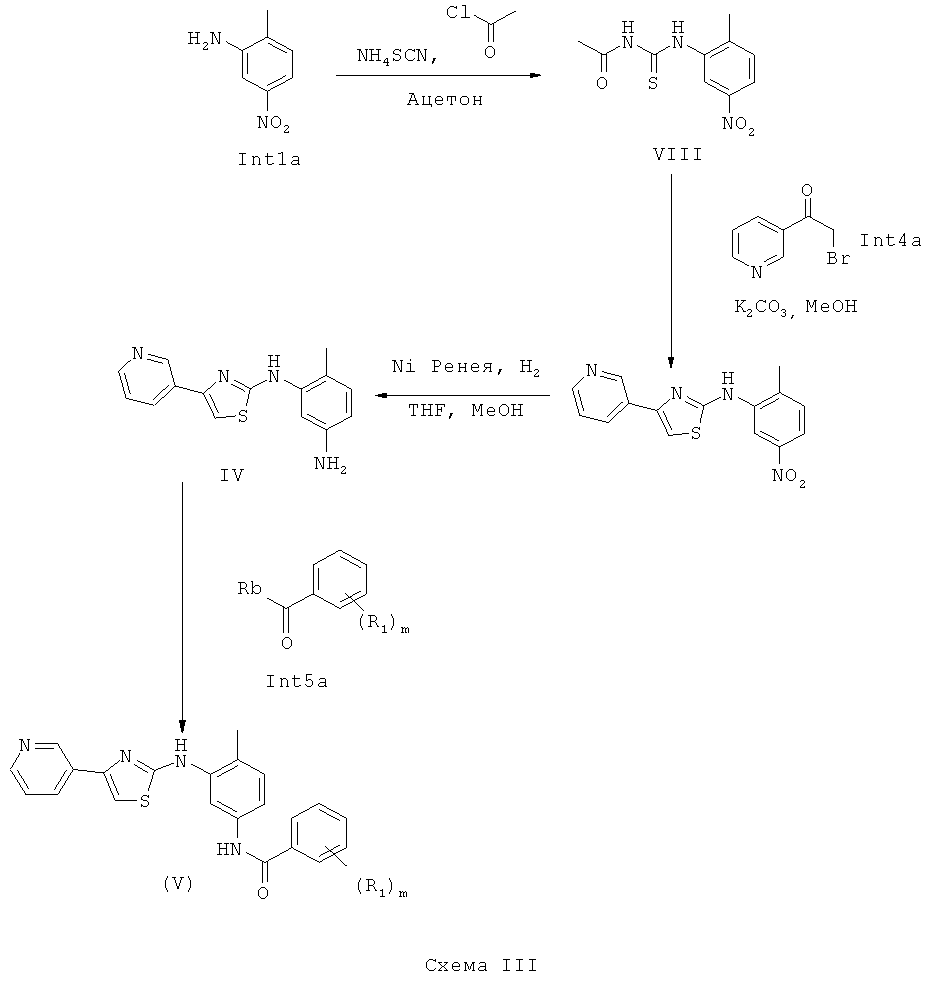
Соединение (V) получают с использованием различных условий:
1) где Rb представляет собой алкоксигруппу, сложный эфир (Int5a) подвергают реакции присоединения с (VI) с использованием триметилалюминия в качестве активирующего агента в апротонном растворителе, таком как дихлорметан или толуол.
2) где Rb представляет собой галоген, такой как хлорид, хлорангидрид (Int5a) подвергают сочетанию с (VI) в основных условиях с использованием предпочтительно триэтиламина в апротонном растворителе, таком как дихлорметан.
3) где Rb представляет собой гидроксильную группу, карбоновую кислоту (Int5a) подвергают сочетанию с (VI) с использованием активирующих агентов, таких как реагент Мукайяма или HOBt/EDCI, в апротонном растворителе, предпочтительно DMF.
Изобретение поясняется подробно в примерах, представленных ниже, которые предложены лишь в качестве иллюстрации и поэтому не должны рассматриваться как ограничение объема изобретения.
ПРИМЕР 1
1-Ацетил-3-(2-метил-5-нитрофенил)тиомочевина
В реактор вводили тиоцианат аммония (25 кг, 328,43 моль), ацетилхлорид (24 кг, 337,53 моль), ацетон (225 л) и 2-метил-5-нитроанилин (Int1) (42 кг, 276,04 моль). Температуру поддерживали при 25±10°C в течение приблизительно 4 часов. Добавляли воду (413 л), и реакционную смесь перемешивали в течение приблизительно 1 часа. Осадок фильтровали, промывали водой и диизопропиловым эфиром. Продукт затем сушили в лотковой сушилке при 45-50°C.
Выход=84%.
1H ЯМР (ДМСО-d6): δ=12.37 (1Н, s); 11.68 (1Н, s); 8.68 (1Н, d, J=2.5 Гц); 8.06 (1Н, dd, J=8.4, 2.5 Гц); 7.58 (1Н, d, J=8.4 Гц); 2.33 (3Н, s); 2.18 (3H, s).
MS (ES+) m/z=254,1 (M+H)+; (ES-) m/z=252,3 (M-H)-.
Т.пл.=205°C.
ПРИМЕР 2
(2-Метил-5-нитрофенил)-(4-пиридин-3-илтиазол-2-ил)амин
В реактор вводили метанол (1120 л), карбонат калия (287 кг, 2076,70 моль) и 1-ацетил-3-(2-метил-5-нитрофенил)тиомочевину (67 кг, 264,53 моль). Затем добавляли 2-бром-1-пиридин-3-илэтанон (Int4) (52 кг, 259,96 моль) и температуру поддерживали при 25-30°C в течение 4 часов. К реакционной смеси добавляли воду (692 л), и осадок фильтровали, промывали водой и диизопропиловым эфиром. Продукт затем сушили в лотковой сушилке при 45-50°C.
Выход=95%.
1Н ЯМР (ДМСО-d6): δ=9.83 (1Н, s); 9.60 (1Н, d, J=2.5 Гц); 9.18 (1Н, d, J=1.9 Гц); 8.53 (1Н, dd, J=4.6, 1.5 Гц); 8.27 (1Н, dt, J=8.0, 1.9 Гц); 7.80 (1Н, dd, J=8.2, 2.5 Гц); 7.66 (1 H, s); 7.48 (2H, m); 2.44 (3H, s).
MS (ES+) m/z=313,1 (M+H)+; (ES-) m/z=311,3 (M-H)-.
Т.пл.=225°C.
ПРИМЕР 3
4-Метил-N3-(4-пиридин-3-илтиазол-2-ил)бензол-1,3-диамин
В реакторе смесь (2-метил-5-нитрофенил)-(4-пиридин-3-илтиазол-2-ил)амина (40 кг, 128,06 моль), никеля Ренея (2,7 кг, 46,00 моль) и метанола (600 л) нагревали до 40-45°C и гидрировали при давлении водорода (5 кг/см2) в течение 2 часов. Реакционную смесь фильтровали и концентрировали. К остатку добавляли воду при перемешивании. Продукт затем фильтровали и сушили в лотковой сушилке при 45-50°C.
Выход=85%.
1H ЯМР (ДМСО-d6): δ=9.20 (1Н, s); 9.09 (1Н, dd, J=2.3, 0.76 Гц); 9.48 (1Н, dd, J=4.8, 1.7 Гц); 8.20 (1Н, dt, J=8.0, 2.1 Гц); 7.42 (1Н, ddd, J=7.8, 4.8, 0.8 Гц); 7.38 (1Н, s); 7.09 (1Н, d, J=2.3 Гц); 6.85 (1Н, d, J=8.0 Гц); 6.29 (1Н, dd, J=8.0, 2.3 Гц); 4.95 (1Н, s);2.10(3H,s).
MS (ES+) m/z=283,1 (M+H)+; (ES-) m/z=281,4.
Т.пл.=136°C.
ПРИМЕР 4
N-[4-Метил-3-(4-пиридин-3-илтиазол-2-иламино)фенил]бензамидные производные
Способ А
В реактор и при низком давлении азота добавляют 4-метил-М3-(4-пиридин-3-илтиазол-2-ил)бензол-1,3-диамин (95 г, 336,45 ммоль), дихлорметан (2 л). К этой суспензии, охлажденной до температуры 5°С, добавляли по каплям 2М/н-гексановый раствор триметилалюминия (588 мл). Реакционную смесь доводили постепенно до 15° и поддерживали в течение 2 ч при перемешивании. В течение 10 минут добавляли 4-(4-метилпиперазин-1-илметил)бензойной кислоты метиловый эфир (100 г, 402,71 ммоль) в дихлорметане (200 мл). После 1 ч перемешивания при комнатной температуре реакционную смесь нагревали до температуры дефлегмации в течение 20 ч и охлаждали до комнатной температуры. Этот раствор переносили по каплям через канюлю в реактор, содержащий 2 н. NaOH (2,1 л), охлажденный до 5°C. После перемешивания в течение 3 ч при комнатной температуре осадок фильтровали через целит. Раствор экстрагировали дихлорметаном, и органический слой промывали водой и насыщенным раствором хлорида натрия, сушили над MgSO4 и концентрировали под вакуумом. Полученное коричневое твердое вещество перекристаллизовывали из i-Pr2O с получением 130,7 г (78%) порошка бежевого цвета.
Способ Б
Получение хлорангидрида
К смеси 4-(4-метилпиперазин-1-илметил)бензойной кислоты дигидрохлорида (1,0 экв.), дихлорметана (7 об.) и триэтиламина (2,15 экв.) добавляли тионилхлорид (1,2 экв.) при 18-28°С.Реакционную смесь перемешивали при 28-32°C в течение 1 часа.
Присоединение хлорангидрида к аминотиазолу
В охлажденной (0-5°C) суспензии 4-метил-N3-(4-пиридин-3-илтиазол-2-ил)бензол-1,3-диамина (0,8 экв.) и тиэтиламина (2,2 экв.) в дихлорметане (3 об.) раствор хлорангидрида (полученный выше) поддерживал температуру ниже 5°C. Реакционную смесь нагревали до 25-30°C и перемешивали при той же температуре в течение 10 ч. К реакционной смеси добавляли метанол (2 об.) и воду (5 об.) и перемешивали. После разделения слоев к водному слою добавляли метанол (2 об.), дихлорметан (5 об.) и раствор гидроксида натрия (водный, 10%, до тех пор, пока pH не стал 9,5-10,0) и перемешивали в течение 10 минут. Слои разделяли. Органический слой промывали водой и насыщенным раствором хлорида натрия. Органический слой концентрировали и добавляли этанол (2 об.) и перемешивали. Смесь концентрировали. К остатку добавляли этанол и перемешивали. Продукт фильтровали и сушили при 50-55°C в вакуумной лотковой сушилке.
Выход=65-75%.
Способ В
К раствору 4-метил-N3-(4-пиридин-3-илтиазол-2-ил)бензол-1,3-диамина (1,0 экв.) в ДМФ (DMF) (20 об.) добавляли последовательно триэтиламин (5 экв.), 2-хлор-1-метилпиридиния йодид (2 экв.) и 4-(4-метилпиперазин-1-илметил)бензойную кислоту (2 экв.). Реакционную смесь перемешивали в течение 7 ч при комнатной температуре. Затем смесь разбавляли в диэтиловом эфире и промывали водой и насыщенным водным NaHCO3, сушили над Na2SO4 и концентрировали. Сырой продукт очищали с помощью колоночной хроматографии с использованием элюции 100% EtOAc с получением желтого твердого вещества.
Выход=51%.
1H ЯМР (CDCl3): δ=9.09 (1Н, s, NH); 8.52 (1Н, br s); 8.27 (1Н, s); 8.13 (1Н, s); 8.03 (1Н, s); 7.85 (2H, d, J=8.3 Гц); 7.45 (2Н, m); 7.21-7.38 (4H, m); 6.89 (1Н, s); 3.56 (2H, s); 2.50 (8H, br s); 2.31 (6H, br s).
MS (Cl) m/z=499 (M+H)+
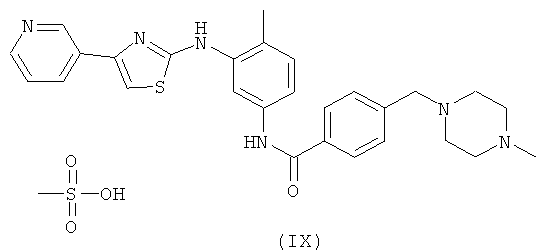
Дополнительный аспект настоящего изобретения относится к конкретному полиморфу соли метансульфоновой кислоты N-[4-метил-3-(4-пиридин-3-илтиазол-2-иламино)фенил]бензамида формулы (IX).
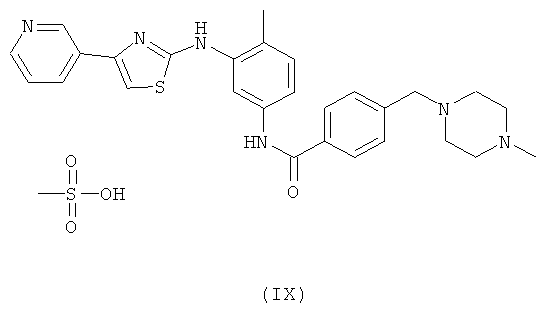
Ниже описана полиморфная форма соединения (IX), которая имеет наиболее предпочтительные свойства, относящиеся к технологичности, хранению и приготовлению препаратов. Например, эта форма остается сухой при 80% относительной влажности и термодинамически стабильной при температурах ниже 200°C.
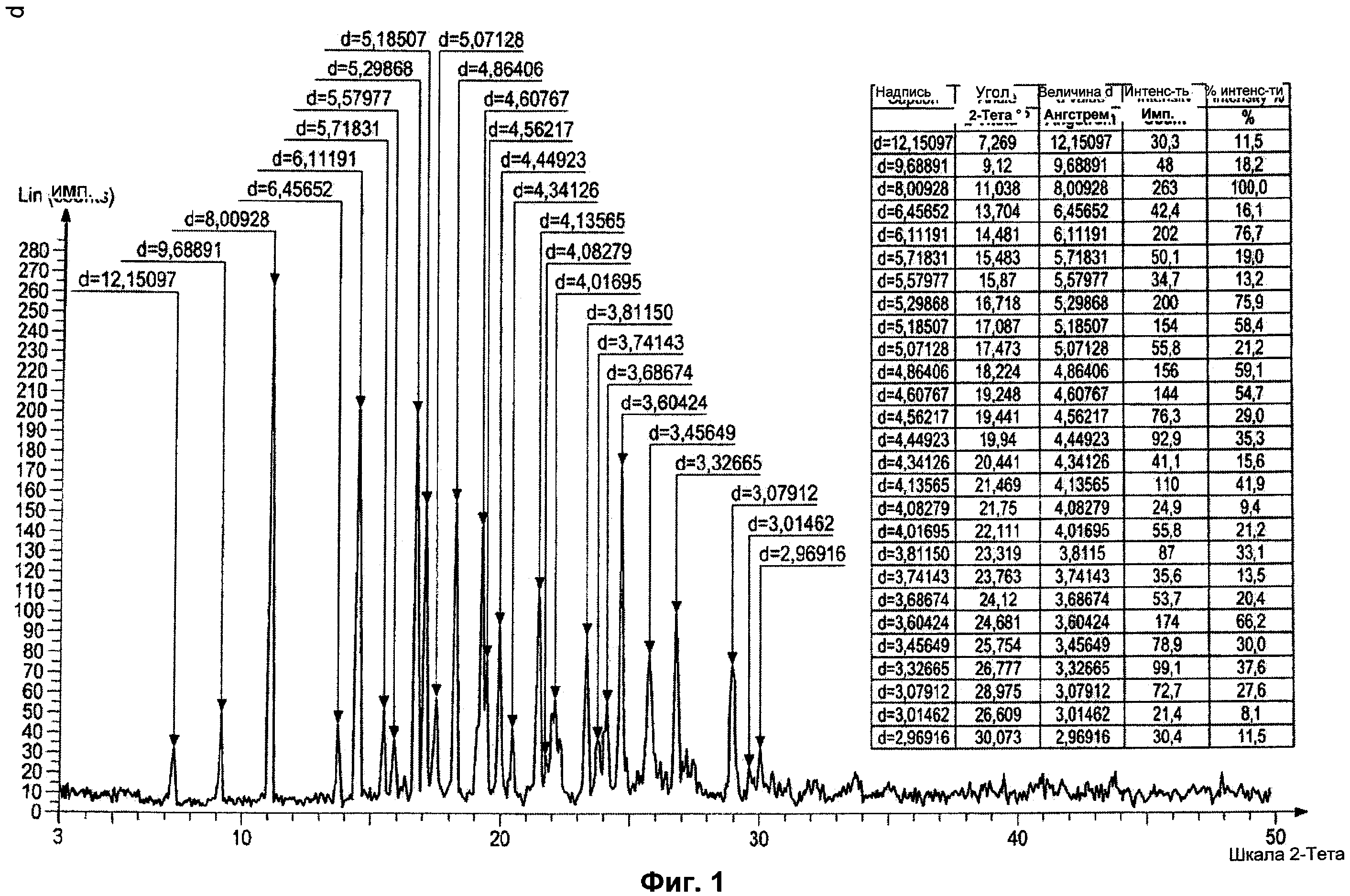
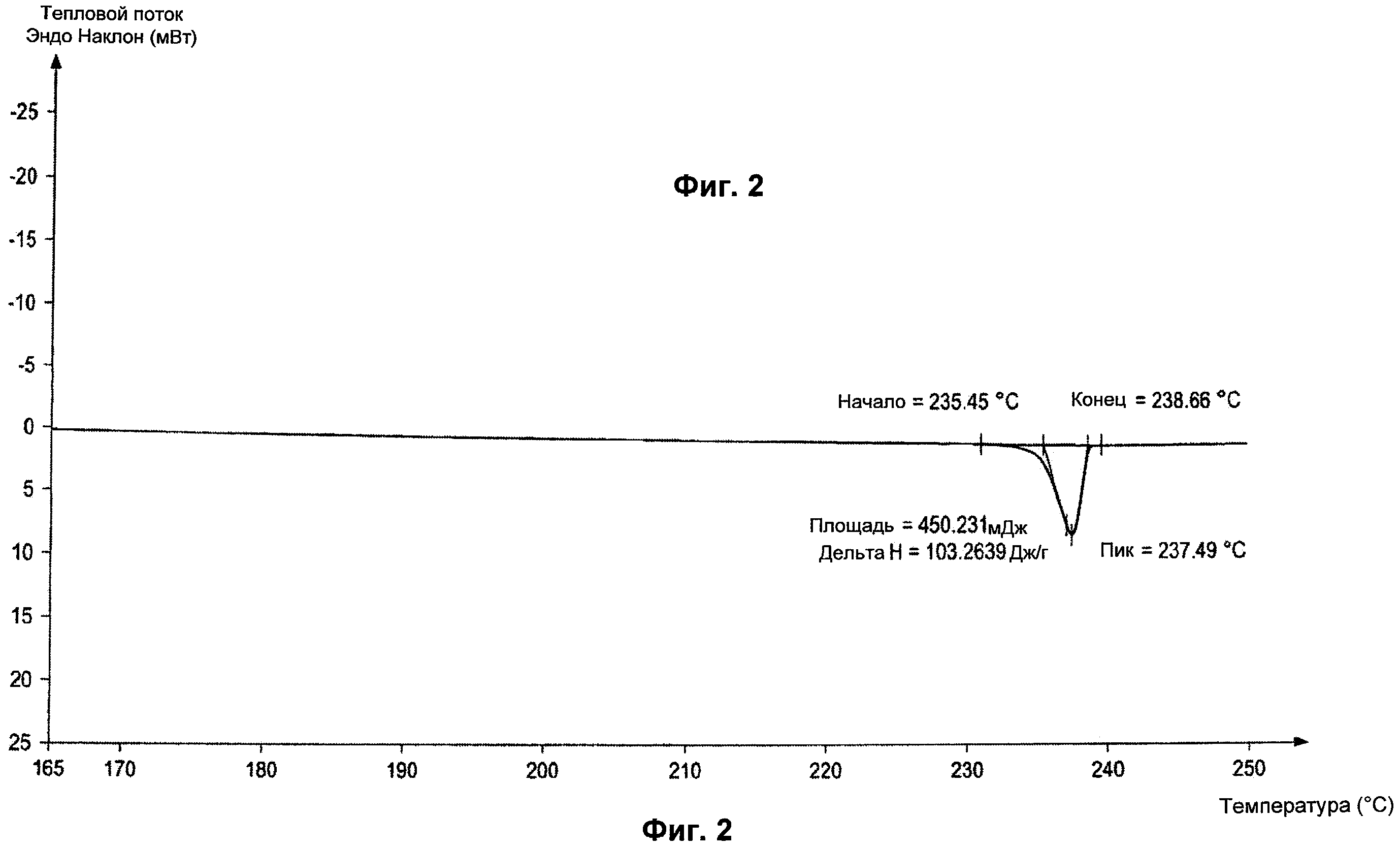
Полиморф этой формы характеризуется картиной дифракции рентгеновских лучей, проиллюстрированной на Фиг.1, включающей характеристические пики приблизительно 7.269, 9.120, 11.038, 13.704, 14.481, 15.483, 15.870, 16.718, 17.087, 17.473, 18.224, 19.248, 19.441, 19.940, 20.441, 21.469, 21.750, 22.111, 23.319, 23.763, 24.120, 24.681, 25.754, 26.777, 28.975, 29.609, 30.073 градусов Θ, а также характеризующейся дифференциальной сканирующей калориметрией (DSC), проиллюстрированной на Фиг.2, которая демонстрирует единственное максимальное значение при приблизительно 237,49±0,3°C.
Картину дифракции рентгеновских лучей получают с использованием Bruker AXS (D8 advance). Дифференциальную сканирующую калориметрию (DSC) осуществляют с использованием Perking Elmer Precisely (Diamond DSC).
Эта полиморфная форма может быть получена путем обработки 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-илтиазол-2-иламино)фенил]бензамида 1,0-1,2 эквивалентами метансульфоновой кислоты при подходящей температуре, предпочтительно от 20 до 80°C.
Реакцию осуществляют в подходящем растворителе, в особенности полярном растворителе, таком как метанол или этанол, или кетон, такой как ацетон, или простой эфир, такой как диэтиловый эфир, или диоксан, или их смесь.
Это изобретение поясняется в примере, представленном ниже, который предложен лишь в качестве иллюстрации и поэтому не должен рассматриваться как ограничение объема изобретения.
Получение вышеуказанной полиморфной формы 4-(4-метилпиперазин-1-илметил)-М-[4-метил-3-(4-пиридин-3-илтиазол-2-иламино)фенил]бензамида метансульфоната.
4-(4-Метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-илтиазол-2-иламино)фенил]бензамид (1,0 экв.) растворяли в этаноле (4,5 об.) при 65-70°C. Метансульфоновую кислоту (1,0 экв.) добавляли медленно при той же температуре. Смесь охлаждали до 25-30°C и поддерживали в течение 6 ч. Продукт фильтровали и сушили в вакуумной лотковой сушилке при 55-60°C. Выход=85-90%. Начальная точка плавления Н.т.пл.=236°C.