Результат интеллектуальной деятельности: БАКУЛОВИРУСНЫЕ ВЕКТОРЫ С ДВОЙНЫМ ПРОМОТОРОМ, ВКЛЮЧАЮЩИМ В СЕБЯ ПРОМОТОР ПОЗВОНОЧНОГО И ПРОМОТОР БАКУЛОВИРУСА, КОНТРОЛИРУЮЩИМ ИММУНОГЕННЫЙ СЛИТЫЙ ГЕН
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новому вектору для переноса, рекомбинантному бакуловирусу, полученному гомологичной рекомбинацией вектора для переноса и бакуловирусной ДНК, и к способам их получения.
Настоящее изобретение, кроме того, относится к фармацевтическим препаратам (например, вакцинам и профилактическим или терапевтическим лекарственным средствам для лечения инфекционных болезней, таких как малярия и грипп), содержащим рекомбинантный бакуловирус в качестве активного ингредиента.
УРОВЕНЬ ТЕХНИКИ
Бакуловирус применяли в качестве вектора в способах промышленного получения требуемого белка с использованием клеток насекомых. В последние годы было обнаружено, что бакуловирус может вводить чужеродный ген не только в клетки насекомых, но также в клетки млекопитающих, и была выявлена возможность его применения в качестве вектора для введения терапевтического гена. В патентном документе 1 описан рекомбинантный бакуловирусный экспрессирующий вектор, содержащий множество независимых промоторов, включая промотор, полученный из раннего гена бакуловируса, который имеет область ДНК, содержащую ген, кодирующий неструктурный белок вируса, и промотор, полученный из позднего гена бакуловируса, который имеет область ДНК, содержащую ген, кодирующий структурный белок вируса.
В патентном документе 2 раскрыт способ, включающий в себя введение в клетки млекопитающих вирусного вектора, содержащего ДНК организма, отличного от млекопитающего, который содержал множество независимых промоторов, регулируемых так, чтобы экспрессировать требуемый чужеродный ген, связанный с промоторами; и экспрессию чужеродного гена в клетках млекопитающих.
Кроме того, в патентном документе 3 раскрыт способ получения белка способом на основе рекомбинации генов с использованием бакуловируса. Такой способ включает в себя экспрессию слитого гена, полученного связыванием гена gp64 бакуловируса с геном, кодирующим требуемый белок, чтобы получить требуемый белок в слитой с вирусными частицами форме, сбор вирусных частиц, слитых с требуемым белком, и отщепление требуемого белка от вирусных частиц, чтобы собрать белок.
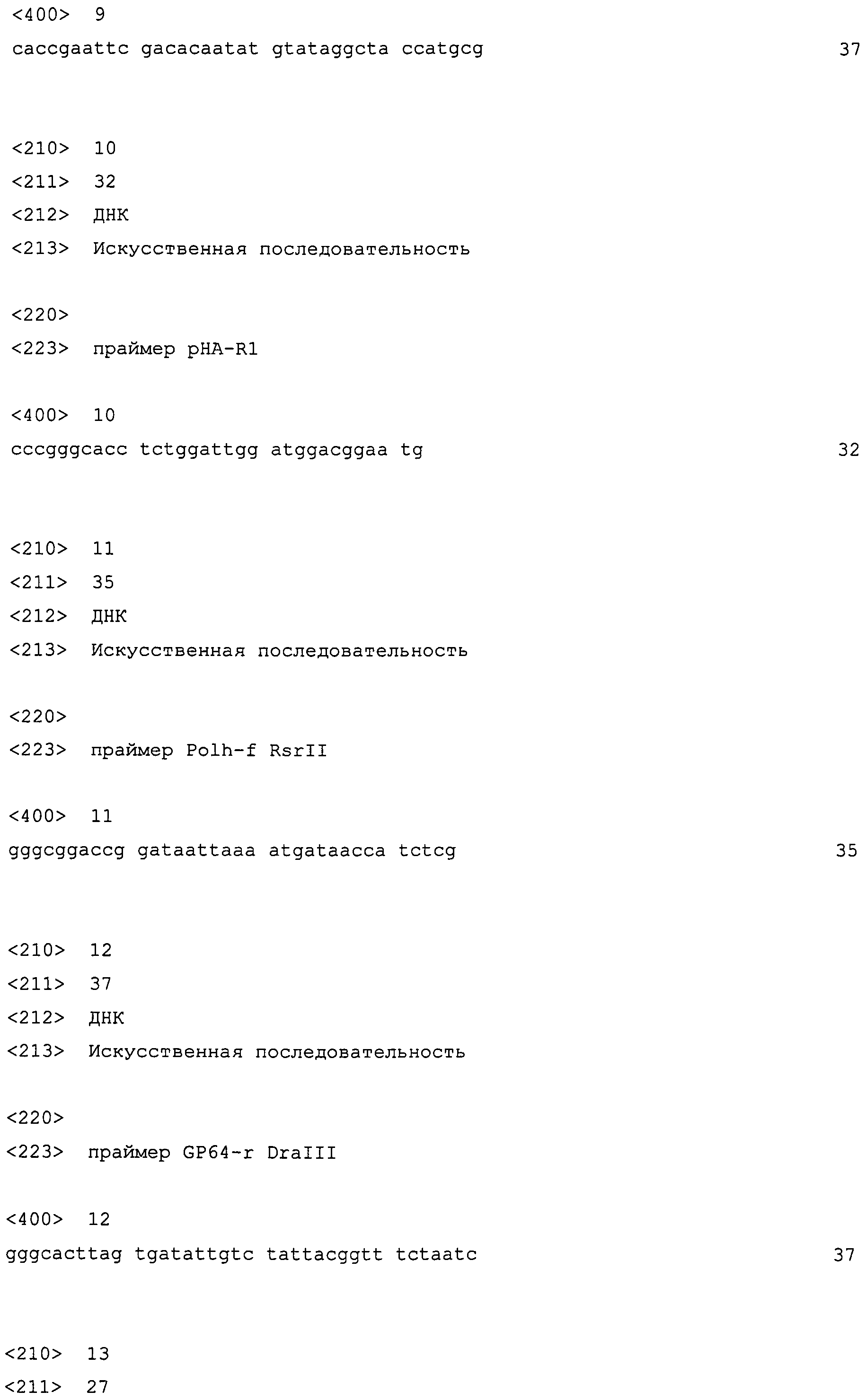
Что касается бакуловирусной системы экспрессии, то в патентом документе 4 описан рекомбинантный бакуловирусный экспрессирующий вектор, имеющий несколько независимых промоторов, содержащий первую последовательность нуклеиновой кислоты, кодирующую регистрируемый маркер, который связан в способной к функционированию форме с первым промотором, который является активным в клетках-хозяевах и неактивным в не соответствующих клетках, и вторую последовательность нуклеиновой кислоты, содержащую чужеродную последовательность нуклеиновой кислоты, которая связана в способной к функционированию форме со вторым промотором, который является активным в не соответствующих клетках.
В патентном документе 5 описано, что рекомбинантный бакуловирусный вектор, экспрессирующий антиген гемагглютинин (HA) вируса гриппа, связанный с промотором CAG, полученным из β-актина цыпленка, оказывает профилактический эффект в отношении инфекции вирусом гриппа и поэтому применим в качестве вакцинного препарата.
В патентном документе 6 раскрыт способ получения бакуловирусного вектора, включающий в себя стадию котрансфекции в клетки насекомых плазмиды, содержащей бакуловирусный промотор и промотор, полученный из клеток млекопитающих, с которым связан ген, кодирующий белок, экспрессируемый на клеточной поверхности, или плазмиды, содержащей два бакуловирусных промотора, с которыми связан ген, кодирующий белок, экспрессируемый на клеточной поверхности.
В патентном документе 7 описано исследование активности против вируса гриппа, т.е. активности, направленной против инфекции вирусом гриппа, рекомбинантного бакуловируса, содержащего кДНК HA вируса гриппа, введенную в промотор CAG, и указано, что не только рекомбинантный бакуловирус, но также бакуловирус дикого типа обладает активностью против вируса гриппа.
Как указано выше, в последние годы разработаны различные рекомбинантные бакуловирусные векторы, и были предприняты многочисленные попытки разработать фармацевтические средства для млекопитающих, содержащие такой рекомбинантный бакуловирусный вектор в качестве активного ингредиента.
В данной области техники требуется разработка фармацевтических препаратов, особенно препаратов вакцин, содержащих в качестве активного ингредиента новый рекомбинантный бакуловирус, который представляет собой рекомбинантный бакуловирусный вектор, имеющий новую структуру и эффективный против малярии, гриппа, туберкулеза и подобных инфекционных болезней, или таких заболеваний, как злокачественная опухоль.
Патентный документ 1: патент Японии No. 3366328. Multiple Promoter Baculovirus Expression System and Defect Particle Products.
Патентный документ 2: WO98/011243, Non-mammalian DNA Virus Having Modified Coating Protein.
Патентный документ 3: JP No. 2002-235236-A, Methods of Producing Proteins.
Патентный документ 4: JP No. 2003-284557-A, Novel Baculovirus-Transfecting Vector and Recombinant Baculovirus for Expression of Foreign Gene.
Патентный документ 5: WO 02/062381, Baculovirus Vector Vaccine.
Патентный документ 6: WO 04/029259, Baculovirus Vector, Method of Producing Baculovirus Vector, and Method of Introducing Gene.
Патентный документ 7: JP No. 2005-15346-A, Baculovirus-containing Anti-viral Agent.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
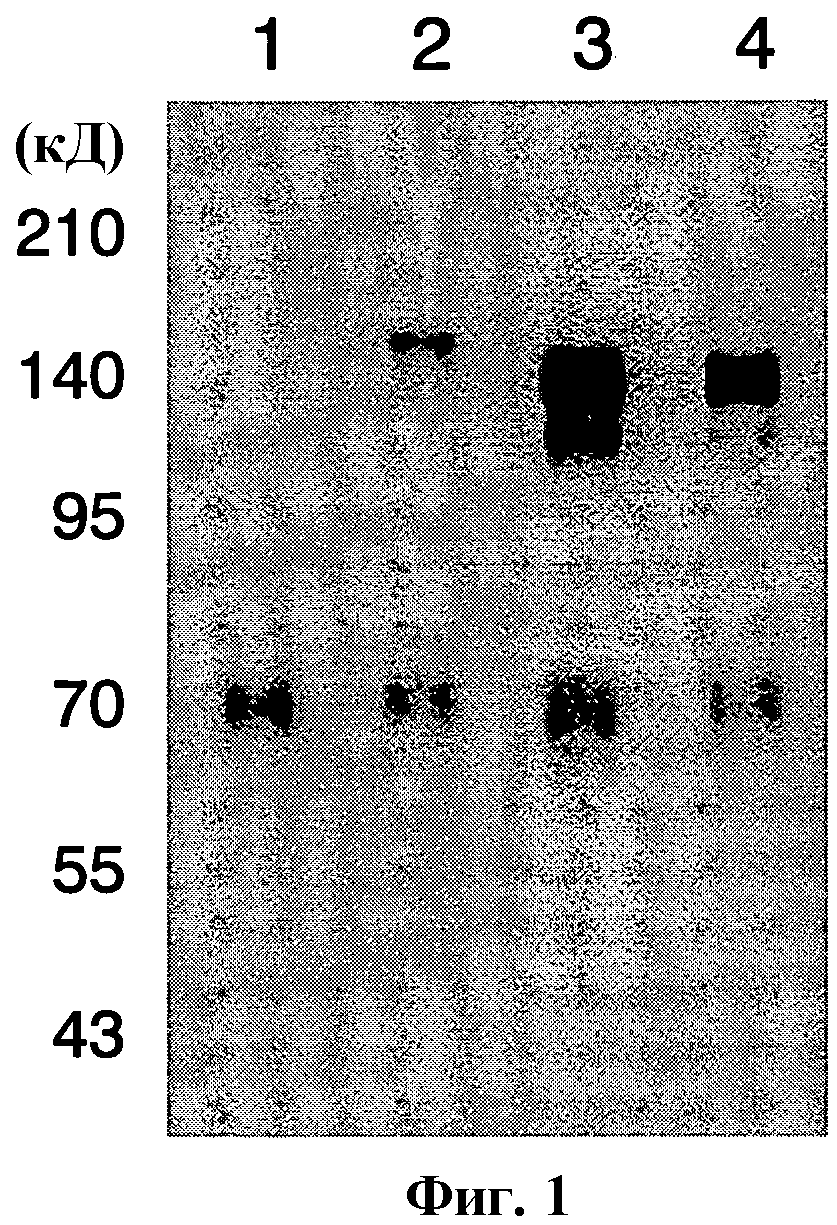
Фиг.1 показывает результаты тестирования экспрессии антигенов вакцины рекомбинантными бакуловирусами согласно настоящему изобретению в клетках насекомых, как описано в примере 3.
Выявление с использованием моноклонального антитела против gp64 (AcV5)
Дорожка 1: AcNPV-WT
Дорожка 2: AcNPV-CAP-PfCSP
Дорожка 3: AcNPV-CAP-HA1/Anhui
Дорожка 4: AcNPV-CAP-HA1/Vietnam.
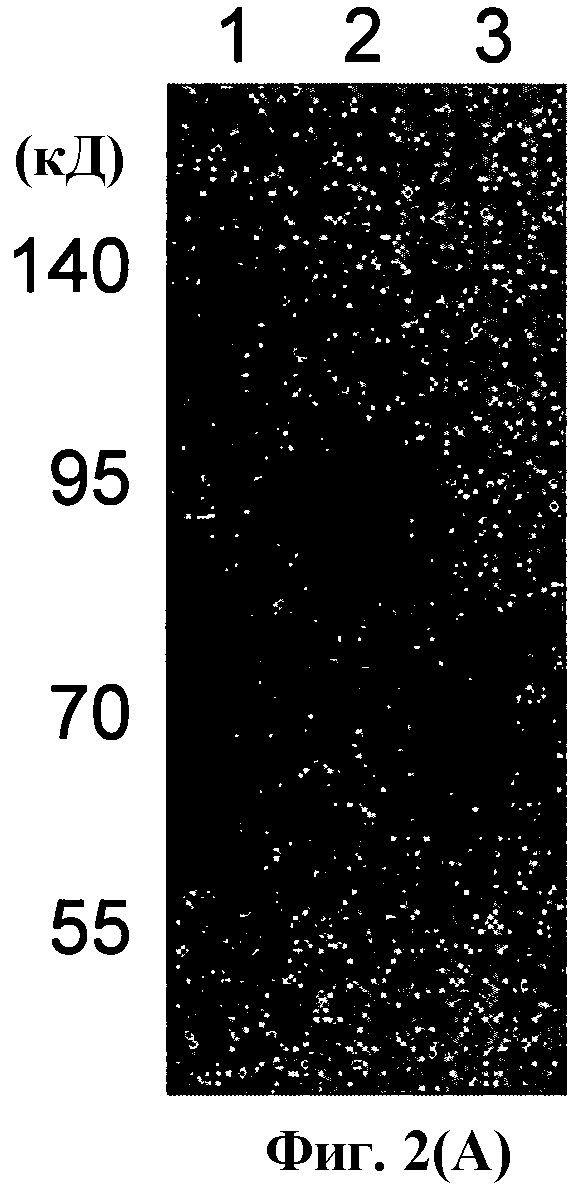
На фиг.2 (A) показан основанный на Вестерн-блоттинге анализ, показывающий экспрессию гена CSP (PfCSP) малярии человека в вирусных частицах рекомбинантных бакуловирусов, полученных из рекомбинантных векторов для переноса.
Выявление с использованием моноклонального антитела против PfCSP (2A10)
Дорожка 1: AcNPV-CAP-PfCSP
Дорожка 2: AcNPV-CAP-PfCSP/272
Дорожка 3: AcNPV-CAP-PfCSP/467.
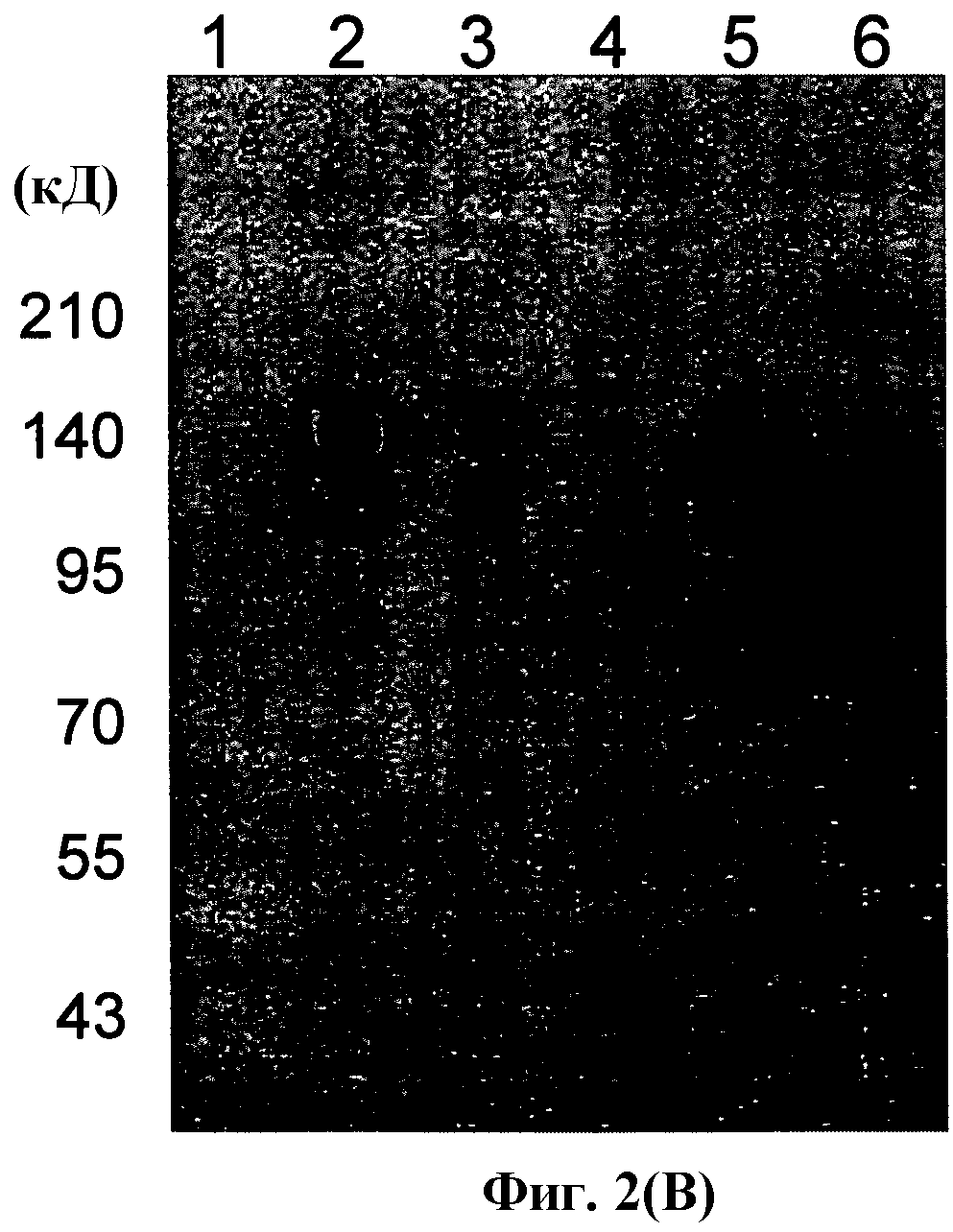
На фиг.2 (B) показан основанный на Вестерн-блоттинге анализ, показывающий экспрессию гена H5N1/HA1 в вирусных частицах рекомбинантных бакуловирусов, полученных из рекомбинантных векторов для переноса.
Выявление с использованием поликлонального антитела против H5N1/Vietnam (IT-003-005)
Дорожка 1: AcNPV-WT (лизат клеток)
Дорожка 2: AcNPV-CAP-HA1/Anhui (лизат клеток)
Дорожка 3: AcNPV-CAP-HA1/Vietnam (лизат клеток)
Дорожка 4: AcNPV-WT (вирион)
Дорожка 5: AcNPV-CAP-HA1/Vietnam (вирион)
Дорожка 6: Очищенный антиген H5N1/Anhui (IT-003-0053p).
На фиг.3 показаны клетки HepG2, окрашенные флуоресцентно меченым антителом, и показано, что антиген экспрессировался рекомбинантным бакуловирусом, содержащим слитый ген, состоящий из гена PfMSP1 и гена PfCSP, в клетках HepG2. Результаты, представленные на фиг.3 (A) подтвердили экспрессию антигена PfCSP. Результаты, представленные на фиг.3 (B) подтвердили экспрессию антигена PfMSP-119.
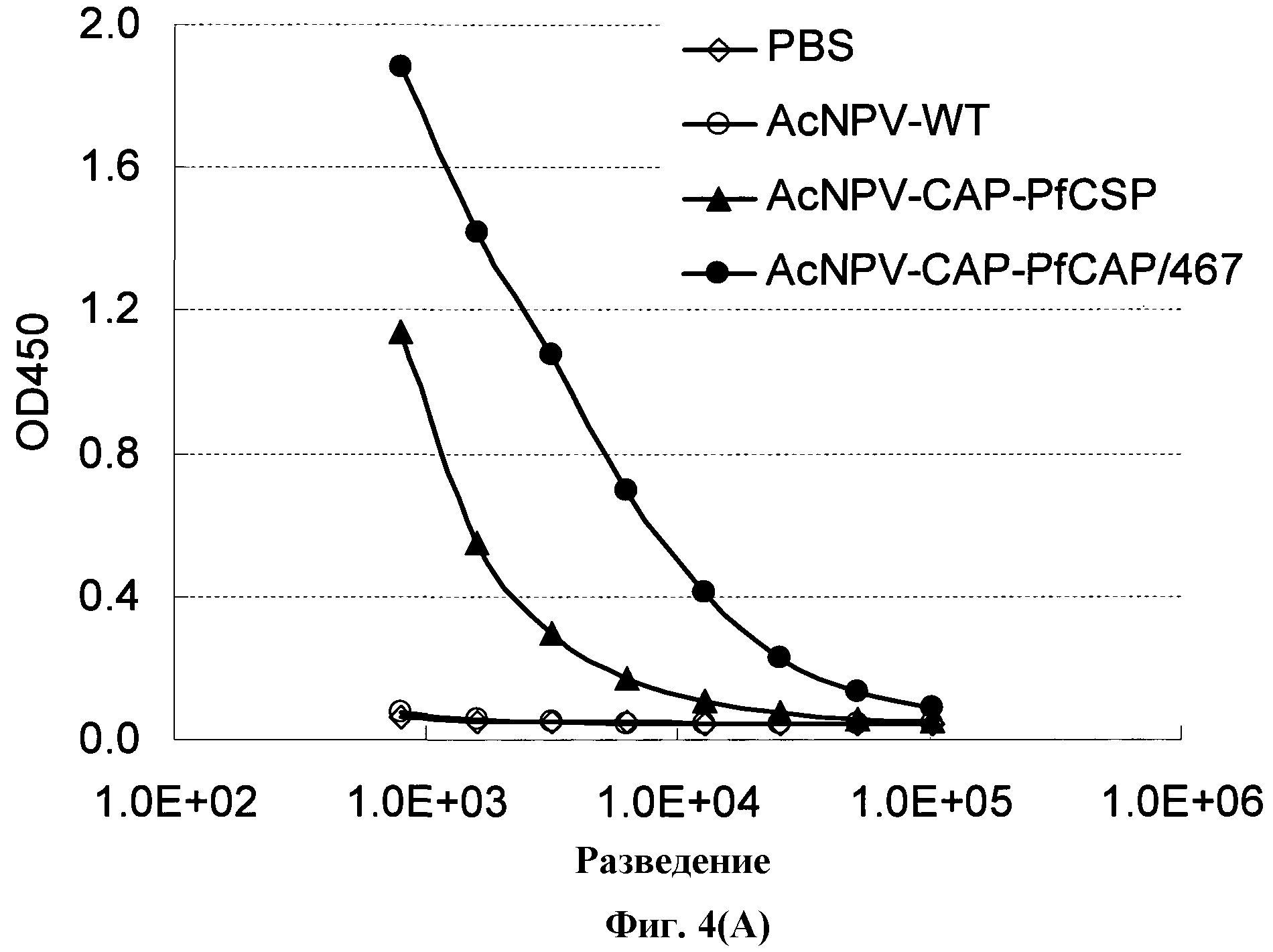
На фиг.4 показаны результаты измерения титров антител, полученных в примере 6.
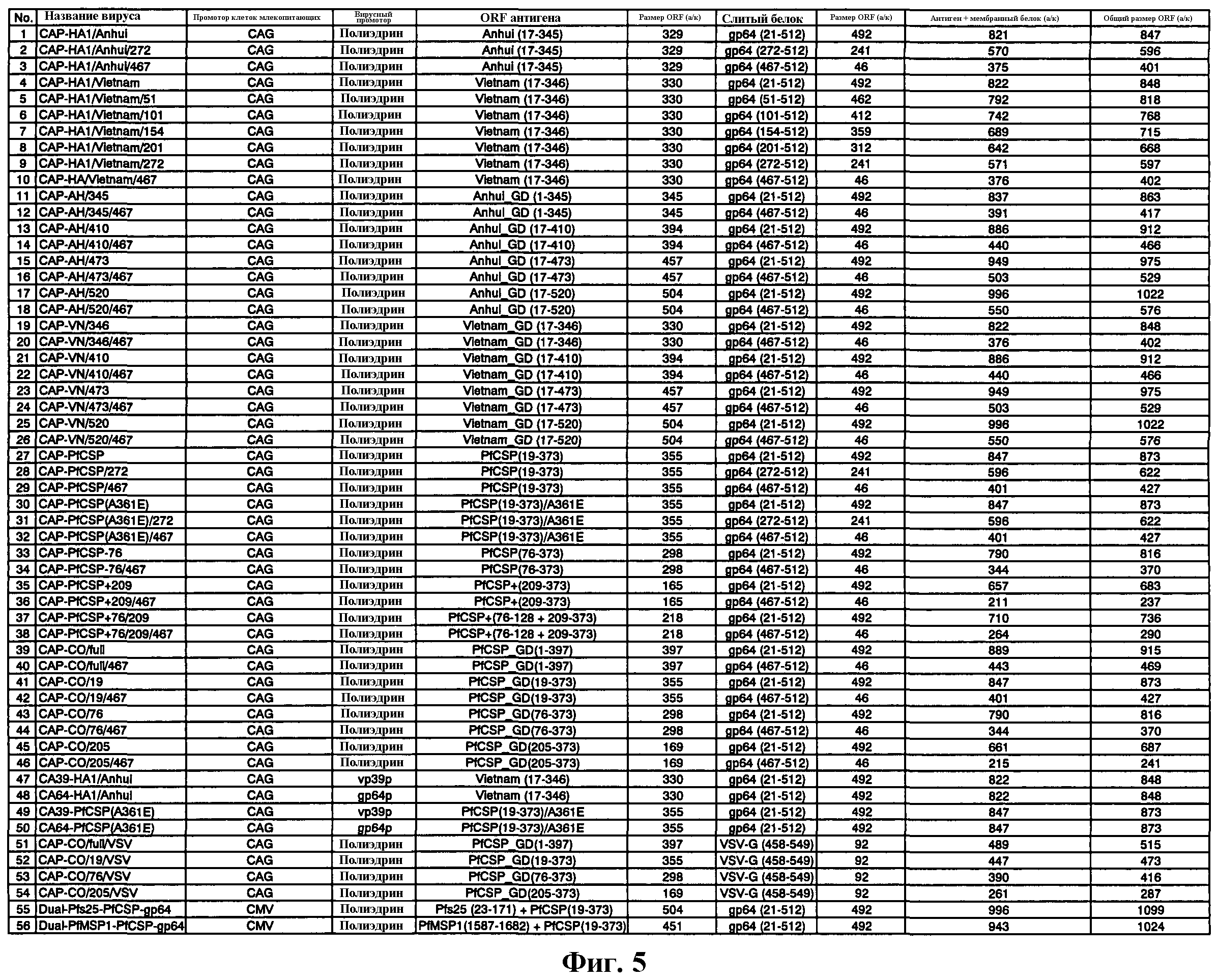
На фиг.5 показаны векторы для переноса согласно настоящему изобретению.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
Целью настоящего изобретения является получение нового рекомбинантного вектора для переноса, рекомбинантного бакуловируса, полученного в результате гомологичной рекомбинации между рекомбинантным вектором для переноса и бакуловирусной ДНК, и способы его получения. Другой целью настоящего изобретения является получение фармацевтического препарата, в частности, вакцинного препарата, содержащего рекомбинантный бакуловирус в качестве активного ингредиента.
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМ
Авторы настоящего изобретения получили вектор для переноса, имеющий новую структуру, способный экспрессировать слитый белок, состоящий из белка, имеющего требуемую иммуногенность, или части такого белка и структурного белка вируса, в клетках насекомых и в клетках позвоночных (в частности, в клетках млекопитающих и птиц); и рекомбинантный бакуловирус, полученный в результате гомологичной рекомбинации вектора для переноса и бакуловирусной ДНК. Используя полученный рекомбинантный бакуловирус, авторы настоящего изобретения осуществили всестороннее исследование фармацевтических препаратов, содержащих в качестве активного ингредиента рекомбинантный бакуловирус, обладающий профилактическим и терапевтическим действием против инфекционных заболеваний. В результате авторы изобретения обнаружили, что полученный рекомбинантный бакуловирус обладает требуемым фармацевтическим действием.
Таким образом, авторы настоящего изобретения получили рекомбинантный вектор для переноса, имеющий новую структуру, рекомбинантный бакуловирус, полученный в результате гомологичной рекомбинации вектора для переноса и бакуловирусной ДНК, и предложили способы их получения, и установили, что рекомбинантный бакуловирус как таковой применим в качестве фармацевтического препарата, обеспечивающего возможность экспрессии белка, обладающего требуемой иммуногенностью, в клетках-мишенях, и в качестве фармацевтического препарата для профилактики инфекционных заболеваний, таких как малярия и грипп.Настоящее изобретение осуществлено на основе указанных открытий.
Настоящее изобретение относится к объектам изобретения, указанным в следующих пунктах 1-22:
Пункт 1. Вектор для переноса, который представляет собой любой из векторов pCAP-PfCSP, pCAP-PfCSP/272, pCAP-PfCSP/467, pCAP-PfCSP(A361E), pCAP-PfCSP(A361E)/272, pCAP-PfCSP(A361E)/467, pCAP-PfCSP-76, pCAP-PfCSP-76/467, pCAP-PfCSP+209, pCAP-PfCSP+209/467, pCAP-PfCSP+76/209, pCAP-PfCSP+76/209/467, pCAP-HA1/Anhui, pCAP-HA1/Anhui/272, pCAP-HA1/Anhui/467, pCAP-HA1/Vietnam, pCAP-HA1/Vietnam/51, pCAP-HA1/Vietnam/101, pCAP-HA1/Vietnam/154, pCAP-HA1/Vietnam/201, pCAP-HA1/Vietnam/272, pCAP-HA1/Vietnam/467, pCAP-AH/345, pCAP-AH/345/467, pCAP-AH/410, pCAP-AH/410/467, pCAP-AH/473, pCAP-AH/473/467, pCAP-AH/520, pCAP-AH/520/467, pCAP-VN/346, pCAP-VN/346/467, pCAP-VN/410, pCAP-VN/410/467, pCAP-VN/473, pCAP-VN/473/467, pCAP-VN/520, pCAP-VN/520/467, pCAP-CO/full, pCAP-CO/full/467, pCAP-CO/19, pCAP-CO/19/467, pCAP-CO/76, pCAP-CO/76/467, pCAP-CO/205, pCAP-CO/205/467, pCA39-HA1/Anhui, pCA64-HA1/Anhui, pCA39-PfCSP(A361E), pCA64-PfCSP(A361E), pCAP-CO/full/VSV, pCAP-CO/19/VSV, pCAP-CO/76/VSV, pCAP-CO/205/VSV, pDual-Pfs25-PfCSP-gp64 и pDual-PfMSP1-PfCSP-gp64.
Пункт 2. Рекомбинантный бакуловирус, который представляет собой любой из бакуловирусов AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-HA1/Anhui, AcNPV-CA64-HA1/Anhui, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64.
Пункт 3. Композиция для лечения инфекционных болезней, содержащая рекомбинантный бакуловирус по п.2 в качестве активного ингредиента.
Пункт 4. Композиция для лечения инфекционных болезней, содержащая рекомбинантный бакуловирус по п.2 в качестве активного ингредиента, при этом композицию вводят внутримышечным, респираторным или назальным путем.
Пункт 5. Вакцина, содержащая рекомбинантный бакуловирус по п.2 в качестве активного ингредиента.
Пункт 6. Вакцина, содержащая рекомбинантный бакуловирус по п.3 в качестве активного ингредиента, при этом композицию вводят внутримышечным, респираторным или назальным путем.
Пункт 7. Терапевтическое или профилактическое средство против инфекции вирусом гриппа, содержащее в качестве активного ингредиента любой из AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CA39-HA1/Anhui и AcNPV-CA64-HA1/Anhui.
Пункт 8. Терапевтическое или профилактическое средство против инфекции вирусом гриппа по п.7, которое вводят внутримышечным, респираторным или назальным путем.
Пункт 9. Вакцина против инфекции вирусом гриппа, содержащая в качестве активного ингредиента любой из AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CA39-HA1/Anhui и AcNPV-CA64-HA1/Anhui.
Пункт 10. Вакцина против инфекции вирусом гриппа по п.7, которую вводят внутримышечным, респираторным или назальным путем.
Пункт 11. Терапевтическое или профилактическое средство против малярийной инфекции человека, содержащее в качестве активного ингредиента любой из AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64.
Пункт 12. Терапевтическое или профилактическое средство против малярийной инфекции человека по п.11, которое вводят внутримышечным, респираторным или назальным путем.
Пункт 13. Терапевтическое или профилактическое средство против малярийной инфекции человека, содержащее в качестве активного ингредиента любой из AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64.
Пункт 14. Терапевтическое или профилактическое средство против малярийной инфекции человека по п.13, которое вводят внутримышечным, респираторным или назальным путем.
Пункт 15. Способ профилактики малярийной инфекции или инфекции гриппа или лечения малярии или гриппа, включающий в себя введение субъекту эффективного количества рекомбинантного бакуловируса по п.2, композиции для лечения инфекционных болезней по п.3 или 4, или вакцины по п.5, 6, 9, 10, 13 или 14.
Пункт 16. Способ по п.15, в котором рекомбинантный бакуловирус, композицию или вакцину вводят субъекту в качестве липосомного препарата.
Пункт 17. Способ по п.15, в котором рекомбинантный бакуловирус, композицию или вакцину вводят субъекту внутримышечным, респираторным или назальным путем.
Пункт 18. Способ по п.16, в котором рекомбинантный бакуловирус, композицию или вакцину вводят субъекту внутримышечным, респираторным или назальным путем.
Пункт 19. Способ иммуностимуляции, включающий в себя введение субъекту эффективного количества рекомбинантного бакуловируса по п.2, композиции для лечения инфекционных болезней по п.3 или 4, или вакцины по п.5, 6, 9, 10, 13 или 14.
Пункт 20. Способ по п.19, в котором рекомбинантный бакуловирус, композицию или вакцину вводят субъекту в виде липосомного препарата.
Пункт 21. Способ по п.19, в котором рекомбинантный бакуловирус, композицию или вакцину вводят субъекту внутримышечным, респираторным или назальным путем.
Пункт 22. Способ по п.20, в котором рекомбинантный бакуловирус, композицию или вакцину вводят субъекту внутримышечным, респираторным или назальным путем.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предлагается новый рекомбинантный вектор для переноса, рекомбинантный бакуловирус, полученный в результате гомологичной рекомбинации рекомбинантного вектора для переноса и бакуловирусной ДНК, и способы его получения. Фармацевтические препараты, содержащие рекомбинантный бакуловирус согласно настоящему изобретению в качестве активного ингредиента, применимы в качестве терапевтических или профилактических лекарственных средств для лечения инфекционных болезней, таких как малярия и грипп, или в качестве клеточных лекарственных средств и препаратов вакцин.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Сокращенные названия, используемые в настоящем описании для обозначения аминокислот, пептидов, последовательностей оснований, основаны на сокращениях, принятых комиссией ИЮПАК-ИЮБ по биохимической номенклатуре, Eur. J. Biochem., 138: 9 (1984) и «Guideline for Preparing Specifications Including Base Sequences and Amino Acid Sequences» (патентное ведомство), и сокращениях, обычно используемых в данной области техники. В настоящем описании молекула ДНК может включать не только двунитевую ДНК, но также однонитевую ДНК, т.е., смысловую цепь и антисмысловую цепь, составляющие двунитевую ДНК, и не ограничена полной длиной. Полинуклеотид (молекула ДНК), кодирующая иммуногенный чужеродный ген согласно настоящему изобретению, охватывает двунитевую ДНК, содержащую геномную ДНК, однонитевую ДНК (смысловую нить), содержащую кДНК, и однонитевую ДНК (антисмысловую нить), имеющую последовательность, комплементарную смысловой нити, синтетическую ДНК и их фрагменты, если не оговорено особо.
Термины «полинуклеотид» или «молекула ДНК», используемые в настоящем описании, не ограничены функциональной областью и могут включать в себя, по меньшей мере, одну область подавления экспрессии, кодирующую область, лидерную последовательность, экзон и интрон.
Кроме того, примерами полинуклеотида являются РНК и ДНК. Полипептид, содержащий конкретную аминокислотную последовательность, и полинуклеотид, содержащий конкретную последовательность ДНК, включают фрагменты, гомологи, производные и мутанты полинуклеотида.
Примерами мутантов полинуклеотида, например, мутантной ДНК, являются встречающиеся в природе аллельные мутанты; искусственные мутантны; и мутанты, имеющие делецию, замену, присоединение и/или инсерцию. Однако следует понимать, что такие мутанты кодируют полипептиды, обладающие по существу такой же функцией, как и полипептид, кодируемый исходным немутантным полинуклеотидом.
В настоящем изобретении термин «вектор для переноса» относится к плазмиде для получения рекомбинантного бакуловируса, имеющего структуру, в которую включен слитый ген, образованный связыванием, по меньшей мере, одного гена, кодирующего белок, способный быть компонентом вирусных частиц, по меньшей мере, с одним иммуногенным чужеродным геном, ниже двойного промотора, содержащего два связанных промотора, т.е. один промотор позвоночного (например, промотор млекопитающего или промотор птицы) и один бакуловирус промотор.
В одном предпочтительном варианте осуществления изобретения иммуногенный чужеродный ген расположен ниже двойного промотора и выше гена, кодирующего белок, способный быть компонентом вирусных частиц. Рекомбинантный бакуловирус согласно настоящему изобретению применяют в качестве активного ингредиента фармацевтических препаратов или вакцин для позвоночных. Примерами позвоночных являются млекопитающие, такие как человек, крупный рогатый скот, лошади, свиньи, овцы, козы, обезьяны, мыши, собаки и кошки. Примерами птиц являются куры, перепела, гуси, дикие утки, голуби, индейки, цесарки и попугаи.
В одном варианте настоящее изобретение относится к вектору для переноса, содержащему новую структуру, имеющую в своем составе слитый ген из одного иммуногенного чужеродного гена и гена, кодирующего мембранный белок вируса, который может быть экспрессирован в клетках насекомых под контролем двойного промотора, содержащего один промотор позвоночных и один промотор бакуловируса, связанные друг с другом. Совместная трансфекция такого вектора для переноса с бакуловирусной ДНК в клетки насекомых индуцирует гомологичную рекомбинацию и, таким образом, приводит к получению рекомбинантного бакуловируса с включенным в него слитым геном, который экспрессируется под контролем бакуловирусного промотора в клетках насекомых и который может продуцировать слитый белок, способный быть компонентом отпочкованных вирусных частиц.
В настоящем изобретении при введении рекомбинантного бакуловируса позвоночным слитый белок, состоящий из белка, способного быть компонентом отпочкованных вирусных частиц, и иммуногенного белка, по-видимому, функционирует как многокомпонентная вакцина. Кроме того, рекомбинантный бакуловирус, введенный позвоночному, проникает в клетку позвоночного, и в клетке позвоночного с вирусного генома продуцируется слитый антиген с требуемым иммуногенным чужеродным антигеном и функционирует как ДНК-вакцина.
Таким образом, например, в том случае, когда рекомбинантный бакуловирус согласно настоящему изобретению вводят млекопитающему, слитый белок, состоящий из белка, способного быть компонентом вирусных частиц, и иммуногенного белка, презентируется в виде антигена на поверхности вирусных частиц, и слитый белок, состоящий из белка, способного быть компонентом вирусных частиц, и иммуногенного белка, продуцируется в клетке млекопитающего и, по-видимому, функционирует в качестве профилактического или терапевтического средства против инфекционных болезней, таких как вирусная, протозойная и бактериальная инфекция, благодаря своему иммуностимулирующему действию.
Бакуловирусная ДНК, трансфицируемая совместно с вектором для переноса, может представлять собой бакуловирусную ДНК дикого типа, мутантную или рекомбинантную бакуловирусную ДНК. Примерами клеток-хозяев, подвергаемых котрансфекции, являются клетки насекомых, такие как клетки Spodoptera frugiperda.
В настоящем изобретении термин «иммуногенный чужеродный ген» относится к гену, кодирующему аминокислотную последовательность антигенного белка, используемого в качестве иммуногена в иммунотерапии, такой как вакцинная терапия, для профилактики и лечения инфекционных болезней, таких как малярия и грипп.Конкретными примерами являются гены, кодирующие аминокислотные последовательности белков, таких как малярийный антиген и антиген вируса гриппа.
«Чужеродный» ген в используемом в настоящем описании смысле относится к гену, вводимому извне. Даже если такой же ген присутствует в клетке, ген, вводимый извне, называют «чужеродным» геном.
В настоящем изобретении ген, кодирующий аминокислотную последовательность белка, используемого в качестве иммуногена, особым образом не ограничен, при условии, что ген способен кодировать аминокислотную последовательность антигенного белка, обладающего иммуногенностью, направленной против вещества, которое вызывает заболевания, такие как инфекционные болезни. Примеры генов, кодирующих аминокислотную последовательность антигенного белка, обладающего иммуногенностью, приведены ниже.
Примеры генов, кодирующих аминокислотную последовательность малярийного антигена, включают гены, кодирующие аминокислотные последовательности поверхностного антигена спорозоита CSP (белок циркумспорозоита) малярийных паразитов, поверхностного мембранного белка мерозоита MSP1 (поверхностный белок мерозоита 1), малярийного S-антигена, секретируемого из эритроцитов, инфицированных возбудителем малярии, белка PfEMP1, присутствующего в выростах эритроцитов, инфицированных возбудителем малярии, белка SERA, белка TRAMP, белка AMA1 и подобных белков.
Примерами генов, кодирующих аминокислотные последовательности антигенов вируса гриппа, являются гены, кодирующие аминокислотные последовательности антигена HA (антиген гемагглютинина) антигена NA (антиген нейраминидазы), антигена M2 (антиген белка матрикса), антигена NP (нуклеопротеидный антиген) и подобных белков.
Среди генов позвоночных примерами генов млекопитающих являются гены, кодирующие аминокислотные последовательности антигенных белков инфекционных болезней человека, крупного рогатого скота, лошадей, свиней, овец, обезьян, мышей, собак и кошек. Примерами генов птиц являются гены антигенов (например, антигена HA гриппа птиц) инфекционных болезней кур, диких уток, голубей, индеек, цесарок и попугаев.
Гены патогенов, об ассоциации которых с инфекционными болезнями млекопитающих и птиц, которые указаны выше, сообщалось ранее, легко доступны от организаций, в которых хранятся зарегистрированные опубликованные данные о генах патогенов, таких как Genbank.
В настоящем изобретении предлагается вектор для переноса, содержащий такой иммуногенный чужеродный ген, и рекомбинантный бакуловирус, полученный в результате гомологичной рекомбинации вектора для переноса. Кроме того, в настоящем изобретении предлагается фармацевтическая композиция, содержащая в качестве активного ингредиента рекомбинантный бакуловирус, имеющий иммуногенный чужеродный ген, и вакцинный препарат, содержащий фармацевтическую композицию.
Бакуловирус, используемый в настоящем изобретении, относится к патогенным вирусам насекомых, которые вызывают инфекцию насекомых и которые составляют одну группу (Baculoviridae) ДНК-вирусов, имеющих циклическую двунитевую ДНК в качестве гена. Среди таких вирусов одна группа вирусов, называемых вирусами ядерного полиэдроза (NPV), продуцируют тело включения, называемое полиэдром, в ядре инфекционных клеток в поздней фазе инфекции. Даже если чужеродный ген, который необходимо экспрессировать, встроен на участке гена полиэдрина, вирусная инфекция и рост осуществляются в достаточной степени для получения большого количества требуемого продукта чужеродного гена. Поэтому в последние годы такой вирус использовали для получения требуемых белков.
Примерами бакуловирусов, используемых в настоящем изобретении, являются вирус ядерного полиэдроза Autographa californica: AcNPV, вирус ядерного полиэдроза Bombyx mori: BmNPV, вирус ядерного полиэдроза Orgyia pseudotsugata: OpNPV, и вирус ядерного полиэдроза Lymantria disper: LdNPV.
Бакуловирусная ДНК может представлять собой любую ДНК, которая может подвергаться гомологичной рекомбинации с вектором для переноса согласно настоящему изобретению. Более конкретно вирусный ген в бакуловирусной ДНК, который может подвергаться гомологичной рекомбинации с вектором для переноса согласно настоящему изобретению, имеет размер до 130 т.п.н., и в него может быть встроен иммуногенный чужеродный ген длиной 15 т.п.н. или более. Поскольку бакуловирусный ген сам по себе вряд ли экспрессируется в клетках позвоночных, то едва ли существует необходимость учитывать его цитотоксичность. Таким образом, полагают, что он не индуцирует опасного иммунного ответа.
(1) Вектор для переноса и получение вектора для переноса согласно настоящему изобретению
Получение ДНК иммуногенного чужеродного гена
ДНК иммуногенного чужеродного гена, которую можно сливать с вирусным геном, являющимся одним из компонентов бакуловирусного вектора для переноса, легко можно продуцировать или получить в результате синтеза на основании информации о последовательности нуклеиновой кислоты полинуклеотида, кодирующего аминокислотную последовательность антигенного белка, имеющего требуемую иммуногенность, описанного в настоящей публикации, или в результате непосредственного синтеза ДНК, соответствующей последовательности нуклеиновой кислоты кодирующей области иммуногенного чужеродного гена, на основании информации о последовательности нуклеиновой кислоты иммуногенного чужеродного гена (способ химического синтеза ДНК). Для такого получения можно использовать общие способы конструирования гена (смотри, например, «Molecular Cloning» 2d Ed, Cold Spring Harbor Lab. Press (1989); Zoku Seikagaku Jikken Kouza, «Idenshi Kenkyuho I, II, III», edited by Japanese Biochemistry Society, 1986).
Примерами способов синтеза ДНК являются способы химического синтеза, такие как фосфаттриэфирный способ и фосфатамидитный способ (J. Am. Chem. Soc., 89, 4801 (1967); там же, 91, 3350 (1969); Science, 150, 178 (1968); Tetrahedron Lett., 22, 1859 (1981); там же, 24, 245 (1983)) и способы на основе их сочетания. ДНК также может быть химически синтезирована фосфорамидитным способом или триэфирным способом или синтезирована с использованием коммерчески доступного автоматического синтезатора олигонуклеотидов. Двунитевой фрагмент может быть получен в результате синтеза комплементарной нити и отжига комплементарной нити с химически синтезированной первой нитью в подходящих условиях, или при добавлении комплементарной нити с подходящими последовательностями праймеров к химически синтезированной первой нити с использованием ДНК-полимеразы.
Конкретными примерами ДНК иммуногенного чужеродного гена, получаемой в настоящем изобретении, являются ДНК, содержащие последовательность ДНК, кодирующую аминокислотную последовательность антигенного белка возбудителя малярии, и последовательность ДНК, кодирующую аминокислотную последовательность антигенного белка вируса гриппа.
ДНК, применяемая в настоящем изобретении, не ограничена полноразмерной последовательностью ДНК, кодирующей аминокислотную последовательность полипептида антигенного белка, обладающего иммуногенностью, и может представлять собой последовательность ДНК, кодирующую его частичную последовательность, при условии, что белок с аминокислотной последовательностью, кодируемой такой последовательностью ДНК, обладает иммуногенностью.
ДНК иммуногенного чужеродного гена, используемая в настоящем изобретении, не ограничена молекулами ДНК, имеющими такую конкретную последовательность ДНК, и может представлять собой молекулы ДНК, имеющие последовательность ДНК, получаемую посредством соответствующей селекции кодонов для каждого аминокислотного остатка. Выбор кодонов можно осуществлять стандартным способом, например, учитывая частоту использования кодонов у хозяина (Nucleic Acids Res., 9, 43 (1981)).
ДНК иммуногенного чужеродного гена, используемая в настоящем изобретении, может быть получена способами генной инженерии, более конкретно с помощью получения библиотеки кДНК из подходящего источника, который экспрессирует ДНК иммуногенного чужеродного гена, стандартным способом, и отбора требуемого клона из библиотеки с использованием соответствующего зонда или антитела против экспрессируемого продукта, которое специфично по отношению к иммуногенному чужеродному гену (смотри, например, Proc. Natl. Acad. Sci., USA., 78, 6613 (1981); Science, 222, 778 (1983)).
Примерами источника геномной ДНК являются различные клетки, ткани и полученные из них культивируемые клетки, которые экспрессируют ДНК иммуногенного чужеродного гена. Особенно предпочтительны экстракты эритроцитов, инфицированных малярийными паразитами, и экстракты клеток, инфицированных вирусами гриппа. Экстракцию и разделение суммарной ДНК и РНК из источника, разделение и очистку мРНК и получение и клонирование кДНК можно осуществлять стандартными способами.
Как описано выше, ДНК иммуногенного чужеродного гена может быть получена с использованием библиотеки кДНК для каждого иммуногена, полученной в результате экстракции, разделения и очистки мРНК иммуногенной ткани или клеток из указанного выше экстракта. ДНК иммуногенного чужеродного гена также может быть получена с использованием фаговой библиотеки, получаемой экстракцией мРНК каждого иммуногена, добавлением поли-A к РНК, сбором поли A-РНК, получением кДНК с использованием обратной транскриптазы, добавлением сайтов для ферментов рестрикции к обоим концам кДНК и включением кДНК в фаг.
Способ скрининга ДНК иммуногенного чужеродного гена из библиотеки кДНК особым образом не ограничен и может быть осуществлен обычным способом. Конкретными примерами таких способов являются: способ отбора соответствующего клона кДНК в результате иммунологического скрининга с использованием специфичного антигена (например, противомалярийное антитело, антитело против вируса гриппа и т.д.) против белка, продуцируемого кДНК; способ гибридизации на бляшках с использованием зонда, избирательно связывающегося с последовательностью ДНК-мишенью; способ гибридизации колоний; и их сочетания.
Зонд, используемый в таких способах гибридизации, обычно представляет собой фрагмент ДНК, химически синтезированный на основании информации о последовательности ДНК иммуногенного чужеродного гена. Уже полученные последовательности ДНК иммуногенного чужеродного гена или их фрагменты также успешно можно использовать в качестве зонда. Смысловой праймер и антисмысловой праймер, сконструированные на основе информации о последовательности ДНК иммуногенного чужеродного гена, также могут быть использованы в качестве зонда для скрининга.
ДНК (нуклеотиды), используемая в качестве зонда, представляет собой часть ДНК (нуклеотидов), соответствующей последовательности ДНК иммуногенного чужеродного гена. ДНК (нуклеотиды) имеет, по меньшей мере, 15 последовательных нуклеотидов ДНК, предпочтительно, по меньшей мере, 20 последовательных нуклеотидов ДНК и более предпочтительно, по меньшей мере, 30 последовательных нуклеотидов последовательности ДНК. Позитивный клон для получения ДНК, который описан выше, как таковой также может быть использован в качестве зонда.
Чтобы получить ДНК иммуногенного чужеродного гена, предпочтительно используют способ ДНК/РНК-амплификации с помощью ПЦР (Science, 230, 1350 (1985)). В частности, когда из библиотеки трудно получить полноразмерную кДНК, предпочтительно используют способ RACE (быструю амплификацию концов кДНК; Jikken Igaku 12(6), 35(1994)), в частности, способ 5'-RACE (M. A. Frohman, et al., Proc. Natl. Acad. Sci., USA., 8, 8998(1988)).
Праймеры, используемые для ПЦР, могут быть сконструированы на основе информации о последовательности ДНК иммуногенного чужеродного гена и синтезированы стандартными способами. В качестве праймеров также можно использовать части ДНК (промотор/праймер SP6 и терминатор/праймер T7), добавляемые к обоим концам плазмидного вектора, содержащего ДНК иммуногенного чужеродного гена, включенную в такой вектор, как описано в примерах ниже.
Выделение/очистку фрагмента ДНК/РНК, амплифицированного в ПЦР, можно осуществить стандартными способами, например, гель-электрофорезом.
Последовательность ДНК иммуногенного чужеродного гена, полученная таким образом, или различных фрагментов такой ДНК, может быть определена стандартными способами, например, способом с использованием дидезоксинуклеотидов (Proc. Natl. Acad. Sci., USA., 74, 5463(1977)) или способом Максама-Гильерта (Methods in Enzymology, 65, 499(1980)), или просто с использованием коммерчески доступного набора для секвенирования.
Ген, кодирующий аминокислоты белка, который может быть компонентом вирусных частиц, может представлять собой любой ген, который может кодировать белок, который образует слитый белок с белком иммуногенного чужеродного гена, как описано выше, в клетках-мишенях, и может быть экспрессирован в виде белка, который может быть компонентом вирусных частиц в клетках насекомых.
Примерами гена, кодирующего аминокислоты белка, который может быть компонентом вирусных частиц, являются гены белка gp64 (GenBank, номер доступа L22858), гликопротеина G вируса везикулярного стоматита (VSVG: GenBank, номер доступа J02428), гликопротеина вируса простого герпеса (KOS: GenBank, номер доступа K01760), gp120 вируса иммунодефицита человека типа I (GenBank, номер доступа U47783), мембранного гликопротеина респираторно-синцитиального вируса человека (GenBank, номер доступа M86651), белка гемагглютинина вируса гриппа A (GenBank, номер доступа U38242) и гены белков оболочки вирусов, близкородственных бакуловирусу. В настоящем изобретении предпочтительно можно использовать ген gp64, описанный в примерах ниже.
ДНК гена, кодирующего аминокислоты белка, который может быть компонентом вирусных частиц, может быть легко продуцирован или получен в результате синтеза на основании информации о последовательности нуклеиновой кислоты полинуклеотида, кодирующего аминокислотную последовательность полипептида гена, кодирующего аминокислоты белка-мишени, который может быть компонентом вирусных частиц; или в результате непосредственного синтеза ДНК, соответствующей нуклеотидной последовательности, кодирующей аминокислотную последовательность, на основании информации об аминокислотной последовательности полипептида гена, кодирующего аминокислоты белка, который может быть компонентом вирусных частиц (химический синтез ДНК), как и в случае получения ДНК иммуногенного чужеродного гена.
Последовательность ДНК, соответствующая последовательности нуклеиновой кислоты, кодирующей аминокислоты белка, который может быть компонентом вирусных частиц, не ограничена полноразмерной кодирующей областью и может представлять собой ДНК, содержащую часть такой последовательности ДНК.
Как и в случае получения молекулы ДНК иммуногенного чужеродного гена, ДНК гена, кодирующего аминокислоты белка, который может быть компонентом вирусных частиц, может быть получена обычными способами генной инженерии (смотри, например, Molecular Cloning 2d Ed, Cold Spring Harbor Lab. Press (1989); Zoku Seikagaku Jikken Kouza, “Idenshi Kenkyuho I, II, III”, edited by the Japanese Biochemistry Society, 1986).
В настоящем изобретении также можно использовать коммерчески доступные плазмидные векторы, в которые была введена часть промотора, который контролирует экспрессию иммуногенного чужеродного гена, описанного далее, и был введен (частичный) ген, кодирующий аминокислоты белка, который может быть компонентом вирусных частиц.
Промоторы позвоночных
Примерами промотора позвоночных (промотора, способного функционировать в клетках позвоночных), который является одним из компонентов вектора для переноса, используемого в настоящем изобретении, являются промоторы млекопитающих и промоторы птиц.
Промоторы млекопитающих
Примерами промотора млекопитающих (промотора, способного функционировать в клетках млекопитающих), который является одним из компонентов вектора для переноса, используемого в настоящем изобретении, являются промоторы цитомегаловируса, промоторы SV40, промоторы ретровируса, промоторы металлотионеина, промоторы белков теплового шока, промоторы CAG, промоторы фактора элонгации 1α, промоторы актина, промоторы убиквитина, промоторы альбумина и промоторы MHC.
Промоторы птиц
Примерами промотора птиц являются промоторы β-актина, промоторы белков теплового шока, промоторы факторов элонгации, промоторы убиквитина и промоторы альбумина.
Бакуловирусные промоторы
Примерами бакуловирусного промотора, который является одним из компонентов бакуловирусного вектора для переноса, используемого в настоящем изобретении, являются промотор полиэдрина, промотор p10, промотор ie1, промотор p35, промотор vp39 и промотор gp64.
Получение рекомбинантного вектора для переноса
Настоящее изобретение относится к новому вектору для переноса, имеющему структуру, способную экспрессировать требуемый иммуногенный чужеродный ген в виде антигенного белка как в клетках насекомых, так и в клетках позвоночных, в частности, в клетках млекопитающих. Новый вектор для переноса, полученный согласно настоящему изобретению, имеет структуру, в которой последовательность ДНК, кодирующая аминокислотную последовательность требуемого иммуногенного белка, и последовательность ДНК, кодирующая аминокислотную последовательность белка, который может быть компонентом вирусных частиц, связаны ниже по ходу транскрипции от связанных промоторов, состоящих из одного промотора позвоночного, в частности промотора млекопитающего, и одного бакуловирусного промотора. Области ДНК, содержащие последовательности ДНК двух промоторов, т.е. одного промотора позвоночных, в частности промотора млекопитающих, и одного бакуловирусного промотора, могут быть непосредственно связаны друг с другом или между последовательностями ДНК двух промоторов присутствует промежуточная последовательность ДНК (однако при условии, что два промотора должны обладать промоторной активностью в клетках насекомых и в клетках позвоночных, и в частности, в клетках млекопитающих). Область промотора имеет такую структуру, что любой из промоторов, либо промотор позвоночных, в частности промотор млекопитающих, либо бакуловирусный промотор, связанные друг с другом, может более близко располагаться к экспрессируемому гену. В описанных ниже примерах бакуловирусный промотор располагается более близко к экспрессируемому гену, чем промотор млекопитающих.
В описанной выше структуре последовательность ДНК слитого гена, состоящего из гена, кодирующего белок, который может быть компонентом вирусных частиц, и требуемого иммуногенного чужеродного гена, может быть такой, что два указанных гена непосредственно связаны друг с другом, или между генами присутствует промежуточная последовательность ДНК (однако при условии, что она не вызывает сдвиг рамки расположенного ниже гена и расположенного выше гена). Предпочтительно антигенпрезентирующий домен белка чужеродного гена, обладающего требуемой иммуногенностью, сливают с белком, который может быть компонентом вирусных частиц. Поэтому белок чужеродного гена, обладающий требуемой иммуногенностью, не нужно отщеплять от белка, который может быть компонентом вирусных частиц, а следует использовать в слитой с ним форме.
Слитый ген, содержащий два таких гена, может быть получен заранее и затем включен в вектор. Альтернативно один из генов сначала может быть включен в вектор, а затем другой может быть включен в вектор с образованием слитого гена в векторе.
Чтобы получить такой вектор для переноса можно использовать коммерчески доступные экспрессирующие векторы, уже имеющие некоторые необходимые компоненты вектора для переноса согласно настоящему изобретению, т.е., область промотора, включающую в себя промотор позвоночных, в частности, промотор млекопитающих, и бакуловирусный промотор, и область гена, кодирующего аминокислотную последовательность белка, который может быть компонентом вирусных частиц, и требуемые компоненты могут быть встроены в результате необязательного расщепления такого коммерчески доступного экспрессирующего вектора ферментами рестрикции и введения другого промотора, чтобы встроить слитую последовательность ДНК чужеродного гена, обладающего требуемой иммуногенностью, и гена, кодирующего аминокислотную последовательность белка, который может быть компонентом вирусных частиц, в область клонирования вектора, или в результате встраивания чужеродного гена, обладающего требуемой иммуногенностью, с N-концевой стороны от области ДНК гена, кодирующего аминокислотную последовательность белка, который может быть компонентом вирусных частиц, уже включенного в плазмиду.
В настоящем изобретении плазмидный вектор, имеющий структуру, способную экспрессировать чужеродный белок, обладающий требуемой иммуногенностью, в качестве антигенного белка как в клетках насекомых, так и в клетках позвоночных, в частности в клетках млекопитающих, может быть получен с использованием коммерчески доступной плазмиды, уже имеющей часть его структуры. Может быть встроена промежуточная аминокислотная последовательность пептида для расщепления слитого белка ферментами в клетках позвоночных. В векторе для переноса согласно настоящему изобретению энхансер для увеличения активности транскрипции в клетках позвоночных, в частности в клетках млекопитающих, может быть помещен выше двух промоторов, или последовательность ДНК, кодирующая аминокислотную последовательность сигнального пептида для облегчения внеклеточной секреции экспрессированного белка из клеток-хозяев может быть связана с геном, который сливают и экспрессируют. Для терминации транскрипции область терминатора позвоночных, такая как терминатор β-глобина кролика, которая является эффективной в клетках позвоночных, может быть помещена ниже гена, который сливают и экспрессируют.
Таким образом может быть получен вектор для переноса, способный экспрессировать слитый ген, состоящий из иммуногенного чужеродного гена, способного экспрессировать требуемую иммуногенность в бакуловирусных частицах, и гена, кодирующего аминокислотную последовательность белка, который может быть компонентом вирусных частиц.
Конкретные примеры вектора для переноса и способа его получения согласно настоящему изобретению показаны в описанных ниже примерах. Более конкретно, примерами векторов для переноса, имеющих структуру, в которой промотор CAG, полученный в результате модификации промотора цитомегаловируса (CMV), в качестве промотора позвоночных, в частности промотора млекопитающих, и промотор полиэдрина (polh), промотор vp39 или промотор gp64 в качестве бакуловирусного промотора связаны друг с другом, и встроена слитая последовательность ДНК, состоящая из гена антигена вируса гриппа или гена малярийного антигена в качестве чужеродного гена и гена антигена gp64 в качестве гена, кодирующего аминокислотную последовательность белка, который может быть компонентом вирусной частицы, являются следующие векторы pCAP-PfCSP, pCAP-PfCSP/272, pCAP-PfCSP/467, pCAP-PfCSP(A361E), pCAP-PfCSP(A361E)/272, pCAP-PfCSP(A361E)/467, pCAP-PfCSP-76, pCAP-PfCSP-76/467, pCAP-PfCSP+209, pCAP-PfCSP+209/467, pCAP-PfCSP+76/209, pCAP-PfCSP+76/209/467, pCAP-HA1/Anhui, pCAP-HA1/Anhui/272, pCAP-HA1/Anhui/467, pCAP-HA1/Vietnam, pCAP-HA1/Vietnam/51, pCAP-HA1/Vietnam/101, pCAP-HA1/Vietnam/154, pCAP-HA1/Vietnam/201, pCAP-HA1/Vietnam/272, pCAP-HA1/Vietnam/467, pCAP-AH/345, pCAP-AH/345/467, pCAP-AH/410, pCAP-AH/410/467, pCAP-AH/473, pCAP-AH/473/467, pCAP-AH/520, pCAP-AH/520/467, pCAP-VN/346, pCAP-VN/346/467, pCAP-VN/410, pCAP-VN/410/467, pCAP-VN/473, pCAP-VN/473/467, pCAP-VN/520, pCAP-VN/520/467, pCAP-CO/full, pCAP-CO/full/467, pCAP-CO/19, pCAP-CO/19/467, pCAP-CO/76, pCAP-CO/76/467, pCAP-CO/205, pCAP-CO/205/467, pCA39-HA1/Anhui, pCA64-HA1/Anhui, pCA39-PfCSP(A361E), pCA64-PfCSP(A361E), pCAP-CO/full/VSV, pCAP-CO/19/VSV, pCAP-CO/76/VSV, pCAP-CO/205/VSV, pDual-Pfs25-PfCSP-gp64 и pDual-PfMSP1-PfCSP-gp64.
(2) Получение рекомбинантного бакуловируса
Настоящее изобретение относится к способу получения рекомбинантного бакуловируса, включающему в себя стадию получения вектора для переноса, имеющего структуру, в которой слитый ген, состоящий, по меньшей мере, из одного гена, кодирующего белок, способный быть компонентом вирусной частицы, и по меньшей мере один иммуногенный чужеродный ген, встроен ниже двойного промотора, состоящего из двух связанных промоторов, т.е. одного промотора позвоночных и одного бакуловирусного промотора, и стадию котрансфекции вектора для переноса и бакуловирусной ДНК в клетку-хозяина и выделения рекомбинантного бакуловируса.
В указанном выше способе получения рекомбинантного бакуловируса способ введения требуемой рекомбинантной ДНК (вектора для переноса) в клетку-хозяина и способ трансформации специально не ограничен. Можно использовать различные способы, которые хорошо известны и обычно используются в данной области. Например, можно использовать обычные способы генетической рекомбинации (например, Science, 224, 1431 (1984); Biochem. Biophys. Res. Comm., 130, 692 (1985); Proc. Natl. Acad. Sci. USA, 80, 5990 (1983), чтобы получить рекомбинантный бакуловирус. Рекомбинантная ДНК (вектор для переноса) может быть экспрессирована и получена, как описано в Ohno et al., «Tanpaku Jikken Protocol 1 Functional Analysis, Saibo Kogaku Bessatsu, Jikken Protocol Series, 1997, Shujun-sha». Общие способы, используемые для работы с клетками насекомых, рекомбинации генов и котрансфекции могут быть такими же как хорошо известные способы получения рекомбинантного вируса в клетках насекомых (Baculovirus expression vectors: A laboratory manual, Oxford University Press, 1994).
Полученный рекомбинантный бакуловирус можно культивировать стандартными способами. Слитый продукт (экспрессированный продукт), состоящий из ДНК чужеродного гена, кодирующего требуемую иммуногенность, с ДНК, кодирующей аминокислотную последовательность белка, который может быть компонентом вирусных частиц согласно настоящему изобретению, экспрессируется и продуцируется (накапливается и секретируется) внутри, снаружи или на клеточной мембране клеток насекомых при культивировании бакуловируса.
В качестве среды для культивирования могут быть использованы различные обычно применяемые среды по выбору в соответствии с используемой клеткой-хозяином. Культивирование можно осуществлять в условиях, подходящих для роста клетки-хозяина.
Более конкретно способ получения рекомбинантного бакуловируса включает в себя стадию получения бакуловирусной ДНК, которую необходимо подвергнуть гомологичной рекомбинации с вектором для переноса, получаемым как описано выше, и стадию котрансфекции вектора для переноса и бакуловирусной ДНК в клетки насекомых, такие как клетки Sf9 и клетки Sf21, полученные из Spodoptera frugiperda, и клетки Tn5 (клетки High Five), полученные из Trichoplusia ni, в качестве клеток-хозяев.
Полученная таким образом бакуловирусная ДНК, которую необходимо подвергнуть гомологичной рекомбинации с вектором для переноса, может представлять собой бакуловирусную ДНК дикого типа, мутантную или рекомбинантную бакуловирусную ДНК. Бакуловирусная ДНК может повысить вероятность гомологичной рекомбинации с вектором для переноса согласно настоящему изобретению при условии, что она имеет структуру ДНК, гомологичную полученной из бакуловируса ДНК, содержащей ДНК области двойного промотора, и ДНК слитого гена, полученного слиянием иммуногенного чужеродного гена и гена, кодирующего белок, который может быть компонентом вирусных частиц.
Чтобы индуцировать гомологичную рекомбинацию соотношение в смеси вектора для переноса и бакуловирусной ДНК по массе предпочтительно составляет примерно от 1:1 до 10:1.
После стадии котрансфекции для одновременного введения в клетки насекомых клетки культивируют и получают вирусы из надосадка культуры и затем суспендируют в среде. Вирус элюируют с агара при встряхивании и центрифугируют, получая раствор, содержащий рекомбинантный вирус.
В описанном выше способе можно использовать коммерчески доступные продукты в качестве бакуловирусной ДНК. Например, можно использовать ДНК BacVector-1000 и ДНК BacVector-2000 (поставляемые Novagen), в которых ген полиэдрина был удален из AcNPV.
Котрансфекция для гомологичной рекомбинации полученного вектора для переноса и бакуловирусной ДНК в клетки насекомых может быть осуществлена с использованием коммерчески доступного набора для трансфекции векторов (наборы для трансфекции BacVector, поставляемые Novagen) как описано выше в соответствии с инструкциями, прилагаемыми к набору для трансфекции векторов. Таким образом, полученный вектор для переноса можно котрансфицировать вместе с бакуловирусной ДНК в клетки насекомых, такие как клетки Sf9, чтобы получить рекомбинантный бакуловирус.
В настоящем изобретении согласно описанному выше способу получения рекомбинантного бакуловируса вектор для переноса, который представляет собой любой из векторов pCAP-PfCSP, pCAP-PfCSP/272, pCAP-PfCSP/467, pCAP-PfCSP(A361E), pCAP-PfCSP(A361E)/272, pCAP-PfCSP(A361E)/467, pCAP-PfCSP-76, pCAP-PfCSP-76/467, pCAP-PfCSP+209, pCAP-PfCSP+209/467, pCAP-PfCSP+76/209, pCAP-PfCSP+76/209/467, pCAP-HA1/Anhui, pCAP-HA1/Anhui/272, pCAP-HA1/Anhui/467, pCAP-HA1/Vietnam, pCAP-HA1/Vietnam/51, pCAP-HA1/Vietnam/101, pCAP-HA1/Vietnam/154, pCAP-HA1/Vietnam/201, pCAP-HA1/Vietnam/272, pCAP-HA1/Vietnam/467, pCAP-AH/345, pCAP-AH/345/467, pCAP-AH/410, pCAP-AH/410/467, pCAP-AH/473, pCAP-AH/473/467, pCAP-AH/520, pCAP-AH/520/467, pCAP-VN/346, pCAP-VN/346/467, pCAP-VN/410, pCAP-VN/410/467, pCAP-VN/473, pCAP-VN/473/467, pCAP-VN/520, pCAP-VN/520/467, pCAP-CO/full, pCAP-CO/full/467, pCAP-CO/19, pCAP-CO/19/467, pCAP-CO/76, pCAP-CO/76/467, pCAP-CO/205, pCAP-CO/205/467, pCA39-HA1/Anhui, pCA64-HA1/Anhui, pCA39-PfCSP(A361E), pCA64-PfCSP(A361E), pCAP-CO/full/VSV, pCAP-CO/19/VSV, pCAP-CO/76/VSV, pCAP-CO/205/VSV, pDual-Pfs25-PfCSP-gp64 и pDual-PfMSP1-PfCSP-gp64, и бакуловирусная ДНК могут быть котрансфицированы в клетки насекомых Sf9 с получением любого из рекомбинантных бакуловирусов AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-HA1/Anhui, AcNPV-CA64-HA1/Anhui, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64.
Кроме описанного выше способа получения рекомбинантного бакуловируса другие способы получения рекомбинантного бакуловируса включают, например, способ, основанный на использовании транспозона в виде фагмиды (бакмиды), содержащей включенный в нее полный геном бакуловируса, чтобы эффективно встроить чужеродный ген в Escherichia coli.
Согласно указанному способу бакмиду, несущую вирусный ген, экстрагируют из бактериальных клеток и трансфицируют в клетки насекомых, таким образом легко получая и собирая рекомбинантный бакуловирус.
Очистка рекомбинантного бакуловируса согласно настоящему изобретению, полученного описанным выше способом получения рекомбинантного бакуловируса, может быть осуществлена с использованием известных способов очистки вирусов.
Для очистки рекомбинантного бакуловируса, например, от 0,5 до 1,0 мл исходной культуры вируса, полученного описанным выше способом получения рекомбинантного бакуловируса, инокулируют в клетки насекомых (1×107 клеток/чашку диаметром 10 см), такие как клетки Sf9, надосадок культуры собирают через несколько дней после инфекции и осадок вирусов, полученный центрифугированием, суспендируют в буфере, таком как PBS. Полученную суспензию наносят на градиент сахарозы от 10 до 60% и затем центрифугируют (25000 об./мин, 60 минут, 4°C) и собирают полосу, соответствующую вирусу. Затем собранные вирусы суспендируют в PBS, затем центрифугируют (в таких же условиях, как описано выше), и полученный осадок очищенных рекомбинантных вирусов хранят при 4°C в буфере, таком как PBS.
Титр инфекционности полученного очищенного рекомбинантного вируса, описанного выше, можно измерить в анализе бляшек (Baculovirus expression vectors: A laboratory manual, Oxford University Press, 1994), используя клетки насекомых, такие как клетки Sf9.
В рекомбинантных вирусах, описанных в примерах, N-конец бакуловирусного белка gp64 находится с внешней стороны частицы, тогда как его C-конец находится внутри частицы. Поэтому если белок, кодируемый чужеродным геном, обладающим требуемой иммуногенностью, слит с N-концом gp64, то он экспонируется в виде компонента вирусной частицы снаружи вирусной белковой частицы в клетках насекомых, и следовательно антиген более доступно презентирован, что подходит для применения в качестве вакцинного препарата согласно настоящему изобретению.
(3) Фармацевтическая композиция согласно настоящему изобретению (фармацевтический препарат, содержащий рекомбинантный бакуловирус согласно настоящему изобретению в качестве активного ингредиента)
Рекомбинантный бакуловирус согласно настоящему изобретению, который является активным ингредиентом фармацевтической композиции согласно настоящему изобретению, может быть получен способами генетической инженерии, указанными выше в пункте (2).
Фармацевтическая композиция согласно настоящему изобретению в основном содержит в качестве активного ингредиента рекомбинантный бакуловирус, полученный в результате гомологичной рекомбинации бакуловирусной ДНК и вектора для переноса, сконструированного так, что слитый ген, полученный в результате слияния иммуногенного чужеродного гена согласно настоящему изобретению с геном, кодирующим аминокислотную последовательность белка, который может быть компонентом вирусной частицы, может быть экспрессирован в клетках насекомых и клетках позвоночных, в частности, в клетках млекопитающих, включая человека.
Настоящее изобретение в частности относится к фармацевтической композиции, содержащей в качестве активного ингредиента специальный рекомбинантный бакуловирус, который представляет собой любой из бакуловирусов AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-HA1/Anhui, AcNPV-CA64-HA1/Anhui, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64.
Рекомбинантный бакуловирус согласно настоящему изобретению, который представляет собой любой из бакуловирусов AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-HA1/Anhui, AcNPV-CA64-HA1/Anhui, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64, используемый в качестве активного ингредиента фармацевтической композиции согласно настоящему изобретению, оказывает действие, усиливающее эффекты предотвращения инфекции, направленные против инфекционного антигена, и уменьшающее титр инфекционности. Благодаря использованию такого действия и активности рекомбинантный бакуловирус можно применять для лечения болезней, ассоциированных с инфекцией клеток-мишеней и тканей. Примеры клеток-мишеней, поражаемых такой инфекцией, включают клетки крови, клетки печени, клетки почек, клетки головного мозга, клетки легких, эпителиальные клетки и мышечные клетки. Примеры тканей, содержащих такие клетки, включают легкие, печень, почки, головной мозг, артерии и вены, желудок, кишечник, уретру, кожу и мышцы.
Фармацевтическая композиция усиливает эффекты предотвращения инфекции, направленные против инфекционных антигенов, например, малярийных антигенов, таких как поверхностные антигены спорозоита (CSP и TRAP) малярийных паразитов, белок поверхностной мембраны мерозоита MSP1, малярийный S-антиген, секретируемый из эритроцитов, инфицированных малярийным паразитом, белок PfEMP1, присутствующий в выростах эритроцитов, инфицированных возбудителем малярии, белок SERA, белок TRAMP, белок AMA1 и Pfs25, известный как антиген, блокирующий трансмиссию; и антигенов гриппа, таких как антиген HA, антиген NA, антиген M2 и антиген NP, и уменьшает титр инфекционности (например, титр инфекционности вируса), таким образом увеличивая период жизнеспособности и коэффициент выживаемости млекопитающих, включая человека, по сравнению с группой, в которой не вводили фармацевтическую композицию согласно настоящему изобретению. Следовательно, фармацевтическая композиция особенно применима в качестве профилактического или терапевтического средства против малярии и инфекции вирусом гриппа.
Фармацевтическая композиция согласно изобретению обладает действием, усиливающим эффекты предотвращения инфекции, направленные против инфекционных антигенов, и уменьшающие титры инфекционности, и поэтому применима в качестве профилактического или терапевтического средства для лечения инфекционных болезней, вызванных такими патогенами, как вирусы гриппа и малярия, и их осложнений.
При использовании гена, который является иммуногенным по отношению к позвоночным, отличным от человека, в качестве иммуногенного чужеродного гена в векторе для переноса, чтобы получить рекомбинантный бакуловирус, используемый в качестве активного ингредиента фармацевтической композиции согласно настоящему изобретению, может быть получена, например, вакцина против гриппа кур, которая обладает действием, усиливающим эффекты предотвращения инфекции, направленные против инфекционного антигена, и уменьшающим титр инфекционности. Благодаря использованию такого действия и активности фармацевтическую композицию можно применять для лечения болезней, ассоциированных с инфекцией клеток-мишеней и тканей.
Фармацевтическая композиция согласно настоящему изобретению может быть получена в виде композиции, содержащей фармацевтически эффективное количество рекомбинантного бакуловируса согласно изобретению и фармацевтически приемлемый носитель.
Эффект предотвращения инфекции, которым обладает рекомбинантный бакуловирус согласно настоящему изобретению, у позвоночных, в частности у млекопитающих, включая человека, или в клетках млекопитающих может быть получен, например, в результате введения фармацевтической композиции, содержащей рекомбинантный бакуловирус согласно настоящему изобретению и добавки, используемые для фармацевтического введения позвоночным, в частности млекопитающим, включая человека, внутримышечным, подкожным, внутрикожным, внутрибрюшинным, назальным или респираторным путем, и затем иммунизации позвоночных фармацевтической композицией, содержащей рекомбинантный бакуловирус согласно настоящему изобретению в качестве активного ингредиента, несколько раз. Респираторное введение фармацевтической композиции согласно изобретению является особенно предпочтительным.
Эффект предотвращения инфекции можно оценить посредством сравнения коэффициента выживаемости позвоночных, в частности млекопитающих, включая человека, которые были иммунизированы фармацевтической композицией согласно изобретению несколько раз и затем инфицированы патогеном-мишенью, с коэффициентом выживаемости позвоночных, которым не вводили фармацевтическую композицию.
(4) Вакцина согласно настоящему изобретению
Рекомбинантный бакуловирус, который представляет собой любой из бакуловирусов AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-HA1/Anhui, AcNPV-CA64-HA1/Anhui, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64, используемый в качестве активного ингредиента фармацевтической композиции согласно настоящему изобретению, может усиливать эффекты предотвращения инфекции патогеном, как описано в примерах ниже, и экспрессированный слитый продукт последовательности ДНК, полученной слиянием гена, кодирующего аминокислотную последовательность белка, который может быть компонентом вирусных частиц, и чужеродного гена с требуемой иммуногенностью согласно настоящему изобретению, способный уменьшать титр инфекционности, получают в виде вирусных частиц после баддинга (отделения) от клеток насекомых. Когда фармацевтическую композицию согласно изобретению вводят в форме вирусных частиц позвоночным, в частности млекопитающим, включая человека, чужеродный антигенный белок, являющийся компонентом вирусных частиц, стимулирует искусственный иммунитет (гуморальный иммунитет и клеточный иммунитет), и кроме того, антигенный белок в виде экспрессированного продукта слитой последовательности ДНК, по-видимому, стимулирует искусственный иммунитет (гуморальный иммунитет и клеточный иммунитет) в клетках позвоночных, в частности в клетках млекопитающих, включая человека. Таким образом, рекомбинантный бакуловирус согласно настоящему изобретению применим в качестве вакцины.
Настоящее изобретение, в частности, относится к вакцине, содержащей в качестве активного ингредиента специальный рекомбинантный бакуловирус, который представляет собой любой из бакуловирусов AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-HA1/Anhui, AcNPV-CA64-HA1/Anhui, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64.
Как и фармацевтическая композиция, описанная выше в пункте (3), вакцина усиливает эффекты предотвращения инфекции, направленные против инфекционных антигенов, например, малярийных антигенов, таких как поверхностные антигены спорозоита (CSP и TRAP) малярийного паразита, белок поверхностной мембраны мерозоита MSP1, малярийный S-антиген, секретируемый из эритроцитов, инфицированных малярийным паразитом, белок PfEMP1, присутствующий в выростах эритроцитов, инфицированных возбудителем малярии, белок SERA, белок TRAMP и белок AMA1; и антигенов гриппа, таких как антиген вируса гриппа HA, антиген вируса гриппа NA, антиген вируса гриппа M2 и антиген вируса гриппа NP; вакцина также уменьшает титр инфекционности (например, титр инфекционности вируса), таким образом увеличивая период жизнеспособности и коэффициент выживаемости млекопитающих, включая человека, по сравнению с группой, в которой не вводили фармацевтическую композицию согласно настоящему изобретению. Следовательно, вакцина особенно применима в качестве профилактического или терапевтического средства против малярии и инфекции вирусом гриппа.
Вакцина согласно изобретению усиливает эффекты предотвращения инфекции, направленные против инфекционных антигенов, и уменьшает титр инфекционности, и поэтому применима в качестве профилактического или терапевтического средства для лечения инфекционных болезней, вызванных патогенами, такими как вирусы гриппа и малярия, и их осложнений.
При использовании гена, который является иммуногенным по отношению к позвоночным, отличным от человека, в качестве иммуногенного чужеродного гена в векторе для переноса, чтобы получить рекомбинантный бакуловирус, используемый в качестве активного ингредиента фармацевтической композиции согласно настоящему изобретению, может быть получена, например, вакцина против гриппа кур, которая может усиливать эффекты предотвращения инфекции, направленные против инфекционного антигена, и уменьшать титр инфекционности. Благодаря использованию такой активности вакцину можно применять для лечения болезней, ассоциированных с инфекцией клеток-мишеней и тканей.
Рекомбинантный бакуловирус, который представляет собой любой из бакуловирусов AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-HA1/Anhui, AcNPV-CA64-HA1/Anhui, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64, используемый в качестве активного ингредиента вакцины согласно настоящему изобретению, может усиливать эффекты предотвращения инфекции, направленные против инфекционного антигена, и уменьшать титр инфекционности. Благодаря использованию такой активности рекомбинантный бакуловирус можно применять для лечения болезней, ассоциированных с инфекцией клеток-мишеней и тканей.
Примеры клеток-мишеней, поражаемых такой инфекцией, включают клетки крови, клетки печени, клетки почек, клетки головного мозга, клетки легких, эпителиальные клетки и мышечные клетки. Примеры тканей, содержащих такие клетки, включают легкие, печень, почки, головной мозг, артерии и вены, желудок, кишечник, уретру, кожу и мышцы.
Вакцина согласно настоящему изобретению может быть получена в виде фармацевтической композиции, описанной выше в пункте (3), содержащей фармацевтически эффективное количество рекомбинантного бакуловируса согласно изобретению (любого из бакуловирусов AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520,AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-HA1/Anhui, AcNPV-CA64-HA1/Anhui, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64) и фармацевтически приемлемый носитель.
Вакцина может быть получена в форме фармацевтической композиции с использованием фармацевтически приемлемого носителя, который применяют в фармацевтической композиции, описанной выше в пункте (3), согласно стандартному способу. Примерами носителей являются физиологически приемлемые растворы, такие как физиологический раствор соли и стерильный забуференный раствор соли.
Вакцина («препарат» далее означает тоже самое, что и в случае фармацевтической композиции) может быть получена в виде липосомного препарата, содержащего в качестве активного ингредиента рекомбинантный бакуловирус согласно изобретению (любой из бакуловирусов AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-HA1/Anhui, AcNPV-CA64-HA1/Anhui, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64) и может быть использована в сочетании с адъювантом.
Конкретными примерами вакцины (фармацевтической композиции) согласно настоящему изобретению являются липосомные препараты. Липосомный препарат может представлять собой препарат, в котором рекомбинантный бакуловирус согласно настоящему изобретению находится в липосоме, содержащей кислый фосфолипид в качестве мембранного компонента или содержащей нейтральный фосфолипид и кислый фосфолипид в качестве мембранных компонентов.
Кислый фосфолипид и нейтральный фосфолипид, используемые в качестве мембранных компонентов, особым образом не ограничены, и можно использовать различные липиды, обычно применяемые для липосомных препаратов, отдельно или в сочетании двух или более фосфолипидов.
Мембрану липосом получают стандартным способом, используя кислый фосфолипид отдельно или вместе с нейтральным фосфолипидом. Когда кислый фосфолипид используют вместе с нейтральным фосфолипидом, доля кислых фосфолипидов среди компонентов мембраны липосом предпочтительно составляет примерно от 0,1 до 100% моль, более предпочтительно от 1 до 90% моль и еще более предпочтительно примерно от 10 до 50% моль.
Чтобы получить липосому можно добавить, например, холестерин или тому подобное. Таким образом, можно регулировать текучесть фосфолипидов и облегчить получение липосом. В общем, холестерин предпочтительно добавляют в эквивалентном количестве или меньше, и предпочтительно от 0,5-кратного количества до эквивалентного количества по массе по отношению к фосфолипиду.
В липосомном препарате отношение в смеси кислого фосфолипида к активному ингредиенту составляет примерно от 0,5 до 100 эквивалентов, предпочтительно примерно от 1 до 60 эквивалентов и более предпочтительно примерно от 1,5 до примерно 20 эквивалентов.
Рекомбинантный бакуловирус согласно настоящему изобретению в качестве активного ингредиента используют в количестве от нескольких % моль до нескольких десятков % моль, предпочтительно примерно от 5 до примерно 10% моль, и обычно около 5% моль, в расчете на общее количество липидов.
Контроль получения, концентрации и диаметра частиц препарата липосом можно осуществлять стандартными способами. При необходимости в липосомный препарат также можно включать различные добавки, которые описаны выше.
Чтобы получить липосомный препарат, рекомбинантный бакуловирус согласно изобретению в качестве активного ингредиента может быть использован в форме, связанной с жирной кислотой (например, бегеновой кислотой, стеариновой кислотой, пальмитиновой кислотой, миристиновой кислотой и олеиновой кислотой), алкильной группой, группой холестерила или тому подобной. Липосомный препарат, содержащий такие связанные компоненты, также может быть получен стандартным способом (смотри, например, Long Circulating Liposomes: Old Drugs, New Therapeutics., M. C. Woodle, G. Storm, Eds: Springer-Verlag Berlin (1998)).
Вакцина (фармацевтическая композиция) согласно настоящему изобретению предпочтительно может быть использована в виде вакцинной композиции. Вакцину предпочтительно используют в сочетании с фармацевтически эффективным количеством адъюванта, чтобы усилить противоинфекционное (противомалярийное или противогриппозное) действие.
В качестве адъюванта можно использовать любой адъювант, обычно используемый для такого типа вакцины. Примерами таких адъювантов являются полный адъювант Фрейнда, мурамилдипептид, гидроксид алюминия, BCG, IL-12, N-ацетилмурамин-L-аланил-D-изоглутамин (MDP), тимозин α1 и QS-21. Количество используемого адъюванта может быть соответственно выбрано в зависимости от степени проявления симптомов, таких как размягчение кожи, боль, эритема, повышенная температура, головная боль и мышечная боль, которые могут проявляться как часть иммунного ответа у человека или животных после введения вакцины такого типа.
Вакцину (фармацевтическую композицию) согласно настоящему изобретению можно использовать в сочетании с другими общеизвестными фармацевтическими продуктами, такими как пептиды, стимулирующие иммунный ответ, и антибактериальные средства (синтетические антибактериальные средства).
Вакцина (фармацевтическая композиция) может дополнительно содержать другие лекарственные средства и добавки. Примерами являются лекарственные средства, которые способствуют захвату рекомбинантного бакуловируса согласно настоящему изобретению внутрь клетки, такие как ионы кальция. Также можно использовать липосому и другие лекарственные средства и добавки, которые облегчают трансфекцию, такие как фторуглеродные эмульгаторы, спиралевидные липидные системы (кохлеаты), трубочки, частицы золота, биоразрушаемые микросферы и катионные полимеры.
Количество активного ингредиента, входящего в состав вакцины (фармацевтической композиции) (лекарственного средства) согласно настоящему изобретению особым образом не ограничено и может быть выбрано из широкого диапазона, при условии, что такое количество является фармацевтически эффективным количеством. Доза вакцины (фармацевтической композиции) особым образом не ограничена и может быть соответствующим образом выбрана из широкого диапазона в соответствии с требуемым терапевтическим эффектом, способом введения (путем введения), продолжительностью терапии, возрастом пациента, полом и другими условиями, и т.д.
Когда рекомбинантный бакуловирус в качестве активного ингредиента вакцины (фармацевтической композиции) согласно настоящему изобретению вводят человеку, рекомбинантный бакуловирус вводят в количестве, соответствующем 102-1014 БОЕ, предпочтительно от 105 до 1012 БОЕ и более предпочтительно от 106 до 1010 БОЕ на пациента, при расчете в виде БОЕ рекомбинантного вируса.
Доза рекомбинантного бакуловируса (любого из бакуловирусов AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-HA1/Anhui, AcNPV-CA64-HA1/Anhui, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64), используемого в качестве активного ингредиента вакцины (фармацевтической композиции) согласно настоящему изобретению, может быть выбрана из широкого диапазона в единицах количества экспрессируемой ДНК, вводимой хозяину, или количества транскрибируемой РНК. Такие количества также зависят от силы промоторов транскрипции и трансляции, используемых в векторах для переноса согласно изобретению.
Вакцину (фармацевтическую композиция) согласно настоящему изобретению вводят с помощью прямой инъекции суспензии рекомбинантных бакуловирусов, полученной в результате суспендирования рекомбинантных бакуловирусов в PBS (фосфатно-солевом буфере) или физиологическом растворе, в локальное место (например в ткань легкого, печень, мышцу или головной мозг), или посредством назальной или респираторной ингаляции или посредством внутрисосудистого (например, внутриартериального, внутривенного введения и введения в воротную вену), подкожного, внутрикожного или внутрибрюшинного введения. Вакцину согласно изобретению предпочтительно вводят с помощью респираторной ингаляции.
Вакцину (фармацевтическую композицию) согласно настоящему изобретению предпочтительно вводят более одного раза. Более конкретно, после начального введения предпочтительно осуществляют дополнительные вакцинации от одного до нескольких раз, наблюдая при этом за состоянием. Это может усилить требуемый эффект. После введения вакцины (фармацевтической композиции) может быть осуществлена бустер-иммунизация фармацевтической композицией, содержащей рекомбинантный бакуловирус согласно настоящему изобретению (любой из бакуловирусов AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-HA1/Anhui, AcNPV-CA64-HA1/Anhui, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64). Кроме того, использование различных других лекарственных средств вместе с вакциной согласно изобретению, как указано выше, может усиливать терапевтический эффект, достигаемый при введении вакцины (фармацевтической композиции).
В одном варианте вакцины (фармацевтической композиции) согласно настоящему изобретению, рекомбинантный бакуловирус, используемый в качестве одного из активных ингредиентов вакцины (фармацевтической композиции) согласно изобретению, обычно получают в результате гомологичной рекомбинации бакуловирусной ДНК и вектора для переноса, в который был введен слитый ген, полученный слиянием чужеродного гена, обладающего требуемой иммуногенностью, и гена, кодирующего белок, который может быть компонентом вирусных частиц. Рекомбинантный бакуловирус смешивают в инъецированной дозированной форме (раствор, суспензия или эмульсия) с фармацевтически приемлемым носителем (т.е., нетоксичным для человека и других позвоночных в используемой дозе и концентрации и совместимым с другими ингредиентами в препарате), получая препарат. Предпочтительно полученный таким образом препарат не содержит окислителей или любого другого соединения, которые, как известно, являются опасными для рекомбинантного бакуловируса.
Носитель может содержать следовые количества добавок, таких как вещества, которые обеспечивают изотоничность и повышают химическую стабильность. Такие добавки являются нетоксичными для млекопитающих, включая человека, в применяемой дозе и концентрации, и примерами добавок являются буферы, такие как фосфорная кислота, лимонная кислота, янтарная кислота, уксусная кислота и другие органические кислоты и их соли; антиоксиданты, такие как аскорбиновая кислота; полипептиды с низкой молекулярной массой (например, менее чем примерно 10 остатков) (например, полиаргинин и трипептид) белки (например, сывороточный альбумин, желатин и иммуноглобулин); аминокислоты (например, глицин, глутаминовая кислота, аспарагиновая кислота и аргинин); моносахариды, дисахариды и другие углеводы (например, целлюлоза и ее производные, глюкоза, манноза и декстрин), хелатирующие агенты (например, EDTA); сахарные спирты (например, маннит и сорбит); противоионы (например, натрий); неионогенные поверхностно-активные вещества (например, полисорбат и полоксамер); и ПЭГ.
Фармацевтическую вакцину (композицию), содержащую рекомбинантный бакуловирус обычно можно хранить в виде водного раствора или лиофилизованного продукта в емкости для одной единичной дозы или множества доз, такой как запаянная ампула или флакон.
Настоящее изобретение, кроме того, относится к способу профилактики малярийной инфекции или инфекции гриппа или к способу лечения малярии или гриппа, включающему в себя введение субъекту эффективного количества рекомбинантного бакуловируса, вакцины, препарата и фармацевтической композиции согласно изобретению. Настоящее изобретение, кроме того, относится к способу иммуностимуляции, включающему в себя введение субъекту эффективного количества рекомбинантного бакуловируса, вакцины, препарата и фармацевтической композиции согласно изобретению. Примерами субъектов являются такие субъекты, которые могут быть инфицированы малярийными паразитами или вирусами гриппа, такие как человек и другие животные (такие как млекопитающие, птицы, рептилии, рыбы и земноводные), и субъекты, инфицированные малярийными паразитами или вирусами гриппа. Вирусом гриппа, которым инфицирован субъект, предпочтительно является вирус гриппа A и более предпочтительно вирус гриппа A подтипа H1, или вирус гриппа A подтипа H3. Примерами малярийных паразитов являются Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae и Plasmodium ovale.
Рекомбинантный бакуловирус согласно настоящему изобретению отдельно или вместе с фармацевтически приемлемым носителем готовят в виде вакцины, препарата или фармацевтической композиции и вводят субъекту.
Путь введения может представлять собой, например, любой путь введения, указанный выше. Фармацевтически приемлемый носитель для применения в настоящем изобретении может быть соответствующим образом выбран из носителей, обычно используемых в данной области техники, в соответствии с формой получаемой фармацевтической композиции.
Например, когда фармакологическую композицию получают в водном растворе, в качестве носителя можно использовать очищенную воду (стерильную воду) или физиологический буферный раствор. Когда фармацевтическую композицию получают в виде других подходящих растворов, в качестве носителя можно использовать сложные органические эфиры, которые могут быть инъецированы, такие как гликоль, глицерин и оливковое масло. Композиция может содержать стабилизаторы, эксципиенты и тому подобные компоненты, обычно используемые в данной области техники, и в частности, в области приготовления вакцин.
Количество рекомбинантного бакуловируса в вакцине, препарате или фармацевтической композиции согласно настоящему изобретению особым образом не ограничено и может быть соответствующим образом выбрано из широкого диапазона. В общем, количество рекомбинантного бакуловируса в композиции предпочтительно составляет примерно от 0,0002 до примерно 0,2 (% масс./об.) и более предпочтительно от 0,001 до 0,1 (% масс./об.). Способ введения рекомбинантного бакуловируса, вакцины, препарата или фармацевтической композиции согласно изобретению особым образом не ограничен и может быть соответствующим образом выбран в зависимости от формы дозирования, возраста, пола и состояния пациента, тяжести заболевания и т.д. Предпочтительной дозированной формой является форма для парентерального введении, такая как инъекции, капли, назальные капли и средства для ингаляции. Когда композицию готовят в виде инъекционного препарата или капель, инъекционный препарат можно вводить внутривенно в смеси с замещающей жидкостью, такой как раствор глюкозы или раствор аминокислот, которая необходима, или можно вводить внутримышечно, внутрикожно, подкожно или внутрибрюшинно.
Суточная доза рекомбинантного бакуловируса, вакцины, препарата или фармацевтической композиции согласно настоящему изобретению может варьировать в зависимости от состояния субъекта, массы тела, возраста, пола и т.д., и поэтому не может быть точно указана. Однако обычно доза такова, чтобы обеспечить введение рекомбинантного бакуловируса в количестве от 0,001 до 100 мг на кг массы тела в сутки. Вакцину, препарат или композицию согласно изобретению можно вводить один раз в сутки или несколько раз в сутки.
Когда рекомбинантный бакуловирус вводят в качестве активного ингредиента вакцины (препарата или фармацевтической композиции) согласно настоящему изобретению, рекомбинантный бакуловирус вводят в количестве, соответствующем 102-1014 БОЕ, предпочтительно 105-1012 БОЕ и более предпочтительно 106-1010 БОЕ на пациента в единицах БОЕ рекомбинантного вируса.
Вакцину (композицию) согласно настоящему изобретению вводят согласно надлежащей медицинской практике, учитывая клиническое состояние (например, состояние, подвергаемое профилактике или лечению) каждого пациента, место доставки вакцины (композиции), содержащей рекомбинантный бакуловирус, ткань-мишень, способ введения, схему дозирования и другие факторы, общеизвестные специалистам в данной области. Поэтому, точную дозу вакцины (композиции) в данном случае определяют, учитывая указанные выше факторы.
ПРИМЕРЫ
Настоящее изобретение будет описано ниже более подробно со ссылкой на примеры. Приведенные примеры являются только иллюстрациями настоящего изобретения и не ограничивают настоящее изобретение.
Пример 1: Плазмидный вектор для переноса и способ его получения согласно настоящему изобретению
(1) Конструирование плазмидных векторов для переноса pCAP-PfCSP, pCAP-PfCSP/272 и pCAP-PfCSP/467 согласно настоящему изобретению
(1.1) Конструирование плазмиды pBACsurf-Hsp65
Ген Hsp65 получали посредством экстракции геномной ДНК из штамма M. tuberculosis H37Rv с использованием набора QIAamp DNA Midi (Qiagen) и клонирования с помощью ПЦР. Более конкретно, геномную ДНК, экстрагированную из штамма M. tuberculosis H37Rv, амплифицировали в ПЦР, используя праймеры phsp65-F1 (5'-AATAATAGATCTAATGGCCAAGACAATTGCGTACGACGAAGA-3' (SEQ ID NO: 1); сайт BglII подчеркнут) и phsp65-R1 (5'-AATCCAATGCGGCCGCGGGAATTCGATTCCTGCAGGTCAGAAATCCATGCCACCCATGTCGCC-3' (SEQ ID NO: 2); сайт NotI подчеркнут). Продукт ПЦР очищали, расщепляли ферментами рестрикции BglII и NotI, лигировали в pcDNA3.1(+) (Invitrogen), расщепленную BamHI и NotI. Полученная плазмида названа pcDNA-hsp65. ПЦР осуществляли, используя pcDNA-hsp65 в качестве матрицы и используя праймеры phsp65-F2 (5'-CACCCCTGCAGGACTACAAGGACGACGATGACAAGGAATTCATGGCCAAGACAATTGCGTACGACGAAGAGGCC-3' (SEQ ID NO: 3); сайты Sse8387I и EcoRI подчеркнуты, и последовательность FLAG показана курсивом), и phsp65-R2 (5'-CCCGGGCGAAATCCATGCCACCCATGTCGCCGCCACC-3' (SEQ ID NO: 4); сайт Cfr9I подчеркнут). Полученный фрагмент ДНК гена Hsp65 клонировали в pENTR/D-TOPO (из Invitrogen), затем расщепляли Sse8387I/Cfr9I и встраивали в PstI/Cfr9I-сайт pBACsurf-CSP (Yoshida et al., Virology 316: 161-70, 2003). Сконструированная таким образом плазмида названа pBACsurf-Hsp65.
(1.2) Конструирование плазмиды pENTR-gp64
ПЦР осуществляли, используя pBACsurf-1 (из Novagen) в качестве матрицы и используя праймеры pPolh-F2 (5'-CACCCGGACCGGATAATTAAAATGATAACCATCTCGCAAATAAATAAG-3' (SEQ ID NO: 5); сайт RsrII подчеркнут), и pgp64-R2 (5'-GGTACCATATTGTCTATTACGGTTTCTAATCATAC-3' (SEQ ID NO: 6); сайт KpnI подчеркнут). Полученный фрагмент ДНК гена gp64 встраивали в pENTR/D-TOPO, получая плазмиду pENTR-gp64. Сконструированная таким образом плазмида названа pENTR-gp64.
(1.3) Конструирование вектора для переноса pDual-Hsp65-gp64 согласно настоящему изобретению
pBACsurf-Hsp65 расщепляли PstI/Cfr9I и фрагмент ДНК гена hsp65 встраивали в PstI/Cfr9I-сайт pENTR-gp64, получая плазмиду pENTR-Hsp65-gp64. pENTR-Hsp65-gp64 расщепляли RsrII/KpnI и фрагмент ДНК, состоящий из промотора полиэдрина и гена hsp65-gp64, встраивали в pTriEx-3.1 (Novagen), расщепленный RsrII и KpnI, получая плазмидный вектор для переноса pDual-Hsp65-gp64, способный экспрессировать слитый белок, состоящий из антигена Hsp65 и белка gp64, в клетках млекопитающих и насекомых под контролем требуемого двойного промотора, состоящего из промотора CMA промотор и промотора полиэдрина.
(1.4) Конструирование вектора для переноса pDual-H1N1/HA1-gp64 согласно настоящему изобретению
РНК экстрагировали из надосадка культуры клеток MDCK, инфицированных штаммом вируса гриппа PR/8/34, используя набор QIAamp MinElute Virus Spin (из Qiagen), и амплифицировали в ОТ-ПЦР, используя праймеры HA-f (5'-CCTGCAGGTATGAAGGCAAACCTACTGGTC-3' (SEQ ID NO: 7); сайт SbfI подчеркнут) и HA-r (5'-GCCCGGGCGATGCATATTCTGCA-3' (SEQ ID NO: 8); сайт SbfI подчеркнут). Полученный фрагмент гена HA вируса гриппа клонировали в pCR-Blunt II-TOPO (из Invitrogen). Полученная плазмида названа pCR-Blunt-HA. ПЦР осуществляли, используя pCR-Blunt-HA в качестве матрицы и используя праймеры pHA-F1 (5'-CACCGAATTCGACACAATATGTATAGGCTACCATGCG-3' (SEQ ID NO: 9); сайт EcoRI подчеркнут) и pHA-R1 (5'-CCCGGGCACCTCTGGATTGGATGGACGGAATG-3' (SEQ ID NO: 10); сайт Cfr9I подчеркнут). Полученный фрагмент ДНК гена H1N1/HA1 клонировали в pENTR/D-TOPO, затем расщепляли EcoRI/Cfr9I и встраивали в EcoRI/Cfr9I-сайт pDual-Hsp65-gp64, конструируя таким образом плазмиду pDual-H1N1/HA1-gp64.
(1.5) Конструирование плазмиды pBACsurf-HA1
pDual-H1N1/HA1-gp64 расщепляли EcoRI/CfrI и Фрагмент ДНК гена H1N1/HA1 встраивали в pBACsurf-Hsp65, расщепленный EcoRI и CfrI, конструируя таким образом плазмиду pBACsurf-HA1.
(1.6) Конструирование плазмиды pCP-H1N1/HA1-gp64
ПЦР осуществляли, используя pBACsurf-HA1 в качестве матрицы и используя Polh-f RsrII (5'-GGGCGGACCGGATAATTAAAATGATAACCATCTCG -3' (SEQ ID NO: 11); сайт RsrII подчеркнут) и GP64-r DraIII (5'- GGGCACTTAGTGATATTGTCTATTACGGTTTCTAATC-3' (SEQ ID NO: 12); сайт DraIII подчеркнут). Полученный фрагмент ДНК встраивали в pDual-H1N1/HA1-gp64, расщепленный RsrII и DraIII, получая pCP-H1N1/HA1-gp64.
(1.7) Конструирование плазмиды pCAP-H1N1/HA1-gp64
pCP-H1N1/HA1-gp64 расщепляли ферментами рестрикции RsrII и DraIII, получая фрагменты гена HA1 и gp64. Фрагменты встраивали в вектор, полученный расщеплением pTriEx-1.1 (из Novagen) ферментами рестрикции RsrII и DraIII, получая плазмидный вектор для переноса pCAP-H1N1/HA1-gp64, способный экспрессировать слитый белок, состоящий из антигена HA1 и белка gp64, в клетках млекопитающих и насекомых под контролем требуемого двойного промотора, состоящего из промотора CAG и промотора полиэдрина.
(1.8) Конструирование плазмиды pCAP-H1N1/NP-gp64
ОТ-ПЦР осуществляли, используя геномную РНК вируса гриппа штамма PR/8/34 в качестве матрицы и используя NP-f EcoRI (5'-ACGGAATTCCATTCAATTCAAACTGGA-3' (SEQ ID NO: 13); сайт EcoRI подчеркнут) и NP-r Cfr9I (5'-GATCCCGGGCCTTGTCAATGCTGAATGGCAA-3' (SEQ ID NO: 14); сайт Cfr9I подчеркнут). Полученные фрагменты расщепляли ферментами рестрикции EcoRI и Cfr9I и встраивали в pCAP-H1N1/HA1-gp64, расщепленный ферментами рестрикции EcoRI и Cfr9I, получая pCAP-H1N1/NP-gp64.
(1.9) Конструирование плазмид pCAP-H1N1/NP/272 и pCAP-H1N1/NP/467
ПЦР осуществляли, используя gp64(272)-f (5'-GACTCCCCGGGTCGAGCACCGAGTCAAGAAG-3' (SEQ ID NO: 15); сайт XmaI подчеркнут), gp64(467)-f (5'-GACTCCCCGGGACATCACTTCCATGGCTGAA-3' (SEQ ID NO: 16); сайт XmaI подчеркнут), и GP64-r DraIII (5'-GGGCACTTAGTGATATTGTCTATTACGGTTTCTAATC-3' (SEQ ID NO: 12); сайт DraIII подчеркнут) pCAP-H1N1/HA1-gp64. Полученные фрагменты расщепляли ферментами рестрикции XmaI и DraIII и встраивали в pCAP-H1N1/NP-gp64, расщепленный XmaI и DraIII, получая pCAP-H1N1/NP/272 и pCAP-H1N1/NP/467.
(1.10) Конструкция векторов для переноса pCAP-PfCSP, cCAP-PfCSP/272 и pCAP-PfCSP/467 согласно настоящему изобретению
Геномную ДНК P. falciparum экстрагировали их эритроцитов человека, инфицированных штаммом Plasmodium falciparum 3D7, используя набор QIAamp DNA Midi (из Qiagen). Ген PfCSP клонировали с помощью ПЦР, используя указанную геномную ДНК в качестве матрицы, согласно следующему способу. ПЦР осуществляли, используя праймеры PfCSP-f(19)(5'-GACTCTGCAGTTATTCCAGGAATACCAGTGCTATGGAAG-3' (SEQ ID NO: 17); сайт PstI подчеркнут) и PfCSP-r(373)(5'-CGATCCCGGGCTTTTTCCATTTTACAAATTTTTTTTTCAATATC-3' (SEQ ID NO: 18); сайт XmaI подчеркнут). Полученный фрагмент ДНК встраивали в pCAP-H1N1/NP-gp64, pCAP-H1N1/NP/272 и pCAP-H1N1/NP/467, каждая из которых была расщеплена PstI и XmaI. Сконструированные плазмиды названы pCAP-PfCSP, pCAP-PfCSP/272 и pCAP-PfCSP/467.
Аминокислотная последовательность белка циркумпорозоита (CS) Plasmodium falciparum 3D7 имеет номер доступа в GenBank XP_001351122.
(2) Конструирование вектора для переноса pDual-Pfs25-PfCSP-gp64 согласно настоящему изобретению
(2.1) Конструирование плазмиды pDual-PbAMA1D123-gp64
Образец крови брали у мыши BALB/c, инфицированной малярийным паразитом P. berghei штамма ANKA, и геномную ДНК P. berghei экстрагировали, используя набор QIAamp DNA Midi (Qiagen). Домен 123 (D123) гена PbAMA1 клонировали в ПЦР, используя полученную геномную ДНК в качестве матрицы, согласно следующему способу. ПЦР осуществляли, используя праймеры pAMA-F1 (5'-CACCGAATTCAATCCATGGGAAAAGTATACGGAAAAATAT-3' (SEQ ID NO: 19); сайт EcoRI подчеркнут) и pAMA1-R1 (5'-CCCGGGCTTCTCTGGTTTGATGGGCTTTCATATGCAC-3' (SEQ ID NO: 20); сайт Cfr9I подчеркнут). Полученный фрагмент ДНК PbAMA1D123 клонировали в pENTR/D-TOPO, затем расщепляли EcoRI/Cfr9I и встраивали в pBACsurf-Hsp65, расщепленную EcoRI и Cfr9I. Сконструированная плазмида названа pBACsurf-PbAMA1D123.
Затем pBACsurf-PbAMA1D123 расщепляли EcoRI/Cfr9I и фрагмент ДНК гена PbAMA1D123 встраивали в pDual-Hsp65-gp64, расщепленную EcoRI и Cfr9I, получая плазмиду pDual-PbAMA1D123-gp64.
(2.2) Конструирование плазмиды pDual-PfCSP-gp64
Ген PfCSP клонировали с помощью ПЦР, используя геномную ДНК P. falciparum в качестве матрицы, согласно следующему способу. ПЦР осуществляли, используя праймеры pPfCSP-F1 (5'-CACCGAATTCTTATTCCAGGAATACCAGTGCTATGGAAGT-3' (SEQ ID NO: 21); сайт EcoRI подчеркнут) и pPfCSP-R1 (5'-CCCGGGCTTTTTCCATTTTACAAATTTTTTTTTC-3' (SEQ ID NO: 22); сайт Cfr9I подчеркнут). Полученный фрагмент ДНК PfCSP клонировали в pENTR/D-TOPO, затем расщепляли EcoRI/Cfr9I и встраивали в pDual-PbAMA1D123-gp64, расщепленную EcoRI и Cfr9I. Сконструированная плазмида названа pDual-PfCSP-gp64.
(2.3) Конструирование вектора для переноса pDual-Pfs25-PfCSP-gp64 согласно настоящему изобретению
Ген Pfs25 клонировали с помощью ПЦР, используя геномную ДНК P. falciparum в качестве матрицы согласно следующему способу. ПЦР осуществляли, используя праймеры pPfs25-F1 (5'-CACCGAATTCAAAGTTACCGTGGATACTGTATGCAAAAGAGGA-3' (SEQ ID NO: 23); сайт EcoRI подчеркнут) и pPfs25-R2 (5'-CAATTGAGATCCGCCGCCACCGCCACCAGTACATATAGAGCTTTCATTATCTATTATAAATCCATC-3' (SEQ ID NO: 24); сайт MunI подчеркнут). Полученный фрагмент ДНК Pfs25 клонировали в pENTR/D-TOPO, затем расщепляли EcoRI/MunI и встраивали в pDual-PfCSP-gp64, расщепленный EcoRI. Сконструированная плазмида названа pDual-Pfs25-PfCSP-gp64.
(3) Конструирование плазмиды для переноса pDual-PfMSP1-PfCSP-gp64 согласно настоящему изобретению
Ген PfMSP1 клонировали в ПЦР, используя геномную ДНК P. falciparum в качестве матрицы согласно следующему способу. ПЦР осуществляли, используя праймеры pPfMSP119-F1 (5'-CACCGAATTCAACATTTCACAACACCAATGCGTAAAAAAAC-3': (SEQ ID NO: 25); сайт EcoRI подчеркнут) и pPfMSP119-R2 (5'-CAATTGAGATCCGCCGCCACCGCCACCGTTAGAGGAACTGCAGAAAATACCATCGAAAAGTGGA-3' (SEQ ID NO: 26); сайт MunI подчеркнут). Полученный фрагмент ДНК PfMSP119 клонировали в pENTR/D-TOPO, затем расщепляли EcoRI и MunI и встраивали в pDual-PbCSP-gp64, расщепленную EcoRI. Сконструированная плазмида названа pDual-PfMSP1-PfCSP-gp64.
(4) Конструирование плазмидных векторов для переноса pCAP-PfCSP(A361E), pCAP-PfCSP(A361E)/272 и pCAP-PfCSP(A361E)/467 согласно настоящему изобретению
ПЦР осуществляли с использованием pCAP-PfCSP и PfCSP-f(19)(5'-GACTCTGCAGTTATTCCAGGAATACCAGTGCTATGGAAG-3': (SEQ ID NO: 17); сайт PstI подчеркнут) и PfCSP-r(373 A361E) (5'-CGATCCCGGGCTTTTTCCATTTTACAAATTTTTTTTTCAATATCATTTTC-3': (SEQ ID NO: 27); сайт XmaI подчеркнут). Полученный фрагмент ДНК расщепляли PstI и XmaI и встраивали в pCAP-H1N1/NP-gp64, pCAP-H1N1/NP/272 и pCAP-H1N1/NP/467, каждая из которых была расщеплена PstI и XmaI. Сконструированные плазмиды названы pCAP-PfCSP(A361E), pCAP-PfCSP(A361E)/272 и pCAP-PfCSP(A361E)/467.
(5) Конструирование плазмид для переноса pCAP-PfCSP-76 и pCAP-PfCSP-76/467 согласно настоящему изобретению
ПЦР осуществляли с использованием pCAP-PfCSP(A361E) и PfCSP-f(76) (5'-GACTCTGCAGGATGATGGAAATAACGAAGACAACG-3': (SEQ ID NO: 28); сайт PstI подчеркнут) и PfCSP-r(373 A361E) (5'-CGATCCCGGGCTTTTTCCATTTTACAAATTTTTTTTTCAATATCATTTTC-3': (SEQ ID NO: 27); сайт XmaI подчеркнут). Полученный фрагмент ДНК расщепляли PstI и XmaI и затем встраивали в pCAP-H1N1/NP-gp64 и pCAP-H1N1/NP/467, каждая из которых была расщеплена PstI и XmaI. Сконструированные плазмиды были названы pCAP-PfCSP-76 и pCAP-PfCSP-76/467.
(6) Конструирование плазмид для переноса pCAP-PfCSP+209 и pCAP-PfCSP+209/467
Искусственную последовательность гена (PfCSP+: SEQ ID NO: 29) получали на основе аминокислотной последовательности PfCSP P. falciparum штамма 3D7 (в которой однако A в положении 361 была заменена на E), используя кодоны, часто используемые в клетках Sf9 и в клетках человека. Используя полученную искусственную последовательность гена в качестве матрицы, осуществляли ПЦР, используя PfCSP-f(+209) (5'-GACTCTGCAGAACGCTAATCCAAACGCTAATCCCAACGCTAATCCCAATGCC-3' (SEQ ID NO: 30); сайт PstI подчеркнут) и PfCSP-r(+A361E) (5'-CGATCCCGGGCTTTTTCCATTTTGCAAATTTTTTT-3' (SEQ ID NO: 31); сайт XmaI подчеркнут). Полученный фрагменты ДНК расщепляли PstI и XmaII и затем встраивали в pCAP-H1N1/NP-gp64 и pCAP-H1N1/NP/467, расщепленные PstI и XmaII. Сконструированные плазмиды были названы pCAP-PfCSP+209 и pCAP-PfCSP+209/467.
(7) Конструирование плазмид для переноса pCAP-PfCSP+76/209 и pCAP-PfCSP+76/209/467 согласно настоящему изобретению
Используя искусственную последовательность гена (PfCSP+: SEQ ID NO: 29) в качестве матрицы, осуществляли ПЦР с использованием PfCSP-f(+76) (5'-GACTCTGCAGGACGACGGCAACAACGAAGACAACG-3' (SEQ ID NO: 32); сайт PstI подчеркнут), PfCSP-r(+128) (5'-CGTTAGGATCCACATTTGGGTTGGCATTTGGG-3' (SEQ ID NO: 33); сайт BamHI подчеркнут), PfCSP-f (+209) BamHI (5'-GACTGGATCCTAACGCTAATCCAAACGCTAATCCC-3':(SEQ ID NO: 34); сайт BamHI подчеркнут), и PfCSP-r(+A361E) (5'-CGATCCCGGGCTTTTTCCATTTTGCAAATTTTTTT-3' (SEQ ID NO: 31); сайт XmaI подчеркнут) с полученной искусственной последовательности гена. Полученные фрагменты ДНК расщепляли PstI/BamHI и BamHI/XmaI, соответственно и затем встраивали в pCAP-H1N1/NP-gp64 и pCAP-H1N1/NP/467, каждая из которых была расщеплена PstI и XmaI. Сконструированные плазмиды были названы pCAP-PfCSP+76/209 и pCAP-PfCSP+76/209/467.
(8) Конструирование плазмид для переноса pCAP-HA1/Anhui, pCAP-HA1/Anhui/272 и pCAP-HA1/Anhui/467
Искусственную последовательность гена (SEQ ID NO: 35) получали на основе аминокислотной последовательности области гемагглютинина HA1 вируса гриппа H5N1/Anhui/1/05, используя кодоны, часто используемые в клетках Sf9 и в клетках человека. Используя полученную искусственную последовательность гена в качестве матрицы, осуществляли ПЦР с использованием AH-F1 (5'-CAGTCTGCAGGACCAGATTTGCATC-3': (SEQ ID NO: 36); сайт PstI подчеркнут) и AH-R4 (5'-CAGTCCCGGGCTCTCTTGCGCCTGC-3': (SEQ ID NO: 37); сайт XmaI подчеркнут). Полученный фрагмент ДНК расщепляли PstI и XmaI и затем встраивали в pCAP-H1N1/NP-gp64, pCAP-H1N1/NP/272 и pCAP-H1N1/NP/467, каждая из которых была расщеплена PstI и XmaI. Сконструированные плазмиды были названы pCAP-HA1/Anhui, pCAP-HA1/Anhui/272 и pCAP-HA1/Anhui/467.
Аминокислотная последовательность гемагглютинина вируса гриппа A/H5N1/Anhui/1/05 имеет номер доступа в GenBank ABD28180.
(9) Конструирование плазмидных векторов для переноса pCAP-HA1/Vietnam, pCAP-HA1/Vietnam/51, pCAP-HA1/Vietnam/101, pCAP-HA1/Vietnam/154, pCAP-HA1/Vietnam/201, pCAP-HA1/Vietnam/272 и pCAP-HA1/Vietnam /467 согласно настоящему изобретению
Искусственную последовательность гена (SEQ ID NO: 38) получали на основе аминокислотной последовательности области HA1 гемагглютинина вируса гриппа H5N1/Vietnam/1203/4, используя кодоны, часто используемые в клетках Sf9 и в клетках человека. Используя полученную искусственную последовательность гена в качестве матрицы, осуществляли ПЦР с использованием VN-F1 (5'-CAGTCTGCAGGACCAGATCTGTATC-3': (SEQ ID NO: 39); сайт PstI подчеркнут) и VN-R4 (5'-CAGTCCCGGGCTCTCTTCTTCCTGC-3': (SEQ ID NO: 40); сайт XmaI подчеркнут). Полученный фрагмент ДНК расщепляли PstI и XmaI и встраивали в pCAP-H1N1/NP-gp64, pCAP-H1N1/NP/272 и pCAP-H1N1/NP/467, каждая из которых была расщеплена PstI и XmaI. Сконструированные плазмиды были названы pCAP-HA1/Vietnam, pCAP-HA1/Vietnam/272 и pCAP-HA1/Vietnam/467.
Кроме того, используя pCAP-HA1/Vietnam в качестве матрицы, осуществляли ПЦР с использованием gp64(51)-f (5'-GACTCCCCGGGTGGAAATCACCATCGTGGAGACG-3': (SEQ ID NO: 41); сайт XmaI подчеркнут) или gp64(101)-f (5'-GACTCCCCGGGATTTGCTTATGTGGAGCATCAGG-3': (SEQ ID NO: 42); сайт XmaI подчеркнут) или gp64(154)-f (5'-GACTCCCCGGGCGCACCACACGTGCAACAAATCG-3': (SEQ ID NO: 43); сайт XmaI подчеркнут), или gp64(201)-f (5'-GACTCCCCGGGACACTGTGCTTCATCGAGACGGC-3': (SEQ ID NO: 44); сайт XmaI подчеркнут) и GP64-r DraIII (5'-GGGCACTTAGTGATATTGTCTATTACGGTTTCTAATC-3' (SEQ ID NO: 12); сайт DraIII подчеркнут). Полученный фрагменты ДНК расщепляли XmaI и DraIII и встраивали в pCAP-HA1/Vietnam, расщепленную XmaI и DraIII. Сконструированные плазмиды были названы pCAP-HA1/Vietnam/51, pCAP-HA1/Vietnam/101, pCAP-HA1/Vietnam/154 и pCAP-HA1/Vietnam/201.
Аминокислотная последовательность гемагглютинина вируса гриппа A/H5N1/Vietnam/1203/2004 имеет номер доступа в GenBank AAW80717.
(10) Конструирование плазмидных векторов для переноса pCAP-AH/345, pCAP-AH/345/467, pCAP-AH/410, pCAP-AH/410/467, pCAP-AH/473, pCAP-AH/473/467, pCAP-AH/520, pCAP-AH/520/467 согласно настоящему изобретению
Искусственную последовательность гена (SEQ ID NO: 45) получали на основе аминокислотной последовательности область гемагглютинина HA вируса гриппа A/H5N1/Anhui/1/05, оптимизируя кодоны с использованием программы Gene Designer, доступной из DNA2.0, Inc. Используя такую искусственную последовательность в качестве матрицы, осуществляли ПЦР с использованием AH17-F (5'-GACTCTGCAGGATCAGATCTGTATTGGGTACC-3':(SEQ ID NO: 46); сайт PstI подчеркнут, и AH345-R (5'-CGATCCCGGGCTCTCTTTCTCCTCCGCTCGC-3': (SEQ ID NO: 47); сайт XmaI подчеркнут), или AH410-R (5'-CGATCCCGGGCGGCCTCGAACTGGGTGTTCATT-3': (SEQ ID NO: 48); сайт XmaI подчеркнут), или AH473-R (5'-CGATCCCGGGCGTCTCTGAGTTGAAGGCGCAC-3':(SEQ ID NO: 49); сайт XmaI подчеркнут, или AH520-R (5'-CGATCCCGGGCACCACTAATTTCCTCTCGCTTC-3':(SEQ ID NO: 50); сайт XmaI подчеркнут). Полученный фрагмент ДНК расщепляли PstI и XmaI и встраивали в pCAP-HA1/Anhui или pCAP-HA1/Anhui/467, расщепленные PstI и XmaI. Сконструированные плазмиды были названы pCAP-AH/345, pCAP-AH/345/467, pCAP-AH/410, pCAP-AH/410/467, pCAP-AH/473, pCAP-AH/473/467, pCAP-AH/520 и pCAP-AH/520/467.
(11) Конструирование плазмидных векторов для переноса pCAP-VN/346, pCAP-VN/346/467, pCAP-VN/410, pCAP-VN/410/467, pCAP-VN/473, pCAP-VN/473/467, pCAP-VN/520 и pCAP-VN/520/467 согласно настоящему изобретению
Искусственную последовательность гена (SEQ ID NO: 51) получали на основе аминокислотной последовательности области гемагглютинина HA вируса гриппа A/H5N1/Vietnam/1203/2004, оптимизируя кодоны с использованием программы Gene Designer, доступной из DNA2.0, Inc. Используя такую искусственную последовательность в качестве матрицы, осуществляли ПЦР с использованием VN17-F (5'-GACTCTGCAGGATCAGATCTGTATCGGATATC-3': (SEQ ID NO: 52); сайт PstI подчеркнут) и VN346-R (5'-CGATCCCGGGCCCGCTTTTTCCTCCTCCGTTCG-3': (SEQ ID NO: 53); сайт XmaI подчеркнут), или VN410-R (5'-CGATCCCGGGCCTCAAACTGCGTATTCATTTTG-3': (SEQ ID NO: 54); сайт XmaI подчеркнут), или VN473-R (5'-CGATCCCGGGCTCTAAGCTGGAGCCTGACTTTGTC-3': (SEQ ID NO: 55); сайт XmaI подчеркнут), или VN520-R (5'-CGATCCCGGGCACTAATCTCCTCTCTTTTAAGTC-3': (SEQ ID NO: 56); сайт XmaI подчеркнут). Полученный фрагмент ДНК расщепляли PstI и XmaI и встраивали в pCAP-HA1/Anhui или pCAP-HA1/Anhui/467, расщепленные PstI и XmaI. Сконструированные плазмиды были названы pCAP-VN/346, pCAP-VN/346/467, pCAP-VN/410, pCAP-VN/410/467, pCAP-VN/473, pCAP-VN/473/467, pCAP-VN/520 и pCAP-VN/520/467.
(12) Конструирование плазмидных векторов для переноса pCAP-CO/full, pCAP-CO/full/467, pCAP-CO/19, pCAP-CO/19/467, pCAP-CO/76, pCAP-CO/76/467, pCAP-CO/205 и pCAP-CO/205/467 согласно настоящему изобретению
Искусственную последовательность гена (SEQ ID NO: 57) получали на основе аминокислотной последовательности CSP штамма Plasmodium falciparum 3D7, оптимизируя кодоны с использованием программы Gene Designer, доступной из DNA2.0, Inc. Используя такую искусственную последовательность в качестве матрицы, осуществляли ПЦР с использованием пары праймеров, состоящей из PfCSP_opt-f (5'-GACTCTGCAGATGATGCGAAAATTGGCCATACTG-3': (SEQ ID NO: 58); сайт PstI подчеркнут) и PfCSP_opt-r (397) (5'-CGATCCCGGGCATTGAGGAACAGAAAGGAAAGAACCATG-3': (SEQ ID NO: 59); сайт XmaI подчеркнут); PfCSP_opt-f (19) (5'-GACTCTGCAGCTGTTTCAGGAATACCAGTGCTATGG-3': (SEQ ID NO: 60); (сайт PstI подчеркнут) и PfCSP_opt-r (373) (5'-CGATCCCGGGCCTTCTCCATCTTACAAATTTTCTTTTCAATATCATTAGC-3': (SEQ ID NO: 61); сайт XmaI подчеркнут); PfCSP_opt-f (76) (5'-GACTCTGCAGGACGACGGAAATAATGAGGACAACG-3': (SEQ ID NO: 62); сайт PstI подчеркнут) и PfCSP_opt-r (373) (5'-CGATCCCGGGCCTTCTCCATCTTACAAATTTTCTTTTCAATATCATTAGC-3': (SEQ ID NO: 61); сайт XmaI подчеркнут); и PfCSP_opt-f (205) (5'-GACTCTGCAGAATGCAAACCCAAATGCCAATCCAAACGC-3': (SEQ ID NO: 63); сайт PstI подчеркнут) и PfCSP_opt-r (373) (5'-CGATCCCGGGCCTTCTCCATCTTACAAATTTTCTTTTCAATATCATTAGC-3': (SEQ ID NO: 61); сайт XmaI подчеркнут). Полученные фрагменты ДНК расщепляли PstI и XmaI и встраивали в pCAP-HA1/Anhui или pCAP-HA1/Anhui/467, расщепленные PstI и XmaI. Сконструированные плазмиды были названы pCAP-CO/full, pCAP-CO/full/467, pCAP-CO/19, pCAP-CO/19/467, pCAP-CO/76, pCAP-CO/76/467, pCAP-CO/205 и pCAP-CO/205/467.
(13) Конструирование плазмидных векторов для переноса pCA64-HA1/Anhui и pCA64-PfCSP(A361E) согласно настоящему изобретению
Используя ДНК Triple Cut BacVector-2000 (из Novagen), осуществляли ПЦР с использованием gp64-p-f (5'-GACTCGGACCGGCCAGATAAAAATAATCTTATCAATTAAG-3': (SEQ ID NO: 64); сайт RsrII подчеркнут) и gp64-p-r (5'-CGATACTAGTAGCACTGAGGCTTCTTATATACCCG-3': (SEQ ID NO: 65); сайт SpeI подчеркнут). Полученный фрагмент ДНК расщепляли RsrII и SpeI и встраивали в pCAP-HA1/Anhui или pCAP-PfCSP(A361E), расщепленные RsrII и SpeI, конструируя таким образом плазмидные векторы для переноса pCA64-HA1/Anhui и pCA64-PfCSP(A361E), способные экспрессировать слитый белок, состоящий из антигена HA1 или антигена PfCSP и белка gp64, в клетках млекопитающих и насекомых под контролем требуемого двойного промотора, состоящего из промотора CAG и промотора gp64.
(14) Конструирование плазмидных векторов для переноса pCA39-HA1/Anhui и pCA39-PfCSP(A361E) согласно настоящему изобретению
Используя ДНК Triple Cut BacVector-2000 (из Novagen), осуществляли ПЦР с использованием vp39-p-f (5'-GACTCGGACCGCGTCGTACAAATCGAAATATTGTTGTG-3':(SEQ ID NO: 66); сайт RsrII подчеркнут) и vp39-p-r (5'-CGATACTAGTGTGATTGAGAAAGAAATCTCTTATTC-3': (SEQ ID NO: 67); сайт SpeI подчеркнут). Полученный фрагмент ДНК расщепляли RsrII и SpeI и встраивали в pCAP-HA1/Anhui или pCAP-PfCSP(A361E), расщепленные RsrII и SpeI, конструируя таким образом плазмидные векторы для переноса pCA39-HA1/Anhui и pCA39-PfCSP(A361E), способные экспрессировать слитый белок, состоящий из антигена HA1 или антигена PfCSP и белка gp64, в клетках млекопитающих и насекомых под контролем требуемого двойного промотора, состоящего из промотора CAG и промотора vp39.
(15) pCAP-CO/full/VSV, pCAP-CO/19/VSV, pCAP-CO/76/VSV и pCAP-CO/205/VSV согласно настоящему изобретению
Используя pVSV-G (из Clonetech) в качестве матрицы, осуществляли ПЦР с использованием VSV-G-f (5'-GACTCCCCGGGCGTTCGAACATCCTCACATTCAAG-3' (SEQ ID NO: 68); сайт XmaI подчеркнут), VSV-G-r (5'-GACTCACTTAGTGCTTTCCAAGTCGGTTCATCTC-3': (SEQ ID NO: 69); сайт DraIII подчеркнут). Полученный фрагмент ДНК встраивали в pCAP-CO/full, pCAP-CO/19, pCAP-CO/76 и pCAP-CO/205, каждая из которых была расщеплена XmaI и DraIII. Сконструированные плазмиды были названы pCAP-CO/full/VSV, pCAP-CO/19/VSV, pCAP-CO/76/VSV и pCAP-CO/205/VSV.
Пример 2: Рекомбинантные бакуловирусы согласно настоящему изобретению и способ их получения
(1) Рекомбинантные бакуловирусы получали, используя набор для получения рекомбинантных бакуловирусов (набор для трансфекции BacVector-2000 из Novagen), посредством котрансфекции в клетки Sf9 ДНК BacVector-2000 с каждым из следующих векторов для переноса, сконструированных, как описано в примере 1: pCAP-PfCSP, pCAP-PfCSP/272, pCAP-PfCSP/467, pCAP-PfCSP(A361E), pCAP-PfCSP(A361E)/272, pCAP-PfCSP(A361E)/467, pCAP-PfCSP-76, pCAP-PfCSP-76/467, pCAP-PfCSP+209, pCAP-PfCSP+209/467, pCAP-PfCSP+76/209, pCAP-PfCSP+76/209/467, pCAP-HA1/Anhui, pCAP-HA1/Anhui/272, pCAP-HA1/Anhui/467, pCAP-HA1/Vietnam, pCAP-HA1/Vietnam/51, pCAP-HA1/Vietnam/101, pCAP-HA1/Vietnam/154, pCAP-HA1/Vietnam/201, pCAP-HA1/Vietnam/272, pCAP-HA1/Vietnam/467, pCAP-AH/345, pCAP-AH/345/467, pCAP-AH/410, pCAP-AH/410/467, pCAP-AH/473, pCAP-AH/473/467, pCAP-AH/520, pCAP-AH/520/467, pCAP-VN/346, pCAP-VN/346/467, pCAP-VN/410, pCAP-VN/410/467, pCAP-VN/473, pCAP-VN/473/467, pCAP-VN/520, pCAP-VN/520/467, pCAP-CO/full, pCAP-CO/full/467, pCAP-CO/19, pCAP-CO/19/467, pCAP-CO/76, pCAP-CO/76/467, pCAP-CO/205, pCAP-CO/205/467, pCA39-HA1/Anhui, pCA64-HA1/Anhui, pCA39-PfCSP(A361E), pCA64-PfCSP(A361E), pCAP-CO/full/VSV, pCAP-CO/19/VSV, pCAP-CO/76/VSV, pCAP-CO/205/VSV, pDual-Pfs25-PfCSP-gp64, pDual-PfMSP1-PfCSP-gp64. Полученные рекомбинантные бакуловирусы были названы AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-PfCSP(A361E), AcNPV-CAP-PfCSP(A361E)/272, AcNPV-CAP-PfCSP(A361E)/467, AcNPV-CAP-PfCSP-76, AcNPV-CAP-PfCSP-76/467, AcNPV-CAP-PfCSP+209, AcNPV-CAP-PfCSP+209/467, AcNPV-CAP-PfCSP+76/209, AcNPV-CAP-PfCSP+76/209/467, AcNPV-CAP-HA1/Anhui, AcNPV-CAP-HA1/Anhui/272, AcNPV-CAP-HA1/Anhui/467, AcNPV-CAP-HA1/Vietnam, AcNPV-CAP-HA1/Vietnam/51, AcNPV-CAP-HA1/Vietnam/101, AcNPV-CAP-HA1/Vietnam/154, AcNPV-CAP-HA1/Vietnam/201, AcNPV-CAP-HA1/Vietnam/272, AcNPV-CAP-HA1/Vietnam/467, AcNPV-CAP-AH/345, AcNPV-CAP-AH/345/467, AcNPV-CAP-AH/410, AcNPV-CAP-AH/410/467, AcNPV-CAP-AH/473, AcNPV-CAP-AH/473/467, AcNPV-CAP-AH/520, AcNPV-CAP-AH/520/467, AcNPV-CAP-VN/346, AcNPV-CAP-VN/346/467, AcNPV-CAP-VN/410, AcNPV-CAP-VN/410/467, AcNPV-CAP-VN/473, AcNPV-CAP-VN/473/467, AcNPV-CAP-VN/520, AcNPV-CAP-VN/520/467, AcNPV-CAP-CO/full, AcNPV-CAP-CO/full/467, AcNPV-CAP-CO/19, AcNPV-CAP-CO/19/467, AcNPV-CAP-CO/76, AcNPV-CAP-CO/76/467, AcNPV-CAP-CO/205, AcNPV-CAP-CO/205/467, AcNPV-CA39-HA1/Anhui, AcNPV-CA64-HA1/Anhui, AcNPV-CA39-PfCSP(A361E), AcNPV-CA64-PfCSP(A361E), AcNPV-CAP-CO/full/VSV, AcNPV-CAP-CO/19/VSV, AcNPV-CAP-CO/76/VSV, AcNPV-CAP-CO/205/VSV, AcNPV-Dual-Pfs25-PfCSP-gp64 и AcNPV-Dual-PfMSP1-PfCSP-gp64.
Пример 3: Тестирование экспрессии антигена вакцины с рекомбинантного бакуловируса согласно настоящему изобретению в клетках насекомых
Клетки Sf9 культивировали в концентрации 1×105 клеток на лунку в 48-луночном планшете (Corning) и инфицировали бакуловирусами AcNPV-CAP-PfCSP, AcNPV-CAP-HA1/Anhui и AcNPV-CAP-HA1/Vietnam, полученными, как описано в примере 2, или бакуловирусом дикого типа AcNPV-WT в качестве контроля при значении множественности инфекции примерно 0,1. Через 5 дней надосадок культуры удаляли из каждой лунки и затем добавляли раствор буфера для образцов (+2ME, x2) (Wako) в количестве 0,05 мл на лунку для полного лизиса клеток. Лизат клеток нагревали при 100°C в течение 5 минут и подвергали электрофорезу в 7,5% SDS-ПААГ. После электрофореза белок переносили на PVDF-мембрану (Immobilon-P, Millipore) и блокирование осуществляли при 4°C в течение ночи, погружая мембрану в 2,5% обезжиренное молоко/SuperBlock (Pierce). Мембрану, на которую был перенесен белок из клеток Sf9, инфицированных каждым из бакуловирусов, инкубировали с анти-gp64-антителом (AcV5 из eBioScience) в качестве первого антитела и затем инкубировали с меченым HRP антителом козы против IgG (H+L) мыши (из BioRad) в качестве второго антитела. Окраску проявляли, используя набор для регистрации при Вестерн-блоттинге ECLplus (из GE Healthcare), чтобы выявить полосу белка. Результаты показаны на фиг.1.
На фиг.1 показан анализ с использованием Вестерн-блоттинга, показывающий экспрессию слитых антигенов в клетках насекомых с рекомбинантных бакуловирусов, содержащих ген PfCSP малярии человека, ген HA1 вируса гриппа штамма H5N1/Anhui/1/05 и ген HA1 штамма H5N1/Vietnam/1203/04. На фиг.1, на дорожке 1 показана полоса бакуловируса дикого типа (AcNPV-WT); на дорожке 2 показана полоса рекомбинантного бакуловируса (AcNPV-CAP-PfCSP), содержащего ген PfCSP и полноразмерный ген gp64, встроенные ниже двойного промотора согласно настоящему изобретению; на дорожке 3 показана полоса рекомбинантного бакуловируса (AcNPV-CAP-HA1/Anhui), содержащего ген HA1 вируса гриппа штамма H5N1/Anhui/1/05 и полноразмерный ген gp64, встроенные ниже двойного промотора согласно настоящему изобретению; и на дорожке 4 показана полоса рекомбинантного бакуловируса ((AcNPV-CAP-HA1/Vietnam), содержащего ген HA1 вируса гриппа штамма H5N1/Vietnam/1203/04 и полноразмерный ген gp64, встроенные ниже двойного промотора согласно настоящему изобретению.
Как показано на дорожках 2, 3 и 4 на фиг.1, полосу, соответствующую экспрессированному слитому продукту гена иммуногенного чужеродного антигена и гена gp64, наблюдали в случае рекомбинантных бакуловирусов, имеющих ген антигена и ген gp64, слитые и экспрессируемые ниже двойного промотора согласно настоящему изобретению.
Описанные выше результаты подтвердили, что в случае применения рекомбинантного вируса согласно настоящему изобретению ген иммуногенного чужеродного антигена и ген gp64 могут быть слиты и экспрессированы в виде слитого продукта в клетках насекомых.
Пример 4: Тестирование для идентификации слитого антигена в антигене вакцины, презентированном на вирусной частице (вирионе) рекомбинантного бакуловируса согласно настоящему изобретению
Клетки Sf9 культивировали до концентрации 1×107 клеток на чашку для культивирования клеток диаметром 150 мм (Sumilon) и инфицировали каждым из указанных выше бакуловирусов при значении множественности инфекции примерно 0,1. Через 7 дней среду дважды центрифугировали при 3000 g при 4°C по 15 минут и раствор, содержащий вирус, наслаивали на 25% раствор сахарозы и центрифугировали, используя ультрацентрифугу, при 25000 об/мин при 4°C в течение 90 минут, получая вирусные частицы. 0,05 мл раствора буфера для образцов (+2ME, x2) (Wako) добавляли к 0,05 мл каждого из вирусных концентратов (1×108 БОЕ/мл) AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272, AcNPV-CAP-PfCSP/467, AcNPV-CAP-HA1/Vietnam и AcNPV-WT, собранных ультрацентрифугированием. Полученные смеси нагревали при 100°C в течение 5 минут и подвергали электрофорезу в 7,5% SDS-ПААГ. После электрофореза полученные белки переносили на PVDF-мембраны (Immobilon-P, Millipore) и погружали в 2,5% обезжиренное молоко/SuperBlock (Pierce), чтобы осуществить блокирование, при 4°C в течение ночи. Мембраны, на которые переносили растворы, содержащие вирусы AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/272 и AcNPV-CAP-PfCSP/467, инкубировали с анти-PfCSP-антителом (2A10, MR-4) в качестве первого антитела и затем инкубировали с меченым HRP антителом козы против IgG (H+L) мыши (BioRad) в качестве второго антитела. Мембрану, на которую переносили раствор, содержащий вирус AcNPV-CAP-HA1/Vietnam, инкубировали с анти-H5N1-антителом (IT-003-005 из Immune Technology) в качестве первого антитела и затем инкубировали с меченым HRP антителом козы против IgG кролика (из GE Healthcare) в качестве второго антитела. Окраску проявляли, используя набор для регистрации при Вестерн-блоттинге ECLplus (GE Healthcare), чтобы выявить полосы белков. Результаты показаны на фиг.2.
На фиг.2 (A) показан анализ, проведенный с помощью Вестерн-блоттинга, показывающий экспрессию гена CSP (PfCSP) возбудителя малярии человека в вирусных частицах рекомбинантных бакуловирусов, полученных с использованием рекомбинантных векторов для переноса. На дорожке 1, изображенной слева на фиг.2 (A), показана полоса рекомбинантного бакуловируса (AcNPV-CAP-PfCSP), содержащего ген PfCSP и полноразмерный ген gp64, встроенные ниже двойного промотора согласно изобретению; на дорожке 2 показана полоса рекомбинантного бакуловируса (AcNPV-CAP-PfCSP/272), содержащего ген PfCSP и ген gp64 неполной длины (241 аминокислотный остаток от C-конца), встроенные ниже двойного промотора согласно изобретению; на дорожке 3 показана полоса рекомбинантного бакуловируса (AcNPV-CAP-PfCSP/467), содержащего ген PfCSP и ген gp64 неполной длины (46 аминокислотных остатков от C-конца), встроенные ниже двойного промотора согласно изобретению. Бакуловирусы подвергали электрофорезу и проверяли наличие экспрессированного слитого продукта гена PfCSP и гена gp64. Интенсивную полосу, показывающую присутствие слитого антигена гена PfCSP и гена gp64 в рекомбинантных вирусных частицах, выявляли на всех дорожках, представленных на фиг.2 (A).
На фиг.2 (B) показан анализ, проведенный с помощью Вестерн-блоттинга, показывающий экспрессию гена H5N1/HA1 в вирусных частицах рекомбинантных бакуловирусов, полученных с использованием рекомбинантных векторов для переноса. На дорожке 1, левая дорожка на фиг.2 (B), показаны результаты, полученные с использованием лизата клеток, инфицированных AcNPV-WT, полученного как описано в примере 3; на дорожке 2 показаны результаты, полученные с использованием лизата клеток, инфицированных AcNPV-CAP-HA1/Anhui, полученного как описано в примере 3; на дорожке 3 показаны результаты, полученные с использованием лизата клеток, инфицированных AcNPV-CAP-HA1/Vietnam, полученного как описано в примере 3; и на дорожке 4 показаны результаты, полученные с использованием вирусных частиц бакуловируса дикого типа (AcNPV-WT); на дорожке 5 показаны результаты, полученные с использованием вирусных частиц рекомбинантного бакуловируса (AcNPV-CAP-HA1/Vietnam), содержащего ген HA1 вируса гриппа штамма H5N1/Vietnam/1203/04 и полноразмерный ген gp64, встроенные ниже двойного промотора согласно настоящему изобретению; и на дорожке 6 показаны результаты для очищенного антигена HA H5N1 (IT-003-0053p из Immune Technology). Бакуловирусы подвергали электрофорезу и проверяли наличие экспрессированного слитого продукта гена PfCSP и гена gp64. Интенсивную полосу, показывающую присутствие слитого антигена гена HA1 H5N1/Vietnam/1203/04 и гена gp64 в рекомбинантных вирусных частицах, выявили на дорожке 5, показанной на фиг.2(B).
Описанные выше результаты, полученные согласно примеру 4, показывают, что чужеродный ген, обладающий требуемой иммуногенностью, и ген gp64 могут быть слиты и экспрессированы в рекомбинантных вирусных частицах рекомбинантного бакуловируса согласно настоящему изобретению, полученного с использованием рекомбинантного вектора для переноса согласно настоящему изобретению.
Пример 5: Тестирование экспрессии антигена вакцины с рекомбинантного бакуловируса согласно настоящему изобретению у млекопитающих
Клетки HepG2 инфицировали AcNPV-Dual-PfMSP1-PfCSP при значении множественности инфекции 1. Через 48 часов надосадок культуры удаляли и чашку три раза промывали PBS. Добавляли раствор, содержащий смесь ацетон/этанол (соотношение в смеси 7:3), охлажденный до -20°C, чтобы иммобилизовать клетки при -20°C в течение 5 минут. Добавляли 5% нормальную сыворотку козы (Sigma), осуществляя блокирование при комнатной температуре в течение 1 часа. Чтобы выявить экспрессию PfCSP добавляли анти-PfCSP-антитело (2A10, MR-4), меченое Alexa Flour 594; и для выявления экспрессии PfMSP-119 добавляли анти-PfMSP-119-антитело (5.2, MR-4), и затем добавляли антитело против Ig мыши, меченое ФИТЦ. После инкубации клетки, которые взаимодействовали с антителами, выявляли с помощью флуоресцентного микроскопа.
Результаты показаны на фиг.3.
На фиг.3 показаны клетки HepG2, окрашенные флуоресцентно меченым антителом, которое указывает, что антиген был экспрессирован с рекомбинантного бакуловируса, содержащего слитый ген, состоящий из гена PfMSP1 и гена PfCSP, в клетках HepG2. Результаты, показанные на фиг.3 (A) подтвердили, что был экспрессирован антиген PfCSP. Результаты, показанные на фиг.3 (B), подтвердили, что был экспрессирован антиген PfMSP-119. Таким образом, было подтверждено, что слитые антигены могут быть экспрессированы в клетках млекопитающих. Результаты, приведенные на фиг.3 (A) и (B) ясно показывают, что рекомбинантный бакуловирус, полученный с использованием вектора для переноса, содержащего двойной промотор согласно настоящему изобретению, может экспрессировать требуемый антиген в клетках млекопитающих.
Результаты свидетельствуют, что в том случае, когда рекомбинантный бакуловирус, полученный с использованием рекомбинантного вектора для переноса согласно настоящему изобретению, вводят человеку и другим млекопитающим, вирусные частицы проникают в клетки млекопитающих и промотор млекопитающих функционирует, продуцируя слитый продукт требуемого гена чужеродного антигена и гена gp64 в клетках млекопитающих, таким образом индуцируя приобретенный иммунитет.
Пример 6: Индукция антитела рекомбинантным вирусом, продуцирующим антиген PfCSP, и рекомбинантным вирусом, продуцирующим антиген H5N1/HA1
1. Инокуляция раствора, содержащего вирусы
Растворы, содержащие вирусы AcNPV-WT, AcNPV-CAP-PfCSP, AcNPV-CAP-PfCSP/467, AcNPV-CAP-HA1/Anhui и AcNPV-CAP-HA1/Vietnam, концентрированные с помощью ультрацентрифугирования, инокулировали в бедренные мышцы самок мышей BALB/c в количестве 1×108 БОЕ два раза с двухнедельными интервалами.
2. Измерение титров антител
Мышей подвергали эвтаназии через две недели после конечной иммунизации и собирали сыворотку мышей и использовали ее для измерения титров специфичных для антигена антител. Индукцию титров специфичных для антигена PfCSP антител при использовании AcNPV-CAP-PfCSP и AcNPV-CAP-PfCSP/467 измеряли в ELISA, используя планшет, на котором иммобилизовали пептид (NANP)4NVDPC (Sigma), т.е., B-клеточный эпитоп PfCSP. Индукцию титров специфичных для антигена H5N1/HA антител при использовании AcNPV-CAP-HA1/Anhui и AcNPV-CAP-HA1/Vietnam измеряли в ELISA, используя планшет, на котором иммобилизовали очищенный антиген HA вируса H5N1 (IT-003-005p, Immune Technology). Оптическую плотность при OD450 нм измеряли, используя MaxiSorp (NUNC) в качестве планшета для ELISA, меченое HRP антитело козы против IgG мыши (H&L) (American Qualex) в качестве второго антитела и TMB (Calbiochem) для цветной реакции.
Результаты показаны на фиг.4.
На фиг.4 (A) приведен график средней оптической плотности для каждой группы при OD450 нм, полученный в том случае, когда сыворотки мышей подвергали двукратному серийному разведению от 800-кратного до 102400-кратного разведения. В группах, которым инокулировали PBS и AcNPV-WT, сыворотки которых не содержали антитела к антигену, оптическая плотность даже при 800-кратном разведении имела значение 0,1 или меньше, что свидетельствует о низкой реактивности. Напротив, в группах, которым инокулировали AcNPV-CAP-PfCSP и AcNPV-CAP-PfCSP/467, оптическая плотность при 800-кратных разведениях составляла 1,138 и 1,878, соответственно, свидетельствуя о высокой реактивности и ясно показывая, что были индуцированы специфичные для антигена антитела. Фиг.4 (B) представляет собой график средней оптической плотности для каждой группы при OD450 нм, полученный для случая, когда сыворотки мышей подвергали двукратному серийному разведению от 400-кратного до 25600-кратного разведения. В группах, которым инокулировали PBS и AcNPV-WT, сыворотки которых не содержали антитела к антигену, оптическая плотность при 800-кратных разведениях составляла 0,1 или меньше, что свидетельствует о низкой реактивности. Напротив, в группах, в которых инокулировали AcNPV-CAP-HA1/Anhui и AcNPV-CAP-HA1/Vietnam, оптическая плотность при 3200-кратном разведении составляла 1,551 и 2,503, соответственно, что свидетельствует о высокой реактивности и ясно показывает, что были индуцированы специфичные для антигена антитела. Фиг.4 ясно показывает, что рекомбинантный бакуловирус, полученный с использованием вектора для переноса, содержащего двойной промотор согласно настоящему изобретению, может индуцировать антитело к требуемому антигену у млекопитающих.
3. Измерение значения нейтрализации
Тест ингибирования гемагглютинации (HI) осуществляли, используя сыворотку мышей, которым инокулировали AcNPV-CAP-HA1/Anhui. Более конкретно, тест проводили согласно способу, описанному в инструкциях, прилагаемых к реагенту «Seiken» для гриппа HI (Denka Seiken Co., Ltd.), используя очищенный антиген HA вируса H5N1 (IT-003-0053p из Immune Technology). Абсорбцию неспецифичных агглютининов осуществляли, используя эритроциты, а удаление неспецифичных ингибиторов агглютинации осуществляли, используя RDE (II) «Seiken» (Denka Seiken Co., Ltd.). Тестирование HI осуществляли следующим образом. 0,025 мл 10-кратно разведенной антисыворотки в 96-луночном планшете подвергали 2-кратному серийному разведению, используя разбавитель. В каждую лунку 96-луночного планшета, содержащего разбавленную антисыворотку, добавляли 0,025 мл антигена HA вируса H5N1, разбавленного так, чтобы получить титр HA 4 на 0,025 мл. Планшет оставляли при комнатной температуре на 30 минут. Добавляли 0,05 мл суспензии эритроцитов для взаимодействия и тщательно перемешивали. Смесь оставляли при комнатной температуре на 60 минут. Последнее разведение тестируемого образца, при котором гемагглютинация была полностью ингибирована, определяли как титр HI-антитела.
Результаты показывают, что в сыворотках в случае инокуляции PBS и AcNPV-WT титры HI-антитела составляли 10 или меньше, тогда как в сыворотке при инокуляции AcNPV-CAP-HA1/Anhui титр HI-антитела составлял 40.
Результаты по-видимому указывают, что при введении человеку и другим млекопитающим рекомбинантный бакуловирус, полученный на основе рекомбинантного вектора для переноса согласно настоящему изобретению, может индуцировать антитела, эффективные по отношению к требуемому гену чужеродного антигена, таким образом обеспечивая эффект вакцины.
Список последовательностей в свободной форме
SEQ ID NO: 1 и 2 представляют собой последовательности праймеров phsp65-F1 и phsp65-R1 для ПЦР геномной ДНК M. tuberculosis H37Rv.
SEQ ID NO: 3 и 4 представляют собой последовательности праймеров phsp65-F2 и phsp65-R2 для ПЦР с использованием pcDNA-hps65 в качестве матрицы.
SEQ ID NO: 5 и 6 представляют собой последовательности праймеров pPolh-F2 и pgp64-R2 для ПЦР с использованием pBACsurf-1 в качестве матрицы для получения фрагмента ДНК гена gp64.
SEQ ID NO: 7 и 8 представляют собой последовательности праймеров HA-f и HA-r в ПЦР для получения фрагмента гена HA вируса гриппа.
SEQ ID NO: 9 и 10 представляют собой последовательности праймеров pHA-F1 и pHA-R1 для ПЦР с использованием pCR-Blunt-HA в качестве матрицы.
SEQ ID NO: 11 и 12 представляют собой последовательности праймеров Polh-f RsrII и GP64-r DraIII для ПЦР с использованием pBACsurf-HA1 в качестве матрицы.
SEQ ID NO: 13 и 14 представляют собой последовательности праймеров NP-f EcoRI и NP-r Cfr9I для ОТ-ПЦР геномной РНК вируса гриппа штамма PR/8/34.
SEQ ID NO: 15, 16, и 12 представляют собой последовательности праймеров gp64(272)-f, gp64(467)-f и GP64-r DraIII для ПЦР pCAP-H1N1/HA1-gp64.
SEQ ID NO: 17 и 18 представляют собой последовательности праймеров PfCSP-f(19) и PfCSP-r(373) для ПЦР с использованием геномной ДНК P. falciparum в качестве матрицы.
SEQ ID NO: 19 и 20 представляют собой последовательности праймеров pAMA-F1 и pAMA1-R1 для ПЦР с использованием геномной ДНК P. berghei в качестве матрицы.
SEQ ID NO: 21 и 22 представляют собой последовательности праймеров pPfCSP-F1 и pPfCSP-R1 для ПЦР с использованием геномной ДНК P. falciparum в качестве матрицы.
SEQ ID NO: 23 и 24 представляют собой последовательности праймеров pPfs25-F1 и pPfs25-R2 для ПЦР с использованием геномной ДНК P. falciparum в качестве матрицы.
SEQ ID NO: 25 и 26 представляют собой последовательности праймеров pPfMSP119-F1 и pPfMSP119-R2 для ПЦР с использованием Геномной ДНК P. falciparum в качестве матрицы.
SEQ ID NO: 17 и 27 представляют собой последовательности праймеров PfCSP-f(19) и PfCSP-r(373 A361E) для ПЦР с использованием pCAP-PfCSP в качестве матрицы.
SEQ ID NO: 28 и 27 представляют собой последовательности праймеров PfCSP-f(76) и PfCSP-r(373 A361E) для ПЦР с использованием pCAP-PfCSP в качестве матрицы.
SEQ ID NO: 29 представляет собой последовательность искусственного гена (PfCSP+), полученного на основании аминокислотной последовательности PfCSP штамма P. falciparum 3D7 (однако в которой A в положении 361 был заменен на E) с использованием кодонов, часто используемых в клетках Sf9 и в клетках человека.
SEQ ID NO: 30 и 31 представляют собой последовательности праймеров PfCSP-f(+209) и PfCSP-r(+A361E) для ПЦР с использованием PfCSP+ в качестве матрицы.
SEQ ID NO: 32, 33, 34 и 31 представляют собой последовательности праймеров PfCSP-f(+76), PfCSP-r(+128), PfCSP-f(+209) BamHI и PfCSP-r(+A361E) для ПЦР с использованием PfCSP+ в качестве матрицы.
SEQ ID NO: 35 представляет собой последовательность искусственного гена, полученного на основании аминокислотной последовательности области HA1 гемагглютинина вируса гриппа H5N1/Anhui/1/05 с использованием кодонов, часто используемых в клетках Sf9 и в клетках человека.
SEQ ID NO: 36 и 37 представляют собой последовательности праймеров AH-F1 (5'-CAGTCTGCAGGACCAGATTTGCATC-3': (SEQ ID NO: 36); сайт PstI подчеркнут) и AH-R4 (5'-CAGTCCCGGGCTCTCTTGCGCCTGC-3': (SEQ ID NO: 37); сайт XmaI подчеркнут) для ПЦР с использованием искусственной последовательности гена SEQ ID NO: 35 в качестве матрицы.
SEQ ID NO: 38 представляет собой последовательность искусственного гена, полученного на основании аминокислотной последовательности области HA1 гемагглютинина вируса гриппа H5N1/Vietnam/1203/04 с использованием кодонов, часто используемых в клетках Sf9 и в клетках человека.
SEQ ID NO: 39 и 40 представляют собой последовательности праймеров VN-F1 (5'-CAGTCTGCAGGACCAGATCTGTATC-3': (SEQ ID NO: 39); сайт PstI подчеркнут) и VN-R4 (5'-CAGTCCCGGGCTCTCTTCTTCCTGC-3': (SEQ ID NO: 40); сайт XmaI подчеркнут) для ПЦР с использованием искусственной последовательности гена SEQ ID NO: 38 в качестве матрицы.
SEQ ID NO: 41, 42, 43, 44 и 12 представляют собой последовательности праймеров gp64(51)-f (5'-GACTCCCCGGGTGGAAATCACCATCGTGGAGACG-3': (SEQ ID NO: 41); сайт XmaI подчеркнут), gp64(101)-f (5'-GACTCCCCGGGATTTGCTTATGTGGAGCATCAGG-3': (SEQ ID NO: 42); сайт XmaI подчеркнут), gp64(154)-f (5'-GACTCCCCGGGCGCACCACACGTGCAACAAATCG-3': (SEQ ID NO: 43); сайт XmaI подчеркнут), gp64(201)-f (5'-GACTCCCCGGGACACTGTGCTTCATCGAGACGGC-3': (SEQ ID NO: 44); сайт XmaI подчеркнут) и GP64-r DraIII (5'-GGGCACTTAGTGATATTGTCTATTACGGTTTCTAATC-3' (SEQ ID NO: 12); сайт DraIII подчеркнут).
SEQ ID NO: 45 представляет собой последовательность искусственного гена, полученного на основании аминокислотной последовательности области HA1 гемагглютинина вируса гриппа H5N1/Anhui/1/05 при оптимизации кодонов с использованием программы Gene Designer, доступной из DNA2.0, Inc.
SEQ ID NO: 46, 47, 48, 49 и 50 представляют собой последовательности AH17-F (5'-GACTCTGCAGGATCAGATCTGTATTGGGTACC-3':(SEQ ID NO: 46); сайт PstI подчеркнут и AH345-R (5'-CGATCCCGGGCTCTCTTTCTCCTCCGCTCGC-3': (SEQ ID NO: 47); сайт XmaI подчеркнут), AH410-R (5'-CGATCCCGGGCGGCCTCGAACTGGGTGTTCATT-3': (SEQ ID NO: 48); сайт XmaI подчеркнут), AH473-R (5'-CGATCCCGGGCGTCTCTGAGTTGAAGGCGCAC-3':(SEQ ID NO: 49); сайт XmaI подчеркнут, и AH520-R (5'-CGATCCCGGGCACCACTAATTTCCTCTCGCTTC-3':(SEQ ID NO: 50); сайт XmaI подчеркнут) для ПЦР с использованием искусственной последовательности гена SEQ ID NO: 45 в качестве матрицы.
SEQ ID NO: 51 представляет собой последовательность искусственного гена, полученного на основании аминокислотной последовательности области HA1 гемагглютинина вируса гриппа H5N1/Vietnam/1203/04 при оптимизации кодонов с использованием программы Gene Designer, доступной из DNA2.0, Inc.
SEQ ID NO: 52, 53, 54, 55 и 56 представляют собой последовательности праймеров VN17-F (5'-GACTCTGCAGGATCAGATCTGTATCGGATATC-3': (SEQ ID NO: 52); сайт PstI подчеркнут) и VN346-R (5'-CGATCCCGGGCCCGCTTTTTCCTCCTCCGTTCG-3': (SEQ ID NO: 53); сайт XmaI подчеркнут), VN410-R (5'-CGATCCCGGGCCTCAAACTGCGTATTCATTTTG-3': (SEQ ID NO: 54); сайт XmaI подчеркнут), VN473-R (5'-CGATCCCGGGCTCTAAGCTGGAGCCTGACTTTGTC-3': (SEQ ID NO: 55); сайт XmaI подчеркнут), и VN520-R (5'-CGATCCCGGGCACTAATCTCCTCTCTTTTAAGTC-3': (SEQ ID NO: 56); сайт XmaI подчеркнут) для ПЦР с использованием искусственной последовательности гена SEQ ID NO: 51 в качестве матрицы.
SEQ ID NO: 57 представляет собой последовательность искусственного гена, полученного на основании аминокислотной последовательности CSP штамма Plasmodium falciparum 3D7 при оптимизации кодонов с использованием программы Gene Designer, доступной из DNA2.0, Inc.
SEQ ID NO: 58, 59, 60, 61 и 62 представляют собой последовательности праймеров PfCSP_opt-f (5'-GACTCTGCAGATGATGCGAAAATTGGCCATACTG-3':(SEQ ID NO: 58); сайт PstI подчеркнут), PfCSP_opt-r (397) (5'-CGATCCCGGGCATTGAGGAACAGAAAGGAAAGAACCATG-3': (SEQ ID NO: 59); сайт XmaI подчеркнут), PfCSP_opt-f (19) (5'-GACTCTGCAGCTGTTTCAGGAATACCAGTGCTATGG-3': (SEQ ID NO: 60); (сайт PstI подчеркнут), PfCSP_opt-r(373) (5'-CGATCCCGGGCCTTCTCCATCTTACAAATTTTCTTTTCAATATCATTAGC -3': (SEQ ID NO: 61); (сайт XmaI подчеркнут), PfCSP_opt-f (76) (5'-GACTCTGCAGGACGACGGAAATAATGAGGACAACG-3': (SEQ ID NO: 62); сайт PstI подчеркнут) и PfCSP_opt-f (205) (5'-GACTCTGCAGAATGCAAACCCAAATGCCAATCCAAACGC-3': (SEQ ID NO: 63); сайт PstI подчеркнут) для ПЦР с использованием искусственной последовательности гена SEQ ID NO: 57 в качестве матрицы.
SEQ ID NO: 64, 65, 66, и 67 представляют собой последовательности праймеров gp64-p-f (5'-GACTCGGACCGGCCAGATAAAAATAATCTTATCAATTAAG-3': (SEQ ID NO: 64); сайт RsrII подчеркнут), gp64-p-r (5'-CGATACTAGTAGCACTGAGGCTTCTTATATACCCG-3': (SEQ ID NO: 65); сайт SpeI подчеркнут), и vp39-p-f (5'-GACTCGGACCGCGTCGTACAAATCGAAATATTGTTGTG-3':(SEQ ID NO: 66); сайт RsrII подчеркнут), и vp39-p-r (5'-CGATACTAGTGTGATTGAGAAAGAAATCTCTTATTC-3': (SEQ ID NO: 67); сайт SpeI подчеркнут) для ПЦР с использованием геномной ДНК бакуловируса в качестве матрицы.
SEQ ID NO: 68 и 69 представляют собой последовательности праймеров VSV-G-f (5'-GACTCCCCGGGCGTTCGAACATCCTCACATTCAAG-3' (SEQ ID NO: 68); сайт XmaI подчеркнут) и VSV-G-r (5'-GACTCACTTAGTGCTTTCCAAGTCGGTTCATCTC-3': (SEQ ID NO: 69); сайт DraIII подчеркнут) для ПЦР с использованием pVSV-G в качестве матрицы.
Фармацевтическая композиция, являющаяся противомалярийной вакциной и содержащая в качестве активного агента рекомбинантный вирус ядерного полиэдроза Autographa californica (AcNPV) и, необязательно, фармацевтически приемлемый носитель, где рекомбинантный вирус AcNPV включает генную структуру, имеющую слитый ген из:(А) гена, кодирующего частичную аминокислотную последовательность SEQ ID No: 70 (белок циркумпорозоита Plasmodium falciparum; PfCSP), и(В) гена, кодирующего частичную аминокислотную последовательность, представленную в GenBank с номером доступа No. L22858 (белок вирусных частиц gp64),под контролем двойного промотора, включающего промотор полиэдрина и промотор CAG, связанные друг с другом (CAP); игде рекомбинантный вирус AcNPV выбран из группы, состоящей из:(1) рекомбинантного вируса AcNPV, который содержит ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 19-373 последовательности SEQ ID NO: 70 в качестве гена (А), и ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 21-512 последовательности, депонированной в GenBank под номером доступа No. L22858, в качестве гена (В) (AcNPV-CAP-PfCSP),(2) рекомбинантного вируса AcNPV, который содержит ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 19-373 последовательности SEQ ID NO: 70 в качестве гена (А), и ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 467-512 последовательности, депонированной в GenBank под номером доступа No. L22858, в качестве гена (В) (AcNPV-CAP-PfCSP/467),(3) рекомбинантного вируса AcNPV, который содержит ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 205-373 последовательности SEQ ID NO: 70 в качестве гена (А), и ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 21-512 последовательности, депонированной в GenBank под номером доступа No. L22858, в качестве гена (В) (AcNPV-САР-СО/205),(4) рекомбинантного вируса AcNPV, который содержит ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 76-373 последовательности SEQ ID NO: 70 в качестве гена (А), и ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 467-512 последовательности, депонированной в GenBank под номером доступа No.L22858, в качестве гена (В) (AcNPV-САР-СО/76/467),(5) рекомбинантного вируса AcNPV, который содержит ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 76-373 последовательности SEQ ID NO: 70 в качестве гена (А), и ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 21-512 последовательности, депонированной в GenBank под номером доступа No. L22858, в качестве гена (В) (AcNPV-САР-СО/76),(6) рекомбинантного вируса AcNPV, который содержит ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 1-397 последовательности SEQ ID NO: 70 в качестве гена (А), и ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 21-512 последовательности, депонированной в GenBank под номером доступа No. L22858, в качестве гена (В) (AcNPV-CAP-CO/full),(7) рекомбинантного вируса AcNPV, который содержит ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 205-373 последовательности SEQ ID NO: 70 в качестве гена (А), и ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 467-512 последовательности, депонированной в GenBank под номером доступа No. L22858, в качестве гена (В) (AcNPV-САР-СО/205/467),(8) рекомбинантного вируса AcNPV, который содержит ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 19-373 последовательности SEQ ID NO: 70 в качестве гена (А), и ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 467-512 последовательности, депонированной в GenBank под номером доступа No. L22858, в качестве гена (В) (AcNPV-САР-СО/19/467),(9) рекомбинантного вируса AcNPV, который содержит ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 19-373 последовательности SEQ ID NO: 70 в качестве гена (А), и ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 21-512 последовательности, депонированной в GenBank под номером доступа No. L22858, в качестве гена (В) (AcNPV-САР-СО/19),(10) рекомбинантного вируса AcNPV, который содержит ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 1-397 последовательности SEQ ID NO: 70 в качестве гена (А), и ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 467-512 последовательности, депонированной в GenBank под номером доступа No. L22858, в качестве гена (В) (AcNPV-CAP-CO/full/467),(11) рекомбинантного вируса AcNPV, который содержит ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 209-373 последовательности SEQ ID NO: 70 в качестве гена (А), и ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 467-512 последовательности, депонированной в GenBank под номером доступа No. L22858, в качестве гена (В) (AcNPV-CAP-PfCSP+209/467), и(12) рекомбинантного вируса AcNPV, который содержит ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 76-128 и 209-373 последовательности SEQ ID NO: 70 в качестве гена (А), и ген, кодирующий аминокислотную последовательность, состоящую из аминокислотных остатков 467-512 последовательности, депонированной в GenBank под номером доступа No. L22858, в качестве гена (В) (AcNPV-CAP-PfCSP+76/209/467).