Результат интеллектуальной деятельности: ПРИМЕНЕНИЕ ОТОБРАННЫХ МОЛОЧНОКИСЛЫХ БАКТЕРИЙ ДЛЯ УМЕНЬШЕНИЯ АТЕРОСКЛЕРОЗА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к определенным штаммам молочнокислых бактерий, отобранных по способности повышать активность гидролазы желчных кислот (BSH) и вследствие этого снижать уровень холестерина-ЛПНП сыворотки и одновременно уменьшать уровень провоспалительного цитокина фактора некроза опухоли-α (TNF-α) для профилактики и/или лечения атеросклероза и других сердечно-сосудистых заболеваний, к способу отбора таких штаммов и к продуктам, содержащим такие штаммы.
УРОВЕНЬ ТЕХНИКИ
Пробиотики
Было показано, что пробиотики оказывают благоприятное воздействие на здоровье (Gorbach, S.L. 2000. Probiotics and gastrointestinal health. Am. J. Gastroenterol. 95:S2-S4). Пробиотикам приписывается множество различных функций; однако механизмы, посредством которых достигаются эти эффекты, являются не до конца понятными. Эффекты включают повышение врожденного и приобретенного иммунитета (Gill, H.S., K.J. Rutherfurd, J. Prasad, and P.K Gopal. 2000. Enhancement of natural and acquired immunity by Lactobacillus rhamnosus (HN001), Lactobacillus acidophilus (HN017) and Bifidobacterium lactis (HN019). Br. J. Nutr. 83:167-176), повышенную продукцию противовоспалительного цитокина (IL-10) (Pessi, T., Y. Sutas, M. Hurme, and E. Isolauri. 2000. Interleukin-10 generation in atopic children following oral Lactobacillus rhamnosus GG. Clin. Exp. Allergy 30:1804-1808) и пониженную кишечную проницаемость (Madsen, K., A. Cornish, P. Soper, C. McKaigney, H. Jijon, C. Yachimec, J. Doyle, L. Jewell, and C. De Simone. 2001. Probiotic bacteria enhance marine and human intestinal epithelial barrier function. Gastroenterology 121:580-591). Различные штаммы Lactobacillus были в частности хорошо изучены как у животных, так и у человека. Они могут быть эффективны для профилактики и лечения диареи путешественников (Marteau, P.R., M. de Vrese, C.J. Cellier, and J. Schrezenmeir. 2001. Protection from gastrointestinal diseases with the use of probiotics. Am. J. Clin. Nutr. 73:430S-436S), реккурентной инфекции Clostridium difficile (Gorbach, S.L. 1987. Bacterial diarrhoea and its treatment. Lancet ii: 1378-1382), ротавируса (Szajewska, H., M. Kotowska, J.Z. Mrukowicz, M. Armanska, and W. Mikolajczyk. 2001. Efficacy of Lactobacillus GG (L. GG) in prevention of nosocomial diarrhea in infants. J. Pediatr. 138:361-365), и инфекции Helicobacter (Mukai, T., T. Asasaka, E. Sato, K. Mori, M. Matsumoto, and H Ohori. 2002. Inhibition of binding of Helicobacter pylori to the glycolipid receptors by probiotic Lactobacillus reuteri. FEMS Immunol. Med. Microbiol. 32:105-110). L. Reuteri, выделенная из тонкого кишечника мышей, ингибировала появление колита у мыши с трансгенно выключенным геном IL-10 (Madsen, K. L., J.S. Doyle, L.D. Jewell, M.M. Tavernini, and R.N. Fedorak. 1999. Lactobacillus species prevents colitis in interleukin 10 gene-deficient mice. Gastroenterology 116:1107-1114). Клиническое испытание со смесью пробиотиков показало значительное облегчение хронического резервуарного илеита (Gionchetti, P., F. Rizzello, A. Venturi, P. Brigidi, D. Matteuzzi, G. Bazzocchi, G. Poggioli, M. Miglioli, and M. Campieri. 2000. Oral bacteriotherapy as maintenance treatment in patients with chronic pouchitis: a double-blind, placebo-controlled trial. Gastroenterology 119:305-309).
Иммунные ответы (Th-1/Th2/TR)
Воспаление опосредовано внутриклеточными сигнальными белками, известными как цитокины, которые продуцируют макрофаги и дендритные клетки эпителия в ответ на антигенный стимул. При контакте между эпителием и антигеном антиген-презентируюшие клетки эпителия (включая дендритные клетки) передают сигнал наивным макрофагам, которые затем отвечают так называемым ответом типа Th-1, при котором макрофаги продуцируют провоспалительные цитокины, включая TNFα, IL-1, IL-6, IL-12. Эти цитокины, в свою очередь, стимулируют продукцию интерферона γ (IFNγ), который является ключевым медиатором воспаления, естественными клетками-киллерами, Т-клетками и другими клетками. Наивные макрофаги также могут отвечать на антигены ответом типа Th-2. Этот ответ суппрессируется посредством IFNγ. Эти клетки типа Th-2 продуцируют противовоспалительные цитокины, такие как IL-4, IL-5, IL-9 и IL-10.
Известно, что IL-10 ингибирует продукцию IFNγ и, таким образом, ослабляет иммунный ответ. Равновесие между клетками типов Th-1 и Th-2 и продукция ими соответствующих цитокинов определяет степень воспалительного ответа на конкретный антиген. Клетки типа Th-2 могут также стимулировать продукцию иммуноглобулинов посредством иммунной системы. Противовоспалительная активность в желудочно-кишечном тракте, где уровень TNFα понижен, коррелирует с активированными эпителиальными клетками (целостность выстилки стенки кишечника) и, таким образом, со снижением негативных эффектов, вызванных желудочно-кишечными патогенами и токсинами.
T-регуляторные клетки (TR) рассматриваются как неотъемлемый компонент иммунного ответа. Эти клетки в первую очередь возникают в точно регулируемом противомикробном иммунитете для максимального изменения опасной иммунной патологии (Powrie F, Maloy KJ. 2003. Regulating the regulators, Science 299 1030-1031). Было показано, что клетки TR продуцируют повышенные уровни противовоспалительного цитокина IL-10 (Smits, H.H., A. Engering, D. van der Kleij, E.C. de Jong, K. Schipper, T.M. van Capel, B.A.J. Zaat, M. Yazdanbakhsh, E.A. Wierenga, Y. van Kooyk, and L. Kapsenberg. 2005. Selective probiotic bacteria induce IL-10-producing regulatory T cells in vitro by modulating dendritic cell function through dendritic cell-specific intercellular adhesion molecule 3-grabbing nonintegrin. J Allergy Clin Immunol. 115:1260-1267). Факторы, контролирующие развитие и активацию клеток TR, должны обеспечить смещение равновесия либо в сторону активности клеток TR (для лечения аутоиммунных заболеваний и повышения выживаемости трансплантированных органов), либо от активности клеток TR (для усиления эффективности вакцинации и отторжения опухоли) (Walter J. Dobrogosz. Enhancement of human health with L. reuteri, A Probiotic, Immunobiotic and Immunoprobiotic. NUTRAfoods. 2005: 4(2/3) 15-28).
Иммуномодулирующие эффекты пробиотиков
Штамм GG (LGG) Lactobacillus rhamnosus является перспективным пробиотическим средством, демонстрирующим во множестве исследований способность заселять кишечник и модулировать ответ эпителия слизистой и иммунный ответ. LGG усиливает пролиферацию энтероцитов и размер ворсинок у моноассоциированных гнотобиотических крыс (Banasaz, M., E. Norm, R. Holma, and T. Midtvedt. 2002. Increased enterocyte production in gnotobiotic rats mono-associated with Lactobacillus rhamnosus GG. Appl Environ Microbiol. 68: 3031-3034). LGG также модулирует пролиферацию лимфоцитарных ответов ex vivo у мыши, следующих за пероральным введением (Kirjavainen, P.V., H.S. ElNezami, S.J. Salminen, J.T. Ahokas, and P.F. Wright. 1999. Effects of orally administered viable Lactobacillus rhamnosus GG and Propionibacterium freudenreichii subsp. shermanii JS on mouse lymphocyte proliferation. Clin Diagn Lab Immunol 6: 799-802) и L. paracasei изменяет модуляторные профили цитокинов CD4+ T-лимфоцитов (Von der Weid T., C. Bulliard, and E.J. Schiffrin.2001. Induction by a lactic acid bacterium of a population of CD4(+) T cells with low proliferative capacity that produce transforming growth factor beta and interleukin-10. Clin Diagn Lab Immunol 8: 695-701). Кроме адаптивных иммунных ответов LGG оказывает воздействия на врожденные иммунные ответы. LGG активирует ядерный фактор каппа B (NF-κB) и сигнальный трансдуктор и активатор транскрипции (STAT) путей прохождения сигналов в макрофагах человека (Miettinen, M., A. Lehtonen, I. Julkunen, and S. Matikainen. 2000. Lactobacilli and Streptococci activate NF-kappa B and STAT signaling pathways in human macrophages. J Immunol 164: 3733-3740), и L. rhamnosus стимулирует продукцию макрофагами интерлейкина-12 (IL-12) (Hessle, C, L.A. Hanson, and A.E. Wold. 1999. Lactobacilli from human gastrointestinal mucosa are strong stimulators of IL- 12 production. Clin Exp Immunol 116: 276-282). LGG также стимулирует продукцию иммуномодулирующих цитокинов, таких как IL-10, у детей (Pessi, T., Y. Sutas, M. Hurme, and E. Isolauri. 2000. Interleukin-10 generation in atopic children following oral Lactobacillus rhamnosus GG. Clin Exp Allergy 30: 1804-1808) и может регулировать провоспалительные ответы in vivo. Клетки-эффекторы врожденного иммунитета, такие как макрофаги, дендритные клетки и нейтрофилы, представляют собой первичные звенья большинства воспалительных ответов (Janeway, C.A., Jr. and R. Medzhitov. 2002. Innate immune recognition. Annu Rev Immunol 20: 197-216). Предположение, что врожденный иммунитет определяет направление как врожденного, так и адаптивных ответов на антигены как собственные, так и не собственные, подчеркивает роль врожденного иммунитета в регулировании воспаления.
Патентная заявка США № 20020019043 относится к лечению воспалительного заболевания пищеварительного тракта путем введения цитокин-продуцирующих грамположительных бактерий или штамма грамположительных бактерий, продуцирующих антагонист цитокина. В конкретных вариантах осуществления цитокин или антагонист цитокина выбирают из IL-10, растворимого рецептора TNF-α или другого антагониста TNF-α, антагониста IL-12, антагониста интерферона-гамма, антагониста IL-1 и других. В конкретных вариантах осуществления грамположительные бактерии создают способами генной инженерии для продукции цитокина, антагониста цитокина и так далее.
Иммуномодулирующие эффекты L. reuteri
Иммуномодулирующие эффекты L. reuteri были описаны, например, Christensen, который показал, что пробиотические лактобациллы оказывали свои иммуномодулирующие эффекты посредством модулирования Th1/Th2/Th3/Tr1/TR-активирующей способности дендритных клеток (DC) (Christensen H.R., H. Frokiaer, and J.J. Pestka. 2002. Lactobacilli differentially modulate expression of cytokines and maturation surface markers in murine dendritic cells. J. Immunol. 168: 171-178). Авторы показали, что, если DC мышей подвергнуть совместному культивированию с различными штаммами Lactobacillus, включая штаммы L. reuteri, то они избирательно модулируют продукцию цитокинов IL-6, IL-10, IL-12 и TNF-a и повышают регуляцию MHC класса II и поверхностных маркеров CD86 зависимым от концентрации способом. Все лактобациллы активировали поверхностные MHC класса II и CD86 маркеры, являющиеся индикаторными для созревания DC. Особенно значительным в данных исследованиях было то, что L. reuteri (штамм 12246) являлся слабым индуктором IL-12, но при совместном культивировании с L. johnsonii или L. casei он избирательно ингибировал продукцию провоспалительных сигнальных цитокинов IL-12, IL-6 и TNF-α, стимулированных последним из двух видов. В этих условиях продукция IL-10 сохранялась неизменной. Эти данные привели к выводам, что L. reuteri могут способствовать вызванной окружающей средой модуляции генерации кишечных дендритных клеток, что способствует усилению резистентности против антигенов, не несущих 'сигнала опасности' при одновременном сохранении способности отвечать на патогенные микроорганизмы, распознаваемые через сигнал опасности, подобный LPS.' Авторы также заключили, что несколько штаммов L. reuteri могут являться перспективным для точно нацеленного лечения, эффективным в отношении подавления продукции IL-12 и TNF-α (и IL-6), включая при этом противовоспалительный IL-10, представляя, таким образом, альтернативный терапевтический способ нейтрализовать провоспалительную кишечную цитокиновую среду.
Smits расширил указанные наблюдения и показал, что L. reuteri способны направлять DC, на стимуляцию продукции T регуляторных клеток (TR). Они использовали три различных вида Lactobacillus, культивированных совместно in vitro с DC человека, производными моноцитов. Две лактобациллы, штамм L. reuteri человека (ATCC 53609) и L. casei, но не штамм L. plantarum, направляли DC, на стимуляцию развития TR клеток. Было показано, что указанные TR клетки продуцируют повышенные уровни IL-10 и могут ингибировать пролиферацию «фоновых» T-клеток в зависимости от IL-10 (Smits, H.H., A. Engering, D. van der Kleij, E.C. de Jong, K. Schipper, T.M.M. van Capel B.A.J. Zaat, M. Yazdanbakhsh, E. A. Wierenga, Y. van Kooyk, and L. Kapsenberg. 2005. Selective probiotic bacteria induce IL-10-producing regulatory T cells in vitro by modulating dendritic cell function through dendritic cell-specific intercellular adhesion molecule 3-grabbing nonintegrin. J Allergy Clin Immunol. 115:1260-1267). Данные исследования взаимодействий L. reuteri-DC рассматриваются в связи с новаторскими исследованиями Hori (Hori S, T. Nomura, and S. Sakaguchi. 2003. Control of regulatory T cell development by the transcription factor Foxp3. Science. 299:1057-1061), а Pasare и Medzhitov (Pasare C. and R. Medzhitov. 2003. Toll pathway-dependent blockade of CD4+Cd25+ T cell-mediated suppression by dendritic cells. Science 299:1033- 1036) предоставили ценные достоверные данные в один из иммунобиотических способов воздействия L. reuteri.
Фактор роста нервов (NGF), кроме своего воздействия на рост нервных клеток, имеет значительные противовоспалительные эффекты в ряде экспериментальных систем in vitro и in vivo, включая модель колита. Ma с соавторами (2004) исследовали механизм действия L. reuteri в эпителиальных клеточных линиях человека на синтез цитокина и NGF и ответ IL-8 на TNF-α. Они заключили, что L. reuteri оказывает мощное прямое противовоспалительное воздействие на эпителиальные клетки человека, которое, похоже, должно относиться к действию принятых внутрь пробиотиков. Они также заключили, что L. reuteri активирует особую противовоспалительную молекулу, NGF, и ингибирует транслокацию NF-κB в ядро (Ma, D., P. Forsythe, and J. Bienenstock. 2004. Live L. reuteri is essential for the inhibitory effect on tumor necrosis factor alpha-induced interleukin-8 expression. Infect. Immun. 72:5308-5314).
Штаммы широкого спектра видов Lactobacillus, включая L. reuteri, использовали в пробиотических композициях. Lactobacillus reuteri представляет собой один из природных организмов желудочно-кишечного тракта животных, и он обнаруживается в кишечнике здоровых животных, включая человека. Известно, что этот организм имеет противомикробное действие. См., например, патенты США № 5439678, 5458875, 5534253, 5837238 и 5849289. Если клетки L. reuteri растут в анаэробных условиях в присутствии глицерина, то они продуцируют противомикробное вещество, известное, как β-гидроксипропиональдегид (3-HPA).
Атеросклероз
Атеросклероз и его сердечно-сосудистые последствия являются ведущей причиной смертности и заболеваемости в Соединенных Штатах и в других странах. Название атеросклероз происходит от греческих слов "жидкая каша" или "вязкое" и "затвердение", и это заболевание определяют как наличие атером или участков повреждений, на внутренних стенках артерий. Участки повреждения, также известные как бляшки, состоят из жировых отложений и других веществ.
Что делает атеросклероз особенно опасным, так это то, что он, вероятно, имеет тенденцию поражать крупные важные артерии. Когда частицы участка повреждения, заполненного бляшками, отрываются от внутренней стенки артерий, то жировой материал устремляется в низлежащие артерии меньшего калибра, которые непосредственно кровоснабжают сердце и головной мозг, где они застревают, мешая крови, богатой питательными веществами и кислородом, достигнуть эти жизненно важные органы. Если возникает полная блокада, результатом может быть инфаркт миокарда или инсульт (Little, W. C, M. Constantinescu, R.J. Applegate, M.A. Kutcher, M.T. Burrows, F.R. Kahl, and W.P. Santamore. Can coronary angiography predict the site of a subsequent myocardial infarction in patients with mild-to-moderate coronary artery disease? Circulation.1988. 78:1157-66). Обычно атеросклероз считали нарушением метаболизма липидов. Факторы риска, связанные с атеросклерозом, включают высокие уровни ЛПНП, гомоцистеина в крови, гипертензию, курение сигарет, ожирение и диабет. Лечение было направлено на модулирование уровней холестерина, например, путем повышения метаболизма желчных солей с помощью определенных кисломолочных бактерий.
При оценке возможности использования молочнокислых бактерий (LAB) в качестве эффективных пробиотиков, многие считают необходимым оценить их способность LAB противостоять действию желчных кислот. Желчные кислоты синтезируются в печени из холестерина и выделяются из желчного пузыря в двенадцатиперстную кишку, конъюгированными с глицином или таурином. Их функцией является эмульгирование поступающих с пищей липидов. Наиболее распространенными первичными жирными кислотами у человека являются холевая и хенодезоксихолевая кислоты, которые представляют собой главные конечные продукты метаболизма холестерина в печени. В результате микробной активности в кишечнике данные кислоты затем подвергаются модификациям химической структуры, таким как деконъюгация и дегидроксилирование, где аминокислоты гидролизуются из конъюгированной формы (Cardona, M.E., V. de Vanay, T. Midtvedt, and K.E. Norin. Probiotics in gnotobiotic mice. Conversion of cholesterol to coprostanol in vitro and in vivo and bile acid deconjugation in vitro. Microb Ecol Health Dis. 2000. 12:219-224; Dunne, C., L. O'Mahony, L. Murphy, G. Thornton, D. Morrissey, S. O'Halloran, M. Feeney, S. Flynn, G. Fitzgerald, D. Daly, B. Kiely, G.C. O' Sullivan, F. Shanahan, and J.K. Collins. In vitro selection criteria for probiotic bacteria of human origin: correlation with in vivo findings. Am J Clin Nutr. 2001. 73 (suppl): 386S-392S). Некоторые желудочно-кишечные (GI) бактерии, например, Enterococcus, Bifidobacterium и Lactobacillus экспрессируют фермент гидролазу желчных кислот (BSH), который катализирует гидролиз конъюгированных желчных кислот, что приводит к образованию молекул свободного глицина или таурина и неконъюгированных желчных кислот (Tanaka, H., K. Doesburg, T. Iwasaki, and I. Mierau. Screening of lactic acid bacteria for bile salt hydrolase activity. J Dairy Sci. 1999. 82: 2530-2535; Bateup, J.M., M.A. McConnell, H. F. Jenkinson, and G.W. Tannock. Comparison of Lactobacillus strains with respect to bile salt hydrolase activity, colonization of the gastrointestinal tract, and growth rate of the murine host. Appl Environ Microbiol. 1995. 61(3): 1147-1149; Tannock, G.W., J.M. Bateup, and H.F. Jenkinson. Effect of sodium taurocholate on the in vitro growth of lactobacilli. Microb Ecol. 1997. 33: 163-167).
Имеются две главные гипотезы, касающиеся воздействия экспрессии BSH на функцию бактерий в желудочно-кишечном тракте. Одна гипотеза заключается в том, что некоторые бактерии деконъюгируют желчные кислоты для того, чтобы использовать аминокислоту таурин в качестве акцептора электронов, тогда как другая утверждает, что фермент понижает токсичность желчных кислот посредством деконъюгации, поскольку деконъюгированные формы являются менее растворимыми с пониженной детергентной активностью, тем самым защищая бактерии. Было обнаружено, что как конъюгированные, так и неконъюгированные желчные кислоты демонстрируют антибактериальную активность в отношении Escherichia coli, видов Klebsiella и видов Enterococcus in vitro, где деконъюгированные формы более выраженно ингибировали рост (Dunne, C., L. O'Mahony, L. Murphy, G. Thornton, D. Morrissey, S. O'Halloran, M. Feeney, S. Flynn, G. Fitzgerald, C. Daly, B. Kiely, G.C. O'Sullivan, F. Shanahan, and J.K. Collins. In vitro selection criteria for probiotic bacteria of human origin: correlation with in vivo findings. Am J Clin Nutr. 2001. 73 (suppl): 386S-392S; Moser, S.A. and D.C. Savage. Bile salt hydrolase activity and resistance to toxicity of conjugated bile salts are unrelated properties in lactobacilli. Appl Environ Microbiol. 2001. 67 (8): 3476-3480).
Выраженные холестерин понижающие действия ферментированных молочных продуктов можно объяснить связыванием холестерина с желчными кислотами и ингибированием мицеллообразования. Механизм, через который пробиотические бактерии в этих продуктах могут оказывать гипохолестеринемическое действие, представляет собой действие посредством желчных кислот, холевой и дезоксихолевой кислот, продуцируемых из холестерина посредством гепатоцитов. Они конъюгированы с глицином и таурином и поступают в тонкую кишку, где абсорбируются и направляются в печень. При реабсорбции конъюгированные желчные кислоты подвергаются воздействию микрофлоры тонкой кишки. Бактерии в ферментированных пищевых продуктах, например лактобациллы и стрептококки, гидролизируют конъюгированные желчные кислоты. Возможно, штамм Lactobacillus с высокой активностью гидролазы желчной соли кишечника повышает желчный гидролиз. Это может привести к более быстрой скорости преобразования холестерина и большей продукции желчных кислот. In vivo, уменьшение холестерина происходит благодаря экскреции желчной кислоты с калом, поскольку деконъюгированные желчные кислоты не реабсорбируются в толстой кишке. Это приводит к увеличению желчи de novo, чтобы сохранить пул желчи в организме постоянным (St-Onge M-P., E.R. Farnworth, and P.J.H. Jones. 2000. Consumption of fermented and nonfermented dairy products: effects on cholesterol concentrations and metabolism. Am J Clin Nutr. 71: 674-681).
Деконъюгация желчных кислот будет ниже уровней холестерина плазмы. Однако эти соединения могут быть затем преобразованы во вторичные желчные кислоты в толстой кишке посредством анаэробных бактерий, а вторичные желчные кислоты, как полагают, являются возможными индукторами рака толстой кишки. Вторичные желчные кислоты являются токсичными для клеточных линий и есть основания полагать, что они оказывают цитотоксическое действие на слизистую толстой кишки, что ведет к повышенной пролиферации клеток. Эти гиперпролиферирующие клетки имеют повышенную чувствительность к мутагенным веществам и тем самым повышают риск возникновения рака толстой кишки (Hepner, G., R. Fried, S. St. Jeor, L. Fusetti, and R. Morin. 1979. Hypercholesterolemic effect of yoghurt and milk. Am. J. Clin. Nutr. 32:19-24). К счастью, молочнокислые бактерии, по-видимому, понижают растворимость деконъюгированных желчных солей и вторичных желчных солей, тем самым понижая их биодоступность. Исследования De Boever с соавторами (2000) показали, что L.reuteri понижали токсичность желчной соли в бактериальных культурах. Более важно, добавление L. reuteri приводило к практически абсолютной устойчивости к лизису красных кровяных клеток и уменьшает токсическое действие желчных солей на клетки HeLa (De Boever, P., R. Wouters, L. Verschaeve, P. Berckmans, G. Schoeters, and W. Verstraete. Protective effect of the bile salt hydrolase-active Lactobacillus reuteri against bile salt cytotoxicity. Appl Microbiol Biotechnol. 2000. 53(6):709-14).
Атеорсклероз как иммунологическое заболевание.
Ученые описывают новую схему развития атеросклероза, полагая, что данная патология может быть следствием дисбаланса между провоспалительными Т-клетками и TR, уравновешивающими их. Это один из интересных научных результатов, который выяснился на конференции Second European Vascular Genomics Network Conference (EVGN Conference - Гамбург, 27-30 сентября 2005). Эти результаты дали новое понимание роли воспаления при развитии сердечных заболеваний и привели к созданию новых информационных моделей формирования тромба и процессов, ведущих к инфаркту миокарда.
Атеросклероз начинается с образования жировых прожилок в эндотелии, поскольку жиры в частицах ЛПНП раздражают эндотелиальные клетки, и включают клеточную инфильтрацию нескольких клеточных типов, включая моноциты и Т-лимфоциты. Моноциты взаимодействуют с эндотелиальным слоем, прочно прикрепляются к эндотелию и мигрируют в субэндотелиальное пространство, где они дифференцируют в макрофаги. Макрофаги высвобождают ряд химических веществ, включая цитокины. Стимулируется продукция факторов роста, что ведет к клеточной пролиферации и продукции матрикса, а также металлопротеиназ, что приводит к дегенерации матрикса. Таким образом, макрофаги усиливают повреждения и могут способствовать нестабильности и тромботическим осложнениям (Ross R. Atherosclerosis - An inflammatory disease. N Engl J Med. 1999. 340: 115-26). Было показано, что T-лимфоциты присутствуют на всех стадиях атеросклероза. Их присутствие обеспечивает дополнительное доказательство связи с иммунным ответом (KoI, A. and P. Libby. 1998. The mechanisms by which infectious agents may contribute to atherosclerosis and its clinical manifestations. Trends Cardiovasc Med. 8: 191-99; Andreotti, F., F. Burzotta, A. Mazza, A. Manzoli, K. Robinson, and A. Maseri. 1999. Homocysteine and arterial occlusive disease: a concise review. Cardiologia. 44:341-5).
Сигнал к началу продукции воспалительных веществ зависит от вовлечения рецепторов, называемых toll-подобными рецепторами, которые распознают некоторые эндогенные молекулы, активирующие воспалительные сигнальные пути (K. Edfeldt, J. Swedenborg, G.K. Hansson, and Z. Yan. 2002. Expression of Toll-Like Receptors in Human Atherosclerotic Lesions: A Possible Pathway for Plaque Activation Circulation. 105: 1158-1161).
Toll-подобные рецепторы (TLR) распознают микробные мотивы и активируют набор генов, что ведет к продукции цитокинов. Традиционно TLR рассматривались как сенсоры микробных инфекций, и их роль состоит в индукции воспалительного ответа. Однако повторы, распознаваемые TLR, не являются специфическими для патогенных микроорганизмов, а представляют собой основные повторы, имеющиеся у всех классов микроорганизмов, и не совсем понятно, как иммунная система устанавливает различие между коменсальными и патогенными бактериями посредством TLR. Данные, полученные в последнее время, показали, что TLR, несмотря на их роль в индукции воспалительного ответа, также играют роль в поддержании кишечного гомеостаза путем распознавания коменсальной микрофлоры (Rakoff-Nahoum, S., J. Paglino, F. Eslami- Varzaneh, S. Edberg and R. Medzhitov. 2004. Recognition of commensal microflora by toll-like receptors is required for intestinal homeostasis. Cell. 23; 118(2):229-41).
Установлено, что маркеры сыворотки воспаления представляют собой независимые факторы риска для сердечно-сосудистой заболеваемости и смертности. Маркеры воспаления, которые связывают с сердечно-сосудистыми эффектами, включают провоспалительные цитокины, такие как IL-6 и TNF-a, фибриноген и С-реактивный белок (CRP) (Libby, P., P.M. Ridker, and A. Maseri. 2001. Inflammation and atherosclerosis. Circulation. 2002.105:1135-1143; Ridker, P.M. High sensitivity C-reactive protein: potential adjunct for global risk assessment in the primary prevention of cardiovascular disease. Circulation. 103: 1813-1818).
Роль C. pneumonie и H. pylori в атеросклерозе
По накапливающимся материалам можно предположить, что атеросклероз является воспалительным заболеванием. Вследствие этого большое внимание в последнее время было сфокусировано на возможности того, что инфекционные агенты могут играть роль в этиологии сердечно-сосудистых заболеваний. Предположение касается определенных инфекционных агентов, основываясь на выделении их из атероматозных бляшек или на присутствии положительных серологических данных для организмов, таких как Chlamydia pneumoniae, Helicobacter pylori, вирус простого герпеса и цитомегаловирус.
Даже хотя перспективным исследованиям не хватает объективных данных, C. pneumoniae, по-видимому, проявляют сильнейшую связь с атеросклерозом. C. pneumoniae была выделена из аутопсий и образцов иссеченных атеросклеротических поражений как из ранних, так и хорошо развитыми поражений. При исследовании посредством иммунологической цитохимии и окрашивания тканей, взаимосвязь была обнаружена в 70-100% случаев. Возможные механизмы, посредством которых инфекционные агенты оказывают свое действие, могут включать (i) местные воздействия на эндотелий, гладкомышечные клетки или макрофаги или (ii) системные действия путем выработки цитокинов, стимуляции моноцитов и активации гиперкоагуляции.
Общепринятое лечение для снижения уровней холестерина
За многие годы было выявлено, что повышенная концентрация холестерина в сыворотке является фактором риска, связанным с атеросклерозом и ишемической болезнью сердца, позднее являющимся основной причиной смерти в Западных странах (Barr, D.P., A.M. Russ, and H. A. Eder. 1951. Protein-lipid relationship in human plasma. II. In atherosclerosis and related conditions. Am. J. Med. 11:480-493). Многочисленные лекарственные препараты, снижающие холестерин, включая ингибиторы 3-гидрокси-метилглютарил-коэнзим А-редуктазы, и лекарственные препараты, повышающие суммарную экскрецию желчных кислот, используются для лечения больных с гипохолестеринемией (HC) (Suckling, K.E., G.M. Benson, B. Bond, A. Gee, A. Glen, C. Haynes, and B. Jackson. 1991. Cholesterol lowering and bile acid excretion in the hamster with cholestyramine treatment. Atherosclerosis 89: 183-190).
Однако нежелательные побочные эффекты этих соединений вызывают вопросы об их терапевтическом применении (Erkelens, D.W., M.G.A. Baggen, J.J. Van Doormeal, M. Kettner, J.C. Koningsberger, and M.J.T.M. Mol. 1988. Clinical experience with simvastatin compared with cholestyramine. Drugs 39(Suppl.):87-90).
Молочнокислые бактерии в качестве лечения для снижения уровней холестерина
Кроме указанных терапевтических средств прием внутрь пробиотических молочнокислых бактерий, возможно, является более естественным способом уменьшить концентрации холестерина в сыворотке человека. Некоторые исследования сообщают об уменьшении холестерина в сыворотке при потреблении больших доз (от 680 до 5000 мл/Д) ферментированных молочных продуктов, но данные результаты не могут быть экстраполированы на более реальные условия потребления (Mann, G.V. 1977. A factor in yogurt which lowers cholesterolemia in man. Atherosclerosis 26:335-340; McNamara, D.J., A. M. Lowell, and J.E. Sabb. 1989. Effect of yogurt intake on plasma lipid and lipoprotein levels in normolipidemic males. Atherosclerosis 79:167-171).
Massey показал, что первоначально потребление йогурта значительно понижает холестерин на 10-12% у взрослых мужчин, но 2 недели спустя концентрации возвращаются к контрольным значениям даже при продолжении потреблении йогурта (Massey, L. 1984. Effect of changing milk and yoghurt consumption on human nutrient intake and serum lipoprotein. J. Dairy Sci. 67:255-262). Подобные противоречивые результаты были получены у экспериментальных животных, которых кормили молоком и его ферментированными продуктами (Hepner, G., R.S.T. Fried, S. Jeor, L. Fusetti, and R. Morin. 1979. Hypocholesterolemic effect of yogurt and milk. Am. J. Clin. Nutr. 32:19-24); Rao, D.R., C.B. Chawan, and S.R. Pulusani. 1981. Influence of milk and thermophilus milk on plasma cholesterol levels and hepatic cholesterogenesis in rats. J. Food Sci.46:1339-1341). Rao сообщал о действии HC у крыс, которых кормили молоком, ферментированным Streptococcus thermophilus (Rao, D.R., C.B. Chawan, and S.R. Pulusani. 1981. Influence of milk and thermophilus milk on plasma cholesterol levels and hepatic cholesterogenesis in rats. J. Food Sci. 46:1339-1341). Rodas обнаружил подобное действие у HC свиней, которых кормили Lactobacillus acidophilus (Rodas, B.Z., S.E. Gilliland, and C.V. Maxwell. 1996. Hypocholesterolemic action of Lactobacillus acidophilus ATCC 43121 and calcium in swine with hypercholesterolemia induced by diet. J. Dairy Sci. 79:2121-2128).
В исследовании, изучающем действие L. reuteri CRL 1098 на общий холестерин, триглицериды и соотношение липопротеинов высокой плотности (ПЛВП) к липопротеинам низкой плотности (ЛПНП) в сыворотке мышей, которых предварительно кормили пищей, обогащенной жиром, L. reuteri вызывала 40%-ное снижение триглицеридов и 20%-ное увеличение соотношения липопротеинов высокой плотности к липопротеинам низкой плотности без транслокации бактерий естественной микрофлоры в селезенку и печень (Taranto, M.P., F. Sesma, A.P. Ruiz Holgado, and G.F. Valdez. 1997. Bile salts hydrolase plays a key role on cholesterol removal by Lactobacillus reuteri. Biotechnol. Lett. 9:245-247). Эти данные предполагают, что L. reuteri CRL 1098 является эффективным гипохолестеринемическим препаратом при низкой концентрации клеток для мышей. Но в отличие от раскрытия изобретения в данной заявке, снижение холестерина происходило только благодаря активности BSH, а не благодаря комбинации активности BSH и иммунорегулирующих воздействий.
Молочнокислые бактерии в качестве лечения для понижения уровней холестерина, иммунорегуляторный путь
Патентная заявка США № 20050169901 относится к способам регуляции уровней и активности цитокинов, для диагностики, профилактики и лечения сердечно-сосудистых нарушений. Регуляция цитокина представляет собой изменение профиля цитокинов с Th2 на Th1 в противоположность изобретению данной заявки, где изменение происходит, предпочтительно, от профиля цитокинов Th1 в сторону снижения продукции TNF-α. В качестве пробиотика заявители упоминают некоторые различные виды и штаммы бактерий, в противоположность изобретению настоящей заявки, где пробиотиком является особый штамм молочнокислых бактерий, отобранный по эффективности понижения уровней TNF-α и одновременно повышения активности BSH.
Bukowska показала, что у пациентов с гиперхолестеринемией, обогащение рациона пробиотическими бактериями Lactobacillus plantarum 299v значительно понижает концентрации холестерина ЛПНП и фибриногена (Bukowska H., J. Pieczul-Mrόz, M. Jastrzebska, K. Chelstowski, and M. Naruszewicz. 1997. Decrease in fibrinogen and LDL-cholesterol levels upon supplementation of diet with Lactobacillus plantarum in subjects with moderately elevated cholesterol. Atherosclerosis. 137:437-8). Это также описано в патенте США № 6214336. Та же группа показала, что обогащение рациона L. plantarum может способствовать профилактике и лечению метаболических нарушений у курящих. Полагают, что данное положительное действие напрямую связано с продукцией пропионовой кислоты посредством бактериальной ферментации волокон. Авторы предполагают, что пропионовая кислота оказывает специфическое противовоспалительное действие через неизвестный до настоящего времени механизм, возможно, относящийся к активации ибупрофеном рецептора активатора пролиферации пероксисом, который модулирует ядерную транскрипцию фактора B и снижает продуцирование воспалительных цитокинов моноцитами-макрофагами (M. Naruszewicz, M-L Johansson, D. Zapolska-Downar, and H. Bukowska, Effect of Lactobacillus plantarum 299v on cardiovascular disease risk factors in smokers. Am. J. Clinical Nutrition. 2002. 76:1249-1255).
В противоположность изобретению настоящей заявки вышеупомянутые ссылки не описывают штаммы, способные как повышать активность BSH, и в то же время понижать уровни TNF-α.
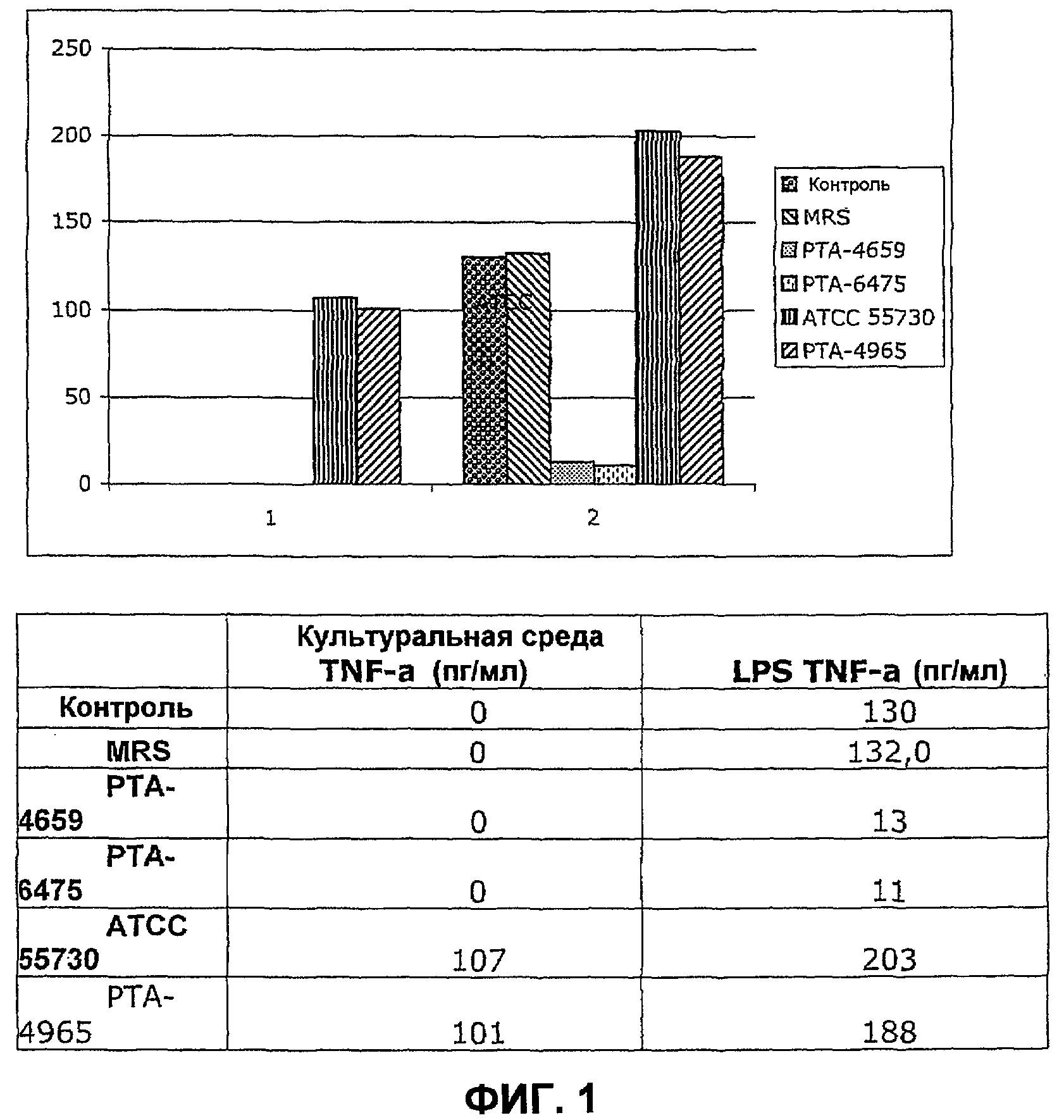
Как упомянуто выше, в течение многих лет было хорошо известно, что повышенная активность BSH снижает уровни холестерина сыворотки и, как следствие, понижает риск атеросклероза. Предварительно также было продемонстрировано, что атеросклероз представляет собой воспалительное заболевание, и была предложена регуляция различных цитокинов, чтобы остановить развитие данного заболевания. Учитывая данные результаты, были отобраны непатогенные штаммы бактерий как для снижения BSH, так и для иммунорегуляторных целей. Неожиданно было обнаружено, что некоторые из штаммов, которые вызывают повышение активности BSH, одновременно понижают уровни провоспалительного цитокина TNF-α, фиг.1. Вследствие этого изобретение относится к применению, например, L. reuteri ATCC-PTA4659, L. reuteri ATCC-6475 или L. coryniformis ATCC-PTA4660 и других штаммов, отобранных таким же путем, и их смесей для получения продукта для профилактики и/или лечения атеросклероза и других сердечно-сосудистых заболеваний.
Вследствие этого целью данного изобретения является получение штаммов молочнокислых бактерий, отобранные по их способности понижать холестерин-ЛПНП сыворотки и понижать уровни провоспалительного цитокина TNF-α. Другие цели и преимущества станут более понятны из нижеприведенного описания и приложенной формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 представляет собой столбчатую диаграмму, показывающую действие кондиционированной среды Lactobacillus на продукцию TNF-α LPS-активированными моноцитами. Штаммы и контрольные группы инкубировали 24 часа.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к определенным штаммам молочнокислых бактерий, отобранных по их способности повышать активность BSH и, как следствие, понижать холестерин-ЛПНП сыворотки и одновременно понижать уровни провоспалительного цитокина TNF-α, для профилактики и/или лечения атеросклероза и других сердечно-сосудистых заболеваний, к способу отбора таких штаммов и к продуктам, содержащим такие штаммы.
Другие цели и признаки изобретений станут более понятны из нижеприведенного подробного описания и приложенной формулы изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ И
ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ЕГО ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к штаммам молочнокислых бактерий, которые были отобраны по их способности уменьшать воспаление и повышать активность BSH, например, при атеросклерозе. Такие штаммы включают Lactobacillus reuteri ATCC- PTA4659, которые были депонированы в Американской Коллекции Типовых Культур, 10801 University Blvd, Manassas, VA, 11 сентября 2002 года на основании Будапештского Соглашения. Lactobacillus reuteri ATCC-PTA6475 был депонирован в ATCC 21 декабря 2004 года. Все ограничения по возможности свободного использования данных штаммов будут безоговорочно устранены после выдачи патента. Продукты, такие как продукты питания, пищевые добавки и готовые формы, фармацевтические или медицинские устройства, содержащие целые клетки или компоненты, полученные из этих штаммов, такие как компоненты, имеющие такую же способность, которая присутствует в бесклеточной культуре этих штаммов, могут быть составлены как известно в данной области, например капсула твердого желатина с замороженной высушенной культурой штамма Lactobacillus или их производных компонентов. Также смеси штаммов, упомянутых в данной заявке, и целых клеток или их компонентов находятся в пределах объема правовых притязаний данного изобретения.
Штаммы, отобранные в примере 3, например L. reuteri ATCC PTA-6475, был добавлен в обычный йогурт. Штамм L. reuteri ATCC PTA-6475 выращивали и лиофилизировали с использованием стандартных способов выращивания Lactobacillus в молочной промышленности. Эту культуру затем добавляли в предварительно ферментированное молоко с использованием стандартных йогуртовых культур, на уровне 10E+6 КОЕ/грамм йогурта, и йогурт использовали для профилактики атеросклероза у людей. Другие принимаемые внутрь вспомогательные материалы, за исключением йогурта, могут представлять собой, например, молоко, творог, кисломолочные продукты, основанные на молоке ферментированные продукты, ферментированные зерновые продукты, порошки, основанные на молоке.
Для определения факторов, которые снижают или уменьшают воспаление, используют модельные системы с соответствующими цитокинами. В изобретении, раскрытом в настоящей заявке, использовано испытание, основанное на клетках человека.
Клетки THP-1 представляют собой моноцитарную клеточную линию человека, полученную у больных с лейкозом, и которые хранятся в Американской Коллекции Типовых Культур (ATCC No TIB202). Источник этих клеток от хозяина человека делает их особенно подходящими для изучаемых взаимодействий кишечной иммунной системы человека с коменсальными бактериями человека.
Данные в изобретении показывают мощное ингибирование продукции TNF-α конкретными штаммами L. reuteri ATCC PTA-4659 и L. reuteri ATCC PTA-6475 и что данная регуляция опосредована веществом, высвобождаемым в среду для выращивания данными двумя конкретными штаммами во время поздней логарифмической/стационарной фазы роста. И наоборот, два других штамма L. reuteri, были не только не способны ингибировать воспалительный ответ клеток на токсин E. coli, но также индуцировали их воспалительный ответ.
Прямой чашечный метод с плотной средой, выбранной de Man, Rogosa и Sharpe (MRS), содержащей желчные соли, применяли для скриннинга штаммов, выделяющих гидролазу желчных солей и определяющих специфическую активность ферментов для их субстрата. Рост бактерий, продуцирующих BSH, дает рост гидролиза и окисление среды. Гидролиз появляется в виде образования кольца осажденных свободных желчных солей вокруг колоний (Dashkevicz, M.P. and S.D. Feighner. 1989. Development of a differential medium for bile salt hydrolase-active Lactobacillus spp. Appl Environ Microbiol. 55 (1): 11-16).
Признаки настоящего изобретения будут более понятны посредством ссылки на следующие примеры, которые не должны быть истолкованы как ограничивающие изобретение.
Пример 1
Оценка штаммов, имеющих способность понижения уровней TNF-α
Клетки THP-1 инкубировали вместе либо с контрольной средой или кондиционированной средой (L-CM) для выращивания отобранных штаммов L. reuteri, L. reuteri ATCC PTA-4659, L. reuteri ATCC PTA-4975, L. reuteri ATCC 55730 и штамма L. reuteri PTA-4965. Кондиционированная среда (L-CM) представляет собой бесклеточные супернатанты из 9-часовой или 24-часовой культур каждой из культур L. reuteri. Клетки THP-1 стимулировали либо контрольной средой, либо LPS, выработанной E. coli (которая ведет к выработке TNFα в нормальном воспалительном ответе) в процессе 3,5-часовой инкубации, после которой клетки извлекли, а супернатанты исследовали на уровни TNFα с применением методики ELISA.
Материалы:
Лейкемическая моноцитарная клеточная линия THP-1 (ATCC, каталоговый номер TIB202)
Среда RPMI 1640 (Gibco-Invitrogen)
Фетальная бычья сыворотка (Gibco-Invitrogen)
Пенициллин-стрептомициновый раствор (Sigma)
Липополисахарид E. coli серотипа О127:B8 (Sigma, каталоговый номер L3137)
TNF-alph/TNF-SFII человека DuoSet ELISA средство разработки (R&D Systems, каталоговый номер DY210)
IL-10 человека DuoSet, 2-е средство формирования (R&D Systems, каталоговый номер DY217)
Метод:
Использовали моноцитарную клеточную линию THP-1. 5% (об/об) среды MRS и 5% (об/об) кондиционированной среды Lactobacillus добавили в соответствующие лунки. Кондиционированная среда Lactobacillus представляла собой супернатант из 24-часовой культуры видов Lactobacillus в среде MRS. Затем кондиционированную среду регулировали по pH посредством скоростной вакуумной сушки и пеллет ресуспендировали в равном объеме культуральной среды. Хотя увлажнительная камера сконструирована так, чтобы минимизировать испарение жидкости, после 48 часов инкубирования, объем клеточной суспензии в 24-луночных планшетах уменьшился до, приблизительно, 475 мкл.
100 нг/мл липополисахарида E. coli серотипа O127:B8 добавили в соответствующие лунки, которые инкубировали в 37°C, увлажненной, 5% CO2 камере.
После 3,5 часов инкубирования, культуры собирали в 1,5 мл центрифужные пробирки и центрифугировали при 1500 RCF в течение 5 минут при 4°C. Супернатант собирали.
Экспрессию цитокина тестировали посредством ELISA (Quantikine TNF-alph/TNF-SFII human DuoSet).
Используемая культуральная среда составляла 10% FBS, 2% пенициллин-стрептомицин в RPMI-растворе 1640.
Результаты - пример 1
Добавление LPS к клеткам THP-1 в отсутствие L-CM привело к выработке 130 пг/мл TNFα в процессе 3,5-часового инкубационного периода. Это является ожидаемым воспалительным ответом клеток THP-1 на токсин. Добавление среды для роста (MRS), которая выступает как контроль для добавлений L-CM, привело к выработке 132 пг/мл TNFα, и, таким образом, MRS не препятствовало ответу на LPS. Добавление 24-часовой L-CM из L. reuteri ATCC PTA 4659 или L. reuteri ATCC PTA 6475 существенно уменьшало уровни LPS стимулированной TNFα, лишь до 13 и 11 пг/мл соответственно. Это отображает ингибирование LPS-стимулированного продуцирования TNFα, равное 90 и 93% соответственно.
И наоборот, в присутствии 24-часовой L-CM из L. reuteri ATCC 55730 и штамма L. reuteri PTA-4965, LPS оставалась все еще способной вызывать значительное повышение TNF-α по сравнению с уровнями в отсутствии LPS. LPS-стимулированное продуцирование TNF-α увеличивалось на 54% и 42% несмотря на присутствие L-CM из L. reuteri ATCC 55730 и штамма L. reuteri ATCC PTA-4965, соответственно (фиг.1).
Подобные эксперименты, проведенные с 9-часовой L-CM из L. reuteri ATCC PTA 4659 или L. reuteri ATCC PTA 6475, продемонстрировали, что ингибирующее воздействие на LPS-стимулированное продуцирование TNFα было значительно меньше, но все еще присутствовало. Таким образом, более длительные периоды инкубирования штаммов L. reuteri с изъятием L-CM в конце логарифмической/стационарной фазы роста, приводят к повышению эффективности в ингибировании продуцирования TNF-α.
Пример 2
Прямой чашечный метод - оценка штаммов с внеклеточной активностью BSH
Штаммы молочнокислых бактерий человека выращивали в условиях с ограничением кислорода при 37°C в бульоне MRS (Acumedia Manufacturers, Inc. Baltimore, Maryland) в течение ночи, и инокулировали в несущую лактобациллы среду (LCM) с 10% глицерином (BDH Laboratory Supplies, England).
|
Исходные культуры хранили при -80°C для дальнейшего применения. Штаммы были получены из BioGaia AB laboratories и коллекций штаммов в Lund (Sweden), Raleigh (NC, United States of America) и Lantbruksuniversitetet (University of Agriculture), Uppsala (Sweden).
Для скрининга внеклеточной BSH активности штаммы выращенных за ночь культур засеяли штрихом на планшеты с MRS-цистеиновым (MRS-c) агаром (Acumedia), содержащие 3 мМ желчных солей, GDCA (Sigma, Steinheim, Germany), TDCA (Sigma), GCA (Sigma), и TCA (Fluka, Sigma-Aldrich, Germany), соответственно. Планшеты анаэробно инкубировали (AnaeroGen, Oxoid, UK) в течение 48 часов при 37°C. Преципитация, которая является результатом деконъюгации желчной кислоты, была оценена визуально, и, таким образом, субъективно, отсюда активность значится как отсутствие активности (-) или активность (+). Планшеты с агаром MRS-ц без добавления желчной соли использовали в качестве контроля роста и негативного контроля.
Пример 3
Отбор штаммов с активностью BSH и способностью одновременно понижать уровни TNF-α
|
Данные таблицы выше подтверждают неожиданные данные, что различные штаммы L. reuteri имеют различные воздействия на продуцирование TNF-α и BSH, и что штаммы L. reuteri ATCC PTA-4659 и L. reuteri ATCC PTA-6475 являются особенно подходящими для применения при атеросклерозе.
Пример 4
Применение кондиционированной среды
Применяя способ примера 1, была отобрана кондиционированная среда от одного эффективно понижающего TNF-α штамма, в данном примере среда от L. reuteri ATCC PTA-4659. Данную среду получали в больших объемах посредством выращивания штамма в среде de Man, Rogosa, Sharpe (MRS) (Difco, Sparks, MD). Выращенные за ночь культуры лактобацилл разводили до OD600, равного 1,0 (соответствующий приблизительно 109 клеток/мл), и дополнительно разводили 1:10 и выращивали в течение дополнительных 24 ч. Бактериальную бесклеточную кондиционированную среду собирали посредством центрифугирования при 8500 об/мин в течение 10 мин при 4°C. Кондиционированную среду отделяли от клеточного осадка, а затем фильтровали через фильтровальную установку с порами 0,22 мкм (Millipore, Bedford, Mass.). Затем кондиционированную среду лиофилизировали и обрабатывали, с использованием стандартных способов, чтобы получить таблетку. Данную таблетку применяли в качестве лекарственного препарата у людей для эффективного лечения атеросклероза.
Пример 5
Применение отобранных противовоспалительных штаммов Lactobacillus reuteri
Применяя способы из примера 1 и 2, был отобран один штамм, эффективно снижающий TNF-α и в то же время повышающий активность BSH, в данном эксперименте L. reuteri ATCC PTA-4659. Штамм L. reuteri затем лиофилизировали и обрабатывали, с использованием стандартных способов, чтобы получить капсулу, в диапазоне равном 105-109 КОЕ. Данную капсулу применяли в качестве лекарственного препарата у людей для эффективного уменьшения выраженности атеросклероза.
Пример 6
Lactobacillus reuteri, уменьшающие бляшки сонной артерии при атеросклерозе
Всего 1059 пациентов было подвергнуто достоверным ультразвуковым исследованиям на исходном исследовании с повторением через один год. На исходном исследовании и в последующем применялись одна и та же ультразвуковая система визуализации изображений и датчик (Acuson Xp10 128, ART, прошедший апгрейд, с 7,5-МГц ультразвуковым датчиком для линейного сканирования, размер апертуры 38 мм, SIEMENS). Параметры регулировки изображения в режиме В предварительно устанавливают для фиксированных значений и не изменяют в ходе проведения каждого обследования. У обследуемого в положении лежа на спине, с головой, повернутой немного влево, сканировали правую сонную артерию под несколькими разными углами облучения как вдоль, так и поперек, от непосредственно над ключицей до как можно дистальнее до бифуркации. Бляшку определяли как локальное выпячивание стенки сосуда в полость, равное, по меньшей мере, 50%, по сравнению с толщиной прилежащих интимы-медии (IMT). У каждого обследуемого индивида регистрировали максимальную из 6 бляшек в ближней и дальней стенках общей сонной артерии, бифуркации и внутренней сонной артерии, соответственно. Для каждой бляшки датчиком записывали неподвижное изображение параллельно стенке сосуда и наиболее перпендикулярно к точке максимальной толщины бляшки с выбранной установкой области расширения до 38 мм × 20 мм. Все регистрационные записи сделаны на видеоплэйере Panasonic 7650 высококачественной видеозаписью системы VHS.
На исходном исследовании 1059 человек имеют наличие бляшек (таблица 1). Площадь бляшек сонной артерии снижалась в любом возрасте. Средняя общая площадь бляшек (SE) на исходном исследовании составляет 24,1 мм2. В последующем периоде после потребления ежедневной дозы L. Reuteri ATCC PTA-4659 (108 КОЕ) все пациенты имеют снижение общей площади бляшек. Среднее снижение составляет 9,0 мм2.
|
Несмотря на то, что изобретение было описано со ссылкой на конкретные варианты осуществления, должны быть понятно, возможны многие варианты, модификации и варианты осуществления, и, соответственно, все такие варианты, модификации и варианты осуществления должны рассматриваться в пределах сущности и объема правовых притязаний изобретения.