ПРИМЕНЕНИЕ 2,4-ПИРИМИДИНДИАМИНОВ ДЛЯ ЛЕЧЕНИЯ АТЕРОСКЛЕРОЗА
Вид РИД
Изобретение
А. ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в основном относится к области фармацевтического лечения атеросклероза и ассоциированного с ним риска возникновения сердечно-сосудистых заболеваний.
Б. ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Сердечно-сосудистые заболевания, главным образом, сердечные заболевания и удар, являются причиной смерти приблизительно одного миллиона американцев ежегодно, что делает их основной причиной смертности в Соединенных Штатах. Повышенный уровень холестерина в крови давно известен как фактор риска и предшественник широкого спектра проблем со здоровьем. Сердечнососудистые заболевания включают состояния, которые приводят к сужению или закупориванию сердца, артерий и вен. Атеросклероз, часто описываемый как склерозирование артерий, возникает при изнашивании нормальной выстилки артерий, утолщении артериальных стенок и росте отложений жира и бляшек внутри артерий, вызывающих их сужение (или даже закупоривание). Гипертензия или высокое кровяное давление возникает вследствие сужения сосудов в результате аналогичных отложений, которые уменьшают кровоснабжение всех областей тела и служат причиной того, что для перекачивания одинакового количества крови сердце должно работать более интенсивно. Недостаточное поступление кислорода в мозг вызывает удар.
Загрязнение окружающей среды, ежедневный стресс и стиль жизни, все это может вносить вклад в сердечно-сосудистые заболевания, также как и ряд влияющих на здоровье привычек, в том числе, курение табака, отсутствие физической активности и плохое питание. Традиционный подход в лечении включает лекарственную терапию и хирургическое вмешательство, а во многих научных исследованиях был показан положительный эффект изменения питания и стиля жизни. Поэтому, оптимальные схемы лечения могут быть комплексными.
Сердечно-сосудистые заболевания являются лидирующей причиной смертности в развитых странах, в США смертность от сердечных заболеваний и удара составляет 35% от общего числа смертей в год. Лекарственные средства, снижающие уровень холестерина, являются одним из наиболее успешных методов терапии в мире, принеся более 25 миллиардов долларов только в 2005 году. Несмотря на очевидность того, что снижение «плохого» холестерина (LDL, липопротеинов низкой плотности) может предупредить множество сердечно-сосудистых патологий, а повышение уровня «хорошего» холестерина (HDL, липопротеинов высокой плотности) коррелирует с улучшением здоровья сердца, один только уровень холестерина не является единственно важным фактором, определяющим риск сердечно-сосудистых заболеваний. Поэтому, для возможности оптимизации лечения конкретных пациентов важно понять связь между высоким уровнем холестерина, увеличением роста жировых отложений (бляшек) в артериях и заболеваниями сердца.
Связь между тучными клетками и патогенезом атеросклероза впервые была предложена в 1953 году (Constantinides, Science 117: 505-6 (1953); Cairns et al. , Science 120: 31-2(1954)). Последующие исследования подтвердили это предположение (смотри статью Kovanen, Immunol. rev. 217: 105-122 (2007), включенную в настоящее описание путем ссылки). Например, число активированных тучных клеток в атеросклеротических бляшках особенно высоко в плечевых областях бляшки, подверженных разрыву, по сравнению с нормальной интимой. Кроме того, число эрозий бляшки и соотношение тучных клеток, связанных с эрозиями, заметно увеличивается при ухудшении течения болезни. Основным механизмом, приводящим к разрыву бляшки, является усиление разрушения компонентов внеклеточного и периклеточного матрикса в фиброзной покрышке. Активированные тучные клетки секретируют протеазы, такие как триптаза и химаза, которые инактивируют HDL и усиливают разрушение внеклеточного матрикса посредством активации матриксных металлопротеиназ (ММР). Гепарин, протеогликановый компонент высвобождаемых гранул, связывает аполипопротеин (аро)В-100 LDL-частиц и приводит к поглощению LDL макрофагами и пенистыми клетками и в итоге к отложению липидных полос в сосудистой бляшке. Высвобождаемый активированными тучными клетками гистамин запускает также коронарный спазм, который может привести к разрыву и эрозии бляшки. Поэтому, ожидается, что фармацевтическое вмешательство, направленное на ингибирование активации тучных клеток и последующей дегрануляции, будет ингибировать как развитие, так и прогрессирование атеросклероза.
Ключевой стадией активации тучных клеток является перекрестное взаимодействие Fc-рецепторов, таких как высокоаффинный рецептор IgE (FceRI) и/или высокоаффинный рецептор IgG (FcyRI). Такое перекрестное связывание активирует сигнальный каскад в тучных и других иммунных клетках, что приводит к высвобождению химических медиаторов, отвечающих за многочисленные отрицательные эффекты. Например, такое перекрестное связывание приводит к высвобождению запасенных медиаторов, таких как гистамин и протеазы, из мест хранения в гранулах посредством дегрануляции. Это также приводит к синтезу и высвобождению других медиаторов, в том числе ростовых факторов, различных цитокинов и факторов активации тромбоцитов (РАР), которые играют важную роль в развитии и прогрессировании атеросклероза. Сигнальный каскад (сигнальные каскады), активируемый перекрестным связыванием Fc-рецепторов, таких как FcsRI и/или FcyRI, включают панель клеточных белков (смотри фигуру 1). Одними из наиболее важных внутриклеточных распространителей сигнала являются тирозинкиназы. Важной тирозинкиназой, вовлеченной в пути передачи сигнала, ассоциированные с перекрестным связыванием рецепторов FceRI и/или FcyRI, а также с другими каскадами передачи сигнала, является киназа Syk (смотри в качестве обзора Valent et al., 2002, Inti. J. Hematol. 75 (4):257-362).
Во-вторых, тромбоциты играют центральную роль на поздней стадии атеросклероза, в ходе разрыва бляшки и образования тромба. В частности, было показано, что Р-селектин тромбоцитов играет критическую роль в развитии атеросклероза (Huo et al., Nat Med. 9: 61-67(2003); Burger et al., Blood 101: 2661-2666(2003)). CD62P участвует в ранних стадиях привлечения лейкоцитов и опосредует взаимодействие тромбоцитов и лейкоцитов с поврежденной сосудистой стенкой через различные механизмы. Р-селектин (CD62P) конститутивно экспрессируется и хранится в α-гранулах тромбоцитов, и быстро перемещается на поверхность клетки в ответ на некоторые воспалительные стимулы. Активация и дегрануляция тромбоцитов также опосредована Syk-каскадом.
Поскольку медиаторы, высвобождаемые в результате перекрестного связывания рецепторов FcεRI и FcyRI в тучных клетках и тромбоцитах, отвечают за или играют важные роли в развитии и прогрессировании атеросклероза, было бы весьма желательно иметь в наличии соединения, способные ингибировать сигнальный каскад (сигнальные каскады), отвечающие за их высвобождение.
II. КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Описан новый способ для предупреждения и лечения всех форм атеросклероза с использованием 2,4-пиримидиндиаминового соединения. Один аспект изобретения относится к способу лечения атеросклероза или регрессирования или уменьшения образования артериальных атеросклеротических поражений, причем указанный способ включает введение млекопитающему с атеросклерозом эффективного количества ингибитора Syk-киназы, представляющего собой N4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин или его соль.
III. КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Специалисту в данной области будет понятно, что описанные ниже рисунки предназначены только для иллюстративных целей. Не предполагается, что рисунки как-либо ограничивают объем настоящей идеи.
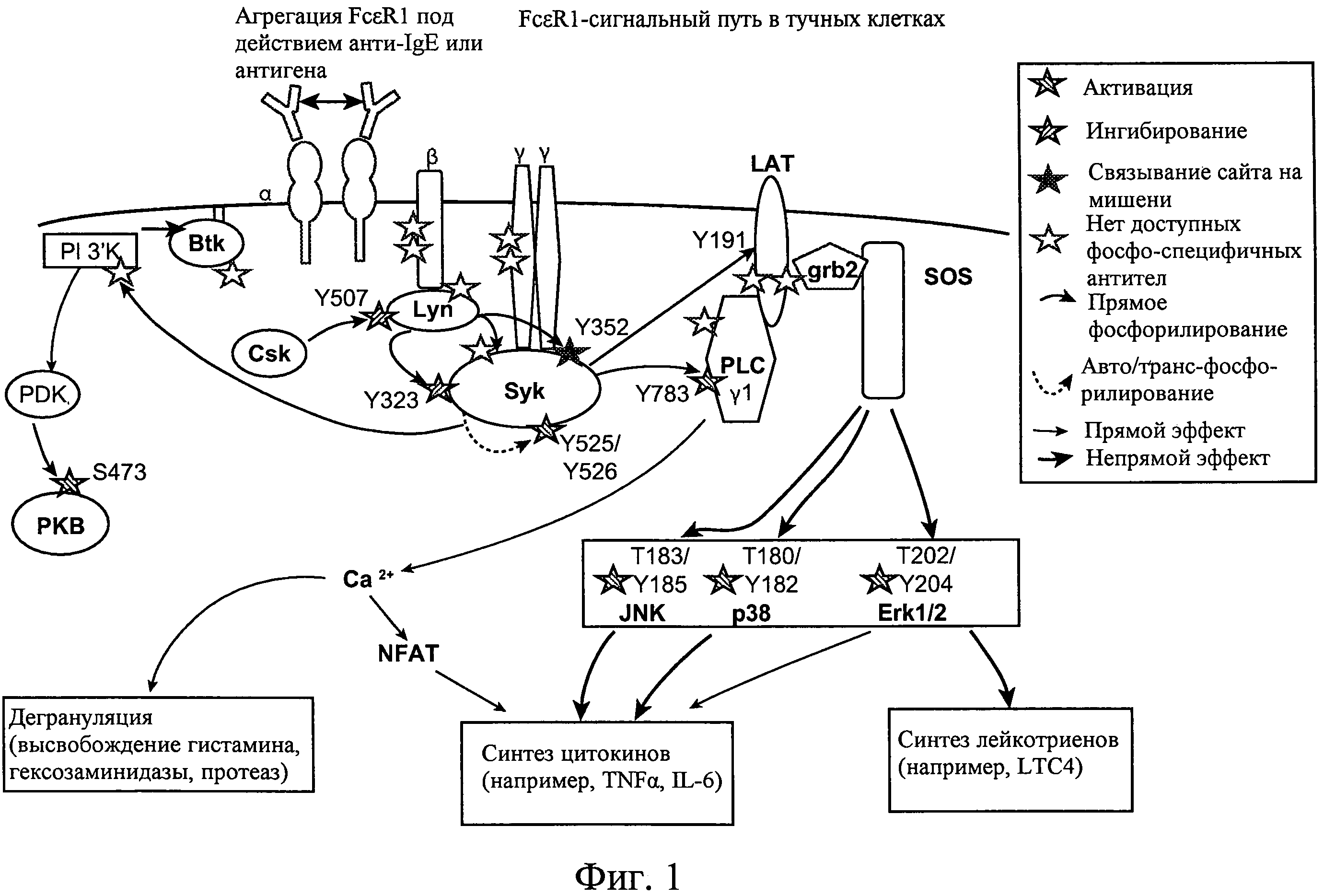
На фиг.1 представлена схема, иллюстрирующая FcεR1-сигнальный каскад, приводящий к дегрануляции тучных клеток.
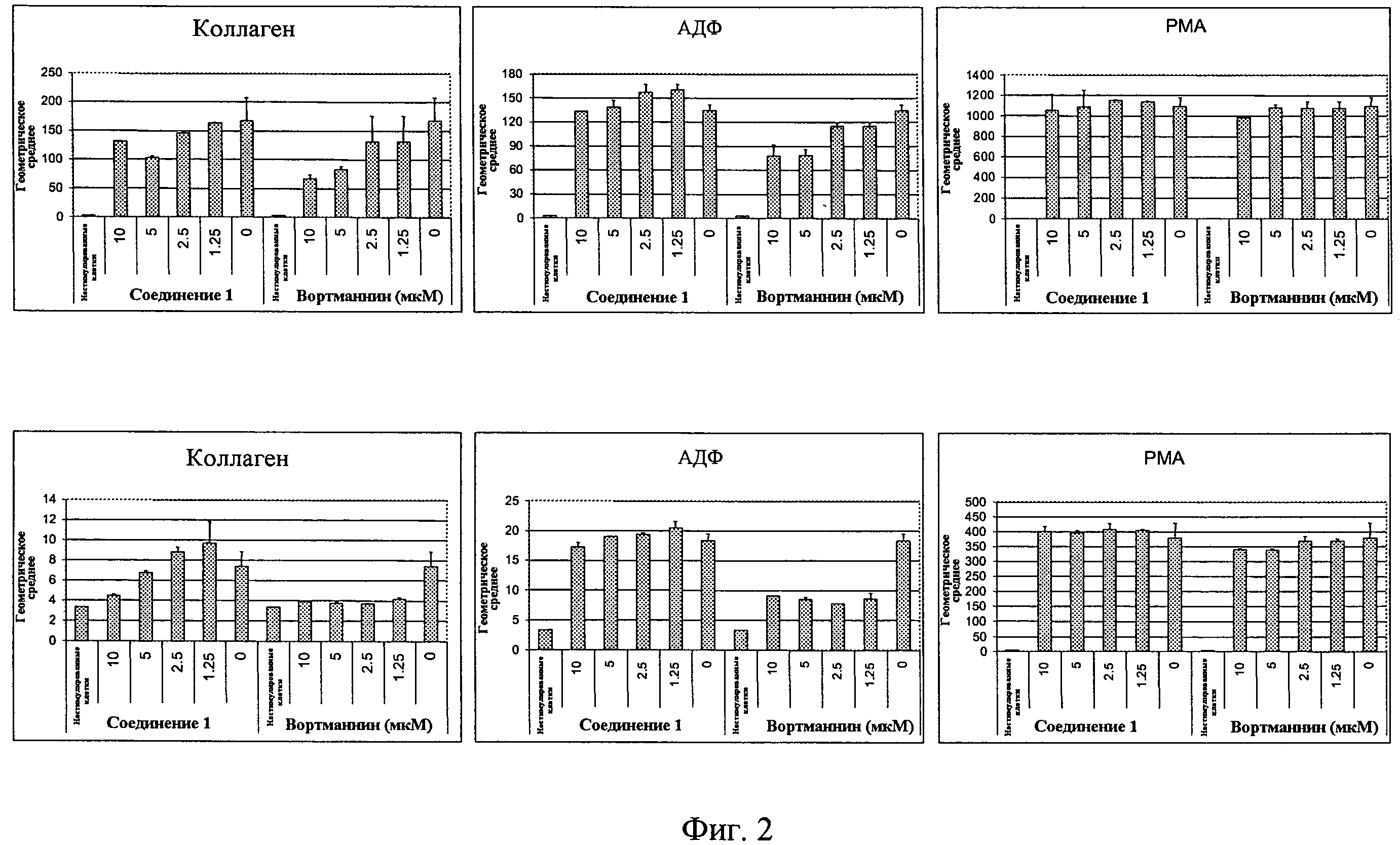
На фиг.2 представлены результаты индуцированной коллагеном, АДФ и РМА экспрессии CD62P на поверхностности тромбоцитов, обработанных 2,4-пиримидиндиамином по изобретению (соединением 1) или вортманнином.
IV. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
А. Введение
Изобретение касается нового способа для предупреждения и лечения всех форм атеросклероза с помощью 2,4-пиримидиндиаминового соединения. 2,4-Пиримидиндиаминовое соединение, используемое в настоящем способе лечения атеросклероза, представляет собой N4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин, соединение 4:
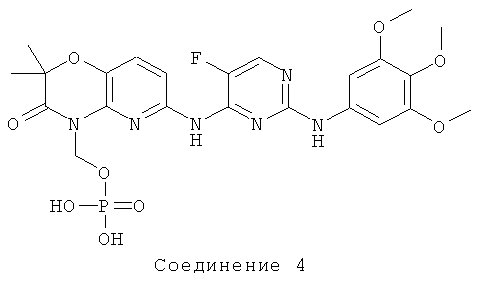
Соединение 4 представляет собой пролекарство 6-(5-фтор-2-(3,4,5-триметоксифениламино)пиримидин-4-иламино)-2,2-диметил-2Н-пиридо[3,2-b][1,4]оксазин-3(4Н)-она (соединение 1).
Б. Определения
Если не указано иное, то следует применять следующие определения, используемые в настоящем описании.
«Пациент» относится к человеку и животным, особенно, млекопитающим.
«Фармацевтически приемлемая соль» относится к фармацевтически приемлемым солям соединения, которые получены с использованием различных органических и неорганических противоионов, хорошо известных в данной области и включающих (только для примера) натрий, калий, кальций, магний, аммоний, тетраалкиламмоний и т.п.; а если молекула имеет основной характер, то этот термин относится к солям органических или неорганических кислот, таким как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и т.п.
«Пролекарство» относится к производному активного 4-пиримидинаминового соединения (лекарственного соединения), которое может требовать превращения в условиях применения, например, в организме, для высвобождения активного 2,4-пиримидиндиаминового лекарственного соединения. Пролекарства часто (но не обязательно) являются фармакологически неактивными до превращения в активное лекарственное соединение. Пролекарства обычно получают, маскируя с помощью прогруппы (определенной ниже) одну или несколько функциональных групп в активном 2,4-пиримидиндиаминовом лекарственном соединении, предположительно частично необходимых для активности, с образованием профункциональной группы, претерпевающей превращение, такое как расщепление, при определенных условиях использования с высвобождением функциональной группы, и, таким образом, активного 2,4-пиримидиндиаминового лекарственного соединения. Расщепление профункциональной группы может происходит спонтанно, например, в результате гидролиза, или его может катализировать или индуцировать другой агент, такой как фермент, свет, кислота или основание, или изменение или воздействие физического или внешнего параметра, такого как температура. Агент может являться эндогенным для условий применения, например, может быть ферментом, присутствующим в клетках, в которые вводится пролекарство, или кислой средой желудка, или он может быть добавлен экзогенно.
«Прогруппа» относится к типу защитной группы, которая при использовании для маскировки функциональной группы в активном 2,4-пиримидиндиаминовом лекарственном соединении для образования профункциональной группы превращает лекарственное соединение в пролекарство. Прогруппы обычно присоединены к функциональной группе лекарственного соединения через связи, расщепляемые при определенных условиях применения. Следовательно, прогруппой является та часть профункциональной группы, которая отщепляется, высвобождая функциональную группу при определенных условиях использования. В качестве конкретного примера, амидная профункциональная группа формулы -NH-С(O)СН3 содержит прогруппу -С(O)CH3.
«Фармацевтически эффективное количество» и «терапевтически эффективное количество» относятся к количеству соединения, достаточному для лечения определенного расстройства или заболевания, или одного или нескольких их симптомов, и/или для предупреждения возникновения заболевания или расстройства.
В. Способы лечения сердечно-сосудистых расстройств
Это изобретение относится к новому способу лечения сердечнососудистых расстройств, в частности, сердечно-сосудистых расстройств, связанных с воспалением, включая, атеросклероз, при которых используют ингибитор Syk-киназы, представляющий собой N4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин или его соль. Тяжесть течения и страдания, вызываемые атеросклерозом, делают разработку новых методов лечения этих состояний крайне необходимой.
Активный 2,4-пиримидин диамин, пролекарством которого является N4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин по изобретению, ингибирует Fc-рецепторные сигнальные каскады, которые приводят (помимо другого) к дегрануляции тучных клеток и тромбоцитов. В качестве конкретного примера, соединение ингибирует FcεRI и/или FcyR-сигнальные каскады, которые приводят к дегрануляции иммунных клеток, таких как тучные клетки. Как тучные клетки, так и тромбоциты играют центральную роль в развитии и прогрессировании атеросклероза. При активации происходит активация пути передачи сигнала от IgE рецептора, которая приводит к дегрануляции клеток и последующему высвобождению и/или синтезу ряда химических медиаторов, включая гистамин, протеазы (например, триптазы и химазы), липидных медиаторов, таких как лейкотриены (например, LTC4), фактора активации тромбоцитов (РДР) и простагландинов (e.g., PGD2) и ряда цитокинов, включая TNF-α, IL-4, IL-13, IL-5, IL-6, IL-8, GMCSF, VEGF и TGF-J3. Высвобождение и/или синтез этих медиаторов из тучных клеток может привести к деградации внеклеточного матрикса, отложению липидных полос в сосудистой системе и разрыву существующих атеросклеротических бляшек.
События на молекулярном уровне в пути передачи сигнала от Fc-рецептора, которые приводят в высвобождению запасенных медиаторов в результате дегрануляции и высвобождению и/или синтезу других химических медиаторов, хорошо известны и приведены на фиг. 1. Согласно схеме, приведенной на фиг.1 Fc-рецептор представляет собой гетеротетрамерный рецептор, состоящий из Ig-связывающей альфа-субъединицы, бета-субъединицы и двух гамма-субъединиц (гамма-гомодимера). Перекрестное связывание связанных с антителом Fc-рецепторов вызывает быстрые ассоциацию и активацию киназы Lyn из семейства Src-киназ. Lyn фосфорилирует иммунорецепторные тирозиновые активирующиеся мотивы (ITAM) в внутриклеточных бета- и гамма-субъединицах, что приводит к привлечению дополнительных молекул Lyn к бета-субъединице и Syk-киназы к гамма-гомодимеру. Эти рецепторно-ассоциированные киназы, активируемые в результате интра- и интер-молекулярного фосфорилирования, фосфорилируют другие компоненты сигнального пути, такие как Btk-киназа, LAT и фосфолипаза С-гамма, PLC-гамма). Активированная PLC-гамма инициируют сигнальные пути, которые приводят к активации протеинкиназы С и мобилизации Са2+, которые оба необходимы для дегрануляции. Перекрестное связывание FcERI также активирует три основных класса митоген-активируемых протеинкиназ (МАР-киназ), а именно, ERKI/2, JNKI/2 и р38. Активация этих путей важна для регуляции транскрипции провоспалительных медиаторов, таких как TNF-α и IL-6, а также липидного медиатора, лейкотриена СА (LTC4). Хотя для этого не приведена схема, полагают, что FcγR-сигнальный каскад разделяет некоторые общие элементы с FcεRI-сигнальным каскадом. Важно отметить, что подобно FcεRI, FcγRI включает гамма-гомодимер, которые фосфорилируется и привлекает Syk, и подобно FcsRI, активация FcyRI-сигнального каскада приводит помимо других событий к дегрануляции. Другие Fc-рецепторы, которые имеют такой же гамма-гомодимер, которые могут регулироваться активными 2,4-пиримидиндиаминовыми соединениями, включают, но не ограничены FcαRI и FcγIII.
Способность 2,4-пиримидиндиаминового соединения по изобретению ингибировать Fc-рецепторные сигнальные каскады можно просто определить или подтвердить аналитическими методами in vitro. Соответствующие аналитические методы для подтверждения ингибирования FcεRI-опосредованной дегрануляции приведены в разделе примеров. В одном типовом методе, клетки, способные к FcεRI-опосредованной дегрануляции, такие как тучные клетки или базофилы, сначала выращивают в присутствии IL-4, фактора стволовых клеток (SCF), IL-6 и IgE для увеличения экспрессии FcεRI, а затем на них воздействуют тестируемым 2,4-пиримидиндиаминовым соединением по изобретению и стимулируют антителами против IgE (или в качестве альтернативы, IgE-специфичным аллергеном). После инкубации с помощью стандартных методик можно определить количество химического медиатора или другого химического агента, высвободившегося и/или синтезированного в результате активации FcεRI-сигнального каскада, и сравнить с количеством медиатора или агента, высвобождаемого контрольными клетками (т.е. клетками, стимулированными без добавления тестируемого соединения). Концентрация тестируемого соединения, которая дает 50%-е снижение количества медиатора или агента по сравнению с контрольными клетками, представляет собой IC50 тестируемого соединения. Происхождение тучных или базофильных клеток, используемых в аналитическом методе, будет отчасти зависеть от предполагаемого применения соединения и будет очевидно для специалистов в данной области. Например, если соединение будет использоваться для лечения или предупреждения болезней людей, подходящим источником тучных или базофильных клеток является человек или какое-либо животное, которое представляет принятую или известную клиническую модель конкретного заболевания. Поэтому, в зависимости от конкретного применения, тучные или базофильные клетки можно получить от различных животных, начиная, например, с низших млекопитающих, таких как мыши и крысы, и до собак, овец и других млекопитающих, обычно используемых в клинических испытаниях, и кончая высшими млекопитающими, такими как мартышки, шимпанзе и обезьяны, и до человека. Конкретные примеры клеток, подходящих для проведения аналитических методов in vitro включают, но не ограничены этим, базофильные клетки грызунов или человека, крысиные базофильные лейкемические клеточные линии, первичные мышиные тучные клетки (такие как мышиные тучные клетки из костного мозга «ВВМС») и первичные тучные клетки человека, выделенные из пуповинной крови («СНМС») или других тканей, таких как легкое. Способы выделения и культивирования этих типов клеток хорошо известны (смотри, например. Demo et al., 1999, Cytometry 36(4):340-348 и патент США №7060827, раскрытие которых включено в настоящее описание путем ссылки). Конечно, также можно использовать другие типы иммунных клеток, которые дегранулируют при активации FcεRI-сигнального каскада, включая, например, эозинофилы.
Соответственно, активность 2,4-пиримидиндиаминового соединения по изобретению также можно подтвердить в биохимических или клеточных анализах активности Syk-киназы. В FcεRI-сигнальном каскаде в тучных и/или базофильных клетках, Syk-киназа фосфорилирует LAT и PLC-гамма 1, что приводим, помимо прочего к дегрануляции. Любую из этих активностей можно использовать для подтверждения активности анти-атеросклеротического соединения по изобретению. В одном варианте осуществления изобретения активность подтверждают контактированием выделенной Syk-киназы или ее активного фрагмента с тестируемым соединением в присутствии субстрата Syk-киназы (например, синтетического пептида или белка, известного как фосфорилируемого Syk в сигнальном каскаде) и оценивая, фосфорилируется ли субстрат Syk-киназой. В качестве альтернативы, анализ можно проводить на клетках, экспрессирующих Syk-киназу. Клетки могут эндогенно экспрессировать Syk-киназу, или их можно модифицировать с помощью генной инженерии для экспрессии рекомбинантной Syk-киназы. Клетки могут необязательно также экспрессировать субстрат Syk-киназы. Клетки, подходящие для проведения таких подтверждающих методов анализа, а также способы создания подходящих клеток методами генной инженерии, будут очевидны специалистам в данной области. Конкретные примеры биохимических и клеточных аналитических методов, подходящих для подтверждения активности ингибитора Syk приведены в разделе примеры. В общем, соединения, являющиеся ингибиторами Syk-киназы, будут иметь IC50 в отношении активности Syk-киназы, такой как способность Syk-киназы фосфорилировать синтетический или эндогенный субстрат в in vitro или клеточном анализе, в диапазоне около 20 мкМ или ниже. Для специалистов будет ясно, что особенно пригодными будет соединения, которые имеют меньшие значения IC50, такие как в диапазоне 10 мкМ, 1 мкМ, 100 нМ, 10 нМ, 1 нМ или еще ниже.
N4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин, вводимый нуждающемуся в этом млекопитающему, представляет собой пролекарство, содержащее биологически активное 2,4-пиримидиндиаминовое соединение, которое замещено по атому азота прогруппой, содержащей фосфор, (Rp) , метаболизирующейся или как-либо еще трансформирующейся в условиях использования, давая активный 2,4-пиримидиндиамин. Для применения в терапии соединение по настоящему изобретению обычно вводят в стандартной фармацевтической композиции, содержащей соединение по изобретению и фармацевтически приемлемый носитель.
N4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин, используемый для введения в способе по изобретению, (соединение 4) имеет следующую формулу:
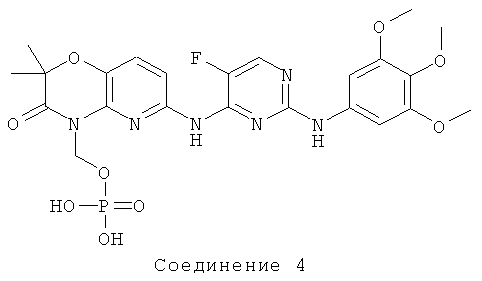
и является пролекарством активного 2,4-2,4-пиримидиндиаминового соединения (соединение 1).
При использовании для лечения или предупреждения таких болезней активные соединения могут вводиться индивидуально или в качестве смесей с одним или несколькими активными соединениями или в смеси или комбинации с другими агентами, пригодными для лечения таких болезней и/или симптомов, ассоциированных с такими болезнями. Активные соединения можно также вводить в смеси или в комбинации с агентами, пригодными для лечения других болезней или заболеваний, такими как антигипертензивные средства (такие как бета-блокаторы, ингибиторы ангиотензин-конвертирующего фермента (АСЕ) и блокаторы кальциевых каналов), лекарственные препараты для контроля уровня холестерина (такие как статин, фибраты или пищевые добавки, ингибирующие всасывание холестерина в пищеварительном тракте, включая эзетимиб), антикоагулянты (например, гепарин или варфарин), средства против агрегации тромбоцитов (например, аспирин в малых дозах), ниацин, омега-3 жирные кислоты и фолиевые кислоты. Активные соединения можно вводить per se или в форме пролекарства или в виде фармацевтических композиций, содержащих активное соединение или пролекарство.
Фармацевтические композиции, содержащие активные соединения (или их пролекарства) могут изготавливаться посредством обычного смешивания, растворения, гранулирования, дражирования, измельчения, эмульгирования, капсулирования, включения лекарственного соединения в носитель или лиофилизации. Композиции могут быть составлены обычным образом с использованием одного или нескольких физиологически приемлемых носителей, разбавителей, эксципиентов или вспомогательных добавок, которые облегчают переработку активных соединений в препараты, которые можно использовать в фармацевтике.
Активное соединение или пролекарство можно ввести в состав фармацевтических композиций per se или форме гидрата, сольвата, N-оксида или фармацевтически приемлемой соли, описанных выше. Обычно такие соли лучше растворяются в водных растворах, чем соответствующие свободные кислоты и основания, но также могут образоваться соли, имеющие меньшую растворимость чем соответствующие свободные кислоты и основания.
Фармацевтические композиции могут принимать форму, подходящую для практически любого типа введения, включая, например, местное, глазное, пероральное, буккальное, системное, назальное, с помощью инъекций, трансдермальное, ректальное, вагинальное и т.д, или форму, подходящую для введения с помощью ингаляции или инсуфляции.
Для местного введения активное соединение или пролекарство можно ввести в состав растворов, гелей, мазей, кремов, суспензий и т.д., хорошо известных в данной области.
Системные препараты включают препараты, разработанные для введения с помощью инъекций, например, подкожных, внутривенных, внутримышечных, интратекальных или интраперитонеальных, а также препараты, созданные для введения через кожу (трансдермального), через слизистую рта или легких.
Препараты, пригодные для инъекций, включают стерильные суспензии, растворы или эмульсии активного соединения в водных или масляных носителях. Композиции могут также содержать вспомогательные агенты, такие как ресуспендирующие, стабилизирующие и/или диспергирующие агенты. Препараты для инъекций могут быть представлены в единичной дозированной форме, например, в ампулах, или в мультидозовых контейнерах, и могут содержать добавленные консерванты.
В качестве альтернативы, препарат для инъекций может быть представлен в форме порошка для восстановления перед использованием в подходящем носителе, включающего, но не ограниченного, стерильную апирогенную воду, буфер, раствор декстрозы и т.д. Для этого активное соединение можно высушить с помощью любой известной в данной области методики, такой как лиофилизация, и восстановить перед использованием.
Для введения через слизистую в препарате используют агенты, способствующие проникновению через барьер. Такие агенты известны в данной области.
Для перорального введения фармацевтические композиции могут представлять собой лекарственные леденцы, таблетки или капсулы, изготовленные стандартными способами с фармацевтически приемлемыми эксципиентами, такими как связывающие агенты (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); лубриканты (например, стеарат магния, тальк или окись кремния); дезинтегранты (например, картофельный крахмал или натрия крахмал гликолят); или увлажняющие агенты (например, лаурилсульфат натрия). Таблетки можно покрыть, например, сахарами, пленкой или кишечно-растворимой оболочкой с помощью способов, хорошо известных в данной области. Соединения, которые особенно подходят для перорального введения, включают 6-(5-фтор-2-(3,4,5-триметоксифениламино)пиримидин-4-иламино)-2,2-диметил-2Н-пиридо[3,2-b][1,4]оксазин-3(4Н)-он и его пролекарство и его фармацевтически приемлемые соли. Жидкие препараты для перорального введения могут находиться в форме, например, эликсиров, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для восстановления водой или другим подходящим носителем перед использованием. Такие жидкие препараты можно приготовить обычными средствами с фармацевтически приемлемыми добавками, такими как ресуспендирующие агенты (например, сорбитовый сироп, производные целлюлозы или гидрированные пищевые жиры); эмульгирующие агенты (например, лецитин или гуммиарабик); неводные носители (например, миндальное масло, маслянистые сложные эфиры, этиловый спирт, КРЕМОФОР™ или фракционированные растительные масла); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). При необходимости препараты также могут содержать буферные соли, консерванты, ароматические добавки, красители и подсластители.
Препараты для перорального введения можно соответственно составить так, чтобы обеспечить контролируемое высвобождение активного соединения или пролекарства, хорошо известного в данной области.
Для буккального введения композиции могут находиться в форме таблеток или лекарственных леденцов, составленных обычным образом.
Для ректального и вагинального путей введения активное соединение может быть составлено в виде растворов (для удерживающей клизмы), суппозиториев или мазей, содержащих обычные основы для суппозиториев, такие как масло какао или другие глицериды.
Для назального введения или введения с помощью ингаляции или инсуффляции активное соединение или пролекарство можно удобно вводить в форме аэрозоля из упаковок под давлением или небулайзера с использованием соответствующего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, фторуглеродов, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением единичная доза может быть определена с помощью клапана, выпускающего дозированное количество. Состав капсул и картриджей для использования в ингаляторе или инсуффляторе (например, капсулы и картриджи, состоящие из желатина) может содержать порошковую смесь соединения и подходящего порошкового основания, такого как лактоза или крахмал.
Конкретный пример препарата водной суспензии, подходящего для назального введения с использованием доступных в продаже устройств для назальных спреев включает следующие ингредиенты: активное соединение или пролекарство (0,5-20 мг/мл); хлорид бензалкония (0,1-0,2 мг/мл); полисорбат 80 (TWEEN® 80; 0,5-5 мг/мл); натриевую карбоксиметилцеллюлозу или микрокристаллическую целлюлозу (1-15 мг/мл); фенилэтанол (1-4 мг/мл); и декстрозу (20-50 мг/мл). pH конечной суспензии можно довести до диапазона от примерно pH 5 до pH 7, причем обычно pH составляет примерно 5,5.
Другой конкретный пример водной суспензии, подходящей для введения соединений с помощью ингаляции и, в частности, для такого введения 2,4-пиримидиндиамина, содержит 1-20 мг/мл соединения или пролекарства, 0,1-1% (объемных) полисорбата 80 (TWEEN® 80), 50 мМ цитрат и/или 0,9% хлорида натрия.
Для пролонгированной доставки активное соединение или пролекарство соединения могут быть составлены в виде депо-препаратов для введения с помощью имплантации или внутримышечной инъекции. Активный ингредиент можно ввести в состав с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в соответствующем масле) или ионообменными смолами, или в виде труднорастворимых производных, например, в виде труднорастворимой соли. В качестве альтернативы можно использовать трансдермальные системы доставки, изготовленные в виде липкого диска или пластыря, которые медленно высвобождают активное соединение для абсорбции через кожу. Для этого можно использовать усилители проникновения для облегчения трансдермального проникновения активного соединения. Подходящими трансдермальными пластырями являются: например, описанные в патенте США №5407713; патенте США №5352456; патенте США №5332213; патенте США №5336168; патенте США №5290561; патенте США №5254346; патенте США №5164189; патенте США №5163899; патенте США №5088977; патенте США №5087240; патенте США №5008110; и патенте США №4921475.
В качестве альтернативы можно использовать другие фармацевтические системы доставки. Липосомы и эмульсии являются хорошо известными примерами носителей, которые можно использовать для доставки активного соединения или пролекарства. Также можно использовать некоторые органические растворители, такие как диметилсульфоксид (ДМСО), хотя обычно за счет большей токсичности.
Фармацевтические композиции можно при желании представить в упаковке или дозаторе, которые могут содержать одну или несколько единичных дозированных форм, содержащий активное соединение. Упаковка может, например, содержать металлическую или пластиковую фольгу, такую как блистерная упаковка. Упаковка или дозирующее устройство могут сопровождаться инструкциями по введению.
Обычно активное соединение или пролекарство по изобретению или их композиции будут использоваться в количестве, эффективном для получения планируемого результата, например, в количестве, эффективном для лечения или предупреждения конкретного заболевания, лечение которого проводится. Соединение(я) можно вводить в терапевтических целях для получения терапевтического эффекта или в профилактических целях для получения профилактического эффекта. Под терапевтическим эффектом понимается устранение или улучшение состояния исходного заболевания, лечение которого проводится лечение, и/или устранение или уменьшение интенсивности одного или нескольких симптомов, ассоциированных с исходным заболеванием, так что пациент сообщает об улучшении ощущений или состояния, несмотря на то, что пациент все еще может иметь исходное заболевание. Например, введение соединения пациенту, страдающему от атеросклероза, обеспечивает терапевтический эффект, не только когда исходное отложение липидов и возникающее в результате закупоривание артерий устраняется или уменьшается, но также когда пациент сообщает о снижении тяжести или длительности симптомов сердечно-сосудистого заболевания. В качестве примера терапевтический эффект в контексте атеросклероза включает уменьшение скорости отложения липидов, замедление атерогенеза или снижение частоты или тяжести сердечных приступов. Терапевтический эффект также включает остановку или замедление развития заболевания, вне зависимости от того достигнуто ли улучшение.
Для профилактики соединение можно вводить пациенту при риске развития у него атеросклероза. В качестве альтернативы профилактическое введение можно применять для того, чтобы избежать появления симптомов у пациента, у которого диагностировано исходное заболевание. Соединения также можно вводить для профилактики вероятно здоровым индивидуумам, которые имеют генетическую предрасположенность к развитию атеросклероза.
Количество вводимого соединения будет зависеть от ряда факторов, включающих, например, конкретное показание, лечение которого проводится, тип введения, тип желаемого эффекта (профилактический или терапевтический), тяжести показаний, лечение которых проводится, и возраста и веса пациента, биодоступности конкретного активного соединения и т.д. Определение эффективной дозировки входит в компетенцию специалистов в данной области.
В начале эффективные дозировки можно определить с помощью аналитических методов in vitro. Например, начальную дозировку для применения у животных можно взять такую, чтобы получить концентрацию активного соединения в кровотоке или сыворотке равную или выше IC50 конкретного соединения, измеренную аналитическим методом in vitro, таким как CHMC-, тромбоцитарный и другие in vitro аналитические методы, описанные в разделе примеров. Вычисление дозировок для получения таких концентраций в кровотоке или сыворотке с учетом биодоступности конкретного соединения вполне входит в компетенцию специалистов. Для руководства можно обратиться к разделу Fingl & Woodbury, "General Principles", в издании: Goodman and Gilman's The Pharmaceutical Basis of Therapeutics, Chapter 1, стр.1-46, последнее издание, издательство Pagamonon Press, и приведенным в нем ссылкам.
Исходные дозировки также можно определить на основе данных in vivo, таких как данные полученные с помощью животных моделей. В данной области хорошо известны животные модели, пригодные для тестирования эффективности соединений для лечения или предупреждения различных заболеваний, описанных выше. Подходящие животные модели атеросклероза описаны в Zadelaar, et al., "Mouse models for atherosclerosis and pharmaceutical modifiers", Arterioscler. thromb. Vasc. Biol. 27(8):1706-21 (2007). Специалисты в данной области могут стандартным способом адаптировать такую информацию для определения дозировок, подходящих для введения людям. Дополнительные подходящие животные модели описаны в разделе примеров.
Дозировки обычно будут находиться в диапазоне от примерно 0,0001 или 0,001, или 0,01 мг/кг/день до примерно 100 мг/кг/день, но могут быть выше или ниже в зависимости от (наряду с другими факторами) активности соединения, биодоступности, типа введения и различных факторов, обсуждаемых выше. Дозировку и интервал можно подобрать индивидуально для получения уровня соединения в плазме, достаточного для поддержания терапевтического или профилактического эффекта. Например, соединения можно вводить один раз в неделю, несколько раз в неделю (например, через день), один раз в день или несколько раз в день, в зависимости (среди других параметров) от типа введения, конкретного показания, лечение которого проводится и решения лечащего врача. В случае местного введения или избирательного введения, такого как локальное местное введение, эффективная локальная концентрация активного соединения может быть не связана с концентрацией в плазме. Специалист будет способен оптимизировать эффективные локальные дозировки, не проводя излишних экспериментов.
Предпочтительно, соединения будут обеспечивать терапевтический или профилактический эффект, не вызывая существенной токсичности. Токсичность соединения можно определить с использованием стандартных фармацевтических процедур. Соотношение доз, дающих токсический и терапевтический (или профилактический) эффект является терапевтическим индексом. Предпочтительными являются соединения с высоким терапевтическим индексом.
Соединение по изобретению также можно использовать для лечения вышеупомянутых заболеваний в комбинации с антигиперлипидемическим, антиатеросклеротическим, антидиабетическим, антиангинальным, противовоспалительным или антигипертензивным агентом или агентом для понижения Lp(a) (липопротеина (a)). Примеры вышеупомянутых соединений включают ингибиторы синтеза холестерина, такие как статины, антиоксиданты, такие как пробукол, инсулиновые сенситизаторы, антагонисты кальциевых каналов и противовоспалительные лекарственные средства, такие как НПВС. Примеры агентов для понижения Lp(a) включают аминофосфонаты, описанные в WO 97/02037, WO 98/28310, WO 98/28311 и WO 98/28312 (Symphar SA and SmithKline Beecham).
Предпочтительной комбинированной терапией будет использование соединения по настоящему изобретению и статина. Статины представляют собой хорошо известный класс агентов для понижения уровня холестерина и включают аторвастатин, симвастатин, правастатин, церивастатин, флувастатин, ловастатин и розувастатин (также именуемый S-4522 или ZD 4522, Astra Zeneca). Эти два агента можно вводить по существу одновременно или в разное время на усмотрение терапевта.
Дополнительной предпочтительной комбинированной терапией будет использование соединения по настоящему изобретению и антидиабетического агента или инсулинового сенсибилизатора, поскольку коронарная болезнь сердца является основной причиной смерти для диабетиков. В этом классе предпочтительные соединения для использования с соединением по настоящему изобретению включают активаторы PPARy, например, G1262570 (GlaxoSmithKline) и глитазоновый класс соединений, таких как розиглитазон (Avandia, GlaxoSmithKline), троглитазон и пиоглитазон.
N4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин, аналогично 2,4-пиримидиндиаминовым соединениям и их пролекарствам, можно синтезировать различными путями с использованием доступных в продаже исходных веществ и/или исходных веществ, полученных стандартными способами синтеза. Примеры подходящих способов, которые можно легко адаптировать для синтеза 2,4-пиримидиндиаминовых соединений и пролекарств приведены в патенте США №5958935, раскрытие которого включено в настоящее описание посредством ссылки. Конкретные примеры, описывающие синтез различных 2,4-пиримидиндиаминовых соединений и пролекарств, а также их промежуточных соединений, описаны в патенте США №7060827, содержание которого полностью включено в настоящее описание путем ссылки. Примеры подходящих способов, которые можно легко использовать и/или адаптировать для синтеза активных 2,4-пиримидиндиаминовых соединений и их пролекарств также можно найти в международной заявке с серийным номером PCT/US03/03022, поданной 31-го января 2003 года (WO 03/063794), заявке США с серийным номером 10/631029, поданной 29-го июля 2003 года, международной заявке с серийным номером PCT/US03/24087 (W02004/014382), заявке США с серийным номером 10/903263, поданной 30-го июля 2004 года, и международной заявке с серийным номером PCT/US2004/24716 (W0005/016893) , раскрытие которых включено в настоящее описание путем ссылки. Соединение (включая пролекарство), используемое в способе по изобретению, можно получить стандартной адаптацией этих способов.
Примеры способов синтеза 2,4-замещенных пиримидиндиаминов описаны в патенте США №7060827 и патентной публикации США №2007-0203161 А1, включенных в настоящее описание путем ссылки. Специалисты в данной области также будут способны легко адаптировать эти способы для синтеза определенных 2,4-замещенных пиримидиндиаминов, описанных в настоящем документе. Тип используемой защитной группы будет зависеть (помимо других параметров) от типа функциональной группы, которую необходимо защитить, и от условий реакции, используемых в конкретной схеме синтеза, и будет очевиден специалистам в данной области. Руководство по выбору защитных групп, их присоединению и удалению, подходящих для конкретного применения, можно найти, например, в Greene & Wuts, supra.
Пролекарство, описанное в настоящем документе, можно получить рутинной модификацией вышеупомянутых способов. В качестве альтернативы, такое пролекарство можно получить реакцией соответственно защищенного 2,4-пиримидиндиамина с подходящей прогруппой. Хорошо известны условия проведения таких реакций и удаления защитных групп для получения пролекарства, описанного в настоящем документе.
В данной области известны многочисленные источники, в которых изложены способы, пригодные для синтеза пиримидинов в общем, а также для синтеза исходных веществ. Конкретное руководство можно найти в Brown, D.J., "The Pyrimidines", in The Chemistry of Heterocyclic Compounds, Volume 16 (Weissberger, A., Ed.), 1962, Interscience Publishers, (A Division of John Wiley & Sons), New York ("Brown I"); Brown, D. J., "The Pyrimidines", in The Chemistry of Heterocyclic Compounds, Volume 16, Supplement I (Weissberger, A. and Taylor, E. C, Ed.), 1970, Wiley-Interscience, (A Division of John Wiley & Sons), New York ("Brown II"); Brown, D.J., "The Pyrimidines", in The Chemistry of Heterocyclic Compounds, Volume 16, Supplement II (Weissberger, A. and Taylor, E. C, Ed.), 1985, An Interscience Publication (John Wiley & Sons), New York ("Brown III"); Brown, D.J., "The Pyrimidines" in The Chemistry of Heterocyclic Compounds, Volume 52 (Weissberger, A. and Taylor, E. C, Ed.), 1994, John Wiley & Sons, Inc., New York, pp.1-1509 ("Brown IV"); Kenner, G. W. and Todd, A., in Heterocyclic Compounds, Volume 6, (Elderfield, R.C, Ed.), 1957, John Wiley, New York, Chapter 7 (пиримидины); Paquette, L. A., Principles of Modern Heterocyclic Chemistry, 1968, W.A. Benjamin, Inc., New York, pp.1-401 (синтез урацила, стр.313, 315; синтез пиримидиндиамина стр.313-316; синтез аминопиримидиндиамина стр.315); Joule, J.A., Mills, К. and Smith, G.F., Heterocyclic Chemistry, 3rd Edition, 1995, Chapman and Hall, London, UK, pp.1-516; Vorbruggen, H. and Ruh-Pohlenz, C, Handbook of Nucleoside Synthesis, John Wiley & Sons, New York, 2001, pp.1-631 (защита пиримидинов ацилированием, стр.90-91; силилирование пиримидинов, стр.91-93); Joule, J.A., Mills, К. and Smith, G.F., Heterocyclic Chemistry, 4th Edition, 2000, Blackwell Science, Ltd, Oxford, UK, pp.1-589; и Comprehensive Organic Synthesis, Volumes 1-9 (Trost, В.М. and Fleming, I., Ed.), 1991, Pergamon Press, Oxford, UK.
Для описания изобретения следующие примеры предложены в качестве иллюстрации, а не ограничения.
V. ПРИМЕРЫ
А. Пример 1: 2,4-пиримидиндиаминовые соединения ингибируют αIgM-индуцированную экспрессию CD69 в первичных В-клетках
В-клетки BJAB человека культивировали стандартным способом в среде RPMI 1640, в которую были добавлены 10% FCS (фетальной сыворотки теленка) (JRH Biosciences, Lenexa, KS) , пенициллин и стрептомицин. Клетки BJAB разделяли в количестве 2,5×105 клеток/мл через 24 часа перед стимуляцией. Клетки осаждали центрифугированием и ресуспендировали в количестве 5×105 клеток/мл в свежей полной среде RPMI 1640 в присутствии от 5 или 10 мкг/мл анти-IgM F(ab')2 (Jackson ImmunoResearch, West Grove, PA) при 37°C и затем оценивали поверхностную экспрессию CD69. CD69 является маркером, экспрессирующимся в В-клетках, активированных через В-клеточный рецептор (BCR). Эти активированные клетки являются источником аутоантител и широкого спектра воспалительных цитокинов, которые, как полагают, играют роль в атеросклерозе (Physiol. Rev. 86: 515-581 (2006)).
|
Б. Пример 2: 2,4-пиримидиндиаминовые соединения ингибируют активацию тучных клеток, индуцированную перекрестным сшиванием FcγR
Тучные клетки человека культивировали и дифференцировали из CD38-отрицательных клеток-предшественников, как описано в патентной публикации США №2005-234049, включенной в настоящее описание путем ссылки. Например, 65 мкл 6-(5-фтор-2-(3,4,5-триметоксифениламино)пиримидин-4-иламино)-2,2-диметил-2Н-пиридо[3,2-b][1,4]оксазин-3(4Н)-она (соединения 1) в различных концентрациях в буфере МТ (137 мМ NaCl, 2,7 мМ KCl, 1,8 мМ CaCl2, 1,0 мМ MgCl2, 5,6 мМ глюкоза, 20 мМ Hepes (pH 7,4), 0,1% бычьего сывороточного альбумина (БСА), (Sigma A4503)), содержащем 2% МеОН и 1% ДМСО, или контрольный буфер добавляли в 2-х повторах к 96-луночным с V-образным дном планшетам. Осажденные и ресуспендированные (в теплом МТ) клетки СНМС (65 мкл) добавляли к каждому 96-луночному планшету, смешивали и инкубировали в течение 1 часа при 37°C. К тестируемым лункам добавляли 25 мкл 6х раствор кроличьих антител против IgG человека (афинно очищенные, Bethyl Laboratories, кат. №A80-105A3), конечная концентрация - 1 мкг/мл. К контрольным лункам добавляли МТ (25 мкл). После инкубации в течение 60 минут при 37°C клетки и клеточный дебрис осаждали центрифугированием при 1000 об/мин в течение 10 мин, и измеряли уровень триптазы и лейкотриена C4.
Для измерения уровня триптазы, 25 мкл надосадочной жидкости из каждой лунки переносили в чистый 96-луночный планшет с черным дном, к которым добавляли 100 мкл свежего раствора субстрата для триптазы [(Z-Ala-Lys-Arg-AMC2TFA; Enzyme Systems Products, кат. № AMC-246)], разведенного 1:2000 в буфере для анализа триптазной активности [0,1 М Hepes (pH 7,5), 10% (вес/объем) глицерина, 10 мкМ гепарин (Sigma, кат. № Н-4898), 0,01% NaN3] . После инкубации в течение 30 мин при комнатной температуре измеряли оптическую плотность в планшетах при 355/460 нм на планшетном спектрофотометре. IC50 приведена в таблице 2.
Количественное определение уровня лейкотриена C4 (LTC4) проводили с использованием набора ELISA на соответственно разведенных образцах надосадочной жидкости, следуя инструкциям изготовителя (Cayman Chemical Co., кат. №520211).
Ингибирование высвобождения и/или синтеза липидных медиаторов оценивали, измеряя высвобождение LTC4, а ингибирование высвобождения и/или синтеза цитокинов оценивали, количественно определяя TNFa, IL-8, GM-CSF, IL-10 и IL-13. Продукцию цитокинов (TNFα, IL-8, GM-CSF, IL-10, IL-13) измеряли чрез 6-8 часов после перекрестного сшивания IgG. Уровень лейкотриена и цитокинов количественно определяли с помощью следующих имеющихся в продаже наборов ELISA: LTC4 (Cayman Chemical, кат. №520211), TNFα (Biosource, кат. № КНС3011), GM-CSF (Biosource, кат. № KHC0901), IL-10 (Biosource, кат. № KHC0122) и IL-13 (Biosource, кат. № KHC0132).
|
В. Пример 4: 2,4-пиримидиндиаминовые соединения активируют тромбоциты по Syk-опосредованному пути
От здоровых доноров, которые не принимали никаких лекарственных препаратов в течение, по меньшей мере, 7 дней, забирали периферическую кровь в пробирки Vacutainer-ACD (пробирки, содержащие кислый раствор цитрата декстрозы (ACD) VWR, кат. № VT4606). Обогащенную тромбоцитами плазму (PRP) и обедненную тромбоцитами плазму (РРР) получали дифференциальным центрифугированием (200 g и >2500 g, соответственно, 20 мин, комнатная температура). Тромбоциты в PRP инкубировали в течение 10 мин при 37°C с растворами тестируемых веществ в ДМСО, которые предварительно разводили в МТ-буфере (137 мМ NaCl, 2,7 мМ KCl, 1,8 мМ CaCl2, 1,0 мМ MgCl2, 5,6 мМ глюкоза, 20 мМ Hepes (pH 7,4), 0,1% БСА, pH 7,4). Тестируемые соединения включали диметилсульфоксид (ДМСО) (Sigma-Aldrich, кат. № D2650), вортманнин из Penlcillium funiculosum (Sigma-Aldrich, кат. № W1628), и 6-(5-фтор-2-(3,4,5-триметоксифениламино)пиримидин-4-иламино)-2,2-диметил-2Н-пиридо[3,2-b][1,4]оксазин-3(4Н)-он (соединение 1).
Клетки стимулировали коллагеном (Chronolog Corp., кат. №385) в концентрации 20 мкг/мл, аденозин-5'-дифосфатом (АДФ) (Sigma-Aldrich, кат. № А2754) в концентрации 33 мкМ, или форбол-12-миристат-13-ацетатом (РМА) (Sigma-Aldrich, кат. № Р8139) в концентрации 33 нг/мл в течение 15 мин при 37°C, затем инкубировали с окрашивающим антителом (анти-СБ62Р, конъюгированным с РЕ) при комнатной температуре в темноте в течение 20 мин, и фиксировали клетки параформальдегидом (буфер для фиксации Cytofix) в темноте в течение 30 мин при комнатной температуре. В конце клетки промывали PBS, содержащим 2%-ю фетальную сыворотку теленка и хранили в темноте при 4°C до анализа с помощью проточной цитофлуориметрии. Измерения проводили на проточном цитофлуориметре FACScalibur (BD Biosciences, San Jose, California, USA). Экспрессию CD62P выражали как геометрическое среднее флуоресценции на оси ординат. Смотри фиг.2.
Соединение 1 ингибировало активацию тромбоцитов, опосредованную коллагеновым рецептором. Однако, соединение 1 не ингибировало повышение поверхностного уровня CD62P в тромбоцитах, активированных АДФ или РМА, что подтверждает, что соединение 1 действует на тромбоциты по Syk-зависимому пути, т.е. коллаген-опосредованному сигнальному пути.
Пример 5. Мышиная модель атеросклероза и ингибирование SYK-киназы
LDLR+/-мышей в возрасте семь недель содержали на корме с высоким содержанием холестерина(HCD), дополненным SYK-ингибитором - соединением 4 (пролекарство соединения 1) при концентрации 0,5 и 2,0 г соединения 4 на кг HCD, или на корме с низким содержанием холестерина ad libitum. Соединение 4 без носителя вводили в HCD производства Ssniff GmbH (Soest, Germany), который также обеспечивал чистый HCD (модифицированный D1208). Этот путь введения достигал уровней лекарства в плазме крови, которые наблюдались также у людей, получающих стандартную дозу соединения 4 в 50 мг или 150 мг два раза в день, как было установлено в кинетическом исследовании, проводимом на LDLR+/- мышах. Через 16 недель мышей умерщвляли, аорты удаляли для последующего анализа.
Анализ удаленных аорт показал, что через 16 недель кормления соединение 4 зависимо от дозы уменьшало размер атеросклеротических поражений вплоть до 59% в корне аорты и вплоть до 68% в дуге аорты, соответственно. Все мыши выглядели здоровыми и не имели очевидных аномалий.
В конце исследования вес мышей, потреблявших корм, дополненный соединением 4, не отличался от веса мышей, потреблявших контрольный HCD. Уровни холестерина и триглицеридов на базовой линии не отличались для этих 2 групп, но уровни триглицеридов были слегка выше в группе животных, которых лечили соединением 4, добавленным в HCD.
Таким образом, лечение соединением 4, представляющим собой ингибитор Syk-киназы, уменьшает размер атеросклеротических поражений у мышей.
1. Способ лечения атеросклероза или регрессирования или уменьшения образования артериальных атеросклеротических поражений, включающий введение млекопитающему с атеросклерозом эффективного количества ингибитора Syk-киназы, представляющего собой N4-(2,2-диметил-4-[(дигидрофосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин или его соль.