СПОСОБ ОПРЕДЕЛЕНИЯ ДОПИНГА У ЛОШАДЕЙ
Вид РИД
Изобретение
Изобретение относится к области исследования или анализа материалов, в том числе ксенобиотиков, путем разделения образцов материалов на составные части с использованием хроматографии и масс-спектрометрии, а точнее к способам идентификации и определения в живом организме веществ, запрещенных к применению, и может быть использовано например в допинговом контроле лошадей.
Известен способ хроматографической идентификации компонентов сложных смесей органических соединений, включающий пропускание вещества через систему последовательно соединенных колонок, заполненных сорбентом различной полярности, отбор пробы после каждой колонки, детектирование на детекторах различных типов и идентификацию определяемого вещества расчетом коэффициента чувствительности и относительного удерживания по данным двух детекторов [1].
К недостаткам указанного способа следует отнести сложность процедуры анализа, а также вероятность получения недостоверных результатов при расчетах значений удерживания разных колонок.
Известен также способ идентификации неизвестных веществ методом газовой хроматографии в сочетании с масс-спектрометрией. По указанному способу регистрируют хроматограмму как функцию времени удерживания и регистрируют масс-спектр в период времени соответствующему выходу вещества из колонки и сравнивают с масс-спектрами известных веществ, находящимися в базе данных, далее определяют индекс удерживания и сравнивают его с таковыми из базы данных и идентифицируют вещество по двум параметрам - масс-спектру и индексу удерживания [2].
Недостатком указанного способа, несмотря на привлекательность использования индекса удерживания, является высокая вероятность получения недостоверных результатов анализа, поскольку индексы удерживания изначально привязаны к конкретной колонке с определенными параметрами и зачастую либо не воспроизводятся либо на другом, хотя и аналогичном оборудовании, воспроизводятся с искажением, что может привести к недостоверной интерпретации результатов анализа.
Известен также способ идентификации неизвестных веществ методом жидкостной хроматографии в сочетании с тандемной масс-спектрометрией. По указанному способу также регистрируют хроматограмму как функцию времени удерживания и регистрируют масс-спектр в период времени соответствующему выходу вещества из колонки и сравнивают с масс-спектрами известных веществ, находящимися в базе данных, далее определяют индекс удерживания и сравнивают его с таковыми из базы данных и идентифицируют вещество по двум параметрам - масс-спектру и индексу удерживания [3].
Недостатком указанного способа является весьма продолжительная стадия подготовки образца к проведению анализа, а также высокие значения граничных концентраций определяемых веществ.
Наиболее близким к заявляемому изобретению по своей технической сущности и достигаемому эффекту является способ определения допинга у лошадей методом жидкостной хроматографии в сочетании с тандемной масс-спектрометрией. По указанному способу также регистрируют хроматограмму как функцию времени удерживания и масс-спектра [4].
Недостатком указанного способа является сложная и продолжительная во времени пробоподготовка и высокая вероятность получения недостоверных результатов анализа.
Техническим результатом, на достижение которого направлено создание данного изобретения, является достоверное определение допинга у лошадей за счет обеспечения возможности однозначной идентификации химических соединений и их фрагментов в биологической жидкости в произвольных комбинациях при одновременном повышении точности определения характеристик исследуемых веществ и оперативности определения.
Поставленный технический результат достигается тем, что у подозреваемой на допинг лошади отбирают два вида биологической жидкости - плазму крови и мочу, каждую из них разделяют на три аликвоты - А, Б и В, из которых аликвоту А замораживают, аликвоту Б подвергают хроматографическому разделению и масс-спектральному анализу и регистрируют показатели времени удержания и соотношение интенсивности характеристичных ионов, а в аликвоте В растворяют искомый ксенобиотик-эталон, осуществляют хроматографическое разделение и масс-спектральный анализ указанной аликвоты, и регистрируют показатели времени удержания и соотношение интенсивности характеристичных ионов, затем выбирают заведомо недопированных лошадей, разделяют их на две равные группы - контрольную и подопытную, и последнюю допируют искомым ксенобиотиком, при этом у подопытной группы лошадей определяют продукты метаболизма искомого ксенобиотика путем сравнения зарегистрированных результатов анализа проб биологических жидкостей подопытной и контрольной групп лошадей, и затем определяют искомый ксенобиотик у подозреваемой лошади, сравнивая показатели времени удержания и соотношение интенсивности характеристичных ионов всех проб с учетом полученных данных о продуктах метаболизма, а при возникновении сомнений в достоверности результата анализа дополнительно проводят анализ замороженных образцов биологической жидкости подозреваемой лошади как вариант ретроспективного определения допинга и полученные результаты всех анализов впоследствии используют в качестве базы данных при допинговом контроле лошадей.
Определение запрещенных препаратов в конном спорте существенно отличается от сложившейся практики определения допингов в человеческом спорте и является сложной задачей по ряду причин. Во-первых, перечень запрещенных препаратов включает соединения других классов, не входящих в Список запрещенных препаратов ВАДА. Это так называемые соединения кислотно-основного характера, прежде всего нестероидные противовоспалительные препараты, барбитураты и оксикамы (релаксанты), для определения которых требуется создание новых методик с применением новейшего оборудования (высокоэффективная жидкостная хроматография - тандемная хромато-масс-спектрометрия, ВЭЖХ-МС/МС). Во-вторых, для процедур пробоподготовки необходимы специальные устройства и приемы для выделения определяемых соединений из биологической матрицы. Моча лошадей содержит большое количество слизи и оксалатов, поэтому традиционные методы пробоподготовки неприменимы. Не все лошади способны сдать мочу, поэтому дополнительно происходит отбор крови, работа с которой также осложнена матричными эффектами.
ВЭЖХ-МС/МС анализ может быть выполнен например на хромато-масс-спектрометре с тройным квадрупольным анализатором TSQ Quantum фирмы Thermo Finnigan (США), соединенным с высокоэффективным жидкостным хроматографом модели Surveyor, оснащенным автосамплером, насосом высокого давления и дегазатором фирмы Thermo Finnigan (США).
Для хроматографического разделения могут быть использованы колонки: Eclipse XDB-C18, 150×2.1 мм, размер частиц 5 мкм, размер пор 100 Ǻ, фирмы Zorbax, США; Hypersil ODS, 150×2.1 мм, размер частиц 3 мкм, размер пор 80 Ǻ, фирмы Agilent Technologies, США; Ultra C18, 150×2.1 мм, размер частиц 5 мкм, размер пор 100 Ǻ, фирмы Restek Co., США; Eclipse XDB-C8, 150×2.1 мм, размер частиц 5 мкм, размер пор 100 Ǻ, фирмы Zorbax, США.
В качестве мобильной фазы может быть использован 0.05% раствор муравьиной кислоты с 0.2 мМ раствором ацетата аммония (pH 3.0) (А) и метанол (В).
Обработка данных может быть проведена с применением программного обеспечения Xcalibur версии 1.3 фирмы Thermo Finnigan, США.
В качестве внутренних стандартов (ISTD) могут быть использованы флюоксиместерон, метилтестостерон и мефрузид.
Для проведения ферментативного гидролиза может быть использована β-глюкуронидаза (Helix Pomatia, Type HP-2).
В процессе пробоподготовки и проведения анализа исследуемых веществ авторы предлагают применять твердофазную экстракцию (ТФЭ) - выделение интересующих компонентов путем сорбции на твердом носителе. Авторы полагают, что применение ТФЭ обеспечит более широкие возможности варьирования природы и силы взаимодействий образца с сорбентом и элюентом, по сравнению с жидкостной экстракцией, вследствие чего может быть осуществлено более селективное и количественное выделение или более тонкая очистка интересующих компонентов - т.е извлекать каждое из определяемых соединений или отделять их от мешающих компонентов. Особенно эффективной ТФЭ должна быть в тех случаях, когда матрица представляет собой многокомпонентную систему, требующую более детального исследования, в частности, как указано выше моча и плазма крови лошадей.
Для ТФЭ могут быть использованы концентрирующие картриджи BoldElute (130 мг, 3 мл) фирмы Varian, США, а также экстрактор с положительным давлением System 48 Cerex® фирмы Crawford Scientific Ltd., Великобритания, совмещенный с генератором азота марки Mistral-4 фирмы Schmidlin-DBS AG, Чехия.
Изобретение может быть осуществлено следующим образом. У лошади с подозрением на допинг отбирают пробу крови из яремной вены. Образцы крови отбирают в стеклянные пробирки, содержащие 20 мг оксалата калия и 25 мг фтористого натрия, центрифугируют при 3000 об/мин и помещают в холодильник +4°C на 15 мин для получения плазмы, 2 мл плазмы переносят в полипропиленовую пробирку, аликвоту сразу же замораживают при -20°C, далее образцы помещают в холодильник с температурой -70°C и хранят до анализа.
Образцы мочи отбирают через катетер в стеклянные транспортные контейнеры для мочи и помещают в морозильную камеру (-20°C), после замораживания образцы до начала анализа хранят при -70°C.
А. Пробоподготовка и анализ образцов мочи.
Образец мочи (аликвота Б) с добавкой раствора внутреннего стандарта наносят на картридж, промывают его фосфатным буферным раствором и сушат в токе азота. Вещества элюируют с картриджа метанолом. Органический растворитель упаривают досуха в токе азота (экстракт свободной фракции).
К образцу мочи (также аликвота Б) добавляют раствор внутреннего стандарта, фосфатный буферный раствор и раствор β-глюкуронидазы и инкубируют. После ферментативного гидролиза мочу наносят на картридж, который предварительно кондиционируют метанолом, фосфатным буферным раствором. После нанесения образца картридж промывают буферным раствором, сушат концентрирующий патрон в токе азота. Вещества элюируют с сорбента метанолом в пробирку, в которой находится высушенный экстракт свободной фракции. Органический растворитель упаривают досуха в токе азота. Сухой остаток перерастворяют в метаноле и часть вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией при атмосферном давлении в режиме регистрации отрицательных ионов и часть - в режиме регистрации положительных ионов.
Скорость потока подвижной фазы поддерживают постоянной. Детектирование определяемых веществ проводят в режиме регистрации селективных реакций (SRM). Обработку данных проводят с применением программного обеспечения Xcalibur версии 1.3 фирмы Thermo Finnigan, США. Идентифицируют искомые вещества по двум параметрам - масс-спектру и индексу удерживания (соотношение интенсивности характеристичных ионов).
Следует отметить, что при выбранных условиях проведения ТФЭ степень извлечения соединений из биологических матриц составляет 76-97%
Пробоподготовку и анализ аликвоты В пробы биологической жидкости ведут так же, как и аликвоты Б, за исключением того, что в нее вводят искомое вещество (ксенобиотик).
Б. Пробоподготовка и анализ образцов крови.
Образец крови центрифугируют, отбирают аликвоту Б (3 мл) плазмы и для депротонизации добавляют раствора трифторуксусной кислоты. Образец выдерживают 5-10 мин при комнатной температуре, затем центрифугируют. Надосадочную жидкость переносят в другую пробирку, добавляют раствора внутреннего стандарта и фосфатного буферного раствора (pH 6.0, 0.1 М). pH раствора должно быть 6.0 (доводят до требуемого pH 0.1 М раствором соляной кислоты или 0.1 М раствором гидроксида калия). Затем наносят образец на картридж BondElute, который предварительно кондиционируют метанолом, водой и фосфатным буферным раствором. Промывают концентрирующий патрон фосфатным буферным раствором, затем раствором уксусной кислоты, сушат картридж в течение 3-7 мин азотом. Вещества, обладающие кислотными свойствами, элюируют с картриджа смесью дихлорметан/этилацетат (4:1). Затем картридж промывают метанолом и сушат в токе азота в течение 5-10 мин. Вещества с основными свойствами элюируют смесью этилацетат/дихлорметан/изопропанол (5:4:1), содержащей 2% аммиака, Органические экстракты объединяют и упаривают досуха в токе азота. Сухой остаток перерастворяют в метаноле и далее 15 мкл вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией при атмосферном давлении в режиме регистрации отрицательных ионов, и 15 мкл - в режиме регистрации положительных ионов. Скорость потока подвижной фазы поддерживают постоянной. Детектирование определяемых веществ проводят в режиме регистрации селективных реакций (SRM). Обработку данных проводят с применением программного обеспечения Xcalibur версии 1.3 фирмы Thermo Finnigan, США. Идентифицируют искомые вещества по двум параметрам - масс-спектру и индексу удерживания (соотношение интенсивности характеристичных ионов). Пробоподготовку и анализ аликвоты В пробы ведут так же, как и аликвоты Б, за исключением того, что в нее вводят искомое вещество (ксенобиотик).
Далее отбирают, проводят пробоподготовку и анализ биологических жидкостей заведомо недопированных и допированных лошадей. Отбор проб и пробоподготовку ведут, как вышеуказано, для мочи и крови. Анализ проб осуществляют так же, как описано выше. Исследуемой группе лошадей вводят ксенобиотики в порядке и количествах, как будет показано в конкретных примерах осуществления изобретения. Результаты анализов биологических жидкостей допированной и контрольной групп лошадей сопоставляют и выявляют характеристичные ионы продуктов метаболизма искомых ксенобиотиков и по полученным результатам выявляют в конечном итоге наличие допинга у подозреваемой лошади.
Пример 1.
При проведении соревнований (скачки) на Центральном ***ском ипподроме по подозрению на допинг были взяты пробы крови и мочи у 10 лошадей. Животные были пронумерованы соответственно 1, 2, 3, 4 и т.д. до 10. Подозревалось, что были использованы ксенобиотики из списка: клостебол, фенилбутазон, оксиместерон, сальбутамол.
У подозреваемых лошадей отбирают пробу крови из яремной вены. Образцы крови отбирают в стеклянные пробирки, содержащие 20 мг оксалата калия и 25 мг фтористого натрия, центрифугируют при 3000 об/мин и помещают в холодильник +4°C на 15 мин для получения плазмы, 2 мл плазмы переносят в полипропиленовую пробирку и сразу же замораживают при -20°C, далее образцы помещают в холодильник с температурой -70°C и хранят до анализа.
Образцы мочи отбирают в стеклянные транспортные контейнеры для мочи и помещают в морозильную камеру (-20°C), после замораживания образцы до начала анализа хранят при -70°C. Перед пробоподготовкой образцы делят на три аликвоты и далее проводят:
а) пробоподготовку и анализ образцов мочи (аликвота Б).
Примечание: Следует отметить, что для сокращения продолжительности анализа и одновременного извлечения всех интересующих веществ из исследуемой биологической жидкости и их интегрального анализа в одну стадию аликвоту Б образца мочи разделяют на две части, в одну из которых вводят внутренний стандарт, а вторую часть подвергают ферментативному гидролизу и далее полученные из обеих частей экстракты перед хроматографическим анализом объединяют.
В качестве внутренних стандартов (ISTD) используют флюоксиместерон и метилтестостерон (LGC Standards, Германия), мефрузид (Sigma-Aldrich, Германия), содержание основного компонента 99%.
Стандартные растворы аналитов (1 мг/мл) готовят растворением точных навесок в точном объеме метанола. Рабочие растворы получают разбавлением. Рабочие растворы до анализа хранят в морозильной камере при -20°C.
Для проведения ферментативного гидролиза используют β-глюкуронидазу (Helix Pomatia, Type HP-2) фирмы Sigma-Aldrich, Германия.
Для приготовления элюента используют метанол «для хроматографии» (Chromasolv®, Merck, Германия), ацетат аммония и муравьиную кислоту (Fluka, Швейцария).
Фосфатный буферный раствор (pH 6.0, 0.1 М) готовят смешением растворов дигидро- и гидрофосфата калия, приготовленные растворением в деионизованной воде твердых солей (Fluka, Германия).
Для осаждения белков используют трифторуксусную кислоту (Merck, Германия).
Образец мочи (3 мл) (первая часть аликвоты Б) с добавкой раствора внутреннего стандарта (50 мкл) наносят на картридж BondElute, который предварительно кондиционируют 3 мл метанола, 3 мл фосфатного буферного раствора (pH 6.0, 0.1 М). После нанесения образца картридж промывают 3 мл фосфатного буферного раствора (pH 6.0, 0.1 М), картридж сушат 5 мин в токе азота. Вещества элюируют с картриджа 3 мл метанола. Органический растворитель упаривают досуха в токе азота (экстракт свободной фракции).
К образцу мочи (3 мл) (вторая часть аликвоты Б) добавляют 50 мкл раствора внутреннего стандарта, 1.0 мл фосфатного буферного раствора (pH 6.0) (pH раствора должно быть 6.0 для проведения ферментативного гидролиза - при необходимости добавляют 0.1 М раствор соляной кислоты для доведения pH до 6.0) и 50 мкл β-глюкуронидазы, инкубируют в течение 2 ч при температуре 57°C. После ферментативного гидролиза мочу наносят на картридж BondElute, который предварительно кондиционируют 3 мл метанола, 3 мл фосфатного буферного раствора (pH 6.0, 0.1 М). После нанесения образца картридж промывают 3 мл фосфатного буферного раствора (pH 6.0, 0.1 М), сушат концентрирующий патрон в течение 5 мин в токе азота. Вещества элюируют с сорбента 3 мл метанола в пробирку, в которой находится высушенный экстракт свободной фракции. Органический растворитель упаривают досуха в токе азота. Сухой остаток перерастворяют в 100 мкл метанола, 15 мкл вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией при атмосферном давлении в режиме регистрации отрицательных ионов и 15 мкл - в режиме регистрации положительных ионов. Скорость потока подвижной фазы поддерживают постоянной. Детектирование определяемых веществ проводят в режиме регистрации селективных реакций (SRM). Обработку данных проводят с применением программного обеспечения Xcalibur версии 1.3 фирмы Thermo Finnigan, США. Идентифицируют искомые вещества по двум параметрам - масс-спектру и индексу удерживания (соотношение интенсивности характеристичных ионов). Далее проводят:
б) пробоподготовку и анализ образцов мочи (аликвота В).
В образец мочи (3 мл) (первая часть аликвоты В) с добавкой раствора внутреннего стандарта (50 мкл) вводят клостебол (4-хлорандрост-4-ен-17β-ол-3-он) в количестве 0,2 мкг/мл и наносят на картридж BondElute, который предварительно кондиционируют 3 мл метанола, 3 мл фосфатного буферного раствора (pH 6.0, 0.1 М). После нанесения образца картридж промывают 3 мл фосфатного буферного раствора (pH 6.0, 0.1 М), картридж сушат 5 мин в токе азота. Вещества элюируют с картриджа 3 мл метанола. Органический растворитель упаривают досуха в токе азота (экстракт свободной фракции).
К образцу мочи (3 мл) (вторая часть аликвоты В) добавляют 50 мкл раствора внутреннего стандарта, 1.0 мл фосфатного буферного раствора (pH 6.0) (pH раствора должно быть 6.0 для проведения ферментативного гидролиза - при необходимости добавляют 0.1 М раствор соляной кислоты для доведения pH до 6.0), вводят клостебол (4-хлорандрост-4-ен-17β-ол-3-он) в количестве 0,2 мкг/мл и 50 мкл (3-глюкуронидазы, инкубируют в течение 2 ч при температуре 57°C. После ферментативного гидролиза мочу наносят на картридж BondElute, который предварительно кондиционируют 3 мл метанола, 3 мл фосфатного буферного раствора (pH 6.0, 0.1 М). После нанесения образца картридж промывают 3 мл фосфатного буферного раствора (pH 6.0, 0.1 М), сушат концентрирующий патрон в течение 5 мин в токе азота. Вещества элюируют с сорбента 3 мл метанола в пробирку, в которой находится высушенный экстракт свободной фракции. Органический растворитель упаривают досуха в токе азота. Сухой остаток перерастворяют в 100 мкл метанола, 15 мкл вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией при атмосферном давлении в режиме регистрации отрицательных ионов и 15 мкл - в режиме регистрации положительных ионов. Скорость потока подвижной фазы поддерживают постоянной. Детектирование определяемых веществ проводят в режиме регистрации селективных реакций (SRM). Обработку данных проводят с применением программного обеспечения Xcalibur версии 1.3 фирмы Thermo Finnigan, США. Идентифицируют искомые вещества по двум параметрам - масс-спектру и индексу удерживания (соотношение интенсивности характеристичных ионов). Далее проводят:
а) пробоподготовку и анализ образцов крови (аликвота Б).
Образец крови центрифугируют в течение 10 мин при 3000 об/мин, отбирают 3 мл плазмы и для депротонизации добавляют 200 мкл раствора трифторуксусной кислоты (10%). Образец выдерживают 10 мин при комнатной температуре, затем центрифугируют в течение 10 мин при 3000 об/мин. Надосадочную жидкость переносят в другую пробирку, добавляют 50 мкл раствора внутреннего стандарта и 2 мл фосфатного буферного раствора (pH 6.0, 0.1 М). pH раствора должно быть 6.0, при необходимости доводят до требуемого pH 0.1 М раствором соляной кислоты или 0.1 М раствором гидроксида калия. Затем наносят образец на картридж BondElute, который предварительно кондиционируют 3 мл метанола, 3 мл воды и 3 мл фосфатного буферного раствора (pH 6.0, 0.1 М). Промывают концентрирующий патрон 3 мл фосфатного буферного раствора (pH 6.0, 0.1 М), затем 2 мл раствора (1.0 М) уксусной кислоты, сушат картридж в течение 5 мин азотом. Вещества, обладающие кислотными свойствами, элюируют с картриджа 3 мл смеси дихлорметан/этилацетат (4:1). Затем картридж промывают 2 мл метанола, сушат в токе азота в течение 5 мин. Вещества с основными свойствами элюируют 3 мл смеси этилацетат/дихлорметан/изопропанол (5:4:1), содержащей 2% аммиака. Органические экстракты объединяют и упаривают досуха в токе азота. Сухой остаток перерастворяют в 100 мкл метанола, и 15 мкл вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией при атмосферном давлении в режиме регистрации положительных ионов. Скорость потока подвижной фазы поддерживают постоянной. Детектирование определяемых веществ проводят в режиме регистрации селективных реакций (SRM). Обработку данных проводят с применением программного обеспечения Xcalibur версии 1.3 фирмы Thermo Finnigan, США. Идентифицируют искомые вещества по двум параметрам - масс-спектру и индексу удерживания (соотношение интенсивности характеристичных ионов). Далее проводят:
б) пробоподготовку и анализ образцов крови (аликвота В).
Образец крови центрифугируют в течение 10 мин при 3000 об/мин, отбирают 3 мл плазмы и для депротонизации добавляют 200 мкл раствора трифторуксусной кислоты (10%). Образец выдерживают 10 мин при комнатной температуре, затем центрифугируют в течение 10 мин при 3000 об/мин. Надосадочную жидкость переносят в другую пробирку, добавляют 50 мкл раствора внутреннего стандарта и 2 мл фосфатного буферного раствора (pH 6.0, 0.1 М). pH раствора должно быть 6.0, при необходимости доводят до требуемого pH 0.1 М раствором соляной кислоты или 0.1 М раствором гидроксида калия, вводят клостебол (4-хлорандрост-4-ен-17β-ол-3-он) в количестве 0,2 мкг/мл. Затем наносят образец на картридж BondElute, который предварительно кондиционируют 3 мл метанола, 3 мл воды и 3 мл фосфатного буферного раствора (pH 6.0, 0.1 М). Промывают концентрирующий патрон 3 мл фосфатного буферного раствора (pH 6.0, 0.1 М), затем 2 мл раствора (1.0 М) уксусной кислоты, сушат картридж в течение 5 мин азотом. Вещества, обладающие кислотными свойствами, элюируют с картриджа 3 мл смеси дихлорметан/этилацетат (4:1). Затем картридж промывают 2 мл метанола, сушат в токе азота в течение 5 мин. Вещества с основными свойствами элюируют 3 мл смеси этилацетат/дихлорметан/изопропанол (5:4:1), содержащей 2% аммиака. Органические экстракты объединяют и упаривают
досуха в токе азота. Сухой остаток перерастворяют в 100 мкл метанола, и 15 мкл вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией при атмосферном давлении в режиме регистрации положительных ионов. Скорость потока подвижной фазы поддерживают постоянной. Детектирование определяемых веществ проводят в режиме регистрации селективных реакций (SRM). Обработку данных проводят с применением программного обеспечения Xcalibur версии 1.3 фирмы Thermo Finnigan, США. Идентифицируют искомые вещества по двум параметрам - масс-спектру и индексу удерживания (соотношение интенсивности характеристичных ионов).
Пробоподготовку и анализ образцов биологической жидкости всех подозреваемых лошадей проводят, как вышесказано, за исключением того, что в аликвоты В мочи и сыворотки крови вводят фенилбутазон или оксиместерон, или сальбутамол.
Результаты анализа проб мочи и крови у подозреваемых на допинг лошадей представлены в Таблице 1 (см. выше). В Таблице 2 представлены зарегистрированные значения молекулярной массы, времени удерживания, прекурсор-ионы и характеристичные ионы, полученные при анализе аликвот В.
|
В Таблице 3 представлены зарегистрированные в числе прочих значения молекулярной массы, времени удерживания, прекурсор-ионы и характеристичные ионы, полученные при анализе аликвот Б у лошадей под номерами 2, 3, 7, 8 и 10.
|
Из сопоставления результатов анализа, представленных в Таблицах 1, 2 и 3, следует, что у лошади под №3 был обнаружен сальбутамол.
Далее на ***ском конно-племенном заводе с любезного согласия администрации формируют четыре группы заведомо не допированных лошадей по 6 голов. Каждую группу в свою очередь разделяют на две равные: подопытную и контрольную группы (11 и 12, 13 и 14, 15 и 16, 17 и 18 соответственно). Подопытным лошадям по группам вводят ксенобиотики:
- клостебол (4-хлорандрост-4-ен-17β-ол-3-он) внутримышечно в виде масляной инъекции эфира ундецилената из расчета 1,1 мг/кг (препарат «Эквипойз», производство фирмы "Сольвэй", США);
- фенилбутазон (4-butyl-1,2-diphenyl-3,5-pyrazolidinedione) внутривенно в виде 20%-ного стерильного водного раствора для инъекций из расчета 2,2 мг/кг («Фенилбутазон 20%», производство фирмы "Ветбиохим Пвт. Лтд.", Индия);
- оксиместерон (17α-метиландрост-4-ен-4,17β-диол-3-он) внутривенно из расчета 0,05 мг/кг.
- сальбутамол (препарат: «Сальгим раствор для инъекций 1%» (Salgim solution for injections 1%), производство фирмы ООО "Фармсинтез", Россия) внутривенно из расчета 2,4 мкг/кг.
Далее ведут отбор мочи и крови у подопытных и контрольных групп лошадей, готовят пробы указанных биологических жидкостей и анализируют их в точном соответствии с процедурами «а» и «б», описанными выше (пробоподготовка и анализ мочи и крови лошадей, подозреваемых на допинг) за исключением того, что пробы не разделяют на аликвоты и не вводят в них искомых ксенобиотиков. Отбор мочи производят через 2, 12, 24, 36, 48 часов после введения препарата. Отбор крови производят через 1, 24, 48 и 72 часа после введения препарата. Готовые пробы вводят в систему ВЭЖХ-МС/МС с электрораспылительной ионизацией при атмосферном давлении в режиме регистрации отрицательных ионов и в режиме регистрации положительных ионов (для мочи) и с режиме регистрации положительных ионов для крови. Скорость потока подвижной фазы поддерживают постоянной. Детектирование определяемых веществ проводят в режиме регистрации селективных реакций (SRM). Обработку данных проводят с применением программного обеспечения Xcalibur версии 1.3 фирмы Thermo Finnigan, США. Идентифицируют искомые вещества по двум параметрам - масс-спектру и индексу удерживания (соотношение интенсивности характеристичных ионов). Результаты анализов биологической жидкости подопытных и контрольных групп лошадей по каждому ксенобиотику представлены в Таблицах 4, 5, 6 и 7 соответственно.
|
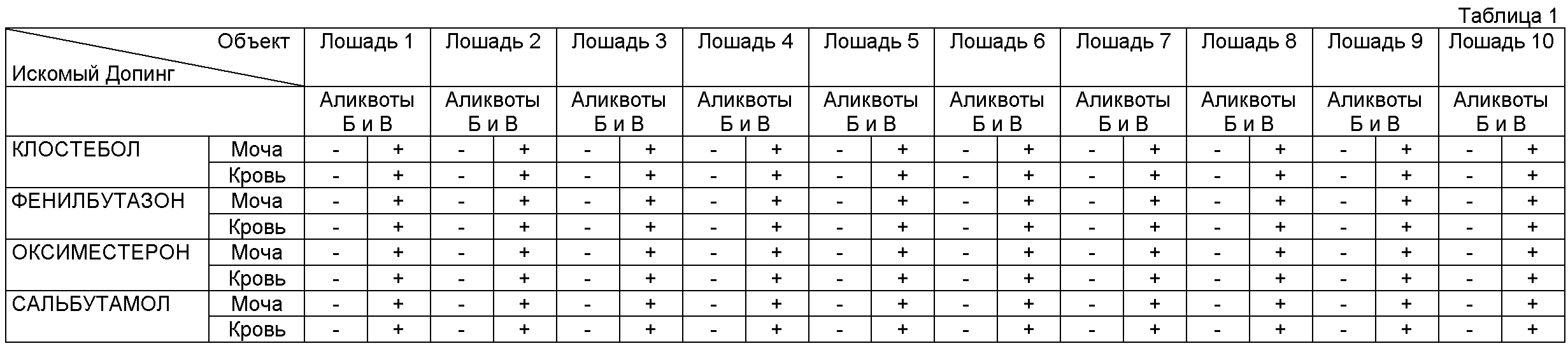
Установлено, что клостебол в организме лошадей метаболирует на два соединения - 4-хлорандрост-4-ен-3α,17β-диол и 4-хлорандростан-3α,17β-диол.
На Рис.1 представлены структурные формулы клостебола и его метаболитов в организме лошади.
|
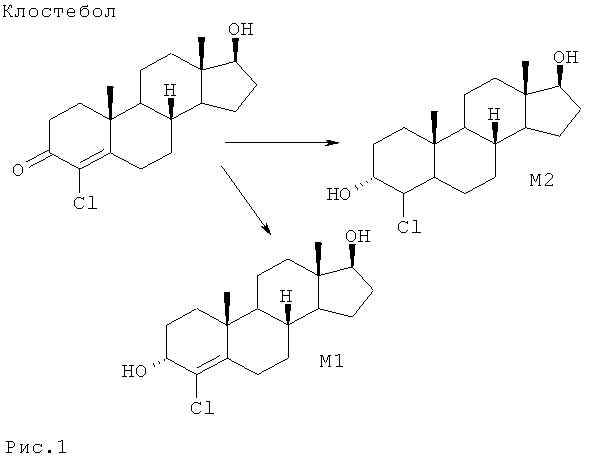
Установлено, что фенилбутазон в организме лошадей метаболирует в оксифенилбутазон и гамма-гидроксифенилбутазон. На рис.2 представлены структурные формулы фенилбутазона и его метаболитов в организме лошади.
|
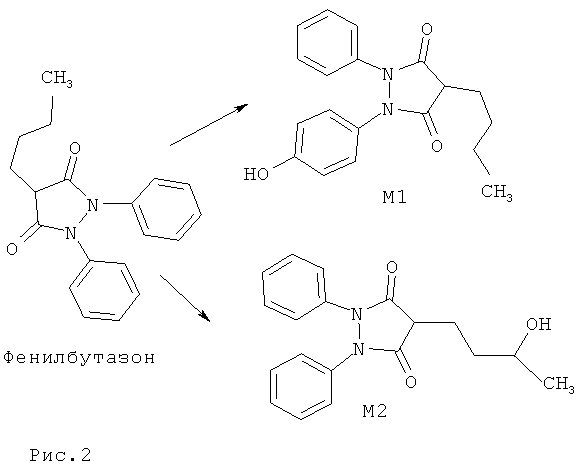
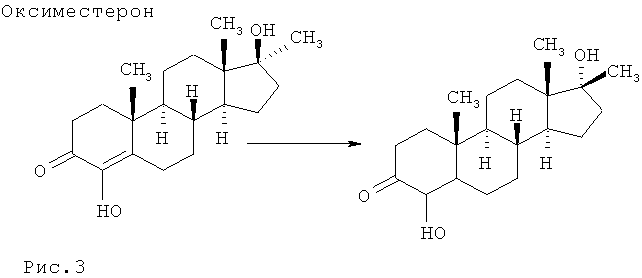
Установлено, что оксиместерон в организме лошадей метаболирует в 17β-метиландрост-4-ен-4,17α-диол-3-он.
На Рис.3 представлены структурная формула оксиместрона и его метаболита в организме лошади.
|
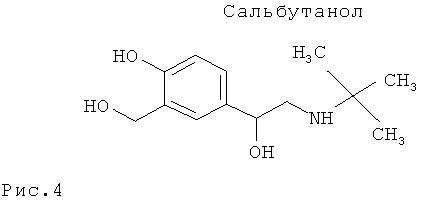
Установлено, что сальбутамол в организме лошади не метаболирует.
На Рис.4 представлена структурная формула сальбутамола.
Сопоставление результатов анализа, представленных в Таблицах 3-7, показывает, что допинг обнаружен в лошадях под номерами 2 (оксиместерон), 3 (сальбутамол), 7 и 8 (фенилбутазон) и 10 (клостебол).
Пример 2 (Контроль достоверности анализа)
Размораживают и проводят анализ аликвоты А образца мочи подозреваемой лошади под №9. Подготовку пробы и анализ ведут как в части «а» Примера 1. Анализ установил наличие фенилбутазона и его метаболитов.
|
Пример 3 (Использование полученных результатов анализов в качестве базы данных при допинговом контроле лошадей).
При проведении соревнований (скачки) на Центральном ***ском ипподроме были взяты пробы крови и мочи у 7 лошадей. Животные были пронумерованы соответственно 19, 20, 21 и т.д. до 25. У подозреваемых лошадей отбирают пробы мочи и крови, как в Примере 1, и далее проводят пробоподготовку образцов мочи и плазмы крови и хроматографический
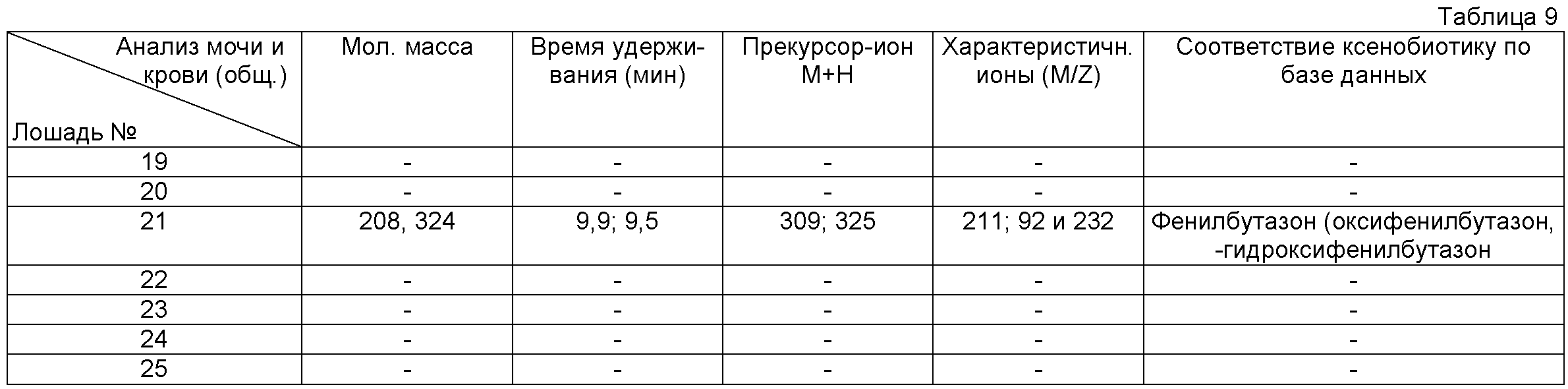
анализ проб также, как в Примере 1 (аликвота Б). Полученные результаты анализа представлены в Таблице 9 (среди прочих найдены прекурсор-ионы со следующими характеристиками, см. Таблицу 9 (стр.24)). Из сопоставления результатов анализа с базой данных, использующей результаты анализов всех вышеописанных проб, вытекает со всей очевидностью, что лошадь под №21 Примера 3 допирована фенилбутазоном.
Таким образом из приведенных примеров осуществления способа (в том числе и примера с определением сальбутамола), очевидно, что предложенный способ позволяет достоверно определить допинг у лошадей за счет обеспечения возможности однозначной идентификации химических соединений и их фрагментов в биологической жидкости в произвольных комбинациях при одновременном повышении точности определения характеристик исследуемых веществ, и соответственно, точности определения фрагментов исходного допингактивного вещества (ксенобиотика).
Источники информации
1. RU 2069363 C1, М.кл. G01N 30/02, публ. 1996 г.
2. WO 2004/104571, М.кл. G01N 30/00, публ. 2004 г.
3. RU 2384846 C1, М.кл. G01N 33/493, публ. 2010 г.
4. Anal. Chim. Acta., 697 (2011), 48-60 - прототип.
Способ определения допинга у лошадей, включающий отбор биологической жидкости, приготовление из нее анализируемой пробы путем экстракции, упаривания экстракта и растворения сухого остатка, хроматографическое разделение и масс-спектральный анализ анализируемой пробы с регистрацией полученных результатов и последующим определением наличия ксенобиотиков, отличающийся тем, что у подозреваемой лошади отбирают два вида биологической жидкости - плазму крови и мочу, каждую из них разделяют на три аликвоты - А, Б и В, из которых аликвоту А замораживают, аликвоту Б подвергают хроматографическому разделению и масс-спектральному анализу и регистрируют показатели времени удержания и соотношение интенсивности характеристичных ионов, а в аликвоте В растворяют вещество - эталон, далее осуществляют хроматографическое разделение и масс-спектральный анализ указанной аликвоты и регистрируют показатели времени удержания и соотношение интенсивности характеристичных ионов, затем выбирают заведомо недопированных лошадей, разделяют их на две равные группы - контрольную и подопытную и последнюю допируют искомым ксенобиотиком, при этом у подопытной группы лошадей определяют продукты метаболизма искомого ксенобиотика путем сравнения зарегистрированных результатов анализа проб биологических жидкостей подопытной и контрольной групп лошадей, и затем определяют искомый ксенобиотик у подозреваемой лошади, сравнивая показатели времени удержания и соотношение интенсивности характеристичных ионов всех проб с учетом полученных данных о продуктах метаболизма, а при возникновении сомнений в достоверности результата анализа дополнительно проводят анализ замороженных образцов биологической жидкости подозреваемой лошади как вариант ретроспективного определения допинга, а полученные результаты всех анализов впоследствии используют в качестве базы данных при допинговом контроле лошадей.
