Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ КЛЕТОК КОСТНОГО МОЗГА
Вид РИД
Изобретение
Изобретение относится к медицине, в частности к клинической биохимии, цитологии, патоморфологии, и может быть использовано для определения энергетической активности клеток костного мозга (ККМ).
Известен способ определения качества трансплантатов костного мозга, периферической и пуповинной крови, содержащих гемопоэтические стволовые клетки (ГСК), основанный на анализе экспрессии поверхностных антигенов, таких как CD34. Способ позволяет провести количественный учет ГСК CD34. Успех трансплантации во многом зависит от достаточной концентрации CD34 ГСК (Sutherland D.R., Anderson L., Keeney M., et al. The ISHAGE guidelines for CD34+ cell determination by flow cytometry. J. Hematother. 1996, 5; p 213-226). Способ основывается лишь на оценке фенотипа молекул клеточной поверхности. Однако применение этого способа имеет ряд ограничений:
- клеточные поверхностные маркеры могут различаться между собой в образцах из разных источников;
- популяция CD34 гетерогенна по экспрессии данного маркера;
- фенотип трансплантированных стволовых клеток может оставаться неизменным, несмотря на их сниженную функциональную активность.
Известен способ определения активности клеток костного мозга, предложенный в 1995 году и заключающийся в оценке активности внутриклеточного фермента альдегид дегидрогеназы (ALDH) (Jones R.J., Barber J.P. Vala M.S. et al. Assessment of Aldehyde Dehydrogenase in Viable Cells. Blood, 1995, Vol.85, №10, P.2742-2746). Способ основан на регистрации интенсивности свечения отрицательно заряженного продукта реакции в результате взаимодействия субстрата (добавленного к суспензии клеток) и фермента ALDH. Продукт реакции сохраняется внутри клетки только тогда, когда цитоплазматическая мембрана интактна (не повреждена). Таким образом, фактически этот метод дает возможность оценить в суспензии долю клеток с неповрежденными цитоплазматическими мембранами. Недостатком способа является высокая стоимость реактивов.
Общим недостатком приведенных способов является определение одной конкретной характеристики исследуемых клеток. Целесообразно использовать для определения качества популяции клеток интегральную характеристику.
Техническим результатом изобретения является расширение технических средств определения активности клеток костного мозга.
Указанный технический результат достигается в способе определения активности ККМ путем исследования суспензии клеток костного мозга, в котором суспензию клеток костного мозга обрабатывают флуоресцентным потенциалчувствительным витальным зондом иодид 2-(п-диметиламиностирил)-1-метилпиридиния до конечной концентрации зонда в пробе 1·10-5-1·10-4 М, инкубируют в течение 45-90 минут при 37°C, измеряют интенсивность флуоресценции зонда в клетках костного мозга, и по величине интенсивности флуоресценции судят об энергетической активности клеток костного мозга.
В настоящее время установлена прямая связь между энергетическим статусом клеток и их функциональной активностью (Скулачев В.П. Биоэнергетика в системе биологических наук. Молекулярные механизмы и регуляция энергетического обмена. Пущино, 1987, С.4-6; Мусил Я. Основы биохимии патологических процессов., М., 1985, С.284-293), а также корреляция между энергетической активностью клеток и уровнями электрических потенциалов на их плазматической и митохондриальных мембранах (Григорович Н.А., Алекса Т.Ф. Иммунология, 1984, №1, С.10-15; Морозова Г.И., Добрецов Г.Е., Дубур Г.Я. и др. Цитология, 1981, №8, с.916-923), установленная при исследовании живых клеток с помощью потенциалчувствительных зондов.
Среди прижизненных флуорохромов широко применяются акридиновый оранжевый и этидий (Кирьянова Е.А., Зеленин А.В. Некоторые закономерности накопления инородных для клеток веществ в лизосомах. ДАН СССР, 1970, 190, №2, С.451-454). Однако указанные флуорохромы не позволяют изучать энергетическое состояние митохондрий и, кроме того, сами влияют на энергетическое состояние живых клеток (Фадеева М.Ф., Браун А.Д. Повреждение интеркалирующими агентами. В кн.: Общие механизмы клеточных реакций на повреждающие воздействия. Л., Наука, 1977, с.149-151).
Использование флуоресцентных зондов позволяет исследовать состояние мембранных систем в клетках, в том числе митохондрий. К ним относятся флуоресцирующие соединения, нековалентно взаимодействующие с мембранными системами (Владимиров Ю.А., Добрецов Г.Н. Флуоресцентные зонды в исследовании биологических мембран, М., Наука, 1980). Наличие трансмембранного потенциала на энергизированных мембранах митохондрий приводит к аккумуляции внутри митохондрий положительно заряженных ионов (Скулачев В.П., Трансформация энергии в биомембранах, М., Наука, 1972).
Для исследования авторами был выбран флуоресцентный потенциалчувствительный витальный зонд иодид 2-(п-диметиламиностирил)-1-метилпиридиния катионного типа (2-DI-1-ASP) (Molecular Probes. Hand Book of Fluorescent Probes and Research Products). Он способен электродиффузно проникать через клеточные мембраны и накапливаться в цитоплазматическом матриксе, митохондриях и ядре в зависимости от величины и знака градиента электрического поля на соответствующих мембранах.
Нами обнаружена способность 2-DI-1-ASP проникать в живые ККМ и флуоресцировать в них. Экспериментально было подтверждено, что флуоресценция 2-DI-1-ASP чувствительна к изменению энергетического потенциала этих клеток при различных условиях их хранения.
Способ может быть осуществлен, например, следующим образом.
К суспензии ККМ добавляют флуоресцентный витальный потенциалчувствительный зонд 2-DI-1-ASP (конечная концентрация зонда в пробе 1·10-5-1·10-4 М), инкубируют при 37°C в течение 45-90 минут, готовят препараты клеток и исследуют на люминесцентном микроскопе, например, Люмам-И2 (ЛОМО, Россия). Флуоресценцию зонда возбуждают ртутной лампой ДРШ-250-2 с длиной волны 405-436 нм. Для регистрации флуоресценции используют фотометрическую насадку ФМЭЛ-1 и интерференционный фильтр с максимумом пропускания 585 нм. Длина волны возбуждения 470 нм, интенсивность флуоресценции регистрируют при длине волны 560 нм. В каждом препарате определяют флуоресценцию массива из 70-100 клеток. Полученные данные статистически обрабатывают.
Рабочая концентрация зонда была подобрана опытным путем с таким расчетом, чтобы можно было регистрировать энергетическую активность клеток как в исходной суспензии (когда они максимально активны), так и после хранения (когда энергетическая активность клеток значительно снижена). При концентрации зонда ниже 1·10-5 М клетки плохо видны, интенсивность их свечения мало отличается от свечения фона. При концентрации зонда выше 1·10-4 М появляется избыточное диффузное окрашивание цитоплазмы и клеточные структуры невозможно дифференцировать. Время инкубации с зондом от 45 до 90 минут. При времени инкубации менее 45 минут интенсивность флуоресценции 2-DI-1-ASP достоверно снижена (для 8 пар наблюдений Р=0,05, критерий Вилкоксона-Манна-Уитни), далее 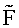 возрастает до максимальной величины и сохраняется постоянной до 90-100 минут инкубации.
возрастает до максимальной величины и сохраняется постоянной до 90-100 минут инкубации.
Способ подтверждается примерами, в которых получение и заготовку ККМ проводили по опубликованной методике (Фрегатова Л.М., Зубаровская Л.С., Эстрина М.А., Головачева А.А., Бабенко Е.В., Платонова Г.Г., Зуева Е.Е., Афанасьев Б.В. Методы получения стволовых клеток у больных и доноров для их последующей трансплантации. СПб, Изд. СПбГМУ, кафедра гематологии, трансфузиологии, трансплантологии ФПО, 2004). Криоконсервацию и размораживание ККМ проводили по методу, описанному ранее (Kessinger A., Armitage J., Landmark J., Weisenburger D. Reconstitution of Human Hematopoietic Function with Autologous Cryopreserved Circulating Stem Cells. Exp.Hemat. Vol.14, 1986, P.192-196). Отмывание клеток от стандартного раствора стабилизатора, а также от криопротектора диметилсульфоксида (ДМСО) после размораживания проводили физиологическим раствором или раствором Хенкса в разведении 1:10. Состав среды Хенкса: 0,13 М хлорида натрия, 5,5 М хлорида калия, 1,2 мМ фосфата натрия, 1,0 мМ хлорида кальция, 1,0 мМ хлорида магния, 10,0 мМ глюкозы; рН 7,4. Состав стандартного раствора стабилизатора: в 100 мл содержится 2,63 г цитрата натрия, 0,327 г лимонной кислоты, 0,251 г дигидрофосфата натрия, 2,9 г декстрозы безводной, 0,0275 г аденина. Подготовку ККМ для флуориметрических измерений проводили по следующей схеме: суспензию клеток после размораживания переносили из пробирок типа Эппендорф в центрифужные пробирки емкостью 10-12 мл, сразу же добавляли физиологический раствор или раствор Хенкса в десятикратном избытке по отношению к объему суспензии клеток, хорошо перемешивали и центрифугировали при 8000-10000 об/мин, в течение 8-12 минут при комнатной температуре, надосадочную жидкость удаляли, осадок ресуспендировали в физиологическом растворе или в растворе Хенкса и далее полученную суспензию клеток использовали для флуориметрических исследований. Центрифугирование при меньшей скорости чем 8000 об/мин, менее 8 минут не дает возможности полностью осадить клетки (надосадочная жидкость мутная, осадок неплотный). При центрифугировании со скоростью более 10000 об/мин, и более 10 минут осадок получается слишком плотный, плохо ресуспендируется, часть клеток остается на стенках центрифужной пробирки.
Пример 1. Донор, ж., 39 л. Для исследования были взяты криоконсервированные ККМ, разморожены, отмыты физиологическим раствором, хранились при 37°C в термостате. Через определенные временные интервалы отбирали пробы клеток, инкубировали их с 2-DI-1-ASP и определяли  , усл.ед. Результаты исследования представлены в таблице 1.
, усл.ед. Результаты исследования представлены в таблице 1.
|
Полученные данные показывают, что при хранении ККМ в физиологическом растворе (0,9 М раствор хлорида натрия) уже через 3 часа суммарная интенсивность флуоресценции 2-DI-l-ASP (F) снижается с 71,5±4,1 до 31,6±2,4 усл.ед.
Пример 2. Донор, ж., 36 л. Криоконсервированные ККМ разморожены, не отмыты от криопротектора (7% ДМСО), хранились в термостате при 37°C. Через определенные временные интервалы отбирали пробы клеток, инкубировали их с 2-DI-1-ASP и определяли 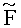 , усл.ед. Результаты исследования представлены в таблице 2.
, усл.ед. Результаты исследования представлены в таблице 2.
|
При хранении ККМ после их размораживания без отмывания от криопротектора ДМСО уже через 1,5 часа 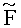 снижается с 65,3±2,1 до 30,3±1,2 усл.ед.
снижается с 65,3±2,1 до 30,3±1,2 усл.ед.
В примерах 3, 4, 5 продемонстрировано воздействие стандартного стабилизатора и среды Хенкса, а также криоконсервации и размораживания при различных сроках хранения на ККМ одного и того же донора, м., 43 года.
Пример 3. ККМ в среде стандартного стабилизатора хранились в термостате при 37°C. Через определенные временные интервалы отбирали пробы клеток, инкубировали их с 2-DI-1-ASP и определяли 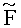 , усл.ед.
, усл.ед.
Результаты исследования представлены в таблице 3.
|
Пример 4. ККМ отмывали от среды стабилизатора, хранили в термостате при 37°C в среде Хенкса. Через определенные временные интервалы отбирали пробы клеток, инкубировали их с 2-DI-1-ASP и определяли 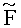 , усл.ед.
, усл.ед.
Результаты исследования представлены в таблице 4.
|
Из примеров 3 и 4 следует, что хранение ККМ в стандартном растворе стабилизатора по сравнению с раствором Хенкса является оптимальным.
Пример 5. ККМ криоконсервированы в одних и тех же условиях в пробирках типа Эппендорф с криопротектором ДМСО. Три параллельных опыта ставили на трех отдельных образцах (в трех пробирках). После размораживания ККМ отмывали и хранили в термостате при 37°C в среде Хенкса. Через определенные временные интервалы отбирали пробы клеток, инкубировали их с 2-DI-1-ASP, определяли 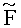 , усл.ед. Результаты исследования представлены в таблице 5.
, усл.ед. Результаты исследования представлены в таблице 5.
|
Усредненные величины по трем образцам приведены в таблице 6.
|
Из примера 5 видно, что Δ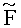 ККМ уже через 24 часа хранения после размораживания снизилась с 96,2±4,8 до 43,3±1,7, таким образом, криоконсервация и размораживание являются дополнительными стрессовыми факторами для ККМ.
ККМ уже через 24 часа хранения после размораживания снизилась с 96,2±4,8 до 43,3±1,7, таким образом, криоконсервация и размораживание являются дополнительными стрессовыми факторами для ККМ.
Способ позволяет с высокой степенью достоверности определять энергетическую активность и судить о воздействии различных факторов на ККМ.
Способ определения активности клеток костного мозга путем исследования суспензии клеток костного мозга, отличающийся тем, что суспензию клеток костного мозга обрабатывают флуоресцентным потенциалчувствительным витальным зондом иодид 2-(п-диметиламиностирил)-1-метилпиридиния до конечной концентрации зонда в пробе 1·10-1·10 М, инкубируют в течение 45-90 мин при 37°C, измеряют интенсивность флуоресценции зонда в клетках костного мозга и по величине интенсивности флуоресценции судят об энергетической активности клеток костного мозга.
