Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 3-АМИНО-1-АДАМАНТАНОЛА И ЕГО КИСЛОТНО-АДДИТИВНЫХ СОЛЕЙ
Вид РИД
Изобретение
Изобретение относится к способу получения 3-амино-1-адамантанола и его кислотно-аддитивных солей, который является ключевым соединением в синтезе фармацевтического препарата «Вилдаглиптин» (лекарство нового поколения для терапии сахарного диабета 2 типа).
Данным изобретением решена задача получения 3-амино-1-адамантанола и его кислотно-аддитивных солей - ключевого соединения для синтеза противодиабетического препарата «Вилдаглиптин».
Известны способы синтеза гидрохлорида 3-амино-1-адамантанола [1-4]. Однако приведенные способы имеют ряд существенных недостатков:
1. Использование дорогостоящих и высокотоксичных реагентов.
2. Сложность аппаратурного оформления процесса.
Известен способ получения гидрохлорида 3-амино-1-адамантанола, заключающийся в восстановлении 1-гидрокси-3-нитроадамантана [5]. В качестве восстановителя используют систему водород - палладий на угле. Выход продукта составляет 99%. Однако исходное нитропроизводное является довольно дорогостоящим и трудно синтезируемым соединением и использование его как сырьевой основы представляется экономически нецелесообразным.
Альтернативный подход к получению гидрохлорида 3-амино-1-адамантанола предложен авторами [6] и заключается в обработке 1-аминоадамантана метилтрифторметилдиоксираном в кислой среде. Несмотря на то, что выход продукта составляет 98%, для проведения реакции требуется дорогостоящее сырье, а саму реакцию необходимо проводить при низкой температуре, что весьма затруднительно в условиях промышленного производства.
Имеется ссылка на способ синтеза гидрохлорида 3-амино-1-адамантанола по модифицированной реакции Курциуса [7]. В качестве исходного соединения используют 3-бром-1-адамантанкарбоновую кислоту, которая через стадию превращения в ацилазид превращается 1-амино-3-гидроксиадамантан. Суммарный выход составляет 80-85%. К очевидным недостаткам данного метода следует отнести: двухстадийность процесса, использование дорогостоящего и взрывоопасного сырья, процесс осуществляется при пониженной температуре.
Наиболее близким по технической сущности к заявляемому способу методом является окисление 1-аминоадамантана концентрированной азотной кислотой в среде серной кислоты [8]. Существенными недостатками этого способа являются необходимость использования дорогостоящего 1-аминоадамантана, синтез которого представляет собой отдельную технологическую проблему, и большой расход концентрированной серной кислоты.
Технический результат изобретения является более простым в техническом отношении, экономически эффективным и безопасным методом получения 3-амино-1-адамантанола.
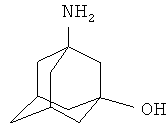
Технический результат достигается тем, что синтез целевого соединения проводили путем окисления адамантана дымящей азотной кислотой в мольном соотношении 1:7-15 соответственно в присутствии ледяной уксусной кислоты в мольном соотношении 1:0,5-2,5 в расчете на адамантан с последующим добавлением водного раствора мочевины (в мольном соотношении 1:1-5 по отношению к адамантану, содержание мочевины в воде 44-52%), являющейся в данной реакции агентом аминирования, нагреванием реакционной смеси в течение 0.5-5 ч при температуре 70-125°С и дальнейшим взаимодействием с концентрированной серной кислотой в мольном соотношении 1:5-20 в расчете на адамантан с последующим нагреванием реакционной массы в течение 6-25 ч при 60-120°С.
Разложение реакционной смеси осуществляли с помощью 30-40%-ного водного раствора гидроксида натрия при температуре 60-70°С. Дальнейшей экстракцией из водного раствора н-бутанолом с последующей отгонкой растворителя получали необходимый 3-амино-1-адамантанол с выходом, близким к количественному. Для получения кислотно-аддитивных солей в органическую фракцию добавляли соответствующую минеральную кислоту.
Основные отличительные признаки предлагаемого способа можно сформулировать следующим образом:
1. В предлагаемом способе в качестве исходного соединения используется адамантан, который является более доступным сырьем в сравнении с 1-аминоадамантаном.
2. Стадия аминирования и окисления процесса объединены в одном реакционном сосуде, что существенно упрощает аппаратурную схему производства и, следовательно, сокращает данную статью расходов.
3. Малое количество стоков и малая экологическая нагрузка.
Выполнение способа
Строение синтезированного соединения подтверждено данными ИК и масс-спектров, контроль над ходом реакции и индивидуальность соединения определялись с помощью ТСХ и ГЖХ. ГЖХ анализ проводился на газовом хроматографе «Кристалл 2000М», кварцевая капиллярная колонка ZB5MS 30 м × 0.32 мм толщина фазы 0.25 µм, газ-носитель гелий. ИК спектр записан на спектрометре Shimadzu FTIR-8400S в таблетках бромида калия либо в тонком слое в призмах. Масс-спектр получен на хроматомасс-спектрометре «Finnigan Trace DSQ» при энергии ионизирующих электронов 70 эВ. Элементный анализ выполнен на автоматическом CHNS-анализаторе " Euro Vector ЕА-3000".

Пример 1. К суспензии 10 г (0.073 моль) адамантана и 10 мл (0.175 моль) ледяной уксусной кислоты при перемешивании по каплям добавляют 21 мл (0.51 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 8 г (0.133 моль) мочевины в 8 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 100°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 40 мл (0.751 моль) концентрированной серной кислоты и нагревают при 80°С в течение 14 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат, растворитель упаривают в вакууме. Выход: 10.34 г (84%). ИК-спектр, v, см-1: 3370, 3340 (NH2-OH), 2912 v (Ad). Масс-спектр, m/z (Iотн., %): 167 (20) [М+]; 110 (100) [М+-57]; 94 (18) [М+-73]; 57 (10) [М+-110]. Найдено, %: С 72.04; Н 10.18; N 8.40. C10H17NO. Вычислено, %: С 71.81; Н 10.25; N 8.37.
Пример 2. К суспензии 10 г (0.073 моль) адамантана и 8 мл (0.14 моль) ледяной уксусной кислоты при перемешивании по каплям добавляют 26 мл (0.657 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 9 г (0.15 моль) мочевины в 10 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 120°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 40 мл (0.751 моль) концентрированной серной кислоты и нагревают при 80°С в течение 15 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат, растворитель упаривают в вакууме. Выход: 10.34 г (84%).
Пример 3. К суспензии 10 г (0.073 моль) адамантана и 9 мл (0.16 моль) ледяной уксусной кислоты при перемешивании по каплям добавляют 26 мл (0.657 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 9 г (0.15 моль) мочевины в 10 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 120°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 40 мл (0.751 моль) концентрированной серной кислоты и нагревают при 90°С в течение 12 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат, растворитель упаривают в вакууме. Выход: 10.43 г (85%).
Пример 4. К суспензии 10 г (0.073 моль) адамантана и 10 мл (0.175 моль) ледяной уксусной кислоты при перемешивании по каплям добавляют 30 мл (0.73 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 8 г (0.133 моль) мочевины в 10 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 120°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 60 мл (1.126 моль) концентрированной серной кислоты и нагревают при 100°С в течение 10 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат, растворитель упаривают в вакууме. Выход: 10.43 г (85%).
Пример 5. К суспензии 10 г (0.073 моль) адамантана и 10 мл (0.175 моль) ледяной уксусной кислоты при перемешивании по каплям добавляют 30 мл (0.73 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 8 г (0.133 моль) мочевины в 8 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 120°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 50 мл (0.938 моль) концентрированной серной кислоты и нагревают при 90°С в течение 15 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН=12 и экстрагируют н-бутанолом. Органическую фракцию сушат, растворитель упаривают в вакууме. Выход: 10.48 г (86%).
Пример 6. К суспензии 10 г (0.073 моль) адамантана и 7 мл (0.123 моль) ледяной уксусной кислоты при перемешивании по каплям добавляют 30 мл (0.73 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 7 г (0.117 моль) мочевины в 7 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 100°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 45 мл (0.845 моль) концентрированной серной кислоты и нагревают при 70°С в течение 18 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат, растворитель упаривают в вакууме. Выход: 10.47 г (86%).
Пример 7. К суспензии 10 г (0.073 моль) адамантана и 10 мл (0.175 моль) ледяной уксусной кислоты при перемешивании по каплям добавляют 30 мл (0.73 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 10 г (0.175 моль) мочевины в 10 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 110°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 45 мл (0.845 моль) концентрированной серной кислоты и нагревают при 100°С в течение 12 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат, растворитель упаривают в вакууме. Выход: 10.47 г (86%).
Пример 8. К суспензии 10 г (0.073 моль) адамантана и 10 мл (0.175 моль) ледяной уксусной кислоты при перемешивании по каплям добавляют 30 мл (0.73 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 10 г (0.175 моль) мочевины в 10 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 120°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 60 мл (1.127 моль) концентрированной серной кислоты и нагревают при 100°С в течение 9 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат, растворитель упаривают в вакууме. Выход: 10.73 г (88%).
Пример 9. К суспензии 10 г (0.073 моль) адамантана и 10 мл (0.175 моль) ледяной уксусной кислоты при перемешивании по каплям добавляют 30 мл (0.73 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 11 г (0.183 моль) мочевины в 10 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 120°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 50 мл (0.938 моль) концентрированной серной кислоты и нагревают при 110°С в течение 6 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат, растворитель упаривают в вакууме. Выход: 10.85 г (89%).
Пример 10. К суспензии 10 г (0.073 моль) адамантана и 10 мл (0.175 моль) ледяной уксусной кислоты при перемешивании по каплям добавляют 30 мл (0.73 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 11 г (0.183 моль) мочевины в 11 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 120°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 50 мл концентрированной серной кислоты и нагревают при 100°С в течение 8 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат, растворитель упаривают в вакууме. Выход: 11.00 г (90%).
Пример 11. К суспензии 10 г (0.073 моль) адамантана и 10 мл (0.175 моль) ледяной уксусной кислоты при перемешивании по каплям добавляют 30 мл (0.73 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 11 г (0.183 моль) мочевины в 11 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 120°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 55 мл (1.03 моль) концентрированной серной кислоты и нагревают при 90°С в течение 12 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат, растворитель упаривают в вакууме. Выход: 11.58 г (95%).
Пример 12. Синтез гидрохлорида 3-амино-1-адамантанола. К суспензии 10 г (0.073 моль) адамантана и 10 мл ледяной уксусной кислоты при перемешивании по каплям добавляют 30 мл (0.73 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 11 г (0.183 моль) мочевины в 11 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 120°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 55 мл (1.03 моль) концентрированной серной кислоты и нагревают при 90°С в течение 12 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат, добавляют концентрированную соляную кислоту. Выпавший осадок отфильтровывают и сушат. Выход: 13.70 г (92%).
Пример 13. Синтез гидробромида 3-амино-1-адамантанола. К суспензии 10 г (0.073 моль) адамантана и 10 мл ледяной уксусной кислоты при перемешивании по каплям добавляют 30 мл (0.73 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 11 г (0.183 моль) мочевины в 11 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 120°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 55 мл (1.03 моль) концентрированной серной кислоты и нагревают при 90°С в течение 12 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат и насыщают газообразным бромоводородом. Выпавший осадок отфильтровывают и сушат. Выход: 16.52 г (91%).
Пример 14. Синтез гидросульфата 3-амино-1-адамантанола. К суспензии 10 г (0.073 моль) адамантана и 10 мл ледяной уксусной кислоты при перемешивании по каплям добавляют 30 мл (0.73 моль) дымящей азотной кислоты при температуре не выше 30°С. После растворения адамантана (контроль реакции по ГЖХ) медленно по каплям добавляют раствор 11 г (0.183 моль) мочевины в 11 мл воды таким образом, чтобы температура не поднималась выше 30°С. Затем реакционную смесь нагревают при 120°С до тех пор, пока 1-адамантанол перестанет аналитически определяться (контроль реакции по ГЖХ). После этого в реакционную смесь добавляют 55 мл (1.03 моль) концентрированной серной кислоты и нагревают при 90°С в течение 12 ч. Реакционную смесь доводят 40%-ным раствором гидроксида натрия до рН 12 и экстрагируют н-бутанолом. Органическую фракцию сушат, добавляют серную кислоту. Выпавший осадок отфильтровывают и сушат. Выход: 18.05 г (93%).
Литература
1. Lavrova, L.N., Indulen, М.K., Ryazantseva, G.М., Korytnyi, V.S., Yashunskii, V.G. // Pharmaceutical Chemistry Journal, 1990. N.24, V.1. P.35-39.
2. Patent; Upjohn Co.; FR 1511936; 1966.
3. Patent US5395846A. Amino bi- and tricarbocyclic alkane bis-arylsqualene synthase inhibitors / Morris, R.L., Neuenshawander, K.W., Learn, K.S., Scotese, A.C. Mar.7, 1995.
4. Patent US5395846A. Amino bi- and tricarbocyclic alkane bis-arylsqualene synthase inhibitors / Morris, R.L., Neuenshawander, K.W., Learn, K.S., Scotese, A.C. Mar.7, 1995.
5. Patent EP0915077A1. Polymerizable adamantine derivates and process for producing the same / ISHII, Yasutaka. 12.09.1988.
6. Asensio, G., Gonzalez-Nunez, M.E., Bernardini, C.B., Mello, R., Adam, W. Regioselective oxyfunctionalization of unactivated tertiary and secondary C-H bonds of alkylamines by methyl(trifluoromethyl)dioxirane in acid medium. // Journal of the American Chemical Society. 1993. N.1 15, V 16. P.7250-7253.
7. B.Donetti et. Al. Synthesis of 1-amino-3-hydroxy-adamantane. I/Synthetic Communications. 1973, V.3. P.165-166.
8. Patent WO2011101861 A1. Preparation for preparation of DPP-IV inhibitors / SATYA-NARAYANA REDDY, Jan. 28, 2011.
Способ получения 3-амино-1-адамантанола и его кислотно-аддитивных солей путем окисления адамантана дымящей азотной кислотой в мольном соотношении 1:7-15 соответственно в присутствии ледяной уксусной кислоты в мольном соотношении 1:0,5-2,5 в расчете на адамантан с последующим добавлением водного раствора мочевины в мольном соотношении 1:1-5 по отношению к адамантану, содержание мочевины в воде 44-52%, являющейся в данной реакции агентом аминирования, нагреванием реакционной смеси в течение 0,5-5 ч при температуре 70-125°С и дальнейшим взаимодействием с концентрированной серной кислотой в мольном соотношении 1:5-20 в расчете на адамантан с последующим нагреванием реакционной массы в течение 6-25 ч при 60-120°С.
