Результат интеллектуальной деятельности: СПОСОБ ЭНАНТИОСЕЛЕКТИВНОГО СИНТЕЗА (R)-ДИЭТИЛ(2-НИТРО-1-ФЕНИЛЭТИЛ) МАЛОНАТА В ПРИСУТСТВИИ КОМПЛЕКСА НИКЕЛЯ
Вид РИД
Изобретение
Изобретение относится к способу получения (R)-диэтил(2-нитро-1-фенилэтил)-малоната формулы I
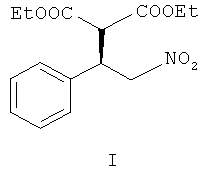
путем энантиоселективного присоединения диэтилмалоната к транс-β-нитростиролу в соответствии со схемой 1
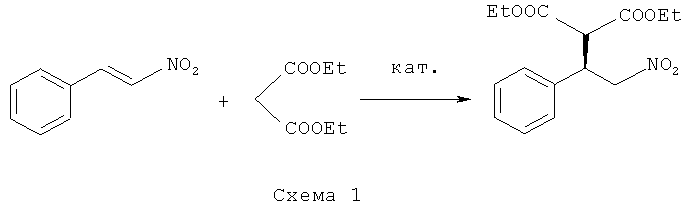
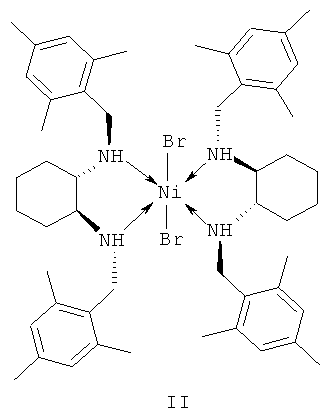
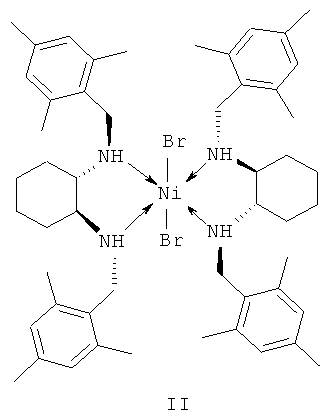
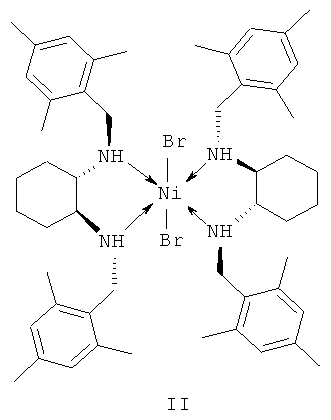
в присутствии хирального катализатора, отличающийся тем, что катализатор представляет собой комплекс никеля (II) формулы II с (S,S)-N,N'-ди(2,4,6-триметилбензил)циклогексан-1,2-диамином.
Соединение формулы I используется для синтеза фармацевтических препаратов фенибут и фенотропил, обладающих нейротропной активностью.
Гареев Г.А., Бовт В.В., Першин Н.С. Пат. RU 2146246 С1. Способ получения гидрохлорида γ-амино-β-фенилмасляной кислоты (фенибута). Дата публикации 10.03.2000. Гареев Г.А., Бовт В.В., Ковалев В.А., Ковалев В.В. Заявка на изобретение RU 2000108535/04. Способ получения производных 3-фенил-4-аминомасляной кислоты (лекарственных препаратов фенибут, карфедон и мефибут). Дата публикации 20.03.2002.
Данным изобретением решена задача энантиоселективного синтеза ключевого полупродукта производства препаратов фенибут и фенотропил с использованием легкодоступного и дешевого катализатора, что обеспечивает значительное удешевление и упрощение технологического процесса. Поскольку нейротропной активностью обладают лишь (R)-изомеры препаратов фенибут и фенотропил (Dambrova М., Zvejniece L., Liepinsh Е., Cirule Н., Zharkova О., Veinberg G., Kalvinsh I. // Eur. J. Pharmacology. 2008. N 583. P.128-134; Veinbergs G., Vorona M., Dambrova M., Zvejniece L., Karina L., Kalvins I., Cernobrovijs A., OLAINFARM AS. Pat. LV 13630 (B). Method of preparation and use of pharmaceutically active N-carbamoylmethyl-4(R)-phenyl-2-pyrrolidinone. Дата публикации 20.12.2007), формирование асимметрического центра требуемой конфигурации на стадии синтеза соединения формулы I исключает необходимость дополнительных стадий разделения рацемических смесей, обычно используемых в производстве данных фармацевтических препаратов.
Veinberg G., Vorona М., Lebedevs A., Chernobrovijs A., Kalvinsh I. Pat. WO 2007/096314 (A2) Enzymatic resolution of racemic 3-aryl-4-aminobutyric acids. Дата публикации 30.08.2007.
Известен ряд способов получения соединения формулы I, основанных на энантио-селективном присоединении диэтилмалоната к транс-β-нитростиролу в присутствии катализаторов - хиральных органических соединений и комплексов переходных металлов.
В литературе описаны методы получения (R)-диэтил(2-нитро-1-фенилэтил)-малоната, основанные на использовании органокатализа.
В работе (Miyabe Н., Takemoto Y. // Bull. Chem. Soc. Japan. 2008. Vol.81. N 7. P.785-795) сообщается о синтезе соединения формулы I присоединением диэтилмалоната к транс-β-нитростиролу в присутствии бифункциональных хиральных производных тиомочевин. Энантиоселективность реакции составляет 35-93% в зависимости от структуры используемого органокатализатора.
В качестве катализатора присоединения диэтилмалоната к нитростиролу использованы хиральные производные /иранс-циклогександиамин-бензимидазола (Almasi D., Alonso D.A., Gomes-Bengoa Е., Najera С. // J. Org. Chem. 2009. Vol.74. N 16. P.6163-6168). Энантиомерный избыток соединения формулы I достигает 93%.
Сообщается об использовании хиральных гуанидинов (Terada М., Ube Н., Yaguchi Y. // J. Am. Chem. Soc. 2006. Vol.128. P.1454-1455) и производных цинхонидина в качестве катализаторов в синтезе соединения формулы I.
Однако использование органокатализаторов представляется малоперспективным с точки зрения возможности реализации в промышленных условиях вследствие необходимости использования высоких концентраций катализаторов (5-20 мольн.%) и их синтетической труднодоступности. Более перспективным является использование металлокомплексного катализа: в этом случае возможно значительное снижение концентраций каталитического комплекса.
В работе (Barnes D.M., Jianguo J., Fickes M.G., Fitzgerald M.A., King S.A., Morton H.E., Plagge F.A., Preskill M., Wagaw S.H., Wittenberger S.J., Zhang J. // J. Am. Chem. Soc. 2002. Vol.124. N 44. P.13097-13105) описано присоединение диэтилмалоната к транс-β-нитростиролу в присутствии катализатора, генерируемого из трифлата магния и хирального бис-оксазолина. Выход соединения формулы I составляет 92%, а энантиомерный избыток (R)-изомера 95%. Недостатком указанного способа является использование высоких концентраций катализатора (5 мольн.%).
В публикациях (Evans D.A., Seidel D. // J. Am. Chem. Soc. 2005. Vol.127. N 28. P.9958-9959 и Evans D.A., Mito S., Seidel D. // J. Am. Chem. Soc. 2007. Vol.129. N 37. P.11583-11592) сообщается об использовании комплекса никеля (II) с (R,R)-N,N'-дибензилциклогексан-1,2-диамином в катализе присоединения диэтилмалоната к транс-β-нитростиролу. Выход продукта присоединения (5)-диэтил(2-нитро-1-фенилэтил)малоната 99%, энантиомерный избыток 95%. Концентрация катализатора составила 2 мольн.% по отношению к нитростиролу, время реакции 4 ч. Описанный авторами работ способ относится к получению (S)-изомера соединения I, в то время как для синтеза фармацевтических препаратов фенибут и фенотропил необходимо использование (R)-изомера соединения I.
Наиболее близким по технической сущности к заявляемому способу является способ получения оптически активных нитро- и цианосоединений присоединением 1,3-дикарбонильных соединений к непредельным нитро- и цианопроизводным в присутствии ареновых комплексов рутения с сульфамидными лигандами на основе (R,R)- и (S,S)-1,2-дифенилэтилендиамина.
Watanabe М., Murata К., Ikariya Т. Pat. US 2005/0101787 Al. Process for preparing optically active nitro compounds and cyano compounds, дата публикации 12.05.2005. Описанный в Pat. US 2005/0101787 A1 способ получения соединения формулы I заключается в том, что [(S,S)-N-(пентаметилбензолсульфонил)-1,2-дифенилэтилендиамин](гексаметилбензол)рутений (0.02 ммоль), транс-β-нитростирол (1.0 ммоль), диэтил-малонат (1.0 ммоль) и 1 мл толуола помещали в сосуд Шленка емкостью 20 мл, заполненный аргоном, и реакционную смесь перемешивали при -20°C в течение 48 ч. Продукт реакции выделяли флэш-хроматографией на силикагеле с использованием элюента гексан/ацетон 80:20. Выход соединения I составил 89%, а энантиомерный избыток (R)-изомера 93%.
Указанный способ обладает целым рядом существенных недостатков:
1. Использование дорогостоящих комплексов рутения в концентрациях 2 мольн. %.
2. Использование труднодоступного хирального лиганда - (S,S)-N-(пентаметилбензолсульфонил)-1,2-дифенилэтилендиамина.
3. Длительность процесса (48 ч) и необходимость его проведения в инертной атмосфере с использованием специального оборудования, что обусловлено чувствительностью катализатора к кислороду воздуха..
Технический результат - получение соединения формулы I с энантиомерным избытком 97% с использованием дешевого и легкодоступного комплекса никеля (II) с хиральным диамином, устойчивым к кислороду и влаге воздуха, упрощение и удешевление технологического процесса.
Технический результат достигается тем, что катализатор представляет собой комплекс никеля (II) формулы II с (S,S)-N,N'-ди(2,4,6-триметилбензил)циклогексан-1,2-диамином, концентрация катализатора формулы II составляет 0.1-1 мольн. % по отношению к субстрату - транс-β-нитростиролу, температура реакции составляет 25-50°C, а время реакции 4-24 ч, катализатор формулы II может быть получен in situ, минуя стадии выделения и очистки каталитического комплекса.
Отличительные признаки:
1. Использование в качестве катализатора хирального комплекса никеля - дихлоро-бис[(S,S)-N,N'-ди(2,4,6-триметилбензил)циклогексан-1,2-диамин]никеля (II).
2. Уменьшение концентрации катализатора до 0.1 мольн.%.
3. Уменьшение времени проведения реакции.
4. Возможность проведения реакции на воздухе и при температуре 25-50°C.
5. Возможность получения катализатора in situ.
Заявляемое изобретение имеет следующие преимущества.
Удешевление производства за счет применения в качестве катализатора энантиоселективного присоединения диэтилмалоната к нитростиролу комплекса никеля и отказа от использования дорогостоящих и труднодоступных комплексов рутения.
Упрощения технологического процесса за счет применения в качестве хирального лиганда для приготовления катализатора легкодоступного (S',S)-N,N'-ди(2,4,6-триметилбензил)циклогексан-1,2-диамина, возможности проведения реакции без использования инертной атмосферы и при комнатной температуре.
Возможность приготовления катализатора in situ, что исключает дополнительные стадии выделения и очистки каталитического комплекса.
Примеры выполнения способа
Спектры ЯМР регистрировали на приборе Jeol JNM-ECX400 с использованием растворителя CDCl3 [399.78 (1H) и 100.53 МГц (13С)]. Измерения проводили без использования дополнительных эталонов с привязкой частоты к сигналу дейтерированного растворителя.
Масс-спектры синтезированных соединений получены на хроматомасс-спектрометре Finnigan Trace DCQ с использованием капиллярной колонки ВРХ-5 30×0.32 компании SGE при энергии ионизирующих электронов 70 эВ.
Энантиомерный состав продуктов реакции определен методом ВЭЖХ с использованием колонки с неподвижной хиральной фазой Chiralcel AD. Условия анализа для соединения формулы I: элюент гексан: изопропанол (95:5), расход 1.0 мл/мин. Время выхода (R)-изомера tr=18.5 мин, (S)-изомера tr=43.1 мин.
Определение удельных углов вращения проводилось на поляриметре Rudolph Research Analitical.
Пример 1
201 мг (0.532 ммоль) (S,S)-N,N'-ди(2,4,6-триметилбензил)циклогексан-1,2-диамина и 54.0 мг (0.247 ммоль) бромида никеля (II) кипятили в 5 мл ацетонитрила в течение 12 ч. Растворитель упаривали в вакууме, а остаток растворяли в 20 мл хлористого метилена. Полученный раствор фильтровали от незначительной взвеси, упаривали хлористый метилен, и полученный комплекс перекристаллизовывали из 5 мл диэтилового эфира при температуре -10°C. Выход: 90 мг (37.3%). [α]D 20 - 12.65° (c 0.03, CHCl3). Найдено, %: C 63.95, H 7.83, N 5.69; C52H76Br2N4Ni; вычислено, %: C 64.01, H 7.85, N 5.74. ИК, см-1: 3298, 3001, 2921, 2855, 2809, 2765, 2346, 1614, 1580, 1481, 1459, 1440, 1374, 1350, 1336, 1109, 1049, 845. 3298, 3001, 2921, 2855, 2809, 2765, 2346, 1614, 1580, 1481, 1459, 1440, 1374, 1350, 1336,1109,1049, 845.
Пример 2
757 мг (2.0 ммоль) (S,S)-N,N'-ди(2,4,6-триметилбензил)циклогексан-1,2-диамина и 273 мг (1.0 ммоль) тригидрата бромида никеля (II) растворяли в 10 мл метанола, раствор выдерживали в течение 1 ч, и полученный 0.1 М раствор катализатора использовали для проведения реакции (см. примеры 5, 6).
Пример 3
К раствору 0.37 г (2.5 ммоль) транс-β-нитростирола и 0.48 г (0.455 мл, 3.0 ммоль) диэтилмалоната в 1.68 мл толуола добавляли 24.4 мг (0.025 ммоль, 1 мольн. % по отношению к нитростиролу) катализатора формулы II. Реакционную смесь выдерживали при температуре 25°C в течение 4 ч. Продукт реакции выделяли флэш-хроматографией на силикагеле. Выход: 0.69 г (89.2%). [α]D 23 - 7.3 (c 1.07, CHCl3). Энантиомерный избыток (R)-изомера 97.0% (по данным ВЭЖХ). ЯМР 1H, δ, м.д.: 1.03 т.(3H, J 7.1 Гц), 1.25 т.(3H, J 7.1 Гц), 3.82 д. (1Н, J 9.0 Гц), 4.01 кв. (2Н, J 7.1 Гц), 4.21 м. (3H), 4.86 д.д. (1Н, J 9.5, 13.2 Гц), 4.92 д.д. (1Н, J 13.2, 4.7 Гц), 7.23 - 7.34 м. (5Н). ЯМР 13С, δ, м. д.: 13.6,13.9,42.9, 54.9, 61.8,62.1, 77.6,127.9,128.3, 128.8,136.2,166.7, 167.4. Масс-спектр m/z (Iотн): 309 [М]+, 263 (12), 218 (12), 190 (13), 189 (100), 171 (58), 161 (56), 145 (30), 133 (22), 131 (20), 117 (28), 115 (70), 105 (15), 104 (55), 103 (34), 91 (26), 78 (15), 77 (20).
Пример 4
К раствору 3.15 г (21.1 ммоль) транс-β-нитростирола и 4.05 г (25.3 ммоль) диэтилмалоната в 14 мл толуола добавляли 20.6 мг (0.0211 ммоль, 0.1 мольн. % по отношению к нитростиролу) катализатора формулы II. Реакционную смесь выдерживали при температуре 50°C в течение 24 ч. Продукт реакции выделяли флэш-хроматографией на силикагеле. Выход: 6.15 г (94.3%). Энантиомерный избыток (R)-изомера 97.0% (по данным ВЭЖХ).
Пример 5
К раствору 0.37 г (2.5 ммоль) транс-β-нитростирола и 0.48 г (0.455 мл, 3.0 ммоль) диэтилмалоната в 1.68 мл толуола добавляли 25 мкл 0.1 М раствора катализатора (0.1 мольн. % металлокомплекса по отношению к нитростиролу). Реакционную смесь выдерживали при температуре 50°C в течение 24 ч. Продукт реакции выделяли флэш-хроматографией на силикагеле. Выход: 0.69 г (89.0%). Энантиомерный избыток (R)-изомера 97.0% (по данным ВЭЖХ).
Пример 6
К раствору 37.0 г (0.25 моль) транс-β-нитростирола и 48.0 г (0.30 моль) диэтилмалоната в 170 мл толуола добавляли 2.5 мл 0.1 М раствора катализатора (0.1 мольн. % металлоком-плекса по отношению к нитростиролу). Реакционную смесь выдерживали при температуре 50°C в течение 24 ч. Толуол отгоняли в вакууме. Продукт реакции выделяли флэш-хроматографией на силикагеле. Выход: 75.2 г (97.2%). Энантиомерный избыток (R)-изомера 97.0% (по данным ВЭЖХ).