Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ РИВАНОЛА В ВОДОРАСТВОРИМЫХ ПОЛИМЕРАХ
Вид РИД
Изобретение
Изобретение относится к области микрокапсулирования лекарственных препаратов на примере риванола, который может использоваться в качестве противомикробного, противогрибкового препаратов наружного применения.
Ранее были известны способы получения микрокапсул лекарственных препаратов. Так, в Пат. 2092155 МПК А61K 047/02, А61K 009/16 опубликован 10.10.1997 Российская Федерация предложен метод микрокапсулирования лекарственных средств, основанный на использовании облучения ультрафиолетовыми лучами.
Недостатками данного способа являются длительность процесса и применение ультрафиолетового излучения, что может оказывать влияние на процесс образования микрокапсул.
В пат. 2173140 МПК А61K 009/50, А61K 009/127 Российская Федерация опубликован 10.09.2001 предложен способ получения кремнийорганолипидных микрокапсул с использованием роторно-кавитационной установки, обладающей высокими сдвиговыми усилиями и мощными гидроакустическими явлениями звукового и ультразвукового диапазона для диспергирования.;
Недостатком данного способа является применение специального оборудования - роторно-квитационной установки, которая обладает ультразвуковым действием, что оказывает влияние на образование микрокапсул и при этом может вызывать побочные реакции в связи с тем, что ультразвук разрушающе действует на полимеры белковой природы, поэтому предложенный способ применим при работе с полимерами синтетического происхождения.
В пат.2359662 МПК А61K 009/56, A61J 003/07, B01J 013/02, A23L 001/00 опубликован 27.06.2009 Российская Федерация предложен способ получения микрокапсул с использованием распылительного охлаждения в распылительной градирне Niro при следующих условиях: температура воздуха на входе 10°С, температура воздуха на выходе 28°С, скорость вращения распыляющего барабана 10000 оборотов/мин. Микрокапсулы по изобретению обладают улучшенной стабильностью и обеспечивают регулируемое и/или пролонгированное высвобождение активного ингредиента.
Недостатками предложенного способа являются длительность процесса и применение специального оборудования, комплекс определенных условий (температура воздуха на входе 10°С, температура воздуха на выходе 28°С, скорость вращения распыляющего барабана 10000 оборотов/мин).
В пат.20110223314 МПК B05D 7/00 20060101 B05D 007/00, В05С 3/02 20060101 В05С 003/02; В05С 11/00 20060101 В05С 011/00; B05D 1/18 20060101 B05D 001/18; B05D 3/02 20060101 B05D 003/02; B05D 3/06 20060101 B05D 003/06 от 10.03.2011 US описан способ получения микрокапсул методом суспензионной полимеризации, относящийся к группе химических методов с применением нового устройства и ультрафиолетового облучения.
Недостатком данного способа являются сложность и длительность процесса, применение специального оборудования, получение микрокапсул методом суспензионной полимеризации, использование ультрафиолетового облучения.
Наиболее близким методом является способ, предложенный в пат. 2134967 МПК A01N 53/00, A01N 25/28 опубликован 27.08.1999 Российская Федерация (1999). В воде диспергируют раствор смеси природных липидов и пиретроидного инсектицида в весовом отношении 2-4: 1 в органическом растворителе, что приводит к упрощению способа микрокапсулирования.
Недостатком метода, предложенного в пат. 2134967 является диспергирование в водной среде, что делает предложенный способ неприменимым для получения микрокапсул водорастворимых препаратов в водорастворимых полимерах.
Техническая задача - упрощение процесса получения микрокапсул водораствормого лекарственного препарата в водорастворимых полимерах синтетического происхождения (поливиниловый спирт, поливинилпирролидон), увеличение стабильности лекарственного препарата риванол с помощью заключения его в водорастворимые полимерные оболочки синтетического происхождения (микрокапсулирования).
Решение технической задачи достигается способом получения микрокапсул риванола в водорастворимых полимерах, отличающемся тем, что при получении микрокапсул физико-химическим методом осаждения нерастворителем в качестве осадителя используется ацетон, при 25°С процесс получения осуществляется без специального оборудования (использование роторно-кавитационной установки, распылительной градирне Niro).
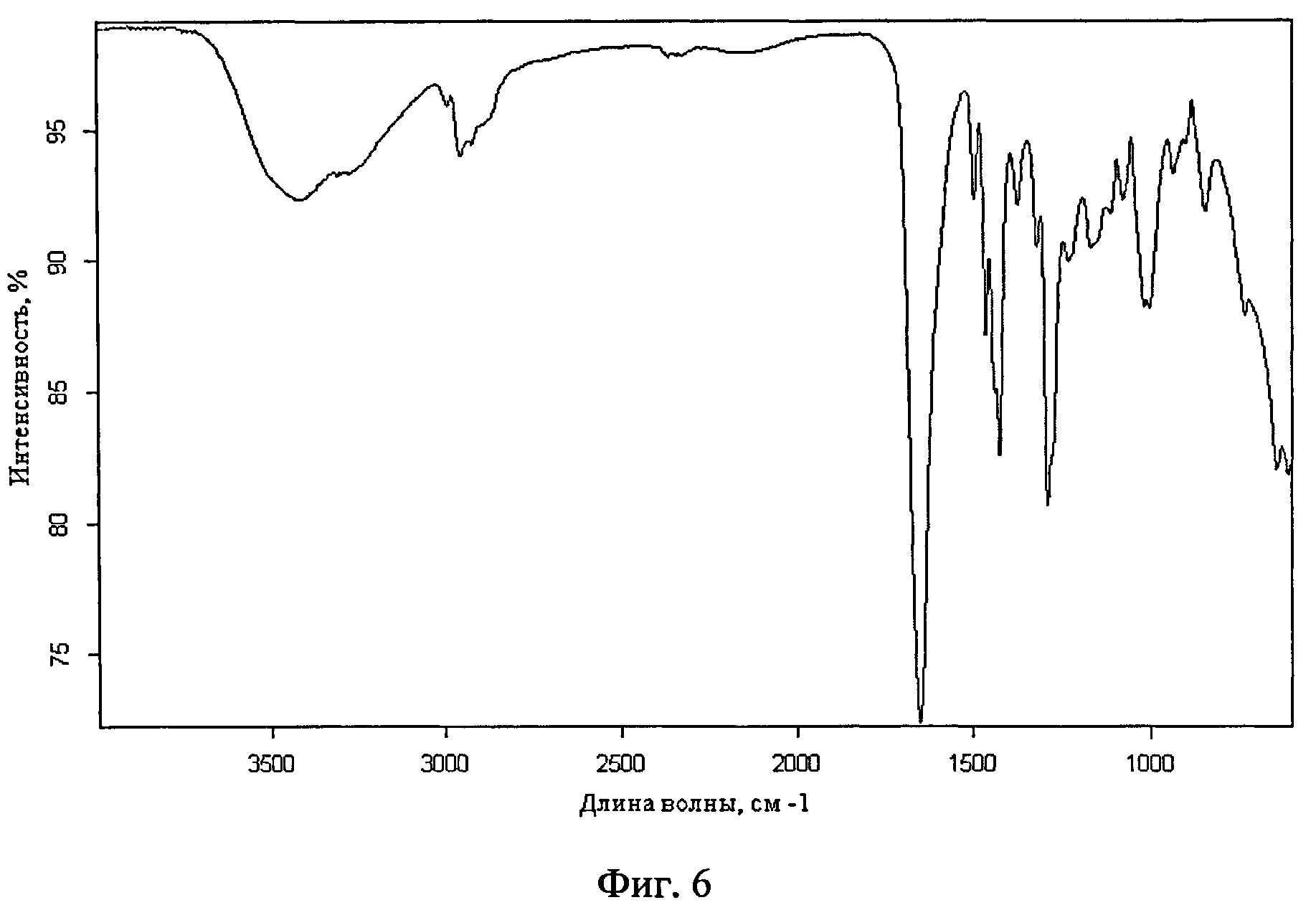
Отличительной особенностью предлагаемого метода является использование метода осаждения ацетоном в качестве нерастворителя как способа получения микрокапсул водорастворимого лекарственного препарата в водорастворимой полимерной оболочке синтетического происхождения без специального оборудования. Результатом предлагаемого метода являются получение микрокапсул риванола в поливинилпирролидоне и поливиниловом спирте при 25°С в течение 30 минут, которые обладают большей стабильностью, чем исходный риванол. Выход микрокапсул составляет 90%.
Необходимый для реакции исходный риванол был промышленного производства (КНР).
Иллюстрации к патенту:
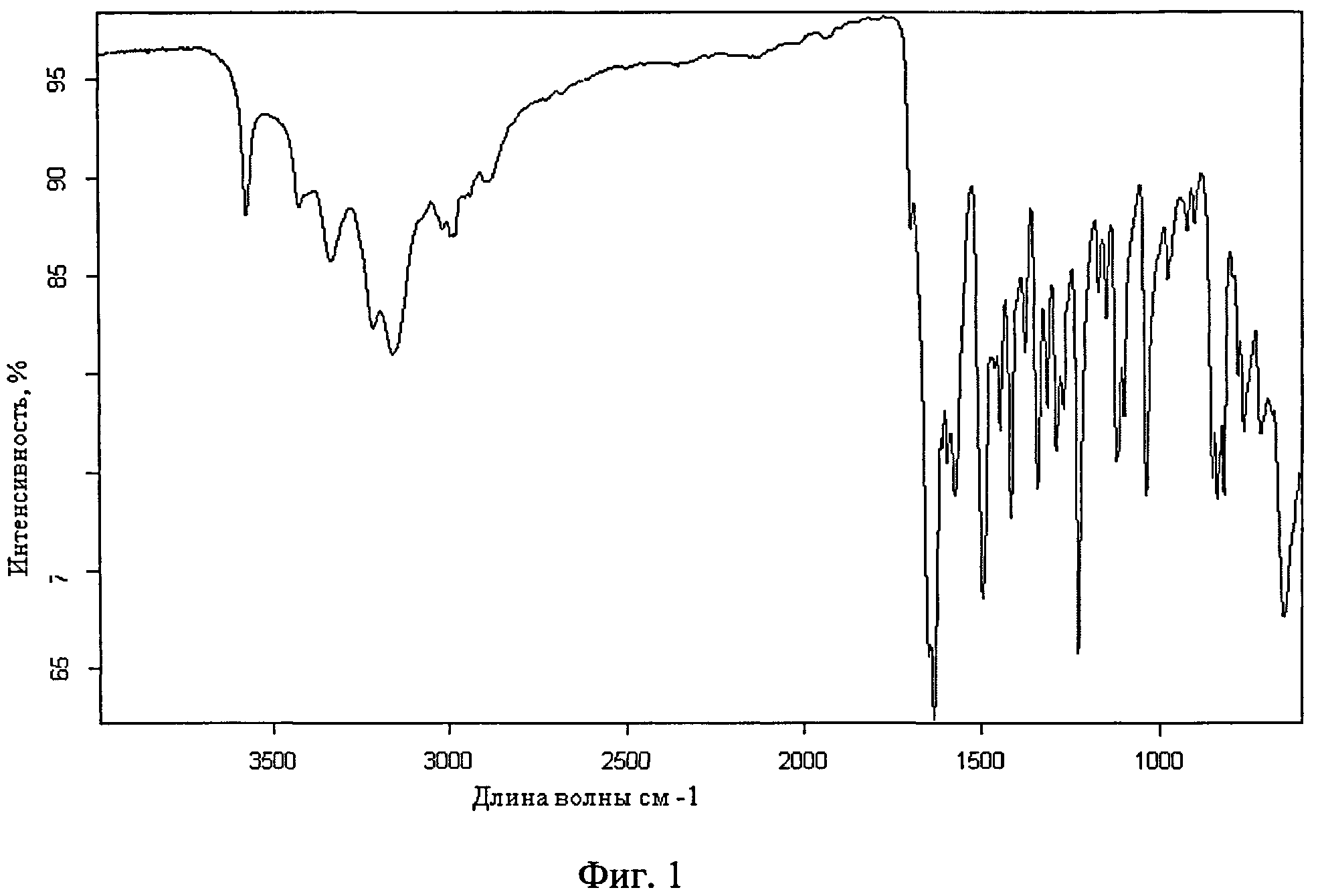
Фиг 1. ИК-спектр поверхности микрокапсул риванола в ПВП, соотношение 1:3
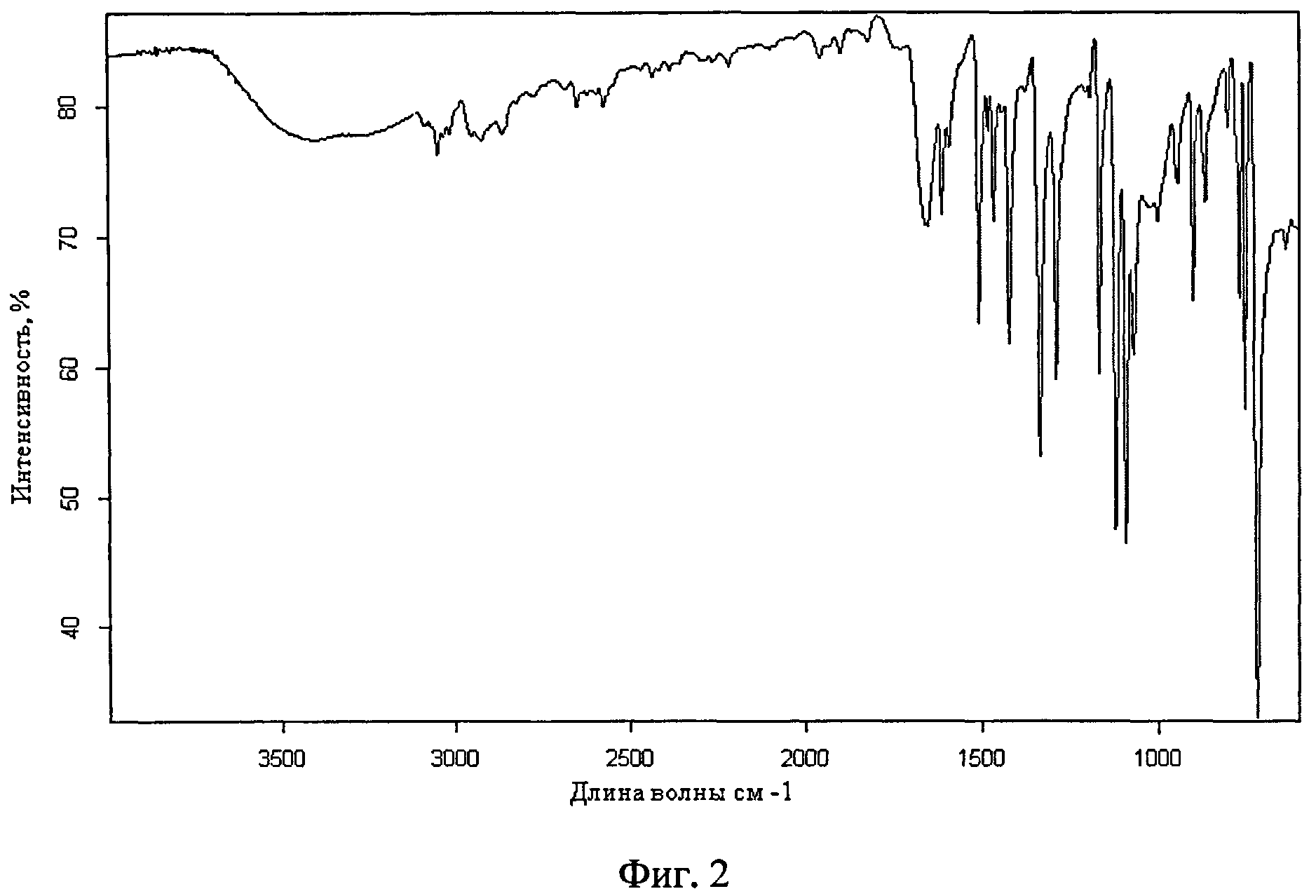
Фиг.2. ИК-спектр поверхности микрокапсул риванола в ПВС, соотношение 1:3
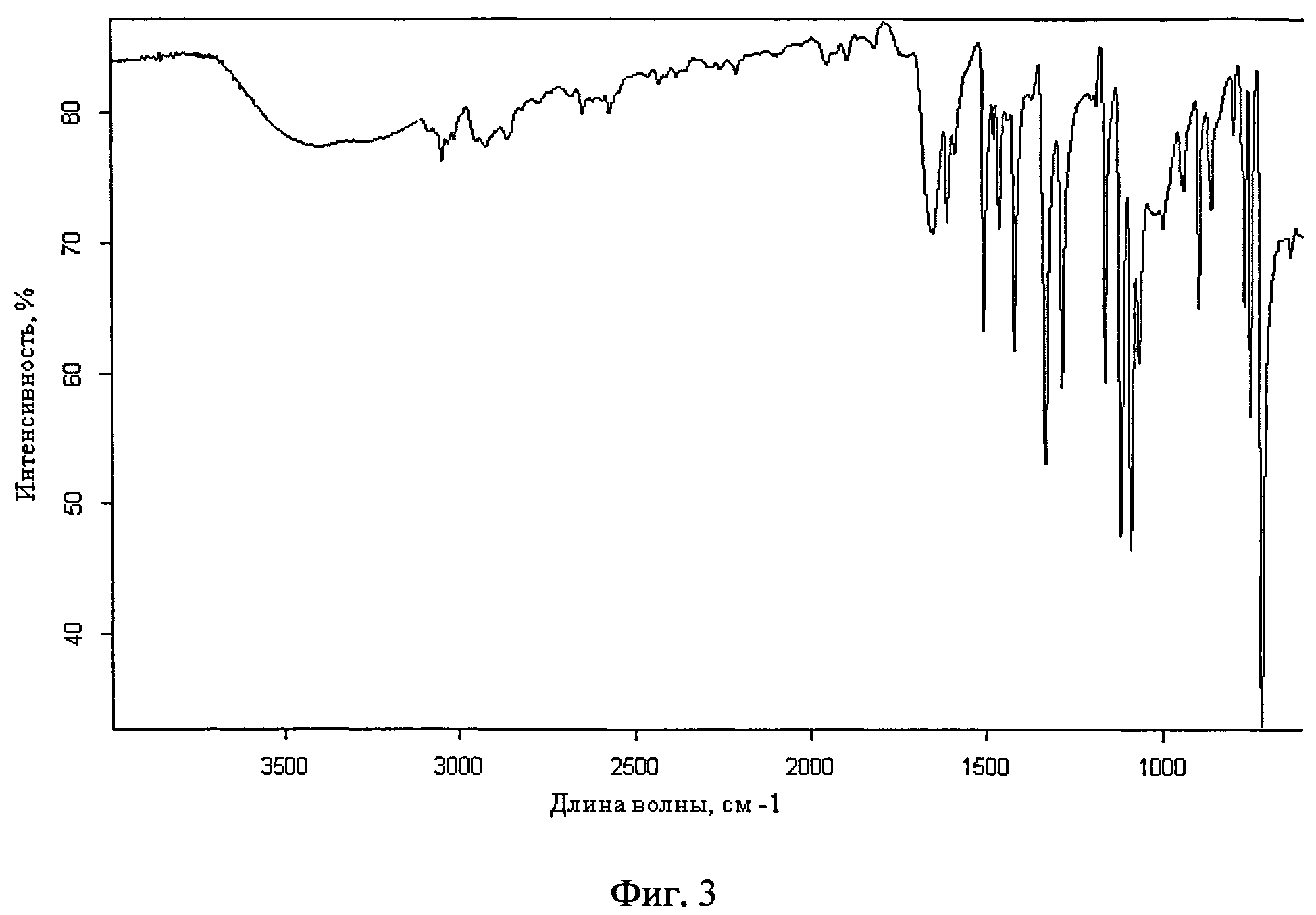
Фиг.3. ИК-спектр поверхности микрокапсул риванола в ПВС, соотношение 1:1
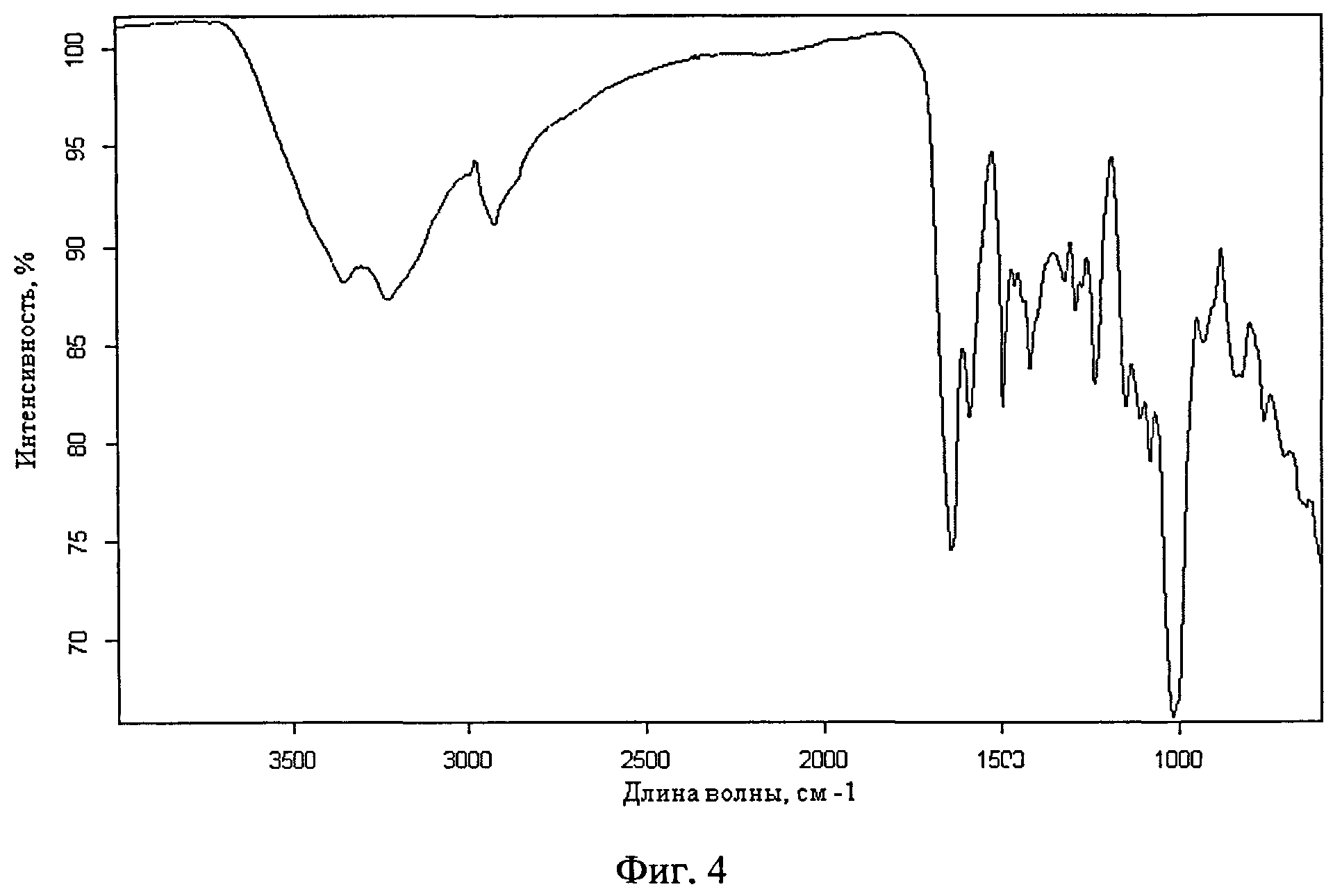
Фиг.4. ИК-спектр поверхности микрокапсул риванола в ПВП, соотношение 1:1
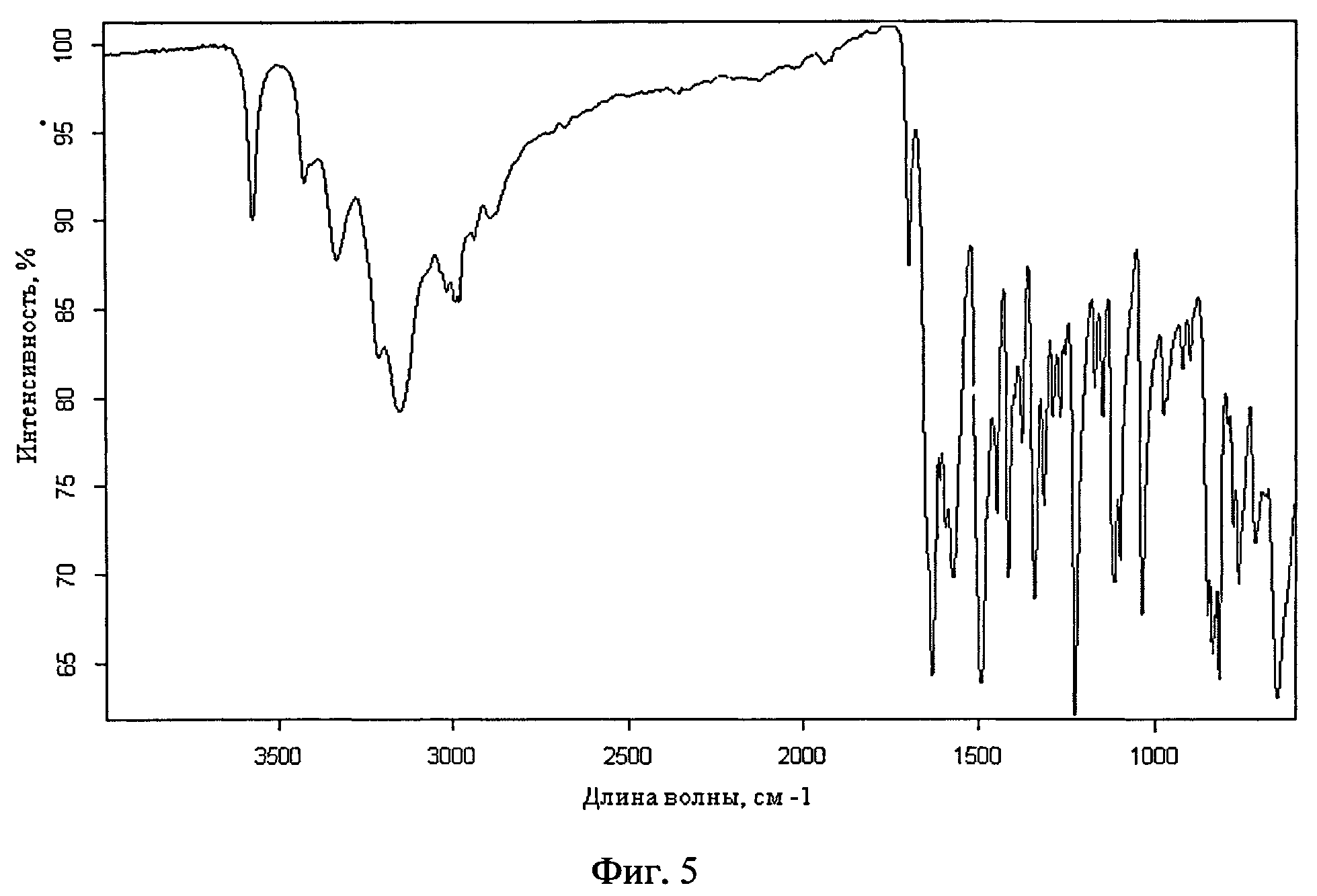
Фиг.5. ИК-спектр риванола
Фиг.6. ИК-спектр пиливинилпирролидона(ПВП)
Фиг.7. Кристаллы риванола, увеличение 505 раз
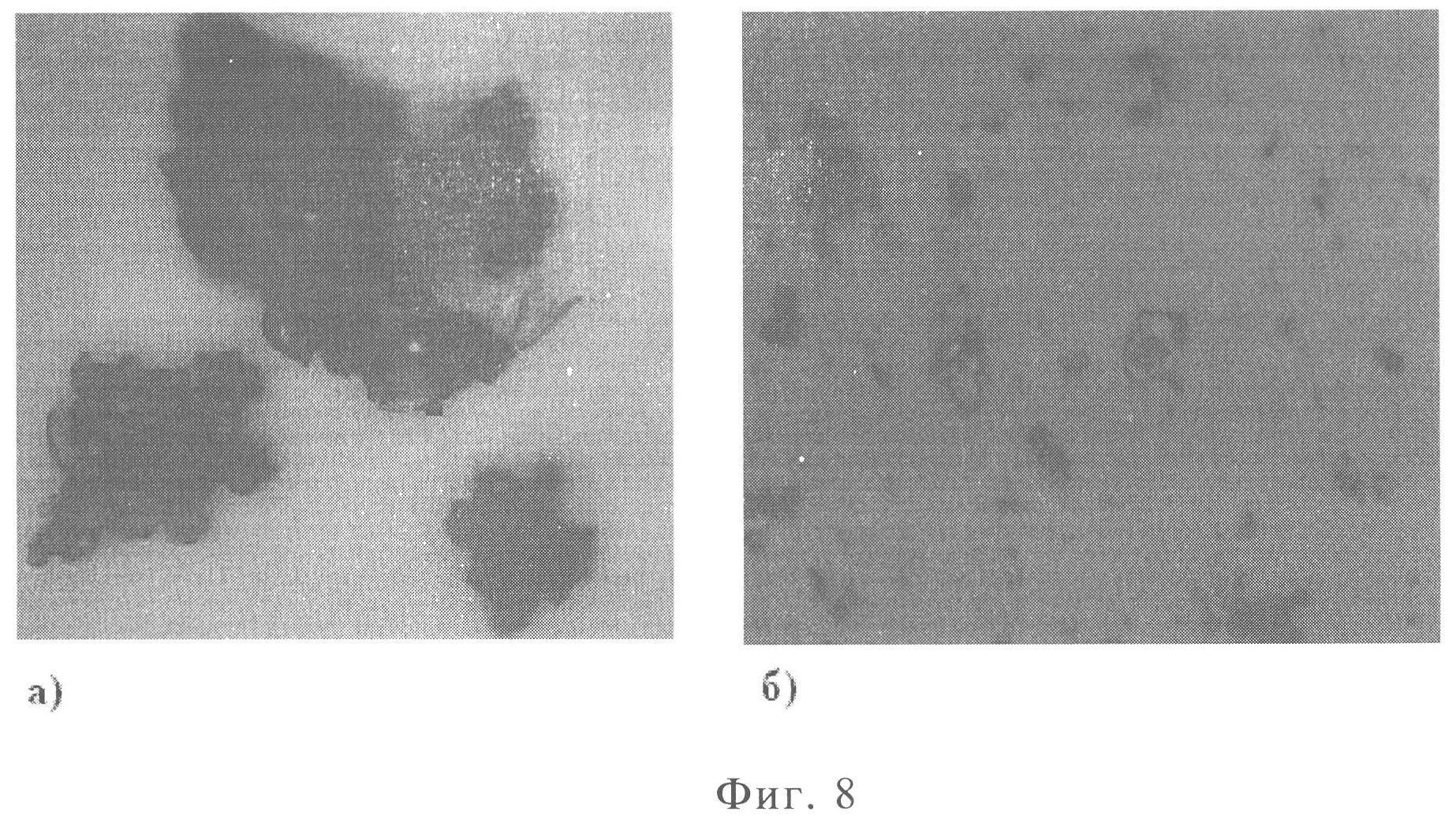
Фиг.8. Микрокапсулы риванола в поливинилпирролидоне:
а) соотношение 1:3, увеличение 260 раз;
б) соотношение 1:1, увеличение 2830 раз.
Фиг.9. Микрокапсулы риванола в поливинилпирролидоне:
а) соотношение 1:3, увеличение 260 раз;
б) соотношение 1:1, увеличение 2830 раз.
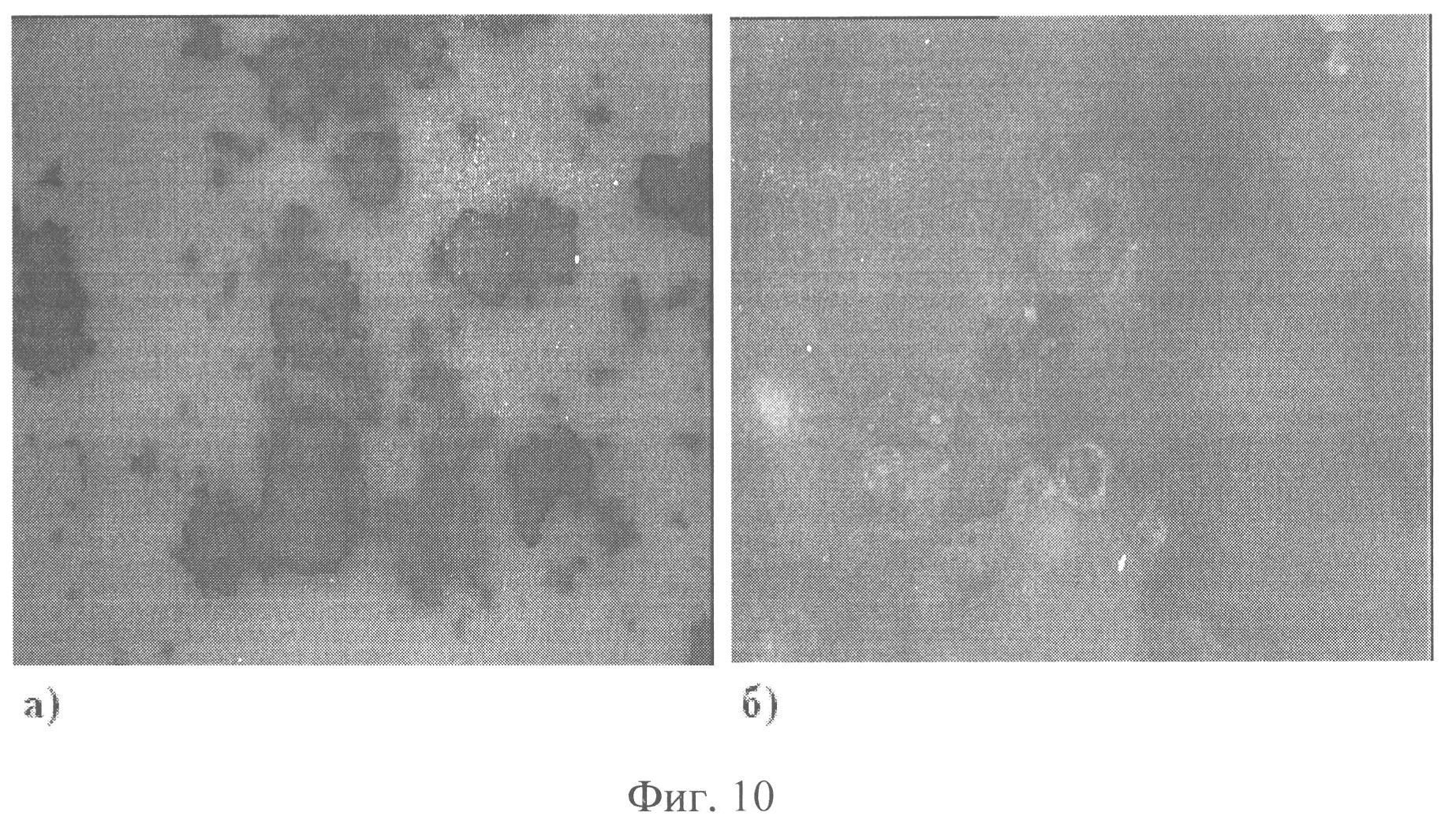
Фиг.10. Микрокапсулы риванола в поливиниловом спирте:
а) соотношение 1:1, увеличение 260 раз;
б) соотношение 1:3, увеличение 2830 раз.
Фиг.11. Конфокальная лазерная сканирующая микроскопия раствора микрокапсул риванола в пиливинилпирролидоне, соотношение 1:1
а) 2% водного раствора микрокапсул риванола, увеличение 1400 раз;
б) 1% водного раствора микрокапсул риванола, увеличение 505 раз;
в) 0,5% водного раствора микрокапсул риванола, увеличение 1770 раз;
г) 0,25% водного раствора микрокапсул риванола, увеличение 1400 раз
Фиг.12. Конфокальная лазерная сканирующая микроскопия раствора микрокапсул риванола в пиливиниловом спирте, соотношение 1:1
а) 2% водного раствора микрокапсул риванола, увеличение 260 раз;
б) 1% водного раствора микрокапсул риванола, увеличение 505 раз;
в) 0,5% водного раствора микрокапсул риванола, увеличение 620 раз;
г) 0,25% водного раствора микрокапсул риванола, увеличение 900 раз.
Фиг.13. Конфокальная сканирующая лазерная микроскопия 2% водного раствора риванола:
а) увеличение 2830 раз;
б) увеличение 1400 раз.
ПРИМЕР 1. Получение микрокапсул риванола в поливинилпирролидоне (ПВП) с использованием 5% раствора уксусной кислоты в ацетоне в качестве осадителя, соотношение 1:3.
В стакан объемом 150 мл помещают 18 г 5% водного раствора ПВП, ставят на магнитную мешалку и включают перемешивание. 0,3 г риванола растворяют в 2 мл этанола при нагревании. Полученный раствор охлаждают и по каплям переносят в раствор ПВП. После образования риванолом самостоятельной твердой фазы по каплям приливают первый осадитель (5% раствор уксусной кислоты в ацетоне, содержащий 0,2% ОС-20 (смесь полиоксиэтиленгликолевых эфиров высших жирных спиртов) в качестве ПАВ) в количестве 50 мл, а затем второй - 0,2% раствор ОС-20 в 15 мл ацетона. Полученную суспензию микрокапсул отфильтровывают на фильтре Шотта и промывают ацетоном. Сушат в эксикаторе над хлористым кальцием. Получают 1,08 г (90%) микрокапсул в виде желтого порошка. Количество вещества в капсуле 33%.
ИК-спектр поверхности см. фиг.1.
Полученные капсулы были исследованы с помощью ИК-спектроскопии. В спектрах поверхности микрокапсул в областях 1655-1013,3 см-1 присутствуют полосы поглощения характерные для риванола, такие как 1655.44 см-1 - СО.
ПРИМЕР 2. Получение микрокапсул риванола в поливиниловом спирте(ПВС) с использованием 5% раствора уксусной кислоты в ацетоне в качестве осадителя, соотношение 1:3.
В стакан объемом 150 мл помещают 18 г 5% водного раствора ПВС, ставят на магнитную мешалку и включают перемешивание. 0,3 г риванола растворяют в 2 мл этанола при нагревании. Полученный раствор охлаждают и по каплям переносят в раствор ПВС. После образования риванолом самостоятельной твердой фазы по каплям приливают первый осадитель (5% раствор уксусной кислоты в ацетоне, содержащий 0,2% ОС-20 в качестве ПАВ) в количестве 50 мл, а затем второй - 0,2% раствор ОС-20 в 15 мл ацетона. Полученную суспензию микрокапсул отфильтровывают на фильтре Шотта и промывают ацетоном. Сушат в эксикаторе над хлористым кальцием. Получают 1,07 г (89%) микрокапсул в виде желтого порошка. Количество вещества в капсуле 27%.
ПК-спектр поверхности см. фиг.2.
Полученные капсулы были исследованы с помощью ИК спектроскопии. В спектрах поверхности микрокапсул в областях 1655-1013,3 см-1 присутствуют полосы поглощения характерные для риванола, такие как 1655.44 см-1-С=O.
ПРИМЕР 3. Получение микрокапсул риванола в поливиниловом спирте (ПВС) с использованием ацетона в качестве нерастворителя, соотношение 1:1.
В стакан объемом 150 мл помещают 0,6 г риванола, 100 мл ацетона, 1 мл 0,2% ОС-20, ставят на магнитную мешалку, включают перемешивание. После образования риванолом самостоятельной твердой фазы по каплям приливают 12 г 5% водного раствора ПВС. Полученную суспензию микрокапсул отфильтровывают на фильтре Шотта и промывают ацетоном. Сушат в эксикаторе над хлористым кальцием. Получают 1,12 г (93%) микрокапсул в виде желтого порошка. Количество вещества в капсуле 65,5%.
ИК-спектр поверхности см. фиг.3.
Полученные капсулы были исследованы с помощью ИК спектроскопии. В спектрах поверхности микрокапсул в областях 1655-1013,3 см-1 присутствуют полосы поглощения характерные для риванола, такие как 1655.44 см-1-С=O.
ПРИМЕР 4. Получение микрокапсул риванола в поливинилпирролидоне (ПВП) с использованием ацетона в качестве нерастворителя, соотношение 1:1.
В стакан объемом 150 мл помещают 0,6 г риванола, 100 мл ацетона, 1 мл 0,2% ОС-20, ставят на магнитную мешалку, включают перемешивание. После образования риванолом самостоятельной твердой фазы по каплям приливают 12 г 5% водного раствора ПВП. Полученную суспензию микрокапсул отфильтровывают на фильтре Шотта и промывают ацетоном. Сушат в эксикаторе над хлористым кальцием. Получают 1,08 г (90%) микрокапсул в виде желтого порошка. Количество вещества в капсуле 60,5%.
ИК-спектр поверхности см. фиг.4.
Полученные капсулы были исследованы с помощью ИК -спектроскопии. В спектрах поверхности микрокапсул в областях 1655-1013,3 см-1 присутствуют полосы поглощения характерные для риванола, такие как 1655.44 см-1-C=O.
ПРИМЕР 5. Методика анализа микрокапсулированных продуктов методом тонкослойной хроматографии с денситометрией
Необходимым условием для проведения анализа данным методом является выбор универсального растворителя, растворяющего и полимер оболочки микрокапсулы, и капсулируемое вещество.
Две пластинки устанавливают вертикально в камеру для хромотографирования, чтобы элюент прошел через всю пластину, тем самым пластина промывается, затем высушивается. Для анализа взвешивают по 0,03-0,02 г чистого образца, который использовался в капсулировании (стандарт), и по 0,02 г анализируемых капсул и растворяем их в 3-5 мл ДМФА либо ДМСО, при необходимости нагревают. Затем в пробирки со стандартом вводят по 2 мл 1,5% раствора внутреннего стандарта в ДМФА, а в растворенные капсулы по 1 мл. Далее из каждого анализируемого раствора отбирают в отдельные пробирки по 70 мкл раствора и разбавляют их 200 мкл ДМФА.
На расстоянии около 2 см от края пластинки (силуфол) карандашом проводят стартовую линию. На 2 пластинки на стартовую линию капилляром наносят образцы полученных растворов. Диаметр пятна должен составлять 2-3 мм. Пластинку высушивают над плиткой. Эту операцию при необходимости повторяют 2-3 раза. Две пластины устанавливают вертикально в камеру для хроматографирования так, чтобы пятна образцов находились над поверхностью элюента (система растворителей ацетон:уксусная кислота в объемном соотношении 15:0,1 для анализа микрокапсул содержащих АУК и акридон, либо 10:0,5 -для микрокапсул содержащих 4-карбоксиакридон и акридонсульфамид). Пластинки не должны касаться друг друга. Пластинки не должна касаться стенок камеры. Процесс прекращают после того, как элюент пройдет от линии старта не менее 7 см. После этого пластинки вынимают, отмечают положение фронта элюента, тщательно высушивают над электрической плиткой. Затем пластину обрабатывают с помощью видеоденситометра «Sorbfil» и программы «Sorbfil 1.8».
Полученные микрокапсулы были сфотографированы на атомно-силовом сканирующем электронном микроскопе, совмещенном с конфокальным OmegaScope AIST-NT.
Из порошка микрокапсул, полученных по методикам, описанным в примерах 3,4 были приготовлены водные растворы концентрациями 2%, 1%, 0,5%, 0,25% и водный раствор сравнения исходного риванола концентрацией 2%. Далее капля каждого из приготовленных растворов помещалась на предметное стекло до полного высушивания и по высушенной поверхности проводилась конфокальная сканирующая микроскопия на атомно-силовом сканирующем электронном микроскопе, совмещенном с конфокальным OmegaScope AIST-NT.
Таким образом, получены микрокапсулы физико-химическим методом осаждения нерастворителем с использованием ацетона в качестве осадителя, что способствует увеличению выхода. Процесс прост в исполнении и длится в течение 30 минут, не требует специального оборудования.
Из представленных выше данных видно, что шарообразную форму имеют микрокапсулы, содержащие меньшее количество действующего вещества, полученные в соотношении 1:3. Внешний вид продуктов имеет существенные отличия от кристаллов исходного риванола. Однако размер частиц не зависит от соотношения при получении, так как наименьший размер зафиксирован при количестве действующего вещества 65% в поливинилпирролидоне, а наибольший - при 65,5% риванола в поливиниловом спирте. Оба образца получены в соотношении 1:1. Содержание лекарственных веществ может варьировать в пределах от 15 до 99% массы микрокапсул. В нашем случае получены образцы с наименьшим и средним для фармацевтической промышленности количеством действующего вещества. Следует также отметить, что неустойчивость растворов риванола на свету - общеизвестный факт. Они меняют цвет с желтого на темно-коричневый, а иногда и черный в течение 3-7 дней хранения. Стабильность полученных растворов микрокалсул исследовалась в течение длительного времени при комнатной температуре, в результате чего срок изменения окраски растворов не установлен. Это свидетельствует о том, с помощью предложенного способа можно получать микрокапсулы неустойчивых лекарственных препаратов с целью получения стабильной системы для решения проблем стабильности неустойчивых лекарственных препаратов различных фармакологических групп.
Способ получения микрокапсул риванола в водорастворимом полимере, представляющем собой поливиниловый спирт или поливинилпирролидон, характеризующийся тем, что при получении микрокапсул физико-химическим методом осаждения нерастворителем в качестве осадителя используется ацетон при 25°С и процесс ведут без специального оборудования.