ИЗОБРЕТЕНИЕ, ОТНОСЯЩЕЕСЯ К GLP-1 И ЭКСЕНДИНАМ
Вид РИД
Изобретение
В топической диагностике гастроэнтеропанкреатических нейроэндокринных опухолей в качестве важного диагностического метода наряду с ультразвуком используют сцинциграфию рецепторов соматостатина (SRS). Используемый принцип состоит в специфическом отображении опухолей с помощью радиоактивно меченых пептидов, которые захватываются опухолевыми клетками. Таким образом с помощью гамма-камеры можно наглядно обнаруживать повышение радиоактивности в опухолевой ткани. Если тип опухоли обладает рецепторами, требующими SRS, например аналог соматостатина октреотид®, определение указанных опухолей возможно без проблем. Однако если соответствующие рецепторы не экспрессируются, они не поддаются сцинциграфическому определению. Но наряду с топикальной диагностикой радиоактивно меченые пептиды также дают возможность подхода к лечению опухолей, при котором путем мечения аналога соматостатина, например октреотида®, подходящим радионуклидом (α- или β-лучами) можно производить специфическую направленную на рецепторы радиопептидную терапию. Так как соответствующие радионуклиды химически связаны с пептидом таким образом (например, путем комплексообразования с ранее связанным с пептидом хелатирующим агентом), что хотя опухолевые клетки их поглощают, но не могут их больше выбрасывать, происходит высокое специфическое обогащение их в опухолевой ткани.
Конечно, целый ряд нейроэндокринных опухолей (NET), в том числе инсулинома и мелкоклеточный бронхогенный рак, не экспрессируют требуемых подтипов рецепторов соматостатина, которые необходимы для SRS или радиопептидной терапии с аналогом соматостатина октреотидом®. В частности, инсулинома в значительном проценте не поддается сцинциграфической диагностике. Также при мелкоклеточном бронхогенном раке SRS не представляет собой подходящего способа, так как хотя первичные опухоли часто могут быть отображены, однако метастазы нет, поскольку утрачивается экспрессия рецепторов. Таким образом, также недоступна радиотерапия, которая представляет собой интересный дополнительный или альтернативный способ лечения. Отсюда возникает потребность в подходящем пептиде, который поглощался бы указанными опухолями.
Гормон внутренней секреции глюкагонподобный пептид-1 (GLP-1), а также его аналоги эксендин-3 и эксендин-4 (из слюны ящериц (Heloderma horridum и Heloderma suspectum)) представляют собой пептиды, для которых инсулинома и мелкоклеточный бронхогенный рак, наряду с многими другими видами опухолей, экспрессируют рецепторы. Инсулинома происходит от продуцирующих инсулин β-клеток островков Лангеранса поджелудочной железы, в котором GLP-1, а также эксендин-3 и эксендин-4 инициируют возникающую после приема пищи секрецию инсулина.
Состояние техники
Для применения глюкагонподобных пептидов (GLP-1) в сцинциграфии требуется мечение пептидов. Способы мечения белков радионуклидами известны специалисту и представлены в многочисленных патентных описаниях (например, DE 69018226 T2) и научных работах. При этом описанные пептиды для использования в диагностических изображениях и для опосредования терапевтически активных молекул в патологических тканях, как правило, содержат у N-конца введенный в пептид амин. Пептиды при этом должны быть дополнительно модифицированы в смысле стабильности.
Например, использованный в патенте US 2003/0232761 A1 GLP-1 и его производное GLP-1(7-37) модифицированы у N-конца амином. Таким образом, N-конец GLP-1 более не может быть использован в связывании с GLP-1-рецепторами, так что с указанными пептидами возможно только неудовлетворительное связывание и внутренние (взаимодействия) с рецепторами, указанные пептиды таким образом не подходят для применения в радиопептидной терапии инсулиномы и мелкоклеточного бронхогенного рака. Мутация, например замена аминокислоты внутри пептидной последовательности GLP-1 и эксендина-3 или эксендина-4 и их возможных модификаций под действием лекарственного препарата или подающей сигнал молекулы, на основе опытов приводит в основном к тому, что структура пептида разрушается таким образом, что становится невозможным связывание с рецепторами.
Дополнительный метод модифицирования GLP-1 без воздействия на N-конец до настоящего времени не известен. Сверх того не известны меченые или немеченые производные GLP-1 для использования при радиотерапии инсулиномы и мелкоклеточного бронхогенного рака.
Задача предлагаемого изобретения состоит в том, чтобы устранить недостаток современного уровня техники и получить пептиды, которые могут быть мечеными, и также с указанным мечением могут связываться с GLP-1-рецепторами и могут вводиться для получения средства для диагностики и терапии заболеваний, при которых играет роль экспрессия рецепторов GLP-1.
Указанную задачу предложено решить путем получения производных пептидов GLP-1, эксендина-3 и эксендина-4, которые модифицированы амином у С-конца, а N-концом связываются с GLP-1-рецепторами, а также химерных пептидов из GLP-1 с эксендином-3 или эксендином-4. Указанные пептиды, а также химерные пептиды, меченые или немеченые, используют для получения средства для диагностики и терапии доброкачественных и злокачественных заболеваний, при которых играет роль экспрессия GLP-1-рецепторов.
С помощью указанных производных пептидов GLP-1, эксендина-3 и эксендина-4, а также химерных пептидов из GLP-1, эксендина-3 или экзендина-4 осуществляют получение средства для сцинциграфического применения, которое используют для диагностики и терапии опухолей, экспрессирующих GLP-1-рецепторы, в том числе NET (в частности, инсулиномы) и мелкоклеточного бронхогенного рака. Прежде всего, это возможно, так как предложенные производные пептидов модифицированы амином у С-конца и таким образом N-конец остается в распоряжении для связывания с GLP-1-рецепторами.
Благодаря связыванию предложенных, например, радиоактивно меченых производных пептидов и химерных пептидов GLP-1, эксендина-3 и эксендина-4 с GLP-1-рецепторами, возможно отображение опухолей, экспрессирующих GLP-1-рецепторы и вместе с тем значительное улучшение помощи пациенту. В первую очередь это (касается) гастроэнтеропанкреатических NET, таких как инсулинома, для которых в настоящее время не существует неинвазивных способов с достаточной чувствительностью, или мелкоклеточного бронхогенного рака, локализованного в области легких, при котором в настоящее время невозможно дифференцирование между воспалительными процессами и опухолями или метастазами, и также невозможны неинвазивные способы (лечения).
Далее посредством предложенных производных пептидов и химерных пептидов отображают плотность продуцирующих инсулин клеток в поджелудочной железе, а также экспрессию GLP-1-рецепторов in vivo и in vitro. Так, например, при отображении клеток, экспрессирующих GLP-1-рецепторы, при сахарном диабете отображение (происходит) in vivo, так как это клетки, которые также выделяют инсулин. Отображение плотности GLP-1-рецепторов в поджелудочной железе особенно важно для пациентов с сахарным диабетом во время и после терапии лекарственными препаратами. Дополнительно отображают распределение GLP-1-рецепторов в злокачественных и доброкачественных тканях. Постановки вопросов носят здесь как клинический, так и научный характер, так как еще не дают всеохватывающих данных in vivo для распределения GLP-1-рецепторов у человека.
Изобретение также имеет то преимущество, что производные пептидов GLP-1 (глюкагонподобного пептида-1), эксендина-3 и эксендина-4, а также химерных пептидов из GLP-1, эксендина-3 или эксендина-4 использовали для получения средства, в частности для направленного на рецепторы специфического отображения и терапии, в частности NET, особенно инсулиномы и мелкоклеточного бронхогенного рака.
В частности, при диагностике мелкоклеточного бронхогенного рака применима сцинциграфия GLP-1-рецепторов и, возможно в первую очередь, специфическое определение пораженных метастазами лимфатических узлов (воспалительно измененных лифатических узлов или пораженных лимфатических узлов).
Дополнительно возможно применение предложенных производных пептидов GLP-1 (глюкагонподобного пептида-1), эксендина-3 и эксендина-4, а также химерных пептидов из GLP-1, эксендина-3 или эксендина-4 в качестве средств для диагностики и терапии всех доброкачественных и злокачественных заболеваний, при которых играет роль экспрессия рецепторов GLP-1, в частности, в качестве контрастных средств для магниторезонансной томографии (MRT), в качестве радиоактивного средства для сцинциграфии (SPECT, компьютерной томографии единичных фотонов) или радиопептидотерапии, в РЕТ (позитронно-эмиссионной томографии), в опосредованной рецепторами химиотерапии и в оптической диагностике. Причем под оптической диагностикой понимают возбуждение флуоресцирующей молекулы волной определенной длины, которая вызывает последующую эмиссию света других длин волн. При этом определяют испускаемые длины волн.
Специалист легко может выбрать вид мечения у С-конца производных пептидов GLP-1 (глюкагонподобного пептида-1), эксендина-3 и эксендина-4, а также химерных пептидов из GLP-1, эксендина-3 или эксендина-4 в зависимости от желаемого применения, которое состоит, например, (в использовании) для сцинциграфии или радиотерапии по радиоактивным нуклидам, для контрастных средств в магниторезонансной томографии (MRT), например по гадолинию, для эндоскопического или научного изучения по флуоресцирующим красителям.
Под злокачественными заболеваниями предложено понимать злокачественные заболевания, при которых наблюдаются изменения соответствующих тканей, отличающие их от здоровых тканей, проявляется инвазивный рост или ткани разрываются на кровяное или лимфатическое русло. Сюда относятся все нейроэндокринные опухоли, в частности, желудочно-кишечного тракта, бронхогенный рак, рак поджелудочной железы и другие злокачественные заболевания, которые связаны со сверхэкспрессией GLP-1-рецепторов.
Под доброкачественными заболеваниями предложено понимать доброкачественные заболевания, которые отличаются тем, что соответствующие ткани не теряют своей степени дифференцировки, не проявляют инвазивного роста и не образуют метастазирования тканей в лимфатическое или кровяное русло. Сюда относятся, например, сахарный диабет, а также нарушения аппетита (Essverhaltens) или психические (расстройства).
Характеристика производных пептидов и химерных пептидов
Неожиданно было обнаружено, что производные пептидов GLP-1, эксендина-3 и эксендина-4, а также химерные пептиды из GLP-1, эксендина-3 или эксендина-4, которые модифицированы амином у С-конца, связываются через N-конец с GLP-1-рецепторами. Они даже проявляют подобно природному пептиду очень высокое сродство к GLP-1-рецепторам. Эксперименты с имеющими опухоли голыми мышами показывают специфический захват опухолевой тканью, позитивной по GLP-1-рецепторам.
Предложенные производные пептидов, а также химерные пептиды, немеченые или через хелатирующий агент меченые у С-концевого амина, вводили в качестве средства для диагностики и терапии доброкачественных и злокачественных заболеваний, при которых играет роль экспрессия рецепторов GLP-1. Вид мечения заключался при этом, в частности, (во введении) радиоактивного металла, MRT-контрастного средства, флуоресцирующего хромофора или химиотерапевтического средства.
Процесс и способы мечения известны специалисту (например, патент DE 69018226 T2) и оно осуществляется, например, путем взаимодействия с радионуклидами немагнитных металлов и другими MRT-контрастными средствами или флуоресцирующими красителями таким образом, чтобы не мешать связыванию с рецепторами или интернализации предложенных производных пептидов, а также химерных пептидов и чтобы связывающие GLP-1-рецепторы N-концы оставались свободными.
Аминокислотные последовательности исходных пептидов:
GLP-1:
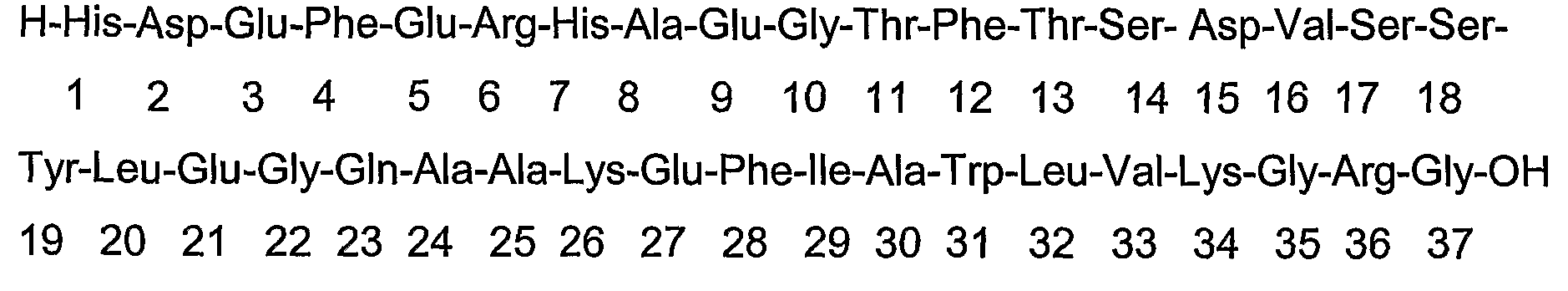
Эксендин-3:

Эксендин-4:

Предложены следующие полученные производные пептидов GLP-1 (1-37), эксендина-3 и эксендина-4
GLP-1(x-y)A 1-37
Эксендин-3(z-k)A 1-40
Эксендин-4(z-k)A 1-40
Причем означают:
х=аминокислоты 1-36 аминокислотной последовательности GLP-1
y=аминокислоты 2-37 аминокислотной последовательности GLP-1
z=аминокислоты 1-38 аминокислотной последовательности эксендина-3 или эксендина-4
k=аминокислоты 2-39 аминокислотной последовательности эксендина-3 или эксендина-4
А=присоединенная группа, состоящая из одной или более аминокислот или их производных в качестве сигнальной молекулы как таковой или для связывания сигнальных молекул или для стабилизации. (Группа) А предпочтительно локализована у С-конца и представляет собой, например, амин, предпочтительно лизин или в качестве альтернативы другую аминокислоту со свободной аминогруппой, такую как, например, орнитин, или органическую группу со свободной аминогруппой, с которыми может взаимодействовать хелатирующий агент для мечения радионуклидами или MRT-контрастным средством, флуоресцирующим красителем или химиотерапевтическим средством. Хелатирующие агенты представляют собой, например, DTPA (диэтилентриаминопентауксусную кислоту, применяемый в качестве альтернативы N,N-бис(2-[бис(карбоксиметил)амино]этил)глицин), в качестве альтернативы DOTA (1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту), HYNIC (6-гидразинопиридин-3-карбоновую кислоту), MAG3 (меркаптоацетилглицилглицилглицин), N4 (1,4,8,11-тетраазаундекан) и известные производные всех названных хелатирующих агентов.
Верхний индекс указывает, в каком месте аминокислотной последовательности могут альтернативно находиться присоединенные группы.
GLP-1(x-y)A1-37
при этом охватывают производные GLP-1 различной длины, в которых x представляет собой число от 1 до 36, но меньше y, который может означать число от 2 до 37. А представляет собой присоединенную группу, которая стоит в любом месте, но предпочтительно у С-конца и у более высокого (положения), чем y. Присоединенная группа предпочтительно представляет собой амин лизин.
Эксендин-3(z-k)A1-40
при этом охватывают производные эксендина-3 различной длины, в которых z представляет собой число от 1 до 38, но меньше k, которое может означать число от 2 до 39. А представляет собой присоединенную группу, которая стоит в любом месте, но предпочтительно у С-конца и у более высокого (положения), чем y. Присоединенная группа предпочтительно представляет собой амин лизин.
Эксендин-4(z-k)A1-40
при этом охватывают производные эксендина-4 различной длины, в которых z представляет собой число от 1 до 38, но меньше k, которое может означать число от 2 до 39. А представляет собой присоединенную группу, которая стоит в любом месте, но предпочтительно у С-конца и у более высокого (положения), чем y. Присоединенная группа предпочтительно представляет собой амин лизин.
В частности, предпочтительны производные пептидов:
1. MC 10: (DTPA-Lys37)GLP-1(7-36)амид
2. MC 13: (DTPA-Lys40)эксендин-3 амид
3. MC 11: (DTPA-Lys40)эксендин-4 амид
Синтез осуществляли, например, через фирму Peptide Specialty Laboratories GnbH по способу Merrifield и очищали ВЭЖХ.
MC 10 (DTPA-Lys37)GLP1(7-36)амид состоит из аминокислот 7-36 GLP-1 и содержит у С-конца в качестве аминокислоты со свободной аминогруппой предпочтительно лизин в положении 37, а также хелатирующий агент DTPA.
МС 13 (DTPA-Lys40)эксендин-3 амид состоит из общей аминокислотной последовательности эксендина-3 и содержит у С-конца в качестве аминокислоты со свободной аминогруппой предпочтительно лизин в положении 40, а также хелатирующий агент DTPA.
МС 11 (DTPA-Lys40)эксендин-4 амид состоит из общей аминокислотной последовательности эксендина-4 и содержит у С-конца в качестве аминокислоты со свободной аминогруппой предпочтительно лизин в положении 39, а также хелатирующий агент DTPA.
Согласно изобретению были получены следующие химерные пептиды из GLP-1(1-37) и эксендина-3 или эксендина-4.
GLP-1(x-y)эксендин-3(z-k)A 1-75
GLP-1(x-y)эксендин-4(z-k)A 1-75
Эксендин-3(z-k)GLP-1(x-y)A 1-75
Эксендин-4(z-k)GLP-1(x-y)A 1-75
Причем (буквы) означают:
х=аминокислоты 1-36 аминокислотной последовательности GLP-1
y=аминокислоты 2-37 аминокислотной последовательности GLP-1
z=аминокислоты 1-38 аминокислотной последовательности эксендина-3 или эксендина-4
k=аминокислоты аминокислотной последовательности 2-39 эксендина-3 или эксендина-4
А=присоединенная группа, состоящая из одной или более аминокислот или их производных в качестве сигнальной молекулы как таковой, или для связывания или стабилизации. (Группа) А предпочтительно локализована у С-конца и предпочтительно представляет собой, например, лизин или, в качестве альтернативы, другую аминокислоту со свободной аминогруппой, такую как, например, орнитин, или органическую группу со свободной аминогруппой, к которой присоединяется хелатирующий агент для мечения радионуклидами или MRT-контрастным средством, флуоресцирующим красителем или химиотерапевтическим средством. Хелатирующий агент представляет собой, например, DTPA (диэтилентриаминопентауксусную кислоту, в качестве альтернативы N,N-бис(2-[бис(карбоксиметил)амино]этил)глицин), в качестве альтернативы DOTA (1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту, NYNIC (6-гидразинопиридин-3-карбоновую кислоту, MAG3 (меркаптоацетилглицилглицилглицин), N4 (1,4,8,11-тетраазаундекан) и известные производные всех названных хелатирующих агентов.
Верхний индекс означает, у какого положения аминокислотной последовательности альтернативно может находиться присоединенная группа.
GLP-1(x-y)эксендин-3(z-k)A 1-75
при этом охватывает химерные пептиды из GLP-1 и эксендина-3, в которых аминокислоты с 1 по 36 происходят от GLP-1 и последующие аминокислоты с 1 по 39 от эксендина-3. (Группа) А представляет собой присоединенную группу, которая стоит в любом месте, но предпочтительно у С-конца, и в большинстве случаев является аминокислотой из GLP-1 и эксендина-3, предпочтительно амином лизином.
GLP-1(x-y)эксендин-4(z-k)A 1-75
при этом охватывает химерные пептиды из GLP-1 и эксендина-4, в которых аминокислоты с 1 по 36 происходят от GLP-1 и последующие аминокислоты с 1 по 39 от эксендина-4. (Группа) А представляет собой присоединенную группу, которая стоит в любом месте, но предпочтительно у С-конца, и в большинстве случаев является аминокислотой из GLP-1 и эксендина-4, предпочтительно амином лизином.
Эксендин-3(z-k)GLP-1(x-y)A 1-75
при этом охватывает химерные пептиды из эксендина-3 и GLP-1, причем z может означать числа от 1 до 38, но меньше k, которое может означать число от 2 до 39. (Группа) А представляет собой присоединенную группу, которая стоит в любом месте, но предпочтительно у С-конца, и в большинстве случаев выше y. Присоединенная группа предпочтительно представляет собой амин лизин.
Эксендин-4(z-k)GLP-1(x-y)A 1-75
при этом охватывает химерные пептиды из эксендина-4 и GLP-1, причем z может означать числа от 1 до 38, но меньше k, которое может означать число от 2 до 39. (Группа) А представляет собой присоединенную группу, которая стоит в любом месте, но предпочтительно у С-конца, и в большинстве случаев выше y. Присоединенная группа предпочтительно представляет собой амин лизин.
Например, химерный пептид GLP-1(x-y)эксендин-3(z-k)A1-75 или GLP-1(х-y)эксендин-4(z-k)A1-75 представляет собой пептид МС12, состоящий из GLP-1(7-36)эксендин(33-39)Lys-амида (синтез на фирме Specialty Laboratories GmbH по способу Merrifield и очистка ВЭЖХ).
МС12: (Ser37, Gly38, Ala39, Pro40, Pro41, Pro42, Ser43, DTPA-Lys44-амид) GLP1(7-36)
МС12 состоит из всей аминокислотной последовательности GLP-1(7-36) и у С-конца содержит амин, предпочтительно лизин, в положении 44, а также хелатирующий агент DTPA, а также дополнительную цепь из 7 аминокислот от эксендина(33-39)Lys- амида. Этим представлен химерный пептид GLP-1(7-36)эксендин(33-39)Lys-амид.
Специалисту очевидно, что при этом (могут быть) представлены производные пептидов из GLP-1, эксендина-3 и эксендина-4, а также химерные пептиды различной длины из GLP-1, эксендина-3 и эксендина-4, в основе которых лежат различные комбинации аминокислотных последовательностей из GLP-1, эксендина-3 и эксендина-4.
Предложенные производные пептидов GLP-1, эксендина-3 и эксендина-4, а также химерные пептиды из GLP-1, эксендина-3 и эксендина-4, которые модифицированы амином у С-конца, а N-концом могут связываться с GLP-1-рецептором, включают в себя также молекулы, аминокислотные последовательности которых отличаются от описанных пептидов GLP-1, эксендина-3 и эксендина-4 по одному или нескольким положениям и имеют более высокую степень гомологии указанных последовательностей. Гомология означает при этом идентичность последовательностей по меньшей мере на 40%, в частности идентичность по меньшей мере на 60%, предпочтительно на 80% и особенно предпочтительно на 90%. Отклонения от вышеописанных аминокислотных последовательностей при этом могут возникнуть в результате удаления, замещения и/или внедрения.
Сверх того были получены предложенные химерные пептиды из GLP-1, эксендина-3 или эксендина-4 также без модифицирования С-конца и при этом найдено их применение, особенно при получении средства для терапии диабета.
GLP-1(x-y)эксендин-3(z-k)
GLP-1(x-y)эксендин-4(z-k)
Эксендин-3(z-k)GLP-1(x-y)
Эксендин-4(z-k)GLP-1(x-y)
MC20:(Ser33, Gly34, Ala35, Pro36, Pro37, Pro38, Ser39) эксендин GLP-1(7-36)
МС20 состоит из всей аминокислотной последовательности GLP-1(7-36) и содержит у С-конца цепь из 7 аминокислот эксендина (33-39). При этом представлен немодифицированный химерный пептид GLP-1(7-36)эксендин(33-39).
Мечение производных пептидов и химерных пептидов
Предложенные производные пептидов и химерные пептиды для получения средства для диагностики и терапии доброкачественных и злокачественных заболеваний, при которых играет роль экспрессия рецепторов GLP-1, растворяли в подходящем стабилизирующем буферном растворе, например, для стабилизации металла, предпочтительно в 0,5 М ацетате натрия, рН 5,4, в концентрации около 10-3 М. В качестве альтернативы для стабилизации флуоресцирующих красителей предпочтителен буферный раствор из ацетата аммония, для стабилизации химиотерапевтических средств и контрастных средств - физиологический буферный раствор.
Мечение осуществляют взаимодействием присоединенной группы А с радионуклидами, контрастными средствами MRT, флуоресцирующими красителями или химиотерапевтическими средствами. При этом для каждого вида применения in vitro или in vivo используют различные варианты.
В качестве радионуклидов для ковалентного или комплексного связывания использовали:
|
|
РЕТ (позитронная эмиссионная томография), SPECT (компьютерная томография единичных протонов).
В качестве флуоресцирующего красителя/хромофора использовали, например флуоресцеин, родамин, кумарин, пирен (каскадный синий (cascadblau)), люцифер желтый (lucifergelb), фикобилипротеин (phycobiliprotein), цианин, алексафтор (alexafluoro), орегон зеленый (oregongruen), тексафирин красный (texasrot), кумарин и их производные.
Хелатирующими агентами являются, например, DTPA (диэтилентриаминпентауксусная кислота, N,N-бис(2-[бис(карбоксиметил)амино]этил)глицин), DOTA (1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота), HYNIC (6-гидразинопиридин-3-карбоновая кислота), MAG3 (меркаптоацетилглицилглицилглицин), N4 (1,4,8,11-тетраазаундекан) или производные всех указанных хелатирующих агентов.
Контрастными средствами MRT являются, например, гадолиний, марганец, европий, медь, никель, хром, празеодим, диспрозий или гольмий или их соединения, а также отрицательные MRT-контрастные средства, такие как, например, перфторуглероды, а также, например, изотопы для MRT-спектроскопии, такие как F-19, H-1, P-31, Na-19.
Отрицательные MRT-контрастные средства представляют собой котрастные средства, которые гасят или сильно ослабляют, но не усиливают сигналы MRT.
Химиотерапевтические средства представляют собой, в частности, аддукторы алкила (Alkylanzien), интеркаляторы, антиметаболиты, ингибиторы ферментов и митотические яды (например, алкилсульфонаты, производные этилиминонитрозомочевины, утратившие азот, аналоги фолиевой кислоты, аналоги пурина, аналоги пиримидина, аналоги подофиллина, таксаны, алкалоиды барвинка, антрациклины, прочие цитостатические антибиотики, соединения платины, производные камптотецина, различные гормоны, факторы роста, интерфероны или интерлейкины), кроме того химиотерапевтические средства, описанные в “Onkologie 2004/05” авторами Preiss, Dornhoff, Hagmann, Schmieder в Zuckschwerdtverlag на стр. 230-267, а также другие цитостатически или цитотоксично действующие вещества.
В зависимости от рода применения предложенных производных белков и химерных белков и от полученных из них средств для диагностики и терапии доброкачественных и злокачественных заболеваний, при которых играет роль экспрессия рецепторов GLP-1, реакцию мечения проводили в двух вариантах.
Мечение для применения in vitro в радиотерапии
3 мкл раствора предложенного производного пептида или химерного пептида в подходящем стабилизирующем буфере, предпочтительно 0,5 М ацетате натрия, рН 5,4, с концентрацией около 10-3 М для мечения прибавляли к 500 мкл 0,5 М ацетата натрия, рН 5,4. При этом рН находился при 3-6. Туда же прибавляли 185 MBq 111InCl3 (Tyco, Petten, Нидерланды) в 500 мл 0,1 М HCl и инкубировали в течение 30 минут при 37°С. Для насыщения всех участков связывания снова прибавляли 3 мкл раствора natInCl3 и инкубировали еще в течение 30 минут.
Контроль качества проводили ВЭЖХ на колонке.
Колонка: СС 250/4,6 Nucleosil 120-5 C18(Machery-Nagel, Oenisingen, Швейцария)
Градиент: 0→5 мин 100% 0,05М NH4OOCCH3, рН 5,4 (буферный раствор А); 5→25 мин 100% буферный раствор А→50% буферного раствора А/50% ацетонитрила.
Контроль качества для применения in vitro выполняли при выходе мечения более 98%.
Таким образом получали в распоряжение радиоактивное меченое средство для диагностики и терапии доброкачественных и злокачественных заболеваний, при которых играет роль экспрессия рецепторов GLP-1, такое как, например, вводимое в клеточные и тканевые культуры поджелудочной железы.
Мечение для применения in vivo при радиотерапии
3 мкл раствора предложенного производного пептида или химерного пептида в подходящем стабилизирующем буфере, предпочтительно 0,5 М ацетате натрия, рН 5,4, с концентрацией около 10-3 М для мечения прибавляли к 500 мкл 0,5 М ацетата натрия, рН 5,4. По окончании туда же прибавляли 185 MBq 111InCl3 (Tyco, Petten, Нидерланды) в 500 мл 0,1 М HCl и инкубировали в течение 30 минут при 37°С. Контроль качества проводили ВЭЖХ на колонке.
Колонка: СС 250/4,6 Nucleosil 120-5 C18(Machery-Nagel, Oenisingen, Швейцария)
Градиент: 0→5 мин 100% 0,05М NH4OOCCH3, рН 5,4 (буферный раствор А); 5→25 мин 100% буферный раствор А→50% буферного раствора А/50% ацетонитрила.
Контроль качества для применения in vivo выполняли при выходе мечения более 98%.
Таким образом получали радиоактивное меченое средство для диагностики и терапии доброкачественных и злокачественных заболеваний, при которых играет роль экспрессия рецепторов GLP-1, например, для определения опухолей у пациента.
Понятие пациент означает здесь равным образом человека и позвоночное животное. Таким образом, средство применимо в медицине и ветеринарии. Терапевтически и диагностически действующие средства по изобретению вводят пациенту как часть фармацевтически приемлемой композиции либо перорально, ректально, парентерально, внутривенно/внутриартериально, внутримышечно, внутрисосудисто, местно (порошок, мазь или капли), либо в виде спрея. Соответствующая дозировка в каждом случае применения для диагностики и терапии доброкачественных и злокачественных заболеваний, при которых играет роль экспрессия рецепторов GLP-1, устанавливается врачом.
Изучение интернализации
Изучение интернализации показывает, например, перенос радиоактивно меченых in vitro предложенных производных пептидов и химерных белков в клетки.
В 6-луночный планшет высевали 100000 СНО-клеток, трансфицированных GLP-1-рецепторами. Клетки выращивали до сливания. Были образованы 4 группы:
Группа 1: общее связывание, промывание PBS
К 2 мл среды прибавляли меченый 100000 cpm 111In пептид (10-15 моль) и инкубировали в течение 1 ч при 37°С. Затем трижды промывали PBS и отделяли клетки 20 мМ MOPS (3-морфолинопропансульфокислотой)+0,1% тритон-Х-100 (pH 7,4). Захват в клетки измеряли на γ-счетчике. Число клеток измеряли по содержанию белка при помощи набора для определения белка из Bio-Rad (Мюнхен, Германия) на основе способа Bradford'a. Результат выражали в cpm/мкг белка.
Группа 2: неспецифическое связывание, промывание PBS
К 2 мл среды прибавляли 20 мкл 10-3 М раствора GLP-1 и меченый 100000 cpm 111In пептид и инкубировали в течение 1 ч при 37°С. Затем трижды промывали PBS и отделяли клетки 20 мМ MOPS (3-морфолинопропансульфокислотой)+0,1% тритон-Х-100 (pH 7,4). Захват в клетки измеряли на γ-счетчике. Число клеток измеряли по содержанию белка при помощи набора для определения белка из Bio-Rad (Мюнхен, Германия) на основе способа Bradford'a. Результат выражали в cpm/мкг белка.
Группа 3: общее связывание, промывание кислотой
К 2 мл среды прибавляли 20 мкл 10-3 М раствора GLP-1 и меченый 100000 cpm 111In пептид и инкубировали в течение 1 ч при 37°С. Затем промывали 1 раз 0,1 М буферным раствором ацетата натрия, рН 4, и дважды PBS и отделяли клетки 20 мМ MOPS (3-морфолинопропансульфокислотой)+0,1% тритон-Х-100 (pH 7,4). Захват в клетки измеряли на γ-счетчике. Число клеток измеряли по содержанию белка при помощи набора для определения белка из Bio-Rad (Мюнхен, Германия) на основе способа Bradford'a. Результат выражали в cpm/мкг белка.
Группа 4: неспецифическое связывание, промывание кислотой
К 2 мл среды прибавляли 20 мкл 10-4 М раствора GLP-1 и меченый 100000 cpm 111In пептид и инкубировали в течение 1 ч при 37°С. Затем промывали 1 раз 0,1 М буферным раствором ацетата натрия, рН 4, и дважды PBS и отделяли клетки 20 мМ MOPS (3-морфолинопропансульфокислотой)+0,1% тритон-Х-100 (pH 7,4). Захват в клетки измеряли на γ-счетчике. Число клеток измеряли по содержанию белка при помощи набора для определения белка из Bio-Rad (Мюнхен, Германия) на основе способа Bradford'a. Результат выражали в cpm/мкг белка.
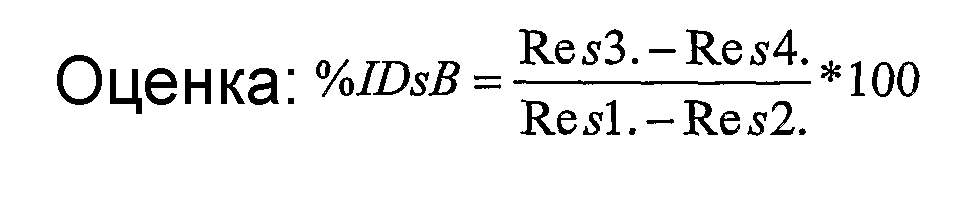
%IdsB=% внедрения специфического связывания
|
Результаты показывают, что происходит хороший перенос в клетки.
Изучение связывания
Изучение связывания показывает специфическое связывание радиоактивно меченых in vivo предложенных производных пептидов и химерных белков с GLP-1-рецепторами.
В 6-луночный планшет высевали 100000 СНО-клеток, трансфицированных GLP-1-рецепторами. Клетки выращивали до сливания. Затем прибавляли в 2 мл маркированного 100000 cpm111In пептида. Для определения связывание блокировали 20 мкл 10-3 М раствора GLP-1.
|
Биораспределение in vivo получали на грызунах, например на голых мышах. Для этого впрыскивали трансфицированные GLP-1 СНО-клетки голым мышам. Через 3-5 недель опухоли вырастали до величины около 300 мг. Мышам впрыскивали предложенный меченый 37 MBq 111In пептид через хвостовую вену и через 4 ч измеряли мышей в γ-камере.
При этом происходило быстрое очищение через почки и поглощение почками. Более высокое поглощение происходило равным образом в опухолевой ткани, позитивной по рецепторам GLP-1, в то время как опухолевые ткани, негативные по рецепторам GLP-1, едва проявляли поглощение. Легкое поглощение также наблюдали в поджелудочной железе, другие органы не проявляли видимого поглощения.
Изучение биораспределения ex vivo проводили в группах по 4 мыши, при котором впрыскивали 555 kBq In-111 в хвостовую вену. Через 1, 4 и 24 ч после впрыскивания мышей убивали и извлекали органы.
Измеряли поглощение радиоактивности и органы взвешивали. Рассчитывали % впрыснутой дозы на грамм массы органа (%i.D./g).
Результаты выглядели следующим образом.
|
Средние значения биораспредения для 4 мышей в группе в %i.D./г. Станд. отклонение: стандартное отклонение.

