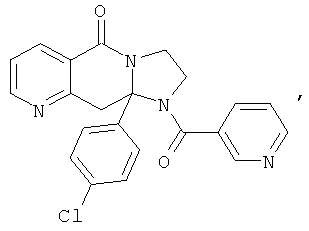
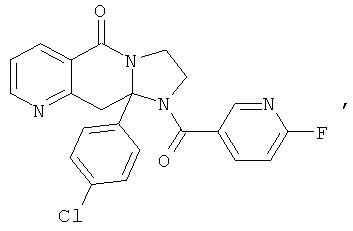
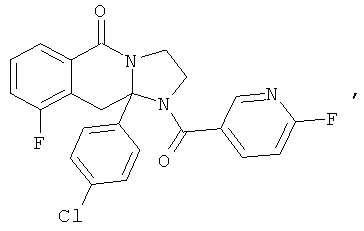
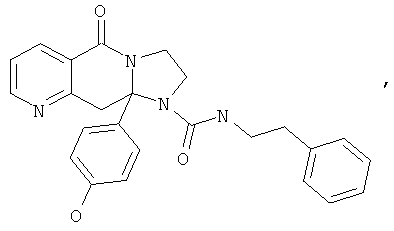
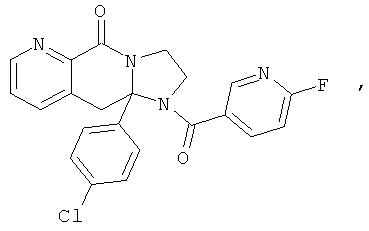
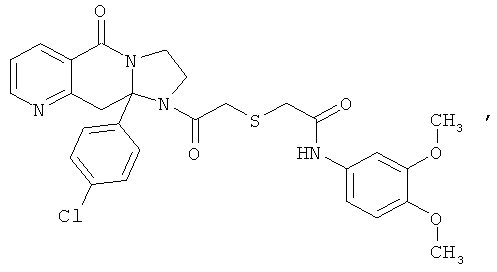
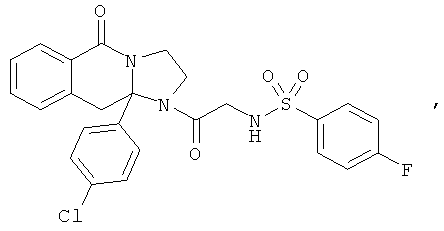
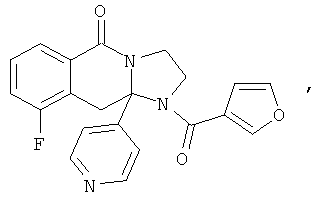
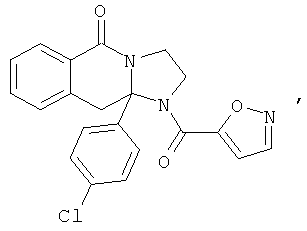
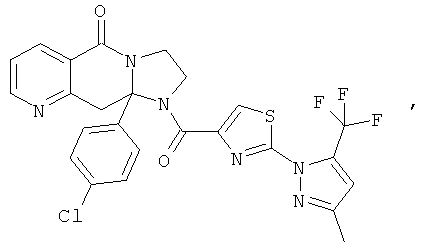
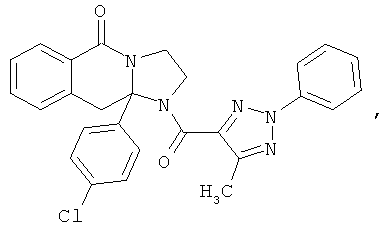
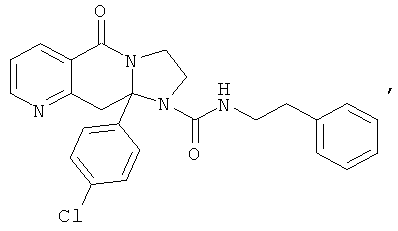
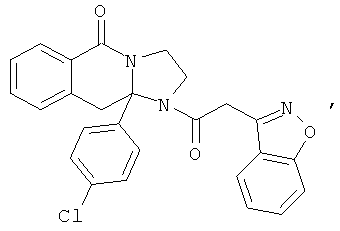
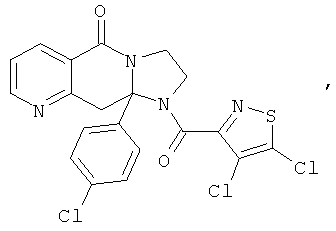
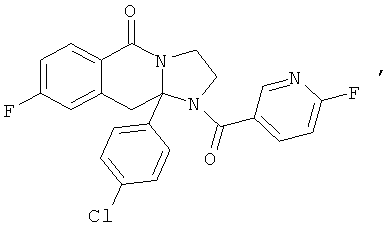
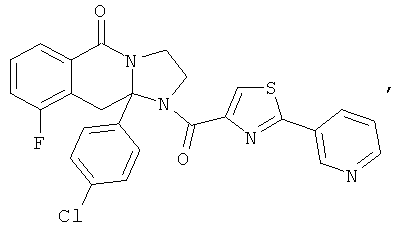
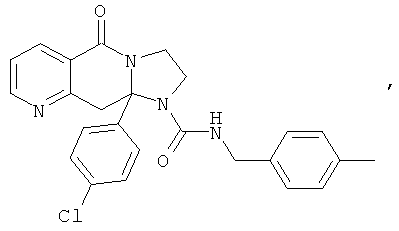
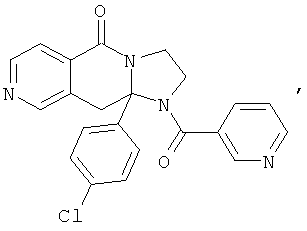
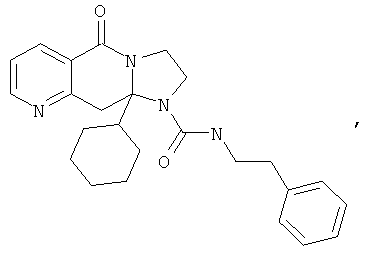
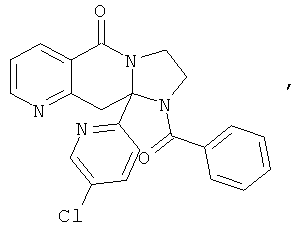
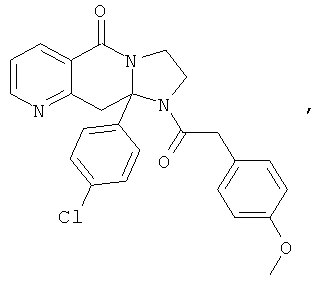
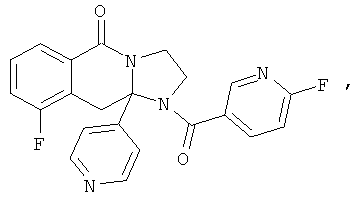
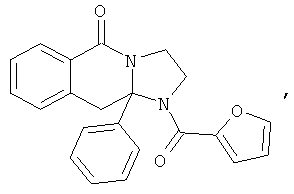
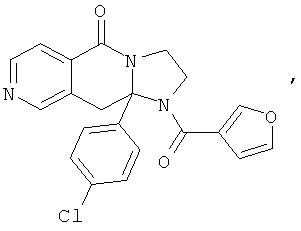
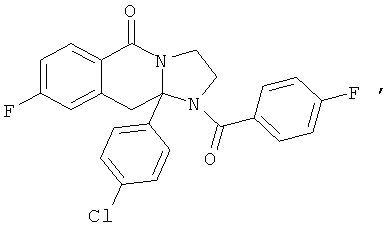
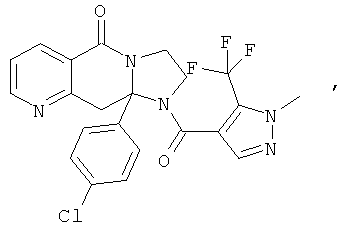
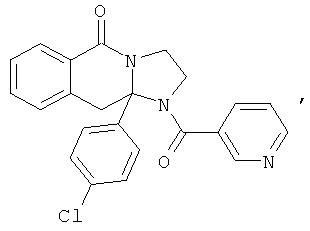
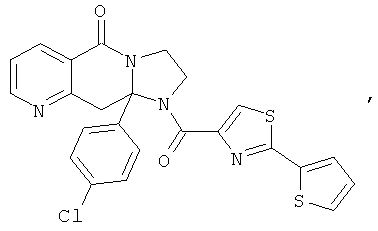
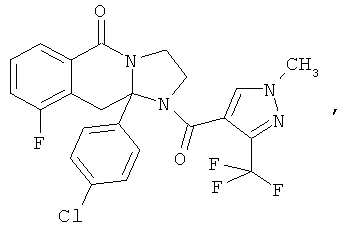
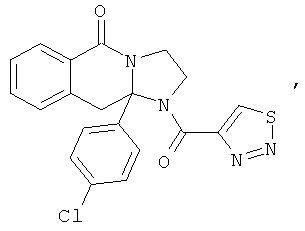
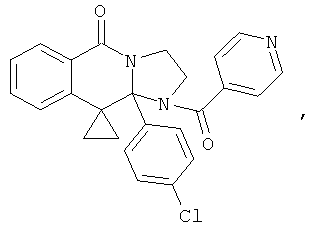
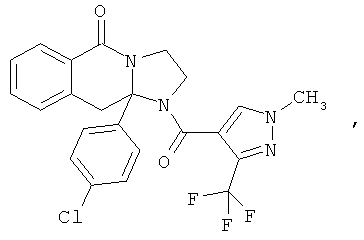
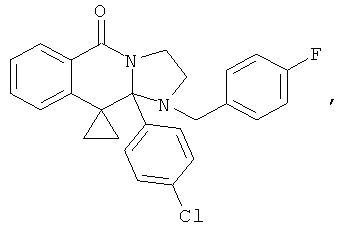
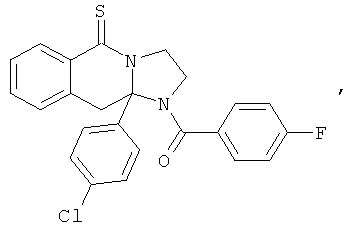
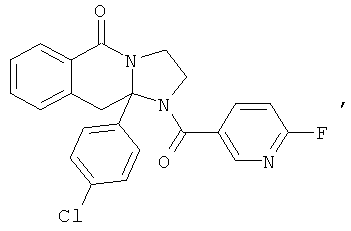
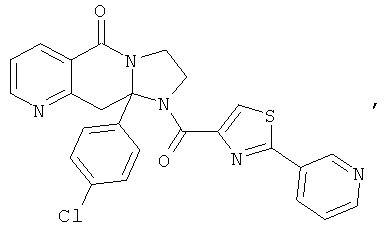
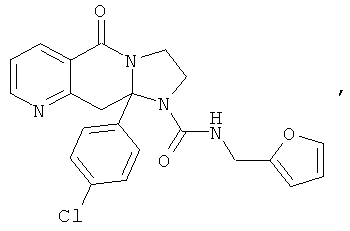
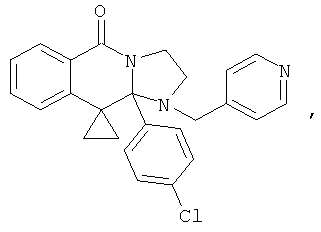
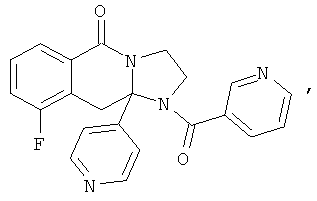
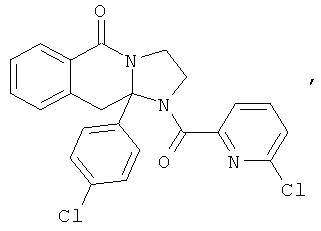
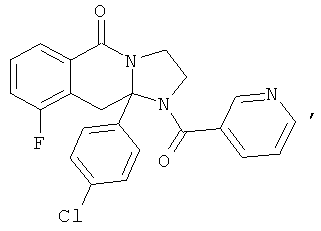
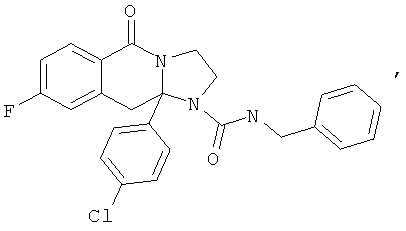
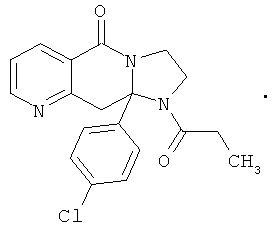
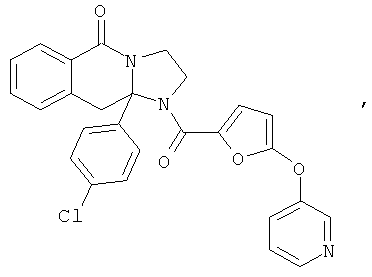
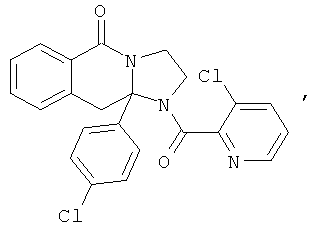
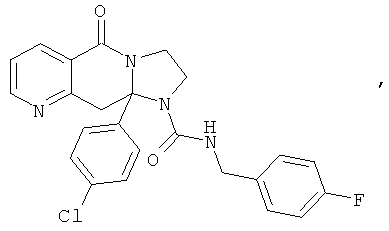
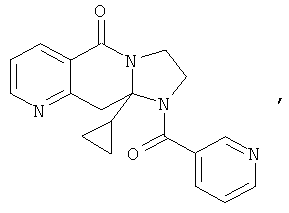
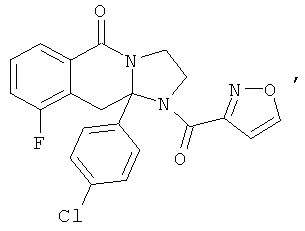
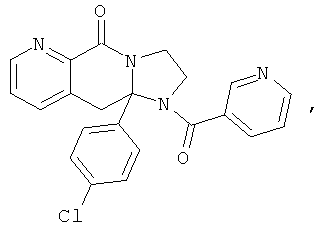
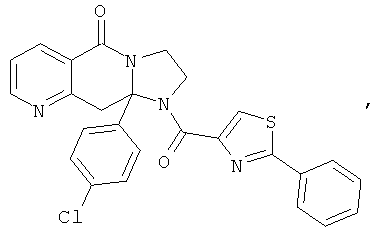
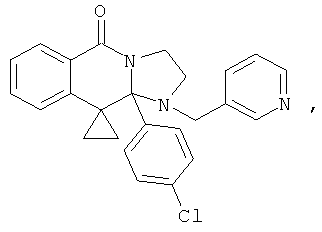
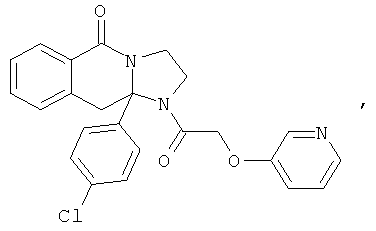
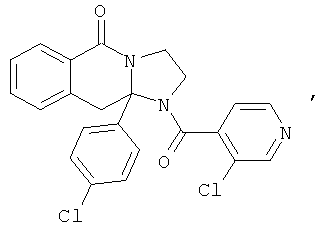
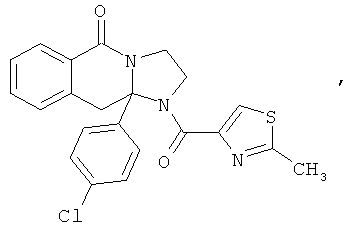
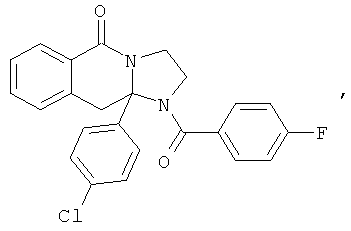
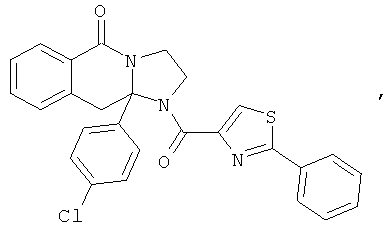
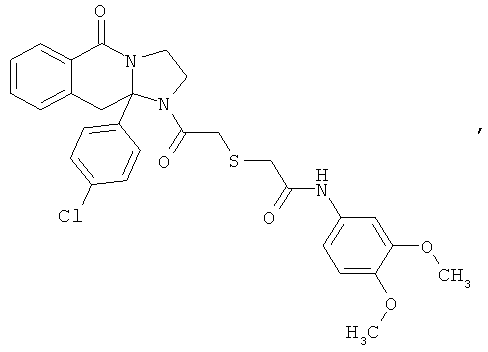
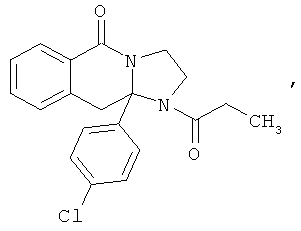
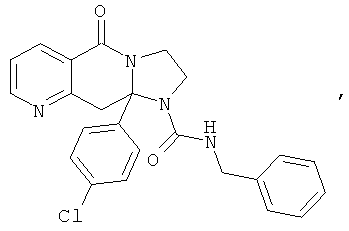
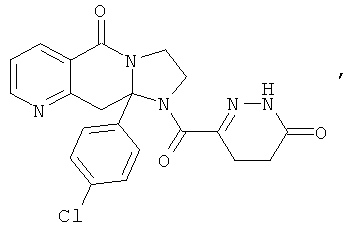
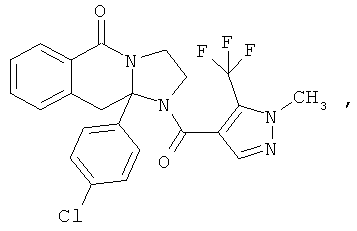
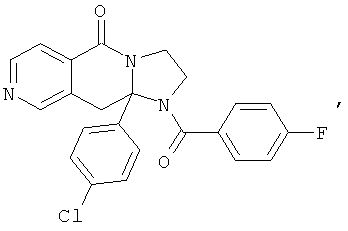
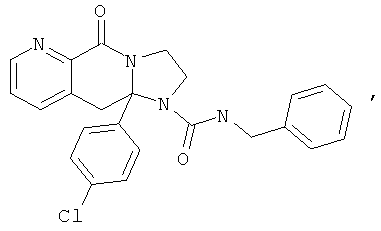
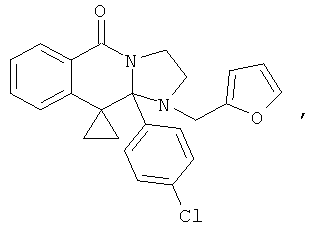
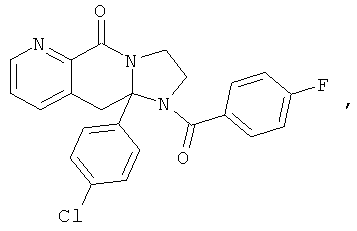
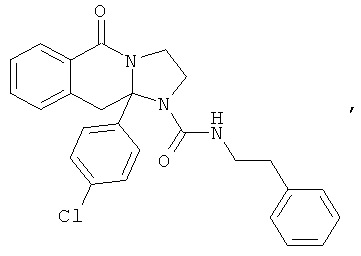
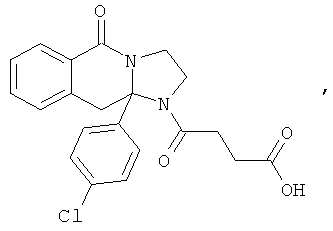
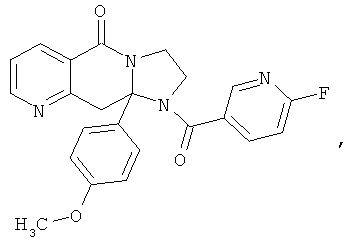
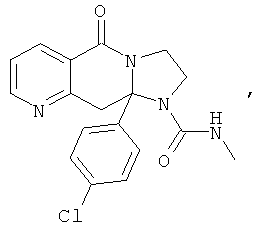
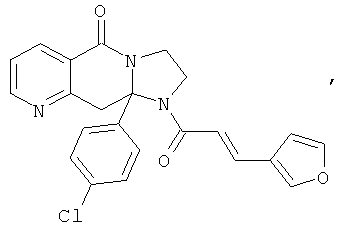
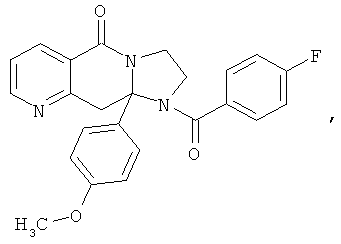
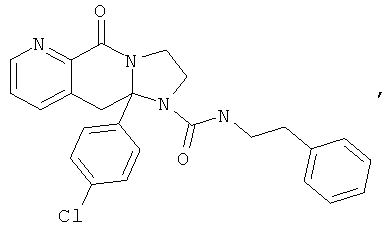
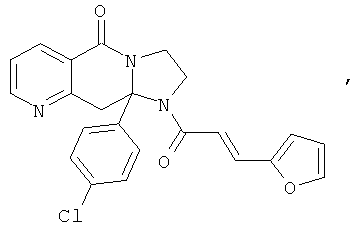
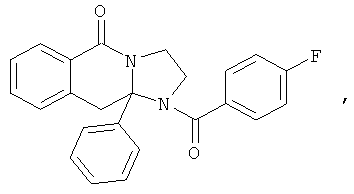
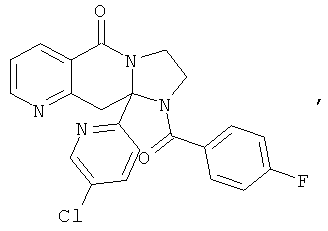
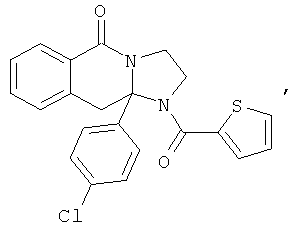
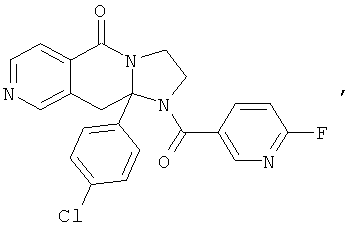
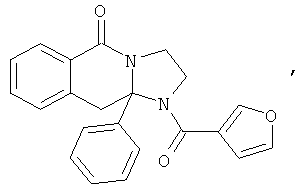
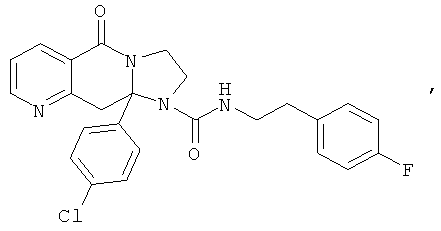
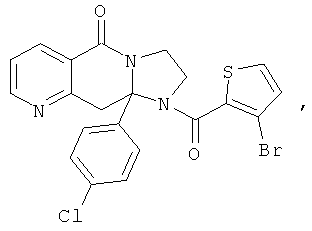
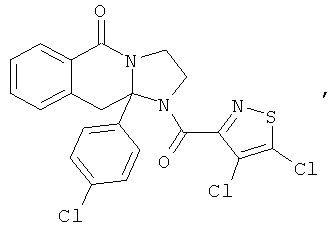
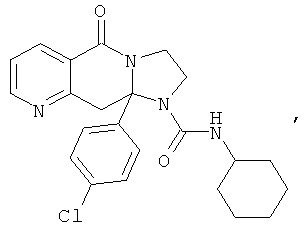
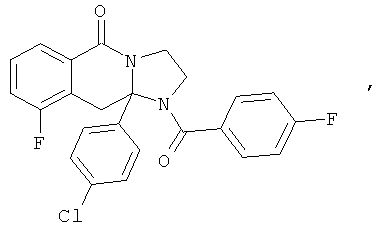
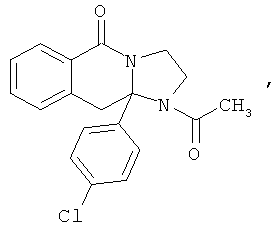
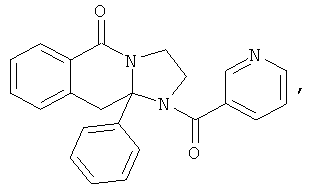
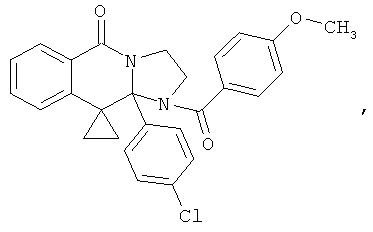
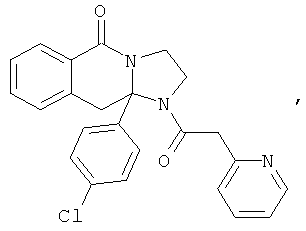
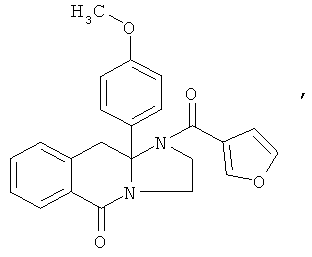
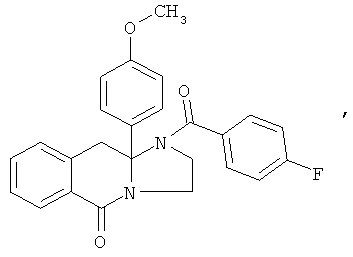
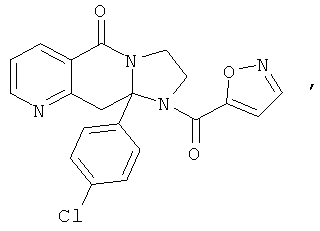
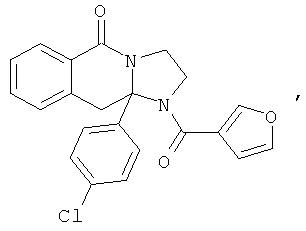
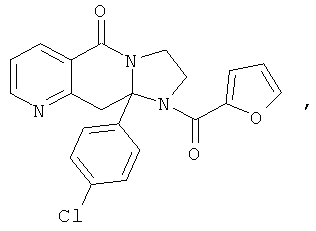
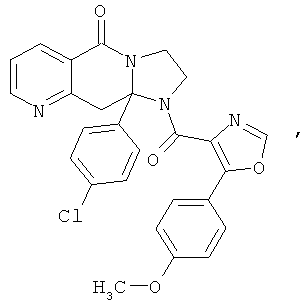
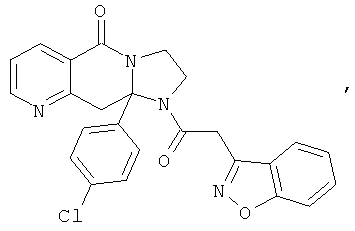
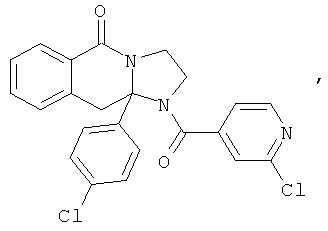
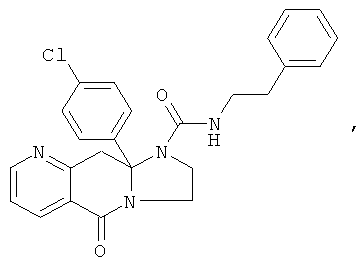
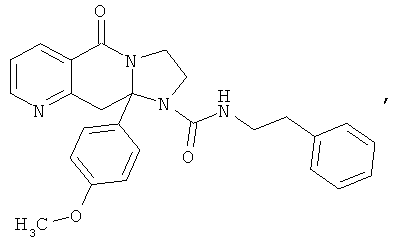
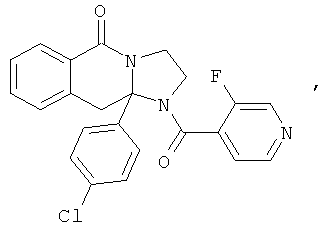
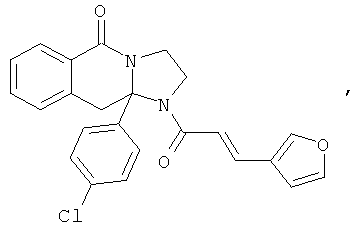
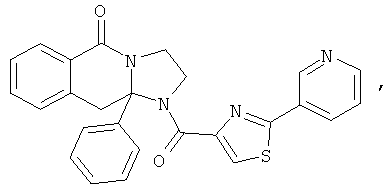
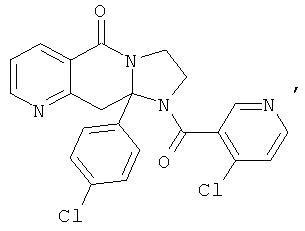
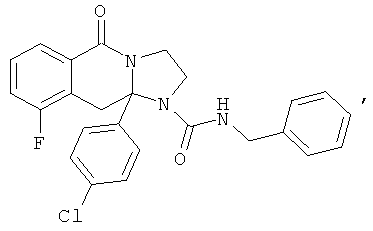
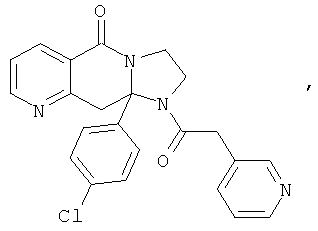
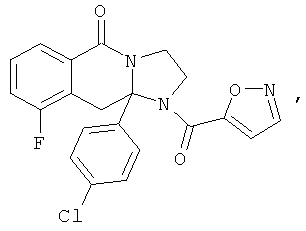
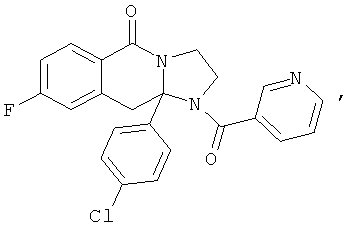
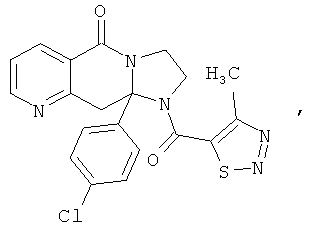
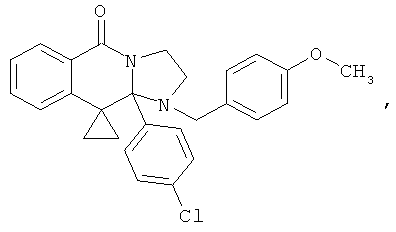
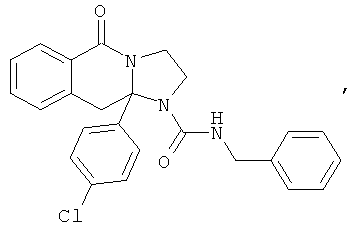
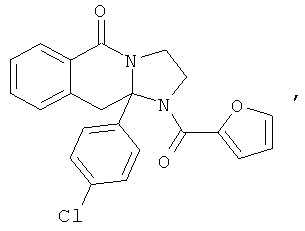
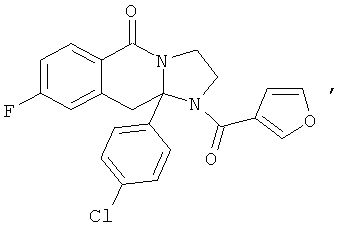
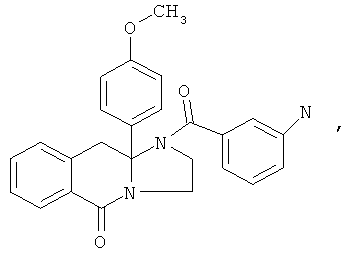
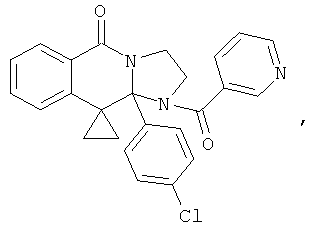
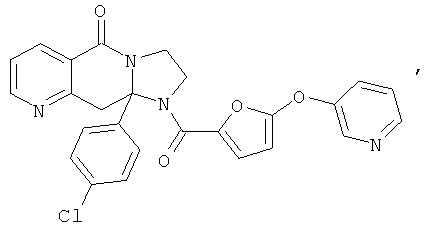
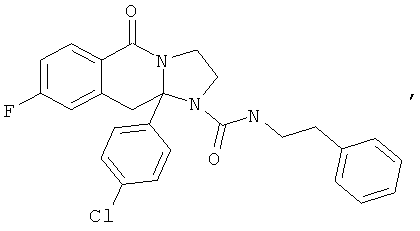
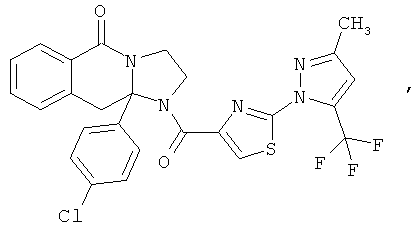
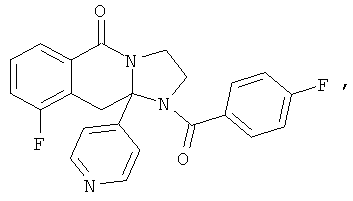
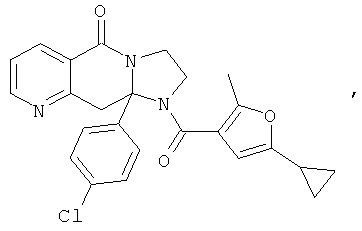
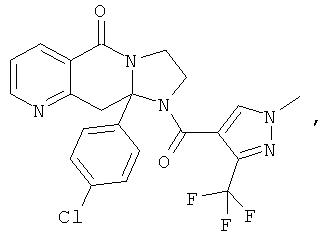
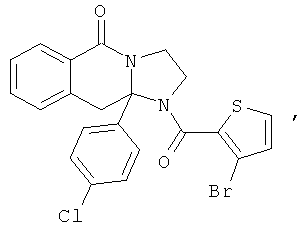
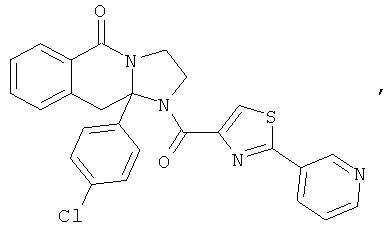
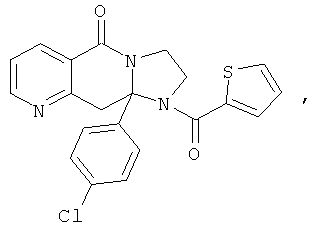
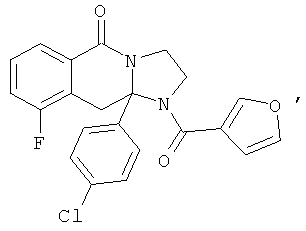
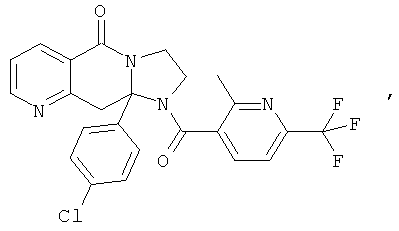
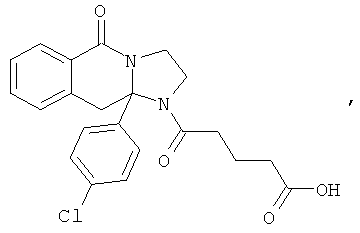
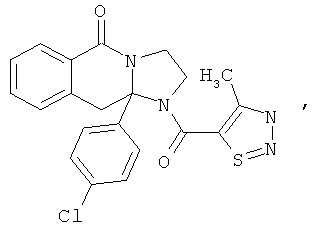
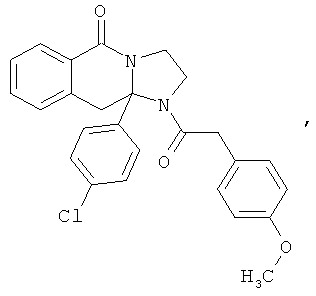
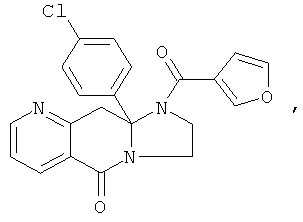
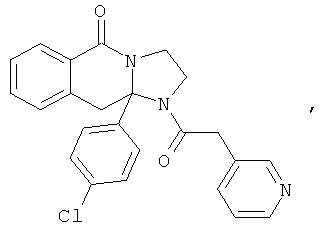
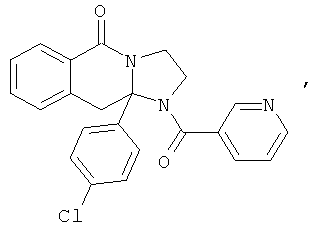
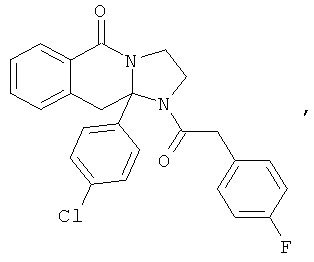
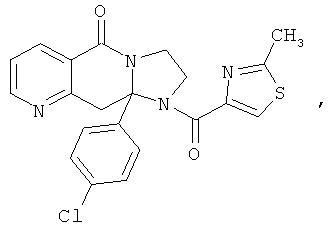
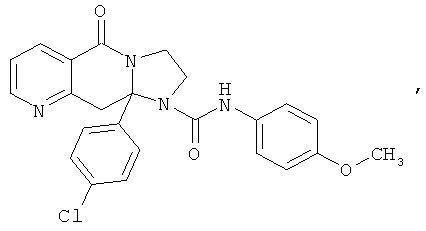
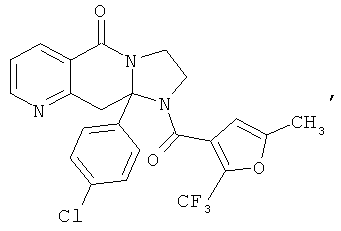
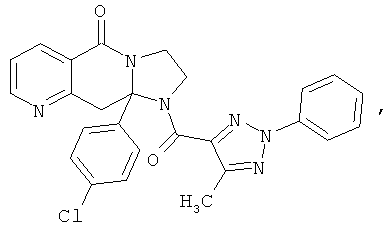
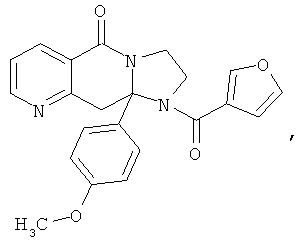
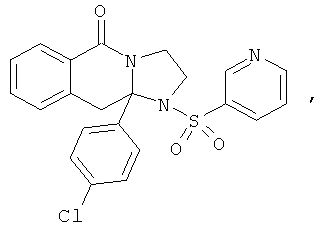
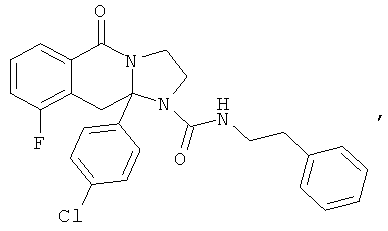
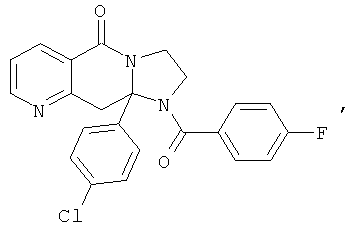
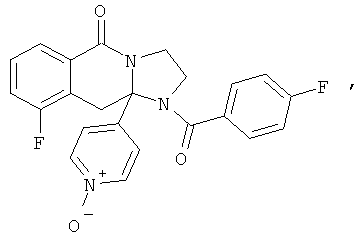
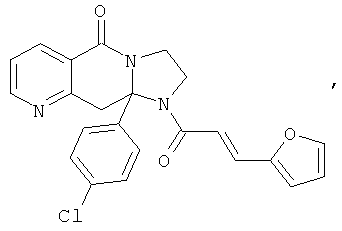
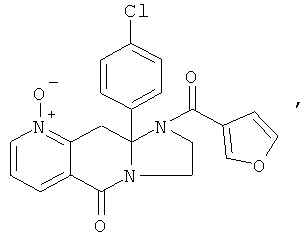
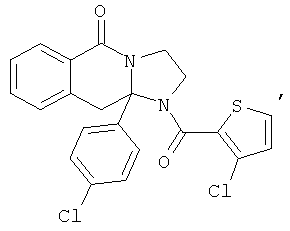
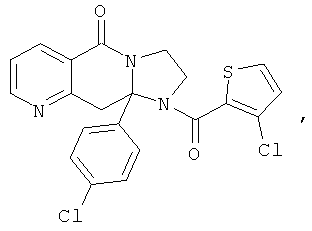
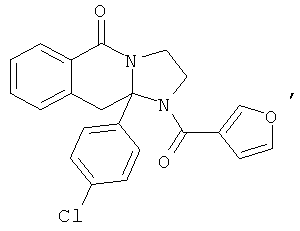
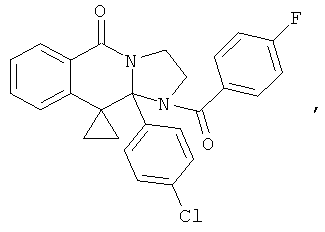
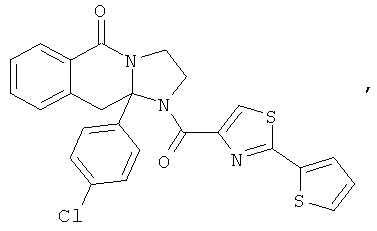
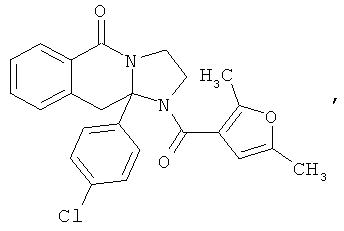
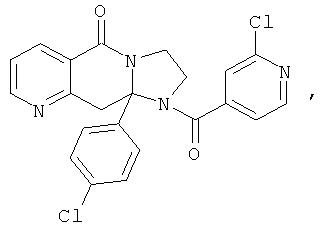
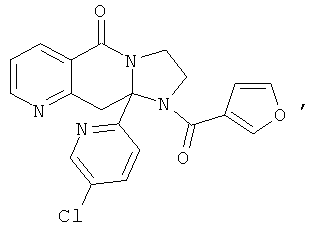
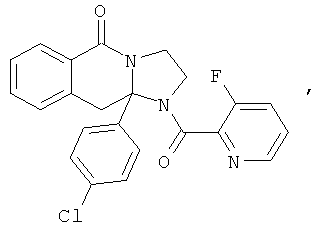
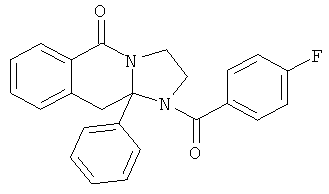
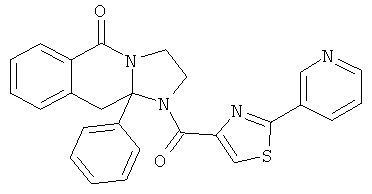
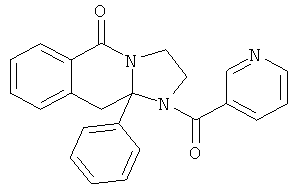
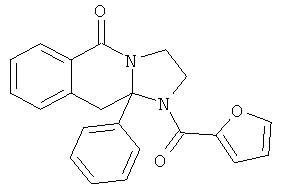
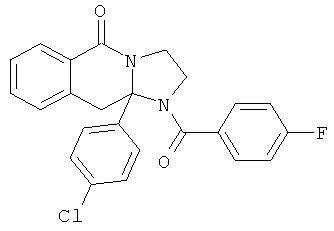
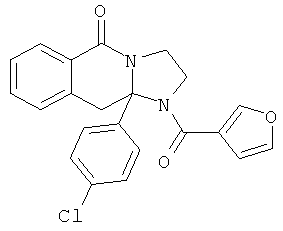
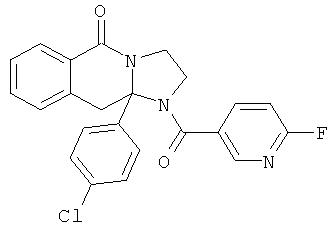
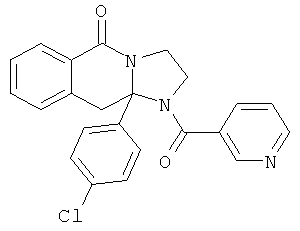
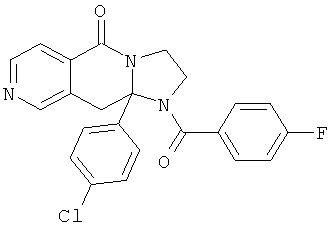
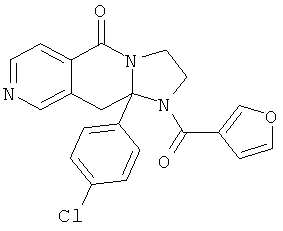
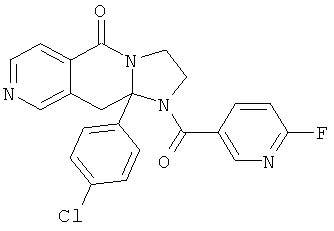
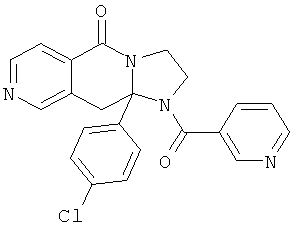
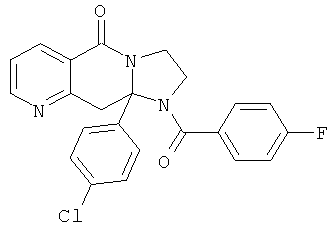
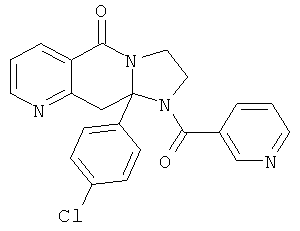
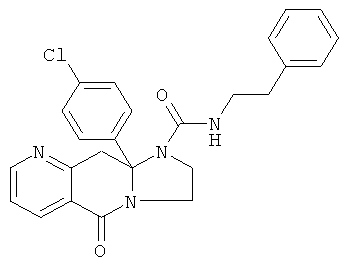
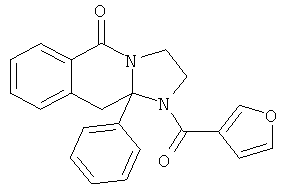
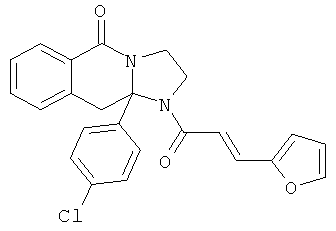
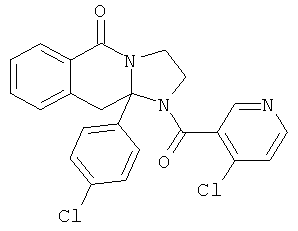
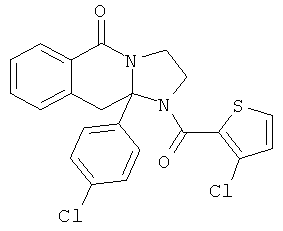
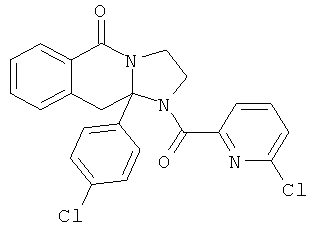
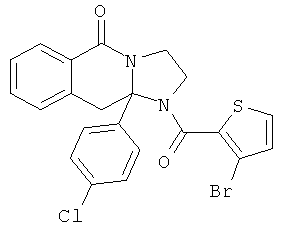
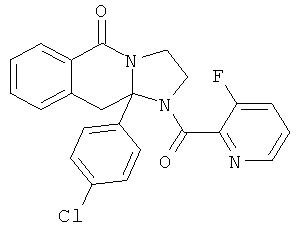
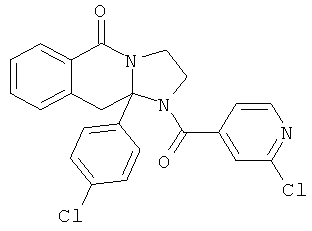
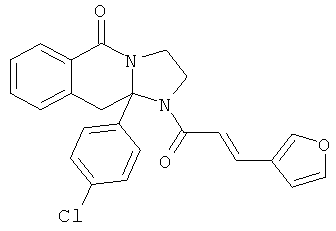
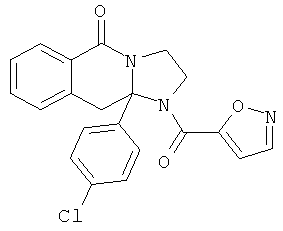
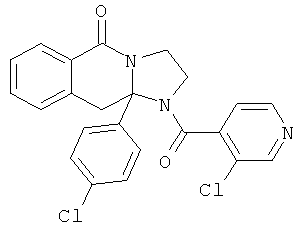
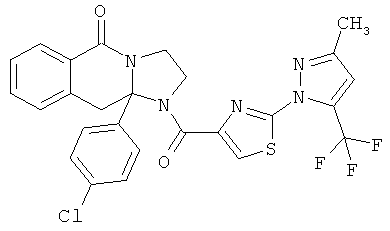
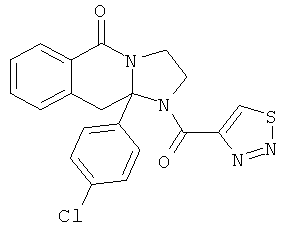
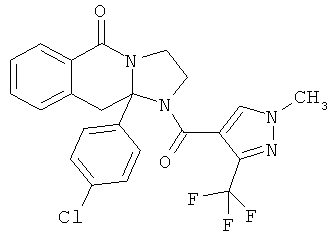
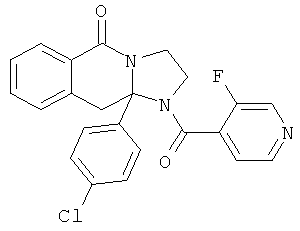
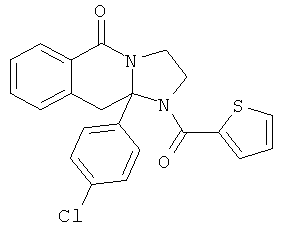
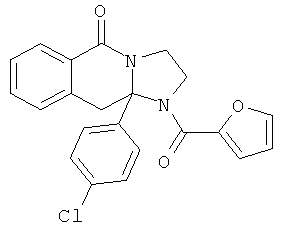
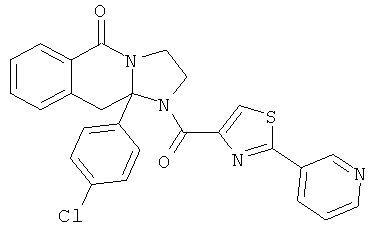
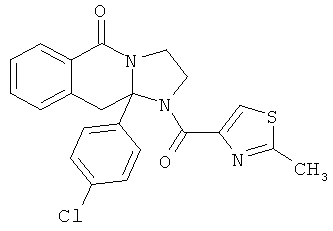
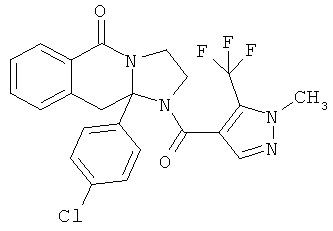
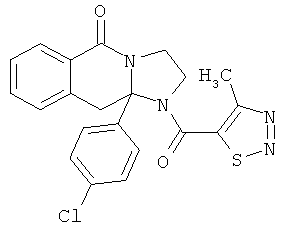
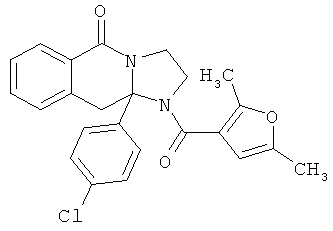
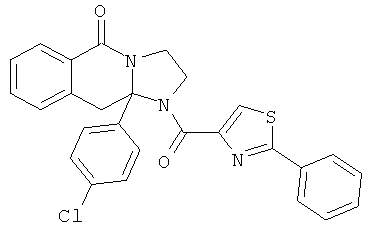
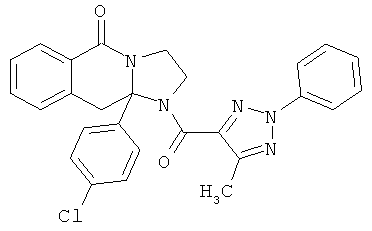
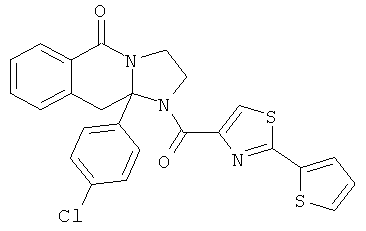
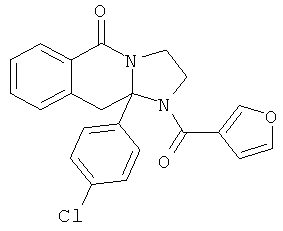
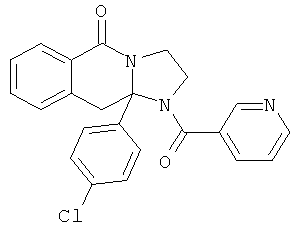
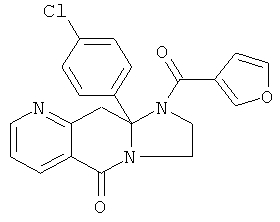
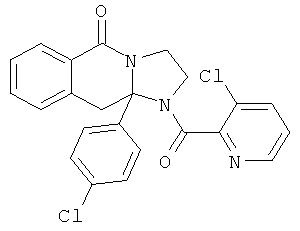
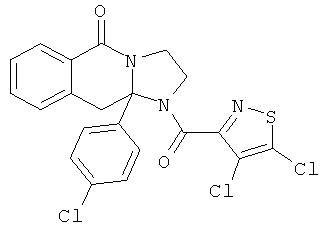
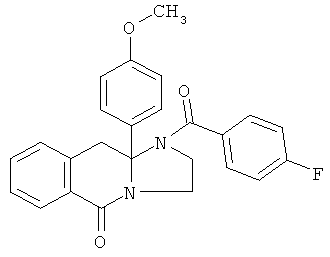
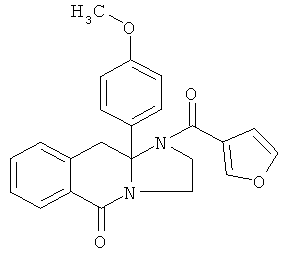
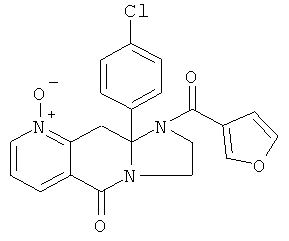
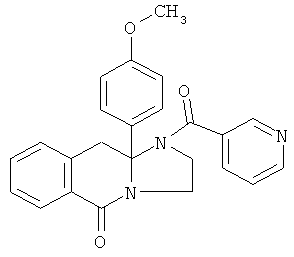
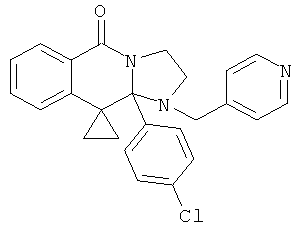
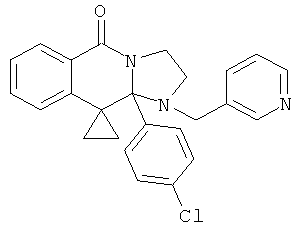
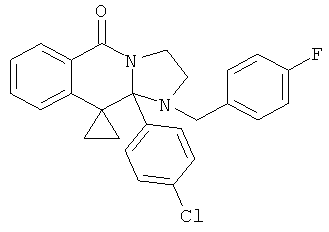
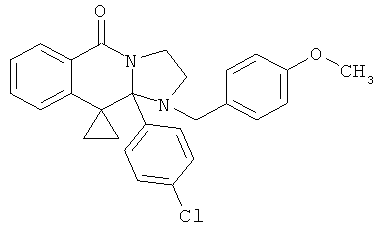
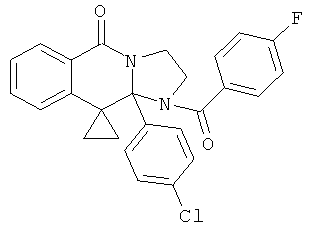
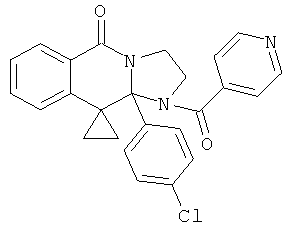
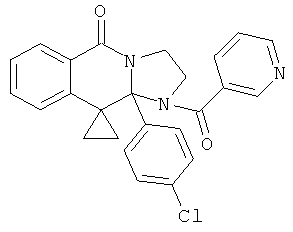
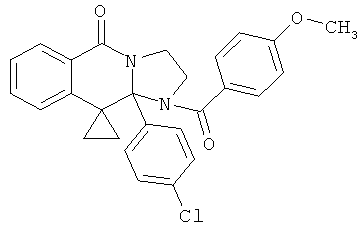
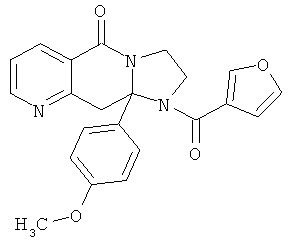
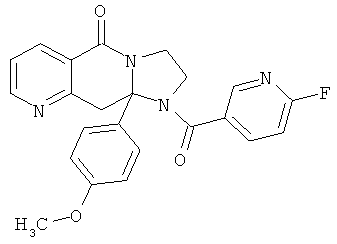
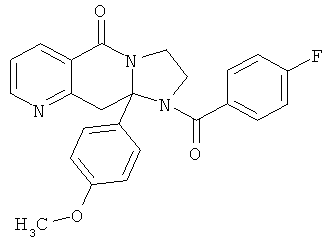
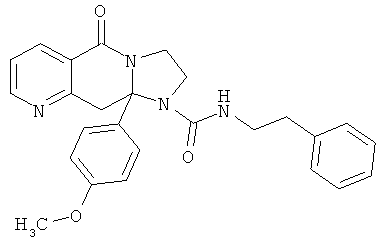
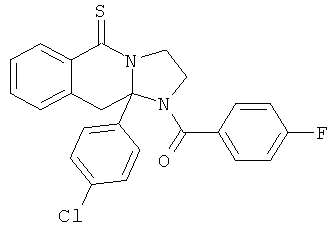
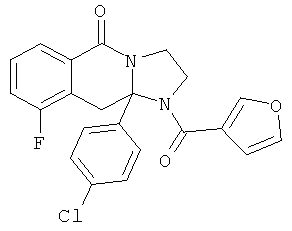
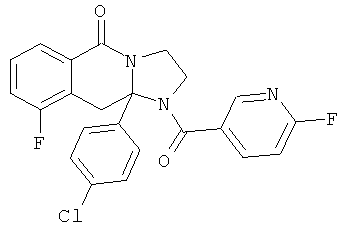
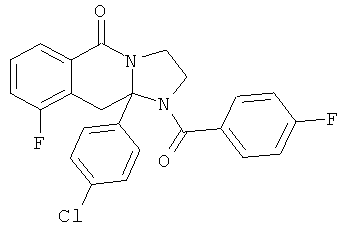
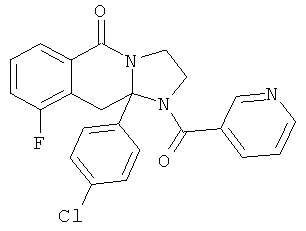
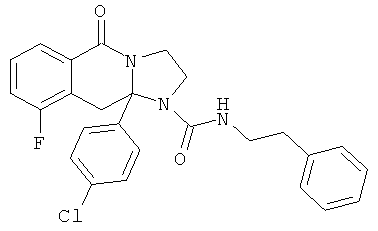
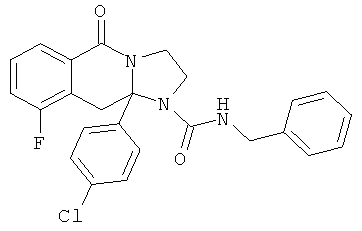
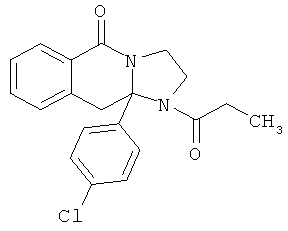
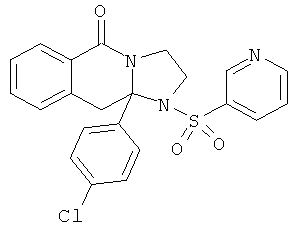
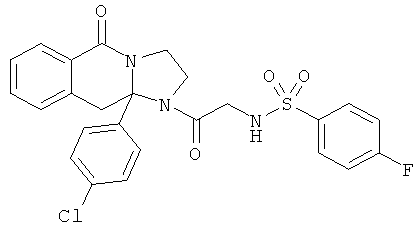
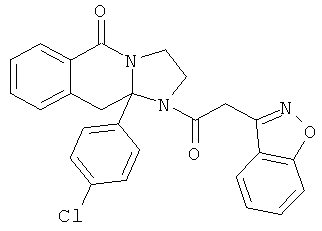
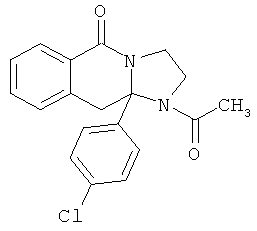
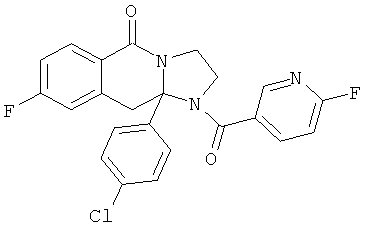
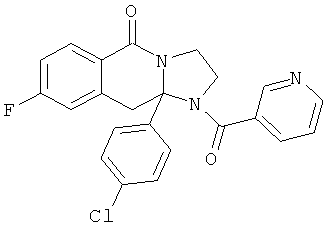
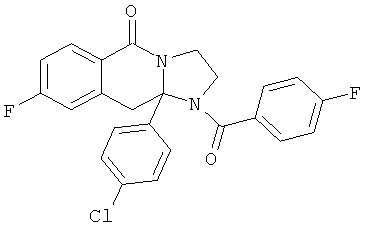
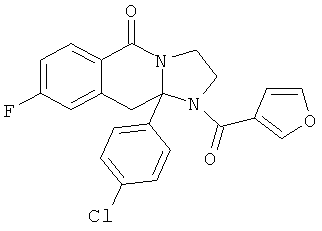
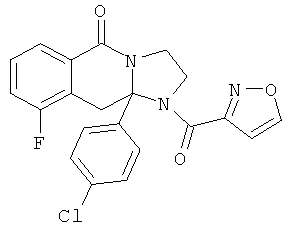
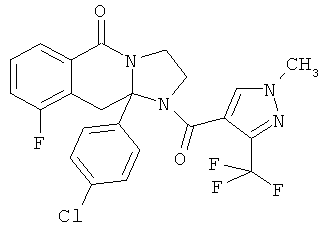
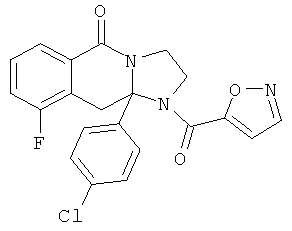
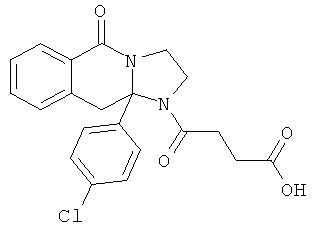
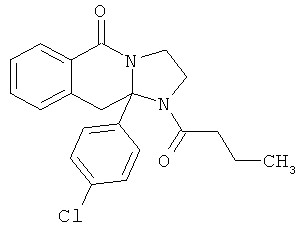
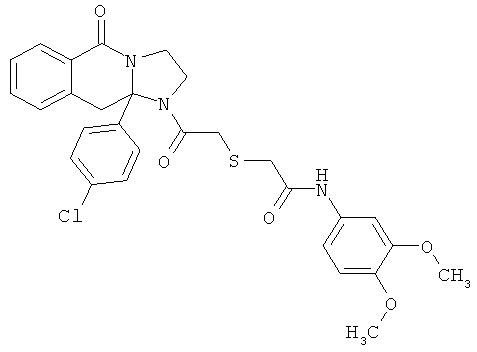
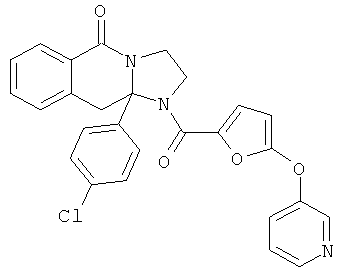
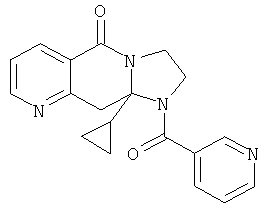
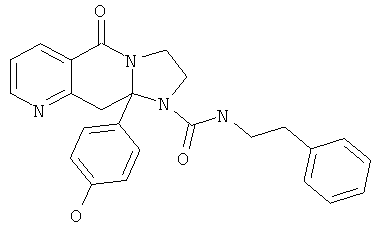
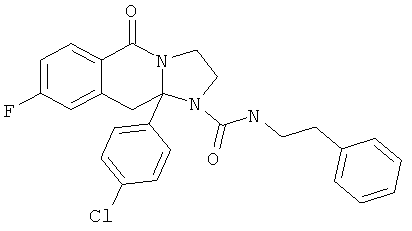
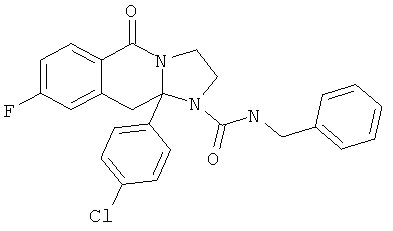
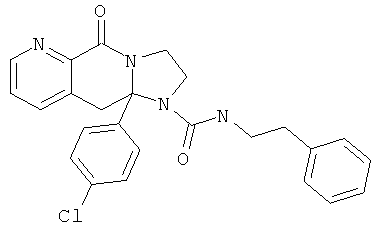
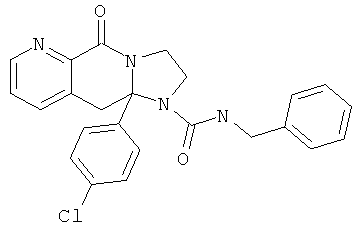
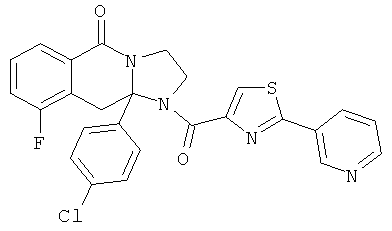
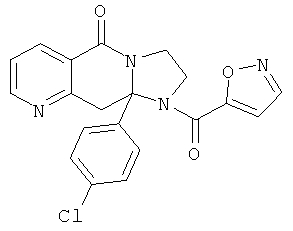
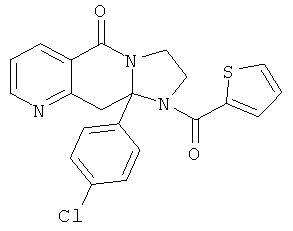
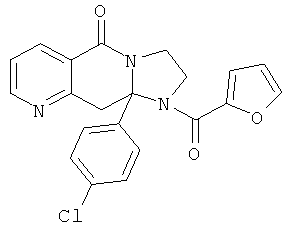
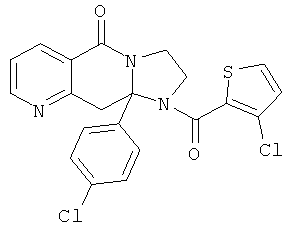
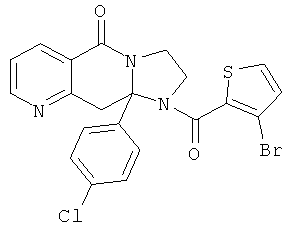
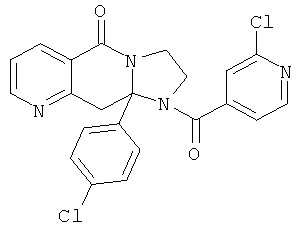
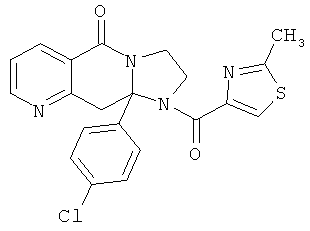
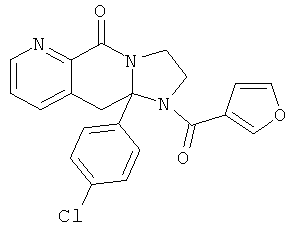
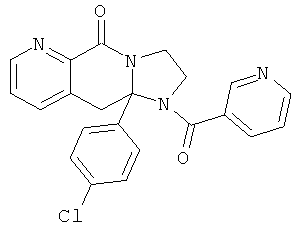
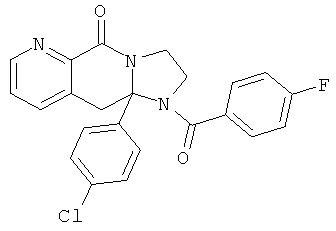
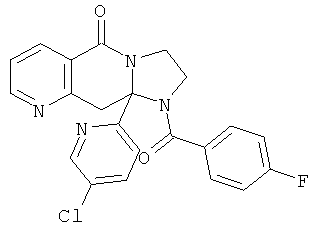
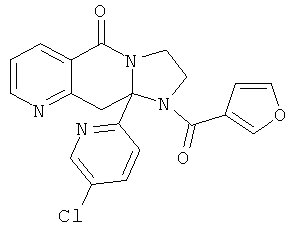
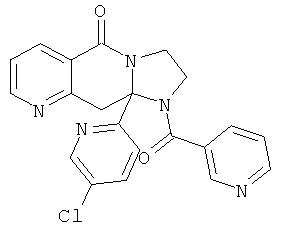
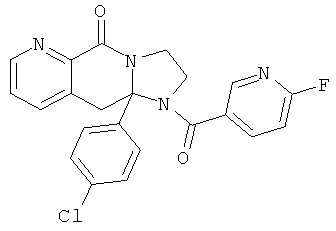
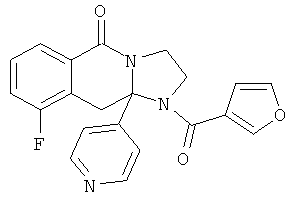
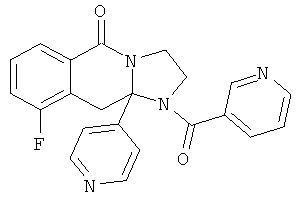
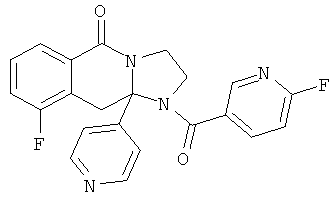
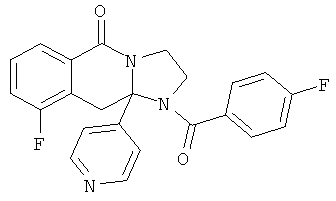
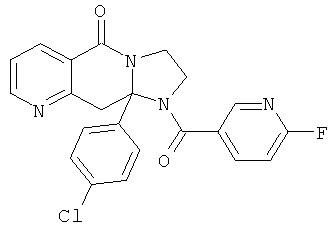
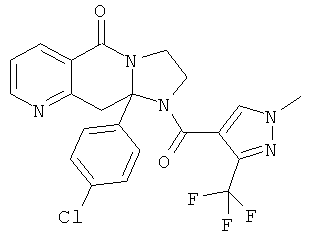
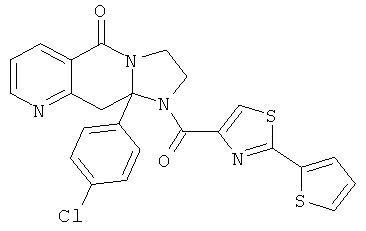
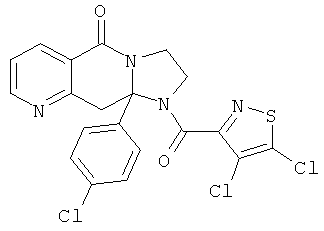
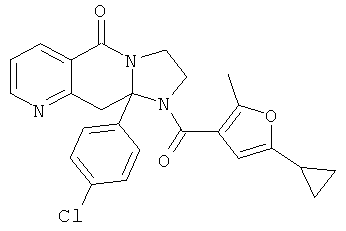
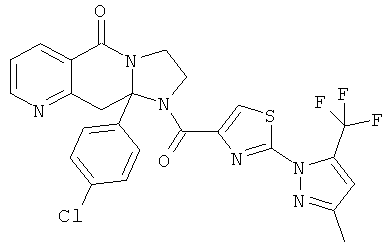
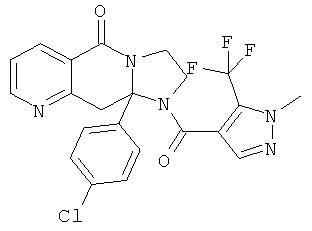
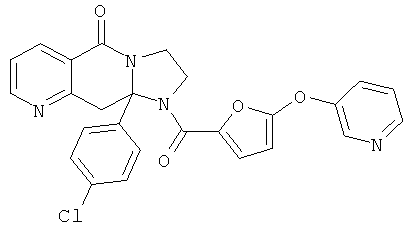
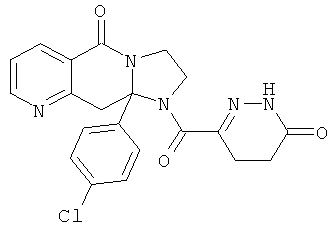
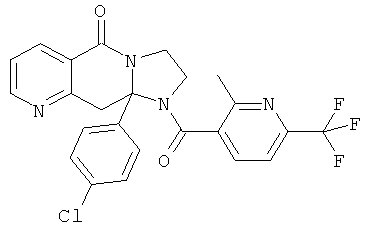
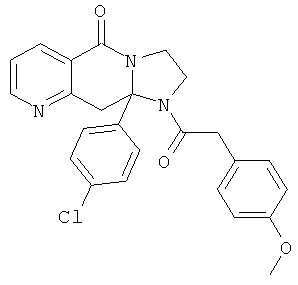
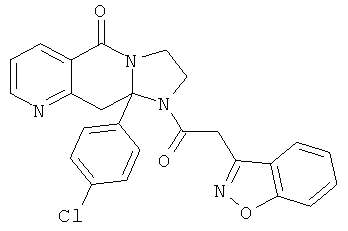
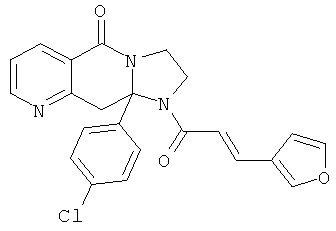
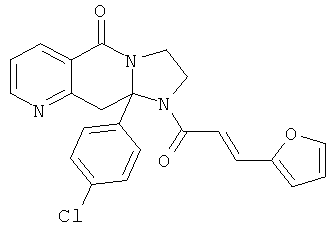
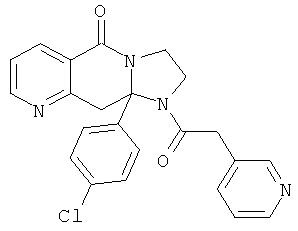
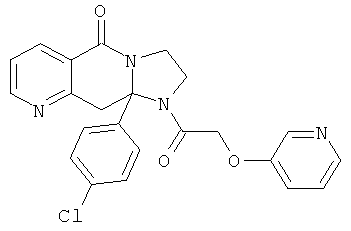
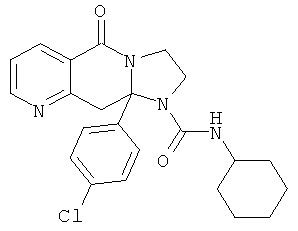
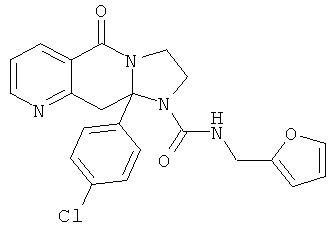
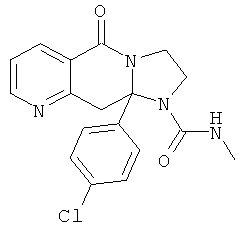
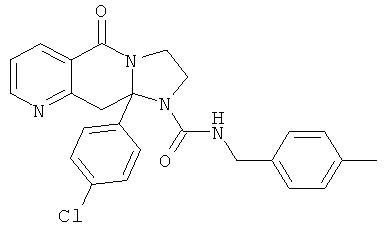
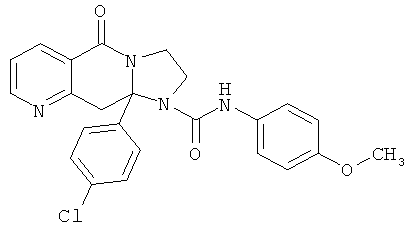
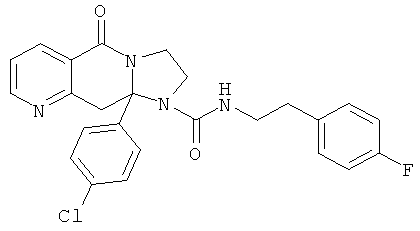
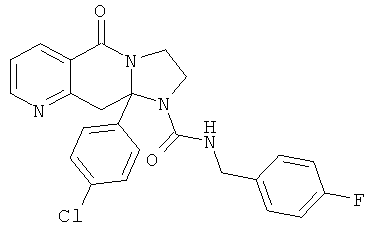
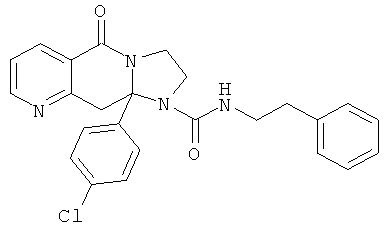
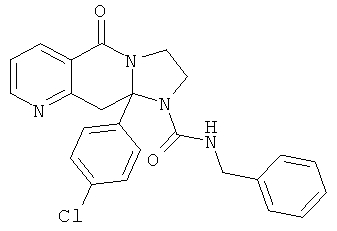
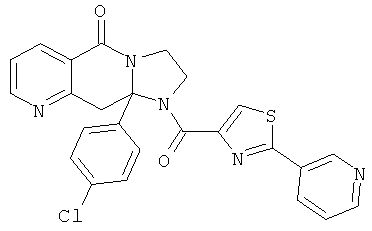
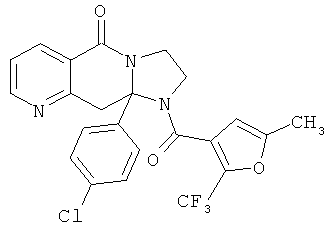
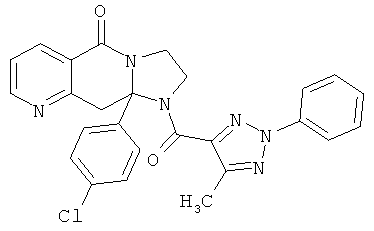
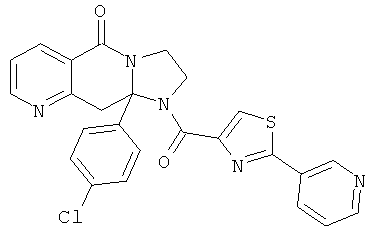
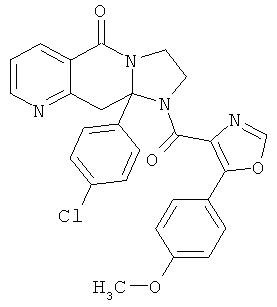
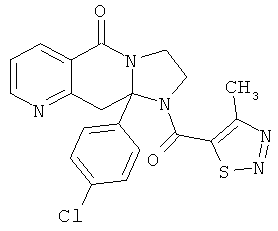
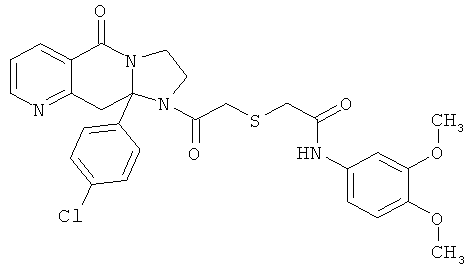
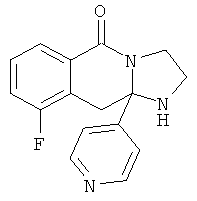
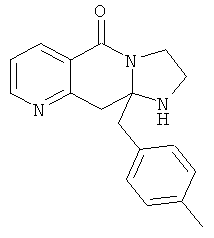
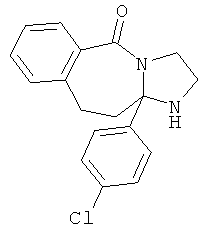
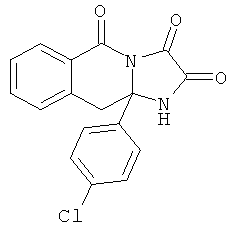
ПОЛИЦИКЛИЧЕСКИЕ АГЕНТЫ ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНО-СИНЦИТИАЛЬНЫХ ВИРУСНЫХ ИНФЕКЦИЙ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к противовирусным соединениям, способам их получения и содержащим их композициям, а также к применению этих соединений и композиций для лечения вирусных инфекций. В частности, данное изобретение относится к применению соединений формулы I для предотвращения и/или лечения респираторно-синцитиальных вирусных инфекций и заболеваний.
Уровень техники
Респираторно-синцитиальный вирус (RSV) является основной причиной острых инфекций верхних дыхательных путей и нижней части дыхательной системы у взрослых, детей младшего возраста и младенцев. Серологическое подтверждение указывает на то, что в западном мире приблизительно 95% всех детей инфицированы RSV к двум годам и 100% детей подвергаются инфекции ко времени достижения периода полового созревания (смотри Black, C.P., 2003, Resp.Care 48: 209-31 для обзора последних достижений биологии и управления RSV). В большинстве случаев инфекции RSV вызывают только незначительные заболевания верхних дыхательных путей с симптомами, напоминающими обычную простуду. Однако тяжелая вирусная инфекция может привести к бронхиту или пневмонии, что может привести к госпитализации или к смерти. В этом году приблизительно 91000 младенцев госпитализированы по поводу инфекции RSV в США. Младенцы, которые были рождены преждевременно или ранее перенесли легочное заболевание, имеют серьезный риск получения тяжелой инфекции и осложнений. Эти инфекции ответственны за 40-50% госпитализаций по поводу детского бронхита и 25% госпитализаций по поводу детской пневмонии. Поскольку иммунная реакция на инфекцию RSV не оказывает защитного действия, инфекции RSV повторяются на протяжении периода полового созревания. Для взрослых и детей старшего возраста инфекцию RSV ассоциируют с инфекцией верхних дыхательных путей, трахеобронхитом и отитом среднего уха. Однако RSV у пожилых госпитализированных больных может оказывать более серьезное действие и проявляться в тяжелой пневмонии и степени смертности, достигающей 20-78% соответственно. Взрослые с предыдущей историей сердечных или легочных заболеваний имеют высокий риск инфекции RSV. Инфекция сопровождается обострением болезни у пациентов с хроническим обструктивным легочным заболеванием. Значительная смертность наблюдается у пациентов с ослабленным иммунитетом, особенно у тех, кто перенес трансплантацию костного мозга (Evans, A.S., eds., 1989, Viral Infections of Humans. Epidemiology and Control, 3rd ed., Plenum Medical Book, New York, p.525-544; Falsey, A.R., 1991, Infect. Control Hosp. Epidemiol. 12:602-608; and Garvie et al, 1980, Br. Med. J. 281:1253-1254; Hertz et al, 1989, Medicine 68:269-281).
RSV является членом отряда Mononegavirales, который включает в себя вирусы, содержащие несегментированные антисмысловые нити РНК, относящиеся к семейству Paramyxoviridae, Rhahdoviridae и Filoviridae. RSV человека (часто также называемый RSV или HRSV) является членом рода Pneumovirus подсемейства Pneumovirinae, входящего в семейство Paramyxoviridae. На основе генетических или антигенных вариаций в структурных белках RSV делят на две подгруппы, А и В (Mufson, M. et al., J.Gen. Virol. 66: 2111-2124). Другие члены Pneumovirus genus включают в себя такие вирусы, как бычий RSV (BRSV), овечий RSV (ORSV) и вирус пневмонии мышей (PVM) в числе других. Подсемейство Pneumovirinae также включает в себя род Metapneumovirus, который содержит недавно идентифицированный и важный патоген человека, метапневмовирус человека (hMPV).
hMPV вызывает респираторные заболевания в диапазоне от легких симптомов респираторных заболеваний верхних дыхательных путей до тяжелых заболеваний нижней части дыхательной системы, таких как бронхит и пневмония (van den Hoogen, В et al., 2001, Nat. Med. 7:719-724). В зависимости от испытанной популяции пациентов от 5 до 15% респираторных инфекций у детей младшего возраста может быть отнесено к инфекциям, вызываемым hMPV (van den Hoogen, В. et al., 2003, J.Infect. Dis. 188:1571-1577). 12-50% случаев отита среднего уха у детей также связывают с hMPV (van den Hoogen, et al., 2004, Pediatr. Infect. Dis. J. 23:S25-S32). В Нидерландах 55% подвергнутых испытаниям лиц оказались серопозитивными в отношении hMPV к 2 годам, и почти все индивидуумы в возрасте 5 лет и старше оказались серопозитивными (van den Hoogen, et al., Virology 295:119-132).
Помимо вышеописанных свойств генома, характеристики семейства включают в себя липидную оболочку, содержащую один или более разновидностей гликопротеинов, которые считают ответственными за присоединение и вхождение в клетку-хозяина. Считают, что вхождение осуществляется при применении способа, состоящего в слиянии оболочки вируса с мембраной клетки-хозяина. Например, слияние инфицированных клеток с их соседями может также приводить к образованию объединенных многоядерных клеток, в некоторых случаях известных как синцитий. Считают, что способ слияния опосредован гликопротеином и это свойство присуще различным вирусам, окруженным оболочкой, в других таксономических группах. В случае вирусов Parctmyxoviridae всех видов обычно экспрессирует слитый гликопротеин (F), который опосредует слияние мембран.
Несмотря на то что лицензированная вакцина RSV пока недоступна, некоторый успех достигнут в области предотвращения высокого риска тяжелого заболевания нижней части дыхательной системы у младенцев, вызываемых также и снижением LRI. В частности, существуют два способа лечения, основанные на использовании иммуноглобулинов, позволяющие защитить младенцев с высокой степенью риска от сильно сниженного LRI: RSV-IGIV (RSV - внутривенный иммуноглобулин, также известный как RespiGam™) и palivizumab (SYNAGIS®). RSV-IGIV (RespiGam, Massachusetts Public Health Biological Laboratories and Medlmmune Inc, Gaithersburg, MD) лицензирован Food and Drug Administration в Январе 1996 для предотвращения тяжелого заболевания нижней части дыхательной системы у младенцев и детей, младше 24 месяцев, вызванного RSV, страдающих CLD или имеющих историю преждевременных родов (<35 недель беременности). В июне 1998 Food and Drug Administration лицензировали palivizumab (Medlmmune, Gaithersburg, MD) для введения в качестве ежемесячной внутримышечной инъекции для предотвращения тяжелого респираторного заболевания, вызванного RSV, у младенцев и детей, имеющих историю преждевременных родов (<35 недель беременности), или CLD.
Единственным лекарственным средством, разрешенным для лечения тяжелого заболевания, вызванного RSV, является противовирусное лекарственное вещество Виразол (Virazole), также известный как Рибавирин (Ribavirin), в настоящее время лицензированное для лечения пневмонии и бронхита, вызванных RSV (Hall et al, 1983, N.Engl. J.Med., 308: 1443; Hall et al., 1985, JAMA, 254:3047). Этот агент обладает широким спектром противовирусной активности вместе с вирустатическими эффектами и действует путем ингибирования репликации RSV. К сожалению, этот агент является токсичным, поэтому введение агента ограничивается применением в больничных условиях (Black, C.P., 2003, Resp. Care 48(3): 209-31). Его введение дополнительно осложняется необходимостью следовать строгому процедурному способу, когда агент вводят для того, чтобы минимизировать вероятность некоторых нежелательных эффектов. Агент имеет ряд нежелательных эффектов, включая внезапное резкое ухудшение респираторной функции (бронхоспазм). Эффективность Виразола остается неоднозначной и поэтому существует реальная необходимость нахождения альтернативного агента для лечения RSV инфекции.
Раскрытие изобретения
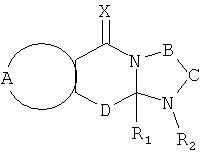
Настоящее изобретение предусматривает соединения, применимые для предотвращения и/или лечения инфекции и заболевания, вызываемые RSV, формулы I и их соли
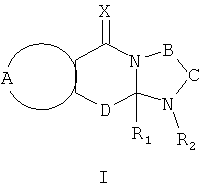
где:
R1 выбран из C1-12 алкила, С2-12 алкенила, С2-12 алкинила, -(СН2)nC3-7 циклоалкила, -(СН2)nC4-7 циклоалкенила, -(СН2)n арила, -(CH2)n арилС1-12 алкила, -(СН2)n арилС2-12 алкенила, - (СН2)nарилС2-12 алкинила, и -(СН2)n гетероциклила; n равен 0-6 и указанные алкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные и гетероциклильные группы необязательно являются замещенными;
R2 выбран из Н, О, -CH2R3, -С(=Y)R3, -С(=Y)OR3, -С(=Y)N(R4)R3, -C(=Y)CH2N(R4)R3, -C(=Y)CH2SR3 и -S(O)wR5, где R3 выбран из водорода, C1-12 алкила, С2-12 алкенила, C2-12 алкинила, -(СН2)nC3-7 циклоалкила, -(СН2)mC4-7 циклоалкенила, -(СН2)m арила, -(СН2)mарилС1-12 алкила, -(СН2)mарилС2-12 алкенила, - (СН2)mарилС2-12 алкинила, и -(СН2)m гетероциклила; и когда R2 представляет собой -CH2R3, или -С(=Y)R3; R3 может быть также выбран из -S-R5 и -O-R5; m равен 0-6; R4 является водородом или C1-6 алкилом; R5 представляет собой C1-6 алкил, С2-6 алкенил, С2-6 алкинил, С3-7 циклоалкил, C4-7 циклоалкенил, бензил, арил или гетероциклил; w равен 0, 1 или 2, и алкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные и гетероциклильные группы необязательно являются замещенными;
Х и Y независимо выбраны из О, S и NR6, где R6 независимо выбран из водорода, низших алкилов, гидрокси- и низших алкоксигрупп;
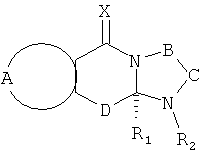
А вместе с атомами, к которым она присоединена, образует необязательно замещенное ароматическое кольцо;
В-С вместе с атомами, к которым они присоединены, образуют необязательно замещенное гетероциклическое кольцо, имеющее от 5 до 8 атомов в кольце;
D представляет собой двухвалентную связывающую группу длиной от одного до трех атомов,
и при условии, что когда А вместе с атомами, к которым он присоединен, образует незамещенное фенильное кольцо, Х представляет собой О, D представляет собой -СН2-, В-С представляет собой -СН2СН2-, и R1 представляет собой незамещенный фенил, тогда R2 не является Н.
Настоящее изобретение также предусматривает применение соединений и их солей для приготовления лекарственных средств для предотвращения и/или лечения RSV инфекций.
Хотя данное изобретение описано со ссылкой на лечение RSV, и, в частности, RSV человека, будет высоко поощряться, если данное изобретение может быть также использовано для лечения других вирусов под-семейства Pneumovirinae, более конкретно семейства Pneumovirus и Metapneumovirus, более конкретно штаммов RSV животных и человека и Metapneumovirus.
Соответственно, данное изобретение также предусматривает применение соединений формулы Ia и их солей
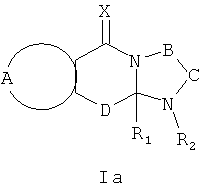
где:
R1 выбран из C1-12 алкила, С2-12 алкенила, C2-12 алкинила, -(СН2)nC3-7 циклоалкила, -(CH2)n C4-7 циклоалкенила, -(CH2)n арила, -(CH2)nарилC1-12 алкила, -(СН2)nарилС2-12 алкенила, - (СН2)nарилС2-12 алкинила, и -(CH2)n гетероциклила; n равен 0-6 и указанные алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил и гетероциклические группы необязательно являются замещенными;
R2 выбран из Н, О, -CH2R3, -С(=Y)R3, -С(=Y)OR3, -C(=Y)N(R4)R3, -C(=Y)CH2N(R4)R3, -C(=Y)CH2SR3 и -S(O)wR5, где R3 выбран из водорода, C1-12 алкила, С2-12 алкенила, C2-12 алкинила, -(СН2)mC3-7 циклоалкила, -(СН2)mC4-7 циклоалкенила, -(CH2)m арила, -(СН2)mарилС1-12 алкила, -(СН2)mарилС2-12 алкенила, -(СН2)mарилС2-12 алкинила, и -(СН2)m гетероциклила; и когда R2 представляет собой -CH2R3, или -С(=Y)R3; R3 может быть также выбран из -S-R5 и -O-R5; m равен 0-6; R4 является водородом или C1-6 алкилом; R5 является C1-6алкилом, С2-6алкенилом, С2-6алкинилом, С3-7циклоалкилом, C4-7циклоалкенилом, бензилом, арилом или гетероциклилом; w равен 0, 1 или 2, и алкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные и гетероциклильные группы необязательно являются замещенными;
Х и Y независимо выбраны из О, S и NR6, где R6 независимо выбран из водорода, низших алкилов, гидроксила и низших алкоксигрупп;
А вместе с атомами, к которым она присоединена, образует необязательно замещенное ароматическое кольцо;
В-С с атомами, к которым они присоединены, образуют необязательно замещенное гетероциклическое кольцо, имеющее от 5 до 8 атомов в кольце;
D представляет собой двухвалентную связывающую группу длиной от одного до трех атомов,
для приготовления лекарственных средств для предотвращения и/или лечения RSV инфекций.
Настоящее изобретение также предусматривает способ лечения RSV инфекции у субъекта, нуждающегося в нем, включающий стадию введения соединения формулы Ia или его фармацевтически приемлемой соли указанному субъекту.
Наилучший способ осуществления изобретения
Термин "ароматический", используемый в данном контексте, относится к арильным циклам или циклическим системам и ароматическим гетероциклическим циклам или циклическим системам, известным как гетероарильные или гетероароматические циклы.
В данном контексте термин "арил" относится к карбоциклическим (негетероциклическим) ароматическим циклам или циклическим системам. Ароматическими циклами могут быть моно-, бициклические или трициклические системы. Ароматические циклы или циклические системы обычно состоят из 5-10 атомов углерода. Примеры подходящих арильных групп включают в себя, но не ограничиваются фенилом, бифенилом, нафтилом, тетрагидронафтилом и т.п.
Предпочтительные арильные группы включают в себя фенил, нафтил, инденил, азуленил, флуоренил или антраценил.
Термин "гетероциклический" или "гетероциклильный", используемый в данном контексте, относится к моно- или бициклам или циклическим системам, которые включают в себя один или несколько гетероатомов, выбранных из N, S и О. Циклы или циклические системы обычно включают в себя помимо гетероатома(ов) 1-9 атомов углерода и могут быть насыщенными, ненасыщенными или ароматическими (в том числе, псевдоароматическими). Термин "псевдоароматические" относится к циклическим системам, которые не являются строго ароматическими, но являются стабилизированными посредством делокализации электронов и ведут себя так же, как и ароматические циклы. Ароматика включает в себя псевдоароматические циклические системы, например фурильные, тиенильные и пирролильные циклы.
Примеры 5-членных моногетероциклов включают в себя фурил, тиенил, пирролил, Н-пирролил, пирролинил, пирролидинил, оксазолил, оксадиазолил (в том числе, 1,2,3- и 1,2,4-оксадиазолилы), тиазолил, изоксазолил, фуразанил, изотиазолил, пиразолил, пиразолинил, пиразолидинил, имидазолил, имидазолинил, триазолил (в том числе, 1,2,3- и 1,3,4-триазолилы), тетразолил, тиадиазолил (в том числе, 1,2,3- и 1,3,4-тиадиазолилы). Примеры 6-членных моногетероциклов включают в себя пиридил, пиримидинил, пиридазинил, пиранил, пиразинил, пиперидинил, 1,4-диоксанил, морфолинил, 1,4-дитианил, тиоморфолинил, пиперазинил, 1,3,5-тритианил и триазинил. Гетероциклы могут быть необязательно замещенными широким набором заместителей и, предпочтительно, C1-6алкилом, C1-6алкоксилом, С2-6алкенилом, С2-6алкинилом, атомом галогена, гидроксигруппой, меркаптогруппой, трифторметилом, аминогруппой, цианогруппой или моно- или ди(С1-6алкил) аминогруппой.
Гетероциклы могут быть конденсированы с карбоциклами, например фенилом, нафтилом, инденилом, азуленилом, флуоренилом или антраценилом.
Примеры 8, 9 и 10-членных бициклических гетероциклов включают в себя 1Н тиено[2,3-с]пиразолил, тиено[2,3-b]фурил, индолил, изоиндолил, бензофуранил, бензотиенил, бензоксазолил, бензотиазолил, бензизоксазолил, бензизотиазолил, бензимидазолил, индазолил, изохинолинил, хинолинил, хиноксалинил, уридинил, пиринил, циннолинил, фталазинил, хиназолинил, хиноксалинил, бензотриазинил, нафтиридинил, птеридинил и т.п. Эти гетероциклы могут быть необязательно замещенными, например, C1-6алкилом, C1-6алкоксилом, C2-6алкенилом, С2-6алкинилом, атомом галогена, гидроксигруппой, меркаптогруппой, трифторметилом, аминогруппой, цианогруппой или моно- или ди(С1-6алкил) аминогруппой.
В одном из вариантов осуществления гетероциклические радикалы включают в себя (необязательно замещенные) изоксазолы, изотиазолы, 1,3,4-оксадиазолы, 1,3,4-тиадиазолы, 1,2,4-оксадиазолы, 1,2,4-тиадиазолы, оксазолы, тиазолы, пиридины, пиридазины, пиримидины, пиразины, 1,2,4-триазины, 1,3,5-триазины, бензоксазолы, бензотиазолы, бензизоксазолы, бензизотиазолы, хинолины и хиноксалины. Эти гетероциклы могут быть необязательно замещенными, например, C1-6алкилом, C1-6алкоксилом, С2-6алкенилом, C2-6алкинилом, атомом галогена, гидроксигруппой, меркаптогруппой, трифторметилом, аминогруппой, цианогруппой или моно- или ди(С1-6алкил)аминогруппой.
В дополнительном варианте осуществления гетероциклические радикалы включают в себя фурил, тиенил, пиридил, оксазолил, тиазолил, пиразолил, фуразанил, изоксазолил, изотиазолил, 1,2,3-триазолил, 1,3,4-триазолил, 1,2,3-тиадиазолил, 1,3,4-тиадиазолил, пиридазинил, пиримидинил, бензо[b]фуранил, бензо[b]тиофенил и бензоизоксазолил.
Примеры ненасыщенных 5-членных гетероциклов включают в себя оксазол, тиазол, имидазол, 1,2,3-триазол, изоксазол, изотиазол, пиразол, фуран, тиофен и пиррол. Примеры ненасыщенных 6-членных гетероциклов включают в себя пиридин, пиримидин, пиразин, пиридазин и 1,2,4-триазин.
В одном из вариантов осуществления гетероциклическое кольцо является ароматическим кольцом. Гетероарилы и гетероароматика используют в данном контексте, чтобы отнести к этой группе гетероциклы. Гетероарилы включают в себя фурил, тиенил, пиридил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,4-оксадиазол-5-он, 1,2,3-триазолил, 1,3,4-тиадиазолил, пиридазинил, пиримидинил, пиразинил, 1,3,5-триазинил, 1Н тиено[2,3-с]пиразолил, тиено [2,3-b]фурил, индолизинил, индолил, изоиндолил, 3Н-индолил, индолинил, бензо[b]фуранил, бензо[b]тиофенил, 1Н- индазолил, бензимидазолил, тетразолил, уридинил и цитозинил.
В дополнительном варианте осуществления гетероарилы или гетероароматика выбраны из изоксазолила, оксазолила, имидазолила, тиазолила, тиадиазолила, изотиазолила, фуразанила, триазолила, пиридила, пиримидинила, фурила, пиразолила, пиридазинила, тиенила и арилсодержащих конденсированных с арилом гетероароматических циклов, например бензфуранила, бензотиофенила и бензоизоксазолила.
В другом варианте осуществления гетероциклическое кольцо является неароматическим кольцом, выбранным из группы, состоящей из пирролидина, имидазолина, 2-имидазолидона, 2-пирролидона, пирролин-2-она, тетрагидрофурана, 1,3-диоксолана, пиперидина, тетрагидропирана, оксазолина, 1,3-диоксана, 1,4-пиперазина, морфолина и тиоморфолина.
Гетероциклическое кольцо, содержащее связывающую группу В-С, может быть выбрано из вышеописанных гетероциклов при условии, что кольцо отвечает требованиям, согласно которым оно содержит по меньшей мере два атома азота и исключает участие ароматических циклических систем.
Если не будет определено иначе, термин "необязательно замещенный", используемый в данном контексте, означает, что группа может включать один или несколько заместителей, которые не снижают связывающую активность соединения формулы I и Ia. В некоторых случаях заместитель может быть выбран для улучшения связывания и изменения других свойств молекулы. Группа может быть замещена одним или несколькими заместителями, выбранными из атома галогена, C1-6алкила, С2-6алкенила, С2-6алкинила, -(СН2)pC3-7циклоалкила, -(СН2)рС4-7циклоалкенила, -(CH2)p арила, -(СН2)р гетероциклила, -C6H4S(O)1C1-6 алкила, -С(Ph)3, -(CH2)pZ, -COZ, -CN, -OR, -O-(CH2)1-6-R, -O-(CH2)1-6-OR, -OCOR, -COR, -COOR, -OCONR'R", -C(O)NR1R", -NR1R", -NRCOR', -NRCONR'R", -NRC(=S)NR'R", -NRSO2R1, -NRCOOR', -C(=NR)NR'R", -CRNOR, -C(=NOH)NR'R", -CONR'R", -C(=NCN)-NR'R", -C(=NR)NR'R", -C(=NR')SR", -NR'C(=NCN)SR", -CONRSO2R', -C(=S)NR1R", -S(O)1R5 -SO2NR1R", -SO2NRCOR', -OS(O)2R, -PO(OR)2 и -NO2; где р равен 0-6, t равен 0-2, Z представляет собой N-замещенную аминокислоту, выбранную из группы, состоящей из аланина,. аспарагина, аспарагиновой кислоты, глутаминовой кислоты, глутамина, глицина, пипеколиновой кислоты, α-аминомасляной кислоты, α-аминопропионовой кислоты и иминодиуксусной кислоты, Z присоединен по атому азота указанной N-замещенной аминокислоты к атому углерода, и каждый из R, R' и R" независимо выбраны из Н, C1-6алкила, С2-6алкенила, C2-6алкинила, С3-7циклоалкила, C4-7циклоалкенила, арила, гетероциклила, C1-6алкиларила и C1-6алкилгетероциклила, где алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, гетероциклил, C1-6алкиларил или C1-6алкилгетероциклил могут быть необязательно замещенными одной - шестью одинаковыми или различными группами, выбранными из атома галогена, гидроксила, низших алкилов, низших алкоксилов, -CO2H, CF3, CN, фенила, NH2 и NO2; или когда R' и R" присоединены к одному и тому же атому азота, они могут вместе с атомом, к которому они присоединены, образовать 5-7-членное азотсодержащее гетероциклическое кольцо.
Если необязательный заместитель представляет собой или содержит алкильную, алкенильную, алкинильную, циклоалкильную, циклоалкенильную, арильную или гетероциклильную группу, сама эта группа может быть необязательно замещенной одной - шестью одинаковыми или различными атомом галогена, гидроксильной группой, низшей алкильной группой, низшей алкоксильной группой, галоген-C1-6алкильной группой (в том числе, -CF3), фенильной группой, бензильной группой, -CN, -C(=O)-C1-6алкильной группой, меркаптогруппой, -NH2, моно- или ди- (низший алкил) аминогруппой или -NO2.
Что касается азотсодержащих гетероциклов, хотя и иначе обозначаемых, необязательно замещенные гетероциклы включают в себя
пиридиниевые соли и N-оксиды подходящих атомов азота кольца.
Что касается неароматических карбоциклических или гетероциклических соединений, хотя и иначе обозначаемых, такие соединения могут быть также необязательно замещенными одной или двумя группами =O вместо или дополнительно к вышеописанным необязательным заместителям.
Примеры необязательных заместителей включают в себя атом галогена, С1-4алкил, С2-4алкенил, C2-4алкинил, C1-4алкоксигруппу, C1-4галогеналкил, -CF3, -ОН, фенил, -NH2, -NHC1-4алкил, -N(C1-4)2, -CN, меркаптогруппу, C1-4алкилкарбонил и C1-4алкоксикарбонил.
Используемый в данном контексте термин "C1-12алкил" относится к насыщенным углеводородным группам с прямой или разветвленной цепью, содержащим 1-12 атомов углерода. Примеры таких алкильных групп включают в себя метильную, этильную, н-пропильную, изопропильную, н-бутильную, изобутильную, втор-бутильную или трет-бутильную группы. Аналогично, "C1-6алкил" или "низший алкил" относится к таким же группам, содержащим 1-6 атомов углерода.
Используемый в данном контексте термин "С3-7циклоалкил" относится к неароматичеким насыщенным циклическим группам, содержащим 3-7 атомов углерода. Примеры включают в себя циклопентильную и циклогексильную группы.
Используемый в данном контексте термин "алкокси" относится к алкильным группам с прямой или разветвленной цепью, ковалентно связанным через О, а термины "C1-6алкоксильные группы" и "низшие алкоксильные группы" относится к таким группам, содержащим один - шесть атомов углерода, как метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси и т.п.
Используемый в данном контексте термин "C2-12алкенил" относится к группам, образующимся из С2-12 прямого или разветвленного нециклического углеводорода, содержащего одну или несколько двойных связей. Примеры C2-12алкенилов включают в себя аллильную, 1-метилвинильную, бутенильную, изо-бутенильную, 1,3-бутадиенильную, 3-метил-2-бутенильную, 1,3-бутадиенильную, 1,4-пентадиенильную, 1-пентенильную, 1-гексенильную, 3-гексенильную, 1,3-гексадиенильную, 1,4-гексадиенильную и 1,3,5-гексатриенильную группы.
Используемый в данном контексте термин "C4-7 циклоалкил " относится к неароматическим карбоциклическим группам, содержащим 4-7 атомов углерода и имеющим одну или несколько двойных углеродных связей. Примеры включают в себя циклопентенил, 1-метил-циклопентенил, циклогексенил, 1,3-циклопентадиенил, 1,3-циклогексадиенил и 1,4-циклогексадиенил.
Используемый в данном контексте термин "C2-12алкинил" относится к углеводородам с прямой или разветвленной цепью, содержащим одну или несколько тройных связей, например одну или две тройные связи. Примеры включают в себя 2-пропинил и 2- или 3-бутинил.
Термин "арил C1-12алкил" относится к вышеописанным карбоциклическим ароматическим циклам или циклическим системам и замещенным C1-12алкильной группой, так же как описано выше. Аналогично термины "арил C2-12алкенил" и "арил С2-12алкинил" относятся к вышеописанным карбоциклическим ароматическим циклам или циклическим системам и замещенным C2-12алкенильной или C2-12алкинильной группами, описанными выше.
Арильная группа, а также алкильная, алкенильная или алкинильная группа могут быть необязательно замещенными. В одном из вариантов осуществления арильная группа является необязательно замещенной.
В другом варианте осуществления алкильная, алкенильная или алкинильная группа являются необязательно замещенными. В дополнительном варианте осуществления заместитель выбирают из атома галогена, -CN, -NR1R", -COR, - COOR или -CONR'R". R, R' и R" могут быть независимо выбраны из водорода или низшего алкила.
Используемый в данном контексте термин "гало" или "галоген" относится к атому фтора, хлора, брома и иода.
Используемая в данном контексте "галогеналкильная" группа содержит один или несколько атомов водорода в алкильной группе, замещенных атомом галогена. Пример включает в себя -CF3.
В одном из вариантов осуществления соединения по изобретению включают в себя такие соединения, в которых А представляет собой двухвалентную связывающую группу, состоящую из 3 или 4 атомов, выбранных из С, N, О и S. При таком расположении А и атомы, с которыми она соединена, вместе образуют ароматическое кольцо, состоящее из пяти или шести кольцевых атомов. Когда все атомы связывающей группы являются атомами углерода, образующееся кольцо является карбоциклическим ароматическим кольцом или циклической системой. Когда атомы связывающей группы включают в себя один или несколько атомов N, О или S, то образующееся кольцо является ароматическим гетероциклическим кольцом. Примеры включают структуру:
представляющую собой:
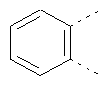
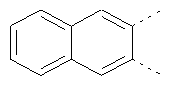
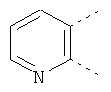
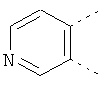
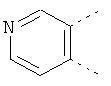
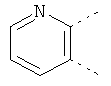
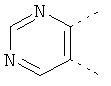
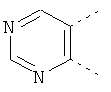
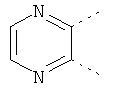
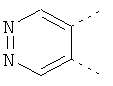
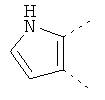
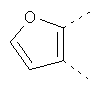
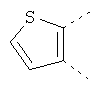
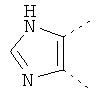
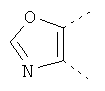 or
or 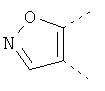
or - или
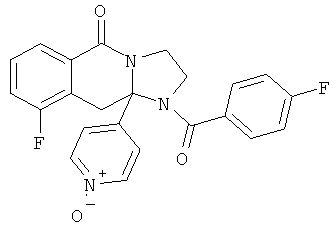
В другом варианте осуществления кольцо А представляет собой необязательно замещенное арильное или гетероарильное кольцо, например фенил, пиридил, пиридазинил, пиримидил или пиразинил, и в дополнительном варианте осуществления выбрано из фенила или пиридила. Необязательные заместители включают в себя N-оксиды атомов азота кольца.
Ароматические циклы могут быть необязательно замещенными, например, не более чем 3 заместителями. В одном из вариантов осуществления ароматические циклы могут иметь 1-3 заместителя, выбранных из атома галогена, низшего алкила, галогенированных форм низшего алкила, гидроксигруппы, низшей алкоксигруппы, нитро, амино, низшей алкиламино, карбокси, карбоксамидо, фенила и бензила. Рассматриваются также N-оксиды атомов азота кольца. Когда А представляет собой пиридил, атом азота может находиться в форме N-оксида, или кольцо может находиться в форме пиридиниевой соли.
В одном из вариантов осуществления кольцо А представляет собой незамещенный фенил.
В другом варианте осуществления кольцо А представляет собой незамещенный пиридил.
Что касается гетероциклического кольца, образованного В-С, будет понятно, что это кольцо не может быть выбрано из всех гетероциклов, описанных выше, в связи с тем, что значение термина определяется атомами, к которым присоединена В-С. Это кольцо ограничивается моноциклическими, неароматическими гетероциклами, которые включают в себя по меньшей мере два атома азота. Это кольцо может включать в себя дополнительные гетероатомы и может быть частично ненасыщенным.
В другом варианте осуществления В-С представляет собой двухвалентную связывающую группу из 1-3 атомов. Связывающая группа В-С вместе с атомами, к которым она присоединена, образует неароматический гетероцикл. Примеры включают структуру:
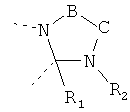
представляющую собой:
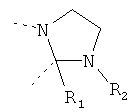
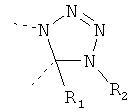
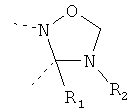
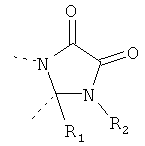
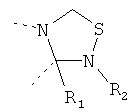
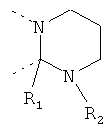
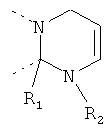
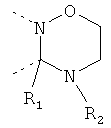
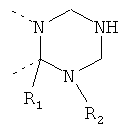
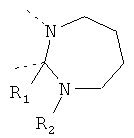
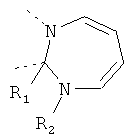
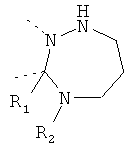 or
or 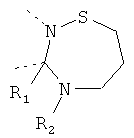
В дополнительном варианте осуществления В-С представляет собой -CH2-(CH2)z-, где z равен 1-4, например 1, 2 или 3. В еще одном дополнительном варианте осуществления z равен 1 или 2.
Атомы, образующие связывающую группу В-С, могут быть необязательно замещенными, например, не более чем 3 заместителями. Возможно большое разнообразие заместителей, и они включают в себя атом галогена, низший алкил, гидрокси, низший алкоксил, фенил и бензил.
В другом варианте осуществления В-С представляет собой -CH2CH2-.
В одном из вариантов осуществления конденсированное кольцо А и кольцо, содержащее двухвалентную связывающую группу, являются необязательно замещенными одним или двумя заместителями, независимо выбранными из атома галогена и C1-6алкила. В дополнительном варианте осуществления конденсированное кольцо А и кольцо, содержащее двухвалентную связывающую группу, являются незамещенными.
Двухвалентная связывающая группа D вместе с атомами, к которым она присоединена, может образовывать 6-, 7- или 8-членный неароматический гетероцикл, содержащий остаток -C(=X)-N<, представленный следующей структурой:
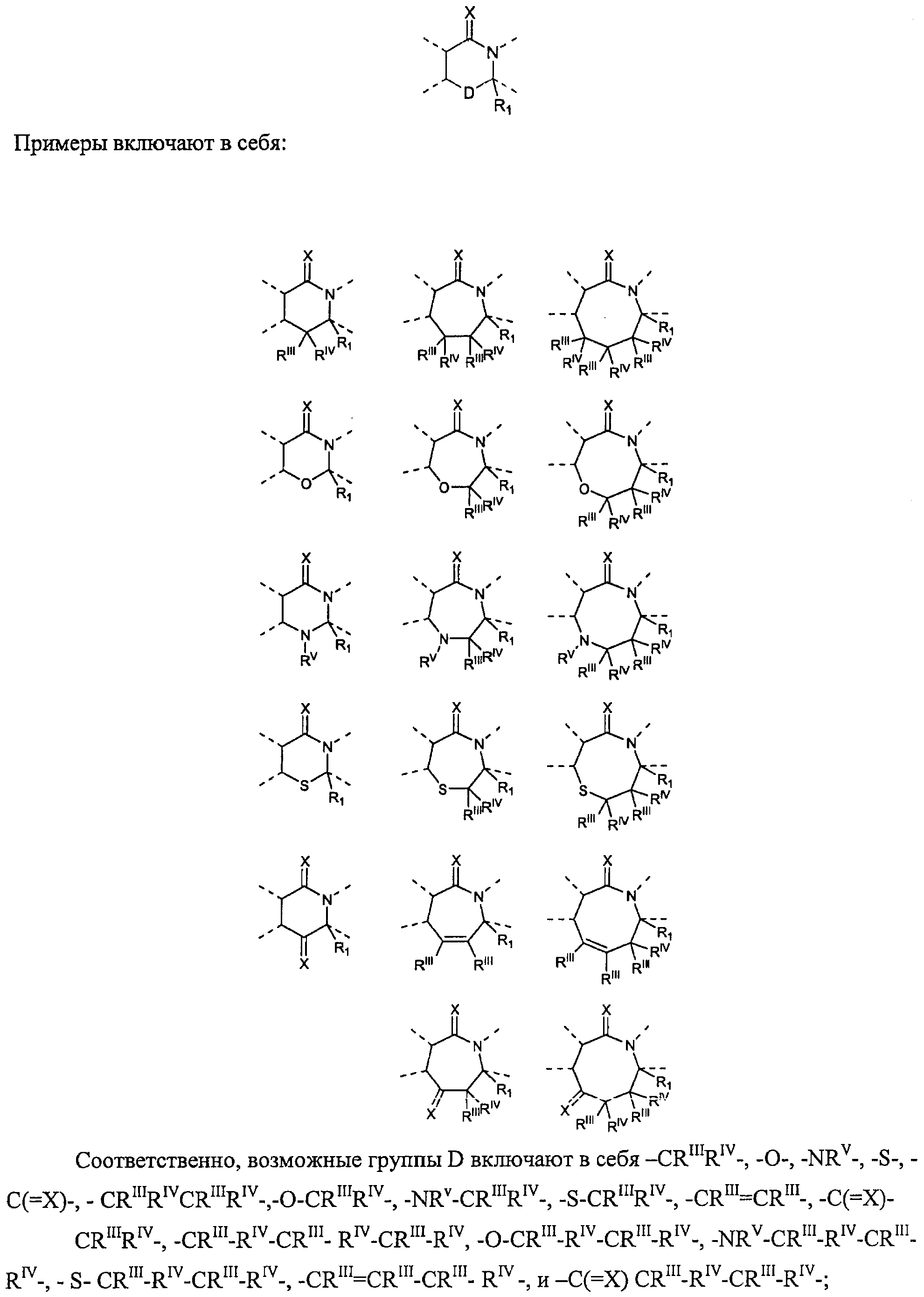
где каждый из RIII и RIV независимо выбраны из водорода, атома галогена, гидроксила, C1-12алкила, C2-12алкенила, C2-12алкинила, -(СН2)nC3-7циклоалкила, -(СН2)nC4-7циклоалкенила, -(СН2)nарила, -(СН2)nарилС1-12алкила, -(СН2)nарилС2-12алкенила, -(СН2)nарилС2-12алкинила, и -(СН2)nгетероциклила, или RIII и RIV вместе с атомом, к которому они присоединены, представляют собой 3-7-членное циклоалкильное или гетероциклическое кольцо; n равен 0-6 и указанные алкильная, алкенильная, алкинильная, циклоалкильная, циклоалкенильная, арильная и гетероциклильная группы являются необязательно замещенными;
RV выбран из О, -CH2R3, -С(=Y)R3, -С(=Y)OR3, -(C=Y)N(R4)R3, -C(=Y)CH2N(R4)R3, -C(=Y)CH2SR3 и -S(O)wR5; где R3 выбран из водорода, C1-12алкила, C2-12алкенила, C2-12алкинила, -(CH2)mC3-7циклоалкила, -(СН2)mC4-7циклоалкенила, -(СН2)mарила, -(СН2)mарилС1-12алкила, -(СН2)mарилС2-12алкенила, -(СН2)mарилС2-12алкинила и -(CH2)mгетероциклила; и где RV представляет собой - CH2R3, или -С(=Y)R3; R3 может быть также выбран из -S-R5 и -O-R5; m равен 0-6; R4 представляет собой водород или C1-6алкил; R5 представляет собой C1-6алкил, С2-6алкенил, С2-6алкинил, С3-7циклоалкил, C4-7циклоалкенил, бензил, арил или гетероциклил; w равен 0, 1 или 2, и алкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, арильные и гетероциклильные группы являются необязательно замещенными; и
Х и Y необязательно выбраны из О, S и NR6, где R6 независимо выбран из водорода, низших алкилов, гидроксильной группы и низших алкоксилов.
Будет предпочтительным, если там, где D представляет собой, например, двухвалентную связывающую группу -O-CRIIIRIV-, рассматриваются обе следующие структуры:
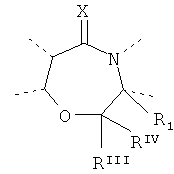 and
and 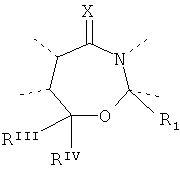
and - и
В одном из вариантов осуществления двухвалентная связывающая группа D вместе с атомами, к которым она присоединена, образует 6-членный неароматический гетероцикл.
В дополнительном варианте осуществления D представляет собой -CRIIIRIV-, -O-, -NRV-, -S-, или -С(=Х)-.
В еще одном дополнительном варианте осуществления D представляет собой -CRIIIRIV-, где:
(i) по меньшей мере один из RIII и RIV представляет собой водород, а другой может быть выбран из атома галогена, гидроксильной группы, необязательно замещенной С1-12алкильной группы и необязательно замещенной арильной группы;
(ii) RIII и RIV являются одинаковыми и представляют собой C1-3 алкил; или
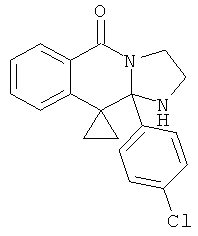
(iii) RIII и RIV вместе с атомами, к которым они присоединены, представляют собой 3-, 4-, 5-, 6- или 7-членный циклоалкил или гетероцикл.
В другом варианте осуществления D представляет собой -CRIIIRIV-, где:
(i) оба RIII и RIV являются Н;
(ii) оба RIII и RIV являются СН3; или
(iii) RIII и RIV вместе с атомом, к которому они присоединены, представляют собой 3-членное циклоалкильное кольцо или симметричное 6-членное гетероциклическое кольцо.
В другом варианте осуществления Х в соединениях формул I и Ia представляет собой О.
В дополнительном варианте осуществления настоящего изобретения все циклы: конденсированное кольцо А, кольцо, содержащее двухвалентную связывающую группу В-С и двухвалентную связывающую группу D, являются незамещенными.
R1 может быть необязательно замещенным арилом, алкилом или гетероциклилом. В одном из вариантов осуществления R1 представляет собой необязательно замещенный арил или гетероциклил, например фенил, тиенил, пирролил или пиридил. R1 может быть также -C1-6алкилфенилом. Циклы R1 могут быть необязательно замещены галогеном, гидроксилом, нитро, -NR'R" (где R' и R" независимо выбраны из водорода, низших алкилов и -C(O)R, где R представляет собой C1-6алкил, фенил или гетероциклил), C1-12алкилом, фенилом и -O-Ra, где Ra представляет собой -C1-12алкил, -С3-7циклоалкил, -C1-12алкил С3-7циклоалкил, фенил или -С1-12алкилфенил; и С1-12алкил, фенил или группа Ra могут быть необязательно замещены галогеном, -CN, -NR'R", -CO2R или -CONR'R", где R, R' и R" независимо выбраны из водорода или низших алкилов. В дополнительном варианте осуществления цикл представляет собой фенил и он необязательно замещен в пара- или 4-положении.
R1 может быть фенилом, замещенным алкильной цепью С1-10, где алкильная цепь замещена галогеном, -CN, -NR'R", -CO2R или -CONR'R", где R, R' и R" независимо выбраны из водорода или низших алкилов. В одном из вариантов осуществления алкильная цепь находится в 4-ом положении фенильного кольца, и заместители присоединены к углероду свободного конца алкильной группы.
R1 может быть фенилом, необязательно замещенным заместителем, выбранным из атома галогена, -C1-6алкила, -C1-6галогеналкила, -C1-6алкила CN, -OC1-6алкила, -O-галогенС1-6алкила, -OC16алкил CO2NH2, -OC1-6алкил CN, -OC1-6алкил С3-7циклоалкил, -OC1-6алкилС6Н5, -OC1-6алкил ОСН3, -ОС6Н5, -ОС6Н4галоген, -CF3, -OCF3, -NR'R" (где R' и R" независимо выбраны из водорода, -С(O)С1-6алкила, -С(O)С6Н5, -С(O)СН=CHCO2H, -С(O)С1-6алкилСO2Н, -C(O)C1-6алкил СO2СН3, -C(O)C1-6алкил С6Н5, -С(O)С1-6алкил С6Н4СН3, -C(O)C1-6алкил С6Н4OСН3 и -C(O)C1-6алкил С6Н4 галоген), -CO2H, -CO2C1-6алкила, -NO2, -ОН, -С6Н5, -C6H4C1-6алкила, -С6Н4галоген и -OC(O)C1-6алкила.
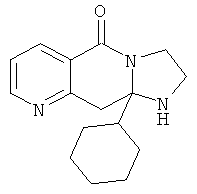
В дополнительном варианте осуществления R1 является необязательно замещенным фенилом, в котором каждый из заместителей независимо выбран из атома галогена, гидрокси- или алкоксигрупп; циклоалкилом; или необязательно замещенным пиридилом или его N-оксидом, в которых каждый из заместителей независимо выбран из атома галогена.
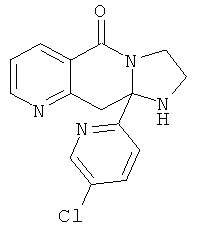
В дополнительном варианте осуществления R1 является необязательно замещенным фенилом, в котором каждый из заместителей независимо выбран из атома хлор-, гидрокси- или метоксигруппы, низшего циклоалкила или необязательно замещенного пиридила или его N-оксида, в которых каждый из заместителей независимо выбран из атома хлора.
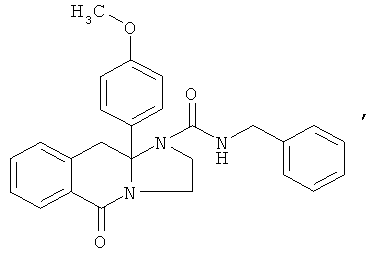
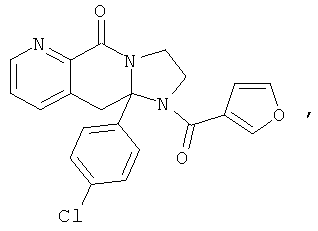
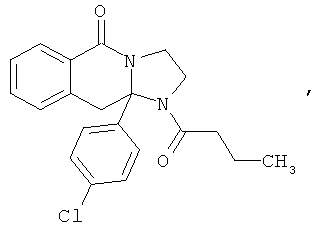
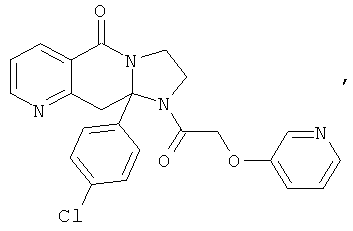
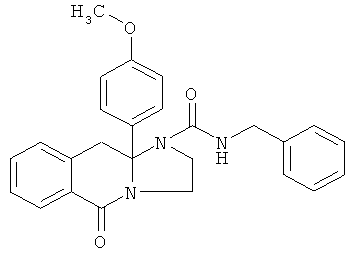
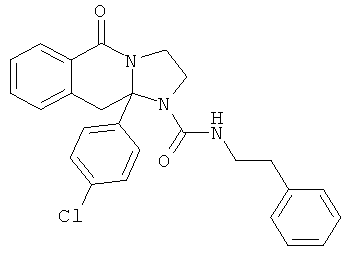
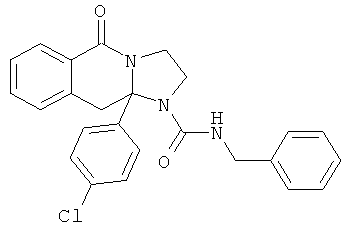
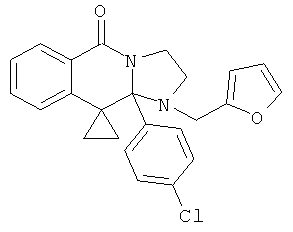
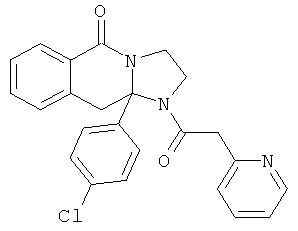
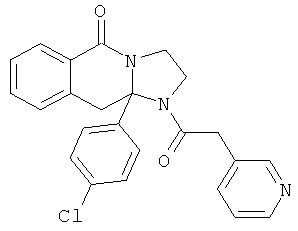
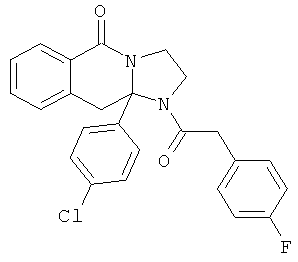
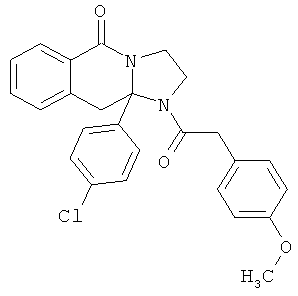
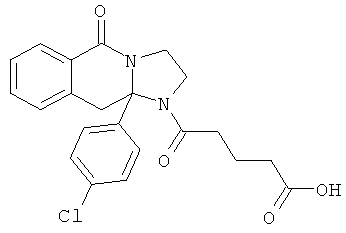
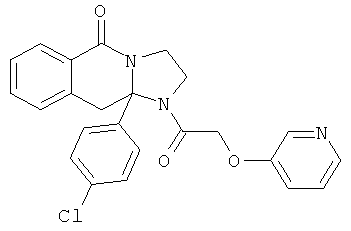
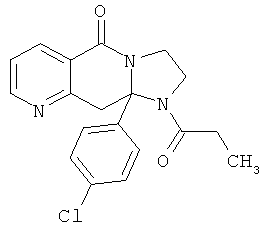
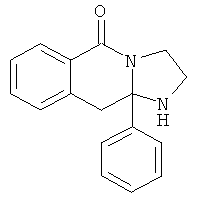
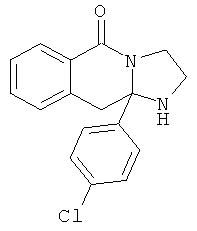
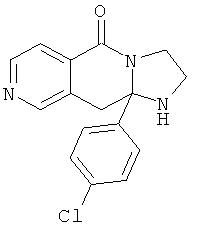
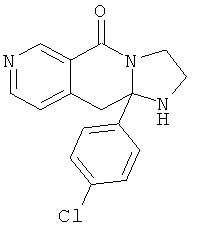
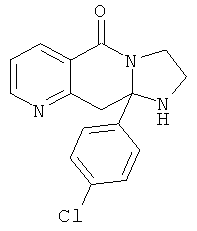
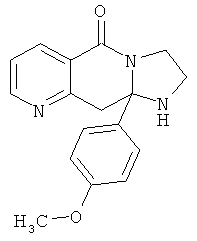
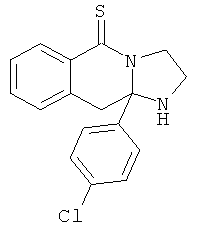
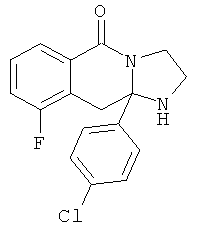
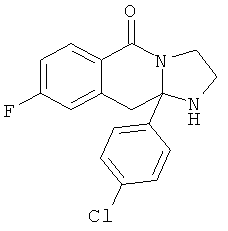
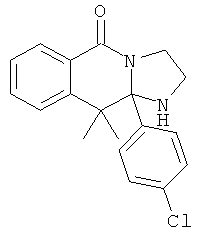
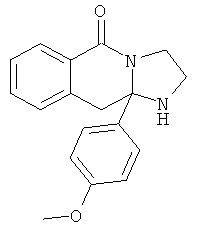
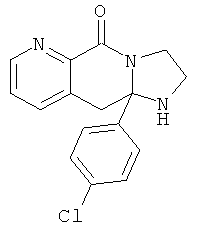
В еще одном дополнительном варианте осуществления R1 является фенилом, 4-хлорфенилом, 4-метоксифенилом, 4-гидроксифенилом, 5-хлор-2-пиридилом, 4-пиридилом или 4-пиридил-N-оксидом.
В другом варианте осуществления R1 является незамещенным фенилом или галогенфенилом. В дополнительном варианте осуществления R1 является 4-хлорфенилом.
В дополнительном варианте осуществления R2 не является водородом.
В еще одном дополнительном варианте осуществления представлены соединения формулы Ia.
В другом варианте осуществления, когда R2 представляет собой -СН2-R3, R3 представляет собой -(СН2)mарил или -(СН2)mгетероциклил, где m равен 0-3. R3 может быть бензилом (m=1). Атомы кольца могут необязательно быть замещенными широким спектром различных заместителей. Предпочтительные заместители выбраны из атома галогена, низших алкилов, гидроксильных групп, низших алкоксилов и фенила.
В другом варианте осуществления, когда R2 представляет собой -C(=Y)CH2N(R4)R3 или -C(=Y)CH2SR3, R3 представляет собой -(СН2)mарил или -(СН2)mгетероциклил, где m равен 0-3. Сам гетероциклил может быть замещенным оксогруппой, гидроксигруппой или низшим алкилом.
В еще одном варианте осуществления, когда R2 представляет собой -CON(R4)R3, R4 представляет собой водород и R3 представляет собой -(CH2)mарил или -(СН2)mгетероарил. В другом варианте осуществления m равен 0-2, и предпочтительно 0 или 1. Атомы арильного и гетероарильного кольца могут быть необязательно замещенными широким спектром различных заместителей. В вышеописанном варианте осуществления заместители могут включать в себя галогены, низшие алкилы, гидроксильные группы, низшие алкоксилы и фенил.
В другом варианте осуществления R2 представляет собой -С(=Y)-R3, где Y представляет собой О. В другом варианте осуществления R3 представляет собой - (СН2)mарил или -(СН2)mгетероарил, где m равен 0-3. В другом варианте осуществления R3 представляет собой необязательно замещенный арил или необязательно замещенный гетероцикл (m=0), и более предпочтительно необязательно замещенный 5- или 6-членный моногетероцикл или необязательно замещенный 9- или 10-членный бициклический гетероцикл или необязательно замещенную арильную группу.
В вышеописанном варианте осуществления заместители R3 могут представлять собой фенил, нафтил, фурил, тиенил, пирролил, Н-пирролил, пирролинил, пирролидинил, оксазолил, оксадиазолил (в том числе, 1,2,3- и 1,2,4-оксадиазолилы), тиазолил, изоксазолил, фуразанил, изотиазолил, пиразолил, пиразолинил, пиразолидинил, имидазолил, имидазолинил, триазолил (в том числе, 1,2,3- и 1,3,4-триазолилы), тетразолил, тиадиазолил (в том числе, 1,2,3- и 1,3,4-тиадиазолилы), пиридил, пиримидинил, пиридазинил, пиранил, пиразинил, пиперидинил, 1,4-диоксанил, морфолинил, 1,4-дитианил, тиаморфолинил, пиперазинил, 1,3,5-тритианил, триазинил, 1Н тиено[2,3-с]пиразолил, тиено[2,3-b]фурил, индолил, изоиндолил, бензофуранил, бензотиенил, бензоксазолил, бензотиазолил, бензизоксазолил, бензизотиазолил, бензимидазолил, индазолил, изохинолинил, хинолинил, хиноксалинил, уридинил, пуринил, циннолинил, фталазинил, хиназолинил, хиноксалинил, бензотриазинил, нафтиридинил или птеридинил.
Гетероциклическое кольцо может быть конденсировано с карбоциклическим кольцом, например с фенилом, нафтилом, инденилом, азуленилом, флуоренилом или антраценилом.
Арильная или гетероциклическая группы могут быть необязательно замещенными широким спектром различных заместителей, и, предпочтительно, C1-6алкилом, C1-6алкоксилом, алкенилом, С2-6алкенилом, С2-6алкинилом, галогеном, гидроксилом, меркапто, трифторметилом, амино, нитро, циано и моно- или ди(С1-6алкил)аминогруппой. Эти заместители также включают в себя фенил, бензил и гетероциклил.
В одном из вариантов осуществления R3 выбран из фенила, фурила, тиенила, пиридила, оксазолила, тиазолила, пиразолила, фуразанила, изоксазолила, изотиазолила, 1,2,3-триазолила, 1,3,4-триазолила, 1,2,3-тиадизолила, 1,3,4-тиадиазолила, пиридазинила, пиримидинила, бензо[b]фуранила, бензо[b]тиофенила и бензоизоксазолила (которые могут быть необязательно замещенными).
В одном из вариантов осуществления R2 представляет собой -CH2R3, -С(=O)R3, -C=O)N(R4)R5 или -SO2R6; где
а. R3 является необязательно замещенным алкилом, где заместители независимо выбраны из -СООН, -SCH2CONH арила, -NHSO2 арила, гетероарила и арила, каждый из которых независимо замещен галогеном или алкоксигруппой; необязательно замещенным фенилом, в котором заместители независимо выбраны из галогена; необязательно замещенным 5- или 6-членным гетероарилом, в которых заместители независимо выбраны из галогена, алкила, галогеналкила, циклоалкила, арила, гетероарилокси и гетероарила, необязательно замещенного алкилом или галогеналкилом; или необязательно замещенным алкенилом, в котором заместители независимо выбраны из гетероарила;
b. R4 представляет собой Н;
с. R5 представляет собой циклоалкил, гетероаралкил, алкил или аралкил; и
d. R6 представляет собой гетероарил.
В дополнительном варианте осуществления R2 представляет собой -CH2R3, -С(=O)R3, -C(=O)N(R4)R5 или -SO2R6; где
а. R3 является необязательно замещенным метилом, этилом или пропилом, в котором заместители независимо выбраны из -СООН, -SCH2CONH-3,4-диметоксифенила, -NHSO2-4-фторфенила, пиридилокси, бензизоксазолила, пиридила, фурила, 4-фторфенила или 4-метоксифенила; необязательно замещенным фенилом, в котором заместители независимо выбраны из метоксигрупп, F и Cl; необязательно замещенным тиазолилом, пиридилом, фурилом, тиенилом, изоксазолилом, изотиазолилом, 1,2,3-тиадиазолилом или пиразолилом, в котором заместители независимо выбраны из пиридилокси, циклопропила, Me, CF3, фенила, тиенила, пиридила, F, Cl, Br, 5-CF3-3-метил-1-пиразолила; или 2-фурилэтен-1-илом;
b. R4 представляет собой Н;
с. R5 представляет собой 2-фенэт-1-ил, бензил, циклогексил, 2-фурилметил, метил или 4-метилбензил; и
d. R6 представляет собой пиридил.
В другом варианте осуществления R2 представляет собой -COR3, конденсированное кольцо А представляет собой необязательно замещенный фенил или необязательно замещенный пиридил (в том числе включая его N-оксиды и пиридиниевые соли), и D представляет собой -CRIIIRIV-.
В еще одном варианте осуществления, где настоящее изобретение относится к соединениям формулы I или формулы Ia per se, R1 представляет собой необязательно замещенный фенил, Х представляет собой О, А вместе с атомами, к которым он присоединен, образует необязательно замещенное фенильное или необязательно замещенное пиридильное кольцо (в том числе включая его N-оксиды и пиридиниевые соли), В-С представляет собой -СН2СН2-, D представляет собой - СН2- и R2 представляет собой -С(O), необязательно замещенный арилом, или -С(O), необязательно замещенный гетероциклилом.
Будет высоко поощряться, когда соединения формулы I или формулы Ia и некоторые их производные могут содержать по меньшей мере один асимметрический центр, и поэтому способны находиться в более чем одной стереоизомерной форме. Настоящее изобретение распространяется на каждую из этих форм в отдельности и на их смеси, включая рацематы. Изомеры могут быть разделены обычными хроматографическими способами или с использованием агента для оптического расщепления. В качестве альтернативы индивидуальные изомеры могут быть получены асимметрическим синтезом с использованием хиральных промежуточных продуктов.
Например, будет учитываться, что соединения настоящего изобретения будут хиральными за счет неравномерного расположения заместителей у атома углерода, соединенного с заместителем R1. Соответственно, соединения настоящего изобретения могут находиться в виде смеси энантиомеров, например энантиомерно обогащенных смесей или рацемических смесей. Однако, предпочтительно, чтобы соединения настоящего изобретения были "энантиомерно чистыми".
В данном контексте при ссылке на энантиомер термин "энантиомерно чистый" означает, что энантиомер по существу не содержит энантиомерной пары. Энантиомерную чистоту обычно выражают в терминах энантиомерного избытка или % е.е. Для пары энантиомеров [(+) и (-)], когда смесь двух изомеров выражают в виде молярных или массовых долей F(+) и F(-) (где F(+)+F(-)=1), энантиомерный избыток определяют как |F(+)-F(-)|. Соответственно, процентное соотношение е.е. выражают в виде 100×|F(+)-F(-)|. В данном контексте термин "энантиомерно чистый" относится к энантиомеру, имеющему % е.е. больший, чем 70%. Предпочтительно, энантиомерно чистый энантиомер имеет % е.е. больший, чем 80%, более предпочтительно больше, чем 90%, и наиболее предпочтительно больше, чем 95%.
Предпочтительный стереоизомер соединения формулы I, который содержит асимметрический центр в точке присоединения R1, изображен структурой, представленной ниже.
Специалисты в данной области техники учитывают, что установление абсолютной конфигурации (R или S) зависит от старшинства следования каждой группы, соединенной с асимметрическим центром в соответствии с правилом Кана-Ингольда-Прелога.
Когда соединение имеет по меньшей мере одну углерод-углеродную двойную связь, оно может находиться в Z- и Е-формах, и все изомерные формы соединений включены в настоящее изобретение.
Соли соединений формул I и Ia являются предпочтительно фармацевтически приемлемыми, однако учитывают, что нефармацевтически приемлемые соли также включены в рамки настоящего изобретения, поскольку их используют в качестве промежуточных веществ при приготовлении фармацевтически приемлемых солей.
Будет приниматься во внимание, что фармацевтически приемлемые производные соединений формул I и Ia и их соли также включены в объем и сущность данного изобретения. Такие производные включают в себя фармацевтически приемлемые сложные эфиры, пролекарства, сольваты и гидраты соединений или их солей. Фармацевтически приемлемые производные могут включать в себя любые сольваты, гидраты или любые другие соединения или пролекарства, которые при введении субъекту способны предоставить (прямо или косвенно) соединение формулы I или метаболит, обладающий противовирусной активностью или его остаток.
Фармацевтически приемлемые соли включают в себя аддитивные соли кислот, аддитивные соли оснований, соли фармацевтически приемлемых сложных эфиров и соли четвертичных аммонийных и пиридиниевых оснований. Аддитивные соли кислот образуются из соединения настоящего изобретения и фармацевтически приемлемой неорганической или органической кислоты, но не ограничиваются хлористоводородной, бромистоводородной, серной, фосфорной, метилсульфоновой, толуолсульфоновой, бензолсульфоновой, уксусной, пропионовой, аскорбиновой, лимонной, малоновой, фумаровой, малеиновой, молочной, салициловой, сульфаминовой или винной кислотами. Противоион четвертичных аммонийных и пиридиниевых оснований включает в себя хлорид, бромид, иодид, сульфат, фосфат, метилсульфонат, цитрат, ацетат, малонат, фумарат, сульфамат и тартрат. Аддитивные соли оснований включают в себя, но не ограничиваются солями, например, натрия, калия, кальция, лития, магния, аммония и алкиламмония. Кроме того, основные азотсодержащие группы могут быть кватернизованы такими агентами, как низшие алкилгалогениды, например метил-, этил-, пропил- и бутилхлоридами, бромидами и иодидами; диалкилсульфатами, такими как диметил- и диэтилсульфат; и другие. Соли могут быть получены известным способом, например обработкой соединения соответствующей кислотой или основанием в присутствии подходящего растворителя.
Соединения настоящего изобретения могут находиться в кристаллической форме либо в виде свободных соединений, либо сольватов (например, гидратов) и имеется в виду, что обе формы входят в объем настоящего изобретения. Способы сольватации обычно известны в данной области техники.
Термин "сольват" относится к комплексу переменной стехиометрии, образующейся растворимым веществом (в настоящем изобретении соединением настоящего изобретения) и растворителем. Такие растворители предпочтительно не мешают проявлению биологической активности растворимого вещества. В качестве примера растворителями могут быть вода, этанол или уксусная кислота. Способы сольватации обычно известны в данной области техники.
Термин "пролекарство" используют в самом широком смысле и охватывает такие производные, которые превращаются in vivo в соединения настоящего изобретения. Такие производные часто встречаются специалистам в данной области техники и включают в себя, например, соединения, в которых свободные гидроксильные группы превращаются в сложноэфирное производное или кольцевой атом азота превращается в N-оксид. Примеры сложноэфирных производных включают в себя алкиловые сложные эфиры, эфиры фосфорной кислоты и таковые, образующиеся из аминокислот, предпочтительно валина. Любое соединение, являющееся пролекарством соединения настоящего изобретения, включено в объем и сущность настоящего изобретения. Обычные процедуры для получения подходящих пролекарств согласно настоящему изобретению описаны в учебниках, например, "Design of Prodrugs" Ed.H.Bundgaard, Elsevier, 1985. Термин "фармацевтически приемлемый сложный эфир" включает в себя биологически приемлемые сложные эфиры соединения настоящего изобретения, например производные сульфоновой, фосфоновой и карбоновой кислоты.
Таким образом, другой аспект настоящего изобретения предусматривает пролекарство или фармацевтически приемлемый сложный эфир соединения формул I и Ia. В другом варианте осуществления настоящего изобретения предусматривается фармацевтическая композиция, которая содержит терапевтически эффективное количество одного или нескольких вышеописанных противовирусных (RSV) соединений формул I и Ia, в том числе их фармацевтически приемлемые производные, и необязательно фармацевтически приемлемый носитель или растворитель.
Если не дано другого определения, термины "лечение" или "лечить" в контексте данного способа или применения настоящего изобретения включают в себя как терапевтическое, так и профилактическое лечение.
В дополнительном варианте осуществления предусматривается применение соединений формул I и Ia или их солей для лечения (терапевтического или профилактического) инфекций RSV.
Не вдаваясь в теорию, предполагают, что соединения настоящего изобретения проявляют подходящую противо-RSV активность за счет ингибирования способа слияния, обусловленного вирусом RSV.
В дополнительном варианте осуществления предусматривается способ получения соединений формул I и Ia. Эти соединения могут быть получены с использованием процедуры, описанной в следующих способах.
Схема 1 отражает общий способ получения соединений формулы III. Соединения формулы III включены в сферу рассмотрения соединений формулы Ia, где R2 представляет собой Н, и выступают в роли полезных синтетических промежуточных соединений. Соединения формулы III могут быть получены из соответствующих исходных материалов формулы II.
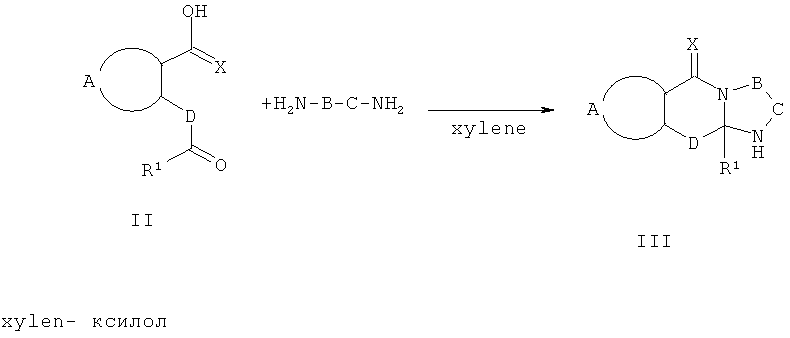
Схема 1
Обычно один эквивалент соответствующей кетокислоты формулы II взаимодействует приблизительно с 3 эквивалентами соответствующего диамина общей формулы H2N-B-C-NH2. Смесь нагревают при кипячении в инертном растворителе, например 1,2-дихлорэтане, толуоле или ксилоле в колбе, снабженной аппаратом Дина-Старка, в течение 3-24 час. Может быть использован катализатор толуолсульфокислота. После этого реакционной смеси дают охладиться и продукт фильтруют и перекристаллизовывают из подходящего растворителя. Если осадок не образуется, растворитель упаривают и остаток перекристаллизовывают или очищают с использованием флэш-хроматографии или препаративной ВЭЖХ.
Способы получения 2-(2'-окси-2'-арил)бензойных кислот формулы II описаны Guion Т.S. et al., 1996, Synthetic Communications, 26:1753-1762, Epsztajn, J. et al., Synth. Communications, 1992, 22:1239-1247, Bruggink A. et al., Tetrahedron, 1975, 31:2607-2619 и Ames, D.E. et al., 1976, J.Chem. Soc. Perkin Trans. 1,1073-1078.
В дополнительном аспекте настоящего изобретения разработаны новые способы получения некоторых соединений формулы II и описаны в данном контексте. Схема 2 иллюстрирует пример последовательности реакций, применимой для получения кетокислот формулы II (где Х=O и D представляет собой -CH2-). Обычно, соответствующую ароматическую о-галогенкарбоновую кислоту суспендируют в трет-бутаноле или другом подходящем растворителе приблизительно вместе с 1,5 эквивалентами подходящего β-дикетона. К этой смеси добавляют приблизительно 0,25 эквивалентов меди, бромида меди (I) или иодида меди (I) или обоих компонентов. Затем суспензию обрабатывают приблизительно 1,6 эквивалентами трет-бутоксида калия или этоксида натрия, запаивают в стойкий к давлению сосуд и нагревают в микроволновом реакторе при перемешивании приблизительно при 180°С в течение приблизительно 1 часа. В качестве альтернативы может быть использован растворитель с достаточно высокой температурой кипения (например, N,N-диметилацетамид) и смесь нагревают при кипячении в открытом сосуде до тех пор, пока не произойдет практически полное превращение субстрата. Образующуюся смесь разбавляют водой, нейтрализуют водным NH4Cl и экстрагируют подходящим органическим растворителем. Органические экстракты сушат и концентрируют и остаток очищают флэш-хроматографией. Лактонное промежуточное соединение затем гидролизуют обработкой разбавленным водным раствором щелочи с использованием ацетонитрила в качестве сорастворителя.
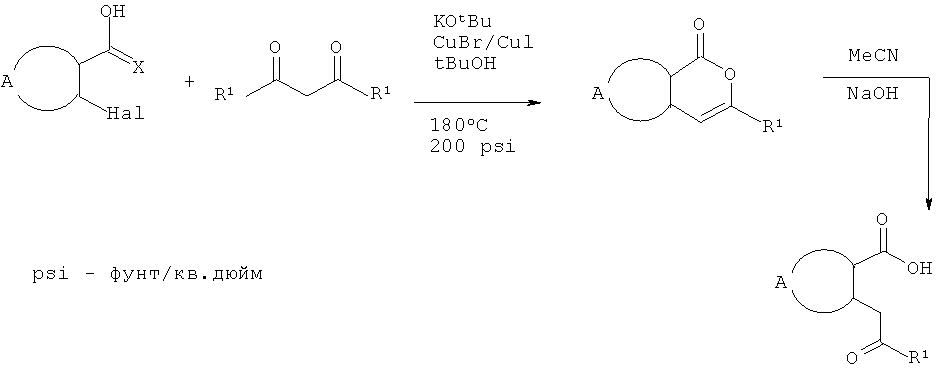
Схема 2
Другие соединения формулы II могут быть получены замещением α-метиленкетона. Подходящая кетокислота формулы II (где Х=O и D представляет собой -[СН2]n-) и каталитическое количество 18-краун-6-эфира суспендируют в ТГФ и охлаждают до -78°С. Добавляют выбранный алкилгалогенид или дигалогенид (приблизительно 3 эквивалента), а затем трет-бутоксид калия. Смесь перемешивают и дают нагреться до комнатной температуры. Когда реакция заканчивается, смесь вновь охлаждают и гасят насыщенным раствором аммонийхлорида и разбавляют небольшим количеством воды. Органический слой отделяют и промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. Остаток может быть очищен перекристаллизацией или флэш-хроматографией. Этот способ является модификацией процедур, описанных в J.Org.Chem. 1991, 56:7188-7190.
Другие соединения формулы I могут быть получены ацилированием соединений формулы III, как показано на Схеме 3.

Схема 3
В одном из способов два эквивалента диизопропилэтиламина или триэтиламин добавляют к одному эквиваленту соединения формулы III в ТГФ при 0°С. Хлорангидрид или другой ацилирующий агент добавляют к смеси и затем реакцию контролируют при помощи ВЭЖХ. Когда реакция заканчивается, реакционную смесь гасят водой и продукт экстрагируют в подходящий органический растворитель и обрабатывают стандартными способами. Подобное ацилирование может также выполняться при взаимодействии одного эквивалента соединения формулы III с одним эквивалентом соответствующего хлорангидрида в ксилоле при 120°С в течение 1-24 час. Затем реакции дают охладиться и продукт выделяют. В качестве альтернативы соединения формулы III могут быть обработаны приблизительно 2,2 эквивалентами соответствующего хлорангидрида или ангидрида в пиридине при приблизительно -5°С. Смеси дают нагреться до комнатной температуры и после перемешивания в течение 2-24 час продукт выделяют стандартными способами. Ацилирование может быть также проведено обработкой соответствующего соединения формулы III соответствующей карбоновой кислотой (3 эквивалентами), TFFH (3,3 эквивалентами) и DIEA (3,3 эквивалентами) в ДМФА и нагреванием до 45°С в течение приблизительно 14 дней. После этого продукт выделяют стандартными способами.
N-алкилированные и N-сульфонилированные соединения формулы I являются лучшими из полученных с использованием подходящих N-замещенных диаминов. Они могут быть получены известными способами, например, описанными Kruse L.L, et al., J.Med. Chem. 1990, 33, 781-789. Соответствующую кетокислоту (2 эквивалента) и N-замещенный диамин (1 эквивалент) в хлорбензоле, толуоле или ксилоле помещают в колбу, снабженную мешалкой и водоотделителем Дина-Старка, и нагревают при кипячении до тех пор, пока не будет видно отделения новых порций воды (1-8 час) (Схема 4). Растворитель затем удаляют, и осадок может быть очищен с использованием стандартных способов.
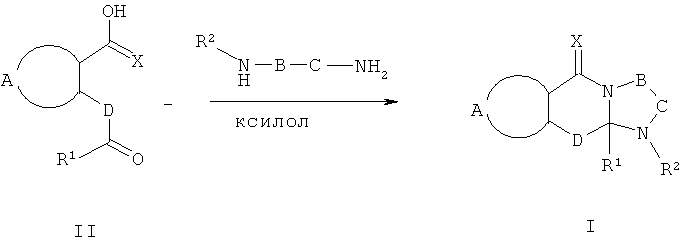
Схема 4
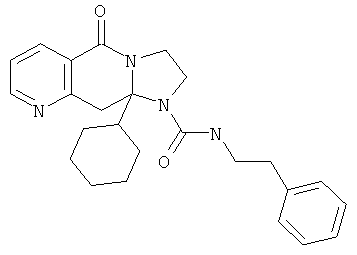
При получении соединений формулы I, где R2 представляет собой мочевину или тиомочевину, один эквивалент соответствующего соединения формулы III взаимодействует с одним эквивалентом соответствующего изоцианата или изотиоцианата в инертном растворителе, например, ТГФ или ксилоле при температуре в диапазоне 20-120°С в течение 1-24 час. Затем охлаждают реакционную смесь, и продукт отфильтровывают, промывают или либо перекристаллизовывают из соответствующего растворителя или очищают с использованием хроматографии.
Другие соединения формулы I могут быть получены присоединением, удалением или модификацией имеющихся заместителей. Это может быть достигнуто при использовании стандартных способов взаимопревращения функциональных групп, хорошо известных в промышленности, например, таких, которые описаны в "Comprehensive organic transformations: a guide to functional group preparations", Larock R. C5 New York, VCH Publishers, Inc. 1989.
Примерами взаимопревращения функциональных групп являются: -C(O)NRR из -CO2CH3 нагреванием в присутствии каталитически активного цианида металла, например, NaCN, и HNRR в СН3ОН; -OC(O)R из -ОН, или без него, в присутствии, например, ClC(O)R в пиридине; -NC(S)NR'R" из -NHR с алкилизотиоцианатом или тиоциановой кислотой; -NRC(O)OR' из -NHR с алкилхлорформиатом; -NRC(O)NR'R" из -NHR обработкой изоцианатом, например, HN=C=O или RN=C=O; -NRC(O)R' из -NHR обработкой ClC(O)R' в пиридине; - C(=NR)NR'R" из -C(NR'R)SR обработкой H3NR+OAc- нагреванием в спирте; -C(NR'R")SR из -C(S)NR'R" с R-I в инертном растворителе, например ацетоне; -C(S)NR'R" (где R' или R" не является водородом) из -C(S)NH2 с HNR'R"; -C(=NCN)-NR'R" из -C(=NR'R")-SR с NH2CN нагреванием в безводном спирте, альтернативно из -C(=NH)-NR'R" обработкой BrCN и NaOEt в EtOH; -NR-C(=NCN)SR из -NHR' обработкой (RS)2C=NCN; -NR"SO2R из -NHR' обработкой ClSO2R нагреванием в пиридине; -NR'C(S)R из -NR'C(O)R обработкой реагентом Лоуссона [2,4-бис(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфидом]; -NRSO2CF3 из -NHR обработкой ангидридом трифторметансульфокислоты и основанием, -CH(NH2)CHO из -CH(NH2)C(O)OR' обработкой Na(Hg) и HCl/EtOH; -СН2С(O)ОН из -С(O)ОН обработкой SOCl2, затем CH2N2, затем H2O/Ag2O; -C(O)OH из -СН2С(O)ОСН3 обработкой PhMgX/HX, затем уксусным ангидридом, затем CrO3; R-OC(O)R' из RC(O)R' обработкой R"СО3Н; -CCH2OH из -C(O)OR' обработкой Na/R'OH; -СНСН2 из -CH2CH2OH по реакции Чугаева; -NH2 из -С(O)ОН по реакции Курциуса; -NH2 из -C(O)NHOH обработкой TsCl/основание, затем H2O; -CHC(O)CHR из -CHCHOHCHR с использованием реагента Десса-Мартина или CrO3/водн. H2SO4/ацетон; -С6Н5СНО из -С6Н5СН3 при обработке CrO2Cl2; -СНО из -CN при обработке SnCl2/HCl; -CN из -C(O)NHR при обработке PCl5; -CH2R из -C(O)R при обработке N2H4/KOH.
При проведении реакций некоторые группы должны быть защищены. Подходящие защитные группы хорошо известны в данной области и были описаны во многих ссылках, например Protective Groups in Organic Synthesis, Greene, T.W. and Wuts, P.G.M., Wiley-biterscience, New York, 1999 или Protecting Groups, Kocienski, PJ., Thieme, Stuttgart, 1994.
Сокращения, которые могут быть использованы данном контексте, включены в Схемы 1-4 и в экспериментальный раздел, являются следующими, если не определены иначе:
DCM: дихлорметан
DIEA: диизопропилэтиламин
DMF: диметилформамид (ДМФА)
Et: этил
EtOAc: этилацетат
Me: метил
МеОН: метиловый спирт
MS: масс-спектрометрия
NMR: ядерный магнитный резонанс (ЯМР)
Ph: фенил
HPLC: высокоэффективная жидкостная хроматография (ВЭЖХ)
TEA: триэтиламин
TFA: трифторуксуснаям кислота (ТФУ)
TFFH: фтор-N,N,N",N"-тетраметилформамидиний гексафторфосфат
ТНР: тетрагидрофуран (ТГФ)
TsCl: тозилхлорид
TsOH: толуолсульфокислота
Настоящее изобретение также относится к терапевтическим композициям для предотвращения и/или лечения RSV, содержащим по меньшей мере одно соединение формулы I или Ia, в том числе фармацевтически приемлемые соли или пролекарства.
Предполагают, что композиции настоящего изобретения могут также содержать или быть введенными в одно или несколько других соединений, обладающих противовирусной активностью в отношении RSV, например Виразол или другие агенты, например RespiGam™ или Synagis®.
Предполагают, что композиции настоящего изобретения могут также содержать или быть введенными в комбинации с другими лекарственными средствами для лечения симптомов заболевания, например, такими, как противовоспалительные лекарственные средства, например диклофенак, дифлунизал, этодолак, фенопрофен, флубипрофен, ибупрофен, индометацин, кетопрофен, кеторолак, мефанамовая кислота, мелоксикам, набуметон, напроксен, оксапрозин, пироксикам, салсалат, сулиндак, толметин.
Предполагают, что композиции настоящего изобретения могут также содержать или быть введенными вместе с другими лекарственными средствами для лечения симптомов заболевания, например стероидами, такими как бета-антагонисты: альбутерол, левалбутерол, битолтерол, пирбутерол, тербуталин, ипратропийбромид, преднизон, преднизолон и метилпреднизолон; бета-антагонисты пролонгированного действия, такие как сальметерол или формотерол; модификаторы лейкотриена, такие как монолеукаст, зафилукаст и цилеутон; теофиллины; недохромилы и хромолины.
Термин "композиция" предназначен для того, чтобы включить рецептуры активного ингредиента с обычными носителями и эксципиентами, а также с инкапсулирующими материалами, такими как носитель для того, чтобы получить капсулу, в которой активный ингредиент (вместе с другими носителями или без них) окружен инкапсулирующим носителем.
Как без труда определяют специалисты в данной области техники, способ введения и природа фармацевтически приемлемого носителя зависит от природы заболевания и животного, подвергающегося лечению. Предполагают, что выбор конкретного носителя или системы доставки и способа введения может быть легко определен специалистом в данной области техники. При приготовлении любой лекарственной формы, содержащей соединения настоящего изобретения, необходимо позаботиться о том, чтобы активность соединения не уменьшалась при их приготовлении и чтобы соединение было способным достичь места приложения действия без разрушения. При некоторых обстоятельствах необходимо защитить соединение способами, известными в данной области техники, такими, например, как микроинкапсулирование. Аналогично этому, выбранный способ введения должен быть таковым, чтобы соединение достигало места его приложения.
Фармацевтические композиции или лекарственные формы включают в себя таковые, подходящие для перорального, ректального, назального, локального (в том числе, ротового и подъязычного), вагинального или парентерального (в том числе, внутримышечного, подкожного и внутривенного) введения или в форме, подходящей для введения путем ингаляции или вдувания. Предусматривается, что композиции могут быть предоставлены в форме, подходящей для перорального или назального введения или для ингаляции или вдувания.
Соединения настоящего изобретения вместе с обычным адъювантом, носителем или растворителем могут таким образом находиться в форме фармацевтической композиции и ее одноразовой лекарственной формы, и в такой форме могут быть использованы в виде твердых веществ, например таблеток или гидравлических капсул, или жидкостей, например растворов, суспензий, эмульсий, эликсиров, или капсул, заполненных этими жидкостями, все для перорального использования, в форме свечей для ректального введения; или в форме стерильных инъекционных растворов для парентерального (в том числе, подкожного) использования.
Такие фармацевтические композиции и их одноразовые лекарственные формы могут содержать обычные ингредиенты в обычных пропорциях, вместе с дополнительными активными соединениями или действующим началом или без них, и такие одноразовые лекарственные формы могут содержать любое подходящее эффективное количество активного ингредиента, сопоставимого с планируемым ежедневным диапазоном доз, который должен быть использован. Лекарственные формы, содержащие десять (10) миллиграмм, могут содержать любое подходящее эффективное количество или, более широко, от 0,1 до одной сотни (100) миллиграмм, на одну таблетку, соответственно, являются подходящими типичными одноразовыми лекарственными формами.
Соединения настоящего изобретения могут быть введены в широком наборе пероральных и парентеральных лекарственных форм. Специалистам в данной области техники будет понятно, что следующие лекарственные формы могут содержать в качестве компонента либо соединение настоящего изобретения, либо фармацевтически приемлемую соль соединения настоящего изобретения.
Для получения фармацевтических композиций из соединений настоящего изобретения фармацевтически приемлемые носители могут быть твердыми веществами или жидкостями. Препараты в твердой форме могут включать в себя порошки, таблетки, пилюли, капсулы, крахмальные капсулы, свечи и разовые гранулы. Твердый носитель может состоять из одного или нескольких веществ, которые также могут выступать в роли растворителей, ароматизирующих веществ, солюбилизаторов, смазочных веществ, суспендирующих агентов, связующих веществ, консервирующих добавок, агентов, расщепляющих таблетки, или инкапсулирующего материала.
Например, в порошках носитель представляет собой тонко измельченное твердое вещество, находящееся в смеси с тонко измельченным активным компонентом.
Например, в таблетках активный компонент смешивают с носителем, обладающим необходимой связывающей способностью, в подходящих пропорциях и компактной форме и нужным объемом.
Порошки и таблетки предпочтительно содержат от пяти или десяти до приблизительно семидесяти процентов активного компонента. Подходящими носителями могут быть карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатина, трагант, метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, низкоплавящийся воск, масло какао и т.п. Имеется в виду, что термин "препарат" включает в себя лекарственную форму активного соединения, содержащую инкапсулирующий материал в качестве носителя, обеспечивающий капсулу, в которой активный компонент вместе с носителем или без него окружен носителем, который таким образом связан с ним. Аналогично, включены и крахмальные капсулы и таблетки для рассасывания. Таблетки, порошки, пилюли, капсулы, крахмальные капсулы и таблетки для рассасывания могут быть использованы в качестве твердых форм, подходящих для перорального введения.
Для приготовления свечей низкоплавящийся воск, например, смесь глицеридов жирных кислот и масла какао сначала расплавляют, и активный компонент гомогенно диспергируют в ней при перемешивании. Расплавленную гомогенную смесь затем выливают в формы удобного размера, дают охладиться и таким образом затвердеть.
Лекарственные формы, подходящие для вагинального введения, могут быть представлены в виде маточных колец, тампонов, кремов, гелей, паст, пен или аэрозолей, содержащих кроме активного ингредиента такие носители, которые, как известно в данной области техники, являются подходящими.
Жидкая форма препаратов включает в себя растворы, суспензии и эмульсии, например воду или растворы вода-пропиленгликоль. Например, парентеральные инъекционные жидкие препараты могут быть приготовлены в виде растворов в растворе водного полиэтиленгликоля.
Стерильные композиции жидкой формы включают в себя стерильные растворы, суспензии, эмульсии, сиропы и эликсиры. Активный ингредиент может быть растворен или суспендирован в фармацевтически приемлемом носителе, например стерильной воде, стерильном органическом растворителе или смеси обоих компонентов.
Композиции согласно настоящему изобретению могут таким образом быть приготовленными для парентерального введения (например, путем инъекций, например инъекцией ударной дозы вещества или непрерывным вливанием) и могут быть представлены в форме одноразовых доз в ампулах, шприцов-ручек, инъекций малых объемов или упаковки лекарственных средств для многократного приема вместе с консервирующими веществами или без них. Композиции могут использовать такие формы в качестве суспензий, растворов или эмульсий в масляных или водных везикулах и могут содержать агенты для приготовления лекарственных форм, например суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может находиться в форме порошка, полученного путем асептического выделения стерильного твердого вещества или лиофилизацией из раствора, для включения в подходящую среду, например стерильную, не содержащую пирогена воду, перед использованием.
Фармацевтические формы, подходящие для инъекционного использования, включают в себя стерильные инъекционные растворы или дисперсии стерильные порошки для экстемпорального приготовления стерильных инъекционных растворов. Они могут быть стабильными в условиях приготовления и хранения и могут быть защищены от окисления и загрязняющего действия микроорганизмов, таких как бактерии или грибы.
Специалисты в данной области техники могут легко принять решение в отношении подходящих лекарственных средств для соединений настоящего изобретения с использованием обычных подходов. Установление предпочтительного диапазона рН и подходящих эксципиентов, например антиоксидантов, является рутинной операцией в данной области техники. Буферные системы обычно используют для обеспечения значений рН в нужном диапазоне и включают в себя буферы на основе карбоновых кислот, например ацетатный, цитратный, лактатный и сукцинатный. Для таких лекарственных средств доступны различные антиоксиданты, включая фенольные соединения, например ВНТ или витамин Е, восстанавливающие агенты, например метионин или сульфит, и хелатирующие металлы, например EDTA.
Растворитель или дисперсионная среда для инъекционных растворов могут содержать любой из обычных растворителей или систем-носителей для соединений и может содержать, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), их подходящие смеси и растительные масла. Подходящая текучесть может быть достигнута, например, использованием защитного слоя, например, лецитина, за счет поддержания желаемого размера частиц в случае дисперсии и использованием поверхностно-активных веществ. Предупреждение действия микроорганизмов может быть достигнуто, если это необходимо включением различных антибактериальных противогрибковых агентов, например парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимерозола и т.п. Во многих случаях будет предпочтительным включать агенты для выравнивания осмоляльности, например, сахара или хлорида натрия. Предпочтительно, чтобы лекарственные средства для инъекций были изотоничны по отношению к крови. Пролонгированное всасывание инжектируемых композиций может быть обусловленно использованием в композиции агентов, замедляющих всасывание, например алюминий моностеарата и желатины. Фармацевтические формы, подходящие для инъекционного использования, могут быть введены любым подходящим способом, включая внутривенную, внутримышечную, внутримозговую, интратекальную, эпидуральную инъекцию или инфузию.
Стерильные инъецируемые растворы готовят введением активных соединений в требуемое количество соответствующего растворителя с различными другими ингредиентами, например, перечисленными выше, если это необходимо, с последующей фильтрующей стерилизацией. Обычно, дисперсии готовят введением различных стерилизованных активных ингредиентов в стерильную среду, содержащую исходную дисперсионную среду и требуемые другие ингредиенты из числа тех, которые перечислены выше. В случае стерильных порошков для приготовления стерильных инжектируемых растворов предпочтительными способами приготовления является вакуумная сушка или лиофилизация предварительно стерильно отфильтрованного раствора активного ингредиента плюс любые дополнительные нужные ингредиенты.
Когда активные ингредиенты надлежащим образом защищены, они могут быть введены перорально, например, вместе с инертным растворителем или с усвояемым годным к употреблению в пищу носителем, или они могут быть заключены в твердую или мягкую оболочку желатиновой капсулы, или они могут быть подвергнуты сжатию в таблетки, или они могут быть введены непосредственно вместе с пищевой диетой. Для перорального терапевтического введения активное соединение может быть введено с эксципиентами и быть использованным в форме принимаемых внутрь таблеток, таблеток для медленного растворения в щечном кармане, пастилок, капсул, эликсиров, суспензий, сиропов, лепешек и т.п. Такие композиции и препараты предпочтительно содержат по меньшей мере 1 масс.% активного соединения. Процентное содержание композиций и препаратов может конечно меняться и может быть подходящим в диапазоне от приблизительно 5 до приблизительно 80 масс.% единиц. Количество активного соединения в терапевтически полезных композициях может быть достаточным для получения подходящей дозы.
Таблетки, пастилки, драже, капсулы и т.п. могут также содержать компоненты, перечисленные ниже: связывающие вещества, например клей, акацию, кукурузный крахмал или желатину; эксципиенты, например дикальцийфосфат; дезинтегрирующие агенты, например кукурузный крахмал, картофельный крахмал, альгиновую кислоту и т.п.; смазочные материалы, например магний стеарат; и подсластители, например сахароза, лактоза или сахарин, которые могут быть добавлены, или ароматизирующие вещества, например мятное масло, масло винтергрена или вишневый аромат. Когда одноразовой лекарственной формой является капсула, она кроме материалов описанного выше типа может содержать жидкий носитель.
Различные другие материалы могут быть представлены в виде покрытий или таковых, модифицирующих физическую форму одноразовых лекарственных веществ. Например, таблетки, пилюли или капсулы могут быть покрыты шеллаком, сахаром или обоими веществами. Сироп или эликсир может содержать активное соединение, сахарозу или подсластитель, метил- и пропилпарабены в качестве консервирующих веществ, краситель и ароматизирующие агенты, например вишневый или апельсиновый аромат. Любой материал, используемый для получения любой одноразовой лекарственной формы, может быть фармацевтически чистым и в значительной степени нетоксичным в используемых количествах. Кроме того, активное соединение(я) может быть включено в препараты и лекарственные формы с замедленным высвобождением, включая те, которые позволяют осуществить адресную доставку активного пептида к специфическим областям кишечника.
Водные растворы, подходящие для перорального использования, могут быть получены растворением активного компонента в воде и добавлением подходящих красителей, ароматизирующих, стабилизирующих и загущающих агентов, при необходимости.
Водные суспензии, подходящие для перорального использования, могут быть получены диспергированием тонко измельченного активного компонента в воде с вязким материалом, например природной или синтетической камедью, смолой, метилцеллюлозой, натриевой солью карбоксиметилцеллюлозы или другими хорошо известными суспендирующими агентами.
Фармацевтически приемлемые носители и/или растворители включают в себя любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и агенты и агенты, замедляющие всасывание и т.п. Использование таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области техники. Наряду с тем, что любая обычная среда или агент несовместимы с активным ингредиентом, их использование в терапевтических композициях следует серьезно обдумать. В композицию могут быть также введены дополнительные компоненты.
Также включают твердые формы препаратов, которые предполагают превращать незадолго перед использованием в жидкие формы препаратов для перорального введения. Такие жидкие формы препаратов включают в себя растворы, суспензии и эмульсии. Эти препараты могут содержать помимо активного компонента красители, ароматизирующие агенты, стабилизаторы, буферы, искусственные и природные подсластители, диспергирующие агенты, загустители, солюбилизирующие агенты и т.п.
Для локального введения в верхний слой кожи соединения согласно настоящему изобретению могут быть приготовлены в виде мазей, кремов или лосьонов или в виде трансдермального пластыря. Мази и кремы могут, например, быть приготовлены на водной или масляной основе с добавлением подходящих загустителей и/или желирующих агентов. Лосьоны могут быть приготовлены на водной или масляной основе и будут обычно также содержать один или несколько эмульгирующих агентов, солюбилизирующих агентов, диспергирующих агентов, суспендирующих агентов, загустителей или красителей.
Лекарственные формы, предназначенные для локального введения в рот, включают в себя таблетки для рассасывания, содержащие активный агент на ароматизированной подложке, обычно сахарозу и акацию или трагант; пастилки, содержащие активный ингредиент на инертной подложке, например желатине и глицерине или сахарозе и акации; и жидкости для полоскания рта, содержащие активный ингредиент в подходящем жидком носителе.
Растворы или суспензии применяют непосредственно введением в носовую полость обычными способами, например с помощью капельницы, пипетки или опрыскивателя. Лекарственные формы могут быть применены в одноразовой или многократной форме. В последнем случае при использовании капельниц или пипеток это может быть достигнуто введением пациенту соответствующего, заранее определенного объема раствора или суспензии. В случае опрыскивателя это может быть достигнуто, например, при использовании мерного распыляющего насоса. Для улучшения назальной доставки и их сохранения соединения согласно настоящему изобретению могут быть инкапсулированы при помощи циклодекстринов или приготовлены с другими агентами, которые предположительно увеличивают доставку и сохранение в слизистой оболочке носа.
Введение в дыхательную систему может быть также достигнуто при помощи приготовления аэрозольной лекарственной формы, в которой активный ингредиент предоставляют герметично упакованным с подходящим распыляющим веществом, например хлорфторуглеродом (CFC), например дихлордифторметаном, трихлорфторметаном или дихлортетрафторэтаном, диоксидом углерода или другим подходящим газом. Удобно, если аэрозоль может также содержать поверхностно активное вещество, например лецитин. Дозу лекарственного вещества можно контролировать устройством с мерным клапаном.
В качестве альтернативы активные ингредиенты могут быть предоставлены в форме сухого порошка, например смеси порошка соединения в подходящей порошковой подложке, например лактозе, крахмале, производных крахмала, например гидроксиметилцеллюлозе и поливинилпирролидоне (PVP). Обычно порошковый носитель образует гель в носовой полости. Порошковая композиция может быть представлена в форме однократной дозы, например в капсулах или в гильзах, например желатины, или в блистерной упакове, из которой порошок может быть введен при помощи ингалятора.
В лекарственных формах, предназначенных для введения в дыхательную систему, в том числе в интраназальных лекарственных формах, соединение обычно имеет маленький размер частиц, например порядка 5-10 микрон или меньше. Такой размер частиц может быть получен способами, известными в данной области техники, например очень тонким измельчением.
При желании могут быть использованы лекарственные формы, пригодные для замедленного высвобождения активного ингредиента.
Фармацевтически препараты предпочтительно находятся в одноразовой форме. В такой форме препарат preparation is дробят на одноразовые дозы, содержащие соответствующие количества активного компонента. Одноразовая лекарственная форма может представлять собой расфасованный препарат, упаковку, содержащую определенное количество препарата, например упакованных таблеток, капсул и порошков в пузырьках или ампулах. Кроме того, одноразовая лекарственная форма может представлять собой капсулу, таблетку, крахмальную капсулу или таблетку для рассасывания, или она может состоять из соответствующего количества любых из этих расфасованных форм.
Особенно предпочтительно приготовить парэнтеральные композиции в виде одноразовой лекарственной формы для удобства введения и единообразия дозировки. Одноразовая лекарственная форма, используемая в данном контексте, относится к физически разобщенным единицам, соответствующим единичным дозам, предназначенным для субъектов, подвергающихся лечению, причем каждая единица содержит заранее определенное количество активного материала, рассчитанное на то, чтобы произвести желаемый терапевтический эффект, вместе с необходимым фармацевтическим носителем. Характеристика одноразовых лекарственных форм настоящего изобретения определяется и напрямую зависит от (а) индивидуальных свойств активного материала и конкретного терапевтического эффекта, который должен быть достигнут, и (b) от ограничений, свойственных области приготовления такого активного материала для лечения заболеваний у живых субъектов, находящихся в патологическом состоянии, при котором физическое здоровье ослаблено.
Настоящее изобретение также включает в себя соединения формул I, Ia, II в отсутствие носителя, когда эти соединения находятся в одноразовой лекарственной форме.
Количество вводимого соединения формулы I может находиться в диапазоне от приблизительно 10 мг до 2000 мг в день в зависимости от активности соединения и заболевания, подлежащего лечению.
Предпочтительными композициями являются жидкости или порошки для интраназального введения, таблетки или капсулы для перорального введения и жидкости для внутривенного введения.
Специалисты в данной области техники понимают ценность того, что изобретение, описанное в данном контексте, подвержено изменениям и модификациям, отличающимся от тех, которые конкретно описаны. Следует понимать, что настоящее изобретение включает в себя все такие изменения и модификации, которые соответствуют сущности и объему изобретения. Настоящее изобретение также включает в себя все стадии, признаки, композиции и соединения, относящиеся или указанные в этой спецификации, индивидуально или коллективно, и любую и все комбинации любых двух или нескольких стадий или признаков.
Ссылка в этой спецификации на любую предыдущую публикацию (или вытекающую из нее информацию), или на любой материал, который известен, не рассматривается и не должна рассматриваться как подтверждение или признание или как любая форма предположения, что предыдущая публикация (или вытекающая из нее информация) или известный материал формирует часть широко распространенного основного знания в области науки, к которой относится данная спецификация.
По всей этой спецификации и следующей далее формуле изобретения, если иное не вытекает из контекста, слово "содержать" и такие вариации, как "содержит" и "включающий", подразумевает включение принятого единого целого или стадии или группы из единого целого или стадий, а не выделение любого другого единого целого или стадии или группы из единого целого или стадий.
Экспериментальная часть
Синтетические процедуры
1H ЯМР спектры снимали либо на Bruker Avance DRX 400, AC 200 либо на спектрометре AM 300. Спектры регистрировали в CDCl3, d6-ацетоне, CD3OD или d6-ДМСО при использовании остаточного пика растворителя в качестве репера. Химические сдвиги представляли на δ шкале в частях на миллион (м.д.), при использовании следующих условных обозначений распределения кратности: с (синглет), д (дублет), т (триплет), кв (квартет), м (мультиплет) и поставленный префикс b (широкий). Масс-спектры (ESI) регистрировали на Flimigan LCQ Advantage spectrometer. Флэш-хроматографию проводили на 40-63 мкм силикагеле 60 (Merck No. 9385). Препаративную ВЭЖХ проводили с использованием Gilson 322 насоса с Gilson 215 жидкостным манипулятором и детектором HPI 100 PDA. Если не указано иное, системы HPLC используют колонки Phenomenex C8(2) с использованием воды, содержащей 0,1% ТФУ и либо ацетонитрил, либо ацетонитрил, содержащий 0,06% ТФУ.
Способ А
Один эквивалент соответствующей кетокислоты формулы II или ее сложного эфира взаимодействует с приблизительно 3 эквивалентами соответствующего диамина общей формулы H2N-B-C-NH2. Смесь нагревают при кипячении в инертном растворителе, например 1,2-дихлорэтане, толуоле или ксилоле, в колбе, которая может быть снабжена аппаратом Дина-Старка, в течение 1-24 ч или до тех пор, пока в ловушке не перестанет собираться вода. Может быть использован катализатор, например толуолсульфокислота. После этого реакционной смеси дают охладиться и продукт фильтруют и перекристаллизовывают из подходящего растворителя. Если осадок не образуется, растворитель упаривают в вакууме и остаток перекристаллизовывают или очищают с использованием флэш-хроматографии или препаративной ВЭЖХ.
Этот способы получения соединения формулы III являются модификацией процедур, описанных в US 4,058,529, Sulkowski, T.S., et al., 1967, J.Org. Chem., 32:2180-2184 и Houlihan, W.J., et al., 1975, J.Med. Chem., 18:182-185.
10а-(4-Хлорфенил)-2,3,10,10а-тетрагидро-1Н-имиазо[1,2-b]изохинолин-5-он
Указанное выше производное изохинолина получают по Способу А с использованием этилендиамина и 2-(бензоилметил)бензойной кислоты.
Данные 1H ЯМР: (300 МГц, d6-ацетон) δ 2,58-2.70 (м, 1Н), 3,27-3,36 (м, 1Н), 3,43-3,52 (м, 1Н), 3,46 (д, 1Н, J 15,4 Гц), 3,53 (д, 1Н, J 15,3 Гц), 3,68-3,79 (м, 1Н), 7,05-7,10 (м, 1Н), 7,24 (д, 2Н, J 8,8 Гц), 7,29-7,34 (м, 2Н), 7,32 (д, 2Н, J 8.8 Гц). 7,93-7,97 (м, 1Н).
Данные электрораспылительной масс-спектрометрии (ESI-MS) m/z: рассчитано для [М+Н]+: 299,0; определено: 298,9.
9а-(4-Хлорфенил)-2,3,9,9а-тетрагиро-1Н-1,3а,8-триазациклопента[b]нафталин-4-он
Производное вышеуказанного полиазатетрагидронафталенона получают по Способу А с использованием этилендиамина и 2-[2-(4-хлорфенил-2-оксиэтил]-никотиновой кислоты.
Данные 1Н ЯМР: (300 МГц, d6-ацетон) δ 3,33-3,79 (м, 6Н), 7,26-7,36 (м, 5Н), 8,21 (дд, 1Н), 8,48 (дд, 1Н).
Данные ESI-MS m/z: рассчитано для [М+Н]+: 300.0; определено: 299.9.
Способ В
Два эквивалента диизопропилэтиламина или триэтиламина добавляют к одному эквиваленту соединения формулы III в ТГФ или другом подходящем инертном растворителе при 0°С. К смеси добавляют изоцианат, изотиоцианат, хлорангидрид или другой ацилирующий агент и реакцию контролируют при помощи ВЭЖХ. После завершения реакцию гасят водой и продукт экстрагируют EtOAc. EtOAc последовательно промывают растворами 1:1 насыщенного NH4Cl(вод)/вода, 1:1 насыщенного Na2CO3(вод)/вода и насыщенного Na2CO(вод). EtOAc сушат (Na2SO4 или MgSO4), растворитель упаривают в вакууме и остаток либо перекристаллизовывают, либо очищают с использованием флэш-хроматографии или препаративной ВЭЖХ.
N-{2-[10а-(4-Хлорфенил)-5-оксо-2,3,10,10а-тетрагидро-5Н-имидазо[2-b]изохинолин-1-ил]-2-оксиэтил}-4-фторбензолсульфонамид
Указанный выше амид получают по Способу В с использованием 4-(фторбензолсульфонамино)ацетилхлорида и триэтиламина в дихлорметане и очищают с использованием флэш-хроматографии.
Данные 1Н ЯМР: (300 МГц, CDCl3) δ 3,39 (д, 1Н, J 15 Гц), 3,54-3,62 (м, 1Н), 3,66-3,89 (м, 4Н), 4,44 (д, 1Н, J 16 Гц), 4,44-4,53 (м, 1Н), 5,48-5,51 (м, 1Н), 7,13-7,33 (м, 8Н), 7,37-7.42 (м, 1Н), 7,86-7,91 (м, 2Н), 7,97 (дд, Н, J 7,5 Гц, 1,3 Гц).
Данные ESI-MS m/z: рассчитано для [М+Н]+: 514,0; определено: 514,0.
Способ С
Одному эквиваленту соответствующего соединения формулы III дают взаимодействовать с одним эквивалентом соответствующего хлорангидрида или другого ацилирующего агента в подходящем инертном растворителе, например в толуоле, в присутствии ненуклеофильного основания, например триэтиламина, при повышенной температуре до тех пор, пока реакция в основном не будет завершена. Ацилпереносящий реагент, например N,N-диметил-4-аминопиридин, может быть также добавлен к реакционной смеси. Затем смеси дают охладиться, и продукт фильтруют и перекристаллизовывают из подходящего растворителя. Если осадок не образуется, растворитель упаривают в вакууме и остаток перекристаллизовывают или очищают с использованием флэш-хроматографии или препаративной ВЭЖХ.
4-[10а-(4-Хлорфенил)-5-оксо-2,3,10,10а-тетрагидро-5Н-имидазо[1,2-b]изохинолин-1-ил]-4-оксомасляная кислота
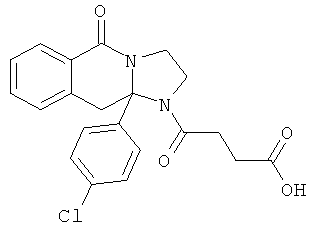
Указанный выше амид получают по Способу С с использованием янтарного ангидрида и триэтиламина с добавлением N,N-диметил-4-аминопиридина в толуоле при кипячении в течение 3 дней и очищают с использованием флэш-хроматографии.
Данные 1Н ЯМР: (300 МГц, CDCl3) δ 2,57-2,60 (м, 2Н), 2,64-2,67 (м, 2Н), 3,55 (д, 1Н, J 16 Гц), 3,76-3,84 (м, 2Н), 3,96-4,06 (м, 1Н), 4,43-4,52 (м, 1Н), 4,60 (д, 1Н, J 16 Гц), 7,12-7,20 (м, 3Н), 7,28-7,0 (м, 4Н), 7,96 (дд, 1Н, J 1,6 Гц, 1,2 Гц).
Данные ESI-MS m/z: рассчитано для [М+Н]+: 399,0; определено: 399,0.
Способ D
N-замещенные диамины могут быть получены способами, которые хорошо известны специалистам в данной области техники. Одна из таких процедур описана Kruse L.I., et al., 1990, J.Med. Chem., 33:781-789.
Соответствующее соединение формулы II (2 эквивалента) и N-замещенный диамин формулы H2N-B-C-NHR3 (1 эквивалент) в толуоле, ксилоле или других подходящих инертных растворителях помещают в колбу, снабженную мешалкой и аппаратом Дина-Старка. Смесь нагревают при кипячении до тех пор, пока в ловушке не перестанет отделяться вода (обычно 1-24 ч). Затем растворитель отгоняют и остаток охлаждают. Остаток очищают с использованием флэш-хроматографии или препаративной ВЭЖХ.
10а'-(4'-Хлорфенил)-1'-(4'-фторбензил)-2'3'10'10a'-тетрагидро-1'Н-спиро[циклопропан-(1,10'-имидазо[1,2-b]изохинолин[5]он)]
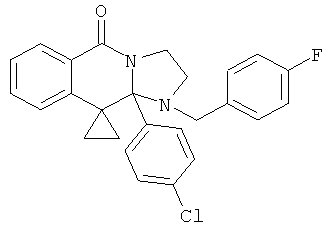
Указанный выше амид получают по Способу D с использованием N-(4-фторбензил)этилендиамина в ксилолах при кипячении в течение 21 ч и очищают флэш-хроматографией.
Данные 1H ЯМР: (300 МГц, CDCl3) δ 0,42-0,49 (м, 1H), 1,56-1,64 (м, 1Н), 1.76-1,82 (м, 1Н), 1,92-1,99 (м, 1Н), 2,36 (д, 1Н, J 14 Гц), 2,55-2,65 (м, 1Н), 3,19-3,25 (м, 1Н), 3,71 (д, 1Н, J 14 Гц), 3,83-3,93 (м, 1Н), 4,12-4,19 (м, 1Н), 6,97-7,05 (м, 3Н), 7,13-7,21 (м, 5Н), 7,25-7,35 (м, 3Н), 7,84 (дд, 1Н, J 7,6 Гц, 1,3 Гц).
Данные ESI-MS m/z: рассчитано для [М+Н]+: 433,0; определено: 433,1.
Способ Е
Один эквивалент соответствующего соединения формулы III взаимодействует с одним эквивалентом соответствующего изоцианата или изотиоцианата в ТГФ или ксилоле при температуре в диапазоне 20-120°С в течение 1-48 ч. Затем реакции дают охладиться, и продукт фильтруют, промывают и перекристаллизовывают из подходящего растворителя. Если осадок не образуется, продукт может быть очищен с использованием флэш-хроматографии или препаративной ВЭЖХ.
Способ F
Соответствующий изоцианат, изотиоцианат, сульфонилхлорид, хлорангидрид, ангидрид или другой ацилирующий агент (2,2 эквивалента) добавляют непосредственно, если они являются жидкостями или в виде растворов в пиридине (~1 М), если они являются твердыми веществами, к раствору соответствующего соединения формулы III (0,1 ммоль) в пиридине (500 мкл) при -5°С. Реакцию перемешивают и дают нагреться до комнатной температуры в течение 2-24 ч. Реакцию последовательно разбавляют водой и три раза экстрагируют CH2Cl2 или другим подходящим органическим растворителем. Объединенные органические экстракты промывают 1 N NaOH (3×) и 10% HCl (3×). В случае основных продуктов опускают промывание кислотой и в случае кислых продуктов опускают промывание основанием. Для нейтральных и основных продуктов грубая стадия очистки может быть улучшена перемешиванием объединенных экстрактов в CH2Cl2 в присутствии иммобилизованного на полимере основания (например, МР-карбонатной смолы. Argonaut Technologies Inc.) в течение 0,5-12 ч. Экстракт в CH2Cl2 сушат (MgSO4), и растворитель упаривают в вакууме. Неочищенные продукты последовательно очищают флэш-хроматографией.
10а-(4-Хлорфенил)-1-(пиридин-3-карбонил)-2,3,10,10а-тетрагидро-1Н-имидазо[1,2-b]изохинолин-5-он
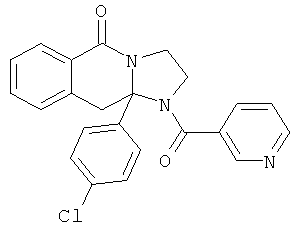
Указанное выше ацилированное производное изохинолина получают Способом F при использовании никотинилхлорида и 10а-(4-хлорфенил)-2,3,10,10а-тетрагидро-1Н-имидазо[1,2-b]изохинолин-5-она.
Данные 1Н ЯМР: (300 МГц, d6-ацетон) δ 3,78-3,88 (м, 3Н), 3,97-4,09 (м, 1Н), 4,28-4,38 (м, 1Н), 4,72 (д, 1Н, J 16,0 Гц), 7,29 (д, 2Н, J 8,9 Гц), 7,31-7,38 (м, 1Н), 7,41-7,52 (м, 3Н), 7,58 (д, 2Н, J 8,9 Гц), 7,87-7,91 (м, 1Н), 7,92 (ддд, 1Н, J 1,7 Гц, J 2,2 Гц, J 7,9 Гц), 8,67 (дд, 1Н, J 1,7 Гц, J 4,9 Гц), 8,73 (дд, 1Н, J 0,9 Гц, J 2,2 Гц).
Данные ESI-MS m/z: рассчитано для [М+Н]+: 404,0; определено: 404,1.
10а-(4-Хлорфенил)-1-(2-пиридин-2-ил-ацетил)-2,3,10,10а-тетрагидро-1Н-имидазо[1,2-b]изохинолин-5-он
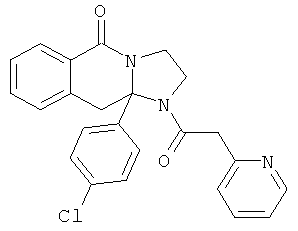
Указанное выше ацилированное производное изохинолина получают Способом F. Пиридин-2-ил-уксусную кислоту предварительно активируют обработкой одним эквивалентом О-бензотриазол-N,N,N',N'-тетраметилуронийгексафторфосфатом в растворе ДМФА/пиридина. Через 10 минут этот раствор добавляют к 10а-(4-хлорфенил)-2,3,10,10а-тетрагидро-1Н-имиазо[1,2-b]изохинолин-5-ону.
Данные 1H ЯМР: (300 МГц, CD2Cl2) δ 3,57 (д, 1Н, J 16,0 Гц), 3,73-3,96 (м, 4Н), 4,04-4,12 (м, 1Н), 4,37-4,45 (м, 1Н), 4,63 (д, 1Н, J 16,0 Гц), 7,16-7,46 (м, 9Н), 7,68 (ддд, 1Н, J 7,7 Гц, 7,7 Гц, 1,8 Гц), 7,92 (дд, 1Н, J 7,7 Гц, 1,8 Гц), 8,52 (д, 1Н, J 4.9 Гц).
Данные ESI-MS m/z: рассчитано для [М+Н]+: 418,0; определено: 418,0.
Способ G
Этот способ является модификацией способа, описанного Coperet, С.et al., J. Org. Chem., 1998, 63, 1740-1741. 30% Пероксид водорода (10 экв.) добавляют к раствору либо соответствующего соединения формулы I или формулы III (1 экв.) и триоксида рения 2,5 мол.% в CH2Cl2 (4× объем раствора пероксида водорода) при температуре окружающей среды. Смесь перемешивают в течение ночи, после чего смесь разбавляют водой и перемешивают еще в течение 30 минут. После этого отделяют CH2Cl2 и водный слой экстрагируют дополнительным количеством CH2Cl2 (2×). Объединенные экстракты сушат и растворитель упаривают в вакууме, что приводит к получению желаемого продукта, который может быть очищен кристаллизацией или хроматографией в случае необходимости.
9а-(4-Хлорфенил)-1-(фуран-3-карбонил)-8-окси-2,3,9,9а-тетрагидро-1Н-1,3а,8-триаза-циклопента[b]нафталин-4-он
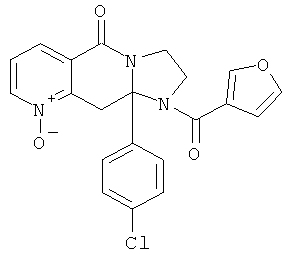
Указанное выше окисленное производное получают способом G из 10а-(4-хлорфенил)-2,3,10,10а-тетрагидро-1Н-имидазо[1,2-b]изохинолин-5-она.
Данные 1Н ЯМР: (300 МГц, d6-ацетон) δ 3,38 (д, 1Н, J 17,8 Гц), 3,93-4,02 (м, 1Н), 4,24-4,35 (м, 2Н), 4,37-4,56 (м, 1Н), 5,46 (д, 1Н, J 17,8 Гц), 6,76-6,77 (м, 1Н), 7,26 (д, 2Н, J 8,7 Гц), 7,35-7,39 (м, 1Н), 7,41 (д, 2Н, J 8,7 Гц), 7,59-7,61 (м, 1Н), 7,64 (д, 1Н, J 7,9 Гц), 8,07-8,08 (м, 1Н), 8,33 (д, 1Н, J 6,5 Гц).
Данные ESI-MS m/z: рассчитано для [М+Н]+: 410,0; определено: 410,0.
Способ Н
Соответствующую ароматическую о-галогенкарбоновую кислоту суспендируют в трет-бутаноле или другом подходящем растворителе вместе с приблизительно 1,5 эквивалентами соответствующего β-дикетона. К этой смеси добавляют приблизительно 0,25 эквивалентов меди, бромида меди (I) или иодида меди (I). Затем суспензию обрабатывают приблизительно 1,6 эквивалентами трет-бутоксида калия или этоксида натрия, запаивают в стойкий к давлению сосуд и нагревают в микроволновом реакторе при перемешивании приблизительно при 180°С в течение приблизительно 1 часа. В качестве альтернативы может быть использован растворитель с достаточно высокой температурой кипения (например, N,N-диметилацетамид) и смесь нагревают при кипячении в открытом сосуде до тех пор, пока не произойдет полное превращение субстрата. Образующуюся смесь разбавляют водой, нейтрализуют водным NH4Cl и экстрагируют подходящим органическим растворителем. Органические экстракты сушат и концентрируют и остаток очищают флэш-хроматографией. Лактонное промежуточное соединение затем гидролизуют обработкой разбавленным водным раствором щелочи с использованием ацетонитрила в качестве сорастворителя.
3-[2-(4-Хлорфенил)-2-оксоэтил]изоникотиновая кислота
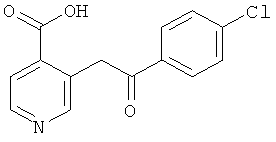
Указанную выше 3-[2-(4-Хлорфенил)-2-оксиэтил]изоникотиновую кислоту получают по Способу Н с использованием 3-хлор-изоникотиновой кислоты и 1,3-бис-(4-хлорфенил)-пропан-1,3-диона.
Данные 1H ЯМР: (300 МГц, d6-ДМСО) δ 4,74 (с, 2Н), 7,62 (д, 2Н, J 8,7 Гц), 7,72 (д, 1Н, J 5,0 Гц), 8,06 (д, 2Н, J 8.7 Гц), 8,51 (с, 1H), 8,57 (д, 1Н, J 5,0 Гц).
Данные ESI-MS m/z: рассчитано для [М+Н]+: 276,0; определено: 276,1.
Способ I
Соответствующее производное ароматической карбоновой кислоты обрабатывают алюминийхлоридом (1-3 эквивалентами) и избытком подходящего ароматического нуклеофила. Смесь охлаждают или нагревают (обычно до 0-90°С) при необходимости и подвергают взаимодействию до тех пор, пока производное карбоновой кислоты в значительной степени не будет израсходовано. Реакционную смесь выливают в ледяную воду и разбавленную HCl. Если твердое вещество осаждается, его можно отфильтровать и промыть. Если твердое вещество не осаждается, смесь экстрагируют этилацетатом или дихлорметаном, сушат над MgSO4 и концентрируют. Продукт может быть дополнительно очищен перекристаллизацией из подходящего растворителя или хроматографией. В некоторых случаях продукт циклизуется с образованием лактона, который может быть подвергнут гидролизу обработкой разбавленным раствором гидроксида с использованием ацетонитрила в качестве сорастворителя.
2-[2-(4-Хлорфенил)-2-оксоэтил]бензойная кислота
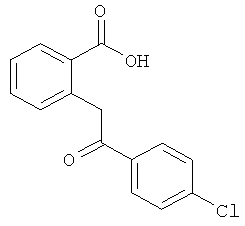
Указанную выше 2-[2-(4-хлорфенил)-2-оксиэтил]бензойную кислоту получали по Способу I, используя гомофталевый ангидрид и хлорбензол. В этом случае было показано, что предпочтительно нагревать реакционную смесь до 85°С в течение 4 часов. Продукт выделяли флэш-хроматографией.
Данные 1H ЯМР: (300 МГц, CDCl3) 4.66 (с, 2Н), 7,26 (д, 1Н, J 7,1 Гц), 7,41 (дд, 1Н, J 7,6 Гц, J 7,6 Гц), 7,45 (д, 2Н, J 8,5 Гц), 7,55 (дд, 1Н, J 7,4 Гц, J 7,5 Гц), 7,96 (д, 2Н, J 8,5 Гц), 8,12(д, 2Н, J 7,8 Гц).
Способ J
Смесь соответствующей 2-метилзамещенной ароматической карбоновой кислоты в ТГФ обрабатывают приблизительно 2-4 эквивалентами литийдиизопропиламида при температуре от -78°С до 0°С. Смесь перемешивают в течение приблизительно 1 часа, в то время как температура повышается до 0°С. Затем смесь охлаждают до -78°С и затем добавляют приблизительно 1,2 эквивалента соответствующего сложного эфира, амида, амида Вайнреба или другого подходящего электрофильного агента. Реакционной смеси дают нагреться до 0°С при перемешивании в течение 2-4 часов и затем дают нагреться до комнатной температуры до того, как вылить в разбавленную водную HCl. Неочищенный продукт собирают фильтрацией и очищают перекристаллизацией или флэш-хроматографией. Если осадок не образуется, раствор экстрагируют подходящим органическим растворителем и органический экстракт сушат и концентрируют. Остаток может быть очищен перекристаллизацией или флэш-хроматографией.
Этот способ является модификацией процедур, описанных Guion, Т.S., et al., 1996, Synth. Communications, 26:1753-1762 и Epsztajn, J., et al., 1992, Synth. Communications, 22:1239-1247.
2-[2-(4-Хлорфенил)-2-оксоэтил]-3-фторбензойная кислота
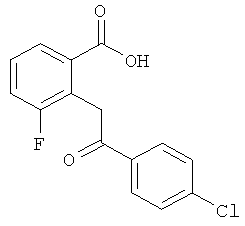
Указанную выше кетокислоту получают по Способу J, используя 3-фтор-2-метилбензойную кислоту и метил-4-хлорбензоат.
Данные 1H ЯМР: (300 МГц, d6-ацетон) δ 4,76 (с, 2Н), 7,33 (м, 1Н), 7,43 (м, 1Н), 7,47 (д, 2Н, J 8,5 Гц), 7,93 (д, 1Н, J 7,7 Гц), 7,98 (д, 2Н, J 8,5 Гц).
Способ К
Соединение формулы II (где Х=O и D представляет собой -[СН2]n-) и каталитическое количество 18-краун-6-эфира суспендируют в ТГФ и охлаждают до -78°С. Добавляют выбранный алкилгалогенид или дигалогенид (приблизительно 3 эквивалента) и затем трет-бутоксид калия. Смесь перемешивают и дают нагреться до комнатной температуры. После завершения реакции смесь охлаждают вновь и гасят насыщенным раствором аммонийхлорида и разбавляют небольшим количеством воды. Органический слой отделяют и водой и промывают насыщенным солевым раствором, сушат над MgSO4 и концентрируют. Остаток может быть очищен перекристаллизацией или флэш-хроматографией.
Этот способы является модификацией процедур, описанных в J.Org. Chem. 1991, 56:7188-7190.
Метиловый эфир 2-[2-(4-хлорфенил)-1,1-диметил-2-оксоэтил]бензойной кислоты
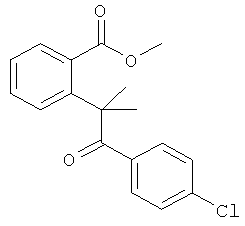
Указанный выше кетоэфир получают по Способу К из 2-[2-(4-хлорфенил)-2-оксиэтил]бензойной кислоты и 3,1 эквивалентов метилиодида.
Данные ESI-MS m/z: рассчитано для [М+Н]+: 317,0; определено: 317,0.
Способ L
Соответствующую 2-формилзамещенную ароматическую карбоновую кислоту и соответствующий α-метиленкетон растворяют или суспендируют в этаноле. Смесь охлаждают до 0°C и температуру поддерживают ниже 5°С, в то время как по каплям прибавляют водный раствор, содержащий приблизительно 1,2 эквивалента 1М гидроксида натрия. Перемешиваемому раствору дают нагреться до температуры окружающей среды. Раствор подкисляют H2SO4, нагревают до 60°С в течение 30 минут и затем фильтруют. Полученный таким образом кетолактон суспендируют в этаноле и гидролизуют, используя водный гидроксид натрия. Затем раствор неочищенного кенона подвергают взаимодействию с водородом в присутствии палладия или активированного угля до тех пор, пока алкен не будет полностью израсходован. Реакционную смесь подкисляют, экстрагируют этилацетатом, сушат над MgSO4 и концентрируют.
2-[3-(4-Хлорфенил)-3-оксопропил]бензойная кислота
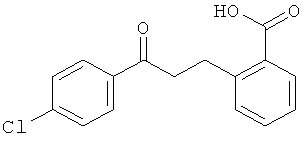
Указанную выше кетокислоту получают по Способу L из 2-формилбензойной кислоты и 1-(4-хлорфенил)этанона.
Данные 1H ЯМР (300 МГц, CDCl3): 3,15-3,50 (М, 4Н), 7,15-7,62 (м, 5Н, перекрывается с CHCl3), 7,74-7,83 (м, 1Н), 7,87-7,98 (м, 2Н)/
Данные ESI-MS m/z: рассчитано для [М+Н]+: 289,0; определено: 288,9/
Способ М
Соответствующее соединение формулы I, которое содержит окисляемую алкиленовую группу, растворяют или суспендируют в дихлорметане и обрабатывают перманганатом калия (5 эквивалентов) и каталитическим количеством 18-краун-6-эфира в дихлорметане и смесь перемешивают при температуре окружающей среды. После предоставления времени (обычно 2-48 часов) для протекания реакции, смесь промывают равным объемом воды приблизительно шесть раз. Затем органический слой сушат (MgSO4) и концентрируют. Остаток может быть очищен флэш-хроматографией. В качестве альтернативы субстрат растворяют или суспендируют в уксусной кислоте и обрабатывают оксидом хрома (VI). После предоставления времени (обычно 2-48 часов) для протекания реакции, смесь разбавляют этилацетатом и промывают несколько раз водой. Затем органический слой сушат (MgSO4) и концентрируют. Неочищенный продукт может быть очищен флэш-хроматографией.
10а'-(4'-Хлорфенил)-1'-(4'-метоксибензоил)-2',3',10',10а'-тетрагиро-1'Н-спиро[циклопропан-(1,10'-имидазо[1,2-b]изохинолин[5]он)]
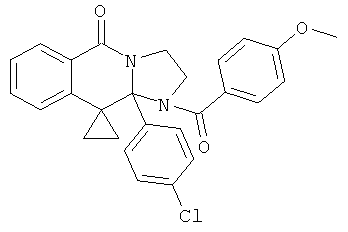
Указанное выше изохинолиновое производное получают по Способу М из 10а'-(4'-хлорфенил)-1'-(4'-метоксибензил)-2',3',10',10а'-тетрагиро-1'Н-спиро[циклопропан-(1,10'-имидазо[1,2-b]изохинолин[5]она) при использовании перманганата калия в дихлорметане и очищают флэш-хроматографией.
Данные 1H ЯМР: (300 МГц, d6-ацетон) δ 0,62 (ддд, 1H, J 10,1, 7,4, 4,5 Гц), 1,61 (ддд, IH, J 10,1, 6,6, 4,5), 2,10-2,19 (м. 2Н), 3,85 (с, 3Н), 3,94-4,14 (м, 3Н), 4,36-4,41 (м, 1H), 6,97 (д, 2Н, J 8,8 Гц), 7,15 (d, 2Н, J 8,8 Гц), 7,26 (тд, 1H, J 7,7, 1,1 Гц), 7,36 (д, 1H, J 7,7 Гц), 7,41 (д, 2Н, J 8,8 Гц), 7,53 (т, 1H, J 7,7 Гц), 7,59 (д, 2Н, J 8,8 Гц), 7,77 (дд, 1H, J 7,7, 1,1 Гц).
Данные ESI-MS: m/z рассчитано для [М+Н]+: 459,0; определено: 459,0.
10а-(4-Хлорфенил)-10,10а-дигидро-1Н-имидазо[1,2-b]изохинолин-2,3,5-трион
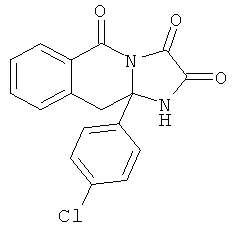
Указанное выше изохинолиновое производное получают по Способу М из 10а-(4-хлорфенил)-2,3,10,10а-тетрагидро-1Н-имидазо[1,2-b] изохинолин-5-она при использовании оксида хрома (VI) в уксусной кислоте.
Данные 1H ЯМР: (300 МГц, d6-ацетон) δ 4,04 (д, 1Н, J 15,7 Гц), 4,31 (д, 1Н, J 15,7 Гц), 7,37 (д, 2Н, J 8,9 Гц), 7,39-7,44 (м, 1Н), 7,48-7,53 (м, 1Н), 7,51 (д, 2Н, J 8,8 Гц), 7,60 (ддд, 1Н, J 7,5 Гц, 7,4 Гц, 1,1 Гц), 7,98 (дд, 1H, J 7,8, 1,1 Гц).
Данные ESI-MS: m/z рассчитано для [М+Н]+: 327,0; определено: 326,9.
Способ N
Выбранное карбонильное соединение растворяют в толуоле или подходящем инертном органическом растворителе и обрабатывают реагентом Лоуссона (приблизительно 1,1 эквивалента). Смесь нагревают при кипячении в течение 24-72 ч. Затем охлажденную смесь несколько раз промывают водой и органическую фазу сушат (MgSO4) и концентрируют. Остаток может быть очищен флэш-хроматографией.
10а-(4-Хлорфенил)-2,3,10,10a-тетрагидро-1Н-имидазо[1,2-b]изохинолин-5-тион
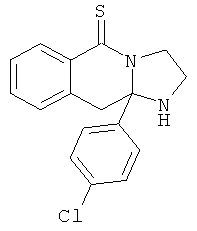
Указанный выше тиоамид получают по Способу N из 10а-(4-хлорфенил)-2,3,10,10а-тетрагидро-1Н-имидазо[1,2-b]изохинолин-5-она.
Данные 1H ЯМР (300 МГц, d6-ацетон) δ 2,68-2,75 (м, 1Н), 3,38-3,42 (м, 1Н), 3,55 (шир с, 2Н), 3,71 (шир с, 1Н), 3,87 (дд, 1Н, J 13,5, 7,7 Гц), 4,05 (ддд, 1Н, J 13,5, 9,7, 8,3 Гц), 7,04 (д, 1Н, J 7,l Гц), 7,22-7,33 (м, 6Н), 8,42 (д, 1Н, J 7,5 Гц).
Данные ESI-MS: m/z рассчитано для [М+Н]+: 315,0; определено: 315,0.
Способ О
Выбранные соединения настоящего изобретения могут быть разделены на индивидуальные стереоизомеры ВЭЖХ при использовании хроматографических колонок с хиральной стационарной фазой. Например, следующие рацемические соединения были разделены на энантиомеры в условиях, подробно описанных ниже.
Колонка: Chiralcel OD-H Column 250×4,6 мм
Длина волны детектора: 254 нм
Разделение соединения 1-019
Мобильная фаза А: Этанол
Скорость истечения: 0,7 мл/мин
Изократическое элюирование: 100% Мобильная Фаза А
Продолжительность эксперимента: 30 мин
Температура колонки: 30°С
Вводимый объем: 20 мкл
Разделение соединений 1-008,1-036 & 1-043
Мобильная фаза А: Гексан
Мобильная фаза В: Этанол
Скорость истечения: 0,7 мл/мин
Рабочее время: 42 мин
Время после окончания работы колонки: 5 мин
Температура колонки: 30°С
Вводимый объем: 20 мкл
Градиентный График:
|
Разделение соединений 1-006, 1-005, 1-029, 1-031, 1-032, 2-02 & 2-06
Мобильная фаза А: Гексан
Мобильная фаза В: Этанол
Скорость истечения: 0,7 мл/мин
Изократическое элюирование: 70% Мобильной фазы А, 30% Мобильной фазы В
Рабочее время: 33 мин
Температура колонки: 30°С
Вводимый объем: 20 мкл
Таблица 1: Разделение энантиомеров с использованием колонки Chiralcel OD-H (условия элюции описаны выше)
|
Понятно, что соединения формулы I, полученные описанными выше способами, когда это нужно, могут быть превращены в дополнительные соединения формулы I при использовании способов, известных в данной области техники. Вышеописанные способы используют для получения соединений, приводимых ниже в Таблице 2 и Таблице 3. Все представленные соединения были получены. Эти соединения охарактеризованы масс-спектрометрией и определенные массы молекулярных ионов указаны в таблицах.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Биологические данные
Способ Р: Протокол противовирусной RSV активности
Проведено испытание соединений настоящего изобретения на их противовирусную активность против респираторно-синцитиального вируса. Определения цитопатического действия (CPE) проводят, главным образом, как описано в литературе (смотри, например, Watanabe et al, 1994, J.Virological Methods, 48:257). Последовательные разведения контрольных образцов проводят в 96-луночном планшете. Клетки НЕр2 (1,0×104 клеток/лунка) инфицируют RSV при низкой множественности заражения (например, RSV А2 при множественности заражения, равной ~0,01) и добавляют к планшетам для того, чтобы оценить противовирусную активность. Неинфицированные клетки НЕр2 используют для того, чтобы оценить цитотоксичность данного соединения. Пробы инкубируют в течение 5 дней при 37°С на воздухе, содержащем 5% CO2. Степень СРЕ определяют по метаболизму жизненно важного красителя 3-(4,5-диметилтиаксол-2-ил)-2,5-дифенилтетразолийбромида (МТТ). МТТ (1 мг/мл) добавляют к каждой лунке и планшеты инкубируют в течение 2 часов инкубации при 37°С. Из лунок удаляют жидкость, добавляют изо-пропанол (200 мкл) и определяют поглощение при 540/690 нм. Концентрации соединения, которые ингибируют СРЕ на 50% (ЕС50) и проявляют цитотоксичность (СС50), определяют с использованием нелинейного регрессионного анализа.
Типичные данные для соединений настоящего изобретения, обладающих противовирусной активностью против RSV А2, представлены в Таблицах 4 и 5, где значения ЕС50 находятся в интервалах А: <0,25 мкМ, В: 0,25-1,0 мкМ, С: 1,0-5,0 мкМ и D: >5,0 мкМ.
|
|
Способ Q: Определение слияния RSV
Выбранные соединений настоящего изобретения могут быть испытаны на их способность ингибировать важные процессы слияния респираторно-синцитиальных вирусов.
Формирование конструкций RSV-F
Олигонуклеотиды одноцепочечной синтетической ДНК, кодирующие участки гликопротеина RSV A2 F, содержащего оптимальные кодоны и без потенциального поли (А) присоединения или сайтов сплайсинга, образуются синтетическим путем (Mason et al, W00242326). Мембраносвязанный первичный продукт трансляции F в основном образуется по способу, описанному в данном контексте и в Morton et al.
Определение образования синцития
Активность слияния конструкций RSV-F определяют в 293 клетках, главным образом, способом, описанным Morton et al, 2003, Virology, 311:275. Например: шесть лунок планшета при приблизительно 80%-ном слиянии трансфицируют добавлением плазмиды ДНК (2 мкг/лунку), поддерживающей интересующую нас конструкцию в растворе CaPO4 в течение 4 часов. После глицеринового шока и промывания трансфицированные клетки подвергают трипсинолизу и добавляют 1,5×104 клеток/лунку в 96-луночном планшете, содержащем испытуемые вещества с полулогарифмическим последовательным разведением. Образование синцития обнаруживают визуальным наблюдением и количественно определяют путем 48-часовой пост-трансфекцией при добавлении 20 мкл CellTiter 96 One Solution (Promega) с последующей инкубацией в течение 4 часов при 37°С. Затем цветную реакцию останавливают добавлением 25 мкл 10%-ного ДДС (SDS) в каждую лунку и определяют поглощение при 540/690 нм. Концентрацию соединения, которое снижает значение поглощения относительно необработанных контрольных культур на 50% (ЕС50), рассчитывают, используя нелинейный регрессионный анализ.
Способ R: Модель с использованием RSV хлопкового хомяка
Модель с использованием хлопкового хомяка используют в основном так, как описано в литературе (Wyde et al, 2003, Antiviral Res., 60:221). Вкратце, хлопковые хомяки весом 50-100 г слегка анестезируют изофураном и дают дозу лекарства, соответствующую введению 100 мг/кг/день соединения или контрольного плацебо. Вирусная инфекция наступает через 2 часа после воздействия у мышей, анестезированных подобным образом, при интраназальном введении по каплям при приблизительно 1000 TCID50 RSV A2 на животное. Через четыре дня после заражения вирусом каждого хлопкового хомяка умерщвляют и удаляют легкие и определяют титры RSV реакцией розеткообразования.
Способ S: Модель с использованием RSV Balb/c мышей
Модель с использованием мышей используют в основном так, как описано Cianci et al., 2004, Antimicrobial Agents and Chemotherapy, 48:413). Вкратце, старых восьминедельных самок Balb/c мышей взвешивают, анестезируют внутрибрюшинно Avertin™ и соединением или плацебо, вводимыми перорально за 6 часов до инфицирования. Мышей заражают внутриназально приблизительно 10000 TCID50 RSV A2 на животное. Через три дня после заражения вирусом каждую мышь умерщвляют, удаляют ее легкие и определяют титры RSV реакцией розеткообразования.