Результат интеллектуальной деятельности: СПОСОБ ОЦЕНКИ МОРФОФУНКЦИОНАЛЬНОГО СТАТУСА ТРОМБОЦИТОВ ЧЕЛОВЕКА
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно производственной и клинической трансфузиологии, и может быть использовано для оценки качества тромбоцитов и эффективности их применения в клинической практике при лечении больных с неотложными состояниями.
Тромбоциты предупреждают и прекращают кровотечения и кровоточивость, связанные с их недостатком в циркулирующей крови (тромбоцитопения) или с их функциональной неполноценностью (тромбоцитопатия). Определены показания к переливанию концентрата тромбоцитов (КТ): спонтанная мелкоточечная кровоточивость или локальные кровотечения при уровне тромбоцитов менее 20·109/л, обусловленном депрессией кроветворения; гипокоагуляционная фаза ДВС синдрома; острая массивная кровопотеря, сопровождающаяся снижением уровня тромбоцитов менее 100·109/л [Инструкция по применению компонентов крови, утверждена приказом Минздрава РФ №363 от 25.11.2002]. Биологическая полноценность и функциональная активность клеток, используемых в клинической практике, определяют проведение обоснованной компенсации нарушений в системе клеточного гомеостаза и лечебную эффективность [Приложение 1 к «ТЕХНИЧЕСКОМУ РЕГЛАМЕНТУ О ТРЕБОВАНИЯХ БЕЗОПАСНОСТИ КРОВИ, ЕЕ ПРОДУКТОВ, КРОВЕЗАМЕЩАЮЩИХ РАСТВОРОВ И ТЕХНИЧЕСКИХ СРЕДСТВ, ИСПОЛЬЗУЕМЫХ В ТРАНСФУЗИОННО-ИНФУЗИОННОЙ ТЕРАПИИ», постановление правительства РФ №29 от 26.01.2010 года, таблица 1]. Анализ показывает, что в представленных показателях нет данных, регламентирующих биологическую полноценность и функциональную активность тромбоцитов. Следовательно, требуется разработка и внедрение адекватной оценки функциональной активности тромбоцитов, используемых в клинической практике.
|
Тромбоцит рассматривают как клетку с полифункциональной активностью - коагулологическая, ангиотрофическая и эндотелиальноподдерживающая, транспортная, рост стимулирующая функции, участие в воспалении, репарации и регенерации [Мининкова А.И. СТРУКТУРА И ФУНКЦИИ ТРОМБОЦИТОВ (ОБЗОР ЛИТЕРАТУРЫ). I ЧАСТЬ; ИССЛЕДОВАНИЕ ТРОМБОЦИТОВ МЕТОДОМ ПРОТОЧНОЙ ДИТОФЛЮОРИМЕТРИИ (ОБЗОР ЛИТЕРАТУРЫ). II ЧАСТЬ. Клиническая лабораторная диагностика, 2010, №11, с.21-26; 2011, №4, с.25-30; Шитикова А.С. Тромбоцитарный гемостаз. СПб. ГМУ, 2000, 227 с.; Долгов В.В., Свирин П.В. Лабораторная диагностика нарушений гемостаза. - М.-Тверь, «Триада», 2005, 227 с.]. Морфологически в тромбоцитах выделяют четыре зоны: 1-я - надмембранный слой (гликокаликс); 2-я - мембрана, 3-я зона - матрикс или гель-зона: 4-я - зона органелл, содержащая в высоких концентрациях гранулы с биологически активными веществами, синтезируемые и выделяемые тромбоцитами (таблица 2).
|
Следовательно, морфологическое исследование фракции плотных гранул, фракции α-гранул, фракции лизосом и пузырьков тромбоцитов человека позволяет адекватно оценить их морфофункциональный статус. Значимость такого подхода эффективна при диагностике различных типов тромбоцитопатий [Amy D. Shapiro Platelet Function Disorders. Treatment of Hemophilia Monograph Series, Number 19. World Federation of Hemophilia: 1999]. Таким образом, исследование гранул тромбоцитов может служить интегральным параметром оценки их функции.
Исследование морфологии тромбоцитов с помощью электронной и атомно-силовой микроскопии имеет ряд существенных недостатков: высокая стоимость оборудования, трудоемкость и длительность подготовки и фиксация образцов препятствуют активному использованию метода в целях клинической диагностики [Донников М.Ю., Орлов С.А., Зиновьева А.В. КАЧЕСТВЕННАЯ ОЦЕНКА МОРФОФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ТРОМБОЦИТОВ ПО ДАННЫМ АТОМНО-СИЛОВОЙ МИКРОСКОПИИ. Клиническая лабораторная диагностика, 2009, №8, с.30-32].
Прототип - оценка функциональной полноценности концентрата живых тромбоцитов с помощью метода витальной компьютерной морфометрии на основе отечественного фазово-интерференционного микроскопа «Цитоскан». Из локтевой вены осуществляют забор крови в объеме 1,0 мл в стандартную пробирку из ареактивного пластика с антикоагулянтом (ЭДТА). Исследуют тромбоциты в капле плазмы, обогащенной тромбоцитами, для получения которой кровь центрифугируют при 1000 об/мин в течение 5 минут. Алгоритм морфометрии обеспечивает автоматическое определение заданных размерных параметров отдельных клеток (диаметр, периметр, высота, площадь, объем), подсчет процента активированных тромбоцитов, статистическую обработку данных на популяционном уровне и документирование результатов в виде цитограмм. Уровень функциональной активности тромбоцитов определяли на основании подсчета различных морфологических типов. Подавляющее большинство тромбоцитов представлено плоскими, округлыми клетками с гладкой или складчатой поверхностью - «гладкие» и «рифленые» дискоциты, идентифицируемые как клетки «покоя» (1-й морфологический тип). Ко 2-му типу тромбоцитов были отнесены дискоидные клетки округлой, неправильной формы с гладкой или складчатой поверхностью и одним-тремя короткими (меньше диаметра клетки) отростками-псевдоподиями, являющимися выростами поверхностной мембраны - тромбоциты с низким уровнем активности. Клетки, имеющие от двух до пяти длинных (больше диаметра клетки) отростков-«антенн», отнесены к 3-му типу и отличались большим многообразием форм: от плоских дисков до неправильной причудливой формы - высокоактивированные тромбоциты. Тромбоциты неправильной формы с неровной бугристой поверхностью, большим количеством отростков различной длины и многочисленными вакуолями были отнесены к 4-му морфологическому типу - дегенеративно-измененным клеткам, практически исчерпавшим свой функциональный резерв. Распределение морфологических типов клеток в концентрате тромбоцитов (КТ) оказалось 56,7%; 26,2%; 14,1%; 3,0%. В крови соматически здоровых людей соотношение морфологических типов клеток составляет - 64, 21, 12 и 3% соответственно. Метод позволяет исследовать живые нативные тромбоциты, не подвергавшихся предварительной обработке или фиксации [прототип - Колосова Е.Н., Василенко И.А., Ковалева Л.Г. Оценка морфофункционального состояния тромбоцитов у больных идиопатической тромбоцитопеничской пурпурой методом витальной компьютерной морфометрии. Бюллетень СО РАМН, 2011, 31, №2, с.58-63]. Недостатками данного метода являются: необходимость получения плазмы, богатой тромбоцитами; предлагаемый алгоритм морфометрии клеток (диаметр, периметр, высота, площадь, объем) не позволяет оценить целостность внутреннего состава исследуемых тромбоцитов; отсутствие адекватного анализа высокой и низкой функциональной активностью среди дисковидных тромбоцитов; использование дорогостоящей уникальной микроскопической аппаратуры. Итак, предлагаемый биофизический метод не отражает структурно-функциональную целостность тромбоцитов. Следовательно, для оценки клетки как единого целого необходимо использовать методы, витального окрашивания тромбоцитов, позволяющие оценить функциональную активность живых клеток [Pollard M.D., Earnshaw W.C. Cell Biology // - Elsivier Science, 2007, 928 с.].
Достигаемым техническим результатом является объективная оценка морфофункционального статуса тромбоцитов человека за счет учета данных, полученных путем исследования витально окрашенных клеток во флуоресцентном микроскопе.
Значительную часть цитоплазмы тромбоцита составляют везикулы (гранулы) с различными секреторными веществами [Хэм А., Кормак Д. Гистология / Пер. с англ. // М.: Мир, 1983]. При различных заболеваниях увеличивается доля тромбоцитов, не содержащих гранул: такие клетки обладают сниженной функциональной активностью или являются дегенеративными [Walker HK, Hall WD, Hurst JW Clinical Methods: The History, Physical, and Laboratory Examinations. 3rd edition. // Boston: Butter-worth's; 1990]. Следовательно, наличие в тромбоците гранул, а также их количество можно рассматривать в качестве критериев жизнеспособности и функциональной активности клеток. Известно, что часть тромбоцитарных гранул обладает сродством к акридиновым красителям - в частности, к акридиновому оранжевому. Флуорохром акридиновый оранжевый (АО) широко используется в клеточной биологии, в том числе и для прижизненных исследований. Другой акридиновый краситель - трипафлавин - обладает способностью прижизненно окрашивать мембранные компоненты клеток, т.е. с помощью этого флуорохрома возможно окрасить цитоплазму нефиксированных тромбоцитов. Таким образом, имеются весомые основания полагать, что прижизненный краситель на основе этих флуорохромов (трипафлавина и АО) позволит выявить цитоплазму нефиксированных тромбоцитов и гранулы в их составе. Для дифференциального прижизненного окрашивания тромбоцитов нами предложен краситель, изготовленный на основе 2-х флуорохромов - трипафлавина и акридинового оранжевого. В нефиксированных тромбоцитах после окрашивания отчетливо выявляются гранулы, имеющие характерное красное свечение во флуоресцентном микроскопе, при этом контуры тромбоцитов четко различимы.
Изготовление красителя. Смесь трипафлавина и акридинового оранжевого готовят на 0,15 М фосфатном буфере Зеренсена (рН 7.3). Для получения 100 мл 0,15 М этого буфера смешивают 23 мл 0,15 М NaH2PO4·Н2О (18,38 г в 1000 мл диет H2O) и 77 мл 0.15 М Na2HPO4 (18.92 г в 1000 мл дист. Н2О).
Приготовление красителя состоит из двух этапов. На первом этапе готовят концентрированные растворы трипафлавина (раствор А) и акридинового оранжевого (Раствор Б): Раствор А - трипафлавин разводят 0.15 М буфером Зеренсена в соотношении 1:2000-1:5000. Необходимо добиться полного растворения кристаллов трипафлавина. Раствор Б - акридиновый оранжевый разводят 0.15 М буфером Зеренсена в соотношении 1:1500-5000. Затем оба красителя смешивают в соотношении 1:1, получают рабочий раствор. Прижизненную окраску тромбоцитов можно производить как в пробирке, так и на предметном стекле. Тромбоциты крови, плазма обогащенная тромбоцитами, тромбоконцентрат заготавливали на соответствующем антикоагулянте. Соотношение крови и антикоагулянта (CPD) составляло 7:1; соотношение плазмы, обогащенной тромбоцитами, и антикоагулянта (ACD-A) - 16:1; соотношение тромбоцонцентрата, полученного методом афереза, и антикоагулянта (Haemonetics) - 12:1 [Инструкция Министерства здравоохранения РФ по заготовке и консервированию донорской крови от 29.05.1995 г., новая редакция от 08.09.1999 г.].
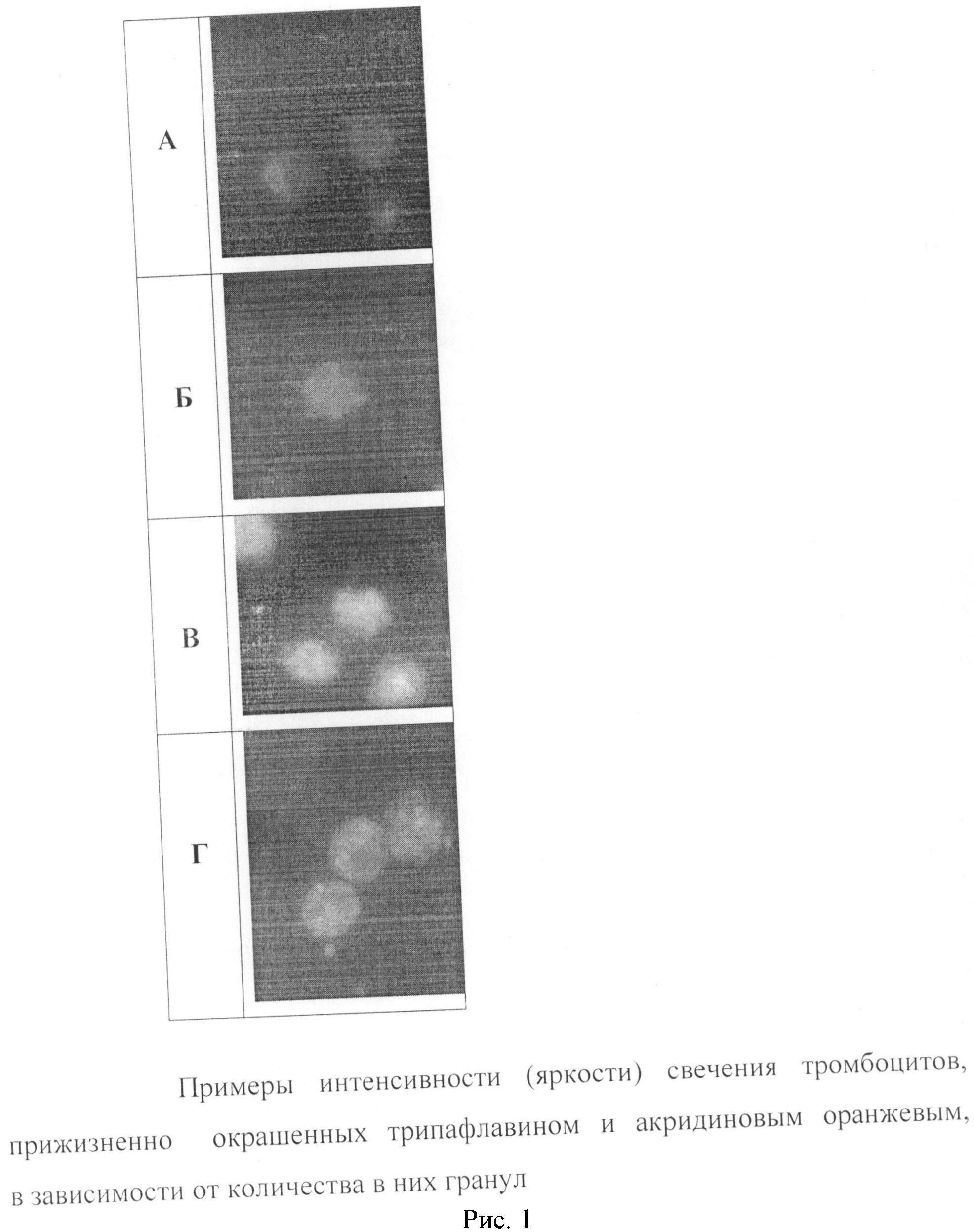
В пробирке смешивают 10-20 мкл анализируемого образца и 10-20 мкл рабочего раствора красителя. Окрашивание проводят в течение 5-10 минут. Затем пипеткой отбирают 10-15 мкл смеси, переносят на предметное стекло и накрывают покровным стеклом. Оценку прижизненно окрашенных тромбоцитов проводят с помощью флуоресцентного микроскопа (объектив ×100, числовая апертура 1.25, λ возбуждения 450-490 нм, λ эмиссии - от 520 нм) в полуавтоматическом режиме. С помощью цифровой фотокамеры при экспозиции 0.25-0.5 сек получают цифровые изображения тромбоцитов и переносят в компьютер. Для морфометрического исследования тромбоцитов используют программу Adobe Photoshop. Анализ характера и интенсивности свечения прижизненно окрашенных тромбоцитов можно наблюдать в течение длительного времени (24-48 часов). При этом среди пула анализируемых тромбоцитов отчетливо выявляются клетки с гранулами и клетки без гранул (рисунок 1. Обозначения: А) клетки без гранул; Б) клетка содержат 2 гранулы; В) клетки содержат от 3 до 7 гранул; Г) клетки содержат более 10 гранул). Подчеркнем, что интенсивность свечения тромбоцитов зависит от количества в них гранул и существенно выше интенсивности свечения клеток без гранул (таблица 3). Тромбоциты с гранулами содержат от 3 до 15 визуально различимых везикул диаметром 300-600 нм, которые распределены по всему объему клетки и интенсивно окрашиваются также на Са2+ и серотонин. Тромбоциты без гранул не содержат везикул диаметром 300-600 нм или содержат 1-2 меньших размеров гранулы, которые всегда связаны с клеточной оболочкой и практически не окрашиваются на Са2+ и серотонин. Тромбоциты, прижизненно окрашенные трипафлавином и акридиновым оранжевым, сохраняют свою адгезивную и агрегационную активность, которая зависит от количества тромбоцитов, содержащих более 3 гранул (таблица 4). Кроме того, в экспериментах показано, что как неокрашенные, так и окрашенные флуохромами тромбоциты после их активации кальцием проявляют ростстимулирующее действие в культуре фибробластов человека.
Таким образом, прижизненно окрашенные трипафлавином и акридиновым оранжевым тромбоциты человека полностью сохраняют свою функциональную активность. Результаты этих исследований обосновывают возможность оценки морфофункциональной активности этих клеток.
|
|
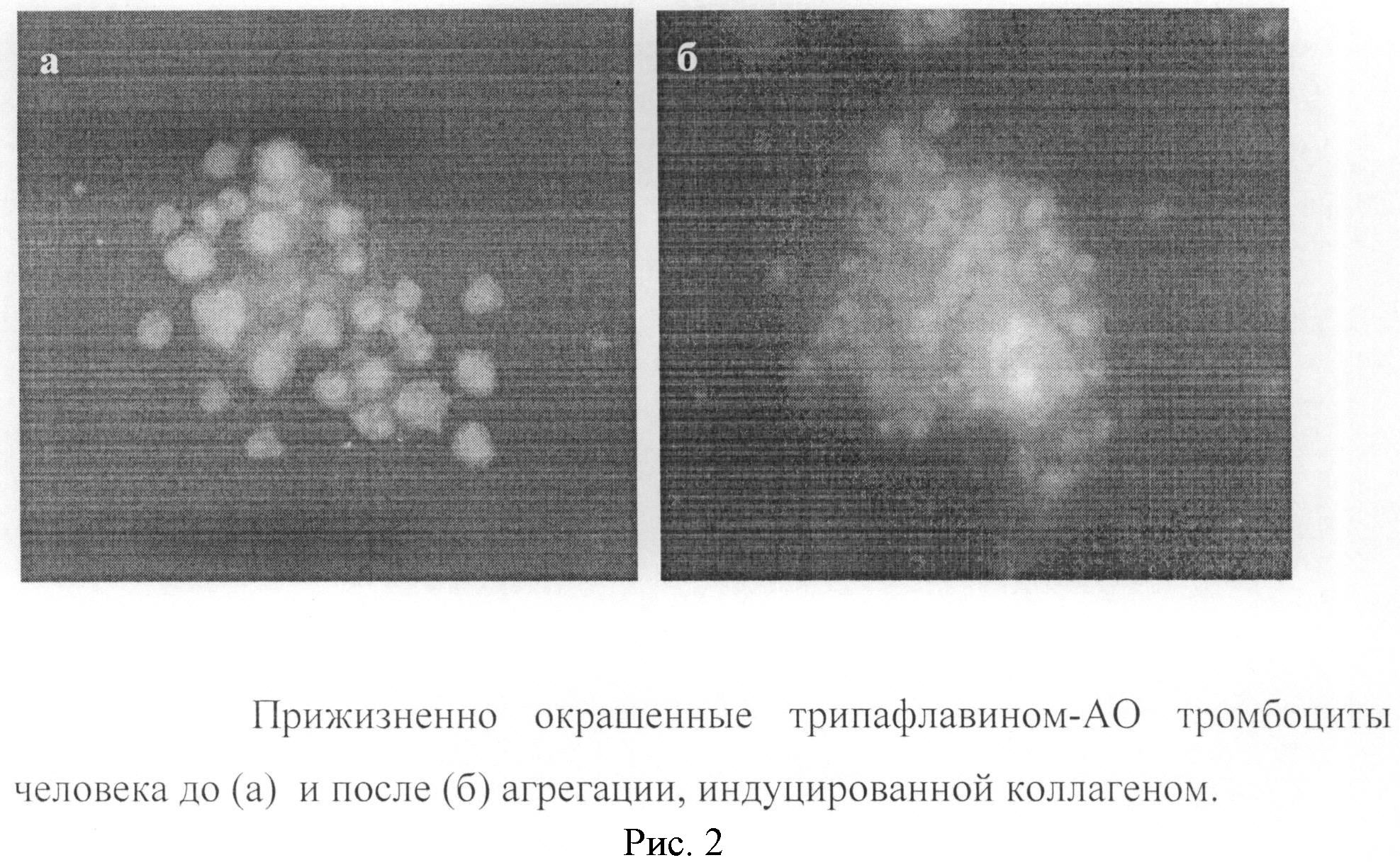
Установлено, что прижизненно окрашенные тромбоциты после воздействия индуктором агрегации (коллаген) образуют тесное скопление клеток (агрегатов), которые не содержат гранул (рис 2.). Следовательно, отсутствие или уменьшение количества тромбоцитов с гранулами указывает на прошедший процесс активирования клеток в анализируемой популяции. Эти клетки либо потеряли, либо снизили свой функциональный потенциал. Клиническая эффективность трансфузии такой популяции тромбоцитов для коррекции система гемостаза у больных не высока или отсутствует. С другой стороны, выявление популяции тромбоцитов без или с повышенным количеством гранул в крови имеет большое диагностическое значение. Такая информация указывает на активацию (возможность тромбообразования) или подавления (возможность кровотечения) системы гемостаза и обосновывает необходимость проведения соответствующей коррекции у больного.
Единицы оценки качества тромбоцитов.
1. Концентрация тромбоцитов (Стр) в анализируемом образце (тыс/мкл) (определяют с помощью гематологического анализатора).
2. Относительное содержание тромбоцитов с гранулами (Dтр.гр), выражают в %. При большом увеличении (объектив ×100) оценивают от 150 до 200 прижизненно окрашенных клеток и регистрируют количество тромбоцитов, содержащих более 3 гранул в цитоплазме, и выражают в %. Например, при исследовании 150 тромбоцитов 85 клеток содержали гранулы. Относительное содержание тромбоцитов с гранулами (Dт.гр) равна 85:150×100-56,5%.
Относительное содержание тромбоцитов без гранул (Dтр.безгр.) рассчитывают по формуле Dтр.безгр.=100%-Dт.гр., или 100,0%-56,5%=43,5%.
3. Концентрация тромбоцитов с гранулами (Cтр.гр) в анализируемом образце (тыс/мкл). Определяется по формуле - Стр.гр=Стр×Dтр.гр, т.е.количество тромбоцитов в образце (тыс/мкл) × долю тромбоцитов с гранулами (100%=1,0; 25%=0,25; 50%=0,5; 75%=0.75 и т.д.)
Например, при исследовании концентрата тромбоцитов количество клеток составило 2000 тыс/мкл, а доля тромбоцитов с гранулами составила 69,3% или в доле 0,693. Количество тромбоцитов с гранулами в концентрате тромбоцитов равнялось 2000 тыс/мкл×0,693=1386 тыс/мкл.
4. Морфофункциональная активность тромбоцита (МФАТ) в популяции анализируемого образца крови, плазмы, обогащенной тромбоцитами, тромбоцитном концентрате. Измеряют яркость свечения от 100 до 200 витально окрашенных трипафлавином-АО клеток, рассчитывают среднюю величину интенсивности свечения тромбоцита. Единицу яркости свечения выражают в фут-канделах на 1 клетку или в баллах. 1 фут-кандел эквивалентен 1 баллу [Поликарпов И.А., Эрлихман В.Д. Photoshop 4, изучение на примерах, Харьков, Омега, 1997; 415 с.]. МФАТ или удельная яркость свечения тромбоцита = ∑ свечений обследованных тромбоцитов делят на количество обследованных тромбоцитов.
По сумме морфофункциональной и адгезивной активностей, выраженных в баллах, оценивают морфофункциональный статус тромбоцитов (МФСТ), который при 80-130 баллах считают нормальным, при 60-79 баллах - сниженным, при 41-59 баллах - низким, при менее чем 40 баллах - очень низким, при 131-150 баллах - высоким, при 151-170 баллах - очень высоким.
Пример 1. При исследовании популяции из 100 тромбоцитов 72 клетки (72% или 0,72) содержали более трех гранул и 28 клеток (28% или 0,28) не содержали гранул. Яркость свечения клеток с гранулами ваьировала от 60 до 70, составляя в среднем 66,3 фут-кандел на 1 тромбоцит; яркость свечения клеток без гранул - варьировала от 10 до 30, составляя в среднем 17,7 фут-кандел на 1 тромбоцит. Расчет морфофункциональной активности тромбоцитов анализируемой популяции:
МФАТ = 66,3×0.72+17.7×0,28=47,7+5,0=52,7 фут-кандел на 1 клетку или 52.7 балла
Пример 2. При исследовании популяции из 200 тромбоцитов 40 клеток (20% или 0,2) содержали более трех гранул и 160 клеток (80% или 0,8) не содержали гранул. Яркость клеток с гранулами варьировала от 25 до 40, составляя в среднем 33,1 фут-кандел на 1 тромбоцит, яркость клеток без гранул - варьировала от 5 до 20, составляя в среднем 12,7 фут-кандел на 1 тромбоцит. Расчет морфофункциональной активности тромбоцитов анализируемой популяции:
МФАТ = 33,7×0.20+12.7×0,80=6,7+10,2=16,9 фут-кандел на 1 клетку или 16,9 балла.
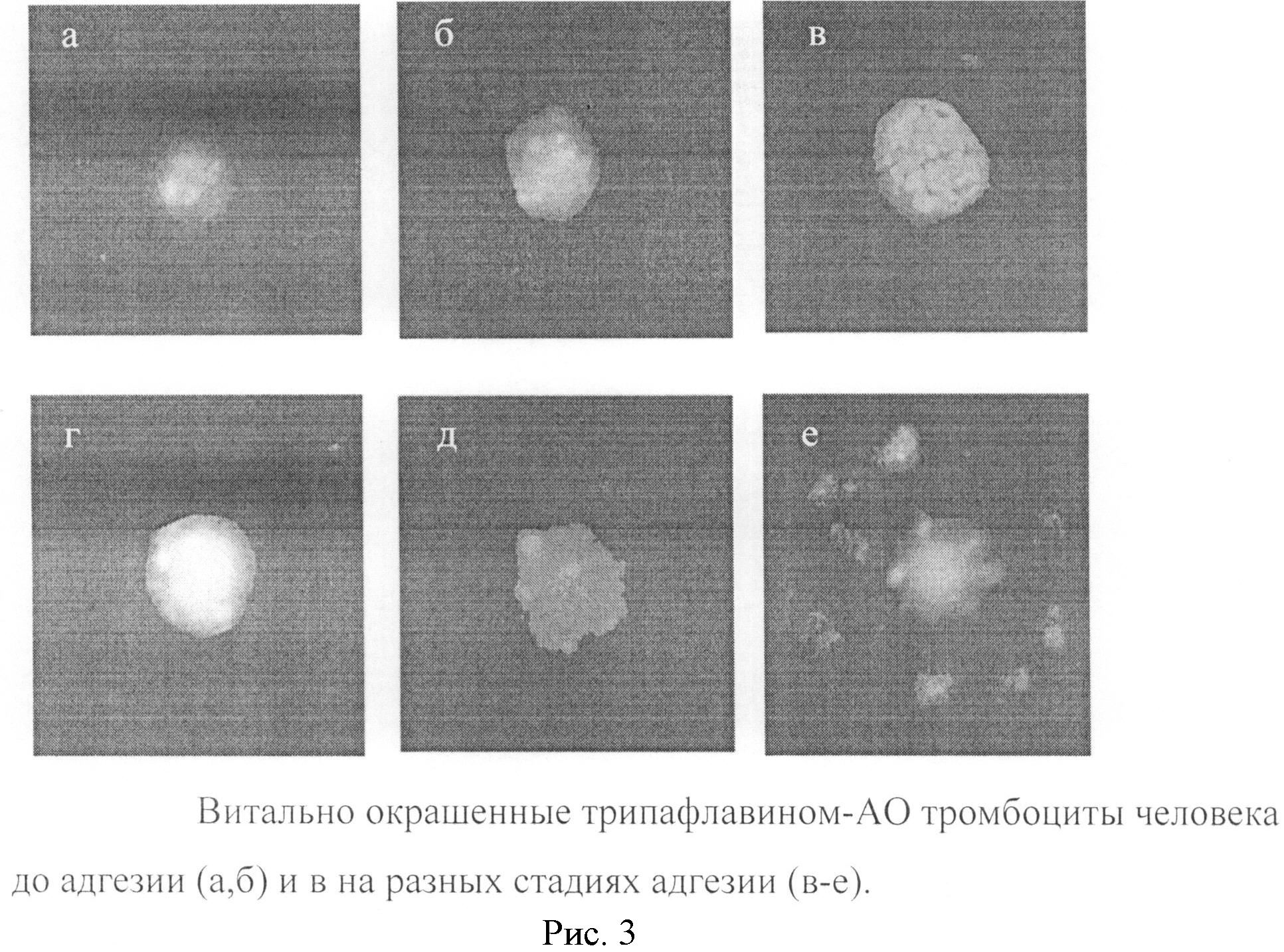
5. Адгезивная активность тромбоцитов (ААТ) на стекле морфологический анализ. Препарат с прижизненно окрашенными трипафлавином-АО клетками на стекле помещают на 10-15 мин в термостат при 37°С, затем с помощью флуоресцентного микроскопа определяют количество адгезировавших тромбоцитов в расчете на 100 или 150 анализируемых клеток. Адгезировавшие тромбоциты представляют собой большие распластанные клетки овальной или округлой формы (их диаметр в 2-3 раза больше диаметра исходных неадгезировавших тромбоцитов), в которых гранулы распределены по периферии клетки вблизи ее границ или уже выходят за пределы клетки (рис.3). Адгезивная активность выражают в % адгезировавших тромбоцитов к общему числу обследованных тромбоцитов или в баллах. 1% адгезивной активности равен 1 баллу.
Например, при исследовании 150 витально окрашенных тромбоцитов отмечено 95 больших распластанных по стеклу клеток. Адгезивная активность тромбоцитов (ААТ) равна 95:150×100=63,3% или 63,3 балла.
6. Морфофункциональный статус тромбоцитов (МФСТ). Расчет этого показателя осуществляют по формуле МФСТ=МФАТ+ААТ и выражают в баллах.
Проведена оценка качества тромбоцитов в крови, ее компонентах (плазма, обогащенная тромбоцитами, концентрат тромбоцитов) у доноров и больных по 6 предложенным параметрам (таблица 5).
У доноров крови концентрация тромбоцитов (Стр) варьировала от 180 до 320 тыс/мкл, относительное содержание тромбоцитов с гранулами (Dтр.гр) - от 35 до 80%, концентрация тромбоцитов с гранулами (Стр.гр) - от 60 до 180 тыс/мкл, морфофункциональная активность тромбоцитов (МФАТ)- от 37 до 57 фут-кандел/клетку или 37-57 баллов; адгезивная активность тромбоцитов (ААТ) на стекле (морфологический анализ) - от 40 до 70% и или 40-70 баллов: морфофункциональнальный статус тромбоцитов (МФСТ) - от 77 до 127 баллов.
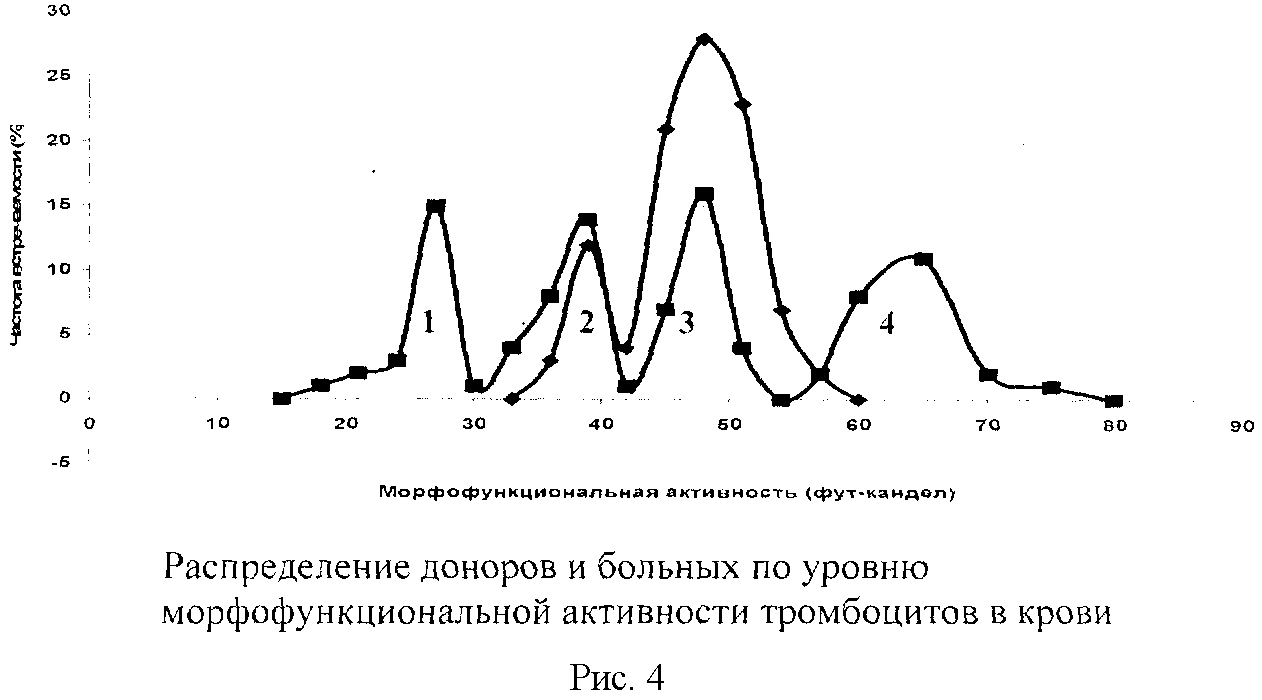
Проведен анализ распределения тромбоцитов крови доноров по морфофункциональной активности (МФАТ). Выявлено три популяции клеток: основная - 82% клеток (МФАТ - 42-55 фут-кандел/тромбоцит или 42-55 баллов); с пониженной активностью клеток - 16% (МФАТ - 37-40 фут-кандел/тромбоцит или 37-40 баллов) и умеренно повышенной активностью - 2% (МФТА - 57-60 фут-кандел/тромбоцит или 57-60 баллов). С учетом этих данных представлен анализ распределения тромбоцитов в крови у 4 группы больных с различными заболеваниями (Рис.4. На абсциссе МФАТ в фут-канделах на клетку или баллах). Больные с травмой конечностей (группа №3) по 6 анализируемым параметрам качества тромбоцитов соответствовали таковым у доноров. Больные с экзогенными отравлениями (группа №2) имели снижение морфофункциональной активности клеток - МФАТ варьировала от 32 до 42 фут-кандел/тромбоцит или 32-42 балла, подавление адгезивной активности клеток (ААТ), которая варьировала от 10 до 45% или 10-45 баллов и уменьшение морфофункционального статуса тромбоцитов (МФСТ) - 40-87 баллов.
|
У гематологических больных с геморрагическим синдромом (группа №1) морфофункциональная активность была крайне подавлена, что привело к угнетению клеточного звена системы гемостаза и развитию геморрагического синдрома. С другой стороны, у больных с тромбоэмболиболическими осложнениями (группа 4) имела место резкая активация системы клеточного звена гемостаза, что проявлялось в резком увеличении концентрации тромбоцитов, содержащих гранулы (до 700 тыс/мкл), МФАК была максимальной - 65-80 фут-кандел на клетку или 65-80 баллов, адгезивная активность составляла 80-90% или 80-90 баллов.
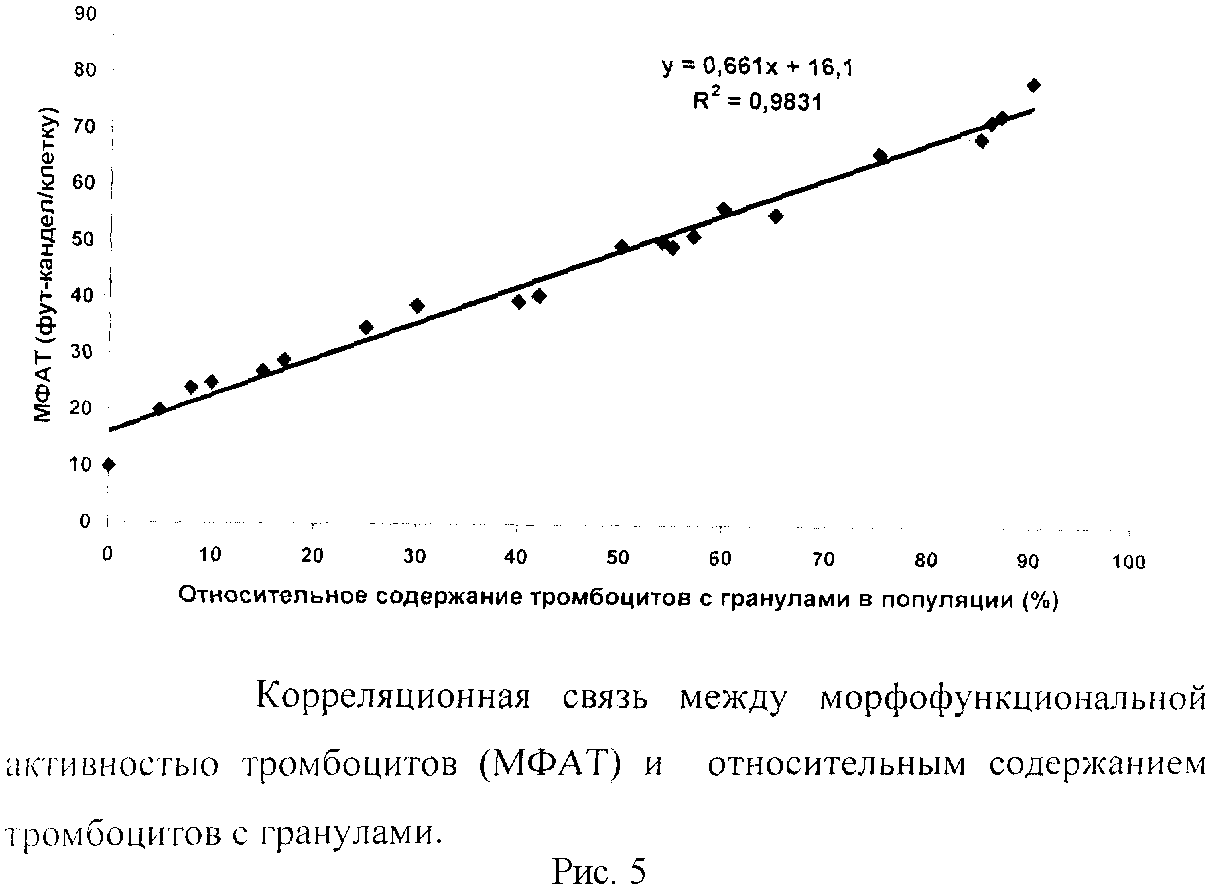
Апробация предложенного способа оценки морфофункционального статуса тромбоцитов в клинической практике выявила тесную взаимосвязь МФАТ с относительным содержанием тромбоцитов с гранулами (рис.5).
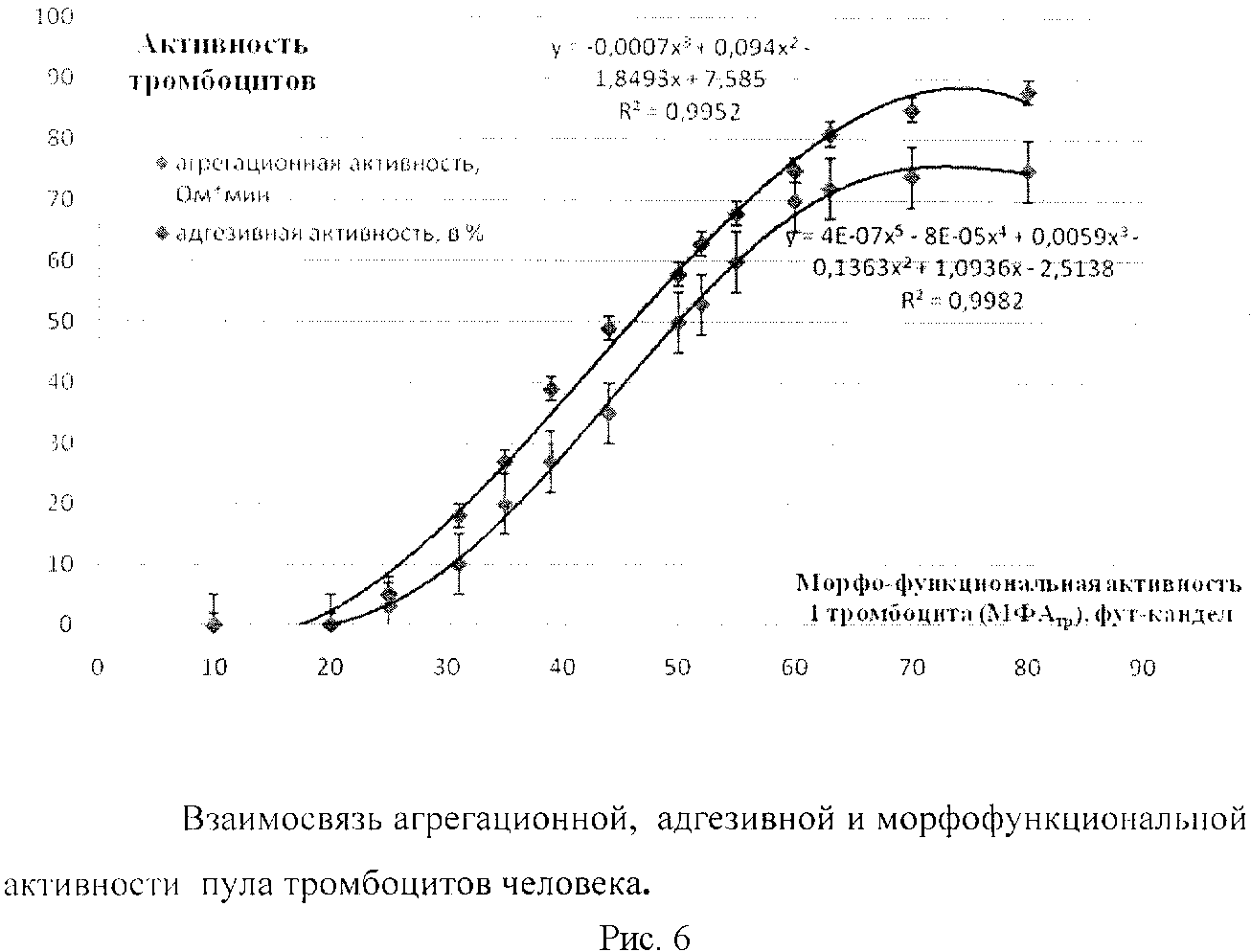
Обоснованность и достоверность предложенного способ оценки морфофункционального статуса тромбоцитов человека подтверждена корреляционным и математическим анализом тесной взаимосвязи агрегационной, адгезивной и морфофункциональной активности анализируемых тромбоцитов человека (рис.6.)
Для лучшего понимания предложенного «Способа оценки морфофункционального статуса тромбоцитов человека» приводим несколько конкретных примеров:
№1а Методом афереза от донора получен тромбоцитный концентрат в объеме 100 мл. Проведена оценка морфофункционального статуса тромбоцитов предлагаемым способом.
№1б Тот же тромбоцитный концентрат в объеме 100 мл на 5 сутки хранения при комнатной температуре. Проведена оценка морфофункционального статуса тромбоцитов предлагаемым способом. Результаты исследования отражены в таблице 6.
|
Пример 2. Б-й М., возраст 32 года. Диагноз: острый миелоидный лейкоз, выраженный геморрагический синдром 1-й степени (на коже). Проведена оценка морфофункционального статуса тромбоцитов крови предлагаемым способом. Получены следующие результаты
1. Концентрация тромбоцитов (Стр) - 14 тыс/мкл, или 14×109/л, или 14 млрд клеток в л.
2. Относительное содержание тромбоцитов с гранулами (Dтр.гр) - 5%.
3. Концентрация тромбоцитов с гранулами (Стр.гр) - 0.7 тыс/мкл или 0,7 млрд/л.
4. Морфофункциональная активность тромбоцитов (МФАТ) - 10 фут-кандел/клетку или 10 баллов.
5. Адгезивная активность тромбоцитов (ААТ) на стекле (морфологический анализ) - от 0% или 0 баллов.
6. Морфофункциональнальный статус тромбоцитов (МФСТ) - 10+0=10 баллов.
Заключение: тромбоциты крови имеют очень низкий морфофункциональный статус, что может привести к развитию клинических осложнений в виде геморрагического синдрома.
Пример 3. Больной К., диагноз - тромбоз сосудов печени, тромбоцитоз. Проведена оценка морфофункционального статуса тромбоцитов крови предлагаемым способом. Получены следующие результаты
1. Концентрация тромбоцитов (Стр) в крови - 800 тыс/мкл, или или 800×109/л, или 800 млрд клеток в л.
2. Относительное содержание тромбоцитов с гранулами (Dтр.гр) - 85%.
3. Концентрация тромбоцитов с гранулами (Стр.гр) - 640 тыс/мкл или 640×109/л, или 640 млрд/л.
4. Морфофункциональная активность тромбоцитов (МФАТ) - 64 фут-кандел/клетку или 64 балла.
5. Адгезивная активность тромбоцитов (ААТ) на стекле (морфологический анализ) - 85% или 85 баллов.
6. Морфофункциональнальный статус тромбоцитов (МФСТ) - 64+85=149 баллов.
Заключение: тромбоциты крови имеют высокий морфофункциональный статус. Активирована система клеточного звена гемостаза, возможно тромбообразование.
Способ оценки морфофункционального статуса тромбоцитов, включающий морфометрию параметров отдельных клеток, подсчет процента активированных тромбоцитов, отличающийся тем, что образцы крови, или плазмы, или концентрата тромбоцитов окрашивают в микропробирке в течение 5-10 мин при комнатной температуре витальным флуорохромным красителем на буферном растворе, содержащим трипафлавин и акридиновый оранжевый в соотношении 1:1, затем окрашенные клетки переносят на предметное стекло, накрывают покровным стеклом и с помощью флуоресцентного микроскопа - объектив ×100, длина волны возбуждения 450-490 нм, длина волны эмиссии - от 520 нм, оценивают количество тромбоцитов с гранулами, измеряют яркость свечения витально окрашенных трипафлавином и акридиновым оранжевым клеток, измеряют яркость свечения 100-200 витально окрашенных трипафлавином-АО клеток, суммируют значения яркости обследованных клеток, делят на количество обследованных тромбоцитов, рассчитывают среднюю величину интенсивности свечения тромбоцита и выражают в фут-канделах на 1 клетку, соответствующего одному баллу, характеризующую морфофункциональную активность тромбоцитов (МФАТ) анализируемого образца, далее препарат с витально окрашенными тромбоцитами помещают в термостат при 37°С на 5-15 мин, после чего с помощью флуоресцентного микроскопа подсчитывают число распластанных тромбоцитов с выходящими наружу гранулами, делят на общее число обследованных клеток и выражают в %, причем один процент соответствует одному баллу, характеризующих адгезивную активность тромбоцитов (ААТ) анализируемого образца, затем по сумме морфофункциональной и адгезивной активностей, выраженных в баллах, оценивают морфофункциональный статус тромбоцитов (МФСТ), который при 80-130 баллах считают нормальным, при 60-79 баллах - сниженным, при 41-59 баллах - низким, при менее чем 40 баллах - очень низким, при 131-150 баллах - высоким, при 151-170 баллах - очень высоким.