ПРИМЕНЕНИЕ ЭСТРИОЛА В НИЗКОЙ ДОЗЕ
Вид РИД
Изобретение
Область, к которой относится изобретение
Настоящее изобретение относится к применение низких доз эстриола влагалищным путем для предупреждения и/или при лечении урогенитальной атрофии вследствие дефицита эстрогена у женщин.
Предшествующий уровень техники
Климактерический период считается в жизни женщины временной фазой, находящийся между репродуктивной стадией и нерепродуктивной стадией. Во время климактерического периода имеется прогрессирующее снижение продукции эстрогенов яичниками, которое обычно сопровождается серией признаков, симптомов и патологических изменений.
Основным признаком этого перехода является исчезновение менструации (менопауза) и начало множественных гормональных и психических симптомов, вазомоторных расстройств (приливов и потливости) и урогенитальной атрофии, являющейся наиболее распространенным признаком.
С прогрессирующим снижением продукции эстрогенов в период около и после менопаузы происходит постепенное уменьшение толщины слизистой оболочки влагалища, уретры и мочевого пузыря. Когда эта атрофия становится более выраженной, генитальные симптомы - жжение и зуд во влагалище, атрофический вагинит, диспареуния и травматическое кровотечение и урологические симптомы - повторные инфекции, дизурия и недержание мочи - могут увеличиться. Гормональная недостаточность, кроме того, запускает ослабление поддерживающей ткани, что может вызвать пролапсы и стрессовое недержание мочи.
Хотя урогенитальная атрофия является естественным последствием климактерии и менопаузы, связанные с ней расстройства часто воздействуют на качество жизни женщины, и поэтому для врачей важно быстро выявить ее присутствие и назначить лечение.
Эстрогенная недостаточность возникает не только при климактерии, но также и в других ситуациях, таких как послеродовой период, когда также возникает урогенитальная атрофия, которую можно лечить.
Применяемая гормональная заместительная терапия, направленная на коррекцию или снижение последствий гормональной недостаточности, оказывает благоприятные воздействия на вазомоторные и урогенитальные симптомы, снижает потерю костной массы и риск сердечно-сосудистых заболеваний, но также увеличивает риск развития определенных видов рака, в частности, рака молочных желез или эндометрия, и других патологических процессов, например тромбоэмболии и гипертензии.
Ввиду этих ассоциированных рисков обычные протоколы вызывают озабоченность, приводящую к тому, что врачи и пациенты постоянно требуют предложения менее токсичной гормональной заместительной терапии.
В случае урогенитальной атрофии систематическое лечение симптомов посредством гормональной заместительной терапии пероральным путем не всегда необходимо. Альтернативой является введение эстрогенов влагалищным путем. Однако этот путь не лишен риска, поскольку местно введенные эстрогенные гормоны могут способствовать неблагоприятной пролиферации эндометрия, и эта гиперплазия, в случае если она значительно выражена, может дегенерировать в гормонально зависимый рак.
Эстриол представляет собой один из эстрогенов, используемых в лечении урогенитальной атрофии, в частности, влагалищным путем.
Имеющиеся в настоящее время в продаже препаративные формы эстриола предназначены для влагалищного введения дозы 0,5 мг/день (500 мкг/день) в течение первых 2-3 недель лечения с последующим введением дозы 0,5 мг 2 или 3 раза/неделю. Эта доза считается необходимой для того, чтобы местное введение оказывало свой эффект. Однако эти уровни связаны с риском гиперплазии эндометрия при введении в течение длительного времени, и поэтому введение не проводится непрерывно. В целом, рекомендуется не продлевать лечение свыше 2-3 месяцев.
Краткое описание сущности изобретения
Как было указано выше, необходимо располагать режимами влагалищного введения эстриола для предупреждения и/или лечения урогенитальной атрофии, которые обеспечивают как безопасность, так и эффективность, и, следовательно, более приемлемы для врачей и пациентов, таким образом, приводя к большему соблюдению назначенного лечения и к лучшему качеству жизни пациентов.
Неожиданно авторы изобретения обнаружили, что введение менее чем 500 микрограммов (500 мкг = 0,5 мг) эстриола в сутки позволяет достичь этих целей, вызывая обратное развитие урогенитальной атрофии у женщин без гиперплазии эндометрия.
Эти низкие дозы эстриола эффективны и безопасны, независимо от типа препаративной формы, которая используется, и обеспечивают возможность пролонгации лечения без рисков для пациентки. Действительно, это, вероятно, обеспечит возможность ежедневного введения продукта в течение более чем 3 недель.
Настоящее изобретении поэтому относится к применению эстриола при получении фармацевтической композиции для влагалищного введения с целью предупреждения и/или лечения урогенитальной атрофии вследствие эстрогенной недостаточности у женщин, когда указанная композиции вводится так, что пациентка получает дозу эстриола менее чем 0,5 мг/день, причем лечение может быть продолжительным без рисков.
Детальное описание изобретения
Авторы изобретения обнаружили, что местная препаративная форма, содержащая эстриол в качестве активного ингредиента, может вводиться в очень низких дозах и даже при этом сохранять эффективность при лечении урогенитальной атрофии у женщин.
Неожиданно оказалось, что дозы, даже в 10-250 раз меньше, чем обычная доза, вызывают обратное развитие состояния атрофии влагалища, даже не требуя дополнительного лечения. Кроме того, эти низкие дозы значительно снижают риск, связанный с лечением эстрогенами.
В одном аспекте, изобретение относится к применению эстриола при получении фармацевтической композиции для влагалищного введения с целью предупреждения и/или лечения урогенитальной атрофии вследствие эстрогенной недостаточности у женщин, где указанная композиция вводится так, что пациентка получает дозу эстриола меньше, чем 0,5 мг/день.
Фармацевтические композиции, применяемые в настоящем изобретении, могут представлять собой любые из тех, которые известны специалисту в данной области, позволяющие введение доз эстриола меньше, чем 0,5 мг/день. Фармацевтические композиции могут быть представлены, например, в твердой форме (капсулы, таблетки и т.д.), полутвердой форме (гели, кремы и т.д.), жидкой форме или в форме пены. И они могут содержать любой из эксципиентов, известных специалисту в данной области.
Важным аспектом настоящего изобретения являются особенно низкие дозы эстриола, которые можно применять в препаративных формах, определенных в изобретении, и которые эффективны для лечения урогенитальной атрофии вследствие эстрогенной недостаточности.
В определенном варианте осуществления настоящего изобретения эстриол вводится в дозах, меньших или равных 0,3 мг/день, для предупреждения и/или лечения урогенитальной атрофии вследствие эстрогенной недостаточности.
Другой еще более предпочтительный вариант осуществления относится к применению эстриола в дозах, меньших или равных 0,1 мг/день.
Другой особенно предпочтительный вариант осуществления относится к применению эстриола в дозах от 0,002 до 0,05 мг/день (2 и 50 мкг/день).
Другой особенно предпочтительный вариант осуществления относится к применению эстриола в дозах от 0,02 до 0,05 мг/день (20 и 50 мкг/день).
Неожиданно оказалось, что при использовании эстриола в таких низких дозах продукт может вводиться ежедневно и в течение периодов, пролонгированных во времени, без имеющихся побочных эффектов. Ввиду высокой безопасности схемы введения эстриола по настоящему изобретению, предупреждение или лечение урогенитальной атрофии может проводиться без прерывания в течение длительного времени, например месяцев или лет.
В определенном варианте осуществления изобретения препаративная форма вводится ежедневно в течение, по меньшей мере, 3 недель. В другом варианте осуществления она может вводиться ежедневно в течение, по меньшей мере, 30 дней, по меньшей мере, 60 дней, по меньшей мере, 90 дней, по меньшей мере, 6 месяцев, или, по меньшей мере, 1 года. В этих случаях, предпочтительно, нет необходимости в прерывании лечения.
В других вариантах осуществления препаративная форма может вводиться по схеме 1 раз в 2 дня, 1 раз в 3 дня, или 1 раз в неделю в течение, по меньшей мере, 3 недель, по меньшей мере, 30 дней, по меньшей мере, 60 дней, по меньшей мере, 90 дней, по меньшей мере, 6 месяцев или, по меньшей мере, 1 года.
Ниже описаны несколько иллюстративных примеров изобретения. Однако представленные примеры не следует рассматривать как ограничивающие интерпретацию формулы изобретения.
Примеры
Эффективность применения низких доз эстриола при лечении урогенитальной атрофии показана посредством следующих анализов in vivo.
Анализ I
Препаративные формы
В настоящем исследовании были испытаны две препаративные формы, каждая из которых содержала 0,005% (масю/мас.) эстриола.
Для растворения активного ингредиента готовили маточный раствор эстриола в глицерине. Для этого 25 мг микронизированного эстриола добавляли к 50 г растительного глицерина, перемешивали в течение 1 часа и верифицировали полное растворение эстриола.
Для получения состава в форме крема (Препаративная форма 1), с одной стороны, 20 г самостоятельно эмульгирующейся основы Neo PCL в форме масляно-водной эмульсии во внешней водной фазе нагревали при 75°С при магнитном перемешивании, тогда как, с другой стороны, 40 мг бронопола растворяли в 70 мл очищенной воды при 75°С. Раствор бронола (водный, w) постепенно добавляли на самостоятельно эмульгирующуюся основу (масляную, o) и, при постоянном перемешивании температуру снижали до достижения 30°С. Не останавливая перемешивание, добавляли 10 грамм ранее полученного раствора эстриола в глицерине для получения препаративной формы 0,005% эстриола со следующей композицией:
|
Для получения препаративной формы в виде геля (Препаративная форма 2) 40 мг бропонола растворяли в 88 мл очищенной воды и медленно добавляли 2 г натросола при постоянном перемешивании. Наконец, без прекращения перемешивания, добавляли 10 г раствора эстриола в глицерине для получения препаративной формы 0,005% эстриола со следующей композицией:
|
Оценка воздействия на атрофию влагалища
В этом исследовании всего использовали 8 самок крыс Wistar Han, подвергнутых овариэктомии, которых случайным методом распределяли на 2 группы, по 4 животных в каждой. Группу А лечили Препаративной формой 1, тогда как группу В лечили Препаративной формой 2.
По истечении 18 дней от момента получения животных, подвергнутых овариэктомии, у каждой крысы периодически выполняли несколько влагалищных мазков до тех пор, пока у всех крыс не было верифицировано состояние менопаузы (в частности, влагалищной атрофии) путем определения индекса созревния влагалищного эпителия.
С началом лечения Препаративную форму 1 (0,005% крем эстриола) и 2 (0,005% гель эстриола) водили, соответственно, экспериментальной группе А и В один раз в день в течение 5 дней. Введение проводили влагалищным путем в количестве 5,8 мг препаративной формы/животное (соответствующем 0,29 мкг эстриола/животное) с использованием множественной пипетки с положительным смещением, оборудованной специальным наконечником.
Для расчета подлежащей введению дозы учитывали среднюю массу тела 60 кг для женщин и 350 г для крыс, в результате чего каждой крысе вводили 0,29 мкг эстриола для оценки вероятного эффекта введения 0,05 мг эстриола у женщин.
Мазок влагалища выполняли у каждой крысы в день перед введением, а другой мазок выполняли по истечении 8 часов после введения в 5-й день. Мазки выполняли посредством методики влагалищного лаважа и фиксировали и окрашивали по методике Папаниколау.
Эффект лечения каждой из препаративных форм оценивали по виду ороговевших клеток, определением индекса созревания влагалищного эпителия и оценкой общей трофики.
Полученные результаты показаны в следующих таблицах.
|
|
|
Результаты показывают, что введение дозы эстриола, в 10 раз меньшей, чем доза, обычно применяемая в настоящее время, устраняет состояние атрофии влагалища у крыс обеих групп, присутствие ороговевших и промежуточных клеток и индекса созревания соответствует эутрофичному эндометрию, полученному после лечения.
Поэтому можно сделать вывод, что схема введения, предложенная в настоящем изобретении, позволит получить терапевтическую эффективность, аналогичную той, которая достигается современными способами лечения, но с большей безопасностью.
Анализ II
Две препаративные формы в геле были испытаны в настоящем исследовании, одна содержащая 0,002%, а другая 0,0002% (мас./мас.) эстриола со следующей композицией.
|
Оценка воздействия на влагалищную атрофию
Для этого анализа использовали взрослых самок крыс Wistar, подвергнутых овариэктомии, которых содержали в поликарбонатных клетках типа Е размером 255×405×197 мм с подстилками из мелких опилок или им подобных.
Методом случайной выборки крыс распределяли на группы по 5 животных в каждой клетке и их содержали в блоках для содержания животных в регулируемых условиях температуры (22±2°С), светового периода (12/12 ч свет/темнота), воздушного давления, количества смен подстилки и относительной влажности (40-60%).
Животные получали стандартный рацион для крыс в виде гранулированного корма, поставляемого Harlan Iberica S.L., и им была предоставлена возможность неограниченного доступа к питьевой воде (питьевой воде для общественного потребления).
В данном исследовании использовали 5 экспериментальных групп по 5 животных в каждой группе. Подлежащие анализу вещества представляли собой 3 фармацевтические препаративные формы на основе эстриола и плацебо:
Группа А: Контроль (имитация)
Группа В: лечение гелем плацебо
Группа С: лечение 0,0002% гелем
Группа D: лечение 0,002% гелем
Группа Е: лечение эталонным веществом (0,1% овестинон)
Для расчета количества анализируемого вещества, вводимого каждому животному, учитывалась дозировка у людей 1 г геля в день.
Принимая 60 кг для женщин и 350 г для крыс в качестве средней массы тела, использовали следующие дозировки.
Для женщины с массой тела 60 кг = 1 г геля
Для крысы с массой тела 350 г = 5,8 мг геля
В случае эталонного вещества (0,1% овестинон) дозировка у людей составляла 0,5 г в день.
Принимая 60 кг для женщин и 350 г для крыс в качестве средней массы тела, использовали следующие дозировки.
Для женщины с массой тела 60 кг = 0,5 г крема
Для крысы с массой тела 350 г = 2,9 мг крема
Таким образом, 5,8 мг соответствующего анализируемого вещества должно было вводиться каждому животному из групп В, С и D, тогда как животные группы Е должны были получать 2,8 мг эталонного вещества.
0,0002%/0,002% гели = 0,0002 г/0,002 г эстриола в 100 г геля
0,002 г/0,02 мг эстриола в 1 г геля
0,1% Овестинона = 0,1 г эстриола в 100 г крема
0,0005 г эстриола в 0,5 г крема
Поэтому эквивалент активного ингредиента, введенного каждой группе, представляет собой:
Группа А: Контроль = 0 мкг эстриола
Группа В: плацебо = 0 мкг эстриола
Группа С: 0,0002% гель = 0,01 мкг эстриола: ДОЗА 1
Группа D: 0,002% гель = 0,1 мкг эстриола: ДОЗА 2
Группа Е: 0,1% овестинон = 2,9 мкг эстриола: ДОЗА 3
Включена контрольная группа, в которой влагалищное введение имитировалось для обеспечения возможности определения вклада возможного «механического» воздействия на наблюдаемую трофическую реакцию.
Исследование состояло из четырех фаз:
Первая фаза продолжалась 15 дней и включала ежедневное лечение животных.
Вторая фаза продолжалась 15 дней и включала лечение животных дважды в неделю (все группы).
Третья фаза продолжалась 7 дней и включала лечение животных один раз в неделю (все группы).
Третья фаза продолжалась 15 дней и не включала лечение.
Перед первым введением (24 ч) анализируемых и эталонных веществ у каждой крысы выполняли влагалищный мазок для верификации ее состояние менопаузы (влагалищной атрофии), определяя индекс созревания влагалищного эпителия.
Для этого влагалищные мазки выполняли посредством методики лаважа и фиксировали растворимым в воде фиксирующим аэрозолем для цитодиагностики и окрашивали в соответствии с методикой Папаниколау для оценки индекса созревания.
Затем каждой группе лечения вводилась первая доза соответствующей препаративной формы. Это введение повторялось один раз в день (через 24 часа) в течение 15 последовательных дней.
По истечении этого периода дозировку изменяли на введения два раза в неделю во всех группах A, B, C, G и E (контроль, плацебо, 0,0002% гель, 0,002% гель и 0,1% овестинон) в течение 2 недель.
По окончании этого 2-недельного периода во всех группах дозировку изменяли еще раз на введение один раз в неделю.
В течение периода первоначального повторного введения (15 последовательных дней) у всех животных ежедневно выполняли влагалищный мазок до 8-го дня (включительно) перед введением, соответствующим этому дню. Другой влагалищный мазок также выполняли у всех животных на 16-й день, через 24 часа после последнего введения.
С этой точки далее влагалищные мазки выполняли у всех животных 1 раз в 3 дня до конца исследования.
Все мазки фиксировали растворимым в воде фиксирующим аэрозолем для цитодиагностики и окрашивали в соответствии с методикой Папаниколау для оценки индекса созревания.
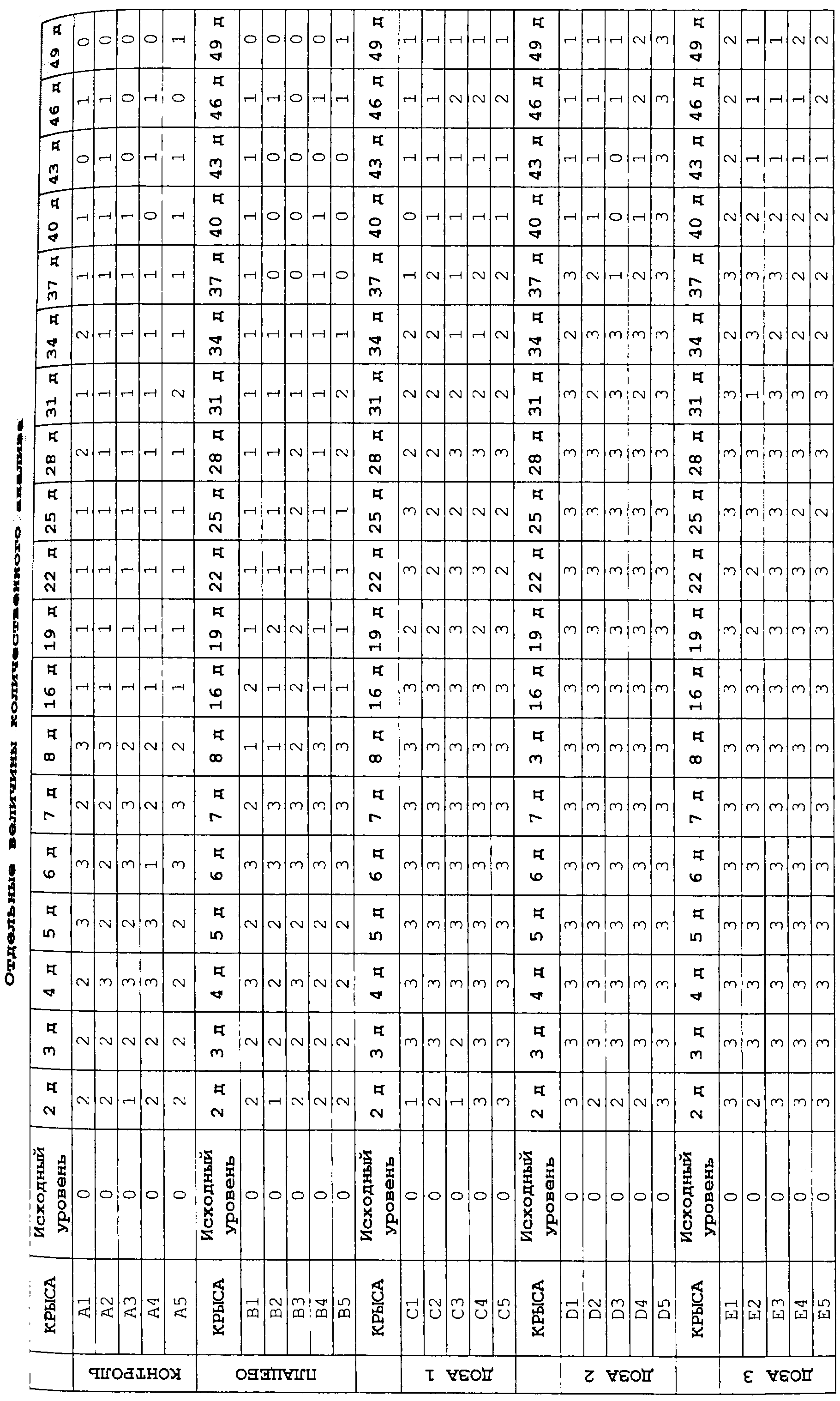
Количественную оценку трофического эффекта различных применяемых способов лечения проводили в соответствии со следующей схемой:
А - Атрофическая цитология
Н - Гипотрофическая цитология
М - Цитология промежуточной трофики
В - Цитология при хорошей трофике
Для проведения первоначального статистического анализа цифровую величину присваивали каждому из следующих диагнозов:
0 - А - Атрофическая цитология
1 - Н - Гипотрофическая цитология
2 - М - Цитология промежуточной трофики
3 - В - Цитология при хорошей трофике
В соответствии с этими предпосылками были получены следующие результаты:
|
|
Поэтому наблюдалось, что:
В группе контроля (имитация) и плацебо промежуточный трофический эффект наблюдался между 2 и 8 днями, причем хорошая трофика наблюдалась между 4 и 7 днями (только в некоторые дни). Это увеличение может вносить вклад в механический эффект взятия действительного цитологического образца, так же как последующее снижение может быть фактором вследствие «привыкания» или десенсибилизации к указанному механическому воздействию, как наблюдалось в предыдущих исследованиях (см. таблицы 8 и 9).
В группах, в которых вводились вещества с эстриолом (доза 1 (0,01 мкг эстриола), доза 2 (0,1 мкг эстриола), доза 3 (2,9 мкг эстриола)), хорошая трофика наблюдалась между 2 и 7 днями. С этого периода возникает урогенитальная гипотрофия, совпадающая с прекращением введения различных аналитических и эталонных веществ (36-й день был последним днем введения).
Таким образом, наличие препаративной формы, содержащей очень низкие дозы эстриола, обеспечивающей возможность введения в течение длительного времени, предотвращая периоды гипотрофии или урогенитальной атрофии и обеспечивая высокую безопасность для пациента, имеет большое преимущество.
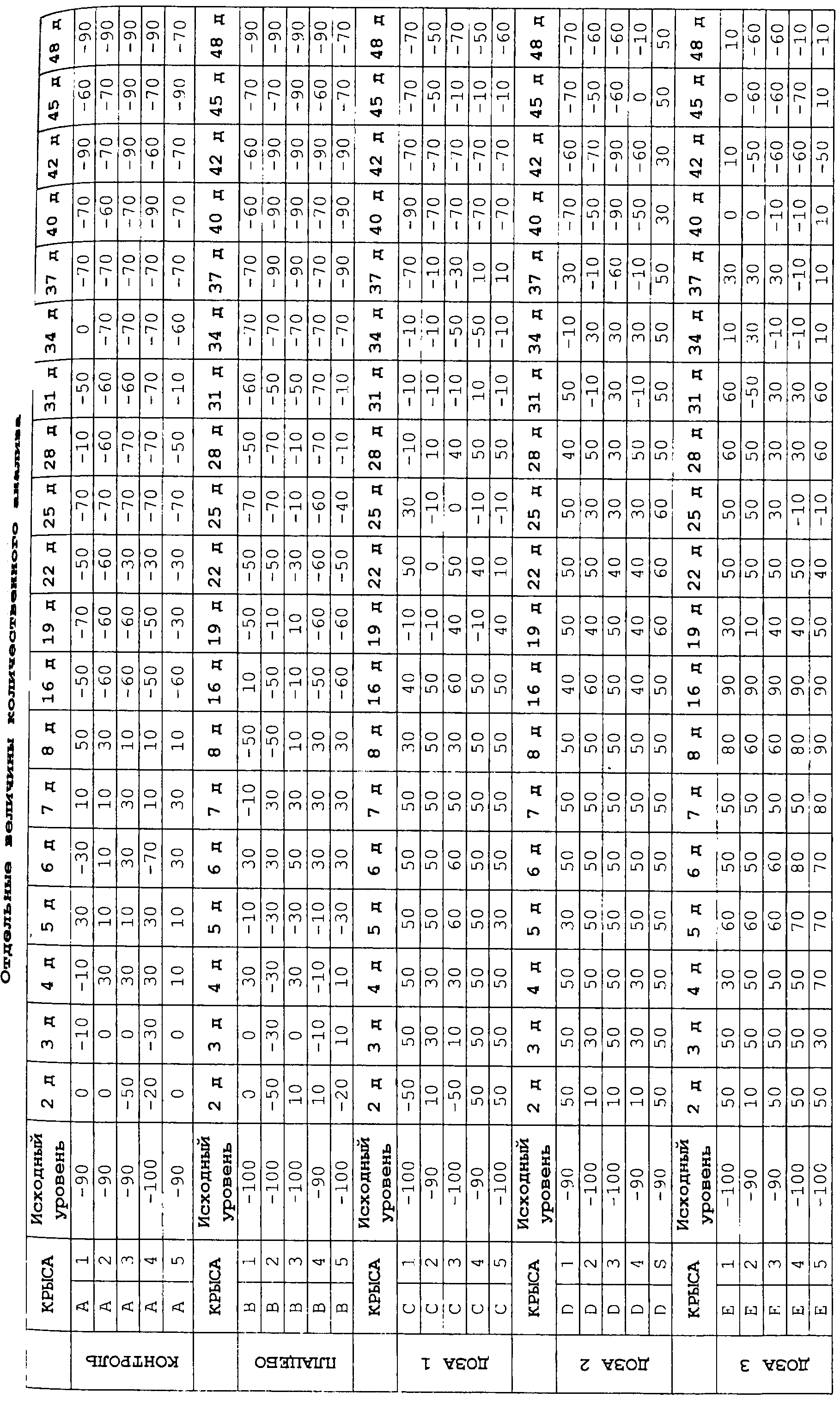
Количественный анализ проводился с использованием индекса созревания клеток (MI), определяющего соотношение общего количества клеток к количеству базальных/парабазальных, промежуточных и поверхностных клеток в процентах (B/I/S).
Для проведения первоначального статистического анализа, с целью присвоения цифровой величины каждому образцу, использовали следующую формулу:
ВЕЛИЧИНА = (-1*B)+(0*I)+(1*S)
Диапазон величин от -100 (100% базальных/парабазальных клеток) до 100 (100% поверхностных клеток) получали посредством этой формулы, причем величина менее чем -90 считалась полной атрофией, от -89 до -30 - гипотрофией, от -29 до +20 - промежуточной трофикой, и более чем +20 - хорошей трофикой.
В соответствии с этими предпосылками были получены следующие результаты:
|
|
Поэтому наблюдалось, что:
Результаты, оценка и анализ очень похожи на те, которые получены при количественной оценке.
В группах контроля (имитации) и плацебо промежуточный трофический эффект наблюдался между 2 и 8 днями, причем хорошая трофика наблюдалась между 4 и 7 днями, что демонстрировалось появлением промежуточных клеток, и в некоторых случаях - поверхностных клеток. Этот эффект прогрессивно уменьшался в течение всего исследования.
В группе дозы 1 (0,01 мг эстриола) хорошая трофика с промежуточными и поверхностными клетками наблюдалась между 2 и 16 днями лечения, совпадая с ежедневным введением до 15 дня. Затем наблюдалось колебание между хорошей трофикой и промежуточной трофикой, приводя к состоянию промежуточной трофики с 37-го дня исследования (36-й день был последним днем введения), достигая гипотрофического состояния с 40-го дня.
В остальных группах лечения эстриолом (доза 2 (0,1 мкг эстриола) и доза 3 (2,9 мкг эстриола)) наблюдалось аналогичное поведение трофики. Хорошая трофика наблюдалась между 2 и 36 днями. На 37-й день имелась хорошая трофика, тогда как для дозы 2 имелась промежуточная трофика. При дозе 2 состояние гипотрофии развивалось на один день быстрее, чем при дозе 3.

