Результат интеллектуальной деятельности: ЛЕКАРСТВЕННЫЕ ФОРМЫ С УЛУЧШЕННЫМИ ФАРМАКОКИНЕТИЧЕСКИМИ СВОЙСТВАМИ
Вид РИД
Изобретение
Данное изобретение относится к новым лекарственным формам варденафила, которые быстро растворяются во рту и которые приводят к повышению биодоступности и к равномерной кривой концентрации в плазме, а также к способу их изготовления.
Производные имидазотриазинона, такие как варденафил, а также их применение в качестве ингибитора cGMP фосфодиэстеразы, и их рабочий спектр известны (например, из WO 99/24433), и они продаются на рынке под наименованием Levitra®. Однако терапевтическое применение варденафила снижает его ценность из-за его незначительной биодоступности около 14%, а также быстрого падения концентрации в плазме в течение примерно 1 часа после применения варденафила. Незначительная биодоступность влечет за собой в принципе высокую изменчивость концентрации в плазме у разных индивидов, кроме того, должна быть повышена дозировка для достижения определенного воздействия. Быстрое падение концентрации в плазме в течение примерно 1 часа после орального употребления варденафила таит риск, что в дальнейшем результатом будет незначительное терапевтическое воздействие. Поэтому пациенты должны точно планировать время приема, чтобы воспользоваться преимуществом высокой концентрации в плазме.
На основании этого предпринимались попытки найти лекарственную форму варденафила, которая решила бы вышеназванную проблему. В американской заявке US 2003/0134861 A1 приводятся препаративные формы для трансмукозного применения ингибиторов фосфодиэстеразы, например, буккальных (защечных) лекарственных форм или таблеток под язык. Как показано в примерах 1-3, в случае варденафила после его применения на слизистой оболочке рта возникает очень неудовлетворительная концентрация в плазме с сильно изменяющейся, неполной и медленной абсорбцией биологически активного вещества.
Наряду с этим были описаны лекарственные формы с замедленным высвобождением ингибиторов cGMP фосфодиэстеразы (WO 00/24383). Подобные лекарственные формы могут решить проблему быстрого снижения концентрации в плазме. Однако лекарственные формы с замедленным высвобождением большие и для некоторой части пациентов трудны для глотания. Кроме того, они не решают проблему незначительной биодоступности варденафила.
Далее, описаны растворимые во рту лекарственные формы ингибиторов cGMP фосфодиэстеразы. В американском патенте US 6221402 описывается лекарственная форма, кроме прочего, против импотенции, в которой сердцевина, содержащая биологически активное вещество, покрыта, в том числе, нерастворимым в слюне полимером. В американской заявке US 2002/0002172 описывается растворимая во рту лекарственная форма ингибитора cGMP фосфодиэстеразы силденафила, которая содержит биологически активное вещество в виде свободного основания малорастворимого в воде. Подобные лекарственные формы, растворимые во рту, обладают преимуществом легкого приема пациентами, так как лекарственная форма растворяется уже во рту. Однако она не вызывает ни повышения биодоступности, ни долгого перерыва в концентрации в плазме. Так как растворимая лекарственная форма проглатывается пациентом в течение короткого времени, то растворение биологически активного вещества происходит, как при обычных таблетках для глотания, прежде всего в желудке. Отсюда в самом лучшем случае оно вызовет биодоступность, подобную такой, как после применения обычной таблетки для глотания.
Теперь неожиданно были обнаружены лекарственные формы варденафила, растворимые во рту, которые приводят к повышению биодоступности и к равномерной кривой концентрации в плазме. Формы согласно изобретению обладают по сравнению с обычными таблетками, глотаемыми с водой, явно повышенной биодоступностью. При этом достигаются повышенные концентрации в плазме, особенно в период времени, в который уже снова происходит снижение концентрации в плазме при обычных глотательных таблетках, т.е. примерно в пределах от 0 до 5 часов после достижения максимальной концентрации в плазме. В результате следует рассчитывать при той же дозе на улучшенную эффективность в это же время. Особенно неожиданным представляется повышение концентрации в плазме спустя несколько часов после применения особо быстро растворимой и высвобождаемой лекарственной формы, так как ввиду ускорения растворения биологически активного вещества можно ожидать более быстрого увеличения и быстрого снижения концентрации варденафила в плазме.
Поэтому объектом изобретения является форма лекарственного средства, содержащая варденафил, отличающаяся тем, что растворимость введенной формы варденафила в большой массе водной жидкости достаточно высока, и скорость растворения растворимой во рту формы достаточно быстрая. Было обнаружено, что она обеспечивается, когда, по меньшей мере, 80% дозы варденафила из вводимой формы вещества, например, соли или смеси с кислотой, растворяется при 25°С в 10 мл физиологического раствора поваренной соли, и когда высвобождаемая доля из лекарственной формы в 900 мл физиологического раствора поваренной соли в течение первых 5 минут составляет, по крайней мере, 70% (37°С, аппарат USP с вращающимися лопастями, 50 оборотов/мин).
Следующим аспектом изобретения является применение оптимального способа приема лекарственной формы, приготовленной согласно изобретению. Обычно трансмукозные лекарственные формы приводятся по возможности в длительный и интенсивный контакт со слизистой оболочкой, например, путем прикладывания пленки, содержащей вещество, к слизистой оболочке рта. Когда это нежелательно или невозможно, глотают таблетки, как обычно, с некоторым количеством воды. Было обнаружено, что оба образа действия снижают ценность достигаемой биодоступности варденафила. В отличие от этого повышение биодоступности варденафила может быть достигнуто, когда пациент помещает в ротовую полость лекарственную форму согласно изобретению, разложение которой ожидается во рту, и затем проглатывает соответствующий раствор или суспензию. Поэтому лекарственные формы согласно изобретению упаковывают в основное упаковочное средство, например в пластмассовый флакон или в пузырек, и снабжают этикеткой или упаковочным листком, в котором описан вышеназванный способ применения.
В частности, для приготовления препаративных форм согласно изобретению варденафил содержится в форме его соли с кислотой. Соль может быть свободна от растворителя или содержать растворитель и находиться в различных полиморфных формах, например, это может быть варденафил гидрохлорид тригидрат, варденафил димесилат моногидрат или варденафил мономесилат.Однако возможны также соли варденафила с лимонной кислотой, винной кислотой, янтарной кислотой, серной кислотой, ледяной кислотой, адипиновой кислотой, глюконовой кислотой, глюкуроновой кислотой, глютаминовой кислотой, глутаровой кислотой, глицерофосфорной кислотой, молочной кислотой, малеиновой кислотой, яблочной кислотой, фосфорной кислотой, лактобионовой кислотой, малоновой кислотой, нафталинсульфоновой кислотой, нафталиндисульфоновой кислотой или толуолсульфоновой кислотой. Альтернативно возможно также, чтобы препаративные формы согласно изобретению содержались в лекарственной форме путем совместной обработки варденафила и кислоты. В этом случае в процессе растворения во рту образуется соответствующая соль. Для достижения скорости растворения согласно изобретению выгодно еще, когда соль варденафила содержится в лекарственной форме в молотом, аморфном или уже растворенном виде. Предпочтительно, чтобы варденафил или соль варденафила добавлялись в микронизированном виде, когда средняя величина частиц менее 20 мкм. Содержание варденафила или соли варденафила в быстрорастворимой во рту лекарственной форме предпочтительно лежит в пределах от 0,8% до 25% (из расчета на варденафил).
Соль варденафила добавляется в быстрорастворимую во рту лекарственную форму одним из известных способов. Под быстрорастворимой во рту лекарственной формой здесь понимается, что время растворения лекарственной формы (по методике Европейской фармакопеи) составляет меньше, чем 3 минуты, предпочтительно меньше, чем 1 минута. К тому же, пригодна смесь вещества с сахарами, сахарными спиртами, смачивающими средствами или другими ускорителями разложения, а также с другими вспомогательными веществами, такими как поверхностно-активное вещество, лубрикант, средство регулирования текучести, вкусовые вещества, красители или наполнители и прессование на таблеточных машинах. При этом предпочтительно применение сахарных спиртов, таких как маннит или сорбит, особенно в концентрации (в расчете на готовую таблетку) от 40% до 99%. Альтернативно соль варденафила вместе со вспомогательными веществами, такими как сахара, сахарные спирты, полимеры или поверхностно-активные вещества, можно растворить или суспендировать в водном растворителе, дозировать раствор или суспензию в лунку блистерной (пузырчатой) упаковки и осуществить процесс сушки вымораживанием. Также альтернативно можно соль варденафила вместе со вспомогательными веществами, такими как пленкообразователи, смягчители, вкусовые и красящие вещества растворить или суспендировать в органическом растворителе и обработать до пленки. Также возможно изготовление пленки без растворителей с плавкими пленочными препаративными формами. После изготовления пленки разрезают на куски, соответствующие целым дозам.
Сравнительный пример 1
Низкая и медленная абсорбция варденафил гидрохлорида из лекарственной формы при прикладывании к слизистой оболочке рта
30 мг варденафил гидрохлорида, 54 мг метилпарагидроксибензоата, 6 мг пропилпарагидроксибензоата и 9 г сахарозы растворяют примерно в 20 г воды. РН устанавливают 20%-ным раствором молочной кислоты на 3,9. После этого дополняют водой на общую вводимую массу 33,405 г. Десять испытуемых помещали каждый 11,97 г этого раствора (соответственно 10 мг варденафила) на 15 минут под язык. Для сравнения в контрольном способе давалась обычная таблетка для глотания с водой, которая состояла из следующих компонентов: 11,852 мг варденафила гидрохлоридатригидрата (соответственно 10 мг варденафила), 105,023 мг микрокристаллической целлюлозы, 6,25 мг поперечно-сшитого поливинилпирролидона, 0,625 мг коллоидной двуокиси кремния, 1,25 мг стеарата магния, 2,391 мг гипромеллозы, 0,797 мг Макрогола 400 (Macrogol 400), 0,653 мг двуокиси титана, 0,133 мг желтой окиси железа и 0,011 мг красной окиси железа. По сравнению с этой стандартной таблеткой, служащей эталоном, для раствора, прикладываемого под язык, относительная биодоступность оказалась только лишь 24,6%.
Сравнительный пример 2
Низкая и медленная абсорбция варденафила из лекарственной формы при прикладывании к слизистой оболочке рта
2 г варденафила, 0,1 г аскорбилпалмитата, 0,5 г α-токоферола и 7,8 г трометамола растворяли в 250 г Полисорбата 20, 400 г 1,2 пропиленгликоля, 250 г 96%-ного этанола, 35,8 г 1М соляной кислоты и 52,6 г воды. 5 мл этого раствора (соответственно 10 мг варденафила) давали 10 испытуемым на 15 минут под язык. В контрольном способе испытуемые получали как эталонные 10-мг таблетки варденафила, описанные в сравнительном примере 1, которые проглатывались с водой. Относительная биодоступность раствора, применяемого под язык, составляла 18,9%.
Сравнительный пример 3
Низкая и медленная абсорбция варденафил месилата из лекарственной формы при прикладывании к слизистой оболочке рта
10 испытуемых получили каждый по одной таблетке для помещения на 15 минут под язык, таблетка состояла из 2,39 мг варденафил мономесилата, 0,0986 мг метансульфоновой кислоты, 20 мг маннита, 2 мг кроскармеллозы натрия, 25,3 мг микрокристаллической целлюлозы, 1 мг стеарата магния и 0,25 мг высокодисперсной двуокиси кремния. Таблетка имела время растворения 4 минуты. В контрольном способе испытуемые получали как эталонные 10-мг таблетки варденафила, описанные в сравнительном примере 1, которые проглатывались с водой. Нормированная дозой относительная биодоступность таблетки, помещаемой под язык, составляла 43,9%.
Сравнительный пример 4
Недостаточно повышенная биодоступность в случае применения быстрорастворимой во рту таблетки, не соответствующей изобретению
11 испытуемых получили каждый по одной быстрорастворимой во рту таблетке, состоящей из 10,7 мг варденафил дигидрата (соответственно 10 мг варденафила), 0,484 мг желтой окиси железа, 0,066 мг красной окиси железа, 1,1 мг абрикосовой отдушки, 4,4 мг аспартама, 6,6 мг стеарата магния и 196,65 мг Фармабурста (Pharmaburst®) (торговое наименование смеси вспомогательных веществ фирмы SPI). Эта быстрорастворимая во рту таблетка не соответствует изобретению, так как в 10 мл физиологического раствора поваренной соли при 25°С растворяется только около 0,1 мг варденафил дигидрата (соответственно около 1% применяемой дозы), и поэтому не выполняется критерий растворимости введенной формы биологически активного вещества. По сравнению с эталонной таблеткой, приведенной в сравнительном примере 1, относительная биодоступность составляет 97,3%.
Сравнительный пример 5
Недостаточно повышенная биодоступность в случае применения быстрорастворимой во рту таблетки, не соответствующей изобретению
11 испытуемых получили каждый по одной быстрорастворимой во рту таблетке, состоящей из 10,7 мг варденафил дигидрата (соответственно 10 мг варденафила), 5 мг размельченной янтарной кислоты, 0,484 мг желтой окиси железа, 0,066 мг красной окиси железа, 1,1 мг абрикосовой отдушки, 4,4 мг аспартама, 6,6 мг стеарата магния и 191,65 мг Pharmaburst® (торговое наименование смеси вспомогательных веществ фирмы SPI). Эта быстрорастворимая во рту таблетка не соответствует изобретению, так как высвобождение биологически активного вещества в 900 мл физиологического раствора поваренной соли при 37°С и 50 об/мин в аппарате USP для смешивания с лопастями, составляет только 40% за 5 минут, и поэтому не выполняется критерий скорости растворения. По сравнению с эталонной таблеткой, приведенной в сравнительном примере 1, относительная биодоступность составляет 101,8%.
Пример 6
Доказательство повышенной биодоступности в случае быстрорастворимой во рту таблетки согласно изобретению
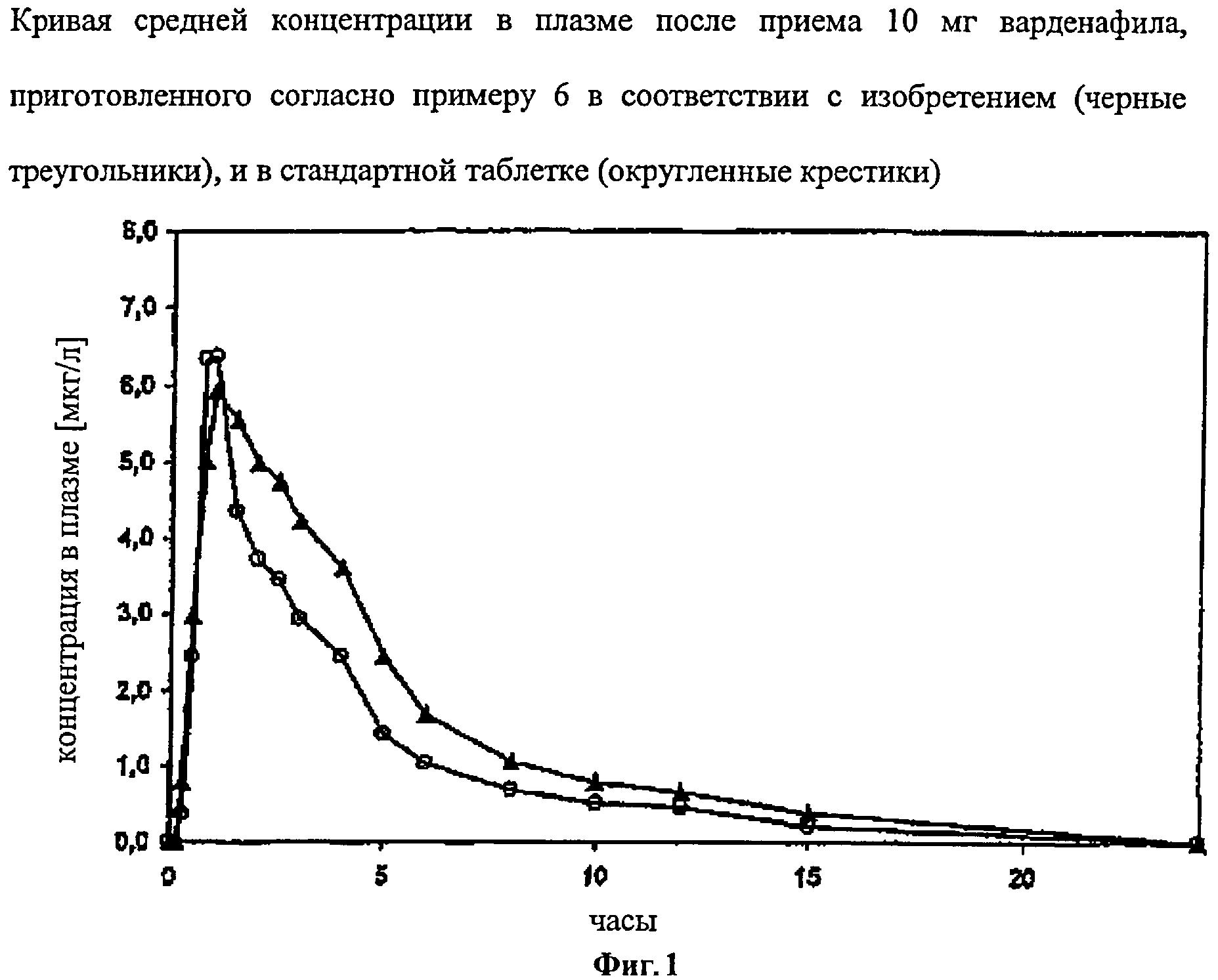
12 испытуемых получили каждый по одной быстрорастворимой во рту таблетке, состоящей из 11,85 мг варденафил гидрохлорид тригидрата, 0,55 мг желтой окиси железа, 0,075 мг красной окиси железа, 0,75 мг абрикосовой отдушки, 0,125 мг неогесперидиндигидрохалькона, 2,50 мг аспартама, 0,625 мг высокодисперсной двуокиси кремния, 3,125 мг стеарата магния и 105,4 мг Pharmaburst®. Из введенного вещества растворилось при 25°С в 10 мл физиологического раствора поваренной соли около 10,4 мг (соответственно 8,8 мг варденафила) и таким образом 88% дозы. Высвобождение биологически активного вещества в 900 мл физиологического раствора поваренной соли при 37°С и 50 оборотов в минуту в аппарате USP для размешивания с лопастями составляет 73% за 5 минут. Таким образом, выполняется критерий скорости растворения и растворимости согласно изобретению. По сравнению с эталонной таблеткой, приведенной в сравнительном примере 1, относительная биодоступность составляет 141%. Соответствующие фармакокинетические параметры приведены в таблице 1 (Приложение), для сравнения представлена кривая изменения средней концентрации в плазме на фиг.1 (Приложение).
Пример 7
Доказательство повышенной биодоступности в случае быстрорастворимой во рту таблетки согласно изобретению
11 испытуемых получили каждый по одной быстрорастворимой во рту таблетке, состоящей из 5,93 мг варденафил гидрохлорид тригидрата, 0,352 мг желтой окиси железа, 0,048 мг красной окиси железа, 0,48 мг абрикосовой отдушки, 0,08 мг неогесперидиндигидрохалькона, 1,60 мг аспартама, 0,40 мг высокодисперсной двуокиси кремния, 2 мг стеарата магния и 69,11 мг Pharmaburst®. Введенное биологически активное вещество растворяли при 25°С в 10 мл физиологического раствора поваренной соли до 91%. Высвобождение вещества в 900 мл физиологического раствора поваренной соли при 37°С и 50 оборотов в минуту в аппарате USP для размешивания с лопастями составляет 78% за 5 минут. Таким образом, выполняется критерий скорости растворения и растворимости согласно изобретению. Для сравнения в контрольном способе давалась обычная, проглатываемая с водой таблетка, которая состоит из следующих компонентов: 5,926 мг варденафил гидрохлорид тригидрата (соответственно 5 мг варденафила), 75,419 мг микрокристаллической целлюлозы, 4,35 мг поперечно-сшитого поливинилпирролидона, 0,435 мг коллоидной двуокиси кремния, 0,87 мг стеарата магния, 1,664 мг гипромеллозы, 0,555 мг Макрагол 400, 0,455 мг двуокиси титана, 0,092 мг желтой окиси железа и 0,007 мг красной окиси железа. По сравнению с этой эталонной таблеткой относительная биодоступность составляет 149,6%.
Еще около 12 часов после приема таблетки согласно изобретению концентрации в плазме оставались выше, чем после приема стандартной таблетки.
Пример 8
Доказательство повышенной биодоступности в случае быстрорастворимой во рту таблетки согласно изобретению
В аппарате для смешивания смешивают следующие компоненты: 697 г микронизированного варденафил гидрохлорид тригидрата, 500 г смеси красящего вещества, состоящей из 4,4% желтой окиси железа, 0,6% красной окиси железа и 95% Pharmaburst®, 30 г абрикосовой отдушки, 5 г неогесперидиндигидрохалькона, 100 г аспартама и 3518 г Pharmaburst®. Смесь порошков (Порошковая смесь) смешивается в смесителе свободного падения с 25 г высокодисперсной двуокиси кремния и просеивается через 0,5-мм сито. Эта смесь далее смешивается со 125 г стеарата магния в смесителе свободного падения в течение 5 минут. Готовая порошковая смесь прессуется на таблеточном прессе в круглые таблетки с массой 170 мг, диаметром 8 мм и пределом прочности около 35 Н. Для сравнения в контрольном методе давалась обычная таблетка, глотаемая с водой, которая состоит из следующих компонентов: 23,705 мг варденафил гидрохлорид тригидрата (соответственно 20 мг варденафила), 141,797 мг микрокристаллической целлюлозы, 8,85 мг поперечно-сшитого поливинилпирролидона, 0,885 мг коллоидной двуокиси кремния, 1,77 мг стеарата магния, с покрытием: 3,385 мг гипромеллозы, 1,128 мг Макрогол 400, 0,925 мг двуокиси титана, 0,188 мг желтой окиси железа и 0,015 мг красной окиси железа. По сравнению с этой эталонной таблеткой относительная биодоступность составляет 128,2%.
Пример 9
Было смешано и потом высушено и размельчено валиком: 18,96 кг варденафил гидрохлорид тригидрата, 76,54 кг микрокристаллической целлюлозы, 20 кг кросповидона и 80 кг силиката кальция. Затем крошка была смешана с: 1 кг высокодисперсной двуокисью кремния, 0,5 кг сукралозы, 1 кг порошкообразной апельсиновой отдушки и 2 кг просеянного стеарата магния. Готовая смесь была спрессована на прессе с круговым ходом в таблетки с диаметром 7 мм и массой 125 мг.
Пример 10
Были смешаны следующие компоненты: 21,4 кг варденафил дигидрата, 60 кг измельченной янтарной кислоты, 1,1 кг сукралозы и 342,1 кг Pharmaburst® В2, 13,2 кг просеянного стеарата магния и 2,2 кг порошкообразной апельсиновой отдушки. Смесь была спрессована в таблетки с диаметром 9 мм и массой 220 мг (соответствует дозе 10 мг варденафила).
10 мг варденафила и 30 мг янтарной кислоты растворялись при 25°С в 10 мл физиологического раствора поваренной соли полностью. Скорость растворения таблетки составляла 90% за 5 минут в аппарате USP с лопастями для смешивания с 900 мл физиологического раствора поваренной соли, 37°С и 50 оборотов в минуту.
|