Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ИМАТИНИБА И ЕГО ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
Вид РИД
Изобретение
Область техники
Предметом настоящего изобретения является способ получения 4-метил-N-3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамина и его аналогов, промежуточных соединений, используемых для синтеза иматиниба, или 4-[(4-метил-1-пиперазинил)метил]-N-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]фенил]бензамида.
Существующий уровень техники
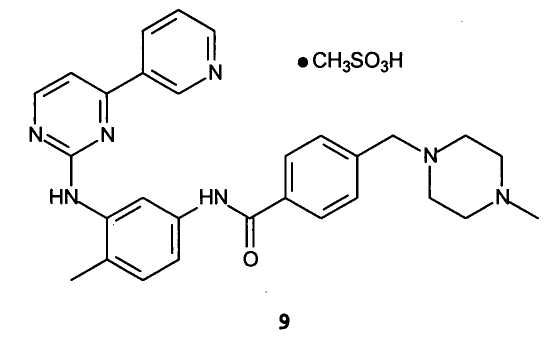
Иматиниба мезилат, молекула формулы 9, является важным лекарственным средством, применяемым в лечении хронического миелолейкоза.
Его получение впервые было описано в Европейском патенте ЕР 564409 фирмы Новартис, и обобщенный синтез представлен на следующей схеме. В данном документе не сообщают о выходах с различных рабочих операций.
Схема 1
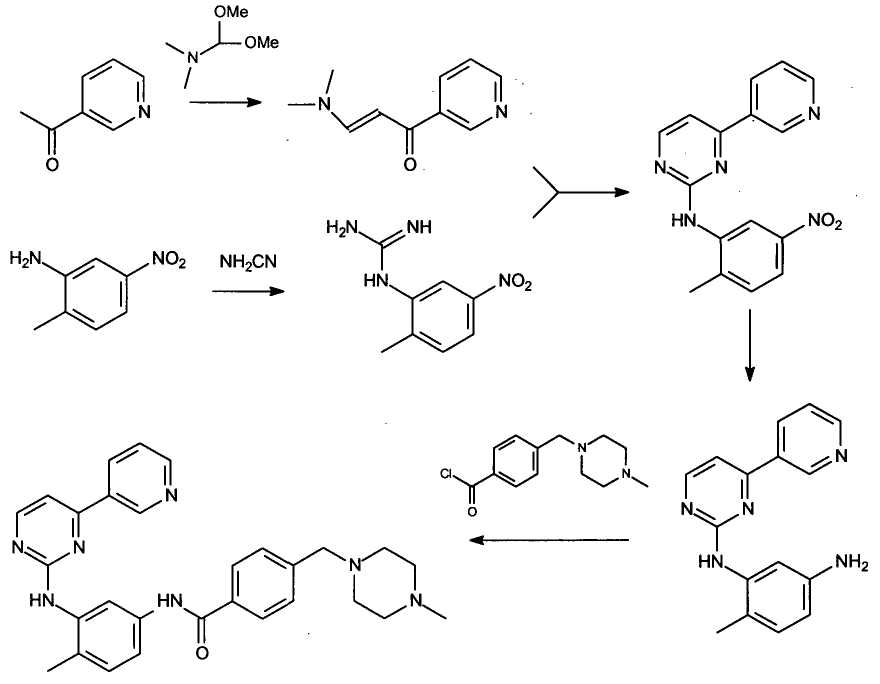
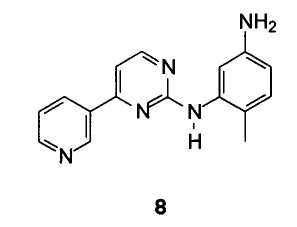
Однако в Международной публикации WO 2006/071130 было описано, что при использовании указанного способа синтеза общий выход иматиниба не превышал 15%. Кроме того, многие стадии синтеза представляют собой продолжительные и трудновыполнимые операции, и по этой причине они не пригодны для промышленного применения. Кроме того, диметилацеталь N,N-диметилформамида является дорогостоящим реагентом, и поэтому данный способ синтеза не является экономически выгодным. Перечисленные выше проблемы представляются особенно существенными для синтеза промежуточного соединения 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамина формулы 8.
Поэтому технической задачей, которая должна быть решена с учетом известного уровня техники, является разработка способа получения 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамина и его аналогов, который осуществляется с высокими выходами, является легко выполнимым в промышленном масштабе и экономически выгодным.
Краткое описание изобретения
Настоящее изобретение относится к получению 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамина и его аналогов, исходя из β-оксо-3-пиридинпропионового альдегида, его соли или его простого енольного эфира, или из β-оксо-3-пиридинпропионовой кислоты или ее сложного эфира.
Подробное описание изобретения
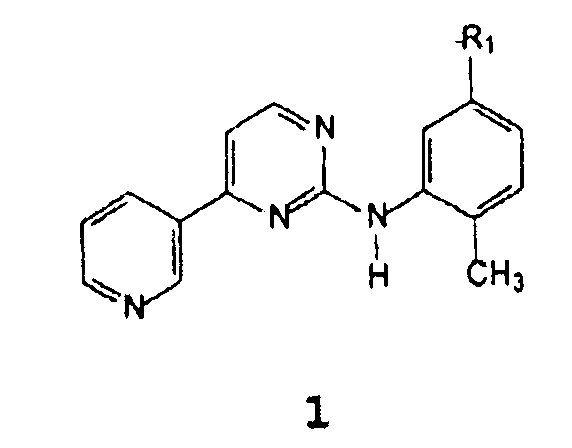
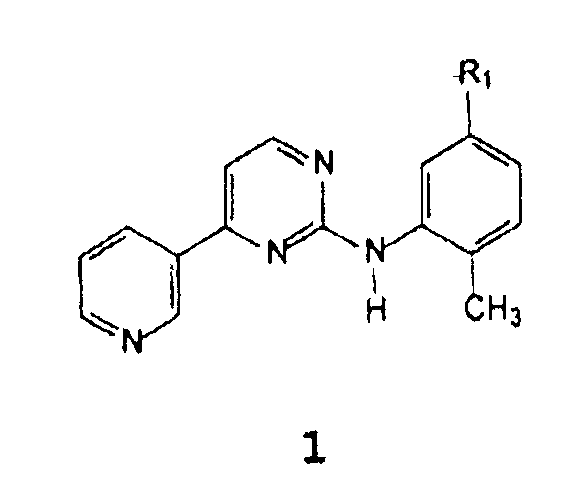
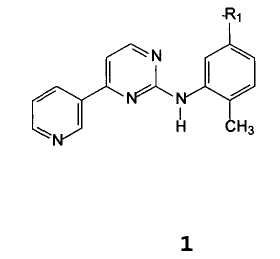
Неожиданно был найден способ получения соединения формулы 1
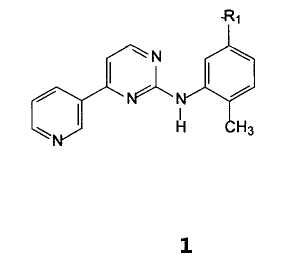
В которой R1 представляет собой амино, нитро, галоген, гидрокси, NH(CO)R3, NHR4,
R3 представляет собой 4-(галогенметил)фенил, 4-(гидроксиметил)фенил, 4-((4-метилпиперазинил)карбонил)фенил, 4-(алкоксикарбонил)фенил или 4-[(4-метил-1-пиперазинил)метил]фенил, где алкокси означает C1-C4 алкокси, R4 представляет собой защитную группу для аминогруппы,
Способ, включающий стадии
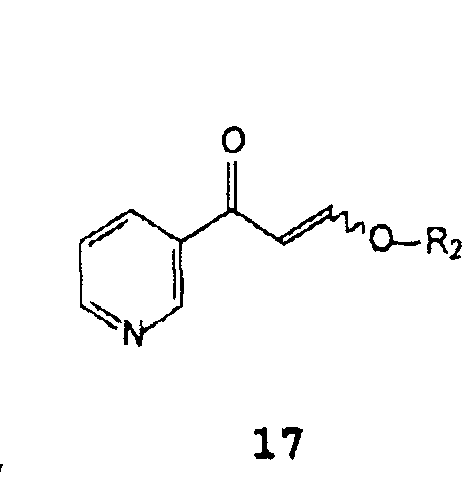
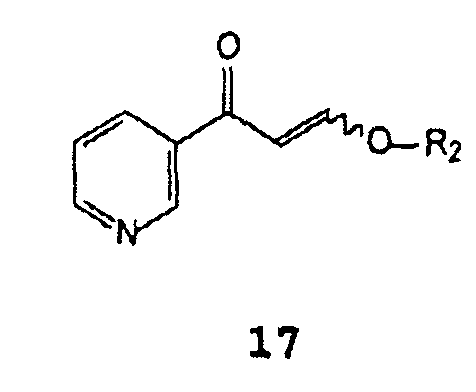
A) взаимодействие β-оксо-3-пиридинпропионового альдегида, его соли или его енольного простого эфира формулы 17
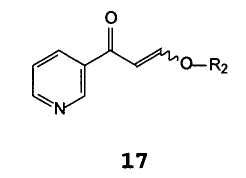
В которой R2 представляет собой водород, C1-C4 алкил, бензил или фенил,
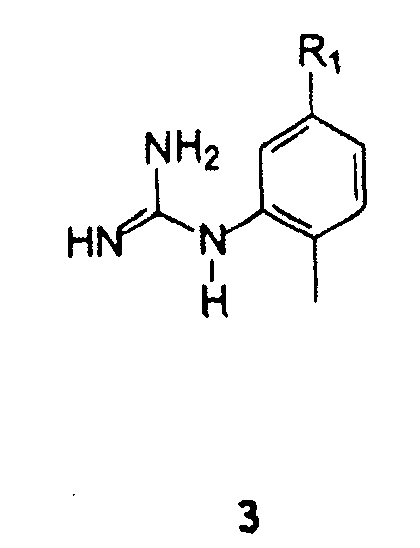
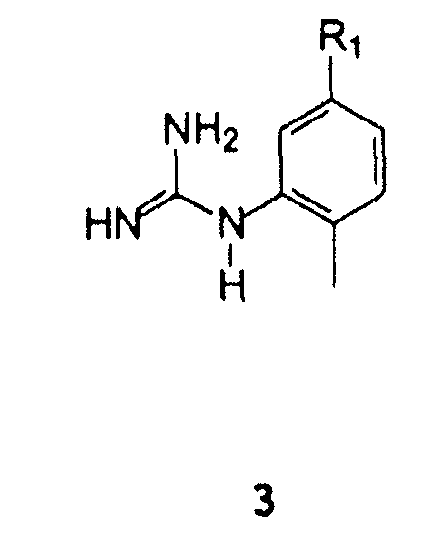
С арилгуанидином формулы 3
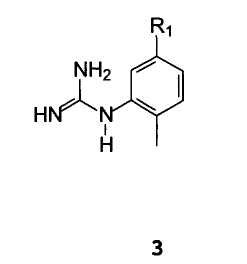
В которой R1 имеет значение, описанное выше,
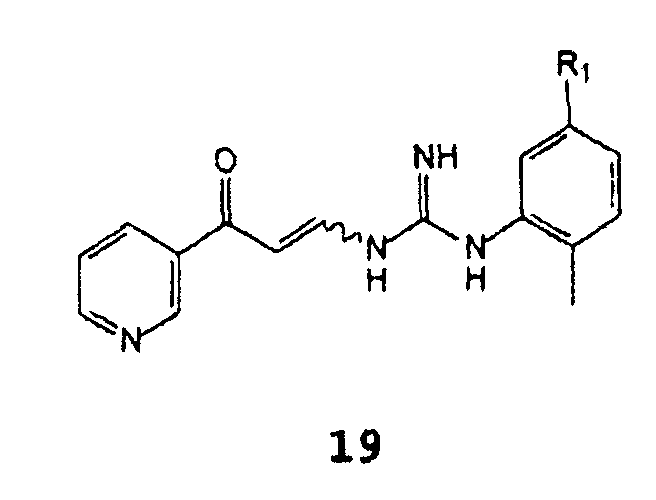
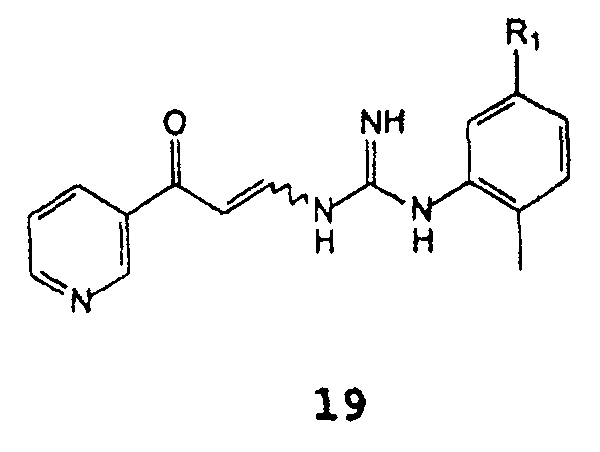
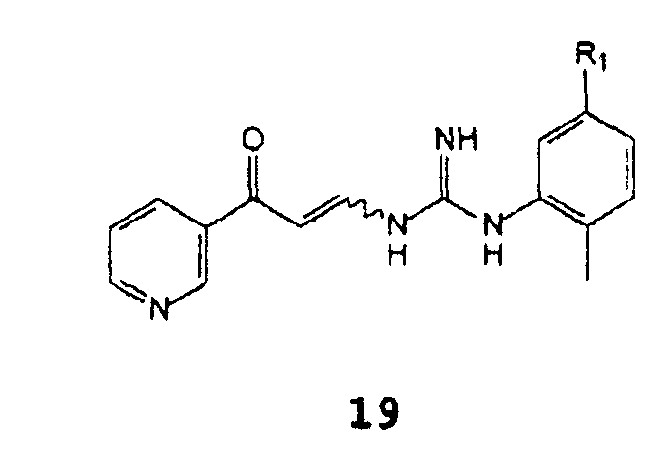
С получением соединения формулы 19
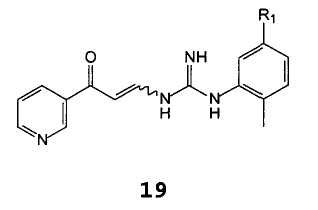 ,
,
В которой R1 имеет указанное выше значение,
И b) циклизация соединения формулы 19 в присутствии основания.
R1 предпочтительно представляет собой амино, нитро, NH(CO)R3, NHR4, более предпочтительно амино- или нитрогруппу;
R2 предпочтительно представляет собой водород, изопропил или n-бутил;
R3 предпочтительно представляет собой 4-(хлорметил)фенил или 4-[(4-метил-1-пиперазинил)метил]фенил;
R4 предпочтительно представляет собой карбоксамид, сульфонамид или карбамат, более предпочтительно данная группа представляет собой COCH3, (CO)obn, (CO)O-t-Bu, (SO2)Ph, (SO2)(4-Me-Ph)-группу;
Когда R1 означает NH(CO)R3-группу, в которой R3 представляет собой 4-(галогенметил)фенил, 4-(гидроксиметил)фенил, 4-((4-метилпиперазинил)карбонил)фенил, 4-(алкоксикарбонил)фенил, где алкокси означает C1-C4 алкокси, описанный выше синтез будет приводить к более перспективному промежуточному соединению в синтезе иматиниба, чем 4-метил-N3- [4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамин, соединение формулы 8; такое промежуточное соединение обладает способностью превращаться в иматиниб способами, известными в литературе (смотреть международную публикацию WO 2004108699, Европейский патент EP 52853, международную публикацию WO 2005005414 или публикацию в Arch. Pharmacal Res., 27(11), 1093-1098 (2004)).
В случае, когда R1 является NH(CO)R3-группой, в которой R3 представляет собой 4-[(4-метил-1-пиперазинил)метил]фенил, описанный выше синтез прямо приведет к иматинибу. Реакция циклизации b) требует присутствия основания, предпочтительно Выбранного из группы, состоящей из гидроксида натрия, карбоната натрия, C1-C4 алкоголятов натрия, гидроксида калия, карбоната калия, C1-C4 алкоголятов калия, гидроксида лития, карбоната лития, C1-C4 алкоголятов лития, гидроксида цезия, карбоната цезия, аммиака и 4-диметиламинопиридина, более предпочтительным является гидроксид калия. Основание может отсутствовать на стадии а), или оно может присутствовать даже на стадии а).
Описанный выше способ включает необязательную стадию выделения промежуточного соединения формулы 19 при условии, что стадию а) не осуществляют в присутствии основания, используемого на стадии b); в таком случае промежуточное соединение получают с высоким выходом и чистотой.
Синтез предпочтительно осуществляют в растворителе, выбранном из группы, состоящей из метанола, этанола, изопропанола, n-бутанола, диметилсульфоксида, диметилформамида, диметилацетамида, N-метилпирролидона, толуола и их смесей, более предпочтительным является изопропанол. Стадию а) предпочтительно осуществляют при температуре, колеблющейся между 0°С и 50°С, и в период времени между 2 и 6 часами, и стадию b) предпочтительно осуществляют при температуре, колеблющейся между 80°С и 140°С, и в период времени между 6 и 24 часами.
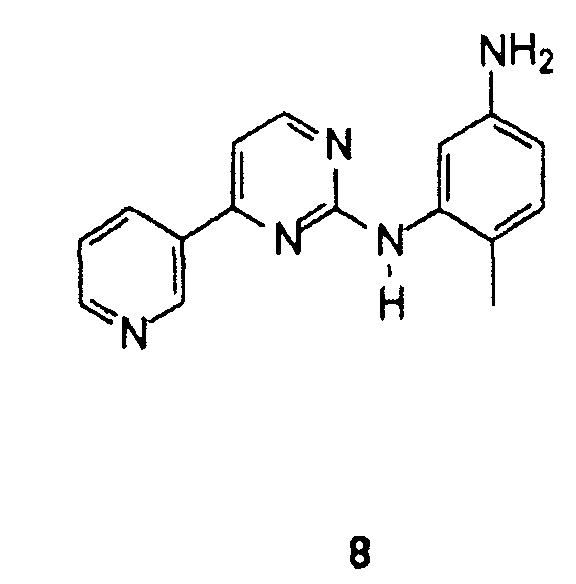
Особенно предпочтительным вариантом осуществления изобретения является способ получения 4-метил-N3-[4-(3- пиридинил)-2-пиримидинил]-1,3-фенилендиамина формулы 8
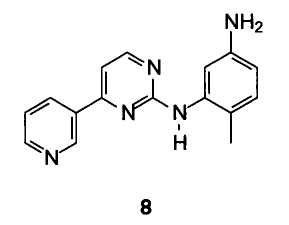
Включающий стадии
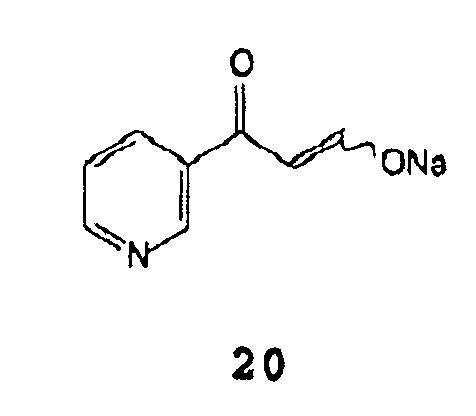
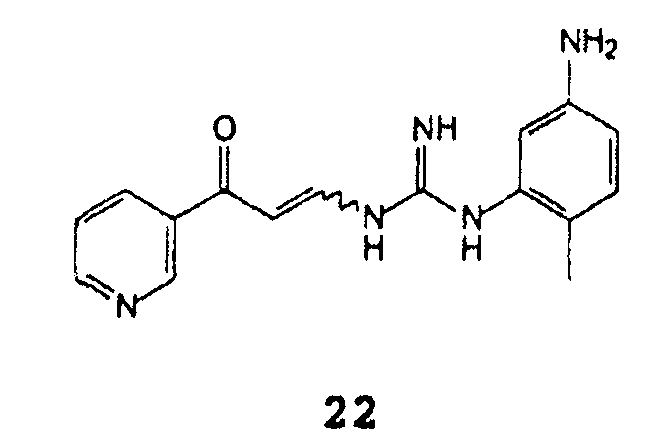
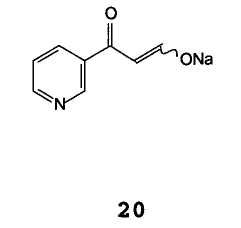
А) взаимодействие натриевой соли β-оксо-3-пиридинпропионового альдегида формулы 20 (или его таутомера)
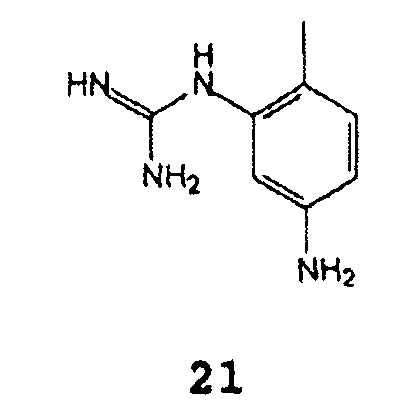
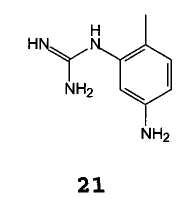
С (2-метил-5-аминофенил)гуанидином формулы 21
С получением соединения формулы 22
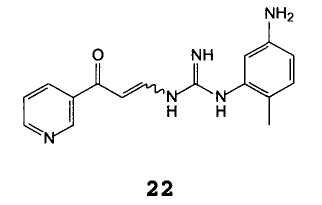
B) циклизация промежуточного соединения формулы 22 в присутствии основания.
К тому же (2-метил-5-аминофенил)гуанидин взаимодействует с β-оксо-3-пиридинпропионовым альдегидом быстрее, чем (2-метил-5-Нитрофенил)гуанидин.
После добавления кислоты к смеси натриевой соли β-оксо-3-пиридинпропионового альдегида формулы 20 и (2-метил-5-аминофенил)гуанидина формулы 21 при комнатной температуре продукт формулы 22 выпадает в осадок, который может быть отфильтрован.
Неочищенный 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамин подходящим образом кристаллизуют из толуола с выходом 80% и чистотой выше 99% (ВЭЖХ). Продукт такого качества используют в синтезе иматиниба, описанном в Европейском патенте ЕР 564409.
β-Оксо-3-пиридинпропионовый альдегид или его енольный простой эфир формулы 17 подходящим образом синтезируют путем добавления кислоты к соли β-оксо-3-пиридинпропионового альдегида формулы 18
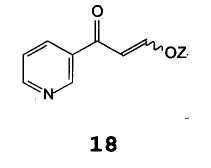
В которой Z представляет собой щелочной металл или щелочноземельный металл, предпочтительно натрий или калий. В случае, когда R2 в соединениях формулы 17 отличается от водорода, растворителем, используемым для их получения, является спирт формулы R2OH. Кислотой предпочтительно является хлористоводородная кислота или уксусная кислота.
Натриевая соль β-оксо-3-пиридинпропионового альдегида формулы 20 и ее аналоги формулы 18 могут быть получены согласно Методикам, описанным в патенте Германии DE 2125310, и могут быть выделены или непосредственно использованы.
(2-Метил-5-аминофенил)гуанидин формулы 21 и его аналоги формулы 3 могут быть получены согласно методикам, описанным в Международной публикации WO 2004110452.
Другим предметом настоящего изобретения являются соединения формулы 19
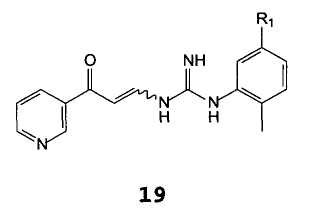
В которой R2 имеет значение, описанное выше.
В особенности, предпочтительным является соединение формулы 22.
Другой аспект настоящего изобретения заключается во втором способе получения 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамина и его аналогов, исходя из β-оксо-3-пиридинпропионовой кислоты или ее сложного эфира.
Неожиданно был найден способ получения соединения формулы 1′
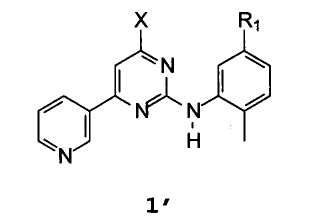
В которой R1 представляет собой нитро, амино, галоген, гидрокси, NH(CO)R3, NHR4,
X представляет собой водород, хлор, бром, йод, гидрокси или OR5,
R3 представляет собой 4-(галогенметил)фенил, 4-(гидроксиметил)фенил, 4-((4-метилпиперазинил)карбонил)фенил, 4-(алкоксикарбонил)фенил или 4-[(4-метил-1-пиперазинил)метил]фенил, где алкокси означает C1-C4 алкокси, R4 представляет собой защитную группу для аминогруппы,
R5 представляет собой активирующую группу для гидроксильной группы,
Способ, включающий взаимодействие β-оксо-3-пиридинпропионовой кислоты или ее сложного эфира формулы 2
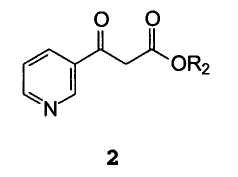
В которой R2 представляет собой водород, C1-с4алкил, бензил или фенил,
С арилгуанидином формулы 3
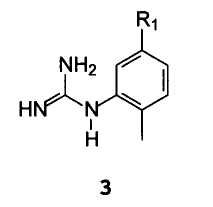
В которой R1 имеет значение, описанное выше.
R1 предпочтительно представляет собой нитро, амино, NH(CO)R3, NHR4, более предпочтительно нитро- или аминогруппу;
X предпочтительно представляет собой водород, хлор, бром или гидрокси;
R2 предпочтительно представляет собой метил, этил или Изопропил;
R3 предпочтительно представляет собой 4-(хлорметил)фенил или 4-[(4-метил-1-пиперазинил)метил]фенил;
R4 предпочтительно представляет собой карбоксамид, сульфонамид или карбамат, более предпочтительно данная группа представляет собой COCH3, (CO)obn, (CO)O-t-Bu, (SO2)Ph, (SO2)(4-Me-Ph)-группу;
R5 предпочтительно представляет собой сложный эфир карбоновой кислоты или сульфокислоты, более предпочтительно -CO-алкил(C1-C4) или -SO2R6-группу, в которой R6 выбирают из метила, трифторметила, фенила, 4-метилфенила, 4-нитрофенила, 4-бромфенила.
Другой аспект настоящего изобретения относится к соединениям формулы 1′
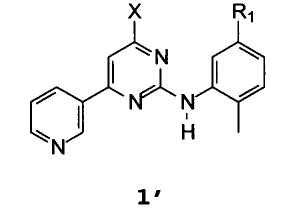
В которой R1 имеет описанное выше значение и Х представляет собой хлор, бром, йод, гидрокси или OR5.
Х предпочтительно представляет собой хлор, бром или гидрокси. В случае, когда Х представляет собой гидроксильную группу, соединение формулы 1′ (указанное выше в енольной форме) может существовать в таутомерной кето-форме.
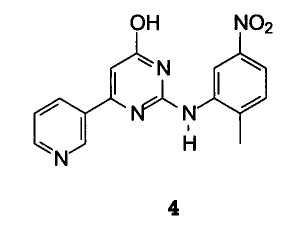
В особенности предпочтительным вариантом осуществления изобретения является способ получения 6-гидрокси-N-(2-метил- 5-нитрофенил)-4-(3-пиридил)-2-пиримидинамина формулы 4
Включающий взаимодействие этил β-оксо-3-пиридинпропионата 5
С (2-метил-5-нитрофенил)гуанидином формулы 6
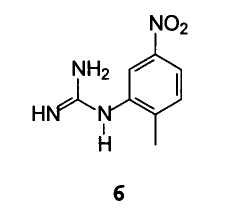
Взаимодействие предпочтительно осуществляют в растворителе, выбранном из группы, состоящей из диметилформамида, N-метилпирролидона, изопропанола, 2-метоксиэтилового простого эфира, диметилсульфоксида, более предпочтительно N-метилпирролидона, при температуре, предпочтительно колеблющейся между 100°С и 160°С, и в течение периода времени, предпочтительно колеблющегося между 6 и 18 часами.
Реакцию проводят при высоких температурах, что способствует протеканию процессов конденсации и дистилляции спирта, воды и побочных продуктов, которые образуются в течение реакции.
β-Оксо-3-пиридинпропионовую кислоту или ее сложный эфир формулы 2 предпочтительно используют в молярном отношении, колеблющемся между 1,2:1 и 2:1 относительно арилгуанидина формулы 3.
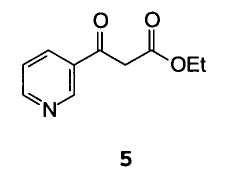
Этил β-оксо-3-пиридинпропионат 5 и, по аналогии, соединения формулы 2 могут быть получены согласно методикам, описанным в Arch. Pharm., 291, 12-22 (1958) и J. Am. Chem. Soc., 63, 490-492 (1941).
Выполняя настоящее изобретение, можно получить 6-гидрокси-N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамин формулы 4 с выходом выше 70% и с чистотой выше 95%. Такой продукт используют в синтезе 6-хлор-N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамина, приведенном в описании ниже.
Описанный выше способ включает необязательную стадию галогенирования для получения соединений формулы 1′, в которой Х представляет собой хлор, бром или йод и R1 имеет указанное выше значение, способ, включающий взаимодействие соединений формулы 1′, в которой Х представляет собой гидроксил или OR5 и R5 имеет указанное выше значение, с галогенирующим реагентом.
В особенности предпочтительным вариантом осуществления изобретения является способ получения 6-хлор-N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамина формулы 7
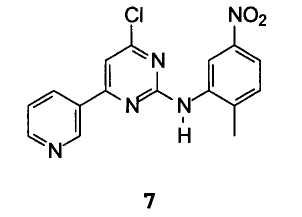
Способ, включающий взаимодействие 6-гидрокси-N-(2-метил-5- нитрофенил)-4-(3-пиридил)-2-пиримидинамина с галогенирующим реагентом. Галогенирующий реагент предпочтительно выбирают из группы, состоящей из хлорокиси фосфора, треххлористого фосфора, пятихлористого фосфора, тионилхлорида, бромокиси фосфора, трехбромистого фосфора, пятибромистого фосфора и трехиодистого фосфора, более предпочтительным является хлорокись фосфора.
Реакцию активизируют путем использования основания, предпочтительно выбранного из группы, состоящей из гидроксида натрия, карбоната натрия, бикарбоната натрия, гидроксида калия, карбоната калия, бикарбоната калия, гидроксида цезия, карбоната цезия, бикарбоната цезия, более предпочтительно карбоната калия, предпочтительно добавленного в количествах 1-3 эквивалента.
Взаимодействие предпочтительно осуществляют в растворителе, выбранном из толуола и ксилола, или в отсутствие растворителя, более предпочтительно в отсутствие растворителя. Реакцию предпочтительно проводят при температуре, колеблющейся между 20°С и 100°С, и в период времени между 3 и 18 часами.
Реакцию активизируют путем использования галогенирующего реагента в избытке относительно соединения формулы 1′, предпочтительно в молярном отношении между 8:1 и 20:1; такой избыток реагента способствует развитию реакции, и он может быть впоследствии извлечен путем дистилляции при пониженном давлении.
Соединение формулы 1′, в которой Х представляет собой хлор, бром или йод, может быть очищено кристаллизацией или измельчением из одного или более растворителей, предпочтительно выбранных из группы, состоящей из воды, толуола, ксилола, этилацетата, изопропилацетата и изопропанола, более предпочтительно из воды и толуола.
Выполняя настоящее изобретение, можно получить сырой хлоргидрат 6-хлор-N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамина с количественным выходом и с чистотой выше 75%. Продукт такого качества используют в синтезе N-(2-метил-5-аминофенил)-4-(3-пиридил)-2-пиримидинамина, приведенном в описании ниже.
Описанный выше способ включает необязательную стадию восстановления для получения соединений формулы 1′, в которой Х представляет собой водород, и R1 имеет упомянутое выше значение, способ, включающий взаимодействие соединений формулы 1′, в которой Х представляет собой хлор, бром или йод или -OSO2R6, где R6 имеет упомянутое выше значение, с восстанавливающим реагентом.
В случае, когда R1 представляет собой нитрогруппу, восстановление осуществляется посредством удаления галогена из пиримидинового кольца и сопутствующего восстановления нитрогруппы до аминогруппы бензольного кольца. В особенности предпочтительным вариантом осуществления изобретения является способ получения 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1, 3-фенилендиамина формулы 8
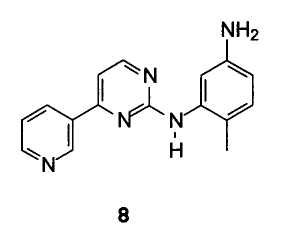
Включающий взаимодействие 6-хлор-N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамина формулы 7 с восстанавливающим реагентом.
Восстанавливающий реагент предпочтительно выбирают из группы, состоящей из водорода, циклогексадиена, муравьинокислого аммония, двухлористого олова, олова, хлористого олова, никеля, литийалюминийгидрида, натрийалюминийгидрида, гидросульфита натрия, более предпочтительным является водород. В случае использования водорода, циклогександиена и муравьинокислого аммония реакцию проводят в присутствии катализатора, предпочтительно основанного на палладии или никеле, более предпочтительно выбранного из группы, состоящей из палладия на угле, палладия на сульфате бария и палладия на карбонате кальция. Катализатор предпочтительно используют в количествах между 0,02 и 0,1 в молях относительно соединения, подвергаемого восстановлению. Реакцию предпочтительно осуществляют в присутствии основания, предпочтительно выбранного из группы, состоящей из триэтиламина, пиридина, гидроксида натрия, карбоната натрия, бикарбоната натрия, гидроксида калия, карбоната калия, бикарбоната калия, гидроксида цезия, карбоната цезия, бикарбоната цезия, более предпочтительным является триэтиламин.
Восстановление предпочтительно осуществляют в растворителе, выбранном из группы, состоящей из этанола, метанола, изопропанола, этилацетата, изопропилацетата, тетрагидрофурана и диметилформамида, более предпочтительно из этанола, реакцию предпочтительно осуществляют при температуре, колеблющейся между 20 и 80°С, и в период времени между 2 и 18 часами.
Соединение формулы 1′, применяемое в качестве реагента, в которой Х представляет собой хлор, бром или йод, может быть Использовано в виде свободного основания или в виде соли. Добавление описанного выше основания приводит к нейтрализации кислоты, которая образуется в течение реакции, и солюбилизации реагента формулы 1′, если он существует в солевой форме.
Соединение формулы 1′, полученное путем восстановления, в которой Х представляет собой водород, соответствующим образом очищают кристаллизацией, предпочтительно из толуола или метанола.
Выполняя настоящее изобретение, можно получить сырой 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамин формулы 8 с высоким выходом и чистотой. Сырой 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамин соответствующим образом очищают перекристаллизацией из толуола или метанола с 80% выходом и чистотой выше 99% (ВЭЖХ). Продукт такого качества используют в синтезе иматиниба, описанном в Европейском патенте ЕР 564409.
В качестве альтернативы, стадию восстановления можно осуществлять до стадии галогенирования. В таком случае описанный выше способ включает необязательную стадию восстановления для получения соединений формулы 1′, в которой R1 представляет собой аминогруппу, и Х представляет собой гидрокси или OR5, и R5 имеет упомянутое выше значение, способ, включающий взаимодействие соединений формулы 1′, в которой R1 представляет собой нитрогруппу, с восстанавливающим реагентом. Однако для получения соединения 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамина формулы 8 необходимо, чтобы дальнейшая стадия Восстановления следовала за стадией галогенирования, чтобы удалить Х-группу.
В случае, когда R1 представляет собой NHR4-группу, в которой R4 представляет собой защитную группу для аминогруппы, или Х представляет собой OR5-группу, в которой R5 представляет собой активирующую группу для гидроксильной группы, необходимо предусмотреть дальнейшие стадии введения и удаления защитных или активирующих групп для получения 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиаминового соединения формулы 8. В частности, способ синтеза соединений формулы 1′, в которой Х представляет собой -OSO2R6-группу, и R6 имеет упомянутое выше значение, включает взаимодействие соединений формулы 1′, в которой Х представляет собой гидроксигруппу, с сульфонилирующим реагентом, предпочтительно R6SO2Y, у которого Y представляет собой хлор, бром, йод, -OSO2R6.
В случае, когда R1 является NH(CO)R3-группой, в которой R3 представляет собой 4-(галогенметил)фенил, 4-(гидроксиметил)фенил, 4-((4-метилпиперазинил)карбонил)фенил, 4-(алкоксикарбонил)фенил, где алкокси означает C1-C4 алкокси, описанный выше синтез приведет к более перспективному промежуточному соединению в синтезе иматиниба по сравнению с 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиаминовым соединением формулы 8.
В случае, когда R1 является NH(CO)R3-группой, в которой R3 представляет собой 4-[(4-метил-1-пиперазинил)метил]фенил, описанный выше синтез приведет прямо к иматинибу.
Другой аспект настоящего изобретения заключается в третьем Способе получения 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамина и его аналогов, исходя из β-оксо-3-пиридинпропионовой кислоты или ее сложного эфира.
Неожиданно был найден способ получения соединений формулы 1
В которой R1 представляет собой нитро, амино, галоген, гидрокси, NH(CO)R3, NHR4,
R3 представляет собой 4-(галогенметил)фенил, 4-((4-метилпиперазинил)карбонил)фенил, 4-(гидроксиметил)фенил, 4-(алкоксикарбонил)фенил или 4-[(4-метил-1-пиперазинил)метил]фенил, где алкокси означает C1-C4 алкокси,
R4 представляет собой защитную группу для аминогруппы,
Способ, включающий стадии:
А) взаимодействие β-оксо-3-пиридинпропионовой кислоты или ее сложного эфира формулы 2
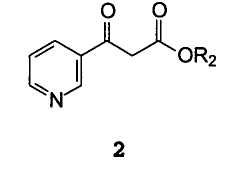
В которой R2 представляет собой водород, С1-C4 алкил, бензил или фенил,
С ортомуравьиным эфиром формулы HC(OR7)3, в которой R7 представляет собой C1-C4 алкил, бензил или фенил,
С получением енольного эфира формулы 10
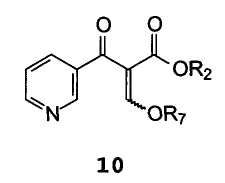
В которой R2 и R7 имеют значение, упомянутое выше,
B) взаимодействие енольного эфира формулы 10 с арилгуанидином формулы 3
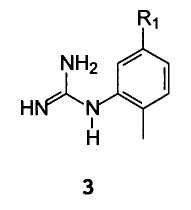
В которой R1 имеет значение, упомянутое выше,
С получением соединения формулы 11
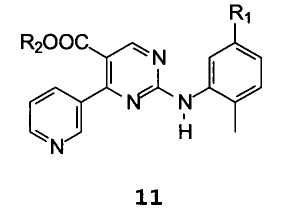 ,
,
В которой R1 и R2 имеют значение, упомянутое выше,
С) удаление COOR2-группы.
R1 предпочтительно представляет собой нитро, амино, NH(CO)R3, NHR4, более предпочтительно нитро- или аминогруппу; R2 предпочтительно представляет собой метил, этил или изопропил;
R3 предпочтительно представляет собой 4-(хлорметил)фенил или 4-[(4-метил-1-пиперазинил)метил]фенил;
R4 предпочтительно представляет собой карбоксамид, сульфонамид или карбамат, более предпочтительной группой является COCH3, (CO)obn, (CO)O-t-Bu, (SO2)Ph, (SO2)(4-Me-Ph)-группа;
R7 предпочтительно представляет собой метил, этил или фенил.
Другой аспект настоящего изобретения относится к соединениям формулы 10
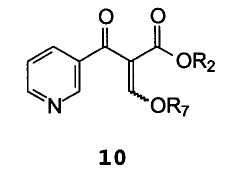
В которой R2 и R7 имеют значение, упомянутое выше.
Другой аспект настоящего изобретения относится к соединениям формулы 11
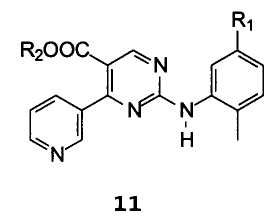
В которой R1 имеет значение, описанное выше, и R2 представляет собой водород, C1-C4 алкил, бензил или фенил, или щелочной или щелочноземельный металл.
R2 предпочтительно представляет собой водород, метил, этил, изопропил, натрий или калий.
В особенности предпочтительным вариантом осуществления изобретения является способ получения N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамина формулы 13
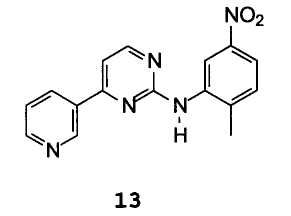
Способ, включающий стадии:
А) взаимодействие этил β-оксо-3-пиридинпропионата 5
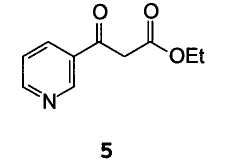
С триэтоксиметаном формулы HC(oet)3 с получением этил α-(этоксиметилен)-β-оксо-3-пиридинпропионата формулы 12
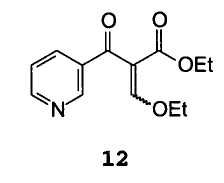
B) взаимодействие соединения формулы 12 с арилгуанидином формулы 6
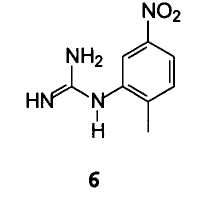
С получением 2-[(2-метил-5-нитрофенил)амино]-4-(3-пиридинил)пиримидин-5-карбоксилата формулы 14
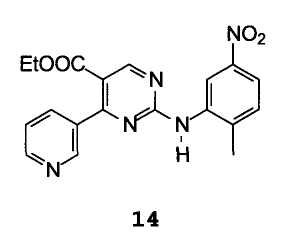
С) удаление cooet-группы.
В случае, где соединение формулы 2 представляет собой β-оксо-3-пиридинпропионовую кислоту (R2=H), реакцией с ортомуравьиным эфиром формулы HC(OR7)3 можно получить соединение формулы 10, в которой группа R2 является такой же, как и R7. Стадию а) предпочтительно, но необязательно, осуществляют в присутствии ангидрида или кислоты. Ангидридом предпочтительно является уксусный ангидрид, и кислоту предпочтительно выбирают из группы, состоящей из р-толуолсульфоната пиридиния, сухой хлористоводородной кислоты, сухой бромистоводородной кислоты, серной кислоты, метансульфокислоты, трифторметансульфокислоты, бензолсульфокислоты, р-толуолсульфокислоты, более предпочтительной является р-толуолсульфонат пиридиния. Ангидрид предпочтительно используют в количестве, колеблющемся между 1 и 3 эквивалентами, в то время как кислоту предпочтительно используют в количествах, колеблющихся между 0,001 и 0,1 эквивалентами относительно соединения формулы 2.
Ортомуравьиный эфир предпочтительно используют в качестве растворителя, с избытком между 1 и 6 объемами относительно соединения формулы 2, и избыток может быть регенерирован в конце реакции путем дистилляции.
Реакцию предпочтительно осуществляют при температуре между 100°С и 140°С и в период времени между 1 и 5 часами путем дистилляции спирта R7OH, который образуется в течение конденсации.
Соединение этил α-(этоксиметилен)-β-оксо-3-пиридинпропионат формулы 12 обычно получают с количественным выходом и с чистотой выше 80%. Продукт такого качества используют на стадии b).
Стадию b) предпочтительно осуществляют в высококипящем органическом растворителе, предпочтительно выбранном из группы, состоящей из толуола, ксилола, хлорбензола, диметилсульфоксида, N-метилпирролидона, изопропилацетата, еще более предпочтительно из толуола. Реакцию предпочтительно осуществляют при температуре, колеблющейся между 100°С и 150°С в период времени между 30 минутами и 5 часами, путем отгона спирта и воды, которые образуются в течение реакции.
Соединение формулы 10 предпочтительно используют в молярном избытке относительно арилгуанидина формулы 3.
Соединение формулы 11 может быть выделено в конце реакции путем охлаждения реакционной смеси и фильтрования кристаллизованного продукта. Этил 2-[(2-метил-5-нитрофенил)амино]-4-пиридин-3-илпиримидин-5-карбоксилат 14 получают с выходом выше 85% и чистотой выше 97% (ВЭЖХ).
Стадия с) предпочтительно включает стадии
С1) гидролиза соединений формулы 11 с получением соединений формулы 15
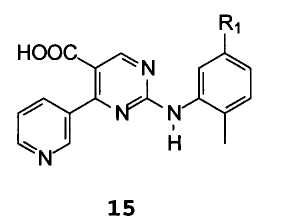
С2) удаления СООН-группы путем декарбоксилирования.
В особенности предпочтительным вариантом осуществления изобретения является способ получения N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамина формулы 13, включающий стадии:
С1) гидролиз этил 2-[(2-метил-5-нитрофенил)амино]-4-пиридин-3-илпиримидин-5-карбоксилата формулы 14 с получением 2-[(2-метил-5-нитрофенил)амино]-4-(3-пиридинил)пиримидин-5-карбоновой кислоты формулы 16
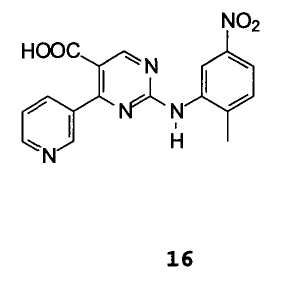
С2) удаление СООН-группы путем декарбоксилирования.
Стадия гидролиза с1) может быть осуществлена как в присутствии кислоты, так и в присутствии основания.
Кислотой предпочтительно является неорганическая кислота, предпочтительно выбранная из группы, состоящей из серной, хлористоводородной, бромистоводородной и хлорной кислоты, предпочтительной является хлористоводородная кислота.
Основанием предпочтительно является неорганическое основание, предпочтительно выбранное из карбоната натрия, Гидроксида натрия, карбоната калия, гидроксида калия, карбоната лития, гидроксида лития, более предпочтительно карбоната натрия, и его предпочтительно используют в молярном отношении между 1:1 и 3:1 относительно сложного эфира формулы 11.
Стадию с1) предпочтительно осуществляют в воде или спирте или в их смеси. Спирт предпочтительно выбирают из группы, состоящей из метанола, этанола, изопропанола, более предпочтительным является этанол.
Реакцию предпочтительно осуществляют при температуре между 80 и 100°С, в период времени между 1 и 18 часами, и в условиях дистилляции, подходящих для завершения реакции.
Соединения формулы 15 могут быть выделены путем охлаждения реакционной смеси и, в случае использования основания для проведения гидролиза, путем подкисления реакционной смеси кислотой, при этом продукт выпадает в осадок в виде кристаллического твердого вещества, которое может быть собрано фильтрацией. Альтернативно, в случае гидролиза в щелочной среде, все соединения формулы 15 можно выделить в виде соответствующих солей.
2-[(2-Метил-5-нитрофенил)амино]-4-(3-пиридинил)пиримидин-5-карбоновую кислоту формулы 16 получают с выходом выше 95% и чистотой выше 95%.
Стадию декарбоксилирования с2) предпочтительно осуществляют при высокой температуре и в присутствии кислоты, как для стадии с1), или в присутствии катализатора на основе меди, предпочтительно выбранного из группы, состоящей из металлической меди и окиси меди(II), более предпочтительно окиси меди(II). Катализатор предпочтительно используют в количествах между 0,01 и 0,1 моля относительно реагента формулы 15. Использование меди способствует лучшему протеканию реакции, снижая до минимума побочную реакцию деградации.
Декарбоксилирование предпочтительно осуществляют в растворителе, выбранном из группы, состоящей из хинолина, N-метилпирролидона и сульфолана, еще более предпочтительно N-метилпирролидона. Реакцию предпочтительно осуществляют при температуре между 160 и 200°С и в период времени между 0,5 и 4 часами.
Стадии с1) и с2) могут быть осуществлены в таких же реакционных условиях путем обработки соединений формулы 11 кислотой, предпочтительно хлористоводородной кислотой.
N-(2-Метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамин формулы 13 получают после подщелачивания и фильтрации с количественным выходом и чистотой выше 95%. Продукт такого качества используют в синтезе иматиниба и его аналогов, описанном в Европейском патенте ЕР 564409.
Исходя из соединений формулы 1, в которой R1 представляет собой нитрогруппу, можно получить соединения формулы 1, в которой R1 представляет собой аминогруппу, и, в частности, 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамин формулы 8 согласно описанному выше способу восстановления.
И, наконец, настоящее изобретение предоставляет простой способ получения 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамина и его аналогов, имеющий следующие преимущества:
В отличие от Европейского патента ЕР 564409 в способе не Используют диметилацеталь N,N-диметилформамида, дорогостоящий исходный материал;
Описанные методики являются легкими и могут быть легко перенесены в производство;
Регенерация и рециркуляция многих реагентов, используемых в избытке, являются возможными, способствуя, таким образом, увеличению выхода, не влияя на себестоимость продукции;
Синтез 4-метил-N3-[4-(3-пиридил)-2-пиримидил]-1,3-фенилендиамина формулы 8, исходя из соли β-оксо-3-пиридинпропионового альдегида 21, приводит к общему выходу, равному или выше 80%, синтез N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамина формулы 13, исходя из этил α-(этоксиметилен)-β-оксо-3-пиридинпропионата 12, приводит к общему выходу, равному или выше 70%, и синтез 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамина формулы 8, исходя из этил β-оксо-3-пиридинпропионата 5, приводит к общему выходу, равному или выше 60%, таким образом, присоединяя указанные способы к числу самых экономически выгодных среди способов, описанных в литературе.
Следующие характеристики и преимущества способа изобретения будут понятны из представленного ниже описания предпочтительных типичных вариантов осуществления изобретения, которые даны в качестве не ограничивающего примера.
Примеры
Пример 1: 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамин 8
В условиях инертной атмосферы 16 г натриевой соли β-оксо-3-Пиридинпропионового альдегида, с чистотой 99% (A%) по данным ВЭЖХ и 25% содержания соли (остаток при кальцинации), и 11,7 г (2-метил-5-аминофенил)гуанидина суспендировали в 115 мл n-бутанола. Затем добавляли 9 мл уксусной кислоты и смесь перемешивали при комнатной температуре в течение часа. После этого 6 г гидроксида калия добавляли порциями и смесь кипятили с обратным холодильником в течение 18 часов, при этом удалялась вода с помощью аппарата Дина-Старка. Как только реакция завершалась, суспензию охлаждали и органический слой промывали водой. Органический слой концентрировали до небольшого объема и толуол добавляли. Выпавший осадок фильтровали и после сушки получали 15,5 г продукта с чистотой по данным ВЭЖХ 99,2% (А%), идентифицированного посредством ЖХ-МС и 1Н-ЯМР.
ЖХ-МС: [М+1]+=278.
ЯМР (300 мгц, ДМСО-д6):  (ч/млн) 2,02 (с, 3H); 4,85 (с, 2H); 6,31 (д, 1H); 6,76 (с, 1H); 6,84 (д, 1H); 7,33 (д, 1H); 7,50 (м, 1H); 8,38 (д, 1H); 8,43 (д, 1H); 8,66 (шир.с, 1H); 9,22 (с, 1H).
(ч/млн) 2,02 (с, 3H); 4,85 (с, 2H); 6,31 (д, 1H); 6,76 (с, 1H); 6,84 (д, 1H); 7,33 (д, 1H); 7,50 (м, 1H); 8,38 (д, 1H); 8,43 (д, 1H); 8,66 (шир.с, 1H); 9,22 (с, 1H).
Пример 2: 1-(5-амино-2-метилфенил)-3-[(3-оксо-3-(3-пиридинил-1-проп-1-енил]гуанидин 22
В условиях инертной атмосферы 10 г натриевой соли β-оксо-3-пиридинпропионового альдегида, с чистотой 99% (A%) по данным ВЭЖХ и содержанием соли 25% (остаток при кальцинации), суспендировали в 80 мл изопропанола. Затем добавляли 24 мл 15% раствора хлористоводородной кислоты в изопропаноле и смесь перемешивали при комнатной температуре в течение часа. После этого 7 г (2-метил-5-аминофенил)гуанидина добавляли порциями и Смесь перемешивали при комнатной температуре в течение 12 часов. Как только реакция завершалась, выпавший осадок фильтровали, после сушки получали 13,5 г продукта с чистотой по данным ВЭЖХ 98% (А%) и содержанием соли 30% (остаток при кальцинации), идентифицированного посредством ЖХ-МС.
ЖХ-МС: [М+1]+=296.
Пример 3: N-(2-метил-5-нитрофенил)-4-(3-пиридинил)-2-пиримидинамин 1 (R1=NO2)
В условиях инертной атмосферы 5 г натриевой соли β-оксо-3-пиридинпропионового альдегида, с чистотой 99% (A%) по данным ВЭЖХ и содержанием соли 25% (остаток при кальцинации), и 8 мл хлористоводородной кислоты в изопропаноле суспендировали в 50 мл толуола. Затем добавляли 3,7 г (2-метил-5-нитрофенил)гуанидина и смесь перемешивали при комнатной температуре в течение часа. Смесь кипятили с обратным холодильником в течение 18 часов, при этом удалялась вода с помощью аппарата Дина-Старка. Как только реакция завершалась, суспензию охлаждали до 10°С и выпавший осадок фильтровали; полученный осадок измельчали в теплой воде, после фильтрации и сушки получали 2,5 г продукта с чистотой 96% (А%) по данным ВЭЖХ, идентифицированного посредством ГХ-МС.
МС m/e (относит. Интенсивность): 307 (М+)(100); 292 (76); 260 (63); 246 (38).
Пример 4: этил α-(этоксиметилен)-β-оксо-3-пиридинпропионат 12
В условиях инертной атмосферы 20 г этил β-оксо-3-пиридинпропионата растворяли в 100 мл триэтоксиметана. Затем добавляли 0,2 г р-толуолсульфоната пиридиния и смесь кипятили с Обратным холодильником в течение трех часов, при этом отгонялось 13 мл побочных продуктов. По окончании реакции смесь охлаждали при комнатной температуре и триэтоксиметан отгоняли при пониженном давлении. Остаток брали в 80 мл толуола и смесь обрабатывали обесцвечивающим углем. Раствор концентрировали при пониженном давлении до остатка, получая 26 г продукта в виде темного масла с концентрацией 80% по данным ВЭЖХ (А%). Продукт идентифицировали посредством ГХ-МС.
МС m/e (относит. Интенсивность): 249 (M+) (8); 204 (28); 192 (22); 174 (30); 159 (100); 115 (38); 106 (100).
Пример 5: этил 2-[(2-метил-5-нитрофенил)амино]-4-(3-пиридинил)пиримидин-5-карбоксилат 14
В условиях инертной атмосферы 19 г этил α- (этоксиметилен)-β-оксо-3-пиридинпропионата и 14,8 г (2-метил-5-нитрофенил)гуанидина (полученного из соответствующей соли нитрата путем обработки водным раствором соды в ТГФ) растворяли в 200 мл толуола и раствор кипятили с обратным холодильником, отгоняя около 25 мл легких фракций. По окончании реакции горячий раствор обрабатывали обесцвечивающим углем, охлаждали до 0°С и выпавший осадок фильтровали. После сушки получали 25,5 г продукта с чистотой 97% по данным ВЭЖХ (А%), идентифицированного посредством ГХ-МС и 1Н-ЯМР.
МС m/e (относит. Интенсивность): 379 (M+) (100); 364 (37); 350 (60); 332 (23); 304 (18).
1H ЯМР (300 мгц, cdcl3):  (ч/млн)=1,20 (т, J=7,1, 3H); 2,47 (с, 3H); 4,25 (кв., J=7,1, 2H); 7,37 (са, 1H); 7,40 (с, 1H); 7,46 (м, 1H); 7,90 (дд, J=8,4, J=2,4, 2H); 8,05 (м, 1H); 8,71 (дд, J=4,8, J=1,6, 1H); 9,01 (с, 1H); 9,27 (д, J=2,2, 1H).
(ч/млн)=1,20 (т, J=7,1, 3H); 2,47 (с, 3H); 4,25 (кв., J=7,1, 2H); 7,37 (са, 1H); 7,40 (с, 1H); 7,46 (м, 1H); 7,90 (дд, J=8,4, J=2,4, 2H); 8,05 (м, 1H); 8,71 (дд, J=4,8, J=1,6, 1H); 9,01 (с, 1H); 9,27 (д, J=2,2, 1H).
Т.пл.=125-130°С.
Пример 6: 2-[(2-метил-5-нитрофенил)амино]-4-(3-пиридинил)пиримидин-5-карбоновая кислота 16
Этил 2-[(2-метил-5-нитрофенил)амино]-4-(3-пиридинил)пиримидин-5-карбоксилат в количестве 23 г и 19 г карбоната натрия суспендировали в смеси, состоящей из 150 мл воды и 150 мл этанола. Суспензию кипятили с обратным холодильником в течение трех часов, при этом отгонялся этанол, и потеря объема компенсировалась водой. По окончании реакции реакционную смесь охлаждали до 50°С, и рн доводили до 6 уксусной кислотой. Суспензию фильтровали, получали после сушки 20 г продукта с чистотой по данным ВЭЖХ 95% (А%), который идентифицировали посредством 1Н-ЯМР.
1H ЯМР (300 мгц, cdcl3):  (ч/млн)=2,42 (с, 3H); 3,3 (са, 2H) 7,49 (м, 1H); 7,55 (м, 1H); 7,98 (м, 2H); 8,57 (м, 1H); 8,65 (дд, J=4,6, J=1,5, 1H); 8,73 (д, J=1,7, 1H) 8,96 (с, 1H).
(ч/млн)=2,42 (с, 3H); 3,3 (са, 2H) 7,49 (м, 1H); 7,55 (м, 1H); 7,98 (м, 2H); 8,57 (м, 1H); 8,65 (дд, J=4,6, J=1,5, 1H); 8,73 (д, J=1,7, 1H) 8,96 (с, 1H).
Т.пл.=299,5-302,0°С с выделением газа.
Пример 7: N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамин 13
К 25 мл N-метилпирролидона добавляли 5,0 г 2-[(2-метил-5- нитрофенил)амино]-4-(3-пиридинил)пиримидин-5-карбоновой кислоты и 0,2 г окиси меди. Смесь нагревали до 180°С в течение 2 часов, затем охлаждали до 60°С и добавляли 1 мл 30%-ного водного раствора аммиака и 50 мл воды. Смесь охлаждали до 25°С и выпавший осадок фильтровали, после сушки получали 4,3 г продукта с чистотой по данным ВЭЖХ 97% (А%), который идентифицировали Посредством ГХ-МС.
МС m/e (относит. Интенсивность): 307 (М+) (100); 292 (76); 260 (63); 246 (38).
Пример 8: N-(2-метил-5-нитрофенил)-4-(3-пиридинил)-2-пиримидинамин 13
Этил 2-[(2-метил-5-нитрофенил)амино]-4-(3-пиридинил)пиримидин-5-карбоксилат в количестве 140 г и 109 г карбоната калия суспендировали в смеси, состоящей из 1050 мл воды и 560 мл этанола. Смесь кипятили с обратным холодильником в течение 1 часа, затем 700 мл растворителя медленно отгоняли. По окончании реакции смесь охлаждали до 80°С и доводили рн до 7,95 мл уксусной кислоты. Затем добавляли 560 мл N-метилпирролидона и 0,9 г cuo. Воду отгоняли при пониженном давлении и смесь нагревали до 175-180°С в течение 2 часов. По окончании реакции смесь охлаждали до 80-90°С. Медленно добавляли 1000 мл воды и 5 г ЭДТА, смесь перемешивали при комнатной температуре, продукт фильтровали и промывали водой. После сушки 108 г продукта с чистотой по данным ВЭЖХ 95% (А%) получали. Продукт перекристаллизовывали из 10 объемов смеси ксилол/N-метилпирролидон 95:5 с получением продукта с чистотой 98% (А%) и выходом 80%.
Пример 9: натрия 2-[(2-метил-5-нитрофенил)амино]-4-(3-пиридинил)пиримидин-5-карбоксилат
Этил 2-[(2-метил-5-нитрофенил)амино]-4-(3-пиридинил)пиримидин-5-карбоксилат в количестве 1,0 г и 0,8 г карбоната натрия суспендировали в 20 мл этанола и 4 мл воды. Смесь кипятили с обратным холодильником в течение 4 часов, Отгоняя этанол и компенсируя водой потери объема. Смесь охлаждали при комнатной температуре и выпавший осадок фильтровали с получением 0,84 г продукта.
Т. Пл.=363°С с разложением.
Пример 10: этил α-(этоксиметилен)-β-оксо-3-пиридинпропионат 12
В условиях инертной атмосферы 100 г этил β-оксо-3-пиридинпропионата растворяли в 130 г триэтоксиметана и 400 мл ксилола. Смесь кипятили с обратным холодильником и перемешивали в течение приблизительно 6 часов, при этом отгонялись легкие фракции. По окончании реакции смесь охлаждали до комнатной температуры и избыток триэтоксиметана отгоняли при пониженном давлении. Остаток брали в 50 мл ксилола и смесь концентрировали при пониженном давлении до образования остатка с получением 129 г продукта в виде масла с концентрацией 85% по данным ВЭЖХ (А%).
Пример 11: 6-гидрокси-N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамин 4
(2-Метил-5-нитрофенил)гуанидин в количестве 40 г растворяли в 160 мл N-метилпирролидона. Смесь нагревали до 150°С и этил β-оксо-3-пиридинпропионат добавляли порциями, всего 50 г, в период времени 5 часов, при этом отгоняли приблизительно 15 г побочных продуктов в атмосфере азота. По окончании реакции смесь охлаждали и разбавляли этанолом. Осадок фильтровали, после сушки получали 46,4 г продукта с чистотой по данным ВЭЖХ 99% (А%), идентифицированного посредством ЖХ-МС и 1Н-ЯМР.
ЖХ-МС: [М+1]+=324.
1H ЯМР (300 мгц, cdcl3): 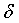 (ч/млн)=2,37 (с, 3H); 6,59 (с, 1H); 7,47 (м, 2H); 7,85 (дд, 1H); 8,36 (дт, 1H); 8,40 (С, 1H); 8,63 (дд, 1H); 9,20 (д, 1H); 9,30 (с, 1H).
(ч/млн)=2,37 (с, 3H); 6,59 (с, 1H); 7,47 (м, 2H); 7,85 (дд, 1H); 8,36 (дт, 1H); 8,40 (С, 1H); 8,63 (дд, 1H); 9,20 (д, 1H); 9,30 (с, 1H).
Пример 12: 6-хлор-N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамин 7
В условиях инертной атмосферы, 27 г 6-гидрокси-N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамина суспендировали в 125 мл хлорокиси фосфора и 11,5 г карбоната калия добавляли порциями. Смесь нагревали до 50°С в течение 6 часов при перемешивании. По окончании реакции суспензию концентрировали с образованием остатка, его разбавляли водой, охлаждали и осадок фильтровали. После сушки получали 26,6 г продукта с чистотой по данным ВЭЖХ 80% (А%), идентифицированного посредством ЖХ-МС и 1Н-ЯМР. Такой неочищенный продукт также содержит побочный продукт в количестве приблизительно 15% (А%), который в течение последующей реакции восстановления дает желаемый продукт (4-метил-N3-[4-(3-пиридинил)-2- пиримидинил]-1,3-фенилендиамин). Поэтому неочищенный материал использовали в Примере 13.
ЖХ-МС: [M+1]+=342; [M+2+1]+=344.
1H ЯМР (300 мгц, cdcl3): 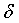 (ч/млн)=2,37 (с, 3H); 7,49 (д, 1H); 7,83 (м, 2H); 7,92 (дд, 1H); 8,6 (с, 1H); 8,75 (д, 1H); 8,84 (с, 1H); 9,36 (с, 1H); 9,80 (с, 1H).
(ч/млн)=2,37 (с, 3H); 7,49 (д, 1H); 7,83 (м, 2H); 7,92 (дд, 1H); 8,6 (с, 1H); 8,75 (д, 1H); 8,84 (с, 1H); 9,36 (с, 1H); 9,80 (с, 1H).
Пример 13: 4-метил-N3-[4-(3-пиридинил)-2-пиримидинил]-1,3-фенилендиамин 8
В автоклав загружали 5 г 6-хлор-N-(2-метил-5-нитрофенил)-4-(3-пиридил)-2-пиримидинамина, 0,5 г палладия на угле 5% влажного с 50% воды, 50 мл этанола и 5 мл триэтиламина. Смесь подвергали гидрированию при 5 бар и комнатной температуре в течение 40 Часов. По окончании реакции катализатор отфильтровывали и фильтраты концентрировали в вакууме. Остаток брали в изопропилацетате и водном растворе карбоната. Слои разделял и органический слой концентрировали с получением после сушки 3 г продукта с чистотой по данным ВЭЖХ 85% (А%), который идентифицировали посредством ЖХ-МС и 1Н-ЯМР.
ЖХ-МС: [M+1]+=278.
1H ЯМР (300 мгц, cdcl3): 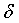 (ч/млн) 2,02 (с, 3H); 4,85 (с, 2H); 6,31 (д, 1H); 6,76 (с, 1H); 6,84 (д, 1H); 7,33 (д, 1H); 7,50 (м, 1H); 8,38 (д, 1H); 8,43 (д, 1H); 8,66 (шир.с, 1H); 9,22 (с, 1H).
(ч/млн) 2,02 (с, 3H); 4,85 (с, 2H); 6,31 (д, 1H); 6,76 (с, 1H); 6,84 (д, 1H); 7,33 (д, 1H); 7,50 (м, 1H); 8,38 (д, 1H); 8,43 (д, 1H); 8,66 (шир.с, 1H); 9,22 (с, 1H).
Пример 14
Получение иматиниба в виде свободного основания
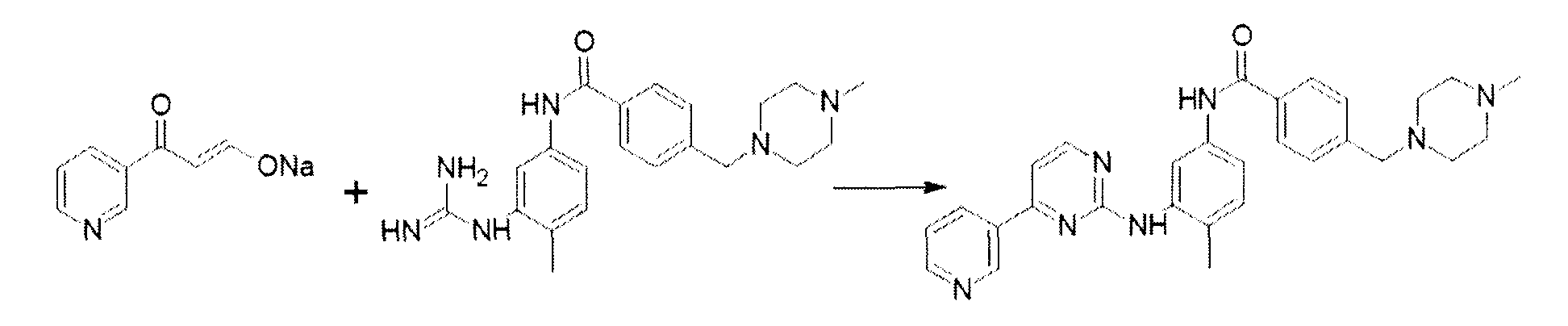
В инертной атмосфере 16 г натриевой соли β-оксо-3-пиридинпропаналя хромотографической чистоты 99% и содержанием соли 25% (остаток после отжига) и 28,6 г N-(3-гуанидино-4-метилфенил)-4-(метилпиперазин-1-ил-метил)бензамида (изготовленного в соответствии с методом, раскрытым в WO 2003066613) суспендируют в 150 мл н-бутанола. Добавляют 9 мл уксусной кислоты и перемешивают реакционную смесь при комнатной температуре в течение часа. Порциями добавляют 6 г гидроксида калия и кипятят полученную смесь с обратным холодильником в течение 18 часов, удаляя воду при помощи насадки Дина-Старка. После окончания превращения суспензию охлаждают и органический слой промывают водой. Органический слой затем концентрируют до малого объема и добавляют толуол. Выпавший осадок дает после сушки 27,5 основания иматиниба, структура продукта подтверждена LC-MS и 1 H ЯМР.
Пример 15
Получение N-(5-хлор-2-метилфенил)-4-(пиридин-3-ил)пиримидин-2-амина
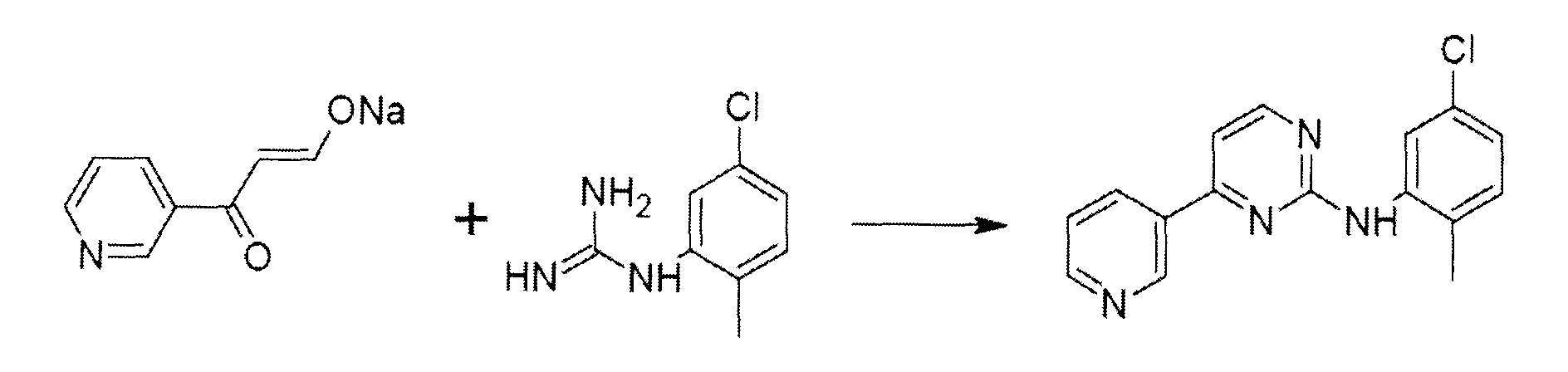
Следуют методике примера 14, однако используют 13,2 г 1-(5-хлор-2-метилфенил)гуанидина, который получают в виде свободного основания из мезилатной соли, которую заказывают в Life chemicals Building Block, номер F2158-0728), вместо N-(3-гуанидино-4-метилфенил)-4-(метилпиперазин-1-ил-метил)бензамида. Получают 15.6 г N-(5-хлор-2-метилфенил)-4-(пиридин-3-ил)пиримидин-2-амина.