Результат интеллектуальной деятельности: ТВЕРДАЯ ПЕРОРАЛЬНАЯ ЛЕКАРСТВЕННАЯ ФОРМА И СПОСОБ ЛЕЧЕНИЯ
Вид РИД
Изобретение
Настоящее изобретение относится к твердым пероральным лекарственным формам, включающим ингибитор ренина перорального действия алискирен или его фармацевтически приемлемую соль в качестве активного ингредиента в среде подходящего носителя. В частности, настоящее изобретение предусматривает галеновы составы, включающие алискирен, предпочтительно его полуфумаровую соль, один или в комбинации с другим активным агентом. Настоящее изобретение также относится к способам их получения и применения в качестве лекарственных средств.
Применяемый ниже термин «алискирен», если не указывается конкретно, подразумевает и свободное основание, и соль, особенно фармацевтически приемлемую соль алискирена, наиболее предпочтительно полуфумарат.
Ренин, выделяемый почками, расщепляет ангиотензиноген в кровотоке с образованием декапептида ангиотензина I. Ангиотензин I в свою очередь расщепляется ангиотензинконвертирующим ферментом в легких, почках и других органах с образованием октапептида ангиотензина II. Октапептид повышает кровяное давление и непосредственно путем сужения артерий, и косвенным образом за счет выделения надпочечниками гормона альдостерона, удерживающего ионы натрия, причем повышение кровяного давления сопровождается увеличением объема внеклеточной жидкости. Ингибиторы ферментативной активности ренина вызывают снижение формирования ангиотензина I. В результате вырабатывается меньшее количество ангиотензина II. Пониженная концентрация такого активного пептидного гормона является непосредственной причиной, например, антигипертензивного эффекта ингибиторов ренина. Следовательно, ингибиторы ренина или их соли могут применяться, например, в качестве антигипертензивных средств или для лечения застойной сердечной недостаточности.
Известно, что ингибитор ренина алискирен, особенно его полуфумарат, эффективен для лечения пониженного кровяного давления, независимо от возраста, пола или расы пациента, и хорошо переносится. Алискирен в форме свободного основания представлен формулой
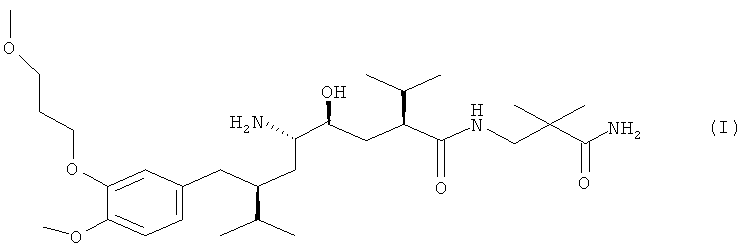
и имеет химическое название 2(S),4(S),5(S),7(S)-N-(3-амино-2,2-диметил-3-оксопропил)-2,7-ди(1-метилэтил)-4-гидрокси-5-амино-8-[4-метокси-3-(3-метоксипропокси)фенил]октанамид. Выше было указано, что наиболее предпочтительной формой является соль полуфумарат алискирена, которая конкретно описана в ЕР 678503 А в примере 83.
Пероральное введение таких фармацевтических агентов в виде таблеток или капсул имеет определенные преимущества по сравнению, например, с внутривенным или внутримышечным введением. Заболевания, требующие лечения болезненными инъекционными составами, расцениваются в качестве более тяжелых заболеваний, чем те состояния, которые можно лечить пероральными лекарственными формами. Однако большим преимуществом пероральных составов является возможность их самостоятельного введения пациентами, в отличие от парентеральных составов, которые в большинстве случаев должен вводить врач или представитель среднего звена медицинского персонала.
Однако алискирен трудно перерабатывать, и поэтому раньше не могли получать пероральные составы в форме таблеток надежным и четким способом. В галеновом составе, включающем алискирен или его фармацевтически приемлемую соль, обычно требуется большое количество лекарственного вещества (ЛВ) с такими свойствами, которые затрудняют приготовление таблеток.
Например, алискирен образует игольчатые кристаллы, которые отрицательно воздействуют на объемные свойства лекарственного вещества, например на реологические свойства и объемную плотность. Лекарственное вещество трудно прессуется, при этом под давлением образуются слабые связи между частицами и полиморфные изменения. Алискирен обладает выраженной эластичностью, и это свойство также приводит к ослаблению связей внутри частиц. Высокая доза (до 300 или 600 мг свободного основания на таблетку) требует большой нагрузки лекарственного вещества, чтобы достичь приемлемого размера таблетки.
Качество лекарственного вещества весьма вариабельно, что влияет на технологические характеристики таблеток, например распределение частиц по размеру, объемную плотность, текучесть, способность к увлажнению, площадь поверхности и тенденцию к спеканию. Кроме того, алискирен высоко гигроскопичен. При соприкосновении с водой полиморфное лекарственное вещество переходит в аморфную стадию, которая демонстрирует пониженную стабильность по сравнению с кристаллическим состоянием. Сочетание этих проблем чрезвычайно затрудняет способ получения стандартных таблеток.
Прямое прессование невозможно в ходе обычного производства, например, из-за высокой гигроскопичности, игольчатой структуры частиц, плохой текучести с соответствующими технологическими проблемами и проблемами стандартизации доз. Процесс вальцевого прессования понижает большой объем лекарственного вещества. До сих пор предварительное прессование лекарственного вещества при вальцевом прессовании делает дальнейшее прессование в таблетки, обладающие значительной жесткостью и устойчивостью к ломкости без высокого содержания эксципиентов, чрезвычайно трудным процессом из-за низкой сжимаемости лекарственного вещества. Было обнаружено, что таблетка, в которой нагрузка лекарственного соединения алискирена выше примерно 35%, приводит к получению некачественных таблеток (например, ломких, жестких) и некачественному процессу (например, склеиванию и ручной сортировке при вальцевом прессовании и таблетированию).
Таким образом, необходимо разработать подходящие и качественные галеновы составы, преодолевающие указанные выше проблемы, связанные со свойствами алискирена.
Настоящее изобретение решает указанные выше проблемы, предлагая качественный состав, который избавлен от всех указанных выше недостатков в ходе процесса, пригодного для крупномасштабного получения твердых пероральных лекарственных форм.
Настоящее изобретение относится к твердой пероральной лекарственной форме, содержащей терапевтически эффективное количество алискирена или его фармацевтически приемлемой соли, в которой активный ингредиент присутствует в количестве более 46 мас.% от общей массы пероральной лекарственной формы, зависящей или не зависящей от какого-либо покрытия или материала капсулы.
Если нет зависимости от какого-либо используемого покрытия или капсулы, активный ингредиент присутствует в количестве более 48 мас.% от общей массы пероральной лекарственной формы. В случае зависимости от какого-либо используемого покрытия или капсулы, активный ингредиент присутствует в количестве более 46 мас.% от общей массы пероральной лекарственной формы.
В предпочтительном варианте осуществления настоящего изобретения активный агент присутствует в количестве 46-60 мас.% от общей массы пероральной лекарственной формы.
В другом предпочтительном варианте осуществления настоящего изобретения активный агент присутствует в количестве более 46% и до 56 мас.% от общей массы пероральной лекарственной формы.
В твердой пероральной лекарственной форме согласно настоящему изобретению, в которой активный агент состоит исключительно из алискирена или его фармацевтически приемлемой соли, предпочтительно, если активный агент присутствует в количестве, варьирующем примерно от 75 мг до примерно 600 мг свободного основания в одной стандартной лекарственной форме.
В предпочтительном варианте осуществления настоящего изобретения активный агент состоит исключительно из алискирена или его фармацевтически приемлемой соли и присутствует в количестве, варьирующем примерно от 75 мг до примерно 300 мг свободного основания в одной стандартной лекарственной форме.
В другом предпочтительном варианте осуществления настоящего изобретения доза алискирена применяется в виде его полуфумарата и содержится в количестве примерно 83, примерно 166, примерно 332 или примерно 663 мг в одной стандартной лекарственной форме.
Твердые пероральные лекарственные формы согласно настоящему изобретению предусмотрены для введения активного ингредиента в меньшей пероральной форме, чем была возможна ранее для данной одной дозы активного агента. Кроме того, полученные пероральные лекарственные формы стабильны и при процессе получения, и при хранении, например, в течение 2 лет в традиционной упаковке, например в запаянной алюминиевой блистерной упаковке.
Понятия «эффективное количество» и «терапевтически эффективное количество» относятся к количеству активного ингредиента или агента, которое снижает прогрессирование подвергаемого лечению состояния или которое полностью или частично излечивает или воздействует паллиативно на это состояние.
Алискирен или его фармацевтически приемлемую соль, например, приготавливают известным способом, прежде всего описанным в ЕР 678503 А, например, в примере 83.
Твердая пероральная лекарственная форма является капсулой или более предпочтительно таблеткой или таблеткой с пленочным покрытием (филм-таблеткой).
Твердая пероральная лекарственная форма согласно настоящему изобретению включает добавки или эксципиенты, которые пригодны для приготовления твердой пероральной лекарственной формы согласно настоящему изобретению. Могут использоваться вспомогательные средства для таблетирования, обычно применяемые в составе таблеток, причем известно, что по данному вопросу имеется много литературных источников, например Fiedler's «Lexicon der Hilfstoffe», 1996, 4-е изд., ECV Aulendorf, включенный в настоящее изобретение в виде ссылки. К ним относятся, но ими не ограничиваются, наполнители, связующие агенты, дезинтегрирующие агенты, замасливатели, глиданты, стабилизаторы, наполнители или разбавители, поверхностно-активные соединения, образующие пленку агенты, смягчители, пигменты и т.п.
В предпочтительном варианте осуществления настоящего изобретения твердая пероральная лекарственная форма согласно настоящему изобретению включает в качестве дополнительного агента наполнитель.
В предпочтительном варианте осуществления настоящего изобретения твердая пероральная лекарственная форма согласно настоящему изобретению включает в качестве дополнительного агента, помимо наполнителя, дезинтегрирующий агент.
В предпочтительном варианте осуществления настоящего изобретения твердая пероральная лекарственная форма согласно настоящему изобретению включает в качестве дополнительного агента, помимо наполнителя и дезинтегрирующего агента, замасливатель.
В предпочтительном варианте осуществления настоящего изобретения твердая пероральная лекарственная форма согласно настоящему изобретению включает в качестве дополнительного агента, помимо наполнителя, дезинтегрирующего агента и замасливателя, глидант.
В предпочтительном варианте осуществления настоящего изобретения твердая пероральная лекарственная форма согласно настоящему изобретению включает в качестве дополнительного агента, помимо наполнителя, дезинтегрирующего агента, замасливателя и глиданта, связующий агент.
Под наполнителями главным образом подразумеваются крахмалы, например картофельный крахмал, пшеничный крахмал, кукурузный крахмал, гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза (ГПМЦ) и предпочтительно микрокристаллическая целлюлоза, например коммерческие продукты, зарегистрированные под торговыми марками AVICEL, FILTRAK, HEWETEN или PHARMACEL.
Под связующими агентами для влажного гранулирования главным образом подразумеваются поливинилпирролидоны (ПВП), например продукт ПВП К 30, ГПМЦ, например марки вязкости 3 или 6 сП, и полиэтиленгликоли (ПЭГ), например ПЭГ 4000. Наиболее предпочтительным связующим является продукт ПВП К 30.
Под дезинтегрирующими агентами главным образом подразумеваются кальциевая соль карбоксиметилцеллюлозы (КМЦ-Са), натриевая соль карбоксиметилцеллюлозы (КМЦ-Na), ПВП с поперечными сшивками (например, продукты CROSPOVIDONE, POLYPLASDONE или KOLLIDON XL), альгиновая кислота, альгинат натрия или гуаровая смола, наиболее предпочтительно ПВП с поперечными сшивками (продукт CROSPOVIDONE), КМЦ с поперечными сшивками (продукт Ac-Di-Sol), натриевая соль карбоксиметилкрахмала (продукты PIRIMOJEL и EXPLOTAB). Наиболее предпочтительным разрыхлителем является продукт CROSPOVIDONE.
Под агентами скольжения главным образом подразумеваются коллоидный кремний, например коллоидный диоксид кремния, например продукт AEROSIL, трисиликат магния, порошкообразная целлюлоза, крахмал, тальк и фосфат трехосновного кальция или их комбинации с наполнителями или связующими агентами, например окремненная микрокристаллическая целлюлоза (продукт PROSOLV). Наиболее предпочтительным глидантом является коллоидный диоксид кремния (например, продукт AEROSIL 200).
Под наполнителями или разбавителями главным образом подразумеваются сахарная глазурь, прессованный сахар, декстраты, декстрин, декстроза, лактоза, маннит, микрокристаллическая целлюлоза, особенно обладающая плотностью примерно 0,45 г/см3, например продукт AVICEL, порошкообразная целлюлоза, сорбит, сахароза и тальк. Наиболее предпочтительным наполнителем является микрокристаллическая целлюлоза.
Под замасливателями главным образом подразумеваются стеарат магния, стеарат алюминия (Al) или кальция (Са), полиэтиленгликоли от ПЭГ 4000 до ПЭГ 8000, тальк, гидрированное касторовое масло, стеариновая кислота и ее соли, сложные эфиры глицерина, стеарилфумарат натрия, гидрированное хлопковое масло и другие. Наиболее предпочтительным смазывающим агентом является стеарат магния.
К вспомогательным материалам, применяемым для нанесения пленочного покрытия, относятся полимеры, например ГПМЦ, ПЭГ, ПВП, сополимер поливинилпирролидона и винилацетата (ПВП-ВА), поливиниловый спирт (ПВС) и сахар в качестве образующих пленку агентов. Наиболее предпочтительным материалом для нанесения покрытия является ГПМЦ, особенно ГПМЦ 3 сП (предпочтительно в количестве 5-6 мг/см2), и ее смеси с дополнительными вспомогательными средствами, например, известными под зарегистрированной торговой маркой OPADRY. К дополнительным добавкам относятся пигменты, матрицы, лаки, наиболее предпочтительны ТiO2 и оксиды железа, агенты от склеивания, например тальк, и смягчители, например ПЭГ 3350, 4000, 6000, 8000 и другие. Наиболее предпочтительными вспомогательными средствами являются тальк и ПЭГ 4000.
Настоящее изобретение также относится к твердой пероральной лекарственной форме, включающей терапевтически эффективное количество алискирена или его фармацевтически приемлемой соли в качестве активного агента и наполнитель в качестве вспомогательного средства. К другим вспомогательным средствам относятся, но ими не ограничиваются, связующие агенты, дезинтегрирующие агенты, замасливатели, глиданты, стабилизаторы, разбавители, поверхностно-активные вещества, образующие пленку агенты, пигменты, смягчители, препятствующие склеиванию агенты и т.п. Количества активного ингредиента и дополнительных вспомогательных средств предпочтительно являются такими же, что и описанные выше.
Настоящее изобретение также относится к твердой пероральной лекарственной форме, включающей терапевтически эффективное количество алискирена или его фармацевтически приемлемой соли в качестве активного агента, а также наполнитель и дезинтегрирующий агент в качестве вспомогательных средств. К другим вспомогательным средствам относятся, но ими не ограничиваются, связующие агенты, замасливатели, глиданты, стабилизаторы, разбавители, поверхностно-активные вещества, образующие пленку агенты, пигменты, смягчители, препятствующие склеиванию агенты и т.п. Количества активного ингредиента и дополнительных вспомогательных средств предпочтительно являются такими же, что и описанные выше.
Настоящее изобретение также относится к твердой пероральной лекарственной форме, включающей терапевтически эффективное количество алискирена или его фармацевтически приемлемой соли в качестве активного агента, а также наполнитель, дезинтегрирующий агент и замасливатель в качестве вспомогательных средств. К другим вспомогательным средствам относятся, но ими не ограничиваются, связующие агенты, глиданты, стабилизаторы, разбавители, поверхностно-активные вещества, образующие пленку агенты, пигменты, смягчители, препятствующие склеиванию агенты и т.п. Количества активного ингредиента и дополнительных вспомогательных средств предпочтительно являются такими же, что и описанные выше.
Настоящее изобретение также относится к твердой пероральной лекарственной форме, включающей терапевтически эффективное количество алискирена или его фармацевтически приемлемой соли в качестве активного агента, а также наполнитель, дезинтегрирующий агент, замасливатель и глидант в качестве вспомогательных средств. К другим вспомогательным средствам относятся, но ими не ограничиваются, связующие агенты, стабилизаторы, разбавители, поверхностно-активные вещества, образующие пленку агенты, пигменты, смягчители, препятствующие склеиванию агенты и т.п. Количества активного ингредиента и дополнительных вспомогательных средств предпочтительно являются такими же, что и описанные выше.
Настоящее изобретение также относится к твердой пероральной лекарственной форме, включающей терапевтически эффективное количество алискирена или его фармацевтически приемлемой соли в качестве активного агента, а также наполнитель, дезинтегрирующий агент, замасливатель, глидант и связующий агент в качестве вспомогательных средств. К другим вспомогательным средствам относятся, но ими не ограничиваются, стабилизаторы, разбавители, поверхностно-активные вещества, образующие пленку агенты, пигменты, смягчители, препятствующие склеиванию агенты и т.п. Количества активного ингредиента и дополнительных вспомогательных средств предпочтительно являются такими же, что и описанные выше.
Один или несколько из этих вспомогательных средств могут быть выбраны и могут применяться специалистом в данной области с учетом определенных желаемых качеств твердой пероральной лекарственной формы с помощью обычных экспериментов и без чрезмерной нагрузки.
Количество применяемого вспомогательного средства каждого типа, например глиданта, связующего агента, дезинтегрирующего агента, наполнителя или разбавителя и замасливателя или образующего пленку агента, может варьировать в диапазонах, обычно применяемых в данной области техники. Например, количество замасливателя может варьировать в диапазоне 0,2-5 мас.%, например для стеарата магния 0,5-2 мас.%, например 0,8-1,5 мас.%; количество связующего агента может варьировать в диапазоне 0-20 мас.%, например 3-4 мас.%; количество дезинтегрирующего агента может варьировать в диапазоне 0-20 мас.%, например 13,5-16 мас.%; количество наполнителя или разбавителя может варьировать в диапазоне 0-80 мас.%, например 20-32 мас.%; тогда как количество глиданта может варьировать в диапазоне 0-5 мас.%, например 0,4-0,6 мас.%; а количество пленочного покрытия может варьировать в диапазоне 0-20 мг/см2, например 4-7 мг/см2.
Отличительное свойство предусмотренных в настоящем изобретении твердых пероральных лекарственных форм заключается в том, что они содержат только относительно небольшое количество вспомогательных средств и, соответственно, большое содержание активного агента. Это позволяет получать вещественно маленькие единичные лекарственные формы. Общее количество добавок в данной единичной дозовой форме без покрытия может составлять примерно 60 мас.% или меньше от общей массы твердой пероральной лекарственной формы, более предпочтительно примерно 54 мас.% или менее. Предпочтительно содержание добавок в диапазоне примерно 35-55 мас.%, более предпочтительно содержание добавок варьирует примерно от 50 до примерно 52 мас.%.
Предпочтительное количество наполнителя, особенно микрокристаллической целлюлозы, варьирует примерно от 20 до 32 мас.% от массы единичной лекарственной формы.
Предпочтительное количество связующего агента, особенно ПВП К 30, варьирует примерно от 3 до 4 мас.% от массы единичной лекарственной формы.
Предпочтительное количество дезинтегрирующего агента, особенно кросповидона, варьирует примерно от 13,5 до 15 мас.% от массы единичной лекарственной формы.
Предпочтительное количество глиданта, особенно коллоидного диоксида кремния, варьирует примерно от 0,4 до 0,6 мас.% от массы единичной лекарственной формы.
Предпочтительное количество замасливателя, особенно стеарата магния, варьирует примерно от 0,8 до 1,5 мас.% от массы единичной лекарственной формы.
Предпочтительное количество пленочного покрытия, особенно ГПМЦ 3 сП, варьирует примерно от 4 до 7 мг/см2 единичной лекарственной формы.
Предпочтительные количества алискирена и вспомогательных средств также показаны в поясняющих примерах.
Абсолютные количества каждого вспомогательного средства и количества, выраженные относительно других вспомогательных средств, также зависят от желаемых свойств твердой пероральной лекарственной формы и также могут быть выбраны специалистом в данной области с помощью обычных экспериментов и без чрезмерной нагрузки. Например, твердая пероральная лекарственная форма может быть выбрана для того, чтобы проявить ускоренное и/или отсроченное высвобождение активного агента с количественным контролем высвобождения активного агента или без него.
Таким образом, если необходимо ускоренное высвобождение дезинтегрирующего агента, можно использовать, например, ПВП с поперечными сшивками, например те продукты, которые зарегистрированы под торговыми марками POLYPLASDONE XL или KOLLIDON CL, в частности, обладающие молекулярным весом, превышающим 1000000, более предпочтительно имеющие размер частиц менее 400 мкм или предпочтительно менее 74 мкм или включающие реактивные добавки (шипучие смеси), которые вызывают быстрое разрушение таблетки в присутствии воды, например так называемые шипучие таблетки, содержащие кислоту в твердой форме, обычно лимонную кислоту, которая действует в воде на основание, содержащее химически связанный диоксид углерода, например гидрокарбонат натрия или карбонат натрия, и высвобождающее диоксид углерода.
Если требуется высвобождение с задержкой, можно использовать технологию нанесения покрытия для форм, состоящих из множества частиц (например, пеллет, мини-таблеток), восковых матричных систем, полимерных матричных таблеток, или полимерных покрытий, или других технологий, традиционных в данной области техники.
Количественный контроль высвобождения активного агента может быть достигнут традиционными способами, известными в данной области техники. Такие лекарственные формы известны в качестве пероральных осмотических систем (например, OROS), таблеток с покрытием, матричных таблеток, таблеток с нанесением покрытия прессованием, многослойных таблеток и т.п.
В твердой пероральной дозовой форме, в которой активный агент представлен только алискиреном, или его фармацевтически приемлемой солью, или комбинацией алискирена с другими активными фармацевтическими ингредиентами, предпочтительными вспомогательными средствами являются микрокристаллическая целлюлоза, гидроксипропилцеллюлоза, ПВП с поперечными сшивками, ПВП, ПЭГ, КМЦ-Na или КМЦ-Ca, стеарат магния, стеарат Са или стеарат Al, безводный коллоидный кремний, тальк, диоксид титана и пигменты оксида железа. Количества применяемых вспомогательных средств будут зависеть от количества применяемого активного агента. Стеарат, например стеарат магния, предпочтительно применяют в количествах 0,8-1,5 мас.%, а кремний предпочтительно применяют в количестве 0,4-0,6 мас.%.
Количество алискирена в форме его полуфумарата от общей массы единичной лекарственной формы без покрытия составляет предпочтительно примерно от 83 до примерно 663 мг, наиболее предпочтительно количество полуфумарата алискирена составляет примерно 83, примерно 166 или примерно 332 мг на одну лекарственную форму.
Количество связующего агента в составе общей массы единичной лекарственной формы без покрытия составляет предпочтительно 2-5 мас.%, наиболее предпочтительно 3-4 мас.% на одну лекарственную форму.
Количество дезинтегрирующего агента в составе общей массы единичной лекарственной формы без покрытия составляет предпочтительно 0-20 мас.%, наиболее предпочтительно 13,5-16 мас.% на одну лекарственную форму.
Количество глиданта в составе общей массы единичной лекарственной формы без покрытия составляет предпочтительно 0-5 мас.%, наиболее предпочтительно 0,4-0,6 мас.% на одну лекарственную форму,
Количество замасливателя в составе общей массы единичной лекарственной формы без покрытия составляет предпочтительно 0,2-5 мас.%, наиболее предпочтительно 0,8-1,5 мас.% для стеарата магния на одну лекарственную форму.
Предпочтительное количество пленочного покрытия, особенно ГПМЦ 3 сП, составляет примерно от 4 до примерно 7 мг/см2 на одну лекарственную форму.
Соотношение масс алискирена и связующего агента предпочтительно варьирует примерно от 8:1 до примерно 25:1, более предпочтительно примерно от 11:1 до примерно 15:1. Наиболее предпочтительно соотношение масс составляет примерно 12,5:1.
Соотношение масс алискирена и дезинтегрирующего агента предпочтительно варьирует примерно от 2:1 до примерно 4:1, более предпочтительно примерно от 2,5:1 до примерно 3,7:1. Наиболее предпочтительно соотношение масс составляет примерно 3,1:1.
Соотношение масс алискирена и глиданта предпочтительно варьирует примерно от 75:1 до примерно 125:1, более предпочтительно примерно от 80:1 до примерно 90:1. Наиболее предпочтительно соотношение масс составляет примерно 83,3:1.
Соотношение масс алискирена и замасливателя предпочтительно варьирует примерно от 25:1 до примерно 63:1, более предпочтительно примерно от 30:1 до примерно 50:1. Наиболее предпочтительно соотношение масс составляет примерно 30:1.
Твердые пероральные лекарственные формы согласно настоящему изобретению также могут быть в форме таблеток с пленочным покрытием (филм-таблеток) или драже, причем в этом случае твердая пероральная лекарственная форма предусматривается с покрытием обычно полимерной природы, например ГПМЦ, ПВП и т.п., или состоящим из сахара, шеллака или других пленочных покрытий, хорошо известных в данной области техники. Привлекают внимание многочисленные способы нанесения покрытия, известные в данной области техники, например способ напыления в псевдоожиженном слое, например известные способы с использованием аппаратуры, которую можно приобрести на фирмах Aeromatic, Glatt, Wurster или Hüttlin, с помощью установки для нанесения покрытий с перфорированной кюветой, например известны способы с применением аппаратов фирм Accela Cota, Glatt, Driam или других, или другие способы, известные в данной области техники. Вспомогательные средства, обычно применяемые при изготовлении кондитерских изделий, могут использоваться в данных способах.
Другим вариантом осуществления настоящего изобретения является способ получения твердой пероральной лекарственной формы согласно настоящему изобретению.
Влажное гранулирование алискирена с эксципиентами в присутствии воды и/или водного связующего раствора приводит к изменению полиморфизма лекарственного вещества, которое частично переходит в аморфное состояние, и вызывает ухудшение химической стабильности лекарственного продукта (ЛП).
Однако было обнаружено, что влажное гранулирование алискирена в присутствии смеси органических растворителей или органических связующих растворов является лучшим способом получения подходящих твердых пероральных лекарственных форм алискирена, особенно таблеток, имеющим следующие преимущества:
- указанное влажное гранулирование снижает объем алискирена при гранулировании;
- воздействия на изменение качества лекарственного вещества являются минимальными;
- высокая нагрузка лекарственного средства, превышающая 46 мас.% от массы единичной лекарственной формы, может быть легко достигнута;
- состав таблеток делает возможным обеспечение достаточных прочности, устойчивости к ломкости, времени расщепления, скорости растворения и т.п.;
- тенденция к спеканию и медленная скорость выпрессовки лекарственного вещества снижаются до минимума;
- достигается качественный способ получения ЛП;
- достигается масштабирование состава и способа получения ЛП воспроизводимым способом;
- достигается достаточная стабильность для обеспечения обоснованного срока годности.
Эксципиенты могут быть распределены частично во внутренней (гранулированной) фазе и частично во внешней фазе, и именно такой случай описан в настоящем изобретении. Микрокристаллическая целлюлоза (наполнитель) и кросповидон (дезинтегрирующий агент) находятся частично во внутренней и частично во внешней фазе, ПВП К 30 (связующий агент) только частично находится во внутренней фазе, являясь связующим агентом во время гранулирования, а коллоидный диоксид кремния (глидант) и стеарат магния (замасливатель) являются только частью внешней фазы.
Эксципиенты внутренней фазы, например наполнитель, связующий агент и дезинтегрирующий агент, и лекарственное вещество смешивают и гранулируют с этанольным раствором связующего агента и дополнительным этанолом. Гранулят высушивают и просеивают. Внутреннюю фазу, содержащую, например, дезинтегрирующий агент, наполнитель, агент скольжения и смазывающий агент, просеивают вместе с сухим гранулятом и перемешивают. Смесь прессуют в таблетки. На сердцевины необязательно может быть нанесено пленочное покрытие.
Фаза гранулята определяется в качестве внутренней фазы, а добавленные к грануляту эксципиенты определяются в качестве внешней фазы таблетируемой смеси.
Настоящее изобретение также относится к способу приготовления твердых пероральных лекарственных форм согласно описанному выше. Такие твердые пероральные лекарственные формы могут быть получены путем переработки компонентов согласно описанному выше в подходящих количествах для формирования единичных лекарственных форм. Таким образом, настоящее изобретение предусматривает способ получения твердой пероральной лекарственной формы настоящего изобретения, включающий:
1) смешивание активного ингредиента и вспомогательных средств и гранулирование указанных компонентов в присутствии жидкости для гранулирования,
2) высушивание полученного гранулята,
3) смешивание высушенного гранулята с эксципиентами внешней фазы,
4) прессование образующейся смеси для получения твердой пероральной лекарственной формы в виде сердцевин таблеток и
5) необязательно нанесение покрытия на полученную сердцевину таблетки для получения таблетки с пленочным покрытием.
Предпочтительно вспомогательные средства на стадии (1) выбирают из наполнителя, дезинтегрирующего агента и связующего агента, а эксципиенты внешней фазы на стадии (3) выбирают из наполнителя, дезинтегрирующего агента, замасливателя и глиданта.
Жидкостью для гранулирования может быть этанол, смесь этанола и воды, смесь этанола, воды и изопропанола или раствор ПВП в описанных выше смесях. Предпочтительная смесь этанола и воды варьирует примерно от 50/50 до примерно 99/1 (соотношение мас.%), наиболее предпочтительно соотношение компонентов в смеси составляет примерно 94/6 (соотношение мас.%). Предпочтительная смесь этанола, воды и изопропанола варьирует примерно от 45/45/5 до примерно 98/1/1 (соотношение мас.%), наиболее предпочтительно примерно от 88,5/5,5/6,0 до примерно 91,5/4,5/4,0 (соотношение мас.%). Предпочтительная концентрация ПВП в указанных выше смесях варьирует примерно от 5 до 30 мас.%, предпочтительно примерно от 15 до примерно 25 мас.%, более предпочтительно примерно от 16 до примерно 22 мас.%.
Привлекают внимание многочисленные известные способы гранулирования, высушивания и перемешивания, применяемые в данной области техники, например гранулирование разбрызгиванием в псевдоожиженном слое, влажное гранулирование в смесителе с мощными ножницами, гранулирование плавлением, высушивание в сушилке с псевдоожиженным слоем, перемешивание в смесителе свободного падения или переворачивания, прессование в таблетки однопробойным или роторным прессом для таблеток.
Получение гранулята может быть выполнено на стандартном оборудовании, пригодном для процессов гранулирования органических соединений. Получение конечной смеси и прессование таблеток также может быть выполнено на стандартном оборудовании.
Например, стадия (1) может выполняться на грануляторе с мощными ножницами, например Collette Gral; стадия (2) может выполняться в сушилке с псевдоожиженным слоем; стадия (3) может выполняться в смесителе свободного падения (например, контейнерном смесителе, смесителе переворачиванием); и стадия (4) может выполняться с применением метода сухого прессования, например, на роторном прессе для таблеток.
Выше указывалось, что на сердцевины таблеток затем может быть нанесено пленочное покрытие.
Из-за высокой гигроскопичности и чувствительности алискирена к воде, которые изменяют полиморфизм, предпочтительно следует избегать применения воды для того, чтобы предупредить полиморфные изменения лекарственного вещества по вышеуказанным причинам (аморфное состояние, пониженная химическая стабильность). Решением указанной проблемы является применение способа нанесения органического пленочного покрытия.
Неожиданно было обнаружено, что способ нанесения водного пленочного покрытия с применением стандартной композиции пленочного покрытия может быть применен для сердцевин таблеток алискирена без изменения полиморфизма.
Пленочное покрытие предпочтительно состоит из ГПМЦ, применяемой в качестве полимера, пигментов оксида железа, диоксида титана, применяемого в качестве красителя, ПЭГ в качестве смягчителя и талька в качестве агента предотвращения склеивания. Применение окрашивающих агентов или красителей может быть полезным для улучшения внешнего вида, а также для идентификации композиций. К другим красителям, пригодным для использования, обычно относятся каратиноиды, хлорофилл и красочные лаки.
Условия нанесения пленочного покрытия должны гарантировать, что сердцевины таблеток не впитают значительного количества влаги и что лекарственное вещество в таблетках не придет в тесное соприкосновение с каплями воды. Это достигается установкой параметров процесса, которые снижают количество влажности, попадающей в сердцевины таблеток.
Твердые пероральные лекарственные формы настоящего изобретения применяют для понижения кровяного давления, систолического или диастолического, или и того, и другого. К состояниям, для лечения которых может применяться настоящее изобретение, без ограничений относятся гипертония (независимо от того, является ли она злокачественной, идиопатической, почечно-сосудистой, диабетической, солитарной систолической или другого вторичного типа), застойная сердечная недостаточность, стенокардия (и стабильная, и нестабильная), инфаркт миокарда, атеросклероз, диабетическая нефропатия, диабетическая кардиомиопатия, почечная недостаточность, заболевание периферических сосудов, гипертрофия левого желудочка, когнитивная дисфункция (например, болезнь Альцгеймера), инсульт, головная боль и хроническая сердечная недостаточность.
Настоящее изобретение также относится к способу лечения гипертонии (независимо от того, является ли она злокачественной, идиопатической, почечно-сосудистой, диабетической, солитарной систолической или другого вторичного типа), застойной сердечной недостаточности, стенокардии (и стабильной, и нестабильной), инфаркта миокарда, атеросклероза, диабетической нефропатии, диабетической кардиомиопатии, почечной недостаточности, заболевания периферических сосудов, гипертрофии левого желудочка, когнитивной дисфункции, например болезни Альцгеймера, инсульта, головной боли и хронической сердечной недостаточности, заключающемуся в введении животному, а также человеку, нуждающемуся в таком лечении, терапевтически эффективной твердой пероральной лекарственной формы согласно настоящему изобретению.
Настоящее изобретение также относится к применению твердой пероральной лекарственной формы согласно настоящему изобретению для получения лекарственного средства для лечения гипертонии (независимо от того, является ли она злокачественной, идиопатической, почечно-сосудистой, диабетической, солитарной систолической или другого вторичного типа), застойной сердечной недостаточности, стенокардии (и стабильной, и нестабильной), инфаркта миокарда, атеросклероза, диабетической нефропатии, диабетической кардиомиопатии, почечной недостаточности, заболевания периферических сосудов, гипертрофии левого желудочка, когнитивной дисфункции, например болезни Альцгеймера, инсульта, головной боли и хронической сердечной недостаточности.
Настоящее изобретение также относится к фармацевтической композиции для лечения гипертонии (независимо от того, является ли она злокачественной, идиопатической, почечно-сосудистой, диабетической, солитарной систолической или другого вторичного типа), застойной сердечной недостаточности, стенокардии (и стабильной, и нестабильной), инфаркта миокарда, атеросклероза, диабетической нефропатии, диабетической кардиомиопатии, почечной недостаточности, заболевания периферических сосудов, гипертрофии левого желудочка, когнитивной дисфункции, например болезни Альцгеймера, инсульта, головной боли и хронической сердечной недостаточности, включая твердую пероральную дозовую форму согласно настоящему изобретению.
Таким образом, точная доза активного агента и конкретный состав, предназначенный для введения, зависят от ряда факторов, например подвергаемого лечению состояния, требуемой длительности лечения и скорости высвобождения активного агента. Например, необходимое количество активного агента и скорость его высвобождения могут быть определены известными методами in vitro и in vivo, с помощью которых устанавливают длительность поддержания в плазме крови определенной концентрации активного агента, уровень которой приемлем для терапевтического эффекта.
Приведенное выше описание полностью раскрывает настоящее изобретение, в том числе предпочтительные варианты его осуществления. Модификации и усовершенствования вариантов осуществления настоящего изобретения, в частности приведенных в настоящем описании, соответствуют приводимой ниже формуле изобретения. Специалист в данной области, используя настоящее описание, может в полной мере применить настоящее изобретение без дополнительного усовершенствования. Следовательно, приводящиеся примеры следует рассматривать исключительно в виде иллюстраций, которые никоим образом не ограничивают настоящего изобретения.
Пример 1
Состав таблеток без покрытия (мг/единицу), содержащих 150 мг алискирена (свободного основания)
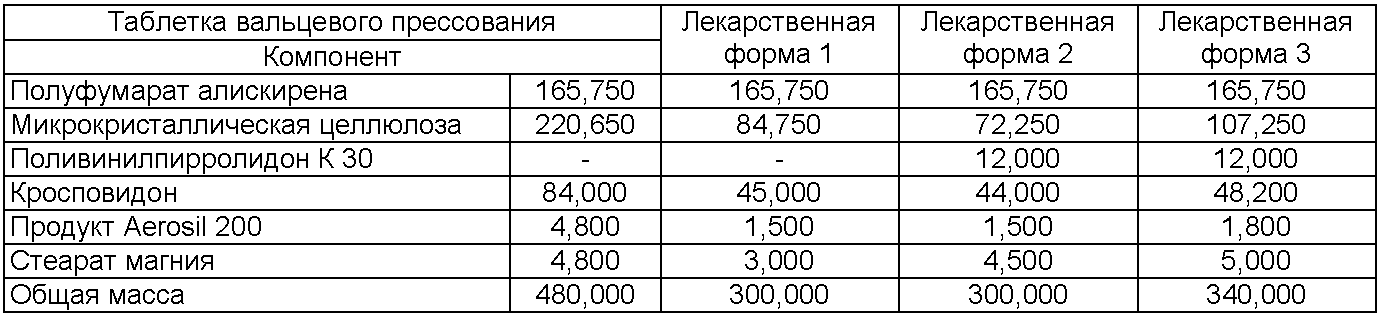
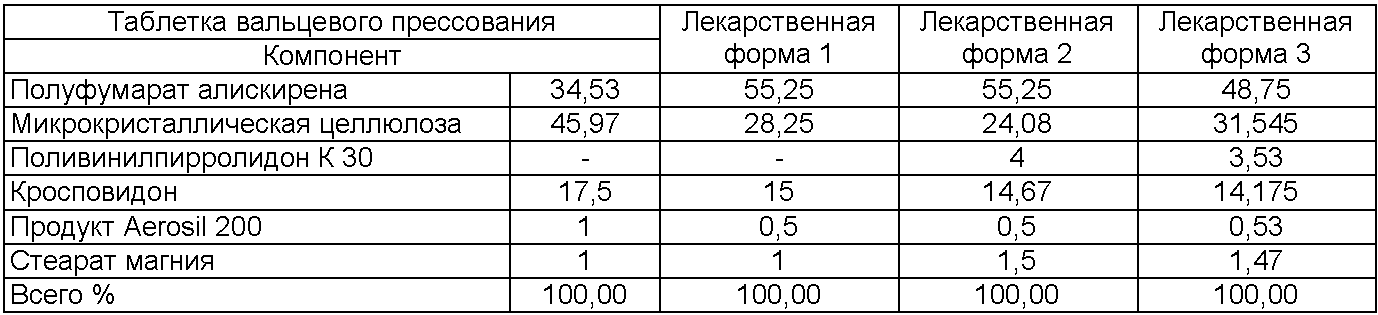
Состав таблеток без покрытия (в мас.%), содержащих 150 мг алискирена (свободного основания)
Состав таблеток без покрытия (мг/единицу), содержащих 150 мг алискирена (свободного основания) (состав поделен на внутреннюю/внешнюю фазу)
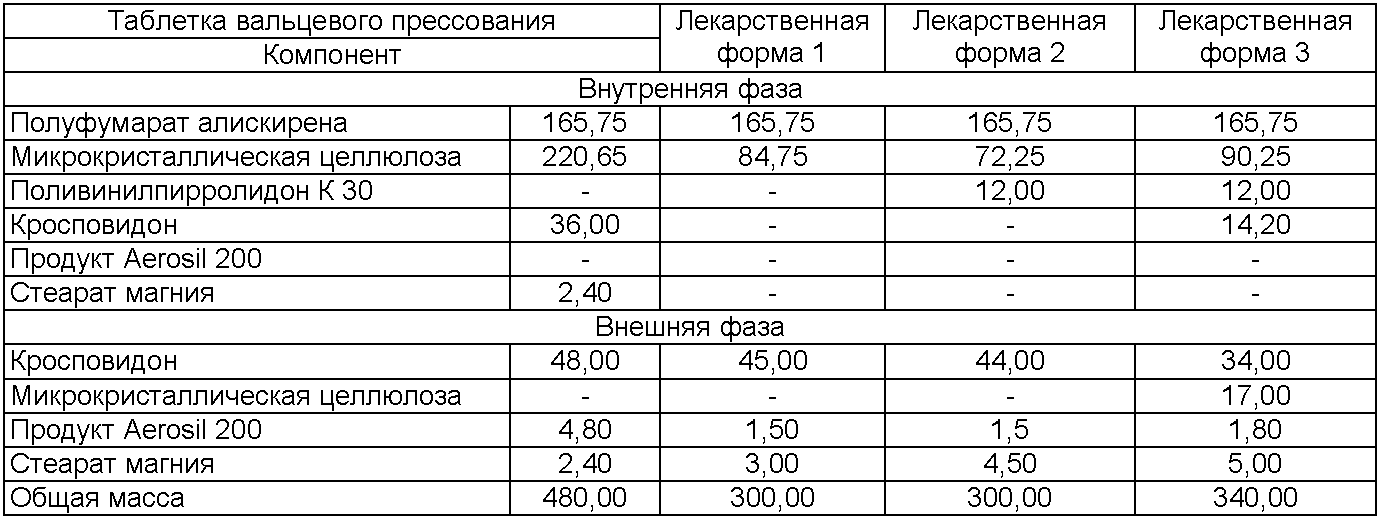
Состав таблеток без покрытия (мас.%), содержащих 150 мг алискирена (свободного основания) (состав поделен на внутреннюю/внешнюю фазу)
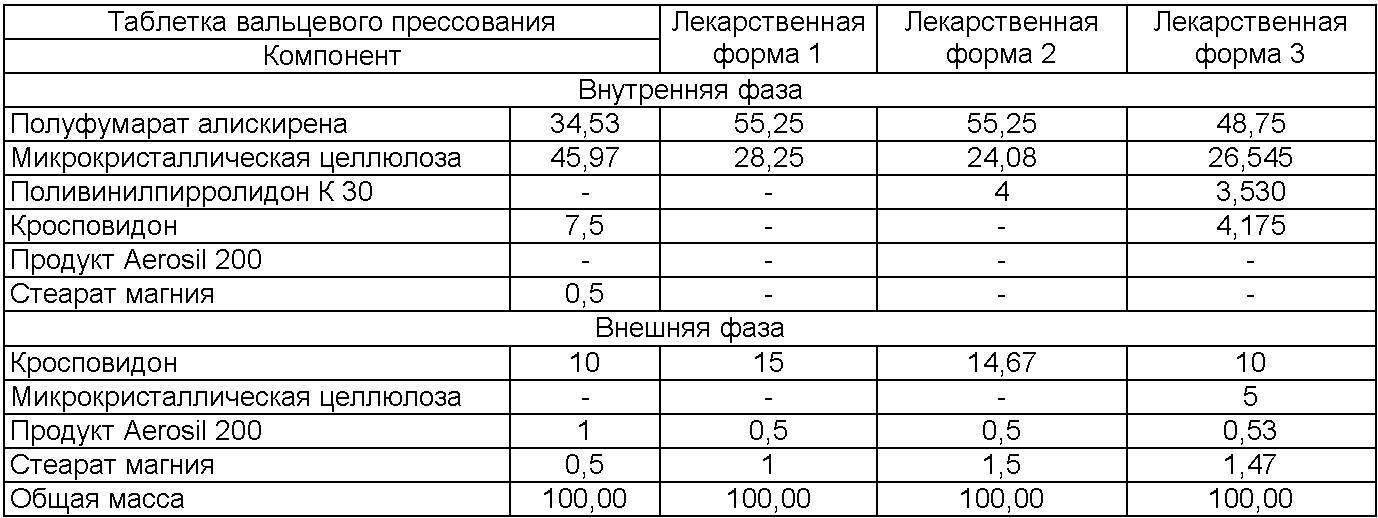
Пример 2
Состав таблеток алискирена с пленочным покрытием (лекарственная форма 3) (мг/единицу)
|

