Результат интеллектуальной деятельности: ТЕРМОЧУВСТВИТЕЛЬНЫЙ ИНТЕРПОЛИМЕРНЫЙ НОСИТЕЛЬ РАДИОНУКЛИДОВ
Вид РИД
Изобретение
Изобретение относится к области ядерной медицины, радиофармацевтики, радиофармакологии, более узко - к сфере локальной радиотерапии.
Центральная задача ядерной медицины состоит в том, чтобы добиться максимального разрушения опухоли при минимальном повреждении окружающих ее нормальных тканей. Для решения этой задачи применяются разнообразные методы и средства, и именно по пути их совершенствования идет развитие радионуклидной терапии [1, 2]. Пространственное ограничение действия радиоизотопа достигается с помощью его капсулирования или остекловывания. Широкое распространение получили микроисточники для брахитерапии - герметичные титановые цилиндры диаметром 0,8 мм, в которых заключено тарированное количество радионуклида и которые вводятся в организм с помощью шприца. Микроисточники не обладают биосовместимостью, при их изготовлении используются сложные и трудоемкие операции, такие как лазерная сварка, к тому же они очень дороги.
Подвижность радиоизотопов в окрестности места инъекции может быть эффективно ограничена за счет связывания с помощью химических агентов в полимерном геле. В качестве гелеобразующих полимеров могут применяться производные целлюлозы, агар-агар, желатина, альгинат и др. Однако при этом возникают значительные трудности с управлением процессом гелеобразования. Поэтому предпочтение отдается (со)полимерам, в водном растворе которых происходит обратимый фазовый золь-гель переход, вызываемый изменением в достаточно узком интервале факторов среды, таких как температура, pH, ионная сила [3, 4]. Наиболее часто используются (со)полимеры, в водных растворах которых происходит термотропный переход клубок-глобула при нагревании от комнатной до температур, близких к температуре человеческого тела.
В американских патентах US 2002/0131935 A1 и US 2004/0228794 A1 содержится описание носителя терапевтического агента в виде статистического сополимера, линейные цепи которого состоят из чередующихся последовательностей звеньев термочувствительного поли-N-изопропилакриламида (ПНИПАМ) и гидрофильной полиакриловой кислоты (ПАК) с мольным содержанием последней несколько процентов. В качестве терапевтического агента используются соли радиоактивного изотопа 90Y (YCl3, YPO4), находящиеся в коллоидном состоянии с размером частиц 0,2-1 мкм, которые благодаря хелатным связям со звеньями акриловой кислоты служат узлами пространственной полимерной сетки. Концентрацию сополимерной составляющей препарата и ее молекулярную массу выбирали такими, чтобы при комнатной температуре вязкость водного раствора составляла несколько десятков мПа·с, благодаря чему облегчается инъекция препарата шприцом с иглой калибра G25 (диаметр 0,5 мм). Нижняя критическая температура фазового расслоения (Тфр) гомополимера ПНИПАМ, определенная по точке помутнения, составляла 32,6°C, а присутствие гидрофильных звеньев ПАК сдвигало Тфр сополимера в область физиологических температур 36-38°C. Термически обратимое гелеобразование в сополимере с 2%-ным мольным содержанием акриловой кислоты происходило при 36,5°C. Недостатком данного изобретения является необходимость использовать растворы с такой комбинацией молекулярных и концентрационных параметров, в которых фазовый переход происходит с образованием геля, но без синерезиса жидкой фазы, по крайней мере, с объемной долей не более 10 об.%. Как показали эксперименты на животных, при незначительном удалении системы от бинодали за счет не совсем благоприятного соотношения температуры тела и температуры фазового перехода наблюдается неполное удерживание воды в геле и, в результате, распространение радионуклида по всему организму.
Такого развития событий можно избежать, если ионно-координационные связи между полимерным носителем и радионуклидом заменить на ковалентные. Этот прием использовали в работе [5]. С участием целенаправленно синтезированного инициатора, содержащего определенные группы, была проведена радикальная полимеризация N-изопропилакриламида, после чего выделенный полимер модифицировали путем аминолиза остатков инициатора, находящихся в концевых фрагментах цепи, в присутствии L-тирозинамида. Заключительный продукт многостадийного синтеза представляет собой термочувствительный полимер ПНИПАМ, содержащий концевые тирозинамидные группы, в свою очередь обладающие способностью присоединять радиоактивные изотопы йода. При этом радионуклид ковалентно связывается с фенильным кольцом концевой тирозиновой группы. Температура фазового расслоения Тфр водного раствора близка к 32°C, среднечисленная молекулярная масса полимера Mn≈7·104, максимальная теоретическая активность применительно к 131I составляет около 50 ГБк/мг. Это высокая удельная активность терапевтических препаратов для локального облучения опухолей.
Недостатками способа являются сложность многостадийного синтеза, низкая молекулярная масса получаемого полимера и жесткая взаимосвязь между активностью препарата, молекулярной массой и концентрацией полимера. С одной стороны, чем меньше молекулярная масса ПНИПАМ, тем легче он выводится из организма. С другой стороны, низкая молекулярная масса не способствует превращению исходного водного раствора в плотный гель в результате термотропного перехода. Это системное противоречие присуще излагаемому способу и часто будет иметь следствием неблагоприятный эффект делокализации радиоактивности по отделам организма. Желание уплотнить конечную полимерную фазу за счет увеличения концентрации исходного раствора сталкивается с ограничениями по активности препарата.
Рассмотренные примеры реализации препаратов для локальной радиотерапии с различной молекулярной архитектурой имеют общий недостаток, корнем которого является соединение в одну макромолекулу двух функционально различных последовательностей, отдельных звеньев или групп, одни из которых ответственны за проявление термотропного перехода, а другие - за включение с помощью тех или иных химических связей терапевтических агентов, например радионуклидов. Такая молекулярная архитектура вступает в противоречие с требованием, согласно которому при комнатной температуре водный раствор препарата должен быть гомогенным и маловязким, а после фазового перехода стать достаточно плотным гелем с иммобилизованными в нем атомами радионуклида. Консистенция обогащенной полимером фазы определяется, как уже отмечалось, концентрацией раствора и молекулярной массой (со)полимера.
Наиболее близок к предлагаемому изобретению термо- и pH-чувствительный полимерно-белковый коньюгат, составленный из казеина и поли-N-изопропилакриламида [6] - прототип. Коньюгат был синтезирован с помощью радикальной привитой полимеризации N-изопропилакриламида к денатурированному казеину в водной среде при 90°C. Компонентами инициирующей редокс-системы служили трет-бутилгидропероксид и аминные группы казеина. В результате был получен привитой сополимер, чувствительный и к температуре, и к значению pH в водной среде. Тфр водного раствора ПНИПА мало зависит от присутствия белка. Зависимость Тфр от pH может с одной стороны быть достоинством, а с другой - серьезным недостатком. Например, согласно данным прототипа (рис.4 и схема 2 из работы [6]) соотношения между физиологическими параметрами сыворотки крови и фазового золь-гель перехода в растворе полимерно-протеинового коньюгата (36,6°C>Тфр и pH=6,5>pI≈4,5) неблагоприятны для гелеобразования выше Тфр и поэтому непригодны для создания локального терапевтического РФП.
Недостатков, отмеченных в аналогах и прототипе, лишен разработанный в предлагаемом изобретении двухкомпонентный полимерный носитель радионуклида. Решаемая техническая задача заключается в создании полимерного носителя радионуклида, прежде всего удовлетворяющего главному требованию: содержащийся в препарате радионуклид не должен обладать подвижностью, которая бы позволила ему сразу после введения или со временем выйти за пределы компактной полимерной фазы. Эта задача в настоящем изобретении решается с помощью разделения основных функций препарата покомпонентно и создания условий для межкомпонентных скрепов в виде интерполимерных комплексов. Конкретная реализация достигается применением в качестве термочувствительного полимера поли-N-винилкапролактама (ПВКЛ) - представителя класса поли-N-виниламидов, обладающего Тфр в физиологической области температур. Замечательно, что ПВКЛ биосовместим, нетоксичен, стерилизуем и давно применяется в медицинской практике [7].
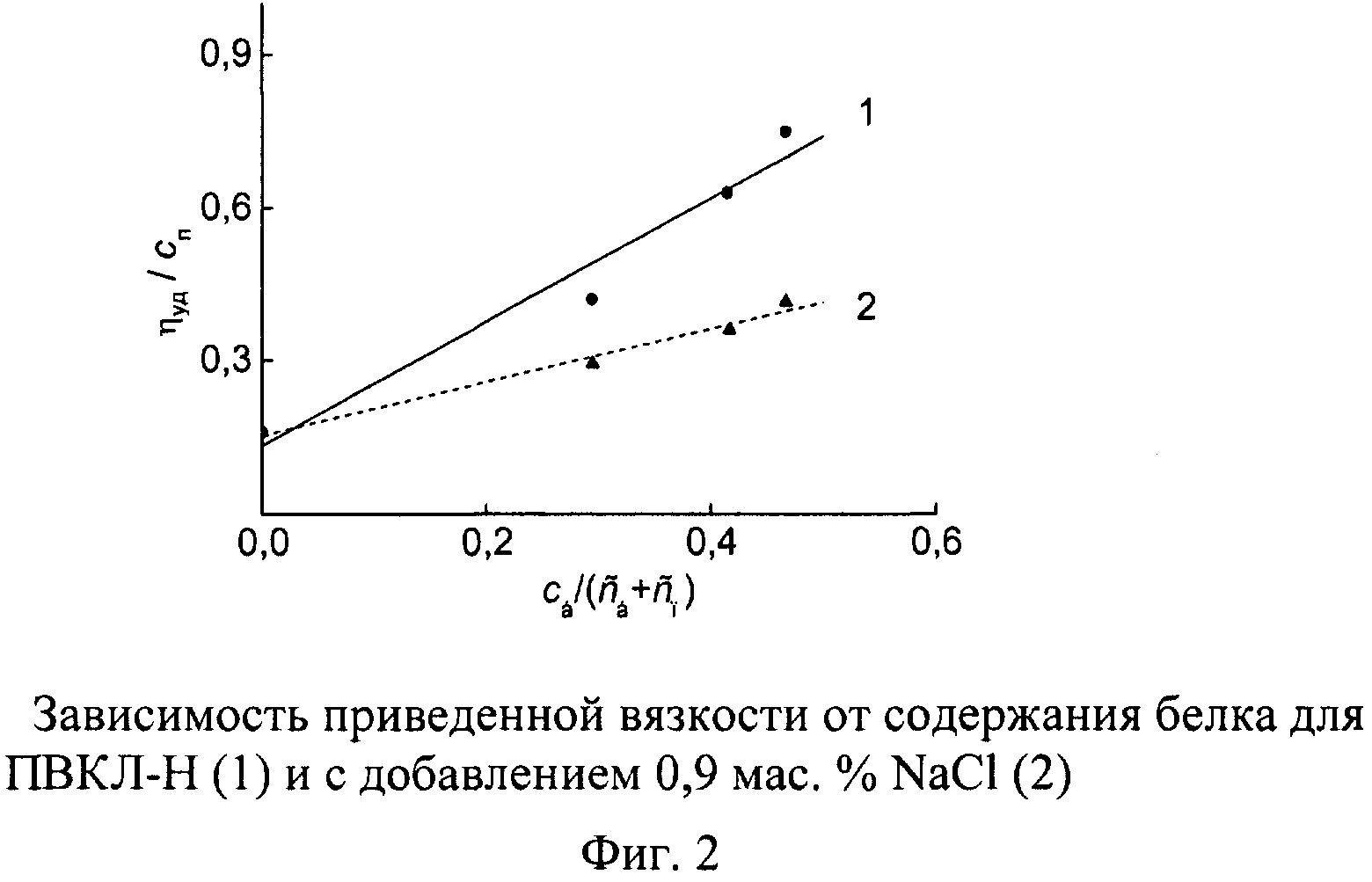
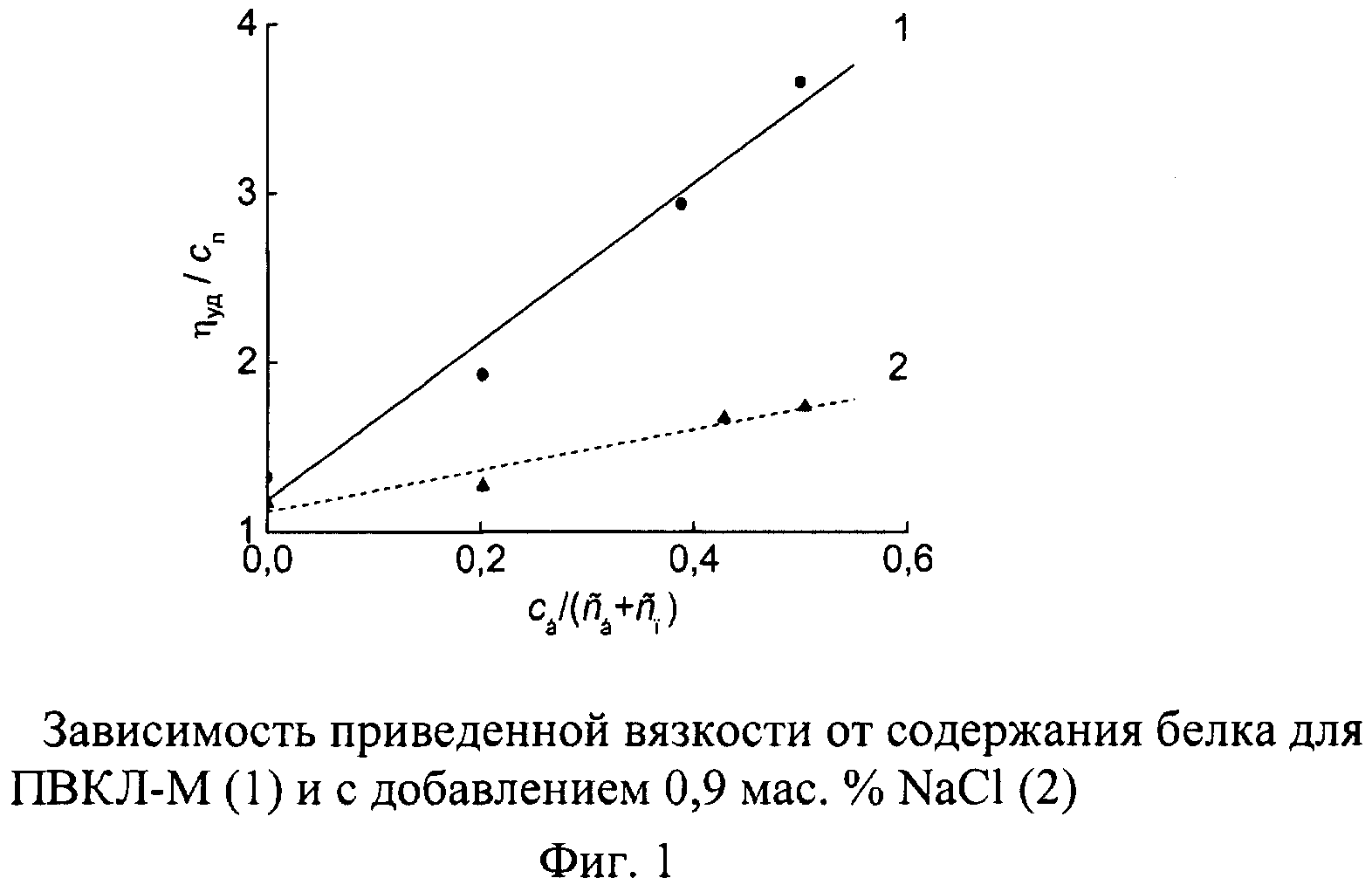
В качестве носителя радиоактивного йода был выбран казеин - глобулярный белок, имеющий в своем составе остаток аминокислоты тирозин, с фенильным кольцом которого можно ковалентно связать атомы йода, и йодированный казеин (йодказеин), в котором йод предварительно уже связан с фенильным кольцом. С помощью йодирования казеина радиоактивным йодом или изотопного обмена в йодказеине белковые молекулы легко сделать радиоактивно меченными с заданной активностью. В дальнейшем казеин с любой степенью йодирования, в том числе в результате мечения, будем называть йодказеином. Принципиальное отличие настоящего изобретения от рассмотренных выше аналогов и прототипа заключается в способности макромолекул ПВКЛ и глобулярных белковых молекул йодказеина объединяться в водном растворе в устойчивые ассоциаты - межполимерные комплексы. Это свойство оказывает благотворное воздействие на структуру пространственного геля, возникающего в растворе благодаря термотропному переходу в связанной физическими скрепами системе. При комнатной температуре существует достаточно сильное гидрофобное взаимодействие между капролактамовым кольцом звеньев ПВКЛ и гидрофобной сердцевиной белковой глобулы, проявляющееся в многократном увеличении приведенной вязкости раствора за счет формирования интерполимерных комплексов (фиг.1, 2).
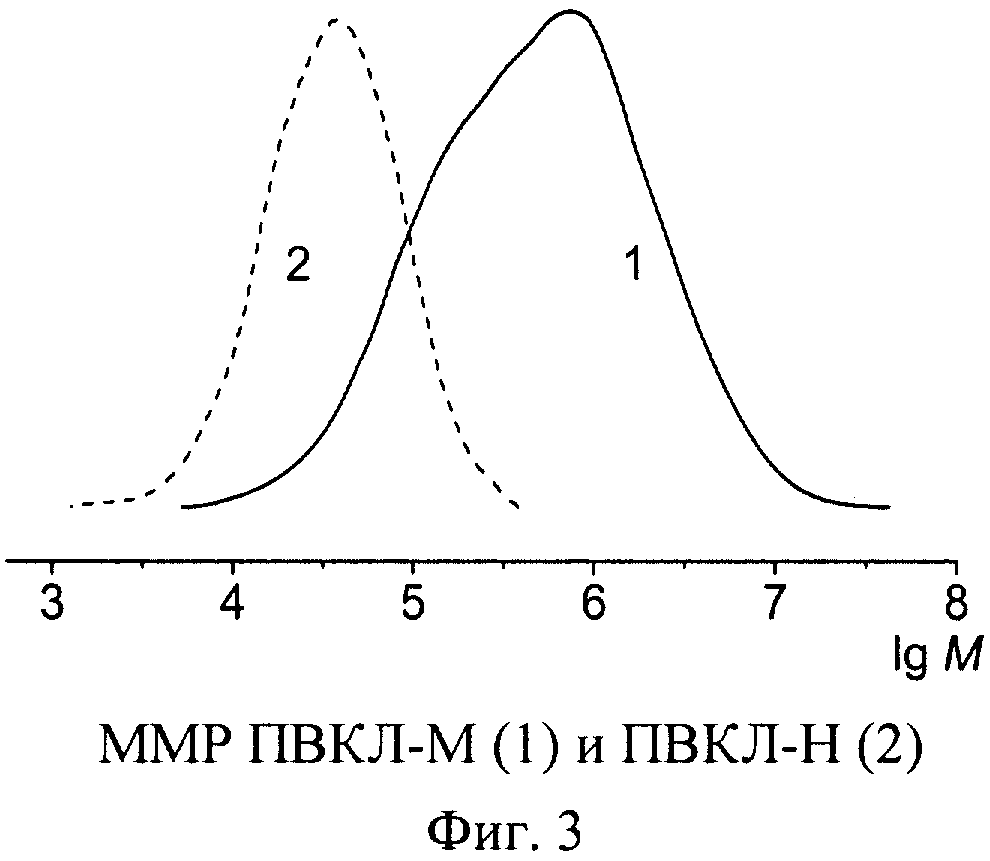
В работе использовали два образца ПВКЛ. Высокомолекулярный образец ПВКЛ-М, синтезированный в водном растворе методом радиационно-инициированной полимеризации, имеет: характеристическую вязкость в воде [η]=1,08 дл/г, средневязкостную ММ Мη≈1,3·106 рассчитанную по формуле [η]=3,5·10-4Мη 0,57 [7], широкодисперсное ММР с двумя плохо разрешенными максимумами и параметрами Мw=15,3·105, Мn=1,9·105 (фиг.3, кривая 1). Низкомолекулярный образец ПВКЛ-Н, синтезированный методом радикальной полимеризации в диоксане, имеет: характеристическую вязкость в воде [η]=0,16 дл/г, средневязкостную ММ Мη≈46·103; параметры ММР (фиг.3, кривая 2): Мw=74·103, Mn=43·103.
Одиночная молекула казеина со средней молекулярной массой ~20·103 представляет собой глобулу с эффективным диаметром ~10 нм. Коррелограмма раствора ЙК, полученная методом динамического светорассеяния, представляет собой одиночный пик с Rz≈100 нм. Измерения ДРС производили на установке Malvern Zetasizer Nano ZS. Разбавленные растворы с концентрацией полимера 0,1 мас.% фильтровали через полимерные мембраны с диаметром пор 0,45 мкм. Растворы ЙК даже после фильтрации сохраняли мутность. Столь крупные частицы суть не что иное как мицеллы - агрегаты многих десятков индивидуальных глобул [9]. Их присутствие в наших образцах мы обнаруживали также методом аналитического ультрацентрифугирования наряду с более мелкими субмицеллами. Казеин, в том числе йодированный, растворим в воде при pH 8-10. В дальнейшем изложении все растворы, в которых присутствует белок, имеют pH ~9.
По мере нагревания раствора происходит разрушение водородных связей в системе, которые способствуют растворению молекул белка, участвуют в создании гидратной оболочки вокруг цепей ПВКЛ и комплексообразовании между полимером и белком. Взаимодействие макромолекул ПВКЛ с молекулами белка при нагревании осуществляется в основном через молекулы воды, находящиеся в гидратной оболочке ПВКЛ вблизи амидных групп и входящих в сетку водородных связей. Эта оболочка сохраняется и при нагревании. Для гидрофобных взаимодействий характерно их усиление с повышением температуры. Температура определяет количество структурированной воды вокруг гидрофобных групп и, таким образом, стабильность гидрофобных ассоциатов. Именно гидрофобные взаимодействия являются движущей силой фазового распада и его эндотермического характера. Макромолекулы ПВКЛ, близко расположенные к участкам белковой молекулы, в свою очередь, также оказывают влияние на конформационное состояние белковой молекулы. Повышение температуры водного раствора ПВКЛ вызывает сжатие клубка, сопровождающееся падением подвижности звеньев. Макромолекулы ПВКЛ, "обжимающие" белковую молекулу, создают вокруг нее каркас, который с повышением температуры становится все более жестким. Матричный полимер увлекает в осадок входящие в комплекс глобулы йодказеина и формирует компактный псевдосшитый гель, несущий ковалентно связанный йод.
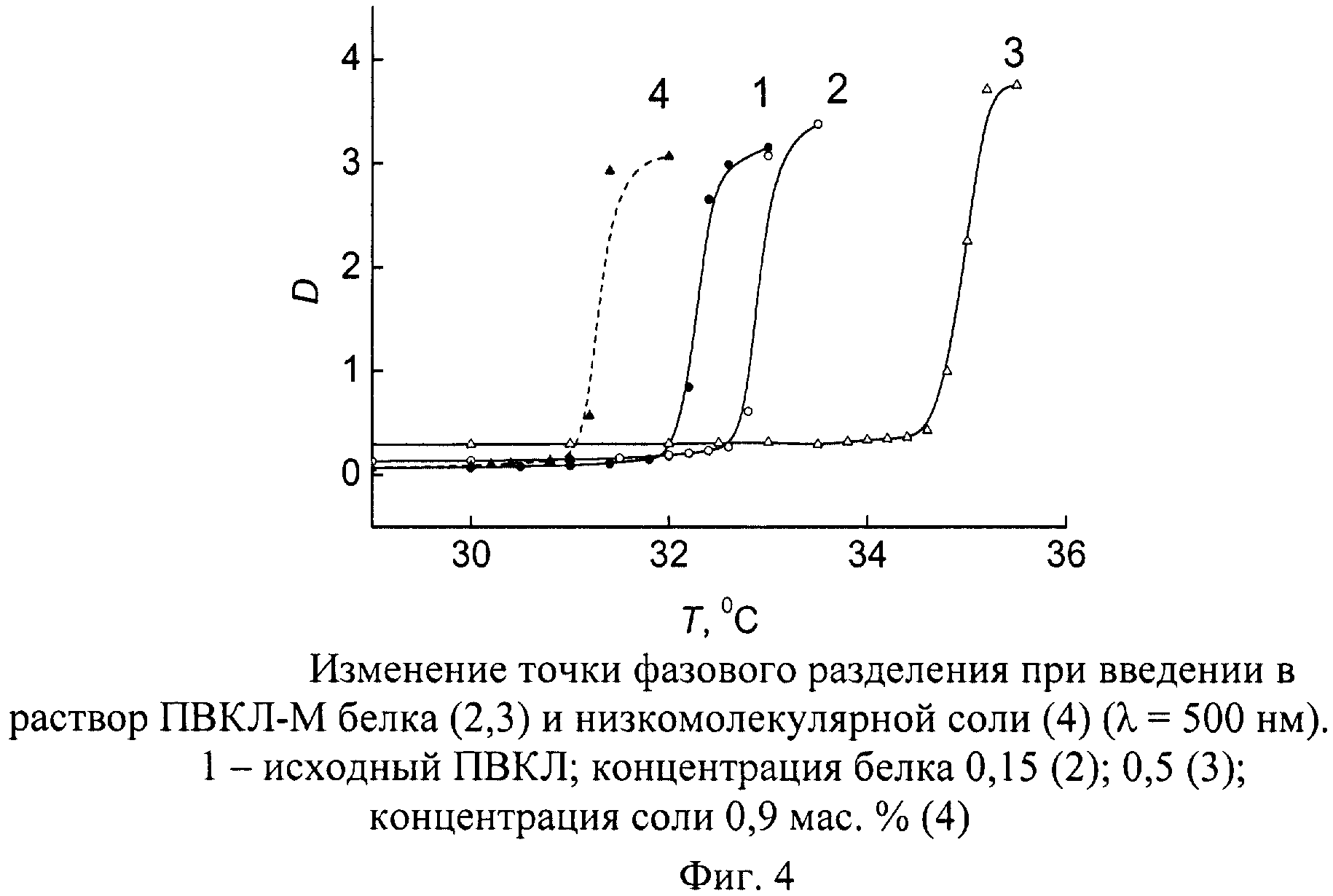
Определенная с помощью кривой помутнения температура перехода водных растворов зависит от молекулярной массы ПВКЛ (Тфр≈33,3 и 34,8°C для гомополимеров ПВКЛ-М и ПВКЛ-Н соответственно) и смещается в зависимости от концентраций белка и низкомолекулярной соли (фиг.4). В предварительных экспериментах было установлено, что при термоосаждении раствор композиции ПВКЛ с белком часто распадается на две макрофазы - жидкую фазу и компактный полимерный гель, удерживающий некоторое количество связанной воды. Контроль жидкой фазы, проводившийся спектрометрически и рефрактометрически, показал, что она является чистой водой.
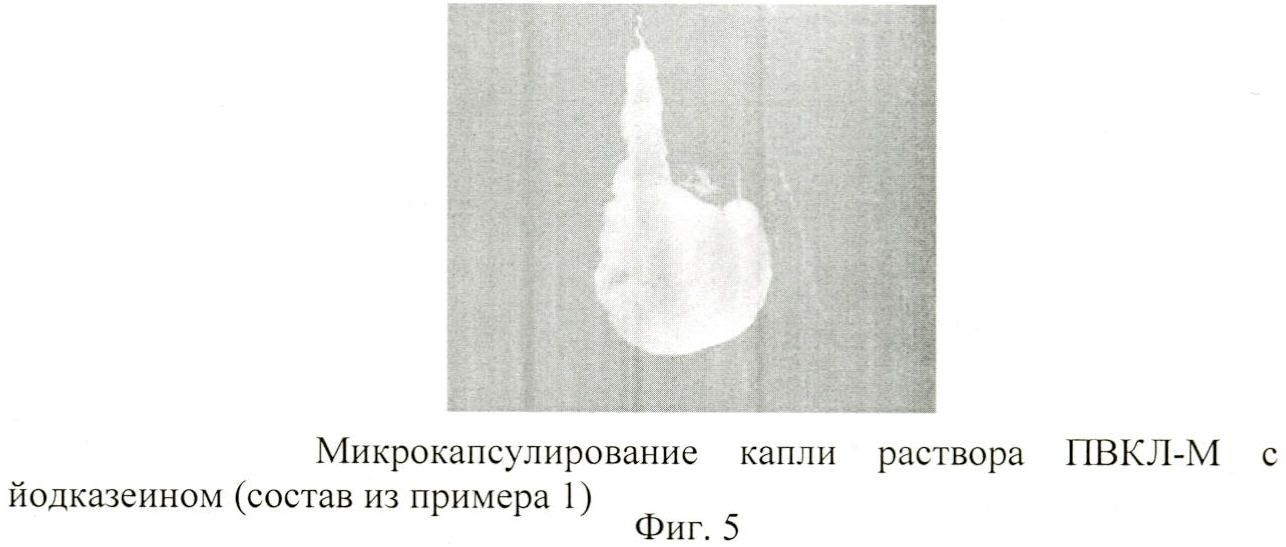
Кинокамера фиксировала процесс микрокапсулирования при введении шприцом капли объемом в 0,1 см3 водного раствора ПВКЛ-М + йодказеин, находящегося при комнатной температуре, в 1%-ный гель агар-агара, нагретый до 37°C. Коллапс капель происходит за секунды, а компактный гель сохраняется месяцы даже при комнатной температуре (фиг.5).
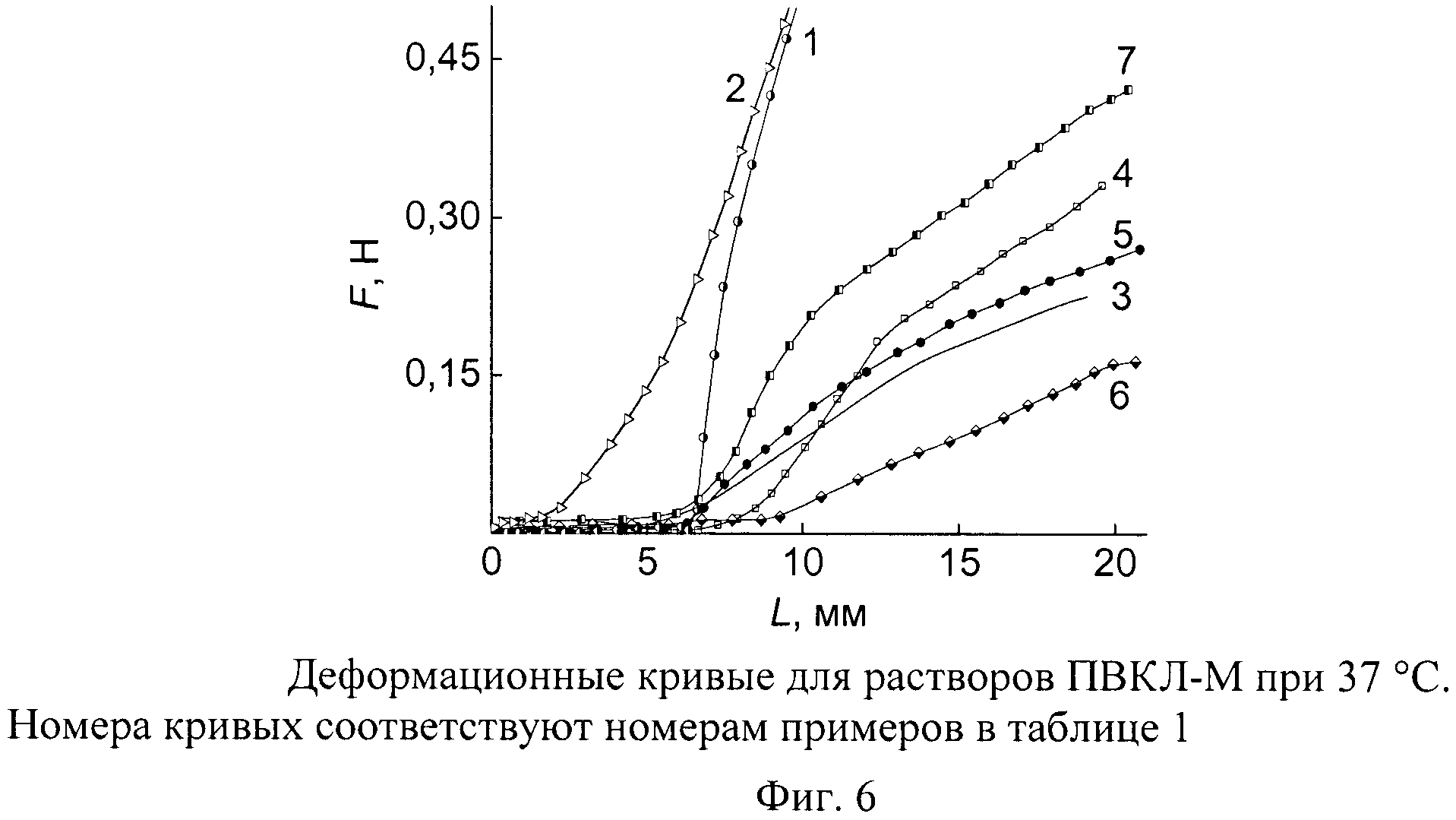
Упругие свойства водных растворов интерполимерных комплексов, претерпевших термотропный переход, определяли методом одностороннего сжатия (фиг.6). В цилиндрическую ячейку из нержавеющей стали диаметром 20 мм, снабженную термостатирующей рубашкой, заливали 8 см3 исследуемого раствора, помещали на платформу разрывной машины Zwick, нагревали до 37°C и выдерживали 20 мин. Стержень из ПТФЭ диаметром 15 мм закрепляли в подвижном зажиме и осуществляли погружение в содержимое ячейки. На графике испытаний отображалась кривая сила-перемещение. В наших испытаниях благодаря наличию зазора между поршнем и стенкой ячейки растягивающее напряжение внутри виртуального цилиндра под поршнем создает гидростатическое давление, направленное наружу, так что S(α)=S0, d(F/S0)≈Ecdα, Еc=d(F(α)/S0)/dα (S0 - площадь сечения образца, F - сила при степени сжатия α<1). Поэтому эффективный модуль Еc определяли из наклона деформационной кривой на линейном начальном участке при L>L*, где L - текущее значение перемещения, L* - значение L, при котором реакция на сжатие становится больше нуля при контакте с плотной сердцевиной. Почти всегда усилие регистрируется не сразу по достижению поршнем верхней границы образцов из-за наличия жидкой оболочки, которая обязана своим происхождением синерезису воды во время фазового распада системы. За объемную долю жидкой фазы принимали отношение L*/L0, где L0 - начальная высота столба жидкости в ячейке. В приведенных примерах (таблица 1) значения L*/L0 изменяются в интервале 0,1-0,3. Упругий модуль сжатия, в общем, зависит от скорости деформирования W, поэтому объективности ради следовало проводить измерения Еc при нескольких W и экстраполировать к W=0. Это довольно трудоемкая процедура, поэтому для сравнительных оценок ограничивались испытаниями при одной скорости W=50 мм/мин.
Температуру фазового распада композиции Тфр определяли по точке перегиба на кривой помутнения растворов в кювете спектрофотометра, абсолютную вязкость раствора при η0 25°С - на шариковом вискозиметре Гепплера. Исходные растворы тестировали также на способность к всасыванию в шприц (свш) с помощью иглы 08×40 С ГОСТ 25377-82.
Изобретение иллюстрируется следующими примерами. Примеры разделены на две группы, в которых в качестве термочувствительного полимера используются ПВКЛ-М и ПВКЛ-Н, отличающиеся средней молекулярной массой. Исходные водные растворы характеризуются следующим набором показателей:
Сп - концентрация ПВКЛ, мас.%;
Сб - концентрация белка йодказеина, мас.%;
Сs - концентрация соли NaCl, мас.%;
η0 25°C - абсолютная вязкость при 25°C, мПа·с;
Тфр - температура фазового разделения,°C;
свш - способность к всасыванию в шприц (СВШ) с помощью иглы 08×40 С ГОСТ 25377-82. В таблице 1 примеров имеется соответствующая колонка, в которой выдержавшие этот тест растворы отмечены знаком (+), в противном случае - знаком (-).
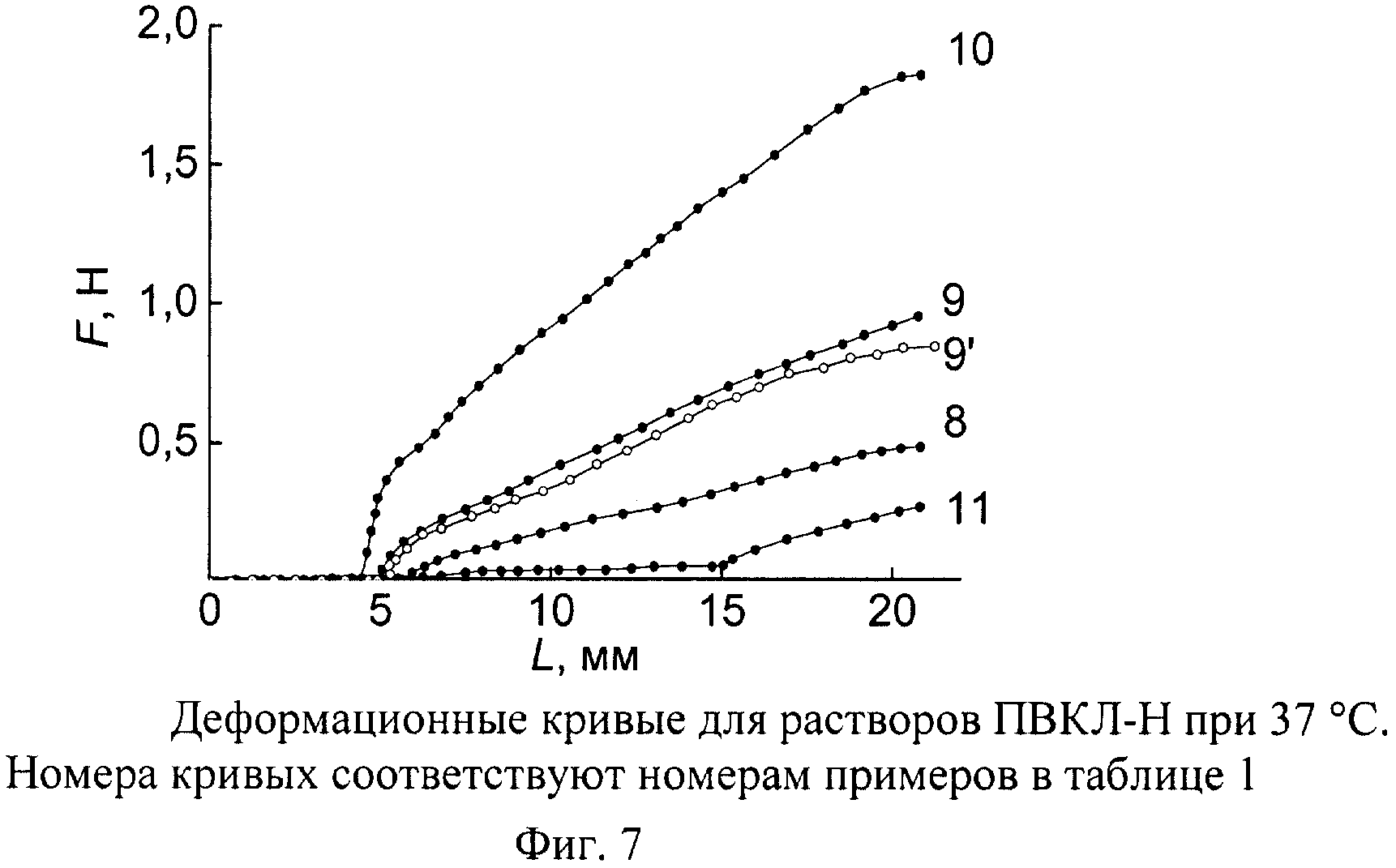
Состояние раствора при 37°C характеризуется долей вытесненной воды (L*/L0), модулем сжатия гелевой сердцевины Еc 37° (Па) и полной кривой сила-перемещение. Реакция на сжатие полимерно-белковых систем на основе ПВКЛ-Н и ПВКЛ-М в области Т>Тфр растворов, в первую очередь, отличаются тем, что пороговые концентрации полимера, при достижении которых регистрируется вязкоупругое напряжение гелевой фазы, составляют приблизительно 15 и 2 мас.% для ПВКЛ-Н и ПВКЛ-М соответственно. При относительно больших концентрациях полимера на деформационных кривых наблюдается крутой подъем напряжения в окрестности L>L*, что отражает наличие достаточно жесткой оболочки на границе с вытесненной водой. В таком случае в таблице 1 приводятся два значения модуля сжатия - до и после излома кривой, то есть для оболочки и сердцевины.
Комментарии к таблице 1. Пример 1 - отрицательный. Высокие молекулярная масса и концентрация ПВКЛ-М в растворе в присутствии белка и соли обеспечивают в результате термотропного перехода превосходную компактность и упругость гелевой фазы, составленной из интерполимерных комплексов. Компактный гель сохраняется при 37°C в течение по крайней мере месяца (фиг.5). Однако имеется существенный недостаток - вязкость исходной композиции излишне велика, чтобы раствор можно было набрать в шприц с тонкой иглой.
Пример 2 - отрицательный. Композиция также неприемлема в качестве базы для РФП из-за повышенной вязкости исходного водного раствора. Вязкоупругие свойства конечной структуры интерполимерных комплексов вполне удовлетворяют требованиям, предъявляемым к РФП.
Примеры 3-5 - положительные. Вязкоупругие полимерные тела, обладающие модулем упругости 103-104 Па, относятся к эластичным студням [8]. В примерах 3-5 водно-солевые растворы интерполимерных комплексов в результате термотропного перехода приобретают компактную кинетически стабильную морфологию с модулем сжатия Ec 37°≥103 Па и по этому показателю соответствуют поставленным перед изобретением задачам. Умеренная вязкость исходных растворов при этом позволяет производить с ними необходимые для инъекций операции.
Примеры 6-7 - положительные. Содержание ПВКЛ-М, превышающее порог перекрывания Спер ~1/[η] всего в 3 раза, позволяет получать в композиции с йодказеином и солью растворы с удобной для работы вязкостью ~15 мПа·с. Пространственная структура, формирующаяся из интерполимерных комплексов после преодоления температуры фазового разделения, обладает необходимым уровнем вязкоупругих свойств.
Примеры 8-9 - положительные. Исходные растворы интерполимерных комплексов на основе ПВКЛ-Н обладают приемлемой для инъекций вязкостью, а компактная полимерно-белковая фаза - превосходными вязкоупругими характеристиками и, кроме того, имеет сравнительно жесткую оболочку. Зависимость под номером 9' (фиг.7) подтверждает временную стабильность гелеобразного состояния и представляет собой повторную регистрацию деформационной кривой 9 после суточной выдержки при 37°C.
Пример 10 - отрицательный. Концентрация полимера излишне велика. Оболочка и сердцевины интерполимерной фазы имеют высокий уровень упругости. Однако исходная композиция не удовлетворяет требованиям, предъявляемым к текучести раствора.
Пример 11 - отрицательный. После термотропного перехода реакция системы на сжатие типична для дисперсии типа латекса и не годится для изготовления РФП.
Операция по мечению казеина и йодказеина, приготовление радиофармпрепарата. 0,5 мл раствора белка Сб=10 мас.%, 0,5 мл раствора хлорамина Б концентрацией Схб=10 мг/мл (все растворы сделаны в карбонатном буфере с pH 9,6) сливали в медицинский флакон, добавляли 0,05 мл водного раствора Na131I с удельной активностью 20 МБк/мл, переданного из горячей камеры в химический бокс, перемешивали и выдерживали 20 мин. Из полученной смеси отделяли раствор меченого белка от сопутствующих низкомолекулярных соединений на колонке с сефадексом G25 и измеряли объемную активность белковой фракции объемом 9 мл, которая оказалась 0,094 МБк/мл. Эффективность мечения по 131I составила 85%. Приготовленный подобным образом раствор радиоактивного йодказеина с заданной активностью представляет собой субстанцию, необходимую для приготовления радиофармпрепарата (РФП). В необходимом объеме она добавляется в базовую композицию, содержащую ПВКЛ, белок, хлористый натрий, так что конечный препарат соответствует примеру №5 из таблицы 1 и в дальнейшем именуется 131I-РФП/5.
Проведение модельных экспериментов на лабораторных животных. Полученные модельные растворы радиофармпрепарата 131I-РФП/5 были использованы для проведения модельных экспериментов на лабораторных животных и выполнения доклинических испытаний РФП. Исследования были выполнены на беспородных белых мышах-самках. Всего было использовано 50 животных, которым перевивали опухоль (карцинома Эрлиха) путем внутрибрюшинного или подкожного введения асцитной жидкости. Через 7 сут, когда объем опухоли достигал 100-200 мм3, отбирали мышей приблизительно с одинаковым объемом опухоли. Каждому животному внутриопухолево вводили по 0,185 МБк (5 мкКи) в 0,1 мл 3%-ного раствора 131I-РФП/5. Через 7 сут животных забивали путем декапитации под наркозом, выделяли пробы органов и тканей, помещали их в пластиковые пробирки, взвешивали на электронных весах "Sartorius" и проводили радиометрию с помощью автоматического гамма-счетчика "Wizard" версии 2480 фирмы Perkin Elmer/Wallac. Измерения 131I проводили по фотопику с энергией гамма-излучения 364 кэВ. По данным радиометрии рассчитывали коэффициенты дифференциального уровня накопления как частное от деления величин концентрации активности в опухоли и в других органах и тканях (таблица 2).
Полученные данные свидетельствуют о высокой стабильности препарата ин виво.
Доклинические испытания радиофармпрепарата. Результаты изучения острой токсичности 131I-РФП/5.
Работа была проведена на самках белых беспородных мышей после внутрибрюшинного и подкожного введении 131I-РФП/5.
Внутрибрюшинное введение. Для определения токсичности использовали клинически здоровых белых мышей в количестве 40 штук массой 30-40 г, по 10 мышей в каждой группе. 131I-РФП/5 вводили однократно в следующих дозах: первая группа - 2 г/кг; вторая - 1 г/кг; третья - 0,2 г/кг; четвертая - 0,02 г/кг; контрольная группа - 0 г/кг (физиологический раствор). Объем вводимого раствора 131I-РФП/5 во всех группах составил 1 мл. Наблюдения за животными вели в течение 3 недель и фиксировали клиническое состояние опытных и контрольных животных, их поведение, массу тела и сохранность кожного и шерстяного покрова. В результате проведенных исследований токсического действия после внутрибрюшинного введения 131I-РФП/5 не выявлено (таблица 3). Только в первой группе погибло 6 животных через 5 сут после инъекции 131I-РФП/5, остальные 34 через 3 недели остались живы. Внешний вид и поведение выживших мышей в первой и остальных группах не отличались.
Подкожное введение. Результаты испытаний так же, как и при внутрибрюшинном введении, продемонстрировали нетоксичность препарата. Внешний вид животных (кожные покровы, шерсть), вес, поведение, двигательная активность не изменились за 3 недели наблюдения, и не погибла ни одна мышь. В конце опыта мыши в группе с максимальной дозой были забиты, и проведена оценка капсулы, образовавшейся в месте введения препарата. Установлено, что после подкожного введения 131I-РФП/5 желеобразной консистенции в организме мышей препарат превращается в белое мягкое вещество.
Заключение по доклиническим испытаниям. В результате проведенных исследований в организме мышей с карциномой Эрлиха показано, что высокий уровень 131I-РФП/5 депонируется в опухоли после внутриопухолевого введения и удерживается в течение 7 сут, что достаточно для создания лечебной поглощенной дозы внутреннего облучения. Изучение острой токсичности 131I-РФП/5 после внутрибрюшинного и подкожного введения показало, что препарат не обладает токсическим действием.
Полученные результаты свидетельствуют о перспективности 131I-РФП/5 для использования его в радионуклидной терапии солидных опухолей.
Литература
1. Volker W.A., Hellman Т.J. Therapeutic Radiopharmaceuticals // Chem. Rev. 1999. V.99. P.2269-2292.
2. Teaching course on radiation oncology. Principles of treatment and Evidence-based Practice for Radiotherapy. ESTRO, IAFA: Cairo, Egypt. 2001. 390 р.
3. Галаев И.Ю. "Умные" полимеры в биотехнологии и медицине // Успехи химии. 1995. Т.65. №5. С.505-524.
4. Филиппова О.Е. Восприимчивые полимерные гели // Высокомолек. соед. С.2000. Т.42. №12. С.2328-2355.
5. Hruby M., Subr V., Kucka J., Kozempel J., Lebeda O., Skoda A. Thermoresponsive polymers as promising new materials for local radiotherapy // Applied Radiation and Isotopes. 2005. V.63. P.423-431.
6. Cao Z., Jin Y., Zhang В., Miao Q., Ma C. A novel temperature- and pH-responsive polymer-biomolecule conjugate composed of casein and poly-N-isopropylacrylamide // Iranian Polymer Journal. 2010. V.19. №9. P.689-698.
7. Кирш Ю.Э. Поли-N-винилпирролидон и другие поли-N-виниламиды: Синтез и физико-химические свойства. M.: Наука, 1998.
8. Папков С.П. Студнеобразное состояние полимеров. M.: Химия, 1974.
9. Попов Е.М. Проблема белка. Т.3. Структурная организация белка. M.: Наука, 1997.
|
|