Результат интеллектуальной деятельности: БИОЛОГИЧЕСКИЙ МИКРОЧИП НА ОСНОВЕ ДИЭЛЕКТРОФОРЕЗА, СИСТЕМА ДЛЯ ЭКСПРЕСС-ИДЕНТИФИКАЦИИ ВИРУСОВ И СПОСОБ ЭКСПРЕСС-ИДЕНТИФИКАЦИИ ВИРУСОВ С ИХ ИСПОЛЬЗОВАНИЕМ
Вид РИД
Изобретение
Изобретение относится к биологическим микрочипам с системой компьютерной регистрации и учета результатов, способу экспресс-идентификации вирусов с их применением и может быть использовано в медицине, молекулярной биологии, вирусологии и охране окружающей среды.
Предшествующий уровень техники
В настоящее время для видовой идентификации вирусов применяются следующие методы:
Иммунная электронная микроскопия [Маренникова С.С., Янова Н.Н., Жукова О.А. 1990. Электронная микроскопия как метод диагностики при эпидемиологическом надзоре за поксвирусными инфекциями. // Ж. микробиол. Вып.8. С.57-62];
Иммуноферментный анализ вирусов [Маренникова С.С., Мпацевич Г.Р., Хабахпашева Н.А., Новохатский А.С., Малахова И.В., Шелухина Э.М. 1986. Повышение специфичности иммуноферментного анализа за счет использования коньюгата на основе моноклональных антител. // Вопр. вирусол. Вып.6. С.689-690.];
Реакция непрямой гемагглютинации [Носков Ф.С., Маренникова С.С., Конникова Р.Е. и др. 1972. Применение реакции непрямой гемагглютинации для лабораторной диагностики оспы. // Вопр. вирусол. Вып.3. С.347-351];
Методы, основанные на ПЦР:
а) с последующим анализом длины амплифипированного фрагмента [Meyer, H., Pfeffer, M. & Rziha, H.-J. 1994. Sequence alterations Withinand downstream of the A-type inclusion protein genes allow differentiation of Orthopoxvirus species by polymerase chain reaction. J. Gen. Virol. Vol.75, 1975-1981];
b) с последующим рестрикционным анализом [Roop, S.L., Jin, Q., Knight, J.C., Massung, R.F. & Esposito, J.J. 1995. PCR strategy for identification and differentiation of smallpox and other orthopoxviruses. // Journal of Clinical Microbiology 33, 2069-76].
Однако вышеприведенные методы и средства требуют длительного времени для получения результата диагностики.
Известны средства диагностики гепатита С, предусматривающие использование (исследование) крови людей, зараженных или подозрительных на заражение вирусом гепатита С (Патент РФ №2194993, МПК G01N 33/569, опубл. 20.12.2002 г.). Обнаружение (выявление) антигенов вируса гепатита С (ВГС) основано на способности антигенов ВГС агглютинировать эритроциты гусей или голубей в реакции гемагглютинации (РГА), при этом результаты считаются положительными, если титры антигенов ВГС в РГА превышают 1:20-1:40. Реакцию гемагглютинации ставят при рН 6,1-6,5. В качестве буферной смеси в РГА используют боратный буфер рН 9,0, содержащий 0,4% бычьего альбумина и смесь фосфатных буферов рН 6 и рН 7. Диагностика гепатита С предусматривает использование (исследование) крови людей, зараженных или подозрительных на заражение вирусом гепатита С, при котором выявляют индуцируемые гемагглютининами ВГС антитела в реакции торможения гемагглютинации (РТГА).
Однако вышеуказанные диагностические средства имеют длительные сроки получения результов (не менее 1,5-2-х часов).
Известен биологический микрочип для видовой идентификации вирусов рода Orthopoxvirus, представляющий собой пластинку-носитель, на которой расположена гелевая микроматрица, в ячейках которой иммобилизованы дифференцирующие олигонуклеотиды для видовой идентификации вирусов рода Orthopoxvirus (патент РФ №2270252, МПК C12Q 1/68, опубл. 20.02.2006 г.).
Кроме того, известен способ видовой идентификации вирусов рода Orthopoxvirus с использованием вышеуказанного биологического микрочипа (патент РФ №2270252, МПК C12Q 1/68, опубл. 20.02.2006 г.), включающий стадии:
а) приготовление биологического микрочипа, охарактеризованного в п.2, заключающееся в нанесении гелевой микроматрицы на стеклянную подложку и последующей иммобилизации дифференцирующих олигонуклеотидов, характеризованных в п.1;
б) амплификация фрагмента гена crmB методом двухстадийной асимметричной ПЦР с использованием флуоресцентно меченного праймера для получения амплифицированной одноцепочечной вирусной ДНК;
в) гибридизация одноцепочечной ДНК, полученной из стадии б), с указанными дифференцирующими олигонуклеотидами на биологическом микрочипе, полученном согласно стадии а), путем инкубации указанного микрочипа в герметичной реакционной камере для образования дуплексов амплифицированных фрагментов вирусной ДНК с дифференцирующими олигонуклеотидами микрочипа;
г) регистрация полученного результата, осуществляемая путем детекции флуоресцентного сигнала меченого образца,
д) интерпретация полученного результата, осуществляемая путем сравнения полученной гибридизационной картины с шаблонами. Регистрацию флуоресцентного сигнала осуществляют визуально или с использованием программного обеспечения. Интерпретацию полученной гибридизационной картины проводят путем сравнения ее с набором стандартных, индивидуальных для каждого вида шаблонов, подобранных таким образом, что флуоресцентный сигнал совершенного дуплекса позволяет однозначно провести видовую идентификацию вирусов рода Orthopoxvirus.
Однако вышеуказанный биологический микрочип требует синтеза дорогостоящих видоспецифичных олигонуклеотидов и высококвалифицированного персонала для проведения анализа.
Наиболее близким аналогом (прототипом) является биологический микрочип для определения наличия вирусов в биоматериале и их концентрации Св в жидком биологическом материале (патент РФ №2225446, МПК C12Q 1/06, опубл. 10.03.2004 г.), включающее прозрачную измерительную кювету, в которой расположены электроды, соединенные с источником электропитания, а также измерительный блок, отличающееся тем, что источник электропитания представляет собой генератор переменного электрического напряжения, а измерительный блок содержит микроскоп, оптически связанный с измерительной кюветой, и систему анализа изображения для измерения скорости движения тест-клеток, содержащую видеокамеру, оптически связанную с микроскопом, и компьютер, соединенный с видеокамерой. Электроды в измерительной кювете установлены с зазором, достаточным для формирования в нем средней напряженности электрического поля в пределах от 104 до 106 В/м.
Другим наиболее близким аналогом (способом-прототипом) является способ определения наличия вирусов и их концентрации Св в в жидком биологическом материале (патент РФ №2225446, МПК C12Q 1/06, опубл. 10.03.2004 г.), включающий отбор проб исследуемого материала в жидкой форме на наличие вирусов, разведение их с заданным коэффициентом k, смешение разведенных проб с тестовой клеточной суспензией в учетной лунке с заданной концентрацией клеток Ск с последующим определением концентрации вирусов Св, отличающийся тем, что предварительно отбирают тестовые клетки, обладающие высокой специфичностью к исследуемому виду вируса и определяют среднее количество β вирусов, обеспечивающих инфицирование указанных клеток, одним из известных методов, например, методом электронной микроскопии, а концентрацию вирусов Св определяют путем переноса смеси исследуемых проб материала с заданной концентрацией клеток Ск в измерительную кювету, формирования в кювете неоднородного переменного электрического поля, измерения средней скорости движения каждой клетки в суспензии и определения доли неподвижных клеток.
Однако вышеприведенные наиболее близкие аналоги (микрочип и способ индикации вирусов) не обеспечивают возможность идентифицировать конкретный вид вируса, присутствующего в жидком биологическом материале.
Техническим результатом заявляемого изобретения является обеспечение возможности экспресс-идентификации конкретного вида вируса, присутствующего в жидком биологическом материале.
Указанный технический результат достигается заявляемым биологическим микрочипом, включающим оптически прозрачную пластину-матрицу со съемным покровным стеклом, на которой сформированы несколько гидроизолированных ячеек, ограниченных по крайней мере тремя и более электродами, установленными с зазором относительно друг друга и соединенными с источником переменного напряжения, обеспечивающим последовательно на частотах отрицательного и положительного диэлектрофореза формирование между электродами неоднородного переменного электрического поля со средней напряженностью Е>105 В/м, каждая из ячеек микрочипа заполнена смесью суспензии эритроцитов, чувствительных к вирусному агенту в концентрации не менее 1,0×103 шт/мкл и положительной сыворотки, специфичной к искомому вирусному агенту, причем первая ячейка микрочипа заполнена пробой, содержащей эритроциты, чувствительные к вирусу, вторая ячейка заполнена пробой, содержащей эритроциты, чувствительные к вирусу, и вирус, который агглютинирует используемые эритроциты, третья ячейка заполнена пробой, содержащей эритроциты, чувствительные к вирусу, пробу с исследуемым вирусом, который агглютирирует используемые эритроциты, и положительную сыворотку, специфичную к исследуемому вирусу, четвертая ячейка содержит эритроциты, чувствительные к вирусу, вирус который агглютинирует используемые эритроциты, и нормальную сыворотку, кроме того, конечный состав электролита в пробах содержит 0.3 М раствора сахарозы и 5 мМ NaCl, а во второй, третьей и четвертой ячейках содержится один и тот же вирус. Отрицательный диэлектрофорез предпочтительно соответствует частоте 50 кГц, а положительный диэлектрофорез предпочтительно соответствует частоте 2000 кГц.
Указанный технический результат достигается также заявляемой системой для идентификации вируса в суспензии исследуемой пробы с исследуемым вирусом, включающий биологический микрочип по пп.1-2 формулы изобретения, установленный в поле зрения микроскопа, к окуляру которого подсоединена видеокамера, связанная с компьютером, причем источник переменного напряжения микрочипа соединен с компьютером.
Указанный технический результат достигается также заявляемым способом идентификации вируса в суспензии исследуемой пробы с исследуемым вирусом, содержащим включение всех блоков системы идентификации вируса по п.3, подготовку ячеек микрочипа по п.1, 2 к исследованию, зондирование неоднородным переменным электрическим полем с напряженностью Е>105 В/м последовательно на двух частотах 50 кГц (отрицательный диэлектрофорез) и 2000 кГц (положительный диэлектрофорез) последовательно всех ячеек микрочипа, отключение напряжения, подаваемого на микрочип и сравнение реакции эритроцитов в ячейках микрочипа, причем исследуемый вирус идентифицируют с помощью положительной сыворотки, специфичной к исследуемому вирусу, в третьей ячейке, если на частоте 50 кГц во всех ячейках эритроциты собираются в центре измерительной камеры, а на частоте 2000 кГц эритроциты в первой ячейке притягиваются к электродам, а в третьей ячейке ведут себя, как контрольные эритроциты в первой ячейке.
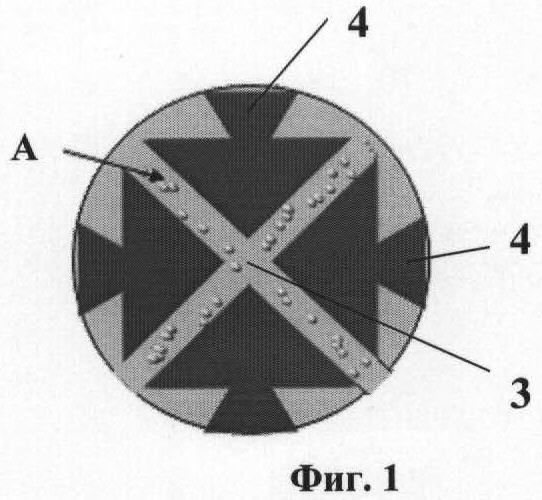
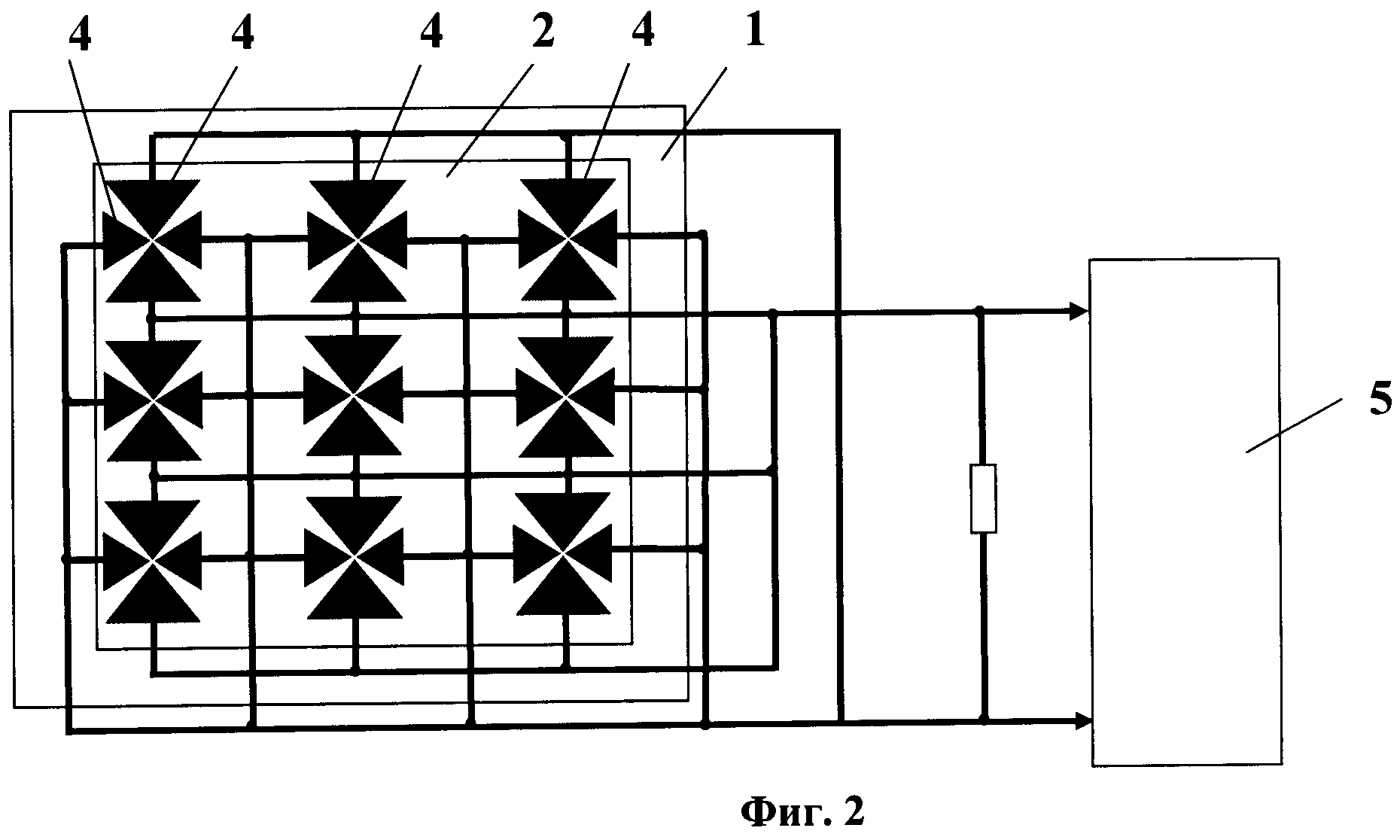
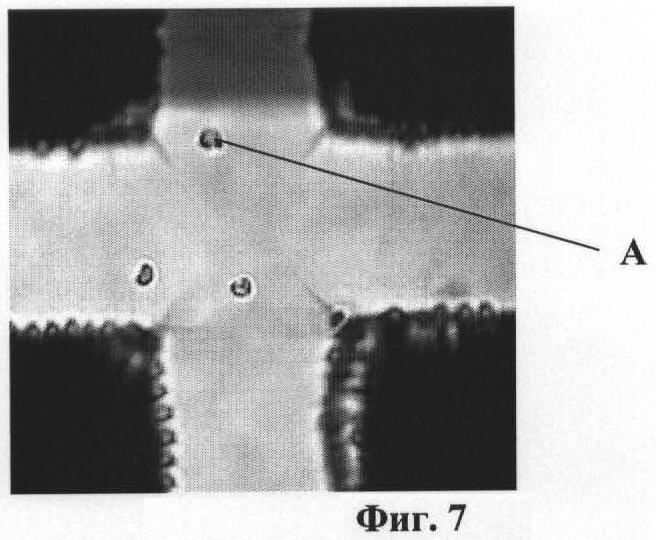
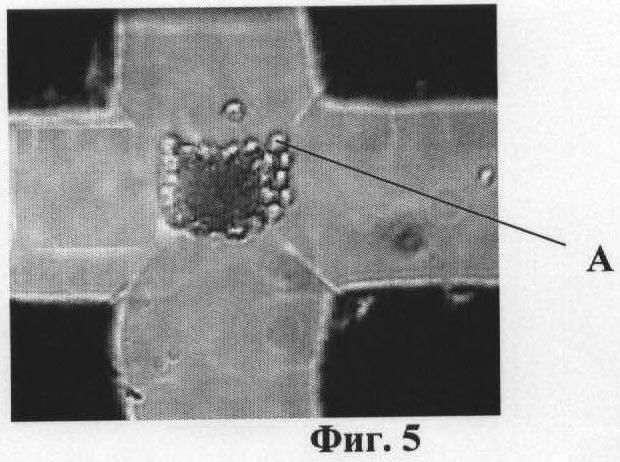
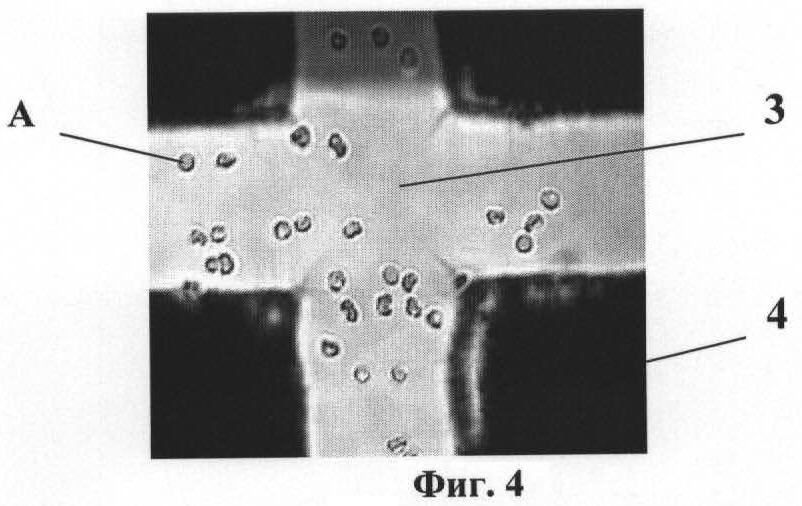
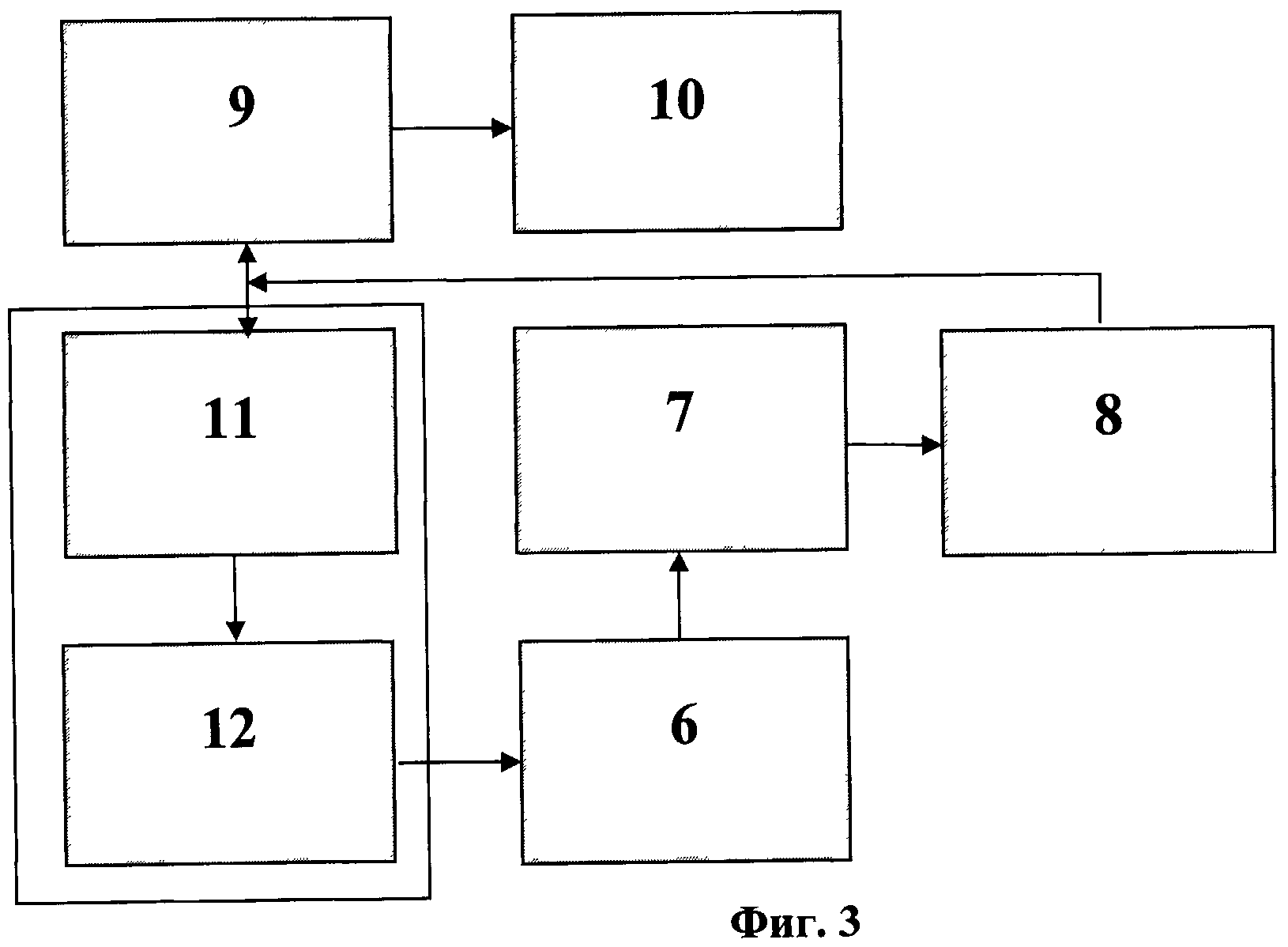
На фиг.1 приведена схема ячейки микрочипа. На фиг.2 изображена схема биологического микрочипа. На фиг.3 приведена схема системы идентификации вирусов. На фиг.4 представлены эритроциты А лошади в измерительной ячейке 3 микрочипа 6 без напряжения на электродах 4. На фиг.5 представлены эритроциты А лошади в измерительной ячейке 3 микрочипа 6. Частота 50 кГц, напряжение 5 В и напряженностью электрического поля Е>105 В/м (сформирован агрегат эритроцитов между электродами, что является характерной картиной для отрицательного диэлектрофореза). На фиг.6 представлен процесс распада агрегата эритроцитов А между электродами 4. Эритроциты А лошади в измерительной ячейке микрочипа без напряжения. На фиг.7 представлены эритроциты А лошади в измерительной ячейке микрочипа. Частота 2000 кГц, напряжение 5 В и напряженность электрического поля Е>105 В/м (эритроциты оседают на ближайших электродах 4, что является характерной картиной для положительного диэлектрофореза).
Биологический микрочип (фиг.1, 2) включает оптически прозрачную пластину-матрицу 1 со съемным покровным стеклом 2, на которой сформирована одна или несколько ячеек 3, ограниченных по крайней мере тремя и более электродами 4, установленными с зазором относительно друг друга и соединенными с источником переменного напряжения 5, обеспечивающим последовательно на частотах отрицательного и положительного диэлектрофореза формирование между электродами 4 неоднородного переменного электрического поля со средней напряженностью Е>105 В/м. Каждая из ячеек 3 микрочипа заполнена смесью суспензии эритроцитов А (фиг.4-7) чувствительных к вирусному агенту в концентрации не менее 1,0×103 частиц/мкл и положительной сыворотки к искомому вирусному агенту. Отрицательный диэлектрофорез соответствует частоте 50 кГц, а положительный диэлектрофорез соответствует частоте 2000 кГц. В каждой ячейке 3 микрочипа размещены положительные сыворотки к разным видам вирусов.
Система для идентификации вирусов (фиг.3) включает биологический микрочип 6 с ячейками 3, установленный в поле зрения микроскопа 7, к окуляру которого подсоединена видеокамера 8, связанная с компьютером 9 и монитором 10. Источник переменного напряжения 5 микрочипа содержит генератор переменного напряжения 11, соединенный с компьютером 9 и через усилитель 12 с электродами 4 ячеек 3 микрочипа 6.
Способ идентификации вирусов с использованием биологического микрочипа и системы идентификации осуществляют следующим образом.
Способ включает подготовку микрочипа 6 и системы анализа (компьютер 9, видеокамера 8, микроскоп 7) и реагенты к исследованию. Подготовка суспензии эритроцитов. 0.5% суспензию эритроцитов готовят из цельной гепаринизированной крови путем 5-кратной отмывки в фосфатно-солевом буфере.
Подготовка к выполнению измерений. Перед выполнением измерений проводят подготовку рабочего места и вспомогательные работы: подготовку посуды, автоматических пипеток, покровных стекол, дистиллированной воды, 0.3 М раствора сахарозы с 5 мМ, NaCl, а также биологический микрочип. Осуществляется подготовка к работе микроскопа, видеокамеры согласно инструкциям по эксплуатации, генератора и усилителя.
Рабочее место состоит из двух лабораторных столов. На первый стол устанавливают компьютер 9, монитор 10, усилитель 12. На второй стол устанавливают микроскоп 7 с видеокамерой 8, штатив с пробирками, пипетками, носиками к пипеткам, покровными стеклами с размером 18*18 мм, пинцет. На рабочем месте устанавливается три химических стакана: с дистиллированной водой (100 мл), спиртом (50 мл), для сбора отходов (250÷500 мл). Второй стол используется как чистое рабочее место. Перед началом и окончанием работы производится протирка спиртом всех его поверхностей и расположенного на нем оборудования (исключая оптику). Подготовка посуды. В ходе подготовки к измерениям необходимо тщательно соблюдать чистоту на рабочем месте. Используются одноразовые пластиковые пробирки объемом 0.25 см3. Подготовка раствора 0,3 М раствора сахарозы. Используется стерильный раствор 0.3 М сахароза с 5 мМ NaCl.
Подготовка микроскопа 7. На микроскоп устанавливают объективы и окуляры, обеспечивающие режим "План" и увеличение в диапазоне 150÷250 раз. Общую подготовку микроскопа осуществляют согласно инструкции по эксплуатации. Настройка освещения, фокусировка на объект (микрочастицы) осуществляется также согласно инструкции по эксплуатации. На экране монитора компьютера должны наблюдаться сфокусированное изображение граней электродов, микрочастиц с выраженной яркостью, контрастностью и равномерно освещенных. Микроскоп после настройки должен обеспечивать разрешающую способность 0,5 мкм!
Подготовка усилителя 12. Усилитель 12 (Г3-112/1) устанавливается на первый стол, радом с компьютером. Производится его подключение к компьютеру и микрочип согласно функциональной схеме (Фиг.3). Подготовка усилителя к работе осуществляется в соответствии с инструкцией по эксплуатации. Постоянная составляющая выходного напряжения усилителя не должна превышать ±50 мВ. Не допускается включение или выключение усилителя тумблером "Сеть", если он подключен к измерительной ячейке и в ней находится суспензия микрочастиц или какая-либо жидкость (дистиллированная вода, раствор сахарозы). Переходные электрические процессы, возникающие на выходе усилителя, в моменты включения/выключения могут разрушить электроды измерительной ячейки.
Подготовка видеокамеры 8. Видеокамеру 8 устанавливают в оптический ход микроскопа 7 (тринокулярный путь) и жестко фиксируется. Подготовка к работе осуществляется согласно инструкции по эксплуатации. В процессе измерений рекомендуется использовать видеокамеру 8 в режиме ручной фокусировки. Режим автофокусировки видеокамеры 8 часто приводит к срыву видеоизображения.
Подготовка одноразового биологического микрочипа 6. К электродам 4 биологического микрочипа 6 припаиваются контактные проводники с выхода усилителя 12, например, Г3-112/1. Пайка осуществляется припоем. В качестве флюса используется ортофосфорная кислота. После пайки место тщательно промывается проточной водой с использованием моющих средств до полного устранения остатков флюса. Далее микрочип 6 промывают дистиллированной водой и сушат в сушильном шкафу при температуре 60°С, до полного испарения воды. Далее микрочип 6 обрабатывают силиконизирующим раствором (Silicone Solution SERVA для стекла и металлов) с целью придания его поверхности гидрофобных свойств. Биологический микрочип 6 жестко закрепляется на подвижном столе микроскопа 7, так чтобы измерительная ячейка 3 находилась в центре поля зрения микроскопа 7.
Подготовка компьютера 9 и программы управления процессом к работе.
Компьютер 9 включают в сеть и запускают программу для видеозахвата, например, MovieMaker, которая входит в Windows, AdobePremiere, Nero или другие.
В компьютере 9 аппаратно должна присутствовать последовательная высокоскоростная шина (IEEE-1394 FireWire, i-Link) для обмена цифровой информацией между компьютером 9 и другими электронными устройствами. Системы. Основное ее применение - копирование видео с miniDV камеры 8 в файлы на компьютере 9 (видеозахват) см. Фиг.3.
Далее готовят миропробирки с объемом по 250 мкл. Формируют ряд пробирок. Количество микропробирок в ряду выбирается с учетом списка наименований используемых сывороток плюс 2 шт. В каждую микропробирку, кроме первой, вносится суспензия исследуемой пробы с исследуемым вирусом объемом 10 мкл, который в априори известно, что он агглютинирует используемые эритроциты.
Далее в первую пробирку вносится 10 мкл фосфатно-солевого буфера (ФСБ).
В первую и вторую пробирку вносится еще по 10 мкл ФСБ.
В пробирку №3 вносят 10 мкл специфической (положительной) сыворотки.
В пробирку №4 вносят 10 мкл нормальной (отрицательной) сыворотки.
Далее в каждую пробирку вносится по 10 мкл эритроцитов.
Все пробирки центрифугируют в течение 30 секунд с целью получения осадка эритроцитов на дне пробирок. Надосадочную жидкость в объеме 25 мкл удаляют пипеткой из всех пробирки. Затем во все пробирки вносят по 200 мкл 0.3 М раствора сахарозы с содержанием 5 мМ NaCl. Содержимое всех пробирок центрифугируют в течение 30 секунд с целью получения осадка эритроцитов на дне пробирок. Надосадочную жидкость в объеме 180 мкл удаляют пипеткой из пробирок. Полученные осадки эритроцитов перемешивают в пробирках и используют для анализа, который осуществляется в два шага.
Первый шаг анализа - осуществляется сканирование пробы на наличие гемагглютинирующего агента в пробирке №2. Производится исследование поведения клеток в НПЭП методом диэлектрофореза. А именно, осадок эритроцитов забирают пипеткой в объеме 5-10 мкл и вносят в соответствующий измерительный объем измерительной ячейки 3 на матрице микрочипа 6, и накрывают покровным стеклом 2. Далее на электроды 4 микрочипа 6 в течение 20 секунд подается напряжение 5 В и частотой 50 кГц. С помощью видеокамеры 8 и компьютера 9 производится запись видеофайла поведения эритроцитов в измерительных ячейках 3 микрочипа 6. Напряжение выключается. На электроды 4 в течение 20 секунд подается следующее напряжение, но уже с частотой 2000 кГц. Аналогично производится видеозапись поведения эритроцитов в измерительной ячейке 3. Напряжение выключается.
Если есть реакция во 2-й пробирке (эритроциты на частотах 50 и 2000 кГц собираются в центральной области измерительной ячейки 3), то выполняется второй шаг. Суспензия из третьей пробирки объемом 5-10 мкл вносится в свободную ячейку 3 микрочипа 6 и накрывается покровным стеклом 2. Производится идентификация вируса специфической (положительной) сывороткой из пробирки 3 методом диэлектрофореза на частотах 50 и 2000 кГц. С помощью видеокамеры 8 и компьютера 9 производится запись видеофайла поведения эритроцитов в измерительных ячейках 3 микрочипа 6.
Пробирка №4, в которой присутствует нормальная (отрицательная) сыворотка - используется как отрицательный контроль специфической (положительной) сыворотки. Суспензия из указанной пробирки объемом 5-10 мкл вносится в свободную ячейку 3 микрочипа 6 и накрывается покровным стеклом 2.
|
Производится идентификация вируса нормальной сывороткой методом диэлектрофореза на частотах 50 и 2000 кГц. С помощью видеокамеры 8 и компьютера 9 производится запись видеофайла поведения эритроцитов в измерительных объемах микрочипа. Учет реакции ведут согласно табл.1.
Если реакции во второй пробирке не наблюдается, процесс повторяется сначала, но уже с другой вирус - клеточной парой.
После зондирования неоднородным переменным электрическим полем последовательно на двух частотах 50 кГц и 2000 кГц сравнивается реакция эритроцитов в центральной области измерительной камеры.
1. Контрольные эритроциты должны:
- на частоте 50 кГц собираться в центральной области измерительной камеры, отталкиваться от электродов;
- на частоте 2000 кГц удаляться из центральной области измерительной камеры, притягиваться к электродам.
2. Эритроциты, чувствительные к вирусному агенту, в составе суспензии должны:
- на частоте 50 кГц и 2000 кГц собираться в центральной области измерительной камеры, отталкиваться от электродов.
3. Эритроциты, чувствительные к вирусному агенту, в составе суспензии после добавления к ним специфической сыворотки должны вести себя, как контрольные. Они должны:
- на частоте 50 кГц собираться в центральной области измерительной камеры, отталкиваться от электродов, а на частоте 2000 кГц оседать на электродах.
4. Эритроциты, чувствительные к вирусному агенту, в составе суспензии после добавления к ним нормальной сыворотки должны вести себя, как эритроциты, чувствительные к вирусному агенту без нормальной сыворотки суспензии. Они должны:
- на частоте 50 кГц и 2000 кГц собираться в центральной области измерительной камеры, отталкиваться от электродов.
5. Эритроциты, не чувствительные к вирусному агенту, в составе суспензии ведут себя, как контрольные, независимо от наличия специфической или нормальной сыворотки в составе суспензии. Они должны:
- на частоте 50 кГц собираться в центральной области измерительной камеры, отталкиваться от электродов;
- на частоте 2000 кГц удаляться из центральной области измерительной камеры, притягиваться к электродам.
Пример. Проведение идентификации вируса гриппа H5N1 A Common gull Chany/P/2006
В эксперименте используются следующие реагенты:
- 0.5% суспензия эритроцитов лошади готовится из цельной гепаринизированной крови путем 5-кратной отмывки в фосфатно-солевом буфере компании "Биолот" Санкт- Петербург 0.01М фосфатный буфер Ph 7.3-7.5, содержащий 0.137 М/л NaCl и 0.0027 М/л KCl.
- вирус гриппа - антиген H5N1 A Common gull Chany/P/2006 получен из банка ГНЦ ВБ Вектор.
- титр в реакции гемагглютинации с 0.5% суспензии эритроцитов лошади составлял 128 ГАЕ в 0.025 мл.
- специфическая сыворотка (+) к указанному выше штамму вируса получена на хорьках с титром 1:2560 с 4 ГАЕ антигена.
- нормальная сыворотка (-) получена на хорьках. Нечувствительная к вышеуказанному вирусу по п.1.
- 0.3 М +0.005 M NaCl раствор сахарозы производства ГНЦ ВБ Вектор. - 0.01М фосфатный буфер Ph 7.3-7.5, содержащий 0.137 М/литр NaCl и 0.0027 М/л KCl. "Биолот" Санкт-Петербург.
Используя перечисленные ингредиенты, осуществлялась идентификация вируса H5N1 A Common gull Chany/P/2006 с применением заявляемых микрочипа, системы и способа идентификации по вышеприведенной методике.
Данные идентификации вируса в исследуемой пробе по поведению инфицированных и неинфицированных клеток эритроцитов лошади в ячейках заявляемого микрочипа под действием НПЭП приведены в табл.2.
|
Примечание: Характерные картины реакции эритроцитов для отрицательного и положительного диэлектрофореза представлены на фиг.4-7.
Общие временные затраты, связанные с идентификацией вируса гриппа специфической сывороткой с учетом времени подготовки эритроцитов, вируса, вирус-клеточных суспензий, их центрифугирования, анализа поведения клеток в измерительном объеме на частотах 50 и 2000 кГц, составили не более 30 минут.
Таким образом, вышеприведенные данные подтверждают достижение технического результата с использованием заявляемого изобретения: обеспечение возможности экспресс-идентификации конкретного вида вируса, присутствующего в жидком биологическом материале.