Результат интеллектуальной деятельности: СПОСОБЫ И СИСТЕМЫ ДЛЯ УХОДА ЗА РОТОВОЙ ПОЛОСТЬЮ
Вид РИД
Изобретение
Данная заявка испрашивает приоритет Патентной заявки Соединенных Штатов с серийным №61/027437, зарегистрированной 9 февраля 2008 г., а также заявляет приоритет Патентной заявки Соединенных Штатов с серийным №61/027442, зарегистрированной 9 февраля 2008 г., и Патентных заявок Соединенных Штатов с серийными №№61/027432; 61/027431; 61/027420 и 61/027435, зарегистрированных 8 февраля 2008 г., содержание которых включено в описание данной заявки в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к способу измерения относительных уровней кариесогенных и аргинолитических бактерий в ротовой полости, например, как части режима стоматологического обслуживания, путем применения композиции, включающей основную аминокислоту в форме свободного соединения или соли.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Ранее было предложено использовать аргинин и другие основные аминокислоты для применения при уходе за ротовой полостью, поскольку считается, что они имеют существенные преимущества в борьбе с образованием налета и чувствительностью зубов. Доступными в продаже основанными на аргинине зубными пастами являются DenClude® и ProClude®, содержащие CaviStat®, который содержит аргинин и бикарбонат кальция.
Тип биофлоры в ротовой полости играет существенную роль в поддержании отдельных частей и ротовой полости в целом в здоровом состоянии. Например, была сформулирована гипотеза, что существенным фактором благоприятного действия аргинина является то, что аргинин и другие основные аминокислоты могут перерабатываться конкретными типами бактерий, например S.sanguis, которые не являются кариесогенными и которые конкурируют с такими кариесогенными бактериями, как S.mutans за место на зубах и в ротовой полости. Аргинолитические бактерии могут использовать аргинин и другие основные аминокислоты для получения аммиака, повышая, таким образом, рН окружающей их среды, в то время как кариесогенные бактерии перерабатывают сахар, чтобы получить молочную кислоту, которая способствует снижению рН налета и деминерализации зубов, приводящим в конечном счете к кариесу.
Было бы полезно иметь эффективный способ мониторинга типа биофлоры в ротовой полости, например, чтобы определить оптимальное лечение и проводить мониторинг эффективности лечения пациентов.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение обеспечивает быстрые и простые способы оценки биофлоры в ротовой полости.
В первом варианте изобретения измеряют уровни продукции аммиака в налете, чтобы определить относительную популяцию аргинолитических бактерий.
В другом варианте изобретения измеряют уровни молочной кислоты в налете, чтобы определить относительную популяцию кариесогенных бактерий.
В другом варианте изобретения применяют полимеразную цепную реакцию (ПЦР), например количественную ПЦР в реальном времени, чтобы охарактеризовать биофлору в ротовой полости, например в налете или слюне.
В другом варианте изобретения применяют ПЦР с обратной транскриптазой (RT-PCR), чтобы охарактеризовать биофлору в ротовой полости, например в налете или слюне.
В другом варианте применяют пробы антител, например пробы флуоресцентных антител, чтобы охарактеризовать биофлору в ротовой полости, например в налете или слюне.
Например, изобретение подсчитывает уровни, по меньшей мере, одних кариесогенных бактерий, например S.mutans, и, по меньшей мере, одних аргинолитических бактерий, например S.sanguis.
В другом варианте пациента оценивают при помощи одного из указанных способов и прописывают соответствующее лечение.
Способы по изобретению применяют, в частности, чтобы определить потенциально вредоносные изменения экологии налета и чтобы сделать возможным корректирующее лечение до того, как произойдет измеримая или существенная деминерализация или повреждение зубов.
Таким образом, изобретение обеспечивает способы улучшения здоровья ротовой полости, например
a) снижение или торможение образования зубного кариеса,
b) снижение или торможение деминерализации и ускорение реминерализации зубов,
c) лечение, снижение или торможение образования ранних повреждений эмали,
d) снижение гиперчувствительности зубов,
e) снижение или торможение гингивита,
f) способствование заживлению язв и порезов в ротовой полости,
g) снижение уровня кислотообразующих бактерий,
h) увеличение относительных уровней аргинолитических бактерий,
i) торможение образования микробной биопленки в ротовой полости,
j) повышение и/или поддерживание рН налета, по меньшей мере, на уровне рН 5,5 с последующим введением сахара,
k) уменьшение образования налета,
l) лечение, ослабление или уменьшение сухости во рту,
m) отбеливание зубов,
n) улучшение системного здоровья, включая сердечно-сосудистое здоровье, например, снижая потенциальную возможность системного заражения через ткани ротовой полости,
o) иммунизирование зубов против кариесогенных бактерий и их эффектов,
p) чистка зубов и ротовой полости и/или
q) уменьшение эрозии зубов,
включая измерение биофлоры ротовой полости, например, используя любой из указанных способов, и, если указано, введение продукта для ухода за ротовой полостью, включающего эффективное количество основной аминокислоты или ее соли, например аргинина.
Изобретение дополнительно обеспечивает применение основной аминокислоты в форме свободного соединения или соли для получения лекарственного средства для улучшения здоровья ротовой полости у пациента, биофлора ротовой полости которого включает повышенные уровни кариесогенных бактерий, и/или повышенные уровни лактата, и/или низкие уровни аргинолитических бактерий, и/или низкие уровни образования аммиака в налете, измеренные способом по данному изобретению.
Изобретение дополнительно обеспечивает способ косметического улучшения ротовой полости (в котором такое косметическое улучшение может включать, например, отбеливание зубов и/или уменьшение неприятного запаха изо рта), этот способ включает измерение биофлоры ротовой полости способом по данному изобретению и, если указано, при присутствии повышенных уровней кариесогенных бактерий и/или повышенных уровней лактата и/или присутствии низких уровней аргинолитических бактерий и/или низких уровней образования аммиака в налете, введение продукта для ухода за ротовой полостью, включающего основную аминокислоту в форме свободного соединения или соли.
ПОДРОБНОЕ ОПИСАНИЕ
Метаболизм в налете - Образование аммиака
Способность зубного налета превращать аргинин в аммиак является маркером аргинолитической активности. Определенные бактерии обладают способностью превращать аргинин в аммиак, так же как определенные бактерии могут превращать сахара в кислоту. Повышать относительную концентрацию аргинолитических видов выгодно потому, что эти бактерии создают условия, которые неблагоприятны для пролиферации кариесогенных бактерий, которые благоприятствуют кислым условиям и повышают риск кариеса. Предполагается, что ежедневное применение аргинина произведет сдвиг в экологии налета, который благоприятствует аргинолитическим бактериям аналогичным способом, как частое потребление сахара создает условия, которые благоприятствуют ацидопродуцирующим бактериям. Аммиак является основанием, способным к нейтрализации кислот и поддержанию нейтрального рН налета. Условия нейтрального рН более благоприятны для непатогенных бактерий. Измерение образования аммиака определяет способность всех бактерий превращать аргинин в аммиак. Этот метод отличается от метода ПЦР в реальном времени (описанного ниже), который измеряет концентрацию выборочных аргинолитических бактерий и не распознает метаболически активные (живые) и неактивные (мертвые) бактерии.
Наборы для определения аммиака доступны в продаже, например, у Diagnostic Chemicals Limited (Oxford, CT), чтобы измерять образование аммиака. Принцип подсчета и определения заключается в определении прореагировавшего аммиака с альфа-кетоглутаратом и понижении образования L-глутамата и НАДФ из никотинамидадениндинуклеотидфосфата (НАДФН). Реакцию катализирует глутаматдегидрогеназа (ГДГ). Снижение поглощения при 340 нм из-за окисления НАДФН пропорционально концентрации аммиака. Образцы налета собирают после предписанного лечебного протокола. В некоторых публикациях налет собирают с образцов эмали или НАР, прикрепленных на держатель. В других публикациях налет собирают непосредственно с зубов.
Экология налета на основании уровня молочной кислоты
Так как измерение уровней аммиака служит показателем для измерения уровня аргинолитических бактерий, молочная кислота служит показателем для измерения уровней кариесогенных бактерий. У пациентов забирают налет при отсутствии утренней гигиены ротовой полости, при этом они не ели и не пили с предыдущего вечера. Они полоскают рот 10% раствором сахарозы в течение 2 минут. Через 8 минут налет собирают, соскабливая его с поверхности(ей) зубов. Образцы налета собирают в условиях холода в предварительно взвешенные пробирки и определяют вес налета. Анализ включает добавление ледяной воды к известному количеству образцов налета, последующее нагревание образцов до 80°С в течение 5 минут, чтобы убить бактерии и высвободить все кислоты до того, как образцы охлаждают в ледяной воде в течение дополнительных 5 минут. Затем образцы центрифугируют и фильтруют супернатант. Концентрацию лактата измеряют при помощи капиллярного электрофореза.
Экология налета на основании количественной ПЦР в реальном времени
Количественная ПЦР (полимеразная цепная реакция) в реальном времени является высокочувствительным методом количественного определения ДНК. Бактериальная ДНК, выделенная из зубного налета, применяется для подсчета суммарных уровней бактерий, так как количество ДНК напрямую связано с количеством присутствующих бактерий. ПЦР в реальном времени признается правительственными организациями, такими как Центр по контролю за заболеваниями (Center for Disease Control) и FDA, как очень убедительный и чувствительный метод. Воспользовавшись известными геномными последовательностями многих бактерий ротовой полости, составляют пробы для определения суммарных уровней бактерий ротовой полости или определенных бактерий, таких как S.mutans или S.sanguis. ДНК, выделенную из образцов налета или слюны, амплифицируют при помощи полимеразной цепной реакции. Количество ДНК экспоненциально увеличивается с каждым циклом реакции ПЦР. Метод называют «в режиме реального времени» потому, что реакцию отслеживают в реальном времени при помощи флуоресцентных репортерных молекул. В одном из вариантов изобретения в качестве репортерной молекулы используют SYBR Green. Эта молекула сильно флуоресцирует при связывании с двухцепочечной ДНК. Подсчет производится при помощи установки порогового значения флуоресценции и применения ДНК стандартов в различных концентрациях, чтобы определить количество циклов, необходимых для достижения порогового значения. Чем больше присутствует ДНК, тем меньше ДНК циклов необходимо для достижения порогового значения. Коммерческие приборы для ПЦР в реальном времени доступны у многих производителей, таких как Roche Diagnostics.
Образцы налета собирают с образцов эмали или гидроксиапатита с известной и постоянной площадью поверхности. Стандартизация сбора налета является критической потому, что количество присутствующей ДНК напрямую зависит от того, как много налета собирают. Неправильно использовать большое количество налета в качестве средства стандартизации суммарных бактерий, измеренных при помощи ПЦР в реальном времени, потому что эти два количества существенно коррелируют. Результаты выражают в мкг ДНК в мл. Статистический анализ можно проводить на концентрациях ДНК или Ln(концентрации ДНК). Для суммарных бактерий применяется двойной фактор ANOVA, использующий пациента и лечение в качестве факторов. Различия считают достоверными, если различие определяют с 95% уровнем достоверности. Для определенных бактерий, таких как S.mutans или S.sanguis, проводится двойной фактор ANCOVA, используя суммарные бактерии в качестве ковариата. Общее количество определенных бактерий, так как оно связано с суммарной популяцией бактерий, является более релевантным маркером здоровья экологии налета.
В конкретном варианте изобретения S.mutans измеряют в качестве маркера для кариесогенности. S.mutans выбраны потому, что они являются широко признанным фактором риска, связанным с инициированием зубного кариеса. В то время как другие кислотообразующие бактерии принимают участие в процессе кариеса, известно, что S.mutans играют существенную роль непосредственно в инициации и ранних стадиях кариесогенного процесса. В одном из вариантов изобретения S.sanguis выбраны в качестве маркера сдвига в сторону более здоровой экологии налета потому, что S.sanguis являются бактериями, для которых известна способность проявлять высокий уровень аргинолитической активности (способность превращать аргинин в аммиак).
Экология налета на основании РТ-ПЦР
ПЦР с обратной транскрипцией измеряет РНК транскрипты в образце. Выделяют РНК, транскрипты превращают в кДНК при помощи обратной транскриптазы и амплифицируют кДНК при помощи ПЦР. Преимущество РТ-ПЦР в том, что способы для определения бактерий ротовой полости, основанные на ДНК, не определяют жизнеспособность этих видов. Так как бактерии ротовой полости наиболее часто обнаруживают в составе сообществ биопленки, ДНК мертвых бактерий может сохраняться внутри архитектуры биопленки на протяжении длительных периодов времени после убийства. Другие способы, такие как анализы жизнеспособности, основанные на флуоресценции (Live Dead kit, Molecular Probes), могут определить, есть или нет у организмов аномальные мембраны, но не могут напрямую определять определенные виды.
Таким образом, ПЦР в реальном времени с обратной транскрипцией является способом подсчета жизнеспособных организмов определенных видов бактерий ротовой полости, присутствующих в сложном сообществе. мРНК имеет относительно короткий период полужизни и, следовательно, является показателем бактерий, активных в настоящий момент. Были получены видоспецифичные праймеры к фактору элонгации tuf. Этот ген не регулируется в значительной степени фазой роста, средой или окружающими условиями, минимизируя, таким образом, ложные эффекты на определяемое количество бактерий. При использовании Aggregatibacter actinomycetemcomitans в качестве тестируемого организма могут быть определены различия в жизнеспособности в смешанных популяциях живых и убитых EtOH бактерий, когда только лишь 20% присутствующих организмов являются жизнеспособными. Кроме того, способ делает возможным надежное определение присутствия A. actinomycetemcomitans в смешанных видовых популяциях, содержащих до шести различных видов бактерий. Подсчитанные концентрации бактерий плотно коррелировали со значениями, установленными на основании OD610, для тех же культур (r=0,96, <1% отличие). Этот анализ представляет собой средство изучения экологии определенных организмов в сложной окружающей среде ротовой полости. Когда будут доступны дополнительные данные генетических последовательностей, можно будет сконструировать праймеры к широкому спектру бактерий ротовой полости.
Уровни бактерий на основании пробы флуоресцентных антител
Набор для диагностики кариеса применяется для определения уровней бактерий кариесогенного типа, например S.mutans, и/или некариесогенного типа, например S.sanguis, в слюне посредством применения моноклональных антител. Конкретные применяемые антитела специфичны для видов бактерий и имеют флуоресцентный краситель, прикрепленный к антителу. Уровни бактерий могут быть определены при помощи измерения количества испускаемой флуоресценции.
ПРИМЕРЫ
Пример 1 - ПЦР в реальном времени для измерения уровней суммарных бактерий в налете
Уровни суммарных бактерий в налете измеряют (ДНК бактериальных микроорганизмов/мл) у пациентов, применяющих различные составы зубной пасты, применяя процедуры, описанные выше:
|
Аргинин-фторсодержащий состав эффективен при сокращении массы суммарного бактериального налета и массы налета S.mutans (кариесогенный), в то время как он повышает массу S.sanguis (аргинолитический).
Пример 2 - Образование аммиака
Образование аммиака измеряют у пациентов, применяющих различные составы зубной пасты, применяя способы, описанные выше:
|
Образование аммиака существенно больше в налете пациентов, применяющих аргининсодержащий состав.
Пример 3 - Уровни молочной кислоты
Уровни молочной кислоты в налете измеряют у пациентов, применяя капиллярный электрофорез, как описано выше, показывая, что лактат существенно повышен в присутствии сахарозы.
|
Пример 4 - ПЦР в реальном времени/RT-PCR
В настоящем изобретении объединены принципы определения видов бактерий при помощи ПЦР в реальном времени и с помощью матричной РНК (мРНК) в качестве индикатора биологической активности у клеток. Вслед за выделением мРНК из бактериального образца применяют ПЦР в реальном времени с обратной транскрипцией для определения и подсчета определенных бактерий в простой или сложной окружающей среде. Изобретение показывает как последовательности праймеров, так и способ определения мРНК и его применение.
Одной из функций ДНК в жизнеспособных клетках является кодирование синтеза белков. ДНК кодирует соответствующую ей цепочку мРНК, которая затем применяется в качестве инструкции для сборки готовых белков. В отличие от ДНК мРНК имеет очень короткое время полужизни (от секунд до минут) и присутствует только в клетках, которые либо жизнеспособны, либо убиты совсем недавно. В то время как ДНК присутствует в клетках в фиксированном количестве копий, уровни мРНК часто меняются в зависимости от условий, в которых существует клетка. Экспрессия различных белков может увеличиваться или уменьшаться в зависимости от изменений температуры, ростовой среды, фаз роста и других условий окружающей среды. Таким образом, если таргетный ген не достаточно тщательно подобран, возможно, что колебания условий окружающей среды будут ложно прочитаны как колебания жизнеспособности популяции. Чтобы избежать этих эффектов, данное изобретение использует фактор элонгации tu, ген tuf, в качестве таргетной последовательности. Эту последовательность использовали ранее в качестве маркера потому, что не наблюдалось или наблюдалось мало изменений в экспрессии tuf при различных экспериментальных условиях.
ПЦР в реальном времени применяет базовую химию в качестве основы для амплификации генетического материала в полимеразной цепной реакции (ПЦР) и соединяет ее с определением флуоресцентных меток в реальном времени в качестве механизма подсчета количества копий полученной генетической последовательности, присутствующего после каждого цикла амплификации. Самый простой из этих способов использует SYBR Green I, флуоресцентную пробу, которая специфично интеркалирует в двухцепочечную ДНК (дцДНК). Таким образом, повышающиеся уровни SYBR Green коррелируют с более высокими концентрациями двухцепочечной ДНК. Когда этот краситель включают в реакцию ПЦР, с использованием затравки из определенных генетических последовательностей, увеличение флуоресценции соответствует увеличению количества копий таргетного гена. Впоследствии количество циклов, при котором сигнал пересекает определенное ранее пороговое значение интенсивности, может быть соотнесено с концентрацией генетической последовательности в исходном материале.
Развитие технологии ПЦР в реальном времени дало возможность быстро и с высокой степенью аккуратности определять и подсчитывать определенные биологические виды. Традиционные способы подсчета видов бактерий основаны на написании праймеров к изменчивым участкам ДНК, кодирующим 16s субъединицу рибосомы. Эта субъединица является критичной для репликации бактерий, и, таким образом, ее последовательность нелегко мутирует. Определение последовательностей 16s рДНК, специфичных для конкретных видов, может облегчить определение и установление количества отдельного вида бактерий в сложной окружающей среде.
Праймеры составляют на основании последовательностей генов tuf из общедоступных баз данных (National Center for Biotechnology Information and the Los Alamos Oral Pathogens Database). Последовательности выравнивают, используя программу DNA Star Lasergene модуль MegAlign. Это выравнивание применяется, чтобы выбрать участок с большей дивергенцией, чтобы максимально увеличить вероятность видоспецифичности. Последовательности праймеров выбирают на основании аналитической информации, доступной в программном обеспечении Roche Diagnostics Light Cycler Probe Design. Праймеры, предусмотренные в данном изобретении, включают не только те, которые уже были сконструированы и протестированы, но все праймеры к этому генетическому участку патогенных организмов ротовой полости.
Суммарную РНК выделяют из образцов при помощи соответствующего набора для выделения РНК или другого способа выделения РНК. Для выделения РНК может применяться любой предпочтительный способ. Очищенную РНК дважды обрабатывают соответствующими ДНКазными агентами. Эта стадия удаляет любые ДНК-загрязнения препарата РНК и предотвращает получение ложноположительных результатов. Выделенная РНК затем подвергается обратной транскрипции, чтобы синтезировать молекулу комплиментарной ДНК (кДНК). Полученную в результате кДНК амплифицируют и определяют при помощи SYBR Green. В качестве контроля качества для полного удаления ДНК реакция ПЦР в реальном времени может проводиться без стадии обратной транскрипции. ПЦР продукт, полученный в отсутствие реакции обратной транскрипции, должен быть результатом ДНК-загрязнения.
Стандартную кривую получают, проводя реакцию ПЦР в реальном времени с обратной транскрипцией на образцах РНК, выделенных из культур, содержащих известные количества жизнеспособных бактерий. Второй производный максимум кривых амплификации РНК, выделенной из неизвестных бактериальных образцов, затем можно сравнить со стандартной кривой, чтобы определять концентрацию жизнеспособных организмов в популяции образца. Эти данные станут ценной информацией для улучшения эффектов антибактериальных средств и активных молекул на экологию среды ротовой полости.
Представленная ниже пара праймеров сконструирована, чтобы амплифицировать участок из 288 пар оснований гена tuf Aggregatibacter (Actinobacillus) actinomycetemcomitans:
|
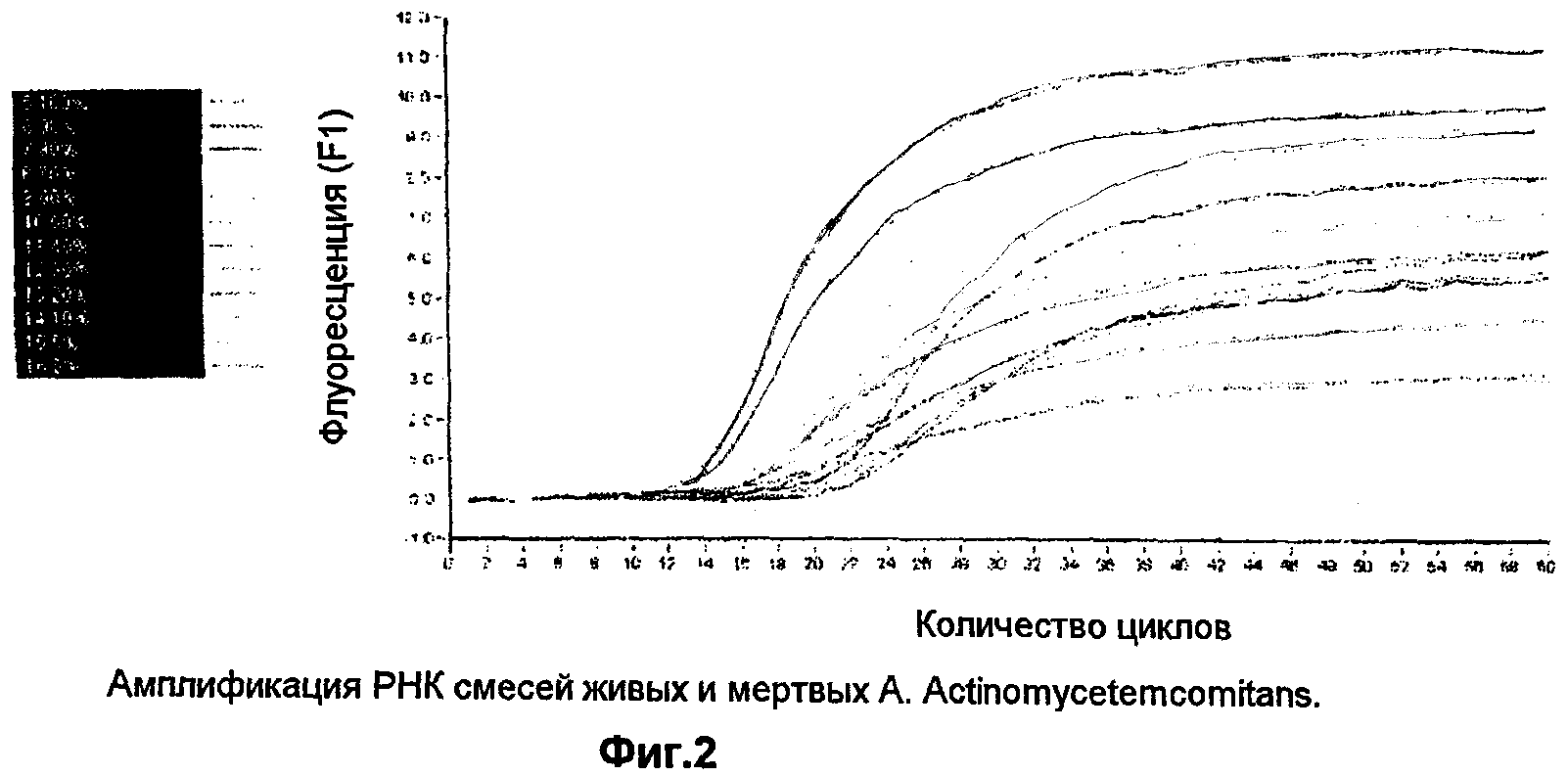
Эти праймеры применяются, чтобы амплифицировать РНК, выделенную как из чистых культур A. actinomycetemcomitans, так и из смешанных популяций, как включающих, так и не включающих A. actinomycetemcomitans. Результаты, в частности отношение между флуоресценцией (F1) и количеством циклов, показаны на графике фиг.1. В фиг.1 «вода» представляет собой отрицательный контроль, а «Аа» представляет собой положительный контроль чистой культуры A.actinomycetemcomitans. «Mix 1» была выделена из популяции, содержащей Prevoltella intermedia, Streptococcus sobrinus, Streptococcus oralis и Actinomyces viscosus, и, таким образом, должна быть отрицательной по амплификации с этими праймерами. «Mix 3» выделена из популяции, содержащей A.actinomycetemcomitans, Porphyromonas gingivalis, Streptococcus gordonii, Streptococcus mutans и Streptococcus sanquinis, и должна быть положительной по амплификации A.actinomycetemcomitans.
Этот график показывает, что в то время как смесь, содержащая A.actinomycetemcomitans, амплифицируется с той же кривой, что и положительный контроль, смесь без них следует той же кривой амплификации, что и водный контроль, это показывает, что эти праймеры способны аккуратно определять A. actinomycetemcomitans из смеси разновидностей РНК.
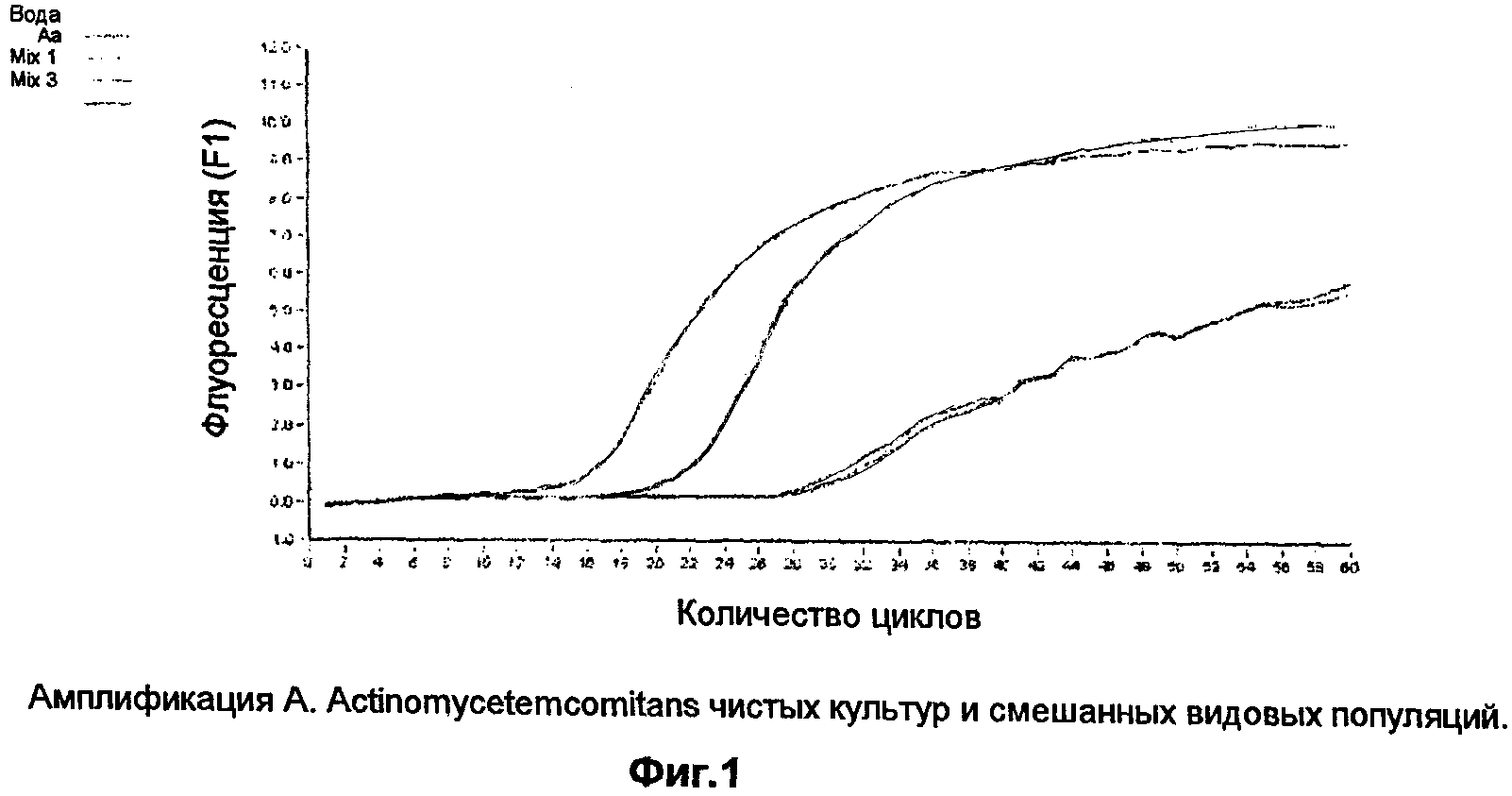
Способность этих праймеров аккуратно определять и количественно определять только жизнеспособные организмы A. actinomycetemcomitans определяется, как указано ниже. Известную концентрацию клеток A.actinomycetemcomitans убивают, суспендируя в 80% этанола в течение 15 минут. Затем бактерии осаждают центрифугированием и ресуспендируют в свежей Brain Heart Infusion broth ростовой среде. Убитые этанолом бактерии инкубируют в течение ночи при 37°С и проверяют на рост, чтобы подтвердить, что не осталось жизнеспособных организмов. Затем убитые этанолом бактерии смешивают, в определенном соотношении, с жизнеспособными организмами и проводят обратную транскрипцию с последующей ПЦР в реальном времени. Амплификация этих образцов показана на фиг.2, которая показывает амплификацию РНК смесей живых и мертвых A.actinomycetemcomitans.
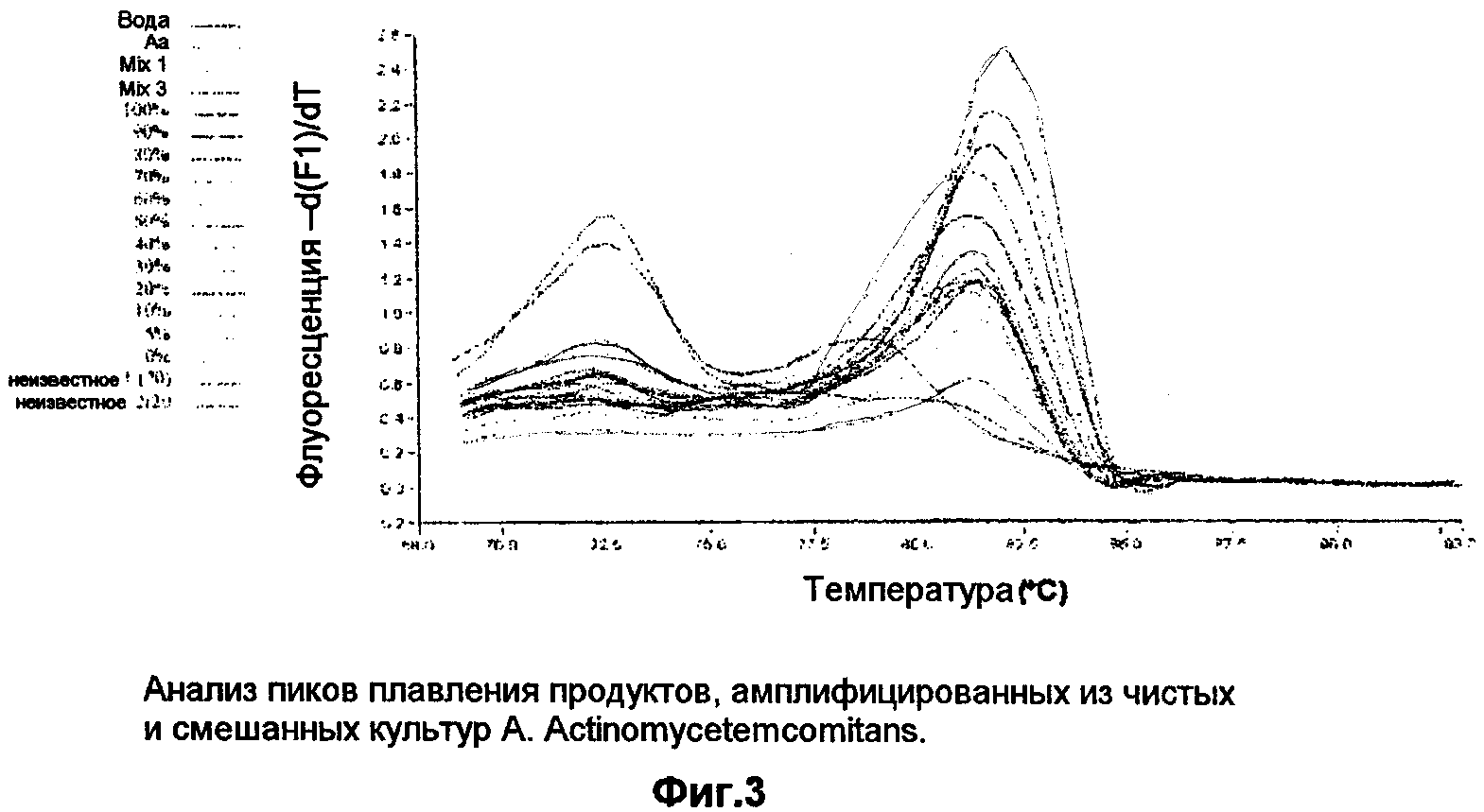
Несмотря на тот факт, что все популяции, использованные в качестве образцов для этой реакции, содержали одинаковое суммарное количество организмов, более ранняя амплификация наблюдается в образцах, содержащих больше жизнеспособных организмов, это показывает, что этот анализ способен определять жизнеспособные организмы как в смеси живых, так и мертвых бактерий. Кроме того, кривая плавления этих образцов, как показано на фиг.3, показывает, что единичный, идентичный продукт амплифицируется во всех образцах, что показывает высокую специфичность этого анализа. Фиг.3 показывает анализ пика плавления продуктов, амплифицированных из чистой и смешанной культур A.actinomycetemcomitans. Перекрывание этих кривых показывает, что из образцов был амплифицирован единичный продукт. Таблица 2 показывает сравнение ожидаемого и подсчитанного количества организмов в выбранных образцах стандартной кривой.
|
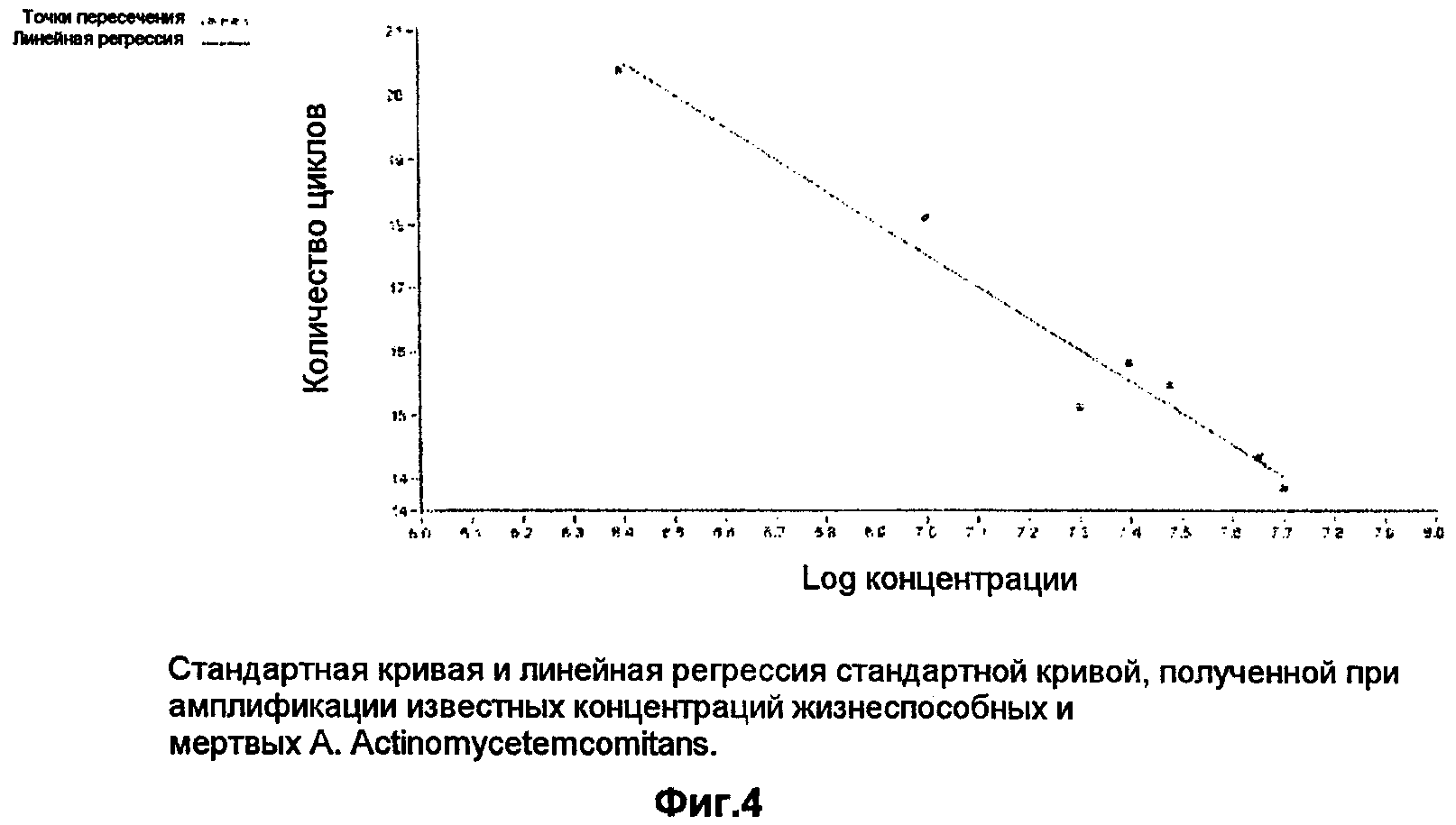
На основании известных концентраций жизнеспособных и убитых начальных культур подсчитывают приблизительное количество жизнеспособных организмов в каждой популяции и применяют в связи со вторым производным максимумом каждой из амплификационных кривых, чтобы получить стандартную кривую. Результаты показаны на фиг.4, которая иллюстрирует стандартную кривую и линейную регрессию стандартной кривой, полученной из амплификации известных концентраций жизнеспособных и мертвых A.actinomycetemcomitans. Значение r2 линии регрессии равно 0,96.
Значение r2 линии линейной регрессии показывает близость значения формулы регрессии к наблюдаемым значениям. r2, близкое к 1,00, показывает, что наблюдаемые значения находятся вблизи линии регрессии. Для указанного выше примера значение r2 стандартной кривой составляет 0,96, это показывает, что приблизительно 96% от общих наблюдаемых колебаний в линии обусловлено действительными измеренными изменениями в образцах и что эта стандартная кривая может использоваться для подсчета концентрации жизнеспособных организмов в неизвестной популяции.
На практике в единичном эксперименте концентрация жизнеспособных организмов, посчитанная на основании этой стандартной кривой, существенно не отличалась от действительной концентрации, добавленной перед выделением РНК, а отличалась на <20%. Эти данные показывают, что этот анализ представляет собой быстрый аккуратный способ определения и подсчета жизнеспособных организмов определенного вида в сложной популяции организмов. Это представляет собой потенциально мощный инструмент для анализа эффектов лечения на экологию микробного сообщества.