Результат интеллектуальной деятельности: СПОСОБ ХАРАКТЕРИЗАЦИИ РЕКОМБИНАНТНОГО ПОЛИКЛОНАЛЬНОГО БЕЛКА
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к способу структурной характеризации популяции различных видов легких цепей в композиции рекомбинантных поликлональных антител. Способ полезен как для количественного, так и для качественного анализа и может использоваться, например, для анализа постоянства от партии к партии, а также для оценки композиционной стабильности во время процесса производства и для определения того, отвечает ли данная партия конкретной определенной заранее спецификации для выпуска продукта.
Уровень техники
WO 2006/007853 раскрывает процедуру характеризации образца, который включает рекомбинантное поликлональное антитело. Способ включает расщепление цепей антитела с высвобождением маркерного пептида, который уникален для каждого конкретного вида белка (так называемый метод 'маркерного пептида').
Необходимым условием для промышленного производства рекомбинантного поликлонального белка, предназначенного для профилактики и терапевтического использования, является сохранение разнообразия белков в процессе культивирования и последующей обработки. Таким образом, важно иметь возможность мониторинга и измерения клонального разнообразия поликлональной клеточной линии, продуцирующей поликлональный белок, а также относительной представленности индивидуальных белков в поликлональном белке в любой желаемый момент времени и в любом соответствующем образце, что позволяет анализировать стабильность экспрессирующей системы за один раунд, а также вариации конечного продукта от партии к партии.
Анализ постоянства от партии к партии в различных партиях лекарственного вещества, получаемого из индивидуальных поликлональных рабочих клеточных банков, необходим для гарантии того, что конкретная партия соответствует определенной заранее спецификации для выпуска продукта. При проведении такого анализа можно воспользоваться методом, который способен определять относительные содержания индивидуальных белков в поликлональной смеси белков.
Осуществление метода маркерного пептида, описанное в WO 2006/007853, обеспечивается методом LC-MS (жидкостная хроматография с масс-спектрометрией) для идентификации и характеризации уникальных гидрофобных пептидов, произошедших из вариабельного участка, генерированных с помощью ферментативного расщепления, что позволяет идентифицировать конкретные виды антител в рекомбинантном поликлональном антителе.
У Adamczyk et al. (Краткие Сообщения в Масс-спектрометрии 14, 49-51 (2000)) описан анализ поликлонального антитела путем очистки поликлонального антитела животного происхождения (т.е. нерекомбинантного) с восстановлением дисульфидных связей между легкой и тяжелой цепями, а также осуществление LC-MS одновременно для тяжелых и легких цепей с получением профиля поликлонального антитела сывороточного происхождения. У Wan et al. в публикации (J. of Chromatography A 913, 437-446 (2001)) описано использование LC-MS для рекомбинантного моноклонального антитела, продуцированного в CHO-клетках, для количественной оценки гликоформ антитела непосредственно из клеточной культуры. Образцы рекомбинантного антитела из клеточной культуры восстанавливают и вводят непосредственно в систему ВЭЖХ, которая присоединена к масс-спектрометру.
Дополнительные данные по уровню техники представлены в WO 2006/007853.
Сущность изобретения
В изобретении предлагается способ характеризации типа легкой цепи в композиции рекомбинантных поликлональных антител, включающий стадии:
a) производства и очистки композиции рекомбинантных поликлональных антител;
b) восстановления цистеиновых мостиков, соединяющих тяжелую и интактную легкую цепи;
с) отделения тяжелых цепей от интактных легких цепей;
d) по меньшей мере, одного хроматографического анализа интактных легких цепей, в котором белки разделяются согласно физико-химическим свойствам;
e) масс-спектрометрии разделенных интактных легких цепей со стадии (d); и
f) анализа данных, полученных на стадии (e), для характеризации вида интактной легкой цепи в композиции рекомбинантных поликлональных антител.
Для того чтобы уменьшить сложность метода и для улучшения данных, полученных с использованием изолированных интактных легких цепей, авторами настоящего изображения обнаружено, что необходимо отделять тяжелые цепи от легких цепей. Авторы настоящего изобретения предполагают, что это, скорее всего, связано с высокой степенью гетерогенности физико-химических свойств тяжелых цепей, которые препятствуют характеризации легких цепей. Кроме того, авторы настоящего изобретения неожиданно обнаружили, что при использовании интактных легких цепей можно получить более точную количественную оценку состава легких цепей антител в рекомбинантном поликлональном антителе. Еще одно преимущество по сравнению с методом маркерного пептида заключается в том, что процедура упрощается посредством меньшего количества стадий, что делает ее более надежной и более удобной в использовании.
Белки с интактными легкими цепями, которые необходимо охарактеризовать, как правило, происходят из известных генетических последовательностей, т.е. последовательности, используемые для создания поликлонального антитела, являются известными. Таким образом, стадия (f), как правило, включает сравнение данных, полученных на стадии (е), с генетическими данными, такими как установленный молекулярный вес каждой интактной легкой цепи, как определяется для генетической последовательности (или с помощью других генетических анализов, описанных в данном документе), или стадия (f) включает сравнение данных, полученных на стадии (е), с данными, полученными при определении молекулярного веса изолированного вида легкой цепи. Молекулярный вес изолированного вида легкой цепи может быть получен путем экспрессии антитела в виде моноклонального антитела с разделением легкой и тяжелой цепей и с определением молекулярного веса легкой цепи с использованием масс-спектрометрии. При сравнении данных, полученных на стадии (е), с данными по определению молекулярного веса будут приниматься во внимание посттрансляционные модификации, оказывающие влияние на молекулярный вес.
Хотя настоящее изобретение относится исключительно к анализу легких цепей, конечный результат может включать определение количества и/или относительного содержания цельных антител в композиции, так как между легкой цепью и тяжелой цепью всегда существует соотношение 1:1. Это позволяет оценить фактическое количество (на основе веса) каждого вида антител, поскольку структура тяжелой цепи, ассоциированной с той или иной легкой цепью, заранее известна из ее кодирующей последовательности. Это также можно сделать путем измерения молекулярного веса каждой изолированной тяжелой цепи с помощью, например, масс-спектрометрии, чтобы принять во внимание посттрансляционные изменения (в частности, гликозилирование).
В изобретении также предлагается способ детектирования вариации между популяциями интактных легких цепей в двух или более композициях рекомбинантных поликлональных антител, включающий осуществление вышеописанного способа характеризации вида легкой цепи в композиции рекомбинантных поликлональных антилел, для каждой из двух или более композиций рекомбинантных поликлональных антител, и определение любой вариации между популяциями интактных легких цепей в двух или более композициях рекомбинантных поликлональных антител.
Краткое описание фигур
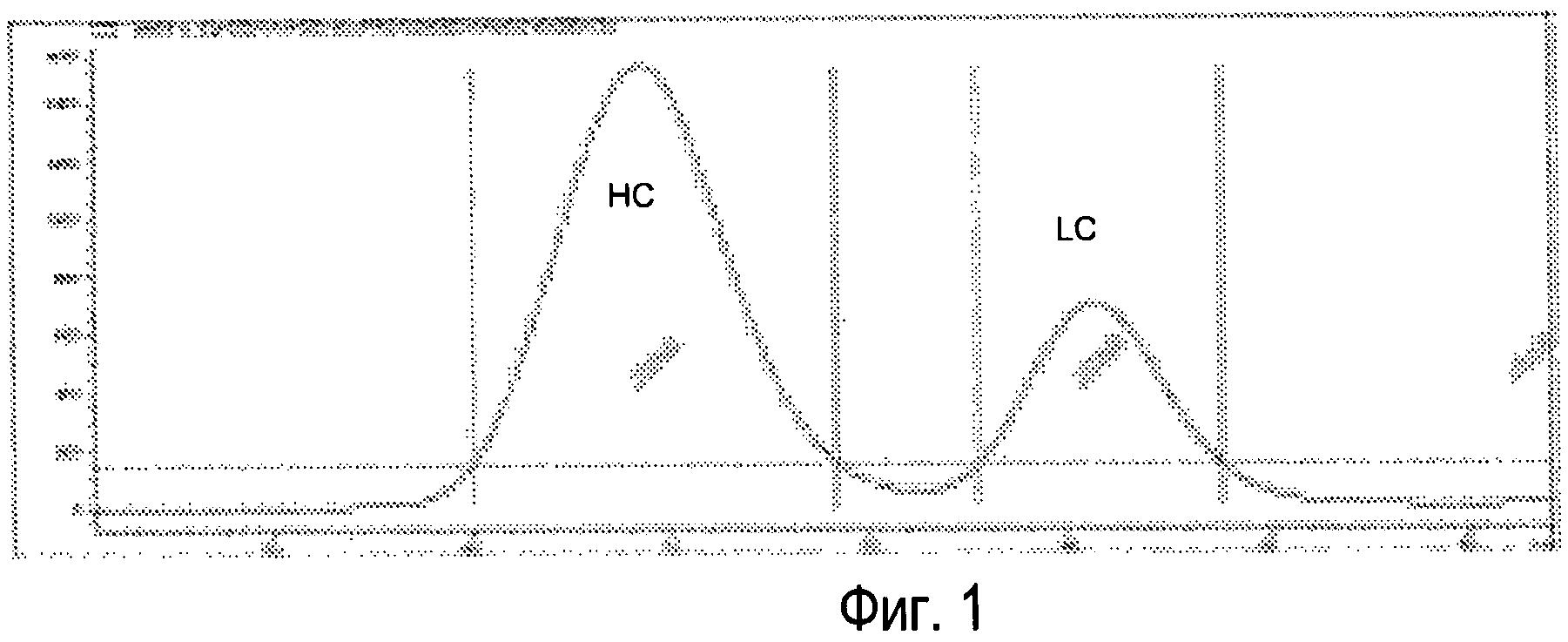
Фиг.1 - Типичная хроматограмма SEC (эксклюзионная хроматография) восстановленного и алкилированного Sym00l. HC=тяжелая цепь, LC=легкая цепь.
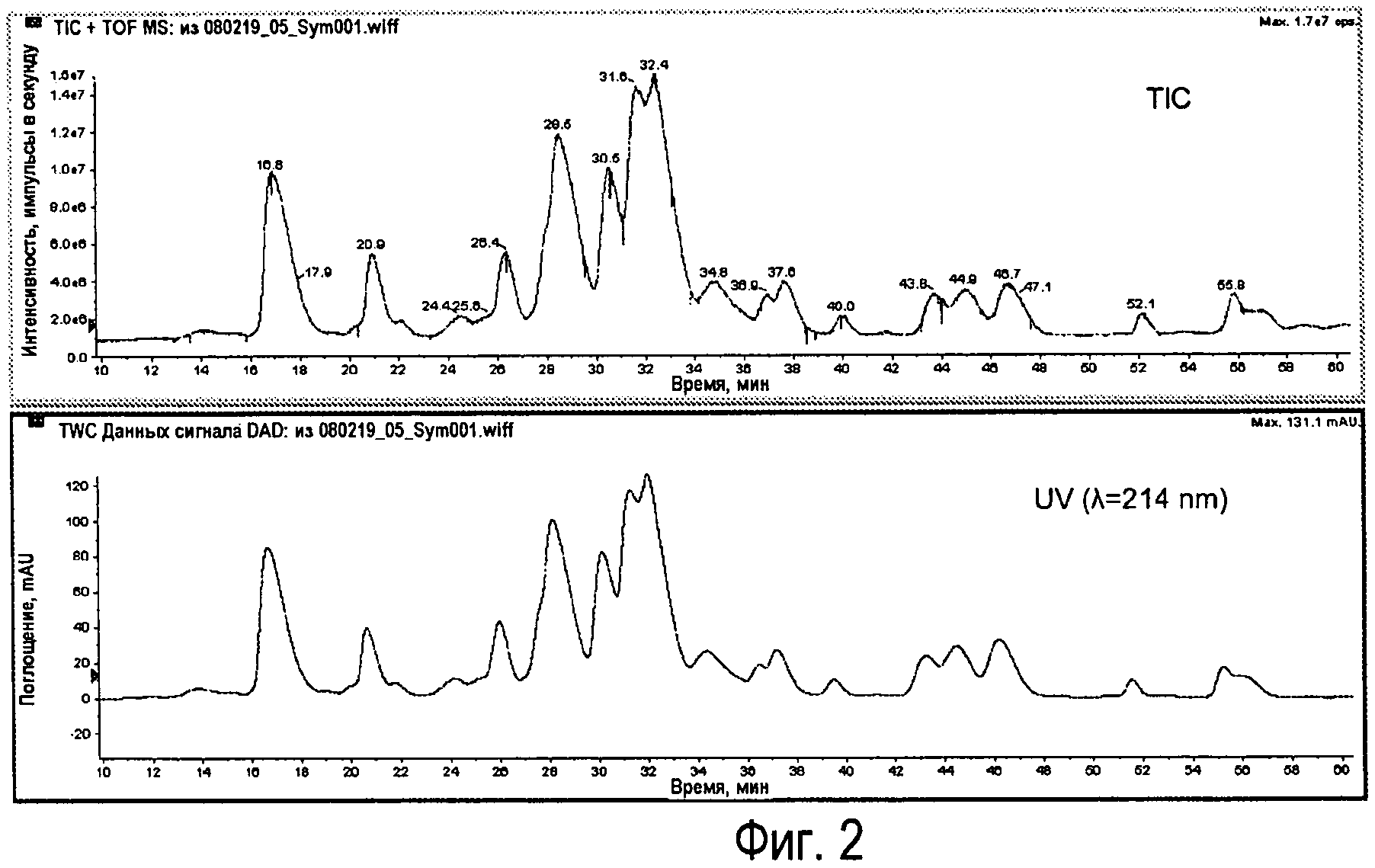
Фиг.2 - Типичные хроматограммы LC-MS легких цепей Sym00l. Вверху показана регистрация суммарного количества ионов (TIC) и внизу показана регистрация УФ при 214 нм.
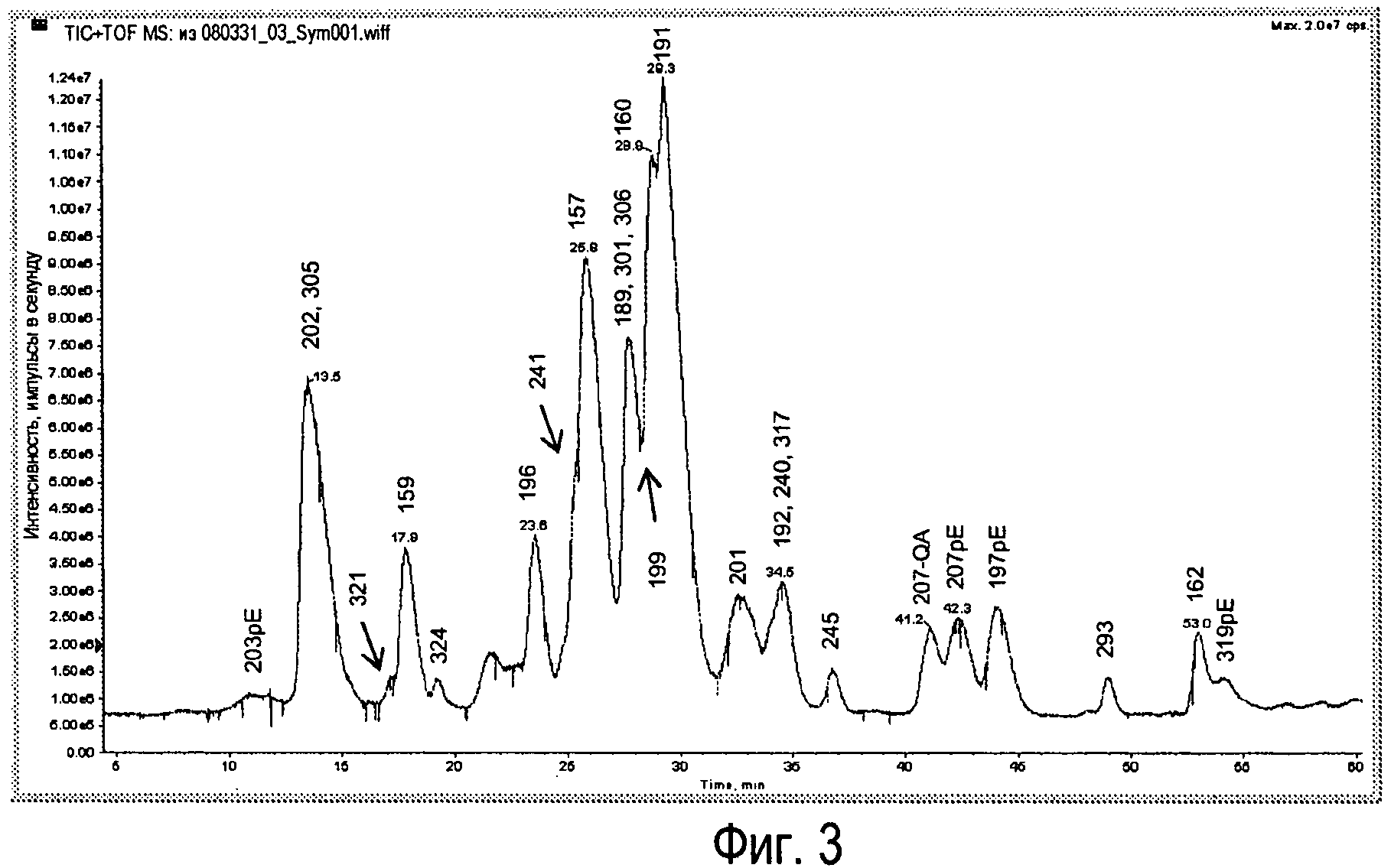
Фиг.3 - Типичная УФ-хроматограмма легких цепей Sym00l с временем удерживания индивидуальных антител.
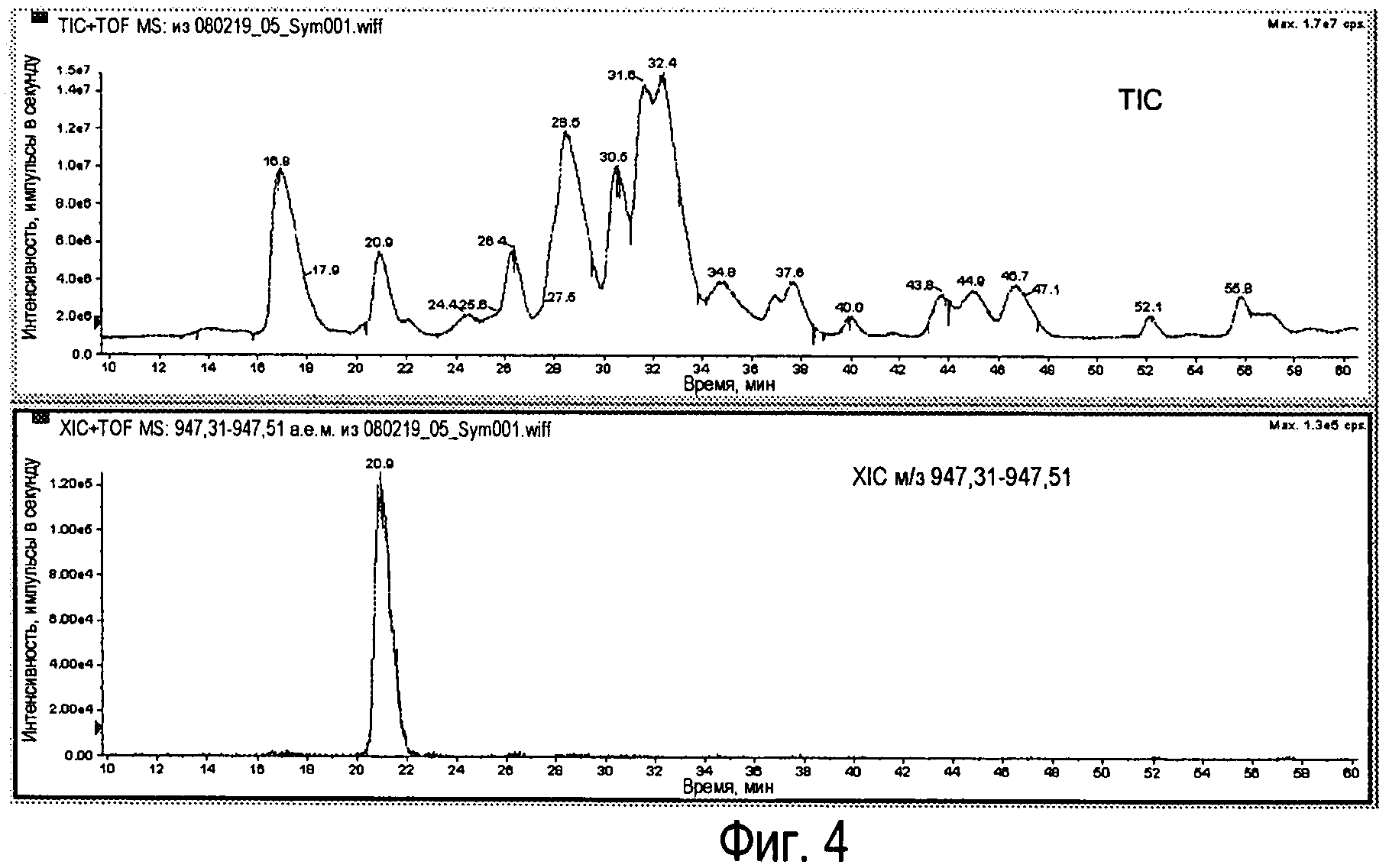
Фиг.4 - TIC легких цепей Sym00l (вверху) с хроматограммой экстрационной ионной хроматографии (XIC) для RhD159 (внизу).
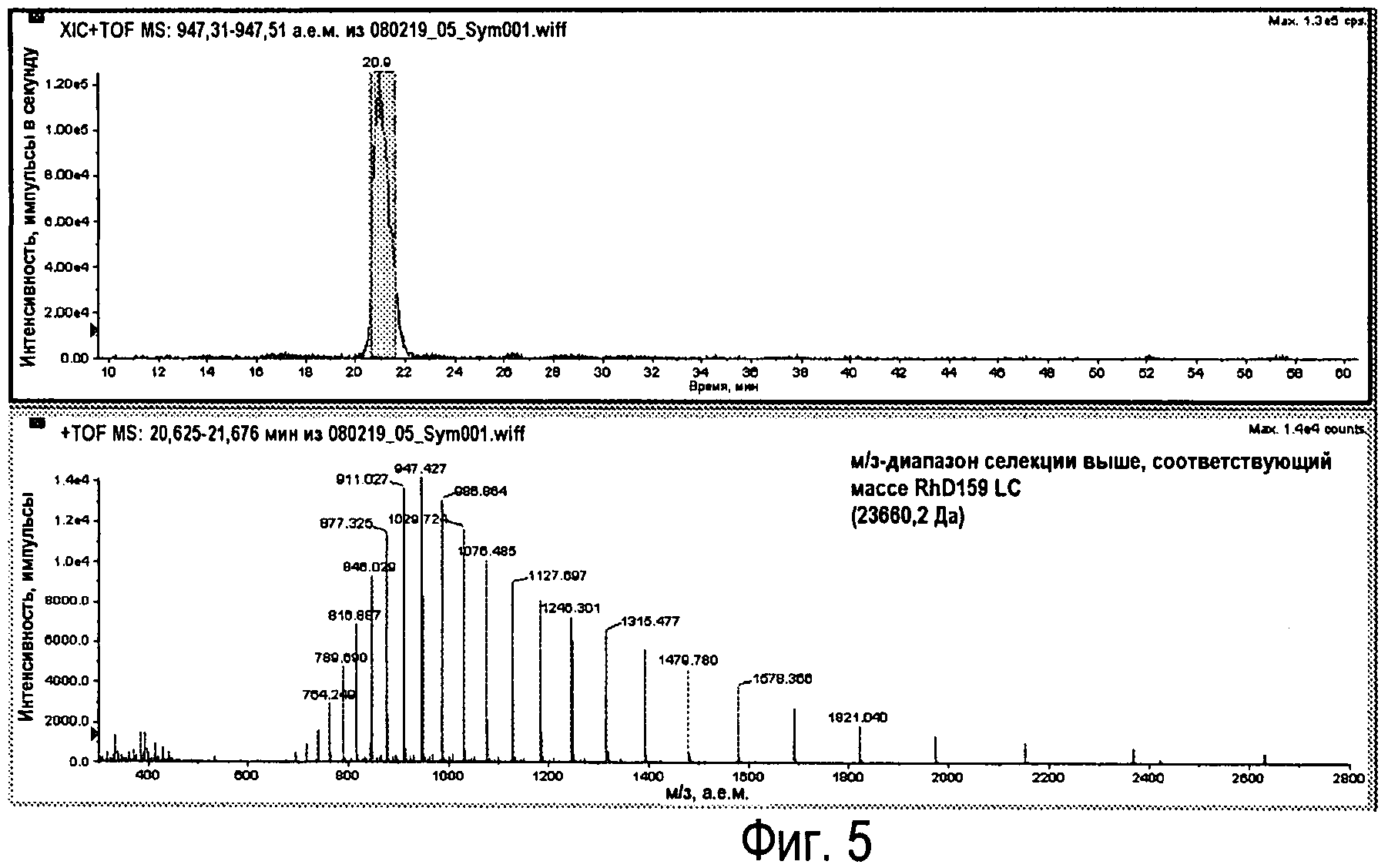
Фиг.5 - XIC для RhD159 (вверху) с соответствующим м/з-диапазоном.
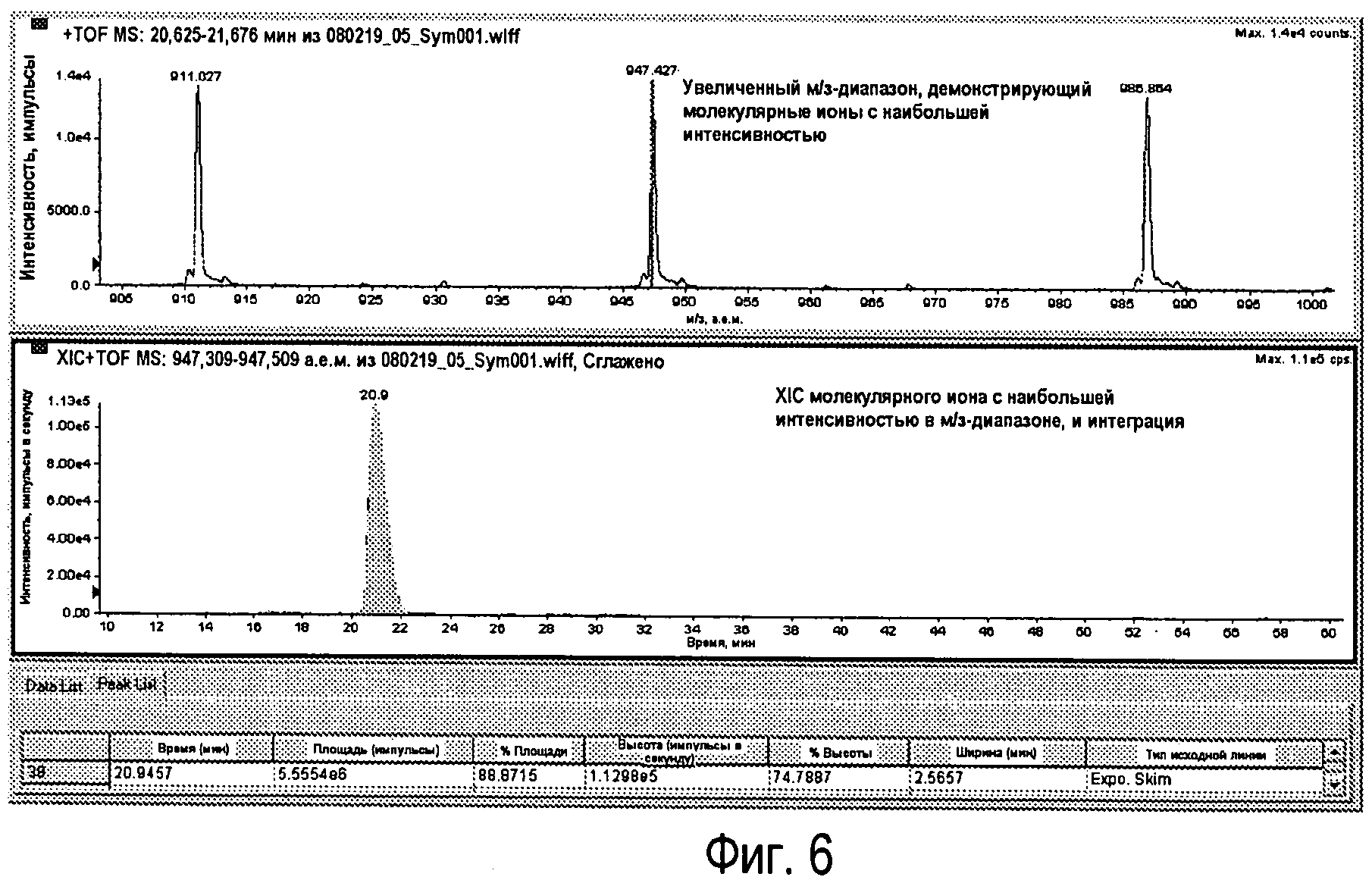
Фиг.6 - Расширение м/з-диапазона, показанное на Фиг.5 (вверху) с соответствующим XIC (внизу).
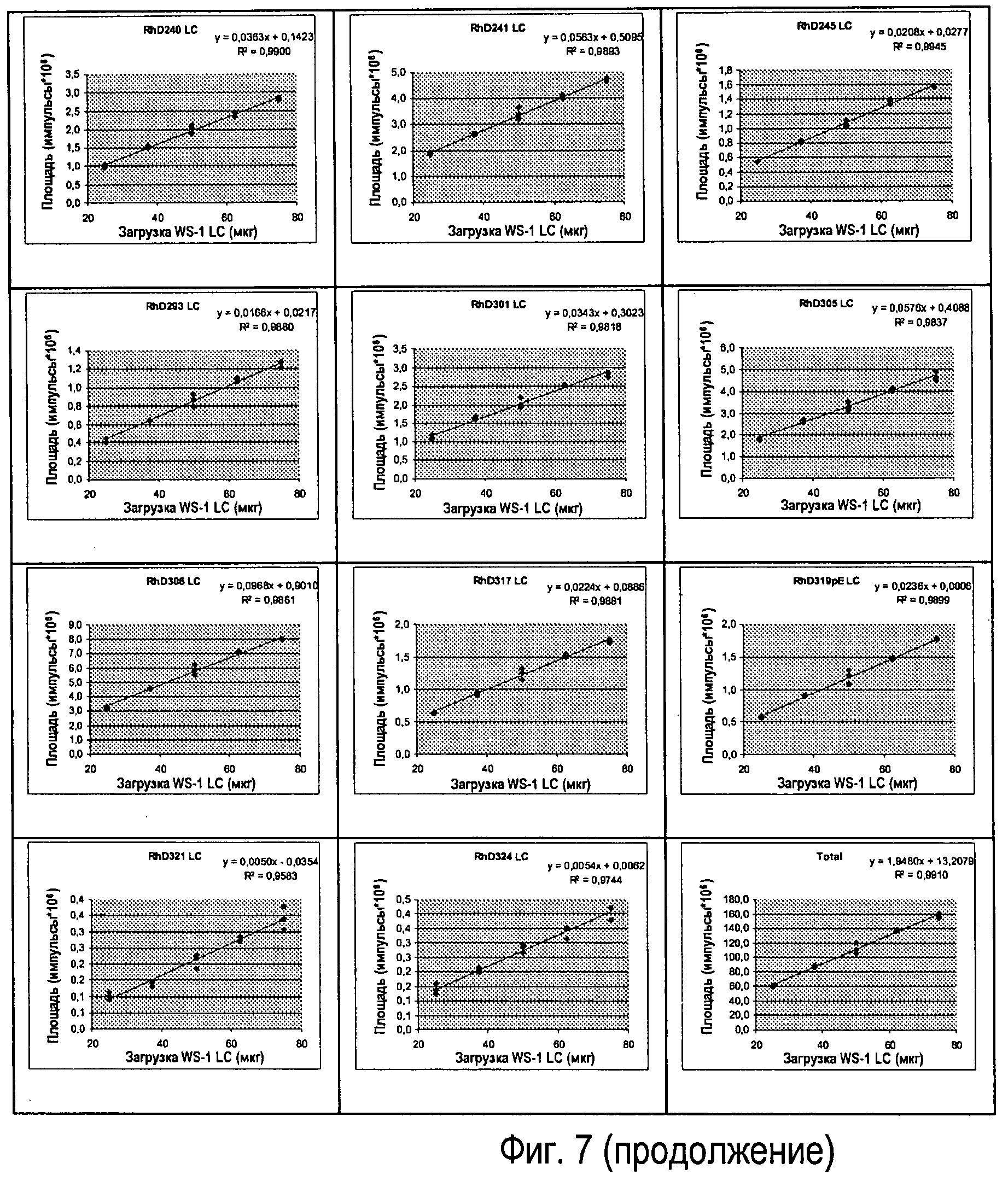
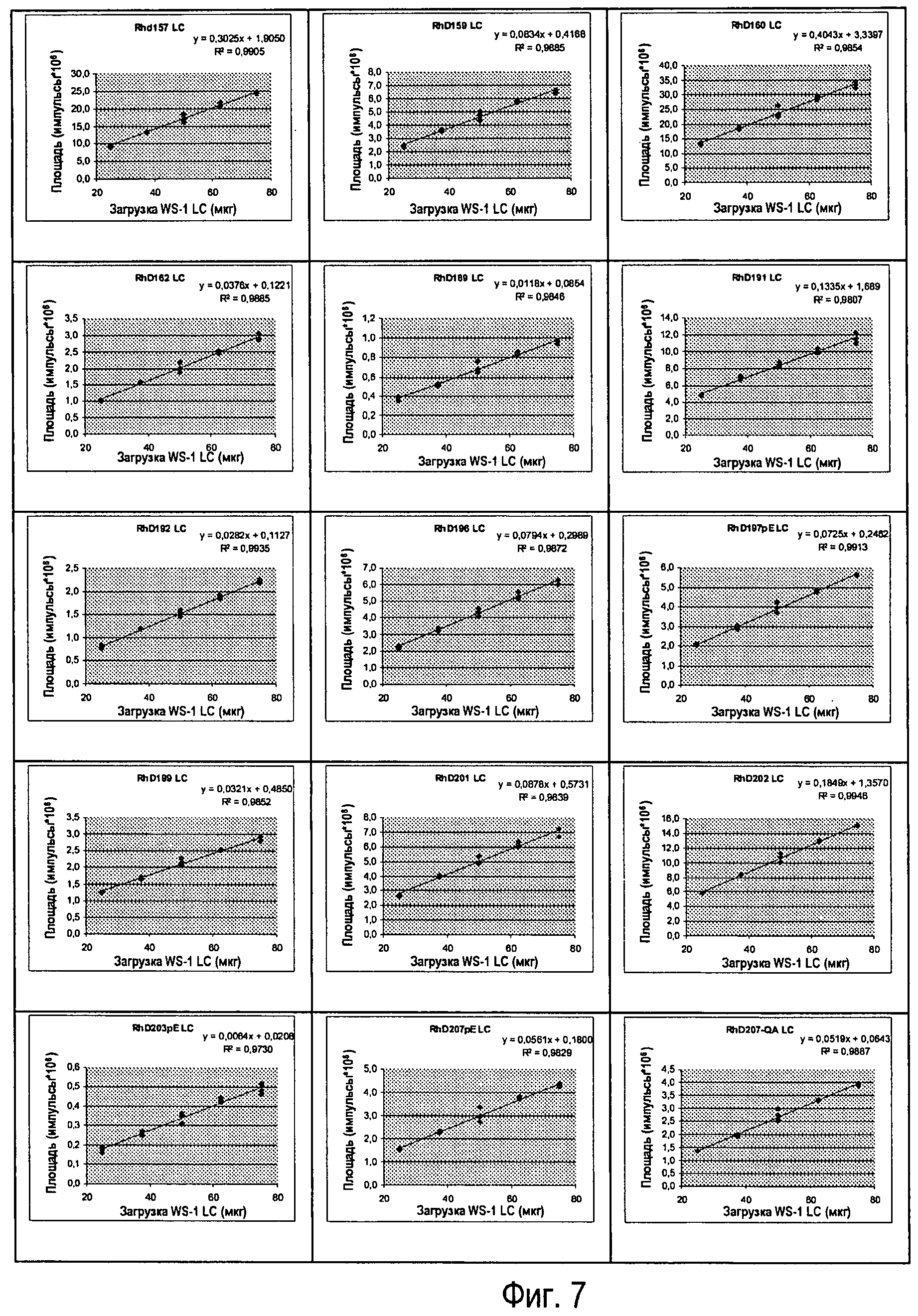
Фиг.7 - Различные вводимые количества Sym00l WS-I LC, линейность клонов (n=3).
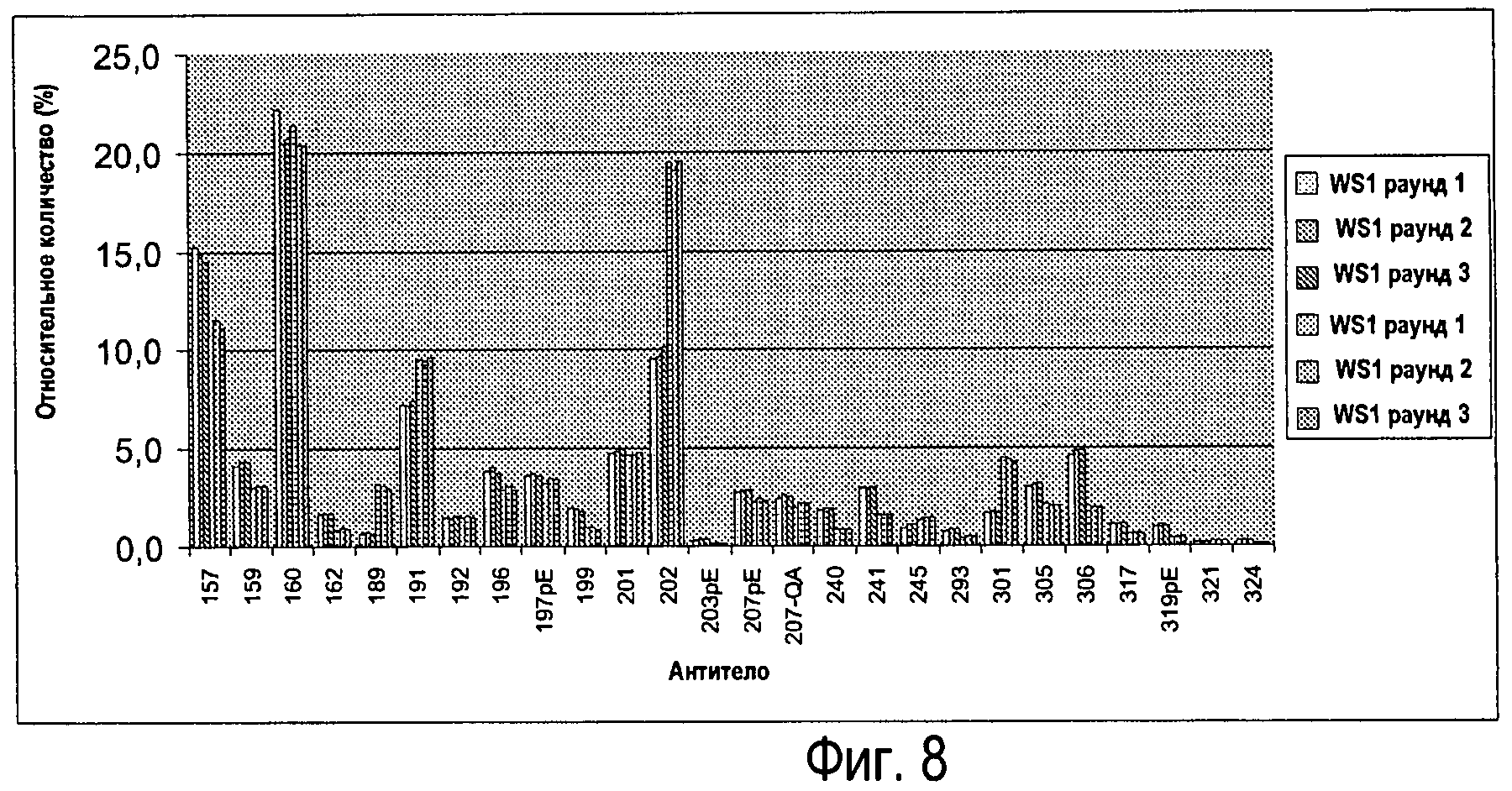
Фиг.8 - Анализ двух различных партий Sym00l (n=3).
Описание изобретения
Определения
Термин "антиидиотипическое антитело" обозначает полноразмерное антитело или его фрагмент (например, Fv, scFv, Fab, Fab' или F(ab)2), которые специфично связываются с изменчивой частью индивидуального компонента поликлонального белка. Предпочтительно, антиидиотипическое антитело по настоящему изобретению специфично связывается с изменчивой частью индивидуального компонента поликлонального антитела или поликлонального TcR. Специфичность антиидиотипического антитела предпочтительно направлена против антиген-специфичной части индивидуального компонента поликлонального антитела или поликлонального T-клеточного рецептора, так называемого V-участка. Оно может также демонстрировать специфичность по отношению к определенной субпопуляции индивидуальных компонентов, например к специфичному семейству генов VH, представленному в смеси.
Термин "антиидиотипический пептид" обозначает специфичный пептид-лиганд, который способен к специфичной ассоциации и, следовательно, идентификации индивидуального белкового компонента в смеси гомологичных белков. Предпочтительно, антиидиотипический пептид по настоящему изобретению специфично связывается с индивидуальным компонентом поликлонального антитела или поликлонального TcR. Антиидиотипические пептиды по настоящему изобретению предпочтительно направлены против антиген-специфичной части последовательности индивидуального антитела или индивидуального Т-клеточного рецептора. Однако антиидиотипический пептид также может демонстрировать специфичность к определенной субпопуляции индивидуальных компонентов.
Термин "клональное разнообразие" или "поликлональность" обозначает вариабельность или разнообразие поликлональных белков, кодирующих их последовательностей нуклеиновых кислот, или продуцирующей их поликлональной клеточной линии. Вариабельность характеризуется различиями в аминокислотных последовательностях индивидуальных компонентов поликлонального белка или различиями в последовательностях нуклеиновых кислот из библиотеки кодирующих последовательностей. Для поликлональных клеточных линий клональное разнообразие может оцениваться по вариабельности последовательностей нуклеиновых кислот, представленных в клеточной линии, например, как точечные интеграции в геноме индивидуальных клеток. Однако оно может также оцениваться как вариабельность аминокислотных последовательностей, представленных на поверхности клеток внутри клеточной линии.
Термин "эпитоп" обозначает часть антигенной молекулы, с которой будет связываться T-клеточный рецептор или антитело. Антиген или антигенная молекула будут, как правило, представлять несколько или даже большое количество эпитопов одновременно.
Термин "антитело" описывает функциональный компонент сыворотки и часто обозначается либо как совокупность молекул (антитела или иммуноглобулины, фрагменты и т.д.), либо как одна молекула (молекула антитела или молекула иммуноглобулина). Молекула антитела способна связываться или реагировать с конкретной антигенной детерминантой (антигена или антигенных эпитопов), которая, в свою очередь, может приводить к индукции эффекторных иммунологических механизмов. Молекула индивидуального антитела обычно рассматривается как моноспецифичная, и композиция молекул антител может быть моноклональной (т.е. состоящей из идентичных молекул антител) или поликлональной (т.е. состоящей из различных молекул антител, реагирующих с одним и тем же или с различными эпитопами на одном и том же антигене или на отдельных, различных антигенах). Отдельные и различные молекулы антител, составляющие поликлональное антитело, могут быть обозначены термином "компоненты". Каждая молекула антитела обладает уникальной структурой, которая позволяет ему специфично связываться с его соответствующим антигеном, и все молекулы природных антител обладают такой же общей базовой структурой из двух идентичных легких цепей и двух идентичных тяжелых цепей.
Термин "иммуноглобулин" часто используется в качестве общего обозначения для смеси антител в крови или сыворотке. Поэтому полученное из сыворотки поликлональное антитело часто обозначается термином иммуноглобулин или гамма-глобулин. Однако "иммуноглобулин" также может использоваться для обозначения смеси антител, полученных из других источников, как например рекомбинантный иммуноглобулин.
Термин "индивидуальный клон", используемый здесь, обозначает изогенную популяцию клеток, экспрессирующих конкретный белок, например моноклональное антитело. Такие индивидуальные клоны могут, например, быть получены путем трансфекции клетки-хозяина целевой нуклеиновой кислотой, и после селекции положительных трансфектантов один клон может быть размножен или ряд индивидуальных клонов может быть объединен и размножен. Поликлональные клеточные линии могут быть генерированы путем смешивания индивидуальных клонов, экспрессирующих различные индивидуальные компоненты поликлонального белка.
Термины "индивидуальный компонент" или "отдельный компонент" обозначают белковую молекулу белковой композиции, включающей различные, но гомологичные белковые молекулы, такие как поликлональный белок, где индивидуальная белковая молекула гомологична другим молекулам композиции, а также содержит один или более участков полипептидной последовательности, характеризующейся различиями в аминокислотной последовательности между индивидуальными компонентами поликлонального белка, также обозначаемых термином вариабельный участок. Например, в поликлональном антителе, состоящем из антител Ab1-Ab50, все белки с последовательностью Ab1 будут рассматриваться как индивидуальный компонент поликлонального антитела, и Ab1 может, например, отличаться от белков Ab2 в последовательности участка CDR3. Субпопуляция индивидуальных компонентов может, например, состоять из антител, принадлежащих к Ab1, Abl2 и Ab33.
Термин "поликлональное антитело" описывает композицию различных молекул антител, которая способна связываться или реагировать с различными конкретными антигенными детерминантами на одном и том же или на различных антигенах. Поликлональное антитело также может рассматриваться как "коктейль моноклональных антител". Вариабельность поликлонального антитела локализована в так называемых вариабельных участках индивидуальных антител, составляющих поликлональное антитело, конкретно, в участках, определяющих комплементарность, CDRl, CDR2 и CDR3. Поликлональные антитела, которые могут быть охарактеризованы с помощью способа по изобретению, могут иметь любое происхождение, например могут быть химерными, гуманизированными или полностью человеческими.
Термины "поликлональная продуцирующая клеточная линия", "поликлональная клеточная линия", "поликлональный главный клеточный банк pMCB)" и "поликлональный рабочий клеточный банк (pWBC)" используются взаимозаменяемо, и обозначают популяцию экспрессирующих белок клеток, которые трансфицированы библиотекой изменчивых последовательностей нуклеиновых кислот, представляющих интерес. Индивидуальные клетки, которые в совокупности входят в состав рекомбинантной поликлональной продуцирующей клеточной линии, могут нести только одну копию представляющей интерес отдельной последовательности нуклеиновой кислоты, кодирующей один компонент представляющего интерес рекомбинантного поликлонального белка, причем каждая копия предпочтительно интегрирована в одно и тоже место генома каждой клетки. Альтернативно, каждая индивидуальная клетка может нести множество копий отдельной последовательности нуклеиновой кислоты, кодирующей компонент рекомбинантного поликлонального белка. Клетки, которые могут входить в состав такой продуцирующей клеточной линии, могут, например, представлять собой бактерии, грибы, эукариотические клетки, такие как дрожжи, клетки насекомых или клетки млекопитающих, особенно иммортализованные клеточные линии млекопитающих, такие как клетки CHO, клетки COS, клетки BHK, клетки миеломы (например, клетки Sp2/0, NSO), NIH 3T3, YB2/0 и иммортализованные человеческие клетки, такие как клетки HeLa, клетки HEK 293 или PER.C6.
В настоящем документе термин "поликлональный белок" обозначает белковую композицию, включающую различные, но гомологичные белковые молекулы, предпочтительно выбранные из суперсемейства иммуноглобулинов. Еще более предпочтительны гомологичные белковые молекулы, которые представляют собой антитела или Т-клеточные рецепторы (TcR), конкретно антитела. Таким образом, каждая белковая молекула гомологична другой молекуле композиции, а также содержит, по меньшей мере, один участок вариабельной полипептидной последовательности, которая характеризуется различиями в аминокислотной последовательности между индивидуальными компонентами, также называемыми отдельными изменчивыми компонентами поликлонального белка. Известные примеры таких поликлональных белков включают антитела, Т-клеточные рецепторы и В-клеточные рецепторы. Поликлональный белок может состоять из определенного набора белковых молекул, которые определяются по общей черте, такой как общая активность связывания по отношению к целевой мишени, например в случае поликлонального антитела против целевого антигена-мишени. Рекомбинантный поликлональный белок, как правило, состоит из такого определенного набора молекул, где последовательность каждого компонента является известной. В отличие от иммуноглобулина, полученного из сыворотки, рекомбинантный поликлональный белок обычно не содержит значительной доли неспецифичных к мишени белков.
Термин "белок" обозначает любую цепь аминокислот независимо от длины и посттрансляционной модификации. Белки могут существовать в виде мономеров или мультимеров, включающих две или более собранных полипептидных цепей, фрагментов белков, полипептидов, олигопептидов или пептидов.
Термин "уникальные маркерные пептиды" описывает ряд пептидов с происхождением из вариабельного участка индивидуальных компонентов поликлонального белка. Пептиды предпочтительно генерируют обработкой протеаз или другими способами фрагментации белков, и пептиды, которые могут быть однозначно обозначены как единственный индивидуальный компонент поликлонального белка, обозначаются термином уникальные маркерные пептиды.
Термин "рекомбинантное поликлональное антитело" обозначает коллекцию антител, полученных с использованием рекомбинантной технологии. В контексте настоящего изобретения антитело считается рекомбинантным, если его кодирующая последовательность является известной, т.е., также, если оно экспрессируется гибридомой или иммортализованной В-клеткой. Будет понятно, однако, что настоящее изобретение конкретно относится к характеризации композиций рекомбинантных поликлональных антител, где антитела экспрессируются с использованием клеточных линий, которые обычно используются для коммерческого производства рекомбинантных антител, например, с использованием одной из человеческих клеточных линий или других клеточных линий млекопитающих, упомянутых выше. В контексте настоящего изобретения термин "рекомбинантный поликлональный белок" включает "рекомбинантное поликлональное антитело".
Рекомбинантное поликлональное антитело согласно изобретению предпочтительно включает популяцию, по меньшей мере, из двух различных антител, где, по меньшей мере, легкие цепи отличаются.
Все иммуноглобулины, независимо от их специфичности, имеют общую структуру, содержащую четыре полипептидные цепи: две идентичные тяжелые цепи, каждая из которых потенциально несет ковалентно присоединенные олигосахаридные группы в зависимости от условий экспрессии; а также две идентичные не гликозилированные легкие цепи. Дисульфидная связь соединяет вместе тяжелую цепь и легкую цепь. Тяжелые цепи также соединены друг с другом с помощью дисульфидных связей. Все четыре полипептидные цепи содержат константные и вариабельные участки, расположенные в карбокси-концевой области и амино-концевой области, соответственно.
Иммуноглобулины делятся на пять основных классов в зависимости от компонентов их тяжелой цепи: IgG, IgA, IgM, IgD и IgE. Существует два типа легких цепей, K (каппа) и λ (лямбда). Индивидуальные молекулы могут содержать каппа или лямбда цепи, но никогда обе одновременно. IgG и IgA дополнительно делятся на подклассы, которые получаются в результате незначительных различий в аминокислотной последовательности в пределах каждого класса. У людей обнаружено четыре подкласса IgG, IgGl, IgG2, IgG3 и IgG4. У мышей также обнаружено четыре подкласса IgG: IgGl, IgG2a, IgG2b и IgG3. У людей существует три подкласса IgA, IgAl, IgA2 и IgA3.
Термин "интактная легкая цепь" обозначает рекомбинантно полученный полипептид, который состоит из обоих участков полипептида легкой цепи, вариабельного и константного. Интактная легкая цепь представляет собой продукт экспрессии кодирующего легкую цепь плинуклеотида, принимая во внимание посттрансляционные модификации, которые могут происходить во время продуцирования внутри экспрессирующего хозяина, а также во время последующей очистки и/или обработки.
Подробное описание изобретения
Целью настоящего изобретения является предложение платформы для структурной характеризации для получения информации относительно присутствия или отсутствия относительного содержания индивидуальных антител в образцах, включающих рекомбинантное поликлональное антитело. Платформа характеризации может использоваться для оценки различных аспектов в процессе продуцирования, или очистки рекомбинантного поликлонального антитела, или в процессе долгосрочного хранения композиции рекомбинатного поликлонального антитела.
Предпочтительно, платформа характеризации по настоящему изобретению используется для одной из следующих целей i) для определения относительной представленности индивидуальных компонентов или некоторых из индивидуальных компонентов по отношению друг к другу внутри одного образца, ii) для оценки относительного содержания одного или более из индивидуальных компонентов в различных образцах для определения постоянства от партии к партии и iii) для оценки фактического содержания одного или более из индивидуальных компонентов. Необязательно, это может осуществляться путем сравнения с транслированными последовательностями в экспрессирующих векторах, исходно использованных для генерирования поликлональной продуцирующей клеточной линии. Платформа характеризации может использоваться для мониторинга клонального разнообразия поликлональной клеточной линии и/или представленности индивидуальных антител в рекомбинантном поликлональном антителе, продуцированном клеточной линией. Платформа характеризации особенно подходит для характеризации композиционной стабильности во время индивидуальных раундов продуцирования и для мониторинга постоянства от партии к партии.
Один вариант осуществления настоящего изобретения представляет собой способ характеризации одного или несколько образцов, каждый из которых включает одно или несколько из рекомбинатных поликлональных антител, где поликлональные антитела включают множество антител, которые отличаются по их вариабельным участкам, так что полученная информация касается относительного содержания или присутствия индивидуальных антител рекомбинантного поликлонального антитела, причем указанный способ включает отделение аликвот изолированных легких цепей из указанных образцов с помощью, по меньшей мере, одного хроматографического метода, и впоследствии изолированные легкие цепи подвергают масс-спектрометрии и, необязательно, проводят один или более из генетических анализов последовательностей, кодирующих белок. Легкие цепи могут представлять собой или лямбда-изотип, или каппа-изотип, или смесь обоих изотипов в случае человеческих антител, или могут представлять собой другие изотипы в случае антител с происхождением из любого источника, кроме человека.
Важная особенность настоящего изобретения заключается в том, что последовательности, кодирующие каждую родственную пару тяжелой и легкой цепей, входящих в состав компонентов поликлонального антитела, являются известными. Информация, полученная из аналитических способов по настоящему изобретению, относится исключительно к легким цепям. Путем определения количества различных легких цепей в поликлональном антителе количество цельных антител также может быть рассчитано, как рассчитанный молекулярный вес каждой тяжелой цепи известен из ее кодирующей последовательности или определен экспериментально с использованием, например, масс-спектрометрии.
В одном предпочтительном варианте осуществления изобретения интактные легкие цепи включают полную аминокислотную последовательность легкой цепи, т.е. полипептида легкой цепи, полученного с помощью продуцирующей клеточной линии, включая посттрансляционный процессинг, который происходит во время экспрессии и секреции интактных легких цепей. В одном варианте осуществления изобретения интактные легкие цепи содержат N-концевой аминокислотный остаток, отличный от глутамина, поскольку можно предположить, что N-концевой остаток может быть подвергнут процессингу перед характеризацией. С-концевой остаток также может быть подвергнут процессингу.
В одном варианте осуществления изобретения хроматографический способ основан, по меньшей мере, на одном физико-химическом свойстве, отличном от размера.
В одном варианте осуществления изобретения индивидуальный хроматографический способ основан, по меньшей мере, на одном физико-химическом свойстве, выбранном из группы, состоящей из суммарного заряда, гидрофобности, изоэлектрической точки и аффинности.
В одном варианте осуществления изобретения индивидуальный хроматографический способ основан на суммарном заряде.
В одном варианте осуществления изобретения хроматографический способ осуществляют в виде многомерной хроматографии.
В одном варианте осуществления изобретения хроматографический способ представляет собой или включает жидкостную хроматографию высокого разрешения.
В одном варианте осуществления изобретения композиция поликлональных антител представляет собой фракцию клеточной культуры, такую, которая включает клетки указанной культуры. Фракция клеточной культуры обычно представляет собой образец клеточной культуры, включающий клетки, представляющие каждую из клеточных линий в клеточной культур, так чтобы образец был репрезентативным для большей части клеточной культуры.
В одном варианте осуществления изобретения стадия (а) включает получение композиции поликлональных антител из одного или несколько супернатантов клеточных культур.
В одном варианте осуществления изобретения характеризация видов антител в композиции рекомбинантных поликлональных антител включает определение присутствия или отсутствия видов легких цепей в композиции рекомбинантных поликлональных антител.
В одном варианте осуществления изобретения характеризация видов антител в композиции рекомбинантных поликлональных антител включает определение относительного содержания видов легких цепей в композиции рекомбинантных поликлональных антител.
В одном варианте осуществления изобретения определение относительного содержания видов интактных легких цепей в композиции рекомбинантных поликлональных антител включает анализ одного или нескольких из сигнальных белков, присутствующих в указанной композиции.
В одном варианте осуществления изобретения стадия (f) включает сравнение данных, полученных на стадии (е), с данными, полученными, по меньшей мере, одним дополнительным аналитическим методом, выбранным из группы, состоящей из дополнительного метода характеризации белка и генетического метода.
В одном варианте осуществления изобретения, по меньшей мере, один дополнительный аналитический метод представляет собой генетический анализ полинуклеотидов, кодирующих легкие цепи, или полинуклеотидов, полученных или выделенных из производящей клеточной линии.
В одном варианте осуществления изобретения генетический анализ выбран из RFLP, T-RFLP, анализа микрочипов, количественного анализа ПЦР и секвенирования нуклеиновых кислот.
В одном варианте осуществления изобретения метод дополнительной характеризации представляет собой метод белковой характеризации, выбранный из N-концевого секвенирования и характеризации комплексных смесей гомологичных белков со специфическими детекторными молекулами, такими как антиидиотипические антитела или антиидиотипические пептиды.
В одном варианте осуществления изобретения, по меньшей мере, один дополнительный анализ осуществляют до, во время или после стадий а)-е).
В изобретении также предлагается способ детектирования дисперсии между популяциями интактных легких цепей в двух или более композициях рекомбинантных поликлональных антител, включающий осуществление способа характеризации вида легкой цепи, как описано в настоящем документе, для каждой из двух или более композиций рекомбинантных поликлональных антител, и определение любой вариации между популяциями интактных легких цепей в двух или более композициях рекомбинантных поликлональных антител.
В одном варианте осуществления изобретения две или более композиции рекомбинантных поликлональных антител получают из одной поликлональной клеточной культуры в различные моменты времени во время культивирования.
В одном варианте осуществления изобретения две или более композиции рекомбинантных поликлональных антител получают из различных поликлональных клеточных культур в конкретный момент времени.
В одном варианте осуществления изобретения вариацию детектируют путем сравнения относительного содержания, по меньшей мере, трех, по меньшей мере, 5 или, по меньшей мере, 10 легких цепей, присутствующих в двух или более композициях рекомбинантных поликлональных антител.
В одном варианте осуществления изобретения вариацию детектируют путем сравнения относительного содержания, по меньшей мере, двух легких цепей, присутствующих в двух или более композициях рекомбинантных поликлональных антител. Как правило, сравнение осуществляют с интактными легкими цепями в количестве 50 или менее, присутствующими в двух или более композициях рекомбинантных поликлональных антител, например, с таким количеством интактных легких цепей, как 2-40, 2-30, 2-25, 2-20, 2-15, 2-10 или 2-5. Рекомбинантные поликлональные антитела могут быть подвергнуты необязательной дополнительной характеризации, такой как генетический и/или белковый анализ. Генетические анализы обозначают методы, такие как вывод аминокислотной последовательности, и/или теоретически определенной массы из генетических последовательностей, кодирующих интактные легкие или тяжелые цепи, анализ полиморфизма длины фрагментов рестрикции (RFLP), концевой-RFLP (T-RFLP), анализ микрочипов, количественный анализ ПЦР, такой как ПЦР в режиме реального времени, и секвенирование нуклеиновых кислот. Методы белковой характеризации обозначают методы, как правило, используемые в области протеомики для характеризации неизвестных белков, например хроматографические анализы, которые разделяют белки сообразно физико-химическим свойствам.
Дополнительно к масс-спектрометрии может использоваться один или несколько из следующих методов белковой характеризации - или, при необходимости, на том же образце, или целесообразнее на параллельных образцах: анализ протеолитического расщепления гомологичных белков, "суммарное" N-концевое секвенирование, а также анализ с использованием специфических детекторных молекул гомологичных белков.
Генетические анализы клонального разнообразия поликлональной продуцирующей клеточной линии
В некоторых вариантах осуществления настоящего изобретения дополнительно к способам характеризации по настоящему изобретению в экспрессирующей системе для продуцирования поликлонального белка осуществляют мониторинг поликлональности с помощью оценки количества клеток, кодирующих конкретный компонент поликлонального белка.
Дополнительно к способам белковой характеризации также может осуществляться один или несколько из генетических анализов, описанных здесь, включающих определение уровня мРНК, кодирующей индивидуальные компоненты поликлонального белка. С помощью генетического анализа может осуществляться мониторинг на уровне мРНК или на уровне генома, например, с помощью RFLP или T-RFLP анализа, анализа олигонуклеотидных микрочипов, количественного анализа ПЦР, такого как ПЦР в режиме реального времени, и секвенирования нуклеиновых кислот - вариабельных участков генных последовательностей, полученных из (или использованных для создания) продуцирующей клеточной линии. Альтернативно, такие же методы могут использоваться для дальнейшей качественной демонстрации (генетического) разнообразия поликлональной клеточной линии. Может проводиться мониторинг последовательностей нуклеиновых кислот, кодирующих поликлональный белок, на образцах, полученных из одной поликлональной клеточной культуры в различные моменты времени во время культивирования, осуществляя таким образом мониторинг относительного содержания индивидуальных кодирующих последовательностей в процессе раунда продуцирования для оценки их композиционной стабильности. Альтернативно, может осуществляться мониторинг последовательностей нуклеиновых кислот, кодирующих поликлональный белок, на образцах, полученных из различных поликлональных клеточных культур в конкретный момент времени, осуществляя таким образом мониторинг относительного содержания индивидуальных кодирующих последовательностей в различных партиях для оценки вариации от партии к партии. Предпочтительно, образец, используемый в генетических анализах, представляет собой фракцию, обогащенную клетками культуры, например, путем преципитации или центрифугирования. В одном варианте осуществления изобретения генетический анализ может осуществляться на продуцирующей клеточной линии(ях), которая продуцирует рекомбинантное поликлональное антитело, тогда как хроматографический анализ и масс-спектрометрический анализ осуществляют на образце поликлонального антитела, полученном из клеточной линии. Образец для генетического анализа, как правило, получают путем сбора фракции клеточной культуры в нужный момент времени с последующим удалением среды, например, с помощью центрифугирования. Образцы для сравнения постоянства от партии к партии предпочтительно получают из клеток, которые находятся на пределе in vitro возраста клеток для продуцирования.
В одном варианте осуществления изобретения генетический анализ может быть осуществлен ранее, такой как секвенирование генов, которые кодируют индивидуальные легкие цепи и которые используются для создания продуцирующей клеточной линии(й). Кроме того, предполагается, что такой генетический анализ может осуществляться одновременно или после стадий белковой характеризации, таких как хроматографический и масс-спектрометрический анализы.
Подробности осуществления указанного здесь метода генетического анализа понятны специалисту в данной области, и дополнительное руководство того, как осуществить RFLP/T-RFLP, анализ олигонуклеотидных микрочипов, количественный анализ ПЦР и секвенирование нуклеиновых кислот в контексте изобретения представлено в WO 2006/007853.
Разделение тяжелых и легких цепей
Одна особенность настоящего изобретения представляет собой разделение тяжелых и легких цепей в стадии, предшествующей масс-спектрометрии. Это разделение служит нескольким целям. Во-первых и прежде всего, оно уменьшает количество различных белковых субъединиц в образце. Во-вторых, известно, что тяжелые цепи антител, если продуцируются в экспрессирующих системах млекопитающих, варьируются по их степени гликозилирования, так что вероятно, что каждая тяжелая цепь порождает несколько пиков на хроматограмме масс-спектрометра. Таким образом, исключение тяжелых цепей из стадии масс-спектрометрии обеспечивает лучшую и более точную характеризацию антител.
Разделение тяжелых и легких цепей может проводиться с использованием разделения по размеру, такого как гель-фильтрация, которая является достаточно точной для количественного разделения двух групп цепей (смотри Фиг.1). Другие методы разделения также могут быть использованы, такие как стадия аффинной хроматографии, где тяжелые цепи сохраняются, в то время как легкие цепи элюируются.
Масс-спектрометрия
Анализ масс-спектрометрии (MS) представляет собой важный инструмент для структурной характеризации белков. Масс-спектрометрические измерения проводят в газовой фазе на ионизированных анализируемых образцах. По определению, масс-спектрометр состоит из источника ионов, масс-анализатора, который измеряет соотношение массы к заряду (м/з) ионизованных анализируемых образцов, а также детектора, который регистрирует количество ионов при каждом значении м/з. Электрораспылительная ионизация (ESI) и лазерная десорбция-ионизация в присутствии матрицы (MALDI) представляют собой два наиболее широко используемых метода для испарения и ионизации белков и пептидов для MS-анализа. ESI ионизирует анализируемые образцы из раствора и, таким образом, легко комбинируется с инструментами разделения на основе жидкости (например, хроматографическими и электрофоретическими). MALDI сублимирует и ионизирует образец из сухого, кристаллического матрикса с помощью лазерных импульсов. MALDI-MS, как правило, используется для анализа относительно простых пептидных смесей, тогда как интегрированные жидкие хроматографические системы ESI-MS (LC-MS) предпочтительны для анализа сложных образцов. Масс-анализатор имеет центральное значение для технологии, и его ключевые параметры представляют собой чувствительность, разрешение, точность массы и возможность генерирования информации - богатых ионами масс-спектров из пептидных фрагментов (MS/MS-спектры). Существует четыре основных типа масс-анализаторов, используемых в настоящее время в протеомном исследовании. Эти анализатор с ионной ловушкой, времяпролетный (TOF), квадрупольный и фурье-преобразующий ионный циклотронный (FT-MS) анализатор. Они существенно различаются по конструкции и производительности, каждый со своей сильной и слабой стороной. Эти анализаторы могут располагаться отдельно или в некоторых случаях могут быть расположены вместе, чтобы можно было воспользоваться преимуществами каждого из них (подробности см. у Aebersold & Mann, Nature 2003, 422: 198-207).
В обоих MALDI и ESI-MS связь между количеством присутствующих анализируемых образцов и измеряемой интенсивности сигнала является сложной и не полностью понятной. Масс-спектрометры, таким образом, по существу, представляют собой устройства с неудовлетворительным количественным определением. Для получения количественных MS-данных в протеомной области были разработаны методы мечения белков стабильными изотопами. Эти методы используют тот факт, что пары химически идентичных пептидов с различным составом стабильных изотопов могут быть дифференцированы в масс-спектрометре благодаря их различию по массе, а также благодаря тому, что соотношение интенсивностей сигналов для таких пар пептидов точно указывает на относительное содержание двух пептидов. Таким образом, может быть определено относительное содержание их соответствующих белков в исходных образцах. Метки стабильного изотопа могут вводиться в белки посредством i) метаболического мечения, ii) ферментативно или iii) химических реакций. В настоящее время химическое мечение белков или пептидов изотопами представляет собой наиболее используемый метод (подробности см. у Aebersold & Mann, Nature 2003, 422: 198-207). Наращивание усилий в последнее время было направлено на разработку способа без использования метки, который опирается на прямое сравнение площадей пиков пептидов между раундами LC-MS. Варьируя количество одного белка или несколько стандартных белков, было показано, что интенсивности сигналов пептидных пиков почти линейно соответствуют их концентрации в образце, и что соотношение площадей пиков между различными раундами LC-MS надежно отражает их относительные количества в образце (Wang et al., J. Proteome Res. 2006, 5: 1214-1223).
Хроматографические методы разделения
Согласно настоящему изобретению интактные легкие цепи подвергаются одному или более методам хроматографического разделения (стадия d.).
Хроматографическое разделение индивидуальных компонентов поликлонального белка может быть основано на различиях в физико-химических свойствах, таких как i) суммарный заряд (например, в ионно-обменной хроматографии (IEX)), ii) гидрофобность (например, в хроматографии с обращенной фазой (RP-HPLC) и в хроматографии гидрофобного взаимодействия, основанной на концентрации соли (HIC)), iii) изоэлектрическая точка (значение pI) (например, в хроматофокусировании) или iv) аффинность (например, в аффинной хроматографи с исользованием антиидиотипических пептидов/антител или хроматография белков L для разделения антител легких цепей капа и лямбда). Пятый хорошо известный хроматографический метод основан на физико-химическом свойстве размера. Однако это не особенно подходящий метод для разделения гомологичных белков, таких как легкие цепи антител, так как все легкие цепи по существу имеют одинаковый размер.
Предпочтительно, чтобы метод хроматографического разделения обеспечивал достаточно хорошее разделение видов легких цепей с идентичными или почти идентичными молекулярными массами, так чтобы их можно было впоследствии различить в масс-спектрометре. Способность масс-спектрометра разделять и различать два вида легких цепей, имеющих почти одинаковую молекулярную массу, решает, какие виды легкой цепи должны быть разделены на исходной хроматографической стадии. Методы достижения достаточного разделения в методе хроматографического разделения лежат в пределах возможностей специалиста в данной области, который может регулировать используемый буфер, градиент, скорость потока, давление, материал колонки и т.д. Хотя в принципе может использоваться любой метод хроматографического разделения более удобно использовать метод и систему, которые совместимы с последующим использованием масс-спектрометра, так чтобы можно было избежать смены буфера. Использование LC-MS является предпочтительным, поскольку обе системы (жидкостная хроматография и масс-спектрометрия) являются совместимыми, тем самым устраняется необходимость сбора фракций.
a) Ионно-обменная хроматография
В некоторых вариантах осуществления настоящего изобретения ионно-обменная хроматография используется для разделения индивидуальных компонентов легких цепей рекомбинантного поликлонального антитела или субпопуляции индивидуальных компонентов поликлонального белка. Разделение с помощью ионно-обменной хроматографии основано на суммарном заряде индивидуальных легких цепей в композиции, которую следует разделить. В зависимости от значений pI легких цепей, а также значений pH и концентраций солей выбранного буфера для колонки, индивидуальные легкие цепи могут разделяться, по меньшей мере, до некоторой степени с использованием или анионно-обменной или катионно-обменной хроматографии. Например, все индивидуальные легкие цепи, как правило, связываются с отрицательно заряженной катионо-обменной средой при условии, что pH значительно ниже самого низкого значения pI индивидуальных легких цепей. Индивидуальные компоненты связанных легких цепей могут впоследствии элюироваться с колонки в зависимости от суммарного заряда индивидуальных белков, обычно с использованием увеличения градиента соли (например, хлорида натрия) или увеличения значения pH. Несколько фракций получают во время элюирования. Одна фракция предпочтительно содержит индивидуальный компонент легкой цепи, но также может содержать 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20 или более отдельных компонентов. Общие принципы катионо-обмена и анионо-обмена хорошо известны из уровня техники, и колонки для ионо-обменной хроматографии являются коммерчески доступными.
b) Хроматофокусирование
В следующих вариантах осуществления настоящего изобретения хроматофокусирование используется для разделения индивидуальных компонентов легких цепей рекомбинантного поликлонального антитела или субпопуляции индивидуальных компонентов легких цепей поликлонального антитела. Разделение с помощью хроматофокусирования основано на различиях в значениях pI индивидуальных белков и осуществляется с использованием буфера колонки, имеющего значение рН выше значения pI легких цепей. Рекомбинантный поликлональный белок, где индивидуальные компоненты имеют относительно низкие значения pI, будут связываться с положительно заряженной слабой катионо-обменной средой. Индивидуальные компоненты легких цепей связанного рекомбинантного поликлонального белка могут, по существу, элюироваться из колонки в зависимости от значений pI индивидуальных компонентов легких цепей путем генерирования в колонке уменьшения градиента рН с использованием полибуфера, созданного для перекрывания рН-интервала значений pI индивидуальных компонентов. Несколько фракций получают во время элюирования. Одна фракция предпочтительно содержит индивидуальный компонент легкой цепи поликлонального белка, но может также содержать 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20 или более отдельных компонентов легких цепей. Общие принципы хроматофокусирования с использованием анионо-обменников хорошо известны из уровня техники, анионные колонки являются коммерчески доступными. Хроматофокусирование с использованием катионо-обменников также хорошо известно из уровня техники (Kang, X. and Frey, D. D., 2003. J. Chromatogr. 991, 117-128).
с) Хроматография гидрофобного взаимодействия
В следующих вариантах осуществления настоящего изобретения хроматография гидрофобного взаимодействия используется для разделения индивидуальных компонентов легких цепей рекомбинантного поликлонального антитела или субпопуляции индивидуальных компонентов легких цепей поликлонального антитела. Разделение с помощью хроматографии гидрофобного взаимодействия основано на различиях в гидрофобности индивидуальных белков в композиции, которую необходимо разделить. Рекомбинантно продуцированные легкие цепи связаны с хроматографической средой, модифицированной с помощью гидрофобного лиганда в буфере, который способствует гидрофобным взаимодействиям. Этого, как правило, достигают в буфере, содержащем органический растворитель с низким процентным содержанием (RP-HPLC), или в буфере, содержащем выбранную соль с достаточно высокой концентрацией(HIC). Индивидуальные компоненты легких цепей, по существу, элюируются из колонки в зависимости от гидрофобности индивидуальных компонентов легких цепей обычно с использованием увеличения градиента органического растворителя(RP-HPLC) или уменьшения градиента выбранной соли (HIC). Несколько фракций получают во время элюирования. Одна фракция предпочтительно содержит индивидуальный компонент легкой цепи поликлонального белка, но может также содержать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более отдельных компонентов легких цепей поликлонального белка. Общие принципы хроматографии гидрофобного взаимодействия хорошо известны из уровня техники, и колонки для RP-HPLC, а также для HIC являются коммерчески доступными. Масс-спектрометры часто содержат непосредственно с ними связанный HLPC-элемент, что делает предпочтительным использование RP-HPLC перед стадией разделения.
d) Гидрофобная Хроматография с Индукцией Заряда
В следующих вариантах осуществления настоящего изобретения гидрофобная хроматография с индукцией заряда (HCIC) используется для разделения индивидуальных компонентов легких цепей рекомбинантного поликлонального антитела или субпопуляции индивидуальных компонентов легких цепей поликлонального антитела. Разделение с помощью HCIC основано на различиях в гидрофобности индивидуальных белков в композиции, которую необходимо разделить. Адсорбция основана на мягком гидрофобном взаимодействии и осуществляется без добавления солей. Десорбция основана на отталкивании заряда, что достигается путем изменения рН подвижной фазы. Оптимального разделения индивидуальных легких цепей после адсорбции на смоле HCIC можно достичь с помощью оптимизации градиента, например, путем изменения рН и буферной соли в подвижной фазе. Одна фракция предпочтительно содержит индивидуальную легкую цепь, но также может содержать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более отдельных легких цепей. Общие принципы гидрофобной хроматографии с индукцией заряда хорошо известны из уровня техники, и колонки для HCIC являются коммерчески доступными. Примером коммерчески доступной смолы HCIC является MEP HyperCelTM (PALL, East Hills, NY, USA). Сорбент MEP HyperCelTM представляет собой материал с высокой пропускной способностью, с высокой избирательностью хроматографии, специально разработанный для захвата и очистки моноклональных и поликлональных антител.
е) Аффинная хроматография
В следующих вариантах осуществления настоящего изобретения аффинная хроматография используется для разделения индивидуальных компонентов легких цепей поликлонального антитела или субпопуляции индивидуальных компонентов легких цепей поликлонального антитела. Разделение с помощью аффинной хроматографии основано на различиях в аффинности к конкретной детекторной молекуле, лиганду или белку. Детекторная молекула, лиганд или белок, или их совокупность (эти различные варианты далее называются просто лигандами) иммобилизуются на хроматографической среде, и легкие цепи применяют к аффинной колонке в условиях, благоприятных для взаимодействия между индивидуальными компонентами и иммобилизованным лигандом. Белки, демонстрирующие отсутствие аффинности к иммобилизованном лиганду, собирают в проточной колонке, и белки, демонстрирующие аффинность к иммобилизованному лиганду, последовательно элюируют из колонки в условиях, противодействующих связыванию (например, низкое рН, высокая концентрация соли или высокая концентрация лиганда). Несколько фракций может быть получено во время элюирования. Одна фракция предпочтительно содержит индивидуальный компонент легкой цепи поликлонального антитела, но может также содержать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более отдельных компонентов легких цепей поликлонального антитела. Лиганды, которые могут использоваться для характеризации рекомбинантного поликлонального белка, представляют собой, например, антигены-мишени, антиидиотипические молекулы или белок L для разделения антител с легкими цепями каппа или лямбда.
Аффинная хроматография с антиидиотипическии молекулами (например, антиидиотипическими пептидами или антиидиотипическими антителами), которые специфично связываются с индивидуальными компонентами поликлонального белка или субпопуляции таких индивидуальных компонентов может осуществляться для получения информации, касающейся относительного содержания выбранных компонентов рекомбинантного поликлонального белка (также называемых сигнальными белками), или субпопуляции индивидуальных компонентов. В идеале, каждая индивидуальная антиидиотипическая молекула связывается специфично только с одним индивидуальным компонентом, но не с другими компонентами рекомбинантного поликлонального белка, хотя в настоящем изобретении также может использоваться антиидиотипическая молекула, которая связывается с определенной разновидностью компонентов. Предпочтительно, антиидиотипические молекулы генерируются ко всем индивидуальным компонентам, так чтобы можно было охарактеризовать полную поликлональную композицию. В случае, где рекомбинантный поликлональный белок представляет собой поликлональное антитело, антиидиотипические молекулы направлены против антиген-специфичной части последовательности антитела. Антиидиотипические молекулы могут быть иммобилизованы индивидуально на хроматографическую среду, так чтобы колонки содержали антиидиотипическую молекулу, посредством чего получают информацию о конкретном белковом компоненте или субпопуляции белков. Элюат может затем применяться во второй колонке со второй имобилизованной антиидиотипической молекулой и так далее. Альтерантивно, несколько различных антиидиотипических молекул иммобилизуют на одной и той же хроматографической среде, применяемой к одной и той же колонке. Элюцию затем осуществляют в условиях, которые позволяют элюирование индивидуальных белков в различных фракциях, например, путем добавления в колонку увеличенного количества свободных идиотипических молекул или путем использования градиента рН или соли. С помощью этого способа можно получать информацию о содержании нескольких компонентов поликлонального белка с использованием одномерного анализа.
Поликлональное антитело может состоять из индивидуальных компонентов, которые содержат или каппа-легкую цепь или лямбда-легкую цепь. В таком поликлональном антителе антитела с лямбда-легкой цепью могут быть отделены от антител с каппа-легкой цепью путем использования отсутствия аффинности к белку L для лямбда-легкой цепи антител. Таким образом, разновидность компонентов антител, содержащих лямбда-легкую цепь, могут быть отделены от разновидности компонентов антител, содержащих каппа-легкую цепь, с использованием аффинной хроматографии с белком L. Каппа и лямбда разновидности антитела могут быть впоследствии дополнительно охарактеризованы с использованием способа по изобретению.
Многомерная хроматография
Как правило, одного процесса разделения достаточно для получения хорошего разрешения легких цепей на стадии масс-спектрометрии. Конечно, это не исключает использования дополнительных процессов разделения, которые кратко описаны ниже.
В зависимости от сложности вариантов гомологичных белков в образце для анализа, например рекомбинантного поликлонального белка, желательно объединение двух или более хроматографических методов, описанных выше в (а)-(е), в двухмерном, трехмерном или многомерном формате. Предпочтительно использование жидкостной хроматографии во всех направлениях вместо двухмерного гель-электрофореза. Однако это не исключает использования гель-электрофореза или методов преципитаци в одном или более направлениях для характеризации рекомбинантного поликлонального белка. Как правило, предпочтительно использование хроматографических методов на основе различных физико-химических свойств в различных направлениях в многомерной хроматографии, например разделение по заряду в первом направлении, разделение по гидрофобности во втором направлении и по аффинности в третьем направлении. Однако некоторые хроматографические методы могут обеспечивать дополнительное разделение при использовании в последующем направлении, даже если они используют аналогичные физико-химические свойства белка. Например, может быть получено дополнительное разделение при хроматофокусировании после ионо-обменной хроматографии или аффинной хроматографии с различными лигандам, которые сменяют друг друга.
В качестве альтернативы к многомерным LC-методам для характеризации рекомбинантного поликлонального белка может использоваться иммунопреципитация, объединенная с подходящим методом электрофореза, таким как гель-электрофорез или капиллярный электрофорез, а также последующая количественная оценка антигенов. Этот метод конкретно применяется для характеризации рекомбинантного поликлонального антитела, направленного против комплексных антигенов. Рекомбинантное поликлональне антитело, направленное против, например, комплексного вирусного антигена, может быть подвергнуто иммунопрециптации с использованием смеси меченных антигенов и гранул белка А. Антигены могут быть впоследствии разделены с использованием изоэлектрического фокусирования или двухмерного ПААГ с последующей количественной оценкой индивидуальных антигенов, отражающей количество антител в рекомбинантном поликлональном антителе, направленном против специфичных антигенов.
Исключение гетерогенности N-концевого заряда в рекомбинантных белках
В методах характеризации белка, описанных выше, гетерогенность индивидуального белка в пуле гомологичных белков может осложнить характеризацию, так как один белок может приводить к возникновению нескольких пиков, например в профиле IEX. Гетерогенность представляет собой распространенное явление в антителах и других рекомбинантных белках, и происходит благодаря ферментативным и неферментативным посттрансляционным модификациям. Эти модификации могут вызывать гетерогенность по размеру или по заряду. Распространенные посттрансляционные модификации включают N-гликозилирование (только в тяжелых цепях), окисление метионина, протеолитическую фрагментацию и дезамидирование. Гетерогенность также может иметь происхождение из модификаций на генетическом уровне, таких как мутации, введенные во время трансфекции (Harris, J. R, et al. 1993. Biotechnology 11,1293-7), и из случаев кроссинговера между вариабельными генами тяжелых и легких цепей во время транскрипции (Wan, M. et al. 1999. Biotechnol Bioeng. 62,485-8). Эти модификации являются эпигенетическими и, таким образом, не предсказуемы только исходя из структуры конструкции.
Некоторые из этих посттрансляционных модификаций, которые могут приводить к гетерогенности, могут происходить до характеризации. Такие модификации для облегчения характеризации без делетирования значительных частей зрелого белка, продуцированного с помощью поликлональной продуцирующей клеточной линии(й), рассматриваются в контексте настоящего изобретения, предполагающего сохранение интактной легкой цепи, т.е. интактная легкая цепь может быть модифицирована, как например, с помощью одного или более из следующих методов. В одном варианте осуществления изобретения такая 'модифицированная' интактная легкая цепь состоит, по меньшей мере, из 90% аминокислотной последовательности зрелой интактной легкой цепи, например, по меньшей мере, из 91%, например, по меньшей мере, из 92%, например, по меньшей мере, из 93%, например, по меньшей мере, из 94%, например, по меньшей мере, из 95%, например, по меньшей мере, из 96%, например, по меньшей мере, из 97%, например, по меньшей мере, из 98%, например, по меньшей мере, из 99%, например из 100% аминокислотной последовательности зрелой интактной легкой цепи.
Вариации заряда, происходящие из ферментативного удаления С-концевого лизина, могут быть решены путем использования специфичных ингибиторов карбоксипептидаз или путем обработки антитела карбоксипептидазой для упрощения системы в целом (Perkins, M. et al. 2000. Pharm Res. 17, 1110-7).
Химическая деградация белков, такая как дезамидирование, как было показано, является значительной проблемой в процессе производства и хранения и приводит к гетерогенности заряда. Дезамидирование Asn до Asp и образование изо-Asp (изоаспартильные пептидные связи) имеет место при мягких условиях (Aswad, D. W. et al. 2000. J Pharm Biomed Anal. 21, 1129-36). Эти перестройки происходят наиболее часто в последовательностях Asn-Gly, Asn-Ser и Asp-Gly, где локальная гибкость полипептидной цепи является высокой.
Гетерогенность заряда также может возникать в результате N-концевого блокирования пироглутаминовой кислотой (PyroGlu), что происходит в результате циклизации N-концевых остатков глутамина (дезамидирование). Такие посттрансляционные модификации были описаны для IgG, а также для других белков. Частично циклизация N-конца антитела приводит к гетерогенности заряда с получением комплексного характера IEX. Эта проблема не может быть решена путем использования фермента пироглутамат аминопептидазы, прежде всего из-за того, что деблокирование должно осуществляться на восстановленных и алкилированных антителах с целью получения высокого выхода деблокированных антител (Mozdzanowski, J. et al. 1998, Anal. Biochem. 260,183-7), что несовместимо с последующим IEX-анализом, и, во-вторых, из-за того, что невозможно получить 100%-расщепления для всех антител.
Таким образом, следующий аспект настоящего изобретения относится к исключению гетерогенности заряда, вызванной циклизацией N-концевых остатков глутамина. Образование N-концевых остатков PyroGlu исключается путем гарантии того, что ни одна полипептидная цепь не содержит N-концевого глутамина, например путем замены указанного N-концевого остатка глутамина на другой аминокислотный остаток. Для антител остатки Gln на N-конце легкой цепи могут быть заменены. Это делается путем сайт-направленного мутагенеза последовательностей нуклеиновых кислот, которые кодируют полипептиды с N-концевым глутамином. Предпочтительно, N-концевые остатки глутамина заменяют на остатки глутаминовой кислоты, так как это незаряженное производное глутамина. В рекомбинантном поликлональном белке индивидуальные последовательности, кодирующие компоненты, могут быть изменены и повторно вставлены в экспрессирующий вектор для генерирования новой клеточной линии, экспрессирующей измененный белок. Эта клеточная линия может затем быть включена в коллекцию клеток, продуцирующих поликлональный белок.
Методы дополнительной характеризации
В одном варианте осуществления настоящего изобретения проводят мониторинг поликлональности пула гомологичных белков экспрессирующей системы для продуцирования гомологичных белков с помощью, по меньшей мере, одного метода дополнительной характеризации белков. Такой метод дополнительной характеризации может представлять собой любой метод, который индивидуально или в комбинации с другими методами способен обеспечивать получение информации касательно присутствия и относительного содержания индивидуальных компонентов смеси моноклональных белков или рекомбинантного поликлонального белка в растворе или на поверхности клетки, присутствующей в поликлональной клеточной линии. В зависимости от сложности рекомбинантного поликлонального белка может использоваться один или более из следующих методов: i) дополнительные методы хроматографического разделения, ii) анализ с использованием протеолитического расщепления поликлонального белка для идентификации уникальных маркерных пептидов, представляющих собой индивидуальные компоненты поликлонального белка, iii) "суммарное" N-концевое секвенирование и iv) анализ с использованием конкретных детекторных молекул, например, для характеризации сигнальных белков - компонентов поликлонального белка. Соответственно, методы дополнительной характеризации могут осуществляться параллельно или даже после стадий d) и e).
В одном варианте осуществления изобретения метод дополнительной характеризации белка представляет собой анализ с использованием протеолитического расщепления вариабельного участка гомологичных белков, как описано в WO 2006/007853. В WO 2006/007853 также представлены дополнительные инструкции относительно использования "суммарного" N-концевого секвенирования и характеризации комплексных смесей гомологичных белков с конкретными детекторными молекулами.
Однако благодаря преимуществам настоящего способа обычно не требуются никакие другие методы характеризации белков для того, чтобы охарактеризовать вид легкой цепи рекомбинантного поликлонального антитела.
Образец белка
Поликлональный белок может быть выделен, например, из супернатанта клеточной культуры, полученного из поликлональной клеточной культуры, например, в форме "сырого" супернатанта, который был только отделен от клеток, например, с помощью центрифугирования или в форме супернатантов, которые были очищены, например, с помощью аффинной очистки с использованием белка А, иммунопреципитации или гель-фильтрации. Однако эти предварительные стадии очистки не являются частью характеризации рекомбинантного поликлонального белка, так как они не обеспечивают никакого разделения различных гомологичных белков в композиции. Предпочтительно, образец, подвергаемый процессу характеризации по настоящему изобретению, подвергается, по меньшей мере, одной стадии очистки. Наиболее предпочтительными являются образцы, которые включают, по меньшей мере, 90% - чистых гомологичных белков, как например, по меньшей мере, 95% или, более предпочтительно, 99% - чистых гомологичных белков. Альтернативно, поликлональный белок может представлять собой смесь отдельно полученных и очищенных антител.
Может осуществляться мониторинг различных гомологичных белков, входящих в состав поликлонального белка, на образцах, полученных из одной поликлональной клеточной культуры в различные моменты времени во время культивирования, осуществляя таким образом мониторинг относительного содержания индивидуальных компонентов поликлонального белка в процессе раунда продуцирования для оценки их композиционной стабильности. Альтернативно, может осуществляться мониторинг различных гомологичных белков, входящих в состав поликлонального белка, на образцах, полученных из различных поликлональных клеточных культур в конкретный момент времени, осуществляя таким образом мониторинг относительного содержания индивидуальных кодирующих последовательностей в различных партиях для оценки постоянства от партии к партии.
Сложность смеси различных гомологичных белков, подвергнутых характеризации
Образец, который подвергают характеризации с помощью способов по настоящему изобретению, включает определенную разновидность различных гомологичных белков, содержащих различные белки с вариабельными участками, конкретно различные рекомбинантные белки. Как правило, индивидуальные компоненты поликлонального белка определяют по общей черте, такой как, например, в случае антител - общая активность связывания по отношению к целевой мишени. Как правило, композиция поликлональных белков, анализируемая с помощью платформы характеризации по настоящему изобретению, содержит, по меньшей мере, 3, 4, 5, 10 или 20 отдельных вариантов белковых компонентов (различных гомологичных белков). Таким образом, композиция поликлональных белков, как правило, включает (по меньшей мере) 3 различных гомологичных белка, таких как (по меньшей мере) 4, (по меньшей мере) 5, (по меньшей мере) 6, (по меньшей мере) 7, (по меньшей мере) 8, (по меньшей мере) 9, (по меньшей мере) 10, по меньшей мере) 11, (по меньшей мере) 12, (по меньшей мере) 13, (по меньшей мере) 14, (по меньшей мере) 15, (по меньшей мере) 16, (по меньшей мере) 17, (по меньшей мере) 18, (по меньшей мере) 19, (по меньшей мере) 20, (по меньшей мере) 21, (по меньшей мере) 22, (по меньшей мере) 23, (по меньшей мере) 24 или (по меньшей мере) 25 различных гомологичных белков, таких как, например, 2-30 различных гомологичных белков, например, 2-5, 6-10, 11-15, 16-20, 21-25 или 26-30 различных гомологичных белков. В некоторых случаях композиция поликлональных белков может включать большее количество отдельных вариантов белковых компонентов, как например, по меньшей мере, 50 или 100 различных гомологичных белков. Как правило, ни один вариант белкового компонента не составляет более чем 75% от суммарного количества индивидуальных компонентов в композиции поликлональных белков. Предпочтительно, чтобы ни один индивидуальный компонент не превышал более чем 50%, более предпочтительно, 25% от суммарного количества индивидуальных компонентов в конечной поликлональной композиции. Во многих случаях ни один индивидуальный компонент не превышает более чем 10% от суммарного количества индивидуальных компонентов в конечной поликлональной композиции.
В предпочтительном варианте осуществления настоящего изобретения образец, включающий различные гомологичные белки, содержащие различные вариабельные участки, представляет собой поликлональное антитело. Поликлональное антитело может состоять из одного или более различных подклассов или изотипов антител, таких как человеческие изотипы IgGl, IgG2, IgG3, IgG4, IgAl и IgA2 или мышиные изотипы IgGl, IgG2a, IgG2b, IgG3 и IgA.
Изобретение будет дополнительно описано с помощью следующих неограничивающих примеров.
ПРИМЕРЫ
ПРИМЕР 1: Получение рекомбинантного поликлонального антитела.
Композицию рекомбинантного поликлонального антитела, содержащую 25 различных индивидуальных анти-RhD антител, получали согласно Примеру 5 из WO 2006/007850. Эта композиция поликлонального антитела обозначается ниже как "Sym00l".
ПРИМЕР 2: Выделение легких цепей
Согласно настоящему изобретению идентификация индивидуальных антител основана на данных о массе и времени удерживания полноразмерной легкой цепи, а не одного пептида из легкой цепи. Это свойство облегчает способ (желательно не ферментативный) и, таким образом, улучшает надежность метода. Легкие цепи (каппа) в Sym001, которые очень похожи друг на друга по последовательности за исключением CDR-участков, не содержат посттрансляционных модификаций, таких как N-гликозилирование, фосфорилирование и т.д., и, таким образом, может ожидаться ионизация в большей или меньшей или одинаковой степени. Оценивали линейность реакции антител, восстановления и воспроизводимости. Две партии Sym001 также исследовали для оценки относительных количеств индивидуальных антител в различных партиях.
Образец обессоливали с помощью диализа или с использованием PDl0-колонки (GE Healthcare) против воды, и осуществляли мониторинг A280. Образец затем лиофилизовали и восстанавливали в 6M Gua-HCl, 0,2M Tris, pH 8,4 до конечной концентрации 10 мг/мл, и восстанавливали и алкилировали с помощью DTT и иодоуксусной кислоты соответственно.
Легкие цепи образца выделяли на колонке Superose(TM) 12 10/300 GL для эксклюзионной хроматографии (GE healthcare) в HPLC-системе Agilent 1100. Легкие цепи элюировали с помощью 6M Gua-HCl, 50 mM NaP, pH 8,4 со скоростью потока 0,15 мл/мин. Загрузка образца: <1% от объема колонки.
Типичные хроматограммы восстановленного и алкилированного Sym001 показаны на Фиг.l.
LC-MS
Фракцию легких цепей обессоливали с помощью диализа (диализные кассеты Slide-A-Lyzer, 10000 MWCO, Pierce) против 0,1 M ацетата аммония и измеряли A280. Анализ осуществляли на Agilent 1100 HPLC, соединенной последовательно с масс-спектрометром Agilent G1969A LC/MSD TOF, оборудованным клонкой ACE 3 C4-300, 100×2,1 мм, 3 μ. Легкие цепи элюировали с помощью градиента ацетонитрила в 0,04% трифторуксусной кислоте со скоростью потока 0,4 мл/мин, процесс осуществляли при 60ºC.
Репрезентативная хроматограмма показана на Фиг.2.
Оценка - идентификация и количественное определение
Идентичность индивидуальных легких цепей устанавливали на основе данных о массе и времени удерживания (Фиг.3).
Относительное количественное определение было достигнуто за счет построения хроматограмм экстракционной ионной хроматографии (XIC) наиболее интенсивных сигналов в различных наружных оболочках легкой цепи с множественным зарядом и интеграцией площадей их пиков.
Для оценки использовалась программа Analyst QS 1.1 (Agilent). Оценка одного антитела описана ниже, RhD159 LC, с массой 23660,2.
RhDl 59 LC
1) Идентификация пика м/з с наибольшей интенсивностью (импульсы) в м/з-диапазоне.
Для антитела RhD159 (23660,2 Da) теоретическое значение м/з для M+25H составляет 947,41. Это получено на основании TIC (суммарная ионная хроматограмма) для пояснения XIC (хроматограмма экстракционной ионной хроматографии), показанной на Фиг.4.
М/з-диапазон получен для полученного интервала времени пика (Фиг.5).
Молекулярный ион наибольшей интенсивности (импульсы) составляет 947,43 (M+25H).
Количественное определение (определение площади пика) м/з-пика с наибольшей интенсивностью (импульсы) в м/з-диапазоне.
Молекулярный ион наибольшей интенсивности (импульсы) увеличивается. Это получено из TIC с использованием оборудования экстракционной ионной хроматографии, которое обнаруживает максимум пика и устанавливает интервал м/з автоматически. Пик в полученной XIC, соответствующей RhD159 LC, интегрируется после выравнивания (Фиг.6).
Линейность
Линейность реакции антитела подтверждали путем введения пяти уровней (n=3) Sym001 WS-I LC (см. Фиг.7).
Извлечение
Извлечение подтверждали с помощью калибровочных экспериментов (spike-in experiments) 25 индивидуальных антител, входящих в состав Sym001, как показано в Таблице 1. Каждую легкую цепь антитела анализировали индивидуально на одном или двух уровнях и калибровали в Sym001 WS-I LC на двух уровнях.
|
Воспроизводимость - относительное количественное определение
В Таблице 2 показаны результаты относительной площади, рассчитанной для каждой легкой цепи антитела в Sym001 WS-I, анализ проводили для шести различных случаев. Аналитики осуществляли получение шести образцов с использованием четырех препаратов буфера для восстановления и пяти препаратов подвижной фазы, использующейся во время SEC (эксклюзионная хроматография). Были протестированы два лота SEC-колонок. LC-MS-часть осуществляли с помощью четырех препаратов подвижной фазы и двух лотов RPC-колонок (хроматография с обращенной фазой). Значения RSD (относительного стандартного отклонения) находились в интервале 1,1-8,4%.
|
Анализ двух различных партий Sym001
Анализировали две различные партии (n=3), результаты показаны на Фиг.8.
Как видно на Фиг.8, способ LC-MS легких цепей по изобретению способен детектировать изменения между двумя партиями (см., например, антитела 157 и 202).
Заключение
Авторами настоящего изобретения разработан способ на основе LC-MS, с помощью которого можно идентифицировать и количественно определить 25 антител, входящих в состав Sym001:
- способ RP-HPLC был разработан для получения разрешения легких цепей, особенно с близкими массами;
- массы, соответствующие легкой цепи всех 25 антител, были обнаружены в образце Sym001 (Sym001 WS-I). Для одного антитела (RhD207), была обнаружена дополнительная усеченная форма;
- корректное время удерживания было уточнено для всех 25 различных легких цепей;
- линейность реакции легких цепей антител подтверждали с помощью введения различных количеств Sym001 WS-I LC;
- извлечение подтверждали с помощью калибровочных экспериментов всех 25 различных легких цепей;
- воспроизводимость тестировали на одном образце, Sym001 WS-I (n=6);
- анализировали две партии (n=3) и было показано, что способ LC-MS легких цепей способен детектировать изменения между партиями.
Специалисту в данной области будет понятно, что существует множество различных вариаций практического использования описанных здесь способов. Таким образом, не было сделано попытки предложения всех возможных вариаций в рамках настоящего изобретения. Все патентные и непатентные документы, процитированные в настоящем документе, включены в настоящее описание с помощью ссылки в полном объеме и для всех целей.