Результат интеллектуальной деятельности: ТРИЗАМЕЩЕННЫЕ 1,2,4-ТРИАЗОЛЫ
Вид РИД
Изобретение
Настоящее изобретение относится к замещенным производным 1-алкил-3-анилин-5-арилтриазола и к их фармацевтически приемлемым солям, способам их получения, содержащим их фармацевтическим композициям и к их применению в терапии. Изобретение относится к избирательным положительным аллостерическим модуляторам α7-никотинового рецептора ацетилхолина, обладающим способностью усиливать эффективность агонистов никотиновых рецепторов.
Предыдущий уровень техники в данной области
Европейский патент ЕР 1044970 описывает 3-алкиламино-1,2,4-триазолы в качестве лигандов рецептора нейропептида Y.
В статье автор Makara G.M. et al. (Organic Letters (2002) Vol. 4 (10); 1751-1754) описывает твердофазный синтез 3-алкиламино-1,2,4-триазолов и сообщает о безуспешном синтезе N-(4-метоксифенил)-1-метил-5-(4-метилфенил)-1Н-1,2,4-триазол-3-амина, и не указывается о возможных терапевтических применениях указанного выше соединения, в частности, по поводу его использования в качестве позитивного аллостерического модулятора α7-никотинового рецептора ацетилхолина.
Chen Chen et al. в Bioorganic & Medicinal Chemistry letters 11 (2001) 3165-3168 описывает синтез 1-алкил-3-амино-5-арил-1Н-[1,2,4]триазолов, в частности N-(2-метоксифенил)-1-метил-5-(2,4-дихлорфенил)-1Н-1,2,4-триазол-3-амина, и их использование в качестве антагонистов кортикотропин-релизинг-фактора-1 (CRF1).
Предпосылки к созданию изобретения
Как правило, холинергические рецепторы связываются с эндогенным нейротрансмиттером ацетилхолином (АХ, ACh), тем самым стимулируя открытие ионных каналов. Рецепторы АХ в центральной нервной системе млекопитающих можно разделить на мускариновые (мАХР, mAChR) и никотиновые (нАХР, nAChR) подтипы, основываясь на агонистических активностях мускарина и никотина соответственно. Никотиновые рецепторы ацетилхолина являются лиганд-управляемыми ионными каналами, состоящими из пяти субъединиц. Члены семейства генов субъединиц нАХР были разделены на две группы на основании кодируемых ими аминокислотных последовательностей; одна группа, содержащая так называемые β субъединицы, и вторая группа, содержащая α субъединицы. Было показано, что три типа α субъединиц, α7, α8 и α9, образуют функциональные рецепторы при экспрессии только одного типа, и, соответственно, предположили, что они образуют гомоолигомерные пентамерные рецепторы.
Модель н-АХР аллостерического переходного состояния нАХР была разработана, включает, по меньшей мере, состояние покоя, активированное состояние и “десенситизированное” состояние закрытого ионного канала, которое характеризуется тем, что рецепторы становятся нечувствительными к агонисту. Различные лиганды нАХР могут стабилизировать конформационное состояние рецептора, с которым они предпочтительно связываются. Например, агонисты АХ и (-)-никотина стабилизируют соответственно активные и десенситизированные состояния.
Изменения активности никотиновых рецепторов были отмечены в ряде заболеваний. Некоторые из них, например миастения гравис и аутосомно-доминантная ночная лобная эпилепсия (ADNFLE), ассоциированы со снижениями активности передачи сигнала посредством никотиновых рецепторов либо вследствие уменьшения числа рецепторов, либо вследствие повышения десенситизации.
Предполагается, что снижение числа никотиновых рецепторов опосредует когнитивные расстройства, наблюдаемые при заболеваниях, таких как болезнь Альцгеймера и шизофрения.
Эффекты никотина из табака также опосредуются никотиновыми рецепторами, и поскольку действие никотина заключается в стабилизации рецепторов в десенситизированном состоянии, повышенная активность никотиновых рецепторов может ослабить желание курить.
Соединения, связывающиеся с нАХР, были предложены для лечения ряда заболеваний, связанных со снижением холинергической функции, таких как дефицит научения, нарушение познавательной способности, расстройство внимания или потеря памяти. Модуляция активности α7-никотиновых рецепторов, как полагают, окажет благоприятное воздействие в ряде заболеваний, включающих болезнь Альцгеймера, деменцию, развивающуюся при болезни диффузных телец Леви, синдром гиперактивности с дефицитом внимания, тревогу, шизофрению, маниакальный синдром, биполярную депрессию, болезнь Паркинсона, болезнь Гентингтона, синдром Жиля де ля Туретта, травму головного мозга или другие неврологические, дегенеративные или психиатрические расстройства, при которых происходит потеря холинергических синапсов, включающие синдром смены часовых поясов, пристрастие к никотину, боль.
Однако лечение агонистами никотиновых рецепторов, которые оказывают воздействие у того же участка, что и АХ, является проблематичным, поскольку АХ не только активирует, но и блокирует активность рецепторов посредством механизмов, включающих десенситизацию и неконкурентную блокировку. Кроме того, продолжительная активация, по-видимому, вызывает длительную инактивацию. Поэтому можно предположить, что агонисты АХ снижают активность так же, как и усиливают ее.
В целом, у никотиновых рецепторов и особенно у α7-никотинового рецептора десенситизация ограничивает продолжительность действия используемого агониста.
Описание изобретения
К своему удивлению, авторы изобретения обнаружили, что некоторые новые соединения могут увеличивать эффективность агонистов у никотиновых рецепторов ацетилхолина. Соединения, обладающие указанным типом действия, называют как “позитивные аллостерические модуляторы”, и они, вероятно, пригодны для лечения состояний, ассоциированных со снижениями передачи сигнала посредством никотиновых рецепторов. При терапевтическом назначении такие соединения могут восстанавливать межневронную связь без воздействия на временный профиль активации. Кроме того, позитивные аллостерические модуляторы, как полагают, не производят продолжительной инактивации рецепторов, как можно увидеть после повторного или пролонгированного применения агонистов.
Позитивные модуляторы нАХР согласно настоящему изобретению пригодны для лечения или профилактики психических расстройств, снижений или нарушений интеллектуальной деятельности или воспалительных заболеваний или состояний, при которых модуляция α7-никотинового рецептора оказывает благоприятное воздействие.
Настоящее изобретение относится к замещенным производным 1-алкил-3-анилин-5-арилтриазола, проявляющим свойства позитивных аллостерических модуляторов, увеличивающим эффективность агонистов у α7-никотинового рецептора. Изобретение также относится к способам их получения и фармацевтическим композициям, содержащим указанные соединения. Изобретение также относится к соединениям формулы (I) для использования в лечении или предотвращении психических нарушений, снижений или нарушений интеллектуальной деятельности, воспалительных заболеваний или состояний, при которых модуляция α7-никотинового рецептора оказывает благоприятное воздействие. Изобретение также относится к использованию указанных производных для производства лекарственного препарата для лечения или профилактики психических нарушений, снижений или нарушений интеллектуальной деятельности, воспалительных заболеваний или состояний, при которых модуляция α7-никотинового рецептора оказывает благоприятное воздействие.
Соединения согласно настоящему изобретению отличаются по структуре от соединений предыдущего уровня техники в данной области и фармакологически по их активности как позитивных аллостерических модуляторов α7-никотинового рецептора ацетилхолина.
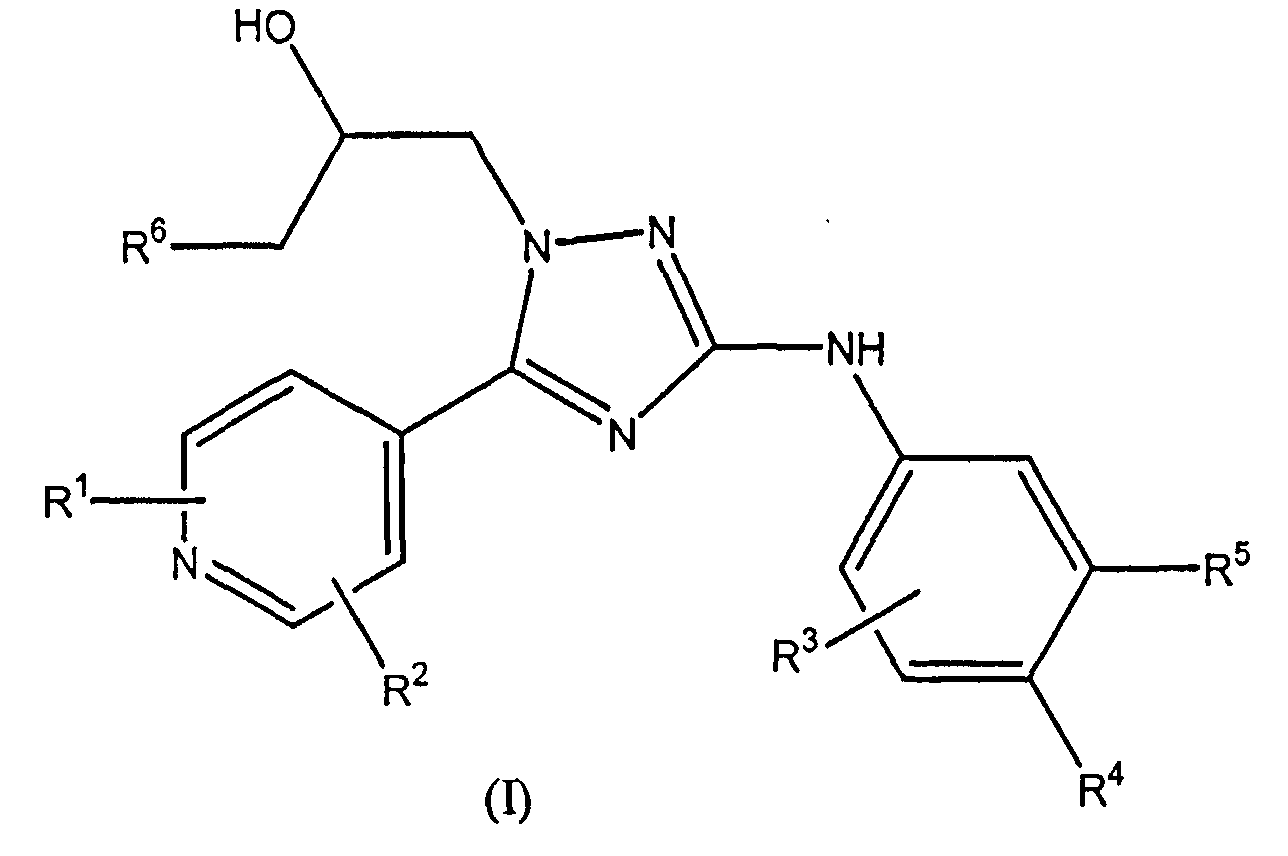
Настоящее изобретение относится к соединению формулы (I)
или к его стереоизомерной форме, где
R1 означает метил, этиламино или метоксиэтиламино;
R2 означает водород или метил;
R3 означает фтор, хлор, трифторметил или метил;
R4 означает водород или фтор;
R5 означает водород, фтор, хлор или метокси;
R6 означает С1-3алкил;
или его фармацевтически приемлемой соли, или гидрату, или сольвату.
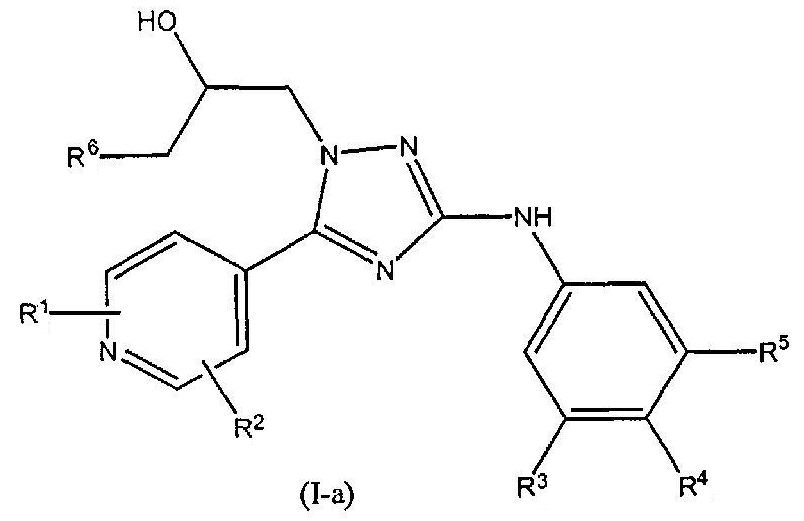
В первом варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I-a)
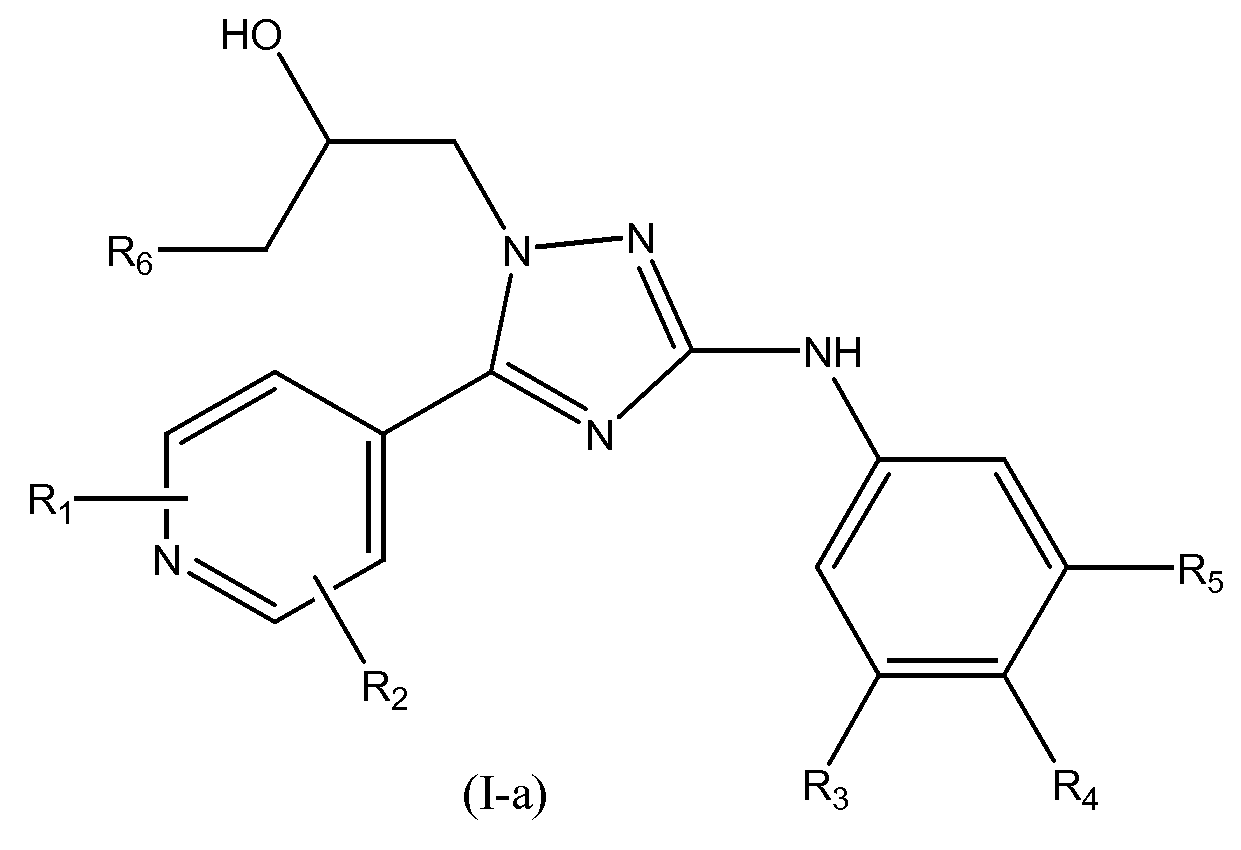
или к его стереоизомерной форме, где
R1 означает метил, этиламино или метоксиэтиламино;
R2 означает водород или метил;
R3 означает фтор, хлор, трифторметил или метил;
R4 означает водород или фтор;
R5 означает водород, фтор, хлор или метокси;
R6 означает С1-3алкил;
или его фармацевтически приемлемой соли, или гидрату, или сольвату.
Во втором варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I-a)
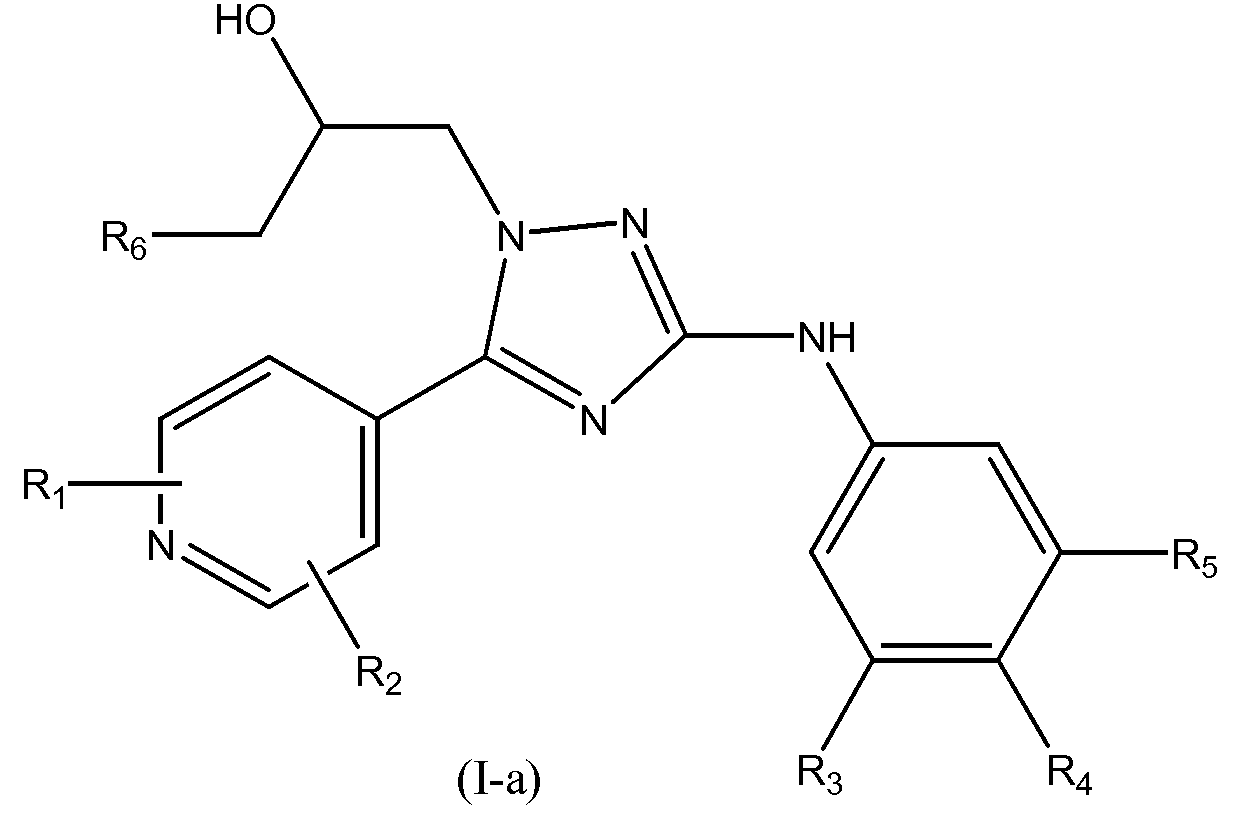
или к его стереоизомерной форме, где
R1 означает метил, этиламино или метоксиэтиламино;
R2 означает водород или метил;
R3 означает фтор, хлор, трифторметил или метил;
R4 означает водород или фтор;
R5 означает водород, фтор или метокси;
R6 означает С1-3алкил;
или его фармацевтически приемлемой соли, или гидрату, или сольвату.
В третьем варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I) или к его стереоизомерной форме, где
R1 означает 2-метил, 2-этиламино или 2-метоксиэтиламино;
R2 означает водород или 6-метил;
R3 означает фтор, хлор, трифторметил или метил;
R4 означает водород или фтор;
R5 означает водород, фтор, хлор или метокси;
R6 означает С1-3алкил;
или его фармацевтически приемлемой соли, или гидрату, или сольвату.
В четвертом варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I) или к его стереоизомерной форме, где
R1 означает 2-метил, 2-этиламино или 2-метоксиэтиламино;
R2 означает водород или 6-метил;
R3 означает фтор, хлор, трифторметил или метил;
R4 означает водород или фтор;
R5 означает водород, фтор, хлор или метокси;
R6 означает метил;
или его фармацевтически приемлемой соли, или гидрату, или сольвату.
В пятом варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I), имеющему полную R-конфигурацию.
В шестом варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I), имеющему полную S-конфигурацию.
В седьмом варианте осуществления настоящего изобретения изобретение относится к соединению формулы (I), имеющему R3-замещение в орто-положении фенильного кольца.
В восьмом варианте осуществления настоящего изобретения изобретение относится к соединению согласно любому из предыдущих вариантов, где
R5 означает водород, фтор или метокси.
В девятом варианте осуществления изобретения соединение формулы (I) выбирают из группы, состоящей из
(S)-1-[3-(3,4-дифторфениламино)-5-(2,6-диметилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола,
(R)-1-[3-(3-хлорфениламино)-5-(2-этиламинопиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[5-(2,6-диметилпиридин-4-ил)-3-(3-метокси-5-трифторметилфениламино)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[3-(3-фтор-5-метоксифениламино)-5-(2-метилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола HCl-соли,
(S)-1-[3-(3-фтор-5-метоксифениламино)-5-(2-метилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[5-(2,6-диметилпиридин-4-ил)-3-(3-фтор-5-метоксифениламино)-[1,2,4]триазол-1-ил]бутан-2-ола HCl-соли,
(S)-1-[5-(2,6-диметилпиридин-4-ил)-3-(3-фтор-5-метоксифениламино)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[3-(4-фтор-3-метилфениламино)-5-(2-метилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола,
включая их любую стереохимически изомерную форму,
и их фармацевтически приемлемых аддитивных солей и сольватов.
В десятом варианте осуществления изобретения соединение формулы (I) выбирают из группы, состоящей из
(S)-1-[5-(2-метилпиридин-4-ил)-3-(2,3,4-трифторфениламино)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[5-(2,6-диметилпиридин-4-ил)-3-(2,3,4-трифторфениламино)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[5-(2,6-диметилпиридин-4-ил)-3-(2,3,4-трифторфениламино)-[1,2,4]триазол-1-ил]бутан-2-ола HCl-соли,
(S)-1-[3-(3-хлор-2-фторфениламино)-5-(2,6-диметилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола,
(S)-1-[3-(3-хлор-2-фторфениламино)-5-(2,6-диметилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола HCl-соли,
включая их любую стереохимически изомерную форму,
и их фармацевтически приемлемых аддитивных солей и сольватов.
В другом варианте осуществления изобретения настоящее изобретение предпочтительно относится к (S)-1-[3-(3,4-дифторфениламино)-5-(2,6-диметилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-олу или (R)-1-[3-(3-хлорфениламино)-5-(2-этиламинопиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-олу.
Соединения формулы (I) и их аддитивные соли, гидраты и сольваты содержат один или более центров хиральности и существуют в виде стереохимически изомерных форм.
Термин “стереохимически изомерные формы”, используемый в описании, определяет все возможные стереоизомерные формы, в которых соединения формулы (I) и их аддитивные соли могут существовать. Если не указано иное, химическое обозначение соединений указывает на смесь всех возможных стереохимически изомерных форм, где указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры, в также каждую из индивидуальных изомерных форм формулы (I) и их соли, сольваты, в основном свободные, т.е. ассоциированные менее чем с 10%, предпочтительно менее чем с 5%, в частности менее чем с 2%, и наиболее предпочтительно менее чем с 1% других изомеров. Очевидно, стереохимически изомерные формы соединений формулы (I) предназначены быть включенными в объем настоящего изобретения.
Для терапевтического использования соли соединений формулы (I) являются такими солями, у которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, в получении или очистке фармацевтически приемлемого соединения. Все соли, являются ли они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения.
Фармацевтически приемлемые аддитивные соли кислоты и основания, представленные в описании, предназначены, чтобы включить типы терапевтически активных нетоксичных аддитивных солей кислоты и основания, которые соединения формулы (I) могут образовывать. Фармацевтически приемлемые кислотно-аддитивные соли могут быть получены подходящим образом путем обработки основной формы соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например хлористоводородная или бромистоводородная кислота, серная, азотная, фосфорная и тому подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и тому подобные кислоты. В свою очередь, указанные солевые формы могут быть превращены обработкой соответствующим основанием в свободную основную форму.
Термин «сольваты» относится к гидратам и алкоголятам, которые могут образовывать соединения формулы (I), а также их соли.
Некоторые из соединений формулы (I) также могут существовать в их таутомерной форме. Хотя такие формы прямо не указаны в представленной выше формуле, они предназначены быть включенными в объем настоящего изобретения.
Получение соединений
Соединение согласно изобретению обычно можно получать путем осуществления ряда последовательных стадий, каждая из которых известна специалисту в данной области. В частности, соединения в данной заявке на патент могут быть получены согласно одному или более следующим способам получения. На следующих схемах, и если не указано иное, все переменные элементы используют, как определено в формуле (I). L′ представляет собой радикал формулы
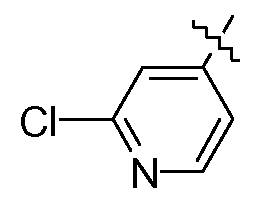 или
или 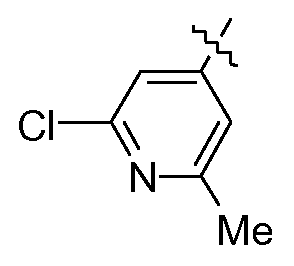 или
или 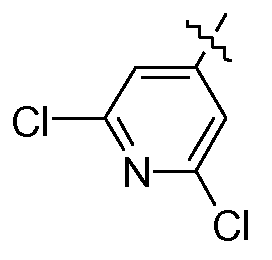
и Q представляет собой
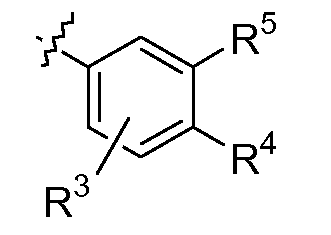
где R3, R4 и R5 являются такими, как определено выше.
Соединения согласно данному изобретению могут быть получены любым из нескольких стандартных способов синтеза, обычно используемых специалистами в области органической химии.
Схема 1
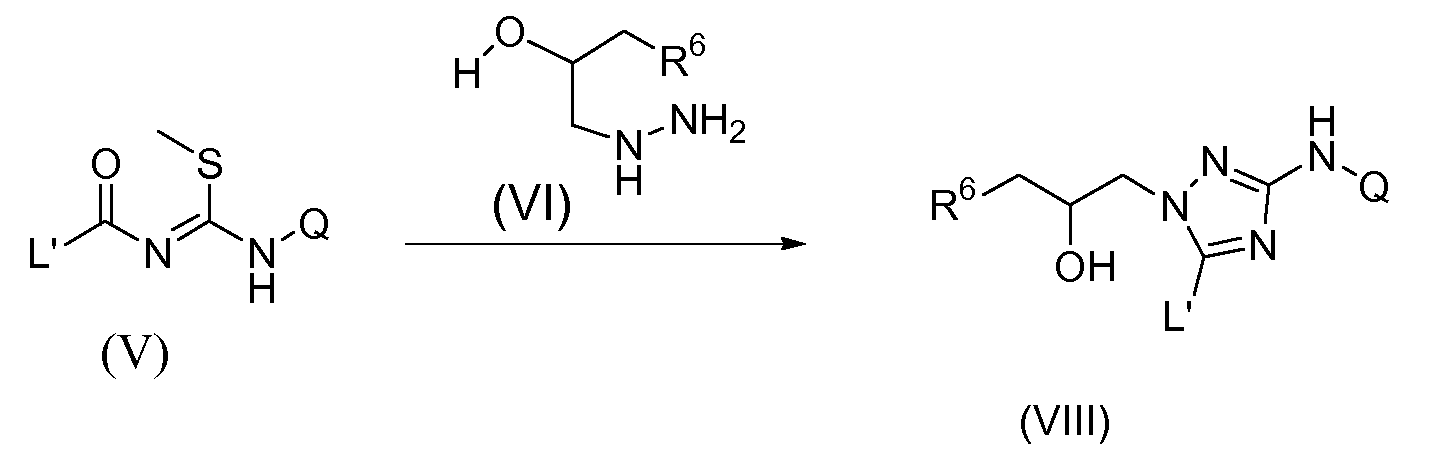
Значимые промежуточные соединения формулы (VIII) обычно можно получить согласно схеме 1 путем превращения N-ацил карбоимидотиокислоты, производного метилового эфира общей формулы (V), в 1,2,4-триазолы формулы (VIII), используя соответствующий гидразин (VI), при известных в данной области условиях. Данное превращение обычно осуществляют в протонном растворителе, таком как метанол или высший спирт, такой как, например, 2-метил-2-пропанол (t-BuOH), и для реакции требуется температура между комнатной температурой и 150°С. В отдельном варианте осуществления изобретения высшим спиртом является третичный бутиловый спирт и температура реакции составляет между 70°С и 120°С, наиболее предпочтительно 100°С. Для указанных реакций, где гидразин (VI) используют в виде HCl-соли, добавление стехиометрического количества основания является предпочтительным. Указанным основанием может быть неорганическое основание, такое как ацетат калия или карбонат калия, наиболее предпочтительно, однако, указанным основанием является третичный амин, такой как диизопропилэтиламин или тому подобное (схема 1). Все переменные элементы на схеме 1 являются такими, как определено выше.
Необязательно, свободная гидроксильная группа в промежуточных соединениях формулы (VIII) может быть защищена обычной защищающей группой (PG), обозначенной в описании (VIII-1), такой как, например, ацетильная группа. Указанный тип взаимодействия может быть осуществлен в присутствии этилацетата. Обычно катализатор, такой как, например, N,N-диметил-4-пиридинамин (DMAP), добавляют. Взаимодействие осуществляют при повышенной температуре, такой как, например, температура кипения с обратным холодильником.
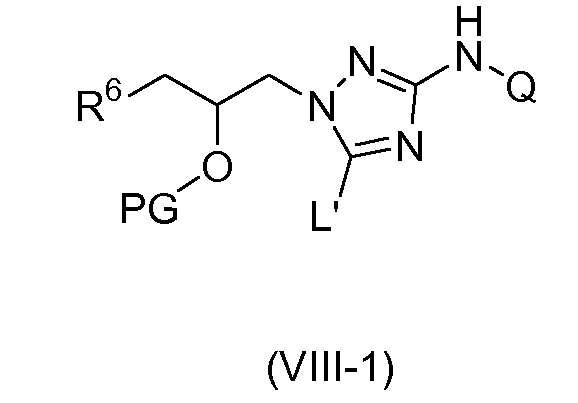
Схема 2
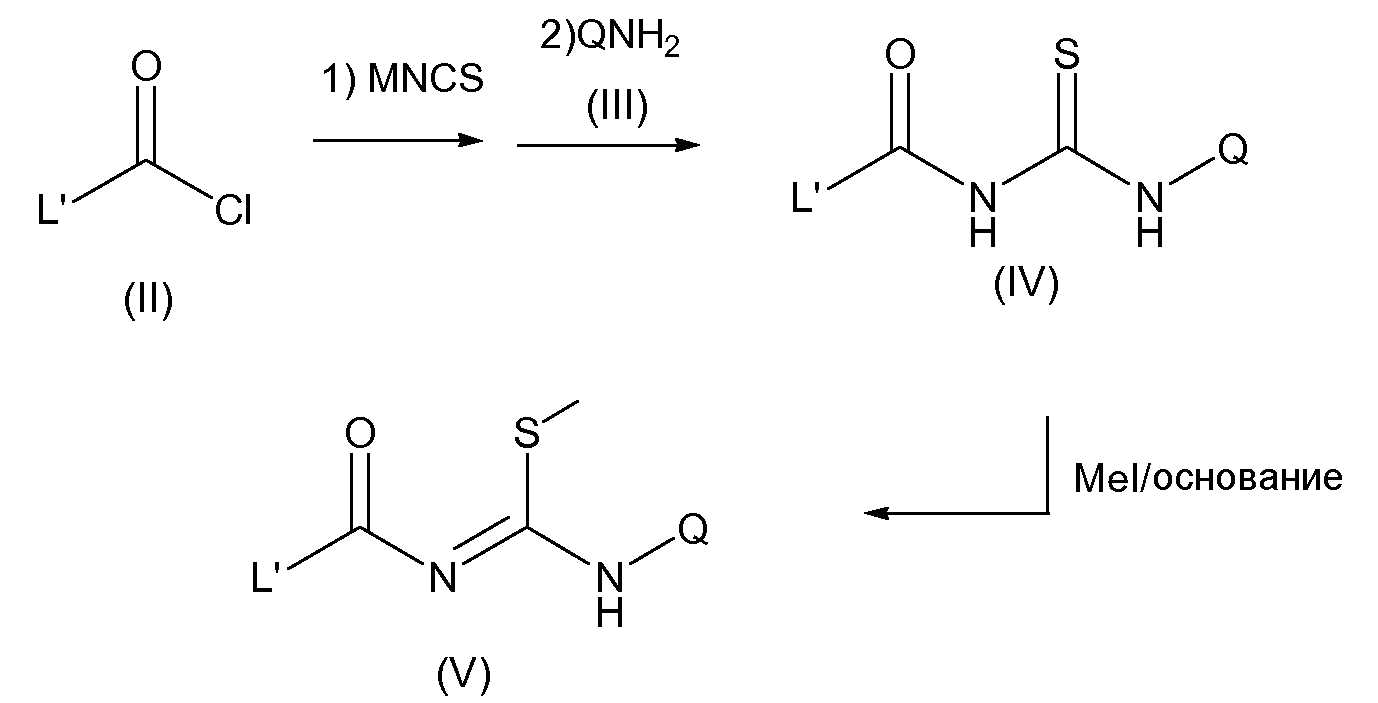
Общее промежуточное соединение (V) в синтезе тризамещенных триазолов согласно настоящему изобретению обычно получают по протоколу, состоящему из 3 синтетических превращений (схема 2), исходным соединением является ацилхлорид общей формулы (II).
На первой стадии ацилирующий реагент, такой как ацилхлорид (II), смешанный или симметричный ангидрид, ацилфторид или тому подобное, взаимодействует с тиоцианатом одновалентного металла-катиона (MNCS на схеме 2), таким как, например, тиоцианат калия или тиоцианат аммония, с получением соответствующего ацилизотиоцианата. Данное взаимодействие обычно осуществляют с использованием ацетона в качестве растворителя и при температуре между 0°С и 70°С, предпочтительно при комнатной температуре.
Промежуточное соединение ацилизотиоцианат не выделяют, а обрабатывают в такой же реакционной среде соответствующим анилином (III) с получением N-ацилтиомочевины общей формулы (IV). Указанное превращение обычно осуществляют при температуре между 0°С и 70°С, предпочтительно при комнатной температуре.
На последней стадии S-метилирование N-ацилтиомочевины (IV) приводит к N-ацилкарбоимидотиокислоте, производному метиловому эфиру общей формулы (V). Для данного конечного превращения требуется присутствие основания, предпочтительно сильного неорганического основания, такого как NaH или карбонат калия, и реакцию осуществляют в апротонном растворителе, таком как, например, ДМФ, ТГФ (тетрагидрофуран) или тому подобное, при температуре, колеблющейся от -70°С до комнатной температуры, предпочтительно 0°С (схема 2).
Схема 3
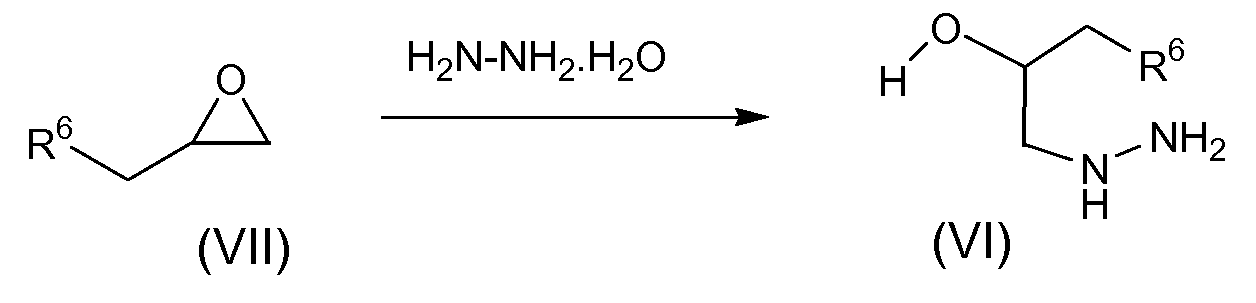
Спирты-гидразины общей формулы VI могут быть получены из монозамещенного оксирана общей формулы (VII) при нагревании в избытке гидрата гидразина (схема 3). Предпочтительно температура реакции составляет 40-70°С и время реакции составляет 2 часа. Если оксиран (VII) доступен в оптически чистом виде, образовавшийся в результате спирт-гидразин (VI) получают с соответствующей стереохимической идентичностью и чистотой, такой как, например, когда R6=метил. В других примерах в настоящем изобретении указанный выше оксиран (VII) доступен в виде рацемической смеси, и поэтому соответствующие промежуточные соединения и конечные продукты получают в виде рацемических смесей. В таком случае конечные продукты можно получать в энантиомерно чистом виде путем разделения рацемической смеси при использовании хиральной хроматографии. В отдельном варианте осуществления изобретения указанную хиральную хроматографию осуществляют со сверхкритической СО2 в качестве подвижной фазы.
Схема 4
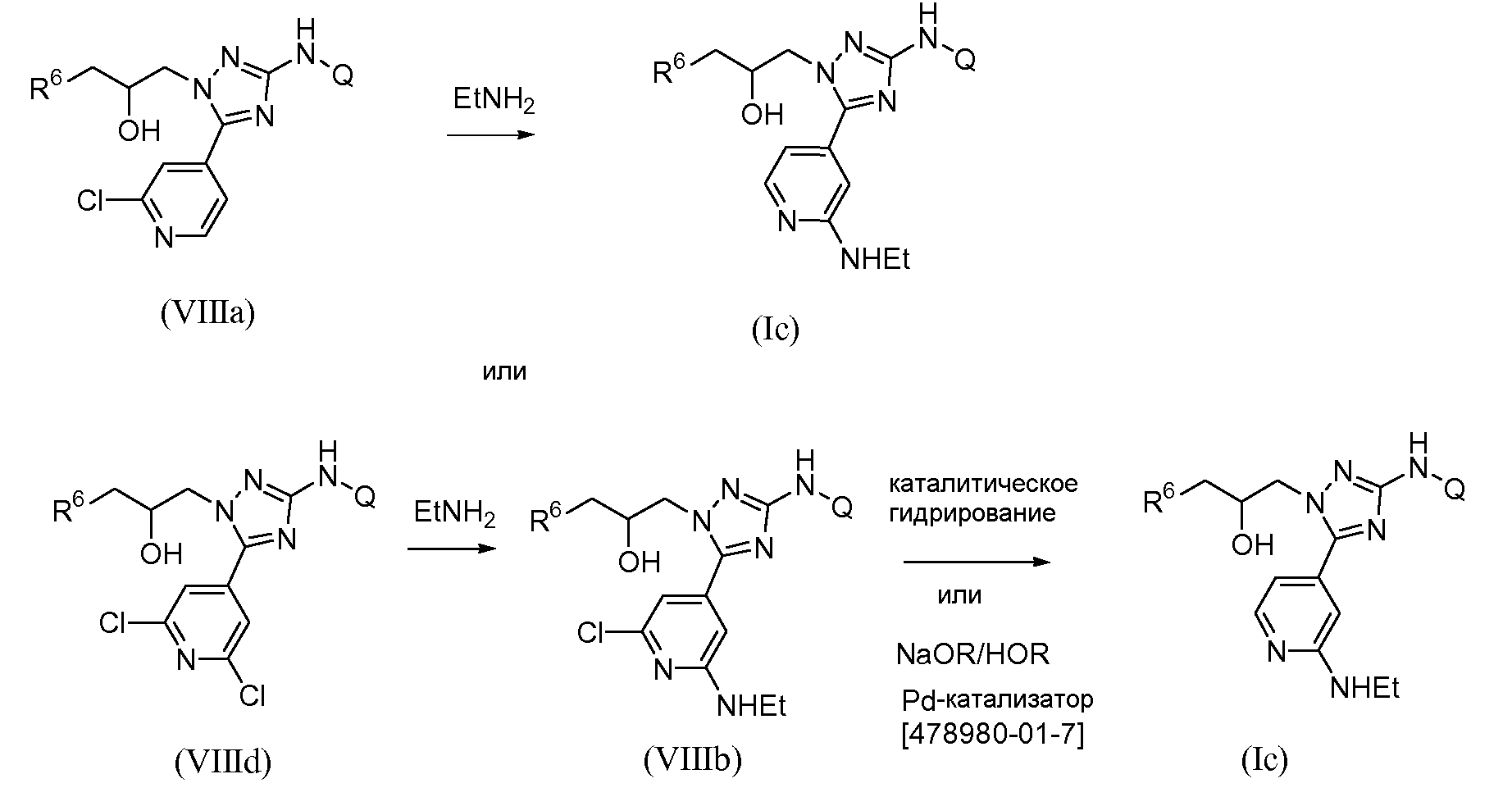
2-Этиламинопиридотриазол общей формулы (Ic) может быть получен путем обработки соответствующего хлорпиридильного предшественника (VIIIa) этиламином в спиртовом растворителе, таком как метанол или 1-бутанол или тому подобное, необязательно в присутствии сорастворителя, такого как ТГФ или тому подобное, и при нагревании при высоких температурах, предпочтительно в области между 140°С и 160°С, в микроволновой печи или при 160°С-180°С в автоклаве (схема 4). Указанное превращение может быть осуществлено в мягких условиях (более низкая температура, такая как между 100°С и 130°С) с использованием в качестве исходного соединения дихлорпиридильного соединения (VIIId) с получением промежуточного соединения общей формулы (VIIIb). Остающийся в (VIIIb) атом хлора может быть удален каталитически, в атмосфере водорода и с использованием Pd/C в качестве катализатора, в присутствии неорганического основания, такого как ацетат калия, или аминного основания, такого как триэтиламин, или тому подобное (схема 4). Альтернативно, когда заместитель Q содержит функциональности, которые несовместимы с условиями каталитического гидрирования, заданное соединение общей формулы (Ic) может быть получено из хлорпиридина общей формулы (VIIIb) путем обработки карбеноподобным катализатором, таким как Pd-катализатор [1,3-бис[2,6-бис(1-метилэтил)фенил]-2-имидазолидинилиден]хлор(η3-2-пропенил)палладий (CAS [478980-01-7]), в присутствии сильного основания, такого как метилат натрия, в протонном растворителе, таком как метанол или 2-пропанол, или тому подобное. Указанную реакцию можно осуществлять при повышенной температуре, такой как 100-120°С, в микроволновой печи (схема 4).
Схема 5
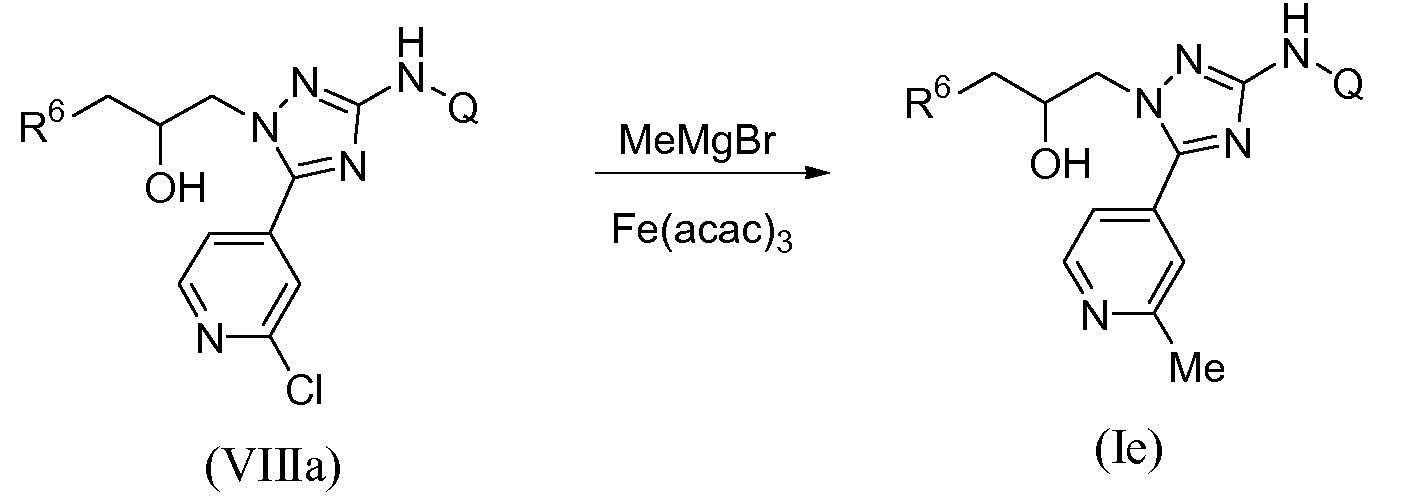
Монометилзамещенный пиридотриазол общей формулы (Ie) может быть получен путем обработки 2-хлорпиридильного предшественника (VIIIa) избытком (3-15 экв.) реагента Гриньяра MeMgBr в присутствии каталитического количества ацетилацетоната железа(III) в органическом растворителе или системе растворителей, состоящей из различных растворителей, такой как, например, смесь ТГФ/NMP. Обычные смеси ТГФ/NMP (1-метил-2-пирролидинон) содержат от 75% до 99% ТГФ и от 1% до 25% NMP по объему. Указанное превращение можно осуществлять в области температур между 0°С и 50°С, наиболее предпочтительно между 0°С и 25°С (схема 5).
Схема 6
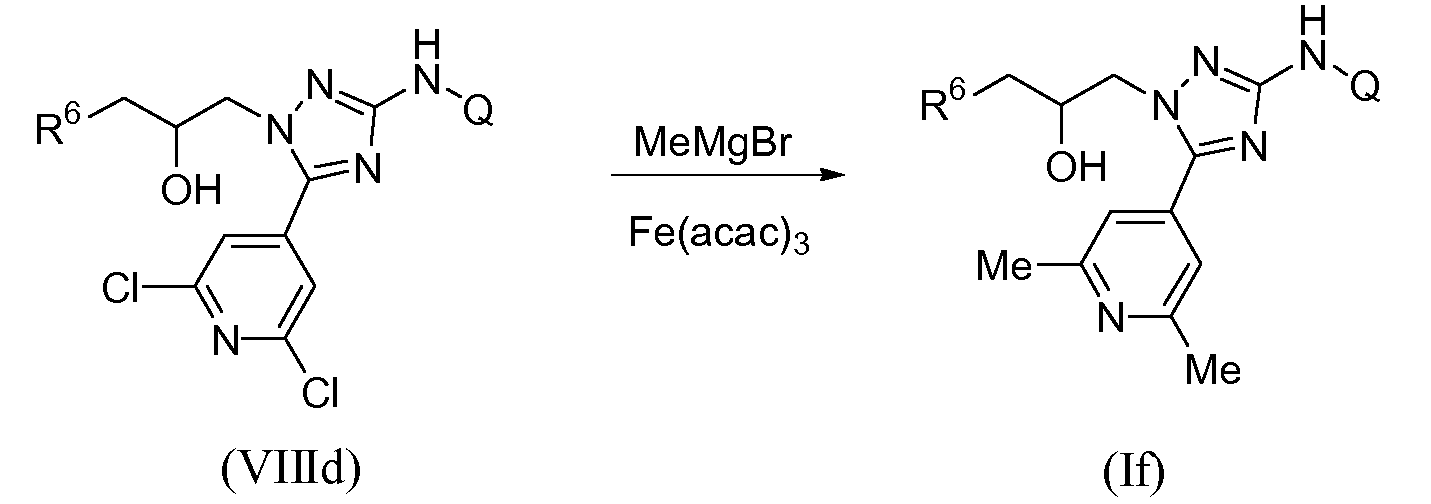
Диметилзамещенный пиридотриазол общей формулы (If) может быть получен путем обработки 2,6-дихлорпиридильного предшественника (VIIId) избытком (10-15 экв.) реагента Гриньяра MeMgBr в присутствии каталитического количества ацетилацетоната железа(III) в органическом растворителе или системе растворителей, состоящей из различных растворителей, такой как смесь ТГФ/NMP. Обычные смеси ТГФ/NMP (1-метил-2-пирролидинон) содержат от 75% до 99% ТГФ и от 1% до 25% NMP по объему. Указанное превращение можно осуществлять в области температур между 0°С и 50°С, наиболее предпочтительно между 0°С и 25°С (схема 6).
Схема 7
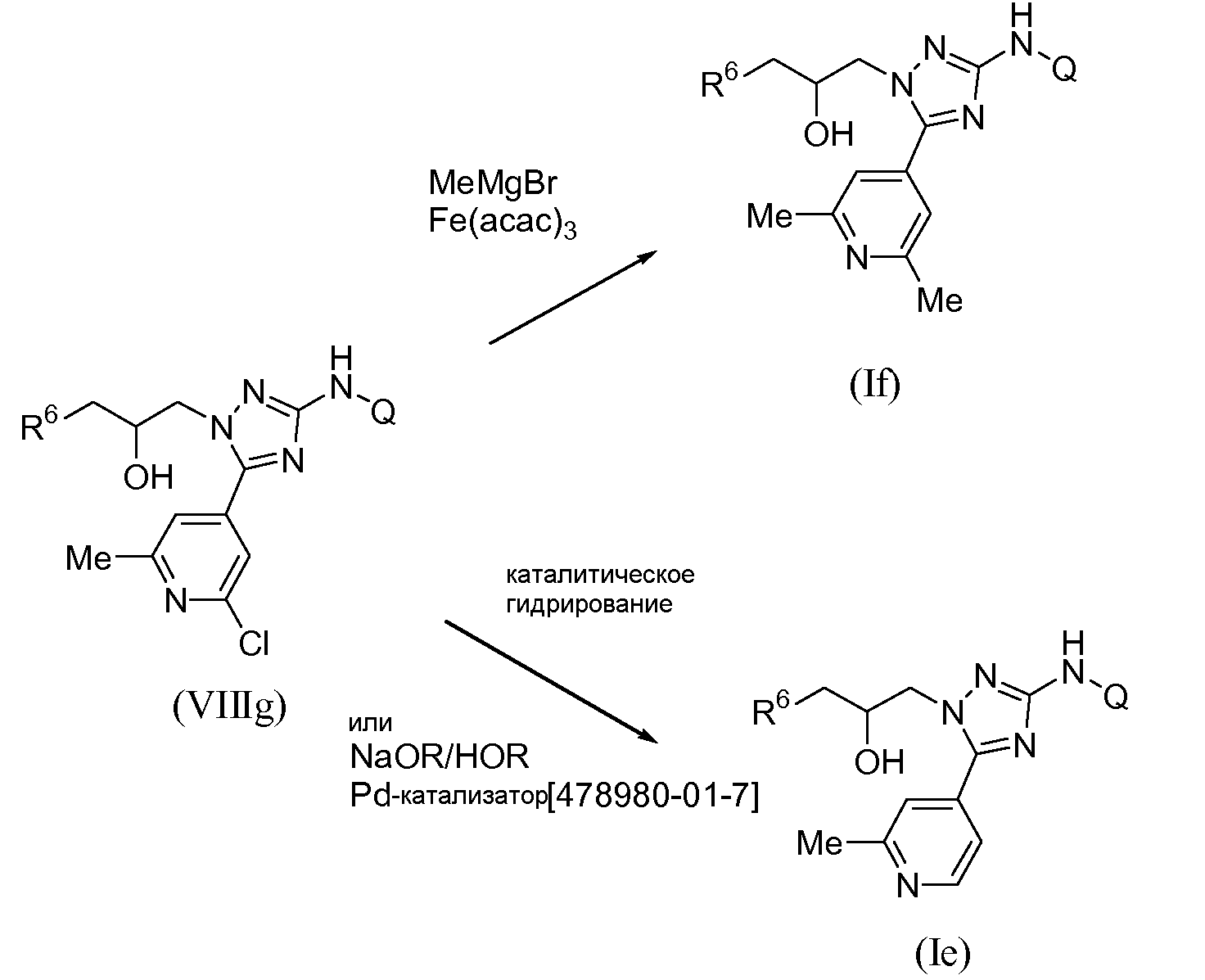
Альтернативно, монометилзамещенный пиридотриазол общей формулы (Ie) и диметилзамещенный пиридотриазол общей формулы (If) могут быть получены через общее промежуточное соединение (VIIIg) (схема 7). Реакция с реагентом Гриньяра MeMgBr, катализируемая ацетилацетонатом железа(III), при использовании описанных выше условий приводит к конечному соединению (If) (схема 7). При каталитическом гидрировании промежуточного соединения (VIIIg) с использованием известных в данной области условий, описанных выше, образуется конечное соединение (Ie). Альтернативно, когда заместитель Q содержит функциональности, которые несовместимы с условиями каталитического гидрирования, заданное соединение общей формулы (Ie) может быть получено из хлорпиридина общей формулы (VIIIg) путем обработки карбеноподобным катализатором, таким как Pd-катализатор [1,3-бис[2,6-бис(1-метилэтил)фенил]-2-имидазолидинилиден]хлор(η3-2-пропенил)палладий (CAS [478980-01-7]), в присутствии сильного основания, такого как метилат натрия, в протонном растворителе, таком как метанол или 2-пропанол, или тому подобное. Указанную реакцию можно осуществлять при повышенной температуре, такой как 100-120°С, в микроволновой печи.
В случае когда промежуточное соединение (VIIIg) имеет защищенную гидроксильную группу, такую как, например, ацетат, соединение общей формулы (If) может быть получено путем взаимодействия с реагентом Гриньяра MeMgBr, катализируемого ацетилацетонатом железа(III), в присутствии органического растворителя или смеси органических растворителей, такой как, например, смесь NMP и ТГФ. Для облегчения удаления защитной группы (такой как, например, ацетильная группа), к реакционной смеси необязательно можно добавлять основание, такое как, например, NaOH.
Фармакология
Соединения согласно настоящему изобретению, как было обнаружено, являются позитивными аллостерическими модуляторами α7-никотинового рецептора. Никотиновый рецептор α7 (α7-нАХР) принадлежит к суперсемейству “cys-петельных”, ионотропных, лиганд-управляемых ионных каналов, которое включает семейства рецепторов 5-НТ3, GABAA и глицина. Никотиновый рецептор α7 активируется ацетилхолином и его продуктом расщепления холином, и основной характеристикой α7-нАХР является его быстрая десенситизация при постоянном присутствии агониста. Он является вторым наиболее распространенным подтипом рецептора в головном мозге и важным регулятором высвобождения многих нейротрансмиттеров. Он имеет дискретное распределение в некоторых структурах головного мозга, значимых для процессов внимания и познания, таких как гиппокамп и префронтальная кора головного мозга, и связанных с рядом психических и неврологических нарушений у человека. Он также вовлечен в холинергический воспалительный путь.
Генетическое доказательство его связывания с шизофренией представлено в виде прочной связи между признаком шизофрении (нарушение сенсорного регулирования) и локусом α7 на 15q13-14 и полиморфизмами в сердцевинной области промотора гена α7.
Свидетельством патологического состояния является потеря иммунореактивности α7 и α-Btx-связывания в гиппокампе, фронтальной и поясной коре головного мозга при шизофрении, при болезни Паркинсона и болезни Альцгеймера и в паравентрикулярном ядре и соединяющем ядре (nucleus reuniens) при аутизме.
Фармакологические данные, такие как выраженная привычка к курению у больных шизофренией по сравнению с нормальными людьми, интерпретировались как попытка больных посредством самолечения добиться недостаточности никотинергической трансмиссии рецептора α7. Преходящая нормализация нарушений сенсорного регулирования (доимпульсивное подавление PPI) как в модели животных, так и в модели человека, при введении никотина и временном восстановлении нормального сенсорного регулирования у шизофреников, когда холинергическая активность переднего мозга низкая (например, стадия 2 сна), была интерпретирована как результат преходящей активации α7-никотинового рецептора после десенситизации.
Таким образом, имеется основание предположить, что активация α7-нАХР будет оказывать терапевтически благоприятные воздействия при ряде нарушений ЦНС (психических и неврологических).
Как уже упоминалось, α7-нАХР быстро снижает свою чувствительность при постоянном присутствии природного трансмиттера ацетилхолина, а также экзогенных лигандов, таких как никотин. В десенситизированном состоянии рецептор остается связанным с лигандом, но функционально неактивным. Такое состояние не представляет собой проблему для природных трансмиттеров, таких как ацетилхолин и холин, поскольку они являются субстратами для эффективных механизмов расщепления (ацетилхолинэстераза) и выведения (холиновый транспортер). Указанные механизмы расщепления/выведения трансмиттеров, вероятно, позволяют сохранить баланс между активируемым и десенситизированным α7-нАХР в физиологически эффективной области. Однако синтетические агонисты, которые не являются субстратами для природных механизмов расщепления и выведения, рассматриваются как проявляющие потенциальную способность как для повышенной стимуляции, так и направляющие равновесие популяции α7-нАХР в сторону постоянного десенситизированного состояния, которое является нежелательным при нарушениях, где недостаточность экспрессии и функции α7-нАХР играет некоторую роль. Агонисты по своей природе должны таргетировать связывающий карман АХ, который является высококонсервативным у различных подтипов никотиновых рецепторов, что приведет к возможным неблагоприятным реакциям в результате неспецифической активации других подтипов никотиновых рецепторов. Поэтому, чтобы избежать указанных возможных недостатков, альтернативной терапевтической стратегией относительно агонизма α7 является усиление реактивности рецептора по отношению к природным агонистам с помощью позитивных аллостерических модуляторов (РАМ). РАМ определяют как агент, который связывается с участком, отличным от участка связывания агониста, и поэтому не следует ожидать, что он проявит свойства агониста или десенситизации, но он усиливает реактивность 7α-нАХР по отношению к природному трансмиттеру. Значение указанной стратегии заключается в том, что для заданного количества трансмиттера величина ответа α7-нАХР увеличивается в присутствии РАМ относительно уровня трансмиссии, возможной в его отсутствие. Что касается нарушений, при которых существует недостаток белка α7-нАХР, РАМ-индуцированное повышение трансмиссии никотинового холинергического рецептора α7 может оказаться благоприятным. Поскольку РАМ зависит от присутствия природного трансмиттера, возможность повышенной стимуляции ограничивается механизмами расщепления/выведения для природного трансмиттера.
Соединения согласно настоящему изобретению классифицируют как тип 1-4 на основании качественных кинетических характеристик, которые определяют методом фиксации напряжения целой клетки. Данная классификация основана на влиянии РАМ-соединения рецептора α7, как описано выше, на сигнал, вызванный используемым агонистом. В частности, указанным выше агонистом является холин при концентрации 1 мМ. В предпочтительных экспериментальных условиях указанные выше РАМ-соединение рецептора α7 и холин одновременно применяют к клетке, как представлено в описании ниже. Десенситизацию определяют как закрытие рецептора при активации в течение действия агониста применяемым в электрофизиологии методом фиксации напряжения целой клетки, о чем свидетельствует снижение уровня выходящего тока после первоначальной активации агонистом.
Определение типов РАМ 1-4 описано ниже:
|
Таким образом, целью настоящего изобретения является предоставление способов лечения, которые включают введение либо позитивного аллостерического модулятора как единственного активного вещества, модулирующего активность эндогенных агонистов никотинового рецептора, таких как ацетилхолин или холин, либо введение позитивного аллостерического модулятора вместе с агонистом никотинового рецептора. В отдельном виде этого аспекта изобретения способ лечения включает лечение позитивным аллостерическим модулятором никотинового рецептора α7, как представлено в описании, и агонистом никотинового рецептора α7 или частичным агонистом. Примеры подходящих соединений с агонистической активностью никотинового рецептора α7 включают, но не ограничиваются ими:
- 1,4-диазабицикло[3.2.2]нонан-4-карбоновой кислоты 4-бромфениловый эфир моногидрохлорид (SSR180711A);
- (-)-спиро[1-азабицикло[2.2.2]октан-3,5′-оксазолидин]-2′-он;
- 3-[(2,4-диметокси)бензилиден]анабазеина дигидрохлорид (GTS-21);
- [N-[(3R)-1-азабицикло[2.2.2]окт-3-ил]-4-хлорбензамида гидрохлорид] (PNU-282987).
Положительные модуляторы нАХР согласно настоящему изобретению пригодны для лечения или профилактики психических расстройств, нарушений умственных способностей или заболеваний или состояний, при которых модуляция активности никотинового рецептора α7 является благотворной. Отдельный аспект способа изобретения составляет способ лечения дефицита научения, нарушения познавательной способности, расстройства внимания или потери памяти, модуляция активности никотинового рецептора α7, как предполагается, окажет благоприятный эффект в ряде заболеваний, включающих болезнь Альцгеймера, деменцию, развивающуюся при болезни диффузных телец Леви, синдром гиперактивности с дефицитом внимания, тревогу, шизофрению, маниакальный синдром, биполярную депрессию, болезнь Паркинсона, болезнь Гентингтона, синдром Жиля де ля Туретта, травму головного мозга или другие неврологические, дегенеративные или психические расстройства, при которых происходит потеря холинергических синапсов, включающие синдром смены часовых поясов, пристрастие к никотину, боль.
Соединения также могут найти терапевтическое использование в качестве противовоспалительных лекарственных средств, поскольку субъединица никотинового ацетилхолинового рецептора α7 является существенной для ингибирования цитокинового синтеза по холинергическому воспалительному пути. Примерами медицинских показаний, которые можно лечить соединениями, являются эндотоксемия, эндотоксический шок, сепсис, ревматоидный артрит, астма, рассеянный склероз, воспалительное заболевание кишечника, воспалительное заболевание желчного пузыря, болезнь Крона, панкреатит, сердечная недостаточность и отторжение аллотрансплантата.
Исходя из описанных выше фармакологических свойств соединения формулы (I) или любая их подгруппа, их фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы могут быть использованы в качестве лекарственного средства.
Исходя из описанных выше фармакологических свойств соединения формулы (I) или любая их подгруппа, их фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы могут быть использованы в лечении или предотвращении психических расстройств, нарушений умственных способностей, воспалительных заболеваний или состояний, при которых модуляция никотинового рецептора α7 оказывает благоприятное действие.
Исходя из описанных выше фармакологических свойств соединения согласно настоящему изобретению могут быть использованы для производства лекарственного средства для лечения или профилактики психических расстройств, нарушений умственных способностей, воспалительных заболеваний или состояний, при которых модуляция никотинового рецептора α7 оказывает благоприятное действие.
С учетом полезности соединений формулы (I) предоставляется способ лечения теплокровных животных, включающих человека, страдающих от заболеваний, или способ предотвращения теплокровных животных, включающих человека, от заболеваний, при которых модуляция никотинового рецептора α7 оказывает благоприятный эффект, таких заболеваний, как шизофрения, маниакальный синдром и биполярная депрессия, тревога, болезнь Альцгеймера, дефицит научения, нарушение познавательной способности, расстройство внимания, потеря памяти, деменция, развивающаяся при болезни диффузных телец Леви, синдром гиперактивности с дефицитом внимания, болезнь Паркинсона, болезнь Гентингтона, синдром Жиля де ля Туретта, травма головного мозга, синдром смены часовых поясов, пристрастие к никотину и боль. Указанные выше способы включают введение, т.е. системное или местное введение, предпочтительно пероральное введение, эффективного количества соединения формулы (I), включая все его стереохимически изомерные формы, его фармацевтически приемлемую аддитивную соль, сольват или гидрат, теплокровным животным, включающим человека.
Специалист в данной области должен признать, что терапевтически эффективным количеством РАМ согласно настоящему изобретению является количество, достаточное для модуляции активности никотинового рецептора α7, и что указанное количество изменяется inter alia в зависимости от типа заболевания, концентрации соединения в терапевтическом препарате и состояния больного. В большинстве случаев количество РАМ, которое должно вводиться в качестве терапевтического средства для лечения заболеваний, при которых модуляция никотинового рецептора α7 оказывает благоприятный эффект, таких как шизофрения, маниакальный синдром и биполярная депрессия, тревога, болезнь Альцгеймера, дефицит научения, нарушение познавательной способности, расстройство внимания, потеря памяти, деменция, развивающаяся при болезни диффузных телец Леви, синдром гиперактивности с дефицитом внимания, болезнь Паркинсона, болезнь Гентингтона, синдром Жиля де ля Туретта, травма головного мозга, синдром смены часовых поясов, пристрастие к никотину и боль, будет определять лечащий врач отдельно для каждого случая.
Вообще подходящей дозой является доза, которая приводит к концентрации РАМ в месте воздействия в области от 0,5 нМ до 200 мкМ и более предпочтительно от 5 нМ до 50 мкМ. Для того чтобы достичь таких воздействующих концентраций, больному, нуждающемуся в лечении, вероятно, будут вводить от 0,005 мг/кг до 10 мг/кг массы тела, в частности от 0,1 мг/кг до 0,50 мг/кг массы тела. Количество соединения согласно настоящему изобретению, также названного в описании как активный ингредиент, требуемое для достижения терапевтического эффекта, как известно, будет различаться в зависимости от случая к случаю, различаться в зависимости от отдельного соединения, способа введения, возраста и состояния реципиента и отдельного нарушения или заболевания, подвергаемого лечению. Способ лечения также может включать введение активного ингредиента по схеме между одним и четырьмя введениями в день. В указанных способах лечения соединения согласно изобретению предпочтительно приготавливают до приема. Как описано ниже, подходящие фармацевтические препараты приготавливают известными способами, используя хорошо известные и легко доступные ингредиенты.
Настоящее изобретение также предоставляет соединения для предотвращения или лечения заболеваний, при которых модуляция никотинового рецептора α7 оказывает благоприятный эффект, таких как шизофрения, маниакальный синдром и биполярная депрессия, тревога, болезнь Альцгеймера, дефицит научения, нарушение познавательной способности, расстройство внимания, потеря памяти, деменция, развивающаяся при болезни диффузных телец Леви, синдром гиперактивности с дефицитом внимания, болезнь Паркинсона, болезнь Гентингтона, синдром Жиля де ля Туретта, травма головного мозга, синдром смены часовых поясов, пристрастие к никотину и боль. Указанные соединения, содержащие терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель или разбавитель.
Хотя возможно вводить активный ингредиент отдельно, предпочтительно представлять его в виде фармацевтической композиции. Таким образом, настоящее изобретение также предоставляет фармацевтическую композицию, содержащую соединение согласно настоящему изобретению вместе с фармацевтически приемлемым носителем или разбавителем. Носитель или разбавитель должен быть “приемлемым”, в смысле быть совместимым с другими ингредиентами композиции и не оказывать неблагоприятное воздействие на реципиентов.
Фармацевтические композиции согласно данному изобретению могут быть приготовлены любыми способами, хорошо известными в области фармации, например такими способами, которые описаны в публикации Gennaro et al., Remington′s Pharmaceutical Sciences (18th ed., Mack Publishing Company, 1990, см. особенно Часть 8: Pharmaceutical preparations and their Manufacture). Терапевтически эффективное количество отдельного соединения в виде основания или аддитивной соли как активного ингредиента объединяют в виде однородной смеси с фармацевтически приемлемым носителем, который может находиться в различных видах в зависимости от формы препарата, желаемой для введения. Указанные фармацевтические композиции желательны в стандартных лекарственных формах, предпочтительно для системного введения, такого как пероральное, чрескожное или парентеральное введение; или местное введение, такое как посредством ингаляции, назального спрея, глазных капель или посредством крема, геля, шампуня или тому подобного. Например, при приготовлении композиций в пероральной дозированной форме любые из фармацевтических сред могут быть использованы, такие как, например, вода, гликоли, масла, спирты и тому подобное в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связывающие вещества, дезинтегрирующие средства и тому подобное в случае порошков, пилюль, капсул и таблеток. Ввиду легкости введения таблетки и капсулы представляют собой самую эффективную пероральную стандартную лекарственную форму, в случае которой, безусловно, используют твердые фармацевтические носители. Для парентеральных композиций носитель будет обычно включать стерилизованную воду, по меньшей мере, по большей части, хотя другие ингредиенты, например способствующие растворимости, могут быть включены. Например, могут быть приготовлены инъецируемые растворы, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть приготовлены инъецируемые суспензии, в случае которых могут быть использованы соответствующие жидкие носители, суспендирующие средства и тому подобное. В композициях, подходящих для чрескожного введения, носитель необязательно включает усиливающее проникновение средство и/или подходящее смачиваемое средство, необязательно объединенное с подходящими добавками любой природы в небольших пропорциях, причем добавки не вызывают каких-либо существенных неблагоприятных воздействий на кожу. Указанные выше добавки могут облегчить введение к коже и/или могут быть полезными для приготовления желаемых композиций. Указанные композиции могут быть введены различными путями, например в виде трансдермального пластыря, в виде попадающего в самую точку средства или в виде мази.
Особенно благоприятно приготовление фармацевтических композиций в стандартной лекарственной форме для легкости введения и однородности дозировки. Стандартная лекарственная форма, как используют в описании и формуле изобретения, относится к физически дискретным единицам, подходящим как однократные дозировки, каждая единица содержит предопределенное количество активного ингредиента, рассчитанное для достижения желаемого терапевтического эффекта, в ассоциации с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включающие делимые или покрытые оболочкой таблетки), капсулы, пилюли, пакетики с порошком, облатки, инъецируемые растворы или суспензии, чайные ложки (какой-либо жидкости или сыпучего вещества), столовые ложки (какой-либо жидкости или сыпучего вещества) и тому подобное и их отдельные кратные единицы.
Соединения согласно настоящему изобретению могут быть использованы для системного введения, такого как пероральное, чрескожное или парентеральное введение; или местное введение, такое как посредством ингаляции, назального спрея, глазных капель или посредством крема, геля, шампуня или тому подобного. Соединения предпочтительно вводят перорально. Точная дозировка и частота введения зависят от отдельного используемого соединения формулы (I), отдельного состояния, подвергаемого лечению, тяжести состояния, подвергаемого лечению, возраста, массы тела, пола, степени нарушения и общего физического состояния отдельного больного, а также другого лекарственного препарата, хорошо известного специалисту в данной области, который индивидуум может принимать. Кроме того, очевидно, что указанное эффективное суточное количество может быть уменьшено или увеличено в зависимости от восприимчивости субъекта, подвергаемого лечению, и/или в зависимости от оценки врача, предписывающего соединения согласно настоящему изобретению.
Соединения формулы (I) также могут быть использованы в комбинации с другими обычными агонистами никотинового рецептора α7, такими как, например, 1,4-диазабицикло[3.2.2]нонан-4-карбоновой кислоты 4-бромфениловый эфир моногидрохлорид (SSR180711A); (-)-спиро[1-азабицикло[2.2.2]октан-3,5′-оксазолидин]-2′-он; 3-[(2,4-диметокси)бензилиден]анабазеина дигидрохлорид (GTS-21) или [N-[(3R)-1-азабицикло[2.2.2]окт-3-ил]-4-хлорбензамида гидрохлорид] (PNU-282987). Таким образом, настоящее изобретение также относится к комбинации соединения формулы (I) и агониста никотинового рецептора α7. Указанная комбинация может быть использована в качестве лекарственного средства. Настоящее изобретение также относится к продукту, включающему (а) соединение формулы (I) и (b) агонист никотинового рецептора α7, в качестве комбинированного препарата для одновременного, раздельного или последовательного использования в лечении заболеваний, где модуляция никотинового рецептора α7 оказывает благоприятное действие. Различные лекарственные средства могут быть комбинированы в одном препарате вместе с фармацевтически приемлемыми носителями.
Экспериментальная часть
Химия
Некоторые способы получения соединений согласно данному изобретению иллюстрированы в следующих примерах. Если не указано иное, все исходные материалы получены от частных поставщиков и использованы без дальнейшей очистки.
В описании после и до “ТГФ” означает тетрагидрофуран; “EtOAc” означает этилацетат; “DIPE” означает диизопропиловый эфир; “ДМФ” означает N,N-диметилформамид; “NPM” означает 1-метил-2-пирролидинон; “q.s.” означает “сколько нужно”, “I.D.” означает внутренний диаметр и “t-BuOH” означает 2-метил-2-пропанол.
Реакции, осуществляемые под действием микроволнового излучения, проводили в одномодовом реакторе: InitiatorTM Sixty EXP microwave reactor (Biotage AB), или в мультимодовом реакторе: MicroSYNTH Labstation (Milestone, Inc.).
Аналитические данные представлены в части С.
А. Получение промежуточных соединений
Описание 1
1-(2-Хлор-6-метилпиридин-4-карбонил)-3-(3,4-дифторфенил)тиомочевина (D1)
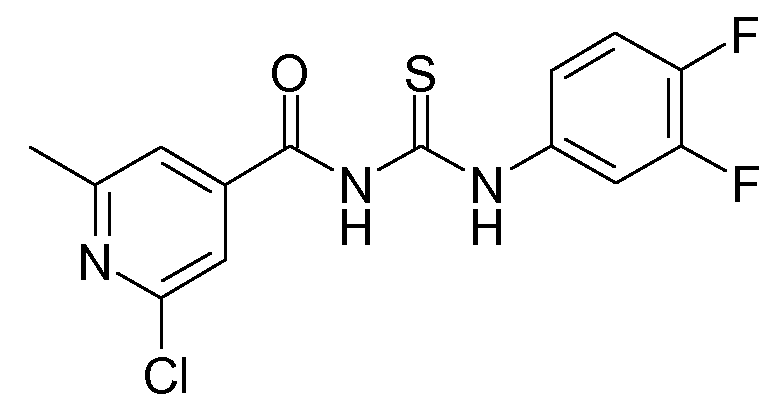
Аммониевую соль тиоциановой кислоты (10,6 г) добавляли к смеси 2-хлор-6-метил-4-пиридинкарбонилхлорида (22,04 г; 116 ммоль) и ацетона (400 мл). Реакционную смесь перемешивали в течение 30 минут и затем 3,4-дифторбензоламин (14,98 г; 116 ммоль) медленно добавляли через дополнительную воронку. Образовавшийся раствор перемешивали в течение 2 часов, реакцию гасили водой (100 мл) и затем реакционную смесь экстрагировали CH2Cl2 (3×100 мл). Объединенную органическую фазу сушили над MgSO4, фильтровали и растворитель упаривали в вакууме. Выход: 38,1 г промежуточного соединения D1.
Описание 2
1-(2-Хлор-6-метилпиридин-4-карбонил)-3-(3,4-дифторфенил)-2-метилизотиомочевина (D2)
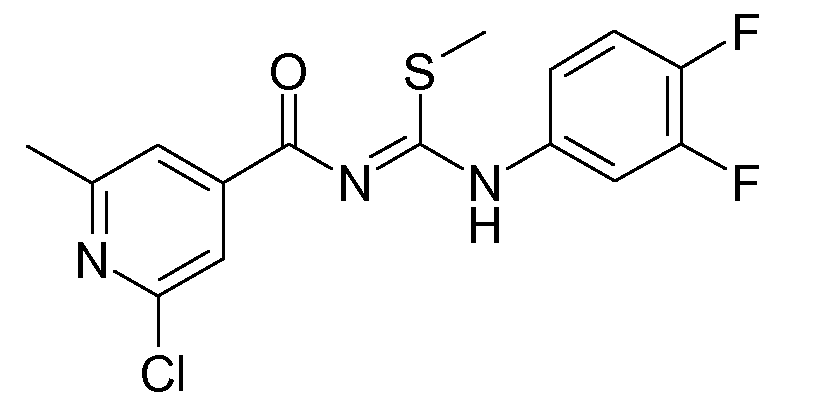
Осторожно добавляли смесь промежуточного соединения D1 (38 г; 111,4 ммоль) в ТГФ (400 мл), охлаждали до 0°С, и NaH (60% чистота) (6,7 г; 167 ммоль). Реакционную смесь перемешивали в течение 15 минут и затем добавляли CH3I (14,2 г; 100 ммоль). Затем смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. Реакцию гасили добавлением воды и затем смесь экстрагировали CH2Cl2 (3×100 мл). Объединенный органический раствор промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и растворитель упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (градиент: гептан/EtOAc от 80/20 до 50/50). Выход: 22,2 г промежуточного соединения D2.
Описание 3
(S)-1-Гидразинобутан-2-ол (D3)
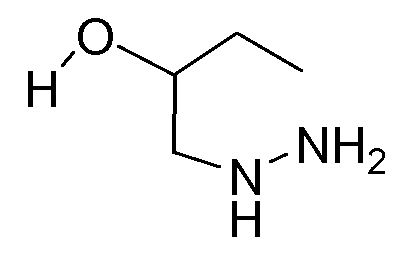
(2-S) 2-этилоксиран (15 г; 208 ммоль) растворяли в гидразине, 64% (42 г; 832 ммоль). Реакционную смесь перемешивали при 50°С в течение 2 часов и затем упаривали в вытяжном шкафу на водяной бане при 50°С. Ксилол добавляли (×2), чтобы удалить упариванием избыточное количество гидразина из сырой реакционной смеси. Выход: 18,9 г промежуточного соединения D3 (белое твердое вещество; S-энантиомер).
Описание 4
(S)-1-[5-(2-Хлор-6-метилпиридин-4-ил)-3-(3,4-дифторфениламино)-[1,2,4]триазол-1-ил]бутан-2-ол (D4)
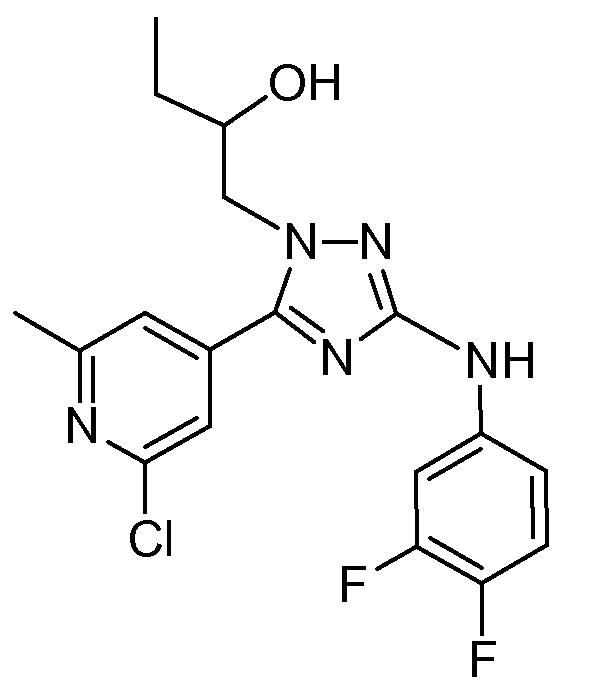
Промежуточное соединение D2 (1 г; 2,81 ммоль) растворяли в t-BuOH (40 мл) и затем добавляли промежуточное соединение D3 (0,44 г; 4,22 ммоль). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 4 часов и затем растворитель упаривали. Остаток очищали колоночной хроматографией на силикагеле (градиент: CH2Cl2/10% CH3OH в CH2Cl2, от 100/0 до 0/100). Выход: 1,1 г промежуточного соединения D4 (S-энантиомер).
Описание 5
1-(2-Хлор-6-метилпиридин-4-карбонил)-3-(3-метокси-5-трифторметилфенил)тиомочевина (D5)
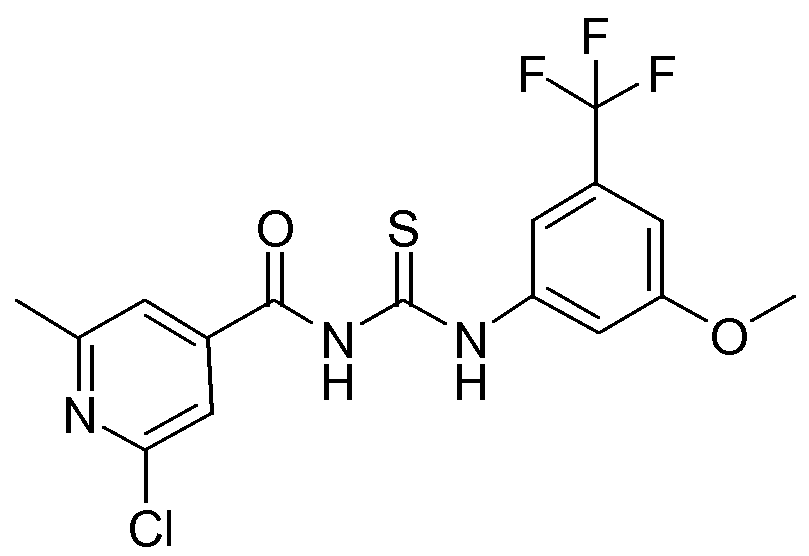
Тиоцианат натрия (6,998 г, 0,08632 моль) добавляли к раствору 2-хлор-6-метил-4-пиридинкарбонилхлорида (14,912 г, 0,078472 моль) в ацетоне (2 л). Образовавшуюся смесь перемешивали в течение 1 часа при комнатной температуре (образование коричневого осадка). Далее, 3-метокси-5-трифторметилбензоламин (15 г, 0,078472 моль) добавляли по каплям и реакционную смесь перемешивали в течение 2 часов при комнатной температуре (коричневый осадок). Смесь растворяли в CH2Cl2 (1,5 л) и затем промывали 2×250 мл водой и насыщенным раствором соли. Отделенный органический слой упаривали и остаток растирали в течение ночи в смеси DIPE/гептан. Продукт отфильтровывали и сушили в вакууме. Выход: 21,32 г промежуточного соединения D5 (67%).
Описание 6
1-(2-Хлор-6-метилпиридин-4-карбонил)-3-(3-метокси-5-трифторметилфенил)-2-метилизотиомочевина (D6)
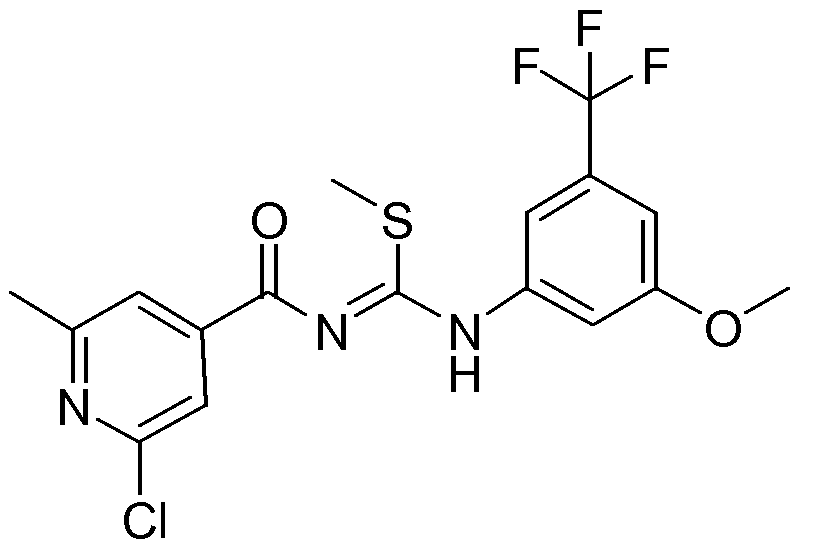
(Реакцию осуществляли в атмосфере N2)
NaH (1,267 г, 0,05279 моль) добавляли порциями к охлажденному на льду раствору промежуточного соединения D5 (21,32 г, 0,05279 моль) в ТГФ (480 мл) и образовавшуюся смесь перемешивали в течение 15 минут при 0°С. Далее добавляли по каплям раствор CH3I (7,493 г, 0,05279 моль) в ТГФ (40 мл) и смесь перемешивали в течение 2 часов при комнатной температуре. Затем реакцию гасили Н2О и смесь экстрагировали CH2Cl2 (3×500 мл). Органические слои разделяли, объединяли, промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и растворитель упаривали в вакууме. Сырой продукт растирали в смеси DIPE/гептан. Не совсем белое твердое вещество отфильтровывали и сушили с получением 16,203 г промежуточного соединения D6 (73,5%). Гептан и H2O добавляли к фильтрату и полученную смесь перемешивали в течение ночи при комнатной температуре. Осадок не совсем белого цвета отфильтровывали и сушили с получением дополнительного количества (1,957 г) промежуточного соединения D6 (9%).
Описание 7
(S)-1-[5-(2-Хлор-6-метилпиридин-4-ил)-3-(3-метокси-5-трифторметилфениламино)-[1,2,4]триазол-1-ил]бутан-2-ол (D7)
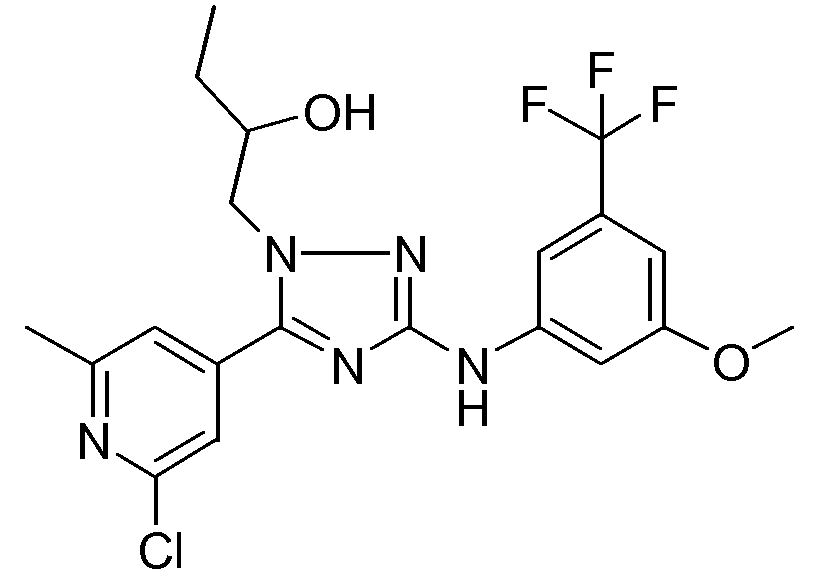
Смесь промежуточного соединения D6 (8,356 г, 0,020 моль) и промежуточного соединения D3 (2,083 г, 0,020 моль) в этаноле (200 мл) перемешивали в течение ночи при кипячении с обратным холодильником. Далее растворитель упаривали с получением промежуточного соединения D7 (S-энантиомер) в виде желтого масла, которое использовали как таковое на следующей стадии реакции.
Описание 8
(S)-1-[5-(2-хлор-6-метилпиридин-4-ил)-3-(3-метокси-5-трифторметилфениламино)-[1,2,4]триазол-1-илметил]пропиловый эфир уксусной кислоты (D8)
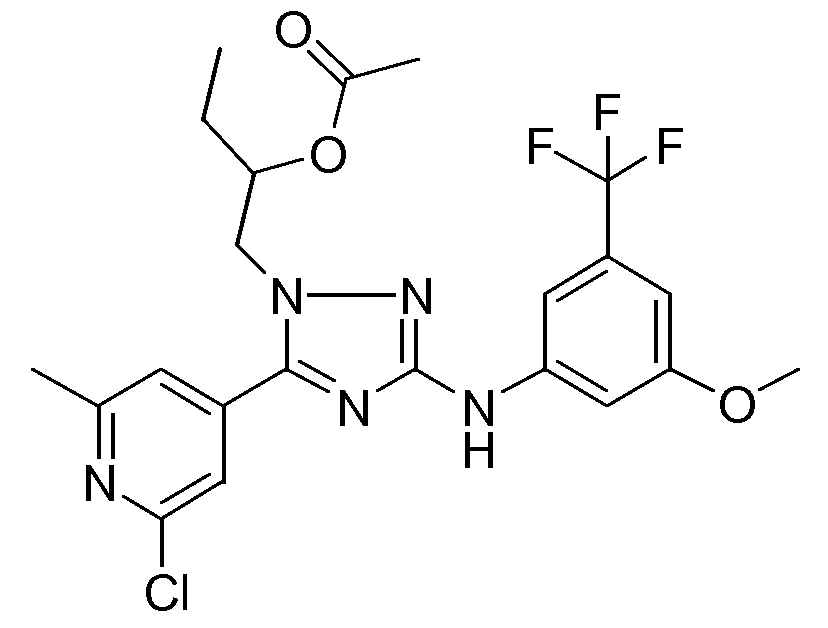
N,N-Диметил-4-пиридинамин (0,1222 г, 0,001 моль) добавляли к раствору промежуточного соединения D7 (9,117 г, 0,020 моль) в этилацетате (378 мл). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 30 минут. Далее смесь охлаждали до комнатной температуры и растворитель упаривали в вакууме. Остаток растворяли в CH2Cl2. Полученный органический раствор промывали насыщенным раствором бикарбоната натрия, промывали насыщенным раствором соли и затем сушили (MgSO4), фильтровали и растворитель упаривали в вакууме. Полученное желтое масло очищали высокоэффективной жидкостной хроматографией с обращенной фазой (Shandon Hyperprep® C18 BDS (Base Deactivated Silica) 8 мкм, 250 г, I.D. 5 см). Градиент с 3 подвижными фазами использовали. Фаза А: 0,25% раствор NH4HCO3 в воде; фаза B: метанол; фаза C: CH3CN). Желаемые фракции собирали. Растворитель упаривали и совместно упаривали с метанолом. Продукт кристаллизовали из смеси DIPE/гептан. Белые кристаллы отфильтровывали и сушили в вакууме. Выход: 3,677 г промежуточного соединения D8 (37%; S-энантиомер).
Описание 9
1-(2,6-Дихлорпиридин-4-карбонил)-3-(2,3,4-трифторфенил)тиомочевина (D9)
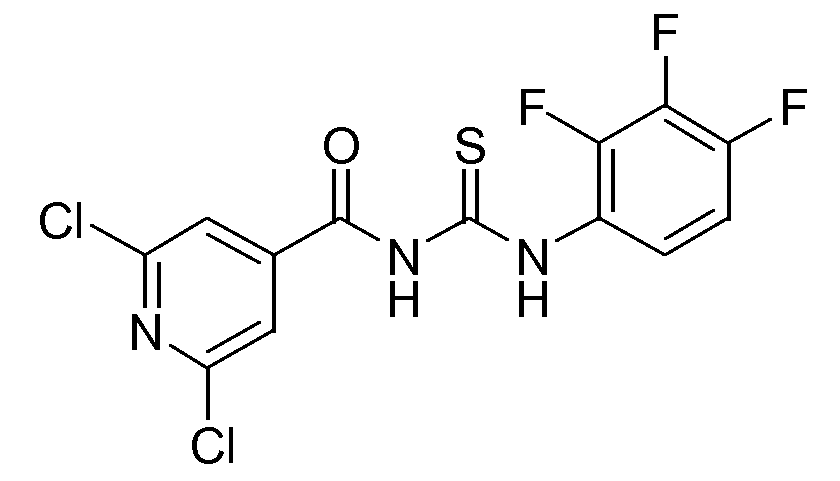
Изотиоцианат аммония (7,726 г, 0,1015 моль) добавляли к раствору 2,6-дихлор-4-пиридинкарбонилхлорида (17,8 г, 0,0846 моль) в ацетоне (300 мл). Смесь перемешивали в течение 30 минут и далее медленно добавляли 2,3,4-трифторбензоламина гидрохлорид (.HCl). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и затем реакцию гасили Н2О (100 мл). Смесь экстрагировали CH2Cl2 (3×80 мл) и объединенные органические слои сушили (MgSO4), фильтровали и растворитель упаривали в вакууме. Остаток очищали флэш-хроматографией (элюент: смесь гептан/EtOAc, от 80/20 до 50/50). Желаемые фракции собирали и растворитель упаривали в вакууме. Выход: 22,2 г промежуточного соединения D9 (69%).
Описание 10
1-(2,6-Дихлорпиридин-4-карбонил)-2-метил-3-(2,3,4-трифторфенил)изотиомочевина (D10)
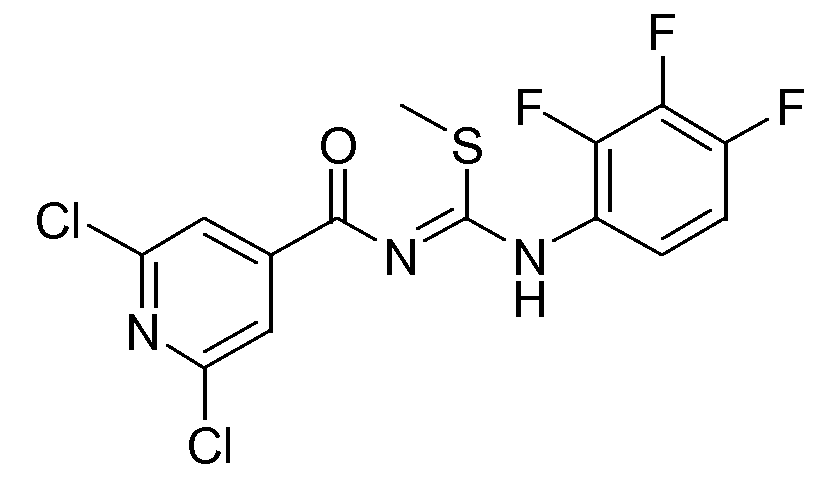
NaH (2,70 г, 0,06747 моль) осторожно добавляли к охлажденному раствору (0°С) промежуточного соединения D9 (28,5 г, 0,04498 моль) в ТГФ (200 мл). Смесь перемешивали в течение 15 минут и затем добавляли CH3I (6,38 г, 0,04498 моль). Баню со льдом отставляли и реакционную смесь перемешивали в течение 2 часов при комнатной температуре. Далее реакцию гасили Н2О и реакционную смесь экстрагировали CH2Cl2 (3×100 мл). Объединенные органические слои промывали (насыщенным раствором соли), сушили (MgSO4), фильтровали и растворитель упаривали в вакууме. Остаток очищали флэш-хроматографией (элюент: смесь гептан/EtOAc, градиент от 80/20 до 50/50). Желаемые фракции собирали и растворитель упаривали. Выход: 5,7 г промежуточного соединения D10 (32%).
Описание 11
(S)-1-[5-(2,6-Дихлорпиридин-4-ил)-3-(2,3,4-трифторфениламино)-[1,2,4]триазол-1-ил]бутан-2-ол (D11)
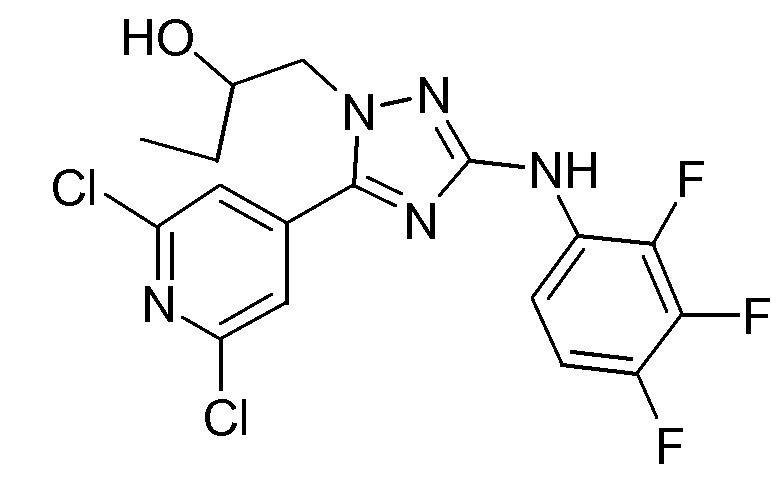
Промежуточное соединение D3 (0,143 г, 0,00137 моль) добавляли к раствору промежуточного соединения D10 (0,3 г, 0,000457 моль) в t-BuOH (40 мл). Реакционную смесь перемешивали в течение ночи при кипячении с обратным холодильником. Растворитель упаривали в вакууме и остаток очищали флэш-хроматографией на силикагеле (элюент смесь EtOAc/гептан, градиент от 20/80 до 50/50). Желаемые фракции собирали и растворитель упаривали. Выход: 0,160 г промежуточного соединения D11 (81%; S-энантиомер).
Описание 12
(S)-1-[3-(3-Хлор-2-фторфениламино)-5-(2,6-дихлорпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ол (D12)
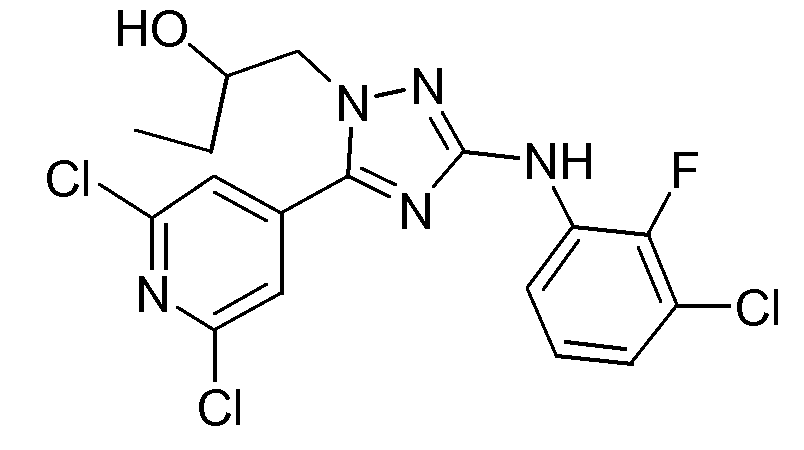
Промежуточное соединение D12 получали согласно процедуре, аналогичной процедуре, используемой для синтеза D11. Выход: промежуточное соединение D12 (79%; S-энантиомер).
Описание 13
1-(2-Хлор-6-метилпиридин-4-карбонил)-3-(3-фтор-5-метоксифенил)тиомочевина (D13)
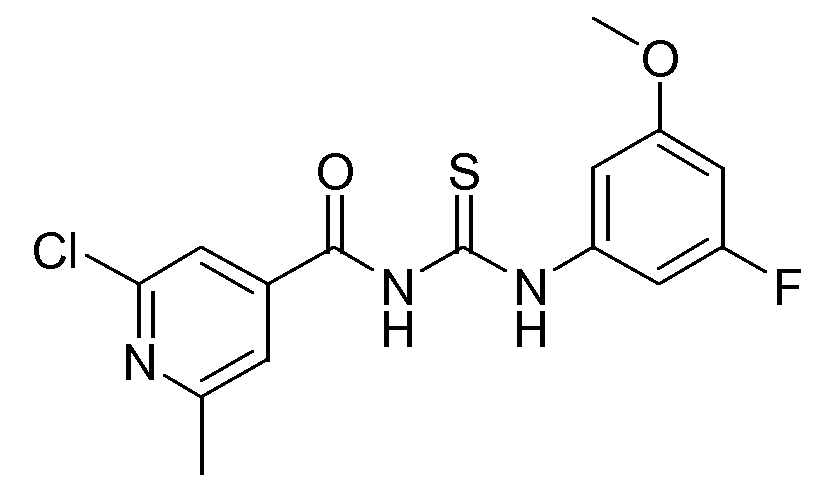
2-Хлор-6-метил-4-пиридинкарбонилхлорид (44,087 г, 0,232 моль) в ацетоне (1 л) обрабатывали изотиоцианатом аммония (21,192 г, 0,278 моль) и смесь перемешивали в течение 1 часа при комнатной температуре. Далее раствор 3-фтор-5-метоксибензоламина (36,02 г, 0,255 моль) в ацетоне (200 мл) добавляли по каплям и реакционную смесь перемешивали в течение 4 часов при комнатной температуре. Растворитель упаривали в вакууме и остаток растворяли в CH2Cl2 (1 л). Полученный органический раствор промывали (Н2О), сушили (MgSO4), фильтровали и растворитель упаривали в вакууме с получением коричневого твердого вещества. Коричневое твердое вещество растирали в ацетонитриле (0,8 л), перемешивали в течение ночи и твердое вещество отфильтровывали и сушили (вакуум-сушильный шкаф, 4 часа при 65°С). Выход: 59,69 г промежуточного соединения D13 (73%).
Описание 14
1-(2-Хлор-6-метилпиридин-4-карбонил)-3-(3-фтор-5-метоксифенил)-2-метилизотиомочевина (D14)
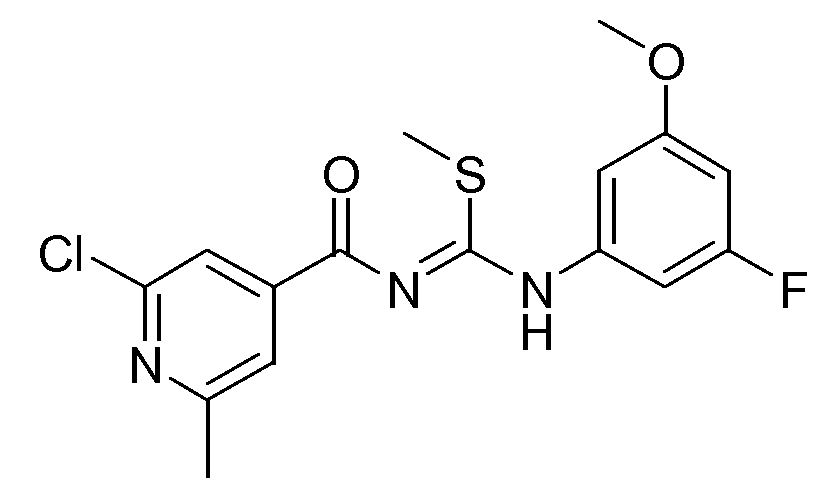
NaH 60% в парафине (10,123 г, 0,253 моль) добавляли порциями к охлажденному на льду раствору промежуточного соединения D13 (59,69 г, 0,169 моль) в ТГФ (1000 мл). Через 15 минут добавляли по каплям CH3I (15,651 мл), растворенный в ТГФ (200 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре и затем реакцию гасили Н2О (25 мл). После обработки и упаривания растворителя твердое вещество растирали в смеси DIPE (0,5 л) и CH3CN (50 мл). Реакционную смесь перемешивали в течение 3 часов и затем продукт отфильтровывали и растворяли в CH2Cl2 (1,5 л). Органический раствор промывали Н2О (0,8 л), сушили (MgSO4), фильтровали и растворитель упаривали в вакууме. Выход: 52,3 г промежуточного соединения D14 (84,3%).
Описание 15
(S)-1-[5-(2-Хлор-6-метилпиридин-4-ил)-3-(3-фтор-5-метоксифениламино)-[1,2,4]триазол-1-ил]бутан-2-ол (D15)
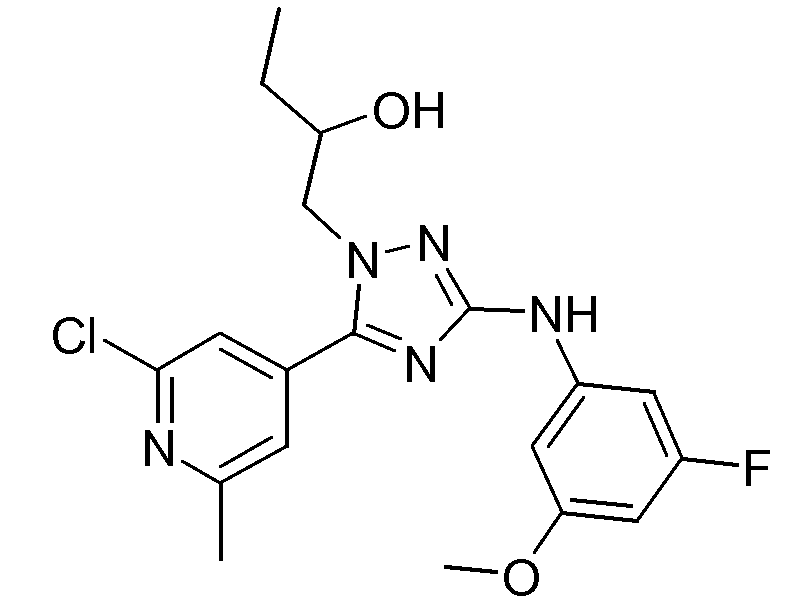
Смесь промежуточного соединения D3 (22,213 г, 0,213 моль), промежуточного соединения D14 (52,3 г, 0,142 моль) и этанола (500 мл) кипятили с обратным холодильником в течение 16 часов, в то же время смесь продували N2. Реакцию гасили раствором NaOCl. Далее растворитель упаривали в вакууме и остаток кристаллизовали из DIPE (400 мл). Светло-желтое твердое вещество отфильтровывали и использовали как таковое на следующей стадии реакции. Выход: 33,124 г промежуточного соединения D15 (57,4%; S-энантиомер).
В. Получение соединений
Пример В1
(S)-1-[3-(3,4-Дифторфениламино)-5-(2,6-диметилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ол (E1)
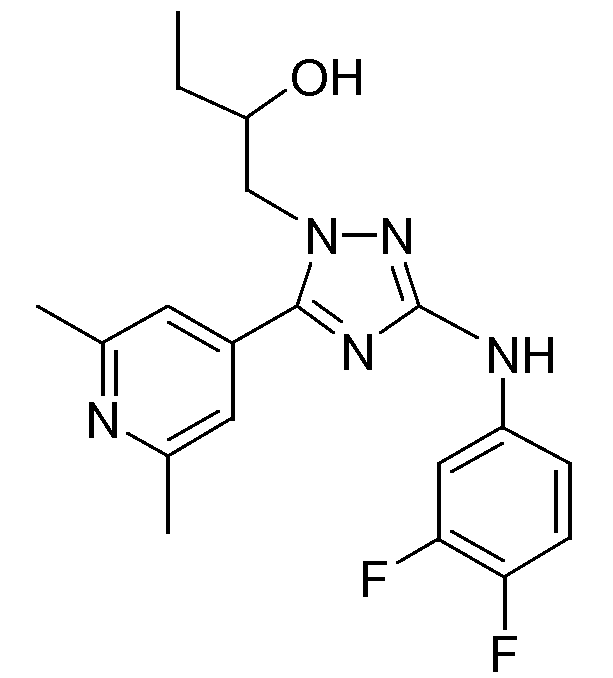
Промежуточное соединение D4 (1,1 г, 2,80 ммоль) растворяли в ТГФ (15 мл) и добавляли ацетилацетонат железа(III) (0,099 г, 0,28 ммоль) и NMP (1 мл). Затем реакционную смесь охлаждали до 0°С. Под защитой N2 (газ) медленно добавляли 3 M раствор CH3MgBr в Et2O (4 мл, 12 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение одного часа до тех пор, пока реакция не заканчивалась. Затем реакцию гасили насыщенным раствором NH4Cl и реакционную смесь экстрагировали CH2Cl2 (3×30 мл). Объединенную органическую фазу промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и растворитель упаривали в вакууме. Остаток очищали высокоэффективной жидкостной хроматографией с обращенной фазой (Shandon Hyperprep® C18 BDS (Base Deactivated Silica) 8 мкм, 250 г, I.D. 5 см). Градиент с 2 или 3 подвижными фазами использовали (фаза А: 0,25% раствор NH4HCO3 в воде; фаза B: CH3OH (необязательная); фаза C: CH3CN). Выход: 0,152 г соединения Е1 (S-энантиомер).
Пример В2
(S)-1-[3-(3-Хлорфениламино)-5-(2-этиламинопиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ол (E2)
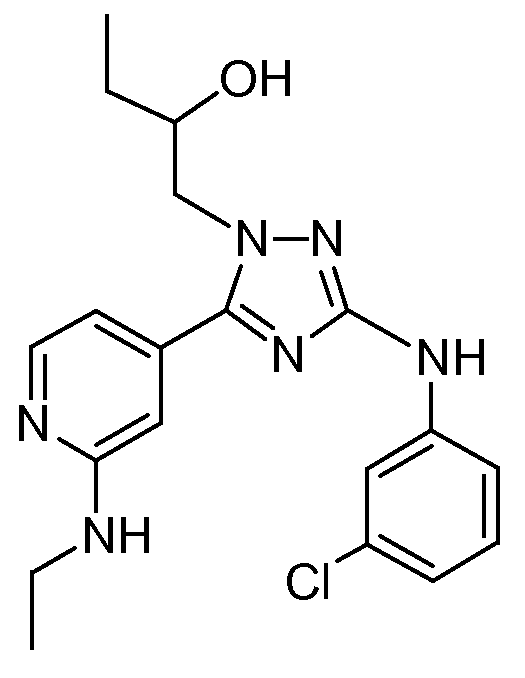
Промежуточное соединение 1-[3-(3-хлорфениламино)-5-(2-хлорпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ол (полученное согласно описанию 4) (1,15 г; 3,04 ммоль) растворяли в СН3ОН (20 мл) и затем добавляли этиламин (3 г). Реакционную смесь перемешивали в течение 16 часов при 160°С при давлении (до тех пор, пока реакция не заканчивалась). Затем растворитель упаривали в вакууме. Остаток очищали высокоэффективной жидкостной хроматографией с обращенной фазой (Shandon Hyperprep® C18 BDS (Base Deactivated Silica) 8 мкм, 250 г, I.D. 5 см). Использовали градиент с 2 подвижными фазами (фаза A: 0,25% раствор NH4HCO3 в воде; фаза B: CH3CN). Желаемые фракции собирали, обрабатывали и, наконец, остаток кристаллизовали из диизопропилового эфира. Выход: 0,1595 г соединения Е2 (S-энантиомер).
Пример В3
1-[3-(3,4-Дифторфениламино)-5-(2-метилпиридин-4-ил)-[1,2,4]триазол-1-ил]гексан-2-ол (E3)
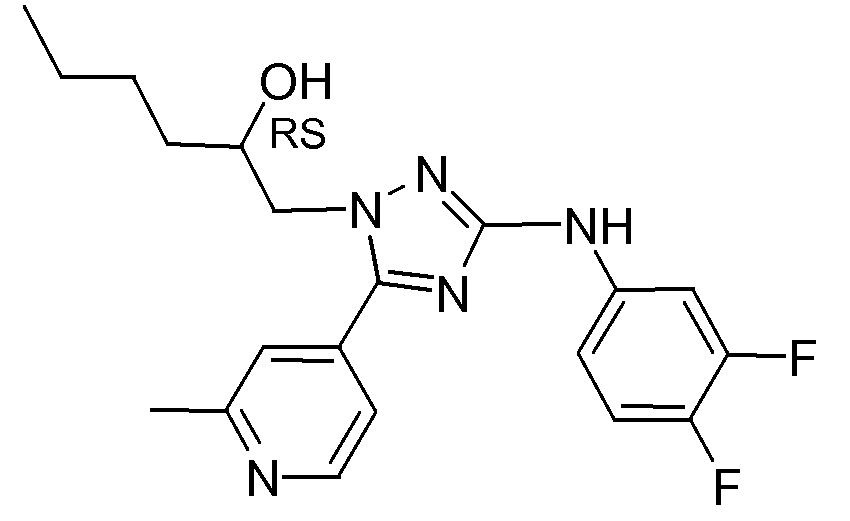
Смесь промежуточного соединения, 1-[5-(2-хлор-6-метилпиридин-4-ил)-3-(3,4-дифторфениламино)-[1,2,4]триазол-1-ил]гексан-2-ола (полученного согласно процедуре получения соединения D4) (1,5 г; 3,5 ммоль) и Et3N (2 мл) в ТГФ (40 мл) подвергали гидрированию с Pd/C 10% (0,020 г) в качестве катализатора в присутствии раствора тиофена (0,1 мл; 4% в DIPE). После того как поглощение Н2 (1 экв.) прекращалось, катализатор отфильтровывали и фильтрат упаривали в вакууме. Остаток суспендировали в DIPE и фильтровали. Кристаллы сушили в вакуум-сушильном шкафу при 70°С в течение ночи.
Выход: 876 мг соединения Е3 (65%).
Пример В4
(-)-1-[3-(3,4-Дифторфениламино)-5-(2,6-диметилпиридин-4-ил)-[1,2,4]триазол-1-ил]гексан-2-ол (E4) и (+)-1-[3-(3,4-дифторфениламино)-5-(2,6-диметилпиридин-4-ил)-[1,2,4]триазол-1-ил]гексан-2-ол (E5)
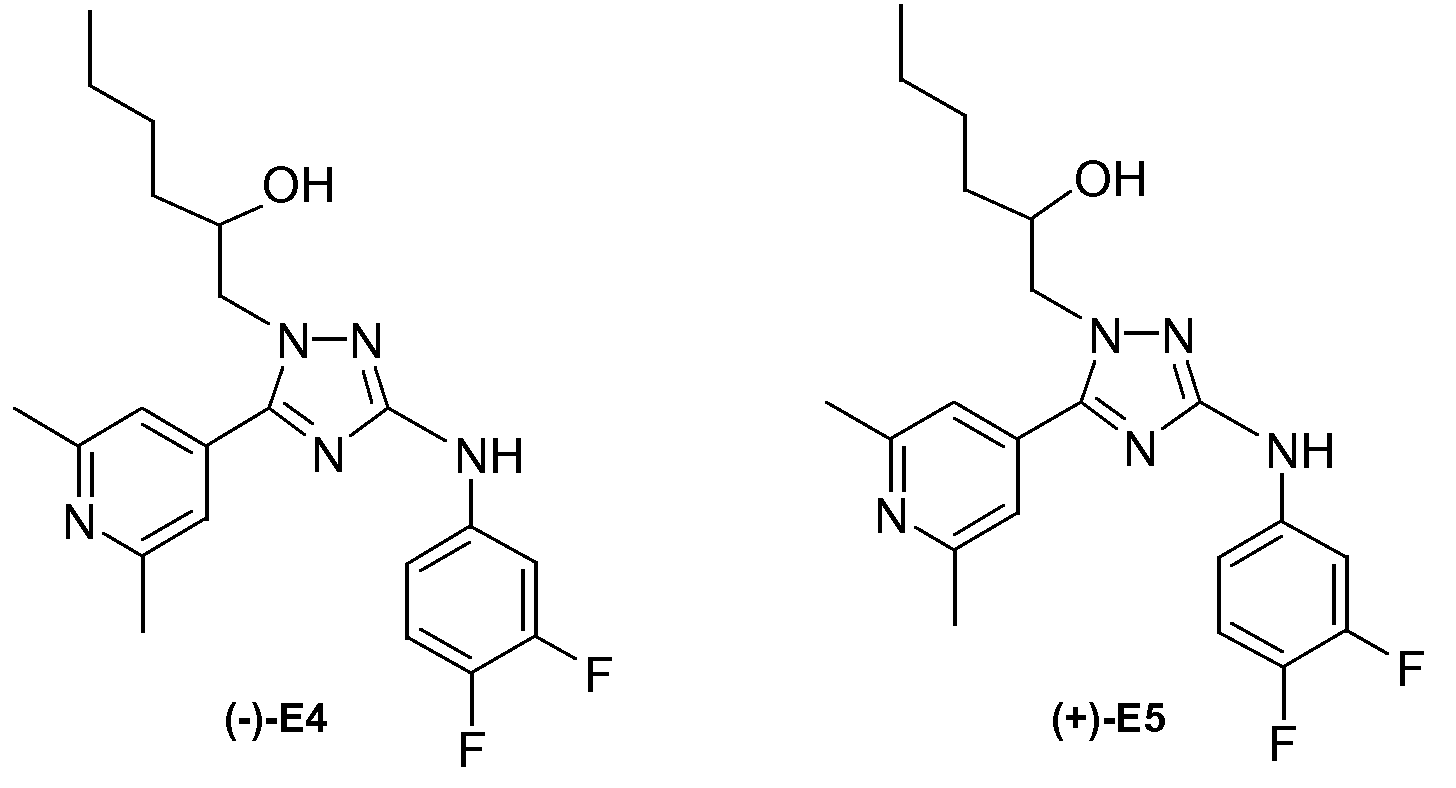
Соединение Е7 (564 мг; 1,4 ммоль) разделяли на энантиомеры посредством сверхкритической флюидной хроматографии (SFC) на колонке Chiralpak AD-H (30×250 мм) со скоростью потока 50 мл/мин. Смесь 30% CH3OH (+ 0,2% 2-пропиламина)/70% CO2 использовали в качестве элюента. Нагреватель колонки устанавливали на температуру 40°С и давление в насадке устанавливали на 100 бар.
Первый элюируемый изомер, пик “A”, собирали и концентрировали, маслянистый остаток растирали в смеси DIPE и гептана. Твердое белое вещество собирали фильтрованием, промывали гептаном и сушили в вакуум-сушильном шкафу. Выход: 200 мг соединения Е4 в виде белого порошка (кристаллический).
Второй элюируемый изомер, пик “B”, собирали и концентрировали, маслянистый остаток растирали в смеси DIPE и гептана. Твердое белое вещество собирали фильтрованием, промывали гептаном и сушили в вакуум-сушильном шкафу. Выход: 212 мг соединения Е5 в виде белого порошка (кристаллический).
Пример В5
(S)-1-[5-(2,6-Диметилпиридин-4-ил)-3-(3-метокси-5-трифторметилфениламино)-[1,2,4]триазол-1-ил]бутан-2-ол (E30)
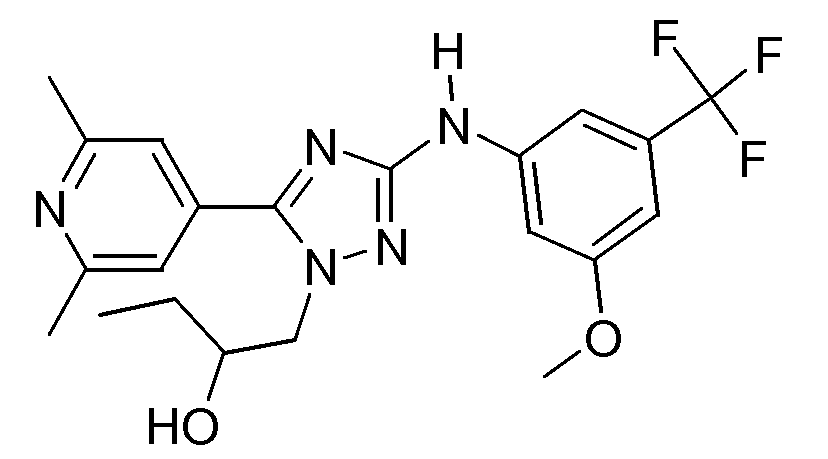
NMP (1 мл; обезвоженный) и ацетилацетонат железа(III) (35,33 г, 0,0001 моль) добавляли к раствору промежуточного соединения D8 (498,08 г, 0,001 моль) в ТГФ (10 мл; обезвоженный) и смесь охлаждали до 0°С. Медленно добавляли метилмагнийбромид (1,67 мл, 0,005 моль) и реакционную смесь перемешивали в течение 5 минут при 0°С. Далее реакцию гасили насыщенным раствором NH4Cl и реакционную смесь экстрагировали CH2Cl2 (3×50 мл). Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и растворитель упаривали. Остаток растворяли в метаноле и добавляли NaOH (800 мг, 0,020 моль). Образовавшуюся смесь перемешивали в течение 1 часа при комнатной температуре. Добавляли насыщенный раствор NH4Cl и смесь экстрагировали CH2Cl2 (3×50 мл). Объединенные органические слои промывали (насыщенным раствором соли), сушили (MgSO4), фильтровали и растворитель упаривали в вакууме. Остаток очищали флэш-хроматографией на колонке с силикагелем (элюент: (7 N NH3/MeOH)/CH2Cl2, градиент от 0/100 до 10/90). Фракции продукта собирали и растворитель упаривали в вакууме. Остаток обрабатывали гептаном, получая белые кристаллы. Полученные белые кристаллы отфильтровывали и сушили в вакууме. Выход: 0,632 г соединения Е30 (83%; S-энантиомер).
Пример В6
(S)-1-[5-(2,6-Диметилпиридин-4-ил)-3-(2,3,4-трифторфениламино)-[1,2,4]триазол-1-ил]бутан-2-ол (E32) и (S)-1-[5-(2-хлор-6-метилпиридин-4-ил)-3-(2,3,4-трифторфениламино)-[1,2,4]триазол-1-ил]бутан-2-ол (D16)
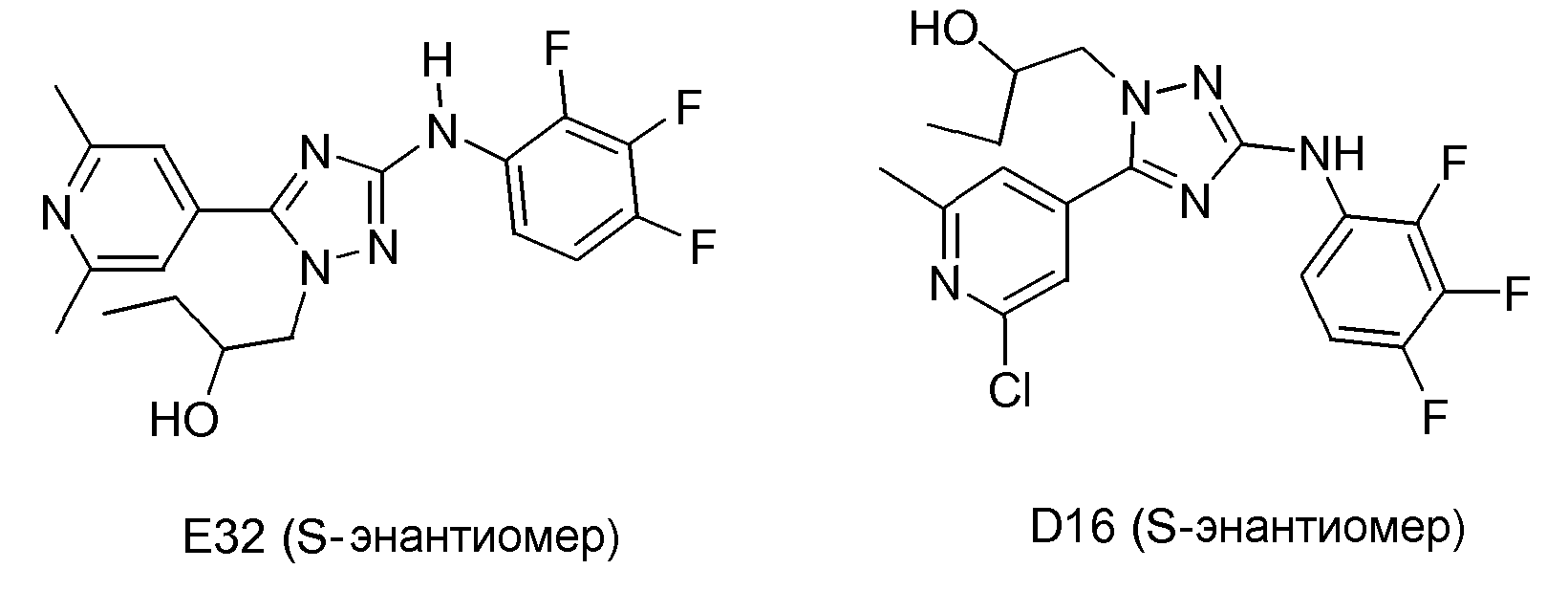
Смесь промежуточного соединения D11 (0,47 г, 0,0011 моль), ацетилацетоната железа(III) (0,0383 г, 0,00011 моль), NMP (1 мл) и ТГФ (25 мл) перемешивали при 0°С. 3 M раствор CH3MgBr в Et2O (2,9 мл, 0,0087 моль) добавляли. Реакционную смесь перемешивали в течение 2 часов при комнатной температуре. Реакцию гасили насыщенным раствором NH4Cl и реакционную смесь экстрагировали CH2Cl2 (3×30 мл). Объединенный органический слой промывали (насыщенным раствором соли), сушили (MgSO4), фильтровали и растворитель упаривали в вакууме. Остаток очищали высокоэффективной жидкостной хроматографией с обращенной фазой (Shandon Hyperprep® C18 BDS (Base Deactivated Silica) 8 мкм, 250 г, I.D. 5 см). Градиент с 3 подвижными фазами использовали. Фаза A: 0,25% раствор NH4HCO3 в воде; фаза B: метанол; фаза С: CH3CN). Две различные фракции продуктов собирали и обрабатывали. Выход: 0,077 г промежуточного соединения D16 (17%). Выход: 0,183 г соединения Е32 (43%; S-энантиомер).
Часть соединения Е32 была превращена в HCl-соль обычными способами, известными специалистам в данной области, с получением соединения Е33 (HCl-соль; S-энантиомер).
Пример В7
(S)-1-[5-(2-Метилпиридин-4-ил)-3-(2,3,4-трифторфениламино)-[1,2,4]триазол-1-ил]бутан-2-ол (E31)
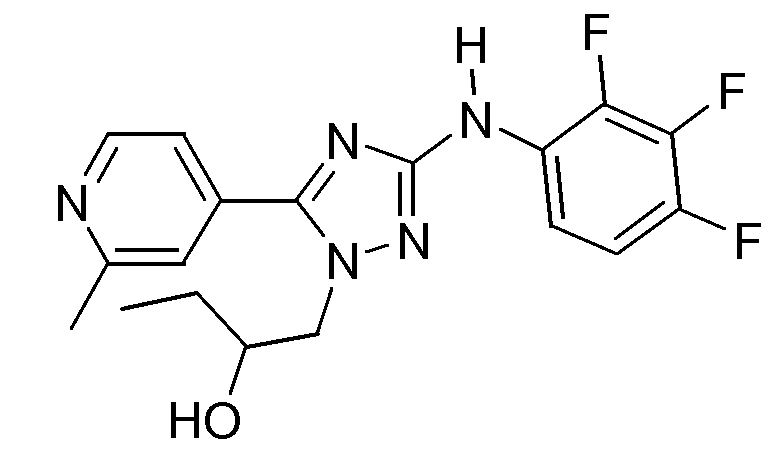
Смесь промежуточного соединения D16 (0,13 г, 0,000316 моль), [1,3-бис[2,6-бис(1-метилэтил)фенил]-2-имидазолидинилиден]хлор(η3-2-пропенил)палладия (CAS [478980-01-7]; катализатор) (0,01814 г, 0,0000316 моль) и NaOCH3 (0,5 M в метаноле) (1 мл) в 2-пропаноле (4 мл) перемешивали при микроволновом излучении в течение 10 минут при 120°С. Растворитель упаривали и концентрат промывали Н2О и экстрагировали CH2Cl2. Органический слой сушили (MgSO4), фильтровали и растворитель упаривали в вакууме. Остаток очищали высокоэффективной жидкостной хроматографией с обращенной фазой (Shandon Hyperprep® C18 BDS (Base Deactivated Silica) 8 мкм, 250 г, I.D. 5 см). Использовали градиент с 3 подвижными фазами. Фаза A: 0,25% раствор NH4HCO3 в воде; фаза B: метанол; фаза С: CH3CN. Желаемые фракции собирали и обрабатывали. Выход: 0,0519 г соединения Е31 (43,5%; S-энантиомер).
Пример В8
(S)-1-[3-(3-Хлор-2-фторфениламино)-5-(2,6-диметилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола HCl-соль (E35)
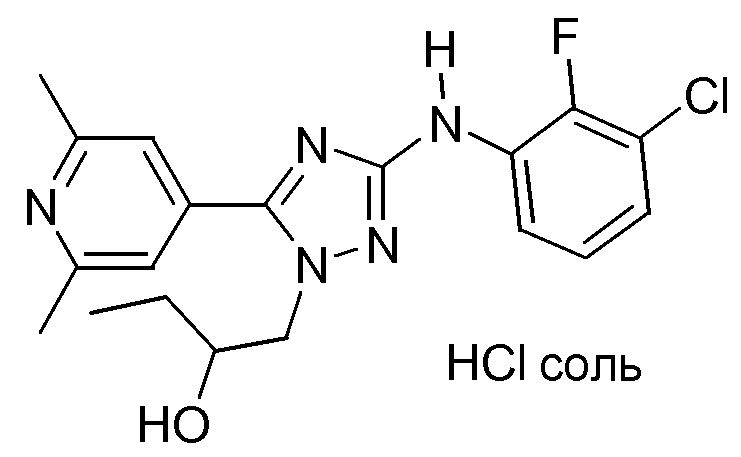
Смесь промежуточного соединения D12 (2,6 г, 0,00604 моль), ацетилацетоната железа(III) (0,427 г, 0,00121 моль), ТГФ (150 мл) и NMP (35 мл) перемешивали при 0°С. Добавляли 3 M раствор CH3MgBr в Et2O (10 мл) и смесь перемешивали в течение 1 часа при комнатной температуре. Добавляли дополнительное количество 3 M раствора CH3MgBr в Et2O (10 мл) и метанол. Растворитель упаривали и к остатку добавляли CH2Cl2 и H2O (несколько мл). Смесь фильтровали через диатомовую землю. Фильтрат упаривали и остаток растворяли в DIPE. Раствор промывали (Н2О) и органический слой сушили (MgSO4), фильтровали и растворитель упаривали в вакууме. Остаток растворяли в 2-пропаноле и к раствору добавляли смесь HCl/2-пропанол при охлаждении на бане со льдом. Далее растворитель упаривали и остаток перемешивали в ацетоне. Кристаллы отфильтровывали и сушили. Выход: 0,96 г соединения Е35 (37%; S-энантиомер; HCl-соль). Дополнительное количество соединения Е35 могло быть извлечено из фильтрата с получением общего выхода 63%.
Пример В9
(S)-1-[3-(3-Фтор-5-метоксифениламино)-5-(2-метилпиридин-4-ил)-[1,2,4]триазол-1-ил]бутан-2-ола HCl-соль (E36) и (E38) (свободное основание E36)
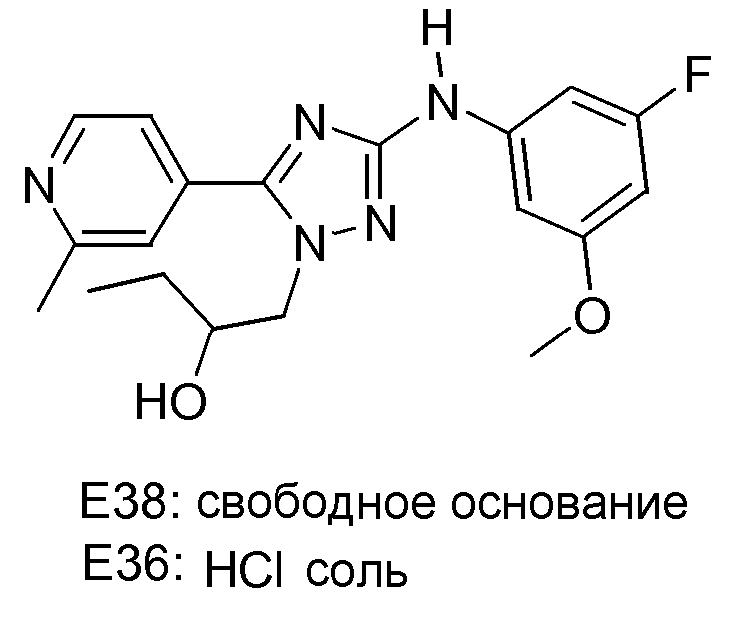
Смесь промежуточного соединения D15 (0,406 г, 0,001 моль), [1,3-бис[2,6-бис(1-метилэтил)фенил]-2-имидазолидинилиден]хлор(η3-2-пропенил)палладия (CAS [478980-01-7]; катализатор) (0,055 г, 0,0000957 моль) и NaOMe (0,2 мл 5,33 M раствора в MeOH, 0,001066 моль) в 2-пропаноле (10 мл) нагревали в микроволновой печи в течение 10 минут при 120°С. Далее реакционную смесь концентрировали в вакууме, разбавляли CH2Cl2 и промывали Н2О. Органический слой сушили (MgSO4), фильтровали и растворитель упаривали в вакууме. Остаток очищали колоночной хроматографией (элюент: CH2Cl2/MeOH, 100/0-95/5). Желаемые фракции собирали и растворитель упаривали с получением 0,300 г бесцветного масла (соединение Е38, которое представляет собой свободное основание соединения Е36). Соединение Е38 (S-энантиомер) превращали в его HCl-соль: масло растворяли в DIPE и обрабатывали 6 н. HCl в 2-пропаноле и полученную смесь перемешивали в течение 5 часов. Желтый осадок отфильтровывали и сушили (вакуум-сушильный шкаф, 65°С, 3 дня). Выход: 0,237 г соединения Е36 (58%; S-энантиомер; HCl-соль).
В таблицах 1 и 2 перечислены соединения формулы (I), которые были получены аналогично одному из приведенных выше примеров (№ примера).
Таблица 1
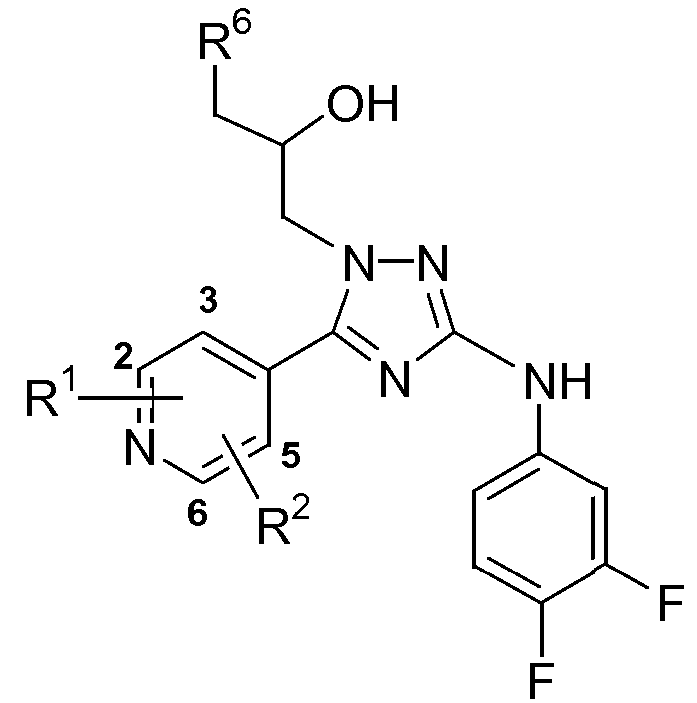
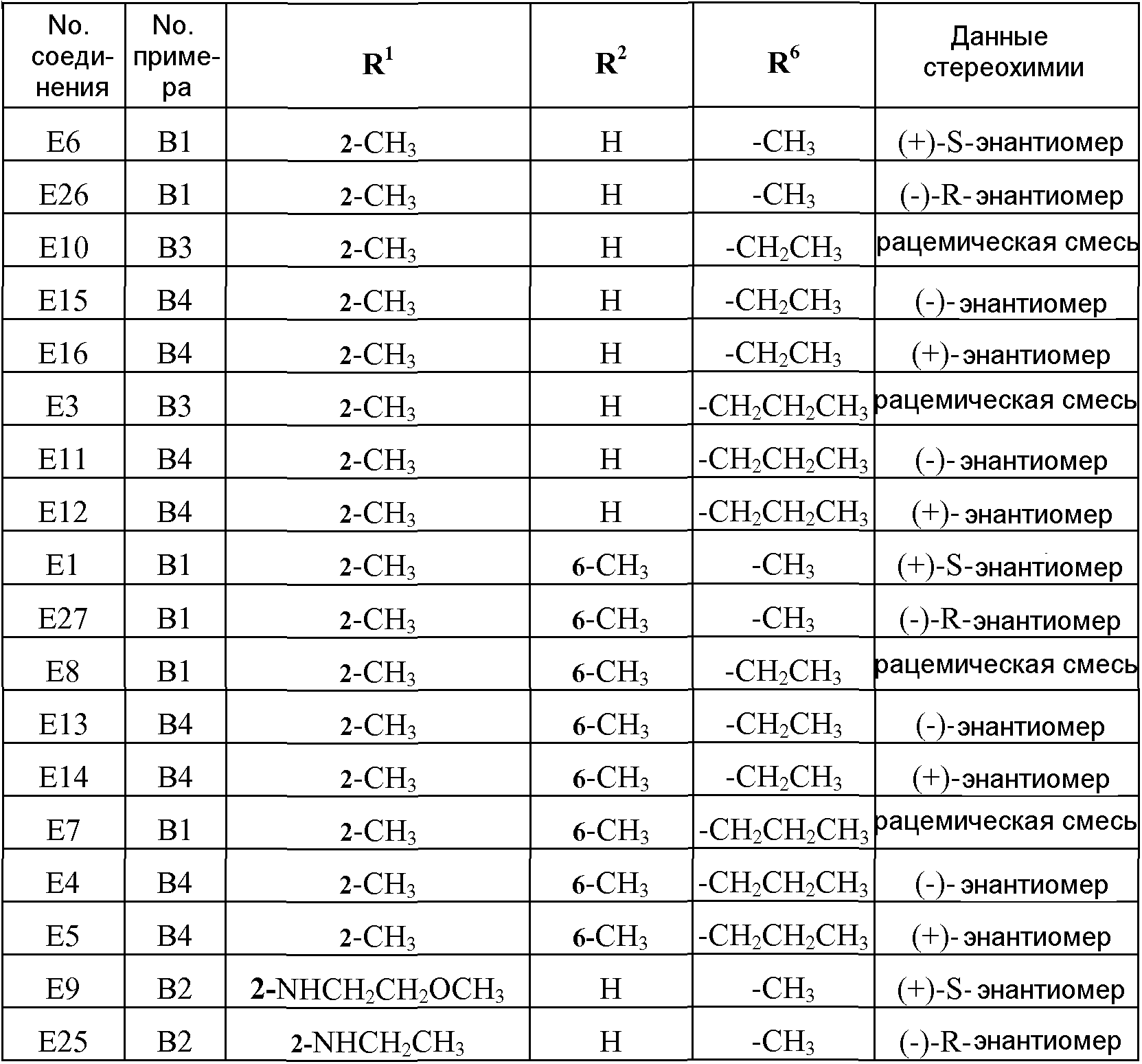
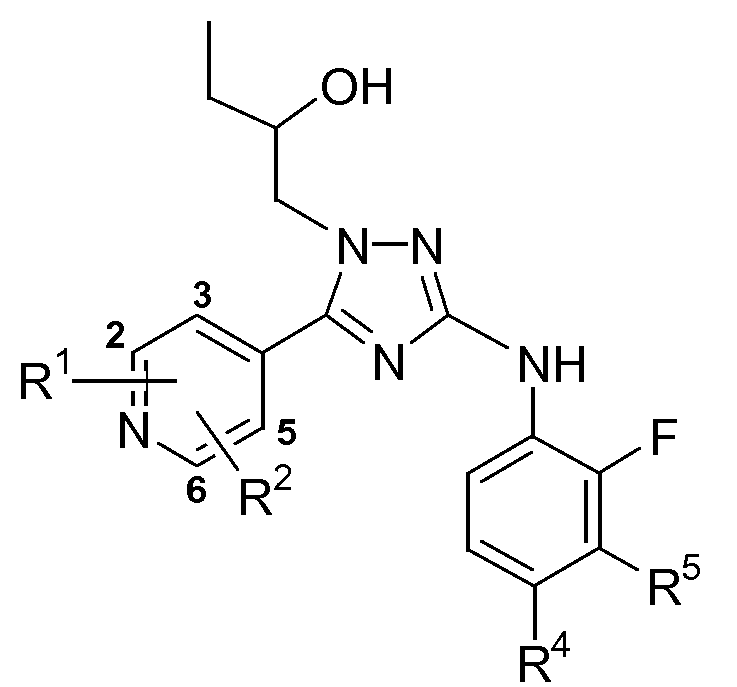
Таблица 2
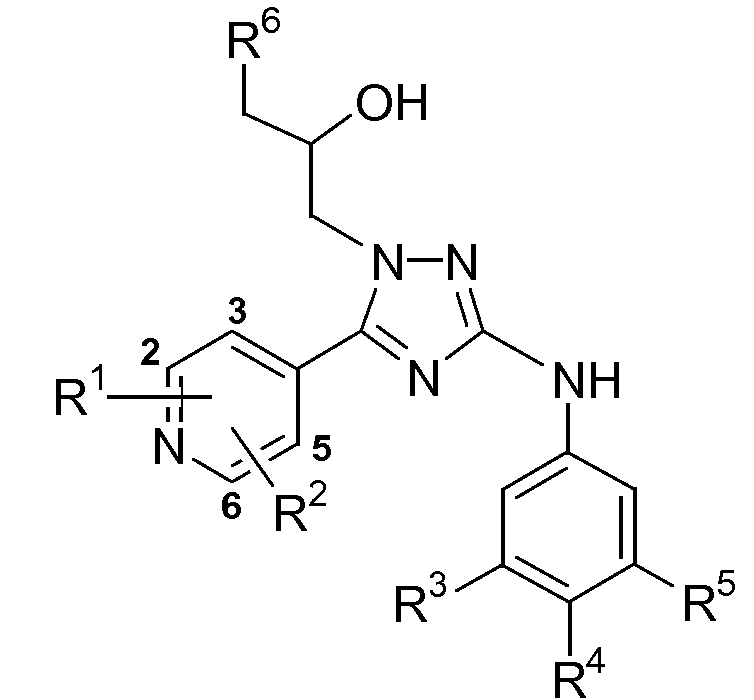
Таблица 3
С. Аналитическая часть
ЖХМС
Общая процедура А
Количественное определение методом ВЭЖХ осуществляли с помощью системы Alliance HT 2790 (Waters), включающей насос для четырехкомпонентных смесей с дегазатором, автоматический дозатор, колоночный термостат (установка на 40°С, если не указано иное), детектор на диодной матрице (DAD) и колонку, как описано в соответствующих способах ниже. Поток из колонки распределен к МС-спектрометру. МС-детектор был установлен с источником электрораспылительной ионизации. Масс-спектры получали путем сканирования от 100 до 1000 в 1 секунду со временем задержки 0,1 секунды. Напряжение капиллярной иглы было 3 кВ, и температуру источника поддерживали при 140°С. Азот использовали в качестве газа для распыления. Сбор данных осуществляли с помощью системы обработки данных Waters-Micromass MassLynx-Openlynx.
Общая процедура В
Количественное определение методом ЖХ осуществляли с помощью системы Acquity UPLC (Waters), включающей насос для двухкомпонентной смеси, устройство для образца, нагреватель колонки (установка при 55°С), детектор на диодной матрице (DAD) и колонку, как описано в соответствующих способах ниже. Поток из колонки распределен к МС-спектрометру. МС-детектор был установлен с источником электрораспылительной ионизации. Масс-спектры получали путем сканирования от 100 до 1000 в 0,18 секунды со временем задержки 0,02 секунды. Напряжение капиллярной иглы было 3,5 кВ, и температуру источника поддерживали при 140°С. Азот использовали в качестве газа для распыления. Сбор данных осуществляли с помощью системы обработки данных Waters-Micromass MassLynx-Openlynx.
ЖХМС - Процедура 1
В добавление к общей процедуре А: ВЭЖХ с обращенной фазой осуществляли на колонке Xterra MS C18 (3,5 мкм, 4,6×100 мм) со скоростью потока 1,6 мл/мин. Три подвижные фазы (подвижная фаза А: 95% 25 мМ ацетата аммония + 5% ацетонитрила; подвижная фаза В: ацетонитрил; подвижная фаза С: метанол) использовали для выполнения программы в градиенте от 100% А до 1% А, 49% В и 50% С за 6,5 минут, до 1% А и 99% В за 1 минуту и сохраняли указанные условия в течение 1 минуты и вновь уравновешивали 100% А в течение 1,5 минут. Объем инъецируемого раствора составлял 10 мкл. Напряжение на конусе было 10 В для типа положительной ионизации и 20 В для типа отрицательной ионизации.
ЖХМС - Процедура 2
В добавление к общей процедуре А: нагреватель колонки установлен при 60°С. ВЭЖХ с обращенной фазой осуществляли на колонке Xterra MS C18 (3,5 мкм, 4,6×100 мм) со скоростью потока 1,6 мл/мин. Три подвижные фазы (подвижная фаза А: 95% 25 мМ ацетата аммония + 5% ацетонитрила; подвижная фаза В: ацетонитрил; подвижная фаза С: метанол) использовали для выполнения программы в градиенте от 100% А до 50% В и 50% С за 6,5 минут, до 100% В за 0,5 минуты и сохраняли указанные условия в течение 1 минуты и вновь уравновешивали 100% А в течение 1,5 минуты. Объем инъецируемого раствора составлял 10 мкл. Напряжение на конусе было 10 В для типа положительной ионизации и 20 В для типа отрицательной ионизации.
ЖХМС - Процедура 3
В добавление к общей процедуре А: ВЭЖХ с обращенной фазой осуществляли на колонке Atlantis C18 (3,5 мкм, 4,6×100 мм) со скоростью потока 1,6 мл/мин. Две подвижные фазы (подвижная фаза А: 70% метанола + 30% Н2О; подвижная фаза В: 0,1% муравьиная кислота в смеси Н2О/метанол 95/5) использовали для выполнения программы в градиенте от 100% В до 5% В + 95% А за 12 минут. Объем инъецируемого раствора составлял 10 мкл. Напряжение на конусе было 10 В для типа положительной ионизации и 20 В для типа отрицательной ионизации.
ЖХМС - Процедура 4 (использовалась только для промежуточных соединений D1, D2 и D4)
В добавление к общей процедуре А: ВЭЖХ с обращенной фазой осуществляли на колонке Chromolith (4,6×25 мм) со скоростью потока 3 мл/мин. Три подвижные фазы (подвижная фаза А: 95% 25 мМ ацетата аммония + 5% ацетонитрила; подвижная фаза В: ацетонитрил; подвижная фаза С: метанол) использовали для выполнения программы в градиенте от 96% А, 2% В и 2% С, до 49% В и 49% С за 0,9 минуты, до 100% В за 0,3 минуты и указанные условия сохраняли в течение 0,2 минуты. Объем инъецируемого раствора составлял 2 мкл. Напряжение на конусе было 10 В для типа положительной ионизации и 20 В для типа отрицательной ионизации.
ЖХМС - Процедура 5
В добавление к общей процедуре А: нагреватель колонки установлен при 45°С. ВЭЖХ с обращенной фазой осуществляли на колонке Atlantis C18 (3,5 мкм, 4,6×100 мм) со скоростью потока 1,6 мл/мин. Две подвижные фазы (подвижная фаза А: 70% метанола + 30% Н2О; подвижная фаза В: 0,1% муравьиная кислота в смеси Н2О/метанол 95/5) использовали для выполнения программы в градиенте от 100% В до 5% В + 95% А за 9 минут и указанные условия сохраняли в течение 3 минут. Объем инъецируемого раствора составлял 10 мкл. Напряжение на конусе было 10 В для типа положительной ионизации и 20 В для типа отрицательной ионизации.
ЖХМС - Процедура 6
В добавление к общей процедуре В: UPLC с обращенной фазой (сверхэффективная жидкостная хроматография) осуществляли на колонке с композиционным материалом этилсилоксан/кремнезем, соединенными мостиковой связью, (ВЕН) С18 (1,7 мкм, 2,1×50 мм; Waters Acquity) со скоростью потока 0,8 мл/мин. Две подвижные фазы (подвижная фаза А: 0,1% муравьиная кислота в смеси Н2О/метанол 95/5; подвижная фаза В: метанол) использовали для выполнения программы в градиенте от 95% А и 5% В до 5% А и 95% В за 1,3 минуты и указанные условия сохраняли в течение 0,2 минуты. Объем инъецируемого раствора составлял 0,5 мкл. Напряжение на конусе было 10 В для типа положительной ионизации и 20 В для типа отрицательной ионизации.
Точки плавления
Для ряда соединений точки плавления (т.пл., m.p.) определяли с помощью калориметра DSC823e (Mettler-Toledo). Точки плавления измеряли с температурным градиентом 30°С/минута. Максимальная температура составляла 400°С.
Величины получали с экспериментальными погрешностями, обычно связанными с данным аналитическим методом.
|
|
Оптическое вращение:
Оптическое вращение измеряли посредством поляриметра Perkin Elmer 341. [α]D 20 обозначает оптическое вращение, измеренное со светом с длиной волны D-линии натрия (589 нм) при температуре 20°С. Длина пути ячейки составляла 1 дм. Ниже представлены фактическая величина концентрации и растворитель, использованный для измерения оптического вращения.
|
Фармакологические примеры
Пример D.1: Визуализация потока Са 2+ (FDSS)
Материалы
а) Буфер для анализа
Сбалансированный солевой раствор Хенкса (HBSS, Invitrogen, Belgium), снабженный 10 мМ HEPES (Invitrogen, Belgium), CaCl2 до конечной концентрации 5 мМ, 0,1% бычьего сывороточного альбумина (Sigma-Aldrich NV, Belgium).
b) Кальций-чувствительный краситель Fluo-4AM
Fluo-4AM (молекулярные зонды, США) растворяли в ДМСО, содержащем 10% плюрониловой кислоты (молекулярные зонды, США), с получением исходного раствора, который разбавляли буфером для анализа, снабженным 5 мМ пробеницида (Sigma, Aldrich NV, Belgium), для получения конечной концентрации 2 мкМ.
с) 384-луночные планшеты
Черный 384-луночный планшет, черные/прозрачные планшеты, предварительно покрытые PDL (Corning, Incorporated, USA)
d) Измерение потока ионов кальция
Функциональная система скрининга лекарственных средств (FDSS, Hamamatsu) была использована для измерения внутриклеточных сигналов потоков свободного кальция.
Способ
Монослои клеток GH4C1, экспрессирующих рецепторы hα7-wt нАХР, выращивали в многолуночных планшетах, в частности в 384-луночных планшетах с черными стенками и прозрачным дном, покрытых поли-D-лизином, в течение 24 часов до внесения флуоресцентного индикатора ионов кальция, в отдельном варианте осуществления изобретения, внесения fluo-4AM вплоть до 120 минут.
Активность РАМ определяли в реальном времени путем внесения соединения, подвергаемого тестированию, к клеткам вместе с агонистом никотинового рецептора α7 в условиях постоянного контроля клеточной кальциевой мобилизации посредством регистрации флуоресценции в системе FDSS. Соединения, производящие ответы в виде пиков флуоресценции, превышающие ответ, произведенный только агонистом, рассматривались как модуляторы РАМ рецептора α7-нАХР. В отдельном варианте осуществления изобретения агонистом никотинового рецептора α7 был холин, в предпочтительном варианте осуществления изобретения холин использовали при субмаксимальной концентрации, составляющей 100 мкМ. В другом варианте осуществления настоящего изобретения соединения, подвергаемые тестированию, вносили до агониста никотинового рецептора α7, в отдельном варианте осуществления изобретения вплоть до 10 минут до внесения агониста.
Контрольный ответ к холину рассчитывали на каждый планшет исходя из разницы пиков флуоресценции в лунках либо с холином, либо только с буфером для анализа. Соединения согласно настоящему изобретению тестировали при концентрации в области от 0,01 мкМ до 30 мкМ. Соединения рассматривались как проявляющие интересующую активность, когда они усиливали сигнал холина, по меньшей мере, с 200% при тестировании с концентрацией соединения 30 мкМ (эффективность 100 мкМ холина определяли как 100% в отсутствие РАМ).
Величины ЕС50 (активность), максимальный эффект (% эффективности) и наклоны кривой Хилла оценивали путем согласования уравнения, описывающего сигмоидальную кривую, с полученными данными при использовании программы GraphPad Prism (GraphPad Software, Inc., San Diego, CA). Величину ЕС50 (или рЕС50) определяли как концентрацию, производящую половину максимального эффекта, когда наблюдали четкую сигмоидальную кривую с верхним плато.
Соединения согласно настоящему изобретению также проявляли потенциирующее действие на ответ к холину при измерении электрофизиологическим методом фиксации напряжения целой клетки на клетках GH4C1, стабильно экспрессирующих повышенные уровни рецептора α7 дикого типа человека, как описано ниже.
Пример D.2: Метод фиксации напряжения целой клетки
Метод фиксации напряжения целой клетки, используемый для клеток млекопитающих, предоставляет убедительные средства оценки функции мембранных белков, которые, как полагают, являются субъединицами лиганд-управляемых ионных каналов. Активация таких белков эндогенными или экзогенными лигандами вызывает открытие поры, ассоциированной с рецептором, через которую ионы перемещаются согласно их электрохимическому градиенту. В случае рекомбинантной клеточной линии GH4C1, экспрессирующей hα7-wt нАХР, избирательная проницаемость по отношению к ионам кальция для данного рецептора означает, что ионы кальция перемещаются в клетку при активации АХ, холином и другими никотиновыми лигандами, вызывающими кальциевый ток. Поскольку указанный рецептор быстро подвергается десенситизации в присутствии агониста, представляется важным использование программной системы, которая позволяет очень быстро поменять растворы (<100 мс) для предотвращения частичной или полной потери чувствительности рецептора, адекватной времени действия агониста. Поэтому вторым подходящим способом оценки увеличения никотиновой эффективности является метод фиксации напряжения целой клетки, используемый для клеток GH4C1, экспрессирующих hα7-wt нАХР, в сочетании с ускоренной программной системой.
Материалы
а) Буферы для анализа
Внешний фиксирующий раствор состоял из 152 мМ NaCl, 5 мМ KCl, 1 мМ MgCl2, 1 мМ кальция, 10 мМ HEPES, pH 7,3. Внутренний фиксирующий раствор состоял из 140 мМ CsCl, 10 мМ HEPES, 10 мМ EGTA, 1 мМ MgCl2, pH 7,3.
b) Метод фиксации потенциала (пэтч-кламп) осуществляли с помощью усилителя пэтч-клампа (Multiclamp 700A, Axon Instruments, CA, USA). Мембранный потенциал клеток GH4C1, экспрессирующих hα7-wt нАХР, был фиксирован в конфигурации целой клетки (Hamill et. al., 1981) посредством боросиликатного стеклянного электрода с сопротивлением на конце 1,5-5 МОм при заполнении его внутренним фиксирующим раствором. Регистрации были сделаны на клетках с мембранным сопротивлением >500 МОм и более предпочтительно 1 гигаОм и последовательным сопротивлением <15 МОм, по меньшей мере, с 60% компенсации последовательного сопротивления. Мембранный потенциал был зафиксирован при -70 мВ.
с) Агонисты
АХ, холин были приобретены у компании Sigma-Aldrich NV, Belgium.
d) Комплексное применение
16-канальную модель Dynflow DF-16 микрогидродинамической системы (Cellectricon, Sweden) для быстрой замены растворов (разрешающее время замены <100 мс) использовали для внесения контроля, агониста и РАМ-соединений к клеткам GH4C1, экспрессирующим hα7-wt нАХР.
Способ
Клетки GH4C1, экспрессирующие hα7-wt нАХР, высевали на чашках во внешнем фиксирующем растворе в камере системы для перфузии Dynaflow и оставляли стабилизировать вплоть до 20 минут. Индивидуальные клетки использовали для метода пэтч-клампа в конфигурации целой клетки и их осторожно отрывали от дна камеры пэтч-пипеткой в постоянно текущий перфузионный поток (0,75 мкл/мин) внешнего фиксирующего раствора. Активность РАМ определяли в реальном времени путем предварительного внесения соединений, подвергаемых тестированию, к клеткам с последующим внесением агониста никотинового рецептора α7 при постоянном контроле тока через клеточную мембрану. Соединения, производящие ответы в виде электрического тока, превосходящие ответы только на действие агониста, рассматривались как модуляторы РАМ рецептора α7 нАХР. В отдельном варианте осуществления изобретения агонист никотинового рецептора α7 активировали неизбирательным никотиновым агонистом, в более конкретном варианте осуществления изобретения агонистом был холин, и даже в более специальном варианте осуществления изобретения холин применяли при субмаксимальной концентрации 1 мМ. В другом варианте настоящего изобретения соединения, подвергаемые тестированию, вносили до агониста никотинового рецептора α7, в более конкретном варианте осуществления изобретения за 30 секунд до агониста. Контрольный ответ рассчитывали исходя из площади под кривой тока, вызванного в каждой клетке при действии субмаксимальной концентрации холина в течение 250 мс. Площадь под кривой является интегрированием суммарного тока в течение времени и является обычным представлением общего ионного потока через канал. Увеличения эффективности агониста, вызванные позитивным аллостерическим модулятором, рассчитывали как потенциирование “площади под кривой” (AUC) ответа агониста, выраженное в проценатах. Потенциирование, оказавшееся выше чем AUC в контроле, вызванное соединениями согласно изобретению, указывает на то, что они, как и ожидали, проявляют пригодную терапевтическую активность.
|
Тип 1 - соединения усиливают размерный эффект тока, вызванного 1 мМ холина, но минимально изменяют кинетику рецептора. В частности, скорость и степень десенситизации, вызванной агонистом, не изменяется. Поэтому соединение, модулирующее ответ к 1 мМ холина, находится близко к линейной шкале ответа к 1 мМ холина в отсутствие соединения α7-РАМ.
Тип 2 - соединения усиливают размерный эффект тока, вызванного 1 мМ холина, в то же время снижают скорость и/или степень десенситизации.
Тип 3 - соединения усиливают размерный эффект тока, вызванного 1 мМ холина. Когда тестируют при более высоких концентрациях вплоть до 10 мкМ, они полностью ингибируют десенситизацию, в частности при действии 1 мМ холина в течение 250 миллисекунд.
Тип 4 - соединения способствуют первоначальной десенситизации рецептора с последующим повторным открытием рецептора в течение действия агониста. При низкопотенциальных концентрациях соединения α7-РАМ индуцированная агонистом активация, за которой следует десенситизация, может быть еще отделена от индуцированного соединением повторного открывания как первоначального входящего тока-максимума. При более высокопотенциальных концентрациях соединения α7-РАМ повторное открытие происходит быстрее, чем закрытие вследствие десенситизации, так что первоначальный ток-максимум исчезает.
Удивительно, что абсолютная стереохимия оказывает влияние на тип модуляции: почти во всех случаях левовращающие соединения, которые предположительно все имеют абсолютную R-конфигурацию, представляют собой модуляторы типа 1, в то время как соответствующие правовращающие соединения, которые предположительно все имеют абсолютную S-конфигурацию, представляют собой модуляторы типа 2. Неожиданно, однако, левовращающее соединение Е28 является модулятором типа 2, в то время как соответствующее правовращающее соединение Е20 является модулятором типа 4.
Пример D.3: hERG
Связывающее сродство всех испытуемых соединений согласно настоящему изобретению у калиевого канала hERG составляет выше 10 мкМ (pIC50<5).