Результат интеллектуальной деятельности: ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ И ОЧИСТКИ РЕКОМБИНАНТНОГО ГОРМОНА РОСТА ЧЕЛОВЕКА ИЗ ТЕЛЕЦ ВКЛЮЧЕНИЯ
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, в частности к промышленному способу получения рекомбинантого гормона роста человека (рГРЧ) человека или соматропина.
Задачей настоящего изобретения является разработка технологического легко масштабируемого и экономически выгодного способа получения высокоочищенного рГРЧ, с чистотой не менее 98%.
Соматропин (соматотропный гормон-СТГ) - белковый гормон, вырабатывается передней долей гипофиза. Секретируется в кровь под воздействием соматостатина и СТГ-выделяющего фактора - соматолиберина. Время и частота выделения регулируются соматостатином, а количество выделяемого ГРЧ регулируется соматолиберином. ГРЧ относится к группе анаболических гормонов [Павловский А.Г. и др. // Гормон роста человека. Сборник научных трудов. Научный центр биологических исследований АН СССР, Пущино, 1988., Т. 305, №4., С.861-864.]. Молекула ГРЧ состоит из 191 аминокислотного остатка с молекулярной массой 22125 Да. Сохраняя схему строения, общую для других млекопитающих (содержит два остатка триптофана, три остатка тирозина и четыре остатка цистеина, которые образуют в молекуле два дисульфидных моста и формируют две петли - большую, включающую центральный участок аминокислотной последовательности между Cys54-Cys165, и малую (на С - концевом участке) между Cys182-Cys189), ГРЧ отличается аминокислотной последовательностью от изученных соматропинов животных на 34-35%. Этим объясняется неэффективность соматропинов животного происхождения как стимуляторов роста при введении людям [Овчинников Ю.А. // Биоорганическая химия. М.: Просвещение, 1987, с.815.].
Рекомбинантный гормон роста человека широко применяется в медицинской практике для лечения различного рода заболеваний, связанных с пониженной секрецией данного гормона в организме человека - малорослость, синдром Шерешевского-Тернера, гипофизарный нанизм [Abdelaziz Elamin, Tuvermo A. // Growth hormone treatment in children and adolescents. Annals of Saudi Medicine, 2002, V.22, P.47-55]. По данным научных исследований рГРЧ может применяться при комплексной терапии таких заболеваний, как диабет II типа, гипертония, атеросклероз, сердечно-сосудистая недостаточность, ожирение и других патологиях, которые проявляются в результате снижения уровня ГРЧ в организме человека с возрастом [Wilson М.Е., Gordon Т.Р., Chikazawa К., Gust D., Tanner J.М., Rudman С.G. // Effects of growth hormone on neonatal growth in nursing rhesus monkeys. J. Clin. Endocrinol. Metab., 1991, V.72(6), P.1302-1307.].
Создание штамма-продуцента ГРЧ позволило получать биологически активный белок в количестве, необходимом как для проведения различных структурно-функциональных исследований, так и для использования в медицинской практике. За рубежом созданы лекарственные препараты на основе рГРЧ (генотропин, протропин, хуматроп и др.). Гормон роста, получаемый в бактериальных клетках Е. coli, содержит дополнительный N-концевой остаток-метионин (Met-рГРЧ), который необходимо отщепить для получения нужного лекарственного препарата (рГРЧ).
Полученный таким образом рГРЧ очищают стандартными способами, упомянутыми, например, в патентах США: US 4601980, US 5424199, US 4658021 и др. В этих способах используют, как правило, солюбилизацию белка в буферных системах, содержащих хаотропные агенты или ионные детергенты в достаточно высоких концентрациях, которые сильно затрудняют очистку белка на последующих стадиях. Также известен способ проведения солюбилизации рГРЧ с помощью мочевины при высоких значениях рН [Ashok К. Patra et all // Optimization of inclusion body solubilization and renaturation of recombinant human growth hormone from Escherichia coli, Protein Expression and Purification, 2000, V 18, p.182-192]. Ренатурация белка проводится с помощью понижения концентрации хаотропного агента или добавлением окислительно-восстановительной пары. Дальнейшую очистку рГРЧ проводят следующими методами: фракционированием полиэтиленимином, гель-фильтрацией на Сефакриле S-200, фракционированием сульфатом аммония, ионообменной хроматографией, аффинной хроматографией с использованием антител против гормона роста. Такие способы трудоемки и дорогостоящи.
Известны также способы получения рГРЧ, [пат. ЕР №0114506, РФ 1596731, РФ 2099348], в которых предлагается проводить очистку белка с помощью его осаждения различными солями металлов, добиваясь, таким образом, избавления продукта от высокомолекулярных белковых примесей. Но такой подход приводит к длительным процессам центрифугирования или фильтрации. Такие методы усложняют процесс очистки белка и приводят к удорожанию технологии.
Наиболее близким к заявленному способу является способ [Воробьев И.И. и др. //Высокоэффективный процесс получения гормона роста человека, Биотехнология, 2005, №5, С.44-48], позволяющий получить интактный нативный рГРЧ, который включает несколько стадий: солюбилизацию телец включения с помощью 6 М гуанидина гидрохлорида, проведение рефолдинга с помощью добавления в реакционную смесь 1 мМ цистеамина и 0,1 мМ цистамина, очистку белка на ионообменном сорбенте Source 15Q, отщепление N-концевого метионина с помощью аминопептидазы. Окончательную очистку проводили с помощью обращенно-фазовой хроматографии на сорбенте С4, Nucleosil. Для перевода белка в фармакологический буферный раствор использовали эксклюзивную гель-фильтрацию на геле Superdex 75. Этот способ позволяет получить рГРЧ с выходом 0,1 г из 1 г целевого белка, солюбилизированного из телец включения.
Недостатком способа-прототипа является то, что использование 6 М гуанидина гидрохлорида для солюбилизации снижает выход Met-рГРЧ после процесса ренатурации и приводит к большим потерям белка до 50% от начального количества. Еще одним недостатком данного способа является необходимость концентрирования белка после ренатурации с помощью осаждения 50% раствором сульфата аммония, что в свою очередь при масштабировании процесса приводит к большим потерям белка и трудоемкостью на стадии центрифугирования.
Таким образом, существует потребность в новых улучшенных и более дешевых способах очистки рГРЧ, позволяющих получать высокоочищенный белок с высокими выходами, а также сократить время очистки.
Техническим результатом заявленного изобретения является упрощение технологии очистки рекомбинантного гормона роста человека.
Указанный технический результат достигается осуществлением заявленного способа очистки рекомбинантного гормона роста человека. Предлагаемый способ получения и очистки рГРЧ, синтезируемого в клетках Е. coli в виде нерастворимых телец включения, состоит из нескольких последовательных стадий.
Тельца включения Met-рГРЧ солюбилизируют в буферном растворе, содержащим 20 мМ Трис-HCl, 2 М мочевину, рН 11.0 и оставляют перемешиваться при комнатной температуре.
Раствор белка, полученный после солюбилизации, разбавляют буферным раствором, содержащим 20 мМ Трис-HCl. Затем доводят рН раствора до значения 8.0, добавляют 37% Н2О2 и продолжают перемешивать при комнатной температуре. Количество правильно уложенного белка контролируют с помощью ОФ ВЭЖХ на колонке YMC C4, 250×4,6, 5 мкм, 300 A (YMC Co., LTD, Japan).
Первую стадию хроматографической очистки Met-рГРЧ проводят при комнатной температуре на аксиальной колонне, упакованной ионообменным сорбентом Q Sepharose FF (GE Healthcare, USA). Раствор белка после ренатурации наносят на колонну, уравновешенную стартовым буферным раствором, который содержит 20 мМ Трис-HCL, рН 8.0. Элюирование белка с колонны ведут линейным градиентом концентрации хлорида натрия от 0-40%.
После первой стадии очистки на Q Sepharose FF для получения нативного белка (рГРЧ) проводят отщепление N-концевого метионина. Для этого в раствор Met-рГРЧ добавляют лейциновую аминопептидазу. Реакцию отщепления проводят при комнатной температуре и контролируют с помощью изократической ОФ ВЭЖХ на колонке Symmetry 300, C18, 300 Å (4,6×250 мм) (Waters, США).
На второй стадии хроматографической очистки рГРЧ, белок с отщепленным метионином наносят на аксиальную колонну, упакованную Butyl Sepharose 4 FF (GE Healthcare, USA) и уравновешенную стартовым буферным раствором, содержащим 20 мМ Трис-HCL, 2М NaCl, pH 7.0. Элюирование белка с колонки проводят снижающимся линейным градиентом концентрации хлорида натрия от 100% до 0.
После гидрофобной хроматографии проводят третью стадию хроматографической очистки рГРЧ на аксиальной колонне, упакованной ионообменным сорбентом Q Sepharose FF (GE Healthcare, USA). Раствор белка переводят с помощью гель-фильтрации на геле Sephadex G-25 Fine (GE Healthcare, USA) в буферный раствор, содержащий 50 мМ Гистидина, pH 6,5. Затем полученный раствор белка наносят на колонну с ионообменным сорбентом, уравновешенную стартовым буферным раствором, который содержит 50 мМ Гистидина, pH 6,5. Элюирование белка с колонны ведут линейным градиентом концентрации хлорида натрия от 0-30%.
Заключительную стадию хроматографической очистки рГРЧ проводят на колонне, заполненной гелем Sephacryl S-100 HR (GE Healthcare, USA). Предварительно колонну уравновешивают буферным раствором, который содержит 20 мМ Na2HPO4, 0,2% глицина, 4% маннитола, pH 6,8.
В результате получают 0,45 г рГРЧ с чистотой по ВЭЖХ 98-99% из 1 г целевого белка, полученного из телец включения.
Применение предложенного изобретения имеет следующие преимущества.
- Солюбилизацию Met-рГРЧ проводят в 2 М мочевине при pH 11.0, что позволяет сохранить сформировавшуюся вторичную структуру белка на стадии образования телец включения в клетка Е. coli. Применение более высоких значений pH приводит к преобразованию дисульфидной связи Cys182-Cys189 в тиоэфирную связь, что в свою очередь влечет за собой образование трудноотделяемых в условиях промышленного производства родственных примесей и снижению активности целевого продукта.
- Процесс ренатурации белка проводят при концентрации, равной 1,2 мг/мл, что позволяет проводить данную стадию в небольших объемах. В качестве окислителя сульфогидрильных групп белка впервые используют перекись водорода. При таких условиях время проведения процесса ренатурации сократилось до 2 ч при промышленных масштабах производства.
- Благодаря подобранным условиям, выход целевого белка после процесса ренатурации удалось поднять до 75-80%.
- Полностью исключены стадии концентрирования белка перед хроматографической очисткой с помощью осаждения белка 50% раствором сульфата аммония.
- Стадия очистки белка на обращенно-фазовом сорбенте заменена на стадию очистки с применением гидрофобной хроматографии, что привело к существенному упрощению и удешевлению процесса.
Предлагаемое изобретение иллюстрируется следующими фигурами.
На фиг.1 представлена аминокислотная последовательность рГРЧ.
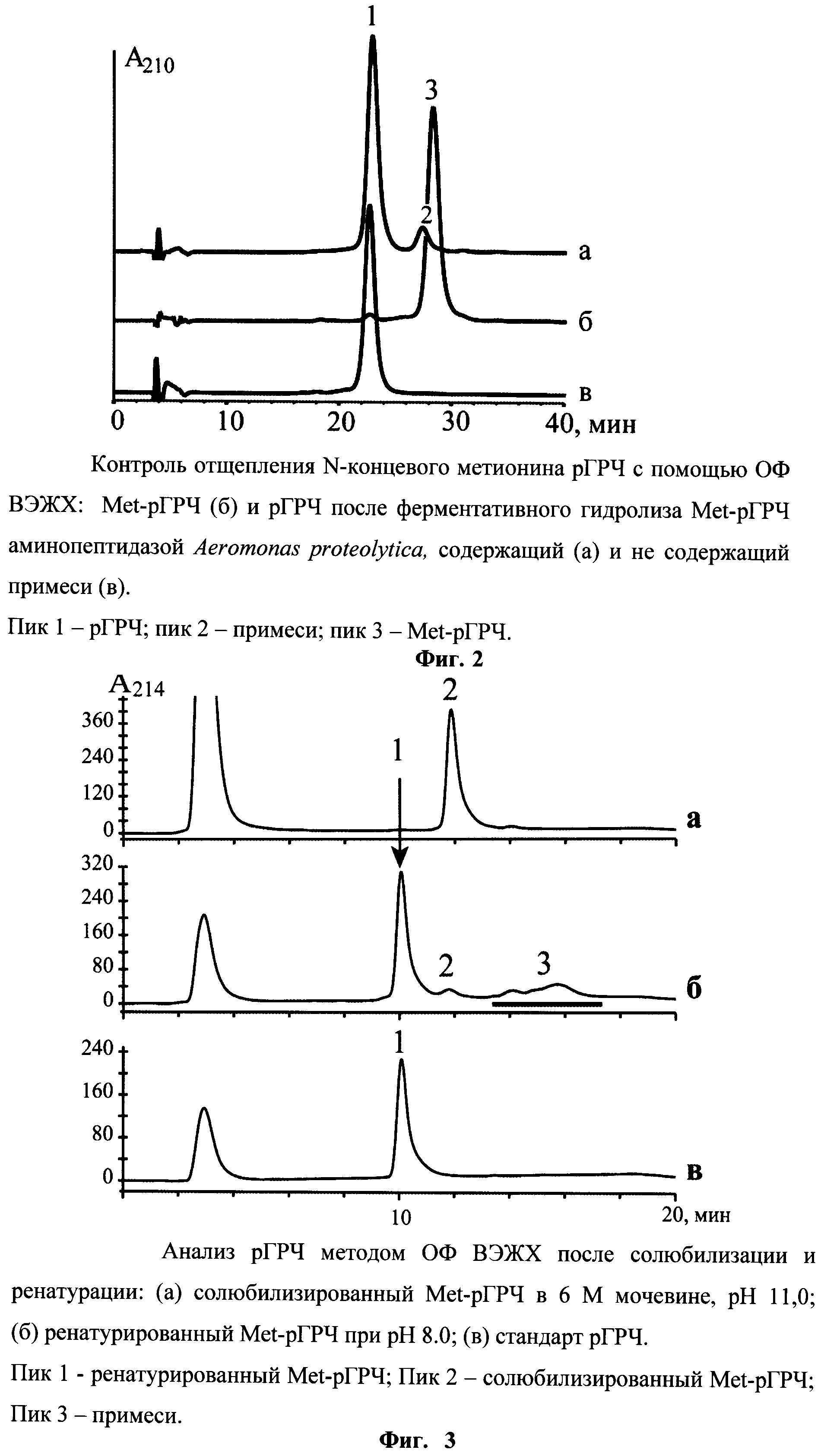
На фиг.2 представлен контроль отщепления N-концевого метионина рГРЧ с помощью ОФ ВЭЖХ
На фиг.3 представлен анализ рГРЧ методом ОФ ВЭЖХ после солюбилизации, ренатурации.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение высокоочищенного рГРЧ.
К 200 г влажных телец включения рГРЧ приливают 4 л буферного раствора, содержащего 20 мМ Трис-HCl, 2 М мочевины, рН 11.0, и оставляют перемешиваться в течение 30 мин при комнатной температуре. Раствор белка, полученный после солюбилизации, разбавляют буферным раствором, содержащим 20 мМ Трис-HCl. Доводят рН раствора до значения 8,0, добавляют 37% H2O2. Затем реакционную смесь оставляют перемешиваться при комнатной температуре в течение 2 часов.
Количество правильно уложенного белка контролируют с помощью ОФ ВЭЖХ на колонке YMC C4. Первую стадию хроматографической очистки рГРЧ проводят при комнатной температуре на аксиальной колонне серии BPG 140×500 мм, заполненную ионообменным сорбентом Q Sepharose FF. Раствор белка после ренатурации наносят на колонну, уравновешенную стартовым буферным раствором, который содержит 20 мМ Трис-HCL, рН 8.0. Нагрузка на сорбент может достигать 80 мг суммарного белка на 1 мл носителя. После нанесения всего объема белка сорбент промывают тремя объемами стартового буферного раствора. Элюирование белка с колонки проводят линейным градиентом концентрации хлорида натрия от 0 до 40%. Детектирование белка проводят при длине волны, равной 280 нм. Фракции, содержащие целевой белок, по результатам анализа на обращенно-фазовой колонке C4, объединяют.
На следующем этапе к раствору Met-рГРЧ, полученного после очистки на Q Sepharose FF, добавляют лейциновую аминопептидазу в расчете 7,5 ед. на 1 г белка. Реакцию отщепления проводят в течение 16 ч при комнатной температуре. Реакцию контролируют с помощью изократической ОФ ВЭЖХ на колонке Symmetry 300, C18, 4,6×250 мм, 5 мкм, 300 A (Waters, USA), фиг.2.
После отщепления N-концевого метионина хроматографическую очистку рГРЧ проводили с помощью гидрофобной хроматографии при комнатной температуре на аксиальной колонне серии BPG 140×500 мм, заполненную Butyl Sepharose 4 FF. К раствору белка после ионообменной хроматографии добавляют хлорид натрия до конечного содержания 2 М, доводят рН до значения 7,0 и наносят на колонну, уравновешенную стартовым буферным раствором. После нанесения всего объема белка сорбент промывают тремя объемами стартового буферного раствора, который содержит 20 мМ Трис-HCL, 2М NaCl рН 7,0. Элюирование белка с колонки проводят снижающимся линейным градиентом концентрации хлорида натрия 100 до 0%. Детектирование белка проводят при длине волны, равной 280 нм. Фракции, содержащие целевой белок, по результатам анализа на обращенно-фазовой колонке С4, объединяют.
Объединенную фракцию белка переводят с помощью гель-фильтрации на геле Sephadex G-25 Fine в буферный раствор, содержащий 50 мМ Гистидина, рН 6,5. Затем полученный раствор белка наносят на колонну с ионообменным сорбентом Q-Sepharose FF, уравновешенную стартовым буферным раствором, который содержит 50 мМ Гистидина, рН 6,5. Элюирование белка с колонны ведут линейным градиентом концентрации хлорида натрия от 0-30%. Детектирование белка проводят при длине волны, равной 280 н. м. Фракции, содержащие целевой белок по результатам анализа на обращенно-фазовой колонке С4, объединяют.
Заключительную стадию хроматографической очистки рГРЧ проводят на колонне, заполненной гелем Sephacryl S-100 HR. Предварительно колонну уравновешивают буферным раствором, который содержит 20 мМ Nа2НРO4, 0,2% глицина, 4% маннитола, рН 6,8. Далее проводят гель-фильтрацию полученного раствора белка после третьей стадии хроматографической очистки. Детектирование белка проводят при длине волны, равной 280 нм. В полученной фракции белка определяют концентрацию с помощью обращенно-фазовой хроматографии на колонке YMC, С4.
Выход готового продукта составляет 0,45 г высокоочищенного рГРЧ с 1 г целевого белка, полученного при солюбилизации из телец включения. Чистота белка - не менее 98%. Материальный баланс промышленного процесса очистки рГРЧ представлен в таблице 1.
|
Пример 2. Контроль отщепления N-концевого метионина рГРЧ с помощью ОФ ВЭЖХ на колонке Symmetry 300, C18.
Хроматографию проводят в изократическом режиме на обращенно-фазовой колонке Symmetry 300, C18, 5 мкм, 300А (4,6 × 250 мм) (Waters, США). Подвижная фаза содержит 0.5 М КН2РO4, рН 6.5, 24% 1-пропанола. Скорость потока - 0.5 мл/мин, температура - 45°С, длина волны - 220 нм. В качестве внешнего стандарта используют Европейский стандарт (CRS) с известной концентрацией. Продукт элюируется одним пиком (фиг.2), чистота продукта составляет не менее 98%.
Пример 3. Анализ рГРЧ с помощью ОФ ВЭЖХ на колонке YMC, C4.
Анализ полученного рГРЧ проводят с помощью обращенно-фазовой хроматографии в градиенте концентрации 1-пропанол:ацетонитрил (20:80) от 30 до 50% в присутствии 0,1% ТФУ на колонке YMC C4, 250х4,6 мм, 5 мкм, 300А (YMC Co., LTD, Japan) на хроматографе Agilent 1200 series (Agilent Corporation, USA). Продукт элюируется одним пиком (фиг.3), чистота продукта составляет не менее 98%.
Пример 4. Масштабирование процесса очистки соматропина рГРЧ.
Данные, приведенные в таблице 2, были получены на 10 опытно-промышленных сериях препарата.
|