Результат интеллектуальной деятельности: БЕЛКОВЫЕ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Родственные заявки
Для настоящей заявки испрашивается приоритет по предварительной заявке на патент США №61/004992, поданной 30 ноября 2007 г. Содержание приоритетной заявки включено в настоящее описание изобретения в качестве ссылки.
Уровень техники
Основной проблемой, связанной с фармацевтическими белковыми композициями, является преодоление определенной неустойчивости белков. Разрушение белков можно разделить на два разных класса, включающих химическую неустойчивость и физическую неустойчивость. Химическая неустойчивость вызывает изменение белка в результате образования или расщепления связей. Примеры проблем, вызываемых химической неустойчивостью, включают деамидирование, рацемизацию, гидролиз, окисление, бета-элиминирование и замену дисульфидных связей. Физическая неустойчивость, с другой стороны, не вызывает изменений ковалентных связей в белках. Физическая неустойчивость скорее предполагает изменение структуры белков более высокого порядка (второго порядка и выше). Такие изменения включают денатурацию, адсорбцию на поверхностях, агрегацию и преципитацию (Manning et al., Pharm. Res. 6, 903 (1989)).
Известно, что вышеуказанные типы неустойчивости, которые могут оказывать сильное влияние на промышленную жизнеспособность и эффективность фармацевтических белковых композиций, могут быть устранены путем введения в композицию дополнительных молекул. Устойчивость белка можно улучшить, вводя в композицию наполнители, которые взаимодействуют с белком в растворе, делая его устойчивым, растворимым и неагрегированным. Например, соли соединений и их ионные разновидности являются обычно используемыми добавками, вводимыми в белковые композиции. Такие соединения помогают устранить денатурацию белков, образуя неспецифические связи с белками и повышая теплостойкость. Соли соединений (например, NaCl, KCl) были успешно использованы в промышленно получаемых инсулиновых препаратах для устранения агрегации и преципитации (там же, на стр.911). Установлено, что аминокислоты (например, гистидин, аргинин), используемые в качестве добавок к композициям, уменьшают изменение вторичных структур белков (Tian et al., Int'l J. Pharm. 355, 20 (2007)). Другие примеры обычно используемых добавок включают многоатомные спирты, такие как глицерин и сахара, и поверхностно-активные вещества, такие как детергенты, как неионогенные (например, твин, плюроник), так и анионогенные (додецилсульфат натрия). Практически повсеместное присутствие добавок во всех жидких промышленно получаемых белковых композициях свидетельствует о том, что растворы белка без таких соединений могут подвергаться изменениям, вызывающим разрушение белков вследствие неустойчивости.
Главной целью белковой композиции является сохранение устойчивости данного белка в его нативной, фармацевтически активной форме в течение продолжительного периода времени для обеспечения приемлемого срока хранения белкового лекарственного средства. Однако сохранение устойчивости и растворимости белков в растворе создает особые трудности при получении фармацевтических композиций с вводимыми добавками. В настоящее время биологические композиции требуют использования дополнительных наполнителей для сохранения устойчивости белка. Жидкие фармацевтические композиции обычно содержат несколько добавок для сохранения устойчивости белка. Например, жидкая композиция, предназначенная для самостоятельного приема субъектом гормона роста человека, нордитропин SimpleXx®, содержит такие добавки, как маннит (сахарный спирт), гистидин и полоксамер 188 (поверхностно-активное вещество), используемые для стабилизации гормона.
Фармацевтические добавки должны быть растворимыми, нетоксичными и должны быть использованы в определенных концентрациях, оказывающих стабилизирующее действие на конкретный терапевтический белок. Так как стабилизирующее действие добавок зависит от белка и его концентрации, добавка, предназначенная для использования в фармацевтической композиции, должна быть тщательно исследована для гарантии того, что она не вызывает неустойчивость или не оказывает других отрицательных воздействий на химический или физический состав композиции. Ингредиенты, используемые для стабилизации белка, могут создавать проблемы, связанные с устойчивостью белка с течением времени или в результате изменения окружающих условий в процессе хранения.
Длительный срок хранения обычно достигается при хранении белка в замороженном виде (например, при -80°С) или в результате лиофилизации белка, то есть при хранении белка в лиофилизованном виде, что требует восстановления белка непосредственно перед использованием и создает существенное неудобство для субъекта. Однако замораживание белковой композиции с целью ее хранения может привести к локализации высоких концентраций белков и добавок, что вызывает локальное повышение значения рН, разрушение и агрегацию белков в композиции. Кроме того, специалистам в данной области хорошо известно, что процессы замораживания и оттаивания часто влияют на устойчивость белка, из чего следует, что даже хранение фармацевтического белка в замороженном виде может быть связано с утратой устойчивости вследствие замораживания и оттаивания. Первая стадия лиофилизации включает замораживание, которое может отрицательно влиять на устойчивость белка. В промышленном производстве фармацевтический белок может подвергаться повторному замораживанию-оттаиванию в процессе изготовления лекарственного средства (стадии выдерживания, хранения, повторного замораживания и повторного оттаивания для лучшего хронометрирования и увеличения размера партии получаемого лекарственного продукта) и во время последующей обработки лекарственного продукта (лиофилизации). Так как хорошо известно, что риск возникновения неустойчивости белка возрастает с увеличением циклов замораживания-оттаивания фармацевтического белка, создание условий, позволяющих сохранить устойчивость белка на протяжении повторяющихся циклов замораживания-оттаивания, становится трудновыполнимой задачей. В биофармацевтической промышленности существует потребность в композициях, которые можно замораживать и оттаивать без возникновения в композициях нежелательных свойств, в частности градиентов рН, осмоляльности, плотности или концентрации белка или наполнителя.
Фармацевтические продукты на основе белка часто должны иметь высокую концентрацию для достижения терапевтической эффективности. Высококонцентрированные белковые композиции желательны потому, что они позволяют уменьшить величину доз, создавая меньше неудобств для субъекта, и являются более экономичными при упаковке и хранении. Однако получение композиций с высокой концентрацией белка создает много проблем, включающих изготовление, сохранение устойчивости, исследование и введение, что особенно характерно для терапевтических белков. Например, трудности, связанные с агрегацией, нерастворимостью и разрушением белков, обычно возрастают по мере увеличения концентраций белка в композициях (для ознакомления с данным вопросом см. публикацию Shire, S.J. et al., J. Pharm. Sci. 93, 1390 (2004)). Ранее неизвестные отрицательные эффекты могут быть вызваны добавками, которые при более низких концентрациях добавок или белка оказывают благоприятное воздействие. Получение композиций с высокой концентрацией белка может вызвать значительные проблемы, связанные с опалесценцией, агрегацией и преципитацией. Помимо возможности агрегации ненативного белка и образования частиц, может возникнуть обратимая самоассоциация, которая может стать причиной повышенной вязкости или возникновения других свойств, осложняющих введение лекарственного средства в виде инъекции. Высокая вязкость может также осложнять получение высоких концентраций белков путем фильтрации.
Таким образом, в фармацевтических белковых композициях обычно тщательно сбалансированы ингредиенты и концентрации для повышения устойчивости белка и удовлетворения терапевтических требований при ограничении любых отрицательных побочных эффектов. Биологические композиции должны включать устойчивый белок, даже в высоких концентрациях, с конкретными количествами наполнителей, уменьшающими возможные терапевтические осложнения, проблемы хранения и общие затраты.
Поскольку белки и другие биологические макромолекулы стали предметом повышенного интереса в качестве лекарственных молекул, композиции, предназначенные для доставки таких молекул, приобретают важное значение. Несмотря на революционный прогресс в области широкомасштабного производства белков для терапевтического применения, эффективная и удобная доставка таких белков в организм субъектов по-прежнему остается главной проблемой в связи с присущими белкам физико-химическими и биологическими свойствами, включая плохую проницаемость через биологические мембраны, большой размер молекул, короткое время полужизни в плазме, самоассоциацию, физическую и химическую устойчивость, агрегацию, адсорбцию и иммуногенность.
Сущность изобретения
Настоящее изобретение относится к удивительному открытию, заключающемуся в том, что белки, находясь в воде, сохраняют растворимость и устойчивость даже в высоких концентрациях в течение длительного срока хранения в жидком виде или в процессе выполнения других стадий обработки, таких как замораживание-оттаивание и лиофилизация.
Настоящее изобретение относится к составам водных белковых композиций, которые включают воду и белок, при этом белок сохраняет устойчивость без необходимости использования дополнительных агентов, и к способам получения таких композиций. В частности, составы по настоящему изобретению получают при помощи диафильтрации, в процессе которой первый раствор, содержащий представляющий интерес белок, подвергают диафильтрации, используя воду в качестве диафильтрующей среды. Указанный процесс выполняют до достижения определенного объемного обмена, например, по меньшей мере пятикратного объемного обмена с водой. В результате выполнения способов по настоящему изобретению полученная водная композиция характеризуется значительным уменьшением общего процентного содержания наполнителей по сравнению с исходным раствором белка. Например, в водной композиции содержится на 95-99% меньше наполнителей по сравнению с исходным раствором белка. Несмотря на уменьшение количества наполнителей, белок остается растворимым и сохраняет биологическую активность, даже находясь в высоких концентрациях. Одним объектом настоящего изобретения являются способы получения составов с повышенной концентрацией белка при одновременном уменьшении дополнительных компонентов, таких как ионные наполнители. Гидродинамический диаметр белка в водной композиции меньше по сравнению с таким же белком в стандартном буферном растворе, таком как физиологический раствор с фосфатным буфером (PBS).
Композиция по настоящему изобретению обладает многими преимуществами по сравнению со стандартными содержащими буфер композициями. В соответствии с одним объектом изобретения водная композиция содержит белок в высоких концентрациях, таких как 50-200 мг/мл или больше. В композиции по настоящему изобретению могут быть введены белки с разной молекулярной массой даже в повышенных концентрациях. Несмотря на высокую концентрацию белка, композиция характеризуется минимальной агрегацией и может храниться в разных состояниях с использованием разных методов, например, замораживания, без вредного влияния, которого можно ожидать в случае композиций с высоким содержанием белка. Композиции по настоящему изобретению не требуют использования наполнителей, таких как, например, поверхностно-активные вещества и буферные системы, обычно применяемых в традиционных композициях для стабилизации белков в растворе. Благодаря низкому уровню ионных наполнителей водная композиция по настоящему изобретению характеризуется низкой проводимостью, например, менее 2 мСм/см. Составы по настоящему изобретению и способы их получения позволяют также получать водные белковые композиции, обладающие низкой осмоляльностью, например, не более 30 мОсмоль/кг. Кроме того, композиции по настоящему изобретению являются более предпочтительными по сравнению со стандартными композициями, так как они обладают пониженной иммуногенностью благодаря отсутствию дополнительных агентов, необходимых для стабилизации белка.
Составы по настоящему изобретению и способы их получения могут быть использованы для получения водной композиции, включающей воду и представляющий интерес белок любого типа. В соответствии с одним объектом изобретения составы по настоящему изобретению и способы их получения предназначены для крупных белков с молекулярной массой более 47 кДа. Антитела и их фрагменты, в том числе используемые in vivo и in vitro, являются еще одним примером белков, которые могут быть использованы в составах по настоящему изобретению и способах их получения.
Кроме того, многостадийные процессы очистки и концентрирования, которые необходимы для получения белковых и пептидных композиций, часто изменяют состав композиций, поэтому точный состав композиции может быть различным в разных партиях. Федеральные правила требуют, чтобы составы лекарственных средств были совершенно идентичными в композициях независимо от места производства и номера партии. Способы по настоящему изобретению могут быть использованы для создания растворов белков в воде, в которые буферы и наполнители добавляют в точных количествах, что позволяет получить белковые композиции с точными концентрациями буферов и/или наполнителей.
Один вариант осуществления изобретения относится к водной композиции, содержащей белок и воду и обладающей определенными характеристиками, которые включают, не ограничиваясь ими, низкую проводимость, например, менее примерно 2,5 мСм/см, концентрацию белка, равную по меньшей мере примерно 10 мкг/мл, осмоляльность не более примерно 30 мОсмоль/кг и молекулярную массу белка (Mw) более примерно 47 кДа. В одном варианте осуществления изобретения композиция по настоящему изобретению обладает лучшей устойчивостью, которая без каких-либо ограничений включает устойчивость при хранении в жидком виде в течение продолжительного периода времени (например, в течение по меньшей мере примерно 3 месяцев или по меньшей мере примерно 12 месяцев) или устойчивость в процессе по меньшей мере одного цикла замораживания/оттаивания (при отсутствии дополнительных циклов замораживания/оттаивания). В одном варианте осуществления изобретения композиция является устойчивой в течение по меньшей мере 3 месяцев в замороженном, лиофилизованном или высушенном распылением виде.
В одном варианте осуществления изобретения белки, входящие в состав композиции по настоящему изобретению, могут иметь минимальный размер, включающий, например, Mw более примерно 47 кДа, Mw более примерно 57 кДа, Mw более примерно 100 кДа, Mw более примерно 150 кДа, Mw более примерно 200 кДа или Mw более примерно 250 кДа.
В одном варианте осуществления изобретения композиция по настоящему изобретению характеризуется низкой проводимостью, включающей, например, проводимость менее примерно 2,5 мСм/см, проводимость менее примерно 2 мСм/см, проводимость менее примерно 1,5 мСм/см, проводимость менее примерно 1 мСм/см или проводимость менее примерно 0,5 мСм/см.
В одном варианте осуществления изобретения белки, входящие в состав композиции по настоящему изобретению, имеют концентрацию, включающую, например, концентрацию, равную по меньшей мере примерно 1 мг/мл, по меньшей мере примерно 10 мг/мл, по меньшей мере примерно 50 мг/мл, по меньшей мере примерно 100 мг/мл, по меньшей мере примерно 150 мг/мл, по меньшей мере примерно 200 мг/мл или более примерно 200 мг/мл.
В одном варианте осуществления изобретения композиция по настоящему изобретению характеризуется осмоляльностью не более примерно 15 мОсмоль/кг.
Один вариант осуществления изобретения относится к водной композиции, включающей воду и белок в данной концентрации, при этом белок имеет гидродинамический диаметр (Dh), который по меньшей мере примерно на 50% меньше Dh белка в буферном растворе при данной концентрации. В одном варианте осуществления изобретения Dh белка по меньшей мере на 50% меньше Dh белка в физиологическом растворе с фосфатным буфером (PBS) при данной концентрации; Dh белка по меньшей мере примерно на 60% меньше Dh белка в PBS при данной концентрации; Dh белка по меньшей мере примерно на 70% меньше Dh белка в PBS при данной концентрации.
Один вариант осуществления изобретения относится к водной композиции, содержащей белок, которая включает, не ограничиваясь ими, антитело или антигенсвязывающий фрагмент, при этом белок имеет гидродинамический диаметр (Dh) менее примерно 5 мкм. В одном варианте осуществления изобретения белок имеет Dh менее примерно 3 мкм.
В составах по настоящему изобретению и в способах их получения может быть использован любой белок. В одном варианте осуществления изобретения композиция включает терапевтический белок. В одном варианте осуществления изобретения композиция включает антитело или его антигенсвязывающий фрагмент. Типы антител или антигенсвязывающих фрагментов, используемых в составах по настоящему изобретению и в способах их получения, включают, не ограничиваясь ими, химерное антитело, человеческое антитело, гуманизированное антитело и домен-специфическое антитело (dAb). В одном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент является антителом против TNFα, которое включает, не ограничиваясь ими, адалимумаб или голимумаб, или антителом против IL-12, которое включает, не ограничиваясь им, антитело J695. Кроме того, композиция по настоящему изобретению может также включать по меньшей мере два разных типа белков, например, адалимумаб и антитело J695.
В другом варианте осуществления изобретения композиция может дополнительно включать неионизируемый наполнитель. Примеры неионизируемых наполнителей включают, не ограничиваясь ими, сахарный спирт или полиол (например, маннит или сорбит), неионогенное поверхностно-активное вещество (например, полисорбат 80, полисорбат 20, полисорбат 40, полисорбат 60) и/или сахар (например, сахарозу). Другие неограничивающие примеры неионизируемых наполнителей, которые могут входить в состав композиции по настоящему изобретению, включают, не ограничиваясь ими, нетрегалозу, раффинозу и мальтозу.
В одном варианте осуществления изобретения композиция не включает агент, выбираемый из группы, состоящей из модификатора тоничности, стабилизатора, поверхностно-активного вещества, антиоксиданта, криопротектора, наполнителя, лиопротектора, основного компонента и кислотного компонента.
Композиция по настоящему изобретению может быть пригодна для любого применения, включая применения in vitro и in vivo. В одном варианте осуществления изобретения композиция по настоящему изобретению предназначена для введения субъекту одним из способов введения, которые включают, не ограничиваясь ими, подкожное, внутривенное, внутрикожное, чрескожное, внутрибрюшинное, внутримышечное введение и введение ингаляцией. Композиция по настоящему изобретению может быть использована при лечении нарушения у субъекта.
В объем настоящего изобретения входят устройства, которые могут быть использованы для доставки композиции по настоящему изобретению. Примеры таких устройств включают, не ограничиваясь ими, шприц, устройство по типу ”писчего пера”, имплант, безыгольное инъекционное устройство, ингалятор и пластырь.
В одном варианте осуществления изобретения композиция по настоящему изобретению является фармацевтической композицией.
Настоящее изобретение относится также к способу получения водной композиции, содержащей белок и воду, который включает получение белка в первом растворе и диафильтрацию первого раствора с использованием воды в качестве диафильтрующей среды до достижения по меньшей мере пятикратного объемного обмена с водой с образованием водной композиции. В одном варианте осуществления изобретения белок в полученной композиции сохраняет свою биологическую активность.
Настоящее изобретение дополнительно относится к способу получения водной композиции, содержащей белок, который включает получение белка в первом растворе; диафильтрацию первого раствора с использованием воды в качестве диафильтрующей среды до достижения по меньшей мере пятикратного объемного обмена с водой с образованием диафильтрованного раствора белка; и концентрирование диафильтрованного раствора белка с образованием водной композиции, содержащей белок. В одном варианте осуществления изобретения белок в полученной композиции сохраняет свою биологическую активность.
В одном варианте осуществления изобретения требуемая концентрация диафильтрованного раствора белка достигается центрифугированием.
В одном варианте осуществления изобретения диафильтрующая среда состоит из воды.
В одном варианте осуществления изобретения первый раствор подвергают диафильтрации с водой до достижения объемного обмена, превышающего пятикратный объемный обмен. В одном варианте осуществления изобретения первый раствор подвергают диафильтрации с водой до достижения по меньшей мере примерно шестикратного объемного обмена. В одном варианте осуществления изобретения первый раствор подвергают диафильтрации с водой до достижения по меньшей мере примерно семикратного объемного обмена.
В одном варианте осуществления изобретения водная композиция имеет конечную концентрацию наполнителей, которая по меньшей мере примерно на 95% меньше, чем в первом растворе.
В одном варианте осуществления изобретения водная композиция имеет конечную концентрацию наполнителей, которая по меньшей мере примерно на 99% меньше, чем в первом растворе.
В одном варианте осуществления изобретения первый раствор белка получают из системы экспрессии в клетках млекопитающего и очищают для удаления белков клеток-хозяев (НСР).
В одном варианте осуществления изобретения способ по настоящему изобретению дополнительно включает добавление наполнителя к водной концентрации.
Краткое описание чертежей
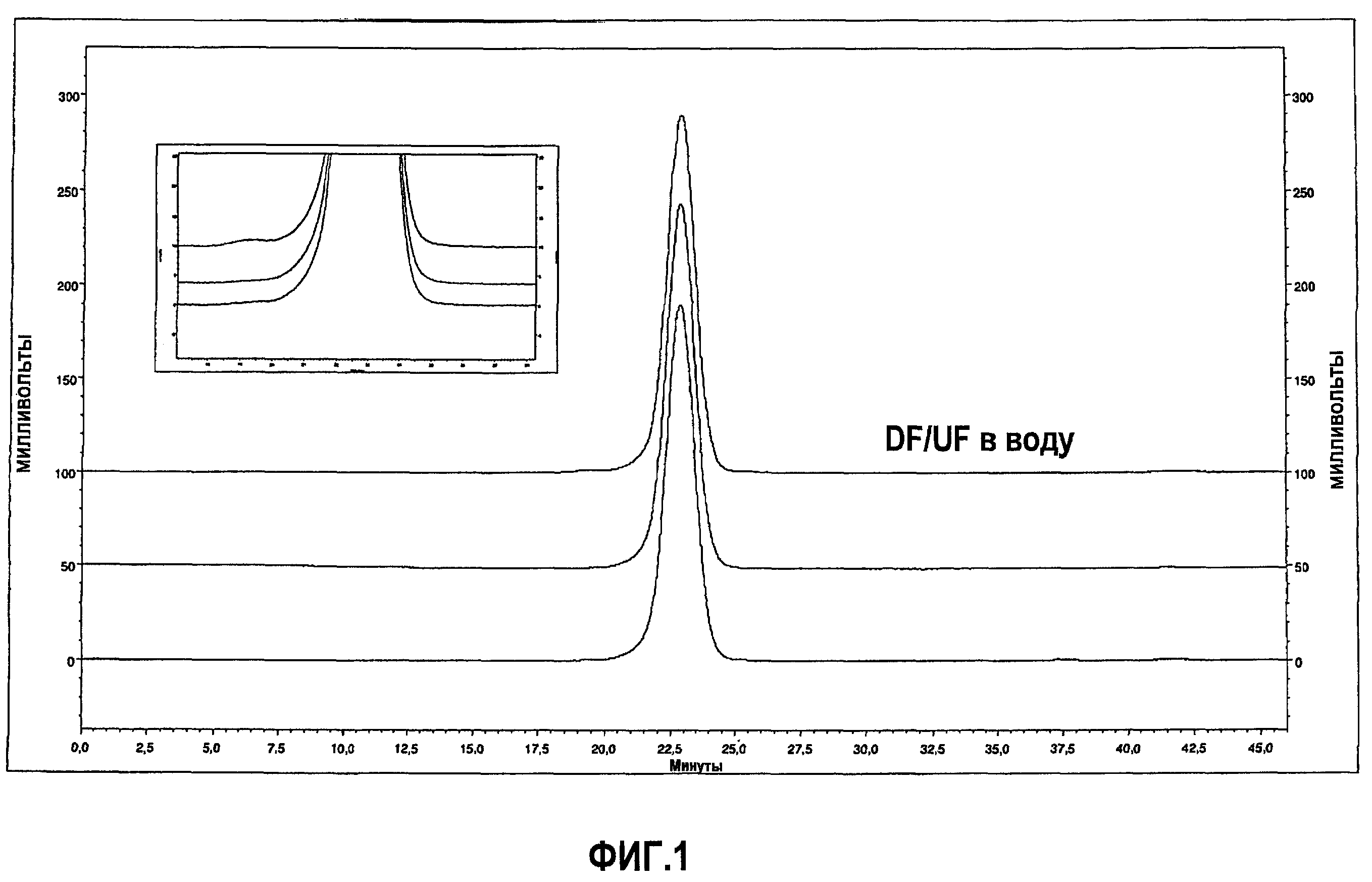
На фиг.1 показана хроматограмма, полученная при помощи вытеснительной хроматографии (SEC), эталона адалимумаба AFP04C (нижняя линия), лекарственного вещества адалимумаба (лекарственное вещество до (средняя линия) и после обработки DF/UF (верхняя линия).
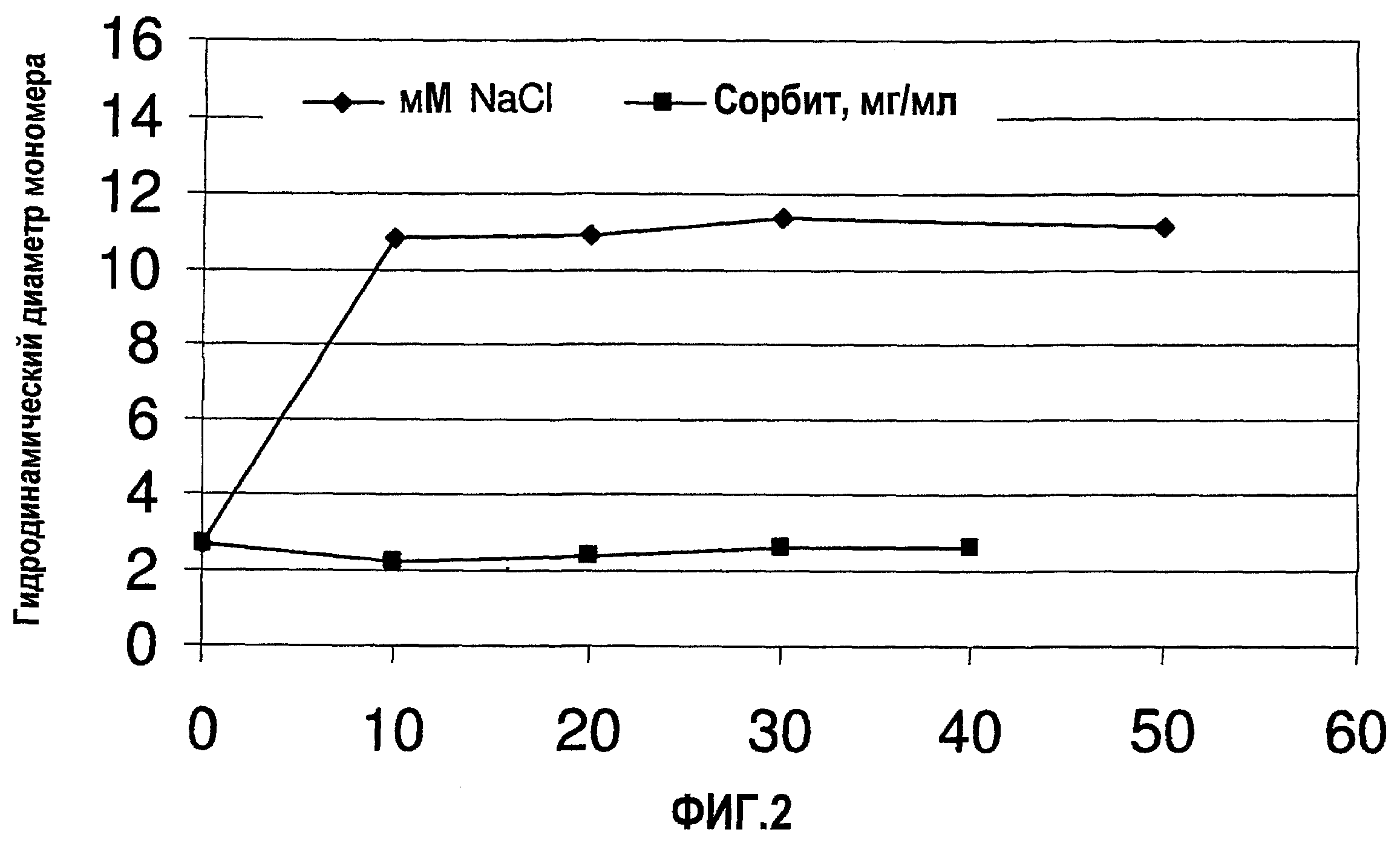
На фиг.2 показано влияние концентраций сорбита (неионизируемый наполнитель) и NaCl (ионизируемый наполнитель) на гидродинамический диаметр (Dh) мономера адалимумаба после добавления соединения наполнителя к DF/UF-обработанному мономеру адалимумаба.
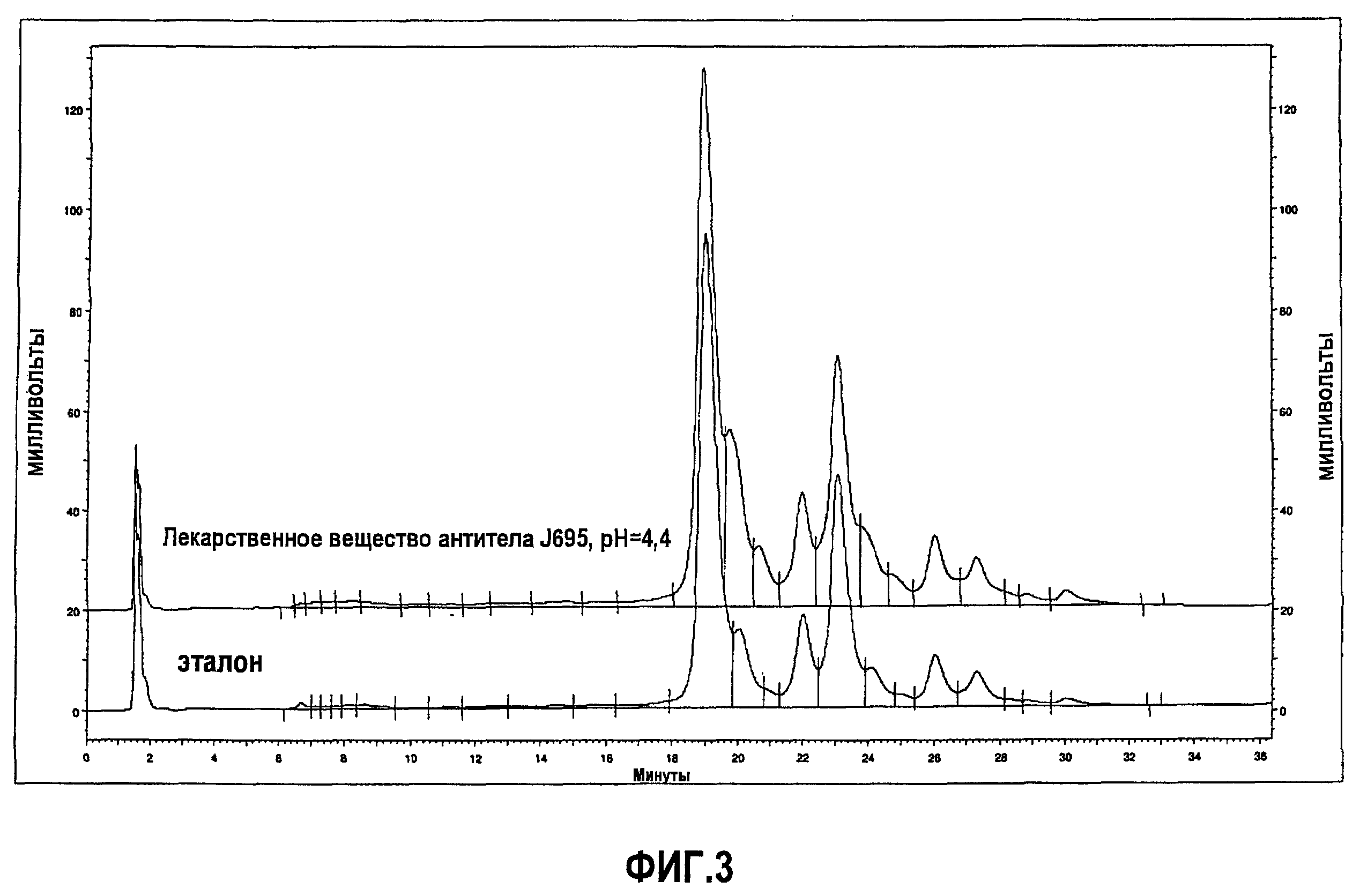
На фиг.3 показан профиль, полученный при помощи ионообменной хроматографии (IEC), эталона антитела J695 (нижний график) и лекарственного вещества антитела J695 при рН, доведенном до рН 4,4 (верхний график).
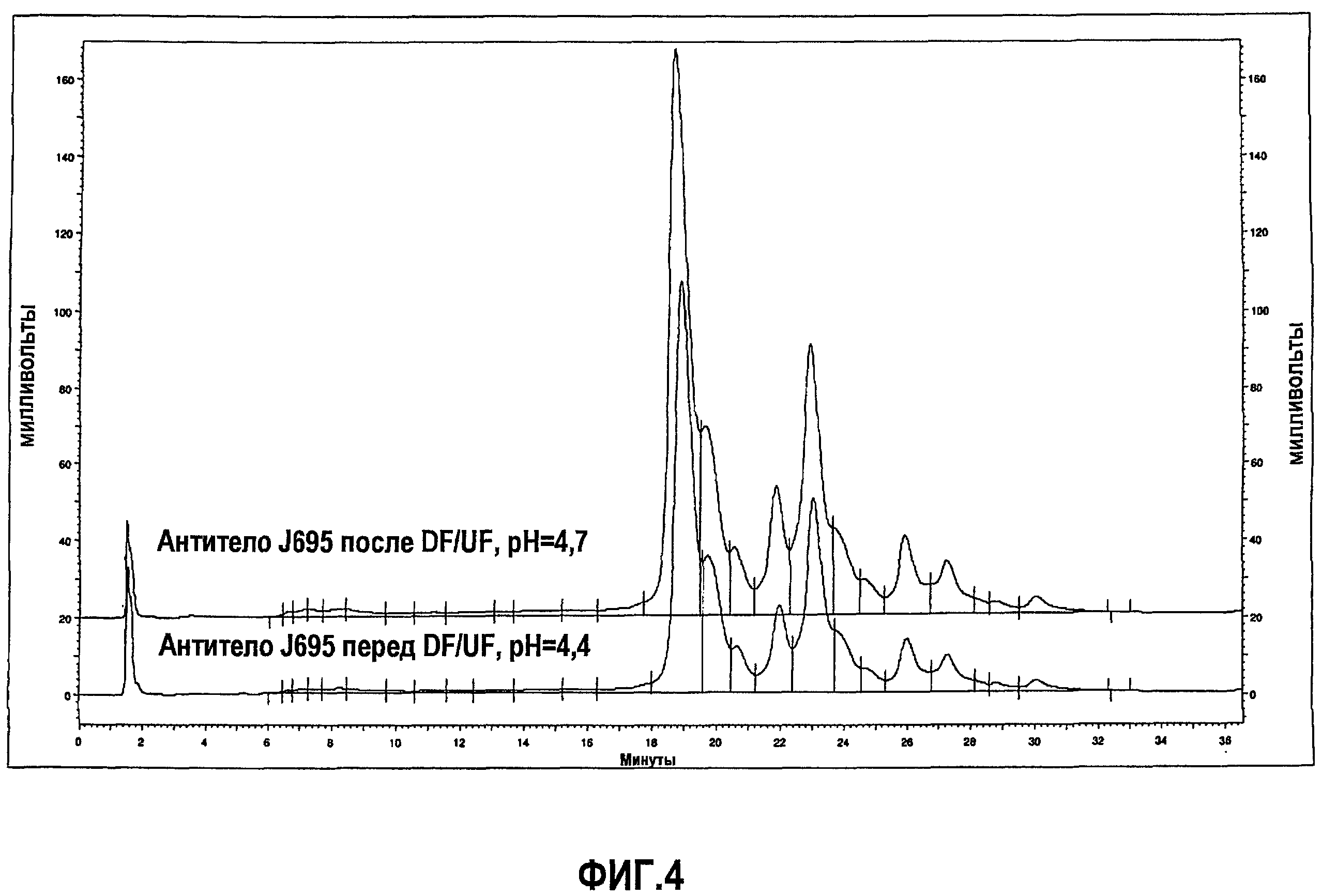
На фиг.4 показан профиль, полученный при помощи IEC, антитела J695 после обработки DF/UF с использованием воды Milli-Q, рН 4,7 (верхний график) и лекарственного вещества антитела J695 до обработки DF/UF, рН доведен до рН 4,4 (нижняя кривая).
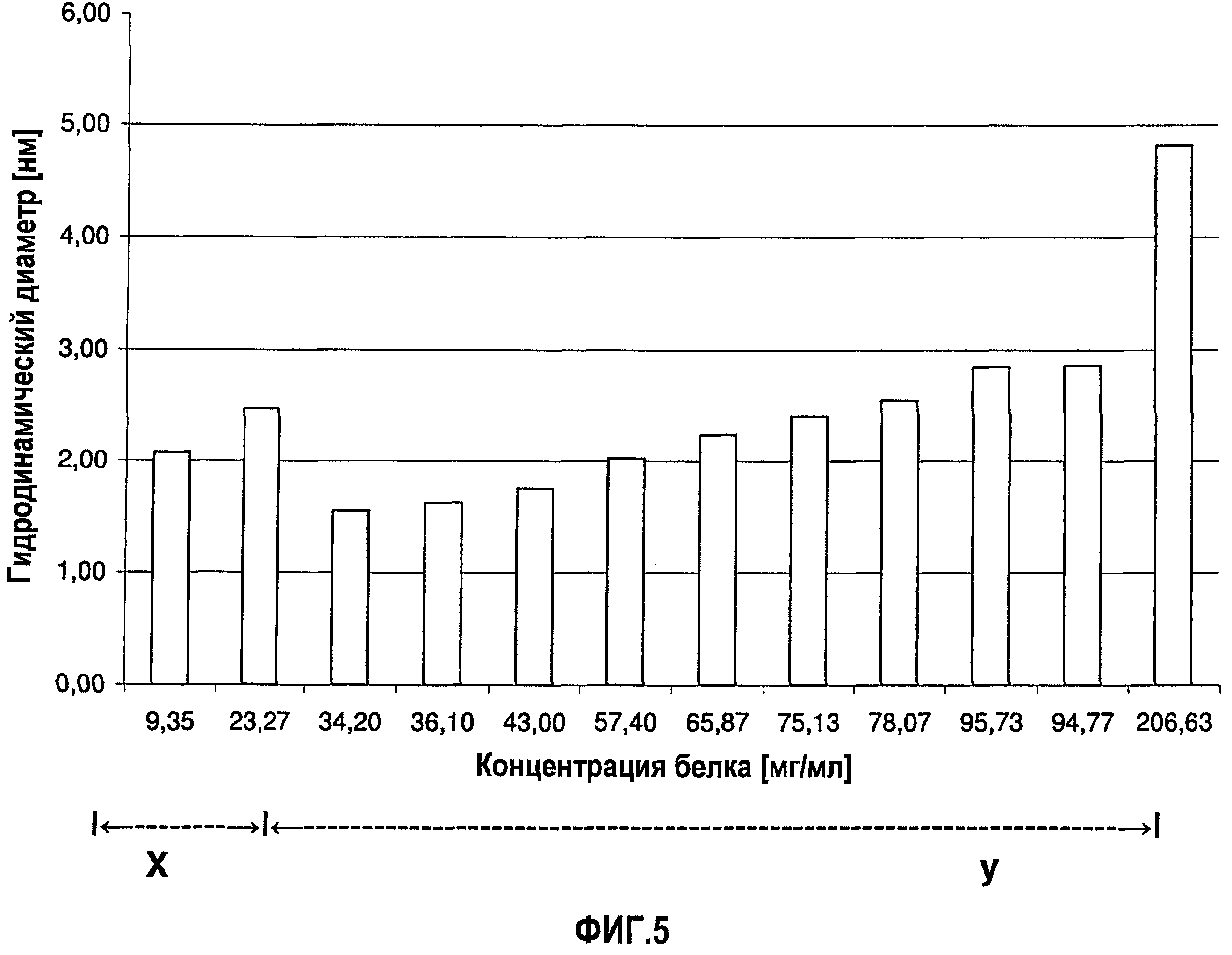
На фиг.5 графически изображена корреляция гидродинамического диаметра (z-среднее) с концентрацией адалимумаба (растворенного в воде для инъекций (WFI)). Х: определение произведено в соответствии со стандартной методикой эксперимента (SOP) при вязкости образца, принятой равной 1,1 мПа*с. У: определение произведено в соответствии с SOP при вязкости образца, принятой равной 1,9 мПа*с.
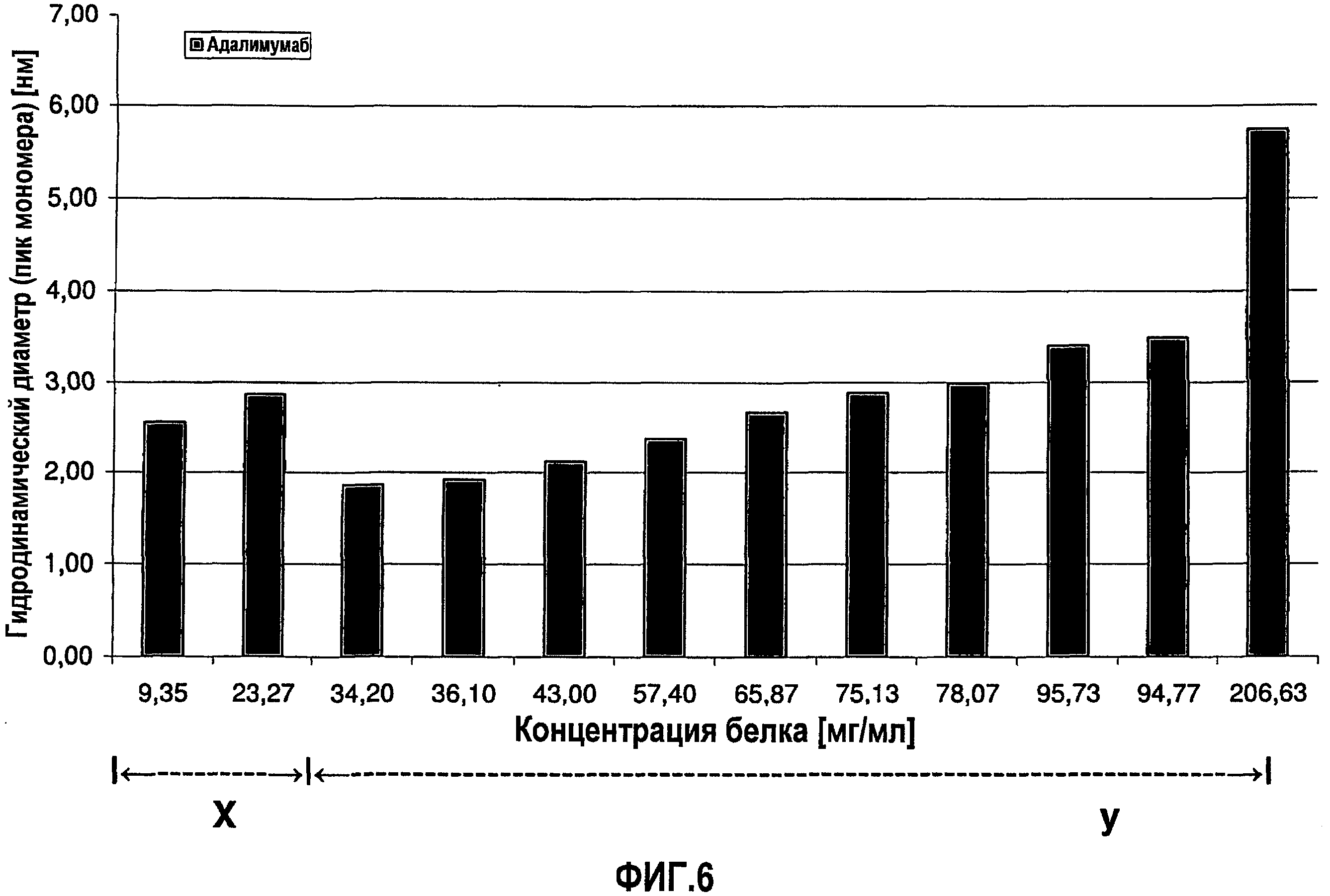
На фиг.6 графически изображена корреляция гидродинамического диаметра (пик мономера) с концентрацией адалимумаба (растворенного в воде для инъекций). Х: определение произведено в соответствии с SOP при вязкости образца, принятой равной 1,1 мПа*с. У: определение произведено в соответствии с SOP при вязкости образца, принятой равной 1,9 мПа*с.
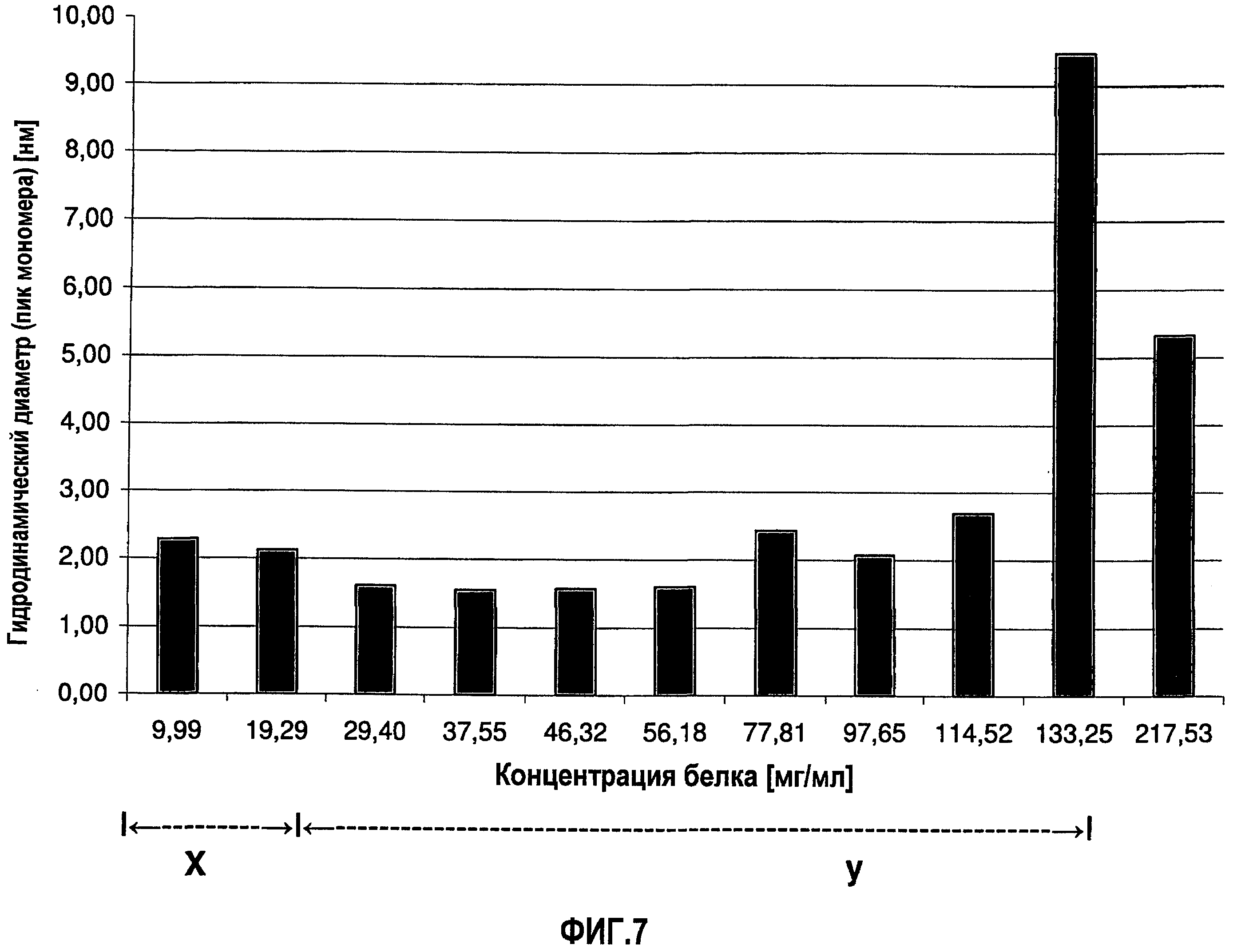
На фиг.7 графически изображена корреляция гидродинамического диаметра (z-среднее) с концентрацией антитела J695 (растворенного в воде для инъекций). Х: определение произведено в соответствии с SOP при вязкости образца, принятой равной 1,1 мПа*с. У: определение произведено в соответствии с SOP при вязкости образца, принятой равной 1,9 мПа*с.
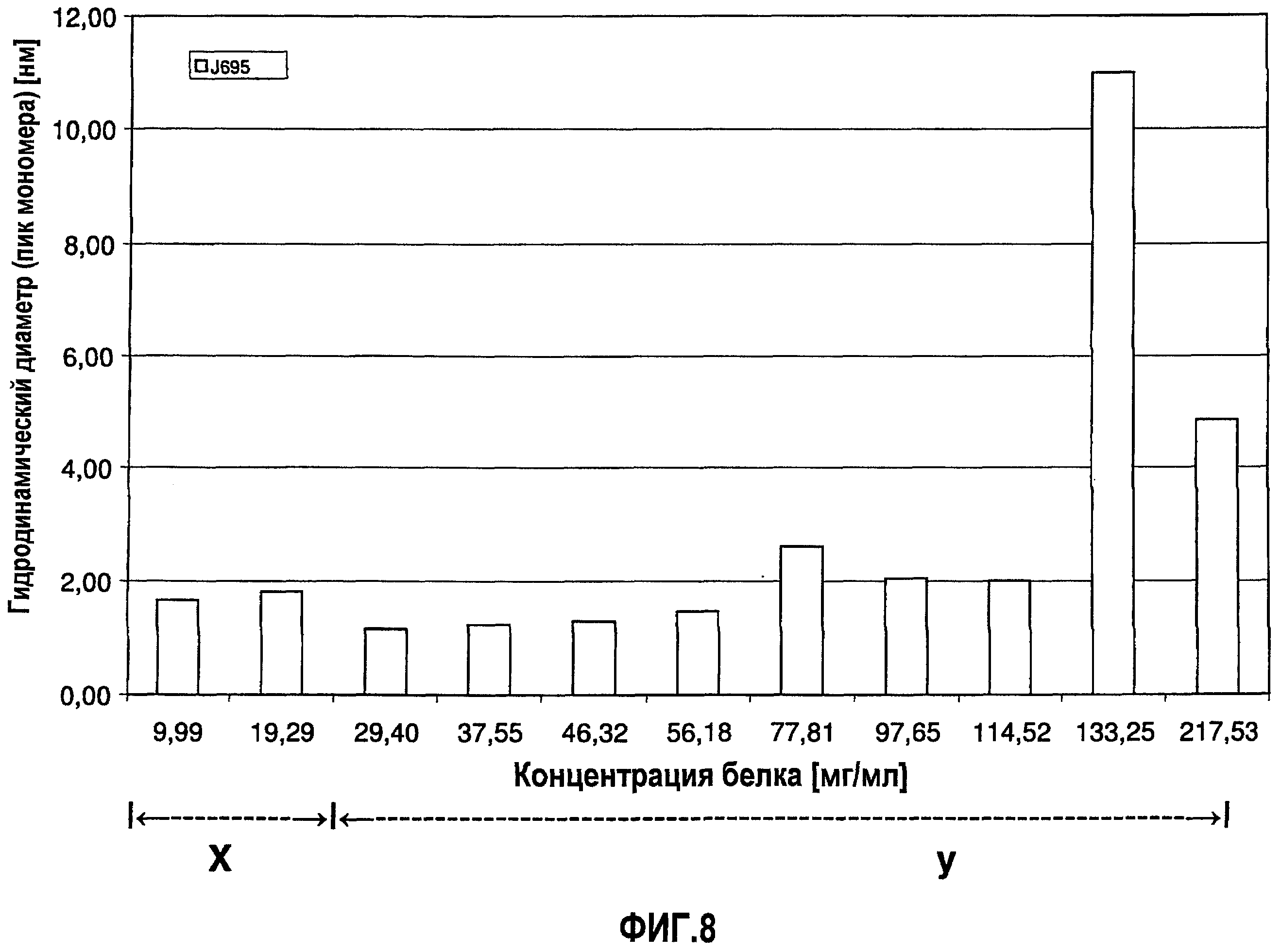
На фиг.8 графически изображена корреляция гидродинамического диаметра (пик мономера) с концентрацией антитела J695 (растворенного в воде для инъекций). Х: определение произведено в соответствии с SOP при вязкости образца, принятой равной 1,1 мПа*с. У: определение произведено в соответствии с SOP при вязкости образца, принятой равной 1,9 мПа*с.
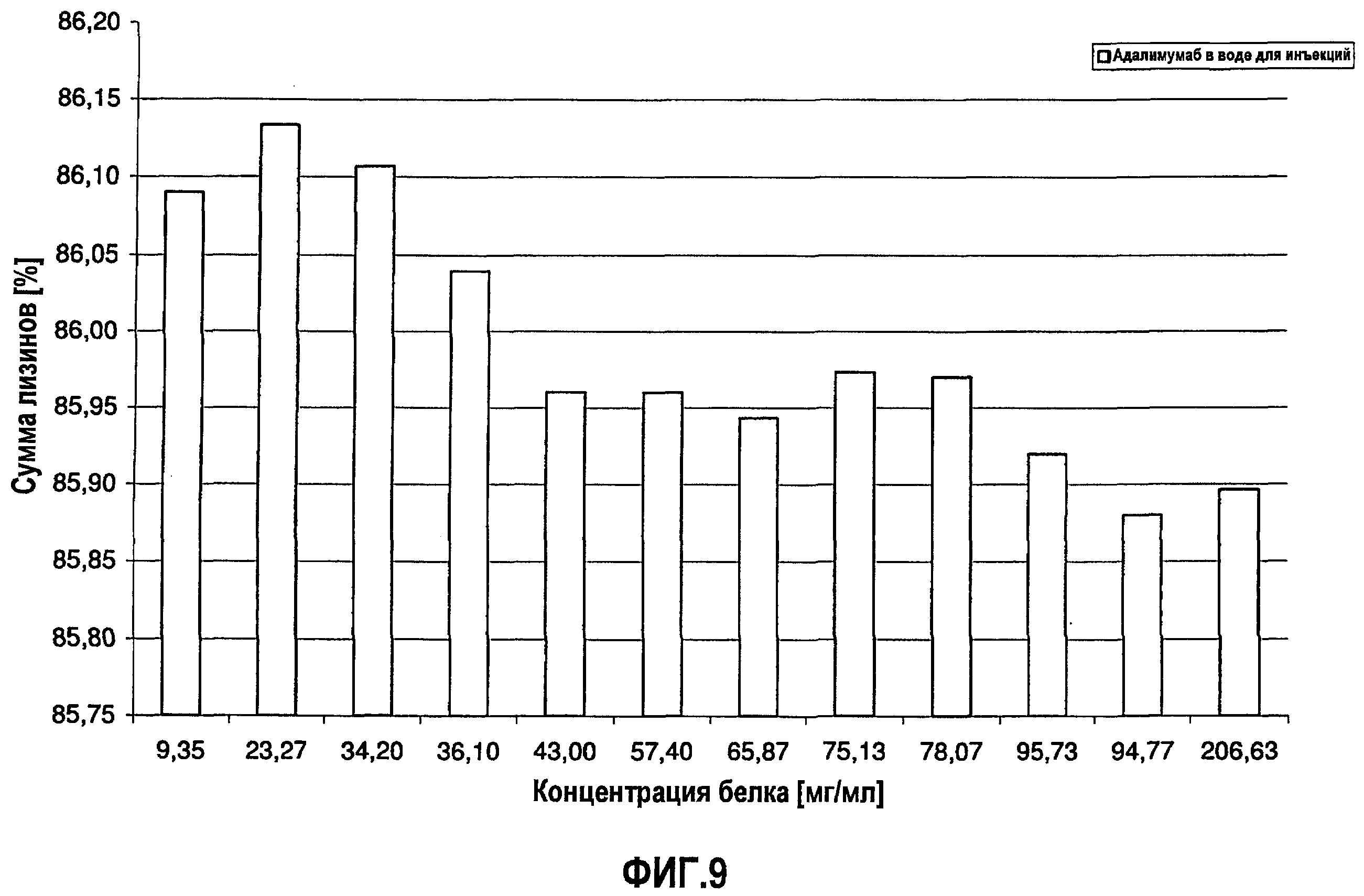
На фиг.9 показана сумма лизина 0, 1 и 2 адалимумаба [%] в зависимости от концентрации адалимумаба в воде для инъекций.
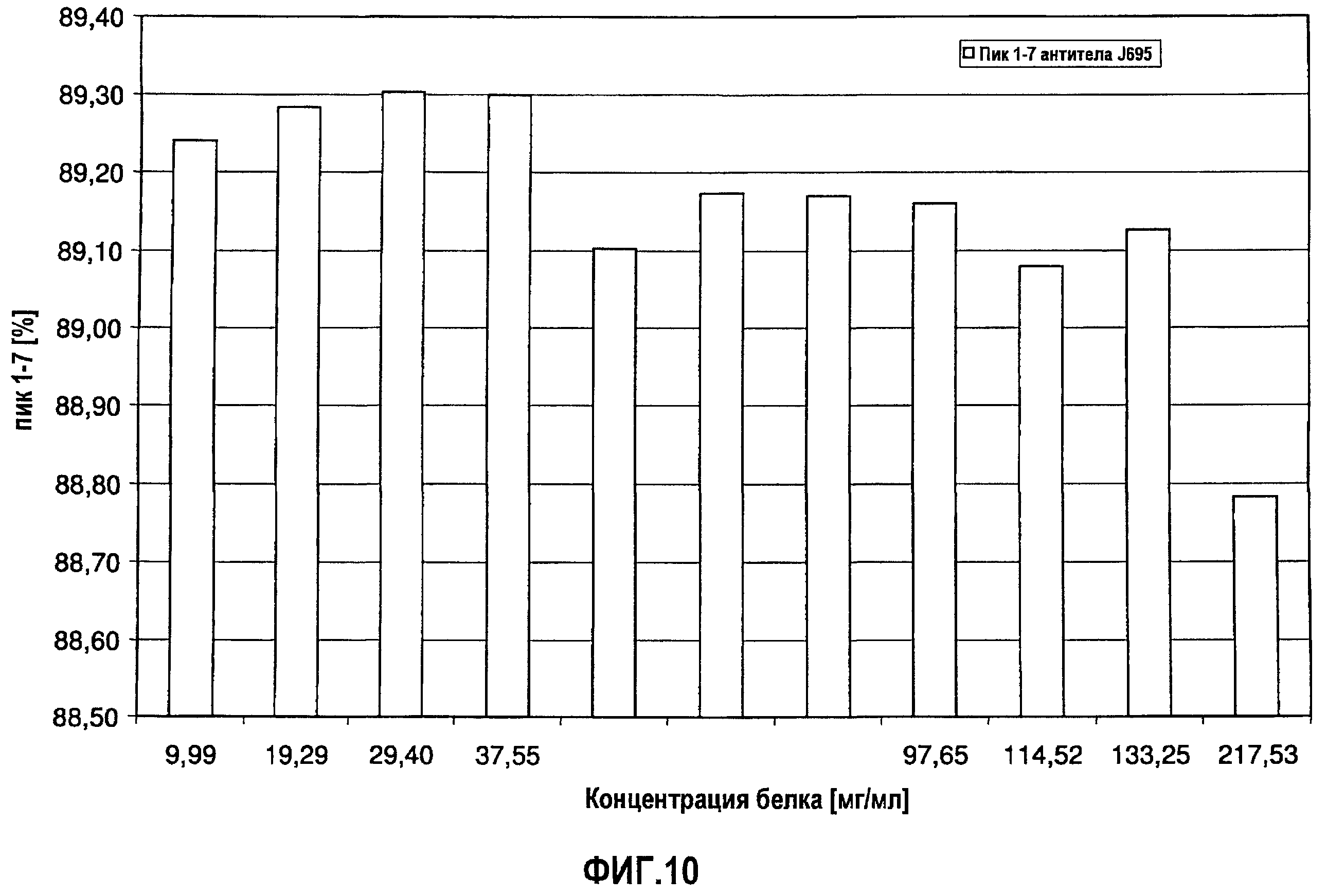
На фиг.10 показана сумма пиков 1-7 антитела J695 [%] в зависимости от концентрации антитела J695 в воде для инъекций.
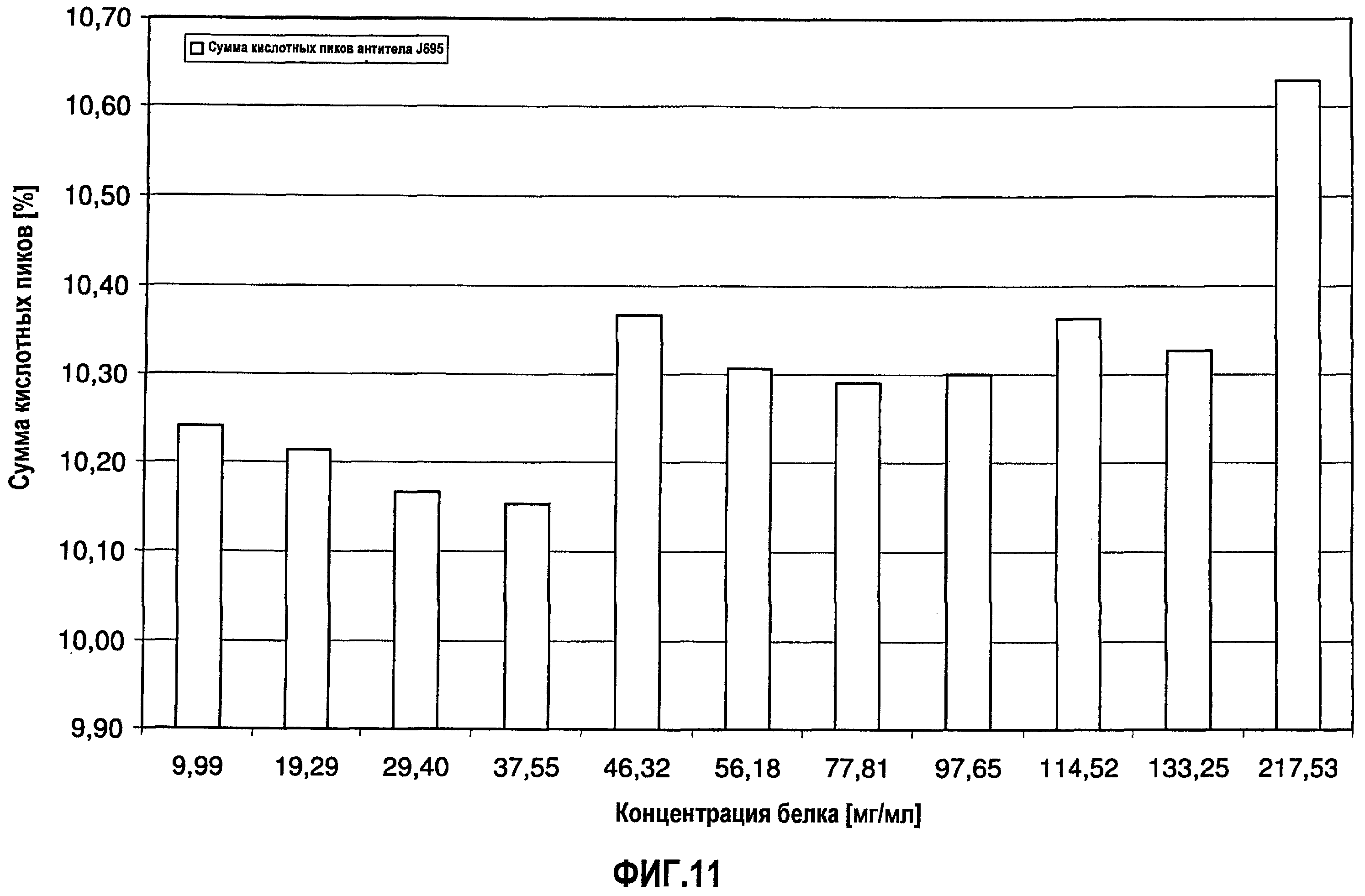
На фиг.11 показана сумма кислотных пиков антитела H695 [%] в зависимости от концентрации антитела J695 в воде для инъекций.
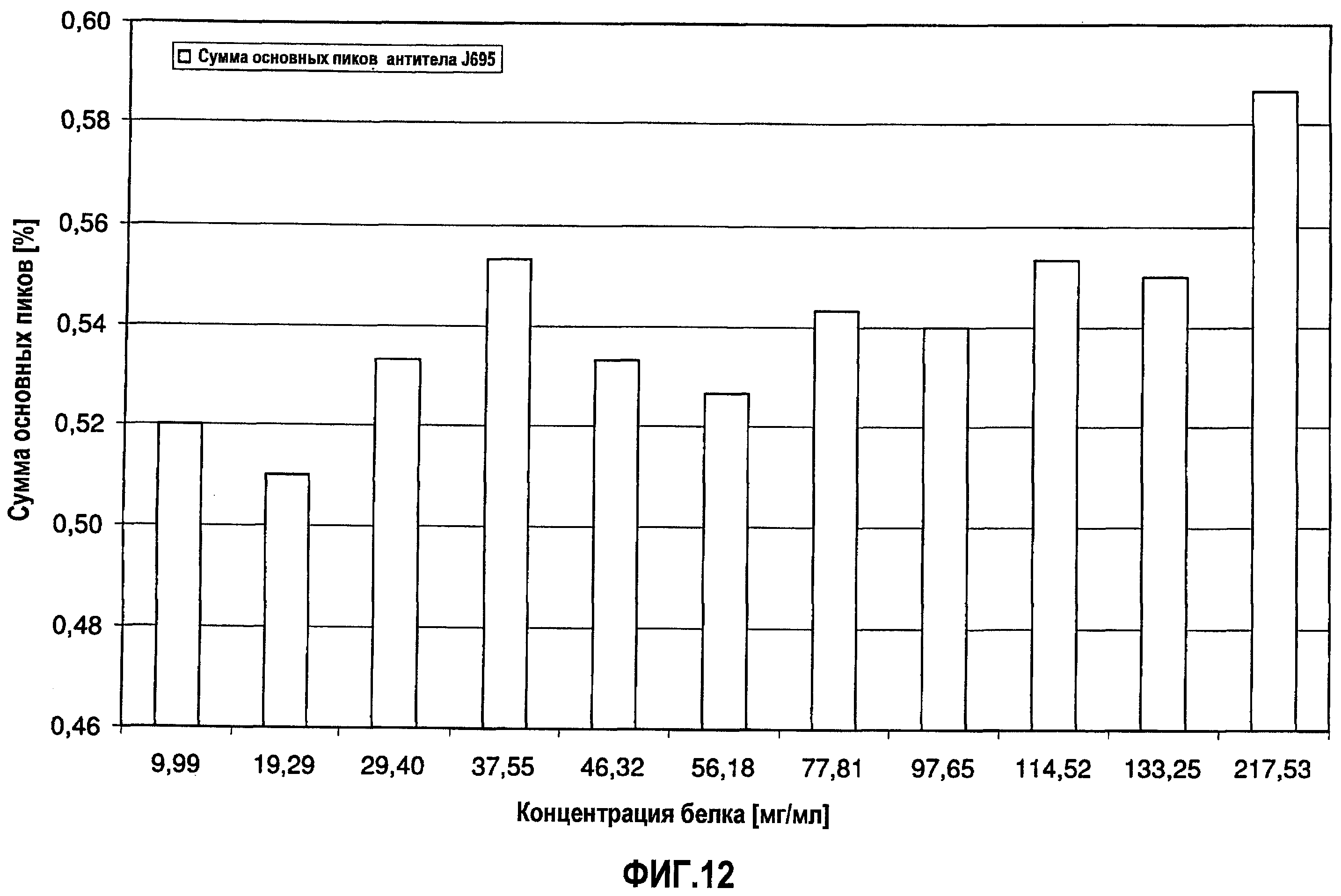
На фиг.12 показана сумма основных пиков антитела J695 [%] в зависимости от концентрации антитела J695 в воде для инъекций.
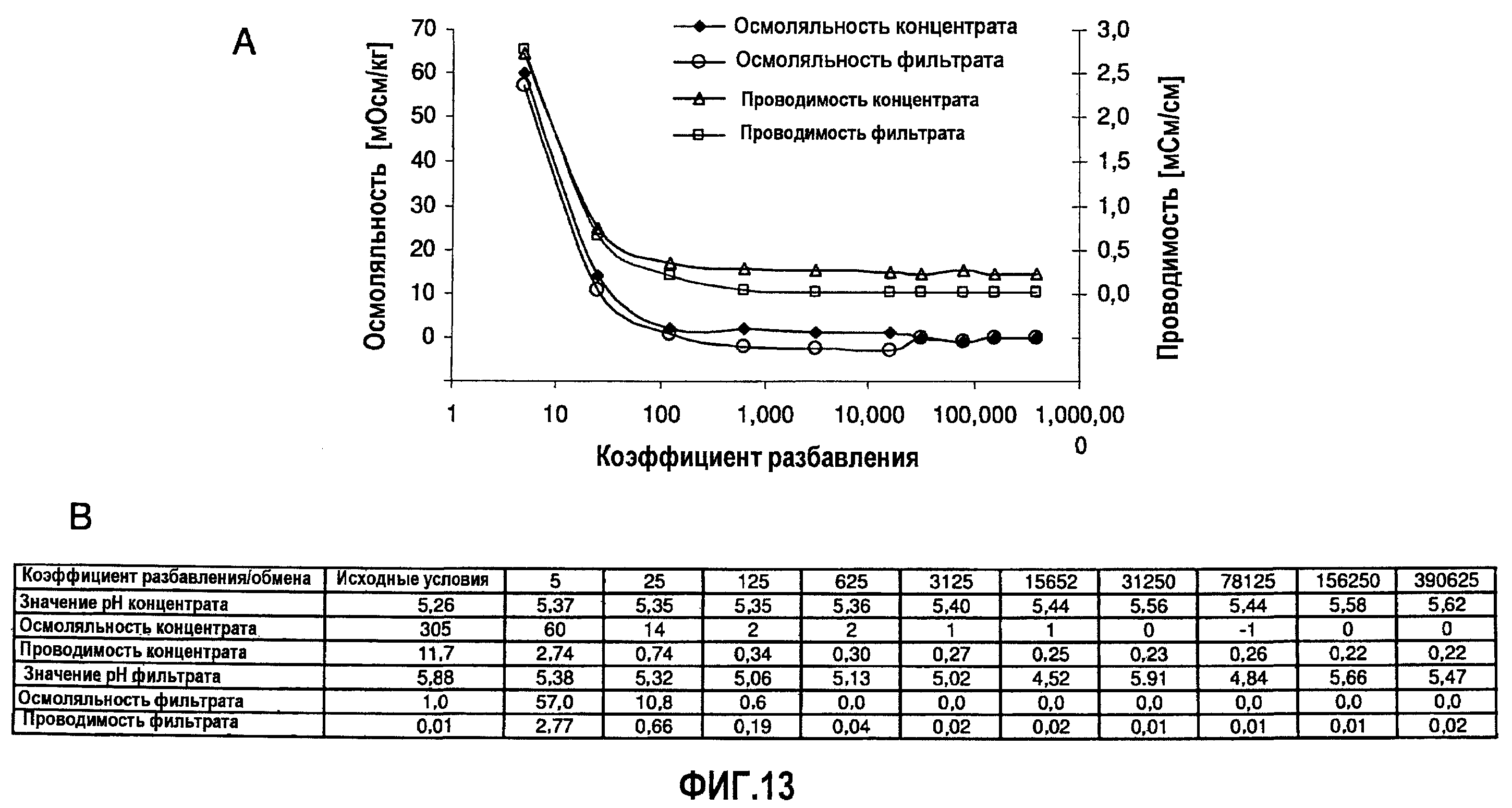
На фиг.13 показана эффективность диализа, выполненного в примере 12, в отношении уменьшения количества компонентов, определяющих осмоляльность и проводимость препарата (BDS, 74 мг/мл, объем образца 10 мл, мембрана SpectraPor7 с MWCO 10000).
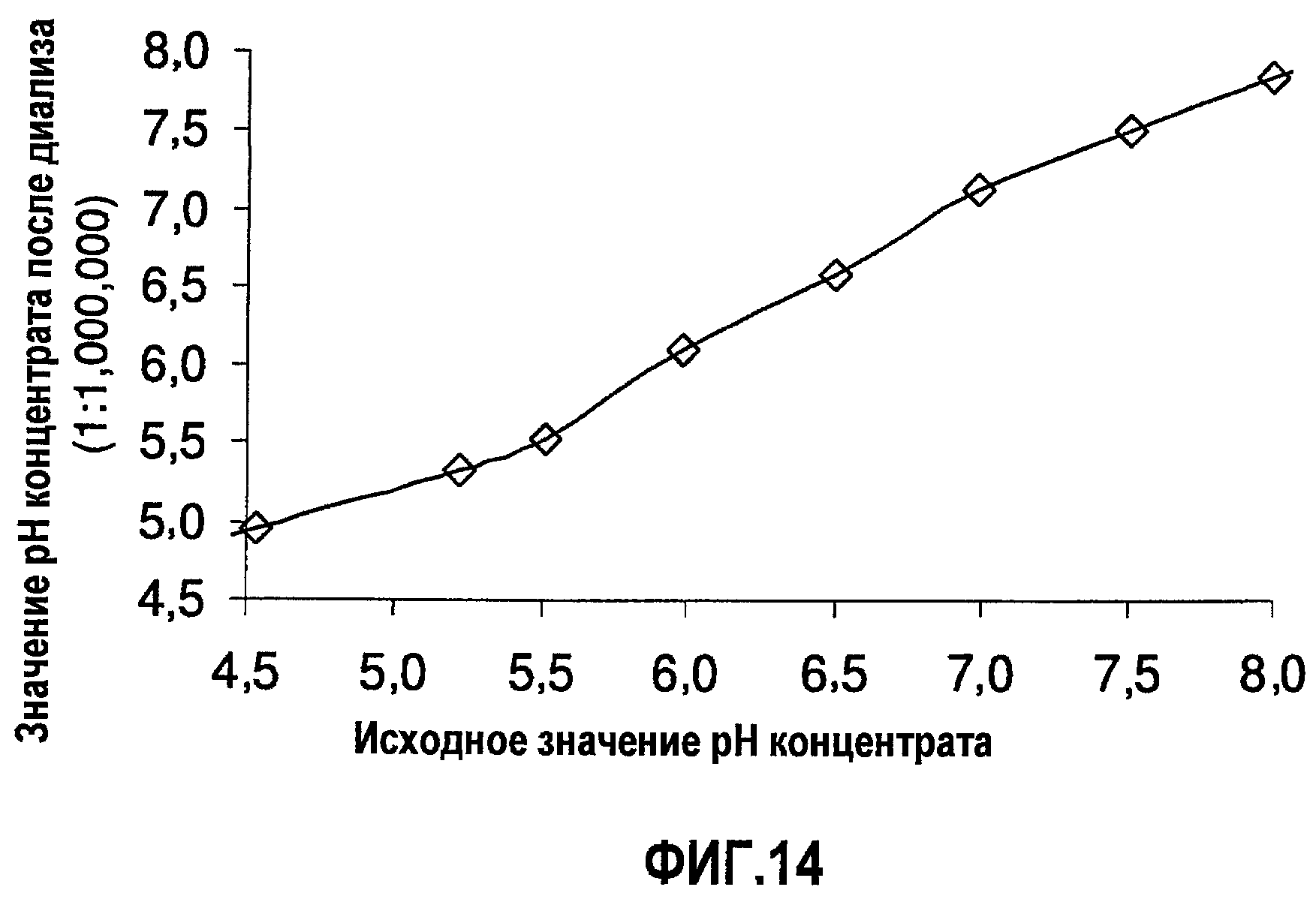
На фиг.14 показана стабильность уровней рН в диализованных нерасфасованных растворах адалимумаба. Показаны уровни рН до и после диализа в деионизированную воду (1:1000000). (BDS, 74 мг/мл, объем образца 10 мл, мембрана SpectraPor7 с MWCO 10000).
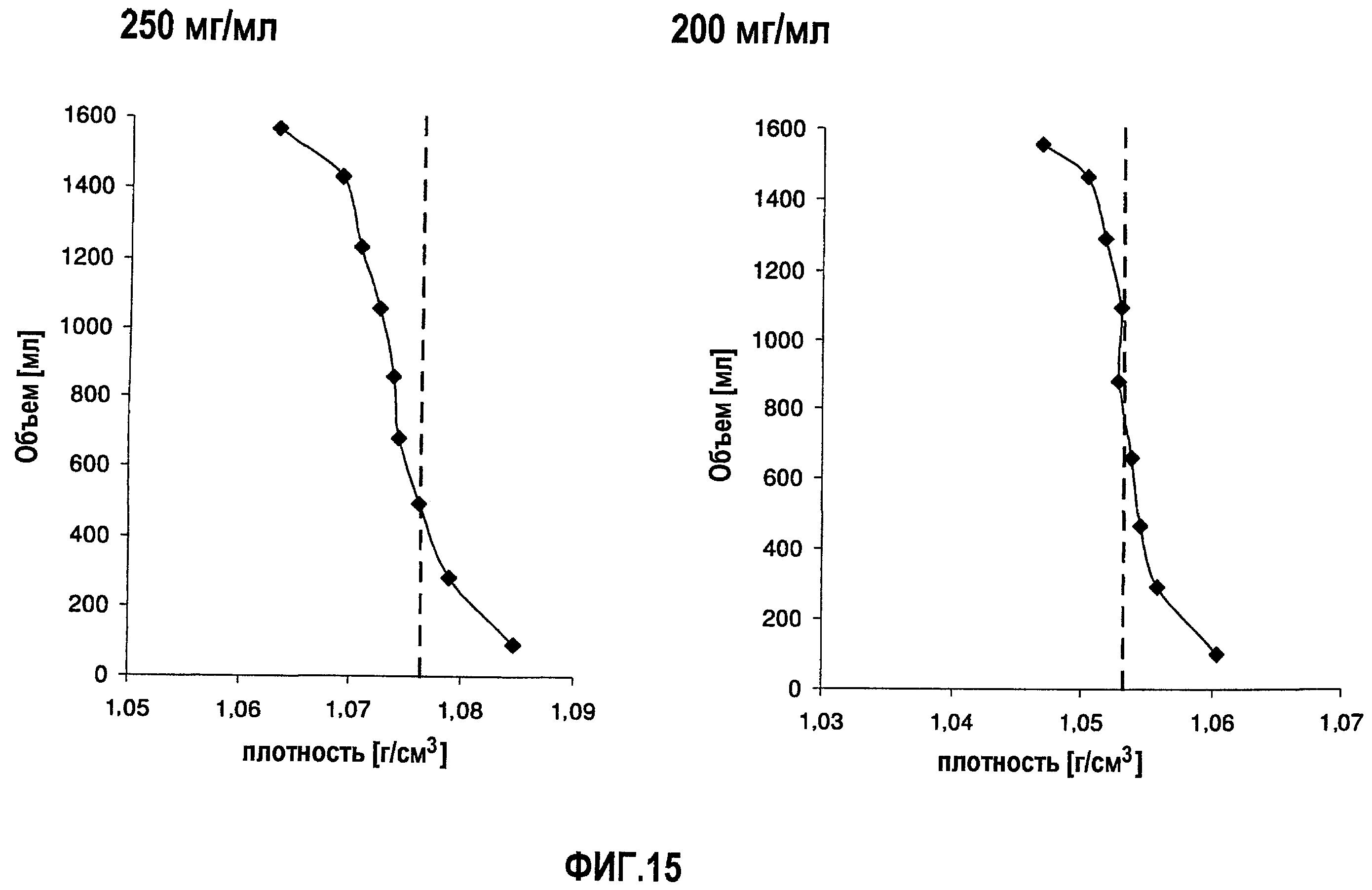
На фиг.15 приведены данные плотности, полученные при картировании бутылок, для низкоионных растворов адалимумаба с концентрацией 250 мг/мл и 200 мг/мл после замораживания-оттаивания.
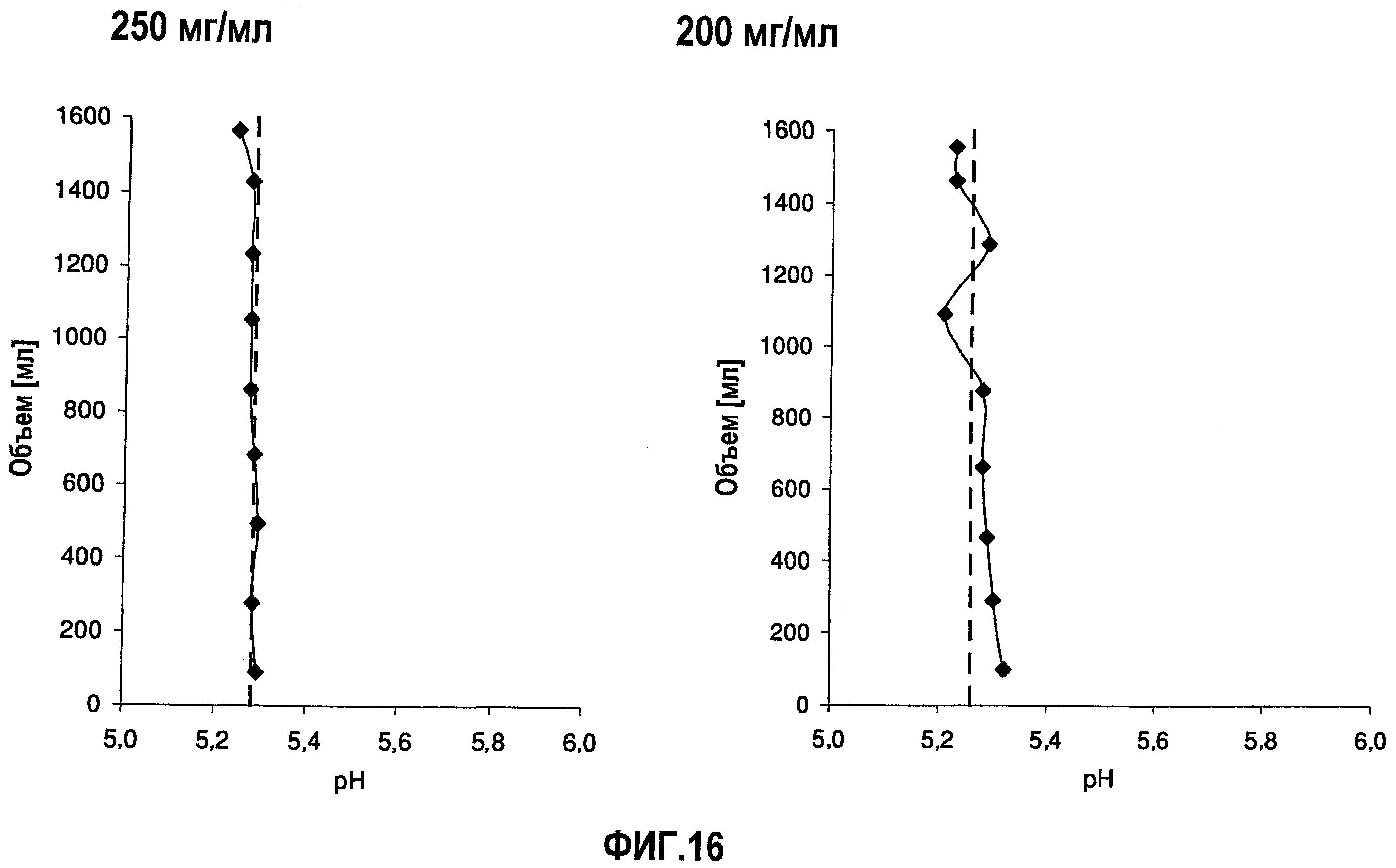
На фиг.16 приведены данные рН, полученные при картировании бутылок, для низкоионных растворов адалимумаба с концентрацией 250 мг/мл и 200 мг/мл после замораживания-оттаивания.
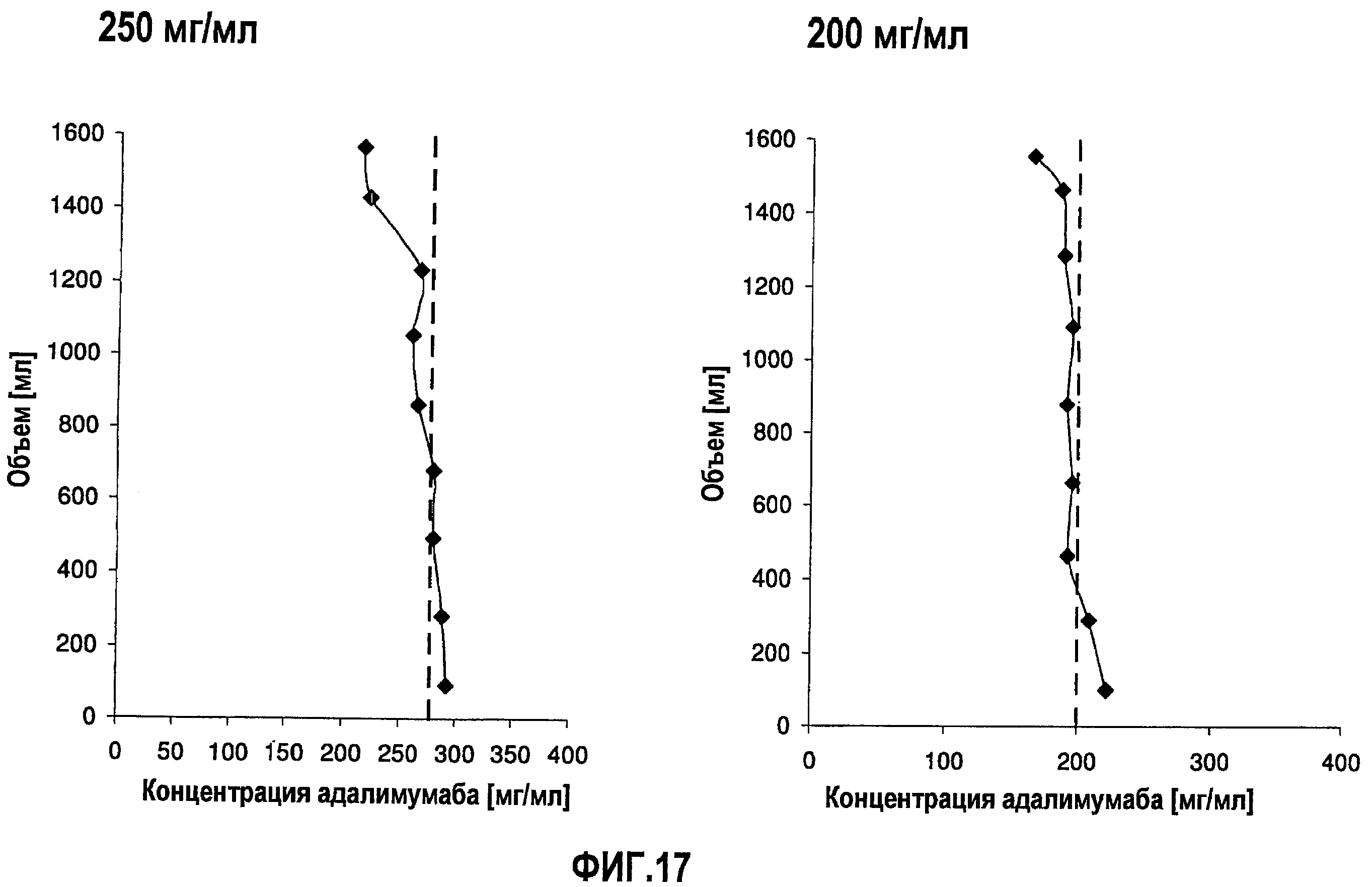
На фиг.17 приведены данные концентрации, полученные при картировании бутылок, для низкоионных растворов адалимумаба с концентрацией 250 мг/мл и 200 мг/мл после замораживания-оттаивания.
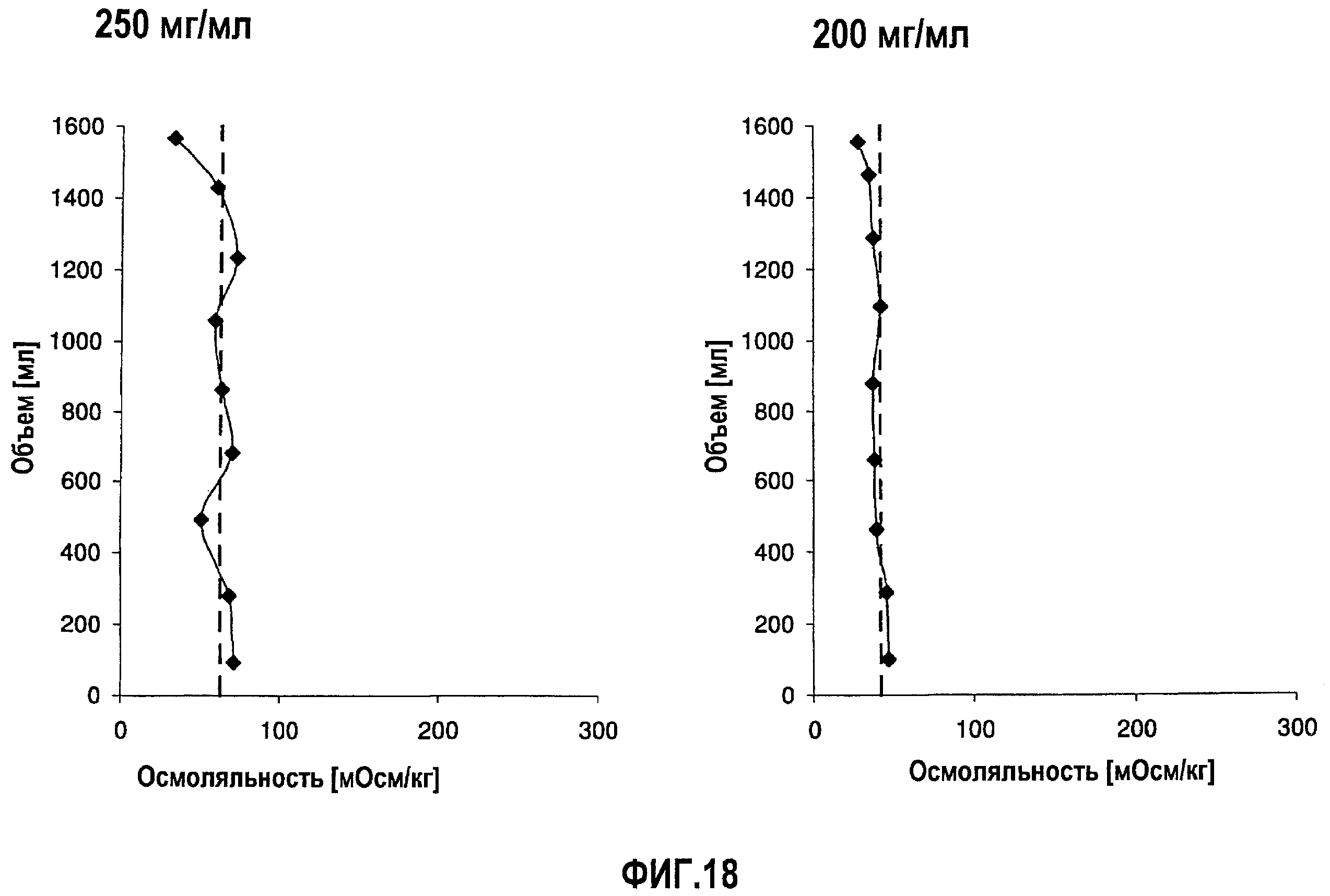
На фиг.18 приведены данные осмоляльности, полученные при картировании бутылок, для низкоионных растворов адалимумаба с концентрацией 250 мг/мл и 200 мг/мл после замораживания-оттаивания.
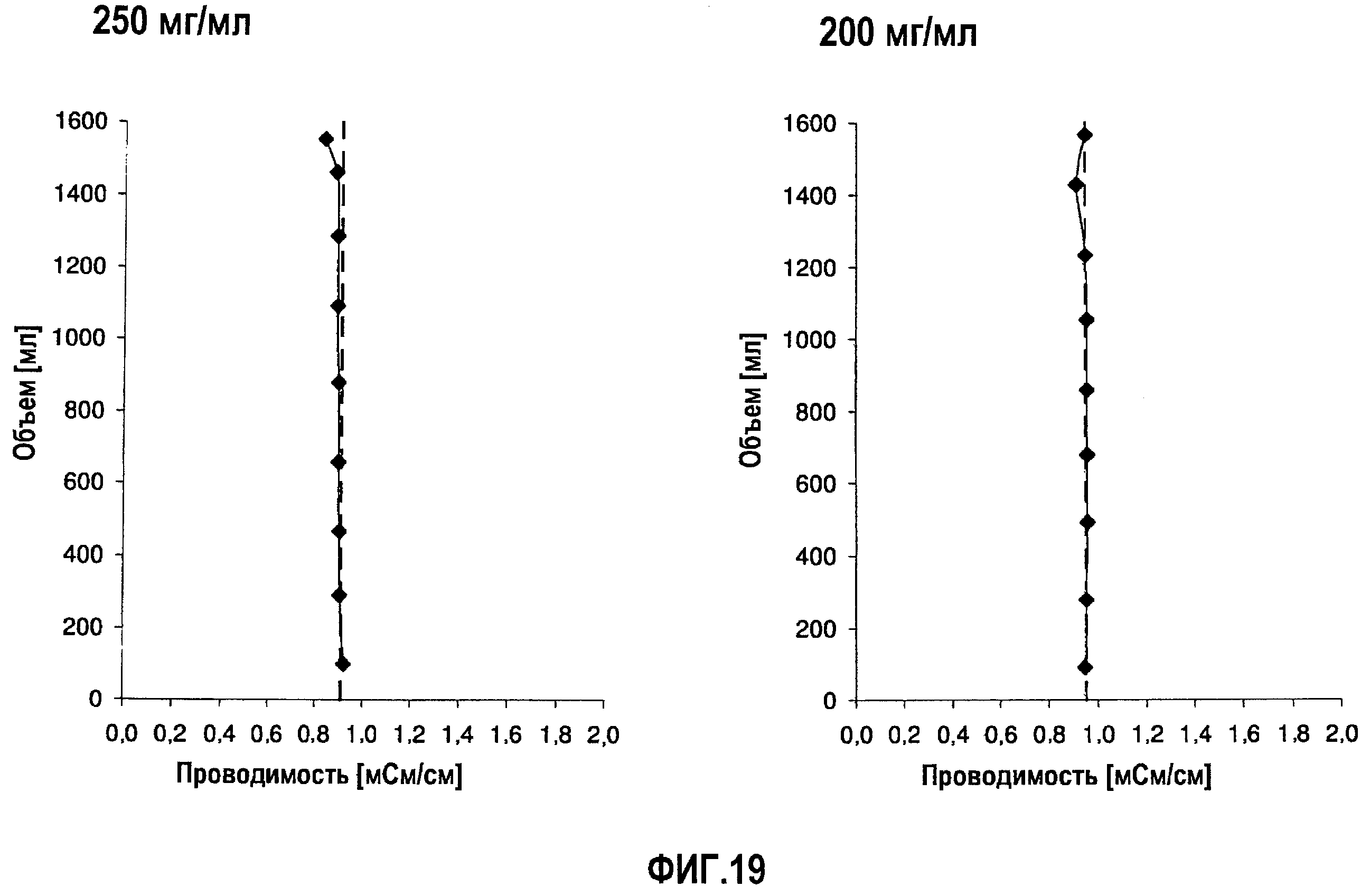
На фиг.19 приведены данные проводимости, полученные при картировании бутылок, для низкоионных растворов адалимумаба с концентрацией 250 мг/мл и 200 мг/мл после замораживания-оттаивания.
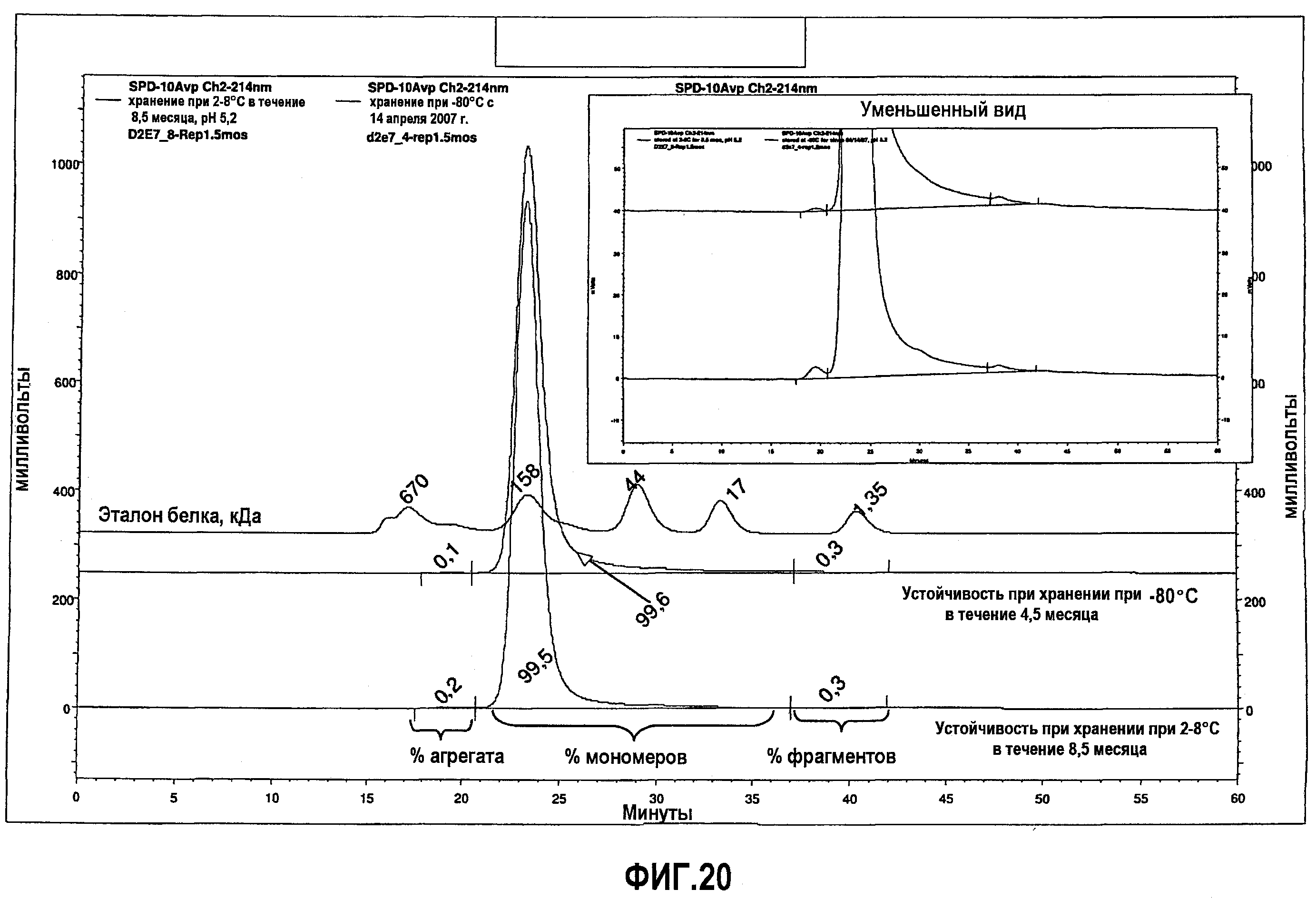
На фиг.20 показан анализ методом SEC низкоионных растворов адалимумаба (определяемого как D2E7 на фиг.20), которые хранили при 2-8°С в течение 8,5 месяца после DF/UF (нижняя кривая) или при -80°С в течение 4,5 месяца после DF/UF (верхняя кривая).
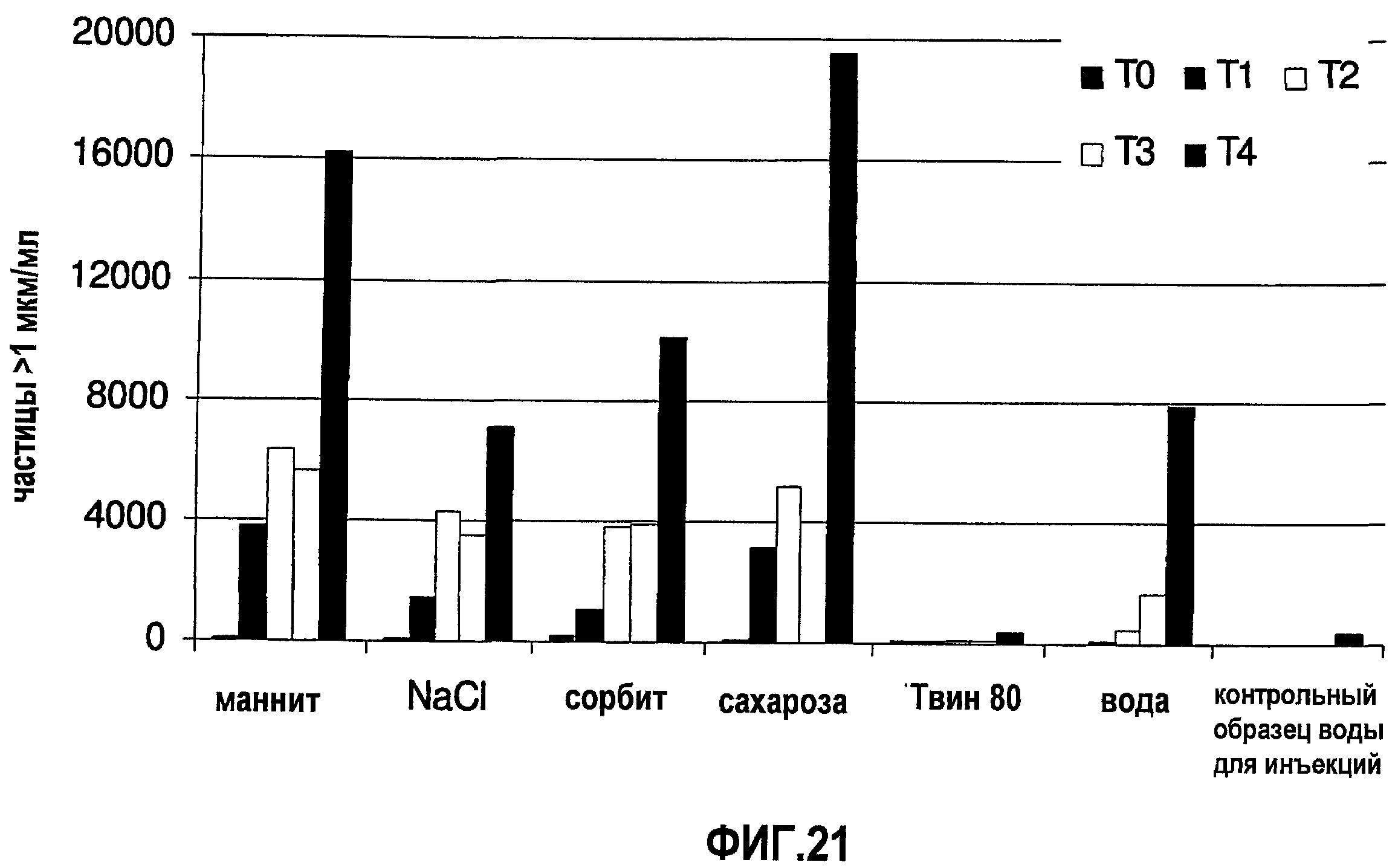
На фиг.21 показана устойчивость моноклонального антитела 1D4.7, полученного в разных растворах и в воде, до замораживания-оттаивания (момент времени Т0) и после каждого из четырех замораживаний-оттаиваний (моменты времени Т1, Т2, Т3 и Т4).
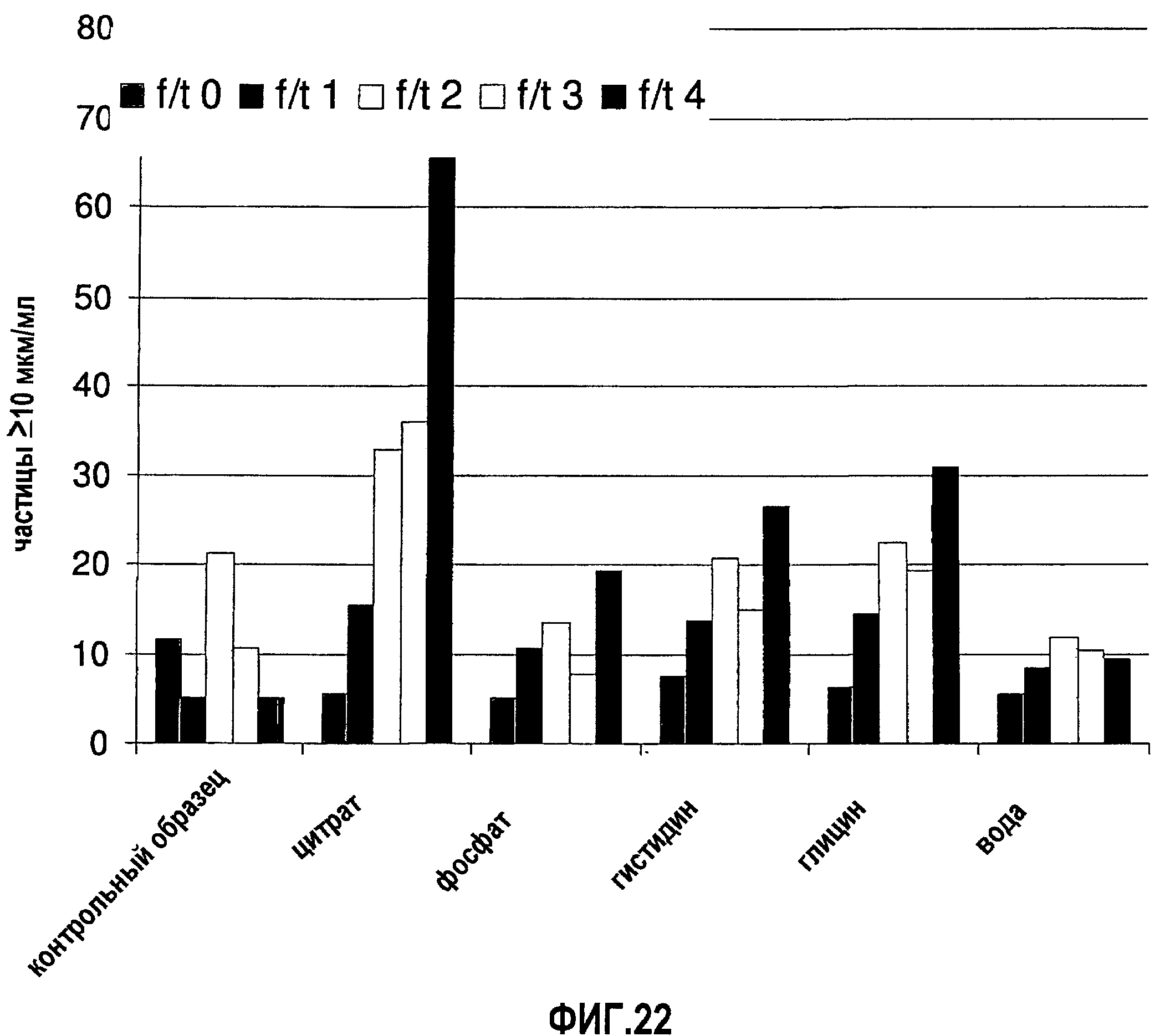
На фиг.22 показана устойчивость моноклонального антитела 13С5.5, полученного в воде и с разными буферами, до замораживания-оттаивания (момент времени Т0) и после каждого из четырех замораживаний-оттаиваний (моменты времени Т1, Т2, Т3 и Т4). Контрольный образец = образец в воде для инъекций.
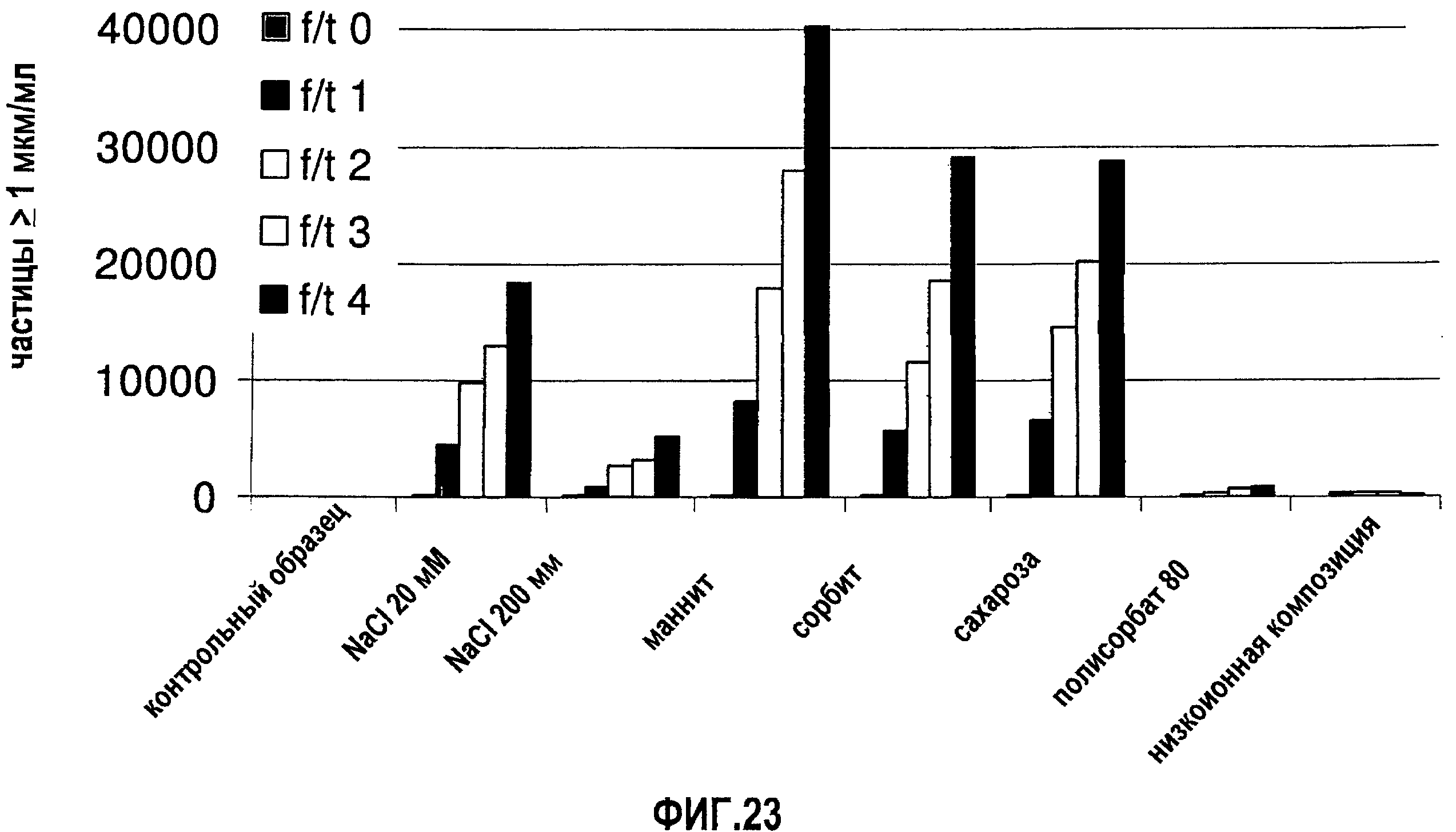
На фиг.23 показана устойчивость моноклонального антитела 13С5.5, полученного в воде и с разными добавленными наполнителями, до замораживания-оттаивания (момент времени Т0) и после каждого из четырех замораживаний-оттаиваний (моменты времени Т1, Т2, Т3 и Т4). Контрольный образец = образец в воде для инъекций.
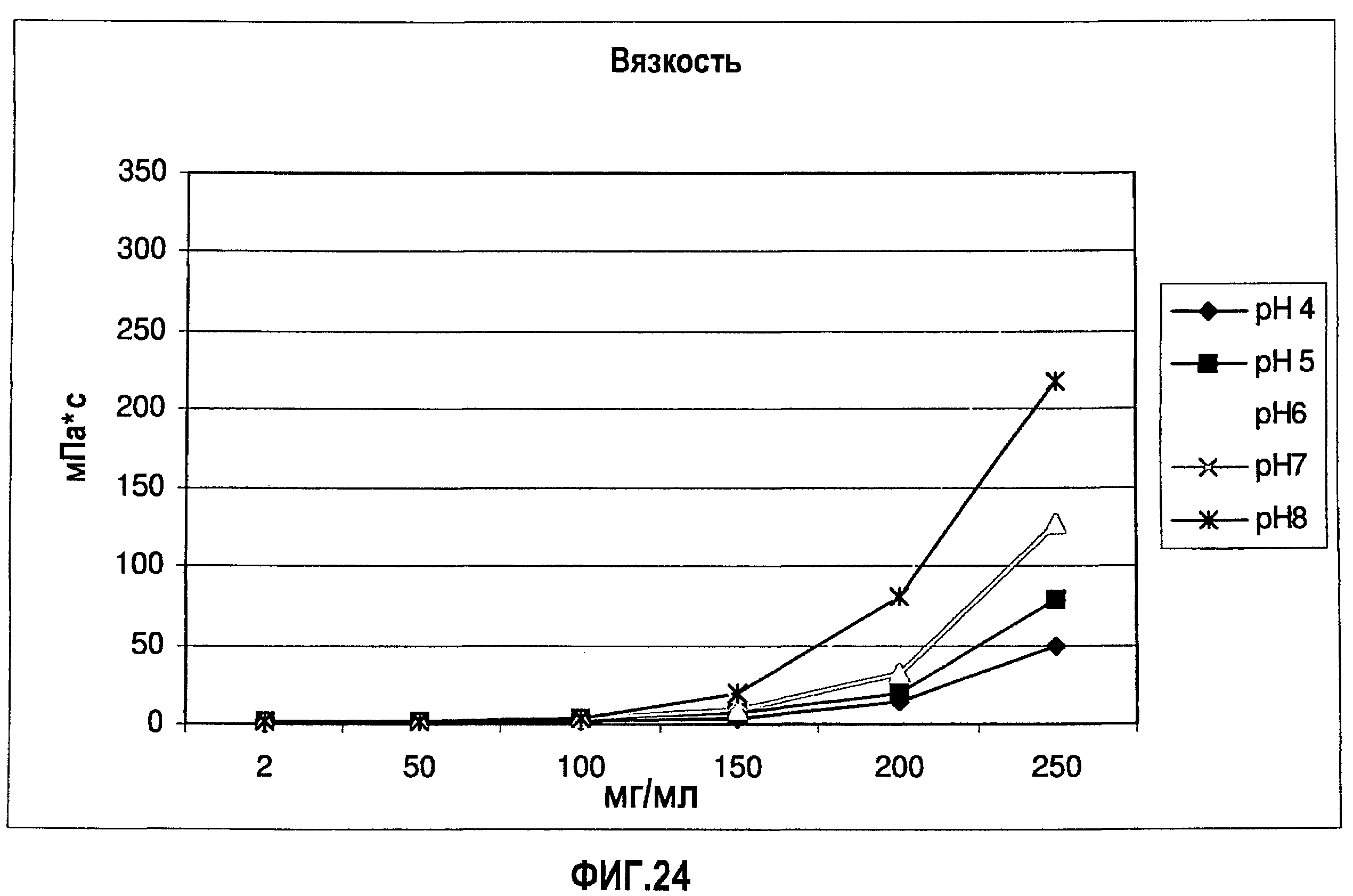
На фиг.24 показано влияние концентрации адалимумаба (композиция в воде для инъекций) и рН раствора на вязкость раствора.
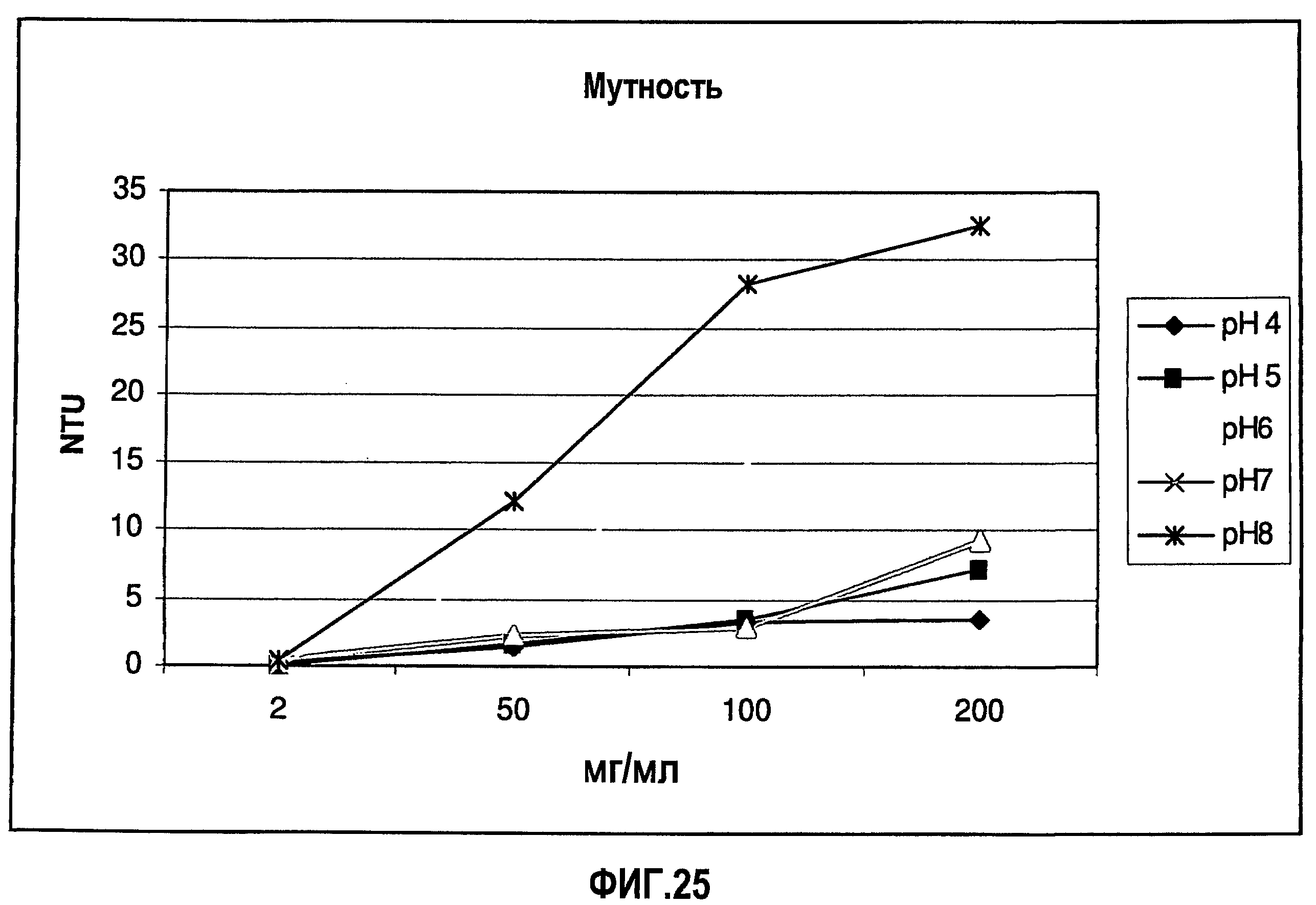
На фиг.25 приведены данные мутности для растворов адалимумаба (композиции в воде для инъекций) с разными концентрациями и значениями рН.
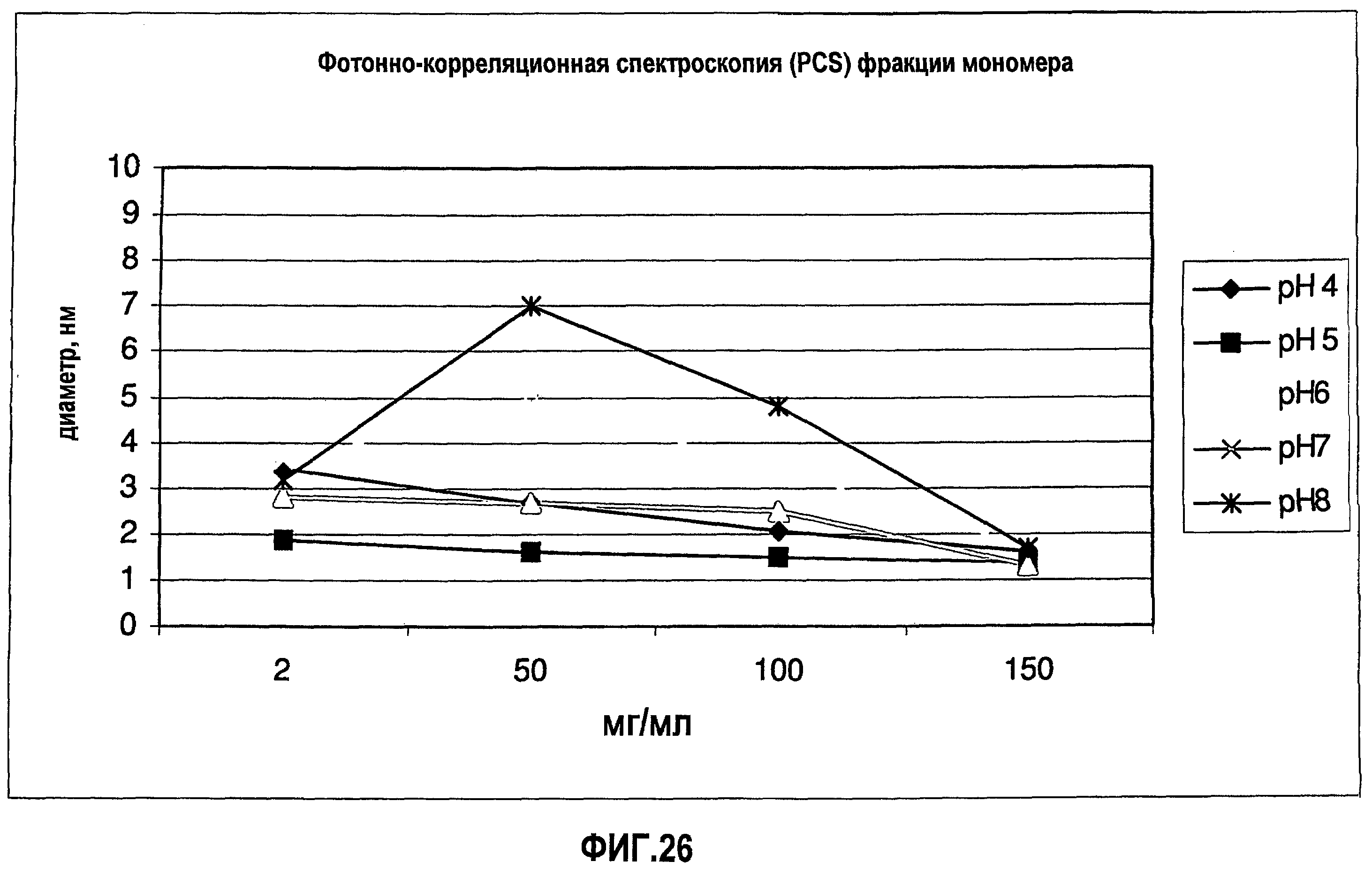
На фиг.26 приведены данные гидродинамического диаметра (Dh) для растворов адалимумаба (композиции в воде для инъекций) с разными значениями рН и концентрациями.
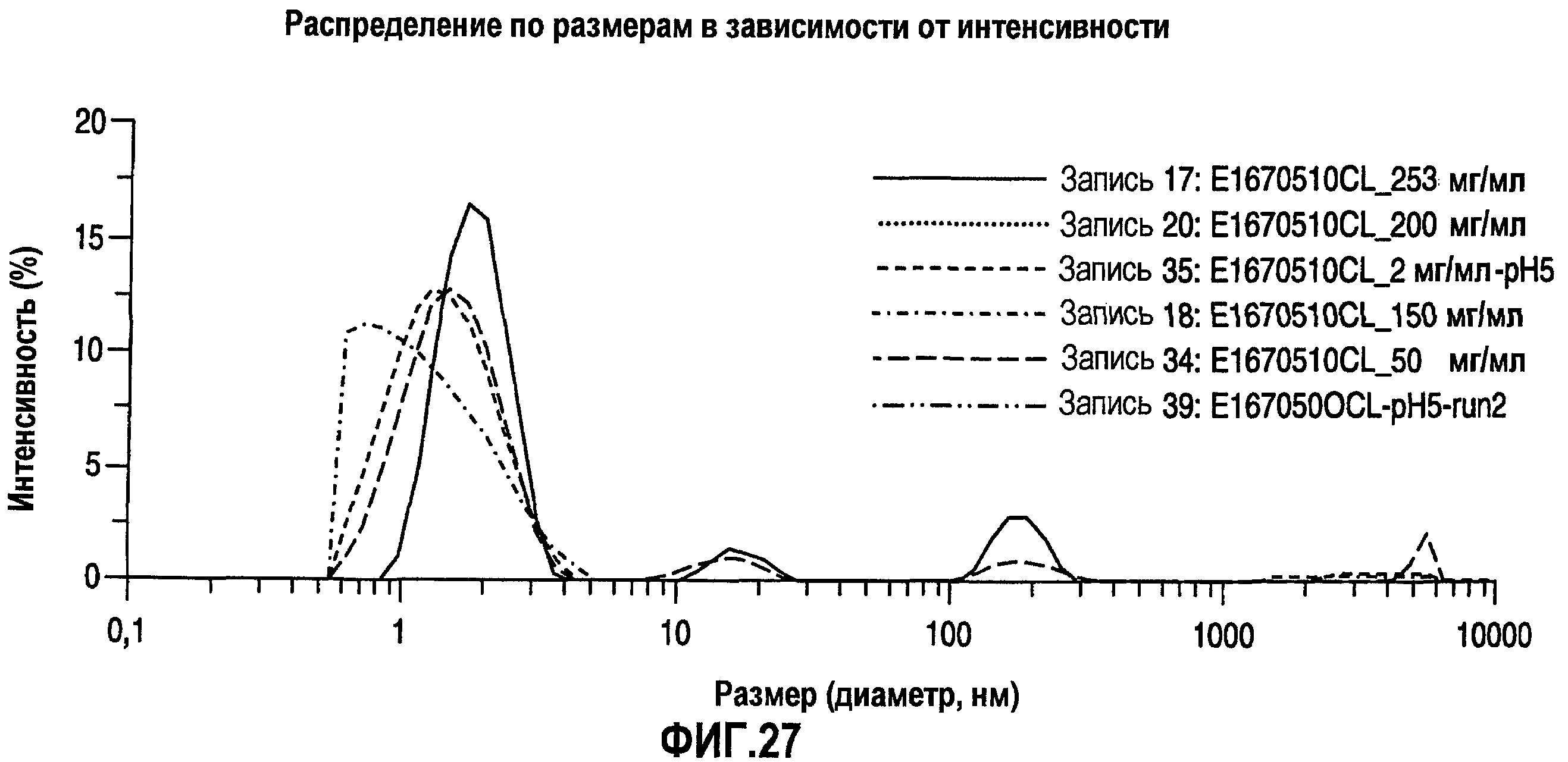
На фиг.27 показано распределение по размерам в виде графика интенсивности (измерения Dh) для адалимумаба в водных растворах, рН 5, с разными концентрациями.
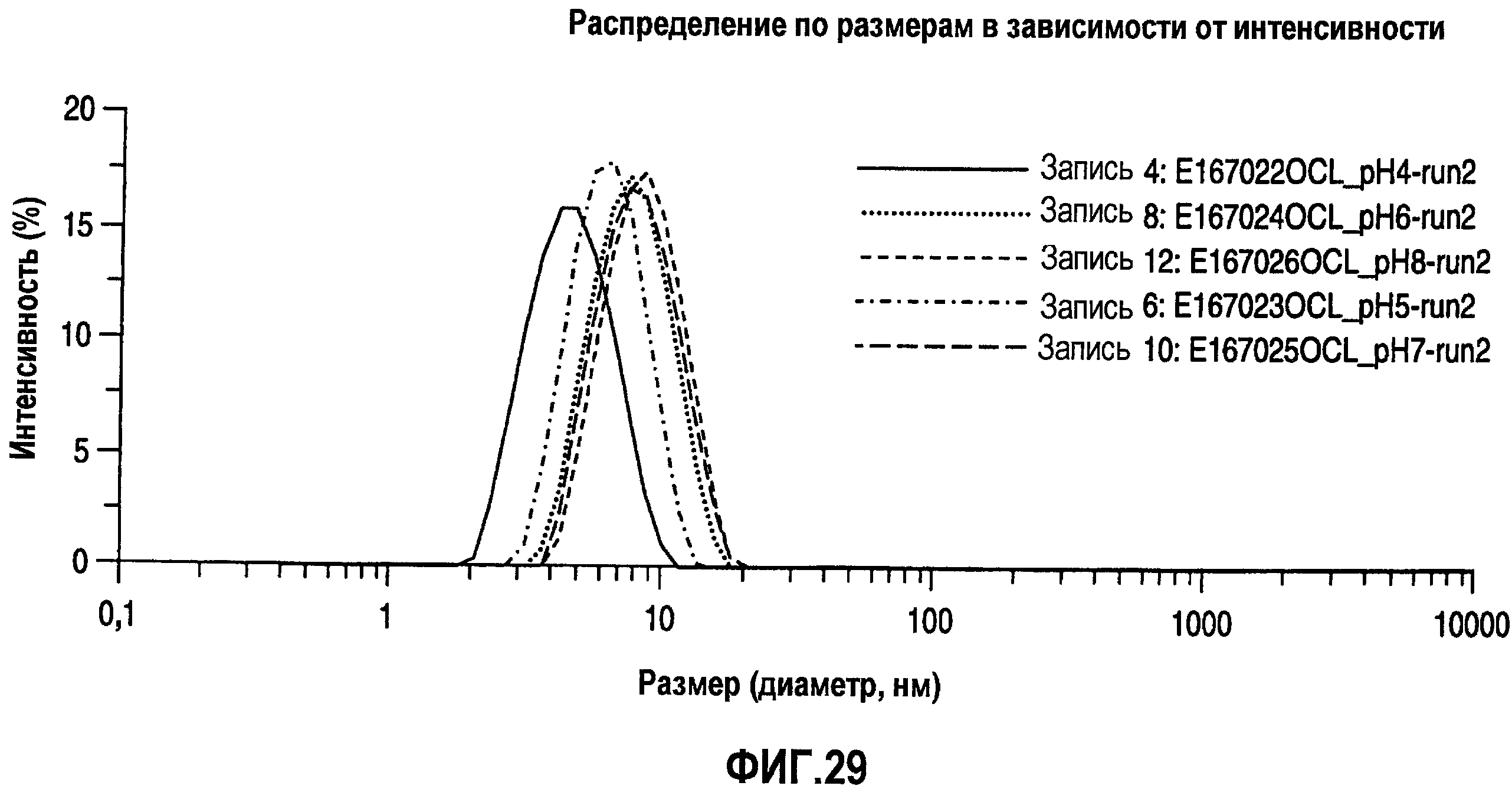
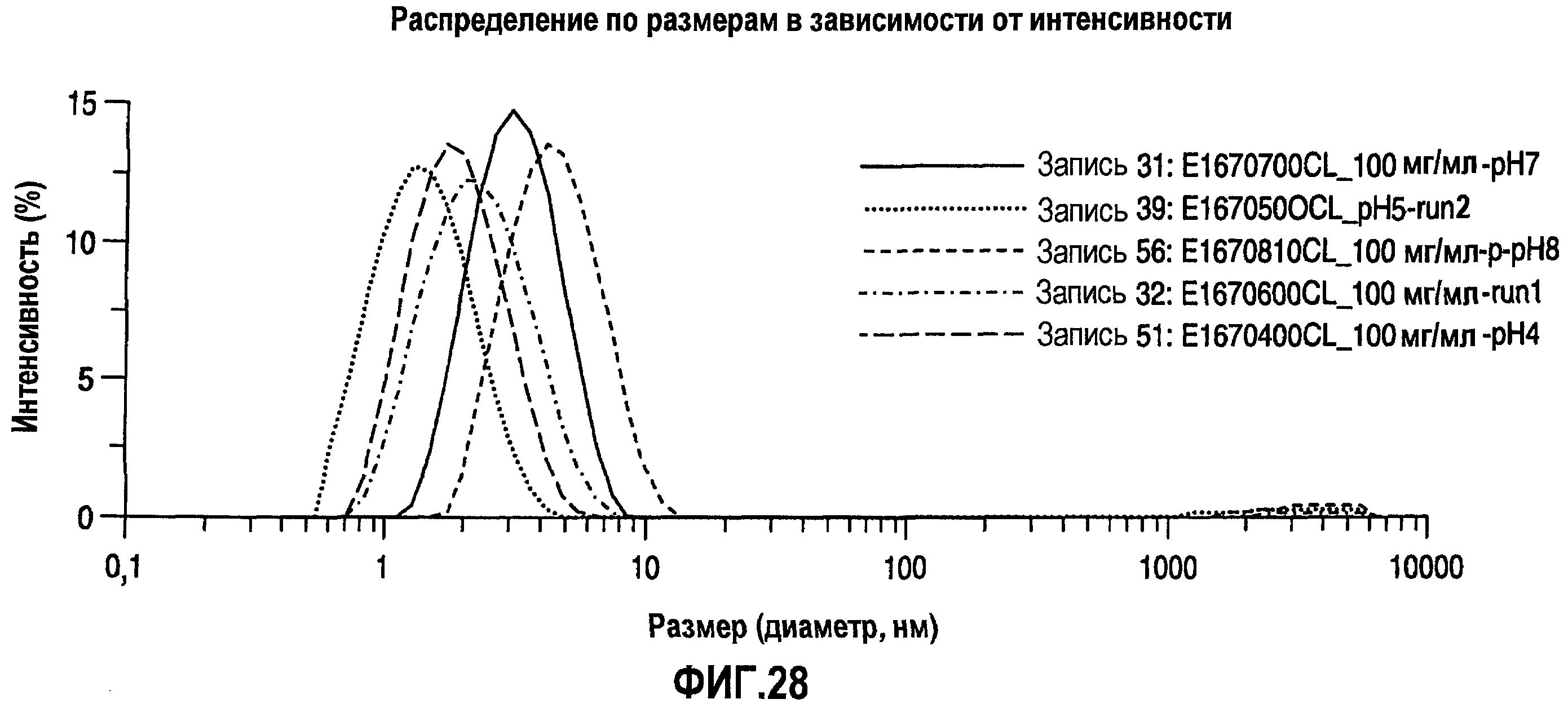
На фиг.28 показано распределение по размерам в виде графика интенсивности для адалимумаба в воде с концентрацией 100 мг/мл при разных уровнях рН.
На фиг.29 также показано распределение по размерам в виде графика интенсивности для адалимумаба в воде с концентрацией 100 мг/мл при разных уровнях рН.
На фиг.30 показано содержание мономера (SEC) для адалимумаба в воде.
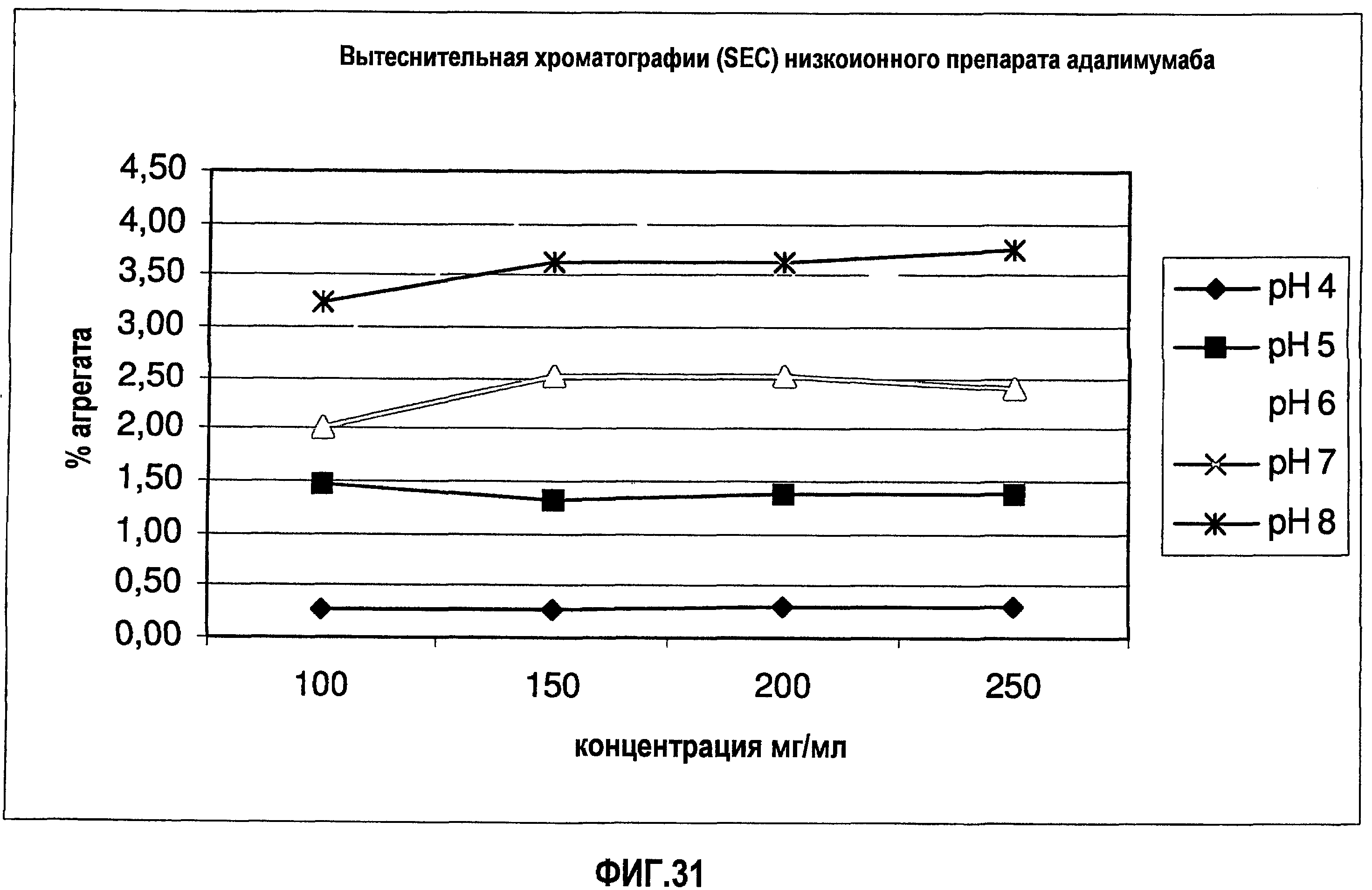
На фиг.31 показано содержание агрегата (SEC) для адалимумаба в воде.
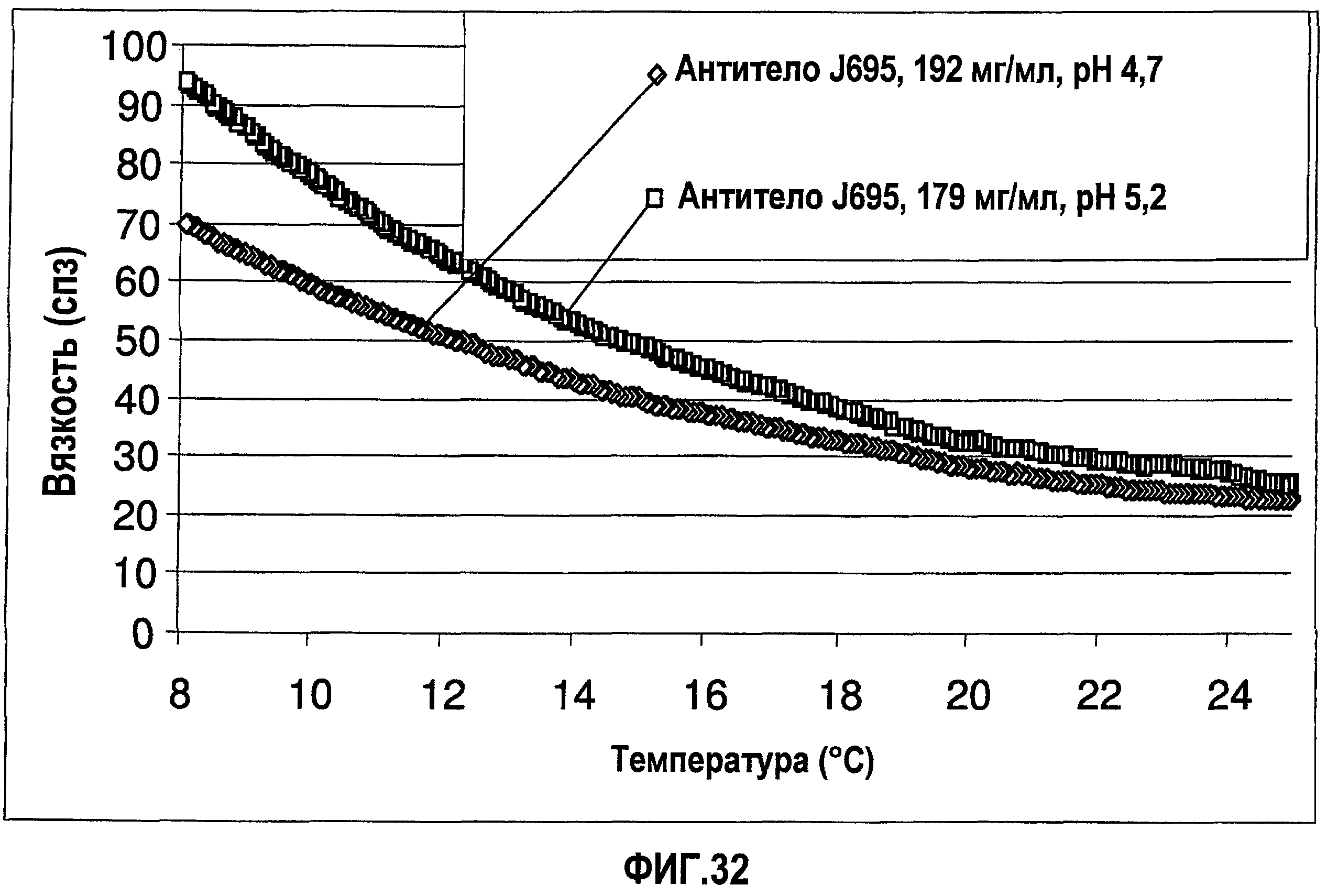
На фиг.32 показана вязкость двух растворов антитела J695 (композиции в воде для инъекций) в зависимости от температуры растворов.
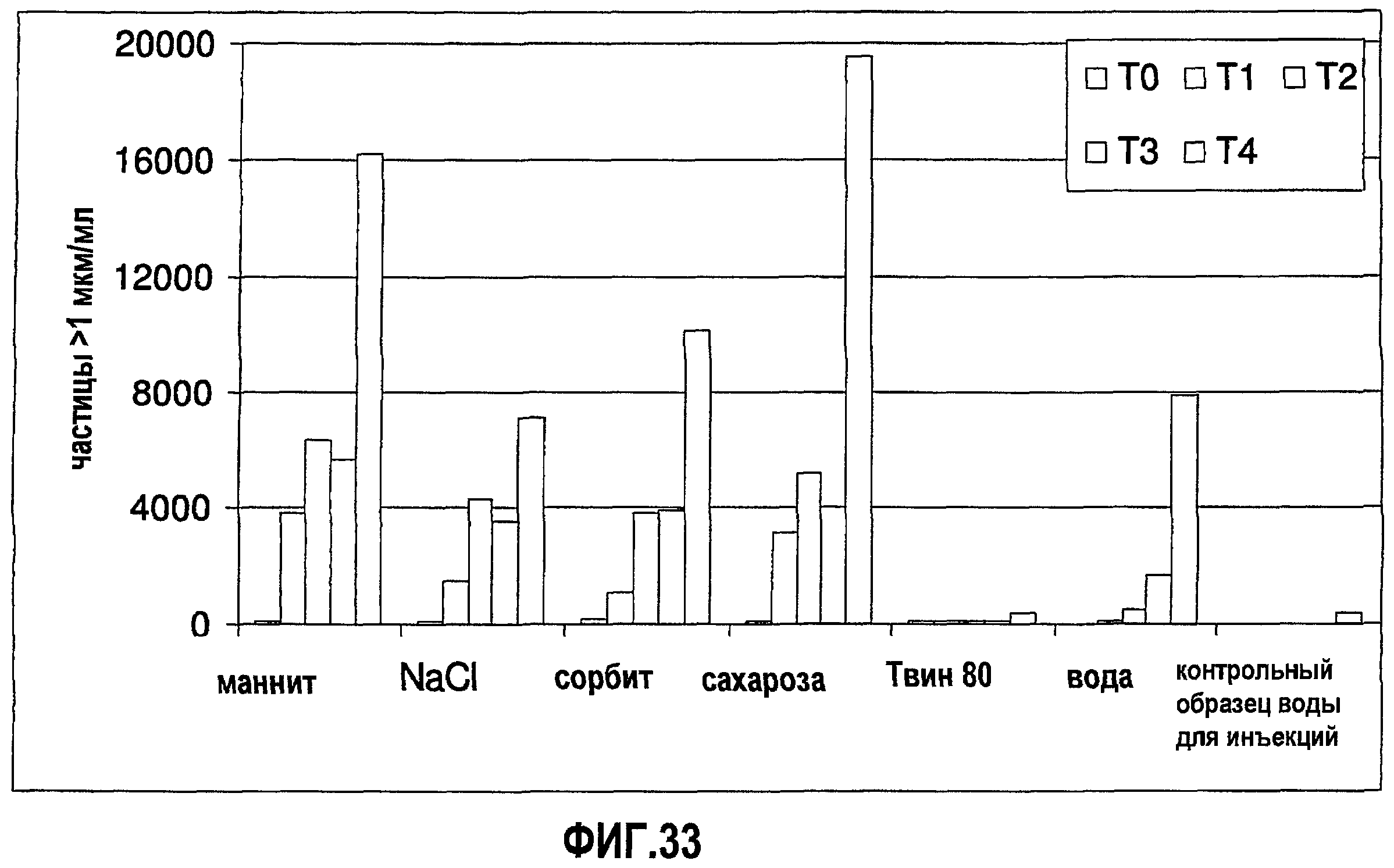
На фиг.33 графически изображена устойчивость антитела 1D4.7, измеренная по количеству невидимых частиц (>1 мкм) во время повторяющихся циклов замораживания-оттаивания (f/t) для ряда разных композиций.
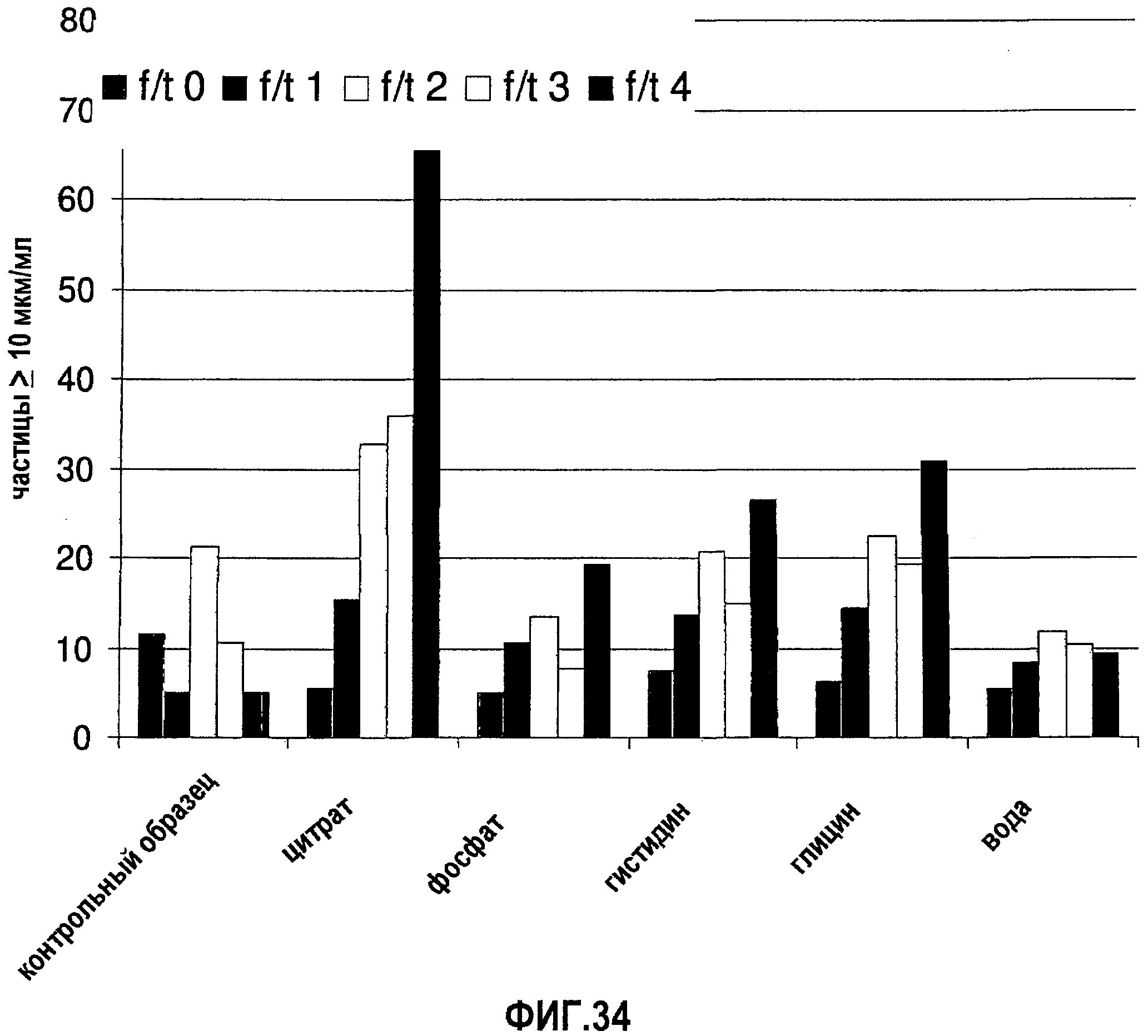
На фиг.34 графически изображена устойчивость антитела 13С5.5, измеренная по количеству невидимых частиц (>10 мкм) во время повторяющихся циклов замораживания-оттаивания (f/t) для ряда разных композиций.
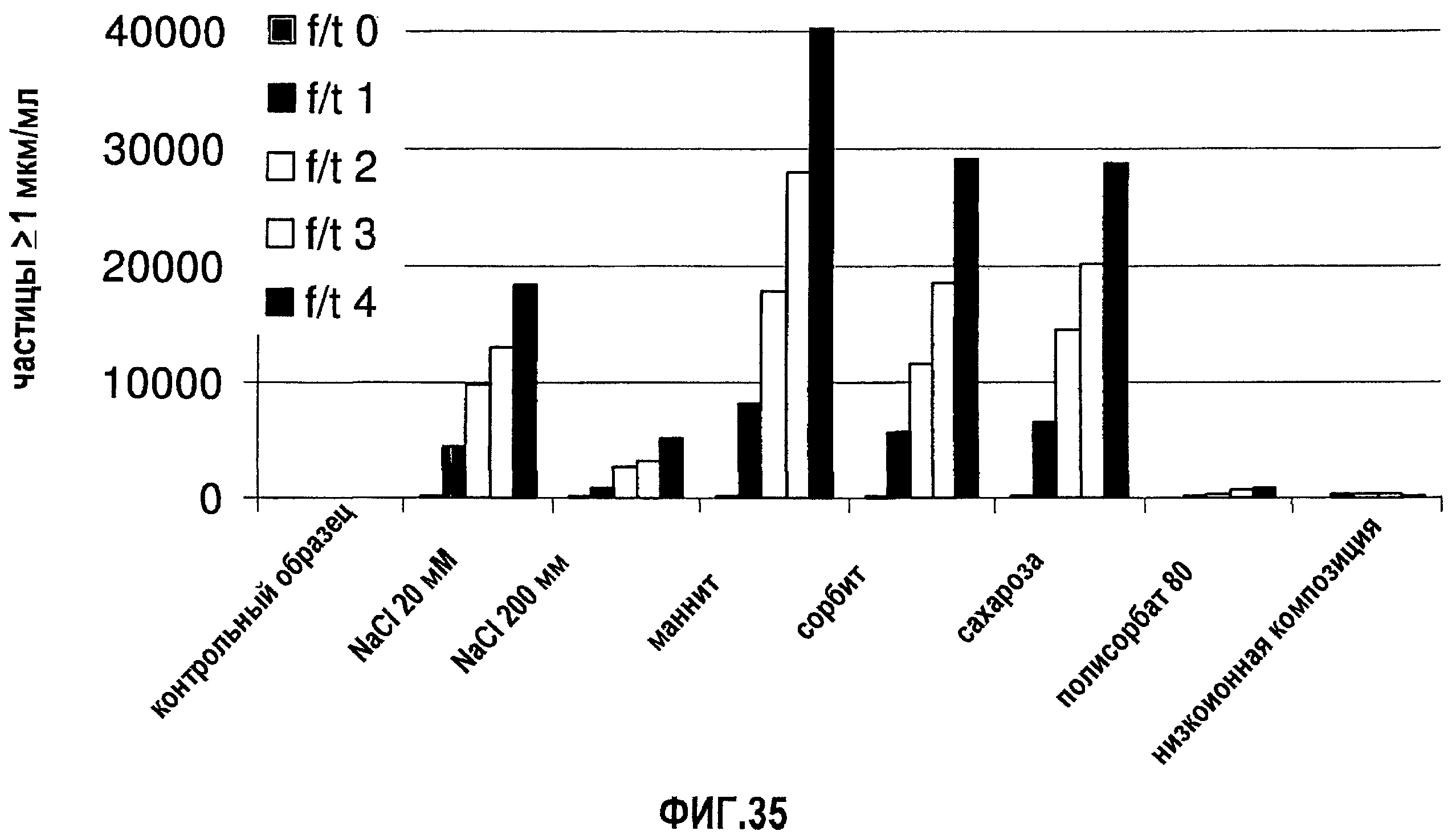
На фиг.35 графически изображена устойчивость антитела 13С5.5, измеренная по количеству невидимых частиц (>1 мкм) во время повторяющихся циклов замораживания-оттаивания (f/t) для ряда разных композиций.
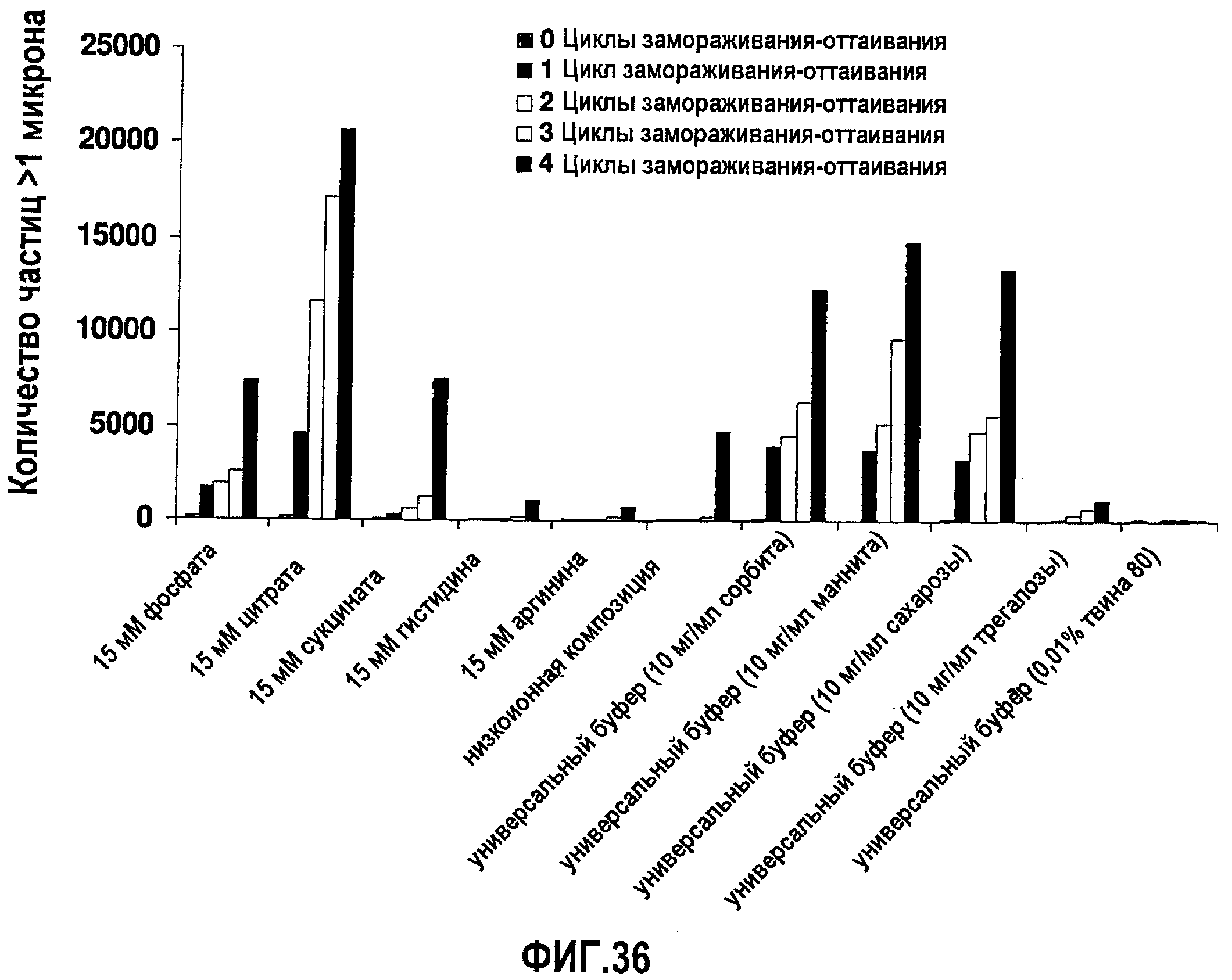
На фиг.36 графически изображена устойчивость антитела 7С6, измеренная по количеству невидимых частиц (>1 мкм) во время повторяющихся циклов замораживания-оттаивания (f/t) для ряда разных композиций.
Подробное описание изобретения
I. Определения терминов
Для лучшего понимания настоящего изобретения ниже приведены некоторые термины, использованные в настоящем описании изобретения.
В использованном здесь значении термин ”кислотный компонент” означает агент, в том числе раствор, имеющий кислотный показатель рН, то есть ниже 7,0. Примеры кислотных компонентов включают фосфорную кислоту, хлористоводородную кислоту, уксусную кислоту, лимонную кислоту, щавелевую кислоту, янтарную кислоту, винную кислоту, молочную кислоту, яблочную кислоту, гликолевую кислоту и фумаровую кислоту. В одном варианте осуществления изобретения водную композицию по настоящему изобретению не содержит кислотного компонента.
В использованном здесь значении термин ”антиоксидант” означает агент, который ингибирует окисление и, таким образом, используется для предотвращения ухудшения качества препаратов в результате окисления. Такие соединения включают в качестве примера и без каких-либо ограничений ацетон, бисульфат натрия, аскорбиновую кислоту, аскорбилпальмитат, лимонную кислоту, бутилированный гидроксианизол, бутилированный гидрокситолуол, гидрофосфорную кислоту, монотиоглицерин, пропилгаллат, метионин, аскорбат натрия, цитрат натрия, сульфид натрия, сульфит натрия, бисульфит натрия, формальдегидсульфоксилат натрия, тиогликолевую кислоту, метабисульфит натрия, EDTA (эдетат), пентетат и другие вещества, известные специалистам в данной области.
Термин ”водная композиция” означает раствор, в котором растворителем является вода.
В использованном здесь значении термин ”основный компонент” означает агент, являющийся щелочью, то есть имеющий значение рН выше 7,0. Примеры основных компонентов включают гидроксид калия (КОН) и гидроксид натрия (NaOH).
В использованном здесь значении термин ”объемный наполнитель” означает соединение, используемое для увеличения объема восстанавливаемого твердого вещества и/или сохранения свойств композиции в процессе получения. Такие соединения включают в качестве примера и без каких-либо ограничений декстран, трегалозу, сахарозу, поливинилпирролидон, лактозу, инозит, сорбит, диметилсульфоксид, глицерин, альбумин, лактобионат кальция и другие вещества, известные специалистам в данной области.
Термин ”проводимость” в использованном здесь значении означает способность водного раствора проводить электрический ток между двумя электродами. Как правило, мерой способности вещества проводить электрический ток является удельная электропроводность. В растворе прохождение тока обеспечивается переносом ионов. Поэтому при увеличении количества ионов, присутствующих в водном растворе, раствор приобретает большую проводимость. Единицей измерения проводимости является мСм/см, и проводимость может быть измерена при помощи измерителя проводимости, продаваемого, например, компанией Orion Research, Inc. (Beverly, MA). Проводимость раствора может быть изменена путем изменения концентрации ионов в растворе. Например, в растворе может быть изменена концентрация ионных наполнителей для достижения требуемой проводимости.
Термин ”криопротекторы” в использованном здесь значении обычно означает агенты, которые обеспечивают устойчивость белка от стрессов, вызванных замораживанием. Примеры криопротекторов включают полиолы, такие как, например, маннит, и сахариды, такие как, например, сахароза, а также поверхностно-активные вещества, такие как, например, полисорбат, полоксамер или полиэтиленгликоль и тому подобные. Криопротекторы также определяют тоничность композиций.
В использованном здесь значении термин ”ультрафильтрация” или “UF” означает любой метод, в соответствии с которым раствор или суспензию фильтруют через полупроницаемую мембрану, которая задерживает макромолекулы, пропуская растворитель и мелкие молекулы растворенного вещества. Ультрафильтрация может быть использована для увеличения концентрации макромолекул в растворе или суспензии. В предпочтительном варианте осуществления изобретения ультрафильтрация используется для увеличения концентрации белка в воде.
В использованном здесь значении термин ”диафильтрация” или “DF” означает специальный класс фильтрации, в соответствии с которым задержанное вещество разбавляется растворителем и повторно фильтруется, в результате чего уменьшается концентрация растворимых компонентов проникающего вещества. Диафильтрация может вызывать или не вызывать увеличения концентрации задержанных компонентов, включая, например, белки. Например, в случае диафильтрации в непрерывном режиме растворитель постоянно добавляется к задержанному веществу со скоростью образования фильтрата. В таком случае объем задержанного вещества и концентрация удерживаемых компонентов не изменяется во время данного процесса. С другой стороны, в случае диафильтрации в периодическом режиме или диафильтрации с последующим разбавлением за стадией ультрафильтрации следует добавление растворителя со стороны задержанного вещества; если объем растворителя, добавляемого со стороны задержанного вещества, не равен или превышает объем образованного фильтрата, то концентрация удерживаемых компонентов увеличивается. Диафильтрация может быть использована для изменения значения рН, ионной силы, состава соли, состава буфера или других свойств раствора или суспензии макромолекул.
В использованном здесь значении термин ”диафильтрация/ультрафильтрация” или “DF/UF” означает любой процесс, метод или комбинацию методов последовательного или одновременного выполнения ультрафильтрации и/или диафильтрации.
В использованном здесь значении термин ”стадия диафильтрации” означает полный объемный обмен во время процесса диафильтрации.
Термин ”наполнитель” означает агент, который может быть добавлен к композиции для обеспечения требуемой консистенции (например, изменения объемных свойств), улучшения устойчивости и/или регулирования осмоляльности. Примеры обычно используемых наполнителей включают, не ограничиваясь ими, сахара, полиолы, аминокислоты, поверхностно-активные вещества и полимеры. Термин ”ионный наполнитель” или ”ионизируемый наполнитель”, используемый во взаимозаменяемом значении, означает агент, имеющий суммарный заряд. В одном варианте осуществления изобретения ионный наполнитель имеет суммарный заряд при наличии определенных условий в композиции, таких как рН. Примеры ионных наполнителей включают, не ограничиваясь ими, гистидин, аргинин и хлорид натрия. Термин ”неионный наполнитель” или “неионизируемый наполнитель”, используемый во взаимозаменяемом значении, означает агент, не имеющий суммарного заряда. В одном варианте осуществления изобретения неионный наполнитель не имеет суммарного заряда при наличии определенных условий в композиции, таких как рН. Примеры неионных наполнителей включают, не ограничиваясь ими, сахара (например, сахарозу), сахарные спирты (например, маннит) и неионогенные поверхностно-активные вещества (например, полисорбат 80).
Термин ”первый раствор белка” или “первый раствор” в использованном здесь значении означает исходный раствор белка или исходное вещество, используемое в способах по настоящему изобретению, то есть исходный раствор белка, диафильтрованный в воду. В одном варианте осуществления изобретения первый раствор белка включает ионные наполнители, неионные наполнители и/или буферную систему.
Термин ”гидродинамический диаметр” или “Dh” частицы означает диаметр сферы, которая имеет плотность воды и скорость перемещения, как у частицы. Таким образом, термин ”гидродинамический диаметр белка” в использованном здесь значении означает определение размера белков в растворе методом динамического рассеяния света (DLS). Устройство для измерения DLS измеряет флуктуацию интенсивности света, рассеиваемого белками в растворе под постоянным углом рассеяния, в зависимости от времени. Dh белка определяют на основании функции автокорреляции интенсивности флуктуации интенсивности в зависимости от времени. Данные интенсивности рассеяния обрабатывают при помощи программного обеспечения устройства для измерения DLS для определения значения гидродинамического диаметра и распределения по размерам рассеивающих свет молекул, то есть белка.
Термин ”лиопротектор” в использованном здесь значении означает агенты, обеспечивающие устойчивость белка при удалении воды в процессе сушки или лиофилизации, например, путем сохранения соответствующей конформации белка. Примеры лиопротекторов включают сахариды, в частности ди- или трисахариды. Криопротекторы также могут действовать подобно лиопротекторам.
Термин ”фармацевтический” в использованном здесь значении применительно к составу означает, например, водную композицию, пригодную для лечения заболевания или нарушения.
Термин ”белок” означает последовательность аминокислот, длина цепи которой достаточна для образования более высоких уровней вторичной, третичной и/или четвертичной структуры. Белок следует отличать от ”пептидов” или других низкомолекулярных лекарственных средств, которые не имеют такой структуры. В одном варианте осуществления изобретения белки по настоящему изобретению имеют молекулярную массу, равную по меньшей мере примерно 47 кДа. Примеры белков, входящих в определение данного термина, включают терапевтические белки. Термин ”терапевтически активный белок” или “терапевтический белок” означает белок, который может быть использован в лечебных целях, то есть для лечения заболевания у субъекта. Следует отметить, что, хотя терапевтические белки могут быть использованы для лечебных целей, настоящее изобретение не ограничивается таким применением, так как указанные белки могут быть также использованы для выполнения исследований in vitro. В предпочтительном варианте осуществления изобретения терапевтический белок является слитым белком, антителом или его антигенсвязывающим фрагментом. В одном варианте осуществления изобретения составы по настоящему изобретению и способы их получения включают по меньшей мере два разных белка, которые определяются как два белка, имеющие разные аминокислотные последовательности. Дополнительные белки не содержат продуктов разрушения белка.
Фраза ”белок растворен в воде” в использованном здесь значении означает белковую композицию, в которой белок растворен в водном растворе, где количество мелких молекул (например, буферов, наполнителей, солей, поверхностно-активных веществ) было уменьшено в результате выполнения DF/UF. Несмотря на то, что абсолютно полное удаление мелких молекул невозможно при выполнении DF/UF, теоретическое уменьшение содержания наполнителей, достигаемое методами DF/UF, является достаточно высоким для создания белковой композиции по существу только в воде. Например, в результате 6-кратного объемного обмена при выполнении DF/UF в непрерывном режиме теоретическое уменьшение наполнителей составляет ~99,8% (ci=е-х, где ci означает начальную концентрацию наполнителя и х означает число объемных обменов).
Термин ”фармацевтическая композиция” означает композиции, в которых биологическая активность активных ингредиентов оказывает эффективное воздействие, поэтому указанные композиции могут быть введены субъекту в терапевтических целях.
“Устойчивая” композиция является такой композицией, в которой белок в основном сохраняет свою физическую стойкость, химическую стойкость и/или биологическую активность в процессе хранения. В данной области существуют разные аналитические методы измерения устойчивости белка, которые рассмотрены, например, в публикациях Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) и Jones, A. Adv. Drug Delivery Rev. 10:29-90 (1993). В одном варианте осуществления изобретения устойчивость белка определяют по процентному содержанию мономера белка в растворе, при этом низкое процентное содержание указывает на наличие разрушенного (например, фрагментированного) и/или агрегированного белка. Например, водная композиция, содержащая устойчивый белок, может включать по меньшей мере 95% мономерного белка. Альтернативно водная композиция по настоящему изобретению может содержать не более 5% агрегированного и/или разрушенного белка.
Термин ”стабилизирующий агент” означает наполнитель, который улучшает или каким-либо другим образом повышает устойчивость. Стабилизирующие агенты включают, не ограничиваясь ими, α-липоевую кислоту, α-токоферол, аскорбилпальмитат, бензиловый спирт, биотин, бисульфиты, бор, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), аскорбиновую кислоту и ее сложные эфиры, каротеноиды, цитрат кальция, ацетил-L-камитин, хелатообразователи, хондроитин, хром, лимонную кислоту, кофермент Q-10, цистеин, гидрохлорид цистеина, 3-дегидрошикимовую кислоту (DHS), EDTA (этилендиаминтетрауксусную кислоту; динатрийэдетат), сульфат железа, фолиевую кислоту, фумаровую кислоту, алкилгаллаты, чеснок, глюкозамин, экстракт виноградных зерен, гугул, магний, яблочную кислоту, метабисульфит, N-ацетилцистеин, ниацин, никотиномид, корень крапивы, орнитин, пропилгаллат, пикногенол, пальму сереноа, селен, бисульфит натрия, метабисульфит натрия, сульфит натрия, сульфит калия, винную кислоту, тиосульфаты, тиоглицерин, тиосорбит, токоферол и его сложные эфиры, например, ацетат токоферола, сукцинат токоферола, токотриенал, ацетат d-α-токоферола, витамин А и его сложные эфиры, витамин В и его сложные эфиры, витамин С и его сложные эфиры, витамин D и его сложные эфиры, витамин Е и его сложные эфиры, например, ацетат витамина Е, цинк и комбинации указанных веществ.
Термин ”поверхностно-активные вещества” обычно означает агенты, которые защищают белок от стрессов, возникающих на поверхности раздела воздух-раствор, и стрессов, возникающих на поверхности раствора. Например, поверхностно-активные вещества могут защищать белок от агрегации. Приемлемые поверхностно-активные вещества могут включать, например, полисорбаты, простые алкиловые эфиры полиоксиэтилена, такие как Brij 35.RTM, или полоксамер, такой как твин 20, твин 80, или полоксамер 188. Предпочтительными детергентами являются полоксамеры, например, полоксамер 188, полоксамер 407; простые алкиловые эфиры полиоксиэтилена, например, Brij 35.RTM, кремофор А25, симпатены ALM/230, и полисорбаты/твины, например, полисорбат 20, полисорбат 80, полоксамеры, например, полоксамер 188, и твины, например, твин 20 и твин 80.
В использованном здесь значении термин ”модификатор тоничности” означает одно или несколько соединений, которые могут быть использованы для регулирования тоничности жидкой композиции. Приемлемые модификаторы тоничности включают глицерин, лактозу, маннит, декстрозу, хлорид натрия, сульфат магния, хлорид магния, сульфат натрия, сорбит, трегалозу, сахарозу, раффинозу, мальтозу и другие вещества, известные специалистам в данной области. В одном варианте осуществления изобретения тоничность жидкой композиции приближается к тоничности крови или плазмы.
Термин ”вода” означает воду, которая была очищена для удаления загрязняющих примесей обычно путем дистилляции или обратного осмоса и определяется также в настоящем описании изобретения как ”чистая вода”. В предпочтительном варианте осуществления изобретения вода, используемая в составах по настоящему изобретению и способах их получения, не содержит наполнителей. В одном варианте осуществления изобретения вода является стерильной водой, пригодной для введения субъекту. В другом варианте осуществления изобретения вода означает воду для инъекций (WFI). В одном варианте осуществления изобретения вода означает дистиллированную воду или воду, пригодную для использования при выполнении анализов in vitro. В предпочтительном варианте осуществления изобретения диафильтрацию выполняют способами по настоящему изобретению, используя только воду в качестве диафильтрующей среды.
Термин ”антитело” в использованном здесь значении означает полные антитела и любые антигенсвязывающие фрагменты (то есть ”антигенсвязывающую часть”) или одиночные цепи антител. Термин ”антитело” означает гликопротеин, включающий по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, соединенные дисульфидными связями, или его антигенсвязывающую часть. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой как VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов СН1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой как VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена CL. VH- и VL-области могут быть далее подразделены на гипервариабельные участки, именуемые областями, определяющими комплементарность, разделенные более консервативными областями, именуемыми каркасными областями (FR). Каждая VH- и VL-область состоит из трех CDR и четырех FR, расположенных от аминоконца до карбоксиконца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат домен связывания, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулинов с тканями или факторами хозяина, включающими разные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплементов.
Термин ”антигенсвязывающая часть” антитела (или просто ”часть антитела”) в использованном здесь значении означает один или несколько фрагментов антитела, которые сохраняют способность специфически связываться с антигеном (например, TNFα, IL-12). Установлено, что антигенсвязывающую функцию антитела могут выполнять фрагменты непроцессированного антитела. Примеры связывающих фрагментов, входящих в определение термина ”антигенсвязывающая часть” антитела, включают (i) Fab-фрагмент, одновалентный фрагмент, состоящий из VL, VH, CL и СН1 доменов; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, включающий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из VH и CH1 доменов; (iv) Fv-фрагмент, состоящий из VL и VH доменов одного плеча антитела; (v) фрагмент dAb (Ward et al., (1989) Nature 341:544-546), состоящий из VH или VL домена; и (vi) выделенную область, определяющую комплементарность (CDR). Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодированы разными генами, они могут быть объединены методами рекомбинантных ДНК с использованием синтетического линкера, который позволяет получить одиночную белковую цепь, в которой VL и VH области спариваются с образованием одновалентных молекул (известен как одноцепочечный Fv-фрагмент (scFv); см., например, публикации Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также входят в определение термина “антигенсвязывающая часть” антитела. Указанные фрагменты антител получают обычными методами, известными специалистам в данной области, и исследуют в отношении их пригодности так же, как интактные антитела. В одном варианте осуществления изобретения фрагмент антитела выбирают из группы, состоящей из Fab, Fd, Fd', одноцепочечного Fv (scFv), scFva и домен-специфического антитела (dAb).
Кроме того, антитело или его антигенсвязывающая часть может быть частью более крупной иммуноадгезивной молекулы, образованной путем ковалентного или нековалентного связывания антитела или части антитела с одним или несколькими другими белками или пептидами. Указанные другие белки или пептиды могут иметь функциональные группы, которые делают возможной очистку антител или их антигенсвязывающих частей либо их связывание друг с другом или с другими молекулами. Таким образом, примеры таких иммуноадгезивных молекул включают использование центральной области стрептавидина для получения молекул, содержащих тетрамерный одноцепочечный вариабельный фрагмент (scFv) (Kipriyanov et al. (1995) Human Antibodies and Hybridomas 6:93-101), и использование остатка цистеина, пептида-маркера и С-концевой полигистидиновой метки для создания двухвалентных и биотинилированных молекул scFv (Kipriyanov et al. (1994) Mol. Immunol. 31:1047-1058). Части антитела, такие как Fab и F(ab')2 фрагменты, могут быть получены из полных антител стандартными методами, такими как расщепление полных антител папаином или пепсином. Кроме того, антитела, части антител и иммуноадгезивные молекулы могут быть получены стандартными методами рекомбинантных ДНК.
Домены антитела являются ”комплементарными”, так как они принадлежат к семейству структур, которые образуют родственные пары или группы или выделены из таких семейств и сохраняют указанный признак. Например, VH-домен и VL-домен антитела являются комплементарными; два VH-домена не являются комплементарными, и два VL-домена не являются комплементарными. Комплементарные домены могут быть найдены в других членах надсемейства иммуноглобулинов, такие как Vα и Vβ (или гамма и дельта) домены Т-клеточного рецептора.
Термин ”домен” означает складчатую структуру белка, которая сохраняет свою третичную структуру независимо от остального белка. Как правило, домены отвечают за отдельные функциональные свойства белков и во многих случаях могут быть добавлены, удалены или перенесены в других белки без утраты функции остальной части белка и/или домена. Один вариабельный домен антитела является складчатым полипептидным доменом, включающим последовательности, характерные для вариабельных областей антитела. Поэтому антитело включает полные вариабельные домены и модифицированные вариабельные домены, в которых, например, одна или несколько петель заменены последовательностями, не характерными для вариабельных доменов антитела или вариабельных доменов антитела, которые были усечены или включают удлинения у N- или C-конца, а также складчатые фрагменты вариабельных доменов, которые сохраняют по меньшей мере частично связывающую активность и специфичность непроцессированного домена.
Вариабельные домены по настоящему изобретению могут быть объединены с образованием группы доменов; например, могут быть объединены комплементарные домены, в частности, VL-домены могут быть объединены с VH-доменами. Некомплементарные домены также могут быть объединены. Домены могут быть объединены разными способами, включающими связывание доменов ковалентными или нековалентными связями.
Термин ”dAb” или “домен-специфическое антитело” означает один полипептид вариабельной области антитела (VH или VL), который специфически связывается с антигеном.
В использованном здесь значении термин ”антигенсвязывающая область” или “антигенсвязывающий сайт” означает часть молекулы антитела или его антигенсвязывающую часть, содержащую аминокислотные остатки, которые взаимодействуют с антигеном и сообщают антителу специфичность и сродство к антигену.
Термин ”эпитоп” означает часть любой молекулы, которая может быть узнана и связана антителом в одной или нескольких антигенсвязывающих областях антитела. В контексте настоящего изобретения первый и второй ”эпитопы” являются разными эпитопами и не связываются одним моноспецифическим антителом или его антигенсвязывающей частью.
Термин ”рекомбинантное антитело” означает антитела, полученные, экспрессированные, созданные или выделенные рекомбинантными методами, например, антитела, экспрессированные при помощи рекомбинантного экспрессирующего вектора, трансфицированного в клетку-хозяина, антитела, выделенные из комбинаторной библиотеки рекомбинантных антител, антитела, выделенные у животного (например, мыши), которое является трансгенным для генов иммуноглобулина человека (см., например, публикацию Taylor et al. (1992) Nucl. Acids Res. 20:6287-6295), или антитела, полученные, экспрессированные, созданные или выделенные любым другим способом, который включает сплайсинг конкретных последовательностей генов иммуноглобулина (таких как последовательности генов иммуноглобулина человека) в другие последовательности ДНК. Примеры рекомбинантных антител включают химерные, CDR-имплантированные и гуманизированные антитела.
Термин ”человеческое антитело” означает антитела, имеющие вариабельные и константные области, соответствующие или выделенные из последовательностей иммуноглобулина зародышевой линии человека, описанные, например, Кабатом и др. (см. публикацию Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication № 91-3242). Однако человеческие антитела по настоящему изобретению могут включать аминокислотные остатки, не кодированные последовательностями иммуноглобулина зародышевой линии человека (например, мутации, введенные при помощи неспецифического или сайт-специфического мутагенеза in vitro или соматической мутации in vivo), например, в CDR-области и, в частности, в CDR3.
Рекомбинантные человеческие антитела по настоящему изобретению содержат вариабельные области и могут также включать константные области, выделенные из последовательностей иммуноглобулина зародышевой линии человека (см., публикацию Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication № 91-3242). Однако в некоторых вариантах осуществления изобретения такие рекомбинантные человеческие антитела подвергают мутагенезу in vitro (или соматическому мутагенезу in vivo при использовании животного, трансгенного к последовательностям Ig человека), и, таким образом, аминокислотные последовательности VH- и VL-областей рекомбинантных антител являются последовательностями, которые, будучи выделенными и родственными последовательностям VH- и VL-областей зародышевой линии человека, могут не существовать в естественных условиях в спектре последовательностей антител зародышевой линии in vivo. Однако в некоторых вариантах осуществления изобретения такие рекомбинантные антитела являются результатом селективного мутагенеза, обратной мутации или того и другого вместе.
Термин ”обратная мутация” означает процесс, в соответствии с которым некоторые или все соматически мутированные аминокислоты человеческого антитела заменяют соответствующими остатками из гомологичной последовательности антитела зародышевой линии. Последовательности тяжелой и легкой цепей человеческого антитела по настоящему изобретению отдельно подвергают сравнительному анализу с последовательностями зародышевой линии в базе данных VBASE для идентификации последовательностей, обладающих наибольшей гомологией. Отличающиеся аминокислоты человеческого антитела по настоящему изобретению возвращают в последовательность зародышевой линии путем мутации нуклеотидов в определенных положениях, кодирующих отличающуюся аминокислоту. Роль каждой аминокислоты, идентифицированной таким образом в качестве кандидата для обратной мутации, должна быть исследована в отношении прямого или непрямого связывания антигена, при этом любая аминокислота, которая, как установлено, после мутации воздействует на любые желаемые характеристики человеческого антитела, не должна быть включена в конечное человеческое антитело. Чтобы свести к минимуму число аминокислот, подвергаемых обратной мутации, аминокислоты в положениях, которые, как установлено, отличаются от ближайшей последовательности зародышевой линии, но являются идентичными соответствующей аминокислоте во второй последовательности зародышевой линии, могут оставаться при условии, что вторая последовательность зародышевой линии идентична и соответствует последовательности человеческого антитела по настоящему изобретению в отношении по меньшей мере 10, предпочтительно 12 аминокислот, с обеих сторон рассматриваемой аминокислоты. Обратная мутация может произойти на любой стадии оптимизации антитела.
Термин ”химерное антитело” означает антитело, которое включает последовательности вариабельной области тяжелой и легкой цепей из одного вида и последовательности константной области из другого вида, например, антитела, включающие вариабельные области тяжелой и легкой цепей, связанные с константными областями человека.
Термин ”CDR-имплантированное антитело” означает антитела, которые включают последовательности вариабельной области тяжелой и легкой цепей из одного вида, но в которых последовательности одной или нескольких CDR-областей VH- и/или VL-областей заменены последовательностями CDR другого вида, например, антитела, включающие вариабельные области тяжелой и легкой цепей мыши, в которых одна или несколько CDR-областей мыши (например, CDR3) заменены последовательностями CDR человека.
Термин ”гуманизированное антитело” означает антитела, которые включают последовательности вариабельной области тяжелой и легкой цепей из вида, отличного от человека, (например, мыши), но в которых по меньшей мере часть последовательности VH- и/или VL-областей была изменена, чтобы быть более похожей на ”человеческую”, то есть более подобной вариабельным последовательностям зародышевой линии человека. Одним типом гуманизированного антитела является CDR-имплантированное антитело, в котором последовательности CDR человека вводят в последовательности VH- и VL-областей, отличные от человеческих, для замены соответствующих последовательностей CDR, отличных от человеческих.
Разные объекты настоящего изобретения подробно описаны в нижеследующих подразделах.
II. Способы по настоящему изобретению
Диафильтрация является методом использования мембран для удаления, замены или снижения концентрации солей или растворителей в растворах, содержащих белки, пептиды, нуклеиновые кислоты и другие биологические молекулы. Методы получения белков часто включают конечную диафильтрацию раствора белка в буфер композиции после очистки белка от загрязняющих примесей, образующихся в результате его экспрессии, например, от белков клетки-хозяина. Настоящее изобретение относится к способу получения водной композиции путем диафильтрации раствора белка с использованием только воды в качестве диафильтрующего раствора. Таким образом, композицию по настоящему изобретению получают с использованием воды в качестве среды для создания композиции в процессе диафильтрации без применения традиционных сред для композиции, которые включают наполнители, такие как поверхностно-активные вещества, используемые для растворения и/или стабилизации белка в конечной композиции. Настоящее изобретение относится к способу переноса белка в чистую воду, используемую в устойчивой композиции, при этом белок остается в растворе и может быть концентрирован до высоких уровней без использования других агентов, необходимых для сохранения устойчивости белка.
До выполнения диафильтрации или DF/UF в соответствии с настоящим изобретением указанный способ сначала включает получение белка в первом растворе. Белок может быть получен в любом первом растворе методами, хорошо известными в данной области, такими как методы синтеза (например, методы рекомбинантных ДНК, методы синтеза пептидов или их комбинация). Альтернативно белок, используемый в составах по настоящему изобретению и способах их получения, выделяют из эндогенного источника белка. Исходный раствор белка может быть получен методом очистки, в соответствии с которым белок очищают от гетерогенной смеси белков. В одном варианте осуществления изобретения исходный раствор белка, используемый в настоящем изобретении, получают методом очистки, в соответствии с которым белки, включая антитела, экспрессированные в системе экспрессии в клетках млекопитающего, подвергают нескольким стадиям хроматографической обработки, при выполнении которых из раствора белка удаляют белки клетки-хозяина (НСР). В одном варианте осуществления изобретения первый раствор белка получают из системы экспрессии в клетках млекопитающего и очищают для удаления белков клетки-хозяина (НСР). Примеры методов очистки описаны в заявке на патент США № 11/732918 (US 20070292442), которая включена в настоящее описание изобретения в качестве ссылки. Следует отметить, что при выполнении способов по настоящему изобретению не требуется специальный метод получения первого раствора белка.
Белки, которые могут быть использованы в составах по настоящему изобретению и способах их получения, могут быть любой величины, то есть иметь любую молекулярную массу (Mw). Например, белок может иметь Mw, равную или больше примерно 1 кДа, Mw, равную или больше примерно 10 кДа, Mw, равную или больше примерно 47 кДа, Mw, равную или больше примерно 57 кДа, Mw, равную или больше примерно 100 кДа, Mw, равную или больше примерно 150 кДа, Mw, равную или больше примерно 200 кДа, или Mw, равную или больше примерно 250 кДа. Числовые значения в интервале между вышеуказанными значениями Mw, например, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170 и так далее, а также все другие числовые значения, приведенные в настоящем описании изобретения, также входят в объем настоящего изобретения. Диапазоны значений, в которых использована комбинация любых вышеуказанных значений в качестве верхних и/или нижних пределов, также входят в объем настоящего изобретения. Например, белки, использованные в настоящем изобретении, могут иметь величину в диапазоне от 57 кДа до 250 кДа, от 56 кДа до 242 кДа, от 60 кДа до 270 кДа и так далее.
Способы по настоящему изобретению включают также диафильтрацию первого раствора белка, содержащего по меньшей мере два разных белка. Например, раствор белка может содержать антитела двух или более типов, направленно воздействующих на разные молекулы или разные эпитопы одной молекулы.
В одном варианте осуществления изобретения белок, находящийся в растворе, является терапевтическим белком, включающим без каких-либо ограничений слитые белки и ферменты. Примеры терапевтических белков включают, не ограничиваясь ими, такие белки как пульмозим (дорназа альфа), регранекс (бекаплермин), активаза (алтеплаза), алдуразим (ларонидаза), амевив (алефацепт), аранесп (дарбепоэтин альфа), концентрат бекаплермина, бетасерон (интерферон бета-1b), БОТОКС (токсин ботулина типа А), элитек (расбуриказа), элспар (аспарагиназа), эпоген (эпоэтин альфа), энбрел (этанерцепт), фабразим (агалсидаза бета), инферген (интерферон альфакон-1), интрон А (интерферон альфа-2а), кинерет (анакинра), МИОБЛОК (токсин ботулина типа В), нейласта (пэгфилграстим), неймега (опрелвекин), нейпоген (филграстим), онтак (денилейкин дифтитокс), ПЕГАСИС (пэгинтерферон альфа-2а), пролейкин (альдеслейкин), пульмозим (дорназа альфа), ребиф (интерферон бета-1а), регранекс (бекаплермин), ретаваза (ретеплаза), роферон-А (интерферон альфа-2), ТНКаза (тенектеплаза), ксигрис (дротрекогин альфа), аркалист (рилонацепт), NPlate (ромиплостим), мирцера (метоксиполиэтиленгликоль-эпоэтин бета), цинриза (ингибитор С1-эстеразы), элапраза (идурсульфаза), миозим (альглюкозидаза альфа), оренциа (абатацепт), наглазим (галсульфаза), кепиванс (палифермин) и актиммун (интерферон гамма-1b).
Белок, используемый в настоящем изобретении, может быть также антителом или его антигенсвязывающим фрагментом. Примеры антител, которые могут быть использованы в настоящем изобретении, включают химерные антитела, антитела, отличные от человеческих, человеческие антитела, гуманизированные антитела и домен-специфические антитела (dAb). В одном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент является антителом против TNFα и/или IL-12 (например, такое антитело может быть антителом с двумя вариабельными доменами (DVD)). Другие примеры антител или их антигенсвязывающих фрагментов, которые могут быть использованы в составах по настоящему изобретению и способах их получения, включают, не ограничиваясь ими, 1D4.7 (антитело против IL-12/IL-23; Abbott Laboratories), 2.5(E)mg1 (антитело против IL-18; Abbott Laboratories), 13C5.5 (антитело против IL-13; Abbott Laboratories), J695 (антитело против IL-12; Abbott Laboratories) афелимомаб (Fab2-фрагмент антитела против TNF; Abbott Laboratories), гумира (адалимумаб, Abbott Laboratories), кампат (алемтузумаб), арцитумомаб СЕА-Scan (Fab-фрагмент), эрбитукс (цетуксимаб), герцептин (трастузумаб), миосцинт (пентетат имциромаба), простасцинт (пендетид капромаба), ремикад (инфликсимаб), РеоПро (абциксимаб), ритуксан (ритуксимаб), симулект (басиликсимаб), синагис (паливизумаб), верлума (нофетумомаб), ксолаир (омализумаб), зенапакс (даклизумаб), зевалин (ибритумомаб тиуксетан), ортоклон ОКТ3 (муромонаб-CD3), панорекс (эдреколомаб), милотарг (гемтузумаб озогамицин), голимумаб (центокор), цимзиа (цертолизумаб пегол), солирис (экулизумаб), CNTO 1275 (устекинумаб), вектибикс (панитумумаб), бексар (тозитумомаб и I131-меченный тозитумомаб), антитело 7 против IL-17, описанное в международной заявке WO 2007/149032 (Кембриджская технология получения антител), которая полностью включена в настоящее описание изобретения в качестве ссылки, антитело САТ-354 против IL-13 (Кембриджская технология получения антител), антитело СЕ9у4РЕ против CD4 человека (IDEC-151, кленоликсимаб) (Biogen IDEC/Glaxo Smith Kline), антитело IDEC СЕ9.1/SB-210396 против CD4 человека (келиксимаб) (Biogen IDEC), антитело IDEC-114 против CD80 человека (галиксимаб) (Biogen IDEC), антитело CR4098 против белка вируса бешенства (форавирумаб), антитело HGS-ETR2 против рецептора 2 TNF-родственного апоптоз-индуцирующего лиганда человека (TRAIL-2) (лексатумумаб) (Human Genome Sciences, Inc.) и авастин (бевацизумаб).
Ниже описаны методы получения антител.
Поликлональные антитела
Поликлональные антитела обычно представляют собой смесь антител, специфичных к определенному антигену, но связывающихся с разными эпитопами на указанном антигене. Поликлональные антитела обычно образуются в организме животных в результате выполнения нескольких подкожных (sc) или внутрибрюшинных (ip) инъекций родственного антигена и адъюванта. Может быть полезно конъюгировать родственный антиген с белком, который является иммунногенным в иммунизируемом виде, таким как, например, гемоцианин лимфы улитки, сывороточный альбумин, бычий тироглобулин или ингибитор соевого трипсина, с использованием бифункционального или образующим производное агента, например, сложного эфира малеимидобензоилсульфосукцинимида (конъюгация по остаткам цистеина), N-гидроксисукцинимида (по остаткам лизина), глутаральдегида, янтарного альдегида, SOCl2 или R1NCNR, где R и R1 означают разные алкильные группы. Методы получения поликлональных антител известны в данной области и описаны, например, в публикации Antibodies: A Laboratory Manual, Lane and Harlow (1988), которая включена в настоящее описание изобретения в качестве ссылки.
Моноклональные антитела
Термин ”моноклональное антитело” в использованном здесь значении означает антитело, полученное из гибридомы (например, антитело, секретированное гибридомой, полученной методом гибридом, таким как стандартный метод гибридом Колера и Милстейна). Например, моноклональные антитела могут быть получены методом гибридом, впервые описанным в публикации Kohler et al., Nature, 256:495 (1975), или могут быть получены методами рекомбинантных ДНК (патент США № 4816567). Таким образом, полученное из гибридомы антитело с двойной специфичностью по настоящему изобретению по-прежнему определяется как моноклональное антитело, хотя указанное антитело обладает антигенной специфичностью в отношении более чем единичного антигена.
Моноклональные антитела получают из популяции по существу гомогенных антител, то есть отдельные антитела, образующие популяцию, являются идентичными за исключением возможных естественных мутаций, которые могут присутствовать в незначительных количествах. Таким образом, термин ”моноклональное” определяет характер антитела, которое не является смесью отдельных антител.
В другом варианте осуществления изобретения антитела могут быть выделены из фаговых библиотек антител, созданных методами, описанными в публикации McCafferty et al., Nature, 348:552-554 (1990). В публикациях Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991) описано выделение соответственно мышиных и человеческих антител с использованием фаговых библиотек. В нижеследующих публикациях описано получение высокоаффинных (в нМ диапазоне) человеческих антител методом перестановки цепи (Marks et al., Bio/Technology, 10:779-783 (1992)), а также комбинаторного инфицирования и рекомбинации in vivo в качестве методов создания очень крупных фаговых библиотек (Waterhouse et al., Nuc. Acids Res., 21:2265-2266 (1993)). Таким образом, указанные методы являются плодотворной альтернативой традиционным методам гибридом для выделения моноклональных антител.
Антитела и фрагменты антител могут быть также выделены из дрожжей и других эукариотических клеток при использовании экспрессирующих библиотек, описанных в патентах США №№ 6423538, 6696251, 6699658, 6300065, 6399763 и 6114147. Могут быть получены эукариотические клетки, способные экспрессировать белки из библиотек, включая комбинаторные библиотеки антител, для отображения на поверхности клетки, что позволяет отобрать конкретные клетки, содержащие клоны библиотек для обладающих сродством антител, с целью выбора молекул-мишеней. После удаления из выделенной клетки клон библиотеки, кодирующий представляющее интерес антитело, может быть экспрессирован на высоком уровне в приемлемой линии клеток млекопитающего.
Дополнительные методы создания представляющих интерес антител включают бесклеточный скрининг методом отображения нуклеиновой кислоты, описанным в патентах США №№ 7195880, 6951725, 7078197, 7022479, 6518018, 7125669, 6846655, 6281344, 6207446, 6214553, 6258558, 6261804, 6429300, 6489116, 6436665, 6537749, 6602685, 6623926, 6416950, 6660473, 6312927, 5922545 и 6348315. Указанные методы могут быть использованы для транскрипции белка in vitro из нуклеиновой кислоты таким образом, чтобы белок был физически ассоциирован или связан с нуклеиновой кислотой, в которой он был образован. Для отбора экспрессированного белка с помощью молекулы-мишени также выбирают нуклеиновую кислоту, кодирующую указанный белок. В одном варианте методов бесклеточного скрининга последовательности антител, выделенные из клеток иммунной системы, могут быть выделены и рандомизированы методами мутагенеза при помощи полимеразной цепной реакции для увеличения разнообразия антител. Указанные частично рандомизированные гены антител затем экспрессируют в бесклеточной системе при одновременной физической ассоциации, созданной между нуклеиновой кислотой и антителом.
ДНК также может быть модифицирована, например, путем замены гомологичных мышиных последовательностей кодирующей последовательностью константных доменов тяжелой и легкой цепей человека (патент США № 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851 (1984)) или путем ковалентного связывания с кодирующей последовательность иммуноглобулина всей или части кодирующей последовательности полипептида, отличного от иммуноглобулина.
Такие полипептиды, отличные от иммуноглобулина, обычно вводят вместо константных доменов антитела или вместо вариабельных доменов одного антигенсвязывающего сайта антитела для создания химерного двухвалентного антитела, включающего один антигенсвязывающий сайт, обладающий специфичностью к одному антигену, и другой антигенсвязывающий сайт, обладающий специфичностью к другому антигену.
Химерные или гибридные антитела могут быть также получены in vitro известными методами синтеза белков, которые включают использование сшивающих агентов. Например, иммунотоксины могут быть созданы при помощи реакции замены дисульфидных связей или образования тиоэфирной связи. Примеры реагентов, пригодных для указанной цели, включают иминотиолат и метил-4-меркаптобутиримидат.
Гуманизированные антитела
Методы гуманизации антител, отличных от человеческих, хорошо известны в данной области. Гуманизированное антитело обычно содержит один или несколько аминокислотных остатков, введенных в него из источника, отличного от человеческого. Указанные аминокислотные остатки, отличные от человеческих, часто определяются как ”чужеродные” остатки, которые обычно получают из ”чужеродного” вариабельного домена. Гуманизация может быть выполнена методом, разработанным Уинтером с соавторами (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), который включает замену соответствующих последовательностей человеческого антитела CDR-областями или последовательностями CDR, отличными от человеческих (например, грызунов). Таким образом, такие ”гуманизированные” антитела являются химерными антителами (патент США № 4816567), в которых по существу часть интактного вариабельного домена человека заменена соответствующей последовательностью вида, отличного от человека. На практике гуманизированные антитела обычно являются человеческими антителами, в которых некоторые остатки CDR и, возможно, некоторые остатки каркасной области (FR) заменены остатками аналогичных сайтов в антителах грызунов. Дополнительные материалы, в которых описан процесс гуманизации, включают публикации Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987); Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993), которые включены в настоящее описание изобретения в качестве ссылки.
Человеческие антитела
Альтернативно в настоящее время можно получить трансгенных животных (например, мышей), способных в результате иммунизации продуцировать полный спектр человеческих антител при отсутствии продуцирования эндогенного иммуноглобулина. Например, установлено, что гомозиготная делеция гена соединительной области (JH) тяжелой цепи антитела в химерных и гаметических мутантных мышах вызывает полное ингибирование продуцирования эндогенных антител. Перенос последовательности гена иммуноглобулина зародышевой линии человека таким гаметическим мутантным мышам вызывает продуцирование человеческих антител при антигенной стимуляции. См., например, публикации Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993). Человеческие антитела могут быть также получены из библиотек отображения на фаге (Hoogenboom et al., J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991)).
В одном варианте осуществления изобретения композиция по настоящему изобретению содержит антитело или его антигенсвязывающую часть, которое связывается с TNFα человека, такое как, например, адалимумаб (определяемый также как гумира, адалимумаб или D2E7; Abbott Laboratories). В одном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент диссоциирует от TNFα человека при KD 1×10-8 М или меньше и константе скорости Koff 1×10-3 сек-1 или меньше, которые определены методом резонанса поверхностных плазмонов, и нейтрализует цитотоксичность TNFα человека при выполнении стандартного анализа L929 in vitro при IC50 1×10-7 М или меньше. Примеры и методы получения человеческих нейтрализующих антител, обладающих высоким сродством к TNFα человека, включая последовательности указанных антител, описаны в патенте США № 6090382 (антитело, определяемое как D2E7), который включен в настоящее описание изобретения в качестве ссылки.
В одном варианте осуществления изобретения композиция по настоящему изобретению содержит антитело или его антигенсвязывающую часть, которое связывается с IL-12 человека, такое как, например, антитело J695 (Abbott Laboratories; определяемое также как АВТ-875) (патент США № 6914128). Антитело J695 является полностью человеческим моноклональным антителом, созданным для направленного воздействия и нейтрализации интерлейкина-12 и интерлейкина-23. В одном варианте осуществления изобретения указанное антитело или его антигенсвязывающий фрагмент обладает следующими характеристиками: оно диссоциирует от IL-1α человека при KD 3×10-7 М или меньше; диссоциирует от IL-1β человека при KD 5×10-5 М или меньше и не связывается с IL-1α мыши или IL-1β мыши. Примеры и методы получения человеческих нейтрализующих антител, которые обладают высоким сродством к IL-12 человека, включая последовательности данного антитела, описаны в патенте США № 6914128, который включен в настоящее описание изобретения в качестве ссылки.
В одном варианте осуществления изобретения композиция по настоящему изобретению содержит антитело или его антигенсвязывающую часть, которое связывается с IL-18 человека, такое как, например, антитело 2.5(Е)mg1 (Abbott Bioresearch; определяемое также как АВТ-325) (см. заявку на патент США № 2005/0147610, включенную в настоящее описание изобретения в качестве ссылки).
В одном варианте осуществления изобретения композиция по настоящему изобретению содержит антитело против IL-12/IL-23 или его антигенсвязывающую часть, которое является антителом 1D4.7 (Abbott Laboratories; определяемое также как АВТ-147) (см. заявку WO 2007/005608 A2, опубликованную 11 января 2007 г., которая включена в настоящее описание изобретения в качестве ссылки).
В одном варианте осуществления изобретения композиция по настоящему изобретению содержит антитело против IL-13 или его антигенсвязывающую часть, которое является антителом 13С5.5 (Abbott Laboratories; определяемое также как АВТ-308) (см. публикацию РСТ/US2007/19660 (WO 08/127271), которая включена в настоящее описание изобретения в качестве ссылки).
В одном варианте осуществления изобретения композиция по настоящему изобретению содержит антитело или его антигенсвязывающую часть, которое является антителом 7С6, в частности антителом против β-амилоидных клеток (Abbott Laboratories; см. публикацию РСТ WO 07/062852, которая включена в настоящее описание изобретения в качестве ссылки).
Биспецифические антитела
Биспецифические антитела (BsAb) являются антителами, обладающими специфичностью связывания в отношении по меньшей мере двух разных эпитопов. Такие антитела могут быть получены из непроцессированных антител или фрагментов антител (например, F(ab')2-фрагменты биспецифических антител).
В данной области известны методы получения биспецифических антител. В основе традиционного получения непроцессированных биспецифических антител лежит коэкспрессия двух пар тяжелой цепи-легкой цепи иммуноглобулина, в которых две цепи имеют разные специфичности (Millstein et al., Nature, 305:537-539 (1983)). Благодаря произвольному набору тяжелых и легких цепей иммуноглобулина указанные гибридомы (квадромы) продуцируют потенциальную смесь из 10 разных молекул антител, из которых только одна имеет правильную биспецифическую структуру. Очистка правильной молекулы, которую обычно производят при помощи аффинной хроматографии, является довольно трудоемким процессом, при этом выход продукта является низким. Аналогичные методы описаны в WO 93/08829 и публикации Traunecker et al., EMBO J., 10:3655-3659 (1991).
В соответствии с другим методом вариабельные домены антитела с требуемой специфичностью связывания (антигенсвязывающие сайты антитела) гибридизируют с последовательностями константного домена иммуноглобулина.
Гибридизацию предпочтительно выполняют с константным доменом тяжелой цепи иммуноглобулина, включающего по меньшей мере часть шарнирной, СН2 и СН3 областей. Желательно, чтобы по меньшей мере в одном из гибридов находилась первая константная область тяжелой цепи (СН1), содержащая сайт, необходимый для связывания легкой цепи. ДНК, кодирующие гибриды тяжелой цепи иммуноглобулина и при желании легкой цепи иммуноглобулина, вводят в отдельные экспрессирующие векторы и котрансфицируют в приемлемый организм-хозяин. Это позволяет гибко регулировать взаимные пропорции трех полипептидных фрагментов, когда неравные соотношения трех полипептидных цепей, используемых в конструкции, обеспечивают оптимальный выход. Однако кодирующие последовательности для двух или всех трех полипептидных цепей можно ввести в один экспрессирующий вектор, когда экспрессия по меньшей мере двух полипептидных цепей в одинаковых соотношениях обеспечивает высокий выход или когда соотношения не имеют конкретного значения.
В предпочтительном варианте осуществления изобретения биспецифические антитела состоят из гибридной тяжелой цепи иммуноглоубина, в которой первая специфичность связывания находится в одном плече и гибридная пара тяжелой цепи-легкой цепи иммуноглобулина (обеспечивающая вторую специфичность связывания) находится в другом плече. Установлено, что такая асимметричная структура облегчает отделение требуемого биспецифического соединения от нежелательных комбинаций цепей иммуноглобулина, так как наличие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает легкое разделение. Указанный способ описан в заявке WO 94/04690, опубликованной 3 марта 1994 г. Для более подробного ознакомления с созданием биспецифических антител см., например, публикацию Suresh et al., Methods in Enzymology, 121:210 (1986).
Биспецифические антитела включают перекрестносшитые или “гетероконъюгатные” антитела. Например, одно из антител в гетероконъюгате может быть связано с авидином, другое может быть связано с биотином. Такие антитела были предложены, например, для направленной доставки клеток иммунной системы к нежелательным клеткам (патент США № 4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373 и европейский патент № 03089). Гетероконъюгатные антитела могут быть получены любыми стандартными методами перекрестного сшивания. Приемлемые перекрестносшивающие агенты хорошо известны в данной области и описаны в патенте США № 4676980 наряду с целым рядом методов перекрестного сшивания.
В научной литературе также описаны методы создания биспецифических антител из фрагментов антител. Следующие методы могут быть также использованы для получения фрагментов двухвалентных антител, которые необязательно являются биспецифическими. Например, Fab'-фрагменты, выделенные из Е. coli, могут быть химически связаны in vitro с образованием двухвалентных антител. См. публикацию Shalaby et al., J. Exp. Med., 175:217-225 (1992).
Описаны также разные методы получения и выделения фрагментов двухвалентных антител непосредственно из культуры рекомбинантных клеток. Например, двухвалентные гетеродимеры были получены с использованием лейциновых застежек-молний. Kostelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды лейциновых застежек-молний из Fos и Jun белков связывали с Fab'-частями двух разных антител путем слияния генов. Гомодимеры антител восстанавливали в шарнирной области с образованием мономеров и затем повторно окисляли с образованием гетеродимеров антител. Метод получения ”диател”, описанный в публикации Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993), представляет собой альтернативный механизм получения фрагментов биспецифических/двухвалентных антител. Указанные фрагменты включают вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) при помощи линкера, который является слишком коротким для возможного спаривания двух доменов в одной цепи. Поэтому VH и VL домены одного фрагмента подвергаются спариванию с комплементарными VL и VH доменами другого фрагмента, образуя таким образом два антигенсвязывающих сайта. Известен также другой метод получения фрагментов биспецифических/двухвалентных антител с использованием димеров одноцепочечных Fv-фрагментов (sFv). См. публикацию Gruber et al., J. Immunol., 152:5368 (1994).
В одном варианте осуществления изобретения композиция по настоящему изобретению содержит антитело, которое является биспецифичным к IL-1 (включая IL-1α и IL-1β). Примеры и методы получения антител, биспецифичных к IL-1, описаны в предварительной заявке на патент США № 60/878165, поданной 29 декабря 2006 г.
При выполнении диафильтрации/ультрафильтрации (обычно определяемые в настоящем описании изобретения также как DF/UF) избирательно используются проницаемые (пористые) мембранные фильтры для разделения компонентов растворов и суспензий на основании размера молекул. Мембрана задерживает молекулы, которые крупнее, чем поры мембраны, в то время как более мелкие молекулы, такие как соли, растворители и вода, свободно проходят через мембрану. Раствор, задерживаемый мембраной, известен как концентрат или задержанное вещество. Раствор, проходящий через мембрану, известен как фильтрат или проникающее вещество. Одним параметром выбора мембраны для концентрирования являются ее характеристики удерживания концентрируемого образца. Как правило, показатель отсечения молекулярной массы (MWCO) мембраны должен составлять 1/3-1/6 молекулярной массы задерживаемой молекулы. Данный параметр предполагает полное задержание. Чем ближе значение MWCO к аналогичному значению образца, тем больше риск потери некоторого количества мелкого продукта в процессе концентрирования. Примеры мембран, которые могут быть использованы в способах по настоящему изобретению, включают полиэфирсульфоновую мембрану (PES) Omega™ (значение MWCO 30 кДа, то есть молекулы с молекулярной массой больше 30 кДа задерживаются мембраной и молекулы с молекулярной массой меньше 30 кДа проходят через мембрану на сторону фильтрата) (Pall Corp., Port Washington, NY); фильтр-насадку для шприца Millex®-GV, PVDF 0,22 мкм (Millipore Corp., Billerica, MA); фильтр-насадку для шприца Millex®-GP, PES 0,22 мкм; фильтр Sterivex® 0,22 мкм (Millipore Corp., Billerica, MA) и концентраторы Vivaspin (MWCO 10 кДа, PES; MWCO 3 кДа, PES) (Sartorius Corp., Edgewood, NY). Чтобы получать низкоионную белковую композицию по настоящему изобретению, раствор белка (который может растворяться в содержащей буфер композиции) подвергают процессу DF/UF, при этом вода используется в качестве среды для DF/UF. В предпочтительном варианте осуществлении изобретения среда для DF/UF состоит из воды и не содержит любых других наполнителей.
При выполнении DF/UF по настоящему изобретению может быть использована любая вода, хотя предпочтительной водой является очищенная или деионизированная вода. Типы воды, известные в данной области, которые могут быть использованы при осуществлении настоящего изобретения, включают воду для инъекций (WFI) (например, воду для инъекций качества HyPure (HyClone), воду для инъекций AQUA-NOVA® (Aqua Nova)), воду UltraPure™ (Invitrogen) и дистиллированную воду (Invitrogen; Sigma-Aldrich).
Существуют два метода DF/UF, включающие DF/UF в периодическом режиме и DF/UF в непрерывном режиме. Способы по настоящему изобретению могут быть выполнены в любом режиме.
Метод выполнения DF/UF в непрерывном режиме (определяемый также как DF/UF с постоянным объемом) включает вымывание исходных буферных солей (или других низкомолекулярных частиц) из концентрата (образец или первый раствор белка) путем добавления воды или нового буфера к концентрату со скоростью, соответствующей образованию фильтрата. В результате этого объем концентрата и концентрация продукта не изменяются в процессе DF/UF. Количество удаленной соли соответствует объему полученного фильтрата относительно объема концентрата. Объем полученного фильтрата обычно определяется термином ”объем диафильтрации”. Единичный объем диафильтрации (DV) является объемом концентрата в начале диафильтрации. При диафильтрации в непрерывном режиме жидкость добавляют со скоростью, соответствующей образованию фильтрата. Когда объем полученного фильтрата соответствует исходному объему концентрата, обработанный объем равен 1 DV.
Метод выполнения DF/UF в периодическом режиме (примеры которого приведены ниже в разделе ”Примеры”) включает два разных метода, а именно DF/UF с последовательным разбавлением в периодическом режиме и DF/UF c уменьшением объема в периодическом режиме. DF/UF с последовательным разбавлением в периодическом режиме включает первое разбавление образца (или первого раствора белка) водой до заранее определенного объема. Разбавленный образец затем снова концентрируют до первоначального объема при помощи UF. DF/UF с уменьшением объема в периодическом режиме включает первое концентрирование образца до заранее определенного объема и последующее разбавление образца до первоначального объема водой или заменяемым буфером. Также как в случае DF/UF в непрерывном режиме, процесс повторяется до полного удаления нежелательных растворенных веществ, например, ионных наполнителей.
Диафильтрация/ультрафильтрация может быть выполнена стандартными методами, известными в данной области, с использованием воды, например, воды для инъекций, в качестве среды для DF/UF (см., например, публикацию Industrial Ultrafiltration Design and Application of Diafiltration Procecces, Beaton & Klinkowski, J. Separ. Proc. Technol., 4(2)1-10 (1983)). Примеры промышленно доступного оборудования для выполнения DF/UF включают систему фильтрации с тангенциальным потоком (TFF) Millipore Labscale™ (Millipore), лабораторную систему фильтрации с тангенциальным потоком LV Centramate™ (Pall Corporation) и систему UniFlux (GE Healthcare).
Например, в предпочтительном варианте осуществления изобретения при выполнении способа по настоящему изобретению для получения диафильтрованного раствора антител использована система фильтрации с тангенциальным потоком (TFF) с 500-мл резервуаром. Процесс DF/UF выполняют в периодическом режиме на протяжении 14 стадий для получения высококонцентрированной композиции антител в воде. Дополнительные типы оборудования, объемы раствора и воды, количество стадий процесса и другие параметры конкретных вариантов осуществления изобретения представлены в приведенном ниже разделе ”Примеры”.
Альтернативные методы диафильтрации для замены буфера, в соответствии с которыми белок вводят в воду способами по настоящему изобретению, включают диализ и гель-фильтрацию, которые являются методами, известными в данной области. Диализ требует заполнения диализного мешка (кожух мембраны с определенной пористостью), который завязывают и помещают в ванну с водой. В результате диффузии концентрация соли в мешке уравновешивается с концентрацией соли в ванне, в результате чего крупные молекулы, например, белки, которые не могут диффундировать из мешка, остаются в мешке. Чем больше объем ванны относительно объема образца в мешках, тем меньше достигаемая равновесная концентрация. Обычно требуется замена воды в ванне для полного удаления всей соли. Гель-фильтрация является методом неадсорбционной хроматографии, которая разделяет молекулы на основе размера молекул. В случае гель-фильтрации крупные молекулы, например, белки, могут быть отделены от более мелких молекул, например, солей, путем вытеснения.
В предпочтительном варианте осуществления изобретения первый раствор белка подвергают повторному объемному обмену с водой, в результате чего получают водную композицию, состоящую по существу из воды и белка. Стадия диафильтрации может быть выполнена любое число раз в зависимости от содержания белка в растворе, при этом одна стадия диафильтрации равна одному полному объемному обмену. В одном варианте осуществления изобретения процесс диафильтрации выполняют 1, 2, 3, 4, 5, 6, 7, 8, 9 или столько раз, сколько необходимо для удаления наполнителей, например, солей, из первого раствора белка, до тех пор, пока белок не будет по существу растворен в воде. Один цикл или стадия диафильтрации считается выполненной, когда объем воды, добавленной со стороны концентрата, равен исходному объему раствора белка.
В одном варианте осуществления изобретения раствор белка подвергают по меньшей мере 2 стадиям диафильтрации. В одном варианте осуществления изобретения стадия диафильтрации или объемный обмен с водой повторяют по меньшей мере четыре раза и предпочтительно по меньшей мере пять раз. В одном варианте осуществления изобретения первый раствор белка подвергают диафильтрации с водой до достижения по меньшей мере шестикратного объемного обмена. В другом варианте осуществления изобретения первый раствор белка подвергают диафильтрации с водой до достижения по меньшей мере семикратного объемного обмена. Промежуточные диапазоны вышеуказанных значений, например, 4-6 или 5-7, также входят в объем настоящего изобретения. Например, в объем настоящего изобретения входят диапазоны значений при использовании любых вышеуказанных значений в качестве верхнего и/или нижнего пределов.
В предпочтительном варианте осуществления изобретения потеря белка на стороне фильтрата ультрафильтрационной мембраны должен быть минимальным. Риск потери белка на стороне фильтрата конкретной мембраны является различным в зависимости от размера белка относительно размера пор мембраны и концентрации белка. С увеличением концентрации белка риск потери белка в фильтрате повышается. Для конкретного размера пор мембраны риск потери белка является более высоким для более мелких молекул белка, размер которых приближается к значению MWCO мембраны, чем для более крупных молекул белка. Таким образом, при выполнении DF/UF более мелкого белка не может быть достигнуто такое же уменьшение объема, как в случае выполнения DF/UF более крупного белка при использовании одной и той же мембраны без неприемлемых потерей белка. Другими словами, по сравнению с ультрафильтрацией раствора более мелкого белка при использовании одного и того же оборудования и мембраны раствор более крупного белка может быть ультрафильтрован до меньшего объема при более высокой концентрации белка в растворе. Процессы DF/UF с использованием мембраны с определенным размером пор могут потребовать выполнения большего числа стадий для более мелкого белка, чем для более крупного белка; большее уменьшение объема и концентрации более крупного белка позволяет добавлять большие объемы воды, что вызывает большее разбавление оставшегося буфера или ингредиентов наполнителя в растворе белка на данной стадии процесса. Поэтому для более крупного белка может понадобиться меньшее число стадий процесса для достижения определенного уменьшения растворенных веществ, чем для более мелкого белка. Специалист в данной области может вычислить концентрацию, возможную на каждой стадии процесса и общее число стадий процесса, необходимых для определенного уменьшения растворенных веществ с учетом размера белка и размера пор используемого ультрафильтрационного устройства.
В результате выполнения методов диафильтрации по настоящему изобретению концентрация растворенных веществ, содержащихся в первом растворе белка, значительно уменьшается в конечной водной концентрации, содержащей в основном воду и белок. Например, в водной композиции конечная концентрация наполнителей по меньшей мере на 95% меньше, чем в первом растворе белка, и предпочтительно по меньшей мере на 99% меньше, чем в первом растворе белка. Например, в одном варианте осуществления изобретения растворение белка в воде для инъекций представляет собой процесс, обеспечивающий теоретическую конечную концентрацию наполнителей, достигаемую в результате выполнения диафильтрации с постоянным объемом при пяти объемах диафильтрации, равную или приближающуюся к значению Ci e-5=0,00674, что соответствует максимальному уменьшению содержания наполнителя, равному примерно 99,3%. В одном варианте осуществления изобретения специалист в данной области может выполнить 6 объемных обменов во время последней стадии промышленного выполнения DF/UF с постоянным объемом, то есть значение Ci может быть равно Ci e-6=0,0025. Таким образом достигается примерно 99,75% максимальное теоретическое уменьшение наполнителей. В другом варианте осуществления изобретения специалист в данной области может выполнить 8 объемных обменов диафильтрации с достижением ~99,9% максимального теоретического уменьшения наполнителей.
Термин ”отсутствие наполнителей” или “не содержащий наполнителей” означает, что композиция по существу не содержит наполнителей. В одном варианте осуществления изобретения отсутствие наполнителей предполагает отсутствие буфера, отсутствие соли, отсутствие сахара, отсутствие аминокислот, отсутствие поверхностно-активного вещества и/или отсутствие полиола. В одном варианте осуществления изобретения термин ”по существу не содержащий наполнителей” означает, что в растворе или композиции наполнители отсутствуют по меньшей мере на 99%. Однако следует отметить, что в некоторых вариантах осуществления изобретения композиция может содержать определенный неионный наполнитель, например, сахарозу или маннит, при отсутствии других наполнителей. Например, композиция может включать воду, белок и маннит и не содержать других наполнителей. В другом примере композиция может включать воду, белок и полисорбат 80 и не содержать других наполнителей. В другом примере композиция может включать воду, белок, сорбит и полисорбат 80 и не содержать других наполнителей.
При использовании воды для диафильтрации первого раствора белка методами, рассмотренными в настоящем описании изобретения, после удаления ионных наполнителей проводимость диафильтрованной водной композиции становится меньше по сравнению с первым раствором белка. Водный раствор, проводящий электричество, должен содержать ионы, присущие ионным наполнителям. Поэтому низкая проводимость является показателем того, что в водной композиции по настоящему изобретению значительно уменьшено количество наполнителей, в том числе ионных наполнителей.
Проводимость раствора измеряют методами, известными в данной области. Для определения проводимости водной композиции могут быть использованы измерители проводимости или ячейки для измерения электропроводности, которые должны быть калиброваны в соответствии со стандартным раствором перед использованием. Примеры измерителей проводимости, имеющихся в данной области, включают цифровой кондуктометр MYRON L (Cole Parmer®) (Metrohm AG) и интегрированные анализаторы проводимости серии 3105/3115 (Kemotron). В одном варианте осуществления изобретения водная композиция имеет проводимость менее 3 мСм/см. В другом варианте осуществления изобретения водная композиция имеет проводимость менее 2 мСм/см. В еще одном варианте осуществления изобретения водная композиция имеет проводимость менее 1 мСм/см. В соответствии с одним объектом изобретения водная композиция имеет проводимость менее 0,5 мСм/см. В объем настоящего изобретения входят промежуточные диапазоны вышеуказанных значений. Например, в объем изобретения входят диапазоны значений, включающие комбинацию любых вышеуказанных значений в качестве верхнего и/или нижнего пределов. Кроме того, в объем настоящего изобретения также входят значения, являющиеся частями приведенных величин, например, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0 и так далее.
Важным аспектом настоящего изобретения является то, что диафильтрованный раствор белка (раствор, полученный в результате диафильтрации первого раствора белка) может быть концентрирован. Было установлено, что белок в высоких концентрациях устойчив в воде. Концентрирование, выполняемое после диафильтрации, позволяет получить водный раствор, содержащий воду и белок в более высокой концентрации по сравнению с первым раствором белка. Таким образом, настоящее изобретение также включает диафильтрацию раствора белка с использованием воды в качестве диафильтрующей среды и последующее концентрирование полученного водного раствора. Концентрирование диафильтрованного раствора белка может быть выполнено способами, известными в данном области, включая центрифугирование. Например, после диафильтрации диафильтрованный раствор белка в воде подвергают центрифугированию, позволяющему концентрировать белок путем ультрафильтрации с образованием высококонцентрированной композиции, по-прежнему представляющей собой раствор на водной основе. В данной области известны способы концентрирования раствора путем центрифугирования с использованием ультрафильтрационных мембран и/или устройств, например, при помощи центробежных концентраторов Vivaspin (Sartorius Corp., Edgewood, NY).
Способы по настоящему изобретению позволяют концентрировать белок до очень высоких уровней в воде без необходимости использования дополнительных стабилизаторов. Концентрация белка в водной композиции, полученной способами по настоящему изобретению, может иметь любое значение, соответствующее требуемой концентрации. Например, концентрация белка в водном растворе, полученном способами по настоящему изобретению, равна по меньшей мере примерно 10 мкг/мл, по меньшей мере примерно 1 мг/мл, по меньшей мере примерно 10 мг/мл, по меньшей мере примерно 20 мг/мл, по меньшей мере примерно 50 мг/мл, по меньшей мере примерно 75 мг/мл, по меньшей мере примерно 100 мг/мл, по меньшей мере примерно 125 мг/мл, по меньшей мере примерно 150 мг/мл, по меньшей мере примерно 175 мг/мл, по меньшей мере примерно 200 мг/мл, по меньшей мере примерно 220 мг/мл, по меньшей мере примерно 250 мг/мл, по меньшей мере примерно 300 мг/мл или больше примерно 300 мкг/мл. В объем настоящего изобретения входят также промежуточные диапазоны вышеуказанных концентраций, например, по меньшей мере примерно 113 мг/мл, по меньшей мере примерно 214 мг/мл и по меньшей мере примерно 300 мг/мл. Кроме того, в объем настоящего изобретения входят диапазоны значений, включающие комбинацию любых вышеуказанных значений (или промежуточных значений вышеуказанных диапазонов) в качестве верхнего и/или нижнего пределов, например, 100-125 мг/мл, 113-125 мг/мл и 126-200 мг/мл или больше.
Преимуществом способов по настоящему изобретению является то, что полученная композиция характеризуется низким процентным содержанием агрегатов белка, несмотря на высокую концентрацию водной белковой композиции. В одном варианте осуществления изобретения водные композиции, включающие воду и белок в высокой концентрации, например, антитела, содержат менее примерно 5% агрегатов белка даже при отсутствии поверхностно-активного вещества и наполнителей других типов. В одном варианте осуществления изобретения композиция содержит не более примерно 7,3% агрегированного белка; композиция содержит не более примерно 5% агрегированного белка; композиция содержит не более примерно 4% агрегированного белка; композиция содержит не более примерно 3% агрегированного белка; композиция содержит не более примерно 2% агрегированного белка, или композиция содержит не более примерно 1% агрегированного белка. В одном варианте осуществления изобретения композиция содержит по меньшей мере примерно 92%, по меньшей мере примерно 93%, по меньшей мере примерно 94%, по меньшей мере примерно 95%, по меньшей мере примерно 96%, по меньшей мере примерно 97%, по меньшей мере примерно 98% или по меньшей мере примерно 99% мономерного белка. В объем настоящего изобретения входят промежуточные диапазоны вышеуказанных концентраций, например, по меньшей мере примерно 98,6%, не более примерно 4,2%. Кроме того, в объем настоящего изобретения входят диапазоны значений, включающие комбинацию вышеуказанных значений в качестве верхнего и/или нижнего пределов.
Многие фармацевтические продукты на основе белка должны быть получены в высоких концентрациях. Например, концентрация продуктов на основе антител должна превышать 100 мг/мл в композиции лекарственного продукта (DP) для достижения требуемой эффективности и удовлетворять требованию пригодности для субъекта, соответствующему максимальному объему инъекции, равному ~1 мл. Поэтому стадии обработки, такие как диафильтрация в буфер конечной композиции или ультрафильтрация для увеличения концентрации белка, также выполняют при более высоких концентрациях.
Классическая термодинамика показывает, что межмолекулярные взаимодействия могут влиять на распределение мелких растворенных веществ на диализной мембране особенно при более высоких концентрациях белка, при этом существуют модели, описывающие неидеальное равновесие диализа и эффекты межмолекулярного взаимодействия (Tanford, Physical chemistry or macromolecules. New York, John Wiley and Sons, Inc., p.182, 1961; Tester and Modell, Thermodynamics and its applications, 3rd ed. Upper Saddle River, NL, Prentice-Hall, 1997). При отсутствии подробных данных термодинамики об условиях выполнения процесса, необходимых для моделей указанного типа, межмолекулярные взаимодействия редко принимаются во внимание при разработке промышленных процессов DF/UF. Поэтому концентрации наполнителей в лекарственном продукте могут существенно отличаться от указанной концентрации. В научной литературе приведено несколько примеров такого расхождения между промышленно выпускаемыми и разработанными продуктами, например, содержание хлорида может быть на 30% ниже предполагаемого количества в антагонисте рецепторов IL-1, содержание гистидина может быть на 40% ниже предполагаемое количества в пэгилированном антагонисте рецептора TNF, и содержание ацетата может быть на 200% выше предполагаемого количества в слитом конъюгатном белке (Stoner et al., J. Pharm. Sci. 93, 2332-2343 (2994)). Существует несколько причин отличия действительного лекарственного продукта от состава буфера, в который диафильтруется белок, которые включают эффект Доннана (Tombs and Peacocke (1974) Oxford; Clarendon Press), неспецифические взаимодействия (Arakawa and Timasheff, Arch. Biochem. Biophys., 224, 169-77 (1983); Timasheff, Annu. Rev. Biophys. Biomol. Struct., 22, 67-97 (1993)) и эффекты объемного вытеснения. Объемное вытеснение охватывает парциальные удельные объемы большинства белков, находящиеся в пределах 0,7-0,8 мл/г5. Так, для глобулярного белка в концентрации 100 мг/мл молекулы белка составляют примерно 7,5% общего объема раствора. Без учета значительных межмолекулярных взаимодействий это приведет к тому, что молярная концентрация растворенных веществ со стороны концентрата мембраны будет составлять 92,5% молярной концентрации со стороны фильтрата мембраны. Данное положение объясняет, почему в основном во всех составах, включающих раствор белка, обязательно изменяется состав в процессе ультрафильтрации. Например, при концентрации 40 мг/мл молекулы белка составляют примерно 3% общего объема раствора, и стадия ультрафильтрации, увеличивающая указанную концентрацию до 150 мг/мл, обязательно вызывает изменение молярных концентраций наполнителей больше, чем на 8% (так белок в концентрации 150 мг/мл составляет более 11% общего объема раствора). В объем настоящего изобретения также входят промежуточные диапазоны вышеуказанных процентных значений. Кроме того, в объем изобретения входят диапазоны значений, включающие комбинацию любых вышеуказанных значений в качестве верхнего и/или нижнего пределов.
Что касается композиций по настоящему изобретению и способов их получения, то изменения состава буфера во время DF/UF могут быть компенсированы использованием чистой воды в качестве диафильтрующей среды. При концентрировании белка больше, чем на ~20% по сравнению с концентрацией, требуемой в конечном лекарственном веществе, наполнители могут быть добавлены позже, например, в высококонцентрированных исходных растворах наполнителей. Таким образом могут быть гарантированы концентрации наполнителей и значения рН раствора, точно соответствующие требуемым значениям.
Преимуществом водной композиции по настоящему изобретению при использовании в качестве исходного вещества является по существу полное отсутствие наполнителя. Любые наполнители, добавляемые к данной композиции после диафильтрации в воде, могут быть точно вычислены, то есть ранее имевшиеся концентрации наполнителей не влияют на выполняемые вычисления. Примеры фармацевтически приемлемых наполнителей приведены в публикации Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1980), которая включена в настоящее описание изобретения в качестве ссылки. Таким образом, еще одним объектом настоящего изобретения является применение водной композиции, полученной способами по настоящему изобретению, для получения композиции, в частности фармацевтической композиции с известными концентрациями наполнителей, включая неионные наполнители или ионные наполнители. Одним объектом настоящего изобретения является дополнительная стадия, в соответствии с которой один или несколько наполнителей добавляют к водной композиции, включающей воду и белок. Таким образом, при помощи способов по настоящему изобретению получают водную композицию, по существу не содержащую наполнителей, которая может быть использована в качестве исходного вещества для получения композиций, включающих воду, белки и наполнители в определенных концентрациях.
В одном варианте осуществления изобретения способы по настоящему изобретению могут быть использованы для добавления к полученной композиции неионных наполнителей, например, сахаров или неионогенных поверхностно-активных веществ, таких как полисорбиты и полоксамеры, без изменения характеристик композиции, таких как концентрация белка, гидродинамический диаметр белка, проводимость и т.д.
Дополнительные характеристики и преимущества водных композиций, полученных вышеуказанными способами, описаны ниже в разделе III. Иллюстративные схемы выполнения способов по настоящему изобретению описаны также ниже в разделе ”Примеры”.
III. Композиции по настоящему изобретению
Настоящее изобретение относится к водной композиции, включающей белок и воду, которая обладает целым рядом преимуществ по сравнению с композициями, известными в данной области, включая устойчивость белка в воде без необходимости использования дополнительных наполнителей, повышенные концентрации белка без необходимости использования дополнительных наполнителей для сохранения растворимости белка и низкую осмоляльность. Композиции по настоящему изобретению обладают также преимущественными свойствами хранения, так как белки в указанной композиции остаются устойчивыми во время хранения, например, при хранении в жидком виде в течение более 3 месяцев при 7°С или в условиях замораживания/оттаивания, даже при высоких концентрациях белка и повторном замораживании/оттаивании. В одном варианте осуществления изобретения композиции по настоящему изобретению включают белки в высоких концентрациях при отсутствии значительной опалесценции, агрегации или преципитации.
В водной композиции по настоящему изобретению отсутствуют стандартные наполнители, например модификатор тоничности, стабилизатор, поверхностно-активное вещество, антиоксидант, криопротектор, объемный наполнитель, лиопротектор, основный компонент и кислотный компонент. В других вариантах осуществления изобретения композиция включает воду, один или несколько белков и не содержит ионные наполнители (например, соли, свободные аминокислоты).
В некоторых вариантах осуществления изобретения водная композиция по настоящему изобретению включает белок в концентрации, равной по меньшей мере 50 мг/мл, и воду, при этом осмоляльность композиции не превышает 30 мОсмоль/кг. Настоящее изобретение относится также к более низким пределам осмоляльности водной композиции. В одном варианте осуществления изобретения осмоляльность водной композиции не превышает 15 мОсмоль/кг. Водная композиция по настоящему изобретению может иметь осмоляльность меньше 30 мОсмоль/кг и при этом содержать белок в высокой концентрации, например, концентрация белка может быть равна по меньшей мерее 100 мг/мл и может достигать 200 мг/мл или выше. В объем настоящего изобретения входят промежуточные диапазоны вышеуказанных концентраций и осмоляльности. Кроме того, в объем настоящего изобретения также входят диапазоны значений, в которых использована комбинация любых вышеуказанных значений в качестве верхних и/или нижних пределов.
Концентрация водной композиции по настоящему изобретению не ограничивается размером белка, и данная композиция может включать белки в любом диапазоне размеров. В объем настоящего изобретения входит водная композиция, включающая по меньшей мере 50 мг/мл и до 200 мг/мл или больше белка, размер которого может находиться в диапазоне от 5 кДа до 150 кДа или больше. В одном варианте осуществления изобретения белок в композиции по настоящему изобретению имеет размер, равный по меньшей мере примерно 15 кДа, по меньшей мере примерно 20 кДа, по меньшей мере примерно 47 кДа, по меньшей мере примерно 60 кДа, по меньшей мере примерно 80 кДа, по меньшей мере примерно 100 кДа, по меньшей мере примерно 120 кДа, по меньшей мере примерно 140 кДа, по меньшей мере примерно 160 кДа или больше примерно 160 кДа. В объем настоящего изобретения входят промежуточные диапазоны вышеуказанных размеров. Кроме того, в объем настоящего изобретения также входят диапазоны значений, в которых использована комбинация любых вышеуказанных значений в качестве верхних и/или нижних пределов.
Водная композиция по настоящему изобретению может быть охарактеризована по гидродинамическому диаметру (Dh) белков в растворе. Гидродинамический диаметр белка в растворе может быть измерен методом динамического рассеяния света (DLS), который является известным аналитическим методом определения Dh белков. Типичные значения для моноклональных антител, например, IgG, равны примерно 10 нм. Низкоионные композиции, подобные рассмотренным в настоящем описании изобретения, могут иметь значительно более низкое значение Dh белков, чем белковые композиции, содержащие ионные наполнители. Установлено, что значения Dh антител в водных композициях, полученных методом DF/UF с использованием чистой воды в качестве обменной среды, значительно ниже Dh антител в стандартных композициях независимо от концентрации белка. В одном варианте осуществления изобретения антитела в водной композиции по настоящему изобретению имеет значение Dh менее 4 нм или менее 3 нм.
В одном варианте осуществления изобретения значение Dh белка в водной композиции меньше значения Dh такого же белка в буферном растворе независимо от концентрации белка. Таким образом, в некоторых вариантах осуществления изобретения белок в водной композиции, полученной способами по настоящему изобретению, имеет значение Dh, которое по меньшей мере на 25% меньше значения Dh белка в буферном растворе при такой же концентрации. Примеры буферных растворов включают, не ограничиваясь ими, физиологический раствор с фосфатным буфером (PBS). В некоторых вариантах осуществления изобретения белки в водной композиции по настоящему изобретению имеют значение Dh, которое по меньшей мере на 50% меньше значения Dh белка в PBS при данной концентрации; по меньшей мере на 60% меньше значения Dh белка в PBS при данной концентрации; по меньшей мере на 70% меньше значения Dh белка в PBS при данной концентрации или более чем на 70% меньше значения Dh белка в PBS при данной концентрации. В объем настоящего изобретения также входят промежуточные диапазоны вышеуказанных процентных значений, например, 55%, 56%, 57%, 64%, 68% и так далее. Кроме того, в объем настоящего изобретения входят также диапазоны значений, в которых использована комбинация любых вышеуказанных значений в качестве верхнего и/или нижнего пределов, например 50%-80%.
Агрегация белка является обычной проблемой в растворах белков и часто возникает вследствие повышенной концентрации белка. Настоящее изобретение относится к способу получения высококонцентрированной композиции с низкой агрегацией белка. Композиции по настоящему изобретению не нуждаются в буферной системе и наполнителях, включая поверхностно-активные вещества, для сохранения растворимости белка и отсутствия агрегации белка в композиции. Композиции по настоящему изобретению могут быть эффективно использованы для терапевтических целей, так как они имеют высокую концентрацию белка, получены на водной основе, не содержат других агентов для достижения высоких, устойчивых концентраций белков в растворе.
Большинство биологических продуктов (включая антитела) подвержено многочисленным процессам разрушения, которые часто возникают в результате неферментативных реакций в растворе. Указанные реакции могут оказывать продолжительное воздействие на устойчивость, безопасность и эффективность продукта. Неустойчивость препарата можно замедлить и даже устранить благодаря хранению продукта при температурах ниже нуля, что создает большое преимущество для производителя с точки зрения гибкости и доступности поставок на протяжении жизненного цикла продукта. Замораживание часто является наиболее безопасным и надежным методом хранения биологического продукта, хотя и создает определенный риск. Замораживание может вызывать стресс в белках в результате холодовой денатурации на поверхности раздела лед-жидкость и концентрирования замораживанием (криоконцентрирование) растворенных веществ при кристаллизации воды.
Криоконцентрирование представляет собой процесс, в соответствии с которым во время замораживания возникает плоский, неконтролируемо движущийся ледяной фронт, исключающий молекулы растворенного вещества (мелкие молекулы, такие как сахароза, соль и другие наполнители, обычно используемые в белковой композиции, или макромолекулы, такие как белки), который вызывает образование зон, где белки могут находиться в относительно высокой концентрации в присутствии других растворенных веществ в концентрациях, которые могут потенциально вести к высоким локальным значениям рН или концентрации ионов. Для большинства белков указанные условия могут вызывать денатурацию и в некоторых случаях преципитацию белка и растворенного вещества. Так как буферные соли и другие растворенные вещества также концентрируются в таких условиях, указанные компоненты могут достигать достаточно высоких концентраций, изменяющих рН и/или параметры окисления-восстановления в разных зонах внутри замороженной массы. Сдвиги рН, наблюдаемые вследствие кристаллизации буферных солей (например, фосфатов) в растворах во время замораживания, могут увеличить значение рН на несколько единиц, что может повлиять на устойчивость белка.
Концентрированные растворенные вещества могут также понизить температуру замерзания до величины, при которой растворенные вещества вообще не могут быть заморожены, и белки будут существовать в растворе в указанных вредных условиях. Часто прибегают к быстрому охлаждению, чтобы уменьшить время пребывания белка в таких нежелательных условиях. Однако быстрое замораживание может вызывать образование большой поверхности раздела лед-вода, в то время как медленное охлаждение вызывает образование меньшей площади поверхности раздела. Например, было установлено, что быстрое охлаждение шести экспериментальных белков во время одного цикла замораживания/оттаивания обнаруживает эффект денатурации в большей степени, чем 10 циклов медленного охлаждения, демонстрируя большой дестабилизирующий потенциал денатурации, вызываемой гидрофобной поверхностью льда.
Водная композиция по настоящему изобретению характеризуется благоприятными свойствами устойчивости и хранения. Устойчивость водной композиции не зависит от формы хранения и включает, не ограничиваясь ими, замороженные, лиофилизованные или высушенные распылением композиции. Устойчивость можно измерить при выбранной температуре в течение выбранного периода времени. В соответствии с одним объектом изобретения белок в водных композициях является устойчивым в жидком виде в течение по меньшей мере 3 месяцев, по меньшей мере 4 месяцев, по меньшей мере 5 месяцев, по меньшей мере 6 месяцев, по меньшей мере 12 месяцев. В объем настоящего изобретения также входят промежуточные значения вышеуказанных периодов времени, например, 9 месяцев и так далее. Кроме того, в объем настоящего изобретения также входят диапазоны значений, в которых использована комбинация любых вышеуказанных значений в качестве верхнего и/или нижнего пределов. Композиция предпочтительно является устойчивой при комнатной температуре (около 30°С) или при 40°С в течение по меньшей мере 1 месяца и/или при температуре около 2-8°С в течение по меньшей мере 1 года или более предпочтительно устойчивым при температуре около 2-8°С в течение по меньшей мере 2 лет. Кроме того, композиция предпочтительно является устойчивой после замораживания (например, до -80°С) и оттаивания, определяемого как ”цикл замораживания/оттаивания”.
Устойчивость белка можно также определить в виде способности сохранять биологическую активность. Белок ”сохраняет биологическую активность” в фармацевтической композиции, если остается биологически активным после введения субъекту. Например, считается, что антитело сохраняет биологическую активность, если значение биологической активности антитела в фармацевтической композиции равно примерно 30%, примерно 20% или примерно 10% (в пределах допустимых ошибок анализа) биологической активности во время получения фармацевтической композиции (например, при определении с помощью анализа связывания антигена).
Устойчивость белка в водной композиции можно также определить в виде процентного содержания мономера, агрегата, фрагмента белка или их комбинаций в композиции. Белок ”сохраняет физическую стойкость” в композиции, если у него отсутствуют признаки агрегации, преципитации и/или денатурации при визуальном исследовании цвета и/или прозрачности, при измерении методом рассеяния ультрафиолетового света или вытеснительной хроматографии. В соответствии с одним объектом изобретения устойчивый водная композиция является композицией, содержащей менее примерно 10% и предпочтительно менее примерно 5% белка в виде агрегата.
Другим отличительным признаком водной композиции по настоящему изобретению является то, что в некоторых случаях диафильтрация белка с использованием воды позволяет получить водную композицию, обладающую лучшими характеристиками вязкости по сравнению с первым раствором белка (то есть вязкость диафильтрованного раствора белка уменьшается по сравнению с первым раствором белка). Специалисту в данной области должно быть известно, что в разных вариантах осуществления изобретения могут быть использованы многие методы измерения вязкости в процессе получения композиций. Например, данные кинетической вязкости (сСт) могут быть получены при помощи капилляров. В других вариантах осуществления изобретения данные динамической вязкости получают отдельно или вместе с другими данными вязкости. Данные динамической вязкости могут быть получены в результате умножения данных кинетической вязкости на плотность.
Один вариант осуществления изобретения относится к способу регулирования определенных характеристик, таких как осмоляльность и/или вязкость, в водных растворах с высокой концентрацией белка путем добавления неионных наполнителей, таких как маннит, без изменения других требуемых свойств, таких как отсутствие опалесценции. Таким образом, в объем настоящего изобретения входят композиции, полученные на водной основе с высокими концентрациями белка, в которые во время или после переноса белка в воду или во время диафильтрации добавляют наполнители, которые улучшают, например, осмоляльность или вязкость композиции. Таким образом, в объем настоящего изобретения входит также добавление неионных наполнителей во время переноса белка в конечную низкоионную композицию. Примеры неионизируемых наполнителей, которые могут быть добавлены в водную композицию по настоящему изобретению для изменения требуемых характеристик композиции, включают, не ограничиваясь ими, маннит, сорбит, неионогенное поверхностно-активное вещество (например, полисорбат 20, полисорбат 40, полисорбат 60 или полисорбат 80), сахарозу, трегалозу, раффинозу и мальтозу.
Композиция по настоящему изобретению может также содержать несколько белков. В фармацевтические композиции при необходимости может быть добавлен другой дополнительный белок, необходимый для лечения конкретного заболевания, предпочтительно обладающий дополнительной активностью, который не оказывает вредного влияния на первый белок. Например, может быть желательно включить в одну композицию два или более белков, которые связываются с TNF или IL-12. Кроме того, в одной композиции могут быть объединены антитела против TNF или IL-12. Такие белки присутствуют в комбинации в количествах, обеспечивающих эффективное достижение поставленной цели.
Примеры белков, которые могут входить в водную композицию, включают антитела или их антиогенсвязывающие фрагменты. Примеры антител или их антигенсвязывающих фрагментов разных типов, которые могут быть использованы в настоящем изобретении, включают, не ограничиваясь ими, химерное антитело, человеческое антитело, гуманизированное антитело и домен-специфическое антитело (dAb). В одном варианте осуществления изобретения антитело, используемое в составах по настоящему изобретению и способах их получения, является антителом против TNFα или его антигенсвязывающим фрагментом, антителом против IL-12 или его антигенсвязывающим фрагментом. Дополнительные примеры антитела или его антигенсвязывающего фрагмента, которые могут быть использованы в настоящем изобретении, включают, не ограничиваясь ими, 1D4.7 (антитело против IL-12/IL-23; Abbott Laboratories), 2.5(E)mg1 (антитело против IL-18; Abbott Laboratories), 13C5.5 (антитело против IL-13; Abbott Laboratories), J695 (антитело против IL-12; Abbott Laboratories), афелимомаб (Fab2-фрагмент антитела против TNF; Abbott Laboratories), гумира (адалимумаб (D2E7); Abbott Laboratories), кампат (алемтузумаб), арцитумомаб СЕА-Scan (Fab-фрагмент), эрбитукс (цетуксимаб), герцептин (трастузумаб), миосцинт (пентета имцикомаба), простасцинт (пендетид капромаба), ремикад (инфликсимаб), ReoPro (абциксимаб), ритуксан (ритуксимаб), симулект (басиликсимаб), синагис (паливизумаб), верлума (нофетумомаб), ксолаир (омализумаб), зенапакс (даклизумаб), зевалин (ибритумомаб тиуксетан), ортоклон ОКТ3 (муромонаб-CD3), панорекс (эдреколомаб), милотарк (гемтузумаб озогамицин), голимумаб (центокор), цимзиа (цертолизумаб пегол), солирис (экулизумаб), CNTO 1275 (устекинумаб), вектибикс (панитумумаб), бекссар (тозитумомаб и I131-меченный тозитумомаб) и авастин (бевацизумаб).
Альтернативно белок является терапевтическим белком, который включает, не ограничиваясь ими, пульмозим (дорназа альфа), регранекс (бекаплермин), активаза (алтеплаза), алдуразим (ларонидаза), амевив (алефацепт), аранесп (дарбепоэтин альфа), концентрат бекаплермина, бетасерон (интерферон бета-1b), БОТОКС (токсин ботулина типа А), элитек (расбуриказа), элспар (аспарагиназа), эпоген (эпоэтин альфа), энбрел (этанерцепт), фабразим (агалсидаза бета), инферген (интерферон альфакон-1), интрон А (интерферон альфа-2а), кинерет (анакинра), МИОБЛОК (токсин ботулина типа В), нейласта (пэгфилграстим), неймега (опрелвекин), нейпоген (филграстим), онтак (денилейкин дифтитокс), ПЕГАСИС (пэгинтерферон альфа-2а), пролейкин (альдеслейкин), пульмозим (дорназа альфа), ребиф (интерферон бета-1а), регранекс (бекаплермин), ретаваза (ретеплаза), роферон-А (интерферон альфа-2), ТНКаза (тенектеплаза), ксигрис (дротрекогин альфа), аркалист (рилонацепт), NPlate (ромиплостим), мирцера (метоксиполиэтиленгликоль-эпоэтин бета), цинриза (ингибитор С1-эстеразы), элапраза (идурсульфаза), миозим (альглюкозидаза альфа), оренциа (абатацепт), наглазим (галсульфаза), кепиванс (палифермин) и актиммун (интерферон гамма-1b).
Другие примеры белков, которые могут быть использованы в составах по настоящему изобретению и способах их получения, включают белки млекопитающих, в частности рекомбинантные белки, такие как, например, гормон роста, в том числе гормон роста человека и гормон роста крупного рогатого скота; фактор, стимулирующий выделение гормона роста, паращитовидный гормон, тиреостимулирующий гормон, липопротеины, α-1-антитрипсин, А-цепь инсулина, В-цепь инсулина, проинсулин, фолликулостимулирующий гормон, кальцитонин, лютеинизирующий гормон, глюкагон, факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевый фактор и фактор фон Виллебранда, факторы, препятствующие свертыванию крови, такие как белок С, натрийуретический фактор предсердия, поверхностно-активное вещество легкого, активатор плазминогена, такой как урокиназный или тканевый активатор плазминогена (t-PA), бомбазин, тромбин, энкефалиназа α- и β-факторов некроза ткани, RANTES (регулируемая активация нормально экспрессируемых и секретируемых Т-клеток), воспалительный белок макрофага человека (MIP-1-α), сывороточный альбумин, такой как сывороточный альбумин человека, муллериан-ингибирующее вещество, А-цепь релаксина, В-цепь релаксина, прорелаксин, гонадотропин-ассоциированный пептид мыши, ДНКаза, ингибин, активин, эндотелиальный фактор роста сосудов (VEGF), рецепторы гормонов или факторов роста, интегрин, белок А или D, ревматоидные факторы, нейротрофический фактор, такой как костный нейротрофический фактор (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6), фактор роста нервов, такой как NGF-β, тромбоцитарный фактор роста (PDGF), фактор роста фибробластов, такой как aFGF и bFGF, эпидермальный фактор роста (EGF), трансформирующий фактор роста (TGF), такой как TGFα и TGF-β, включающий TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5, инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II), дес(1-3)-IGF-I (IGF-I головного мозга), связывающие белки инсулиноподобного фактора роста, CD белки, такие как CD3, CD4, CD8, CD19 и CD20, эритропоэтин (ЕРО), тромбопоэтин (ТРО), остеоиндуктивные факторы, иммунотоксины, костный морфогенный белок (ВМР), инртерферон, такой как интерферон-α, -β и -γ, колониестимулирующие факторы (CSF), например, М-CSF, GM-CSF и G-CSF, интерлейкины (IL), например, IL-1-IL-10, пероксид-дисмутаза, Т-клеточные рецепторы, белки поверхностной мембраны, фактор распада (DAF), вирусный антиген, такой как, например, часть оболочки вируса СПИДа, транспортные белки, ”хоминг”-рецепторы, аддрессины, регуляторные белки, иммуноадгезины, антитела и биологически активные фрагменты или варианты любых вышеуказанных полипептидов.
IV. Применения изобретения
Композиции по настоящему изобретению могут быть использованы в качестве терапевтических средств, то есть in vivo, или в качестве реагентов для исследований in vitro или in situ.
Терапевтические применения
Способы по настоящему изобретению могут быть также использованы для получения композиции на водной основе, обладающей благоприятными характеристиками для терапевтического применения. Водная композиция может быть использована в качестве фармацевтической композиции для лечения нарушения у субъекта.
Композиция по настоящему изобретению может быть использована для лечения любого нарушения, лечение которого возможно с помощью терапевтического белка. Термин ”нарушение” означает любое состояние, на которое может оказать благоприятное воздействие лечение белком. Такое нарушение включает хронические и острые нарушения или заболевания, в том числе такие патологические состояния, которые вызывают предрасположенность млекопитающего в указанному нарушению. В случае антитела против TNFα терапевтически эффективное количество антитела можно вводить для лечения аутоиммунного заболевания, такого как ревматоидный артрит, кишечного нарушения, такого как болезнь Крона, спондилоартропатии, такой как анкилозирующий спондилоартрит, или кожного нарушения, такого как псориаз. В случае антитела против IL-12 терапевтически эффективное количество антитела можно вводить для лечения нейрологического нарушения, такого как рассеянный склероз, или кожного нарушения, такого как псориаз. Другие примеры нарушений, при лечении которых может быть использована композиция по настоящему изобретению, включают рак, в том числе рак молочной железы, лейкоз, лимфому и рак ободочной кишки.
Термин ”субъект” означает живые организмы, например, прокариотические и эукариотические организмы. Примеры субъектов включают млекопитающих, например, человека, собак, коров, лошадей, поросят, овец, коз, кошек, мышей, кроликов, крыс и трансгенных животных, отличных от человека. В конкретных вариантах осуществления изобретения субъектом является человек.
Термин ”лечение” означает как терапевтическое лечение, так и профилактические или предупредительные меры. Субъекты, нуждающиеся в лечении, включают субъектов, уже имеющих нарушение, а также субъектов, у которых необходимо предупредить возникновение нарушения.
Водную композицию можно вводить млекопитающему, включая человека, нуждающемуся в лечении, в соответствии с известными способами введения. Примеры способов введения включают внутривенное введение, такое как инъекция ударной дозы или вливание в течение определенного периода времени, внутримышечное, внутрибрюшинное, интрацереброспинальное, подкожное, внутрисуставное, интратекальное, внутрикожное, чрескожное, пероральное, местное введение или введение ингаляцией.
В одном варианте осуществления изобретения водную композицию вводят млекопитающему подкожно. При таком способе введения композиция может быть инъецирована с помощью шприца, а также других устройств, включая инъекционные устройства (например, устройства Inject-ease и Genject), устройства по типу ”писчего пера” (такие как GenPen), безыгольные устройства (например, MediJector и Biojectorr 2000) и системы подкожной доставки в виде пластыря. В одном варианте осуществления изобретения устройство, например, шприц, автоинъектор по типу ”писчего пера”, содержит иглу с диаметром от 25 G или меньше. В одном варианте осуществления изобретения игла имеет диаметр от 25 G до 33 G (включая промежуточные диапазоны, например, 25 cG, 26 G, 26 cG, 27 G, 28 G, 29 G, 30 G, 31 G, 32 G и 33 G). В предпочтительном варианте осуществления изобретения наименьший диаметр и соответствующую длину иглы выбирают в соответствии с характеристиками вязкости композиции и устройства, используемого для доставки композиции по настоящему изобретению.
Одним преимуществом составов по настоящему изобретению и способов их получения является то, что белок находится в растворе в больших концентрациях, идеально пригодных для введения белка субъекту с помощью безыгольного устройства. Такое устройство позволяет диспергировать белок сквозь ткань субъекта без необходимости инъекции, выполняемой иглой. Примеры безыгольных устройств включают, не ограничиваясь ими, Biojectorr 1000 (Bioject Medical Technologies), Cool. Click (Bioject Medical Technologies), Iject (Bioject Medical Technologies), Vitajet 3 (Biojet Medical Technologies), Mhi500 (The Medical House PLC), Injex 30 (INJEX - Equidyne Systems), Injex 50 (INJEX - Equidyne Systems), Injex 100 (INJEX - Equidyne Systems), безыгольный шприц (INJEX - Equidyne Systems), безыгольный инъектор (Becton-Dickenson), J-Tip (National Medical Devices, Inc.), Medi-Jector VISION (Antares Pharma), MED-JET (MIT Canada, Inc.), DermoJet (Akra Dermojet), Sonoprep (Sontra Medical Corp.), PenJet (PenJet Corp.), MicroPor (Altea Therapeutics), Zeneo (Crossject Medical Technology), Mini-Jet (Valeritas Inc.), ImplaJect (Caretek Medical LTD), Intraject (Aradigm) и Serojet (Biojet Medical Technologies).
В объем настоящего изобретения входят также устройства доставки, которые заполняются водной композицией. Примеры таких устройств включают, не ограничиваясь ими, шприц, устройство по типу ”писчего пера” (такое как автоинъектор по типу ”писчего пера”), имплант, ингалятор, безыгольное устройство и пластырь. Пример автоинъектора по типу ”писчего пера” приведен в заявке на патент США № 11/824516, поданной 29 июня 2007 г.
Настоящее изобретение относится также к способам доставки композиций по настоящему изобретению путем ингаляции и к ингаляторам, содержащим указанную композицию, которые предназначены для такой доставки. В одном варианте осуществления изобретения водную композицию вводят субъекту путем ингаляции с помощью распылителя или жидкостного ингалятора. В распылителях обычно использован сжатый воздух для доставки лекарственного средства в виде влажного аэрозоля или ингалируемого аэрозоля, поэтому необходимо, чтобы лекарственное средство растворялось в воде. Распылители разных типов включают струйные распылители (воздушные струйные распылители и жидкостные струйные распылители) и ультразвуковые распылители.
Примеры распылителей включают Akita™ (Activaero GmbH) (см. заявку на патент США № 2001037806, европейский патент № 1258264). Akita™ представляет собой настольную систему для ингаляции (масса: 7,5 кг, длина × ширина × высота: 260×170×270) на основе контроллера Pari's LC Star, который осуществляет полный контроль за дыханием субъекта. Данное устройство может доставлять до 500 мг лекарственного средства в растворе менее чем за 10 минут при очень высоких скоростях доставки в легкое и периферию легкого. 65% распыленных частиц имеют размер менее 5 микрон, и среднемассовый аэродинамический диаметр (MMAD) равен 3,8 микрона при давлении 1,8 бар. Минимальный заполняемый объем равен 2 мл, и максимальный объем равен 8 мл. Вдыхаемый поток (200 мл/сек) и давление распылителя (0,3-1,8 бар) задается смарт-картой. Данное устройство может быть индивидуально отрегулировано для каждого субъекта на основании измерения жизненной емкости легких.
Другой пример распылителя, который может быть использован для введения составов по настоящему изобретению, включает распылители Aeroneb® Go/Pro/Lab (AeroGen). Распылитель Aeroneb® создан на основе технологии OnQ™, то есть электронного микронасоса (с диаметром 0,9 см (3/8 дюйма) в виде пластины), состоящего из уникальной пластины с куполообразными отверстиями, которая имеет более 1000 точно выполненных суживающихся отверстий, окруженных вибрирующим элементом. Aeroneb® Go является портативным устройством для домашнего пользования, Aeroneb® Pro является стерилизуемым устройством многократного пользования, предназначенным для применения в больницах и амбулаториях, и Aeroneb® Lab является устройством для предклинических исследований аэрозоля и ингаляции. Отличительные особенности указанных систем включают оптимизацию и регулирование размера капель аэрозоля, медленную доставку аэрозоля с точно контролируемым размером капель, обеспечение направленной доставки лекарственного средства в дыхательную систему, гибкость дозирования, возможность использования стандартной ампулы с однократной дозой, содержащей определенный объем лекарственного средства в растворе или суспензии, или промышленно выпускаемых растворов, предназначенных для распылителей общего назначения, непрерывный, активируемый дыханием или программируемый режим работы, адаптацию к потребностям широкого круга субъектов, включая детей и пожилых людей, применение одним или несколькими субъектами.
Для введения композиций по настоящему изобретению может быть также использован распылитель Aerocurrent™ (AerovertRx Corp.) (см. публикацию WO 2006006963). Указанный распылитель является портативным распылителем с вибрирующим ситом, в который вставляется одноразовый, предварительно заполненный или заполняемый пользователем картридж с лекарственным средством.
Для введения композиций по настоящему изобретению может быть также использован распылитель Staccato™ (Alexza Pharma) (см. публикацию WO 03095012). Главной особенностью распылителя Staccato™ является выпаривание лекарственного средства без теплового разрушения, которое достигается в результате быстрого нагревания тонкой пленки лекарственного средства. Менее чем за полсекунды лекарственное средство нагревается до температуры, достаточной для превращения пленки твердого лекарственного средства в пар. Ингалятор состоит из трех основных компонентов: нагревающей подложки, тонкой пленки лекарственного средства, нанесенной на подложку, и воздуховода, через который происходит ингаляция субъекта. Ингалятор приводится в действие дыханием, при этом максимальная доставляемая доза равна 20-25 мг и MMAD равен 1-2 микронам.
Для введения композиций по настоящему изобретению может быть также использован распылитель AERx® (Aradigm) (см. публикацию WO 9848873, патенты США №№ 5469750, 5509404, 5522385, 5694919, 5735263, 5855564). Распылитель AERx® является ручным устройством, действующим от батареи, в котором использован поршневой механизм для выбрасывания композиции. Данное устройство контролирует поток вдыхаемого воздуха и выбрасывает лекарственное средство только при достижении оптимального характера дыхания. Указанное устройство может доставлять примерно 60% выбрасываемой дозы при введении 50-70% выбрасываемой дозы глубоко в легкие при <25% расхождении у разных субъектов.
Другой пример распылителя, который может быть использован для введения составов по настоящему изобретению, включает распылитель Respimat® (Boehringer). Распылитель Respimat® представляет собой систему с резервуаром на несколько доз, которая приводится в действие при поворачивании основания устройства, сжимаемого пружиной, и переносит отмеренный объем композиции из картриджа для лекарственного средства в дозирующую камеру. Во время действия данного устройства пружина высвобождается, воздействует на микропоршень в дозирующей камере и выталкивает раствор через моноблок; моноблок состоит из фильтра с двумя тонкими каналами выходного сопла. MMAD частиц, образуемых распылителем Respimat®, равен 2 мкм, и данное устройство пригодно для доставки низких доз лекарственных средств, традиционно используемых для лечения респираторных нарушений.
Составы по настоящему изобретению могут быть также доставлены при помощи распылителя Collegium™ (Collegium Pharma), который представляет собой распылительную систему, в которой лекарственное средство осаждено на мембране. Лекарственная форма вводится субъекту путем пероральной или назальной ингаляции после восстановления восстанавливающим растворителем.
Другой пример распылителя, который может быть также использован для введения составов по настоящему изобретению, включает распылитель Inspiration® 626 (Respironics). Распылитель 626 является компрессорным распылителем, предназначенным для домашнего применения. Распылитель 626 доставляет частицы размером от 0,5 до 5 микрон.
Распылители, которые могут быть использованы для введения составов по настоящему изобретению, могут включать технологию адаптивной доставки аэрозоля (Adaptive Aerosol Delivery®, Respironics), которая позволяет доставлять точные и воспроизводимые дозы ингалируемого лекарственного средства субъектам независимо от возраста, массы тела и различий в характере дыхания таких субъектов. Системы AAD® включают электронные и сенсорные элементы в ручном аппарате, контролирующие характер дыхания субъекта путем обнаружения изменений давления во время вдоха и выдоха. Сенсорные элементы определяют момент включения доставки аэрозоля лекарственного средства во время первой части вдоха. Во время процедуры сенсорные элементы контролируют три предшествующих дыхания и адаптируют устройство к характеру вдоха и выдоха субъекта. Поскольку системы AAD® доставляют лекарственное средство только тогда, когда субъект дышит через рот, указанные устройства позволяют субъекту вдыхать лекарственное средство без его потери. Примеры распылителей системы AAD® включают HaloLite® AAD®, ProDose® AAD® и I-Neb® AAD®.
Система адаптивной доставки аэрозоля (AAD)® (Respironics) HaloLite® представляет собой пневматическую систему аэрозолизации, приводимую в действие портативным компрессором. Система AAD® контролирует характер дыхания субъекта (обычно каждые десять миллисекунд), и в зависимости от используемой системы или осуществляет подачу аэрозолированного лекарственного средства в конкретные ингалируемые отделы, или вычисляет дозу, выделенную во время ингаляции из ”стоящего аэрозольного облака” (см. европейский патент № 0910421, включенный в настоящее описание изобретения в качестве ссылки).
ProDos AAD® (Respironics) представляет собой распыляющую систему, контролируемую системой ProDose Disc™ (Respironics). ProDose AAD® является пневматической аэрозольной системой, приводимой в действие портативным компрессором, в котором доставляемая доза контролируется содержащим микрочип диском, вставленным в систему таким образом, что наряду с другими вещами инструктирует систему о доставляемой дозе. ProDose Disc™ является пластиковым диском, содержащим микрочип, который вставлен в систему ProDose AAD® и инструктирует ее о доставляемой дозе, количестве доз, которое может быть доставлено, вместе с разными управляющими данными, включающими код партии лекарственного средства и дату истечения срока годности (см. европейский патент № 1245244, который включен в настоящее описание изобретения в качестве ссылки). Промиксин® может быть доставлен при помощи системы Prodose AAD® для лечения легочных инфекций, вызванных Pseudomonas aeruginosa, в частности, муковисцидоза. Промиксин® поставляется в виде распыляемого порошка, который восстанавливается непосредственно перед использованием.
I-neb AAD® представляет собой ручную систему AAD®, которая доставляет точные и воспроизводимые дозы лекарственного средства в соответствии с характером дыхания субъектов без необходимости использования отдельного компрессора (”I-Neb”). I-Neb AAD® является миниатюрным ингалятором AAD®, созданным на основе комбинации технологии аэрозолизации с электронным ситом (Omron) и технологии AAD® для контроля дозирования в соответствии с характером дыхания субъектов. Указанная система имеет размер, примерно соответствующий мобильному телефону, и весит менее 227 г (8 унций). I-Neb AAD® был использован для доставки вентависа® (илопрост) (CoTherix/Schering AG).
Еще одним примером распылителя, который может быть использован для введения составов по настоящему изобретению, является Aria™ (Chrysalis). Распылитель Aria представляет собой капиллярную систему образования аэрозоля. Аэрозоль образуется в результате прокачивания лекарственной композиции через мелкий, электрически нагреваемый капилляр. При выходе из капилляра композиция быстро охлаждается окружающим воздухом, образуя аэрозоль с MMAD в диапазоне 0,5-2,0 мкм.
Кроме того, для доставки состава по настоящему изобретению может быть использован распылитель TouchSpray™ (Odem). Распылитель TouchSpray™ представляет собой ручное устройство, в котором использована перфорированная мембрана, вибрирующая при ультразвуковых частотах, которая контактирует с жидкостью в резервуаре с образованием аэрозольного облака. Вибрирующее действие выбрасывает струи жидкости через отверстия в мембране, разбивающие струи на облако лекарственного средства. Размер капель контролируется формой/размером отверстий, а также химической структурой поверхности и составом раствора лекарственного средства. Как указано, данное устройство доставляет 83% отмеренной дозы глубоко в легкое. Подробное описание конструкции распылителя TouchSpray™ приведено в патенте США № 6659364, который включен в настоящее описание изобретения в качестве ссылки.
Дополнительные распылители, которые могут быть использованы для введения составов по настоящему изобретению, включают распылители, которые являются портативными устройствами и обеспечивают максимальный выход аэрозоля во время вдоха субъекта и минимизируют выход аэрозоля во время выдоха субъекта при помощи двух односторонних клапанов (см. распылители PARI (PARI GmbH). Дефлекторы обеспечивают выход из распылителя частиц оптимального размера. В результате этого образуется высокий процент частиц в пригодном для вдыхания диапазоне. Такие распылители могут быть сконструированы для конкретных категорий субъектов, например, для субъектов младше трех лет (PARI BABY™) и для пожилых людей (PARI LC PLUS® и PARI LC STAR®).
Еще одним распылителем, который может быть использован для введения составов по настоящему изобретению, является распылитель e-Flow® (PARI GmbH), в котором использована вибрирующая мембрана для аэрозолизации раствора лекарственного средства, а также суспензий или коллоидных дисперсий (TouchSpray™; ODEM (United Kingdom)). Распылитель e-Flow® способен подавать жидкость в объеме от 0,5 мл до 5 мл и может образовывать аэрозоли с очень высокой плотностью активного лекарственного средства с точно определенным размером капель и высокой пропорцией пригодных для вдыхания капель, доставляемых в течение самого короткого возможного периода времени. При помощи распылителя e-Flow® можно доставлять такие лекарственные средства как азтреонам и лидокаин. Конструкция распылителя e-Flow® описана в патенте США № 6962151, который включен в настоящее описание изобретения в качестве ссылки.
Дополнительные распылители, которые могут быть использованы для введения составов по настоящему изобретению, включают электронный распылитель Microair® (Omron) и распылитель Mystic™ (Ventaira). В распылителе Microair®, который имеет очень маленький размер, использована технология вибрирующего сита для эффективной доставки растворов лекарственных средств. Устройство Microair имеет емкость, равную 7 мл, и образует частицы лекарственного средства с MMAD около 5 микрон. Более подробно с распылителем Microair® можно ознакомиться в публикации патента США № 2004045547, который включен в настоящее описание изобретения в качестве ссылки. В распылителе Mystic™ использовано сильное электрическое поле для разбивания жидкости на струя почти монодисперсных, заряженных частиц. Система Mystic™ включает резервуар, дозирующую систему, сопла, образующие аэрозоль, и конверторы напряжения, которые вместе обеспечивают доставку многократных доз или однократной дозы. Устройство Mystic™ активируется дыханием и используется для доставки таких лекарственных средств, как корус 1030™ (гидрохлорид лидокаина), ресмицин® (гидрохлорид доксорубицина), акуаир (пропионат флутиказона), NCE компании ViroPharm и NCE компании Pfizer. Более подробно с распылителем Mystic™ можно ознакомиться в патенте США № 6397838, который включен в настоящее описание изобретения в качестве ссылки.
Дополнительные способы доставки композиции по настоящему изобретению в легкие описаны в заявке на патент США № 12/217972, которая включена в настоящее описание изобретения в качестве ссылки.
Соответствующая доза (”терапевтически эффективное количество”) белка будет зависеть от состояния, подлежащего лечению, тяжести нарушения, введения белка в профилактических или терапевтических целях, ранее проводившегося лечения, клинической истории субъекта и реакции на данный белок, типа используемого белка и решения лечащего врача. Белок вводят субъекту один раз или в виде серии введений в любое время после постановки диагноза. Белок может быть введен отдельно или в комбинации с другими лекарственными средствами или методами лечения, пригодными для лечения данного состояния.
Композиции по настоящему изобретению позволяют преодолеть обычную проблему агрегации белков, часто связанную с высокими концентрациями белка, и поэтому представляют собой новый способ введения субъекту терапевтического белка в высокой концентрации. Достоинством высококонцентрированной композиции по настоящему изобретению является возможность введения субъекту большей дозы в объеме, который равен или меньше, чем у композиции, предназначенной для стандартного лечения. Стандартное лечение терапевтическим белком описано на этикетке, предоставляемой производителем белка. Например, в соответствии с информацией на этикетке, предоставленной производителем, инфликсимаб вводят для лечения ревматоидного артрита путем восстановления лиофилизованного белка до концентрации 10 мг/мл. Композиция по настоящему изобретению может содержать инфликсимаб в высокой концентрации, которая выше стандартной концентрации, равной 10 мг/мл. В другом примере в соответствии с этикеткой, предоставленной производителем, ксолаир (омализумаб) вводят для лечения астмы, восстанавливая лиофилизованный белок до концентрации 125 мг/мл. В данном случае высококонцентрированная композиция по настоящему изобретению содержит антитело омализумаб в концентрации, которая выше стандартной концентрации, равной 125 мг/мл.
Таким образом, в одном варианте осуществления изобретения композиция по настоящему изобретению имеет высокую концентрацию, которая по меньшей мере примерно на 10%, по меньшей мере примерно на 20%, по меньшей мере примерно на 30%, по меньшей мере примерно на 40%, по меньшей мере примерно на 50%, по меньшей мере примерно на 60%, по меньшей мере примерно на 70%, по меньшей мере примерно на 80%, по меньшей мере примерно на 90%, по меньшей мере примерно на 100%, по меньшей мере примерно на 110%, по меньшей мере примерно на 120%, по меньшей мере примерно на 130%, по меньшей мере примерно на 140%, по меньшей мере примерно на 150%, по меньшей мере примерно на 175%, по меньшей мере примерно на 200%, по меньшей мере примерно на 225%, по меньшей мере примерно на 250%, по меньшей мере примерно на 275%, по меньшей мере примерно на 300%, по меньшей мере примерно на 325%, по меньшей мере примерно на 350%, по меньшей мере примерно на 375%, по меньшей мере примерно на 400% и так далее больше концентрации терапевтического белка в известной стандартной композиции.
В другом варианте осуществления изобретения композиция по настоящему изобретению имеет высокую концентрацию, которая по меньшей мере примерно в 2 раза больше, по меньшей мере примерно в 3 раза больше, по меньшей мере примерно в 4 раза больше, по меньшей мере примерно в 5 раза больше, по меньшей мере примерно в 6 раза больше, по меньшей мере примерно в 7 раза больше, по меньшей мере примерно в 8 раза больше, по меньшей мере примерно в 9 раза больше, по меньшей мере примерно в 10 раза больше и так далее концентрации терапевтического белка в известной стандартной композиции.
Характеристики водной композиции, предназначенной для терапевтического применения, могут быть улучшены. Например, вязкость композиции, содержащей антитело, может быть улучшена в результате диафильтрации раствора белка антитела с использованием воды без наполнителей в качестве диафильтрующей среды. Как было описано выше в разделе II, наполнители, например, улучшающие вязкость, могут быть добавлены в водную композицию при известной конечной концентрации наполнителя, что позволяет улучшить специальные свойства композиции для конкретного применения. Например, специалисту в данной области должно быть известно, что требуемая вязкость фармацевтической композиции зависит от способа доставки композиции, такого как, например, инъекция, ингаляция, всасывание через кожу и так далее. Требуемая вязкость часто уравновешивает удобство введения композиции субъекту и дозу белка в композиции, необходимую для оказания терапевтического воздействия. Например, общепринятые уровни вязкости для инъецируемых композиций составляют менее примерно 100 мПа*с, предпочтительно менее 75 мПа*с, еще предпочтительнее менее 50 мПа*с. Таким образом, вязкость водной композиции может быть приемлемой для терапевтического применения или может потребовать добавления наполнителей для улучшения требуемой характеристики.
Один вариант осуществления изобретения относится к водной композиции, включающей воду и антитело против TNFα человека или его антигенсвязывающую часть, которая не содержит наполнителей, имеет вязкость, которая делает ее предпочтительной для использования в качестве терапевтического средства, например, низкую вязкость менее 40 спз при 8°С и менее 25 спз при 25°С, при концентрации белка, равной примерно 175 мг/ил. В одном варианте осуществления изобретения концентрация антитела или его антигенсвязывающей части в композиции с лучшей вязкостью равна по меньшей мере примерно 50 мг/мл. В одном варианте осуществления изобретения композиция по настоящему изобретению имеет вязкость в пределах от около 1 до около 2 мПа*с.
Нетерапевтические применения
Водная композиция по настоящему изобретению может быть также использована для нетерапевтических целей, то есть для исследований in vitro.
Водные композиции по настоящему изобретению могут быть использованы для диагностики или экспериментальных исследований в медицине и биотехнологии, включая, не ограничиваясь ими, применение в геномике, протеомике, биоинформатике, исследовании культур клеток, биологии растений и биологии клеток. Например, водные композиции по настоящему изобретению могут быть использованы для получения белков, применяемых в качестве молекулярного зонда в методах мечения и обнаружения. Дополнительным применением композиций по настоящему изобретению является получение добавок для реагентов, используемых в культурах клеток, включая выращивание клеток и продуцирование белка в производственных целях.
Водные композиции по настоящему изобретению могут быть использованы при исследовании взаимодействия наполнителя в композиции с экспериментальной средой, например, противодействия другому реагенту, используемому в данном исследовании. В другом примере водные композиции, содержащие белки в высоких концентрациях, могут быть использованы в качестве реагента для лабораторных исследований. Такие высококонцентрированные формы белка должны расширить существующие в настоящее время границы лабораторных экспериментов.
Другим альтернативным применением композиции по настоящему изобретению является создание добавок для пищевых продуктов. Так как водная композиция по настоящему изобретению состоит в основном из воды и белка, такая композиция может быть использована для введения требуемого белка в высоких концентрациях, например, в виде пищевой добавки, в продукты питания. Водная композиция по настоящему изобретению содержит белок в высокой концентрации в воде без добавок, необходимых для достижения устойчивости/растворимости, которые могут быть неприемлемы для потребления человеком. Например, сывороточные и соевые белки позволяют разнообразить продукты, так как указанные белки обладают способностью имитировать вкус и текстуру жира. Поэтому сывороточные и соевые белки могут быть добавлены в продукты для уменьшения общего содержания жиров без ухудшения вкуса продуктов. Таким образом, может быть получена водная композиция, включающая приемлемые количества сывороточных и соевых белков, и использована в качестве добавки к пищевым продуктам.
Изделия
Другой вариант осуществления изобретения относится к получению изделия, содержащего водную композицию по настоящему изобретению и инструкции по ее применению. Данное изделие включает контейнер. Приемлемыми контейнерами являются, например, бутылки, ампулы (например, двухкамерные ампулы), шприцы (например, двухкамерные шприцы), автоинъектор по типу ”писчего пера”, содержащий шприц, и пробирки. Контейнер может быть изготовлен из разных материалов, таких как стекло, пластик или поликарбонат. Контейнер, содержащий водную композицию, может иметь этикетку с инструкциями по применению. Например, на этикетке может быть указано, что данная композиция предназначена для подкожного введения. Контейнер, содержащий композицию, может представлять собой ампулу для многократного применения, позволяющую повторно вводить (например, производить 2-6 введений) водную композицию. Изделие может далее включать второй контейнер. Изделие может далее содержать другие вещества, желательные с коммерческой и потребительской точки зрения, которые включают буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковку с инструкциями по применению.
Содержание всех материалов, патентов и опубликованных заявок на патенты, приведенные в настоящей заявке, включены в описание изобретения в качестве ссылки.
Настоящее изобретение далее иллюстрируют нижеследующие примеры, которые не ограничивают объем изобретения.
Примеры
В приведенных ниже примерах описаны эксперименты, относящиеся к водной композиции, включающей воду в качестве растворяющей среды. Следует отметить, что в некоторых случаях десятичные числа указаны в соответствии с европейской системой обозначения десятичных чисел. Например, в таблице 31 число ”0,296” аналогично числу ”0.296”.
Пример 1
Диафильтрация/ультрафильтрация с использованием адалимумаба и антитела J695
Вещества и методы
Адалимумаб и антитело J695 подвергали диафильтрации с использованием чистой воды. После по меньшей мере 5-кратного объемного обмена с чистой водой растворы белка подвергали ультрафильтрации до достижения конечной концентрации, равной по меньшей мере 150 мг/мл. Во время обработки DF/UF контролировали состояние белка, измеряя осмоляльность, концентрацию белка (OD280) и производя визуальный осмотр.
При помощи вытеснительной хроматографии и ионообменной хроматографии исследовали устойчивость белка в каждом продукте, подвергнутом DF/UF, по сравнению с исходной композицией, например, исходным лекарственным веществом (DS), и эталонным белком. Лекарственное вещество или ”DS” является активным фармацевтическим ингредиентом и обычно служит для определения терапевтического белка в общем нерасфасованном растворе.
- Лекарственное вещество адалимумаб (коэффициент экстинкции адалимумаба при 280 нм: 1,39 мл/мг см). Лекарственное вещество не содержало полисорбат 80. Состав лекарственного вещества: 5,57 мМ одноосновного фосфата натрия, 8,69 мМ двухосновного фосфата натрия, 106,69 мМ хлорида натрия, 1,07 мМ цитрата натрия, 6,45 мМ лимонной кислоты, 66,68 мМ маннита.
- Раствор адалимумаба, использованный для измерений динамического рассеяния света (DLS): раствор адалимумаба, который был подвергнут диафильтрации с использованием чистой воды в качестве обменной среды, доводили до концентрации 1 мг/мл, разбавляя раствор адалимумаба водой Milli-Q и исходными растворами наполнителей (наполнители, растворенные в воде Milli-Q).
- Лекарственное вещество антитела J695 (коэффициент экстинкции антитела J695 при 280 нм: 1,42 мл/мг см). Состав лекарственного вещества: гистидин, метионин, маннит, рН 5,8 и полисорбат 80.
- Система фильтрации с тангенциальным потоком (TFF) Millipore Labscale™, оснащенная 500-мл резервуаром. Систему TFF Labscale использовали в периодическом режиме при комнатной температуре в соответствии с инструкциями по эксплуатации Millipore. Скорость мешалки была задана примерно равной 1,5, и скорость насоса была задана примерно равной 3. Давление на входе и выходе было соответственно равно примерно 15 фунтов/кв.дюйм и примерно 50 фунтов/кв.дюйм.
- Капсула для фильтрации с тангенциальным потоком Minimate™, оснащенная мембраной PES Omega™ с отсечением молекулярной массы 30 кДа. Капсулу промывали в течение 30 минут 0,1 н. раствором NaOH и в течение еще 30 минут водой Milli-Q.
- Измеритель рН 780, Metrohm, оснащенный зондом для измерения рН Pt1000, № 6.0258.010, и калиброванный буферными калибровочными растворами VWR, красный буферный раствор с рН 4,00, № по каталогу 34170-127, желтый буферный раствор с рН 7,00, № по каталогу 34170-130.
- Ультрафиолетовый спектрофотометр для измерений в видимом спектре Varian 50 Bio, AI 9655, с фиксированным элементом Cary 50 использовали для измерений концентрации белка (длина волны 280 нм). 100-мкл образец белка разбавляли водой (вода Milli-Q для ВЭЖХ) до конечного объема 50,00 мл для измерений концентрации белка во всех образцах антитела J695 и растворе адалимумаба после DF/UF. Концентрацию всех других образцов адалимумаба измеряли, разбавляя 40-мкл раствор образца 1960 мкл воды Milli-Q. Для измерений концентрации использовали одноразовые кюветы для УФ-излучения, 1,5 мл, полумикро, полиметилметакрилат (РММА); воду Milli-QW использовали в качестве контрольного образца при OD 280.
- Вода Milli-Q для ВЭЖХ была использована в качестве среды для DF/UF.
- Прибор Malvern Zetasizer Nano ZS № AI 9494 был использован для измерений динамического рассеяния света (DLS).
- Прецизионные ячейки Hellma, № 105.251.-QS, проходимый светом путь 3 мм, центр 8,5, использовали для измерений DLS (заполнение 75 мкл образца, Malvern Mastersizer Nano ZS, № AI 9494).
- Автоматический осмометр Knauer, № прибора 83963, Берлин, Германия, использовали для измерения осмоляльности (калиброван калибровочным раствором с 400 мОсмоль/кг NaCl, № Y1241, Herbert Knauer GmbH, Berlin, Germany).
- 250-мл колбы для культуры клеток Corning, 75 см2, полистирол, стерильные, Corning, NY, USA, использовали для хранения растворов белков после выполнения DF/UF.
- Хлорид натрия: J.T.Baker использовали для получения 2 М исходного раствора NaCl. Исходный раствор использовали для получения раствора адалимумаба с концентрацией 1 мг/мл в чистой воде с разными концентрациями NaCl (10, 20, 30 и 50 мМ).
- D-сорбит, Sigma Chemical Co., St. Louis, MO 63178, использовали для получения исходного раствора сорбита с концентрацией 200 мг/мл. Указанный исходный раствор использовали для получения раствора адалимумаба с концентрацией 1 мг/мл в чистой воде с разными концентрациями сорбита (10, 20, 30 и 40 мг/мл).
Методы ВЭЖХ
- Адалимумаб, анализ методом вытеснительной хроматографии (SEC): колонка Sephadex 200 (Pharmacia, № по каталогу 175175-01, S/N 0504057). Подвижная фаза: 20 мМ фосфата натрия, 150 мМ хлорида натрия, рН 7,5, скорость потока 0,5 мл/мин, комнатная температура, обнаружение УФ-излучения с длиной волны 214 нм и 280 нм. Каждый образец разбавляли до 1,0 мг/мл водой Milli-Q, образец вводили в количестве 50 мкг (дублированный ввод).
- Адалимумаб, анализ методом ионообменной хроматографии (IEC): колонка Propac WCX-10, Dionex (№ 054993) вместе с соответствующей защитной колонкой (№ 054994). Условия разделения: подвижная фаза А: 10 мМ фосфата натрия, рН 7,5, подвижная фаза В: 10 мМ фосфата натрия, 500 мМ хлорида натрия, рН 5,5, скорость потока 1,0 мл/мин, комнатная температура. Каждый образец разбавляли до 10 мг/мл водой Milli-Q, образец вводили в количестве 100 мкг, дублированный ввод.
- Антитело J695, анализ методом SEC: колонка G3000swxl Tosoh Bioscience, 7,8 мм × 30 см, 5 мкм (№ по каталогу 08541). Подвижная фаза: 211 мМ Na2SO4/92 мМ Na2HPO4, рН 7,0, скорость потока 0,3 мл/мин, комнатная температура, обнаружение при УФ-излучении с длиной волны 214 нм и 280 нм. Каждый образец разбавляли до 2,5 мг/мл водой Milli-QW, образец вводили в количестве 50 мкг (дублированный ввод).
- Антитело J695, анализ методом IEC: колонка Propac WCX-10, Dionex, (№ 054993) вместе с соответствующей защитной колонкой (№ 054994). Условия разделения: подвижная фаза А: 10 мМ Na2HPO4, рН 6,0, подвижная фаза В: 10 мМ Na2HPO4, 500 мМ NaCl, рН 6,0, скорость потока 1,0 мл/мин, температура 35°С. Каждый образец разбавляли до 1,0 мг/мл водой Milli-Q, образец вводили в количестве 100 мкг. Эталон антитела J695 29001BF исследовали для сравнения в виде трех одинаковых образцов и разбавляли до 1 мг/мл водой Milli-Q с учетом концентрации, указанной в сертификате анализа.
Вычисление концентрации белка
Формула для вычисления:
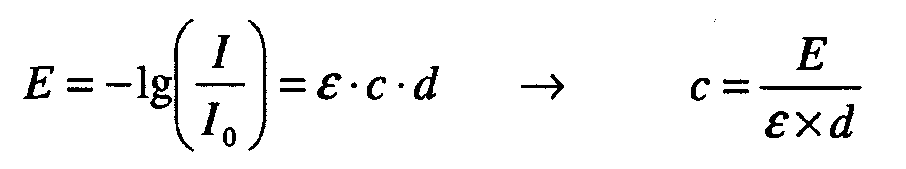
ε - коэффициент поглощения
с - концентрация
d - длина кюветы, проходимой светом
Е - оптическая плотность
I0 - начальная интенсивность света
I - интенсивность света после прохождения через образец
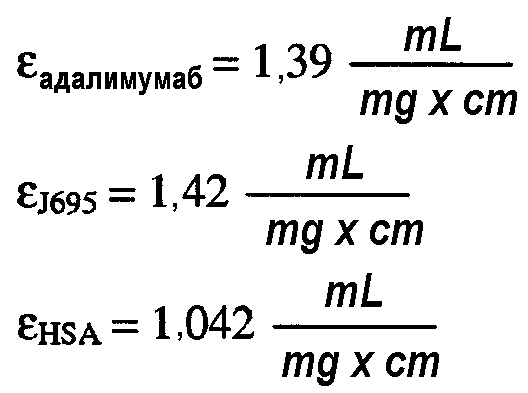
1.1. Обработка адалимумаба методом DF/UF
Эксперименты по обработке методом DF/UF выполняли в соответствии со стандартными процедурами, предписанными производителями оборудования для DF/UF. Например, систему TFF Millipore Labscale™, оснащенную 500-мл резервуаром, использовали в периодическом режиме при комнатной температуре в соответствии с инструкциями по эксплуатации компании Millipore. Скорость мешалки была установлена примерно на 1,5, и скорость насоса была установлена примерно на 3. Давление на входе и выходе было соответственно равно примерно 15 фунтов/кв.дюйм и примерно 50 фунтов/кв.дюйм, при этом давление контролировали во избежание выхода за указанные пределы.
Использовали капсулу для фильтрации с тангенциальным потоком Minimate™, оснащенную мембраной PES Omega™ (Pall Corp., Port Washington, NY), MWCO 30 кДа. Перед использованием капсулу промывали в течение 30 минут 0,1н раствором NaOH и в течение еще 30 минут водой Milli-Q.
Примерно 500 мл раствора адалимумаба вводили в резервуар системы TFF и выполняли DF/UF в периодическом режиме. В таблице 1 приведены данные контроля процесса (IPC), характеризующие выполнение DF/UF.
|
Обработка DF/UF была прекращена после примерно 5-кратного объемного обмена (1 объемный обмен соответствует примерно 250 мл диафильтрующей среды). Если предположить наличие идеальной 100% проницаемости наполнителя через мембрану, то теоретическая конечная концентрация наполнителя, достигаемая при заданных экспериментальных параметрах равна Ci(250/500)5=0,03125*Ci, где Ci означает начальную концентрацию. Поэтому максимальное уменьшение количества наполнителя равно 96,875% (при использовании диафильтрации с постоянным объемом теоретическое уменьшение количества наполнителя 5 диафильтрующими объемами должно быть равно Ci e-5=0,00674, то есть максимальное уменьшение количества наполнителя равно примерно 99,3%). Раствор адалимумаба сливали из системы TFF в 250 мл колбу для культуры клеток (систему TFF промывали небольшим объемом воды для инъекций с достижением концентрации, равной 175,05 мг/мл; без промывки концентрация задержанного белка была равна 213,87 мг/мл). Отбирали образцы для определения рН, осмоляльности и концентрации адалимумаба. Кроме того, отбирали образцы для исследования методами SEC и IEC. Характеристические параметры раствора адалимумаба до и после обработки DF/UF приведены в таблице 2.
|
В процессе выполнения DF/UF концентрация адалимумаба превысила 210 мг/мл. На протяжении всего эксперимента раствор белка оставался прозрачным, при этом отсутствовало помутнение раствора или преципитация белка, которые свидетельствуют об ограниченной растворимости адалимумаба. По сравнению с первоначальным раствором лекарственного вещества адалимумаба (~55 мг/мл) раствор адалимумаба, подвергнутый диафильтрации с использованием чистой воды в качестве обменной среды DF/UF, характеризовался более низкой опалесценцией несмотря на более чем 3-кратное увеличение концентрации белка (~175 мг/мл).
1.2. Исследование адалимумаба при помощи хроматографии
На фиг.1 показана хроматограмма SEC эталонного адалимумаба (стандартный адалимумаб (нижняя линия)) по сравнению со стандартным раствором лекарственного вещества адалимумаба до (средняя линия) и после (верхняя линия) обработки DF/UF. Следует отметить, что все образцы были заморожены при -80°С до выполнения анализа.
В таблице 3 также приведены данные хроматограммы IEC (следует отметить, что все образцы были заморожены при -80°С до выполнения анализа).
|
1.3. Влияние наполнителей на гидродинамический диаметр (D h ) адалимумаба
Ранее было установлено, что гидродинамический диаметр антитела J695, определенный в результате выполнения измерений динамического рассеяния света (DLS), был значительно уменьшен при получении антитела J695 в чистой воде. Антитело J695 в воде для инъекций имело значение Dh, равное ~3 нм, что значительно меньше значений, ожидаемых для иммуноглобулинов. При добавлении ионизируемого NaCl в небольших количествах значения Dh увеличились до ~10 нм (независимо от концентрации NaCl). Добавление неионизируемого маннита увеличивало осмоляльность раствора антитела J695, но не влияло на Dh антитела J695.
Чтобы определить влияние наполнителей на гидродинамический диаметр адалимумаба, который был обработан в соответствии с методом DF/UF, раствор адалимумаба, полученный в эксперименте по обработке DF/UF, использовали для получения растворов адалимумаба в чистой воде с изменением соответственно уровней NaCl (0-50 мМ) и сорбита (0-40 мг/мл). Влияние концентраций сорбита (неионизируемый наполнитель) и NaCl (ионизируемый наполнитель) на значение Dh мономера адалимумаба показано на фиг.2.
Гидродинамический диаметр мономера адалимумаба в чистой воде был равен 2,65 нм. Реакция Dh адалимумаба на соль и неионные наполнители была идентична ранее наблюдавшейся реакции антитела J695. На Dh адалимумаба фактически не влияло присутствие сорбита. Низкие концентрации NaCl вызывают увеличение гидродинамического диаметра мономера до предлагаемых уровней, равных ~11 нм. Полученные результаты показывают, что на гидродинамические диаметры белка, измеренные методом динамического рассеяния света, существенно влияет присутствие ионизируемых наполнителей. Отсутствие ионизируемых наполнителей также влияет на вязкость раствора.
Полученные результаты применимы к высококонцентрированным растворам белка: чем меньше гидродинамический диаметр, тем меньше пространственный объем, занимаемый белками. В высококонцентрированных препаратах вязкость растворов белков, которые получают, используя воду в качестве обменной среды для DF/UF, будет значительно ниже вязкости в традиционных белковых композициях, содержащих значительные количества ионизируемых буферных наполнителей. Данные для адалимумаба подтверждают полученные результаты, так как вязкость растворов, содержащих адалимумаб в количестве 200 мг/мг в воде для инъекций, была ниже 50 мПа*с независимо от значения рН (например, рН 4, рН 5 и рН 6). Дополнительные данные влияния рН на Dh представлены в приведенном ниже примере 17.
Полученные результаты могут быть использованы при определении активности высококонцентрированной белковой композиции, где хорошо известны связанные с вязкостью проблемы изготовления, дозирования и введения. Кроме того, полученные результаты показывают, что значения осмоляльности конечного лекарственного продукта могут быть отрегулированы при введении неионизируемых наполнителей, таких как сахара или сахарные спирты, без увеличения соответственно значения Dh белка и вязкости раствора.
1.4. Обработка антитела J695 (антитело против IL-12) методом DF/UF
Примерно 200 мл раствора антитела J695 доводили до рН 4,4, добавляя 1 М раствор фосфорной кислоты, и вводили в резервуар системы TFF (показатель рН регулировали для гарантии положительного зета-потенциала мономеров антитела J695 и, следовательно, во избежание потенциального влияния незаряженного мономера белка на полученные данные). Затем в резервуар системы TFF добавляли 300 мл воды Milli-Q и начинали обработку DF/UF в периодическом режиме. В резервуар объемом 250 мл добавляли 250 мл воды Milli-Q и снова начинали обработку DF/UF. Обработку DF/UF прекращали после выполнения в общей сложности 5 стадий объемного обмена (1 объемный обмен соответствует примерно 250 мл).
Если предположить наличие идеальной 100% проницаемости наполнителя через мембрану, то теоретическая конечная концентрация наполнителя, достигаемая при заданных экспериментальных параметрах, равна Ci(250/500)5=0,03125*Ci, где Ci означает начальную концентрацию. Поэтому максимальное уменьшение количества наполнителя равно 96,875% (при использовании диафильтрации с постоянным объемом теоретическое уменьшение количества наполнителя 5 диафильтрующими объемами должно быть равно Ci e-5=0,00674, то есть максимальное уменьшение количества наполнителя равно примерно 99,3%). Раствор антитела J695 сливали из системы TFF в 250-мл колбу для культуры клеток (систему TFF не промывали). Отбирали образцы для определения рН, осмоляльности и концентрации антитела J695. Кроме того, отбирали образцы для исследования методами SEC и IEC. Характеристические параметры раствора антитела J695 до и после обработки DF/UF приведены в таблице 4.
|
Так же, как в случае адалимумаба, эксперименты по обработке антитела J695 методом DF/UF показывают принципиальную возможность обработки и получения антитела J695 с использованием чистой воды в качестве обменной среды при выполнении DF/UF. Данные SEC и IEC свидетельствуют об отсутствии значительного влияния на устойчивость антитела J695 при обработке DF/UF в течение 1,5 дня (с прерыванием процесса ночью) при комнатной температуре с использованием воды Milli-Q в качестве диафильтрующей среды. В процессе эксперимента раствор белка оставался прозрачным, что указывает на отсутствие потенциальных ограничений растворимости антитела J695.
1.5. Исследование антитела J695
В таблице 5 приведены процентные значения содержания агрегата, мономера и фрагмента для трех растворов, определенные на основании хроматограммы SEC.
|
На фиг.3 показан профиль IEC эталона антитела J695 (нижний график) и лекарственного вещества антитела J695, значение рН доведено до рН 4,4 (верхний график).
В образцах антитела J695 после обработки DF/UF было отмечено лишь небольшое увеличение содержания агрегата.
На фиг.4 показан профиль IEC антитела J695 после обработки DF/UF с использованием воды Milli-Q, рН 4,7 (верхний график) и лекарственного вещества антитела J695 до обработки DF/UF, значение рН доведено до рН 4,4 (нижняя кривая). Как показано на фиг.4, стадия обработки DF/UF не оказала существенного влияния на устойчивость антитела J695 по результатам ионообменной хроматографии (IEC). Разницу значений между двумя эталонами J695 (см. фиг.3) можно объяснить различиями в производственных процессах компаний 3000L и 6000L. В таблице 6 более подробно представлены данные IEC.
|
1.6. Заключение
В приведенном выше примере рассмотрен эксперимент по диафильтрации/ультрафильтрации (DF/UF) с использованием воды (вода Milli-Q для ВЭЖХ) в качестве диафильтрующей среды для моноклональных антител адалимумаб и J695.
Адалимумаб подвергали обработке DF/UF, используя чистую воду в качестве обменной среды для DF/UF, и получали указанное антитело при рН 5,2 в высоких концентрациях (>200 мг/мл) без легкого помутнения раствора, сильной опалесценции или образования мути. При выполнении одной последующей стадии замораживания/оттаивания данные SEC и IEC свидетельствуют об отсутствии значительных различий между раствором адалимумаба, полученным в воде при помощи DF/UF, и первоначальным лекарственным веществом адалимумаба.
Антитело J695 также подвергали обработке DF/UF, используя чистую воду в качестве обменной среды для DF/UF, и получали указанное антитело при рН 4,7 без влияния на устойчивость антитела J695 (визуальный осмотр, SEC, IEC).
При получении препарата путем обработки DF/UF гидродинамический диаметр (Dh) мономера адалимумаба был равен примерно 2,65 нм. Было установлено, что присутствие неионных наполнителей, таких как сорбит, в концентрациях до 40 мг/мл не влияет на данные Dh, в то время как ионные наполнители, такие как NaCl, уже при низких концентрациях вызывают увеличение Dh мономера адалимумаба примерно до 11 нм (такие данные Dh обычно характерны для IgG). Аналогичные результаты были ранее получены для антитела J695.
В заключение следует отметить, что белки можно обрабатывать и получать с использованием чистой воды в качестве обменной среды для DF/UF. Если предположить наличие идеальной 100% проницаемости наполнителя через мембрану, то теоретическая конечная концентрация наполнителя, достигаемая при диафильтрации с постоянным объемом при использовании 5 диафильтрующих объемов, должна быть равна Ci e-5=0,00674, то есть максимальное уменьшение количества наполнителя равно примерно 99,3%. При обмене с использованием 6 диафильтрующих объемов теоретическое максимальное уменьшение количества наполнителя должно быть равно ~99,98%.
В примерах 2-5 описан эксперимент с использованием трех разных белков, которые концентрировали в водной композиции, и в примерах 6-11 описан анализ каждой водной композиции.
Вещества и методы для примеров 2-11
- Раствор белка адалимумаба (10 мг/мл) в воде для инъекций, лекарственное вещество (DS) белка (49,68 мг/мл), лекарственное вещество содержит твин 80, адалимумаб, лекарственный продукт (DP) адалимумаба (40 мг, раствор для инъекций, фильтрованный раствор промышленного производства). Коэффициент поглощения белка при длине волны 280 нм: 1,39.
- Раствор белка J695 (10 мг/мл) в воде для инъекций, лекарственное вещество (DS) белка (54 мг/мл), лекарственное вещество содержит твин 80. Коэффициент поглощения при длине волны 280 нм: 1,42.
- Раствор белка HSA (10 мг/мл) в воде для инъекций, лекарственный продукт без твина 80, сывороточный альбумин человека Grifols®, 20%, 50 мл. Коэффициент поглощения при длине волны 280 нм: 1,042.
- Ампула 6R и ампула 10R.
- Подготовка ампул: ампулы мыли и обрабатывали в автоклаве.
- Пробки, 19 мм, West, 4110/40/серые.
- Контейнер для образцов (например, контейнер для образцов Eppendorf, замок, гарантирующий неприкосновенность, или простой защелкивающийся замок, 1-2 мл).
- Одноразовые шприцы, стерильные, 20 мл; NormJect, 10 мл.
- Одноразовые фильтрующие устройства (фильтр Millex®-GV, фильтр-насадка для шприца, PVDF, 0,22 мкм; Millex®-GV, фильтр-насадка для шприца, PES, 0,22 мкм, фильтр Sterivex® 0,22 мкм).
- Концентраторы Vivaspin (отсечение молекулярной массы 10 кДа, PES; отсечение молекулярной массы 3 кДа, PES).
- Пипетки (например, Eppendorf, максимальный объем 1000 мкл).
- Вода для инъекций.
- Центрифуга (Eppendorf) и центрифуга № 1 (с регулированием температуры).
- Оборудование для диафильтрации: система TFF Millipore Labscale™, диафильтрующая мембрана Millipore: адалимумаб: полиэфирсульфон (PES); антитело J695: полиэфирсульфон (PES); антитело HSA: регенерированная целлюлоза.
- Зонд для измерения рН (рН-измеритель Metrohm; зонд, пригодный для измерения белка, биотрод 46).
- Станок для создания безвихревого воздушного потока, Steag LF-Werkbenk, № 12,5.
- NaCl; маннит.
- Пластинчатый реометр Gemini 150 Peltier, Malvern.
- Реометр MCR 301 [реометр P-PTD 200 с регулированием температуры (пластина с термообработкой Peltier)] и коническая/пластинчатая измерительная система СР50/0,5° Ti, а также СР50/1° (нержавеющая сталь); Anton Paar.
- Капиллярный вискозиметр, Schott, капилляры: тип 537 20, тип 537 10, тип 537 13.
- 1 М раствор хлористоводородной кислоты (J.T. Baker).
Аналитическая часть
- UV/VIS спектрофотометрия (OD 280 нм); фотонно-корреляционная спектроскопия (PCS): для примерно 10 мг/мл и примерно 20 мг/мл: 1,1 мПа*с, 3 серии, 30 сек, одно измерение, 25°С, примерно от 30 мг/мл и выше: 1,9 мПа*с, 30 сек, 3 серии, одно измерение, 25°С.
- Вытеснительная хроматография (SEC) и ионообменная хроматография (IEC), описанные ниже.
- Измерение вязкости: были использованы разные вискозиметры с индивидуальными и разными установками.
Вычисление концентрации белка
Формула для вычисления:
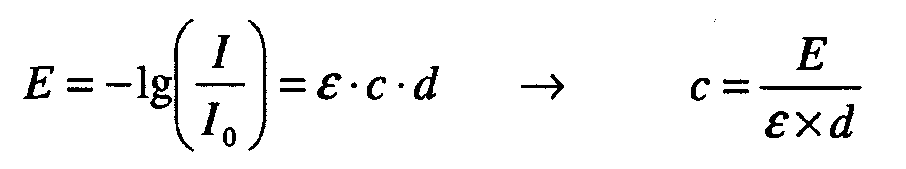
ε - коэффициент поглощения
с - концентрация
d - длина кюветы, проходимой светом
Е - оптическая плотность
I0 - начальная интенсивность света
I - интенсивность света после прохождения через образец
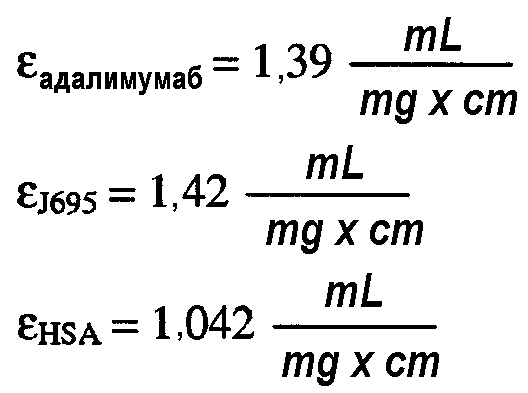
Данные вязкости и вычисление для адалимумаба
Плотность промышленно получаемой композиции адалимумаба (примерно 194 мг/мл):
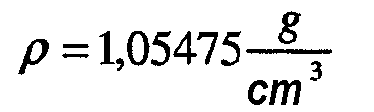
Кинетическая вязкость промышленно получаемой композиции адалимумаба (примерно 194 мг/мл):
К - константа капилляра
t - время, необходимое для прохождения раствора через капилляр [сек]
ν - кинетическая вязкость
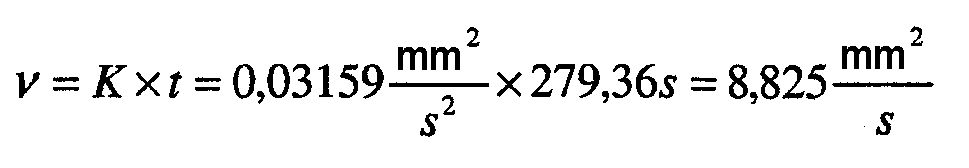
Динамическая вязкость промышленно получаемой композиции адалимумаба (примерно 194 мг/мл):
η - динамическая вязкость
ρ - плотность
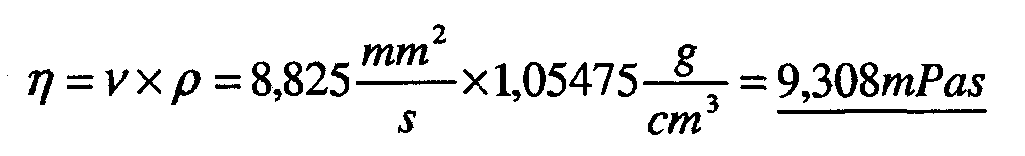
Данные вязкости и вычисление для сывороточного альбумина человека
Плотность промышленно получаемой композиции HSA (примерно 200 мг/мл):
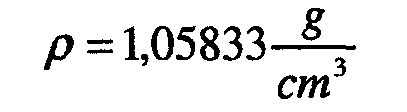
Кинетическая вязкость промышленно получаемой композиции HSA (примерно 200 мг/мл):
К - константа капилляра
t - время, необходимое для прохождения раствора через капилляр [сек]
v - кинетическая вязкость
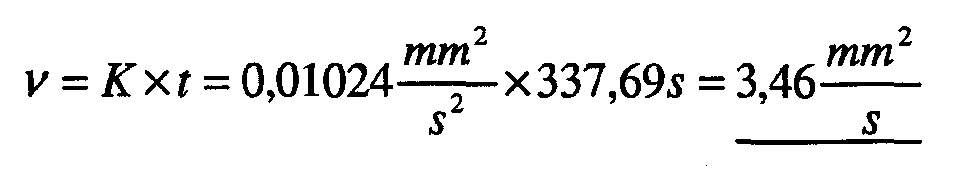
Динамическая вязкость промышленно получаемой композиции HSA (примерно 200 мг/мл):
η - динамическая вязкость
ρ - плотность
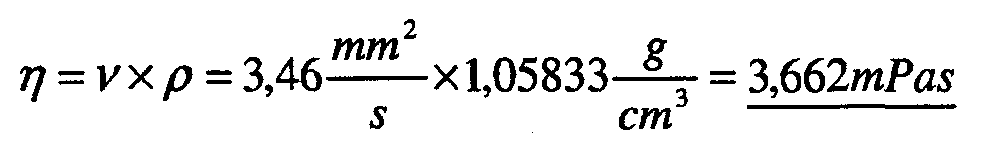
Плотность сывороточного альбумина человека (HSA) в воде для инъекций (WFI) (примерно 180 мг/мл):
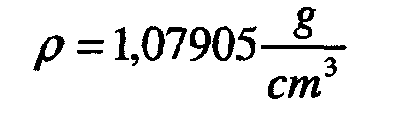
Кинетическая вязкость сывороточного альбумина человека (HSA) в воде для инъекций (WFI) (примерно 180 мг/мл):
К - константа капилляра
t - время, необходимое для прохождения раствора через капилляр [сек]
ν - кинетическая вязкость
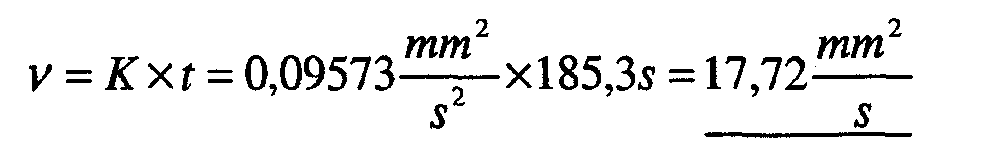
Динамическая вязкость сывороточного альбумина человека (HSA) в воде для инъекций (WFI) (примерно 180 мг/мл):
η - динамическая вязкость
ρ - плотность
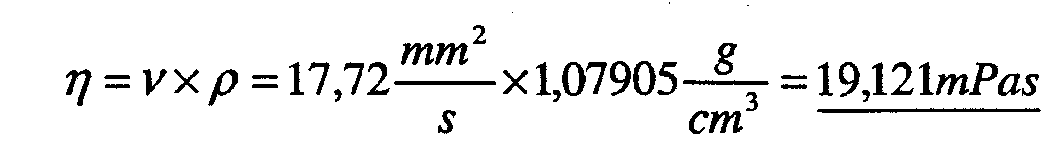
Выполнение общего эксперимента для получения высококонцентрированной жидкости
Способ получения высококонцентрированной, не содержащей соли белковой композиции по настоящему изобретению включает диафильтрацию исходного лекарственного вещества и последующее увеличение концентрации лекарственного вещества в растворе. Данный способ может быть выполнен в виде отдельных процедур или в виде отдельных или одновременно выполняемых стадий одной процедуры.
Диафильтрация
Диафильтрации подвергали достаточное количество лекарственного вещества (DS) (в зависимости от концентрации белка в лекарственном веществе). До выполнения диафильтрации лекарственное вещество разбавляли водой для инъекций до концентрации ~10 мг/мл. Следует отметить, что для выполнения эксперимента потребовалось в общей сложности примерно 540 мл раствора с концентрацией 10 мг/мл.
В качестве диафильтрующей среды использовали воду для инъекций. Число выполненных стадий диафильтрации было равно 5-7 (одна стадия диафильтрации равна одному общему объемному обмену). Образцы для контроля процесса (IPC) отбирали до выполнения диафильтрации и после выполнения диафильтрации (200 мкл для измерения осмоляльности, 120 мкл для выполнения SEC).
Диафильтрацию в оборудовании TFF выполняли при следующих заданных параметрах:
- мешалка: положение 2;
- насос: положение 2;
- давление подаваемого потока/на входе: максимум 20-30 фунтов/кв.дюйм;
- давление отводимого потока/на выходе: максимум 10 фунтов/кв.дюйм.
(Параметры, использованные в данном эксперименте, были взяты из инструкций производителя. Специалист в данной области может изменить рабочие параметры оборудования в соответствии с конкретным белком или различиями в оборудовании, композиции, вязкости и другими переменными величинами).
После выполнения диафильтрации определяли концентрацию белка, измеряя оптическую плотность при длине волны 280 нм (OD280). Концентрацию белка, которая была >10 мг/мл, доводили до 10 мг/мл, разбавляя раствор водой для инъекций.
Концентрирование белка
20 мл подвергнутого диафильтрации раствора белка (например, адалимумаба, J695, HSA) вводили в концентратор Vivaspin 20. Концентратор закрывали и помещали в центрифугу. Раствор белка центрифугировали при максимальной скорости (5000 об/мин).
Отбор образцов
Образцы концентрированных растворов отбирали при концентрации 10 мг/мл и затем после каждого увеличения концентрации на 10 мг/мл (20, 30, 40 мг/мл и т.д.) или до появления агрегатов белка и анализировали образцы следующим образом:
- Раствор белка гомогенизировали в концентраторе Vivaspin и выливали в соответствующую ампулу.
- Оптическую плотность проверяли непосредственно в ампуле.
- 300 мкл использовали для выполнения УФ-спектроскопии, 160 мкл использовали для измерения LCS, 120 мкл использовали для SEC и 300 мкл использовали для IEC.
- Образцы для выполнения SEC и IEC хранили при -80°С.
Исследование методом динамического рассеяния света (DLS)
Исследование методом динамического рассеяния света выполняли в устройстве Zetasizer Nano ZS (Malvern Instruments, Southborough, MA), оснащенном прецизионными ячейками Hellma (Plainview, NY), особо чистое кварцевое стекло, тип 105.251-QS, проходимый светом путь 3 мм, центр Z8,5 мм, ячейки заполняли по меньшей мере 60 мкл образца, образцы белка использовали без предварительной обработки и вводили непосредственно в измерительную ячейку. До выполнения измерения через смотровое окно ячейки проверяли отсутствие пузырьков воздуха или частиц/пыли/других загрязняющих примесей в растворе, которые могут повлиять на измерение DLS. Измерения выполняли в соответствии со стандартными рабочими процедурами (”общий” режим, 25°С, показатель преломления 1,45, режим измерения ”ручной”, 1 серия измерений включала 3 измерения по 30 сек каждое, заданным типом измерения является ”размер”). Для анализа данных использовали программное обеспечение Dispersion Technology Software, версия 4.10b1, Malvern Instruments. Для анализа гидродинамических диаметров (Dh) в презиционную ячейку вводили примерно 70 мкл раствора образца. Вязкость образца по умолчанию была задана равной 1,1 мПа*с для низкоконцентрированных растворов белка (например, <5 мг/мл). Принципы выполнения измерений предполагали, что минимальные различия между значениями действительной вязкости измеряемого раствора образца и используемыми значениями вязкости по умолчанию не оказывают существенного влияния на данные DLS. Данное положение было проверено путем измерений DLS растворов с низкой концентрацией белка (<5 мг/мл), при выполнении которых были определены значения вязкости растворов и учтены в последующих измерениях DLS. Для всех образцом с более высокими концентрациями белка были определены значения вязкости и учтены при выполнении измерений DLS.
Пример 2
Композиция, включающая антитело против TNFα в высокой концентрации
2.1. Диафильрация
Перед выполнением диафильтрации адалимумаб (49,68 мг/мл) разбавляли водой для инъекций до концентрации, равной примерно 15 мг/мл. Для этого 140,8 мл раствора адалимумаба (49,68 мг/мл) вводили в 500-мл мерную колбу. Колбу заполняли водой для инъекций до калибровочной метки. Мерную колбу закрывали и осторожно встряхивали для гомогенизации раствора. Лабораторную систему TFF промывали водой. Подбирали мембрану (PES) и также промывали 1 л дистиллированной воды. Затем лабораторную систему TFF и мембрану промывали примерно 300 мл воды для инъекций. Разбавленный раствор адалимумаба выливали в резервуар системы TFF. Отбирали образцы для измерения осмоляльности (300 мкл), выполнения УФ-спектрофотометрии (500 мкл) и анализа методом SEC (120 мкл). Систему закрывали и начинали диафильтрацию. Диафильтрацию/ультрафильтрацию (DF/UF) заканчивали после выполнения 5 объемных обменов и после достижения значения осмоляльности, равного 3 мОсмоль/кг. Значение рН раствора адалимумаба после диафильтрации было равно рН 5,25.
Диафильтрацию в оборудовании TFF выполняли при следующих заданных параметрах:
- мешалка: положение 2;
- насос: положение 2;
- давление подаваемого потока/на входе: максимум 20-30 фунтов/кв.дюйм;
- давление отводимого потока/на выходе: максимум 10 фунтов/кв.дюйм.
После выполнения диафильтрации определяли концентрацию белка, измеряя оптическую плотность при длине волны 280 нм (OD280). Было установлено, что концентрация равна 13,29 мг/мл.
Раствор адалимумаба стерилизовали фильтрованием.
Систему TFF и мембрану промывали примерно 1 л дистиллированной воды и затем 500 мл 0,1 М раствора NaOH. Мембрану хранили в 0,1 М растворе NaOH, систему TFF снова промывали примерно 500 мл дистиллированной воды.
2.2. Концентрирование белка
Перед концентрированием белка снова определяли концентрацию белка, измеряя оптическую плотность при длине волны 280 нм (OD280). Концентрация адалимумаба была равна 13,3 мг/мл. Затем раствор адалимумаба разбавляли до 10 мг/мл. 375,94 мл раствора адалимумаба (13,3 мг/мл) вводили в 500-мл мерную колбу и заполняли колбу водой для инъекций (WFI) до калибровочной метки. 75,19 мл раствора адалимумаба (13,3 мг/мл) также вводили в 100-мл мерную колбу, которую заполняли до калибровочной метки чистой водой, то есть водой для инъекций (WFI). Обе колбы осторожно встряхивали для гомогенизации. Растворы в обеих колбах помещали в 1-л бутылку из полиэтилентелефталат-гликоля (PETG). Бутылку осторожно встряхивали для гомогенизации растворов.
Использовали четыре концентратора Vivaspin 20 (10 кДа). В каждый из трех концентраторов Vivaspin вводили 20 мл раствора адалимумаба (10 мг/мл). Четвертое устройство Vivaspin заполняли водой в качестве противовеса во время центрифугирования. Концентраторы закрывали и помещали в центрифугу. Раствор адалимумаба центрифугировали с центробежной силой 4500×g (в поворотном роторе).
2.3. Отбор образцов
Образцы концентрированного раствора адалимумаба отбирали при концентрации 10 мг/мл и затем после каждого увеличения концентрации на 10 мг/мл (при 20 мг/мл, 30 мг/мл, 40 мг/мл и т.д. до достижения примерно 200 мг/мл). Через каждые 40 минут концентраторы удаляли из центрифуги, раствор гомогенизировали, после чего раствор и центрифужные адаптеры охлаждали на льду в течение примерно 10 минут. После каждого увеличения концентрации на 10 мг/мл растворы в концентраторах гомогенизировали, проверяли оптическую плотность и отбирали образцы для анализа методами УФ-спектрофотометрии (300 мкл), PCS (160 мкл), SEC (120 мкл) и IEC (300 мкл). После отбора образцов концентраторы заполняли примерно 20 мл раствора адалимумаба (10 мг/мл).
Путем визуального осмотра и анализа методом PCS преципитации белка определяли предел растворимости белка адалимумаба (то есть изоформ) в растворе.
При концентрации, примерно равной 80 мг/мл, стало очевидно, что раствор адалимумаба больше не является опалесцентным, поскольку опалесценция является известной характеристикой растворов адалимумаба, содержащих большое количество фрагментов. Поэтому возникло подозрение, что фрагментация могла произойти во время выполнения эксперимента. Образец раствора адалимумаба (с концентрацией примерно 80 мг/мл) анализировали при помощи вытеснительной хроматографии (SEC). Раствор, оставшийся в каждом концентраторе Vivaspin, а также остаток раствора адалимумаба (10 мг/мл) переносили в фальконовые пробирки и хранили при -80°С. Анализ методом SEC показал наличие чистоты, соответствующей 99,6% мономера.
Раствор оттаивали на водяной бане при 25°С и стерилизовали фильтрованием. Затем растворы из 3 фальконовых пробирок переносили в концентраторы Vivaspin. Концентраторы заполняли примерно до 20 мл и продолжали концентрировать растворы. Эксперимент заканчивали после достижения концентрации, равной примерно 200 мг/мл.
Все образцы для анализа методами SEC и IEC хранили при -80°С до последующего выполнения анализов. УФ-спектрофотометрию и фотонно-корреляционную спектроскопию (PCS) выполняли сразу же после отбора образцов. Остаток концентрированного раствора адалимумаба помещали в контейнер для образцов Eppendorf и хранили при -80°С.
В приведенной ниже таблице 7 показано вычисление объемов раствора белка, вводимых в концентраторы в процессе концентрирования раствора адалимумаба. Схема была вычислена до выполнения эксперимента для определения объема отбираемых образцов. Продолжительность центрифугирования показана в таблице 8.
|
|
Результаты концентрирования адалимумаба показаны также в приведенной ниже таблице 12.
2.4. Измерение вязкости
Вязкость измеряли в растворах адалимумаба с концентрацией 50 мг/мл или 200 мг/мл в воде для инъекций. Вязкость растворов с концентрацией 50 мг/мл и 200 мг/мл в воде для инъекций измеряли при помощи пластинчатого реометра Gemini 150 Peltier, Malvern, и вязкость раствора с концентрацией 200 мг/мл в воде для инъекций измеряли также при помощи реометра MCR 301 [реометр P-PTD 200 с регулированием температуры (пластина с термообработкой Peltier)] и конической/пластинчатой измерительной системы СР50/1 (нержавеющая сталь); Anton Paar).
Растворы адалимумаба (200 мг/мл), находящиеся в пробирках для хранения, оттаивали и гомогенизировали в ампуле 6R. 1 мл адалимумаба (200 мг/мл) разбавляли 3 мл воды для инъекций, получая разбавленный раствор (раствор адалимумаба с концентрацией 50 мг/мл).
Для измерения вязкости реометром Gemini 150 необходимо примерно 2 мл образца и реометром MCR 301 необходимо менее 1 мл образца.
Адалимумаб (примерно 194 мг/мл) в промышленно получаемой композиции получали в пробирках Vivaspin. Пробирки заполняли раствором адалимумаба в промышленном буфере и центрифугировали до достижения концентрации 194 мг/мл. Вязкость измеряли при помощи капиллярного вискозиметра Schott.
2.5. Краткий обзор
Адалимумаб концентрировали с 50 мг/мл до примерно 194 мг/мл в четырех разных пробирках Vivaspin. В начале концентрирования в каждой пробирке (четыре пробирки) находилось 20 мл раствора адалимумаба (50 мг/мл). В конце концентрирования в каждой пробирке находилось 5 мл раствора адалимумаба (примерно 194 мг/мл). Концентрирование выполняли со скоростью 5000 об/мин (примерно 4500×g). Через каждый час квадратные химические стаканы и раствор белка в пробирках Vivaspin охлаждали в измельченном льду в течение примерно 10-15 минут. Плотность измеряли при помощи измерителя плотности DMA 4500, Anton Paar. Дальнейший анализ композиции с высокой концентрацией адалимумаба описан в примерах 5-11.
Пример 3
Композиция, включающая высококонцентрированное антитело против IL-12
3.1. Диафильтрация
Перед выполнением диафильтрации антитело J695 против IL-12 (54 мг/мл) разбавляли водой для инъекций до концентрации, примерно равной 15 мг/мл. Для этого 150 мл раствора антитела J695 (54 мг/мл) вводили в 500-мл мерную колбу и заполняли колбу водой для инъекций до калибровочной метки. Мерную колбу закрывали и осторожно встряхивали для гомогенизации раствора. Лабораторную систему TFF промывали водой. Подбирали полиэфирсульфоновую мембрану (PES), которую также промывали 1 л дистиллированной воды. Затем лабораторную систему TFF и мембрану промывали примерно 300 мл воды для инъекций. Разбавленный раствор антитела J695 выливали в резервуар системы TFF. Отбирали образец для измерения осмоляльности (300 мкл), выполнения УФ-спектрофотометрии (500 мкл) и анализа методом SEC (120 мкл). Систему закрывали и начинали диафильтрацию. После обработки 200 мл диафильтруемого объема диафильтрацию прекращали и отбирали еще одну пробу для выполнения УФ-спектрофотометрии. DF/UF заканчивали после обработки 1800 мл диафильтруемого объема (примерно 3,5-кратный объемный обмен) при достижении значения осмоляльности, равного 4 мОсмоль/кг. Значение рН раствора антитела J695 после диафильтрации было равно рН 6,48.
Диафильтрацию в оборудовании TFF выполняли при следующих заданных параметрах:
- мешалка: положение 2;
- насос: положение 2;
- давление подаваемого потока/на входе: максимум 20-30 фунтов/кв.дюйм;
- давление отводимого потока/на выходе: максимум 10 фунтов/кв.дюйм.
После выполнения диафильтрации определяли концентрацию белка, измеряя оптическую плотность при длине волны 280 нм (OD280). Было установлено, что концентрация равна 16,63 мг/мл.
Раствор антитела J695 стерилизовали фильтрованием.
Систему TFF и мембрану промывали примерно 1 л дистиллированной воды и затем 500 мл 0,1 М раствора NaOH. Мембрану хранили в 0,1 М растворе NaOH и систему TFF снова промывали примерно 500 мл дистиллированной воды.
3.2. Концентрирование
Перед концентрированием раствор антитела J695 разбавляли до концентрации 10 мг/мл: 316 мл раствора антитела J695 (16,63 мг/мл) помещали в 500-мл мерную колбу и заполняли колбу водой для инъекций (WFI) до калибровочной метки. Дополнительно 64 мл раствора антитела J695 (16,63 мл) вводили в 100-мл мерную колбу, которую заполняли водой для инъекций до калибровочной метки. Обе колбы осторожно встряхивали для гомогенизации. Растворы из обеих колб выливали в 1-л бутылку из полиэтилентерефталат-гликоля (PETG). Бутылку осторожно встряхивали для гомогенизации.
Использовали четыре концентратора Vivaspin 20 (отсечение молекулярной массы 10 кДа). В каждый из трех концентраторов Vivaspin вводили 20 мл раствора антитела J695 (10 мг/мл). Четвертый концентратор Vivaspin заполняли водой в качестве противовеса во время центрифугирования. Концентраторы закрывали и помещали в центрифугу. Раствор антитела J695 центрифугировали с центробежной силой 4500×g (в поворотном роторе).
2.3. Отбор образцов
Образцы концентрированного раствора антитела J695 отбирали при концентрации 10 мг/мл и затем после каждого увеличения концентрации на 10 мг/мл (при 20 мг/мл, 30 мг/мл, 40 мг/мл и т.д. до достижения примерно 200 мг/мл). Через каждые 40 минут концентраторы удаляли из центрифуги, раствор гомогенизировали, после чего раствор и центрифужные адаптеры охлаждали на льду в течение примерно 10 минут. После каждого увеличения концентрации на 10 мг/мл растворы в концентраторах гомогенизировали, проверяли оптическую плотность и отбирали образцы для анализа методами УФ-спектрофотометрии (300 мкл), PCS (160 мкл), SEC (120 мкл) и IEC (300 мкл). После отбора образцов концентраторы заполняли примерно 20 мл раствора антитела J695 (10 мг/мл).
Путем визуального осмотра и анализа методом PCS определяли предел растворимость (то есть до возможной преципитации) и устойчивость антитела J695.
В конце эксперимента была достигнута концентрация, примерно равная 200 мг/мл.
Все образцы для анализа методами SEC и IEC хранили при -80°С до последующего выполнения анализов. УФ-спектрофотометрию и фотонно-корреляционную спектроскопию (PCS) выполняли сразу же после отбора образцов. Остаток концентрированного раствора антитела J695 помещали в контейнер для образцов Eppendorf и хранили при -80°С.
Схема центрифугирования подробно описана в приведенной выше таблице 7. Продолжительность центрифугирования антитела J695 показана в таблице 9.
|
3.4. Влияние наполнителей на гидродинамический диаметр антитела J695
В данном эксперименте анализировали влияние хлорида натрия и маннита, используемых отдельно, на гидродинамический диаметр антитела J695. Для указанной цели получали исходные растворы хлорида натрия (12 мг/мл) и маннита (120 мг/мл). 1,2 г NaCl взвешивали в химическом стакане, который заполняли примерно 70 мл воды для инъекций, и 12,002 г маннита взвешивали в химическом стакане, который заполняли примерно 70 мл воды для инъекций. Оба раствора перемешивали для гомогенизации. Каждый раствор вводили в мерную колбу, которую заполняли водой для инъекций до калибровочной метки. Колбы осторожно встряхивали для гомогенизации.
Примерно 8 мл раствора антитела J695 (примерно 200 мг/мл) оттаивали при 37°С. Раствор выливали в ампулу 10R и гомогенизировали. Каждую из семи ампул 2R заполняли 500 мкл раствора антитела J695 (примерно 200 мг/мл). Схема заполнения описана в приведенной ниже таблице 10.
|
Содержимое ампул 2R осторожно гомогенизировали, встряхивая. Анализ методом PCS и измерение осмоляльности выполняли у разных растворов антитела J695 (100 мг/мл).
Прежде чем получить образцы для анализа методом PCS, кюветы сначала промывали 50 мкл образца. Затем производили измерения, используя 100 мкл образец.
Дальнейший анализ композиции с высокой концентрацией антитела J695 описан в примерах 5-11.
Пример 4
Композиция с высокой концентрацией сывороточного альбумина человека (HSA)
4.1. Диафильтрация
Перед выполнением диафильтрации раствор HSA (200 мг/мл, промышленно получаемая композиция) разбавляли водой для инъекций до концентрации 15,29 мг/мл. Для этого 38 мл HSA (200 мг/мл) вводили в 500-мл мерную колбу. Колбу заполняли водой для инъекций до калибровочной метки. Объемную колбу закрывали и осторожно встряхивали для гомогенизации раствора. Лабораторную систему TFF промывали водой. Затем подбирали мембрану (регенерированная целлюлоза), которую также промывали 1 л дистиллированной воды. Лабораторную систему TFF и мембрану промывали примерно 300 мл воды для инъекций. Разбавленный раствор HSA выливали в резервуар системы TFF. Отбирали образцы для измерения осмоляльности (300 мкл), выполнения УФ-спектрофотометрии (500 мкл) и анализа методом SEC (120 мкл). Систему закрывали и начинали диафильтрацию. После диафильтрации объема, равного примерно 300 мл, производили УФ-измерение фильтрата. Концентрация фильтрата была равна 2,74 мг/мл, что свидетельствовало о прохождении белка через мембрану. Диафильтрацию заканчивали после обработки примерно 500 мл и отбирали другой образец для УФ-измерения (концентрация HSA 11,03 мг/мл). DF/UF заканчивали после диафильтрации объема, равного 950 мл (примерно 2 объемных обмена), и достижения значения осмоляльности, равного 4 мОсмоль/кг. Значение рН раствора HSA после диафильтрации было равно рН 7,13.
УФ-спектрофотометрическое измерение фильтрата было выполнено три раза (n=3).
Диафильтрацию в оборудовании TFF выполняли при следующих заданных параметрах:
- мешалка: положение 2;
- насос: положение 2;
- давление подаваемого потока/на входе: максимум 20-30 фунтов/кв.дюйм;
- давление отводимого потока/на выходе: максимум 10 фунтов/кв.дюйм.
После выполнения диафильтрации определяли концентрацию белка, измеряя оптическую плотность при длине волны 280 нм (OD280). Было установлено, что концентрация равна 9,41 мг/мл.
Раствор HSA стерилизовали фильтрованием. Систему TFF и мембрану промывали примерно 1 л дистиллированной воды. Затем выполняли испытание на целостность (см. инструкции по эксплуатации системы TFF Labscale™, стр. 5-3 - 5-5, 1997). Объемный поток был равен 1,2 мл/мл, таким образом, испытание на целостность было пройдено (приемлемый максимальный предел 3 мл/мин). Мембрану еще один раз промывали 500 мл дистиллированной воды и затем 500 мл 0,05 М раствора NaOH. Мембрану хранили в 0,05 М растворе NaOH, систему TFF снова промывали примерно 500 мл дистиллированной воды.
4.2. Процесс концентрирования
Перед концентрированием раствора белка HSA определяли концентрацию белка, измеряя оптическую плотность при длине волны 280 нм (OD280), при этом было установлено, что концентрация равна 9,52 мг/мл. Использовали четыре концентратора Vivaspin 20 (10 кДа). В каждый из 3 концентраторов Vivaspin вводили 20 мл раствора HSA (9,52 мг/мл). Четвертый концентратор Vivaspin заполняли водой в качестве противовеса во время центрифугирования. Концентраторы закрывали и помещали в центрифугу. Раствор HSA центрифугировали с центробежной силой 4500×g (в поворотном роторе).
4.3. Отбор образцов
Образцы концентрированного раствора HSA отбирали при достижении концентрации 10 мг/мл и затем после каждого увеличения концентрации на 10 мг/мл (при 20 мг/мл, 30 мг/мл, 40 мг/мл и т.д. до достижения примерно 200 мг/мл). Через каждые 40 минут концентраторы удаляли из центрифуги, раствор гомогенизировали, после чего раствор и центрифужные адаптеры охлаждали на льду в течение примерно 10 минут. После каждого увеличения концентрации на 10 мг/мл растворы в концентраторах гомогенизировали, проверяли оптическую плотность и отбирали образцы для анализа методами УФ-спектрофотометрии (300 мкл), PCS (160 мкл), SEC (120 мкл) и IEC (300 мкл). После отбора образцов в концентраторы добавляли раствор HSA (9,52 мг/мл) примерно до 20 мл.
Когда предполагаемая концентрация раствора HSA в концентраторе достигала примерно 20 мг/мл, измеряли оптическую плотность фильтрата при длине волны 280 (OD280), в результате чего было установлено, что концентрация равна 0,5964 мг/мл. Концентрация раствора HSA была равна только 15,99 мг/мл, что меньше ожидаемого значения. Образец концентрированного HSA в воде для инъекций (10 мг/мл) анализировали методом SEC для выявления возможной фрагментации. Раствор HSA (15,99 мг/мл), находящийся в концентраторе Vivaspin, переносили в фальконовые пробирки и хранили при -80°С. Оставшийся исходный раствор HSA (9,52 мг/мл), использованный для заполнения концентраторов, также хранили при -80°С.
Выполняли анализ методом SEC для определения возможного разрушения белка HSA с образованием мелких фрагментов, которые могли проходить через мембрану. Однако в результате выполнения анализа методом SEC был обнаружен мономер в количестве 92,45% при концентрации HSA 10 мг/мл в воде для инъекций фактически при отсутствии фрагментов.
Растворы, хранившиеся при -80°С, оттаивали при 25°С и стерилизовали фильтрованием. Растворы в фальконовых пробирках переносили в концентраторы Vivaspin 20 (отсечение 3 кДа). Концентраторы Vivaspin заполняли раствором HSA (9,52 мг/мл) и центрифугировали (см. процесс концентрирования, описанный в приведенном выше разделе 3.2).
Предел растворимости HSA определяли путем визуального осмотра и анализа методом PCS.
После окончания эксперимента была достигнута концентрация, равная примерно 180 мг/мл HSA.
Все образцы, используемые для анализов методами SEC и IEC, хранили при -80°С до последующего анализа. Измерения методами УФ-спектрофотометрии и PCS выполняли сразу же после отбора образцов. Оставшийся концентрированный раствор HSA помещали в контейнеры Eppendorf и хранили при -80°С.
В приведенной выше таблице 7 представлена схема центрифугирования. Продолжительность центрифугирования, выполняемого для концентрирования HSA, показана в таблице 11.
|
4.4. Влияние значения рН на гидродинамический диаметр HSA
Следующая часть эксперимента была выполнена для оценки потенциального влияния рН на гидродинамический диаметр HSA при растворении белка в воде для инъекций. Четыре ампулы 6R заполняли 5,09 мл раствора HSA (9,83 мг/мл) и доводили показатель рН до 3-6, добавляя 1 М раствор HCl (фактическое значение рН: 3,04, 3,99, 5,05, 6,01). Указанные растворы переносили в отдельные 10-мл мерные колбы. Колбы заполняли до калибровочной метки и осторожно встряхивали для гомогенизации.
Растворы HCl вводили в ампулы 10R и анализировали при помощи PCS. Растворы стерилизовали фильтрованием и снова измеряли при помощи PCS. 5,09 мл раствора HSA (9,83 мг/мл) снова переносили в 10-мл мерную колбу и заполняли водой для инъекций до калибровочной метки. Колбу осторожно встряхивали для гомогенизации, раствор стерилизовали фильтрованием и измеряли при помощи PCS.
Подготовка образца для измерения при помощи PCS:
Кюветы промывали 50 мкл образца. Измерение выполняли, используя образец объемом 100 мкл.
4.5. Измерение вязкости
Вязкость HSA в промышленно получаемой композиции (200 мг/мл) и HSA в воде для инъекций (примерно 180 мг/мл) измеряли при помощи капиллярного вискозиметра (Schott, № МР 33.2).
Из 50-мл бутылки, содержащей промышленно получаемую композицию HSA, отбирали 15 мл аликвоту. HSA в воде для инъекций оттаивали примерно при 20°С и примерно 9-мл аликвоту вводили в фальконовую пробирку. Плотность измеряли при помощи устройства для измерения плотности DMA 4500, Anton Paar.
Дальнейший анализ композиции с высокой концентрацией HSA описан в примерах 5-11.
Пример 5
Анализ композиций с высоким содержанием белка - оптические характеристики
В отличие от адалимумаба в промышленно получаемой композиции у адалимумаба в воде для инъекций отсутствовала опалесценция. У антитела J695, растворенного в воде для инъекций, также не была обнаружена опалесценция. Несмотря на то, что концентрация белка адалимумаба была равна 80 мг/мл и 200 мг/мл в воде для инъекций, опалесценция фактически отсутствовала. В отличие от этого в промышленно получаемой композиции, содержащей 50 мг/мл адалимумаба, была обнаружена значительная опалесценция. Таким образом, использование чистой воды, то есть воды для инъекций, в качестве растворяющей среды оказывает положительное воздействие на опалесценцию раствора белка.
Удивительным является то, что (помимо растворения в такой высокой концентрации) адалимумаб в воде для инъекций характеризуется низкой вязкостью даже при более высоких концентрациях, таких как 200 мг/мл.
В зависимости от концентрации оптические характеристики/цвет растворов HSA изменялись с прозрачного и светло-желтого (10 мг/мл в воде для инъекций) до прозрачного и желтого (примерно 180 мг/мл в воде для инъекций).
В процессе концентрирования не была обнаружена преципитация раствора адалимумаба и раствора HSA. Преципитация является показателем предела растворимости. Растворы оставались прозрачными до окончания эксперимента. Следует отметить, что эксперименты были прекращены не потому, что были достигнуты потенциальные пределы растворимости и произошла преципитация, а потому, что объемы растворов, оставшиеся в концентраторах, были недостаточны для продолжения концентрирования (то есть недостаточное количество вещества). По-видимому, пределы растворимости адалимумаба, антитела J695 и HSA превышают концентрацию 220 мг/мл.
В растворе антитела J695 был обнаружен кристаллообразный преципитат при хранении высококонцентрированного раствора в течение ночи при 2-8°С в концентраторах (примерно 120 мг/мл). Кристаллообразный преципитат растворялся примерно через 3-5 минут хранения раствора при комнатной температуре. Таким образом, среда, образующаяся в результате растворения антитела J695 в высокой концентрации в чистой воде, создает условия, в которых кристаллизация белка может происходить в результате простого изменения температуры (например, от комнатной температуры до 2-8°С).
Пример 6
Анализ композиций с высоким содержанием белка - концентрирование белка
Концентрации белка вычисляют в соответствии с описанием, приведенным выше в разделе ”Вещества и методы”.
Обзор концентрирования адалимумаба, антитела J695 и HSA в чистой воде и композиции с высоким содержанием белка представлен в приведенных ниже таблицах 12-14.
|
|
Таблицы 14а и 14b. Концентрации HSA, определяемые методом измерения OD280 в процессе концентрирования
|
|
Все три исследованных белка оставались растворимыми в испытанных диапазонах концентраций (то есть >200 мг/мл для адалимумаба и антитела J695, >175 мг/мл для HSA). Не было обнаружено никаких признаков нерастворимости, например, помутнения или преципитации в растворе. Результаты, полученные для адалимумаба, показывают, что в испытанном диапазоне концентраций все изоформы адалимумаба (то есть варианты лизина) оставались растворимыми при полном отсутствии преципитации. Данное наблюдение сопоставимо с результатами ионообменной хроматографии, приведенными в примере 11, которые показывают, что сумма вариантов лизина остается фактически постоянной независимо от концентрации адалимумаба.
Пример 7
Анализ композиций с высоким содержанием белка - вязкость
7.1. Вязкость адалимумаба
Вязкость адалимумаба (примерно 50 мг/мл) в воде для инъекций была равна примерно 1,5-2 мПа*с. Для адалимумаба (примерно 200 мг/мл) в воде для инъекций были определены два значения. Одно значение, определенное при помощи конического/пластинчатого реометра компании Malvern (Gemini 150), было равно примерно 6-6,5 мПа*с, в то время как другое значение (измеренное при помощи конического/пластинчатого реометра компании Anton Paar, MCR 301) было равно примерно 12 мПа*с.
Вязкость промышленно получаемой композиции адалимумаба (примерно 194 мг/мл):
К - константа капилляра
t - время, необходимое для прохождения раствора через капилляр [сек]
ν - кинетическая вязкость
η - динамическая вязкость
ρ - плотность
|
Вязкость адалимумаба в воде для инъекций (примерно 200 мг/мл) была равна примерно 12 мПа*с при измерении вискозиметром компании Anton Paar и примерно 6 мПа*с при измерении вискозиметром компании Malvern. В отличие от этого вязкость адалимумаба в промышленно получаемой композиции (примерно 194 мг/мл) была выше на 9,308 мПа*с (при измерении капиллярным вискозиметром компании Schott).
7.2. Вязкость сывороточного альбумина человека
Вязкость промышленно получаемой композиции HSA (примерно 200 мг/мл):
К - константа капилляра
t - время, необходимое для прохождения раствора через капилляр [сек]
ν - кинетическая вязкость
η - динамическая вязкость
ρ - плотность
|
Вязкость HSA в воде для инъекций (примерно 180 мг/мл):
К - константа капилляра
t - время, необходимое для прохождения раствора через капилляр [сек]
ν - кинетическая вязкость
η - динамическая вязкость
ρ - плотность
|
Вязкость HSA в воде для инъекций (примерно 180 мг/мл) была равна примерно 19,121 мПа*с. Вязкость HSA в промышленно получаемой композиции (примерно 194 мг/мл) была равна 9,308 мПа*с (при измерении капиллярным вискозиметром компании Schott).
7.3. Анализ вязкости адалимумаба и сывороточного альбумина человека (HSA)
Динамическая вязкость адалимумаба (50 мг/мл) в воде для инъекций была ниже вязкости адалимумаба (200 мг/мл) соответственно в воде для инъекций и промышленном буфере. Динамическая вязкость HSA при концентрации 180 мг/мл в воде для инъекций была примерно в шесть раз больше, чем при концентрации 200 мг/мл в промышленном буфере. Таким образом, интенсивность изменения вязкости (то есть, соответственно, увеличение и уменьшение) под воздействием чистой воды, используемой в качестве растворяющей среды, по-видимому, может зависеть от характеристик конкретного белка.
Пример 8
Анализ гидродинамических диаметров в композициях с высоким содержанием белка - фотонно-корреляционная спектроскопия (PCS)
В нижеследующем примере описан анализ гидродинамического диаметра (Dh) (z-среднее гидродинамического диаметра молекулы) разных белков в водных композициях, полученных методами DF/UF по настоящему изобретению.
8.1. Гидродинамический диаметр адалимумаба
Как показано на фиг.5 и 6, наблюдается увеличение гидродинамического диаметра (Dh) при увеличении концентрации адалимумаба. На фиг.5 показана корреляция между гидродинамическим диаметром (z-среднее) и концентрацией адалимумаба в воде для инъекций. На фиг.6 показана корреляция между гидродинамическим диаметром (пик мономера) и концентрацией адалимумаба в воде для инъекций.
Разница между значениями Dh в образце с концентрацией 23,27 мг/мл и образце с концентрацией 34,20 мг/мл существует вследствие допущения, сделанного в стандартной методике эксперимента (SOP) для измерения гидродинамического диаметра. Для образцов адалимумаба, имеющих концентрацию ≤23,27 мг/мл, измерения методом PCS выполняли, используя SOP, в которой значение вязкости образцов было принято равным 1,1 мПа*с. Для образцов адалимумаба, имеющих вязкость ≥34,20 мПа*с, использовали SOP, в которой значение вязкости образцов было принято равным 1,9 мПа*с. Известно, что на данные PCS сильное влияние оказывает заданная вязкость раствора образца, так как данные PCS основаны на беспорядочном броуновском движении образца, на которое влияет вязкость образца. Таким образом, увеличение гидродинамического диаметра с увеличением концентрации белка можно объяснить тем, что увеличивающаяся концентрация белка повышает вязкость раствора (более высокая вязкость вызывает меньшее броуновское движение и более высокие вычисленные значения Dh). Молекулы белка испытывают меньшее беспорядочное броуновское движение и, таким образом, для данной вязкости могут быть вычислены большие значения гидродинамических диаметров образцов. Значения Dh на основе z-среднего и значения Dh мономера хорошо согласуются. Кроме того, при увеличении концентрации отсутствует увеличение Dh, являющееся показателем нерастворимости белка (то есть высокомолекулярные агрегаты и преципитат (при его наличии) вызывают значительное увеличение Dh).
8.2. Гидродинамический диаметр антитела J695
На фиг.7 и 8 показано, что гидродинамический диаметр антитела J695 не зависел от концентрации белка до достижения концентрации, равной 114,52 мг/мл. Увеличение концентрации антитела J695 c 114,52 мг/мл до 133,25 мг/мл вызывало быстрое увеличение Dh. Гидродинамический диаметр при концентрации 217,53 мг/мл был больше, чем при концентрации 114,52 мг/мл. Такой результат не является удивительным, так как растворы белка измеряли, используя такую же стандартную методику эксперимента (принимая вязкость равной 1,9 мПа*с), тогда как в действительности вязкость увеличивается по мере увеличения концентрации белка. Таким образом, сильное увеличение при изменении концентрации с 114,52 мг/мл до 133,25 мг/мл можно объяснить как артефакт.
8.3. Гидродинамический диаметр сывороточного альбумина человека
Было установлено, что гидродинамический диаметр HSA в воде для инъекций уменьшается при увеличении концентрации с 9,88 мг/мл до 112,74 мг/мл. Однако при увеличении концентрации с 112,74 мг/мл до 177,69 мг/мл гидродинамический диаметр увеличивался.
Сывороточный альбумин человека (HSA) характеризовался общей тенденцией увеличения гидродинамического диаметра (пик маномера) при увеличении концентрации белка, что соответствует теоретическим принципам. Уменьшение Dh при увеличении концентрации с 9,88 мг/мл до 22,89 мг/мл было вызвано изменением SOP (переход с принятой вязкости, равной 1,1 мПа*с, на принятую вязкость, равную 1,9 мПа*с).
Числовые данные гидродинамического диаметра приведены в Приложении А.
Пример 9
Антитело J695: влияние наполнителей на гидродинамический диаметр
Установив, что белки могут растворяться в высоких концентрациях в чистой воде, исследовали влияние ионизируемых и неионизируемых наполнителей, обычно используемых в исходных композициях, на гидродинамический диаметр. Антитело J695 было использовано в качестве модели белка.
В таблице 15 показано, что осмоляльность раствора прямо пропорционально концентрации хлорида натрия. Осмоляльность в растворе белка повышается в соответствии с концентрацией NaCl (почти линейная корреляция). Интересно отметить, что гидродинамический диаметр антитела J695 увеличивался с увеличением концентрации соли. NaCl является ионным наполнителем и диссоциирует на положительно заряженные ионы натрия и отрицательно заряженные иона хлора, которые могут адсорбироваться на поверхности белка. При отсутствии соли гидродинамический диаметр антитела J695 был значительно меньше по сравнению с гидродинамическим диаметром, ожидаемым для антитела J695 (значения обычно определяют при длине волны около 10 нм).
Как показано в таблице 15, осмоляльность линейно увеличивалось с увеличением концентрации маннита в растворе белка. В отличие от этого, гидродинамический диаметр не зависел от концентрации маннита. Маннит является неионным сахарным спиртом/полиолом. Маннит или полиолы используются в качестве стабилизаторов при создании композиций для парентерального введения и в конечных композициях. Маннит стабилизирует белок путем предпочтительного вытеснения. Как и другие осмотические вещества, маннит предпочтительно вытесняется с поверхности белка и находится снаружи гидратной оболочки белка. Таким образом, стабилизируются белки со складчатой структурой, так как нескладчатая структура, которая имеет большую площадь поверхности, является менее привлекательной с точки зрения термодинамики (Foster, T.M., Thermal instability of low molecular weight urokinase during heat treatment. III. Effect of salts, sugars and Tween 80, 134 International Journal of Pharmaceutics 193 (1996); Singh, S. and Singh, J., Effect of polyols on the conformational stability and biological activity of a model protein lysoxyme, 4 AAPS PharmSciTech, Article 42 (2003)). Однако интересно отметить, что осмоляльность можно отрегулировать по желанию, что должно быть важной особенностью белков по настоящему изобретению, не влияя при этом на значение Dh белка. Данное открытие может быть использовано в высококонцентрированной белковой композиции, при получении которой могут возникнуть проблемы, связанные с вязкостью и дозировкой, так как регулирование осмоляльности маннитом не сопровождается увеличением значения Dh белка (из чего следует, что вязкость остается постоянной).
|
Пример 10
Анализ композиций с высоким содержанием белка при помощи вытеснительной хроматографии (SEC)
Для выполнения анализа методом SEC образцы адалимумаба, антитела J695 и HSA разбавляли перед введением до концентрации 2 мг/мл. Адалимумаб вводили в объеме, равном 20 мкл. Антитело J695 и HSA вводили в объеме, равном 10 мкл.
10.1. Анализ адалимумаба методом SEC
Количество мономера адалимумаба немного уменьшилось с 99,4% до 98,8% при концентрировании раствора с 9,35 мг/мл до 206,63 мг/мл. Уменьшение количества мономера связано с увеличением количества агрегата в растворе адалимумаба с 0,4% до 1,1% при концентрировании раствора, соответственно, с 23,27 мг/мл до 206,62 мг/мл. Количество фрагментов оставалось постоянным на уровне 0,1% независимо от концентрации белка (см. таблицу в Приложении В). Таким образом, адалимумаб оставался устойчивым в воде для инъекций.
Увеличение агрегации белка при повышении концентрации белка является незначительным. Аналогичная тенденция уменьшения количества мономера наблюдается при получении белка в буферной системе и при добавлении поверхностно-активных веществ. Белок адалимумаб является удивительно устойчивым при получении в чистой воде.
10.2. Анализ антитела J695 методом SEC
Количество мономера J695 немного уменьшилось с 99,4% до 98,6% при увеличении концентрации белка с 9,99 мг/мл до 217,53 мг/мл. Уменьшение количества мономера было связано с увеличением количества агрегата примерно с 0,4% до 1,2% при увеличении концентрации белка с 9,99 мг/мл до 217,53 мг/мл. Независимо от концентрации белка количество фрагментов было почти постоянным и увеличивалось с 0,17% до 0,23% при увеличении концентрации белка с 9,99 мг/мл до 217,53 мг/мл.
Увеличение агрегации белка при повышении концентрации белка является незначительным. Аналогичная тенденция уменьшения количества мономера наблюдается при получении белка в буферной системе и при добавлении поверхностно-активных веществ. Таким образом, белок J695 является удивительно устойчивым при получении в чистой воде.
10.3. Анализ сывороточного альбумина человека методом SEC
Количество мономера HSA уменьшилось с 95,9% до 92,75% при увеличении концентрации с 9,88 мг/мл до 112,74 мг/мл. Для образца с концентрацией 177,69 мг/мл было установлено увеличение количества мономера до 94,5%. Уменьшение количества мономера происходит вместе с увеличением количества агрегата белка с 4,1% до 7,25% при концентрировании с 9,88 мг/мл до 112,74 мг/мл. Таким образом, белок HSA также оказался устойчивым при получении в чистой воде.
Числовые данные, полученные при выполнении вышеописанных экспериментов методом SEC, приведены в Приложении В.
Пример 11
Анализ композиций с высоким содержанием белка - ионообменная хроматография (IEC)
Для выполнения анализа методом IEC образцы адалимумаба, антитела J695 и HSA разбавляли перед введением до 1 мг/мл. Все белки вводили в объеме, равном 100 мкл.
11.1. Анализ адалимумаба методом IEC
Как показано на фиг.9, адалимумаб был устойчив в воде для инъекций. На фиг.9 показана тенденция, которая может быть интерпретирована как свидетельство того, что сумма вариантов лизина (лизин 0, 1 и 2) уменьшается с увеличением концентрации адалимумаба в воде для инъекций. Однако процентное содержание вариантов лизина изменялось меньше чем на 0,25%.
11.2. Анализ антитела J695 методом IEC
На фиг.10 показано, что сумма пиков 1-7 антитела J695 незначительно уменьшается с увеличением концентрации антитела J695. При уменьшении суммы пиков 1-7 незначительно увеличивались кислотные и основные пики, при этом увеличение кислотных пиков было несколько более выраженным (см. фиг.11 и 12). Сумма кислотных пиков незначительно увеличивалась примерно с 10,2% до 10,6%, и сумма основных пиков увеличивалась соответственно с 0,52% до 0,59%.
Можно отметить, что при выполнении IEC не было обнаружено неустойчивости или нерастворимости композиций антитела J695 в чистой воде.
Числовые данные, полученные при выполнении вышеописанных экспериментов методом IEC, приведены в Приложении С.
Краткий обзор результатов, полученных в примерах 2-11
Первоначально существовало мнение, что перенос белков, таких как антитела, в воду для инъекций, по-видимому, должно вызывать преципитацию белка в результате концентрирования белка выше его предела растворимости в чистой воде. Вышеуказанные исследования показывают, что белки, включая антитела, не только могут быть перенесены в чистую воду для инъекций в более низких концентрациях без преципитации и достижения пределов растворимости, но и, что весьма удивительно, адалимумаб (а также два других испытанных белка) могут быть концентрированы в чистой воде до сверхвысоких концентраций выше 200 мг/мл, при помощи методов UF/DF или центрифугирования (например, оборудование TFF, устройства Vivaspin). Кроме того, весьма неожиданно было обнаружено, что опалесценция адалимумаба значительно уменьшается при получении белка в воде для инъекций. Осмоляльность контролировали для гарантии того, что буферная среда адалимумаба была полностью заменена чистой, не содержащей соли водой (то есть водой для инъекций). Кроме того, во время получения образцов для анализа выполняли процесс замораживания-оттаивания, и при выполнении анализов методами SEC и IEC фактически было установлено отсутствие неустойчивости препарата.
Получение белков, например, адалимумаба, в высоких концентрациях в воде для инъекций позволило уменьшить вязкость, которая часто препятствует прямому получению лекарственного продукта с высокими концентрациями белка.
Наконец, было установлено, что гидродинамический диаметр (измеренный при помощи фотонно-корреляционной спектроскопии, PCS) адалимумаба был значительно меньше в воде для инъекций, чем в промышленном буфере (что свидетельствует о более низкой вязкости).
Полученные данные о растворимости антител и сферической модели белка HSA в чистой воде в сверхвысоких концентрациях позволили сделать вывод о возможности нового взгляда на основополагающие характеристики белков и создания новых способов получения и приготовления белковых лекарственных средств, например, путем:
- уменьшения опалесценции высококонцентрированных белковых композиций;
- уменьшения вязкости высококонцентрированных белковых композиций;
- регулирования осмоляльности в растворах белков в воде для инъекций путем добавления неионных наполнителей, таких как маннит, без изменения таких характеристик как вязкость и отсутствие опалесценции (для антитела J695 было продемонстрировано, что гидродинамический диаметр и опалесценция не изменяются при добавлении маннита, но значительно возрастают при добавлении NaCl);
- создания нового направления получения и обработки лекарственных веществ, так как было продемонстрировано, что белки могут быть подвергнуты DF/UF для концентрирования белка в воде для инъекций до сверхвысоких концентраций, а также замораживанию и оттаиванию без значительного ухудшения устойчивости. Принимая во внимание хорошо известный факт, что во время DF/UF состав белковых композиций, особенно в процессе достижения высоких концентраций, обязательно изменяется (Stoner, M. et al., Protein-solute interactions affect the outcome of ultrafiltration/diafiltration operations, 93, J. Pharm. Sci. 2332 (2994)), новые данные могут быть успешно использованы для регулирования концентрации лекарственного вещества при помощи DF/UF белка в чистой воде и последующего добавления наполнителей при высоких концентрациях лекарственного вещества (что позволит избежать риска изменения состава лекарственного вещества во время обработки). Альтернативно наполнители могут быть добавлены к лекарственному веществу во время окончательной обработки лекарственного продукта.
Пример 12
Получение адалимумаба в водной композиции
Приведенный ниже пример иллюстрирует переход к широкомасштабному производству адалимумаба в воде методами DF/UF.
12.1. Оценка параметров процесса
В лабораторном масштабе были выполнены исследования по оценке процесса диализа для определения приемлемых параметров диализа нерасфасованного раствора лекарственного средства на основе адалимумаба в фосфат-цитратной буферной системе, содержащей другие наполнители, например, маннит и хлорид натрия (фиг.13 и 14).
Проводимость может быть измерена любым измерителем проводимости, пригодным для анализа проводимости в растворах белков, например, измерителем проводимости модели SevenMulti, с возможностью расширения в широком диапазоне рН (Mettler Toledo, Schwerzenbach, Switzerland). Прибор был использован в соответствии с инструкциями производителя (например, при замене датчика проводимости в приборе Mettler Toledo необходимо снова калибровать прибор, так как каждый датчик имеет разную постоянную ячейки; следует обратиться к инструкциям по эксплуатации измерителя проводимости модели SevenMulti). При выполнении инструкций измерения проводимости можно произвести путем прямого погружения измерительного зонда в раствор образца.
На фиг.13 показана эффективность диализа с точки зрения уменьшения количества компонентов, определяющих осмоляльность и проводимость композиции, содержащей адалимумаб в концентрации 74 мг/мл. После уменьшения количества растворенных веществ в растворе антитела в 100 раз измерения осмоляльности и проводимости стабилизировались на уровнях, которые значительно ниже первоначальных измерений указанных параметров в промышленно получаемой композиции.
На фиг.14 показана устойчивость значения рН в диализованных нерасфасованных растворах адалимумаба. Уровни рН до и после диализа в деонизированную воду (1:1000000) показаны для растворов адалимумаба в диапазоне разных исходных значений рН. Уровни рН оставались почти одинаковыми в концентрате до и после диализа.
12.2. Получение высококонцентрированного адалимумаба в нерасфасованном водном растворе лекарственного средства
На первой стадии полученный нерасфасованный раствор лекарственного средства (фосфат-цитратная буферная система, содержащая другие наполнители, например, маннит и хлорид натрия) концентрировали путем ультрафильтрации/диафильтрации до концентрации, равной примерно 100 мг/мл (12 л, 2 миниколонки Bio-A с MWCO 10000 Millipore Pellicon). На второй стадии концентрированный раствор подвергали диализу в деионизированную воду (мембрана SpectraPor7 с MWCO 10000, степень разбавления 1:100000). На третьей стадии диализованный раствор концентрировали путем ультрафильтрации/диафильтрации до концентрации около 250 мг/мл, используя 2 миниколонки Bio-A с MWCO 10000 Millopore Pellicon.
В таблице 16а приведены результаты анализа высококонцентрированного адалимумаба в нерасфасованных водных растворах лекарственного средства (подвергнутых обработке DF/UF), полученных после выполнения 3-й стадии процесса.
|
12.3. Процедура замораживания/оттаивания (F/T), имитирующая производственные условия
Замораживание производили в морозильной камере со сверхнизкими температурами (Revco Ultima II, 20 куб.футов) при производственной загрузке 47 кг жидкости, замораживаемой при температуре ниже -50°С, обычно при температуре от -70°С до -80°С. Жидкость была упакована в отдельные бутылки массой 1,6 кг (например, 2-л квадратные бутылки из PETG компании Nalgene). Замораживание заканчивалось через 48 часов. Оттаивание выполняли на водяной бане с циркуляцией воды (например, Lindergh/Blue) при производственной загрузке 24 кг и температуре в интервале от 20°С до 40°С, обычно при 30°С до полного оттаивания вещества.
12.4. Картирование бутылок во время замораживания и оттаивания
Из бутылок удаляли и анализировали отдельные горизонтальные слои раствора. При концентрациях белка 250 мг/мл и 200 мг/мл в водном растворе адалимумаба было обнаружено образование лишь минимального градиента, как показано на фиг.15-19. Замораживание и оттаивание растворов адалимумаба (растворы с фосфатно-цитратной буферной системой, содержащей другие наполнители, например, маннит и хлорид натрия) при концентрации 250 мг/мл и 200 мг/мл, однако, вызывало образование преципитата на дне бутылки.
12.5. Образование градиента в промышленно получаемых и низкоионных композициях адалимумаба
Сравнивали образование градиентов в результате замораживания-оттаивания в промышленно получаемых и низкоионных (водных) композициях адалимумаба. В таблице 16b приведены результаты визуального осмотра промышленно получаемых растворов адалимумаба в разных концентрациях после стадии замораживания-оттаивания. Образование преципитатов указывает на неустойчивость раствора, возникшую в результате замораживания-оттаивания. При концентрации выше 100 мг/мл наблюдалось значительное образование преципитата. В таблице 17 приведены аналитические данные двух растворов с концентрацией 50 мг/мл и одной низкоионной композиции с концентрацией 100 мг/мл до выполнения эксперимента по замораживанию-оттаиванию.

|
Примерно 1600 мл (растворы с концентрацией 50 мг/мл) или 800 мл (раствор с концентрацией 100 мг/мл) каждой композиции вводили в бутылки из PETG и подвергали стандартным процедурам замораживания (-80°С) и оттаивания (23°С, водяная баня). Образцы отбирали из верхней, центральной и нижней части бутылок из PETG и анализировали в отношении рН, плотности, осмоляльности и концентрации белка. Результаты анализа приведены в таблице 18.
|
В промышленно получаемой композиции адалимумаба при замораживании/оттаивании были обнаружены значительные градиенты плотности (свидетельствующие о гетерогенности/градиентах белка и наполнителей), осмоляльности (свидетельствующие о градиентах наполнителей) и содержания белка. В отличие от этого в низкоионной композиции адалимумаба с концентрацией 50 мг/мл при замораживании/оттаивании градиенты обнаружены не были.
При более высоких концентрациях белка образование градиентов иногда может быть еще больше. Однако в низкоионной композиции адалимумаба с концентрацией 100 мг/мл при замораживании/оттаивании не были обнаружены градиенты рН, плотности, осмоляльности и концентрации белка.
Пример 13
Устойчивость антитела J695 после DF/UF
В нижеследующем примере приведены данные устойчивости антитела J695 после обработки DF/UF способами по настоящему изобретению.
Образцы белка, взятые из антитела J695 в нормальном буфере для лекарственного вещества, анализировали или после регулирования рН, или после диафильтрации. Значение рН доводили до рН 4,4, добавляя 0,1 М раствор фосфорной кислоты, концентрация белка была равна 112 мг/мл. В случае концентрированных образцов в воде для инъекций образцы белка подвергали диафильтрации (DF/UF) в воду в течение примерно 1,5 дня при комнатной температуре с использованием системы TFF, оснащенной мембраной RC для 30 кДа. Концентрация белка после DF/UF была равна примерно 192 мг/мл, рН 4,7.
13.1. Экспериментальные процедуры анализа методом вытеснительной хроматографии (SEC)
Вытеснительную хроматографию выполняли для оценки чистоты антитела J695. Вытеснительная хроматография (SEC) позволяет разделить макромолекулы в соответствии с молекулярной массой. Смола служит в качестве просеивающего агента, задерживающего более мелкие молекулы в порах смолы и пропускающего более крупные молекулы через колонку. Время удерживания и разрешение зависят от размера пор выбранной смолы.
Каждый образец разбавляли до 2,5 мг/мл очищенной водой (Milli-Q) в зависимости от указанной концентрации. 50 мкл каждого образца вводили в колонку в виде двух одинаковых образцов. Для разделения использовали колонку для SEC G3000swx1 Tosoh Bioscience, 7,8 мм × 30 см, 5 мкм (№ по каталогу 08541). В качестве буфера А использовали 211 мМ Na2SO4/92 мМ Na2HPO2, рН 7,0. Обнаружение производили при длине волны 280 нм и 214 нм. Колонку использовали при комнатной температуре со скоростью потока 0,3 мл/мин.
В процессе хроматографирования использовали изократический градиент со 100% растворителем подвижной фазы А в течение 50 минут.
13.2. Данные вытеснительной хроматографии (SEC)
В таблице 19 приведены данные, полученные в результате выполнения экспериментов при помощи вытеснительной хроматографии.
|
13.3. Заключение по анализу методом SEC
Данные, приведенные в таблице 19, показывают, что промышленно получаемая композиция антитела J695 (PFS лекарственного вещества, рН 4,4) характеризуется такими же уровнями фрагментов и агрегата, что и эталон антитела J695. Было выявлено различие в количестве агрегата между контрольной промышленно получаемой композицией антитела J695 и антителом J695, которое было подвергнуто DF/UF в воде (лекарственное вещество в Н2О, рН 4,7, 192 мг/мл): наблюдалось увеличение агрегации с 0,4% до 0,7%. Данное увеличение является незначительным и могло возникнуть вследствие нахождения при комнатной температуре во время выполнения UF/DF. Количество фрагментов не изменилось.
13.4. Экспериментальная процедура анализа методом IEC (WCX-10)
Катионообменную хроматографию выполняли для оценки гетерогенности антитела J695 с использованием колонки WCX-10 Dionex. Катионообменная хроматография позволяет разделить изоформы белка в соответствии с кажущейся изоэлектрической точкой (pI) и взаимодействием поверхностного заряда со смолой. Представляющий интерес белок связывают с колонкой в специфических исходных условиях с низким содержанием соли и элюируют из колонки, увеличивая градиент концентрации соли. Белки с более низкой кажущейся изоэлектрической точкой слабее связываются с катионообменной колонкой и элюируются первыми, а белки с более высокой кажущейся изоэлектрической точкой связываются сильнее и элюируются последними.
Катионообменную хроматографию с использованием колонки WCX-10 выполняли для контроля качества в виде анализа годности партии. Условия анализа были изменены для лучшего разделения известных изоформ антитела J695.
Образец разбавляли до концентрации 1,0 мг/мл очищенной водой (Milli-Q). Эталон анализировали для сравнения в виде трех одинаковых образцов и разбавляли до концентрации 1 мг/мл очищенной водой (Milli-Q).
Для разделения изоформ использовали колонки WCX-10 Dionex Propac (№ 054993) вместе с соответствующими защитными колонками (№ 054994). Буферы, использованные при выполнении данного анализа, включали буфер А (10 мМ Na2HPO4, рН=6,0) и буфер В (10 мМ Na2HPO4, 500 мМ NaCl, рН=6,0). Колонка находилась при температуре 35°С, и скорость потока была равна 1 мл/мин. Вводимые объемы были равны 100 мкл для 100 мкг загрузки, и обнаружение производили при длине волны 280 нм. Градиенты буферов, создаваемые в процессе хроматографического разделения, приведены в таблице 20.
|
13.5. Данные IEC
В таблице 21 приведены результаты экспериментов по сравнению эталона J695 с антителом J695 в промышленном буфере (лекарственное вещество, рН 4,4), а также по сравнению композиции, содержащей промышленный буфер, с антителом J695 после обработки DF/UF (DF/UF в воде, рН 4,7).
|
13.6. Заключение по анализу методом IEC
Были выявлены некоторые различия между эталоном антитела J695 и промышленно получаемой композицией (лекарственное вещество, рН 4,4). Указанные различия были обнаружены в первоначальном испытании образца лекарственного вещества и были отнесены за счет различий в производственных процессах компаний 3000L и 6000L. Не было выявлено различий между контрольным лекарственным веществом, рН 4,4 и антителом J695 в Н2О, рН 4,7, в виде образца с концентрацией 192 мг/мл.
Пример 14
Устойчивость адалимумаба после DF/UF и длительного хранения при 2-8°С
В нижеследующем примере приведены данные, показывающие устойчивость адалимумаба в водной композиции, полученной способами по настоящему изобретению, после хранения в течение 22,5 месяца при 2-8°С.
Образцы адалимумаба, предназначенные для анализа методом SEC и в колонке WCX-10, подвергали диафильтрации в воду и концентрировали примерно до 177 мг/мл. Образцы хранили и анализировали на устойчивость в разные периоды времени.
Стандартный раствор адалимумаба (лекарственное вещество, рН примерно 5,2) в промышленном буфере для антитела гумира был использован в качестве исходного вещества для получения концентрированного раствора в воде. Образцы раствора белка подвергали диафильтрации (DF/UF) в воду в течение примерно 1,5 дня при комнатной температуре, используя систему TFF, оснащенную мембраной RC 30 кДа. Концентрация белка после DF/UF была равна примерно 177 мг/мл, рН 5,2. Образец хранили при 2-8°С в течение 22,5 месяца до выполнения анализа.
14.1. Экспериментальная процедура анализа методом SEC
Вытеснительную хроматографию выполняли для проверки наличия фрагментов и агрегатов антитела. Вытеснительная хроматография (SEC) позволяет разделить макромолекулы в соответствии с молекулярной массой. Смола служит в качестве просеивающего агента, задерживающего более мелкие молекулы в порах смолы и пропускающего более крупные молекулы через колонку. Время удерживания и разрешение зависят от размера пор выбранной смолы.
Каждый образец разбавляли до концентрации 1,0 мг/мл водой Milli-Q и вводили в колонку 50 мкг каждого образца. Для выполнения вытеснительной ВЭЖХ использовали колонку Sephadex 200 (№ по каталогу Pharmacia 175175-01, S/N 0504057) или гель TSK G3000SW (№ по каталогу 08541; для анализа образцов, хранившихся в течение 22,5 месяца). Подвижная фаза колонки состояла из 20 мМ фосфата натрия и 150 мМ хлорида натрия, рН 7,5. Обнаружение производили при длине волны 280 нм и 214 нм. Колонки находились при комнатной температуре, и скорость потока была равна 0,5 мл/мин (колона Sephadex) или 0,3 мл/мин (колонка TSK).
14.2. Данные SEC
На фиг.20 и в таблице 22 приведены результаты анализа низкоионного раствора адалимумаба, хранившегося в виде жидкости при 2-8°С в течение 8,5 месяца, по сравнению с таким же раствором, хранившимся при -80°С. В таблице 23 приведены данные анализа для низкоионного раствора адалимумаба, хранившегося при 2-8°С в течение 22,5 месяца, по сравнению с эталонным образцом адалимумаба.
|
|
Как видно из таблицы 22, анализ методом SEC показал, что адалимумаб в воде оставался устойчивым даже после хранения в течение 9 месяцев при 2-8°С или в течение 4,5 месяца при -80°С, при этом процентное содержание агрегата (% высокомолекулярной фракции) и процентное содержание фрагментов (% низкомолекулярной фракции) было минимальным в течение всего времени.
14.3. Заключение по анализу методом SEC
После хранения в течение 8,5 месяца при 2-8°С в растворе адалимумаба (DF/UF в воду) была обнаружена небольшая фракция высокомолекулярного (HMW) вещества (0,2%) и небольшая фракция фрагментов (0,3%). Хранение в течение 4,5 месяца при -80°С и последующее оттаивание (водяная баня, 23°С) не повлияли на устойчивость адалимумаба (0,1% агрегата, 0,3% фрагментов).
Анализ образца, хранившегося в течение 22,5 месяца при 2-8°С, также позволил выявить количество фрагментов, сравнимое с эталоном адалимумаба (таблица 23). Однако уровни агрегата в образце, хранившемся в течение 22,5 месяца, (1,66%) был несколько выше уровня агрегата, обнаруженного в эталоне.
Известно, что самоассоциация антител в значительной степени зависит от концентрации антител, то есть образование агрегата с нековалентными связями и ассоциированных комплексов является наиболее выраженным при высоких концентрациях белка. Указанная самоассоциация является обратимой, и разбавление буферным раствором уменьшает самоассоциацию (Liu, J. et al., 94 Journal of Pharmaceutical Sciences 1928 (2004)).
Таким образом, причиной разного содержания агрегата в образцах, хранившихся в течение 8,5 месяца и 9 месяцев, возможно, являются различия в получении образцов и разное время задержки между разбавлением раствора адалимумаба (с 177 мг/мл до 1 мг/мл) и последующим анализом образцов при помощи SEC.
14.4. Экспериментальная процедура анализа методом IEC
Катионообменную хроматографию выполняли для оценки гетерогенности заряда антитела с использованием колонки WCX-10 Dionex. Катионообменная хроматография позволяет разделить изоформы белка в соответствии с кажущейся изоэлектрической точкой (pI) и взаимодействием поверхностного заряда со смолой. Представляющий интерес белок связывают с колонкой в специфических исходных условиях с низким содержанием соли и элюируют из колонки, увеличивая градиент концентрации соли. Белки с более низкой кажущейся изоэлектрической точкой слабее связываются с катионообменной колонкой и элюируются первыми, а белки с более высокой кажущейся изоэлектрической точкой связываются сильнее и элюируются последними.
До выполнения анализа образцы разбавляли до концентрации 1,0 мг/мл водой Milli-Q. Для разделения изоформ использовали колонки WCX-10 Dionex Propac (№ 054993) вместе с соответствующими защитными колонками (№ 054994). Были получены два буфера для подвижной фазы, содержащие 10 мМ фосфата натрия, рН 7,5 (буфер А) и 10 мМ фосфата натрия, 500 мМ хлорида натрия, рН 5,5 (буфер В). Колонки находились при комнатной температуре, и скорость потока была равна 1,0 мл/мин. Вводимые объемы были равны 100 мкл для 100 мкл загрузки, и обнаружение производили при длине волны 280 нм. Градиенты буферов, создаваемые в процессе хроматографического разделения, приведены в таблице 24.
|
14.5. Данные ионообменной хроматографии
В таблице 25 приведены данные ионообменной хроматографии для эталона адалимумаба, промышленно получаемой композиции (150 мг/мл) и низкоионного раствора после обработки DF/UF, полученные перед хранением. В таблице 26 приведены данные для эталона в сравнении с низкоионным раствором после хранения в течение 22,5 месяца при 2-8°С.
|
|
14.6. Заключение по анализу методом ионообменной хроматографии
Данные, полученные для образцов в момент времени Т0, свидетельствуют об отсутствии существенных различий в процентном содержании кислотной области 1, 2, лизина 0, лизина 1 или лизина 2 (то есть гетерогенности заряда) между эталоном адалимумаба, промышленно получаемой композицией адалимумаба (использованной в качестве лекарственного вещества для получения адалимумаба в воде методом DF/UF) и адалимумабом, подвергнутым диафильтрации в воду и концентрированным до 177 мг/мл (таблица 25).
Кроме того, после хранения в течение 22,5 месяца образца адалимумаба в воде с концентрацией 177 мг/мл можно было обнаружить лишь незначительные различия в содержании фракций лизина 0, лизина 1 и лизина 2 по сравнению с эталоном адалимумаба. Таким образом, не было обнаружено значительной химической неустойчивости при получении адалимумаба в воде методом DF/UF и хранении в течение 22,5 месяца при 2-8°С с концентрацией 177 мг/мл.
Пример 15
Устойчивость низкоионного раствора антитела 1D4.7 при замораживании/оттаивании
Антитело 1D4.7 (иммуноглобулин G1) против IL-12/IL-23, полученное в воде путем диализа (с использованием кассет slide-a-lyzer в соответствии с инструкциями по эксплуатации производителя, Pierce, Rockford, IL), оставалось устойчивым в процессе повторного замораживания/оттаивания (-80°С/25°С, водяная баня) с концентрацией 2 мг/мл, рН 6, при этом было установлено, что устойчивость антитела 1D4.7, полученного в воде, выше устойчивости антитела 1D4.7, полученного стандартным методом с использованием буферных систем (например, 29 мМ гистидина, 20 мМ глицина, 10 мМ фосфата, 10 мМ цитрата), и даже выше устойчивости препаратов антитела 1D4.7, полученных на основе универсального буфера (10 мМ фосфата, 10 мМ цитрата) с разными наполнителями, обычно используемыми в белковой композиции, например, 10 мг/мл маннита, 10 мг/мл сорбита, 10 мг/мл сахарозы, 0,01% полисорбата 80, 20 мМ NaCl.
SEC, DLS и подсчет частиц выполняли для проверки устойчивости белка, при этом подсчет частиц производили, используя систему подсчета частиц в диапазоне измерения 1-200 мкм (например, счетчик частиц Model Syringe, Markus Klotz GmbH, Bad Liebenzell, Germany). Ниже приведено подробное описание эксперимента:
- антитело 1D4.7, полученное в воде по сравнению с вышеуказанными композициями;
- 4 цикла замораживания/оттаивания;
- 30-мл контейнер из полиэтилентерефталат-гликоля (PETG), заполняемый примерно 25 мл, 2 мг/мл, рН 6;
- отбор проб в моменты времени Т0, Т1 (то есть после одной стадии замораживания/оттаивания), Т2, Т3 и Т4;
- аналитическая часть: визуальный осмотр, SEC, DLS, измерение невидимых частиц.
На фиг.21 показана устойчивость антитела 1D4.7 во время повторных циклов замораживания/оттаивания (-80°С/25°С), определяемая с учетом образованием невидимых частиц >1 мкм. Антитело 1D4.7 было получено в универсальном буфере (10 мМ цитрата, 10 мМ фосфата), после чего были испытаны следующие варианты наполнителей: сорбит (10 мг/мл), маннит (10 мг/мл), сахароза (10 мг/мл), NaCl (100 мМ) и полисорбат 80 (0,01%). Антитело 1D4.7 было также получено в воде (путем диализа) без добавления наполнителей. Воду для инъекций также подвергали циклам замораживания/оттаивания, и выполняли испытание на образование невидимых частиц для оценки потенциального влияния способа обработки вещества, замораживания/оттаивания и отбора образцов на содержание частиц.
Устойчивость антитела 1D4.7, полученного в воде, при замораживании/оттаивании была выше устойчивости растворов антитела 1D4.7, полученных с использованием наполнителей, обычно применяемых в белковых композициях. Известно, что маннит, сахароза и сорбит действуют в качестве лиопротекторов и/или криопротекторов, и полисорбат 80 является неионным наполнителем, используемым главным образом для повышения физической стойкости белков, испытывающих воздействие на поверхностях раздела между гидрофильной и гидрофобной фазами, таких как воздух-вода и лед-вода. Таким образом, растворы антитела 1D4.7, полученные в воде, являются устойчивыми при анализе другими методами (например, SEC, визуальный осмотр и т.д.).
Пример 16
Устойчивость низкоионного раствора антитела 13С5.5 при замораживании/оттаивании
Антитело 13С5.5 против IL-13, полученное в воде, оставалось устойчивым во время повторного процесса замораживания/оттаивания (-80°С/25°С, водяная баня) с концентрацией 2 мг/мл, рН 6. Полученные данные сравнивали со стандартными композициями (2 мг/мл, рН 6), при этом было установлено, что устойчивость антитела 13С5.5, полученного в воде, была выше устойчивости антитела 13С5.5, полученного в стандартных буферных системах (например, 20 мМ гистидина, 20 мМ глицина, 10 мМ фосфата, 10 мМ цитрата), и даже выше устойчивости композиций антитела 13С5.5 на основе универсального буфера (10 мМ фосфата, 10 мМ цитрата), содержащих разные наполнители, которые обычно используются в белковой композиции (например, 10 мг/мл маннита, 10 мг/мл сорбита, 10 мг/мл сахарозы, 0,01% полисорбата 80, 20 мМ NaCl, 200 мМ NaCl).
Получение образцов, экспериментальную обработку, отбор и анализ образцов выполняли аналогично описанию, приведенному в примере 15 для антитела 1D4.7.
- Антитело 13С5.5, полученное в воде, сравнивали с вышеуказанными композициями;
- 4 цикла замораживания/оттаивания;
- 30-мл контейнер из полиэтилентерефталат-гликоля (PETG);
- 2 мг/мл, рН 6;
- отбор проб в моменты времени Т0, Т1, Т2 и Т4;
- аналитическая часть: визуальный осмотр, SEC, DLS, измерение невидимых частиц.
На фиг.22 показана устойчивость антитела 13С5.5 во время повторных циклов замораживания/оттаивания (-80°С/25°С), определяемая с учетом образования невидимых частиц >10 мкм. Антитело 13С5.5 было получено в 10 мМ фосфатного буфера, 10 мМ цитратного буфера, 20 мМ глицинового буфера и 20 мМ гистидинового буфера. Антитело 13С5.5 было также получено в воде (путем диализа) без добавления наполнителей. Воду для инъекций также подвергали циклам замораживания/оттаивания и выполняли испытание на образование невидимых частиц для оценки потенциального влияния способа обработки вещества, замораживания/оттаивания и отбора образцов на содержание частиц (контрольный образец).
Устойчивость антитела 13С5.5, полученного в воде, при замораживании/оттаивании была выше устойчивости растворов антитела 13С5.5, полученных в буферах, обычно используемых в белковых композициях. В растворах антитела 13С5.5, полученных в воде, не было обнаружено неустойчивости при исследовании другими аналитическими методами (например, SEC, визуальный осмотр и т.д.).
На фиг.23 показана устойчивость антитела 13С5.5 во время повторных циклов замораживания/оттаивания (-80°С/25°С), определяемая с учетом образования невидимых частиц >1 мкм. Антитело 13С5.5 было получено в универсальном буфере (10 мМ цитрата, 10 мМ фосфата), после чего были подвергнуты испытанию следующие варианты наполнителей: сорбит (10 мг/мл), маннит (10 мг/мл), сахароза (10 мг/мл), NaCl (200 мМ), NaCl (20 мМ) и полисорбат 80 (0,01%). Антитело 13С5.5 было также получено в воде (путем диализа) без добавления наполнителей и использовано для сравнения (чистая вода). Воду для инъекций также подвергали циклам замораживания/оттаивания и выполняли испытание на образование невидимых частиц для оценки потенциального влияния способа обработки вещества, замораживания/оттаивания и отбора образцов на содержание частиц.
Устойчивость антитела 13С5.5, полученного в воде, при замораживании/оттаивании была выше устойчивости растворов антитела 13С5.5, полученных с использование наполнителей, обычно применяемых в белковых композициях. Известно, что маннит, сахароза и сорбит действуют в качестве лиопротекторов и/или криопротекторов, и полисорбат 80 является неионным наполнителем, используемым главным образом для повышения физической стойкости белков, испытывающих воздействие на поверхностях раздела между гидрофильной и гидрофобной фазами, таких как воздух-вода и лед-вода.
Устойчивость растворов антитела 13С5.5, полученных в воде, была подтверждена другими аналитическими методами (например, SEC, визуальный осмотр и т.д.).
Анализ методом DLS растворов антитела 13С5.5 после замораживания/оттаивания выполняли аналогично приведенному выше описанию. Раствор антитела 13С5.5 с 0,01% твина 80 содержал значительное количество высокомолекулярных (HMW) агрегатных форм уже после первой стадии замораживания/оттаивания, в то время как антитело 13С5.5 в воде не содержало высокомолекулярных агрегатных форм даже после 3 стадий замораживания/оттаивания.
Пример 17
Влияние показателя рН раствора на адалимумаб в воде для инъекций
Нижеследующие эксперименты были выполнены для определения влияния показателя рН раствора на физико-химические характеристики высококонцентрированного адалимумаба, полученного в воде для инъекций. Были испытаны следующие концентрации: 2 мг/мл, 50 мг/мл, 100 мг/мл, 150 мг/мл, 200 мг/мл и 250 мг/мл.
Вещества
- Лекарственное вещество (DS) адалимумаба, промышленно получаемое вещество;
- Водяная баня (с циркуляцией воды) с температурой 25°С, используемая для оттаивания;
- Оборудование для диафильтрации: Sartorius Sartocon Slice, мембрана: PES, 50 кДа, 1000 см2;
- Оборудование для диафильтрации: система TFF Millipore Labscale™, мембрана: PLCTK, 30 кДа, регенерированная целлюлоза, размер: 50 см2;
- Центрифуга Eppendorf 5810 R;
- Контейнер Amicon Ultra-15 для центрифугирования, Ultracel-30k, регенерированная целлюлоза, MWCO 30000;
- Millex GV 0,22 мкм, мембрана Miilipore для стерилизации образцов фильтрованием;
- Контейнер для образцов (контейнер для образцов Eppendorf 1,5 мл, криоампулы Roth 5 мл, бутылка из полиэтилентерефталат-гликоля (PETG), 125 мл);
Аналитическая часть:
- измерение рН при помощи устройства Biothrode;
- измерение плотности;
- измерение осмоляльности;
- УФ/VIS спектрофотометр для измерения концентрации белка;
- фотонно-корреляционная спектроскопия (PCS);
- измерение вязкости;
- измерение мутности;
- вытеснительная хроматография (SEC);
- инфракрасная спектроскопия с преобразованием Фурье (FT-M-IR).
17.1. Обзор подготовки к выполнению DF/UF промышленно получаемой композиции адалимумаба
Раствор лекарственного вещества адалимумаба (120 мг/мл) делили на 7 объемных порций, которые доводили до рН 3, рН 4, рН 5, рН 6, рН 7, рН 8, рН 9, добавляя соответственно 0,25 н. раствор NaOH и 0,25н раствор HCl. Затем образцы разбавляли буфером для адалимумаба с соответствующим значением рН до 100 мг/мл. В растворах появилось небольшое помутнение, которое исчезло после стерилизации фильтрованием (0,22 мкм, стерилизующий фильтр из PVDF). Значение рН снова проверяли после разбавления (см. приведенную ниже таблицу 27).
Из каждого раствора отбирали следующие образцы растворов с концентрацией 100 мг/мл:
- 4 мл для измерения мутности и последующего измерения зета-потенциала;
- 1 мл для измерения вязкости (при помощи вискозиметра с падающим шариком);
- 0,15 мл для измерения осмоляльности;
- 2 мл для измерения плотности;
- 0,15 мл для PCS (с учетом вязкости образца);
- 1 мл для FT-M-IR;
- 2 мл для измерений вязкости и статического рассеяния света.
Образцы, предназначенные для измерения зета-потенциала, вязкости и статического рассеяния света, замораживали (-80°С). Остальные объемы растворов с рН 4, рН 5, рН 6, рН 7 и рН 8 подвергали диафильтрации в непрерывном режиме с использованием воды для инъекций в качестве обменной среды. Образцы сначала замораживали при -80°С. Перед выполнением DF/UF образцы оттаивали при 25°С на водяной бане Julabo.
17.2. Методы DF/UF и концентрирования
Растворы адалимумаба в промышленно получаемой композиции с концентрацией 100 мг/мл, рН 4, 5, 6, 7 и 8, подвергали обработке DF/UF и затем концентрировали путем ультрафильтрации (UF) в центрифуге. В данном разделе в качестве примера описан процесс обработки раствора адалимумаба с рН 6. Другие растворы обрабатывали аналогичным образом.
Раствор адалимумаба (100 мг/мл, рН 6) оттаивали на водяной бане при 25°С и гомогенизировали. Затем раствор подвергали диафильтрации, используя воду для инъекций в качестве обменной среды, в оборудовании TFF М.Р.33.4 при следующих заданных параметрах:
- мешалка: скорость 2;
- насос: скорость 1;
- давление подаваемого потока/на входе: 2-2,4 бара;
- давление отводимого потока/на выходе: 0,6-0,8 бара;
- мембрана: регенерированная целлюлоза, отсечение вещества с молекулярной массой 30 кДа;
- выполнение DF/UF в непрерывном режиме;
- примерно 6-кратный объемный обмен во время выполнения DF/UF.
После достижения 6-кратного объемного обмена определяли концентрацию адалимумаба, измеряя фотометром М.Р.9.7 оптическую плотность при длине волны 280 нм (OD280). Проверяли осмоляльность фильтрата и концентрата.
концентрация: 125,1 мг/мл
осмоляльность фильтрата: 57 мОсмоль/кг
осмоляльность концентрата: 12 мОсмоль/кг
Раствор адалимумаба в воде после выполнения диафильтрации (DF) разбавляли водой для инъекций до концентрации 100 мг/мл и стерилизовали фильтрованием. Из раствора с концентрацией 100 мг/мл после выполнения DF/UF были отобраны следующие образцы:
- 4 мл для измерения мутности и последующего измерения зета-потенциала;
- 1 мл для измерения вязкости;
- 0,15 мл для измерения осмоляльности;
- 2 мл для измерения плотности;
- 0,15 мл для PCS (с учетом вязкости образца);
- 0,15 мл для SEC;
- для измерения рН;
- 1 мл для FT-M-IR;
- 2 мл для измерений вязкости и статического рассеяния света.
Порцию раствора адалимумаба с концентрацией 100 мг/мл разбавляли водой для инъекций, получая при этом растворы с концентрацией 50 мг/мл и 2 мг/мл. Из обоих растворов были отобраны следующие образцы:
- 4 мл для измерения мутности и последующего измерения зета-потенциала;
- 2 мл для измерения вязкости;
- 0,15 мл для измерения осмоляльности;
- 2 мл для измерения плотности;
- 0,15 мл для PCS (с учетом вязкости образца);
- для измерения рН.
Растворы адалимумаба (рН 6, 100 мг/мл) в воде концентрировали путем центрифугирования. Центрифугирование выполняли в центрифуге Eppendorf (5810R M.P.33.57). Каждую стадию центрифугирования выполняли в течение 15 минут со скоростью 4000 об/мин. Затем раствор образца гомогенизировали в концентраторе центрифуги путем осторожного переворачивания для гомогенизации раствора и во избежание образования геля в местах, непосредственно прилегающих к мембране. Температура во время концентрирования была равна 15°С. Раствор центрифугировали до достижения концентрации около 250 мг/мл. Концентрацию определяли фотометром М.Р.9.7, измеряя оптическую плотность при длине волны 280 нм (OD280). Растворы адалимумаба разбавляли до концентраций 250 мг/мл, 200 мг/мл и 150 мг/мл.
После концентрирования и выполнения каждой отдельной стадии разбавления отбирали следующие образцы. Из растворов с концентрацией 250 мг/мл и 150 мг/мл отбирали образцы в следующих объемах:
- 2 мл для измерения вязкости;
- 0,15 мл для PCS (с учетом вязкости);
- 0,15 мл для измерения осмоляльности;
- 0,15 мл для SEC;
- для измерения рН.
Из раствора с концентрацией 200 мг/мл отбирали образцы в следующих объемах:
- 4 мл для измерения мутности и последующего измерения зета-потенциала;
- 1 мл для измерения вязкости;
- 0,15 мл для измерения осмоляльности;
- 2 мл для измерения плотности;
- 0,15 мл для PCS (с учетом вязкости образца);
- 0,15 мл для SEC;
- для измерения рН;
- 2 мл для анализов, выполняемых в устройстве АВС (измерения вязкости и статического рассеяния света).
Раствор адалимумаба в воде прекращали концентрировать при достижении концентрации около 250 мг/мл при каждом значении рН, так как вязкость раствора адалимумаба в воде при более высоких концентрациях и особенно при значениях рН, близких к pI (для адалимумаба значение рН равно примерно 8,5) существенно увеличивалась (вязкость приближалась к образованию геля).
17.3. Визуальный осмотр растворов адалимумаба
После выполнения DF/UF и концентрирования до 250 мг/мл растворы адалимумаба в воде при разных значениях рН казались менее опалесцентными, чем раствор адалимумаба в буфере (промышленно получаемая композиция). Все растворы адалимумаба выглядели как прозрачные растворы при всех значениях рН. Ни в одном из растворов адалимумаба не была обнаружена опалесценция после разбавления. Во время концентрирования и разбавления в растворах адалимумаба в воде отсутствовала преципитация.
17.4. Вязкость
Измерения вязкости выполняли с учетом плотности растворов адалимумаба при рН 5 и соответствующих концентрациях. Был использован вискозиметр с падающим шариком. Вязкости выше 200 мПа·с измеряли при помощи капиллярного вискозиметра.
На фиг.24 показаны данные вязкости растворов адалимумаба в воде при рН в диапазоне от 4 до 8 при разных концентрациях (от 2 мг/мл до 250 мг/мл, при концентрировании с увеличением концентрации на 50 мг/мл). Существует четкая корреляция между значением рН раствора, концентрацией и вязкостью. Вязкость увеличивается с увеличением концентрации белка независимо от значения рН раствора. Увеличение вязкости растворов было наиболее выраженным при значениях рН раствора, близких к изоэлектрической точке (pI) адалимумаба, (то есть рН 7 и рН 8) особенно при более высоких концентрациях белка (то есть 200 мг/мл, 250 мг/мл).
17.5. Мутность
Как показано на фиг.25, аналогичная тенденция была характерна для данных мутности (то есть мутность увеличивалась с увеличением концентрации и увеличением значения рН). Все образцы стерилизовали фильтрованием (0,22 мкм) до измерения мутности.
17.6. Гидродинамический диаметр (PCS)
Измерения при помощи фотонно-корреляционной спектроскопии (PCS) выполняли с учетом вязкости каждого образца, при каждой концентрации и каждом значении рН. Растворы с концентрацией 200 мг/мл и 250 мг/мл подвергали измерению, но полученные данные выходили за пределы испытательных параметров оборудования наносерии Zetasizer (Malvern Instruments), поэтому данные, полученные в результате указанных измерений, не анализировали.
Было установлено, что гидродинамический диаметр (Dh) заметно уменьшается при получении адалимумаба в воде (Dh около 2 нм при 50 мг/мл, рН 5) по сравнению с адалимумабом в промышленно получаемой композиции (Dh около 7 нм). На фиг.26 показаны данные PCS (также приведены в таблице 39). Таблицы с соответствующими данными приведены ниже в разделе 17.11.
Как показано на фиг.26, в растворах со значениями рН 4, 5 и 6 гидродинамический диаметр мономера адалимумаба постоянно уменьшался с увеличением концентрации белка. В отличие от этого в растворах со значениями рН, близкими к изоэлектрической точке (pI) адалимумаба (то есть при рН 7 и рН 8) наблюдалось значительное увеличение Dh при увеличении концентрации с 2 мг/мл до 50 мг/мл. Однако при увеличении концентрации выше 50 мг/мл в растворах с рН 7 и 8 гидродинамический диаметр (Dh) уменьшался. При концентрации 150 мг/мл все растворы имели более низкие значения Dh, чем растворы с соответствующим значением рН при 2 мг/мл. На фиг.27 показано распределение Dh по размерам в растворах с рН 5 и разными концентрациями. На фиг.28 показано распределение Dh по размерам для пяти растворов адалимумаба, полученных в воде, которые содержали белок в концентрации 100 мг/мл и имели разные значения рН. На фиг.29 приведены данные, аналогичные данным, показанным на фиг.28, за исключением того, что пять растворов адалимумаба были получены в буфере.
17.7. Измерение рН
Значение рН растворов измеряли при концентрации 100 мг/мл до и после выполнения DF/UF с использованием воды (то есть при получении адалимумаба соответственно в буфере и воде). Результаты приведены в таблице 27. Значения рН остаются постоянными при рН 5, рН 6 и рН 7 до и после выполнения DF/UF. Значение рН раствора не изменяется при замене среды. Значение рН при рН 4 немного увеличивалось и при рН 8 немного уменьшалось после выполнения DF/UF с использованием воды.
|
17.8. Измерения осмоляльности
Во время выполнения DF/UF образцов растворов с рН 5 после каждого объемного обмена (то есть после получения 100 мл фильтрата, 200 мл фильтрата и т.д.) измеряли осмоляльность раствора, чтобы проверить, является ли 5-кратный объемный обмен достаточным для уменьшения осмоляльности до значений ниже 15 мОсмоль/кг. Результаты приведены в таблице 28.
|
При значениях рН 4, рН 6, рН7 и рН 8 осмоляльность измеряли только в конце процесса DF/UF. В таблице 29 приведены результаты осмоляльности (в единицах мОсмоль/кг) для каждого значения рН.
|
Осмоляльность измеряли в вискозиметре при температуре замерзания.
17.9. Фрагментация (SEC)
Данные SEC свидетельствуют об относительно выраженной фрагментации белка в растворах с рН 4 во всем диапазоне концентраций (100-250 мг/мл), при этом фрагментация почти полностью отсутствовала при рН 5-8 в том же диапазоне концентраций. Поэтому содержание мономера в растворах с рН 4 уменьшилось соответствующим образом (фиг.30). Было установлено, что количество агрегата увеличивается с увеличением значений рН (с рН 4 до рН 8) независимо от концентрации (фиг.31).
17.10. Заключение
Указанный эксперимент был выполнен для проверки влияния значения рН и концентрации белка в растворе на вязкость и гидродинамический диаметр (Dh) растворов адалимумаба, полученных в воде методом DF/UF. Такие растворы определяются как низкоионные растворы. Показатель рН оценивали в пределах 4-8, и концентрации белка испытывали в диапазоне от 2 до 250 мг/мл.
В отношении вязкости (раздел 17.4) было установлено, что низкоионные растворы адалимумаба имеют такие же характеристики, что и растворы адалимумаба, полученные в присутствии ионов (то есть ионных наполнителей, таких как органические буферные компоненты или соли):
- чем выше концентрация белка, тем больше вязкость раствора. Такая корреляция концентрации-вязкости была больше выражена в растворах со значениями рН, близкими к изоэлектрической точке (pI) адалимумаба (то есть рН 7 и рН 8). И, наоборот, в растворах с постоянной концентрацией вязкость зависела от близости значения рН раствора к изоэлектрической точке (pI) адалимумаба.
Относительно данных DLS (раздел 17.6) можно сделать следующий вывод:
- Значения Dh адалимумаба, полученные методом DLS в низкоионных растворах адалимумаба, ниже, чем значения Dh, измеренные в промышленно получаемых композициях адалимумаба, особенно при очень низком значении рН раствора.
- Чем ниже значение рН раствора, тем ниже значения Dh, измеренные методом DLS.
- Чем выше концентрация белка, тем ниже значения Dh в низкоионных растворах адалимумаба при данном значении рН.
Подобное поведение можно объяснить тем, что ионная сила (то есть присутствие ионов и ионизируемых наполнителей) в растворах белка имеет важное значение для взаимодействия между белками. Отталкивание зарядов является более выраженным в низкоионных растворах адалимумаба при более низких значениях рН раствора. При получении белка в воде, используемой в качестве обменной среды при выполнении DF/UF, количество присутствующих ионизируемых противоионов, которые могут образовывать слой Гельмгольца и слой Гоуи-Чапмана, значительно уменьшается. Поэтому межмолекулярные взаимодействия зарядов (вследствие наличия зарядов аминокислотных остатков на поверхности белка) могут быть более выраженными, чем в среде, где имеется большое количество ионизируемых противоионов (то есть ионизируемых наполнителей), при этом отталкивание зарядов между мономерами белка (ведущее к движению молекул в случае отталкивания зарядов) и беспорядочное броуновское движение способствуют подвижности/движению молекулы белка, измеряемой при помощи DLS. В экспериментах по измерению DLS большая подвижность молекул определяется более высокими коэффициентами диффузии молекул, которые обычно присваиваются молекулам с меньшими гидродинамическими размерами при использовании уравнения Стоукса-Эйнштейна. Таким образом можно объяснить, почему гидродинамический диаметр белков уменьшается в низкоионных композициях.
Взаимодействия зарядов могут вызывать отталкивание молекул антител (при более низком значении рН раствора) или притяжение (при более высоком значении рН раствора, близком к изоэлектрической точке белка).
17.11. Таблицы с данными
|
|
|
|
|
|
|
|
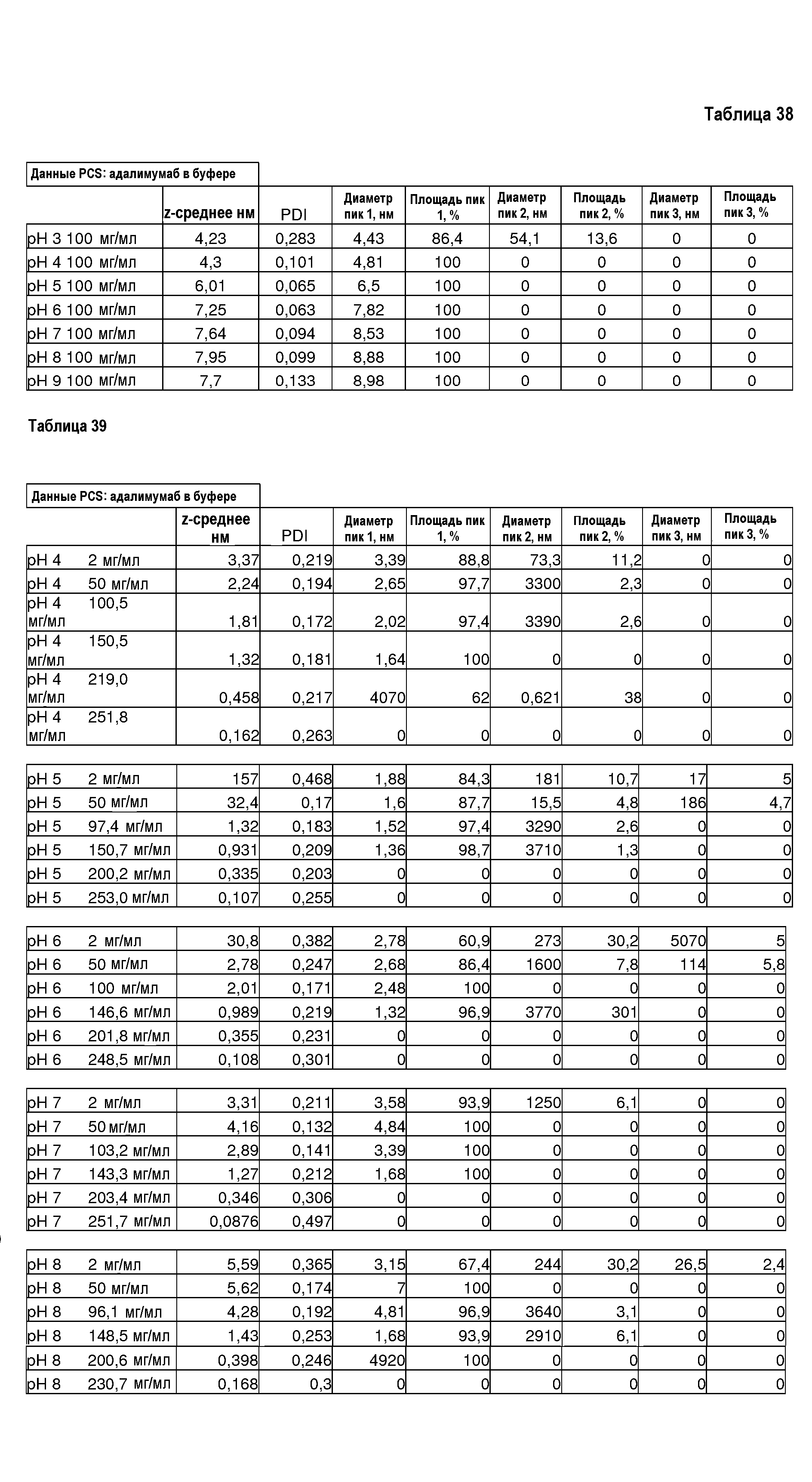
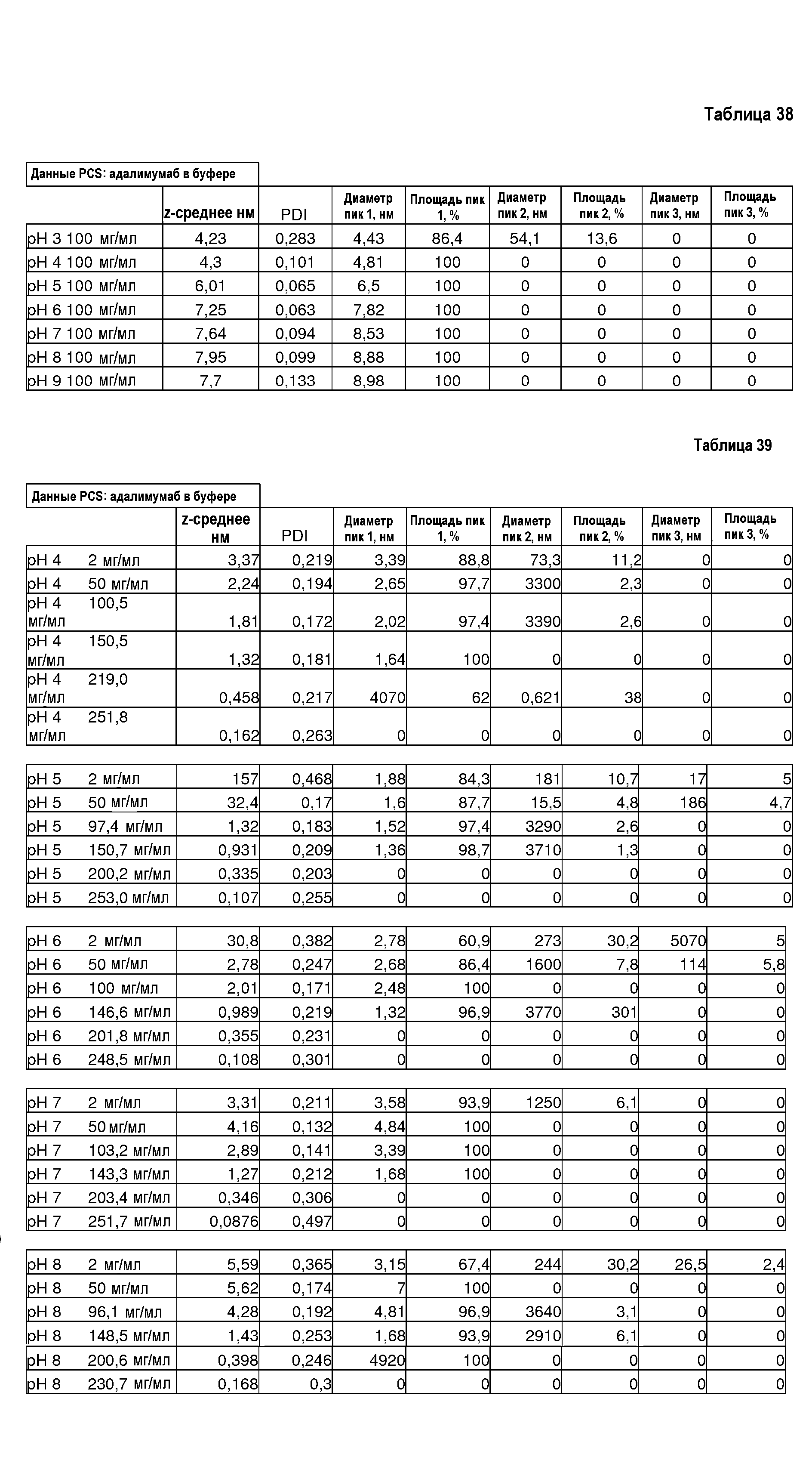
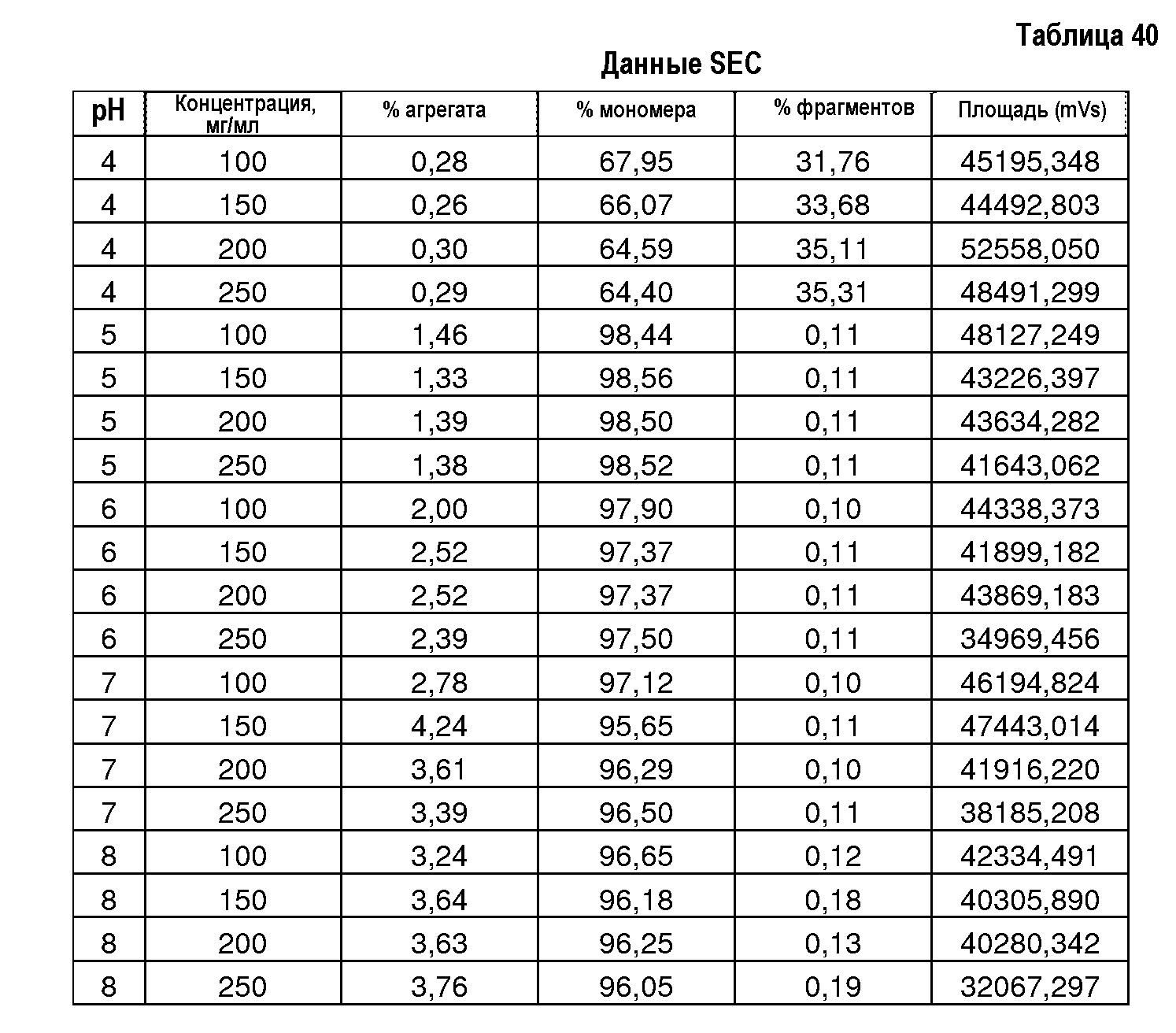
Пример 18
Влияние показателя рН на вязкость антитела J695
Данные вязкости для антитела J695 были получены после выполнения DF/UF с использованием воды в качестве обменной среды. Лекарственное вещество антитела J695 (см. пример 1) подвергали диафильтрации в воду, выполняя по меньшей мере 5 стадий DF/UF. Затем определяли вязкость при разных температурах при помощи пластинчатого вискозиметра, скорость сдвига 100 об/мин, зазор 150 мкм, диаметр пластины 60 мм (оборудование: вискозиметр Bohlin Geminim (Malvern Instruments, Southborough, MA), температурный интервал 8-25°С).
Как показано на фиг.32, при концентрациях 179 мг/мл и 192 мг/мл вязкости растворов антитела J695 были ниже 70 сПз при 12°С, ниже 40 сПз при 20°С и ниже 30 сПз при 25°С.
Пример 19
Фармакокинетика (РК) антитела в чистой воде
Целью данного исследования была оценка потенциального влияния параметров композиции (то есть низкоионной белковой композиции, содержащей воду, по сравнению с обычными белковыми композициями, содержащими ионные наполнители, такие как буферы и соли) на местную переносимость и фармакокинетику после подкожного (s.c.) введения афелимомаба. Кроме того, исследовали системную токсичность и токсикокинетические данные указанных композиций. Концентрации белка находились в пределах от 50 мг/мл до 200 мг/мл, и ионная сила была равна от 3 мОсмоль/кг до 300 мОсмоль/кг.
Возможность введения однократной подкожной дозы исследовали с использованием афелимомаба (MAK195F - F(ab')2-фрагмент антитела мыши против TNF человека (Abbott Laboratories)), который вводили самцам крыс Sprague-Dawley для оценки местной переносимости и токсичности афелимомаба у крыс после подкожного введения жидких концентраций с композицией 50 и 200 мг/кг. После подкожного введения однократных доз наблюдали за восстановлением. Брали ограниченные пробы крови для измерения уровней афелимомаба в кровотоке и оценки абсорбции и времени полужизни в кровяном русле. Объем вводимой дозы был равен 1 мл/кг массы тела. Были созданы следующие экспериментальные группы:
Экспериментальные группы
01 Контрольная группа (наполнитель)
02 50 мг/мл афелимомаба, жидкая, стандартная композиция
07 200 мг/мл афелимомаба, жидкая, водная композиция
Группа А Период наблюдения 2 дня
Группа В Период наблюдения 7 дней
Группа С Период наблюдения 14 дней
Группировка и идентификация крыс (N=1 в группе)
|
Животных неоднократно обследовали с целью выявления клинических симптомов и смертности в 1-й день через 15 минут, 1, 3, 5 и 24 часа после введения и по меньшей мере один раз в день в последующий период. Массу тела измеряли в дни введения дозы (1-й день), аутопсии (соответственно 3-й, 15-й или 21-й день) и дважды в неделю. Пробы крови для анализа лекарственного средства брали в 1-й день (через 4 часа после введения) и во 2-й, 3-й, 5-й, 8-й и 15-й дни. Перед аутопсией собирали кровь и определяли гематологические и клинические химические параметры. У всех животных брали мазки крови перед аутопсией. Во время аутопсии выполняли макроскопию полостей тела. Измеряли массу печени, почек, тимуса, селезенки и лимфатических узлов. Предварительную гистопатологию выполняли в месте инъекции, а также печени, почках, тимусе, селезенке и лимфатических узлах.
Все животные оставались живыми в течение всего исследования до запланированной аутопсии. У крыс, которым вводили водную композицию, были обнаружены струпья в области шеи на 14-й - 15-й день. Ни одно из испытуемых веществ не повлияло на массу тела. Результаты гематологии и клинической химии были различными. В гематологии или клинической химии не было обнаружено изменений, имеющих четко выраженное отношение к испытуемым веществам. При исследовании мочи также не было выявления изменений, имеющих отношение к испытуемым веществам. Измеренная масса органов была различной, при этом не было выявлено изменений, непосредственно относящихся к испытуемым веществам.
При макроскопическом исследовании у крыс, которым вводили водную композицию, на 3-й день было обнаружено покраснение подкожного слоя в месте инъекции. Все другие изменения относились к области спонтанных реакций, обычно наблюдаемых у крыс Sprague-Dawley данной линии и возраста.
Были получены следующие результаты микроскопического исследования:
- Отсутствие изменений в группах 01, 02
- Минимальное диффузное подкожное воспаление в группе 07
- Фокальное подкожное кровоизлияние, соответствующее покраснению, обнаруженному при макроскопическом исследовании в группе 07 (3-й день), которое, как предполагали, было связано с введением препарата
- Результаты предварительного иммуногистохимического исследования влияния пан-Т-клеток, супрессорных/цитотоксических Т-клеток/естественных клеток-киллеров, пан-В-клеток и маркеров панмакрофагов на местные реакции показывают, что подкожное воспаление/инфильтрацию определяют в основном макрофаги и естественные клетки-киллеры. Таким образом, не было обнаружено местной иммуногенной реакции на использованные композиции.
Все другие изменения относились к области спонтанных реакций, обычно наблюдаемых у крыс Sprague-Dawley данной линии и возраста.
После подкожного введения афелимомаба происходило быстрое поглощение при достижении максимальных уровней в сыворотке через 0,2-3 дня после инъекции. Абсолютные уровни афелимомаба во всех исследованных образцах были низкими. Имело место большое расхождение между образцами, по-видимому, из-за ограниченной частоты отбора проб и малого количества использованных животных. В большинстве проб афелимомаб не был обнаружен в сыворотке через 5-8 дней. Такое резкое снижение уровней в сыворотке, вероятно, связано с высоким клиренсом F(ab')2-фрагмента антитела. Наблюдаемое в большинстве проб время полужизни (Т1/2), равное 1-2 дням, соответствовало предыдущим наблюдениям. Более продолжительное время полужизни низкоионной композиции (7,8 дня) может быть обусловлено продолжительным всасыванием образца. Полученные данные приведены в таблицах 41 и 42.
|
Агрегированное состояние не было обнаружено в жидкостях как афелимомаба, так и контрольного вещества.
В случае композиции с низкой ионной силой наблюдалось минимальное диффузное воспаление в месте подкожной инъекции. Воспаление, от минимального до слабого или от слабого до среднего, имело место при повышенной концентрации белка (50 мг/мл и 200 мг/мл). Наблюдалось некоторое местное подкожное кровоизлияние, которое соответствовало покраснению макроскопической патологии; было установлено, что такое кровоизлияние возникло вследствие прокола кровеносного сосуда во время инъекции. Некоторое подкожное покраснение в месте инъекции наблюдалось на 3-й день после введения водной композиции, но не было признано вредным для здоровья. Таким образом, данная композиция обладала местной переносимостью.
В нижеследующей таблице 42 приведены фармакокинетические данные стандартной жидкой композиции в сравнении с водной композицией.

В случае низкоионной композиции (то есть композиции афелимомаба в воде) увеличилась продолжительность нахождения композиции в сыворотке в обнаруживаемых количествах, как показано в таблице 42.
В данном исследовании наблюдаемые абсолютные уровни MAK195F в низкоионном растворе (воде) обеспечили лучшую экспозицию, более продолжительное обнаружение композиции в сыворотке и более длительное время полужизни по сравнению со стандартной жидкой композицией MAK195F.
Время полужизни афелимомаба было равно 1-2 дням в стандартной композиции, что соответствует ранее полученным данным для F(ab')2-молекул. Однако в случае низкоионной композиции время полужизни было более продолжительным (7,8 дня). Таким образом, среднее время пребывания MAK195F в указанной композиции является более продолжительным по сравнению с испытанной стандартной композицией.
Пример 20
DF/UF антитела 2.5(E)mg1 (антитело против IL-18)
Диафильтрацию/ультрафильтрацию (в непрерывном режиме) нерасфасованного раствора антитела 2.5(Е)mg1 (59,6 мг/мл) выполняли примерно с 4-кратным объемным обменом, используя воду для инъекций (далее именуется ”водой”). Выполнение DF/UF контролировали, измеряя мутность, концентрацию белка (OD280), рН и осмоляльность концентрата, и методом DLS. Во время выполнения DF/UF также контролировали осмоляльность фильтрата для определения уменьшения количества наполнителей в нерасфасованных растворах антитела 2.5(Е)mg1.
Вещества и методы
- Нерасфасованное лекарственное вещество антитела 2.5(Е)mg1 (метионин, гистидин, без полисорбата 80) (Abbott Bioresearch Center, Worcester, MA): 2 бутылки из PETG, содержащие в общей сложности 589,12 г раствора, концентрация раствора 59,6 мг/мл.
- Ampuwa (вода для инъекций) (Fresenius Medical Care, Waltham, MA).
- Лабораторное устройство TFF Millipore для DF/UF, включающее 2 фильтрующие кассеты Pellicon XL, Millipore, мембрану PLCTK 30 кДа из регенерированной целлюлозы.
- УФ/VIS спектрофотометр, Specord 50, с длиной волны 280 нм.
- Измеритель показателя рН Metrohm, тип 744, с зондом № 57 Biotrode.
- Осмометр: Knauer, K-7400.
- Оборудование для измерения плотности Paar, DMA 4100.
- Камера с ламинарным воздушным потоком Hereaus.
- Прибор для измерения мутности: Hach, 2100AN.
- Вискозиметр: Paar, AMVn.
- Весы: Mettler Toledo, AT261 и 33.45.
- Фильтры: Millex AP 20 (стекловолокно) и фильтр с высокой пропускной способностью Ministar (ацетат целлюлозы), размер пор 0,20 мкм.
20.1. Экспериментальная часть
Оттаивание образцов лекарственного вещества антитела 2.5(Е)mg1: 2-л бутылки из PETG, содержащие замороженное лекарственное вещество, оттаивали в течение 2 часов на бане с циркуляцией воды при 23°С. Оттаявшее лекарственное вещество было прозрачным, немного опалесцентным и не имело видимых частиц.
Концентрирование лекарственного вещества при помощи DF/UF: из-за ограниченного объема резервуара устройства для DF/UF, равного 530 мл, лекарственное вещество антитела 2.5(Е)mg1 концентрировали до конечного объема, равного 525 мл.
Выполнение DF/UF с использованием воды (буферный обмен): лекарственное вещество (метионин, гистидин, 2.5(Е)mg1) подвергали DF/UF, выполняя 4-кратный объемный обмен. В таблице 43 указаны количества воды, которые были использованы в процессе эксперимента, и в таблице 44 приведены экспериментальные параметры.
|
|
Осмоляльность фильтрата измеряли после обработки примерно каждых 200 мл фильтрата.
После выполнения DF/UF в воду объем раствора антитела 2.5(Е)mg1 был равен 450 мл, и концентрация белка была равна 76,6 мг/мл. Указанный раствор, содержащий антитело 2.5(Е)mg1, по существу растворенное в воде, затем концентрировали.
|
Концентрированный раствор (~130 мг/мл) фильтровали через фильтр с размером пор 0,2 мкм. Раствор охлаждали до 2-8°С и хранили при -80°С.
20.2. Данные, полученные во время DF/UF антитела 2.5(Е)mg1
|
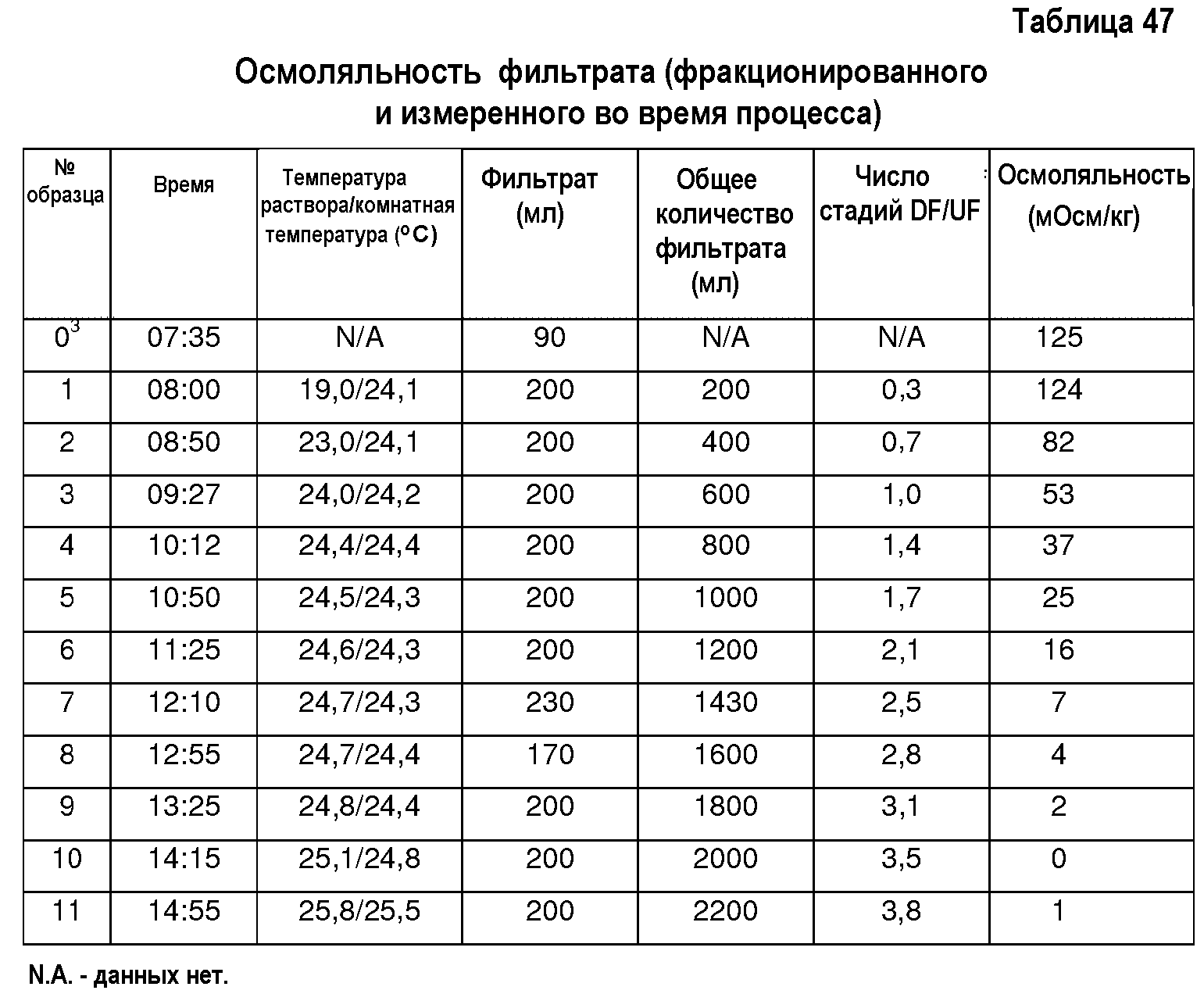
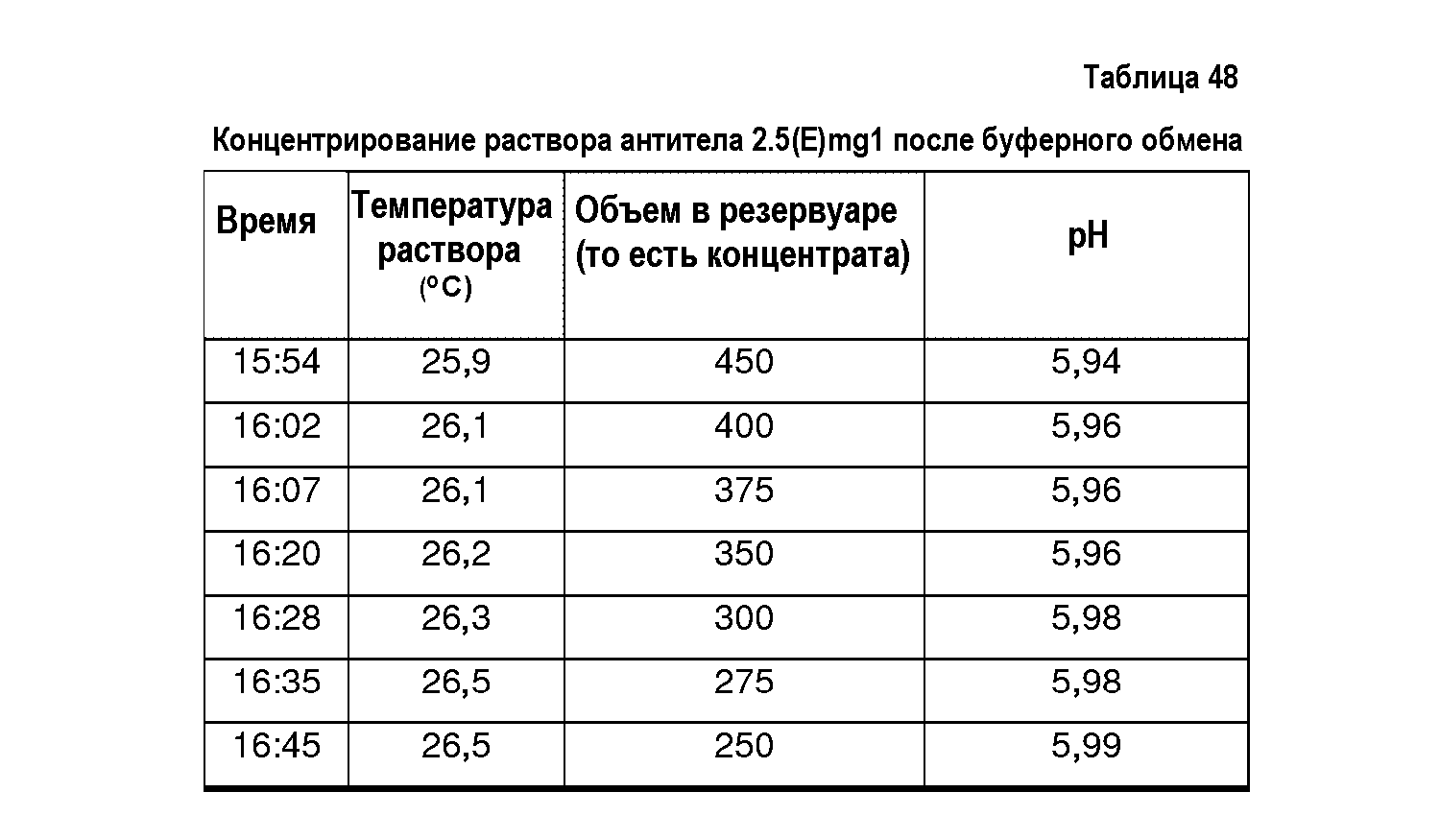
|
|
20.3. Рассмотрение результатов
Результаты эксперимента показали, что антитело 2.5(Е)mg1 (с метиониновым, гистидиновым буфером) может быть получено по существу в воде в более высокой концентрации (никаких ограничений растворимости не было обнаружено при концентрации 130 мг/мл). После 3 объемных обменов с использованием воды осмоляльность фильтрата и концентрата была ниже 10 мОсмоль/кг, свидетельствуя о том, что было эффективно уменьшено количество буферных наполнителей. Опалесценция раствора антитела 2.5(Е)mg1 была уменьшена во время выполнения DF/UF с использованием воды (оптимальный внешний вид), что нашло также отражение в уменьшении мутности (нефелометрические единицы мутности (NTU) исходного раствора лекарственного вещества на 14,5, после 3-кратного объемного обмена на 6,55, после 4-кратного объемного обмена на 10,5.
Как было показано в отношении других антител, гидродинамический диаметр, определенный методом DLS, уменьшился в результате уменьшения количества наполнителей (межмолекулярное отталкивание зарядов дополнительно к беспорядочному броуновскому движению, вызывающее большую подвижность молекул, находит выражение в меньших вычисленных значениях Dh). Значение рН раствора антитела 2.5(Е)mg1 в основном оставалось одинаковым, как до (рН 5,94), так и после (рН 5,99) выполнения DF/UF.
Как показывают результаты контроля методом DLS, антитело 2.5(Е)mg1 сохраняло устойчивость во время выполнения DF/UF. Не было обнаружено значительного увеличения количества высокомолекулярного компонента.
Пример 21
Получение адалимумаба в воде и исследование устойчивости адалимумаба
В нижеследующем примере рассмотрена устойчивость композиции, включающей адалимумаб, которая была получена в результате выполнения процесса, описанного в приведенных выше примерах, то есть адалимумаб был успешно диализован в воду.
Вещества и методы
3323,6 г раствора адалимумаба (71,3 мг/мл) подвергали диафильтрации с использованием чистой воды. После 7-кратного объемного обмена с чистой водой (теоретическое уменьшение количества наполнителей на 99,9%) раствор белка разбавляли/подвергали ультрафильтрации до конечных целевых концентраций, равных, соответственно, 220 и 63 мг/мл. Для проверки состояния белка после выполнения DF/UF измеряли рН, осмоляльность, вязкость, проводимость, выполняли PCS, производили визуальный осмотр и измеряли концентрацию белка (OD280).
После выполнения DF/UF растворы белка стерилизовали фильтрованием (мембранные фильтры 0,22 мкм Millipak-60 и Millipak-200) и затем вводили в шприцы длиной 1 мл BD HyPak SCF™, оснащенные иглами 27.5G RNS и стерильными поршнями BD HyPak BSCF 4432/50. Заполняемый объем одного шприца был равен примерно 0,825 мл.
После заполнения шприцы хранили, соответственно, при 2-8°С, 25°С и 40°С, и выполняли анализ в соответствии с приведенной ниже схемой отбора образцов.
- Лекарственное вещество адалимумаба (коэффициент экстинкции адалимумаба при длине волны 280 нм: 1,39 мл/мг см): лекарственное вещество не содержало полисорбат 80. Буфер лекарственного вещества, рН 5,38.
- Система диафильтрации Sortorius Sartocon Slice, оснащенная мембранными кассетами Ultrasert PES (отсечение 50 кДа и 30 кДа). Систему Sartocon Slice использовали в непрерывном режиме при комнатной температуре в соответствии с экструкциями по эксплуатации Sartorius.
- Электроды для измерения рН
- УФ-спектрофотометр видимого диапазона PerkinElmer, Lambda 35, использовали для измерений концентрации белка (длина волны 280 нм). Одноразовые кюветы для УФ-излучения, 1,5 мл, полумикро, полиметилметакрилат (РММА), использовали для измерения концентрации.
- Стерилизованная вода для инъекций, соответствующая нормам европейской фармакопеи/фармакопеи США, была использована в качестве среды для DF/UF.
- Осмометр ОМ815 Vogel использовали для измерений осмоляльности (калиброванный калибровочным раствором с осмотическим давлением 400 мОсмоль/кг NaCl, № Y1241, Herbert Knauer GmbH, Berlin, Germany).
- Микровискозиметр Anton Paar, тип AWVn, использовали для измерения вязкости растворов белка в соответствии с инструкциями по эксплуатации компании Anton Paar. Вязкость определяли при 20°С.
- Устройство WTW InoLab Cond Level2, нормализованное до 25°С, использовали для измерений проводимости.
- Устройство Zetasizer nano ZS Malvern Instruments использовали для определения значений Z-среднего стандартным методом. Измерения выполняли при 25°С, используя данные вязкости, полученные при помощи вискозиметра с падающим шариком (микровискозиметр Anton Paar, тип AWVn, при 25°С).
Методы ВЭЖХ
- Анализ адалимумаба методом SEC: колонка Sephadex 200 (№ по каталогу фармакопеи 175175-01). Подвижная фаза: 20 мМ фосфата натрия, 150 мМ хлорида натрия, рН 7,5, скорость потока 0,5 мл/мин, комнатная температура, обнаружение при ультрафиолетовом излучении с длиной волны 214 нм и 280 нм. Каждый образец разбавляли до 1,0 мг/мл водой Milli-Q, образец вводили в количестве 50 мкг (дублированное введение).
- Анализ адалимумаба методом IEC: колонка Propac WCX-10, Dionex (№ 054993) вместе с соответствующей защитной колонкой (№ 054994). Условия разделения: подвижная фаза А: 10 мМ фосфата натрия, рН 7,5; подвижная фаза В: 10 мМ фосфата натрия, 500 мМ хлорида натрия, рН 5,5, скорость потока 1,0 мл/мин, комнатная температура. Каждый образец разбавляли до 1,0 мг/мл водой Milli-Q, образец вводили в количестве 100 мкг, дублированное введение.
Вычисление концентрации белка
Формула для вычисления:
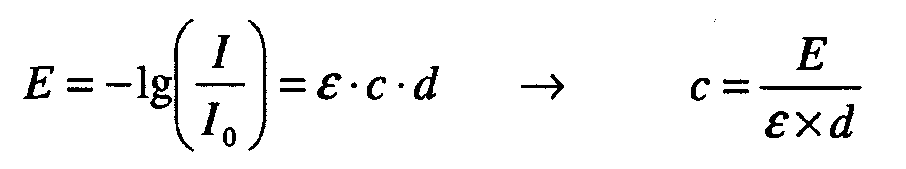
ε - коэффициент поглощения
с - концентрация
d - длина кюветы, проходимой светом
Е - оптическая плотность
I0 - начальная интенсивность света
I - интенсивность света после прохождения через образец
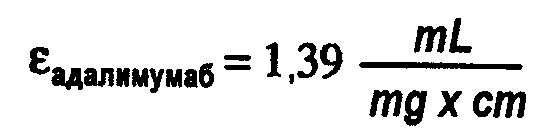
Схема отбора образцов
Образцы полученных растворов хранили при указанных ниже температурах и отбирали (х) в указанные моменты времени после начала исследования.
|
Обработка адалимумаба методом DF/UF
В таблице 51 приведены характеристики адалимумаба после диафильтрации.

Исследование адалимумаба при хранении, включая прозрачность и опалесцентность, степень окрашивания жидкостей, SEC, при разных температура описано в Приложении D.
Заключение
В приведенном выше примере описан эксперимент по диафильтрации/ультрафильтрации, в котором была использована вода (стерилизованная вода для инъекций, европейская фармакопея/фармакопея США) в качестве диафильтрующей среды для моноклонального антитела адалимумаба.
Адалимумаб обрабатывали методом DF/UF, используя чистую воду в качестве обменной среды для DF/UF, и получали при рН 5,57 в высокой концентрации (220 мг/мл) и при рН 5,44 в более низкой концентрации (63 мг/мл) без образования сильной опалесценции или мутности.
Адалимумаб, полученный в результате выполнения экспериментов по обработке методом DF/UF, хранили в шприцах SCF при 2-8°С, 25°С и 40°С в течение 3 месяцев. Полученные данные свидетельствуют о благоприятной общей устойчивости белка.
В заключение следует отметить, что белки можно обрабатывать и получать с использованием чистой воды в качестве обменной среды для DF/UF. Если предположить наличие идеальной 100% проницаемости наполнителя через мембрану, то максимальное уменьшение количества наполнителей может быть равно 99,9%.
Пример 22
Исследование устойчивости адалимумаба, полученного в воде с использованием неионных наполнителей
В следующем примере описано исследование устойчивости композиции, содержащей антитело, то есть адалимумаб, в воде с использованием дополнительных неионных наполнителей.
Вещества и методы
Адалимумаб был таким же, как в примере 21 (обработка методом DF/UF). После обработки методом DF/UF растворы белка получали с использованием наполнителей, указанных в таблице 52. Маннит был выбран в качестве примера из группы сахарных спиртов, таких как маннит, сорбит и т.д. Сахароза была выбрана в качестве примера из группы сахаров, таких как сахароза, трегалоза, раффиноза, мальтоза и т.д. Полисорбат 80 был выбран в качестве примера из группы неионогенных поверхностно-активных веществ, таких как полисорбат 80, полисорбат 20, плюроник F68 и т.д., при этом было получено ~10,7 мл для каждой композиции. Во всех полученных композициях измеряли осмоляльность, вязкость и выполняли PCS.
|
- 0,5% и 5% исходный раствор полисорбата 80 в стерильной воде для инъекций: добавление в отношении 1:50 (раствор адалимумаба в количестве 210 мкл - 10,5 мл, добавление 210 мкл воды для инъекций к образцам, полученным без использования поверхностно-активного вещества, для гарантии одинаковой концентрации белка во всех образцах.
- Добавление маннита/сахарозы в твердом виде (соответственно 525 мг и 840 мг).
Препараты стерилизовали фильтрованием (Millex GV, Millipore, 0,22 мкм, диаметр 33 мм, № SLGV033RS) и вводили в шприцы длиной 1 мл BD HyPak SCF™, оснащенные иглами 27.5G RNS и стерильными поршнями BD HyPak BSCF 4432/50. Заполняемый объем одного шприца был равен примерно 0,6 мл.
После заполнения шприцы хранили соответственно при 2-8°С, 25°С и 40°С и выполняли анализ в соответствии с приведенной ниже схемой отбора образцов.
- Лекарственное вещество адалимумаба (коэффициент экстинкции адалимумаба при длине волны 280 нм: 1,39 мл/мг см): лекарственное вещество не содержало полисорбат 80. Буфер лекарственного вещества, рН 5,38.
- Электроды для измерения рН.
- Стерилизованная вода для инъекций, соответствующая нормам европейской фармакопеи/фармакопеи США, была использована в качестве среды для DF/UF.
- Маннит, полисорбат 80 и сахароза соответствовали качеству, определяемому европейской фармакопеей.
- Остометр ОМ815 Vogel использовали для измерений осмоляльности (калиброванный с использованием калибровочного раствора с осмотическим давлением 400 мОсмоль/кг NaCl, № Y1241, Herbert Knauer GmbH, Berlin, Germany).
- Микровискозиметр Anton Paar, тип AWVn, использовали для измерения вязкости растворов белка в соответствии с инструкциями по эксплуатации компании Anton Paar. Вязкость определяли при 20°С.
- Лабораторное устройство BMG Fluostar Optima (измерение оптической плотности при длине волны 344 нм на луночных планшетах, определение мутности).
- Устройство Zetasizer nano ZS Malvern Instruments использовали для определения значений Z-среднего стандартным методом. Измерения выполняли при 25°С, используя данные вязкости, полученные при помощи вискозиметра с падающим шариком (микровискозиметр Anton Paar, тип AWVn, при 25°С).
Методы ВЭЖХ
- Анализ адалимумаба методом SEC: колонка Sephadex 200 (№ по каталогу фармакопеи 175175-01). Подвижная фаза: 20 мМ фосфата натрия, 150 мМ хлорида натрия, рН 7,5, скорость потока 0,5 мл/мин, комнатная температура, обнаружение при ультрафиолетовом излучении с длиной волны 214 нм и 280 нм. Каждый образец разбавляли до 1,0 мг/мл водой Milli-Q, образец вводили в количестве 50 мкг (дублированное введение).
- Анализ адалимумаба методом IEC: колонка Propac WCX-10, Dionex вместе с соответствующей защитной колонкой. Условия разделения: подвижная фаза А: 10 мМ фосфата натрия, рН 7,5; подвижная фаза В: 10 мМ фосфата натрия, 500 мМ хлорида натрия, рН 5,5, скорость потока 1,0 мл/мин, комнатная температура. Каждый образец разбавляли до 1,0 мг/мл водой Milli-Q, образец вводили в количестве 100 мкг, дублированное введение.
Схема отбора образцов
Образцы полученных растворов хранили при 5°С, 25°С и 40°С и отбирали через 1 минуту (5°С и 40°С) или в момент времени Т0 и через 1 минуту (25°С) после начала исследования. Испытуемые параметры измеряли соответствующими методами, например, цвет определяли визуально, мутность определяли на основании оптической плотности при длине волны 344 нм.
Исследование исходной композиции
В таблице 53 приведены значения осмоляльности и вязкости исходной композиции.
|
Все композиции с одной концентрацией имели одинаковую вязкость. Вязкость композиций, содержащих сахарозу, была несколько выше. Меньшая вязкость высококонцентрированных композиций по сравнению с высококонцентрированной композицией в воде (пример А, вязкость 27,9 спз) можно объяснить разбавлением образца исходными растворами полисорбата 80 или простой водой, в результате чего конечная концентрация была равна ~215 мг/мл по сравнению с 220 мг/мл в примере 21.
В таблице 54 приведены данные PCS, полученные для каждого образца.

Данные, приведенные в таблице 54, показывают, что значения z-среднего существенно не отличаются от значений, полученных для растворов адалимумаба в системах, не содержащих неионных наполнителей (63 мг/мл, диаметр 1,85 нм, 220 мг/мл, диаметр 0,34 нм, пример 21).
Исследование адалимумаба в процессе хранения
В Приложении Е приведены данные об устойчивости адалимумаба при хранении.
Проводимость растворов плацебо
В таблице 55 приведены данные о влиянии неионных наполнителей на проводимость разных композиций адалимумаба. Все растворы плацебо были получены с использованием стерилизованной воды для инъекций, соответствующей нормам европейской фармакопеи/фармакопеи США.
|
Заключение
Препараты хранили в шприцах SCF при 2-8°С, 25°С и 40°С в течение 1 месяца. Данные, полученные в результате исследования хранения, показали, что белок оставался устойчивым во всех испытанных композициях. Данные устойчивости были сравнимы с устойчивостью образцов по примеру 21. Измерение проводимости растворов плацебо, содержащих неионные наполнители, указывает на предельное увеличение проводимости для некоторых наполнителей в диапазоне нескольких мкСм/см. Измерения методом PCS свидетельствуют об отсутствии значительного увеличения гидродинамических диаметров по сравнению с системами, не содержащими неионных наполнителей.
В заключение следует отметить, что белки можно обрабатывать с использованием чистой воды в качестве обменной среды для DF/UF и получать с неионными наполнителями. Адалимумаб также оценивали методом PCS в буфере следующего состава: 10 мМ фосфатного буфера, 100 мМ хлорида натрия, 10 мМ цитратного буфера, 12 мг/мл маннита, 0,1% полисорбата 80, рН 5,2. Концентрация адалимумаба была соответственно равна 50 мг/мл и 200 мг/мл. Значения z-среднего соответствовали диаметру 11,9 нм для композиции с концентрацией 50 мг/мл и 1,01 нм для композиции с концентрацией 200 мг/мл. Таким образом, было ясно продемонстрировано, что гидродинамические диаметры при данной концентрации белка зависят от ионной силы (большие диаметры имеют место в солесодержащих буферах).
Пример 23
Получение антитела J695 в воде с неионными наполнителями
В нижеследующем примере описано получение композиции, содержащей антитело, то есть адалимумаб, в воде с дополнительными неионными наполнителями. В данном примере рассмотрена также устойчивость (измеренная, например, методом вытеснительной ВЭЖХ и IEC) антитела J695, полученного в воде с дополнительными неионными наполнителями.
Вещества и методы
Раствор антитела J695 в количестве 2×30 мл (~125 мг/мл) с разными значениями рН диализовали, используя чистую воду и диализные кассеты Slide-A-Lyzer. Образцы диализовали 3 раза в 3 л чистой воды (теоретическое уменьшение количества наполнителей 1:1000000). Растворы белка подвергали ультрафильтрации до конечной целевой концентрации 200 мг/мл, используя концентраторы Vivaspin 20. Для контроля за состоянием белка во время и после обработки измеряли рН, осмоляльность, вязкость, проводимость, выполняли PCS, производили визуальный осмотр, выполняли ВЭЖХ и измеряли концентрацию белка (OD280).
После обработки из растворов белка получали препараты следующим образом. Маннит был выбран в качестве примера из группы сахарных спиртов, таких как маннит, сорбит и т.д. Сахароза была выбрана в качестве примера из группы сахаров, таких как сахароза, трегалоза, раффиноза, мальтоза и т.д. Полисорбат 80 был выбран в качестве примера из группы неионогенных поверхностно-активных веществ, таких как полисорбат 80, полисорбат 20, плюроник F68 и т.д. Каждая композиция была получена в объеме, равном 0,5 мл. Для контроля за состоянием белка после получения образца измеряли рН, осмоляльность, производили визуальный осмотр и выполняли анализ методом ВЭЖХ.
*Обозначение ”/5” или “/6” добавлено к названиям образцов для отличия образцов со значением рН 5 и 6.
- 0,5% и 5% исходный раствор полисорбата 80 в стерильной воде для инъекций: добавление в отношении 1:50 (раствор антитела J695 в количестве 10 мкл - 0,5 мл, добавление 10 мкл воды для инъекций к образцам, полученным без использования поверхностно-активного вещества, для гарантии одинаковой концентрации белка во всех образцах).
- Добавление маннита/сахарозы в твердом виде (соответственно 25 мг и 40 мг).
- Лекарственное вещество антитела J695 (коэффициент экстинкции антитела J695 при длине волны 280 нм: 1,42 мл/мг см): лекарственное вещество не содержало полисорбата 80. Буфер для лекарственного вещества, рН 6,29.
- Электроды для определения рН.
- Деминерализованная и стерилизованная фильтрованием вода была использована в качестве диализной среды.
- Маннит, полисорбат 80 и сахароза соответствовали качеству, определяемому нормами европейской фармакопеи.
- Осмометр ОМ815 Vogel использовали для измерений осмоляльности (калиброванный с использованием калибровочного раствора с осмотическим давлением 400 мОсмоль/кг NaCl, № Y1241, Herbert Knauer GmbH, Berlin, Germany).
- Микровискозиметр Anton Paar, тип AWVn, использовали для измерения вязкости растворов белка в соответствии с инструкциями по эксплуатации компании Anton Paar. Вязкость определяли при 20°С.
- Лабораторное устройство BMG Fluostar Optima (измерение оптической плотности при длине волны 344 нм на луночных планшетах, определение мутности).
- Центрифуга 5810 R Eppendorf.
- Диализные кассеты Slide-A-Lyzer, Pierce Biotechnology (№ по каталогу 66830).
- Концентраторы Vivaspin 20, мембраны PES, отсекающие молекулярную массу 10 кДа (Vivascience, № продукта VS2001), которые использовали в соответствии со стандартными инструкциями по эксплуатации.
- УФ-спектрофотометр видимого диапазона PerkinElmer, Lambda 35, использовали для измерений концентрации белка (длина волны 280 нм). Одноразовые кюветы для УФ-излучения, 1,5 мл, полумикро, полиметилметакрилат (РММА), использовали для измерений концентрации.
- Устройство WTW Level 2 InoLab Cond, нормализованное до 25°С, использовали для измерений проводимости.
- Устройство Zetasizer nano ZS Malvern Instruments использовали для определения значений z-среднего стандартным методом. Измерения выполняли при 25°С, используя данные вязкости, полученные при помощи вискозиметра с падающим шариком (микровискозиметр Anton Paar, тип AWVn, при 25°С).
Методы ВЭЖХ
- Анализ SEC антитела J695: колонка G3000swxl Tosoh Bioscience, 7,8 мм × 30 см, 5 мкм (№ по каталогу 08541). Подвижная фаза: 211 мМ Na2SO4/92 мМ Na2HPO4, рН 7,0, скорость потока 0,25 мл/мин, комнатная температура, обнаружение УФ-излучения при длине волны 214 нм и 280 нм. Каждый образец разбавляли до 2,0 мг/мл водой Milli-Q, образец вводили в количестве 20 мкг (дублированное введение).
- Анализ IEC антитела J695: колонка Propac WCX-10, Dionex (№ 054993) вместе с соответствующей защитной колонкой (№ 054994). Условия разделения: подвижная фаза А: 10 мМ Na2HPO4, рН 6,0; подвижная фаза В: 10 мМ Na2HPO4, 500 мМ NaCl, рН 6,0, скорость потока 1,0 мл/мин, температура 35°С. Каждый образец разбавляли до 1,0 мг/мл водой Milli-Q, образец вводили в количестве 100 мкг.
Вычисление концентрации белка
Формула для вычисления:
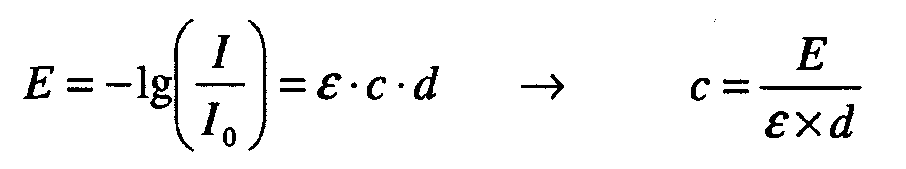
ε - коэффициент поглощения
с - концентрация
d - длина кюветы, проходимой светом
Е - оптическая плотность
I0 - начальная интенсивность света
I - интенсивность света после прохождения через образец
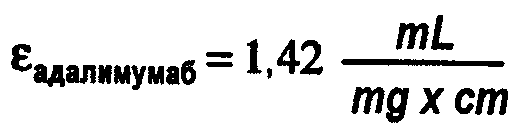
Обработка антитела J695
Антитело J695 в воде исследовали до добавления любых неионных наполнителей. В таблице 57 приведены результаты исследования антитела J695 во время диализа/ультрафильтрации.
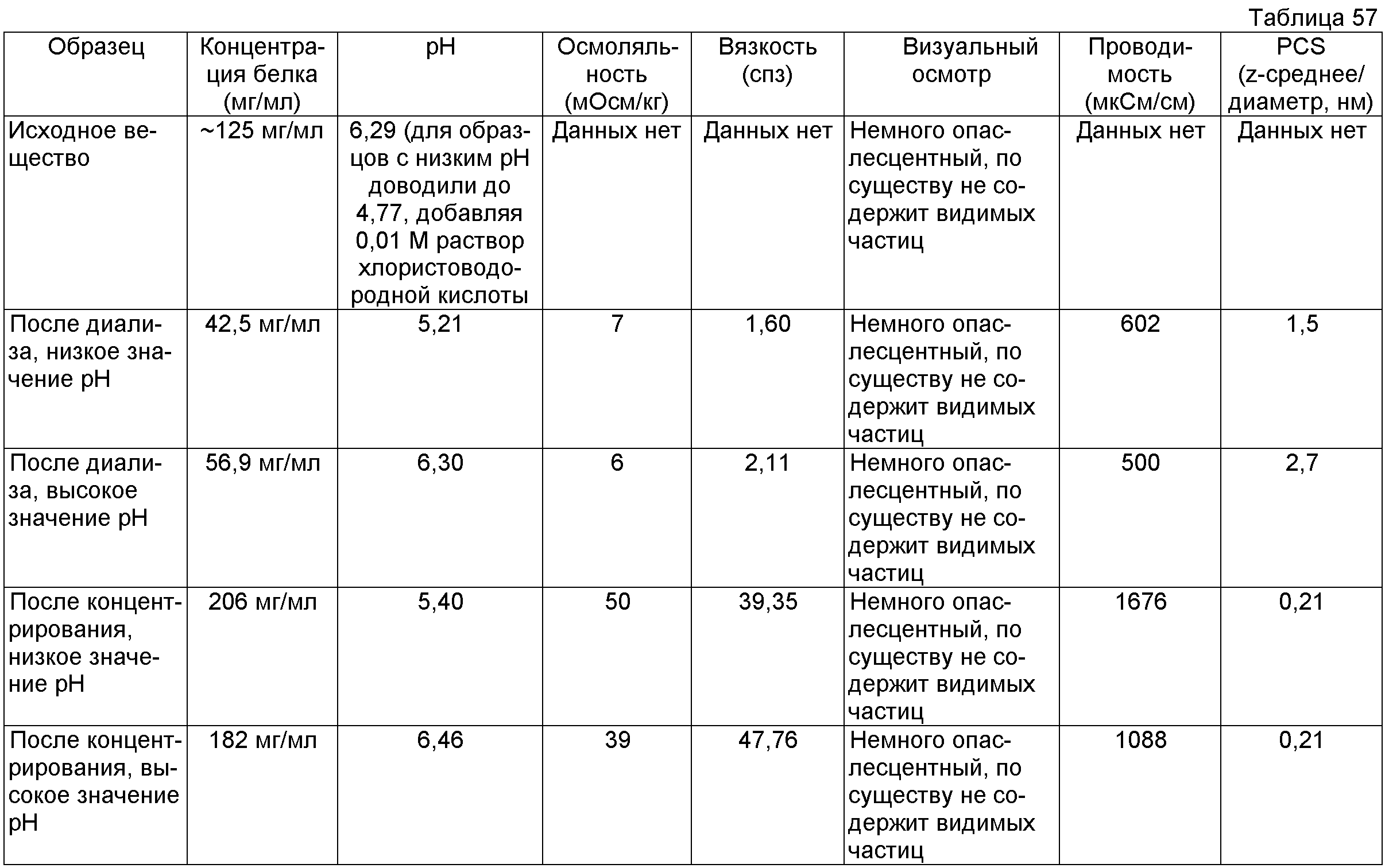
Исследование композиций с неионными наполнителями
После добавления к композиции антитела J695 разных неионных наполнителей (см. описание в таблице 56) анализировали каждую композицию. Результаты измерения осмоляльности, визуального осмотра и определения значений рН приведены в нижеследующей таблице 58.
|
Данные ВЭЖХ
Все композиции антитела J695, содержащие неионные наполнители, также исследовали методами вытеснительной ВЭЖХ и IEC. Данные, полученные в результате выполнения указанных анализов, приведены в таблицах 59 и 60 и включают обзор устойчивости антитела J695 в процессе обработки и получения композиции.
|
|
Заключение
В приведенном выше примере рассмотрен эксперимент, в котором вода (деминерализованная и стерилизованная фильтрованием вода) была использована в качестве диализной среды для моноклонального антитела J695.
Антитело J695 подвергали диализу и концентрировали, используя чистую воду в качестве обменной среды, и получали при рН 5,40 и 6,46 в высокой концентрации (соответственно 206 и 182 мг/мл) без легкого помутнения, сильной опалесценции или образования мути.
Антитело J695, полученное в результате указанного эксперимента, исследовали и объединяли с разными неионными наполнителями. Полученные данные свидетельствуют о благоприятной устойчивости белка в испытанных композициях.
В заключение следует отметить, что белки можно обрабатывать с использованием чистой воды в качестве обменной среды и получать с неионными наполнителями. Если предположить наличие идеальной 100% проницаемости наполнителя через мембрану, то максимальное уменьшение количества наполнителей может быть равно 99,9%.
Пример 24
Возможность использования шприцев для введения композиций адалимумаба в воде
Композиции, полученные в примере 21 (адалимумаб в концентрации 63 и 220 мг/мл), использовали для измерения усилия, необходимого для опорожнения шприца. Образцы адалимумаба с концентрацией 220 мг/мл разбавляли соответственно до 200 мг/мл, 150 мг/мл и 100 мг/мл и производили оценку. Шприц Z2.5/TN1S Zwick использовали с постоянной скоростью подачи 80 мм/мин. Вязкость композиций определяли при помощи микровискозиметра Anton Paar, тип AWVn, при 20°С. Приведенные ниже данные показывают, что диаметр иглы и шприца оказывают значительное влияние на усилие скольжения при опорожнении шприца. Весьма удивительным является то, что высококонцентрированный раствор с концентрацией 220 мг/мл (вязкость 27,9 спз при 20°С) можно выводить, прилагая такое же усилие, что и в случае менее концентрированной композиции с концентрацией 63 мг/мл (вязкость 1,8 спз при 20°С).
|
Приведенные выше данные показывают, что такие композиции даже с высокой концентрацией белка можно вводить при помощи шприца, например, подкожно.
Примеры 25-28
В примерах 25-28 описаны эксперименты по определению устойчивости разных композиций, содержащих антитело, полученное в воде, (определяемых в примерах 26-28 как белковые композиции с низкой ионной силой) в процессе замораживания/оттаивания. При выполнении указанных экспериментов оценивали поведение ряда антител при замораживании/оттаивании, подвергая разные белковые композиции 4-кратному изменению состояния между замороженным и жидким. Препараты замораживали в морозильной камере с регулируемой температурой при -80°С и оттаивали на водяной бане с регулируемой температурой при 25°С. Примерно 25 мл каждого раствора антитела вводили в 30-мл контейнеры из полиэтилентерефталат-гликоля (PETG) для выполнения указанной серии экспериментов.
Образование невидимых частиц вызывает наибольшее беспокойство в случае фармацевтических белковых композиций. Считается, что невидимые частицы белка оказывают отрицательное воздействие в клинической практике в такой же или даже большей степени, чем другие продукты разложения, такие как растворимые агрегаты и химически модифицированные молекулы, которые оцениваются и подвергаются количественному определению в качестве одной из составных частей программ исследования и гарантии качества продуктов (Carpenter, J.F. et al., Commentary: Overlooking subvisible particles in therapeutic protein products: baps that may compromise product quality. J. Pharm. Sci., 2008). Как показано в приведенных ниже примерах, многие антитела оставались устойчивыми - особенно в отношении образования невидимых частиц - при использовании в композиции по настоящему изобретению.
Пример 25
Устойчивость адалимумаба, полученного в воде с использованием неионных наполнителей, при замораживании/оттаивании
В следующем примере рассмотрена устойчивость антитела, например, адалимумаба, в водной композиции и в водных композициях с добавлением неионных наполнителей. Аликвоты образцов, полученных в примерах 21 и 22, подвергали экспериментам по замораживанию/оттаиванию и анализировали методом вытеснительной ВЭЖХ. Данные сравнивали с результатами вытеснительной ВЭЖХ, полученными в экспериментах по замораживанию/оттаиванию с использованием адалимумаба в буфере следующего состава: 10 мМ фосфатного буфера, 100 мМ хлорида натрия, 10 мМ цитратного буфера, 12 мг/мл маннита, 0,1% полисорбата 80, рН 5,2. Адалимумаб в указанном буфере использовали в концентрации 50 мг/мл и 200 мг/мл. Циклы замораживания/оттаивания выполняли в колпачках Eppendorf, при этом препарат замораживали до -80°С и хранили в морозильной камере в течение 8 часов, затем оттаивали при комнатной температуре в течение 1 часа и отбирали образцы. Каждую композицию подвергали 5 циклам замораживания/оттаивания, то есть циклам 0, 1, 2, 3, 4 и 5, описанным в приведенных ниже таблицах.
Метод ВЭЖХ
Анализ SEC адалимумаба: колонка Sephadex 200 (№ по каталогу фармакопеи 175175-01). Подвижная фаза: 20 мМ фосфата натрия, 150 мМ хлорида натрия, рН 7,5, скорость потока 0,5 мл/мин, комнатная температура, обнаружение УФ-излучения при длине волны 214 нм и 280 нм. Каждый образец разбавляли до 1,0 мг/мл водой Milli-Q, образец вводили в количестве 50 мкг (дублированное введение).
Исследование адалимумаба при циклическом замораживании/оттаивании
В таблице 62 приведены данные чистоты адалимумаба во время экспериментов по замораживанию/оттаиванию. Для ознакомления с составом образца обратитесь к примерам 21 и 22.
|
Заключение
В приведенном выше примере рассмотрен эксперимент, в котором адалимумаб, обработанный методом DF/UF в воду (стерилизованная вода для инъекций, соответствующая нормам европейской фармакопеи/ фармакопеи США) и объединенный с разными неионными наполнителями, подвергали циклическому замораживанию/оттаиванию. Полученные данные (приведенные в таблице 62) свидетельствуют о благоприятной устойчивости белка во всех испытанных композициях. Все композиции содержали более 98,5% мономера после 5 циклов замораживания/оттаивания при минимальных количествах агрегата или фрагментов в процессе выполнения указанных циклов.
Пример 26
Устойчивость низкоионных растворов антитела 1D4.7 при замораживании/оттаивания
Белок 1D4.7 (IgG1 против IL-12/IL-23), который вводили в воду путем диализа (с использованием кассет slide-a-lyzer в соответствии с инструкциями по эксплуатации производителя, Pierce, Rockford, IL), оставался устойчивым в течение повторного замораживания/оттаивания (f/t) (-80°С/25°С, водяная баня) при концентрации 2 мг/мл, рН 6. Данные сравнивали с данными для разных композиций (2 мг/мл белка, рН 6), полученных с использованием буферов и наполнителей, обычно используемых при создании белковых композиций, предназначенных для парентерального введения. Было установлено, что устойчивость антитела 1D4.7, полученного в воде, выше устойчивости антитела 1D4.7, полученного в специальных буферных системах (например, 20 мМ гистидина, 20 мМ глицина, 10 мМ фосфата или 10 мМ цитрата), и даже выше устойчивости композиций антитела 1D4.7, полученных на основе универсального буфера (10 мМ фосфата, 10 мМ цитрата), с добавлением разных наполнителей, обычно используемых для стабилизации белковых композиций, например, 10 мг/мл маннита, 10 мг/мл сорбита, 10 мг/мл сахарозы, 0,01% полисорбата 80 или 20 мМ NaCl.
Устойчивость белка контролировали при помощи SEC, DLS и анализа методом подсчета частиц, при выполнении которого использовали систему подсчета частиц в диапазоне измерения 1-200 мкм (счетчик частиц Model Syringe, Markus Klotz GmbH, Bad Liebenzell, Germany). Ниже приведено подробное описание эксперимента:
- антитело 1D4.7, полученное в воде, сравнивали с вышеуказанными композициями;
- 4 цикла замораживания/оттаивания;
- 30-мл контейнер из PETG, заполняемый объем примерно 20 мл, 2 мг/мл белка, рН 6;
- отбор образцов в моменты времени Т0, Т1 (то есть после первой стадии замораживания/оттаивания), Т2, Т3 и Т4;
- аналитическая часть: визуальный осмотр, SEC, DLS, измерение невидимых частиц.
На фиг.33 показана устойчивость антитела 1D4.7 во время повторных циклов замораживания/оттаивания (-80°С/25°С), определяемая по образованию невидимых частиц >1 мкм. Антитело 1D4.7 было получено в универсальном буфере (10 мМ цитрата, 10 мМ фосфата) и испытано с добавлением разных наполнителей: сорбит (10 мг/мл), маннит (10 мг/мл), сахароза (10 мг/мл), NaCl (100 мМ) и полисорбат 80 (0,01%). Антитело 1D4.7 было также получено в воде (путем диализа) без добавления наполнителей (”вода” на фиг.33). Воду для инъекций также подвергали циклическому замораживанию/оттаиванию и анализу на образование невидимых частиц для оценки возможного влияния обработки, то есть замораживания/оттаивания, и отбора образцов на количество частиц.
Устойчивость антитела 1D4.7, полученного в воде, при замораживании/оттаивании была выше устойчивости растворов антитела 1D4.7, полученных с добавлением наполнителей, обычно используемых в белковых композициях. Известно, что маннит, сахароза и сорбит действуют в качестве лиопротекторов и/или криопротекторов, и полисорбат 80 является неионным наполнителем, используемым главным образом для повышения физической стойкости белков, испытывающих воздействие на поверхностях раздела между гидрофильной и гидрофобной фазами, таких как воздух-вода и лед-вода.
Таким образом, растворы антитела 1D4.7, полученные в воде, были удивительно устойчивыми при анализе разными аналитическими методами, обычно используемыми для контроля устойчивости фармацевтических белков в процессе замораживания/оттаивания (например, SEC, визуальный осмотр, динамическое рассеяние света и особенно затемнение света).
Пример 27
Устойчивость низкоионных растворов антитела 13С5.5 при замораживании/оттаивания
Антитело 13С5.5 (IgG1 против IL-13), полученное в воде, оставалось устойчивым в процессе повторного замораживания/оттаивания (-80°С/25°С, водяная баня) при концентрации 2 мг/мл, рН 6. Полученные данные сравнивали с другими композициями (2 мг/мл белка, рН 6), при этом было установлено, что устойчивость антитела 13С5.5, полученного в воде, выше устойчивости антитела 13С5.5, полученного в буферных системах, часто используемых в белковых композициях, предназначенных для парентерального введения (например, 20 мМ гистидина, 20 мМ глицина, 10 мМ фосфата или 10 мМ цитрата), и даже выше устойчивости композиций антитела 13С5.5, полученных на основе универсального буфера (10 мМ фосфата, 10 мМ цитрата), с добавлением разных наполнителей, обычно используемых в белковых композициях (например, 10 мг/мл маннита, 10 мг/мл сорбита, 10 мг/мл сахарозы, 0,01% полисорбата 80 или 20 мМ NaCl, 200 мМ NaCl).
Получение образцов, экспериментальную обработку, отбор и анализ образцов выполняли в соответствии с приведенными выше примерами.
- антитело 13С5.5, полученное в воде, сравнивали с вышеуказанными композициями;
- 4 цикла замораживания/оттаивания;
- 30-мл контейнер из полиэтилентерефталат-гликоля (PETG);
- 2 мг/мл, рН 6;
- отбор образцов в моменты времени Т0, Т1, Т2, Т3 и Т4;
- аналитическая часть: визуальный осмотр, SEC, DLS, измерение невидимых частиц.
На фиг.34 показана устойчивость антитела 13С5.5 во время повторных циклов замораживания/оттаивания (-80°С/25), определяемая по образованию невидимых частиц >10 мкм. Антитело 13С5.5 было получено в 10 мМ фосфатного буфера, 10 мМ цитратного буфера, 20 мМ глицинового буфера и 20 мМ гистидинового буфера. Антитело 13С5.5 было также получено в композиции по настоящему изобретению (путем диализа) без добавления наполнителей. Воду для инъекций также подвергали циклическому замораживанию/оттаиванию и анализу на образование невидимых частиц для оценки возможного влияния обработки, то есть замораживания/оттаивания, и отбора образцов на количество частиц (использована в качестве контрольного образца).
Устойчивость антитела 13С5.5, полученного в воде, при замораживании/оттаивания была выше устойчивости растворов антитела 13С5.5, полученных в буферах, обычно используемых в белковых композициях. Устойчивость растворов антитела 13С5.5 была подтверждена другими аналитическими методами (например, SEC, визуальный осмотр и т.д.).
На фиг.35 показана устойчивость антитела 13С5.5 во время повторных циклов замораживания/оттаивания (-80°С/25°С), определяемая по образованию невидимых частиц >1 мкм. Антитело 13С5.5 было получено в универсальном буфере (10 мМ цитрата, 10 мМ фосфата) и в универсальном буфере с добавлением следующих наполнителей: сорбит (10 мг/мл), маннит (10 мг/мл), сахароза (10 мг/мл), NaCl (200 мМ), NaCl (20 мМ) и полисорбат 80 (0,01%). Антитело 13С5.5 для сравнения было также получено в воде (путем диализа) без добавления наполнителей (чистая вода). Воду для инъекций также подвергали циклическому замораживанию/оттаиванию и анализу на образование невидимых частиц для оценки возможного влияния обработки, то есть замораживания/оттаивания, и отбора образцов на количество частиц.
Устойчивость антитела 13С5.5, полученного в воде, при замораживании/оттаивании была выше устойчивости растворов антитела 13С5.5, полученных с добавлением наполнителей, обычно используемых в белковых композициях. Известно, что маннит, сахароза и сорбит действуют в качестве лиопротекторов и/или криопротекторов, и полисорбат 80 является неионным наполнителем, используемым главным образом для повышения физической стойкости белков, испытывающих воздействие на поверхностях раздела между гидрофильной и гидрофобной фазами, таких как воздух-вода и лед-вода. В образцах антитела 13С5.5, полученного в композиции по настоящему изобретению, было обнаружено удивительно мало невидимых частиц, что свидетельствует о высокой безопасности и устойчивости таких композиций.
Устойчивость растворов антитела 13С5.5, полученных в воде, были подтверждена другими аналитическими методами (например, SEC, визуальный осмотр и т.д.).
Анализ методом DLS растворов антитела 13С5.5 после замораживания/оттаивания выполняли в соответствии с приведенным выше описанием. Результаты анализа методом DLS показали, что раствор антитела 13С5.5 с добавлением 0,01% твина 80 содержал значительное количество высокомолекулярных (HMW) форм агрегата уже после 1-й стадии замораживания/оттаивания, в то время как антитело 13С5.5 в воде не содержало высокомолекулярных форм агрегата даже после 3-х стадий замораживания/оттаивания.
Таким образом, растворы антитела 13С5.5, полученные в воде, являются удивительно устойчивыми при анализе разными аналитическими методами, обычно используемыми для контроля устойчивости фармацевтических белков в процессе замораживания/оттаивания (например, SEC, визуальный осмотр, динамическое рассеяние света и особенно затемнение света).
Пример 28
Устойчивость низкоионных растворов антитела 7С6 при замораживании/оттаивании
Антитело 7С6 (IgG1 против бета-амилоида), полученное в воде, оставалось устойчивым в процессе повторного замораживания/оттаивания (-80°С/25°С, водяная баня) при концентрации 2 мг/мл, рН 6. Полученные данные сравнивали с другими композициями (2 мг/мл белка, рН 6), при этом было установлено, что устойчивость антитела 7С6, полученного в воде, выше устойчивости антитела 7С6, полученного в буферных системах, часто используемых в белковых композициях, предназначенных для парентерального введения, и даже выше устойчивости композиций антитела 7С6, полученных на основе универсального буфера (10 мМ фосфата, 10 мМ цитрата), с добавлением разных наполнителей, обычно используемых в белковых композициях.
Были исследованы следующие составы растворов с целью выявления их способности сохранять физическую стойкость антитела 7С6 во время экспериментов по замораживанию/оттаиванию:
- Фосфатный буфер, 15 мМ
- Цитратный буфер, 15 мМ
- Сукцинатный буфер, 15 мМ
- Гистидиновый буфер, 15 мМ
- Аргининовый буфер, 15 мМ
- Низкоионная белковая композиция без добавления наполнителей
- Универсальный буфер, сорбит (10 мг/мл)
- Универсальный буфер, маннит (10 мг/мл)
- Универсальный буфер, сахароза (10 мг/мл)
- Универсальный буфер, трегалоза (10 мг/мл)
- Универсальный буфер, 0,01% (процентное соотношение массы) полисорбата 80
Получение образцов, экспериментальную обработку, отбор и анализ образцов выполняли в соответствии с описанием, приведенным в примерах 26 и 27.
- Антитело 7С6, полученное в воде, сравнивали с вышеуказанными композициями;
- 4 цикла замораживания/оттаивания;
- 30-мл контейнер из PETG, заполняемый объем равен примерно 20 мл;
- 2 мг/мл, рН 6;
- отбор проб в моменты времени Т0, Т1, Т2, Т3 и Т4;
- Аналитическая часть: устойчивость Аβ-антитела определяли следующими методами:
- Визуальный осмотр раствора белка выполняли в полипропиленовых круглодонных пробирках, в которые вводили образцы для измерений затемнения света. Раствор тщательно исследовали как на черном, так и на белом фоне для выявления признаков, указывающих на физическую неустойчивость белка, таких как слабое помутнение, образование мути и частиц.
- Измерение динамического рассеяния света (устройство AI9494 Zetasizer Nano ZS, Malvern Instruments; оснащенное презиционными ячейками Hellma, особо чистое кварцевое стекло, тип 105.251-QS, проходимый светом путь 3 мм, центр Z8,5 мм, заполнение по меньшей мере 60 мкл образца, для измерений DLS использовали образец белка, оставшийся после измерений затемнения света в полипропиленовых круглодонных пробирках). Выполняли автоматические измерения (1 измерение каждого образца).
- Анализ затемнения света. 3,5 мл образец вводили в 5-мл круглодонную пробирку в условиях ламинарного воздушного потока и измеряли в режиме n=3 (0,8 мл в одном измерении) после первоначальной промывки 0,8 мл.
- Вытеснительная хроматография в сочетании с УФ214/УФ280 и рассеянием света под несколькими углами. Подвижная фаза: 100 мМ Na2HPO4/200 мМ Na2SO4, рН 7,0 (49,68 г безводного динатрийгидрофосфата и 99,44 г безводного сульфата натрия растворяли примерно в 3300 мл воды Milli-Q, рН доводили до 7,0, добавляя 1 М раствор фосфорной кислоты, заполняли до объема 3500 мл водой Milli-Q и раствор фильтровали через мембранный фильтр). Колонку для SEC, TSK-гель G3000SW (№ по каталогу 08541), 7,8 мм × 30 см, 5 мкм, объединяли с защитной колонкой из TSK-геля (№ по каталогу 08543) 6,0 мм × 4,0 см, 7 мкм. Скорость потока 0,3 мл/мин, вводимый объем 20 мкл (эквивалентен 20 мкг образцу), температура колонки соответствовала комнатной температуре, температура автоматического пробоотборника 2-8°С, время анализа 50 минут, изократический градиент, поршень промывали 10% изопропиловым спиртом, обнаружение производили на основании оптической плотности при УФ-излучении, детектор с диодной матрицей: длина волны 214 нм, ширина пика >0,1 мин, ширина полосы: 8 нм, эталонная длина волны 360 нм, ширина полосы 100 нм.
На фиг.36 показана устойчивость антитела 7С6 во время повторных циклов замораживания/оттаивания (-80°С/25°С), определяемая по образованию невидимых частиц >1 мкм. Устойчивость антитела 7С6, полученного в воде, при замораживании/оттаивании во многих композициях была выше устойчивости растворов антитела 7С6, полученных в буферах, обычно используемых в белковых композициях. Устойчивость растворов антитела 7С6, полученных в воде, была подтверждена другими аналитическим методами (например, SEC, визуальный осмотр, динамическое рассеяние света).
Весьма удивительным является то, что устойчивость антитела 7С6, полученного в воде, при замораживании/оттаивании была выше устойчивости растворов антитела 7С6, полученных с добавлением наполнителей, обычно используемых в белковых композициях. Известно, что маннит, сахароза и сорбит действуют в качестве лиопротекторов и/или криопротекторов, и полисорбат 80 является неионным наполнителем, используемым главным образом для повышения физической стойкости белков, испытывающих воздействие на поверхностях раздела между гидрофильной и гидрофобной фазами, таких как воздух-вода и лед-вода. Количество невидимых частиц в образцах антитела 7С6, полученного в композиции по настоящему изобретению, было очень низким, свидетельствуя о высокой безопасности и устойчивости таких композиций.
Таким образом, растворы антитела 7С6, полученные в воде, являются удивительно устойчивыми при анализе разными аналитическими методами, обычно применяемыми для контроля устойчивости фармацевтических белков при замораживании/оттаивании (например, SEC, визуальный осмотр, динамическое рассеяние света и особенно затемнение света).
Пример 29
Получение антитела J695 в воде и исследования его устойчивости
Вещества и методы
427,1 г (80 мг/мл) антитела J695 разбавляли до концентрации, равной 40 мг/мл, и подвергали диафильтрации с использованием чистой воды. После 5-кратного объемного обмена с очищенной водой (теоретическое уменьшение количества наполнителей 99,3%) раствор белка подвергали ультрафильтрации до достижения целевой концентрации, равной 100 мг/мл. Измерения рН, осмоляльности, плотности, визуальный осмотр и измерение концентрации белка (OD280) выполняли для контроля состояния белка после обработки DF/UF.
После обработки DF/UF раствор белка стерилизовали фильтрованием (мембранный фильтр Sterivex GV 0,22 мкм) в 60-мл бутылку из PETG (Nalgene) и хранили при -80°С в течение 3 месяцев.
После оттаивания при 37°С раствор стерилизовали фильтрованием (мембранный фильтр Sterivex GV 0,22 мкм), вводили в стерильные шприцы 29G BD Hypak Physiolis SCF™ длиной 1 мл, ½ дюйма, концевой срез 5, RNS TPE, и закрывали стерильными 1-мл поршнями BD Hypak SCF™ W4023/50 Flur Daikyo. Заполняемый объем шприца был равен 1,000 мл.
Заполненные шприцы хранили соответственно при 2-8°С и 40°С и анализировали в соответствии с приведенной ниже схемой отбора образцов.
- Лекарственное вещество антитела J695 (коэффициент экстинкции при длине волны 280 нм: 1,42 мл/мг см); лекарственное вещество, рН 6,0, не содержало полисорбат 80.
- Система для диафильтрации Sartorius Sartocon Slice, оснащенная полиэфирсульфоновыми (PES) мембранными кассетами Ultrasert (отсечение молекулярной массы 50 кДа). Систему Sartocon Slice использовали в непрерывном режиме при комнатной температуре в соответствии с инструкциями по эксплуатации Sartorius.
- Электроды для измерения рН.
- УФ/VIS спектрофотометр Perkin Elmer, Lambda 25, использовали для измерений концентрации (длина волны 280 нм). Одноразовые кюветы для УФ-излучения, 1,5 мл, полумикро, использовали для измерений концентрации.
- Очищенную воду, фильтрованную через фильтр с размером пор 0,22 мкм, использовали в качестве среды для DF/UF.
- Измеритель плотности DMA 4100 Anton Paar использовали для измерений плотности.
- Осмометр Knauer типа ML использовали для измерений осмоляльности (калиброванный калибровочным раствором 400 мОсмоль/кг NaCl, № Y1241, Herbert Knauer GmbH, Berlin, Germany).
Аналитические методы
- Анализ методом SEC антитела J695: колонка Superdex 200 (Pharmacia). Подвижная фаза: 92 мМ динатрийгидрофосфата, 211 мМ сульфата натрия, рН 7,0, скорость потока 0,75 мл/мин, комнатная температура, обнаружение производили при УФ-излучении с длиной волы 214 нм. Каждый образец разбавляли подвижной фазой до 2,0 мг/мл, образец вводили в количестве 20 мкг (дублированное введение).
- Анализ методом IEC антитела J695: колонка Propac WCX-10, Dionex, вместе с соответствующей защитной колонкой. Условия разделения: подвижная фаза А: 20 мМ динатрийгидрофосфата и 20 мМ ацетата натрия, рН 7,0; подвижная фаза В: 20 мМ динатрийгидрофосфата, 400 мМ хлорида натрия, рН 5,0. Скорость потока 1,0 мл/мин, комнатная температура. Каждый образец разбавляли до 1,0 мг/мл водой Milli-Q, образец вводили в количестве 100 мкг (дублированное введение).
- Анализ методом SDS-PAGE антитела J695: акриламидные гели Novex (8-16% для невосстановительных условий, 12% для восстановительных условий, Invitrogen). Образцы окрашивали кумассии (Invitrogen). Разделение производили в восстановительных (β-меркаптоэтанол) и невосстановительных условиях с использованием трис-глицинового буфера, полученного в результате 10-кратного разбавления исходного раствора (Invitrogen).
- Количественное определение буферных компонентов в препарате антитела J695:
- Маннит: разделение производили на колонке Ca ReproGel (Dr. Maisch, Germany) и продукт обнаруживали на основании показателя преломления (RI), подвижная фаза: деионизированная вода, скорость потока 0,6 мл/мин, образец вводили в количестве 20 мкл. Количественное определение выполняли, используя стандартную калибровочную кривую.
- Гистидин и метионин: флуоресцентное мечение аминокислот выполняли ортофталевым альдегидом (ОРА), разделение производили при помощи ВЭЖХ на колонке ODS-3 ReproSil (Dr. Maisch, Germany) и флуоресцентное обнаружение осуществляли при длине волны 420 нм (экстинкция при 330 нм), подвижная фаза А: 70% буфера на основе лимонной кислоты (10,51 г/л), рН 6,5, 30% метанола, подвижная фаза В: метанол, скорость потока 1,0 мл/мин, образец вводили в количестве 20 мкл. Количественное определение выполняли, используя стандартную калибровочную кривую.
- Анализ методом PCS антитела J695 выполняли, используя неразбавленный раствор с концентрацией 100 мг/мл в одноразовых пластиковых кюветах при 25°С, при помощи устройства Zetasizer nano ZS Malvern Instruments под углом 173°, принимая вязкость раствора, равной 4,3875 мПа*с, показатель преломления белка был равен 1,450 и показатель преломления буферного раствора был равен 1,335. Приведены усредненные результаты 20 сканирований по 20 секунд каждое.
Вычисление концентрации белка
Формула для вычисления:
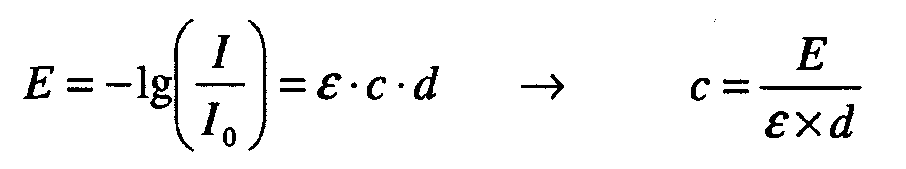
ε - коэффициент поглощения
с - концентрация
d - длина кюветы, проходимой светом
Е - оптическая плотность
I0 - начальная интенсивность света
I - интенсивность света после прохождения через образец
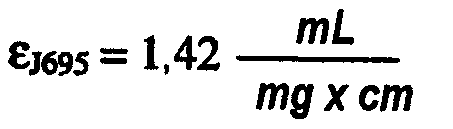
Схема отбора образцов
Образцы полученных растворов хранили при указанных ниже температурах и отбирали (х) в указанные моменты времени после начала исследования (таблица 63). Испытуемые параметры и методы испытания приведены в таблице 64.
|
|
Обработка антитела J695 методом DF/UF
В таблице 65 приведены характеристики состояния антитела J695 после диафильтрации.
|
После выполнения DF/UF производили количественное определение концентраций компонентов исходного буфера для оценки эффективности диафильтрации. Было установлено, что все результаты были ниже практических пределов обнаружения (см. таблицу 66) соответствующих аналитических методов (ВЭЖХ и показатель преломления для маннита и флуоресцентное обнаружение для метионина и гистидина после мечения ОРА).
|
Исследование антитела J695 при хранении
В нижеследующей таблице 67 приведены данные об устойчивости антитела J695 в концентрации 100 мг/мл при хранении после выполнения DF/UF.
|
|
Заключение
В приведенном выше примере описан эксперимент по диафильтрации/ультрафильтрации (DF/UF), в котором в качестве диафильтрующей среды для моноклонального антитела J695 была использована вода (вода, очищенная фильтрацией через фильтр с размером пор 0,22 мкм).
Антитело J695 подвергали обработке DF/UF, используя чистую воду в качестве обменной среды для DF/UF, и получали при рН около 6,4 в высокой концентрации (100 мг/мл) без легкого помутнения раствора, сильной опалесценции или образования мути.
Антитело J695, полученное в результате выполнения экспериментов по DF/UF, хранили в шприцах SCF при 2-8°С и 40°С в течение периода времени до 6 месяцев. Полученные данные указывают на благоприятную устойчивость белка.
В заключение следует отметить, что белки можно обрабатывать и получать с использованием чистой воды в качестве обменной среды для DF/UF. Если предположить наличие идеальной 100% проницаемости наполнителя через мембрану, то максимальное уменьшение количества наполнителей может быть равно 99,3%. Данные, полученные в результате выполнения специальных методов, показывают, что после выполнения DF/UF концентрация наполнителей находится ниже практически обнаруживаемых пределов.
Пример 30
Характеристики замораживания/оттаивания и определение устойчивости высококонцентрированного водного раствора адалимумаба - гомогенность и физическая стойкость
Получение низкоионных растворов адалимумаба
1,6 л лекарственного вещества (DS) в 2-л бутылке из PETG оттаивали при 25°С на водяной бане, гомогенизировали и подвергали DF/UF, используя воду для инъекций в качестве обменной среды для диафильтрации. Диафильтрацию выполняли в непрерывном режиме при помощи оборудования Sartorius Sartocon Slice с заданием следующих параметров:
- производительность насоса: 8%;
- давление на входе: максимум 1 бар (0,8 бара);
- мембрана: 2 х PES, отсечение молекулярной массы 50 кДа.
Во время диафильтрации 5-кратный объемный обмен был достаточным для уменьшения осмоляльности до 8 мОсмоль/кг.
Образцы для контроля процесса (IPC) отбирали до выполнения диафильтрации (SEC, концентрация белка, определяемая путем измерения OD280, рН, осмоляльность и плотность) и после выполнения диафильтрации (концентрация белка, определяемая путем измерения OD280, рН, осмоляльность и плотность). Образцы для IPC не были стерильными.
После диафильтрации ~70 мг/мл адалимумаба в воде разбавляли до 50 мг/мл водой для инъекций и значение рН доводили до 5,2.
1,6 л адалимумаба (50 мг/мл), полученного в воде при рН 5,2, вводили в 2-л бутылку из PETG. Остальной объем раствора адалимумаба подвергали DF/UF для увеличения концентрации до 100 мг/мл.
Адалимумаб в концентрации 100 мг/мл, полученный в воде при рН 5,3, стерилизовали фильтрованием и 0,8 л раствора вводили в 1-л бутылку из PETG.
Аналитическая часть
- Вытеснительная хроматография (SEC)
- Измерение рН
- Измерение осмоляльности
- Измерение плотности
- Определение концентрации белка путем измерения OD280
- Оптические характеристики
- Ионообменная хроматография (IEC)
Эксперимент по замораживанию/оттаивания адалимумаба в 1-л контейнерах
Раствор адалимумаб в воде в концентрации 100 мг/мл, введенный в 1-л контейнеры из PETG, предварительно охлаждали до 2-8°С и затем замораживали при -80°С, цикл замораживания >12 часов. Замороженные образцы в 1-л бутылках из PETG оттаивали при 25°С на водяной бане. Во время оттаивания бутылки с замороженными растворами погружали в водяную баню до уровня жидкости. Сразу же после оттаивания отбирали образцы без гомогенизации и после гомогенизации путем 15 и 30 переворачиваний бутылок.
|
Исследование растворов адалимумаба
Растворы адалимумаба в воде с концентрацией 50 мг/мл и 100 мг/мл все время были прозрачными, светло-желтыми, неопалесцентными и без эффекта волны после осторожного перемещения бутылки.
Кроме того, после замораживания и оттаивания у раствора адалимумаба в воде не изменялся внешний вид (сразу же после оттаивания, а также после 15 и 30 переворачиваний бутылки).
Слабый эффект волны возникал после осторожного перемещения бутылки сразу же после оттаивания и погружения иглы в раствор во время отбора проб.
В отличие от аналогичных экспериментов с использованием адалимумаба в промышленном буфере в растворе адалимумаба в воде в концентрации 50 мг/мл не было обнаружено градиентов концентрации белка, плотности и осмоляльности.
В растворе адалимумаба с концентрацией 100 мг/мл также не было обнаружено градиентов концентрации белка, плотности, осмоляльности.
Устойчивость определяли после хранения в течение 6 месяцев соответственно при -30°С и -80°С.
Ниже приведены соответствующие аналитические данные.
|
|
|
|
Заключение
В адалимумабе, полученном в воде в концентрациях 50 и 100 мг/мл, который исследовали аналитическими методами, не было обнаружено значительной неустойчивости после замораживания/оттаивания и после хранения при -30°С или -80°С в течение периода времени до 6 месяцев.
Пример 31
Процесс замораживания и оттаивания адалимумаба в низкоионной концентрации - пространственная схема процесса, включая содержание белка
Получение раствора
Нерасфасованное лекарственное вещество (BDS) адалимумаба оттаивали на вращающейся водяной бане при 23°С. Раствор концентрировали до требуемой концентрации, равной 100 мг/мл, с целью уменьшения объема методом ультрафильтрации/диафильтрации (UF/DF) (Pellicon ”Mini” 2). В устройство Pellicon 2 вставляли две миникассеты с тангенциальным потоком Millipore Pellicon 2, заполненные полиэфирсульфоном Biomax 10K. В начале процесса скорость потока была равна 60 мл/мин и давление подачи было равно 21 фунт/кв.дюйм. Процесс заканчивали при достижении концентрации белка 111,3 мг/мл.
Для диализа использовали систему трубок с молекулярной пористой мембраной (диаметр 48 мм, объем 18 мл/см, длина 75 см). Адалимумаб объемом 8 л с концентрацией 100 мг/мл при рН 5,2 переносили в 8 диализных трубок. Каждую трубку заполняли 1 л адалимумаба с концентрацией 100 мг/мл. Четыре трубки, содержащие 4 л раствора, помещали в контейнер с 36 л воды для инъекций, то есть коэффициент обмена раствора был равен 1:10. Раствор оставляли до достижения равновесия, после чего для объемного обмена использовали свежую воду для инъекций. Обмен раствора повторяли 5 раз, пока коэффициент обмена раствор не был равен 1:100000.
После того как был произведен полный обмен раствора путем диализа, раствор концентрировали, выполняя вторую стадию UF/DF. Вторую стадию UF/DF выполняли аналогично первой стадии. Конечная концентрация адалимумаба в низкоионной композиции была равна 247,5 мг/мл. Процесс UF/DF выполняли, используя исходное вещество, уже содержащее полисорбат 80. Можно предположить, что содержание полисорбата 80, накопленного в конечном растворе белка, стало больше 0,1%.
Концентрированный нерасфасованный раствор адалимумаба с концентрацией 247,5 мг/мл при необходимости разбавляли водой для инъекций до более низких концентраций белка: 200 мг/мл, 175 мг/мл, 150 мг/мл, 140 мг/мл, 130 мг/мл, 120 мг/мл, 100 мг/мл, 80 мг/мл, 50 мг/мл, 40 мг/мл и 25 мг/мл. Заполняемый объем бутылки был равен 1600 мл во всех экспериментах.
Процедуры замораживания
В данном исследовании использовали серию возрастающих скоростей замораживания: нижняя полка морозильной камеры со сверхнизкой температурой < средняя полка морозильной камеры со сверхнизкой температурой < верхняя полка морозильной камеры со сверхнизкой температурой << сухой лед.
В экспериментах использовали морозильную камеру с температурой <-70°С (емкость: 572 литра (20,2 куб.футов). Использовали три полки. На каждую полку ставили девять 2-л бутылок из PETG. Бутылки хранили при комнатной температуре до установки в морозильную камеру. Замораживание продолжали в течение по меньшей мере 48 часов. Для оценки пространственной схемы были выбраны три положения с возрастающими скоростями замораживания. Переднее положение на нижней полке характеризовалось наименьшей скоростью замораживания. Более быстрые скорости замораживания были характерны для центрального положения на средней полке. Замораживание с самой быстрой скоростью в морозильной камере происходило в заднем/правом положении на верхней полке.
Для замораживания с помощью сухого льда одну бутылку полностью окружали сухим льдом в течение по меньшей мере 8 часов. Основание ящика из пеностирола покрывали слоем сухого льда (толщиной примерно 3-5 см). Одну бутылку ставили поверх слоя сухого льда. Пространство между бутылкой и внутренними стенками ящика из пеностирола заполняли сухим льдом так, что были закрыты все поверхности кроме крышки. По истечении времени замораживания бутылку удаляли и сразу же оттаивали или помещали в морозильную камеру при -70°С для хранения.
Процедуры оттаивания
Данный эксперимент выполняли при нескольких скоростях оттаивания: охлажденный воздух при 4°С << водяная баня при 23°С < водяная баня при 37°С.
Аналитическая часть
Для исследования образцов производили следующими аналитические измерения:
- осмоляльность;
- проводимость;
- рН;
- плотность;
- концентрация белка, определяемая путем измерения прямого УФ-излучения (280 нм).
Для определения концентрации образцы разбавляли водой до достижения оптической плотности <1,2. Коэффициент поглощения для молекулы адалимумаба при 280 нм был равен 1,39.
Исследование растворов адалимумаба
Картирование бутылок выявило незначительную тенденцию к образованию градиента в объеме бутылки. Более высокие концентрации белка были обнаружены у основания бутылки при более низких скоростях замораживания и оттаивания. Указанное явление нашло отражение также в данных проводимости, плотности и осмоляльности. Показатель рН оставался практически постоянным во всех испытанных условиях.
В предшествующих исследованиях пространственной схемы замораживания и оттаивания для бутылок в морозильных камерах со сверхнизкими температурами появление осадка были признано главным недостатком, определяющим границы допустимого рабочего режима. В данном исследовании такая граница не была обнаружена, несмотря на то, что рассмотренная пространственная схема охватывали очень широкие диапазоны. Уникальное поведение данного продукта также нашло отражение в очень низкой тенденции образования градиентов концентрации во время процесса замораживания и оттаивания. В предшествующих исследованиях был сделан вывод о том, что образование градиента, присущее данному продукту и процессу, является причиной появления осадка в определенных условиях выполнения процесса. Поэтому было признано, что с точки зрения процесса данная система пригодна для получения адалимумаба в низкоионной композиции с рН 5 до концентрации нерасфасованного лекарственного вещества, равной 247,5 мг/мл. Исследованная водная композиция адалимумаба по настоящему изобретению продемонстрировала лучшие характеристики по сравнению с другими испытанными композициями адалимумаба.
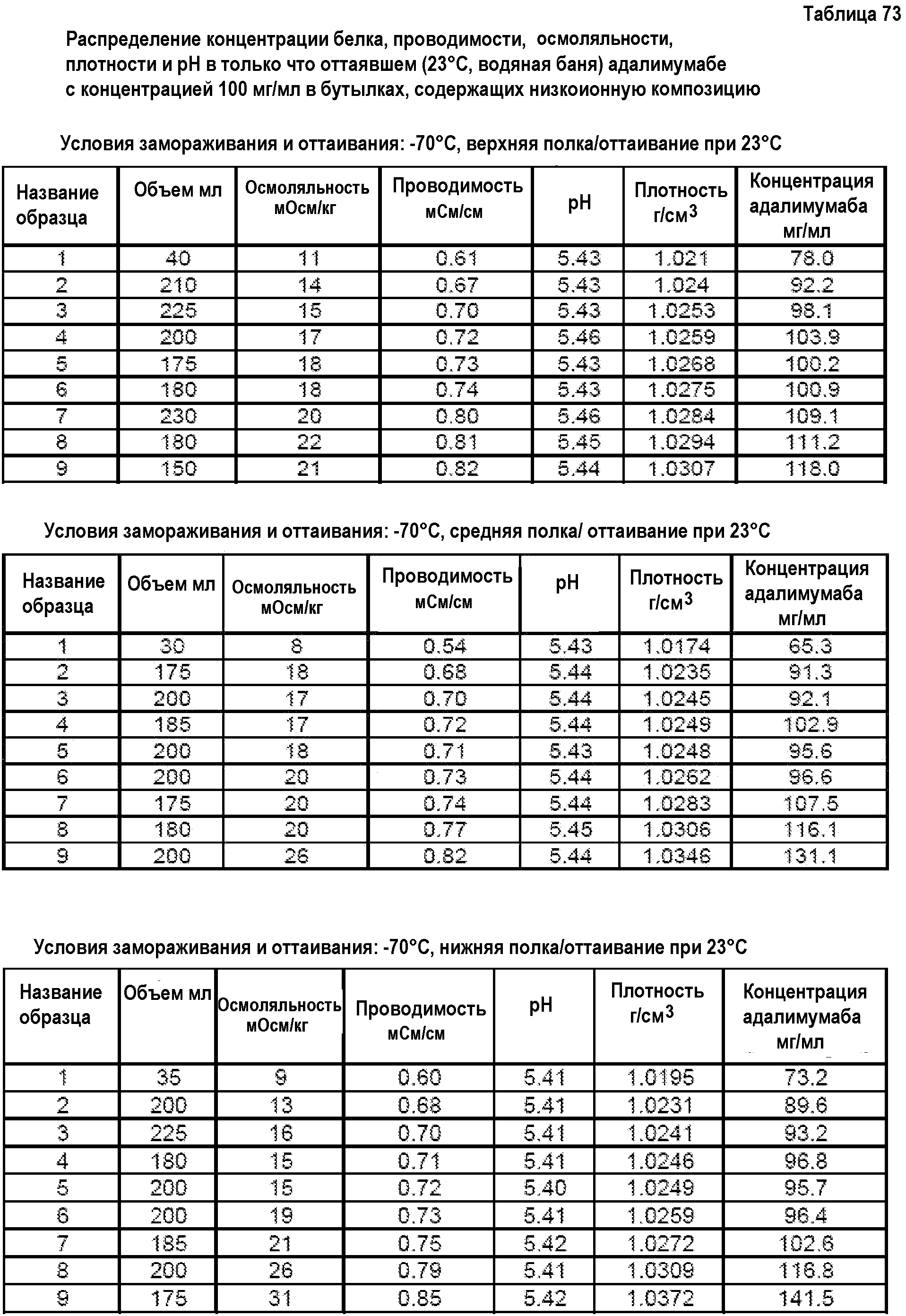
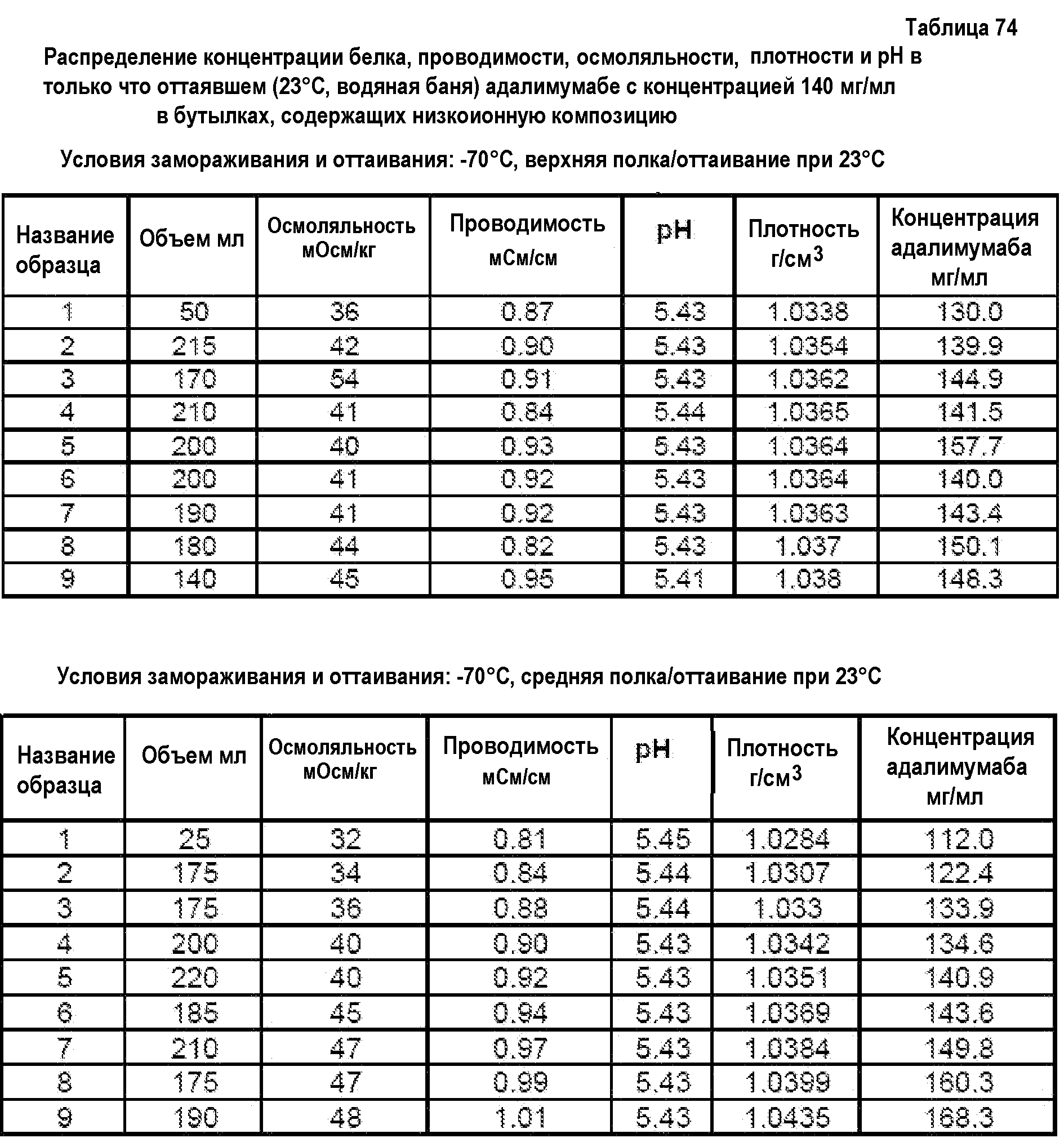
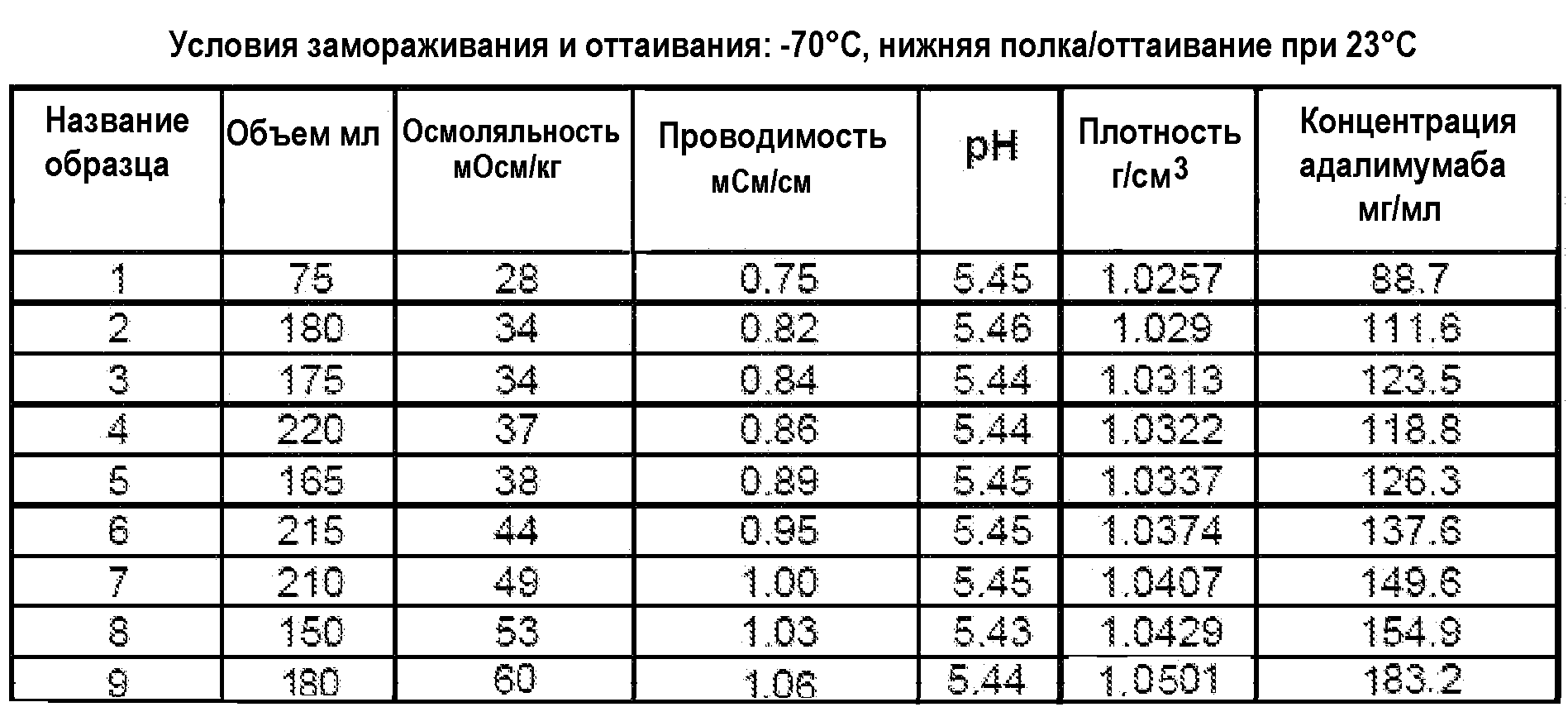
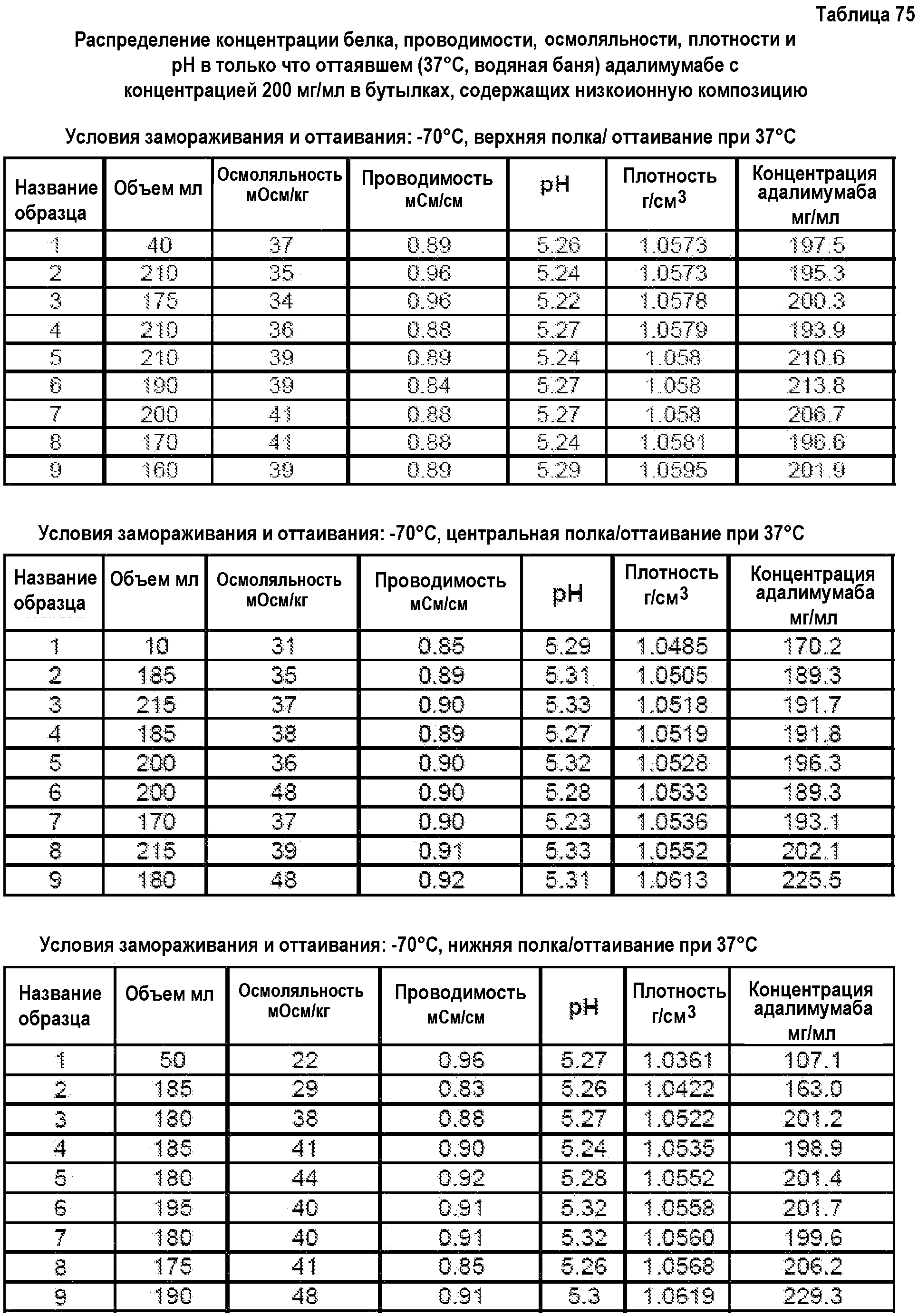
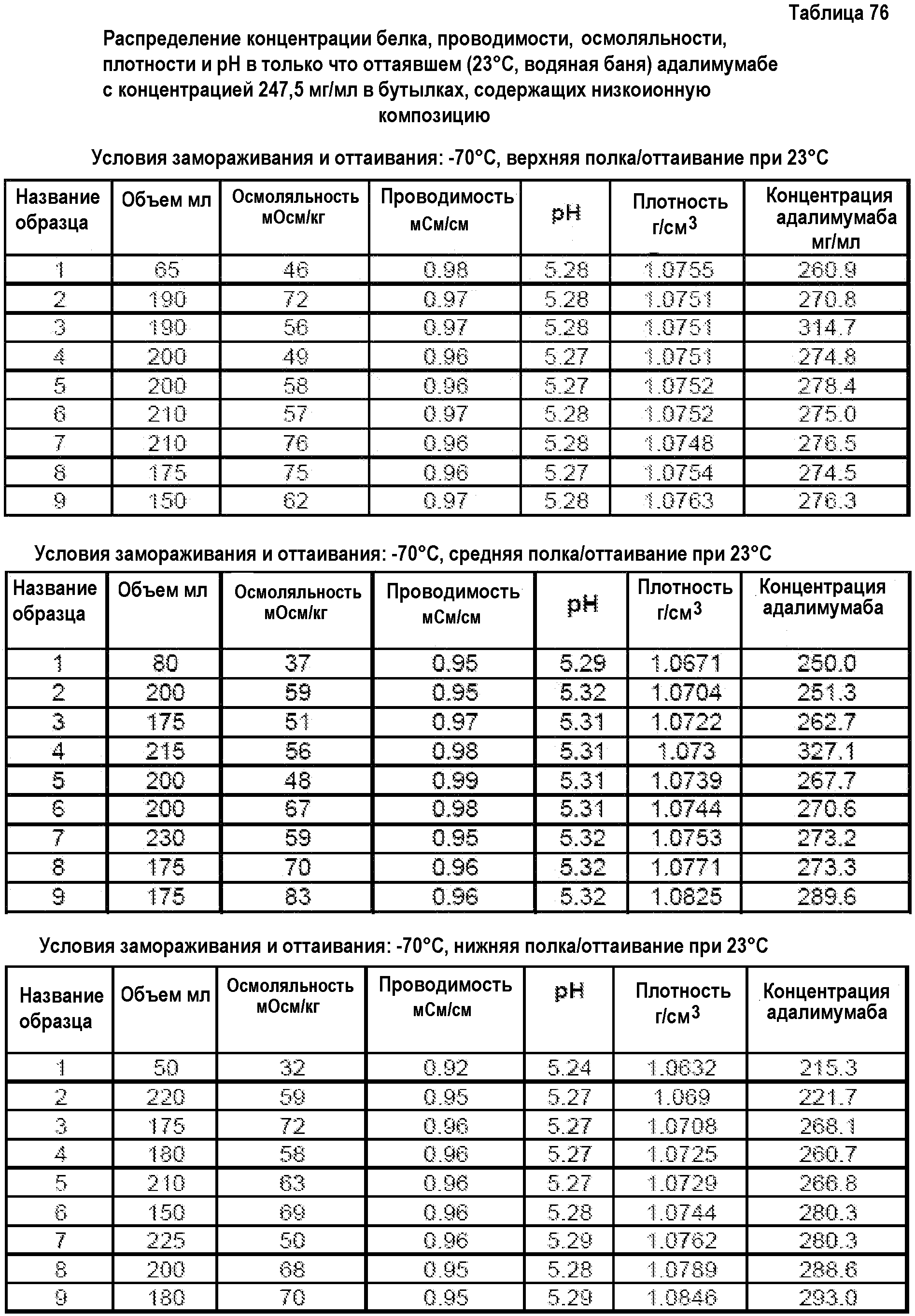
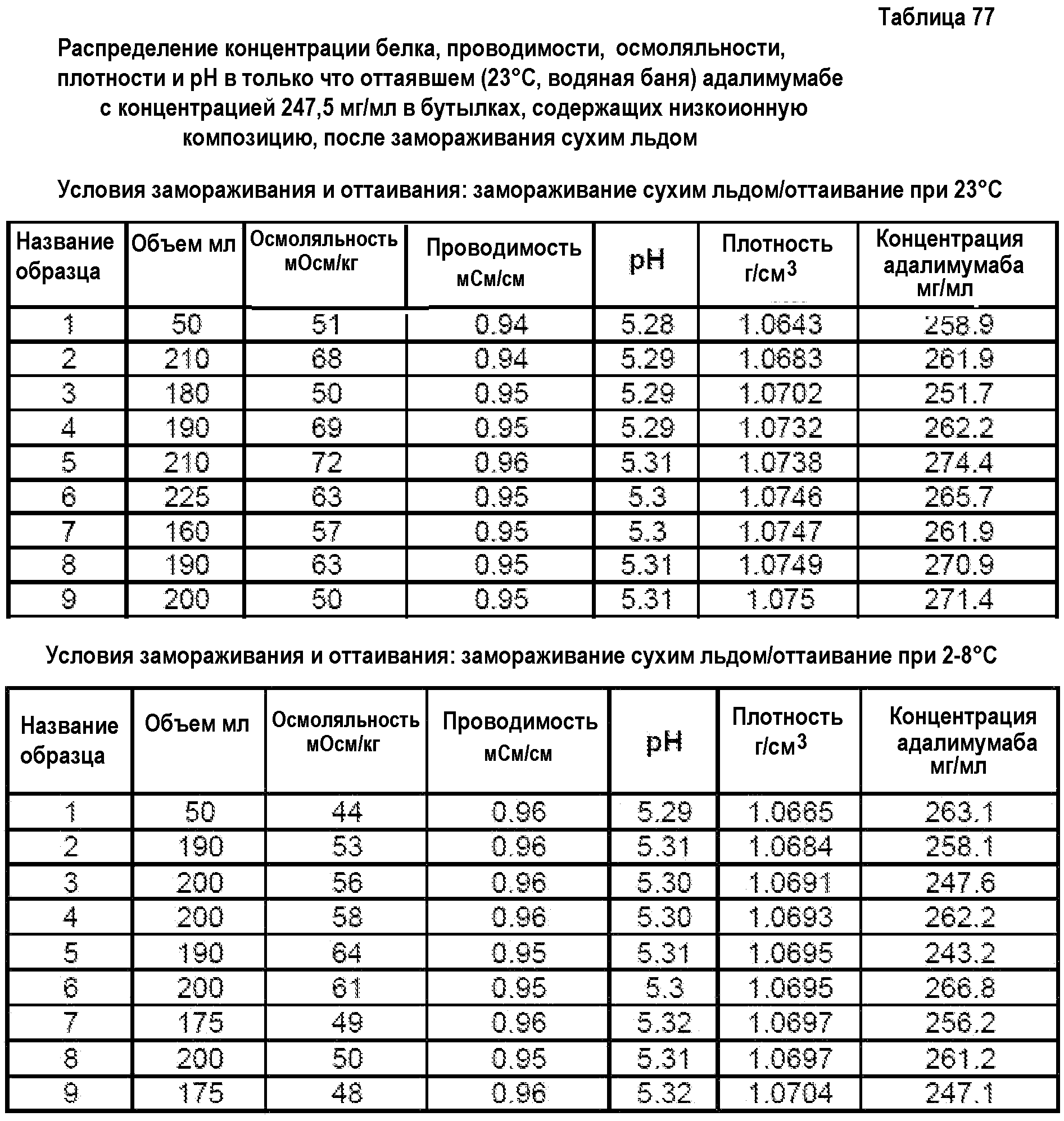
Приложение А. Данные фотонно-корреляционной спектроскопии (PCS)
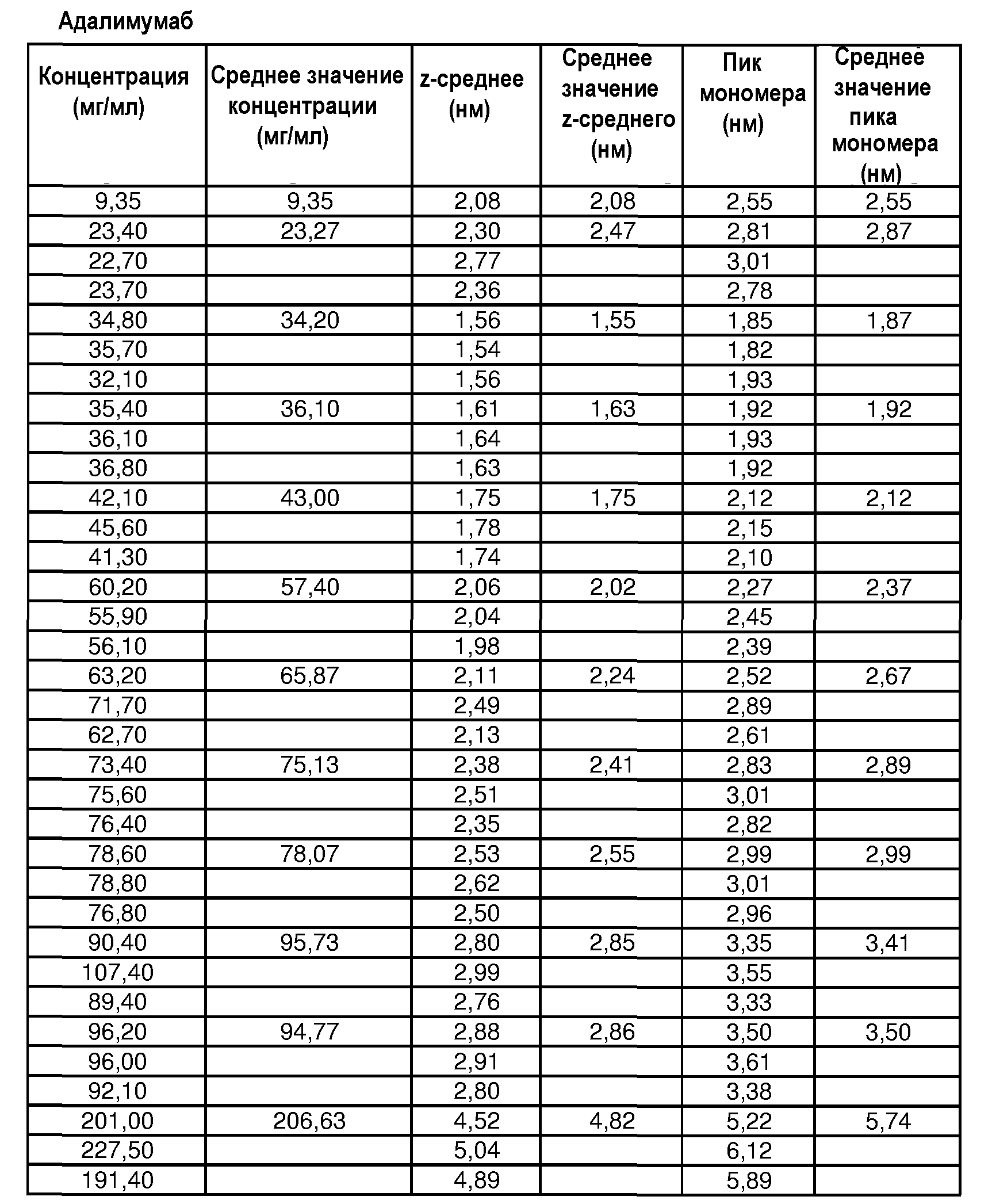
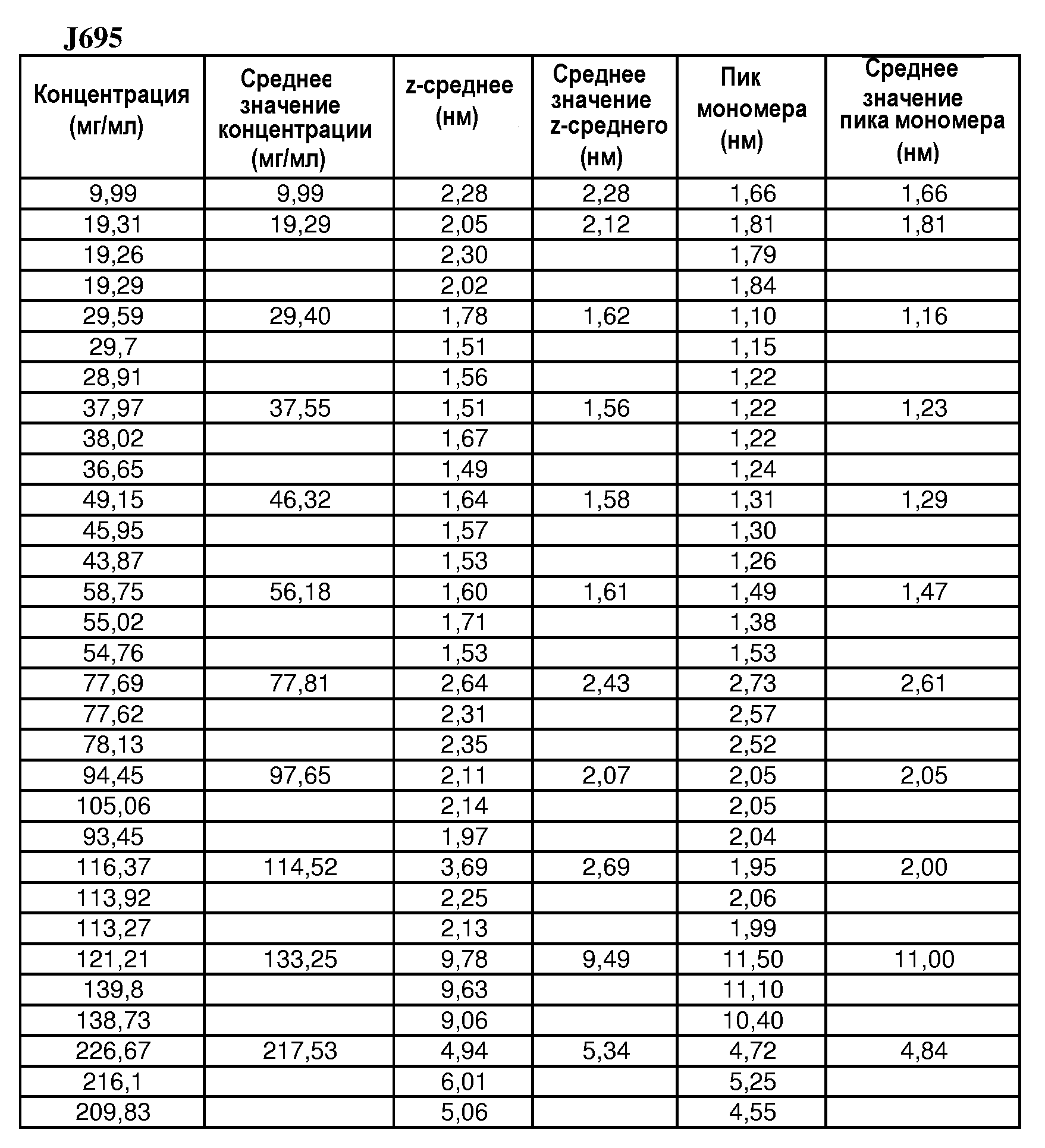
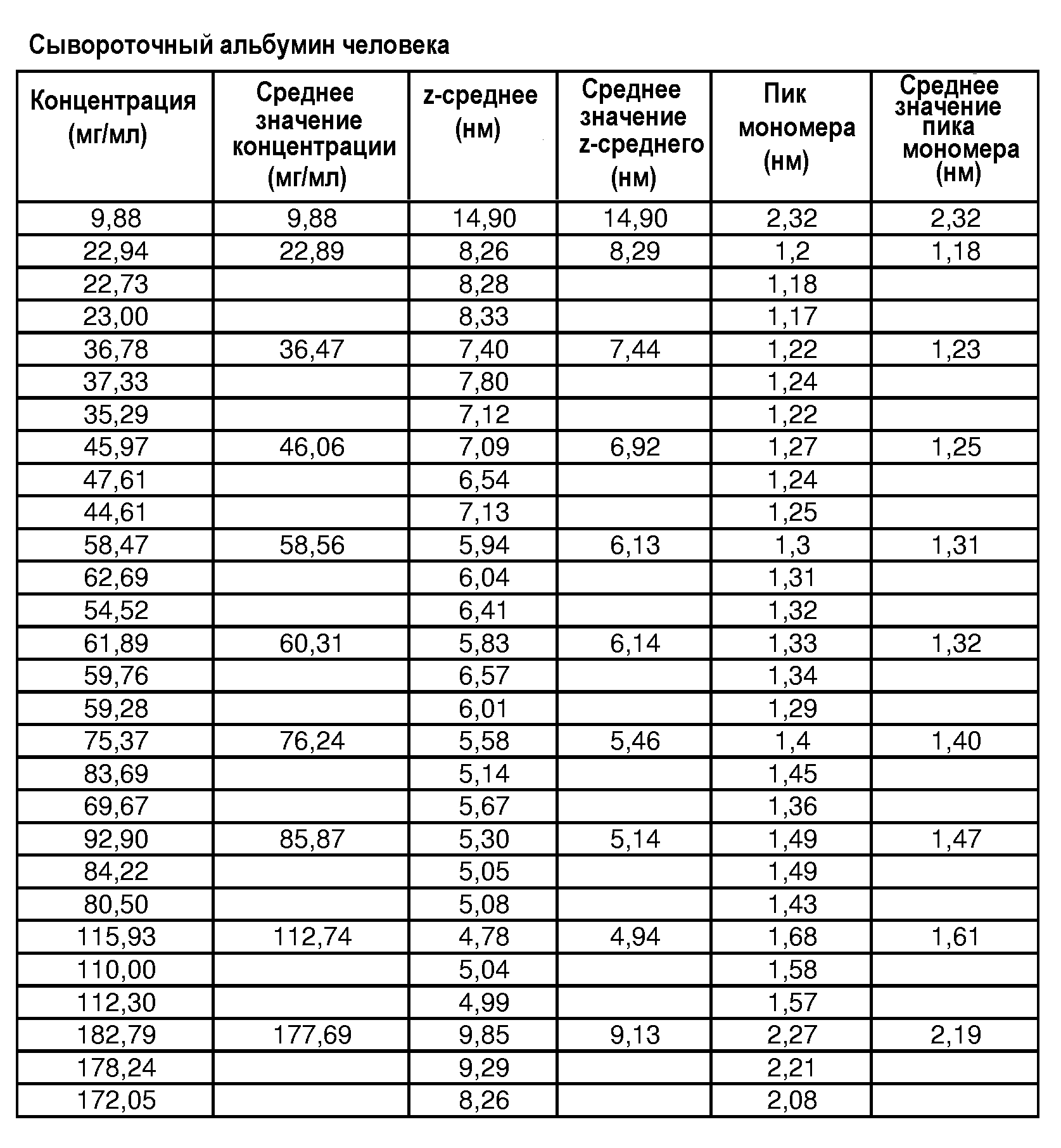
Приложение В. Данные вытеснительной хроматографии (SEC)
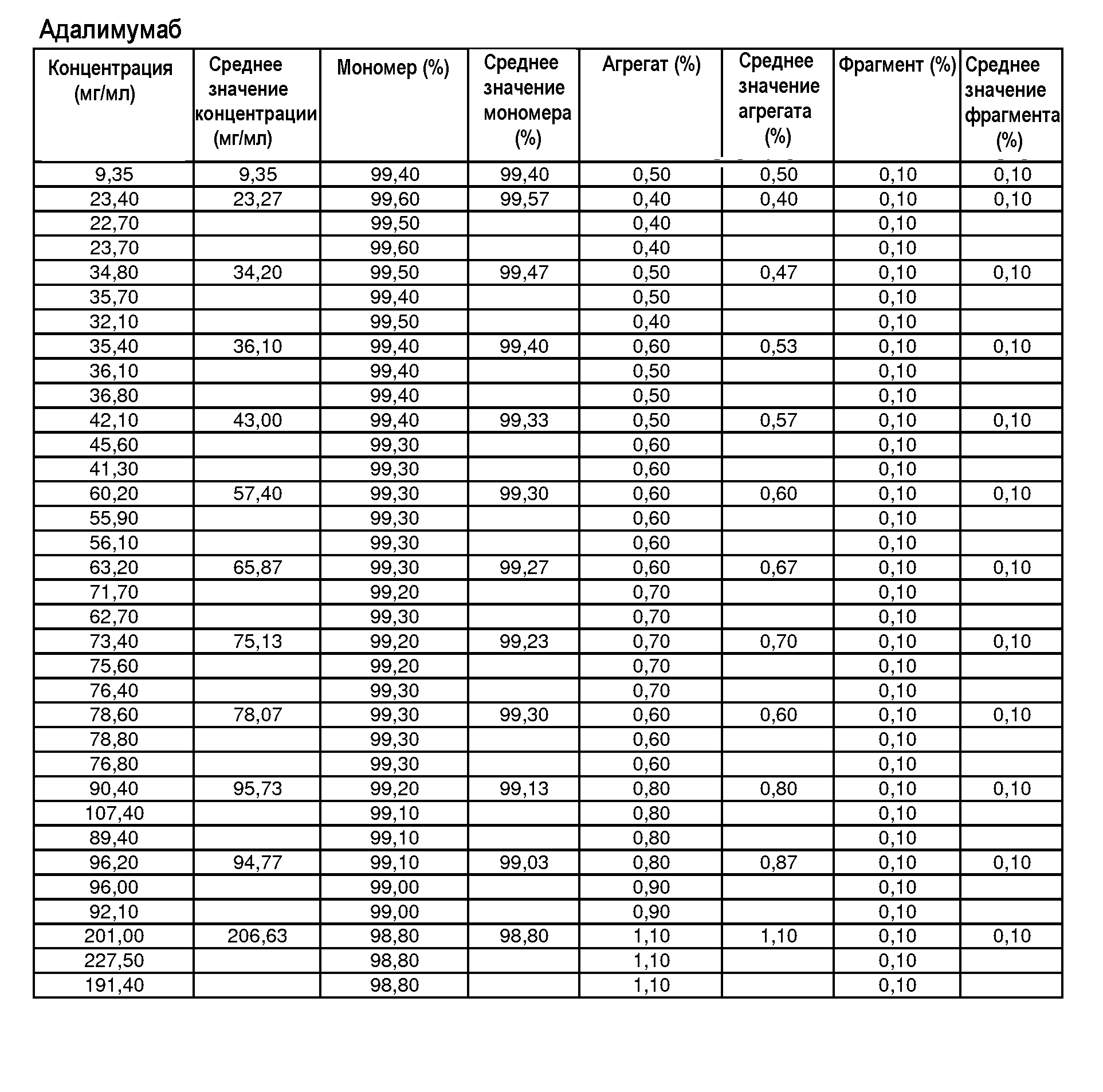
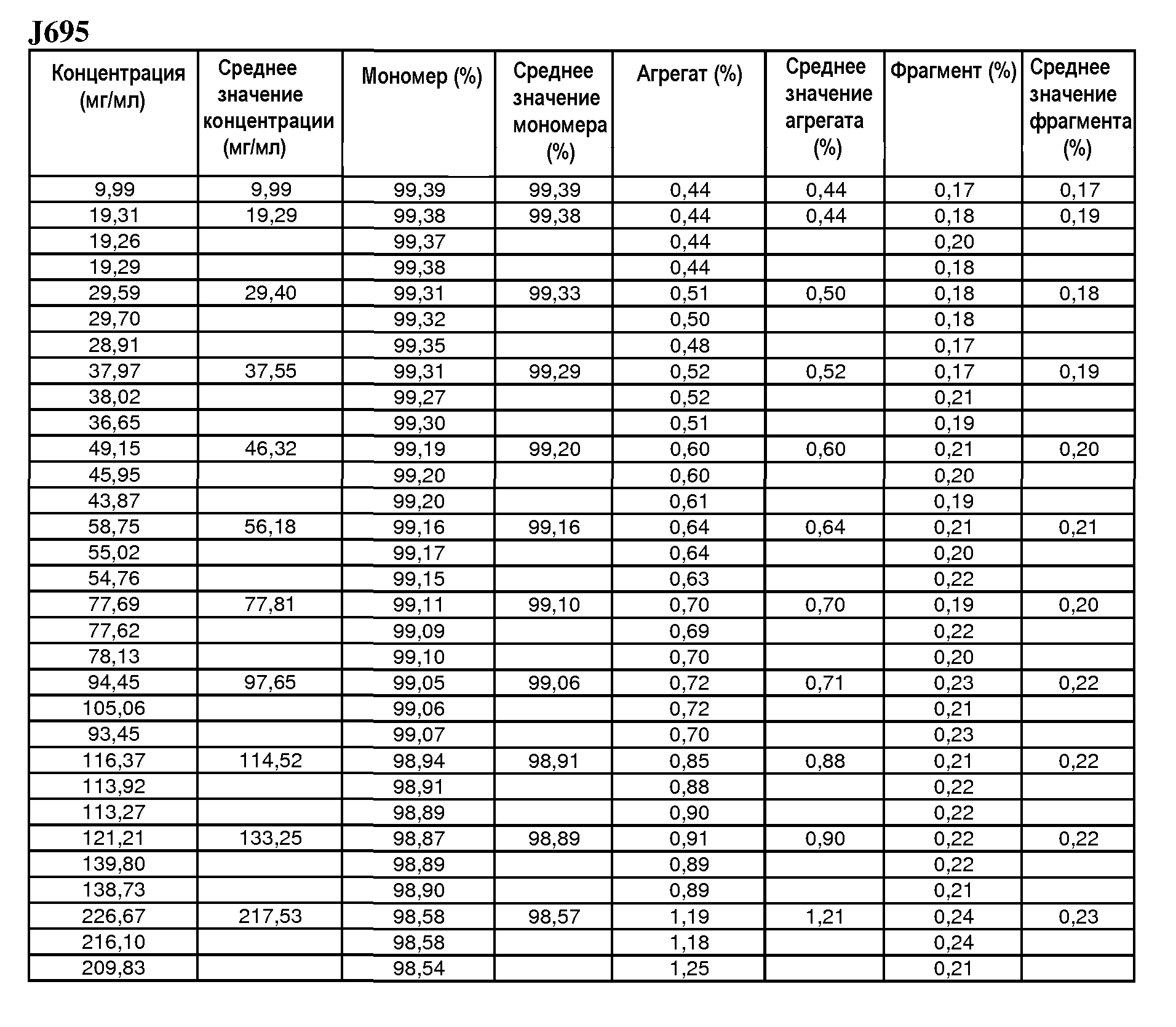
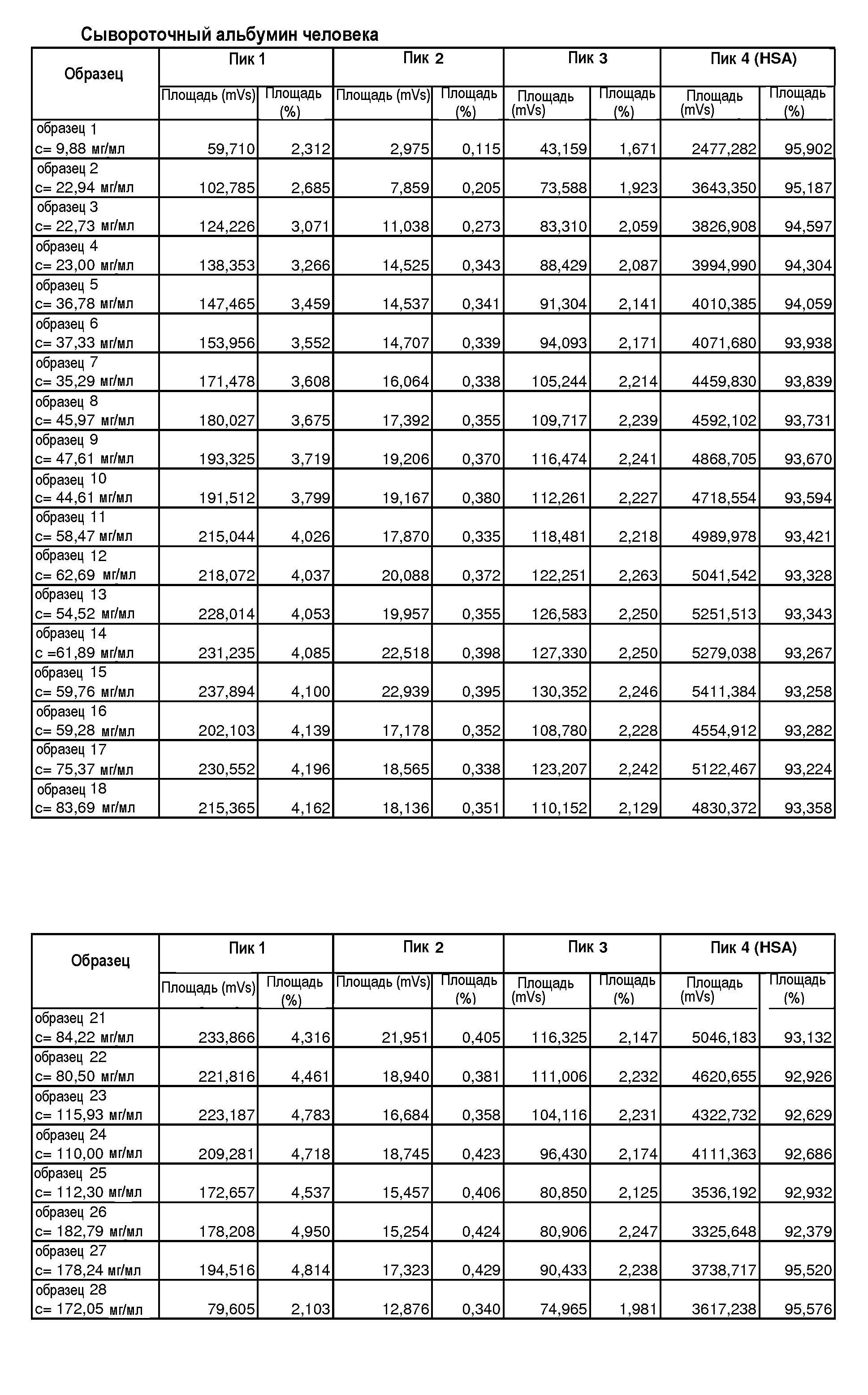
Приложение С. Данные ионообменной хроматографии (IEC)
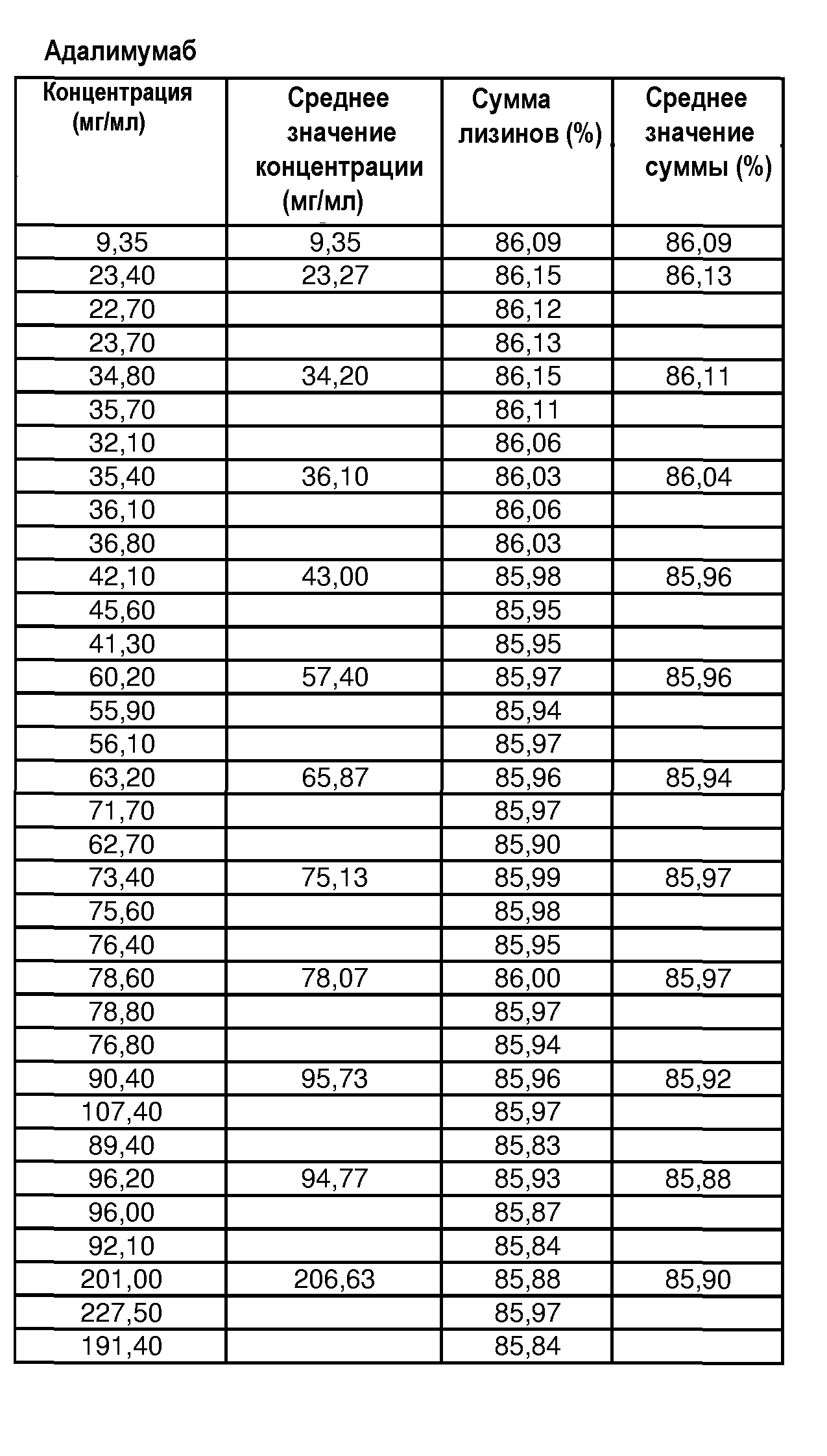
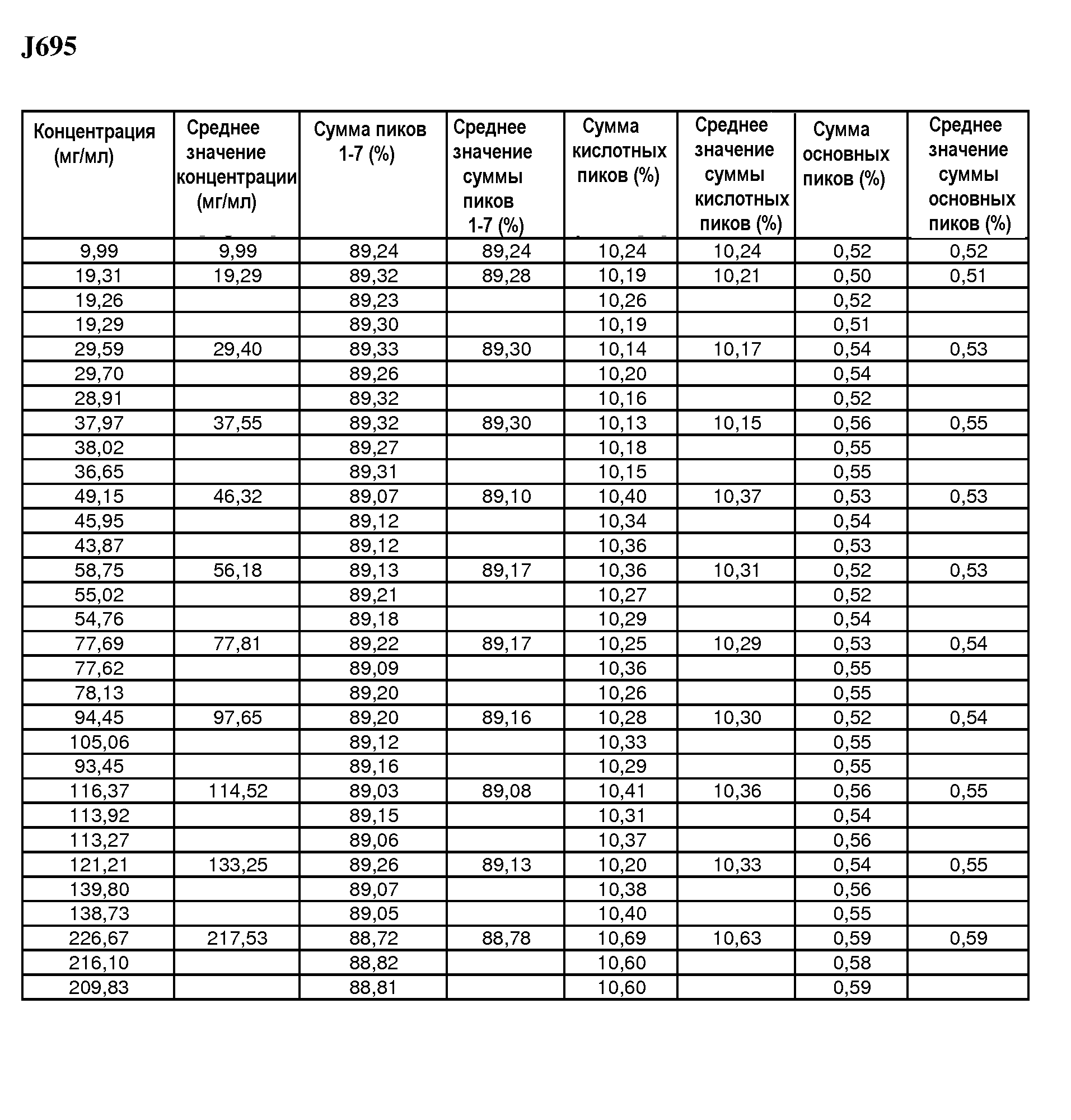
Приложение D
|
|
|
|
|
|
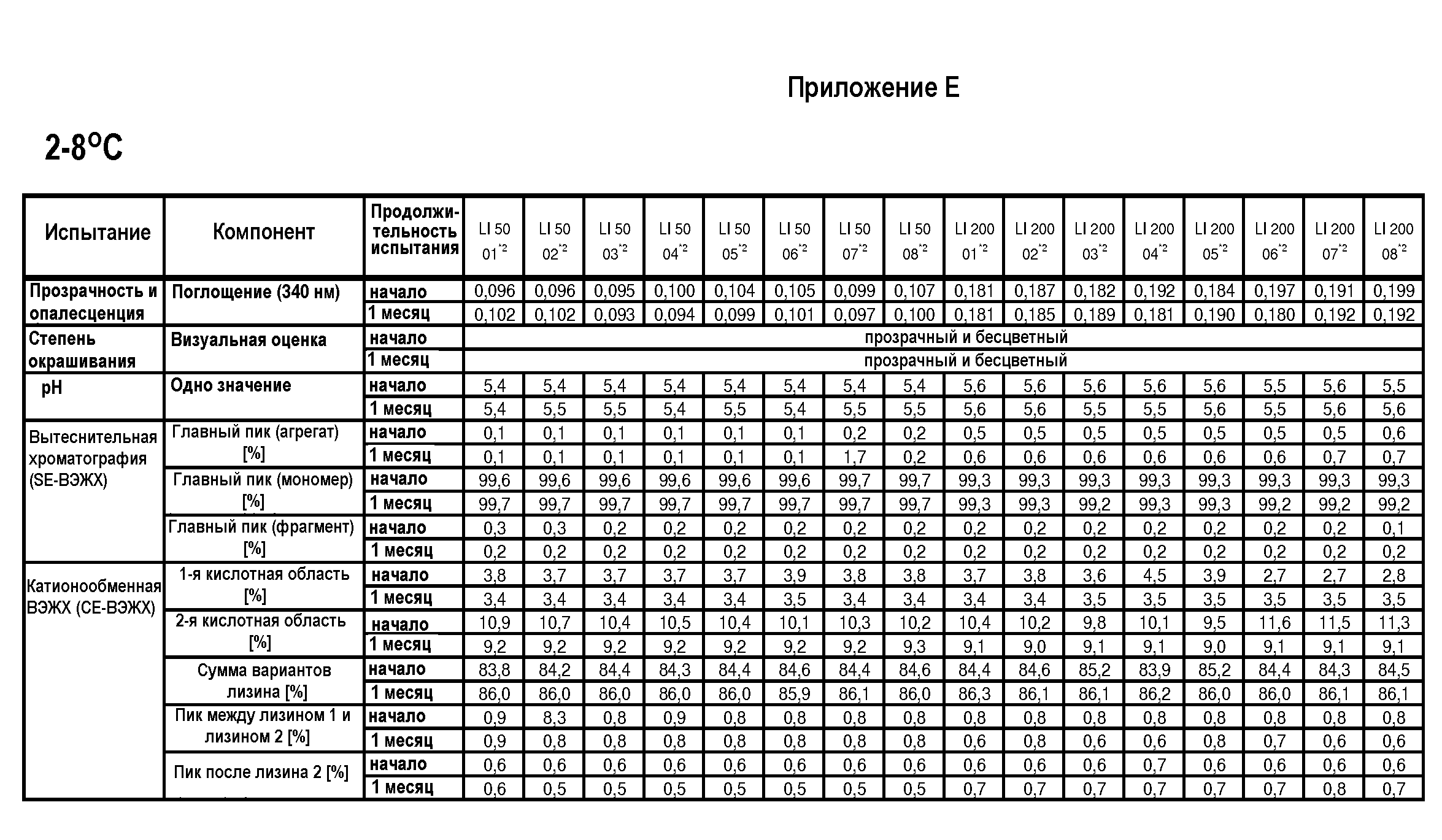
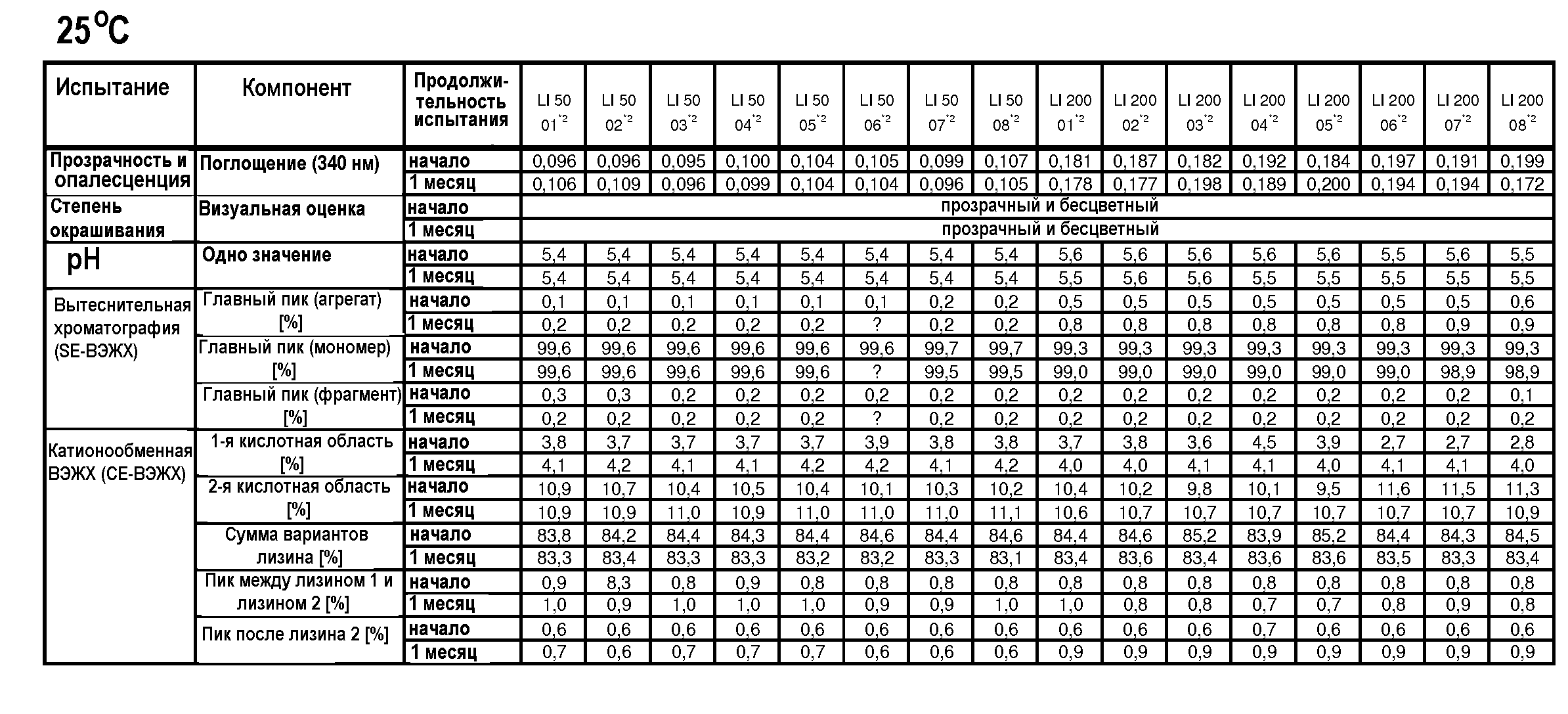
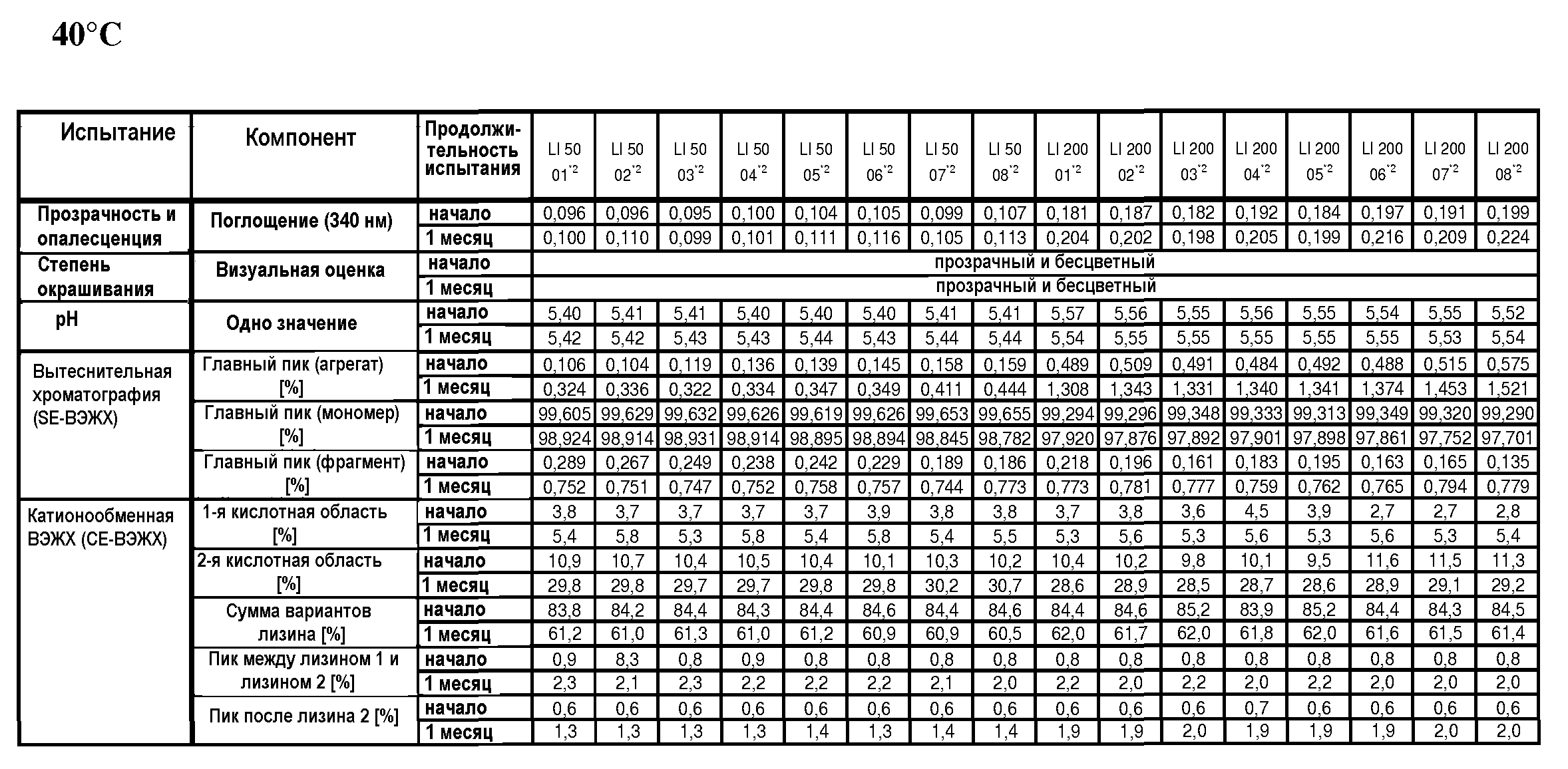
Эквиваленты
Специалисты в данной области должны признать или могут удостовериться в результате обычного экспериментирования в наличии многих эквивалентов конкретных вариантов осуществления изобретения, рассмотренных в настоящем описании изобретения. Такие эквиваленты входят в объем нижеследующей формулы изобретения. Содержание всех приведенных в данной заявке материалов, патентов и опубликованных заявок на патенты включено в настоящее описание изобретения в качестве ссылки.